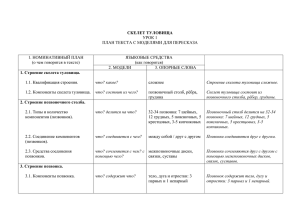
строение и развитие крестцово
advertisement

САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Е. Б. Малашичев СТРОЕНИЕ И РАЗВИТИЕ КРЕСТЦОВО-ТАЗОВОГО КОМПЛЕКСА АМНИОТ Под ред. д-ра биол. наук В. Г. Борхвардта ИЗДАТЕЛЬСТВО С.-ПЕТЕРБУРГСКОГО УНИВЕРСИТЕТА 2006 ББК 28.66 М18 Р е ц е н з е н т ы: д-р биол. наук, проф. А. К. Дондуа (С.-Петерб. гос. ун-т), д-р биол. наук, проф. Ф. Я. Дзержинский (Моск. гос. ун-т им. М. В. Ломоносова) Печатается по постановлению Редакционно-издательского совета биолого-почвенного факультета С.-Петербургского государственного университета М18 Малашичев Е. Б. Строение и развитие крестцово-тазового комплекса амниот / Под ред. В. Г. Борхвардта. — СПб.: Изд-во С.-Петерб. ун-та, 2006. — 000 с. ISBN 5-288-04072-9 ББК 28.66 Издается при финансовой поддержке Российского фонда фундаментальных исследований (грант 05-04-62028-д) ISBN 5-288–04072-9 c Е. Б. Малашичев, 2006 c Издательство С.-Петербургского университета, 2006 ОГЛАВЛЕНИЕ Введение . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5 Глава 1. Материал и методика . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.1. Объекты исследования и эмбриональный материал . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.2. Операции in ovo на эмбрионах курицы и перепела . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.2.1. Удаление почки задней конечности и мезодермы боковой пластинки . . . . . . . . . . . . . . . . 1.2.2. Удаление эктодермы боковой пластинки . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.2.3. Удаление серии крестцовых сомитов . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.2.4. Пересадка серии крестцовых дермамиотомов от эмбриона перепела эмбриону курицы 1.3. Гистологические и гистохимические методики . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7 — 9 10 — 11 12 13 Глава 2. Строение крестцово-тазового комплекса . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2.1. Разнообразие строения крестца и таза у современных и вымерших тетрапод . . . . . . . . . . . . . 2.1.1. Амфибии . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2.1.2. Рептилии, кроме архозавров . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2.1.3. Архозавры . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2.1.4. Therapsida . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2.2. Устройство крестцово-тазового комплекса у объектов исследования . . . . . . . . . . . . . . . . . . . . . . 2.2.1. Настоящие ящерицы (Lacertidae) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2.2.2. Птицы . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2.2.3. Млекопитающие . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15 — — 17 19 22 24 — — 29 Глава 3. Маркёры крестца и его эволюция у тетрапод . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3.1. План строения крестцовой области эмбрионов модельных видов . . . . . . . . . . . . . . . . . . . . . . . . . 3.1.1. Прыткая ящерица . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3.1.2. Серая крыса . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3.1.3. Домашняя курица и японский перепел . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3.1.4. Дрозд-рябинник . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3.2. Морфологические маркёры крестцового отдела позвоночника . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3.2.1. Парное тазовое лимфатическое сердце . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3.2.2. Аорта и парная аллантоисная артерия . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3.2.3. Пояснично-крестцовое и тазовое нервные сплетения . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3.2.4. Сужение брюшной полости и положение клоаки. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3.3. Модульная эволюция крестцового отдела позвоночника . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3.3.1. Роль Hox -генов как генетических маркёров крестцовой области позвоночника . . . . . 3.3.2. «Первично-крестцовые» позвонки . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3.3.3. Гомология крестцовых позвонков птиц и других амниот . . . . . . . . . . . . . . . . . . . . . . . . . . . . 31 — — 32 33 34 — 35 37 39 41 42 — 47 48 Глава 4. Крестцовое окно в миомерах и крестцово-тазовое соединение . . . . . . . . . . . . . . . . . 4.1. Гипотеза о роли гипаксиальной мускулатуры в развитии крестцово-подвздошного соединения . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4.2. Процесс образования «крестцового окна» в гипаксиальных частях крестцовых миомеров у амниот . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4.2.1. Прыткая ящерица . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4.2.2. Безногая ящерица — веретеница . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4.2.3. Обыкновенная гадюка . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4.2.4. Курица . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 51 3 53 55 — — 56 — 4.2.5. Дрозд-рябинник . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4.2.6. Крыса . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4.3. Формирование крестцового окна в миомерах и его следствия . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 57 — — Глава 5. Развитие хрящевых и костных элементов крестцово-тазового комплекса . . . . 5.1. Развитие крестца и таза прыткой ящерицы . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.1.1. Положение и формирование зачатка таза и вертлужной впадины . . . . . . . . . . . . . . . . . . . 5.1.2. Развитие хрящевых элементов крестцово-подвздошного комплекса . . . . . . . . . . . . . . . . . 5.1.3. Развитие хрящевых элементов нижней части таза . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.1.4. Окостенение крестцово-подвздошного комплекса . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.1.5. Окостенение нижней части таза . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.2. Развитие сложного крестца и таза домашней курицы и японского перепела . . . . . . . . . . . . . . 5.2.1. Положение и формирование зачатка таза и вертлужной впадины . . . . . . . . . . . . . . . . . . . 5.2.2. Развитие хрящевых элементов крестцово-подвздошного комплекса . . . . . . . . . . . . . . . . . 5.2.3. Развитие хрящевых элементов нижней части таза . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.2.4. Окостенение крестцово-подвздошного комплекса . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.2.5. Окостенение нижней части таза . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.3. Развитие сложного крестца и таза дрозда-рябинника . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.3.1. Положение и формирование зачатка таза и вертлужной впадины . . . . . . . . . . . . . . . . . . . 5.3.2. Развитие хрящевых элементов крестцово-подвздошного комплекса . . . . . . . . . . . . . . . . . 5.3.3. Развитие хрящевых элементов нижней части таза . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.3.4. Окостенение крестца и таза . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.4. Развитие крестца и таза серой крысы . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.4.1. Положение и формирование зачатка таза и вертлужной впадины . . . . . . . . . . . . . . . . . . . 5.4.2. Развитие хрящевых элементов крестцово-подвздошного комплекса . . . . . . . . . . . . . . . . . 5.4.3. Развитие хрящевых элементов нижней части таза . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.4.4. Окостенение крестца и таза . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.5. Сравнительный очерк хондро- и остеогенеза . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.5.1. Скорость и порядок хряще- и костеобразования . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.5.2. Проблема наличия крестцовых ребер у Lacertilia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.5.3. Контакты элементов крестцово-тазового комплекса . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.6. Роль полости тела в развитии и эволюции формы таза . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.6.1. Морфогенетическая роль полости тела . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5.6.2. Разнообразие формы таза и полость тела у ископаемых амниот . . . . . . . . . . . . . . . . . . . . 61 — — 62 63 64 65 — — 66 68 69 — 70 — — 71 72 — — — 73 74 — — 77 79 81 — 84 Глава 6. Экспериментальный анализ развития крестца и таза птиц . . . . . . . . . . . . . . . . . . . . . 6.1. Закономерности развития крестца и таза . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6.1.1. Таз и свободная конечность в моделе «зоны прогресса» . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6.1.2. Происхождение мускулатуры и скелета конечностей и их поясов в онтогенезе . . . . . . 6.2. Эксперименты in ovo на куриных эмбрионах . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6.2.1. Влияние удаления почки задней конечности . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6.2.2. Влияние удаления эктодермы боковой пластинки в районе презумптивной почки задней конечности . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6.2.3. Влияние удаления боковой пластинки . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6.2.4. Влияние удаления серии крестцовых сомитов . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6.2.5. Результаты трансплантации верхней части крестцовых сомитов от японского перепела к домашней курице . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6.3. Независимость и координированность развития крестца и таза амниот . . . . . . . . . . . . . . . . . . . 6.3.1. Крестец, таз и свободная конечность развиваются независимо . . . . . . . . . . . . . . . . . . . . . . 6.3.2. Формирование крестцового окна не связано с наличием почки конечности или денервацией осевых мышц. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6.3.3. Мезодермальные источники для развития ilium и механизм развития крестцового окна остаются невыясненными . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6.3.4. Верхняя и нижняя части таза имеют несколько различные закономерности развития и эволюции . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 87 — — 88 92 — Литература . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Summary . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4 93 94 95 96 — 97 99 102 104 108 ВВЕДЕНИЕ Среди элементов посткраниального скелета наибольшее внимание эволюционных морфологов привлекали позвоночник и скелет свободных конечностей. Пояса конечностей исследованы меньше. Из них особый интерес вызывает таз, являющийся промежуточным звеном между осевым скелетом и скелетом задних конечностей и составляющий вместе с ним скореллированную систему. Не случайно среди сравнительно-анатомических работ столь важное место занимают исследования их синхронных изменений в процессе редукции у безногих форм. Однако комплексный анализ механизмов развития и факторов эволюции крестца и таза не проводили. До настоящего времени нет единого толкования состава сложного крестца (synsacrum) птиц; продолжается дискуссия о наличии крестцовых ребер у Lacertilia; не ясны механизмы образования крестцово-подвздошного соединения и формы таза (положения лобкового элемента). Решению многих проблем строения и эволюции крестцово-тазового комплекса препятствует скудость фактологической базы, прежде всего морфогенетических данных, которые традиционно служат одной из основ для эволюционных построений. Наличие крестцово-подвздошного соединения — это характерная черта, которая отличает наземных тетрапод от рыб. Его появление в эволюции связано с изменениями как осевого скелета, так и таза. Согласованная эволюция крестца и таза традиционно рассматривалась как одна из важных эволюционных корреляций (Sewertzoff, 1931). Земноводные, в особенности бесхвостые, оказались более изученными, в том числе экспериментально. Накоплен солидный фактический материал по строению и развитию крестца и таза амфибий (Анисимова, 1987; 1990; Low, 1926, 1927, 1929a; Dragomirowa, 1935; Hodler, 1949a, b; Emerson, 1982; Kovalenko, 1994, 1995; Kovalenko, Kovalenko, 1996; Коваленко, 1999; Muller et al., 1996; Malashichev and PawlowskaIndyk, 1997; Dournon et al., 1998; Das and Mohanty-Hejmadi, 2000). Исследования развития крестцово-тазового комплекса амниот, напротив, страдают своей неполнотой. Работ, посвященных строению крестца и таза амниот, хотя и много, но они обычно носят описательный характер и содержат минимум обобщений. Многие исследования, которые нет места перечислять, посвящены строению и эволюции раздельно крестца и таза у представителей конкретных систематических групп. Настоящее исследование призвано восполнить имеющиеся пробелы, насколько это представляется возможным. Кроме того, при написании данной работы автор надеялся, что она станет фундаментом (прежде всего фактологическим, а возможно и идейным), на котором можно будет строить последующие исследования, более широкие и глубокие, чем представленное в настоящей монографии. Для достижения этой цели мною проведено сравнительно-морфологическое исследование относительно близких видов животных, а также видов, относящих5 ся к разным классам амниот. С одной стороны, чешуйчатые рептилии (Reptilia, Squamata), различающиеся степенью развития скелета конечностей, тазового пояса и крестца, оказываются удобными для сравнения морфогенеза данных частей скелета внутри одной группы рептилий. С другой стороны, в работе проводится сравнение морфогенеза крестцово-тазового комплекса у рептилий, птиц и млекопитающих. Такое двухуровневое сравнительное исследование дополняется рядом экспериментов на эмбрионах птиц. Полученные сравнительные и экспериментальные данные обсуждаются разносторонне, с привлечением данных других областей биологии — от генетики развития до палеонтологии. Таким образом, в качестве стратегии исследования выбрано сочетание сравнительного и экспериментального подходов, сопровождающееся широкими интерпретациями в свете смежных направлений биологии. Глава 1. МАТЕРИАЛ И МЕТОДИКА 1.1. ОБЪЕКТЫ ИССЛЕДОВАНИЯ И ЭМБРИОНАЛЬНЫЙ МАТЕРИАЛ Основными объектами сравнительного исследования были выбраны виды с принципиально различным устройством крестца и таза, такие как прыткая ящерица (Lacerta agilis), домашняя курица (Gallus domesticus), серая крыса (Rattus norvegicus). Для сравнения привлечены безногие формы с редуцированными тазом и крестцом: безногая ящерица — веретеница (Anguis fragilis), обыкновенная гадюка (Vipera berus), а также виды, отличающиеся от модельных деталями строения крестца или таза: живородящая ящерица (Zootoca vivipara), стенная ящерица (Podarcis muralis), скальная ящерица (Darevskia saxicola), японский перепел (Coturnix japonicus), дрозд-рябинник (Turdus pilaris). Беременных самок прытких ящериц ловили в их естественных местообитаниях в Белгородской области (окрестности пос. Борисовка). Животных содержали в пластиковых террариумах с субстратом из сырого песка при естественных световом дне и температуре воздуха. В течение нескольких дней, по откладке ящерицами яиц, все самки были отпущены в места поимки. Отложенные после естественного спаривания яйца инкубировали во влажном песке в автоматических климатизированных камерах с программированием фотопериодических и температурных ритмов (Браун и Горышин, 1978) при 16-часовом дне, температуре +26.79±0.05 ◦C (Tmin = 23◦ C; Tmax = 29◦ C) и влажности 96%. Температурный контроль проводили шесть раз в сутки. Яйца вскрывали в разные дни инкубации и эмбрионов фиксировали в жидкости Буэна. В работе использованы также эмбрионы прытких ящериц, собранные в том же районе в 1974–1975 годах В. Г. Борхвардтом, фиксированные и хранящиеся в 4%-ном водном растворе формальдегида в составе коллекции эмбрионов кафедры зоологии позвоночных СПбГУ. Оплодотворенные яйца кур и перепелов хранили до инкубации при температуре +12 ◦ C и инкубировали при температуре +37–39◦C в инкубаторах Newlife–75, MK–4 и других модификаций при влажности 80–100%. Температурный контроль осуществлялся автоматически. Яйца вскрывали по прошествии разного времени от начала инкубации и фиксировали в разных жидкостях в соответствии с дальнейшей методикой исследования. Для рутинных гистологических методик эмбрионов фиксировали в жидкостях Буэна или Серра, для иммуногистохимических методик — в жидкости Серра, для изготовления тотальных препаратов скелета с просветлением мягких тканей — в абсолютном этиловом спирте и уксусной кислоте в соотношении 1:1, либо 70%-ном этиловом спирте. При необходимости длительного хранения осуществлялась перефиксация в 4%-ный водный раствор формальдегида. Эмбрионов крыс необходимого возраста получали по стандартным методикам (Дыбан и др., 1975). Самок крыс подсаживали к самцам в состоянии проэструса, которое определяли по регулярным влагалищным мазкам. Эффективность покры7 8 8 9 6 4 5 6 2 1 3 6 8 11 4 Rattus norvegicus 2 Turdus pilaris 5 3 2 3 4 4 3 1 3 1 9 Gallus domesticus Coturnix japonicus 2 Vipera berus 4 5 3 4 2 8 5 1 1 1 1 1 3 3 3 9 Anguis fragilis 8 1 6 9 1 2 1 1 8 3 2 2 3 4 2 1 6 5 3 4 1 2 1 8 10 2 6 2 2 3 4 1 1 1 1 54 16 13 7 11 78 44 2 37 2 30 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 Стадия развития Podarcis muralis Zootoca vivipara Lacerta agilis Вид Таблица 1. Число нормальных эмбрионов девяти видов рептилий, птиц и млекопитающих, исследованных гистологически тия проверяли в последующие дни по характерной картине мазков. Беременных самок (N=17) усыпляли парами хлороформа или убивали смещением шейных позвонков. Эмбрионов извлекали из рогов матки и фиксировали в жидкости Буэна с последующей перефиксацией в формальдегиде для длительного хранения. Помимо собственного материала в работе использованы взятые из коллекции кафедры зоологии позвоночных эмбрионы, гистологические препараты и сухие скелеты следующих видов животных: Z. vivipara, P. muralis, D. saxicola, A. fragilis, V. berus, G. domesticus, C. japonicus, T. pilaris, R. norvegicus. Эмбрионов классифицировали по стадиям, используя таблицы нормального развития для Z. vivipara (Dufaure and Hubert, 1961), V. aspis (Hubert and Dufaure, 1968), G. domesticus (Hamburger and Hamilton, 1951), R. norvegicus (Дыбан и др., 1975). Общее число исследованных эмбрионов приведено в табл. 1. 1.2. ОПЕРАЦИИ IN OVO НА ЭМБРИОНАХ КУРИЦЫ И ПЕРЕПЕЛА Оплодотворенные яйца курицы инкубировали в течение двух–трех суток и использовали в операциях на стадиях 11–19 в зависимости от задачи эксперимента. Операции проводили в стерильной лаборатории стерилизованными в автоклаве инструментами, яйца перед операцией обрабатывались 70%-ным этанолом. Основные манипуляции с яйцом и эмбрионом проводили по стандартным методикам (Ordahl and Christ, 1998). Положение эмбриона и воздушной камеры определяли на овоскопе. Пропиливали скорлупу над воздушной камерой, а затем выпиливали прямоугольное отверстие на боковой стороне яйца над эмбрионом. При открытии подскорлуповой оболочки происходило схлопывание воздушной камеры и опускание эмбриона на желтке, что препятствовало повреждению эмбриона при дальнейшем вскрытии яйцевых оболочек. Для проведения собственно операции эмбриона поднимали к отверстию в скорлупе путем добавления одного–двух миллилитров раствора Локка с пеницилином и в лучах осветителя ориентировали эмбрион в образовавшейся линзе из жидкости. Оперировали под бинокулярным микроскопом при суммарных увеличениях ×400–900. В качестве инструментов для операций использовали ножницы для глазной хирургии, операционный «карандаш» и операционную микроиглу. «Карандаш» изготавливали из стеклянной палочки, вытянутой на кончике до нити в пламени газовой горелки. Конец нити заплавляли в пламени спиртовки до приобретения им формы шарика и на образовавшийся стеклянный шарик наносили три–четыре слоя красящего раствора (1%-ный раствор нильского голубого в 2,5%-ном водном растворе агарозы). «Карандаш» после застывания краски использовали для подкрашивания бесцветных эмбриональных оболочек и самого эмбриона. Операционную микроиглу изготавливали из пипетки Пастера и кусочка вольфрамовой проволоки толщиной 100 мкм. В пламени спиртовки вольфрамовую проволоку вводили в полый кончик пипетки, который заплавляли. Кончик получившейся микроиглы затачивали электролитически под бинокуляром до получения диаметра на острие 10 мкм при длине заточенного кончика около 100 мкм. На стадии 18 ножницами для глазной хирургии или слабозаточенной операционной микроиглой вскрывали амнион и хорион и расширяли образовавшиеся отверстия. По завершении операции разрез «зашивали» путем сжатия противоположных краев разрыва острым глазным пинцетом, используя адгезивные свойства амниона. 9 На стадиях 17 и на более ранних все операции проводили через естественное окно, образованное несомкнувшимися над эмбрионом краями амниона. После завершения операции через отверстие напротив бывшей воздушной камеры с помощью одноразового шприца отсасывали 1–2 мл белка. При этом прооперированный эмбрион опускался внутрь яйца, и воздушная камера теперь располагалась над ним. Проделанные в скорлупе отверстия заклеивали лейкопластырем, а яйца в положении «на боку» реинкубировали до истечения семи дней с момента оплодотворения (стадии 29–32), эмбрионов извлекали из яйца и фиксировали в жидкости Серра. При фиксации эмбриона производили визуальную внешнюю оценку проведенной операции и отбор эмбрионов для дальнейшего гистологического исследования. 1.2.1. Удаление почки задней конечности и мезодермы боковой пластинки Так как эмбрион курицы уже на второй-третий день инкубации скручивается вправо вокруг своей продольной оси, то его левый бок оказывается лежащим на желтке, а правый — прилежащим к скорлупе яйца и наиболее удобным для операции. Поэтому все односторонние операции проводили на правой стороне эмбриона, тогда как левая служила контролем. Удаление ранней почки задней конечности проводили на стадии 16 (небольшое вздутие), 17 (зачаточная почка) и 18 (формирующаяся почка). Удаляли всю почку задней конечности ножницами для глазной хирургии, начиная разрез с ее каудального края. Особое внимание уделяли полному удалению апикального эктодермального гребня (АЭГ) для предотвращения восстановления почки конечности. Схема операции на стадии 17 показана на рис. 1, а. Аналогичным образом на стадиях 14–16 удаляли всю боковую пластинку вдоль промежуточной мезодермы и линии сомитов, начиная с уровня сомита 24 до уровня сомитов 32–33 или предполагаемого места их расположения, если они еще не сформировались (рис. 1, б ). Латерально удаляли мезодермальный материал вместе с покрывающей его эктодермой на ширину, превышающую ширину осевых органов (двух рядов сомитов с нервной трубкой) вместе взятых. Каждая из операций занимала не более 10–15 минут, включая подготовку яйца и послеоперационную обработку. Всего произведено 65 операций по удалению почки задней конечности и 10 операций по удалению боковой пластинки. Оба типа операций считали проведенными успешно, если эмбрион к моменту фиксации не восстанавливал правую почку задней конечности и не имел каких-либо иных дефектов кроме отсутствия правой ноги. 1.2.2. Удаление эктодермы боковой пластинки Для полного исключения развития почки задней конечности удаляли эктодерму боковой пластинки на стадиях, предшествующих формированию почки конечности, начиная со стадии 17 до стадии 12 включительно (рис. 1, в). Эта операция позволяла оставлять интактной подлежащую мезодерму и одновременно предотвращала развитие почки конечности, так как исключала возможность влияния эктодермальных морфогенетических факторов на подлежащие ткани. После вскрытия яйца эктодерму подкрашивали операционным карандашом, производили разрезы 10 эктодермы операционной микроиглой по краям предполагаемого для удаления прямоугольного участка и лист эктодермы легко убирали пинцетом, так как до стадии 17 эктодерма слабо крепится с помощью коллагеновых волокон на подлежащую мезодерму. Эктодерму удаляли в тех же пределах, в каких ранее производили удаление боковой пластинки, и замещали листом золотой фольги соответствующего размера (рис. 2). Золотая фольга препятствовала восстановлению эктодермы, и в случаях, когда она оставалась на месте операции, конечность не развивалась. У эмбрионов, прооперированных на более ранних стадиях, вероятность смещения золотой фольги или неточное расположение ее относительно будущей тазовой области повышалась из-за увеличения срока реинкубации и бóльших изменений формы и размеров, чем у эмбрионов, прооперированных позднее. Так как у эмбрионов на стадиях 10–12 сегментация в области будущего synsacrum только начинается, а сама тазовая область еще слабо выражена и весь каудальный отдел эмбриона короткий, то часто при операции затрагивали хвостовую почку, что приводило к недоразвитию каудальной части эмбриона и серьезным уродствам. Одна операция занимала 20–30 минут. Всего было проведено 79 операций по удалению эктодермы. Операцию считали проведенной успешно, если эмбрион не развивал почку задней конечности, не имел каких-либо иных дефектов или повреждений, а золотая фольга оставалась на месте операции. Такие эмбрионы (N=18) подвергали дальнейшему гистологическому анализу. 1.2.3. Удаление серии крестцовых сомитов Удаление сомитов проводили по известным методикам (Bagnall et al., 1988; Ordahl and Christ, 1998). Удалить сомит полностью, особенно склеротом, практически невозможно (Kieny et al., 1972; Bagnall et al., 1988). Удаление одиночных сомитов, как правило, сопровождается их полным или частичным восстановлением (Bagnall et al., 1988). Двух первых прооперированных эмбрионов после операции зафиксировали, изготовили гистологические препараты (поперечные срезы толщиной не более 7 мкм), окрасили гематоксилином и исследовали под микроскопом. Исследование показало, что у одного эмбриона был полностью удален дермамиотом и до 90% склеротома в каждом оперированном сегменте, а у второго эмбриона в части сегментов было удалено только около 80% дермамиотома и 50% склеротома. Эти остаточные клетки могли восстанавливать часть структур, в норме развивающихся из сомитов. Поэтому в дальнейшем операции проводили очень тщательно с помощью двух микроигл, используемых также в качестве микроножниц, а отдельные клетки и клеточный дебрис отсасывали модифицированной пипеткой Пастера с боковой мембраной (Ordahl and Christ, 1998; рис. 1). Удаляли серию сомитов от сомита 25 до сомитов 32–33 включительно (рис. 1, г). Для уменьшения вероятности восстановления сомитов в образовавшуюся рану помещали крошку яичной скорлупы соответствующего размера, которая полностью бы замещала удаленный сомит. В процессе развития эмбриона скорлуповая крошка постепенно резорбировалась. Одна операция занимала 20–30 минут. Всего было проведено 18 операций по удалению серии сомитов. Операцию считали проведенной успешно, если на месте операции в серии сомитов наблюдался небольшой провал (не произошло полного 11 восстановления сомитов), развивалась нормально правая задняя конечность и не было иных повреждений или уродств. Такие эмбрионы (N=6) подвергали дальнейшему гистологическому исследованию. 1.2.4. Пересадка серии крестцовых дермамиотомов от эмбриона перепела эмбриону курицы Операцию по трансплантации дермамиотомов проводили в общих чертах по стандартным методикам (Ordahl and Christ, 1998; см. также предыдущий раздел и рис. 3). Реципиента (эмбрион курицы) готовили для приема трансплантата почти так же, как и при удалении сомитов. Отличия состояли в следующем. С помощью операционных микроигл производили продольные и поперечные разрезы между рядом сомитов и нервной трубкой, между рядом сомитов и промежуточной мезодермой и на торцах ряда сомитов между соседними сомитами, однако разрезы делали неглубокими (примерно до середины высоты сомита). Далее две скрещенные микроиглы подводили под верхнюю часть сомита и, работая микроиглами как ножницами, срезали верхнюю часть ряда эпителизованных сомитов — презумптивные дермамиотомы. Отрезанный пласт ткани удаляли пинцетом. Подготовка донора была менее щадящей по отношению к эмбриону и более тщательной по отношению к трансплантату. Эмбриона перепела извлекали из яйца и растягивали на агарозном геле в чашке Петри с раствором Локка. Ряд сомитов, соответствующий подготовленной ране на теле реципиента, грубо отчленяли микроиглами от окружающих тканей с трех сторон. На краниальном конце ряд сомитов от остального эмбриона сначала не отделяли. Свободный конец ряда сомитов всплывал. Далее, работая микроиглами как микроножницами, под большим увеличением бинокулярного микроскопа аккуратно удаляли всю ткань несомитного происхождения, а ряд эпителизованных сомитов разрезали вдоль на две равные части — верхнюю, содержащую презумптивный дермамиотом, и нижнюю, содержащую презумптивный склеротом. Свободный конец метили операционным карандашом для правильной ориентации трансплантата в реципиенте, а краниальный конец отрезали от эмбриона. Трансплантат затягивали в модифицированную пипетку Пастера (см. выше) и переносили в яйцо к реципиенту. С помощью метки трансплантат ориентировали и помещали в подготовленную рану на теле реципиента. Так как сомиты перепела несколько шире сомитов курицы, то, как правило, весь трансплантат плотно входил в подготовленную рану. Края последней, и без того имеющие тенденцию к затягиванию, дополнительно схлопывались при отсасывании альбумина из яйца и опускании эмбриона, до сих пор слегка растянутого в линзе физиологического раствора, образовавшейся при подъеме эмбриона в скорлуповое окно в самом начале операции. Длительность операции, включая время подбора доноров, соответствующих по стадии развития реципиенту, составляла от 45 минут до двух часов. Всего было произведено 14 операций, из которых 7 трансплантаций — на эмбрионах курицы и перепела одного возраста (стадия 17–18) и 7 трансплантаций на эмбрионах разного возраста (донор на стадии 18–19, реципиент на стадии 17–18). Успешной операцию считали в случае, если трансплантат прижился, а эмбрион–реципиент был внешне нормальным, не имел повреждений или уродств. Такие эмбрионы (N=2 в первой серии одновозрастных трансплантаций; N=7 во второй серии разновозрастных трансплантаций) подвергали дальнейшему гистологическому исследованию. 12 1.3. ГИСТОЛОГИЧЕСКИЕ И ГИСТОХИМИЧЕСКИЕ МЕТОДИКИ Эмбрионы или их части с почками задних конечностей проводили через серию спиртовых растворов возрастающей крепости, ксилол и хлороформ (для гистолоr (для гистохимических методик), заливали в гических методик), либо Rotihistol парафин и ориентировали. Парафиновые блоки резали на микротоме с шагом 7– 10 мкм, срезы укладывали сериями на предметные стекла. Серийные срезы во всех трех основных проекциях на всех доступных стадиях развития окрашивали по одной из методик, описанных ниже, а затем исследовали под световым микроскопом и фотографировали. Для получения общих гистологических картин чаще использовали стандартную окраску квасцовым гематоксилином и эозином или азаном. Для лучшего выявления хрящевой ткани использовали окраску альциановым синим или малахитовым зеленым. Для выявления на гистологических срезах скелетной мускулатуры использовали иммуногистохимическую окраску α-десмина — структурного белка всей скелетной мускулатуры. Срезы помещали в 0,3%-ный раствор H2 O2 в метаноле для блокирования эндогенных пероксидаз, преинкубировали в 1%-ном растворе бычьего сывороточного альбумина на фосфатном буфере и гибридизировали с первичными моноклональными антителами против α-десмина (DAKO). После инкубации со вторичными антителами козла против иммуноглобулинов мыши, коньюгированными с пероксидазой хрена (SIGMA), проводили реакцию выявления антител с помощью диамино-бензидина (ДАБ-реакция). Срезы дополнительно окрашивали альциановым синим и ядерным красным и получали препарат, на котором все мышцы имели цвет от коричневого до черного, хрящ — голубой, остальные ткани — слегка розоватый, а ядра всех клеток — красный. Для выявления перепелиных клеток в тканях химерных эмбрионов применяли параллельно окраску по Фёльгену с использованием промышленного реагента Шиффа (SIGMA) и фоновой подкраски нейтральным зеленым и иммуногистохимическое выявление мышц (см. выше) в сочетании с окраской хряща смесью альцианового синего и альцианового зеленого. Для этого срезы укладывали через пять на два ряда стекол и в дальнейшем окраску каждой серии срезов проводили раздельно. Такая методика позволяла выявлять на одной серии срезов перепелиные клетки (содержали окрашенные реагентом Шиффа ядрышки гетерохроматина), а на второй серии срезов — мышечную и хрящевую ткани. Смесь альциановых красителей окрашивает в голубой цвет сульфатированные, в желтый — карбоксильные группы и в зеленый — кислые мукополисахариды (Burck, 1988). Поэтому применение такой смеси позволяло различать куриный и перепеленый хрящи по тональности его окрашивания, так как хрящ этих двух видов птиц, по-видимому, имеет различный состав матрикса и окрашивается в более голубые тона (преобладание сульфатированных групп) у курицы и более зеленые (преобладание кислых мукополисахаридов) у перепела. Вместо окраски по Фёльгену применяли также выявление перепелиных клеток с помощью специфических антител против антигенов перепела (anti-quail antibodies) в сочетании с выявлением α-десмина и окраской ядерным красным. Для этого в качестве первичных антител использовали поликлональные антитела против α-десмина (SIGMA) и моноклональные антитела против антигенов перепела (SIGMA) при одновременной инкубации. В качестве вторичных антител использовали антитела козла против иммуноглобулинов кролика, конъюгированные с пероксидазой хрена 13 (SIGMA), и антитела козла против иммуноглобулинов мыши, коньюгированные с алкалинфосфатазой (SIGMA) также при одновременной инкубации в течение ночи. После цветной ДАБ-реакции по выявлению вторичных антител, конъюгированных с пероксидазой, проводили вторую цветную реакцию с антителами, конъюгированными c алкалинфосфатазой при использовании в качестве субстрата нитроголубого тетразониумхлорида (NBT) и 5-бром-4-хлор-3-индолил-фосфата (BCIP) в алкалинфосфатазном буфере. После подкраски в ядерном красном получали гистологические срезы, на которых мышцы были окрашены в коричневый, ядра перепелиных клеток — от голубого до ярко синего, ядра куриных клеток — в красный, а остальные ткани — в розовато-коричневатый цвет. Для объемного выявления хрящевой и костной тканей на тотальных препаратах эмбрионов и взрослых ящериц окрашивали альциановым синим и ализариновым красным по известной методике (Wassersug, 1976). После просветления мягких тканей в KOH получали препараты с хрящом, окрашенным в голубой цвет, а костью и кальцинированным хрящом — в красный. Эмбрионов крысы, курицы и перепела окрашивали по двум модификациям той же окраски (Kessel and Gruss, 1991; Kant and Goldstein, 1999). В первом случае просветление проводили также в KOH. Во втором случае использовали только альциановый синий для выявления хрящевой ткани; просветление мягких тканей проводили в метилсалицилате (1 сут). Метилсалицилат, в отличие от щелочи, производит щадящее просветление без нарушения гистологических структур. Просветленные с его помощью эмбрионы исследовали под бинокуляром, фотографировали, а затем проводили через ротигистол и заливали в парафин. Срезы в дальнейшем использовали для иммуногистохимической окраски мышц с использованием антител против α–десмина (см. выше), при этом окраска хряща альциановым синим сохранялась. Для выявления скелетных структур и нервной ткани у эмбрионов птиц была использована тройная тотальная окраска альциановым синим, ализариновым красным и судановым черным по модифицированной (без мацерации в трипсине) методике Бауэра (Bauer, 1986). Глава 2. СТРОЕНИЕ КРЕСТЦОВО-ТАЗОВОГО КОМПЛЕКСА 2.1. РАЗНООБРАЗИЕ СТРОЕНИЯ КРЕСТЦА И ТАЗА У СОВРЕМЕННЫХ И ВЫМЕРШИХ ТЕТРАПОД 2.1.1. Амфибии Тазовый пояс предков амфибий — кистепёрых рыб — представляет собой парную костную пластину, лежащую в стенке тела в основании брюшных плавников. Контралатеральные половины пояса объединены связкой и, например, у Eusthenopteron (Clack, 2000) — наиболее хорошо изученного рода Osteolepiformes (Sarcopterygii) — симфиза не образуют. Иногда над местом причленения плавника возвышается небольшой спинной отросток, processus iliacus. Связь таза с осевым скелетом тем не менее отсутствует, а сам отросток таза далеко не достигает позвоночника, в котором, соответственно, нет крестцового отдела. Примитивные девонские тетраподы — Ichthyostegidae — имели таз, состоящий из одного элемента, в котором различались три основные части — подвздошная (ilium), седалищная (ischium) и лобковая (pubis) (Шмальгаузен, 1964). Прямой связи с осевым скелетом таз ихтиостегид не имел. По крайней мере, у Ichthyostega специализированные крестцовые ребра не найдены, а у Acanthostega крестцовые ребра имелись, но лишь в небольшой степени модифицированные, слегка расширенные дистально (Clack, 2000). Однако с внутренней стороны подвздошного отростка таза не обнаруживается никаких следов сочленения с крестцовым ребром, что свидетельствует в лучшем случае о связочном соединении таза с позвоночником. Помимо этого, задний отросток ilium, направленный под углом 45◦ к осевому скелету, крепился на мышцы хвоста. Так же как у рыб, в нижней краниальной части pubis имелось различное число отверстий для прохождения нервов, foramina obturatoria, в отличие от рыб — сочленение таза со скелетом свободной конечности осуществлялось не посредством бугорка на поясе, а уже посредством сочленовной ямки, acetabulum, слабо развитой у Acanthostega и Ichthyostega и вполне сформированной у более продвинутых Greererpeton и Proterogyrinus (Coates, 1996). Вентрально контралатеральные половины таза у ранних тетрапод были сближены по средней линии тела и образовывали симфиз. У позднедевонских тетрапод обнаруживаются некоторые признаки сочленения (форма и характер внутренней поверхности, а также соответствующая ширина) высокой дорсальной пластины ilium с одним, еще малоспециализированным крестцовым ребром (Romer, 1957). Тем не менее у некоторых эмболомеров и Baphetidae каменноугольного периода (Clack, 1998) и у пермских Archeria (Romer, 1957) и Eryops, Eugyrinus (Шмальгаузен, 1964) сохранялся задний отросток ilium. На него крепи15 лись сухожилия мощной хвостовой мускулатуры. Такое устройство таза может свидетельствовать об относительной слабости крестцово-подвздошного сочленения. Наиболее интересные черты преобразования таза лабиринтодонтов заключаются именно в изменениях строения ilium. У темноспондильных Eryops задний отросток заметно уменьшался в размерах до небольшого выступа на каудальном краю вертикальной пластины ilium, что свидетельствует о постепенном все большем вовлечении осевого скелета в сочленение с тазом. Крестцовое ребро постепенно становится все более крупным. У Eugyrinus задний отросток ilium заметно уменьшен, а дорсальная пластина ilium отклонена назад. Таз Archeria оказывается генерализованным типом для всех палеозойских амфибий и ранних рептилий, с треугольным acetabulum, неразделенной широкой лобково-седалищной пластиной и коротким pubis (Romer, 1957). Интересен процесс появления окостенений тазового пояса в эволюции тетрапод. У ихтеостегид передний, лобковый, край таза не окостеневал (Clack, 2000). У каменноугольных и более поздних тетрапод в тазовом поясе имелись центры окостенений во всех трех частях таза. Однако нередко, как у Crassigyrinus (Clack and Carroll, 2000) или Eldeceeon и Silvanerpeton (Smithson, 2000), имелись лишь два окостеневающих элемента — ilium и ischium, тогда как передний отдел — pubis, а также вертлужная впадина оставались хрящевыми. Считается (Smithson, 2000), что у мелких антракозавров, отсутствие окостенения pubis есть ювенильная черта. Не исключено, что и для бесхвостых амфибий, у подавляющего большинства из которых самостоятельного окостенения pubis нет (Trueb, 1996; Roček, Rage, 2000b; Trueb et al., 2000), также применимо подобное объяснение, особенно если учесть мнение о педоморфном происхождении этой группы от темноспондильных амфибий, которые имели все три тазовых окостенения (Smirnov, 1999; Roček, Rage, 2000a). Среди современных амфибий наиболее просто устроеным тазовым поясом и крестцом обладают хвостатые, Caudata. Строение их таза и крестца напоминает таковое стегоцефалов — специализированное крестцовое ребро своим концом причленяется к костному ilium, направленному от acetabulum вверх и вперед. Остальная часть таза представлена горизонтальной хрящевой лобково-седалищной пластиной, которая не разделена у взрослых животных на правую и левую половины. На ее каудальном краю имеется парное окостенение ischium, удаленное от acetabulum. Впереди от этой пластины имеется предлобковый хрящ, epipubis (cartilago ypsiloides). У Ascaphidae из бесхвостых амфибий, Anura, кроме epipubis имеется и залобковый хрящ, postpubis, связанный с совокупительным аппаратом и который логичнее называть hypopubis. В остальных чертах все современные бесхвостые амфибии демонстрируют довольно необычный тип строения крестца и таза. Вертлужные впадины занимают осевое положение позади крестца и даже уростиля. Соответственно, восходящий отросток ilium, ala ilii, сильно удлинен, протягиваясь от каудально смещенного acetabulum к расположенному далеко впереди крестцу. Ближайшая к acetabulum, проксимальная, часть ilium вместе с ischium и pubis образует округлую парасагиттальную пластинку, неподвижно сросшуюся с контралатеральной половиной. (Здесь и далее под дистальным концом тазового элемента понимается конец, наиболее удаленный от вертлужной впадины; ацетабулярный же конец в противоположность дистальному называется проксимальным.) У большинства Anura крестец представлен одним позвонком, несущим крестцовые диапофизы, а не ребра, как у хвостатых и предковых темноспондильных амфибий. У последних длинные крестцовые ребра сочленялись с направленным назад 16 и вверх отростком ilium, который сильно отличался от характерной двулопастевой структуры, свойственной ихтиостегидам и рептилиоморфным лабиринтодонтам (Holmes, 2000). У некоторых современных Pipidae и Bufonidae, а также у ряда ископаемых Anura в крестцово-подвздошном соединении принимают участие два-три позвонка (Шмальгаузен, 1964; Trueb, 1973), хотя этот факт оспаривается по крайней мере для Pipidae (Коваленко, 1999). 2.1.2. Рептилии, кроме архозавров От генерализованного таза ранних лабиринтодонтов дальнейшая эволюция таза вообще, и крестцово-подвздошного сочленения в частности, в линии рептилий шла в ином, чем у амфибий, направлении. У Seymouriamorpha, которых в последнее время иногда рассматривают как одних из самых примитивных амниот (Laurin, 2000), поверхность ilium, обращенная к осевому скелету, заметно расширялась за счет заполнения костью района между вертикальной пластиной и задним отростком ilium. Следствиями этого, возможно, стали наклон ilium назад от acetabulum (бóльшая выраженность заднего отростка, чем вертикального), а также усиление контакта подвздошного элемента таза с осевым скелетом посредством двух крестцовых ребер у более поздних рептилий. Diadectes — Ophiacodon — Dimetrodon демонстрируют морфологический (хотя не филогенетический) ряд этого преобразования (Romer, 1956). Интересно, что у Seymouriamorpha число крестцовых позвонков зависело от среднего размера животного данного вида: крупные имели два позвонка, мелкие — один. При этом первая пара крестцовых ребер была крупнее второй, как у Seymouria, или же только одно из первой пары ребер (правое или левое) контактировало с ilium, как у Kotlassia (Laurin, 2000). Последнее утверждение, возможно, является лишь недоразумением, так как, скорее всего, основано на работе Быстрова (Bystrow, 1944), где изображено соединение с ilium последнего настоящего туловищного ребра на одной стороне тела у экземпляра, имевшего на самом деле только одну пару крестцовых ребер. У всех рептилий три тазовых окостенения. Все три элемента вносят вклад в acetabulum еще у Seymouriamorpha, и такое строение таза всегда сохряняется у рептилий, не относящихся к ветви архозавров, Archosauria. Между лобковой и седалищной костями у большинства сеймуриаморф образуется седалищно-лобковое окно, fenestra ischiopubica, или тироидное окно fenestra thyroidea. Разделение лобковоседалищной пластины на лобковую и седалищную части происходило независимо во всех современных группах рептилий. Эти изменения обычно связывают с эволюцией mm. puboischiofemorales externus et internus (Romer, 1956; Hutchinson, 2001). Запирательный нерв, nervus obturatorius, может проходить либо через единственное запирательное отверстие, foramen obturatorium, в pubis, либо между pubis и ischium через fenestra ischiopubica. Нижняя часть таза претерпевала в эволюции рептилий различного рода преобразования и принимала сложные формы с различным взаиморасположением pubis и ischium (см. ниже). У рептилий в сочленении с тазом принимают участие специализированные крестцовые ребра. Число крестцовых позвонков у базальных рептилий обычно невелико — два-три, но может быть и больше. Интересно заключение Ромера (Romer, 1956): у настоящих рептилий по сравнению с Seymouriamorpha появляется бóльшее число позвонков крестцовой области в результате вовлечения в состав крестца позвонков 17 из хвостовой области, но дальнейшее увеличение их числа происходит не всегда за счет хвоста. Отмечу некоторую, не очень четкую связь между включением в крестцовую область позвонков из смежных участков позвоночника и расширением ilium: подвздошный элемент расширяется с той стороны от acetabulum, с которой происходит вовлечение новых позвонков. У Cotylosauria подвздошная кость обычно направлена вверх и назад и сочленяется с двумя-четырьмя крестцовыми ребрами. В крестце черепах, Testudinata, два позвонка. У скрытошейных черепах, Cryptodira, крестцовые ребра, как и зигапофизы, как правило, хорошо развиты, хотя тела крестцовых позвонков сращены друг с другом. У бокошейных черепах, Pleurodira, крестцовые ребра рудиментарны, а ilium связан с панцирем посредством удлиненных ребер последних двух-четырех грудных позвонков и теряет непосредственную связь с крестцом (Hoffstetter and Gasc, 1969). Pubis и ischium сращены с пластроном. Связь с тазом может, однако, в некоторых случаях быть и у первой пары крестцовых ребер, хотя чаще всего крестцовые позвонки морфологически мало отличимы от хвостовых позвонков. У всех современных черепах запирательный нерв проходит через тироидное окно. Ilium направлен вверх и назад от acetabulum, pubis и ischium — во внутрь и слегка вниз к симфизу, так что лобково-седалищная костная пластина лежит почти в горизонтальной плоскости. Ischium обычно значительно шире pubis. Как pubis, так и ischium снабжены латеральными отростками, которые опираются на xyphiplastron, а у некоторых черепах их костные манжетки объединены. У эмбрионов черепах от тазового симфиза вперед всегда выступает предлобковый хрящ, epipubis, иногда очень большой, а позади симфиза располагается маленькое хрящевое hypoischium. Степень окостенения таза у взрослых варьирует, pubis и ischium могут оставаться разделенными хрящом. Иногда окостеневает epipubis. У вымерших Macrobaenidae окостеневает и hypoischium (Татаринов, 1959). Следует отметить, что в последнем случае речь идет не о самостоятельном элементе, а о разрастании хряща симфизов. У чешуйчатых ящеров, Lepidosauria, как вымерших, так и современных, два крестцовых позвонка. У большинства ящериц, Lacertilia, как и у клювоголовых, Sphenodontida, ilium направлен от вертлужной впадины вверх и назад, ischium — вниз и назад, pubis — вниз и вперед. Последний обычно имеет сильноразвитый передний бугор. Тироидное отверстие обычно хорошо развито. С небольшими модификациями такая форма таза и состав крестца свойственны большинству чешуйчатых рептилий, Squamata. У ряда представителей Lacertilia (например, у некоторых гекконов, Gekkonidae) может быть три позвонка в крестце (Hoffstetter and Gasc, 1969; Wellborn, 1997). Особый интерес представляет явление редукции конечностей и поясов у чешуйчатых рептилий. У безногих форм крестцовых позвонков один или ни одного (Sewertzoff, 1931; Hoffstetter and Gasc, 1969). Тазовый пояс может отсутствовать, как у большинства продвинутых змей, или быть в различной степени редуцированным. У Cylindrophis rufus (Aniliidae) скелет тазового пояса наиболее полный из всех представителей семейства, окостеневший и устроен аналогично таковому Boidae. В нем можно выделить все три части, присущие остальным тетраподам. У Anilius scytale (Aniliidae) тазовый пояс — один из наиболее редуцированных, и имеется только у самца. Он представлен окостенением ilium и хрящевой остальной частью пояса (Mlynarski and Madej, 1961). В различных филогенетических линиях ящериц, в которых наблюдается редукция конечностей и поясов (Scincidae, Anguidae), после18 довательность их редукции такова: сначала исчезают элементы свободной конечности, затем происходит редукция нижних (ischium и pubis) элементов таза, начиная от симфизов, так что у видов с крайними состояниями редукции пояса, таких как Anguis fragilis (Anguidae), они представлены лишь небольшими нижними отростками единственного самостоятельного элемента таза. Его основу составляет ilium, который сохраняет, как правило, связь с осевым скелетом, контактируя с единственным крестцовым ребром. Таким образом, в морфологических сериях от форм с нормальным тазом к формам с редуцированным тазом ilium демонстрирует наибольшую стабильность среди тазовых элементов и подвергается наименьшей редукции (Stokely, 1947). Среди полностью водных групп рептилий редукция крестца и таза наблюдается у ихтиозавров, Ichthyopterygia, однако, она имеет свои, не наблюдаемые у чешуйчатых рептилий, особенности. Крестца как такового у большинства ихтиозавров нет. Лишь для раннетриасовых Chaohusaurus и Utatsusaurus известен один или два крестцовых позвонка с расширенными дистально ребрами. У более поздних ихтиозавров ни тела позвонков, ни ребра не демонстрируют какой-либо специализации на границе туловища и хвоста (McGowan and Motani, 2003). Крестцовую или тазовую область позвоночника, однако, у ихтиозавров выделяют для обозначения положения таза: чаще всего на 45-ом позвонке достигается объединение ди- и парапофизов в единый поперечный отросток. Такую границу туловища и хвоста в принципе можно найти и в скелете других рептилий и птиц, у которых полное объединение верхних и нижних поперечных отростков достигается на последних туловищных или первых хвостовых позвонках. У ихтиозавров палочковидная, часто сильно редуцированная подвздошная кость, направленная от вертлужной впадины назад и вверх, как правило, указывает на эту условную границу туловищного и хвостового отделов позвоночника своим дистальным концом. Особенностью вентральной части таза ихтиозавров является сращение pubis и ischium, наблюдающееся у поздних форм. От позднетриасовых Macgowania к позднеюрским Ophtalmosaurus и Stenopterygius можно построить полный морфологический ряд с переходом от широких пластинчатых и раздельных к палочковидным и слитым почти без следа по своей длине pubis и ischium (McGowan and Motani, 2003). Иногда остается борозда или отверстие, указывающие на границу двух элементов. При этом ilium у ранних форм, как правило, еще может быть расширен на дистальном конце, хотя и потерял связь с осевым скелетом. Интересно, что у всех ихтиозавров сохраняются функционирующие задние конечности в виде ласт со всеми тремя отделами скелета: стилоподием, зейгоподием и автоподием. В этом состоит кардинальное отличие редукции таза у ихтиозавров от таковой у чешуйчатых рептилий — сперва исчезает крестцово-тазовое сочленение, а пояс редуцируется прежде в верхней, а только потом — в нижней своей части. 2.1.3. Архозавры Палеонтологические открытия последних лет делают неуловимой грань между птицами и динозаврами (см. например: Novas and Puerta, 1997; Chen et al., 1998; Ji et al., 1998; Xu et al., 2003). Последние представляют многочисленную и разнообразную группу архозавров, к которым из современных форм относят также крокодилов. В настоящей работе я рассматриваю всех архозавров, включая птиц, в одном разделе, 19 отделяя их от остальных рептилий, исходя из их филогенетической общности и для удобства изложения. Исходно архозаврам свойственны удлиненные pubis и ischium, соединяющиеся, как правило, только в районе acetabulum и расходящиеся от него под прямым углом вперед и назад, вместе с ilium придавая тазу характерное трехлучевое (трехрамное) строение (Romer, 1956; Galton, 1970). В отличие от Lepidosauria и Testudinata, у архозавров в филогенезе устанавливается не тироидное отверстие, которое возникает в результате истончения вертлужной части единой лобково-седалищной пластины (с сохранением нижнего соединения ипсилатеральных pubes и ischia), а лобковоседалищное окно, fenestra ischio-pubica, — за счет вилочкообразного удлинения дистальных концов обеих костей (Hutchinson, 2001). Наиболее просто устроены крестец и таз у текодонтов, Thecodontia, и крокодилов, Crocodilia: в крестце два позвонка. Ранние текодонты имеют весьма примитивный таз со слабо расширенным ilium и единой лобково-седалищной пластиной, лишь у поздних текодонтов нижние элементы таза удлиняются, придавая типичную трехлучевую структуру всему тазу. Для крокодилов характерна бóльшая, чем у лепидозавров, ширина подвздошных костей и величина fenestra ischio-pubica. Характерной особенностью тазового пояса крокодилов (за исключением Protosuchia) является и то, что acetabulum сложена проксимальными частями всего лишь двух костей таза — ischium и ilium. Pubis оказывается подвижным, он вторично укорочен, но направлен вперед в отличие от pubis многих продвинутых архозавров (Hutchinson, 2001). Некоторую подвижность имеет также pubis птерозавров, Pterosauria. Последние имеют, как правило, примитивный и слаборазвитый таз, хотя часто обладающий дополнительным самостоятельным окостенением — praepubis. Динозавры, Dinosauria, подразделяются на две большие группы, в основу разделения которых легло строение таза: ящеротазовые, Saurischia, у которых таз чаще классический — трехлучевой, а pubes и ischia образуют симфизы, и птицетазовые, Ornitischia, у которых pubis состоит из двух ветвей — praepubis, отростка, направленного вперед, и postpubis, или собственно pubis, направленного назад, что придает тазу четырехлучевое строение, а симфиз обычно образуют только ischia. Отросток pubis — processus pectinealis, который исходно имеется у большинства рептилий (Romer, 1956) и рано появляется в онтогенезе (Romer, 1942), возможно, является гомологом praepubis Ornithischia (Hutchinson, 2001). Иногда этот отросток рассматривают как рудимент передней ветви лобкового отдела таза (Шмальгаузен, 1938). У некоторых птиц он имеется и даже значительный, но у большинства отсутствует (Wassif et al., 1980). Птицетазовые динозавры интересны нам прежде всего тем, что их лобковая кость располагается вдоль седалищной и направлена назад от вертлужной впадины (опистопубия). Обычно говорят, что pubis развернут назад по сравнению с исходным состоянием (препубия, как у большинства остальных рептилий). У продвинутых птицетазовых, например у Iguanodontidae, наблюдалось дальнейшее значительное усложнение строения таза за счет предлобкового отростка, который не просто был направлен вперед, но располагался латеральнее остального таза и был вертикально уплощен. У всех двуногих форм ящеротазовых динозавров происходит увеличение числа позвонков, входящих в состав крестца, при совершенно различном устройстве таза. Это увеличение не связано с размерами: мелкие формы могли иметь протяженный сложный крестец, а крупные — Carnosaurus, Tyrannosaurus — крестец с относитель20 но небольшим числом крестцовых позвонков (Hutchinson, 2001). Наиболее заметное изменение ilium — это его значительное, даже по сравнению с ilium крокодилов, кранио-каудальное расширение. Увеличение числа позвонков в составе крестца происходило у ящеротазовых динозавров постепенно. Считается, что у всех добавился сначала один позвонок спереди в связи с развитием преацетабулярной части ilium. В линии Saurischia у звероногих, Theropoda, в состав крестца вошел еще один хвостовой позвонок (Hutchinson, 2001), у многих мелких бегающих двуногих форм число позвонков увеличивалось до шести и более. Самые ранние из известных птиц — Confuciusornithidae — имели 7 (Hou et al., 1999), ранние Ornithurae — 10 (Hutchinson, 2001), а современные птицы — 10–15 позвонков в составе сложного крестца, synsacrum (Wassif et al., 1980). Помимо расширения ilium и удлиннения крестца, у Saurischia наблюдаются серьезные изменения в нижней части таза. Так, у карнозавров направленные вперед pubes образуют не только мощный симфиз, но и каждый в отдельности — расширение на своем дистальном конце («ботинок»), распространяющееся вперед и назад от симфиза. Очень часто срастание pubes начинается далеко от симфиза, когда контралатеральные лобковые элементы резко сходятся и, подойдя вплотную друг к другу, направляются далее вентрально, образуя между собой продольное сращение или так называемый «фартук». Это сращение может быть плотным до самого «симфиза» (дистальных концов pubes), либо образовывать небольшой просвет по ходу костей (foramen pubicum). Оно, возможно, коррелирует с наличием «ботинка». Пространство между pubis и ischium занято соединительной тканью у большинства современных рептилий. В филогенетическом ряду от ранних Theropoda к птицам наблюдается редукция фартука в направлении от проксимального конца pubes к дистальному. Эта редукция коррелирует со все большим углом поворота pubes назад от вертлужной впадины, редукцией «ботинка», потерей симфиза или контакта контралатеральных половин и их расхождением (Hutchinson, 2001). Расхождение ischia у птиц сопровождало процессы разворота pubes назад и расширения постацетабулярной части таза (Hutchinson, 2001). Длина ischia была уже уменьшена у целурозавров (Novas and Puerta, 1997), а затем вторично увеличивалась у Ornithurae и Alvarezsauridae (Hutchinson and Chiappe, 1998), что также сопровождало дальнейшее отклонение pubes и ischia кзади и расширение таза (Hutchinson, 2001). Птицы (Aves) — ближайшие современные родственники динозавров, и поэтому обладают многими чертами строения, свойственными их предкам — тероподам. Так же как и у продвинутых Theropoda и Ornithischia, pubis птиц направлен назад параллельно ischium. Нижние элементы тазового пояса не формируют симфизов с контралатеральными половинами и сильно разведены (исключение составляет африканский страус), что традиционно считается приспособлением для откладки крупных, покрытых твердой скорлупой яиц. Тазовый пояс птиц также отличается очень большой шириной ilium, образующим соединение со сложным крестцом, synsacrum, но в отличие от нижних элементов таза, ilia противоположных сторон оказываются часто сильно сближенными вдоль продольной оси тела, особенно в краниальной своей части, а у нелетающих форм (Struthio, Apterix ) даже срастаются с остистыми отростками позвонков сложного крестца. Слияние крестцовых ребер в спинную пластинку ковнутри от пластин ilium — черта строения Neognathae, коррелирующая с расширением крестца. Какие именно позвонки вошли в состав synsacrum, никто точно не знает, и отно21 сительно его состава существуют различные мнения (на примере домашней курицы, рис. 4): 1. Первые четыре позвонка — сложнокрестцово-грудные, следующие четыре — сложнокрестцово-поясничные, два последующих — «первичные» или «истиннокрестцовые», а заключают сложный крестец три-четыре сложнокрестцово-хвостовых позвонка (du Toit, 1913; Nickel et al., 1977). 2. Один позвонок — грудной, четыре — поясничные, четыре — пояснично-крестцовые, два — первично-крестцовые, четыре — посткрестцовые (Wassif et al., 1980). 3. Один позвонок — грудной, следующие один-два — поясничные, а последующие двенадцать — крестцовые (Селянский, 1968). 4. Один позвонок — грудной, четыре — поясничные и девять — крестцовые (Burke et al., 1995). 5. Существуют два «истинно-крестцовых» позвонка, шесть поясничных, один грудной и шесть хвостовых позвонков (Гуртовой и Дзержинский, 1992). 6. Все позвонки сложного крестца являются vertebrae synsacrales (Baumel et al., 1979). Исключение сделано для грудного позвонка, который несет ребра, не связанные с грудиной, а также имеет часто синдесмоз с последующим позвонком сложного крестца. Впервые понятие «первичных» или «истинных» крестцовых позвонков употребил Гегенбаур (Gegenbaur, 1871) применительно к двум центральным позвонкам synsacrum птиц на том основании, что они несут рудиментарные ребра, которые во взрослом состоянии сращены с позвоночником. Иначе он называл эти позвонки ацетабулярными, поскольку они лежат напротив вертлужной впадины. Это не точно — на самом деле они расположены либо на, либо позади линии, соединяющей противоположные вертлужные впадины. Уместно отметить, что первично-крестцовых позвонков не всегда два — у Charadriiformes такой позвонок один (Wassif et al., 1980). Последние авторы вообще утверждают, что два центральных позвонка всего лишь «напоминают крестцовые позвонки рептилий» (там же, с. 40). При этом они ссылаются на факт их сочленения с ilium посредством диапофизов и парапофизов, т. е. отростков, тогда как у большинства рептилий крестцовые позвонки сочленяются с тазом посредством ребер. Как бы то ни было, с конца XIX века сравнительные анатомы чаще гомологизируют «первично-крестцовые» позвонки птиц с двумя крестцовыми позвонками рептилий (Шмальгаузен, 1938; Дзержинский, 1998; du Toit, 1913; Boas, 1933; Romer, 1956). 2.1.4. Therapsida Sinapsida имели в крестце два-три позвонка, хотя в некоторых случаях их число доходило до восьми. Подвздошная кость расширенная, распространяющаяся немного вперед от вертлужной впадины. Вентральный отдел тазового пояса пластинчатый, и тироидное отверстие не выражено; оно, однако, развивается у высших зверообразных, Therapsida. У них число крестцовых позвонков увеличивается, лобковая кость укорачивается, а тироидное отверстие в большинстве случаев хорошо развито. У некоторых Theriodontia fenestra thyroidea отсутствует, зато foramen obturator — увеличено. У цинодонтов, Cynodontia, в крестце от трех до восьми позвонков, а подвздошная кость сильно разрастается вверх и вперед, расширяясь вдоль увеличенного крестца (Татаринов, 1976). 22 Современные млекопитающие, Mammalia, не отличаются большим разнообразием строения таза, как, впрочем, и крестца. Как и у других амниот, таз состоит чаще из трех элементов: ilium, направленного вперед от acetabulum к крестцу, а также pubis и ischium, направленных назад. Интересно, что направление pubis назад от вертлужной впадины у млекопитающих практически не обсуждается в литературе, в отличие от интенсивных дебатов о причинах и значении опистопубии зауропсид, хотя опистопубическая форма таза млекопитающих ничуть не менее выражена. Нижние ветви таза замыкают запирательное окно, fenestra obturatoria, так как тироидное окно объединено с отверстием для запирательного нерва. В крестце млекопитающих обычно более двух позвонков, как правило, сросшихся между собой. Более каудальные обычно считают сакрализованными хвостовыми позвонками. Проксимальная (вертлужная) часть pubis претерпевает самостоятельное окостенение и называется вертлужной костью — os acetabulare (Шимкевич, 1905). У взрослых животных все четыре костных элемента срастаются в единую безымянную кость, os innominatum. Контралатеральные элементы нижней части таза образуют симфизы, а у большинства современных млекопитающих нижние ветви таза еще и образуют широкое лобково-седалищное сращение и общий симфиз (кроме Insectivora sensu lato, Primates и Carnivora). Примитивные группы млекопитающих, такие как однопроходные и сумчатые, обладают «сумчатыми» костями, ossa prepubica. Эти элементы расположены впереди от лобковых и подвижно связаны с последними. Уникально строение крестцово-тазового комплекса у Xenarthra. В частности, у ленивцев и муравьедов, имеются не только необычные дополнительные сочленения между позвонками, что отражено в названии группы, но и необычное седалищнопозвоночное сочленение (Кэрролл, 1993). У осмотренного мной экземпляра ленивца Bradipus sp. из коллекции кафедры зоологии позвоночных СПбГУ с крылом подвздошной кости, ala ilii, соединялись четыре позвонка с очень широкими поперечными отростками. Не только поперечные отростки, но и тела, и дуги этих четырех позвонков были отделены друг от друга лишь неясными швами. Самые широкие отростки на втором позвонке этой серии. Впереди них расширенный поперечный отросток еще одного, свободного от остальных, позвонка подходил вплотную к краниальному краю ilium и, возможно, ранее имел хрящевой контакт с ним. Позади два позвонка также имели расширенные диапофизы, которые швом соединялись с ischium. Между ними имелся нормальный сустав, а первый из них швом соединялся с впередилежащими крестцовыми позвонками. У муравьедов, Myrmecophaga, в сочленении с тазом участвует до девяти позвонков, причем ilium образует шовное соединение с поперечными отростками крестцовых позвонков, а ischium — хвостовых (Gregory, 1951). Есть и другая возможность интерпретации такого крестцово-тазового комплекса. Можно считать все позвонки, вступающие в сочленение с тазом, крестцовыми. К сожалению анатомические наблюдения не дают возможности решить этот вопрос более или менее точно, так же как и в случае с «сакрализацией» хвостовых позвонков у остальных млекопитающих и рептилий. Называть ли позвонок, лишь частично обладающий свойствами крестцового, крестцовым или нет, один из крупнейших морфологов А. Ромер считал «делом вкуса» (Romer, 1956, p. 276, 280). Далее будут приведены аргументы в пользу второй из названных интерпретаций, а также выдвинута гипотеза о механизме развития такого необычного не только для млекопитающих, но и вообще для тетрапод крестца. 23 2.2. УСТРОЙСТВО КРЕСТЦОВО-ТАЗОВОГО КОМПЛЕКСА У ОБЪЕКТОВ ИССЛЕДОВАНИЯ 2.2.1. Настоящие ящерицы (Lacertidae) Нормальное строение крестца и таза ящериц, Lacertilia, неоднократно подвергалось изучению и подробно описано в литературе (Mivart and Clarke, 1877; Sabatier, 1880; Moodie, 1907; El-Toubi, 1938, 1947; El-Toubi and Khalil, 1950; Kamel, 1951; Romer, 1956; Holder, 1960; Hoffstetter and Gasc, 1969; Raynaud et al., 1975; Raynaud, 1985; Rieppel, 1992). Здесь приводятся лишь самые краткие сведения об устройстве крестцово-тазового комплекса настоящих ящериц, Lacertidae. Как и большинство современных рептилий, настоящие ящерицы обладают крестцом, состоящим из двух позвонков, с мощными крестцовыми ребрами, осуществляющими соединение с ilium (рис. 5, а). У взрослых животных эти ребра без следа прирастают к невральным дугам. Первое крестцовое ребро заметно крупнее второго и контактирует с ilium в средней трети последнего, а задним своим краем налегает на второе крестцовое ребро. Второе крестцовое ребро образует ложе для ilium на своем верхнем дистальном краю. Положение крестца в позвоночнике варьирует у разных видов. Так, у L. agilis крестцовыми чаще всего являются 30 и 31 позвонки (как вариант встречается 29 и 30), у Z. vivipara — 27 и 28 позвонки (28 и 29), а у единственного исследованного экземпляра D. saxicola крестцовыми были позвонки 29 и 30. Нередки случаи аномального строения крестца (рис. 5, в; 6). Таз настоящих ящериц трехлучевой. Цилиндрический ilium направлен от вертлужной впадины вверх и назад к крестцовым позвонкам, которые расположены каудальнее acetabulum. В нижней трети ilium на его латеро-краниальной поверхности расположен краниальный отросток, processus cranialis, прикрывающий сверху и сзади acetabulum. Pubis булавовидный, утолщается к симфизу и направлен вперед и вниз от acetabulum почти в одной плоскости с ilium. В проксимальной трети pubis имеется направленный назад гребенчатый отросток, processus pectinealis. Ischium направлен вниз и назад перпендикулярно ilium и pubis и сильно расширяется к симфизу (рис. 5, б, г). Длина симфиза ischia превосходит длину симфиза pubes в три-четыре раза. Дистальные концы всех элементов таза в районе симфизов, места контакта ilium с крестцовыми ребрами, а также место схождения элементов таза к acetabulum у молодых особей L. agilis хрящевые. На тотальных ализариновых и гистологических препаратах взрослых особей всех исследованных видов настоящих ящериц видны дополнительные конструкции в районе таза — два непарных шиловидных элемента на оси тела впереди (epiischium) и позади (hypoischium) симфиза седалищных костей (рис. 5, б, г). При приближении к симфизу данные элементы слегка утолщаются. У D. saxicola имеется отдельный элемент впереди симфиза pubes — epipubis, окрашиваемый ализарином. Гистологически эти элементы — кальцинированные хрящи, не покрытые костной манжеткой. 2.2.2. Птицы В 1933 году Боас (Boas, 1933) предложил систему индивидуальных обозначений позвонков разных морфологических типов в составе сложного крестца птиц. 24 Передние, сложнокрестцово-грудные позвонки, несущие мощные парапофизы и диапофизы, он обозначал от последнего к первому буквами греческого алфавита (далее именуются «греческой» серией позвонков). Позвонки следующей группы (сложнокрестцово-поясничные по: du Toit, 1913), не имеющие парапофизов, а несущие лишь диапофизы, Боас нумеровал арабскими цифрами от переднего к последнему («арабская» серия). Позвонки заключительной группы с диапофизами и парапофизами (или ребрами на месте парапофизов) автор описываемой системы обозначал от первого к последнему буквами латинского алфавита («латинская» серия). В рамках этой группы «истинно-крестцовые позвонки», хотя и называются так, но не выделяются в качестве отдельной серии, а имеют сквозную нумерацию с последующими сложнокрестцово-хвостовыми позвонками. У домашней курицы и японского перепела в сложный крестец чаще всего входит 15 позвонков, у дрозда-рябинника — 12 (рис. 7, а, б ). Позвонки курицы и перепела по трем описанным сериям распределяются следующим образом: четыре позвонка в «греческой», пять позвонков в «арабской», шесть позвонков в «латинской». У дрозда-рябинника общее число позвонков в составе synsacrum меньше из-за позвонков «арабской» серии — их всего два. Эта особенность характерна не только для этого вида — у воробьинообразных птиц, Passeriformes, по сравнению с другими отрядами, число позвонков, входящих в состав synsacrum, всегда меньше (Wassif et al., 1980). Если следовать приведенной системе обозначений, то нормальное (чаще встречающееся) строение сложного крестца домашней курицы и японского перепела описывается краткой формулой δ5f . Крестец дрозда-рябинника описывает формула: δ2f (рис. 7, а, б ). Иными словами, если не рассматривать вариаций в числе позвонков, входящих в ту или иную серию, то первый позвонок сложного крестца этих птиц обычно должен быть обозначен буквой δ греческого алфавита. Наиболее каудальный позвонок «греческой» серии и, как правило, самый крупный в ней — это всегда позвонок α, т. е. первый в этой серии, но четвертый по счету от начала synsacrum. Первый «истинно-крестцовый» позвонок оказывается либо десятым (у курицы и перепела), либо седьмым (у дрозда) по сквозной нумерации с начала synsacrum, но при этом всегда обозначен латинской буквой a, а последний позвонок «латинской» серии и, одновременно, всего synsacrum — латинской буквой f . При описании строения и развития сложного крестца птиц я далее придерживаюсь приведенной системы обозначений позвонков. Так как synsacrum домашней курицы и японского перепела очень сходны и различаются лишь незначительными деталями, то ниже приведены описания нормального строения synsacrum только у домашней курицы и дрозда-рябинника. Описание сложного крестца домашней курицы составлено для одного, имеющего наиболее типичное строение экземпляра (рис. 7, а) и дополнено краткой информацией о вариантах строения. Описания отдельных позвонков приведены в краниокаудальном порядке. Позвонки обозначены по классификации Боаса (Boas, 1933), кроме того, их положение показано с помощью сквозной нумерации, для чего использованы римские цифры (в скобках). «Греческая» серия. Позвонки этой серии несут диапофизы, парапофизы и высокие остистые отростки. Парапофизы всех позвонков «греческой» серии контактируют с ilium в месте максимального прогиба к осевому скелету его преацетабулярного крыла, ala preacetabularis ilii. Между позвонками — округлые межпозвоночные отверстия. Первый позвонок δ сложного крестца отделен от последующих позвонков швом, все остальные позвонки слиты в единый блок. 25 δ (I) имеет все черты заднегрудного. Двухголовчатое ребро не соединено с грудиной и подвижно сочленено с позвонком на мощном и высоко поднятом диапофизе и на коротком парапофизе, который имеет сочленовную поверхность у основания невральной дуги. Ребро, как правило, укорочено по сравнению с ребрами предыдущих позвонков. γ (II) и β (III) позвонки ребер не несут. Диапофизы короче; на позвонке γ основание диапофиза лежит ниже, чем на позвонке δ. Диапофиз и парапофиз на позвонке β по всей длине от основания до дистальных краев слиты друг с другом без шва в единую вертикальную костную пластину. Их общее основание протягивается от остистого отростка вниз до тела позвонка. У некоторых экземпляров диапофиз и парапофиз неполно объединяются, оставляя между собой круглое отверстие. α (IV) позвонок имеет мощные парапофизы, в основном сложенные дистально хрящем даже у трехмесячных птиц и менее развитые диапофизы. Так же, как и на предыдущем позвонке, у некоторых экземпляров верхний и нижний отростки могут быть слиты неполностью — с отверстием или, по крайней мере, истончением костной пластины между ними. «Арабская» серия. Обычно без парапофизов и с понижающимися от первого к последнему остистыми отростками. Межпозвоночные отверстия вытянуты вертикально, щелевидные. 1 (V) позвонок имеет относительно короткие, направленные косо вверх диапофизы. У некоторых экземпляров этот позвонок может приобретать черты IV и нести лишь немного уступающие по размерам парапофизы, контактирующие с тазом. В этом случае он должен именоваться позвонком α, а дальнейшая нумерация арабскими цифрами начинается с позвонка VI. Формула synsacrum изменяется на ε4f. 2 (VI) — 4 (VIII) позвонки имеют диапофизы, направленные вверх и вбок. Тела широкие, так что тело позвонка 3 почти равно по ширине позвонку α вместе с его парапофизами. 5 (IX) позвонок схож с предыдущим, но может нести рудиментарные парапофизы в виде острых, шиповидных отростков, не достигающих ilium. В одном случае позвонок 5 напоминал позвонок a, т. е. должен быть отнесен к «латинской» серии; соответственно, «арабская» серия состояла всего из четырех позвонков, а «латинская» — из семи. Формулу synsacrum для этого позвоночника, таким образом, следовало записать как δ4g. Позвонки 4 и 5 имеют самые длинные диапофизы из всех позвонков synsacrum, краниально и каудально диапофизы постепенно уменьшаются в длине. На одном скелете «арабская» серия позвонков была увеличена до шести позвонков с двумя практически идентичными, несущими самые длинные диапофизы позвонками 5 и 6. Число позвонков в «греческой» и «латинской» сериях оставалось при этом неизменным. Формулу synsacrum для этого варианта следовало записать как δ6f. «Латинская» серия. Позвонки несут диапофизы и парапофизы. На первых двух позвонках вместо парапофизов имеются крестцовые ребра, которые по размеру крупнее следующих за ними парапофизов. Дистально и ребра, и парапофизы слиты со своими соседями. Позвонки этой серии не имеют остистых отростков. Отверстия для спинномозговых нервов округлые и очень маленькие в диаметре. Диаметр спинномозгового канала и высота невральных дуг уменьшаются каудально; при продвижении от первого позвонка к последнему их тела становятся все более узкими. a (X) и b (XI) позвонки несут диапофизы, направленные вбок и слегка вверх, а 26 также ребра на месте парапофизов. У взрослых экземпляров отличить по виду ребра от парапофизов последующих позвонков серии трудно, хотя иногда сохраняется шов на костной манжетке вследствие окостенения невральной дуги и ребра двумя самостоятельными центрами. У молодых экземпляров ребра явственно различимы и при препарировании могут быть легко отделены от позвонка. Парапофизы слиты с телами позвонков неразличимо. c (XII) — f (XV) позвонки имеют парапофизы и диапофизы, слитые дистально. В этом ряду позвонков ширина и высота тел падает, диапофизы и парапофизы становятся все более слитыми, вначале дистальными концами, а каудальнее — и по всей длине так, что на последнем позвонке серии их не различить. Полное слияние может быть достигнуто на разных позвонках. Ряд деталей строения отличают сложный крестец дрозда-рябинника. В «греческой» серии позвонков (рис. 7, б ). Первый позвонок сложного крестца (δ) несет ребра и отделен швом от последующего позвонка. Поперечный отросток позвонка γ — высокий и мощный, сложенный диа- и парапофизами, слитыми по всей их длине от основания до дистального края. Позвонки β и α имеют раздельные диапофизы и парапофизы с широкими просветами между ними. Позвонок α самый широкий во всем сложном крестце, хотя позвонок β лишь слегка ýже. Все позвонки этой серии имеют высокие остистые отростки. «Арабская» серия позвонков состоит всего из двух позвонков без парапофизов. На позвонке 1 диапофиз очень короткий, такой же, как на α, а на позвонке 2 — самый длинный во всем сложном крестце. Высота слитых остистых отростков резко падает от первого ко второму. В «латинской» серии позвонков a и b имеют ребра, срастающиеся с невральными дугами позвонков (плеврапофизы) и соединяющиеся с диапофизами своими дистальными краями. У последующих четырех позвонков, контактирующих с ilium, диапофизы и парапофизы слиты по всей их длине, как на позвонке γ. Последний позвонок «латинской» серии отделен от предыдущих очень слабой линией шва и напоминает по строению первый свободный хвостовой позвонок, не контактирующий с ilium. Он, однако, в отличие от первого свободного хвостового, так же как и остальные позвонки «латинской» серии, не несет остистого отростка, и его сложные поперечные отростки расширены дистально (у первого свободного хвостового позвонка поперечные отростки дистально сужаются). Итак, в synsacrum дрозда, как и в synsacrum курицы можно выделить группы позвонков различного строения: 1) Грудной позвонок, 2) Три позвонка с диа- и парапофизами и высокими остистыми отростками, 3) Два средних позвонка synsacrum без парапофизов, 4) Последние шесть позвонков synsacrum, несущие диапофизы и парапофизы (или ребра), но не имеющие остистых отростков. В отличие от таковых курицы, диапофизы этих позвонков ориентированы гораздо более полого, так что вместе с верхними краями невральных дуг они образуют горизонтальную плоскость, а не борозду. Строение таза птиц не раз подвергалось тщательному анатомическому описанию и морфофункциональному анализу (Гуртовой и Дзержинский, 1992; Богданович, 1997; Barkow, 1856; Boas, 1933; Nickel et al., 1977; Baumel et al., 1979; Wassif et al., 1980; Amer and Mohammed, 1981; Hutchinson, 2001). В связи с этим я привожу здесь лишь краткие сведения по анатомии таза исследованных видов птиц (рис. 7, б, в). У курицы ilium состоит из двух крыльев — преацетабулярного, ala preacetabularis ilii, и постацетабулярного, ala postacetabularis ilii. Первое начинается над вертлуж27 ной впадиной и распространяется вперед до начала synsacrum. В ширину — как и в отношении всего ilium, под шириной я понимаю протяженность вдоль позвоночника — ala preacetabularis ilii соответствует длине примерно девяти позвонков; второе крыло, ala postacetabularis ilii, — длине примерно шести-семи позвонков. Граница между alae ilii проходит напротив позвонка 5. Напротив позвонков 3 и 4 располагается acetabulum. Ala preacetabularis ilii расположено почти вертикально и прогнуто к позвоночнику, образуя латерально дорсальную ямку подвздошной кости, fossa iliaca dorsalis, медио-вентральной поверхностью срастаясь с дистальными концами диа- и парапофизов. Место контакта закрыто от наблюдения сверху и сбоку крылом. Медио-дорсальный край крыла образует гребень, crista iliaca dorsalis, который срастается с дистальными концами остистых отростков позвонков α-γ. Таким образом, ala preacetabularis ilii, соединяя собой дистальные концы остистых отростков и диапофизов, образует костную крышу над эпаксиальной мускулатурой в передней части synsacrum. Плоскость ala preacetabularis ilii находится под почти прямым углом к ala postacetabularis ilii из-за перекрученности ilium так, что постацетабулярная его часть лежит почти горизонтально и своим медиальным краем контактирует с поперечными отростками позвонков synsacrum c 5 по f . Дорсо-латеральный гребень подвздошной кости, crista dorsolateralis, отделяет медиальную горизонтальную часть ala postacetabularis ilii от направленной вертикально вниз под почти прямым углом сравнительно узкой латеральной части, lamina ischiadica ilii. Узкая ацетабулярная часть ilium ниже крыльев окружает вертлужное отверстие, foramen acetabulum, сверху и спереди, образуя направленный вперед мощный преацетабулярный бугор, tuberculum preacetabulares, а сверху и сзади — antitrochanter. Снизу и сзади f. acetabulum окружено основанием ischium. Ischium направлен вниз и назад от acetabulum и, немного отступя от него, имеет сужение, позади которого расположен processus obturatoris. Отсюда, далее каудально ischium расширяется в вертикально расположенную пластину. Дистально ischium сближается с ilium, образуя синхондроз с lamina ischiadica ilii своим верхним краем. Впереди от синхондроза остается подвздошно-седалищное отверстие, foramen ilioischiadicum. Вентральный край ischium вытянут каудально дальше верхнего. Направляя вперед от acetabulum предлобковый отросток, processus pectinealis, тонкий pubis сам направлен назад вдоль ischium, длиннее последнего и загибается вверх дистально. Костный pubis сливается у взрослых кур с ischium проксимально, но у цыплят в этом месте имеется хрящ. Pubis касается processus obturatorius или сливается с ним, замыкая foramen obturator. Позади этого отростка расположено лобково-седалищное окно, fenestra ischiopubica, открытое дистально у цыплят и замкнутое у взрослых кур, иногда превращаясь в несколько отверстий из-за разрастания и слияния костной манжетки ischium и pubis. Особенностью таза японского перепела является то, что каудальный край ischium неровный или даже образует у молодых птиц выемку, расположенную ближе к синхондрозу с ilium. У дрозда-рябинника ischium позади processus obturatoris почти такой же ширины, что и до него, и только совсем дистально резко расширен, с двумя, а не одной выемками на дистальном краю. Узкость ischium на большей части длины и его срастание с pubis дистально, имеет следствием образование крупного овальной формы fenestra ischiopubica. В отличие от курообразных птиц, у взрослых дроздов дорсальный край ischium слит с горизонтальной пластиной ilium, а lamina ischiadica ilii практически полностью редуцирована. Вентральный край срастается с pubis дистально и в районе processus оbturatoris. 28 2.2.3. Млекопитающие Строение крестца и таза млекопитающих здесь иллюстрируется на одном объекте (см. также п. 2.1.4.). Серая крыса представляет собой обычный лабораторный объект и ее нормальная анатомия хорошо известна. В частности, строение крестца и таза неоднократно описано в ряде руководств (Гамбарян и Дукельская, 1955; Гуртовой и Дзержинский, 1992). Здесь приводится лишь краткое описание крестца и таза крысы. Крестец (рис. 8, а) состоит из четырех позвонков, у взрослых крыс сросшихся между собой. У трехмесячных крыс между телами позвонков сохраняются швы, вдоль которых позвонки могут быть разъединены после вываривания скелета. Тела крестцовых позвонков уменьшаются в длину от первого к последнему, остистые отростки понижаются, а широкие и мощные диапофизы уменьшаются в размерах. Диапофизы первых трех позвонков крестца широкие и утолщенные дистально, их сросшиеся дистально концы образуют общее крестцовое крыло, ala sacralis. Его скошенный шероховатый край служит местом для сочленения с ilium. Проксимальные части диапофизов разделены отверстиями для спинномозговых нервов, foramina sacrales. Зигапофизы образуют подвижный сустав только между последним поясничным и первым крестцовым, а также последним крестцовым и первым хвостовым позвонками. Пре- и постзигапофизы средних крестцовых позвонков у взрослых животных неподвижно сращены друг с другом. Тела двух каудальных позвонков крестца выглядят как цилиндры. У некоторых взрослых особей к крестцу может прирастать и первый хвостовой позвонок, который отличается слабой выраженностью невральных дуг, остистых, поперечных и сочленовных отростков (Гамбарян и Дукельская, 1955; Гуртовой и Дзержинский, 1992). Таз у крысы (рис. 8, б ), как и у других млекопитающих, состоит из трех элементов — ilium, pubis и ischium, неразличимо слитых в единую безымянную кость, os innominatum. Acetabulum расположено почти на уровне позвоночника, в кранио-каудальном отношении — напротив четвертого крестцового позвонка. Pars iliaca безымянной кости от вертлужной впадины направлена слегка вверх, но больше вперед, почти горизонтально, и быстро сужается. Эта проксимальная узкая часть ilium носит название тела подвздошной кости, corpus ossis ilii. Дистальнее ilium резко расширяется в широкое крыло, ala ossis ilii. Дорсально на ilium имеется крестцовый бугор, tuber sacrale, и крестцовая вырезка, incissura sacralis, которые вместе обозначают границу между его телом и крылом. Рядом с acetabulum на corpus ossis ilii расположен подвздошный бугор, tuber ilii, который лежит примерно напротив третьего крестцового позвонка. Ala ossis ilii имеет вид длинной «двускатной крыши» со сторонами, расходящимися почти под прямым углом. Сложенное таким образом крыло ilium образует продольный гребень, crista ilii, на латеральной поверхности кости и вогнутость со стороны крестцовых диапофизов на медиальной. Ala ossis ilii накрывает своей верхней частью наклонную дистальную поверхность ala sacralis, с которой соединяется своей внутренней шероховатой поверхностью. Нижняя часть ala ossis ilii своим длинным краем смотрит вертикально вниз и кранио-вентрально также контактирует с нижним дистальным краем диапофиза первого крестцового позвонка. Ischium занимает, как и ilium, близкое положение к позвоночнику, но лежит позади и ниже acetabulum. Ischium ýже ilium и не контактирует с поперечными отрост29 ками позвонков. Его дистальный край также имеет продольный сгиб, но не столь ярко выраженный, как у ala ossis ilii. Нижняя дистальная часть ischium расширяется в тонкую треугольную пластину, нижний угол которой протягивается далеко вниз в район тазового симфиза. Pubis состоит из двух участков — короткого проксимального, смотрящего почти вертикально вниз ramus acetabularis, заканчивающегося бугром лобковой кости, tuberculum pubicum, и более длинного, направленного назад под углом 45◦ к вертикали, ramus symphyseos. Pubis и ischium одной стороны встречаются друг с другом проксимальнее, чем с одноименными контралатеральными половинами и образуют общий симфиз. Эти две ветви os innominatum, срастаясь перед симфизом, образуют большое овальное запирательное отверстие, foramen obturator. Вертлужная часть pubis представляет самостоятельную вертлужную кость, os acetabularis (Шимкевич, 1905; Гамбарян и Дукельская, 1955), которая претерпевает у 20–25-дневных крысят кальцификацию, тогда как центр окостенения появляется только у крыс месячного возраста (Harrison, 1961). У новорожденных крысят проксимальный край pubis, который входит в acetabulum, всегда хрящевой, без каких-либо следов кальцификации. У взрослых животных os acetabularis неотделима от os innominatum. Глава 3. МАРКЁРЫ КРЕСТЦА И ЕГО ЭВОЛЮЦИЯ У ТЕТРАПОД 3.1. ПЛАН СТРОЕНИЯ КРЕСТЦОВОЙ ОБЛАСТИ ЭМБРИОНОВ МОДЕЛЬНЫХ ВИДОВ У самых молодых из исследованных эмбрионов всех амниот крестцовая область характеризуется рядом особенностей строения, позволяющим уверенно находить ее на гистологических срезах. Ниже приводятся описания маркёров крестцово-тазовой области эмбрионов тех видов, которые были использованы в настоящем исследовании. 3.1.1. Прыткая ящерица Артериальная система. У молодых эмбрионов спинная аорта, aorta dorsalis, очень большая в диаметре. С ростом эмбриона ее относительный диаметр уменьшается, но она легко различима на срезах всех проекций. На передней границе 30-го, или как нередкий вариант — 29-го сегмента тела, от спинной аорты ответвляется крупная парная аллантоисная или пупочная артерия (рис. 9). Краниальнее места ветвления спинной аорты расположен 29-ый (28-ой) спинномозговой ганглий. Так как между затылочными костями черепа и первым шейным позвонком спинальный ганглий не формируется (Гуртовой и др., 1978), то я интерпретирую сегмент, предшествующий месту ветвления аорты, как последний предкрестцовый. У эмбрионов более старшего возраста место ответвления аллантоисной артерии от спинной аорты обнаруживается под передней половиной первого крестцового позвонка. Отделившись от аорты, аллантоисная артерия идет латерально и немного назад, выходя на уровень миосепты, разделяющей первый и второй крестцовые миомеры (далее — первая крестцовая миосепта). Так как аллантоисная артерия уже подразделена на соответствующие ветви, то участок аллантоисной артерии до первого ее ветвления будем называть внутренней подвздошной артерией, arteria iliaca interna (Гуртовой и др., 1978). Сразу позади ответвления a. iliaca interna спинная аорта резко сужается, превращаясь в хвостовую артерию, arteria caudalis, которая, таким образом, начинается уже под будущим крестцом (рис. 9). Это сужение спинной аорты в хвостовую артерию служит дополнительным ориентиром при определении положения будущих крестцовых позвонков. Висцеральные органы. Под первым крестцовым (30-м по счету) сегментом, т. е. местом ответвления a. iliaca interna задняя кишка открывается в клоаку — большое мешкообразное образование, слепо заканчивающееся на своем каудальном конце (рис. 9, б ). Клоака тянется от первого крестцового до первого хвостового сегмента. Ниже места, где задняя кишка открывается в клоаку, расположен выход (горло) 31 ножки аллантоиса из клоаки. При последующем развитии эмбриона задняя кишка, стенка клоаки и горло аллантоиса практически не меняют своего положения относительно позвоночника и, таким образом, также могут рассматриваться как маркёры крестца. Лимфатическая система. В краниальной части первого хвостового сегмента на стадии 32 впервые наблюдается парный зачаток крестцового лимфатического сердца, cor lymphaticum posterius. К лимфатическому сердцу под вторым крестцовым и первым хвостовым позвонками подходят два внутренних лимфатических протока, идущих от подхордового осевого лимфатического синуса (см. также: Cligny, 1899). Лимфатическое сердце соединено протоками с задними кардинальными, 30и 31-й межсегментарными венами. На стадии 33 сердце уже довольно крупное, разделено клапаном поперечно на две камеры. Его можно рассматривать как маркёр крестцовой области ящерицы, так как оно всегда расположено в первом хвостовом сегменте и хорошо различимо на гистологических срезах на всех последующих стадиях эмбрионального развития и у взрослых животных (рис. 6). Нервная система. Два крупных спинномозговых нерва крестцового сплетения, plexus sacralis, выходят впереди и позади места ответвления от аорты аллантоисной артерии и первого крестцового позвонка. Они выделяются уже у самых ранних из исследованных эмбрионов (ст. 29). 3.1.2. Серая крыса Артериальная и венозная системы. У крысы парная аллантоисная артерия — это общая подвздошная артерия, arteria iliaca communis. Она ответвляется от спинной аорты под телом 26-го, т. е. последнего поясничного, позвонка (рис. 10, а). Правая a. iliaca communis заметно больше левой по диаметру. Аорта после отделения аллантоисной артерии уменьшается в диаметре не менее, чем в три раза; после этого сужения ее называют a. caudalis. Между контралатеральными аллантоисными артериями снизу от аорты отделяется и непарная задняя брыжеечная артерия — a. mesenterica posterior, снабжающая внутренние органы тазовой области (рис. 10, б ). Аллантоисная артерия, отделившись от аорты, направлена каудально параллельно аллантоисным венам вдоль двух-трех позвонков, поворачивает вниз вдоль задней стенки брюшной полости и отделяет несколько артерий тазовой области. Здесь она получает название внешней подвздошной артерии, a. iliaca externa. Под первым-вторым крестцовыми позвонками и передним участком a. caudalis, непосредственно позади места ответвлении от аорты aa. iliacae communes, сливаются две общие подвздошные (аллантоисные) вены, venae iliacae communes очень большого диаметра. Вены подходят от конечности, огибая acetabulum сзади, а ischium — сверху. В месте своего слияния они образуют мощный подвздошный анастомоз, от которого вперед к голове направляются две задние кардинальные вены, venae cardinales posteriores. У эмбрионов, по крайней мере до стадии 19, они идут симметрично по бокам от спинной аорты вплотную к ней (рис. 10, б ). Таким образом, магистральные артерии и вены образуют под последним поясничным и первыми двумя крестцовыми позвонками сложное сплетение, позволяющее определять положение крестца на всех стадиях его развития. Висцеральные органы. Брюшная полость резко сужается позади места ответвления аллантоисной артерии (рис. 10, а). Эта узкая часть, вмещающая прямую 32 кишку и ножку аллантоиса, заканчивается тремя–четырьмя сегментами каудальнее. Еще каудальнее, на протяжении длины первых двух хвостовых позвонков и под ними, наблюдается вырост брюшной полости — мошонка. Нервная система. В заднюю конечность направляются нервы с 23-го по 27-й, из которых в поясничное нервное сплетение, plexus lumbalis, входят первые три, связанные со вторым-четвертым поясничными позвонками. Plexus sacralis слагается ветвями следующих трех спинномозговых нервов, выходящих позади последних, пятого и шестого, поясничных и первого крестцового позвонков. Остальные крестцовые нервы в plexus sacralis не входят (рис. 10, в). Запирательный нерв, n. obturatorius, выходящий из крестцового сплетения, проходит позади acetabulum и разделяет мезенхимные скопления pubis и ischium, проходя в f. obturator. Остальные крупные нервы, такие как n. ischiadicus, проходят выше. 3.1.3. Домашняя курица и японский перепел Артериальная система. У птиц нет парной общей подвздошной артерии, arteria iliaca communis, ее функции выполняют сразу три парных кровеносных сосуда, гомологичные ей и ее ветвям у рептилий и млекопитающих и отходящие от аорты самостоятельно, а именно — a. ischiadica, a. iliaca externa (syn. arteria femoralis), a. iliaca interna (syn. arteria hypogastrica, arteria pudenda communis). Эти ветви у птиц сильно разобщены вдоль a. dorsalis и ответвляются от нее напротив позвонков synsacrum разных кранио-каудальных уровней. A. ischiadica является аллантоисной и на стадиях 25–27 она очень большая в диаметре и занимает почти целый сегмент (рис. 11 а–в). Примерное ее положение — под позвонками 3 или 4 (27–28 позвонки, если считать от затылка). На стадии 30, когда осевой скелет проходит хондрификацию и выпрямляется, аллантоисная артерия находится точно под невральной дугой 28-го позвонка. Ответвление аллантоисных артерий асимметрично, но в отличие от сосудов серой крысы, левая артерия толще и отходит слегка каудальнее правой. A. ischiadica после ответвления от аорты идет каудально, потом поворачивает латерально и проходит через foramen ilioischiadicum. После отделения аллантоисных артерий спинная аорта становится хвостовой артерией, a. caudalis, при этом она сильно уменьшается в диаметре. Место перехода аорты в хвостовую артерию различается у курицы и перепела анатомически (рис. 11, в, г). Бедренная артерия, a. iliaca externa, ответвляется от спинной аорты на три-четыре сегмента впереди a. ischiadica, примерно на границе позвонков α и β, подчревная артерия, a. iliaca interna, семью позвонками каудальнее a. ischiadica, т. е. напротив позвонка f (рис. 11, д ). Сразу позади ответвления последней парной артерии от a. caudalis резко вниз отходит задняя брыжеечная артерия, arteria mesenterica posterior. Висцеральные органы. Начало клоаки примерно соответствует месту ответвления аллантоисной артерии и лежит на один позвонок каудальнее (рис. 11, е). Клоака заканчивается примерно через шесть-семь позвонков после отделения аллантоисной артерии от спинной аорты и начала a. caudalis, т. е. под местом ответвления a. iliaca interna. Лимфатическая система. Парное лимфатическое сердце лежит позади поперечных отростков позвонка f , напротив первого свободного хвостового позвонка, позади a. iliaca interna. Оно многокамерное и толстостенное, сопровождаемое каудальнее и латеральнее крупными и тонкостенными лимфатическими мешками. Вся 33 система лимфатических мешков, протоков и камер сердца соответствует по длине не менее, чем трем хвостовым позвонкам. Нервная система. Спинномозговые нервы, связанные с пятью центральными крупными ганглиями, образуют крестцовое нервное сплетение, plexus sacralis. Поясничное нервное сплетение, plexus lumbalis, образуют нервы, идущие от ганглиев при позвонках «греческой» серии (рис. 11, д ). Ганглий позади позвонка α отдает нервы в оба сплетения, связывая их в единое пояснично-крестцовое сплетение, plexus lumbosacralis. 3.1.4. Дрозд-рябинник Артериальная система. Парная a. ischiadica отходит на уровне «арабской» серии позвонков synsacrum, но на ранних эмбрионах (стадии 19–23) определить ее точное сегментное положение трудно из-за сильной изогнутости эмбриона. Позже (стадии 27–28) между затылком и артерией можно насчитать около 24 позвонков (с учетом раннего исчезновения первого шейного сомита; Huang et al., 1997). Таким образом, положение аллантоисной артерии соответствует границе между позвонками 1 и 2 «латинской» серии. Ответвление парной аллантоисной артерии асимметрично, левая ветвь по диаметру больше правой (рис. 12, а) и расположена на длину своего диаметра каудальнее, оказываясь в сегменте 2. A. iliaca externa расположена на один-два сегмента краниальнее, на границе между позвонками β и α, a. iliaca interna — на семь сегментов каудальнее, против позвонка f . Висцеральные органы. Под местом ответвления парной аллантоисной артерии у ранних эмбрионов расположена передняя граница клоаки, которая продолжается еще на протяжении почти четырех позвоночных сегментов. По мере распрямления эмбриона передняя граница клоаки смещается на два-три сегмента каудально, до уровня позвонков a и b. Лимфатическая система. Восемью-девятью сегментами каудальнее аллантоисной артерии расположено лимфатическое сердце неправильной конфигурации. Оно лежит сразу за позвонком f под поперечными отростками первого свободного хвостового позвонка (рис. 12, б, в). Впереди от лимфатического сердца лежит основание a. iliaca interna. Нервная система. Нервы пояснично-крестцового сплетения отходят от пяти спинномозговых ганглиев спереди и позади аллантоисной артерии. Нервы, идущие позади позвонков α, 1 и 2, дают крестцовое сплетение, позади позвонков α–γ — поясничное. Первые, объединяясь в n. ischiadicus, идут назад от места ответвления аллантоисной артерии от a. dorsalis, последние — впереди от этого места и направлены вдоль задней стенки брюшной полости вниз к почке задней конечности, слагая n. obturatorius. 3.2. МОРФОЛОГИЧЕСКИЕ МАРКЁРЫ КРЕСТЦОВОГО ОТДЕЛА ПОЗВОНОЧНИКА Как показано в предыдущем разделе, еще до появления скелетных зачатков крестцовые сегменты амниот легко отличимы от соседних хвостовых и поясничных благодаря наличию хорошо выраженных и стабильных по своему положению 34 морфологических маркёров. К этим маркёрам следует отнести: 1) парное тазовое лимфатическое сердце; 2) место сужения спинной аорты в хвостовую артерию и ответвления от нее парной аллантоисной артерии и других магистральных сосудов тазовой области; 3) спинномозговые нервы, входящие в пояснично-крестцовое и тазовое нервные сплетения; 4) место сужения полости тела в ректальную часть, передняя и задняя границы клоаки (если имеется). 3.2.1. Парное тазовое лимфатическое сердце Лимфатические сердца располагаются в местах соединения лимфатических сосудов с венами, имеют толстые стенки из двух слоев поперечнополосатых и гладких мышц и служат, в частности, для активного перемещения лимфы в крупные вены путем ритмичных сокращений (Великий, 1884; Cligny, 1899; Wilting et al., 1999). Несколько пар лимфатических сердец, в том числе и тазовых, имеется у амфибий и рептилий (Мирецкий, 1934; Терентьев, 1950; Cligny, 1899). Среди птиц одну пару тазовых лимфатических сердец имеют некоторые водоплавающие, использующие лимфу для эрекции копуляторного органа (Budras and Rautenfeld, 1984). У домашней курицы лимфатические сердца присутствуют только у эмбрионов (Baumel et al., 1979). Млекопитающие лишены их вовсе (Wilting et al., 1999). Размер и положение тазовых лимфатических сердец чешуйчатых рептилий неодинаковы у представителей, имеющих нормально развитые и рудиментарные задние конечности (рис. 13). У настоящих ящериц (Lacertidae) — L. agilis, Z. vivipara, P. muralis — лимфатические сердца относительно небольшие и расположены латерально от позвоночника в первом хвостовом сегменте. У безногой ящерицы-веретеницы, A. fragilis, имеющей не два, а всего один крестцовый позвонок, лимфатические сердца увеличены в размерах и располагаются в первом и во втором хвостовых сегментах. У гадюки, V. berus, не имеющей крестца, лимфатические сердца располагаются в пяти клоакальных сегментах, маркируя собой клоакальный отдел позвоночника — переходную зону от типично туловищных к типично хвостовым позвонкам. Мои данные полностью согласуются с известными из литературы сведениями о других видах ящериц и змей (Cligny, 1899; Gasc, 1965(1966); Gasc, 1966; Raynaud et al., 1975). Таким образом, размер и положение лимфатического сердца чешуйчатых рептилий коррелируют с наличием и строением крестцового отдела позвоночника. На рис. 13 приведена обобщающая схема, иллюстрирующая взаиморасположение крестцовых позвонков, ilium и лимфатического сердца у исследованных чешуйчатых рептилий. В ряду Lacerta — Vipera уменьшается число крестцовых позвонков и развитость таза, но увеличиваются протяженность клоакальной области позвоночника (определяется по лимфапофизам) и размер лимфатического сердца. Лимфатические сердца ящериц появляются за несколько стадий до начала формирования хрящевых зачатков крестцовых позвонков, и сегментное положение их переднего края — напротив первого хвостового позвонка — у рептилий, обладающих крестцом, не меняется. Даже при односторонней частичной сакрализации первого хвостового позвонка у Z. vivipara и появлении дополнительного крестцового ребра не наблюдалось изменения положения лимфатического сердца (рис. 6, см. также: Malashichev, 2001). Один из экземпляров Z. vivipara, исследованный на стадии 39, нес аномалию в крестцовом отделе (рис. 6). С левой стороны позвоночника развилось дополнительное крестцовое ребро в первом «хвостовом» сегменте. Левое та35 зовое лимфатическое сердце имело меньшие размеры по сравнению с правым. Оно располагалось позади третьего крестцового ребра. К лимфатическому сердцу шли протоки под третьим крестцовым и первым хвостовым позвонками, а не под вторым и третьим крестцовыми, как того можно было бы ожидать, т. е. они оказались смещенными назад на один сегмент относительно их нормального положения. Тем не менее левое лимфатическое сердце осталось на обычном месте. Таким образом, лимфатические сердца, положение которых у рептилий привязано к первому хвостовому позвонку, могут рассматриваться как надежные морфологические маркёры задней границы крестца. Об их положении можно судить и по позвонкам как современных, так и вымерших рептилий. На нижней поверхности крестцовых ребер и поперечных отростков хвостовых позвонков лимфатические протоки, идущие к лимфатическим сердцам, оставляют заметные борозды, а дистальные концы поперечных отростков — лимфапофизов (Cligny, 1899; Gasc, 1965(1966); Hoffstetter and Gasc, 1969; Gasc and Renous, 1979) — передне-хвостовых (у ящериц) или клоакальных (у змей) позвонков вильчато раздваиваются, обрастая мускульное лимфатическое сердце. У описанного выше аномального экземпляра Z. vivipara вокруг лимфатических протоков нижние поверхности хрящевых третьего крестцового ребра и хвостового поперечного отростка также образовали желобки. Методом введения в лимфатическую систему тазовой области нескольких видов птиц контрастных красителей с последующим рентгеновским обследованием взрослых особей показано (Budras and Rautenfeld, 1984), что лимфатические сердца располагаются у них так же, как у рептилий, в районе первого свободного хвостового позвонка, маркируя тем самым границу сложного крестца и хвоста. Мною лимфатические сердца у эмбрионов дрозда-рябинника, перепела и домашней курицы обнаружены также в первом хвостовом сегменте, т. е. позади synsacrum. Лимфатические сердца располагались под дистальными концами поперечных отростков первого свободного хвостового позвонка. Такое совпадение расположения лимфатических сердец у чешуйчатых рептилий и птиц может свидетельствовать в пользу того, что именно этот позвонок у птиц и является не только первым свободным, но и вообще первым хвостовым позвонком. Это не согласуется с распространенным мнением о том, что в состав synsacrum входят хвостовые позвонки. Интересно, что у мутантных бесхвостых кур, у которых не происходит или сильно задерживается развитие пигостиля и свободных хвостовых позвонков, сложный крестец развивается нормально (du Toit, 1913). Это также говорит о том, что развитие свободных хвостовых и последних позвонков synsacrum несколько различается — если бы это было не так, то аномалия бесхвостости кур затрагивала бы не только свободные хвостовые позвонки, но и каудальную часть synsacrum. Можно предположить, что в состав synsacrum входят не хвостовые позвонки, а позвонки, с самых ранних стадий развивающиеся иначе — по типу крестцовых. Следует, однако, учесть, что возможны ситуации, когда хвостовые позвонки действительно могут прирастать к крестцу на поздних стадиях развития (например, у аномальных или старых особей). Однако в таких случаях их легко можно отличить от крестцовых по морфологическим признакам — сплюснутым телам, низким невральным дугам, отсутствию остистых отростков, наличию всего одной пары поперечных отростков, узким отверстиям для спинномозговых нервов. Хотя у млекопитающих тазовые лимфатические сердца отсутствуют, вывод о возможности использования лимфатических сердец в качестве маркёров задней грани36 цы крестца можно усилить, если привлечь к рассмотрению амфибий. Действительно, если и за пределами группы амниот положение лимфатических сердец напротив первого хвостового позвонка будет неизменным, то их можно рассматривать как важный маркёр границы крестцовых и хвостовых сегментов. У бесхвостых земноводных пара лимфатических сердец обнаруживается впереди от клоаки по бокам от кончика уростиля, где их сокращения можно наблюдать сквозь кожу на живой лягушке без всякой препаровки (Marshall, 1888; Мирецкий, 1934; Терентьев, 1950). Лимфатические сердца у Anura лежат достаточно далеко от единственного крестцового позвонка — у кончика уростиля, но как известно (Коваленко и Анисимова, 1987), основу уростиля представляет гипохордальный хрящ, закладывающийся, несмотря на свою длину, в одном (первом закрестцовом) сегменте тела. Таким образом, лимфатические сердца располагаются у бесхвостых амфибий, как и у амниот в первом сегменте хвоста. У хвостатых земноводных тазовые лимфатические сердца также расположены у корня хвоста (Великий, 1884), т. е. их положение сходно с таковым других тетрапод. 3.2.2. Аорта и парная аллантоисная артерия У эмбрионов рептилий самый крупный сосуд, ответвляющийся от спинной аорты в области таза — это аллантоисная артерия, которая у разных видов получает несколько различные названия ввиду своего различного ветвления. У ряда агамовых ящериц, Agamidae (Гуртовой и др., 1978), она носит название общей подвздошной артерии, arteria iliaca communis, которая отделяет от себя направленную вперед надчревную артерию, a. epigastrica, и до этого ветвления называется внешней подвздошной артерией a. iliaca externa, а после него — внутренней, a. iliaca interna. Последняя, в свою очередь, после отделения a. hypogastrica, носит название седалищной, a. ischiadica, а миновав тазобедренный сустав — бедренной, a. femoralis. У настоящих ящериц, Lacertidae, как исследованных в настоящей работе, так и представителей других видов (Гуртовой и др., 1978; Raynaud et al., 1975), arteriae iliaci externa et interna выходят из спинной аорты раздельно. Аллантоисной артерией при этом является a. iliaca interna (Гуртовой и др., 1978). Эта артерия отделяется от спинной аорты у передней границы первого крестцового сегмента. Примечательно то обстоятельство, что аллантоисную артерию легко отличить от других сосудов тазовой области, так как сразу за местом отделения от аорты ее диаметр умньшается в три-четыре раза, и она становится хвостовой артерией, a. caudalis. Аналогичную картину мы наблюдаем и у млекопитающих. У большинства из них, несмотря на изменчивость ветвления кровеносных сосудов (Orsi et al., 1979; Ventura et al., 1993; Gispert et al., 1994; Ventura and Lopez-Fuster, 1994; Ventura et al., 1994), сохраняется, как и у рептилий, примерно одна схема отношений основных кровеносных стволов тазовой области (Гуртовой и Дзержинский, 1992), причем чаще всего a. iliaca communis является аллантоисной. В некоторых случаях (у хищных, Carnivora) aa. iliaci externa et interna (a. iliaca communis не выделяют) отходят самостоятельно друг за другом в соседних крестцовых сегментах, причем аллантоисной является первая (Гуртовой и Дзержинский, 1992). У крысы аллантоисная артерия покидает спинную аорту под последним поясничным позвонком, т. е. немного краниальнее передней границы крестца. Непосред37 ственно же под крестцом у крысы располагается крупный венозный анастомоз, а аллантоисная артерия несколько смещена вперед от него. Тем не менее она достаточно стабильно привязана к передней границе крестца. В подавляющем большинстве случаев, когда кроме аллантоисной артерии заднюю конечность и внутренние органы таза эмбриона снабжают кровью дополнительные сосуды, они отходят от спинной аорты под крестцовыми позвонками. Так же как у рептилий, у крысы наблюдается резкое сужение диаметра аорты при ее переходе в хвостовую артерию под крестцом. Ветвление сосудов тазовой области птиц заметно отличается от такового рептилий и млекопитающих (Nickel et al., 1977; Baumel et al., 1979; Гуртовой и Дзержинский, 1992). Основное отличие состоит в том, что все три основные магистрали тазовой области — a. iliaca externa, a. iliaca interna, a. ischiadica — отделяются от спинной аорты самостоятельно, т. е. общей подвздошной артерии у птиц нет. Самой крупной является седалищная артерия, которая отходит от аорты между обеими подвздошными, и именно a. ischiadica является аллантоисной. Ее основание расположено одним–двумя сегментами краниальнее позвонка a, т. е. под позвонками «арабской» серии, впереди от так называемых «истинно-крестцовых» позвонков. У большинства рептилий и млекопитающих аллантоисная артерия отходит от аорты непосредственно под первым крестцовым позвонком. Поэтому, если эту артерию использовать в качестве маркёра крестцовых сегментов, возникают сомнения относительно целесообразности выделения «истинно-крестцовых» позвонков в особую группу. У птиц сразу за местом отделения аллантоисной артерии спинная аорта также становится тоньше и еще раз уменьшается в диаметре после отделения a. iliaca interna, которая располагается пятью-шестью позвонками каудальнее аллантоисной, т. е. приблизительно на границе позвонков e и f . A. iliaca externa, наоборот, сильно смещена вперед и покидает спинную аорту под позвонком α. Эта принципиальная схема одна для всех исследованных мной видов птиц, даже различающихся количеством позвонков, входящих в «арабскую» серию, таких как курица (пять позвонков) и дрозд (два позвонка), и дополнительно подтверждается рисунками, приведенными в работе Дю Туа (du Toit, 1913). Таким образом, наружная и внутренняя подвздошные артерии всегда привязаны соответственно к границе между «греческой» и «арабской» сериями позвонков и к каудальному краю synsacrum. Так как самостоятельно покидающие аорту внутренняя и наружная подвздошные и седалищная артерии птиц снабжают кровью те же органы и ткани, что и соответсвующие ветви a. iliaca communis млекопитающих и рептилий, т. е. гомологичны им, а также маркируют сходным образом крестцовые позвонки, то отделение их от аорты на расстоянии многих сегментов друг от друга, возможно, указывает на то, что группа крестцовых позвонков в составе synsacrum птиц скорее всего не ограничена двумя «истинно-крестцовыми» позвонками. Вперед она распространяется на четыре-пять позвонков до начала «греческой» серии (позвонка α). Каудально крестец достигает задней границы synsacrum (позвонка f — непосредственно перед первым свободным хвостовым и лимфатическим сердцем). В таком случае следует признать, что лишь задняя граница крестца совпадает с каудальной границей synsacrum, тогда как позвонки «греческой» серии, хотя и входят в состав последнего, на самом деле являются не крестцовыми, а поясничными. 38 3.2.3. Пояснично-крестцовое и тазовое нервные сплетения Пояснично-крестцовое нервное сплетение делят на два — поясничное, plexus lumbaris, и крестцовое, plexus sacralis, — состоящих из четко обособленных и имеющих лишь соединяющие коллатерали мощных пучков нервов (Raynaud et al., 1975; Baumel et al., 1979; Akita, 1992; Akita et al., 1992). У всех исследованных мною чешуйчатых рептилий, в том числе и имеющих редуцированные конечности, нервы поясничного сплетения связаны с предкрестцовыми позвонками, нервы же крестцового сплетения выходят позади крестцовых и последнего предкрестцового позвонков, хотя к ним могут добавляться коллатерали от соседних сегментов (предпоследнего предкрестцового и первого хвостового) (см. также: Raynaud et al., 1975; Akita, 1992; Akita et al., 1992). Та же картина наблюдается и у крокодилов (Boas, 1933). Срамной нерв, n. pudendus, идущий к висцеральным органам таза, слагается в основном вторым спинномозговым крестцовым нервом, хотя у представителей разных семейств чешуйчатых он образован либо вторым крестцовым и первым хвостовым (Iguanidae), либо двумя крестцовыми (Varanidae) (Akita, 1992). У курицы поясничное сплетение слагают нервы, выходящие позади трех первых позвонков synsacrum (Baumel et al., 1979), т. е. грудного позвонка (δ), чей нерв вносит незначительный вклад в сплетение, и более каудальных позвонков «греческой» серии. По другим данным (Akita et al., 1992), поясничное сплетение слагают второй, третий и четвертый сложнокрестцовые нервы, т. е. нервы, выходящие позади позвонков α–γ. Позади самого каудального позвонка «греческой» серии (позвонок α) и позади следующих нескольких позвонков «арабской» серии выходят нервы, слагающие крестцовое сплетение. Таким образом, позвонок α лежит на границе поясничного и крестцового сплетений, что может служить основанием думать о том, что позади него проходит граница поясничного и крестцового отделов позвоночника птиц. В таком случае, позвонок α и впередилежащие позвонки synsacrum являются поясничными. На тотальных препаратах цыплят с окраской хрящей и нервных стволов видно, что нервы крестцового сплетения выходят из центрального района synsacrum как раз между a. ischiadica и a. iliaca externa (рис. 11, д ). Из этого также следует, что позвонок α птиц соответствует последнему предкрестцовому позвонку рептилий, а в целом позвонки «греческой» серии, за исключением самого первого — грудного, следует называть поясничными. Последующие позвонки сложного крестца птиц, начиная с позвонка 1, маркируют те же нервы, которые идут от крестцовых сегментов у рептилий. Следовательно, эти позвонки птиц можно считать крестцовыми. У большинства млекопитающих, расположение и состав нервных сплетений крестцовой области в целом сходны с таковыми у птиц и рептилий, но могут заметно различаться у представителей разных видов и на внутривидовом уровне (Goffin and Plets, 1987). Общеизвестно (Сапин и Билич, 1989), что у человека, имеющего пять крестцовых позвонков, pl. lumbaris слагают нервы, выходящие позади первых четырех поясничных позвонков и, частично, последнего грудного; pl. sacralis — нервы, выходящие позади пятого (последнего) поясничного и первого-четвертого (из пяти) крестцовых позвонков. К ним иногда присоединяется веточка от четвертого поясничного нерва. Plexus lumbaris у кролика, Oryctolagus cuniculus, слагают поясничные нервы, а pl. sacralis — крестцовые, однако не все, а только первые три, а в основном — первые два из четырех (Терентьев и др., 1952). Нерв, выходящий позади 39 последнего поясничного позвонка, вносит вклад как в поясничное, так и в крестцовое нервные сплетения. Боковой хвостовой нерв, n. caudalis lateralis (syn. копчиковый нерв, n. coccygeus lateralis), слагают последний крестцовый и хвостовые спинномозговые нервы. Таким образом, несмотря на иное, чем у от рептилий и птиц строение крестца, устройство пояснично-крестцового нервного сплетения у млекопитающих принципиально не различается, и спинномозговые нервы четко маркируют крестцовые позвонки. Уместно заметить, что все позвонки крестца млекопитающих, если ориентироваться на границы нервных сплетений, крестцовые, и в их крестец не входят «сакрализованные» хвостовые позвонки. Автономные симпатические волокна, образующие тазовое сплетение, выходят у птиц позади 8–12-го позвонков synsacrum и направляются к тазовым висцеральным органам. По другим данным, в тазовое сплетение входят ветви 7–10-го (Hammond and Yntema, 1947), либо даже 8–14-го (Levi-Montalcini, 1950) сложнокрестцовых нервов. В первом случае это нервы при позвонках с 4 по c, во втором — с 3 по a, в третьем — с 4 по e. Иными словами, область позвоночника, соответствующая крестцу рептилий и захватывающая у птиц «арабскую» и «латинскую» серии позвонков сложного крестца, маркирована автономными волокнами. К висцеральным органам у человека идут через тазовое сплетение автономные волокна третьего и четвертого крестцовых нервов (Browne, 1953; Akita et al., 1992). По другим данным, тазовое сплетение слагают либо второй, третий и четвертый (Wozniak and Skowronska, 1967), либо второй и третий крестцовые нервы (Trumble, 1934). К тазовому сплетению у кролика направляются веточки второго и третьего крестцовых нервов (Терентьев и др., 1952). Автономная иннервация через тазовые сплетения осуществляется у собаки также вторым и третьим крестцовыми нервами (Wozniak and Skowronska, 1967), у кошки — в основном вторым и частично первым крестцовыми нервами (Trumble, 1934), у макаки-резус, Macaca rhesus, — вторым и третьим (Wozniak and Skowronska, 1967) или первым и вторым (Trumble, 1934). Таким образом, автономная иннервация органов тазовой области млекопитающих также осуществляется средними крестцовыми спинномозговыми нервами. Сравнение положения и устройства тазового нервного сплетения млекопитающих и птиц подтверждает интерпретацию позвонков «арабской» и «латинской» серий в сложном крестце птиц как крестцовых, данную выше. У крысы R. norvegicus расположение нервных сплетений тазовой области несколько отличается от наиболее характерной для млекопитающих схемы. Крестцовое нервное сплетение слагают в основном нервы, выходящие через отверстия между четвертым–шестым поясничными позвонками, а также позади первого крестцового позвонка. Иногда указывают, что нервы L4 и S1 в этом сплетении не участвуют (Гамбарян и Дукельская, 1955). Иными словами, у крысы все нервы и сплетения смещены вперед относительно осевого скелета примерно на два сегмента. В связи с иным, чем у других млекопитающих, положением нервных сплетений у крысы, интересно рассмотреть распределение по сегментам аномалий в поясничнокрестцовом нервном сплетении у человека. В случаях, когда какой-либо нерв выходит из сплетения необычным образом, чаще уровень его выхода смещен вперед, а не назад. Например, n. obturatorius в 80% случаев образован четвертым поясничным нервом, в 16% он смещен на один сегмент вперед, либо принимает коллатерали от одного или двух впередилежащих спинномозговых нервов и только в 4% случаев смещен на один сегмент назад, при этом коллатерали от спинномозговых нервов других уровней не принимает (Webber, 1961). Аналогичную статистику можно привести 40 и в отношении n. femoralis (соответственно 68%, 28 и 6%) и других нервов. Стабильность положения некоторых нервов пояснично-крестцового сплетения не превышает 50%, причем обычно смещение на один–два сегмента краниально и гораздо реже — на один сегмент каудально (Webber, 1961). Хотя причины межвидовых различий при образовании сплетений и этиология аномалий в прохождении нервов изучены слабо, крупные изменения в поясничнокрестцовом сплетении у млекопитающих часто коррелируют с изменениями числа поясничных и крестцовых позвонков (Goffin and Plets, 1987). У хвостатых земноводных и Lacertilia относительное расположение исходящих из крестцового сплетения нервов Акита (Akita, 1992) связывает с относительным положением клоаки, которая смещена немного каудальнее у ящериц, и перераспределением нервных волокон в соответствии с новым положением иннервируемых внутренних органов таза, а также мышц. Аналогичная интерпретация возможна и для млекопитающих в связи с вариациями в размещении органов брюшной полости, развитости и положения мышц. 3.2.4. Сужение брюшной полости и положение клоаки Полость тела по приближении к каудальному концу туловища у эмбрионов амниот заметно сужается. Кпереди от сужения остается ее основной объем, вмещающий бóльшую часть внутренних органов. Эта часть полости поддерживается задней стенкой, идущей наклонно или перпендикулярно к продольной оси тела эмбриона. Кзади остается лишь узкая часть полости, поднятая к осевым органам высоко над тазовыми симфизами (если они имеются), и вмещающая лишь горизонтально направленную кишку, а под ней — также горизонтальную ножку аллантоиса. Кишка и аллантоис открываются у рептилий и птиц в крупную клоаку, занимающую в туловище наиболее каудальное положение. У рептилий плавно сужающаяся в каудальном направлении полость тела наиболее узка на уровне первого крестцового позвонка. Здесь кишка и аллантоис открываются в крупную клоаку, которая лежит под вторым крестцовым и первым хвостовым позвонками. При этом передняя граница клоаки находится немного каудальнее места ответвления от аорты аллантоисной артерии. У эмбрионов птиц полость тела довольно резко сужается примерно под аллантоисной артерией (под второй половиной «арабской» серии позвонков). Передняя граница клоаки расположена однимдвумя позвонками каудальнее аллантоисной артерии, а назад она протягивается на длину четырех-шести позвонков. С увеличением в ходе развития полости тела клоака смещается к каудальному краю synsacrum, равняясь в длину примерно четырем позвонкам. На трехмерной реконструкции восьмидневного эмбриона курицы (Browne, 1953) клоака показана приблизительно на уровне 11–14 сложнокрестцовых спинномозговых ганглиев (соответствует положению напротив позвонков c–e). У териевых млекопитающих нет клоаки, но так же, как у птиц, их брюшная полость резко сужается в узкую ректальную часть примерно на один сегмент позади места ответвления от аорты аллантоисной артерии. Прямая кишка и ножка аллантоиса в узкой части брюшной полости протягиваются назад еще примерно на длину четырех позвонков. Таким образом, сужение полости тела, ее наклонная задняя стенка и передняя граница клоаки (если имеется) по крайней мере у ранних эмбрионов всех амниот 41 располагаются под или немного позади места ответвления аллантоисной артерии, т. е. под первым-вторым крестцовыми позвонками (у ящериц), под позвонками 3 – b (у разных видов птиц, в зависимости от числа позвонков в «арабской» серии и возраста эмбриона) и под первым крестцовым позвонком (у крысы). Иными словами, положение этих маркёров согласованно у всех амниот и привязано к передней части крестца. Задняя граница клоаки или положение анального отверстия примерно соответствует вертикали окончания крестцовой зоны позвоночника. Интересно, что и у бесхвостых амфибий сужение брюшной полости приходится на уровень крестцового позвонка, а клоакальное отверстие — на уровень расположения лимфатических сердец у кончика уростиля (т. е. на следующий сегмент тела, см. выше). Как и следовало ожидать на основании исследования расположения других морфологических маркёров, у птиц зона между сужением полости тела и задним краем клоаки наиболее протяженная, что соответствует протяженности крестца в составе synsacrum. Сравнение расположения морфологических маркёров крестцовой области у чешуйчатых рептилий, имеющих исходно просто устроенный крестец, с более сложными комплексами млекопитающих и, особенно, птиц показывает их сходное распределение вдоль позвоночника и позволяет соотнести простой двупозвонковый крестец с более сложными конструкциями, такими как synsacrum птиц. Примечательно совпадение положения различных маркёров у разных видов птиц (представителей Galliformes и Passeriformes). Приложение тех же маркёров крестца ящериц к крестцу других амниот показывает, что более протяженный крестец млекопитающих маркирован теми же структурами, что и короткий крестец рептилий, а synsacrum птиц сложен не только крестцовыми позвонками, хотя крестец в составе последнего занимает большее протяжение, чем два «истинно-крестцовых» позвонка. Как уже было отмечено, если на схему крестцового отдела позвоночника нанести места расположения морфологических маркёров, то все маркёры будут согласованно изменять свое положение у разных амниот в соответствии с протяженностью крестца. 3.3. МОДУЛЬНАЯ ЭВОЛЮЦИЯ КРЕСТЦОВОГО ОТДЕЛА ПОЗВОНОЧНИКА 3.3.1. Роль Hox -генов как генетических маркёров крестцовой области позвоночника Hox -гены млекопитающих, гомологичные гомеобокссодержащим генам (HomC ) дрозофилы, кодируют транскрипционные факторы, которые в процессе развития играют важную роль при регионализации тела эбриона вдоль передне-задней оси. Hox -гены очень консервативны. Их экспрессия наблюдается в раннем онтогенезе всех позвоночных животных, а их гомологов — и у других групп животных и даже у растений, но наиболее изучены они у мыши (см. обзоры: Дондуа, 1997; Krumlauf, 1994; Gilbert, 2000). Мышиный геном содержит 38 Hox -генов, распределенных по четырем кластерам, обозначаемым Hoxa, Hoxb, Hoxc и Hoxd, которые принадлежат четырем разным хромосомам. Hox -гены экспрессируются во времени и в пространстве в теле зародыша колинеарно их расположению в кластере на хромосоме от 3’-конца к 5’-концу и пронумерованы с 1 по 13 в соответствии с этим порядком. В осевой мезодерме и нервной трубке передние границы зон экс42 прессии генов с меньшими номерами располагаются более краниально, а генов с бóльшими номерами — более каудально. Назад зоны экспрессии всех генов распространяются практически до самого конца зародыша, т. е. в каудальных сегментах экспрессируется больше генов, чем в краниальных. Эквивалентные гены каждого кластера (например, Hoxa-9, Hoxb-9, Hoxc-9, Hoxd-9 ) называют паралогичной группой. На развитие крестцовой зоны позвоночника мыши так или иначе влияют Hox -гены, относящиеся к группе «задних» и гомологичные (ортологичные) гену AbdominalB дрозофилы, отвечающему за формирование у плодовой мушки задних брюшных сегментов, начиная с пятого. Всего таких гомологичных генов 15, неравномерно распределенных по кластерам: Hoxa-9, Hoxa-10, Hoxa-11, Hoxa-13, Hoxb-9 (пропуски в нумерации обусловлены отсутствием соответствующих генов в геноме мыши), и гены кластеров Hoxc и Hoxd с 9 по 13 (без пропусков). Несмотря на отношение к 5’подгруппе, ген Hoxb-9 экспрессируется начиная с шейных сегментов и в контроле развития крестца решающего значения не имеет. Из оставшихся 14 генов, зоны экспрессии которых лежат в области поясничных, крестцовых и хвостовых сегментов, наибольшее значение в контроле развития этих отделов позвоночника имеют гены Hoxa и Hoxd, тогда как гены кластера Hoxc играют второстепенную роль (Suemori and Noguchi, 2000; Wahba et al., 2001). Паттерны экспрессии Hox -генов мыши предполагают наличие некоего кода, посредством которого определенные комбинации Hox -генов контролируют развитие того или иного района тела вдоль передне-задней оси эмбриона. Наборы паралогичных генов составляют Hox -код. Доказательства существования Hox -кода были получены в процессе трех разных типов исследований: экспериментов по «нокаутированию» одной или обеих копий одного или более Hox -генов и экспериментов с воздействием ретиноевой кислотой, в которых изменялся паттерн экспрессии генов вдоль передне-задней оси тела и наблюдались соответствующие трансформации осевых структур, а также сравнительных исследований экспрессии Hox -генов у разных позвоночных, у которых зоны экспрессии генов коррелировали с зонами позвонков соответствующих типов (Gilbert, 2000). Например, воздействием тератогенных доз ретиноевой кислоты, которая приводила к экспрессии Hox -генов в нехарактерных местах, было показано (Kessel and Gruss, 1991), что специфичность того или иного позвоночного сегмента определяется комбинацией функционально активных в данной зоне Hox -генов. Авторы обнаружили, что у мыши, подвергнутой воздействию ретиноевой кислоты в момент, когда эмбрионы проходили гаструляцию, рождались потомки, у которых первый или первые два поясничных позвонка имели параметры заднегрудных и несли рудиментарные ребра, тогда как первый крестцовый позвонок нес черты поясничного. Богатый материал по изменчивости крестца у мыши предоставляют исследования по направленному изменению Hox -генов. В последние два десятилетия прошедшего века проведен ряд экспериментов по их нокаутированию — «gene targeting» или «gene knockout» (замещению аллелей дикого типа мутантными) — у мыши (о методике нокаутирования генов см. подробнее: Thomas and Capecchi, 1987; Capecchi, 1989; Capecchi, 1994). Не останавливаясь подробно на всех тонкостях экспериментов и деталях полученных фенотипов, отмечу, что как и предполагают теоретические представления о Hox -коде, выключение функции отдельных генов приводит к закономерному морфологическому изменению позвонков. При отсутствии функции одного из Hox -генов, экспрессирующихся в районе крестца мыши, происходит вовлече43 ние последних поясничных или передних хвостовых позвонков в крестец (расширение крестца), либо наоборот, уменьшение числа крестцовых позвонков и увеличение числа позвонков, которые по морфологическим признакам следует теперь относить к поясничным или хвостовым. Эти изменения в морфологии позвонков связаны с тем, что при исключении транскриптов одного из генов (или их набора в случае с комплексными нокаутами), набор функционально активных генов в данном районе параксиальной мезодермы изменяется. В случае, если в заданном районе после инактивации одного из генов остаются только транскрипты более краниального гена, происходит антериоризация позвонка, т. е. крестцовый позвонок либо становится поясничным, либо приобретает черты более краниально расположенного крестцового позвонка. В случае, если в заданном районе остаются функциональными какиелибо из паралогичных генов с тем же или большим номером, то может произойти постериоризация сегмента, т. е. позвонок, развивающийся здесь, приобретет черты более каудально расположенного позвонка. (Подробнее о пространственной организации экспрессии Hox -генов и их взаимодействиях см.: Gilbert, 2000; Kmita and Duboule, 2003.) Из сказанного следует, что границы зон экспрессии Hox -генов можно использовать в качестве маркёров крестцового отдела позвоночника и сравнить их распределение вдоль продольной оси эмбриона с положением выделенных ранее морфологических маркёров. Передние границы зон экспрессии «задних» Hox -генов у мыши следующие (рис. 14). В поясничных сегментах находятся передние края зон экспрессии генов Hoxd-9 и Hoxa-10 (Kessel and Gruss, 1991; Burke et al., 1995; Favier et al., 1996; Fromental-Ramain et al., 1996), тогда как передняя граница крестца совпадает с границей экспрессии гена Hoxd-10 (см. также Gerard et al., 1996). Паралогичная пара Hoxa-11 и Hoxd-11 экспрессируется в районе крестца, и передние границы зон экспрессии этих генов находятся в его пределах (см. также Small and Potter, 1993). Последним из двух экспрессируется ген Hoxd-11. Заднюю же границу крестца маркирует граница экспрессии гена Hoxd-12 (Kessel and Gruss, 1991; Burke et al., 1995; Favier et al., 1996; Fromental-Ramain et al., 1996). Hoxd-13 экспрессируется только в хвостовых сегментах (Kessel and Gruss, 1991; Favier et al., 1996; Fromental-Ramain et al., 1996). Передние границы зон экспрессии генов Hoxd-9 и Hoxa-10 в параксиальной мезодерме эмбриона курицы соответствуют третьему-четвертому позвонкам synsacrum (рис. 14). Гены Hoxc-10 и Hoxd-10 начинают экспрессироваться на один-два сегмента каудальнее. Передняя граница экспрессии гена Hoxa-11 примерно соответствует восьмому позвонку synsacrum, а Hoxc-11 — десятому-одинадцатому позвонкам. Экспрессия гена Hoxd-11 начинается на уровне последних позвонков сложного крестца, а ген Hoxd-12 экспрессируется, начиная с последнего сложнокрестцового или первого хвостового. Если сравнить паттерны экспрессии Hox -генов у эмбрионов домашней курицы и мыши, то оказывается, что те гены, которые у мыши маркируют крестцовые сегменты, у курицы экспрессируются на протяжении не всего synsacrum, а только в зоне будущих позвонков с 1 по f (рис. 15). В зоне же позвонков «греческой» (α, β, γ) серии у птиц экспрессируются Hox -гены, ответственные за развитие поясничных позвонков у мыши. Передние границы Hox -генов 11 паралогичной подгруппы экспрессируются ступенчато на протяжении крестца курицы, и границы зон их экспрессии маркируют группы морфологически различных позвонков в соста44 ве synsacrum. В том числе, разные наборы генов экспрессируются спереди и сзади «истинно-крестцовых» позвонков (a и b). Гены 12 паралогичной группы обнаруживаются лишь в сомитах, которые дают материал свободных хвостовых позвонков. Таким образом, у эмбрионов мыши и курицы (рис. 14), у которых число крестцовых позвонков резко различается, по экспрессии Hox -генов можно судить о типе будущего позвонка (Gaunt, 1994; Burke et al., 1995). Передние границы экспрессии Hox генов в осевой мезодерме цыпленка не только совпадают с границами групп разных типов позвонков внутри synsacrum, но и соответствуют границам крестца, определяемым по морфологическим маркёрам и не связанным непосредственно с осевым скелетом. Сравнение зон экспрессии Hox -генов будет неполным, если мы ограничимся только двумя наиболее изученными лабораторными видами. К сожалению, экспрессия Hox -генов неизвестна для ящериц, но недавняя работа на шпорцевой лягушке, Xenopus laevis (Lombardo and Slack, 2001), продемонстрировала несомненное сходство в распределении транскриптов Hox -генов в мезодерме цыпленка, мыши и лягушки (рис. 14). Как видно из схемы, за развитие крестцовых сегментов у мыши и курицы отвечают гены 10 и 11 паралогичных групп, тогда как гены 9 паралогичной группы контролируют развитие поясничных позвонков, а гены 12 и 13 — хвостовых. У Xenopus, имеющего один (девятый по счету от начала позвоночника) крестцовый позвонок, в параксиальной мезодерме гены Xhoxd10 и Xhoxa11, ортологи соответсвующих по номерам Hox -генов амниот, имеют передние границы экспрессии на уровне единственного крестцового позвонка (Lombardo and Slack, 2001). Xhox гены 9 паралогичной группы экспрессируются и значительно краниальнее крестца — на уровне третьего–седьмого сомитов, тогда как зона экспрессии 12 паралогичной группы не обнаруживается краниальнее 13 сомита — последнего, вносящего вклад в уростиль. Важно отметить, что гены по крайней мере кластера Hoxd не только определяют специфичность позвоночных сегментов, но вместе с рядом морфогенетически активных молекул, таких как BMP (bone morphogenetic protein), играют важную роль в определении физиологических и анатомических границ кишки и в формировании сфинктеров (Smith and Tabin, 1999; Zakany and Duboule, 1999). Отсутствие функции Hoxd -генов у эмбриона мыши приводит к отсутствию сфинктеров (Kondo et al., 1996; Zakany and Duboule, 1999). Передней границей средней и задней кишки у птиц является ее парный цилиндрический слепой вырост, caeca. Следующий за ним толстый кишечник открывается в клоаку. В мезодерме задней кишки экспрессируются те же Hox -гены, что и в крестцовых мезодермальных сегментах, а порядок их экспрессии соответствует таковому в осевой мезодерме и положению генов на хромосоме (Roberts et al., 1995). Hoxd-9 экспрессируется краниальнее Hoxd-10, последний — краниальнее Hoxd-11 и т.д. Это же правило касается и генов Hoxa-кластера. Передние границы зон экспрессии генов паралогичных групп с номерами 9 находятся в мезодерме caeca, а с номерами 12 — передней части клоаки. Гены паралогичных групп 10 и 11 экспрессируются ступенчато на протяжении кишки, но всегда впереди клоаки. В каудальной части клоаки начинают экспрессироваться Hoxd-13 и Hoxa-13, т. е. гены, отвечающие за развитие хвостового, а не крестцового отдела позвоночника. Примечательно, что и у мыши гены Hoxd-12 и Hoxd-13 экспрессируются с двух сторон от анального сфинктера (Kondo et al., 1996). Иными словами, передняя граница клоаки у птиц или анальный сфинктер у млекопитающих являются границами в кишке, аналогичными границе 45 крестцового и хвостового отделов в позвоночнике, и их развитие контролируется одними и теми же генами. Такая же картина распределения транскриптов Hox -генов в кишке наблюдается и у Xenopus (Lombardo and Slack, 2001). Таким образом, близкое расположение крестца и границы между клоакой и остальной частью задней кишки, является не простой случайностью. Конечно — хотя этого и не следовало бы, наверное, ожидать — абсолютного совпадения уровня передней и задней границ крестца и «крестцовой» зоны кишки мы не наблюдаем. Это неудивительно, так как задняя кишка заметно длиннее крестца даже у птиц, у которых он имеет большое протяжение, и вся кишка строго под ним не помещается. Кроме того, развитие клоаки у птиц и рептилий, возможно, приводит к тому, что сама кишка со всеми зонами экспрессии Hox -генов немного сдвигается вперед относительно задней границы крестца. С другой стороны, у млекопитающих, не имеющих клоаки, совпадение задней границы кишки (анус) и заднего края крестца действительно наблюдается: прямая кишка у крысы заканчивается примерно под четвертым, т. е. последним, крестцовым позвонком. Следует добавить, что связь между экспрессией Hox -генов в мезодерме кишки и в параксиальной мезодерме, больше, чем формальное совпадение. Дифференциация склеротомов контролируется геном Sonic hedgehog (Shh). Именно он является достаточным для индукции экспрессии Hox -генов в мезодерме кишки, а его искусственная мисэкспрессия посредством точечной вирусной инфекции приводит к сдвигу паттерна экспрессии Hox -генов в висцеральной мезодерме цыпленка (Roberts et al., 1995). Иными словами, генный контроль развития как висцеральной, так и параксиальной мезодермы имеет определенные черты сходства. Нельзя исключать возможность того, что и ветвление основных маркёрных артерий, и система лимфатических протоков и сердец — производных мезодермы – стоит в какой-то связи с активностью Hox -генов или других генов, связанных с ними функционально. Особенно привлекательно место ответвления аллантоисной артерии от аорты, так как в этом месте аорта претерпевает резкое сужение в хвостовую артерию. Напомню и обсуждавшуюся в предыдущем разделе вероятную связь между положением клоаки и других внутренних органов со строением нервных сплетений. Hox -гены в данном случае могут выступать в роли координаторов развития, так как экспрессируются не только в параксиальной мезодерме, но и в центральной нервной системе на сравнимых кранио-каудальных уровнях. Хорошо известно (Великий, 1884; Терентьев, 1950), что у амфибий тазовые лимфатические сердца иннервируются окончаниями девятого (крестцового) и десятого спинномозговых нервов и снабжаются кровью ветвями аллантоисной артерии (у амфибий — a. ischiadica). Считается (Wilting et al., 1999), что лимфатические сосуды — производные венозной системы. Поэтому, возможно, неслучайно у млекопитающих, не имеющих лимфатических сердец, именно под крестцом формируется мощная система венозных анастомозов. Как бы то ни было, очень вероятно, что прямое действие некоторых регуляторных генов на ранних этапах эмбриогенеза и взаимное влияние развивающихся структур проявляется в наблюдаемых нами морфологических корреляциях. В таком случае вся система морфологических маркёров крестца, описанных мной в предыдущем разделе, и развитие крестцовых позвонков имеют под собой одну общую генетическую основу, которая и определяет согласованное развитие всего крестца и окружающих его органов и тканей. 46 3.3.2. «Первично-крестцовые» позвонки Впервые понятие «первичные», или «истинные» крестцовые позвонки применительно к двум центральным позвонкам сложного крестца птиц (позвонки a и b) употребил Гегенбаур в 1871 году (Gegenbaur, 1871). Именно они несут рудиментарные ребра, которые у взрослых особей срастаются с телом позвонка. Иначе их называют ацетабулярными позвонками, так как они лежат напротив вертлужных впадин. Эти позвонки с конца XIX века в сравнительной анатомии гомологизируют с двумя крестцовыми позвонками рептилий (Шмальгаузен, 1938; Дзержинский, 1998; du Toit, 1913; Boas, 1933; Romer, 1956). Мои наблюдения не позволяют поддерживать подобный взгляд и склоняют меня к невозможности дальнейшего употребления термина «истинно-крестцовые позвонки». «Истинно-крестцовые» позвонки не у всех птиц лежат строго напротив вертлужных впадин. Так, у курицы и перепела «ацетабулярными» являются последние два позвонка «арабской» серии (позвонки 3 и 4 или 4 и 5 ), и только у дрозда — первые два позвонка «латинской» серии (позвонки a и b). Хотя положение «истинно-крестцовых» позвонков примерно центральное в synsacrum, оно заметно варьирует у разных видов птиц и связано также с различной развитостью alae pre- и postacetabularis ilii. Если же рассматривать вопрос более широко среди разных амниот, то оказывается, что взаиморасположение acetabulum и крестца сильно варьирует. У ящериц крестец расположен в основном позади, у крокодилов — на уровне, а у млекопитающих — впереди acetabulum. Наличие ребер на двух центральных позвонках synsacrum не говорит в пользу их гомологии с двумя крестцовыми позвонками рептилий, так как ребра несут не только крестцовые позвонки, а крестцовые позвонки не всегда несут ребра. У млекопитающих и бесхвостых амфибий крестец причленяется к подвздошным костям таза посредством диапофизов. У динозавров крестцовые позвонки могут срастаться в блок, однако не все из них имеют ребра (Romer, 1956). Наконец, крестцовые ребра двух «истинно-крестцовых» позвонков птиц «парапофизарные», тогда как крестцовые ребра крокодилов, ближайших современных родственников птиц, прикрепляются к диапофизам (Hoffstetter and Gasc, 1969; Rieppel, 1993). Таким образом, наличие или отсутствие ребер — признак непостоянный. Несмотря на морфологическую гетерогенность сложного крестца птиц и развитие нескольких, хорошо отличимых друг от друга групп позвонков, различия между позвонками не так уж велики. Все позвонки synsacrum несут диапофизы, либо поперечные отростки, образованные слиянием диапофизов и парапофизов. Позвонки «арабской» серии, с одной стороны, и ограничивающие их спереди и сзади позвонки «греческой» и «латинской» серий — с другой, различаются между собой в основном тем, что первые не имеют парапофизов, а вторые имеют. В результате на крестце при виде снизу хорошо различим «провал», т. е. центральный район, где на позвонках отсутствуют парапофизы. Число позвонков, входящих в «арабскую» серию, варьирует в широких пределах как на уровне видов, так и на уровне особей. Так, у курицы иногда встречаются короткие, быстро сходящие на конус парапофизы и на крайних позвонках «арабской» серии. Число позвонков без парапофизов варьирует от четырех до шести. У других видов вариации в их числе доходят до крайностей. У сороки (Pica) и некоторых попугаев парапофизы не выражены ни на каких позвонках «арабской» и «латинской» серий, что делает позвонки нераз47 личимыми между собой (Mivart and Clarke, 1877; Boas, 1933). У фрегата (Fregatta), наоборот, все позвонки synsacrum имеют как диапофизы, так и парапофизы (Mivart and Clarke, 1877). Иными словами, разница между позвонками «арабской» и «латинской» серий стирается при рассмотрении большого сравнительного материала, а в целом приведенные факты говорят за то, что границы между морфологическими сериями позвонков в сложном крестце птиц очень условны, так что выделение в составе сложного крестца «истинно-крестцовых» позвонков неоправдано. 3.3.3. Гомология крестцовых позвонков птиц и других амниот Любопытно подробнее рассмотреть систему обозначений позвонков synsacrum, использованную Боасом (Boas, 1933). По морфологическим признакам в крестце птиц он выделил пять групп позвонков, но объединил их всего в три серии: Ia – грудной и Ib — следующие крупные позвонки — «греческая» серия, II — позвонки без парапофизов — «арабская» серия, III — «первично-крестцовые» вместе с IV — остальные позвонки с парапофизами — «латинская» серия. Напомню, что позвонки «греческой» серии обозначаются от каудального конца к краниальному, остальные — в обычном порядке. Такие направления счета аналогичны тем, какие иногда у других амниот используют для обозначения крестцовых и предкрестцовых позвонков: крестцовые считают в порядке от головы к хвосту, а предкрестцовые — от переднего края крестца в краниальном направлении. Точка смены направления счета в системе Боаса совпадает с принятой мною передней границей крестца в составе synsacrum. Позвонки собственно крестца птиц можно для удобства объединить в две большие группы — передне-крестцовые («арабская» серия, несут только диапофизы) и задне-крестцовые («латинская» серия, несут как диапофизы, так и парапофизы). Именно так поступил Боас (Boas, 1933), который повел счет крестцовых позвонков от начала арабскими цифрами, но, столкнувшись с несколько отличным строением более каудальных позвонков, далее обозначал позвонки латинскими буквами. Несмотря на количественную разницу между «истинно-крестцовыми» и последующими позвонками «латинской» серии (c–e), этот автор первые считал крестцовыми на основании связи с тонкими ветвями крестцового нервного сплетения и наличию ребер, а последние (с парапофизами вместо ребер) называл хвостовыми. Однако мы видим, что разделение по морфологическому признаку — наличию или отсутствию парапофизов или ребер — ненадежно. Границей между «арабской» и «латинской» сериями позвонков могла бы быть задняя граница расположения крупных нервных ганглиев и plexus sacralis. Однако во-первых, и по нашим данным, и по рисункам в работе Боаса, второй «истинно-крестцовый» позвонок никак не связан с крестцовым сплетением. Во-вторых, пример млекопитающих показывает, что использование единственного маркёра — такого, как спинномозговые нервы, не очень надежно в связи с вариациями в положении нервов. Использование же дополнительного маркёра первого хвостового сегмента — лимфатического сердца — ясно указывает на то, что все позвонки «латинской» серии synsacrum птиц являются, скорее, крестцовыми, чем хвостовыми. Из сказанного можно заключить, что никакую пару позвонков крестца птиц нельзя гомологизировать с двумя крестцовыми позвонками рептилий. Это заключение можно распространить также на млекопитающих и других амниот, обладаю48 щих крестцом, состоящим из более чем двух позвонков. В онтогенезе как птиц, так и млекопитающих изменена судьба многих позвоночных сегментов, а потому два крестцовых позвонка рептилий теряют свою индивидуальность и гомологичны большему числу позвонков в составе более сложных конструкций. В эволюции крестца амниот от исходного состояния из двух позвонков неоднократно происходило расширение крестцовой зоны и увеличение числа входящих в ее состав позвоночных сегментов. Использование в настоящей работе оригинальных данных и информации, полученной из литературы, о расположении маркёров крестцовой области в районе synsacrum птиц позволяет сделать общее заключение о его составе. Все маркёры крестцовой области млекопитающих и рептилий (положение лимфатического сердца, ветвлений магистральных артерий, нервных сплетений, передних границ клоаки и зон экспрессии Hox -генов) в совокупности указывают на то, что крестцу рептилий и млекопитающих у птиц можно поставить в соответствие «арабскую» и «латинскую» серии позвонков, от позвонка 1 до позвонкаf включительно (рис. 15). Легко заключить, что в сложный крестец входит один заднегрудной позвонок, который может быть определен по наличию у него двухголовчатых ребер и слабой связи с последующими позвонками (наличию, по крайней, мере шва). За ним идут три-четыре крупных позвонка «греческой» серии, которые я считаю поясничными. Следующие 8–11 позвонков до конца synsacrum гомологичны крестцовым позвонкам других амниот. Крестец можно представить не как набор из разного числа позвонков, а как единую структуру, возникающую в онтогенезе из зоны несегментированной параксиальной мезодермы, в которой экспрессируется единый для всех тетрапод набор генов. У птиц к такому «истинному» крестцу добавляются поясничные и даже грудные позвонки, формируя более сложную структуру — synsacrum. Такой взгляд на состав сложного крестца близок неаргументированным представлениям Селянского (1968), а также основанным на изучении экспрессии Hox -генов заключениям Бурке с соавторами (Burke et al., 1995). Усложнение крестца за счет прирастающих к нему поясничных и заднегрудных позвонков связано с общей тенденцией в скелете птиц к слияниям элементов и особенно позвонков. Однако и два крестцовых позвонка рептилий не одинаковы по своему строению. Эта неодинаковость порождала такие термины, как «первичный» и «вторичный» крестцовый (истинно-хвостовой) позвонки (Kamel, 1951, 1952). Такие терминологические нововведения, хотя и отражают разницу в строении позвонков, вряд ли удобны, учитывая постепенность перехода туловищных позвонков в хвостовые. Тем не менее можно разделять передний и задний крестцовые позвонки у амниот, обладающих двумя позвонками, а также передне-крестцовые и задне-крестцовые позвонки в составе более сложных конструкций. Маркёрами этих двух подзон внутри крестца могли бы служить, например, соответственно plexus sacralis и plexus pudendus, отсутствие или наличие парапофизов (у многих птиц) или другие морфологические особенности, а также разный набор экспрессирующихся в этих сегментах Hox генов. В таком случае первый крестцовый позвонок современных рептилий будет гомологичен передне-крестцовым позвонкам птиц и передним двум-трем позвонкам млекопитающих, а второй крестцовый позвонок рептилий — задне-крестцовым птиц и задним крестцовым позвонкам млекопитающих (рис. 16) Я не склонен придавать большого значения этим подзонам внутри крестца, так как точное определение их границ не всегда возможно, но в некоторых случаях может оказаться удобным. 49 Можно предположить, что крестец амниот эволюционировал как структура, состоящая из модулей — групп позвонков, различающихся генетически и морфологически. Крестец и позвоночник вообще — не единственный случай модульной эволюции скелетной структуры. Некоторые авторы применяют подобную терминологию в аналогичном смысле к эволюции не только осевого скелета, или внутреннего скелета парных конечностей, но и лучей (lepidotrichia) и внутреннего скелета (radialia et hypuralia) непарных плавников рыб (Mabee et al., 2002). Такая модульность, присущая многим развивающимся структурам, — один из аспектов упорядоченности развития живых организмов. Глава 4. КРЕСТЦОВОЕ ОКНО В МИОМЕРАХ И КРЕСТЦОВО-ТАЗОВОЕ СОЕДИНЕНИЕ В предыдущей главе, где шла речь о крестце и крестцовых позвонках, был оставлен без ответа один важный вопрос — а что же такое собственно крестец? Традиционно крестец всеми понимается как отдел позвоночника, осуществляющий связь осевого скелета с тазом, однако четкого определения, что такое крестцовый позвонок в литературе не существует. Определение по признаку наличия или отсутствия прямого контакта с ilium удобно практически, особенно когда мы имеем дело с животными с малым числом крестцовых позвонков, но не отражает всех особенностей строения и развития, которые отличают крестцовые позвонки от других. Например, два крестцовых позвонка большинства рептилий резко отличаются по развитию и строению и от впереди-, и от позадилежащих позвонков. Однако если у крокодилов оба поперечных отростка осуществляют контакт с ilium, то у чешуйчатых рептилий очень часто в контакте принимает участие лишь один позвонок. У гекконов иногда выделяют и третий крестцовый позвонок, не связанный с ilium (Wellborn, 1997). Еще нагляднее пример задних крестцовых позвонков млекопитающих. В то же время у птиц последний грудной позвонок прирастает к остальному блоку позвонков сложного крестца и контактирует с ilium, однако его единодушно называют грудным по наличию двухголовчатых ребер. Наконец, должны ли мы называть крестцовыми позвонки, которые осуществляют контакт не с ilium, а с ischium у неполнозубых млекопитающих? Определения крестцового позвонка, вбирающие в себя многие нюансы, существуют, но они громоздки и тем не менее не полны. Майварт и Кларк (Mivart and Clarke, 1877), которые пытались определить крестец через наличие парапофизов или диапофизов, положение acetabulum и нервных сплетений, вынуждены были дать два определения — одно для птиц, а второе — для млекопитающих, рептилий и амфибий. Определение крестцового позвонка для млекопитающих, рептилий и амфибий по Майварту и Кларку (1877, р. 372): «Крестцовый позвонок — это позвонок с парапофизами, которые упираются в ilium пре- или постаксиально, или напротив acetabulum, и с корнями нервов седалищного сплетения, выходящими непосредственно пре- или постаксиально от него». Во-первых оказывается, что если крестцовый позвонок несет не парапофизы, а диапофизы или ребра, то он в определение не укладывается. Во-вторых, acetabulum может занимать любое из трех возможных положений. В-третьих, выражение «упираются в ilium» (про отростки) по-прежнему говорит, как о некрестцовых, о части «крестцовых» (на вид) позвонков динозавров, о задних позвонках, входящих в состав крестцовой кости человекообразных обезьян, о позвонках, сочленяющихся с ischium у неполнозубых млекопитающих, о всех позвонках крестца крысы, кроме первого и т. д. Определение крестцовых позвонков для птиц по Майварту и Кларку (1877, p. 373): «Крестцовые позвонки — это позвонки, обладающие одним из более постак51 сиальных корней седалищного сплетения, выходящим непосредственно пре- или постаксиально, и имеющие парапофизы, упирающиеся в ilium. Подобные позвонки располагаются непосредственно постаксиально от позвонков, которые лишены подобных парапофизов, или они гомологичны позвонку, отвечающему подобным условиям у большинства птиц». Если взять для примера курицу, то речь идет о первых позвонках «латинской» серии, т. е. об «истинно-крестцовых», так как никакие другие позвонки в определение не укладываются. Действительно, именно они имеют парапофизы (точнее сказать — парапофизарные ребра), лежат позади позвонков без парапофизов, а впереди или позади каждого отходит нерв седалищного сплетения. Однако, во-первых, все-таки неясно, где же провести заднюю границу крестца и сколько точно позвонков в «крестце» у птиц — один, два или три, учитывая вариации в положении нервов. Во-вторых, оговорка о том, что ««крестцовые позвонки — это те, которые гомологичны тем, что отвечают подобным условиям у большинства птиц», предоставляет свободу для интерпретации данного определения. В-третьих, если следовать буквально этому определению, то получится, что у некоторых птиц, согласно данным той же работы, вообще нет крестца, так как у них нет «позвонков, несущих парапофизы» и в то же время «находящихся позади позвонков без парапофизов или им гомологичных». В-четвертых, совершенно неясно, почему для птиц делается исключение относительно нервов — почему только каудальные нервы седалищного сплетения «имеют право» выходить впереди или позади крестцового позвонка, а остальным нервам сплетения, используемым в определении крестцового позвонка для остальных тетрапод, в этом «праве» отказано? Эти недоумения и вопросы легко объснить тем, что авторы просто дали определение (причем не очень точное) «истинно-крестцовых» позвонков птиц, заранее решив, что они только и есть крестцовые. Далее авторы пишут, что «комбинацией этих двух определений, приведенных выше, как кажется авторам, крестцовые позвонки могут быть определены для всех позвоночных, обладающих тазовыми конечностями, начиная с амфибий» (Mivart and Clarck, 1877; p. 373). С авторами можно согласиться, однако очевидно, что это не приблизит нас к решению проблемы. Можно ли вообще дать четкое, а главное точное определение крестцового позвонка? Я считаю, что это возможно, так как крестцовый позвонок не просто обладает какими-то конкретными свойствами (контактирует или не контактирует с ilium и т. д.), а развивается по особой программе, имеет отличный от других позвонков морфогенез, что и сказывается в результате на особенностях его строения. Использование морфологических и генетических маркёров крестцового отдела позвоночника позволило нам (см. гл. 3) очертить границы этого отдела у разных амниот. Вопрос теперь заключается в том, чтобы выяснить, обладают ли все позвонки крестцовой зоны какими-либо особенностями развития, которые однозначно выделяли бы их в позвоночнике. В данной главе на основании информации о раннем развитии крестцовых позвонков у амниот, обладающих принципиально различным устройством крестца, я попытаюсь дать универсальное определение крестцового позвонка. 52 4.1. ГИПОТЕЗА О РОЛИ ГИПАКСИАЛЬНОЙ МУСКУЛАТУРЫ В РАЗВИТИИ КРЕСТЦОВО-ПОДВЗДОШНОГО СОЕДИНЕНИЯ Ранние экспериментальные работы, в которых обсуждались связи в морфогенезе таза и крестца, возможные морфогенетические причины развития крестцовоподвздошного соединения, показали некоторую роль системы таз–конечность в развитии крестца. Сравнительная анатомия уже давала повод для такого мнения, основанного на фактах коррелированных изменений скелета конечности, таза и крестца у чешуйчатых рептилий, демонстрирующих разную степень редукции конечностей (Sewertzoff, 1931). В эксперименте по удалению почки задней конечности с одной стороны тела у аксолотля крестцовое ребро формировалось каждый раз, когда развивалась соответствующая половина таза, и всегда отсутствовало при отсутствии таза (Dragomirowa, 1935). При трансплантации конечности в предкрестцовые сегменты тела наблюдалась следующая зависимость: чем ближе трансплантат прилежал к ребру, тем более «сакральное» строение оно имело. Природа трансплантата значения не имела (закладки таза, бедра и даже целлоидин). Но форма трансплантата сказывалась на форме дистального края ребра. Автор предположила, что трансплантат вызывает увеличение массы закладки крестца путем стимуляции местного размножения клеток или привлечения мезенхимы из окружения, но полноту формообразования обусловливает пространство, в котором оно происходит. Автор подразумевала некоторое химическое влияние со стороны трансплантата на мезенхиму крестцового сегмента при непосредственном и подчеркнуто близком контакте. Крестцовые диапофизы у бесхвостых амфибий становились заметными в то время, когда предшествующие несколько позвонков диапофизов не имели вовсе, а ilium располагался на значительном расстоянии от позвонков и только начинал расти вверх и вперед от acetabulum (Hodler, 1949a, b). Никакого контакта между закладками таза и крестца на ранних стадиях не наблюдалось, что не подкрепляло гипотезу Драгомировой. При удалении почки конечности крестцовый диапофиз соответствующей стороны не формировался. При пересадке почки конечности на сегмент вперед (с IX на VIII) более, чем в половине случаев наблюдался асимметричный крестец и увеличение поперечных отростков на VII и даже VI сегментах с оперированной стороны. Даже при частичной регенерации таза мог формироваться крестцовый диапофиз, хотя зачаток таза оставался неразвитым и лежал вдалеке от крестца. Удаление конечности на стадии, когда зачаток ilium начинал расти вверх к позвоночнику, не сказывалось на формировании крестцового диапофиза. Он развивался и при отсутствии пояса и конечности. Хотя Ф. Ходлер и полагал, что у бесхвостых амфибий индукционное влияние распространяется от таза вдоль миосепты к крестцовому позвонку, он отметил, что результаты экспериментов свидетельствуют как в пользу, так и против такой гипотезы. В результате описанных исследований у амфибий были установлены связь наличия-отсутствия почки конечности и крестцовых отростков, индифферентность крестцовых ребер к типу индуцирующего материала, а также временные рамки, в которых имеет место влияние на них таза и конечности, возможность влияния на поздние стадии развития крестца пространства, в котором происходит его формирование. Последнее положение чаще использовалось в последующих работах (Коваленко и Анисимова, 1987). Авторы полагали, что формирование крестца амфибий 53 идет вследствие механического влияния ilium, давящего на миосепту крестцового сегмента и деформирующего форму пространства, в котором развивается зачаток крестцового диапофиза. Скорее всего, это объяснение может касаться поздних стадий развития, когда механические взаимодействия таза и крестца могут модифицировать форму скелетных элементов, прямо или косвенно, через формирование пространств, где скапливается скелетогенная мезенхима. Действительно, имеет место положительная корреляция между сроками начала хондрогенеза ilium (Коваленко и Анисимова, 1987) и его длиной (Emerson, 1982), с одной стороны, и степенью расширенности дистального края крестцовых диапофизов — с другой: чем раньше охрящевевает и, соответственно, чем длиннее подвздошный элемент, тем шире крестцовые диапофизы. Однако подобные механические влияния не могут обеспечивать закладку и ранний морфогенез крестца. Более того, механическая гипотеза удовлетворительно объясняла результаты экспериментов Драгомировой, но ни в коем случае не данные экспериментов и наблюдения Ходлера. В. Г. Борхвардт (1995) указал на аномальных особей Xenopus, у которых имеется один либо оба крестцовых диапофиза при сильно редуцированном тазе и нормально развитых конечностях, что отвергает мнение о ведущей роли таза в развитии крестца. Он также обратил внимание на то обстоятельство, что крестцовые диапофизы уже крупнее предкрестцовых, когда ilium находится далеко внизу и не имеет контакта с ними. Борхвардт обнаружил, что у тетрапод развитию крестца и таза предшествует формирование на месте гипаксиальной мускулатуры большого поля мезенхимы в районе крестца. Подробно это явление было продемонстрировано на L. agilis. Наблюдения Борхвардта по развитию крестца и таза сводились к следующему. Происходит нарушение гипаксиальных частей миомеров крестцовых сегментов на стадии, предшествующей формированию крестца и разрастанию таза. На месте отсутствующей мускулатуры образуется мезенхимное скопление — материал для построения крестцовых диапофизов и ilium. По мнению автора, дегенерация миомеров происходит из-за нарушения их связей с мотонейронами, так как мышцы задних конечностей и пояса «перехватывают» нейроны, которые в их отсутствие могли бы установить контакт с мышечными волокнами будущих крестцовых миомеров (Борхвардт, 1995). Однако уже здесь следует обратить внимание на один интересный факт — различие в событиях, происходящих в онтогенезе амфибий и амниот: если у амниот действительно происходит формирование мезенхимного поля на месте гипаксиальной мускулатуры, то у амфибий мезенхимное скопление есть прежде всего лишь расширенная миосепта. Поэтому нельзя исключать тот факт, что механизмы развития крестца и таза у амниот и амфибий различаются и в других чертах. В дальнейшем при обсуждении развития крестца и таза я буду в основном касаться только амниот. Таким образом, гипотеза Борхвардта по сути дела представляла собой два предположения. Первое заключалось в том, что крестцово-тазовое соединение развивается прежде всего благодаря разрушению части гипаксиальной мускулатуры в районе крестца, а второе — в том, что решающую роль в этом процессе разрушения миомеров играют почки конечностей. Для проверки этих предположений было избрано сочетание сравнительно-анатомического и экспериментального подходов. В настоящей главе будет рассмотрено первое из перечисленных предположений, тогда как роль почек конечностей будет обсуждаться в главе 6, где данные сравнительной анатомии будут дополнены экспериментальным анализом эмбриогенеза. 54 4.2. ПРОЦЕСС ОБРАЗОВАНИЯ «КРЕСТЦОВОГО ОКНА» В ГИПАКСИАЛЬНЫХ ЧАСТЯХ КРЕСТЦОВЫХ МИОМЕРОВ У АМНИОТ 4.2.1. Прыткая ящерица На стадии 31 туловищные миомеры, сложенные миобластами, составляют непрерывный ряд. У эмбрионов, находящихся на стадии 31/32, гипаксиальные части крестцовых миомеров разрушаются. Это разрушение начинается от первой крестцовой миосепты и распространяется вперед и назад (рис. 17, а–в). Первая крестцовая миосепта расширяется и заполняется мезенхимой. В нижней своей части это мезенхимное скопление шире, чем сверху, и переходит без границ в мезенхиму почки конечности (рис. 18, а). Заполненное мезенхимой пространство, формирующееся на месте гипаксиальных отделов крестцовых миомеров и ограниченное спереди и сзади полными миомерами, будем называть «крестцовым окном». Начинаясь на месте каудальной части первого крестцового миомера, крестцовое окно захватывает также бóльшую часть второго крестцового миомера, вплоть до миосепты, разделяющей второй крестцовый и первый хвостовой миомеры. Ближе к продольной оси эмбриона крестцовое окно сужается так, что в передней части второго крестцового сегмента остается участок, содержащий остаток миомера (рис. 17, г). На стадии 32 крестцовое окно составляет в длину около полутора сегментов. Мезенхима крестцового окна слабее прокрашивается гематоксилином, чем клетки окружающих тканей (рис. 17, в, г). 4.2.2. Безногая ящерица — веретеница На стадии 32/33 скелетные элементы представляют собой мезенхимные скопления. Отсутствует наружная гипаксиальная часть одного крестцового миомера, расположенного позади аллантоисной артерии и впереди от лимфатического сердца, которое занимает два первых хвостовых сегмента (рис. 18, б ). На этом месте формируется мезенхимное крестцовое окно, куда снизу внедряется верхний конец ilium (рис. 18, в, г). Ilium расположен косо, поднимаясь от основания почки конечности вверх и назад и верхним краем почти достигая лимфатического сердца. На стадии 34 крестцовое окно снаружи огибает пласт мышц предкрестцового сильно скошенного миомера (рис. 18, д ). Немного мышц остается и во внутренней части крестцового окна. Этот внутренний остаток крестцового миомера сохраняется только в краниальной половине крестцового окна, которое, таким образом, оказывается окруженным мышцами сверху и сбоков. У эмбрионов на стадии 36 ilium сильно удлинен, занимает латеральную часть крестцового окна и подходит снизу и спереди под тупым углом к тазовому лимфатическому сердцу (рис. 18, д ). Центральную часть крестцового окна занимает крестцовое ребро. Рядом с ilium (ilium + ischium + pubis = рудимент таза?) обнаруживается небольшой круглый хрящ, который можно интерпретировать как рудимент femur. У некоторых эмбрионов он присутствует только на одной стороне тела. 55 4.2.3. Обыкновенная гадюка На стадиях 30–31 на вентро-латеральной поверхности тела эмбриона гадюки, V. berus, в районе клоаки появляются два слабых продолговатых утолщения, которые частично можно классифицировать как рудименты почек конечностей. На стадии 33 в этом районе заметны только зачатки гемипенисов и губ клоаки. Разрушение миомеров в районе клоаки не обнаружено ни на одной из исследованных стадий развития. На стадии 37, когда все хрящевые элементы позвоночника сформированы, не обнаруживается никаких скелетных элементов пояса или свободной конечности либо каких бы то ни было черт сакрализации позвонков клоакальной области. Миомеры, лежащие в зоне лимфатического сердца, частично прерваны им на середине своей высоты, но не разрушены (рис. 18, е). 4.2.4. Курица По крайней мере до стадии 24 миомеры составляют непрерывный ряд и к стадии 26/27 распространяются вентрально до уровня спинной аорты (рис. 19, а). Уже на стадии 27 тонкие миомеры впереди и позади района будущего пояса протягиваются вентрально дальше. Их гипаксиальные части более развиты, чем таковые четырехпяти миомеров напротив будущей средней части synsacrum. При этом все миомеры на стадии 28 опускаются чуть ниже нервных ганглиев. Заметно также, что в зоне будущего synsacrum на миосептах скапливается мезенхима. На уровне хорды нижние края миомеров оказываются на одном горизонтальном уровне с верхним краем мезенхимного ilium и далее вниз не распространяются. Пространство между мышцами и ilium заполнено мезенхимой. На стадии 28/29 миомеры напротив почки задних конечностей явно истончены в латеро-медиальном направлении, будучи заметно более узкими, чем грудные (рис. 19, б ). Вентрально они также истончены и на уровне аорты заметны лишь по центру сегмента. Иными словами, напротив позвонков synsacrum мышечные сегменты сужены как в кранио-каудальном, так и медио-латеральном направлении и мало распространяются вентрально (рис. 19, в). Затронуто не менее семи сегментов: один — напротив acetabulum, два — впереди и четыре — позади него. Миомеры практически отсутствуют ковнутри от ilium (рис. 19, г). Cохраняется не меньше трех широких и опускающихся далеко вниз миомеров позади последнего грудного ребра (соответствуют по положению поясничным позвонкам по моей классификации — β, γ и δ). Так как у эмбрионов курицы на этих стадиях не удается найти четких морфологических маркёров, показывающих границу между гипаксиальной и эпаксиальной частями миомеров, определение степени развитости гипаксиальных частей миомеров представляет определенные трудности. Если границу проводить по прямой, соединяющей продольную складку на поверхности тела эмбриона (некогда — граница между рядом сомитов и боковой пластинкой) и хорду, то оказывается, что мышц ниже этой линии и ковнутри от ilium на стадии 30 практически нет (рис. 20). Крестцовое окно в это время по протяженности вдоль позвоночника составляет не менее восьми сегментов. Осевая мускулатура в области synsacrum в это время сложена миотубами. Крестцовые миомеры книзу сужаются (расширены миосепты) и вентрально распространяются не далее чем до хорды. Таким образом, на протяжении 56 стадий 27–30 происходит редукция гипаксиальных частей большей части миомеров в области позвонков сложного крестца с α по f (рис. 20). 4.2.5. Дрозд-рябинник На стадии 26 все миомеры в области synsacrum одинаковые — состоят из вытянутых вдоль продольной оси тела миобластов. На стадии 28 миомеры опускаются вниз до уровня a. dorsalis. Спереди и сзади от a. ischiadica гипаксиальная мускулатура, состоящая из миотуб, однородна вплоть до стадии 29. На стадиях 29–30 миомеры на уровне хорды истончаются, но их ряд по-прежнему непрерывен. На стадии 30/31 гипаксиальные части примерно восьми миомеров отсутствуют напротив центральных позвонков synsacrum и назад до лимфатического сердца. В самом краниальном из них, затронутом процессом формирования крестцового окна, отсутствует лишь каудальная половина его гипаксиальной части. Полной протяженности в 10 миомеров крестцовое окно достигает к стадии 32. В это время и позже мускулатура сохраняется в небольшом объеме между поперечными отростками позвонков β и γ. 4.2.6. Крыса Вплоть до стадии 17 ряд миомеров поясничной, крестцовой и хвостовой областей непрерывен. Однако уже на стадии 16 заметны небольшие отличия четырех миомеров позади места ответвления аллантоисной артерии. Их гипаксиальные части внизу не достигают уровня хвостовой артерии, тогда как остальные миомеры эту линию пересекают. На стадии 17 миомеры крестцовой области по-прежнему короче соседних. Они опускаются самое большее до уровня хорды, тогда как впереди- и позадилежащие миомеры — ниже уровня аорты и хвостовой артерии. В поясничном отделе гипаксиальные части миомеров продолжаются далеко вниз, обходя обширную брюшную полость. На стадии 18 ряд поясничных миомеров, состоящих из миотуб, резко прерывается в гипаксиальной своей части, образуя крестцовое окно, заполненное мезенхимой (рис. 21, а). Оно лежит примерно напротив каудальной половины шестого поясничного, первого-третьего крестцовых и краниальной части четвертого крестцового позвонков. Наибольшую протяженность в дорсо-вентральном направлении крестцовое окно имеет в своей краниальной половине. На стадии 19 мезенхима окна окружает ilium и крестцовые диапофизы (рис. 21, б ). 4.3. ФОРМИРОВАНИЕ КРЕСТЦОВОГО ОКНА В МИОМЕРАХ И ЕГО СЛЕДСТВИЯ Итак, у амниот крестцово-подвздошное соединение образуется на месте отсутствующей в соответствующих сегментах тела эмбриона гипаксиальной мускулатуры. Образованию крестцово-подвздошного комплекса предшествует формирование заполненного мезенхимой разрыва в ряду миомеров, на уровне их гипаксиальных отделов; этот разрыв получил название (Borkhvardt and Malashichev, 2000) крестцового окна (в оригинале — «sacral gap»). У амфибий разрыв в ряду миомеров выра57 жен значительно меньше — в виде расширения всего одной, «крестцовой», миосепты (Борхвардт, 1995). Вдоль этого скопления мезенхимных клеток крестцового окна и растет подвздошный элемент таза у амфибий, что наблюдали и другие исследователи (Коваленко и Анисимова, 1987; Streicher et al., 2001). Детальные морфологические наблюдения подтверждают (Борхвардт, 1995; Borkhvardt and Malashichev, 2000) факт того, что у эмбрионов настоящих ящериц до стадии 30 сохраняются все гипаксиальные части миомеров как туловищной, так и хвостовой областей, однако в дальнейшем гипаксиальные части двух крестцовых миомеров значительно редуцируются. Образуется обширное пространство, свободное от мышц, но заполненное мезенхимой. Гипаксиальная часть второго крестцового миомера разрушается почти полностью, за исключением наиболее медиального участка позади будущего второго крестцового ребра. Каудальная половина гипаксиальной части первого крестцового миомера также отсутствует. У безногой ящерицы (Anguis), имеющей один крестцовый позвонок, в основном разрушением затронут только один миомер. Формирующееся на месте гипаксиальной мускулатуры крестцовое окно меньше по протяженности, чем у настоящих ящериц с двумя крестцовыми позвонками. У змеи (Vipera), не имеющей выраженного крестца, отсутствует и крестцовое окно, а все миомеры клоакальной области остаются нормальными (Borkhvardt and Malashichev, 2000). Борхвардт (1995) отметил, что крестцовое окно у птиц очень большое и по протяженности немногим уступает synsacrum, у млекопитающих также занимает несколько последовательных сегментов. Мое исследование подтверждает и расширяет эти наблюдения. Действительно, крестцовое окно у птиц занимает место примерно семи миомеров у дрозда и десяти у курицы и перепела. Выглядит крестцовое окно на гистологических срезах как обширное пространство, заполненное мезенхимой и лишенное всяких следов гипаксиальной мускулатуры, не выявляемой даже с помощью антител к α-десмину — структурному белку, обязательно присутствующему во всей скелетной мускулатуре позвоночных, начиная со стадии миобластов. У крысы крестцовое окно в длину равно четырем миомерам. Таким образом, наблюдается положительная корреляция между размером крестцового окна и числом позвонков, входящих в крестец. Однако в отличие от ящериц, у эмбрионов птиц и млекопитающих ни на одной из стадий развития мне не удалось наблюдать гипаксиальную мускулатуру, опускающуюся ниже уровня хорды. Как бы то ни было, у всех исследованных до настоящего времени амниот гипаксиальные мышцы в крестцовых сегментах отсутствуют, и развитию крестцово-тазового сочленения всегда предшествует накопление скелетогенной мезенхимы в крестцовом окне. С чем связаны различия в формировании крестцового окна у амниот? Одно из возможных объяснений — это различный характер миграции мышечных предшественников в почку конечности. Действительно, гипаксиальные окончания миотомов рептилий очень рано дают мускульные почки, врастающие в почки задних конечностей (см. обзоры: Северцов, 1950; Raynaud, 1985; Galis, 2001). Число миотомов, вентро-латеральные края которых врастают в почку конечности, коррелирует с числом крестцовых позвонков. У Lacerta с двумя крестцовыми позвонками число сомитов, дающих мускульные почки, равно четырем (Rahmani, 1974; Raynaud, 1985, собственные данные), у безногих ящериц (Anguis и Ophisaurus) с одним крестцовым позвонком — трем (Rahmani, 1974), а у змей (Vipera), лишенных крестца, но имеющих рудиментарную почку конечности, — двум (Raynaud, 1985). У птиц и млекопитающих мускульных почек в том же виде, в каком они предстают у рептилий, 58 не наблюдал никто (Galis, 2001). У них миогенные клетки, которые не отличимы от окружающей недифференцированной мезенхимы морфологически и не экспрессируют еще генных маркёров мышечной дифференцировки, таких как MyoD, мигрируют одиночно или группами. Возможно, именно поэтому при исследовании эмбрионов рептилий создается впечатление о разрушении миомеров, тогда как у птиц и млекопитающих мы наблюдаем неформирование гипаксиальных частей крестцовых миомеров в области будущего крестцового окна. В связи с образованием крестцового окна в миомерах уместно привести пример Splotch мутантов мыши, у которых отсутствует нормальная функция гена Pax3, ответственного за формирование гипаксиальной мускулатуры (Tremblay et al., 1998). Такие мыши лишены мускулатуры конечностей и гипаксиальных частей брюшных мышц, а в скелете наблюдаются многочисленные разрастания и слияния элементов. В частности, у мутантов широкие диапофизы крестцового типа формируются на всех поясничных позвонках, в то время как диапофизы самих крестцовых позвонков формируются, но имеют неправильную форму (Tremblay et al., 1998). Таким образом, в нормальном эмбриогенезе морфогенетическим следствием образования крестцового окна является возможность разрастания скелетных элементов и их контакта друг с другом. Действительно, ilium, особенно у птиц, у которых он контактирует с целым рядом крестцовых позвонков, может образовывать такое протяженное крестцово-подвздошное сочленение только в том случае, если ему не препятствуют расположенные между ним и крестцом гипаксиальные мышцы, что и наблюдается в действительности. Интересно, что окнá в миомерах, аналогичного крестцовому, не образуется в области пояса передних конечностей. Наиболее проксимальный и протяженный относительно позвоночника элемент плечевого пояса — лопатка — в результате лежит свободно среди гипаксиальной мускулатуры и за редкими исключениями (например, у скатов) не образует прочного соединения с осевым скелетом, на что мы специально обращали внимание (Борхвардт, 1995; Malashichev and Borkhvardt, 2001). У рептилий крестцовое окно занимает место первого и второго крестцовых миомеров, давая возможность крестцовым ребрам свободно разрастаться и встречаться друг с другом. Первое крестцовое ребро растет косо назад вдоль сохранившейся краниальной части первого крестцового миомера. Второе ребро направлено немного вперед, так что оба крестцовых ребра неминуемо встречаются. Аналогично у млекопитающих крестцовые диапофизы сильно расширены, особенно дистально, и сливаются уже на хрящевой стадии, образуя единое крыло крестцовой кости. У птиц поперечные отростки synsacrum относительно слабые и не похожи на мощные крестцовые диапофизы млекопитающих или крестцовые ребра рептилий. Тем не менее отсутствие гипаксиальной мускулатуры латеральнее крестцовых позвонков также способствует разрастанию и сближению дистальных концов соседних как ди-, так и парапофизов на хрящевой стадии. В результате в крестце формируется ажурная сеть поперечных и продольных соединений ипсилатеральных отростков. Таким образом, у рептилий, птиц и млекопитающих крестцовые ребра или диапофизы как правило расширены за счет разрастания в зоне крестцового окна, где отсутствует мышечная ткань и накапливается скелетогенная мезенхима. Более того, в зоне крестцового окна развиваются не только крестцовые ребра или поперечные отростки, но и ближайший к ним край ilium. Размер области, лишенной гипаксиальной мускулатуры (число отсутствующих миомеров), соответствует числу расширен59 ных крестцовых отростков или ребер. Иными словами, формирование крестцового мезенхимного окна есть та необходимая предпосылка для развития крестца, которую мы можем положить в основание определения крестцового позвонка и крестца в целом. При этом стоит отдельно отметить, что формирование крестцового окна в миомерах, предшествующее развитию крестцовых отростков или ребер, не зависит от наличия ilium (см. гл. 6), что позволяет нам дать определение крестцового позвонка, основываясь на характеристиках только его собственного развития: Крестцовый позвонок — это позвонок, чьи поперечные отростки или ребра развиваются на месте отсутствующей в данном сегменте тела гипаксиальной мускулатуры. Следствием такого определения будет освобождение от того условия, что крестцовый позвонок обязательно должен контактировать с ilium. Он может осуществлять опосредованный другими крестцовыми позвонками контакт с тазом через сращение с их телами и/или поперечными отростками позвонков, а также осуществлять контакт не только с ilium, но и с ischium. «Некрестцовые» позвонки также могут сливаться с крестцовыми в единый блок, но критическим условием для отнесения их к разряду крестцовых будет служить развитие их поперечных отростков на месте крестцового окна в миомерах. Следуя данному определению, интересно рассмотреть сценарий развития крестца у неполнозубых млекопитающих. Хотя онтогенез крестца этих животных неизучен, по имеющимся анатомическим данным можно предположить, что все позвонки, образующие контакт с тазовыми костями, являются крестцовыми, а не хвостовыми или поясничными, т. е. позвонками, развивающимися на месте отсутствующей гипаксиальной мускулатуры. У этих млекопитающих ischium расположен особенно близко к позвоночнику, почти на одной линии с ilium. Недоразвитие гипаксиальных мышц между ним и позвонками почти наверняка должно привести к разрастанию крестцовых поперечных отростков и вовлечению ischium в крестцово-тазовое соединение, что и наблюдается в действительности. По всей видимости, у эмбрионов неполнозубых крестцовое окно в миомерах увеличено и развивается как впереди, так и позади acetabulum. В результате все позвонки этой обширной области развиваются по крестцовому типу. Это предположение можно проверить в будущем путем гистологического исследования крестцово-тазовой области эмбрионов муравьеда или броненосца, находящихся на стадии ранней почки задней конечности. Данное мною определение крестцового позвонка полностью согласуется с представлениями о модульности эволюции крестцового отдела позвоночника. Действительно, если в основе изменения строения крестца лежит изменение в характере экспрессии Hox -генов, контролирующих развитие всего отдела, то вполне вероятно, что это изменение коснется целого ряда сегментов тела и найдет отражение не только в положении морфологических маркёров, но и в изменении свойств этих сегментов, например таких, как формирование крестцового окна в гипаксиальной мускулатуре. Само крестцовое окно можно также интерпретировать как неоспоримо хороший маркёр крестцовых сегментов (позвонков). Учитывая это обстоятельство, высказанное выше предположение о развитии крестца неполнозубых, в свою очередь, предполагает, что у них должна наблюдаться более широкая, чем у мыши, зона экспрессии паралогичных Hox -генов с 9 по 12, захватывающая сегменты, в которых разовьются позвонки, осуществляющие контакт с ischium. Это предположение также может быть проверено в будущем с помощью in situ-гибридизации. 60 Глава 5. РАЗВИТИЕ ХРЯЩЕВЫХ И КОСТНЫХ ЭЛЕМЕНТОВ КРЕСТЦОВО-ТАЗОВОГО КОМПЛЕКСА Формирование крестцового окна в миомерах знаменует начало формирования в его зоне ранних зачатков таза и дальнейшее развитие крестцово-тазового соединения вплоть до окостенения. Этот процесс будет в деталях рассмотрен в настоящей главе на основе изучения серийных гистологических препаратов эмбрионов всех возрастов представителей модельных видов рептилий, птиц и млекопитающих. 5.1. РАЗВИТИЕ КРЕСТЦА И ТАЗА ПРЫТКОЙ ЯЩЕРИЦЫ Развитие крестца и таза у этого и других настоящих ящериц в целом очень сходно (Raynaud et al., 1975; Rieppel, 1992, 1994). Основное отличие живородящей ящерицы, Z. vivipara, и особенно обыкновенной стенной ящерицы, P. muralis, заключается в том, что на всех этапах развитие крестца и таза слегка задержано по сравнению с из развитием у L. agilis (Malashichev, 2001). 5.1.1. Положение и формирование зачатка таза и вертлужной впадины На стадии 31 общий зачаток таза представляет собой мезенхимное скопление, в котором на стадии 32 различимы все три основных его элемента, построенных из более плотной мезенхимы. Зачаток спереди и сзади ограничен нервными стволами пояснично-крестцового сплетения, plexus lumbo-sacralis, идущими в конечность (рис. 18, а). Спереди — это запирательный нерв, n. obturatorius, который проходит cквозь скопление pubis. Таким образом, запирательное отверстие образуется еще на мезенхимной стадии. Очень крупный большеберцовый нерв, n. tibialis, в это время соизмеримый по диаметру с зачатком таза, обходит его сзади. Зачаток таза формируется вокруг проксимального конца femur, и его геометрический центр совпадает по положению с центром будущей acetabulum. Вертлужную впадину слагают в основном проксимальные концы ischium и ilium, тогда как pubis вносит заметно меньший вклад. На стадии 32/33 acetabulum расположена на уровне чуть выше середины полости тела, а вдоль длинной оси эмбриона — на уровне будущего первого крестцового позвонка. Из-за удлинения позвоночника в процессе развития вертлужная впадина к стадии 38/39 оказывается немного краниальнее, на уровне последнего поясничного позвонка. Тем не менее положение acetabulum по-прежнему стабильно привязано к ветвлениям нервов пояснично-крестцового сплетения, обходящих тазобедренный сустав спереди и сзади, и a. iliaca interna, которая проходит позади мезенхимного зачатка таза у ранних эмбрионов и наблюдается непосредственно позади acetabulum 61 на более поздних стадиях. Контралатеральные вертлужные впадины уже у эмбрионов широко расставлены и расположены по бокам от полости тела. 5.1.2. Развитие хрящевых элементов крестцово-подвздошного комплекса На стадии 33 начинается процесс охрящевения в телах позвонков и невральных дугах до середины их высоты. К стадии 34 расстояние между верхними концами контралатеральных дуг заметно уменьшается, а дуги первого крестцового позвонка слегка накрывают сверху дуги второго. На стадии 35 контралатеральные дуги сходятся над спинным мозгом и начинают формировать мезенхимные остистые отростки, а на стадии 36 они состоят из гипертрофированного хряща и плотно стыкуются. На стадии 32 напротив невральной дуги первого крестцового позвонка формируется отдельное скопление клеток — зачаток ребра. Первое крестцовое ребро растет вдоль первой крестцовой септы, расширяясь на месте каудальной гипаксиальной части первого крестцового миомера. На стадии 33 мезенхимное второе крестцовое ребро закладывается вблизи соответствующей невральной дуги, оно заметно меньше первого (рис. 22, а). Первое крестцовое ребро охрящевевает на стадии 34, второе — на стадии 35. Подобная разница в темпах развития ребер сохраняется и в дальнейшем. Ткань крестцовых ребер менее дифференцирована, чем ткань, слагающая невральные дуги и ilium. Ilium растет в крестцовом окне вверх и назад от acetabulum, доходя до нижнего края хорды на стадии 33. Между ilium и крестцовыми ребрами остается довольно широкое пространство, заполненное мезенхимой. Сравнительно быстро, к стадии 33/34, уже охрящевевающий ilium поднимается до уровня нервных ганглиев, глубоко вторгаясь снизу в крестцовое окно по его латеральному краю (рис. 17, г). На стадии 34 хрящевой ilium поднимается до середины невральной дуги и верхней трети ганглиев. На стадии 35 охрящевевающие крестцовые ребра растут по направлению к ilium, расширяясь на дистальных своих концах. Ilium при этом остается в латеральном положении. К концу этой стадии первое крестцовое ребро вытягивается своим дистальным краем вдоль верхней части ilium. Оно немного наклонено назад и своим задним краем нависает над вторым крестцовым ребром (рис. 22, б ). Хрящевое первое крестцовое ребро на стадии 36 прирастает к невральной дуге, но по-прежнему хорошо отличимо от ее основания; оно как минимум вдвое крупнее второго (рис. 22, в, г). Второе крестцовое ребро также прирастает к невральной дуге с менее четкой (чем у первого ребра) границей между ребром и дугой. Оно сильно скошено вперед к первому крестцовому ребру, занимая вместе с ним бóльшую часть крестцового окна. Дистальные края обоих крестцовых ребер соединяет тяж мезенхимных клеток в виде «мостика» (рис. 22, г). К стадии 35 ilium достигает верхнего края ганглиев и первого хвостового сегмента. В районе хвостовых сегментов тело эмбриона сужается, и ilium, следуя этому сужению, немного поворачивает к продольной оси тела эмбриона, расширяясь на конце и занимая латеро-каудальный угол крестцового окна — между покровами и первым хвостовым миомером (рис. 22, г). В это время формируется processus cranialis ilii. Он отходит как раз перед началом осевой хвостовой мускулатуры, где тело имеет сужение. В верхней части крестцового окна ilium заходит назад за второе крестцовое ребро, оставляя ниже и медиально лимфатическое сердце и первый 62 хвостовой миомер. На самом деле его край остается в пределах второго крестцового сегмента, но из-за скошенности миосепт оказывается напротив первого хвостового миомера. Уже на стадии 36 хрящ ilium настолько плотный, что часто вместе с перихондрием отслаивается вдоль уплощенных мезенхимных клеток крестцового окна, лежащих между ним и крестцовыми ребрами (рис. 22, г, см. также рис. 24, б ). К стадии 38 ilium поднимается до уровня верхнего края спинного мозга. Общая его длина к концу эмбрионального развития равна длине трех позвонков: последнего поясничного, напротив которого расположено acetabulum, и двух крестцовых. На стадии 37 края обоих ипсилатеральных крестцовых ребер сходятся. Охрящевевает частично и та мезенхима, которая в виде «мостика» связывала края ребер на предыдущей стадии. В это время крестцовые ребра заметно крупнее поперечных отростков хвостовых позвонков. Лимфатические протоки между осевым подхордовым синусом и тазовым лимфатическим сердцем разделяют основания второго крестцового ребра и первого хвостового диапофиза, делая их слегка вогнутыми снизу. Диапофиз первого хвостового позвонка принимает также слегка вильчатую форму на своем дистальном крае, обходя тазовое лимфатическое сердце. На стадии 38 первое крестцовое ребро вплотную подходит к ilium. Дистальный край ребра в полтора раза шире проксимального и состоит из молодого хряща. 5.1.3. Развитие хрящевых элементов нижней части таза По зрелости элементов на всех стадиях развития можно определить такую последовательность: ilium — pubis — ischium. Pubis и ischium не проникают на ранних стадиях далеко вниз от acetabulum. Полость тела эмбриона ящерицы узкая и невысокая, сужается каудально вокруг задней кишки и ножки аллантоиса в районе презумптивного таза. Зачаток пояса ограничен сзади клоакой. Впереди pubis заканчивается в мезенхиме ниже и латеральнее пологой задней стенки брюшной полости (рис. 23, а, б ). К стадии 33 охрящевевающий pubis опускается вниз от acetabulum до уровня середины брюшной полости. Мезенхимный ischium от вертлужной впадины так низко еще не распространяется. На стадии 33/34 контралатеральные хрящевые pubes, направленные вниз и вперед, спускаются по бокам от брюшной полости до ее нижней границы, а в дальнейшем проходят ниже и поворачивают навстречу друг другу. На стадии 34 pubes практически сходятся дистальными концами, а на стадии 35 образуют симфиз (рис. 23, в). Впереди от симфиза наблюдается скопление мезенхимных клеток на медиальной оси тела эмбриона. На стадии 37 pubis круглый в поперечном сечении, мощный, сложен гипертрофированным хрящом. На стадии 39 в передней части симфиза контралатеральные pubes слиты, так что их трудно различить. Передний край симфиза лежит далеко впереди от первого крестцового позвонка, примерно под третьим предкрестцовым позвонком, если начинать счет от крестца и вести его вперед (рис. 23, б ). На стадии 34 между дистальными краями контралатеральных ischia сгущается мезенхима. Хрящевой ischium растет почти вертикально вниз, оставаясь в пределах одного сегмента, примерно напротив первого крестцового позвонка. Проксимально он достаточно мощный, шире pubis в 2–3 раза. Подойдя к полости тела, ischium растет параллельно ее стенке, уплощаясь и вытягиваясь вдоль продольной оси эмбриона (рис. 23, в). На стадии 35 контралатеральные ischia стыкуются передними, а 63 на стадии 36 и задними краями. Симфиз ischia тянется по длинной оси эмбриона, начинаясь слегка краниальнее acetabulum, примерно под foramen obturator в pubes. Даже на стадии 36 его протяженность в кранио-каудальном направлении больше, чем симфиза pubes. На стадии 38/39 хрящевые дистальные концы ischia плотно смыкаются на всем своем протяжении. На стадии 36 между брюшной полостью и покровами уже хорошо выражен вертикальный плотный тяж коллагеновых волокон и уплощенных, вытянутых вдоль длинной оси эмбриона клеток, соединяющий лобковый и седалищный симфизы (рис. 23, г). Это осевое скопление распространяется также вперед от симфиза pubes и назад от симфиза ischia. Оно служит основой, на которой формируются мезенхимные зачатки, а впоследствии и хрящи дополнительных элементов пояса. К тяжу также крепятся парные мышцы (mm. puboischiofemorales externus et internus). На стадии 36 позади симфиза ischia по оси тела первым из дополнительных элементов таза формируется мезенхимный hypoischium. На стадии 37 hypoischium сильно вытягивается, а на стадии 38 — охрящевевает. К этому времени впереди симфиза ischia также появляется округлый в поперечном сечении и хрящевой epiischium. Hypoischium и epiischium дискретны от хряща симфиза и слегка раздваиваются при приближении к нему в виде «ласточкина хвоста» (лучше выражен у hypoischium — рис. 5, б ). Кзади hypoischium расширяется булавовидно. На стадии 39 впереди от симфиза pubes появляется хрящевой epipubis. У новорожденных, молодых и взрослых L. agilis ализарин интенсивно окрашивает в красный цвет epiischium, hypoischium, но не epipubis, следовательно в последнем кальцификация хряща задерживается, если вообще имеет место у данного вида ящериц. 5.1.4. Окостенение крестцово-подвздошного комплекса На стадии 36 невральные дуги крестцовых позвонков состоят из сильно гипертрофированного хряща и сходятся над спинным мозгом. Перихондральная кость появляется в это время на восходящих участках дуг, сначала со стороны спинного мозга, к стадии 38 она достигает верхней трети высоты невральной дуги. Появляется перихондральная костная манжетка и на телах позвонков в виде вентральной и дорзальной пластинок. На стадии 38 наблюдаются центры эндохондрального окостенения в теле позвонка — по сторонам от хорды — и в невральных дугах, в средней их части по высоте. Разрушение хряща вокруг места, где ранее появилась костная манжетка, в первом крестцовом позвонке происходит чуть раньше, чем во втором. На стадии 39 разрушение хряща распространяется и к основаниям невральных дуг. До верхних концов невральных дуг внутреннее окостенение доходит лишь к стадии 40, когда лишь их кончики состоят из молодого хряща. Тела позвонков незначительно отстают в развитии от невральных дуг. Между ними и основаниями невральных дуг до стадии 39 сохраняется хрящ. Перихондральная кость впервые наблюдается на верхней поверхности обоих крестцовых ребер на стадии 38 и быстро окружает основание ребра. Особенно быстро это происходит на втором крестцовом позвонке. Эндохондральное окостенение на стадии 39 особенно сильно выражено в основании первого крестцового ребра. Даже на стадии 40 у второго крестцового ребра на гистологических срезах отдельный очаг эндохондрального окостенения обнаружить не удалось. Эндохондральное окостенение проникает здесь от основания невральной дуги. 64 На стадиях 36–37 имеется перихондральное окостенение в средней части подвздошного хряща, а центр эндохондрального окостенения в ilium впервые наблюдается на стадии 38 в нижней его трети, под уровнем крестцовых ребер. Эндохондральное окостенение распространяется вверх и вниз вдоль хряща и достигает acetabulum в конце стадии 39. Концы ilium остаются хрящевыми по крайней мере до вылупления. Хорошо видна разница в зрелости крестцовых ребер и прилежащего к ним ilium (рис. 24, а). Последний покрыт толстой костной манжеткой и в нем начинается формирование эндохондральной кости. До конца стадии 39 только проксимальные половины крестцовых ребер покрываются костной манжеткой, а дистальные, контактирующие с ilium, края состоят еще из молодого хряща. Первое крестцовое ребро слегка нависает над ilium, второе расположено немного ниже. Более молодое по дифференцированности ткани второе крестцовое ребро, огибая снизу дистальный край окостеневшего ilium, образует желобок, в который тот и ложится сверху. 5.1.5. Окостенение нижней части таза На стадии 36 на pubis можно найти тонкую костную манжетку. К стадии 38 она достигает района симфиза. В pubis сосуды прорывают костную манжетку вблизи foramen obturator, и разрушение хряща начинается между ним и processus pectinealis. На стадии 39 эндохондральное окостенение проникает и в участок между foramen obturator и acetabulum (рис. 24, б ), все еще не достигая последнего. Processus pectinealis в это время также покрыт костной манжеткой с боков. Хорошо заметны отличия pubis от ischium — не только по степени гипертрофии хряща, но и по мощности перихондрального окостенения, которое на ischium всегда уступает таковому pubis по толщине (рис. 24, б ). Костная манжетка на ischium еще слабая, тогда как в pubis идет внутреннее окостенение. Ischium покрывается костной манжеткой на стадии 38/39, начиная с краниального своего края, на середине длины. Каудальный его край кость покрывает только на стадии 39/40. Эндохондральное окостенение ischium также появляется в центре элемента. 5.2. РАЗВИТИЕ СЛОЖНОГО КРЕСТЦА И ТАЗА ДОМАШНЕЙ КУРИЦЫ И ЯПОНСКОГО ПЕРЕПЕЛА Развитие крестца и таза у японского перепела протекает так же, как и у домашней курицы, особенно на ранних стадиях. Учитывая их практически одинаковое строение, подробные описания развития крестца и таза для перепела не приведены. Незначительные различия двух видов указаны в тексте и подписях к рисункам. 5.2.1. Положение и формирование зачатка таза и вертлужной впадины На стадии 26 проксимальнее femur, между задней стенкой брюшной полости и нервами пояснично-крестцового сплетения наблюдается мезенхимное сгущение — 65 самый ранний зачаток таза (рис. 25, а). Этот зачаток расположен напротив места ответвления аллантоисной артерии и соответствует кранио-каудальному уровню, на котором формируется acetabulum, которое располагается чуть ниже уровня a. dorsalis. На этой же стадии появляются первые следы охрящевения ilium впереди и над будущим acetabulum. На стадии 28 хрящевой зачаток таза разрастается вокруг проксимального конца femur. Хрящ появляется в pubis, а на стадии 28/29 — в ischium, таким образом foramen acetabuli замыкается снизу. На стадии 30/31 ilium вносит как минимум 50%ный вклад в acetabulum, тогда как ischium — около трети, а оставшуюся часть занимает pubis, на стадии 31/32 оттесняемый от вертлужной впадины двумя другими элементами. При этом ischium в основном слагает дно и вентральную часть acetabulum, тогда как ilium — ее дорсальную, краниальную и, в меньшей степени, — каудальную части. 5.2.2. Развитие хрящевых элементов крестцово-подвздошного комплекса На стадии 26 начинается накопление матрикса вокруг хорды и на расстоянии двух-трех клеточных слоев от нее. На стадии 26/27 вдоль хорды уже наблюдается четковидность скелетогенного материала. На стадии 27 прохондральные невральные дуги поднимаются до уровня нижнего края нервных ганглиев, на стадии 27/28 — двух третей высоты нервных ганглиев, а на стадии 28 — достигают верхнего края нервной трубки. В это время тела и дуги позвонков морфологически видимы уже как очень молодой хрящ, однако между ними имеется неокрашиваемая альцианом мезенхимная прослойка. Эта перемычка, по-прежнему оставаясь мезенхимной, начинает краситься альцианом на стадии 30. В это время контралатеральные хрящевые дуги краниальных позвонков synsacrum сильно сближаются, а на стадии 31 — смыкаются. Хрящевые тела соседних позвонков уже на стадии 30 заметно сближены друг с другом по сравнению с грудными. Между телами сохраняются значительные прослойки молодого хряща и недифференцированных клеток. Тела центральных позвонков synsacrum («арабской» серии) не менее, чем на 20% ниже соседних позвонков «греческой» и «латинской» серий. На стадии 29 на телах позвонков «греческой» серии формируются вентральные отростки, processus ventrales (у взрослых кур часто не выражены), а на стадии 30 — краниальные выступы (начало формирования гетероцельности). На последующих позвонках synsacrum подобных изменений не наблюдается ни на одной из стадий. На позвонках γ и δ на стадии 31 формируются маленькие хрящевые ди- и парапофизы. На позвонках «латинской» серии поперечные отростки долгое время (до стадии 32) — всего лишь мезенхимные скопления, особенно хорошо выраженные на позвонках a и b. На стадии 32/33 крестцовые ребра и диапофизы на позвонках a и b охрящевевают. Диапофиз на позвонке 5 охрящевевает на стадии 33, в это же время появляются ди- и парапофизы на позвонке c. На стадии 34/35 видны диапофизы на позвонках 5 и 4 (рис. 25, б ), а на стадии 35 — небольшие диапофизы на позвонках d, 3 и 2. Иными словами, порядок закладки и охрящевения поперечных отростков соответствует не кранио-каудальному положению в позвоночнике, а коррелирует с их абсолютными дефинитивными размерами: первыми закладываются и охрящевевают поперечные отростки, наиболее крупные у взрослых 66 кур. Этот процесс идет в краниальном и каудальном направлениях от позвонка a. На стадии 36 хрящевые диапофизы позвонков «латинской» серии соединяются дистально с направленными косо назад и вверх хрящевыми же крестцовыми ребрами и парапофизами, но граница на этой стадии между ними видна. На стадии 37 сливаются позвонки сложного крестца. Этот процесс начинается также от центра synsacrum. Между позвонками α–5 расположены спинальные ганглии, особенно крупные позади невральных дуг позвонков α–4 (рис. 25, в, г). Напротив позвонков «арабской» серии края соседних ганглиев сильно сближены и между ними практически нет свободного пространства вблизи тел позвонков и нижней трети невральных дуг. Спинальный ганглий позади позвонка 5 меньшего размера, как и все более каудальные. Ilium — первый из элементов таза, который выделяется более плотным скоплением мезенхимы еще на стадии 27 (рис. 26). Первой охрящевевает кранио-дорсальная часть ilium (место формирования antitrochanter и tuberculum preacetabularis), на уровне хорды. На стадии 28 хрящевой ilium еще сравним по диаметру с femur, подковообразно огибает femur сверху своим основанием. Его продолговатая мезенхимная часть распространяется вверх до нижнего края нервных ганглиев. На стадии 28/29 в ширину она равна кранио-каудальной длине двух-трех позвонков (2–4 «арабской» серии), поднимаясь до уровня нижней трети нервных ганглиев. Обращает на себя внимание тот факт, что даже на более ранней стадии, а именно 27/28 позади acetabulum наблюдается шлейф из накапливающих вокруг себя матрикс мезенхимных клеток, который постепенно претерпевает охрящевение в каудальном направлении в последующем развитии. Рост хрящевого ilium проходит довольно стремительно (рис. 26). После короткого временнóго промежутка (стадии 28–29) равномерного роста на стадиях 29–31 осуществляется в основном увеличение постацетабулярной части ilium, достигающей сегмента с лимфатическим сердцем, тогда как ala preacetabularis ilii почти не увеличивается. На стадии 29 надацетабулярная часть ilium полностью хрящевая и составляет в ширину около четырех позвонков. На стадии 30 хрящевой ilium составляет в ширину около шести сегментов, распространяясь в основном в каудальном направлении. На стадии 31 его ширина равна длине восьми-десяти позвонков, и он достигает заднего края synsacrum. Ilium лежит впереди от лимфатического сердца в зоне крестцового окна и занимает бóльшую его часть. На стадии 32/33 ilium растет в основном вперед, накрывая своим передним краем последнее грудное ребро и вплотную подходя к поперечным отросткам позвонков «греческой» серии. Ilium уже почти заканчивает свой рост в ширину. Соотношение ширины крыльев таза меняется в пользу преацетабулярной части. В дальнейшем рост замедляется: если на стадии 32 ilium протягивается вдоль 11 позвонков, то лишь на стадии 35/36 он равен длине 12 позвонков. До стадии 34 с ilium контактируют только поперечные отростки позвонков α–γ «греческой» серии, но на стадии 34/35 поперечные отростки и ребра более каудально расположенных позвонков с ним также сближаются. На стадии 36 между диапофизами позвонков 1–5 и ilium — прослойка мезенхимы, а позвонки «латинской» серии осуществляют плотный контакт посредством хрящевых крестцовых ребер и парапофизов, которые достигают ilium чуть раньше диапофизов. Парапофизы, или ребра на их месте, длиннее диапофизов. Молодой хрящ дистальных частей ди- и парапофизов разрастается вдоль ilium, и на стадии 37 поперечные отростки позвонков 67 a − f сливаются дистально друг с другом и подобными парами соседних позвонков, хотя границы между хрящами можно различить до стадии 39. 5.2.3. Развитие хрящевых элементов нижней части таза Уже на ранних мезенхимных стадиях задняя стенка брюшной полости быстро принимает почти вертикальное положение (рис. 27). На стадии 27 элементы нижней части тазового пояса — pubis и ischium — не выделяются из общего мезенхимного скопления. Мезенхима pubis уже на стадии 28 уплотнена, а на стадии 28/29 охрящевевает. Pubis направлен вперед и немного вниз к задней стенке брюшной полости, располагаясь целиком впереди от будущей acetabulum. Достигнув стенки брюшной полости, pubis далее растет вдоль нее, прилегая к ее стенке и повторяя ее конфигурацию. На стадии 29 полностью хрящевой pubis тонкий и направленный вниз, в отличие от ischium, который состоит еще из мезенхимы. Pubis — самый маленький из элементов таза, но на всех стадиях развития по состоянию ткани является элементом средней зрелости между ilium и ischium. На стадиях 29 и 30 брюшная полость сильно увеличивается в объеме, а угол, под которым расположена задняя стенка брюшной полости по отношению к осевым органам, почти прямой, на стадии 31/32 — тупой. Одновременно с процессом отодвигания задней стенки брюшной полости назад, особенно ее вентральной части, дистальный конец pubis на последовательных стадиях развития, удлиняясь, все сильнее растет назад, так что на стадии 32 лишь короткий проксимальный его участок, соответствующий раннему зачатку, направлен вперед. Таким образом, pubis оказывается вентральнее ischium и опускается дальше вниз вдоль стенки брюшной полости (рис. 28). Зачаток ischium впервые обнаруживается ниже будущего acetabulum в виде крупного мезенхимного скопления на стадии 28. На стадии 28/29 этот, направленный вниз и назад от acetabulum, зачаток заметно крупнее pubis и по размеру сравним с ala postacetabularis ilii. Хотя и в меньшей степени, чем pubis, ischium также находится в соприкосновении со стенкой брюшной полости. На стадии 30–31 мезенхимный ischium растет параллельно латеральной стенке той части брюшной полости, где расположена клоака. В этом месте брюшная полость сильно сужена, по сравнению с уровнем передней части synsacrum. Так как ischium лежит медиальнее pubis, то задняя стенка брюшной полости оказывается также спереди и от этого зачатка (рис. 29, а). Следуя ей, он направлен под тупым углом назад от acetabulum. В то же время ischium уплощается медио-латерально, распластываясь вдоль латеральной стенки полости тела на расстояние вниз до половины диаметра последней. На стадии 31 ischium охрящевевает. На стадии 32 pubis и ischium имеют равную длину, но еще не достигают уровня заднего края ala postacetabularis ilii, а на стадии 33 pubis обгоняет в росте ischium и загибается вокруг его дистального края. Одновременно лопасть ischium приближается своим дистально-дорсальным углом к каудальному углу ilium (рис. 28, б ). Более молодой по сравнению с ischium хрящ дистальной части ilium обрастает кончик ischium на стадиях 35–36. При этом все три луча таза выстроены почти параллельно друг другу, так как нижние элементы таза повторяют контуры брюшной полости, вокруг которой происходит их рост, и направлены от acetabulum вниз и назад (рис. 28, б ). 68 5.2.4. Окостенение крестцово-подвздошного комплекса Хотя на стадии 37 тела, невральные дуги и ребра грудных позвонков покрыты костной манжеткой, ее нет на телах и дугах позвонков synsacrum. В это время перихондральная кость покрывает хрящ femur. И на стадии 38/39, когда остеогенные процессы активно идут в тазовом поясе, перихондральной кости по-прежнему нет на телах и дугах позвонков synsacrum. Костная манжетка появляется только перед вылуплением, а у цыплят обнаруживается и на поперечных отростках позвонков. Интересно отметить, что самостоятельные центры окостенения мне удалось наблюдать в хряще парапофизов или ребер первых четырех позвонков «латинской» серии, т. е. на позвонках a–d. На стадии 38 начинается остеогенез в средней части ilium над acetabulum и в ala preacetabularis ilii, где манжетка распространяется вверх примерно до уровня парапофизов позвонков «греческой» серии. На стадии 38/39 манжетка распространяется от центральной части ilium и на ala postacetabularis ilii почти до самого конца элемента. При этом сквозь костную манжетку практически сразу начинают проникать в хрящ ilium многочисленные кровеносные сосуды. Эндохондральное окостенение происходит практически по всей ширине ilium. Очаги разрушения хряща в подвздошном элементе наблюдаются ниже уровня середины нервных ганглиев, особенно обширны они напротив позвонков α–γ, т. е. как раз в той части ilium, где ранее появилась костная манжетка. На стадии 39/40 отдельные мелкие очаги внутреннего окостенения ilium сливаются между собой, образуя единую зону разрушенного хряща, протяженностью приблизительно в шесть сегментов — примерно по три сегмента вперед и назад от acetabulum. Краниально эта зона протягивается до уровня позвонка β, а каудально — до позвонка a. Эндохондральное окостенение распространяется далее в alae pre- et postacetabulares ilii выше уровня acetabulum. Однако даже на стадии вылупления ilium не окостеневает полностью, не срастается с synsacrum и по-прежнему отделен от остальных элементов таза хрящом. 5.2.5. Окостенение нижней части таза Остеогенез начинается в нижней части таза на стадии 38/39, когда кость впервые появляется на pubis. В это время перихондральная кость имеется на большей части его длины, тогда как ischium покрыт лишь перихондрием без каких-либо признаков перихондральной кости. На стадии 40 появляется кость и в самом узком месте ischium в виде тонкого пояска. На pubis костная манжетка в это время почти достигает acetabulum. Она распространяется на обоих элементах по всей их длине, и к вылуплению хрящевыми остаются только их дистальные кончики и участки в составе acetabulum. У перепела процесс окостенения таза происходит на одну-две стадии быстрее. Так, на pubis костная манжетка заметна уже на гистологических срезах на стадии 36/37 (рис. 29, б ), а на тотальных препаратах перепелят перед вылуплением окостенения pubis и ischium выглядят более развитыми, а сами элементы — более длинными, чем у цыплят. 69 5.3. РАЗВИТИЕ СЛОЖНОГО КРЕСТЦА И ТАЗА ДРОЗДА-РЯБИННИКА 5.3.1. Положение и формирование зачатка таза и вертлужной впадины Ранний мезенхимный зачаток таза (ст. 27) соответствует по положению будущей acetabulum и расположен немного ниже a. dorsalis, на одном уровне с ответвлением аллантоисной артерии или немного краниальнее. Положение acetabulum относительно позвоночника практически неизменно в течение всего эмбриогенеза — она располагается напротив позвонков 1 и 2. Так же, как и у куриных птиц, вклад тазовых элементов в acetabulum неравномерный: ilium слагает более половины вертлужной впадины, ischium — более трети, а pubis лишь примыкает к остальным элементам небольшим участком снизу и спереди от будущей вертлужной впадины. 5.3.2. Развитие хрящевых элементов крестцово-подвздошного комплекса Первые признаки охрящевения невральных дуг и тел позвонков наблюдаются на стадии 28. К стадии 31 невральные дуги поднимаются до верхней половины спинного мозга, но контралатеральные дуги смыкаются над спинным мозгом только на стадии 35. На стадии 36 формируются низкие остистые отростки на позвонках «греческой» серии. Промежутки между спинномозговыми ганглиями в области synsacrum заметно более узкие, чем в грудном отделе. Три наиболее крупные ганглия расположены за телами позвонков α, 1 и 2 (рис. 30, а). Ганглии настолько крупные, что последние два из них не только контактируют краями, но даже сливаются (рис. 30, б ). Остальное пространство, свободное от нервной ткани, заполнено высоко поднятыми над брюшной полостью тазовыми почками. Каудальнее почки заполняют пространство между крестцовыми ребрами и парапофизами позвонков «латинской» серии. На стадии 35 все позвонки synsacrum несут еще слабо развитые хрящевые диапофизы. Хрящевые крестцовые ребра имеются на первых трех позвонках «латинской» серии a, b и c. Ребра и поперечные отростки позвонков «латинской» серии ilium не достигают. На стадии 36/37, когда диапофизы и парапофизы встречаются, происходит и их контакт с ilium, а на стадии 39 хрящи поперечных отростков, которые расширяются по мере приближения к ilium, полностью сливаются дистально своими краями с контралатеральными соседями. Этот вид оказался очень удобен для наблюдения процесса слияния позвонков synsacrum. На стадиях 37–39 начинается слияние позвонков synsacrum: тела и дуги позвонков сближаются. Между пре- и постзигапофизами соседних позвонков сохраняется плотная мезенхима, и сочленовные поверхности не образуются. На позвонках с β по b видны небольшие хрящевые перемычки между краями тел, тогда как по медиальной линии тела позвонков лишь сильно сближены и между ними видна яственная граница. Быстрее всего процесс слияния протекает у позвонков 1 и 2. Их тела латерально уже слиты настолько, что граница между ними почти не различима на стадии 38. На стадии 39/40, т. е. за один-два дня до вылупления, сливаются тела восьми позвонков. При этом тела центральных позвонков synsacrum выглядят более короткими, чем передние и задние. Слияние невральных дуг протекает быстрее слияния тел позвонков. Если между телами даже позвонков 1 и 2 еще можно различить вентрально границу, то хрящи невральных дуг, за исключением 70 таковых позвонков β и γ, сливаются без различимых границ. От позвонков 1 и 2 степень объединения хрящей тел равномерно снижается в обе стороны; позвонки γ, d, e, f отделены четкими границами от остального блока позвонков или своих соседей; между γ и δ, а также f и первым хвостовым позвонком имеются нормальные суставы. На стадиях 28–30 ilium растет вверх от acetabulum. Узкий, равный по ширине одному-двум позвонкам, мезенхимный ilium поднимается на стадии 28 до аорты, а на стадии 29 уже охрящевевающий ilium достигает нижнего края спинного мозга. Но и на стадии 30 ilium не превышает в ширину длины трех-четырех позвонков, располагаясь на уровне хорды или максимум нижней трети спинномозговых ганглиев, снаружи от миомеров. На стадии 30/31 ilium, сложенный более зрелым хрящом, распространяется далее назад от acetabulum и занимает около пяти сегментов в длину. На стадии 31 каудально он достигает лимфатического сердца, т. е. составляет семь сегментов в длину. Само лимфатическое сердце расположено точно за ilium, в следующем сегменте. На стадии 31/32 ilium поднимается вверх до середины спинномозговых ганглиев. При этом его верхний край проходит к верхнему краю спинного мозга и весьма близко от покровов. На стадии 35 ilium, состоящий из зрелого хряща, поднимается до верхнего края спинного мозга, а в ширину равен 12 сегментам (семь сегментов — ala postacetabularis ilii, пять — ala preacetabularis ilii) и сочленяется с поперечными отростками позвонков «греческой» серии (парапофизами на стадии 35, диапофизами на стадии 36), накрывая передним краем последнее грудное ребро. На стадии 36/37 он продвигается вперед еще на полсегмента. Диапофизы наиболее каудальных позвонков synsacrum своими кончиками, состоящими из хряща более молодого, чем хрящ ilium, достигнув последнего, загибаются вниз, навстречу парапофизам и крестцовым ребрам, с которыми сливаются. Между поперечными отростками наиболее каудальных позвонков synsacrum и ilium даже на стадии 36/37 сохраняется мезенхимная прослойка. 5.3.3. Развитие хрящевых элементов нижней части таза На стадии 30/31, т. е. когда только начинает формироваться хрящевой таз, задняя стенка брюшной полости принимает почти вертикальное положение. На стадиях 28–32 pubis, охрящевение которого началось на стадии 29/30, также растет вперед от acetabulum к задней стенке брюшной полости, но его дистальный край слегка загибается вниз вдоль нее. На стадии 32 брюшная полость продолжает увеличиваться, угол между задним контуром полости и осевыми органами становится тупым. Pubis, продолжая расти вдоль стенки брюшной полости, таким образом, все больше отклоняется каудально относительно acetabulum и своего основания. Различная степень зрелости элементов таза отмечается впервые в самом начале хондрогенеза, и порядок дифференцировки элементов сохряняется на всех последующих стадиях развития: ilium — pubis — ischium. Ischium остается мезенхимным до стадии 30 и последним охрящевевает лишь на стадии 31. Тонкий цилиндрический pubis к стадии 35 достигает вентро-каудального края ischium и начинает загибаться вверх вокруг дистального конца последнего. Дорсо-каудальный угол широкого и плоского ischium сильно вытянут и сближен с задним краем ilium, который огибает брюшную полость и тазовую почку. Хрящ ischium в месте будущего контакта более зрелый, и его граница оформлена, тогда как хрящ края ilium очень молодой и обтекает хрящ ischium. 71 5.3.4. Окостенение крестца и таза На стадиях 36–39 перихондральная кость появляется на длинных элементах конечностей и скелетных элементах головы и передней части туловища. К моменту вылупления в них начинается и процесс эндохондрального окостенения. Окостенения крестца и таза не происходит даже на второй день после вылупления. 5.4. РАЗВИТИЕ КРЕСТЦА И ТАЗА СЕРОЙ КРЫСЫ 5.4.1. Положение и формирование зачатка таза и вертлужной впадины Местоположение тазового пояса и вертлужной впадины можно определить уже на стадии 16/17 по проксимальному концу плотного мезенхимного зачатка femur. На стадии 17 мезенхимный зачаток таза уже хорошо выражен. Он расположен позади задней стенки брюшной полости, у ее верхнего края, т. е. близко к осевым органам, примерно напротив будущего третьего крестцового позвонка. Спереди и сзади его ограничивают нервы пояснично-крестцового сплетения, идущие в конечность — n. obturatorius и n. ischiadicus (рис. 21, в). Положение acetabulum неизменно до стадии 18. Оно лежит примерно напротив третьего крестцового позвонка, т. е. четырьмя-пятью позвонками кзади от места ответвления от аорты аллантоисной артерии. Вертлужные впадины расположены по бокам от узкой, содержащей прямую кишку части брюшной полости и потому сближены (рис. 32, г). Из элементов таза наибольший вклад, до 50%, в acetabulum вносит ilium — он охватывает вертлужную впадину сверху и спереди. Еще треть периметра занимает хрящ ischium, на долю pubis приходится не более 20%. Дно вертлужной впадины слагает в основном ilium. 5.4.2. Развитие хрящевых элементов крестцово-подвздошного комплекса Нервная трубка на стадии 17 очень большая в диаметре, почти десятикратно превышает по диаметру очень маленькую хорду. Спинномозговые ганглии в крестцовой области, а также непосредственно спереди и сзади крестца, очень крупные, высоко подняты и располагаются напротив верхних двух третей спинного мозга. На уровне нижней трети спинного мозга идут только спинномозговые нервы. Это накладывает отпечаток на развитие осевого скелета, в котором на стадии 17 начинается охрящевение. На стадии 18 очень тонкие невральные дуги достигают лишь нижнего края огромных ганглиев. На стадии 19 их хрящ гипертрофируется, но они достигают только середины спинномозговых ганглиев. Контралатеральные невральные дуги достигают верхнего края спинного мозга только на стадии 21, при этом они не проходят между плотно сомкнутыми спинномозговыми ганглиями, а обходят их латерально. Уже на стадии 21 заметно относительное укорочение тел крестцовых позвонков, особенно в сравнении с хвостовыми позвонками. На стадиях 20–22 развиваются хрящевые зигапофизы. На этой же стадии наблюдаются отличия крестцовых межпозвонковых дисков. Тогда как межпозвонковые диски между поясничными позвонками высокие и вертикальные, межпозвонковые диски в крестце неправильной формы, слегка утолщены, особенно между первым-третьим и, в меньшей степени, 72 третьим и четвертым крестцовыми позвонками. К моменту рождения деформация межпозвоночных дисков достигает еще бо́льшей степени. Мезенхимные крестцовые диапофизы появляются на стадии 18, причем они уже крупнее поясничных. Наиболее крупные из них — диапофизы первого и второго крестцовых позвонков. Основания диапофизов лежат заметно ниже ганглиев, и их положение последовательно повышается в ряду от первого к последнему. Первый крестцовый позвонок уже на стадии 18 отличается от остальных крестцовых и впередилежащих поясничных увеличенными и низко опущенными диапофизами. У первых двух крестцовых позвонков они значительно крупнее остальных. На стадии 19 диапофизы охрящевевают и сходятся дистальными краями. Третий диапофиз входит в общее с предыдущими поперечными отростками ala sacralis своим дистальным краем только на стадии 21, а четвертый, если входит, то на стадии 22. Диапофиз первого крестцового позвонка на стадии 22 сближается с крылом ilium. Тела крестцовых позвонков заметно короче поясничных, причем переход от длинных тел к коротким довольно резкий и приходится на первый крестцовый позвонок. В этом месте уже формируется легкий лордоз позвоночника, и тела крестцовых позвонков подняты дорсально относительно поясничных. В конце стадии 17 из общего мезенхимного скопления таза начинает выделяться ilium, охрящевение которого начинается на стадии 17/18. Это самый крупный элемент пояса на этой и последующих стадиях, состоящий всегда из более зрелого хряща, чем остальные элементы. Он направлен от acetabulum вперед и вверх, расширяясь на дистальном конце. Он протягивается на стадии 17 вверх только до уровня хвостовой артерии, а вперед — до второго крестцового позвонка. На стадии 18 ilium достигает впереди уровня первого крестцового позвонка и входит в краниальную часть крестцового окна (рис. 31, а). В конце этой стадии ilium уже доходит до нижнего края ганглиев, заметно расширяясь на своем дистальном краю. Определяются крыло и тело ilium, основные гребни и бугры (рис. 31, а). Расширенное ala ilii равно в длину двум первым крестцовым позвонкам и подходит к их диапофизам, тогда как цилиндрический corpus ilii расположен ниже — на уровне хвостовой артерии. Ilium на стадии 18 относительно короткий и не длиннее всего остального таза вместе с acetabulum, при этом его длина лишь немного превышает максимальную ширину ala ilii (рис. 32, а, в). На стадии 20 ilium составляет не менее трех пятых общей длины таза. На стадии 19 хрящ ilium гипертрофируется. Прежде всего гипертрофии подвергается центральная часть ala и дистальная часть corpus ilii. К стадии 21 длина ala ilii становится равной длине трех крестцовых позвонков, ilium вытягивается в длину в целом и становится длиннее остальной части таза, включая acetabulum. Последняя слегка смещается назад и находится на уровне третьего-четвертого крестцовых позвонков. На стадии 22 отогнутый от длинной оси тела эмбриона краниальный конец ilium достигает уровня последнего поясничного позвонка. Длина ilium теперь равна длине четырех-пяти позвонков. 5.4.3. Развитие хрящевых элементов нижней части таза Брюшная полость крысы с самых ранних из исследованных стадий очень объемна, и ее задняя стенка вертикальна или даже отклонена назад под тупым углом к позвоночнику. Брюшная полость сильно раздается также и латерально. Простран73 ство между задней стенкой брюшной полости и окончанием тела, в котором помещается зачаток таза, очень небольшое и всего лишь в несколько раз превосходит этот зачаток по объему. На стадии 18 задняя стенка брюшной полости еще сильнее отклонена назад (рис. 32, а–в). Ректальная часть полости при этом очень узка (рис. 32, г). Состоящие из молодого хряща pubis и ischium расходятся вниз и назад от acetabulum под сравнительно небольшим углом по бокам от узкой ректальной части брюшной полости. При этом pubis располагается почти параллельно задней стенке расширенной части брюшной полости. Хондрогенез в pubis начинается на стадии 17/18, а в ischium — на стадии 18. Pubis сравнительно узкий, ischium представляет собой широкую и тонкую пластину, выгнутую латерально (рис. 32, д ). В то же время pubis отклоняется сильно назад. Уже на стадии 18 pubis и ischium встречаются друг с другом дистальными мезенхимными концами на уровне нижнего края ректальной части брюшной полости, контралатеральные половины таза достигают места будущего симфиза только на стадии 19. Бóльший вклад в симфиз вносит pubis. 5.4.4. Окостенение крестца и таза Невральные дуги покрываются костной манжеткой и, в отличие от тел, почти сразу же замещаются эндохондральной костью на стадии 22. К моменту рождения эндохондральное окостенение обнаруживается и в телах позвонков, а крестцовые диапофизы остаются в основном хрящевыми и после рождения (рис. 34, а). Костная манжетка появляется на ilium в виде узкого пояска в основании ala ilii на стадии 19 и рапространяется на все крыло на стадии 20/21. Тонкая костная пластинка быстро распространяется в обе стороны по хрящу, включая уровень контакта ilium с крестцовыми диапофизами и основание ilium, так что на стадии 22 окостенение здесь самое обширное из всех трех тазовых центров. На ischium костная манжетка появляется не ранее стадии 21 — небольшой участок в кранио-дорсальной его части, ближе к acetabulum. На стадии 22 в ischium обширный центр эндохондрального окостенения образуется примерно на середине пути между проксимальным и дистальным его концами. Дистальный седалищный бугор и район симфиза состоит из молодого хряща. Pubis на стадии 21 еще хрящевой, тогда как кость наблюдается в виде узкого пояса между acetabulum и лонным бугром лишь на стадии 22/23. У новорожденных центры окостенения тел и дуг позвонков (в том числе контралатеральные), а также все три тазовых окостенения самостоятельны (рис. 34, а, б ). Появляется окостенение os penis. Крестцовые диапофизы и acetabulum, включая район будущей os acetabularis остаются хрящевыми. 5.5. СРАВНИТЕЛЬНЫЙ ОЧЕРК ХОНДРО- И ОСТЕОГЕНЕЗА 5.5.1. Скорость и порядок хряще- и костеобразования Виды настоящих ящериц различаются по скорости развития посткраниального скелета. У Z. vivipara и P. muralis по сравнению с L. agilis наблюдается небольшая задержка развития крестца и таза на 0.5–1 стадию, выражающаяся в более позднем 74 начале костеобразования и времени формирования симфизов. Единственный исследованный взрослый экземпляр D. saxicola по сравнению с остальными ящерицами оказался с очень хорошо развитыми дополнительными элементами в тазовом поясе — более длинные hypoischium и epiischium, а также epipubis, которые претерпели кальцификацию (ср. рис. 5, б и г). У взрослых особей L. viridis из дополнительных кальцинированных элементов описан только hypoischium (Raynaud et al., 1975), который закладывается в онтогенезе первым. Можно предположить, что степень развития окостенений и число кальцинированных хрящей к моменту вылупления зависит от продолжительности развития эмбриона. Действительно, эмбрион L. agilis развивается 40–50 дней (Rieppel, 1994), тогда как у Z. vivipara развитие длится около 70 дней, а P. muralis — 85–96 дней. D. saxicola имеет период эмбриогенеза равный 55–60 дням, а L. viridis — 90 дням (Saint-Girons, 1985). Таким образом, наблюдается отрицательная корреляция между продолжительностью развития эмбриона и процессом кальцинации и окостенения таза у Lacertidae. Чем меньше длится инкубация яиц, тем полнее развиваются окостенения крестца и таза и тем больше образуется дополнительных кальцинированных хрящей в нижней части таза. Похожую картину различий между видами можно наблюдать и у птиц. Выводковые птицы — курица и перепел — демонстрируют при вылуплении почти полное окостенение крестцово-тазового комплекса. При этом у перепела окостенение протекает несколько быстрее, чем у курицы. Эмбрион дрозда-рябинника — птенцовой птицы — напротив, перед вылуплением имеет слабо окостеневший скелет вообще, а в крестцово-тазовом комплексе нет даже следов оссификации. Продолжительность инкубации яиц курицы составляет 20–21 сутки, перепела — 14–15 суток; такая разница во времени инкубации связана с резким различием в размерах птиц этих двух видов. Вылупившийся цыпленок способен к самостоятельному передвижению, тогда как у дрозда-рябинника, инкубация яиц которого занимает 13–15 суток, птенцы до двух недель после вылупления остаются малоподвижными и неспособными к хождению. Таким образом, для полного окостенения скелета эмбриону, а в дальнейшем птенцу дрозда отведено гораздо больше времени — до 30 суток. Интересно, что именно окостенение тазового пояса иногда используется в качестве индикатора общей зрелости эмбриона. Так, на основании сравнения эмбрионов современных (птицы, крокодилы) и вымерших (динозавры) архозавров было установлено, что все динозавры из Ornithischia, Segnosauria и Theropoda, для которых известны сохранившиеся эмбрионы, имели хорошо окостеневший таз при вылуплении, а потому скорее всего являлись «выводковыми» (Geist and Jones, 1996). У чешуйчатых рептилий из скелетных элементов крестцово-тазового комплекса в первую очередь охрящевевают и окостеневают невральные дуги и тела позвонков, во вторую — ilium и pubis. Ischium и крестцовые ребра задерживаются в своем развитии, причем второе крестцовое ребро запаздывает по отношению к первому. Эта последовательность сохранялась у всех исследованных видов ящериц от ранних этапов хондрогенеза до окончания формирования эндохондральной кости. У крокодилов (Rieppel, 1993) и птиц последовательность охрящевения и окостенения элементов крестцово-тазового комплекса та же, что и у чешуйчатых рептилий. Последовательность дифференцировки элементов тазового пояса у перечисленных амниот, однако, не соответствует той последовательности, в которой эти элементы появляются в эволюции, начиная от амфибий и заканчивая птицами. У современных амфибий и стегоцефалов, в том числе и ранних Ichthyostegidae, окостенение 75 pubis чаще отсутствует, т. е. у них именно pubis, а не ischium отстает в развитии от остального таза. У млекопитающих хрящевые закладки элементов крестца и таза появляются в том же порядке, что и у других амниот (см. также: Кабак, 1978). Однако порядок окостенения таза иной: в отличие от других амниот, ischium окостеневает раньше pubis. Не исключено, что различия в порядке окостенения элементов таза есть различия между теропсидной и зауропсидной линиями эволюции амниот. Теропсиды унаследовали исходный порядок, который мы наблюдаем у амфибий, тогда как зауропсиды характеризуются изменением в порядке окостенения основных элементов таза. В последнюю очередь подвергаются кальцификации или окостенению различного рода дополнительные элементы таза. Еще в 1898 году Видерсхайм (Wiedersheim, 1898) запечатлел на рисунках разные варианты строения симфизов pubes и ischia амниот. Из рептилий у Z. vivipara он отметил хрящевой hypoischium, кальцинированный хрящ epipubis и не названный им хрящевой элемент впереди от симфиза ischia. Последний на рисунке Видерсхайма связан с epipubis фиброзным тяжом (fibröses Band). Эта структура еще в 1880 году была названа «epiischion» (Sabatier, 1880). Мной обнаружены все три дополнительных элемента тазового пояса у Lacertidae, хотя epiischium не упоминается в большинстве работ, описывающих строение таза у ящериц (Гуртовой и др., 1978; El-Toubi, 1938; Raynaud et al., 1975; Rieppel, 1992, 1994). У геккона Gonatodes название hypoischium употреблено не только к собственно hypoischium, но и к хрящу, являющемуся ростральным продолжением симфиза ischia (Wellborn, 1997). Такому употреблению названия hypoischium я не следую, так как epiischium и hypoischium возникают соотвественно впереди и позади симфиза седалищных костей как самостоятельные хрящевые элементы, отдельные от симфиза, в дальнейшем претерпевающие кальцификацию. Вместе с epipubis они развиваются в связи с продольной коллагеновой связкой (также отмечена Stephenson, 1960). Эта связка протягивается по брюшной стороне вдоль оси всего тела между покровами и стенкой полости тела, разделяя миомеры противоположных сторон (также у амфибий; см.: Анисимова, 1990) и являясь между тазовыми симфизами опорой для m. pubo-ischio-femoralis externus. У рептилий с редуцированными конечностями, а также у большинства птиц, тазовые симфизы не развиваются, и, соответственно, нет дополнительных образований в тазовом поясе, которые бы лежали на продольной оси тела эмбриона, на его брюшной стороне. У млекопитающих дополнительными образованиями могут считаться сумчатые кости, находимые впереди симфиза pubes, а также вертлужная кость. В обоих случаях, так же как и у рептилий, дополнительные элементы таза развиваются в онтогенезе млекопитающих в последнюю очередь (Low, 1929b; Harrison, 1961). Все дополнительные элементы тазового пояса (кроме вертлужной кости) развиваются сходно с грудиной тетрапод (Борхвардт, 1992). Их мезенхимные закладки обнаруживаются в углах между контралатеральными pubes и ischia (коракоидами в случае грудины), где накапливаются мезенхимные клетки. Действительно, и у хвостатых амфибий наличие ипсилоидного хряща стоит в зависимости от степени развития пластин pubes (Анисимова, 1990). Еще раньше также проводились попытки (Sabatier, 1880) сравнить грудину с ипсилоидным хрящом хвостатых («sternum abdominal») или с hypoischium ящериц («sternum pelvien»). Нет оснований не соглашаться с выводами предшествующих авторов (Борхвардт, 1992; Sabatier, 1880) о схо76 жести структуры и развития нижней части грудного и тазового поясов. Борхвардт (1992) указывал на то, что имеет место корреляция: грудина развивается лишь у животных, имеющих свободные от гипаксиальных мышц пространства на вентральной стороне тела, куда сверху могли проникать коракоиды и где могла скапливаться скелетогенная мезенхима, дающая начало грудине. Мне кажется более важным обратить внимание на то, что грудина, а также дополнительные элементы таза (cartilago ypsiloides, epipubis, epiischium, hypoischium и сумчатые кости) развиваются только при наличии симфизов контралатеральных элементов поясов (коракоидов в случае грудного, и pubes и ischii в случае тазового пояса). Просто наличия свободного пространства недостаточно для скопления мезенхимы — пространство должно быть разделено перегородками на компартменты, в углах которых и может концентрироваться скелетогенная мезенхима. Именно вентральные пластины скелетных элементов поясов конечностей обеспечивают подобное разделение пространства между покровами и полостью тела вместе с коллагеновым тяжом, идущим на брюшной стороне эмбриона по продольной оси тела. Аналогично высказывался и Борхвардт: «Только достигнув средней линии, коракоиды могут влиять на развитие грудины» (1992, с. 9). О замкнутых пространствах в качестве ловушек для мезенхимы писали Борхвардт и Коваленко (1985). 5.5.2. Проблема наличия крестцовых ребер у Lacertilia До сравнительно недавнего времени продолжались споры о том, все ли представители Lacertilia имеют крестцовые ребра. Начало этим спорам положил Муди (Moodie, 1907), который утверждал, что дефинитивные крестцовые поперечные отростки у современных ящериц есть истинные отростки, а не приросшие ребра. Муди не обнаружил отдельных центров окостенения, соответствующих крестцовым ребрам на сухих препаратах скелетов нескольких видов ящериц. Более того, по его наблюдениям, окостенение поперечных отростков происходит благодаря распространению на них костной манжетки с невральной дуги, и автор заключил, что «ящерицы занимают особое положение среди всех известных рептилий, поскольку у них вообще нет крестцовых ребер» (Moodie, 1907, p. 88). Эль-Тоуби (El-Toubi, 1947) нашел аномалию позвоночника у Agama stelio (Agamidae), которая, как он считал, свидетельствовала в пользу противоположного мнения. Последний предкрестцовый позвонок у этого вида ящериц имеет приросшие ребра, однако у найденой аномальной особи правое ребро имело обычное сочленение с поперечным отростком; одновременно первый правый поперечный крестцовый отросток был укорочен, и автор предположил, что у него как раз и отсутствует дистальная часть, соответствующая приросшему ребру последнего предкрестцового позвонка. Позже Камел (Kamel, 1951, 1952) обнаружил отдельные мезенхимные закладки первой пары крестцовых ребер у Chalcides (Scincidae). Эти ребра прикрепляются к дистальному концу крупного поперечного отростка первого крестцового позвонка и соединяют его с поперечным отростком второго крестцового позвонка. Последний, как полагал автор, — это не настоящий крестцовый позвонок, так как он не имеет собственного крестцового ребра, а «вторичный крестцовый» (secondary sacral) или первый хвостовой. Стоит поэтому более детально остановиться на этом вопросе, превлекая дополнительные онтогенетические данные. При гистологическом исследовании развития крестца у серий эмбрионов трех 77 видов настоящих ящериц я наблюдал наличие закладок крестцовых ребер, хотя и вблизи оснований невральных дуг, но четко от них отделенных, начиная с мезенхимного сгущения и позднее на хрящевых стадиях (рис. 17, г). Крестцовые ребра росли от позвонка в крестцовом окне. На более поздних стадиях хондрогенеза, когда ребра были уже достаточно крупными, дистальная мезенхима соединяла ребра друг с другом, распространяясь от дистального конца одного ребра до дистального конца другого в виде «мезенхимного мостика». Камел (Kamel, 1951, 1952) полагал, что это и есть крестцовое ребро. Вернер (Werner, 1971) называл это скопление хрящом и указывал, что это скопление не является ребром. Я согласен с мнением Вернера о том, что «поперечные отростки» крестцовых позвонков ящериц, о которых столько спорили, сами являются ребрами, однако дистальная группа клеток даже на фотографиях в статье этого автора не оставляет впечатления отдельного хрящевого элемента. Я бы охарактеризовал эту дистальную группу мезенхимных клеток, которые охрящевевают последними, как клетки, возможно, служащие для крестцового ребра «камбиальной» зоной. Как раз аппозиционный рост характерен для невральных дуг и их отростков (Wilting et al., 1994), и нет серьезных оснований думать, что крестцовые ребра растут иначе. В более современной литературе (Rieppel, 1992, 1993) факт наличия крестцовых ребер у ящериц опять был подвергнут сомнению на основании отсутствия самостоятельных центров перихондрального окостенения в крестцовых ребрах. В самом деле, перихондральное окостенение у ящериц часто выглядит объединенным с костной манжеткой соответствующей невральной дуги. Однако мне удалось наблюдать отдельные центры окостенений на гистологических срезах и ализариновых препаратах у L. agilis, по крайней мере у первой пары крестцовых ребер. Холдер (Holder, 1960) также наблюдала границы между перихондральной костью ребер и поперечных отростков у Nephrurus (Gekkonidae). Более того, у некоторых особей хорошо было видно, что эндохондральное окостенение начинается в крестцовых ребрах отдельными центрами примерно посередине длины ребра. Так как развитие крестцовых ребер у настоящих ящериц запаздывает по сравнению с другими скелетными элементами крестца и таза, можно предположить, что отдельные центры окостенения не всегда будут легко заметны, так как перихондральная кость с невральной дуги, которая окостеневает первой, может быстро захватывать и крестцовое ребро. Центры окостенений крестцовых ребер могут оказываться от нее в непосредственной близости, а две костные манжетки быстро сливаться между собой, а потому производить впечатление единой. В таком случае наличие или отсутствие отдельных центров окостенения зависит от размера крестцового ребра и скорости созревания хряща. Действительно, у миссисипского аллигатора, Alligator mississippiensis (Rieppel, 1993), так же как и крупных ящериц, таких как Uromastix (Agamidae) или Tropidurus (Iguanidae) (см: Kamel, 1952), отдельные центры окостенений обычно находят. К тому же я наблюдал отдельные центры окостенения на ализариновых препаратах именно на первой паре крестцовых ребер, которые крупнее. Иными словами, можно заключить, что мы имеем дело с модификацией развития ребер на заключительных этапах онтогенеза, которые при этом все же являются настоящими ребрами — отдельными от невральной дуги хрящевыми элементами, и обсуждение проблемы их наличия у ящериц можно закрыть. Стоит обратить внимание на то, что в ряде случаев у птиц удается наблюдать не две, как у большинства рептилий, а три пары крестцовых ребер, соответственно на позвонках a, b и c. У дрозда мне удалось наблюдать этот факт на гистологических 78 срезах, где были ясно различимы три пары хрящевых закладок ребер, а у курицы — на тотальных ализариновых препаратах поздних эмбрионов с самостоятельным центром окостенения крестцового ребра у позвонка c. Интересен тот факт, что первые позвонки «латинской» серии — это позвонки с самыми крупными поперечными отростками и ребрами в центре synsacrum. Поэтому неудивительно, что, как и в случае с чешуйчатыми рептилиями, очевидна зависимость развития отдельного центра окостенения от размера поперечного отростка (ребра). Именно от границы двух серий позвонков — «арабской» и «латинской» — начинается окостенение поперечных отростков и ребер, распространяющееся в краниальном и каудальном направлениях. Сами же размеры поперечных отростков и, в частности, парапофизов связаны с возможностью накопления скелетогенной мезенхимы вблизи тела позвонка. Если пространство достаточно велико, то здесь может образоваться и хрящевой зачаток, самостоятельный от тела позвонка, т. е. крестцовое ребро, что и наблюдается в действительности. 5.5.3. Контакты элементов крестцово-тазового комплекса Одним из результатов разновременности закладки элементов крестца и таза является разновременность формирования симфизов и других контактов между скелетными элементами. Например у ящериц, симфиз pubes формируется раньше симфиза ischia. Более важно то, что степень развития элементов к моменту их возможного контакта определяет его характер. Так, ilium на всех этапах своего развития более зрелый, чем крестцовые ребра (у ящериц) и крестцовые диапофизы (у млекопитающих). Дистальные концы последних двух структур всегда состоят из молодого хряща, тогда как ilium покрыт перихондрием или даже костной манжеткой и быстро претерпевает полное эндохондральное окостенение. Второе крестцовое ребро у рептилий и задние крестцовые диапофизы у млекопитающих не достигают ilium, будучи отделенными от него недифференцированными клетками. Ткани ilium и крестцового ребра в месте их контакта настолько различны по своим физическим свойствам, что эти скелетные элементы даже часто расслаиваются один вдоль другого на гистологических препаратах, и ни о каком плотном контакте, а тем более срастании говорить не приходиться. Этому также не способствует, возможно, и подвижность ilium относительно крестца. Запаздывание в развитии крестцовых ребер или диапофизов у рептилий и млекопитающих может быть связано с тем, что они формируются большей частью в области крестцового окна, развивающегося позже, когда уже идет охрящевение невральных дуг и тазового пояса. Напротив, у птиц мезенхима крестцового окна, вероятно, не участвует в формировании крестцовых поперечных отростков и ребер, они развиваются из материала склеротомов почти одновременно с невральными дугами и ilium. К моменту контакта ilium и крестцовых отростков степени зрелости этих элементов очень сходны, а ввиду протяженности сочленения крестца и таза вдоль продольной оси эмбриона его подвижность ограничена, что обеспечивает плотный контакт ilium и крестца с дальнейшим их срастанием в единый скелетный комплекс. Отмечу, что у птиц степень зрелости хряща соседних крестцовых ребер и диапофизов также мало различается, что способствует их срастанию. У многих аномальных или старых особей рептилий такие срастания соседних крестцовых ребер также не редки (Holder, 1960; Hoffstetter and Gasc, 1969). 79 Интересен и вопрос о слиянии крестцовых позвонков у млекопитающих и птиц. У крысы процесс слияния позвонков начинается со сближения хрящевых закладок тел, которые уже на стадии 21 выглядят укороченными по сравнению с телами предкрестцовых позвонков. В первую очередь происходит сближение и объединение хрящевых оснований невральных дуг. Вероятно, этому способствует не только замедление роста сегментов, но и то обстоятельство, что невральные дуги у крысы не разделены ганглиями, а обходят последние латерально, поэтому следующий этап слияния — это полное объединение невральных дуг и слияние дистальных концов крестцовых диапофизов, а затем — исчезновение границы между соседними хрящами невральных дуг и слияние латеральных частей тел позвонков. К концу стадии 22 nuclei pulposi межпозвонковых дисков между крестцовыми телами оказываются недоразвитыми, утолщенными и деформированными по сравнению с предкрестцовыми. Аналогичные наблюдения сделал Борхвардт (1985) у тушканчиков (Dipodidae): исследуя развитие их шейных позвонков, которые сливаются в единый блок, он обнаружил, что последовательность событий, приводящих к объединению хрящей, следующая. Вначале в шейном отделе тушканчиков тела позвонков укорочены и быстро сближаются в онтогенезе. Затем хрящевые невральные дуги и поперечные отростки, оказавшиеся сближенными, сливаются. Недоразвитие межпозвонковых дисков нарушает нормальное формирование эпифизов, что, по мнению Борхвардта, приводит к слиянию костных тел позвонков. Во всяком случае, слияние невральных дуг и поперечных отростков предшествует слиянию тел позвонков. Мои наблюдения процесса слияния крестцовых позвонков у крысы указывают как будто бы на универсальность описанного механизма слияния позвонков амниот. Они удачно дополняются данными о развитии сложного крестца птиц. Действительно, объединение соседних крестцовых невральных дуг или дистальных концов соседних поперечных отростков и ребер происходит между стадиями 37 и 39, тогда как слияние тел наблюдается на стадии 39 и позже. Объединению хрящей невральных дуг предшествует замедление роста позвонков и их сближение. Кажется вероятным, что замедление роста сегментов и сближение позвонков как у млекопитающих, так и у птиц может приводить к объединению на хрящевой стадии оснований невральных дуг, а также поперечных отростков (или ребер). Последнее обстоятельство может иметь следствием «заякоривание» позвонков один на другой, что будет препятствовать расхождению тел при дальнейшем их росте и в итоге приводить к полному объединению тел позвонков, которые вначале сливаются лишь своими латеральными краями. Интересно, что во всех описанных случаях слияния позвонков, оно происходит не в результате нарушения сегментации параксиальной мезодермы, а на более поздних этапах хондро- и остеогенеза. Это подкрепляется и фактом первоначально нормального развития зигапофизов. Кроме того, описаны аномалии позвоночника у человека, когда именно недоразвитие зигапофизов предполагалось основной причиной слияния грудных или шейных позвонков в блок (Chandraraj, 1987). В этих аномальных скелетах (описано два случая) объединение позвонков было неполным: тела, дуги и остистые отростки были слиты, тогда как поперечные отростки оставались свободными. В обоих случаях происходило недоразвитие межпозвоночных дисков и зигапофизарных сочленений. Автор этого исследования предположил, что именно недоразвитие суставных поверхностей и послужило причиной объединения остальных частей позвонка. Тем не менее приведенные факты не исключают той возможности, что именно замедление роста позвонков и их сближение в резуль80 тате недоразвития межпозвонковых дисков и привело к их слиянию, как описано выше. Интересен и филогенетический аспект объединения позвонков крестца в единый блок. У млекопитающих, обладающих блоком шейных позвонков, процесс протекает примерно так же, как слияние атланта и эпистрофея у крысы (Борхвардт, 1985). Борхвардт пишет: «Можно сказать, что, «формируя» у себя шейные блоки, тушканчики, китообразные и некоторые другие млекопитающие «развивают» далее состояние, возникшее у их предков на границе между телами атланта и эпистрофея (1985, с. 27). И по-видимому, вполне закономерно, что в филогенезе названных животных первыми сливаются обычно тела II и III позвонков, и этот процесс постепенно распространяется назад.» Точно также и в крестце млекопитающих и птиц мы находим определенные параллели между онто- и филогенезом. У млекопитающих первыми осуществляют слияние первый и второй крестцовые позвонки и этот процесс так же, как и в шейном отделе, распространяется назад. Это соответствует нашим представлениям о процессе включения более каудальных позвонков в крестец млекопитающих в филогенезе. Аналогично у птиц раньше всего происходит слияние позвонков «латинской» серии, т. е. тех, что лежат посередине synsacrum (примечательно, что отнюдь не «истинно-крестцовых»), а позже этот процесс распространяется вперед и назад вдоль позвоночника. Точно также и в филогенезе птиц и родственных им предковых форм среди Theropoda наблюдается постепенное вовлечение в крестец впереди и позади лежащих позвонков. 5.6. РОЛЬ ПОЛОСТИ ТЕЛА В РАЗВИТИИ И ЭВОЛЮЦИИ ФОРМЫ ТАЗА 5.6.1. Морфогенетическая роль полости тела В отличие от ilium закладка нижней части таза (ischium et pubis) протекает в существенно иных пространственных условиях, в частности, по отношению к растущей полости тела. У эмбрионов ящериц полость тела имеет сравнительно небольшой объем и слабо увеличивается в процессе развития. Ее задняя стенка пологая и плавно переходит в узкую часть перед клоакой. У птиц и млекопитающих объем полости тела даже у ранних эмбрионов существенно больший и впоследствии еще значительно увеличивается. У птиц задняя стенка полости тела почти вертикальна к моменту начала хондрогенеза pubis и ischium, а в дальнейшем ее объем продолжает увеличиваться. Нижний край ее задней стенки все больше отклоняется назад, так что в конце концов стенка смотрит косо вниз и назад, а не вперед, как у ящериц. У млекопитающих единая полость тела разделена на две полости — грудную и брюшную — диафрагмой, и брюшная полость, содержащая практически все внутренние органы, кроме сердца и легких, становится особенно вздутой. Не только ее задняя стенка уже у ранних эмбрионов практически вертикальна и даже смотрит слегка назад своим нижним краем, но и боковые стенки сильно раздвинуты в стороны, так что эмбрионы принимают характерный «пузатый» вид. У ящериц тазовый пояс закладывается в основании почек конечностей, латерально и немного ниже середины полости тела, позади ее сужения перед клоакой. Таким образом, вертлужные впадины оказываются широко расставленными. От acetabulum мезенхимный pubis растет вниз и вперед. На более поздних стадиях, 81 когда сформирован хрящ, pubis продолжает расти под полостью тела, не встречая на пути своего роста каких-либо препятствий. При этом он растет сбоку и снизу от полости тела и вдоль ее пологой задней стенки. Контралатеральные pubes достигают осевой линии тела и формируют симфиз, который оказывается в результате далеко выдвинутым вперед под полость тела. У птиц и млекопитающих картина развития нижней части таза и, в частности, pubis иная. Зачаток пояса и место будущего acetabulum располагаются довольно высоко и медиально, почти над полостью тела и позади ее задней стенки. У птиц pubis сначала направлен слегка вперед, но достигая задней стенки полости тела, задолго до времени формирования симфиза, растет далее вдоль нее и вместе со стенкой отклоняется назад, постепенно охрящевевая. Аналогичная картина и у млекопитающих, с той лишь разницей, что pubis у них расположен близко к задней стенке брюшной полости, а потому сразу растет вниз и назад без короткой фазы роста вперед. Отклонение роста pubis у птиц было описано давно как «разворот» лобковой кости в онтогенезе (Шмальгаузен, 1938), но никак не связывалось с положением и ростом полости тела на ранних стадиях эмбрионального развития. Здесь я развиваю гипотезу о морфогенетической роли полости тела и, в частности, ее задней стенки в становлении формы таза, предложенную ранее (Malashichev, 1999a, b). Известны четыре способа роста хрящевых элементов скелета (Борхвардт, 1991; Hinchliffe and Johnson, 1983): путем пролиферации хондробластов, секреции матрикса, гипертрофии хондроцитов и вовлечения новых клеток из окружающей ткани. Важно, что на ранних стадиях онтогенеза последний способ часто доминирует; тогда хрящевой элемент растет по мезенхимному скоплению, удлиняясь на своем «ведущем» конце. Брюшная полость эмбриона является тем образованием, которое хрящи обрастают, используя ее стенку, как направляющую для роста. В результате форма таза определяется относительным положением исходного зачатка, размерами и формой полости тела. Важное значение принимает в этом процессе положение задней стенки последней относительно мезенхимного, а впоследствии хрящевого pubis. Pubis направляется с боков и под брюшной полостью вдоль ее задней стенки, добавляя клетки на своем дистальном (ведущем) конце. Таким образом, направление роста pubis и дефинитивная форма таза действительно могут определяться размерами полости тела и положением ее задней стенки. У ящериц брюшная полость узкая с пологой задней стенкой, вертлужные впадины широко расставлены, контралатеральные pubes свободно обрастают ее снизу и сбоку, а таз в результате оказывается препубическим. У птиц относительные размеры полости тела очень велики, вертлужные впадины сильно смещены вверх и медиально. Pubes растут вокруг расширенной полости тела и вдоль отклоненной назад ее задней стенки, и таз оказывается опистопубическим, но, более того, лишенным симфизов контралатеральных элементов. Аналогичным образом и у млекопитающих pubis растет назад, повторяя форму брюшной полости. Иными словами, млекопитающие так же формируют опистопубический таз, как и птицы. Ранее разные авторы отмечали возможную морфогенетическую роль полости тела в формировании посткраниального скелета. Именно с развитием брюшной полости, ограниченной в пространстве десятью сегментами тела, Борхвардт (1982) связывал устройство панциря черепах. По его мнению, именно практически не сжимаемая полость тела давит на ребра и позвонки, смещая их вверх. У птиц аналогичное давление полости тела сказывается на положении тазовых почек, вдавленных между парапофизами крестцовых позвонков (см. гл. 4). Ахмедов и Саркисова (1987) 82 считали, что относительное удлинение пояснично-крестцового отдела у домашних коз, по сравнению с дикими, стало результатом удлинения кишечника, как толстого, так и тонкого, на 10–13 метров в связи с одомашниванием, т. е. в филогенезе (авторы не обсуждали онтогенез). У личинок Anura, которые чаще бывают растительноядными, имеется огромный кишечник и, соответственно, обширная брюшная полость, с наличием которой некоторые авторы связывают развитие длинных гипохордального элемента уростиля и ilia (Коваленко и Анисимова, 1987). Cледует, однако, иметь в виду, что у бесхвостых амфибий с прямым развитием (Eleutherodactylus), стадия личинки, а следовательно, и стадия обширной брюшной полости отсутствует, а кишечник развивается короткий и прямой сразу (см. например: Callery and Elinson, 2000). Вместе с тем, такие виды обладают типичным устройством крестцово-тазового комплекса, а потому заслуживают дополнительного исследования. Последний пример, в частности, указывает на то, что наличие определенной корреляции между размерами полости тела и положением ее стенок относительно хрящевых зачатков, с одной стороны, и дефинитивной формой таза — с другой, вовсе не обязательно говорит о существовании прямой морфогенетической связи между двумя обсуждаемыми явлениями. Действительно, форма таза и форма полости тела могут определяться более глубокими универсальными причинами. Это обстоятельство заслуживает особого внимания в связи со способностью скелетных элементов к самодифференцировке. Одним из возможных вариантов проверки существования морфогенетической связи между полостью тела и формой таза могло бы служить наблюдение развития таза в отсутствие полости тела как таковой, т. е. выращивание зачатков конечности и области тазового пояса, например, курицы в отрыве от естественного окружения, на хориоаллантоисной мембране другого эмбриона или in vitro. При наличии постулированной связи такие трансплантаты не должны давать нормально развитого таза, при ee отсутствии таз должен развивать свою естественную форму с характерным расположением pubis и ischium относительно друг друга. Подобные исследования предпринимались ранее. Брадли (Bradley, 1970) исследовала самодифференцировку почек задних конечностей эмбриона курицы, высаженных на стадии 20 на хориоаллантоис другого эмбриона. Из 55 успешных трансплантаций только у четырех все части скелета тазового пояса и свободной конечности присутствовали. Еще 14 трансплантатов имели неполный скелет со слабо идентифицируемыми частями. В большинстве же случаев скелет был представлен уродливыми и нераспознаваемыми, чаще округлыми хрящами. Во всех случаях тазовый пояс был аномальным, три его элемента варьировали независимо один относительно другого по форме и наличию, причем пояс мог быть развит относительно хорошо при отсутствии дифференцировки дистальных отделов конечности и наоборот. Рисунок 8, приведенный в этой статье (Bradley, 1970), демонстрирует по крайней мере один вариант строения, когда тазовый пояс выглядит почти как нормальный, хотя точная идентификация элементов таза по рисунку по-прежнему затруднительна. Данная работа указывает на принципиальную возможность самодифференцировки многих частей скелета в хориоаллантоисных трансплантатах. Нормальное развитие скелета свободной конечности в трансплантатах менее примечательно, так как хрящи по сути дела развиваются практически в том же физическом окружении, как и в почках конечностей в их естественном положении (за исключением отсутствия иннервации и нехарактерного кровоснабжения). Тазовый пояс оказывается в существенно иных условиях, и эти условия не позволяют в подавляющем большинстве случаев развиваться тазу нормально. Однако наличие хоть и единичных 83 вариантов строения, напоминающих норму, а также некоторые особенности трансплантации (при ампутации почка конечности могла быть вырезана не полностью, без некоторых частей таза) вносят определенное сомнение в существование прямой морфогенетической связи между формой полости тела и формой таза. Тем не менее для окончательного вывода необходимы дополнительные эксперименты, в которых была бы проведена трансплантация не только почки конечности, но и ближайшей мезодермы боковой пластинки, причем не на хориоаллантоис, а в более контролируемые условия, какие имеются, например, в культуре органов in vitro. 5.6.2. Разнообразие формы таза и полость тела у ископаемых амниот Несмотря на определенную дискуссионность вопроса о морфогенетическом влиянии полости тела на развивающийся таз, необходимо отметить существование выраженной положительной корреляции между формой полости тела и формой таза. Знание факторов, влияющих на объем полости тела и положение ее задней стенки, может помочь использовать онтогенетические данные для предсказания относительных размеров полости тела, исходя из формы таза ископаемых животных, и наоборот. Интересно рассмотреть вопрос о том, почему объем полости тела может быть относительно небольшим у одних животных и значительным у других. Существует, по крайней мере два объяснения увеличения относительного объема полости тела — за счет значительного увеличения объема внутренних органов, например кишки и ее производных, что часто связано с растительноядностью, либо за счет укорочения туловища. Среди вымерших животных возможности приложения гипотезы о роли полости тела в развитии формы таза предоставляют рептилии, в особенности динозавры, характеризующиеся большим разнообразием строения таза. Птицетазовые динозавры все развивались в направлении растительноядности и некоторые — двуногости. Поэтому опистопубическое строение их таза не удивительно, так как полностью отвечает предположениям о связи с большой полостью тела из-за возможного сильного развития кишечника. Положение вертлужной впадины, близкое к оси тела, также способствует развитию опистопубии, так как pubis не может в таком случае легко обрасти стенку полости тела сбоку. Однако ранее в литературе большая полость тела и растительноядность рассматривались как следствие опистопубии, а не как ее причина. Часто опистопубию птицетазовых динозавров считали функцией от изменения мест крепления мышц и перехода ряда мышц от аддукции к ретракции бедра. Например, существует мнение о том, что основную роль в повороте pubis сыграла дорсальная миграция места крепления m. pubo-ischiofemoralis internus с pubis на ilium, что «ослабило» pubis и позволило ему разворачиваться у Ornithischia (Walker, 1979). Однако такое объяснение имеет ряд возражений. Во-первых, у птиц на pubis крепятся мышцы брюшного пресса (Дзержинский, 1998), что вряд ли его «ослабляет». Во-вторых, дорсальная миграция m. pubo-ischiofemoralis internus имела место и у крокодилов (Walker, 1979), хотя ни у современных, ни у вымерших представителей этой группы мы не наблюдаем опистопубического таза. Поэтому я склоняюсь к иному объяснению опистопубии: первостепенное значение имело увеличение полости тела, а изменение крепления мышц — явление вторичное, а возможно, и не связанное с обращением pubis назад от вертлужной впадины. Особо следует остановиться на крупных четырехногих зауроподах, которые вели 84 растительноядный образ жизни, но часто обладали препубическим тазом. Возможно, что в их случае решающую роль сыграло латеральное положение вертлужной впадины, так что зачатки pubes без труда обрастали полость тела сбоков и формировали препубический таз. Наоборот, как среди Saurischia, так и среди Ornitischia, именно у форм с узкопоставленными вертлужными впадинами мы прежде всего и находим наиболее сильные смещения лобковых костей назад (ярко выраженная опистопубия). У ряда бипедальных птицетазовых динозавров наблюдается разрастание предлобкового отростка в широкое и длинное образование, направленное латерально и вперед. Praepubis орнитисхий располагался не только спереди, но и латеральнее acetabulum, был уплощен медио-латерально и, по всей видимости, обрастал крупную брюшную полость сбоку, тогда как pubis, расположенный более медиально, не имел такой возможности и параллельно с ростом полости тела отклонялся назад вдоль ее задней стенки. Можно предположить, что более широко расставленные вертлужные впадины позволяли расти переднему отростку pubis сбоку даже от широкой полости тела, в то время как основной элемент рос исключительно назад, так как только такое направление для роста предоставляла ему относительно объемная полость тела со своей вертикальной или даже направленной назад задней стенкой. Среди ящеротазовых тероподы — двуногие хищники, поэтому в рамках моей гипотезы о влиянии полости тела на развитие формы таза не удивительна их препубия. Долгое время считалось, что у хищных двуногих динозавров, таких как Tyranosaurus, кишечник и другие внутренние органы занимали большой объем и проникали в пространство между симфизами pubes и ischia. Однако, согласно моему предположению, обладатели препубического таза должны обладать относительно необъемной полостью тела. Составленная мною реконструкция положения брюшной полости у ящеротазовых и птицетазовых динозавров (рис. 34) по крайней мере частично подтверждена недавними палеонтологическими находками. Найден отпечаток некрупного хищного целурозавра с отлично сохранившимися мягкими тканями (Dal Sasso and Signore, 1998). У этого динозавра с препубическим тазом, кишечник был действительно сравнительно небольшим и располагался в положении гораздо более краниальном, чем обычно полагали, на отпечатке не достигая сзади pubes и их симфиза, что абсолютно согласуется с предсказаниями гипотезы для хищных ящеротазовых динозавров. С мелкими бегающими хищными Theropoda связаны в своей ранней эволюции птицы. Уже среди мелких беззубых Ornithomimidae с препубическим тазом есть указания на растительноядность по находкам гастролитов внутри хорошо сохранившихся скелетов (Kobayashi et al., 1999). Использование гастролитов, однако, не обязательно предполагает сильное увеличение объема внутренних органов и полости тела. Поэтому факторами, способствующими дальнейшей эволюции опистопубической формы таза у Theropoda, могли быть высоко поднятые и узко расставленные вертлужные впадины, а также тенденция к слиянию позвонков и объединению их в synsacrum, что приводило к фактическому укорочению туловища, а следовательно, и к относительному увеличению объема полости тела. Существует мнение (Дзержинский, 1998), что опистопубия птиц в своем происхождении связана с развитием мощной грудины и брюшного пресса, для которых освобождается место при опистопубической форме таза. Однако в онтогенезе мышцы брюшного пресса еще только формируются, когда pubis уже отклоняется назад от вертлужной впадины. В это время большой относительный объем имеет сама полость тела, скорее всего, по причине консолидированности позвоночника и небольшого числа туловищных сегмен85 тов. Развитие мощной грудины и брюшного пресса могло дополнительно влиять на отклонение pubes все дальше назад. Предположение о роли брюшной полости в формировании дефинитивной формы таза не может обойтись без расмотрения примеров, которые вступают в видимое противоречие с ним. Прежде всего речь идет о черепахах. Действительно, у всех черепах сильно укорочен туловищный отдел, не превышающий десяти сегментов, а потому они обладают относительно объемной полостью тела. Между тем, их тазовый пояс очень напоминает таз ящериц, т. е. он препубический. Это кажущееся противоречие легко снимается, если учесть наличие панциря, а особенно пластрона, который ограничивает разрастание брюшной полости и отклонение pubis далеко вниз и назад: часто pubes сильно отклонены вниз, либо прирастают к пластрону у сухопутных черепах. Если пластрон подвижен относительно карапакса (у морских черепах), то полость тела имеет возможность свободно увеличиваться в размере, так что ее задняя стенка, по-видимому, отклоняется очень рано назад. В результате pubes оказываются уже направлены не вперед, а вниз или даже назад, как у морской черепахи Eretmochelys imbricata (собственные наблюдения). Таким образом, относительно объемная полость тела у черепах также оказывает определенное влияние на форму таза и отношения его с пластроном. У млекопитающих и их синапсидных предков немаловажную роль в отклонении назад задней стенки брюшной полости и становлении опистопубии, вероятно, играло возникновение диафрагмы. У современных млекопитающих диафрагма разделяет полость тела на две неравные части. В грудной клетке остаются свободно лежащие легкие и сердечная сумка, в то время как все остальные органы плотно упакованы в брюшной полости. Интересно, что и при длинном туловище у млекопитающих грудная полость занимает значительный объем, так что на брюшную полость остается сравнительно немного места. Все это приводит к тому, что на ранних этапах развития брюшная полость млекопитающих оказывается для тазового пояса весьма важным фактором морфогенеза. Ее задняя стенка перпендикулярна длинной оси тела, а с ростом эмбриона ее нижний край отклоняется все больше назад. Прямым следствием этого является отклонение pubis назад и быстрое соединение с ischium еще до формирования симфиза с его контралатеральной половиной. Появление в теропсидной линии эволюции диафрагмы связывают с наличием поясничного отдела позвоночника, когда грудные позвонки, несущие ребра, формируют грудную клетку впереди от диафрагмы, а поясничные позвонки, их лишенные, лежат напротив брюшной полости (Татаринов, 1976). Палеонтологические данные свидетельствуют и о корреляции подобных изменений с развитием таза. Так, у пеликозавров, как правило, нет выраженного поясничного отдела позвоночника, а нижняя часть таза представлена широкими пластинами pubis и ischium, демонстрируя состояние типичное для многих древних амфибий и рептилий. При этом лобковая кость всегда направлена вперед. Появление таза маммального типа с направленной назад лобковой костью наблюдается в нескольких линиях позднепермских и юрских териодонтов, а также некоторых позднепермских пеликозавров, что коррелирует также и с появлением поясничного отдела позвоночника. Глава 6. ЭКСПЕРИМЕНТАЛЬНЫЙ АНАЛИЗ РАЗВИТИЯ КРЕСТЦА И ТАЗА ПТИЦ 6.1. ЗАКОНОМЕРНОСТИ РАЗВИТИЯ КРЕСТЦА И ТАЗА 6.1.1. Таз и свободная конечность в моделе «зоны прогресса» Парные конечности тетрапод начинают свое развитие в виде почек конечностей. Ведущую роль в процессе пролиферации и дифференцировки мезодермы почки конечности играет эктодерма, клетки которой продуцируют сигнальные факторы семейства факторов роста фибробластов (fibroblast growth factors — FGF) (Moon and Capecchi, 2000; Tickle and Munsterberg, 2001). Особенно сильным источником факторов роста являются клетки апикального эктодермального гребня (АЭГ). Удаление или врожденное отсутствие АЭГ приводит к остановке проксимо-дистального роста почки конечности и ее регрессии. Например, у A. fragilis, имеющей рудиментарные задние конечности и таз, почка задней конечности изначально формируется нормально и обладает АЭГ. Однако в дальнейшем наблюдается гибель клеток АЭГ и подлежащей мезенхимы, и развитие почки конечности останавливается, едва начавшись. В результате у безногих ящериц формируется рудиментарный таз и наиболее проксимальный элемент свободной конечности — femur. Искусственное приложение FGF-2 в естественных дозах к почке конечности задерживает дегенерацию и увеличивает рост почки конечности на 20–30% по сравнению с ростом в обычных условиях (Raynaud et al., 1995). Аналогичные результаты по воздействию FGF-2 на развитие почки задней конечности были получены и на питонах (Cohn and Tickle, 1999). Ранние исследования роли эктодермы в развитии почек конечностей, проведенные в основном на курице, позволили предложить модель развития конечности (Summerbell, 1974; Summerbell and Lewis, 1975), объясняющую влияние эктодермы на последовательную дифференцировку элементов свободной конечности в проксимо-дистальном направлении и господствующую в течение последних десятилетий. Суть этой модели заключается в следующем. Мезенхимные клетки почки конечности активно пролиферируют под влиянием АЭГ и на расстоянии примерно 200 µm от него. Эта узкая зона была названа «зоной прогресса». По мере роста почки конечности АЭГ и, соответственно, зона прогресса смещаются дистально, а мезенхимные клетки выходят из зоны влияния FGF, прекращают деления и приступают к дифференцировке. Таким образом, первыми дифференцируются клетки, расположенные более проксимально — они-то и слагают наиболее проксимальные элементы скелета будущей конечности. При удалении АЭГ конечность недоразвивается в тем большей степени, чем раньше была произведена операция. Важно отметить, что исследования роли эктодермы ограничивались сравнительно поздними стадиями, когда наиболее проксимальные части конечности уже начали свою дифференцировку. В задних конечностях — это проксимальная часть femur и 87 таз (Rowe and Fallon, 1982), который традиционно относят к полю конечности, как происходящий из мезодермы боковой пластинки. В цитируемой работе самое раннее удаление АЭГ у эмбриона курицы производили на стадии 17, и как развивался бы таз при более раннем удалении эктодермы — неизвестно. Пример безногих ящериц, у которых происходит ранняя редукция АЭГ, показывает, что даже раннего влияния эктодермы оказывается достаточно, чтобы проксимальные элементы образовались. Более того, у безногих мутантов курицы, limbless, не формируется АЭГ, тем не менее таз оказывается нормально развитым и имеет нормальное сочленение с крестцовыми позвонками (Prahlad et al., 1979). Один общеизвестный факт явно говорит не в пользу того, что развитие поясов конечностей и, в частности, таза подчиняется описанной модели, — хрящевые элементы пояса, располагаясь наиболее проксимально в системе таз–конечность, начинают свою дифференцировку не первыми, а одновременно с самыми дистальными элементами — аутоподием. Так относится ли таз к полю конечности и подчиняется ли описанной модели или он имеет самостоятельную программу развития? Детально этот вопрос никем не изучался. Активным агентом зоны поляризующей активности (ЗПА), расположенной у проксимально-постаксиального края конечности является ген Sonic hedgehog (Shh). Его экспрессия важна для поддержания преаксиально-постаксиальной полярности развивающейся конечности, а также для нормального формирования скелетных элементов, расположенных дистальнее коленного сустава. У limbless мутантов курицы и oligozeugodactyly (ozd ) мутантов мыши при отсутствии экспрессии Shh в конечности (Noramly et al., 1996; Ros et al., 2003) всегда развивается нормальный таз, и в последних двух случаях — также элементы стилоподия и в меньшей степени — преаксиальные элементы более дистальных частей конечности. Таким образом, ни один из известных центров морфогенетической активности (АЭГ и ЗПА), по-видимому, не оказывает влияния на развитие таза, по крайней мере, у амниот. Некоторые авторы (Ros et al., 2003) выделяют три зоны в системе таз– конечность, ответственность за развитие которых лежит на разных морфогенетических механизмах. По их мнению, Shh-зависимыми являются у мыши постаксиальный элемент зейгоподия (fibula), и большая часть аутоподия, в основном постаксиального (fibulare, метатарзалии и фаланги второго-четвертого пальцев). Независимыми элементами, развивающимися лишь под влиянием АЭГ, являются преаксиальные tibia, tibiale, метатарзалии и фаланги первого пальца, тогда как развитие тазового пояса под влиянием АЭГ или ЗПА авторами не комментируется, и он остается указанным лишь на приводимой ими схеме. Таким образом, можно сделать заключение если не о независимости развития таза от морфогенетических влияний АЭГ и ЗПА, то, по крайней мере, о слабой изученности этого вопроса. 6.1.2. Происхождение мускулатуры и скелета конечностей и их поясов в онтогенезе Еще в XIX веке сравнительные анатомы обратили внимание на то, что сомиты позвоночных животных своими вентральными концами растут вниз вдоль стенки тела, а также продолжаются в почки парных конечностей (см обзор: Galis, 2001). Впервые врастание мускульных почек в почку конечности заметил Антон Дорн у акул, и с тех пор накапливались свидетельства о том, что подобное явление характерно и для других рыб, а с некоторыми модификациями — и для наземных позвоночных 88 (Северцов, 1950). Однако вскоре обнаружились, по крайней мере, два способа проникновения производных сомитов в почку конечности. Так, у двоякодышащих рыб и амфибий не мускульные почки врастают в почку конечности, но отдельные клетки покидают дермамиотомы. У высших позвоночных — птиц и млекопитающих — ясно выраженных продолжений гипаксиальных частей дермамиотомов прямо в почку также не обнаружено. Клетки выселяются одиночно или группами из вентральных их концов и мигрируют активно (Jacob et al., 1978; Galis, 2001). Не так давно (Neyt et al., 2000) явление активной миграции клеток сомитов в почки конечностей обнаружено и у некоторых высших костистых рыб. Эти факты даже послужили основанием для вывода о том, что способ выселения клеток, свойственный костистым рыбам и наземным позвоночным, возник в эволюции до радиации саркоптеригий и тетрапод (Haines and Currie, 2001). Проблематичность такого заключения в том, что у всех изученных на данный момент рептилий наблюдается «классический» «акулий» тип врастания вентральных концов дермамиотомов в почки конечностей (Rahmani, 1974; Raynaud, 1985; Galis, 2001). При этом растущие вентральные концы дермамиотомов только в почке конечности деэпителизуются. У амфибий своеобразие механизма заключается еще и в том, что у них имеются в течение длительного времени функционирующие личиночные миомеры, т.е. миграция клеток осуществляется не напрямую из дермамиотомов. Долгое время продолжались споры относительно того, какие именно структуры в парных конечностях и на боку тела образуются благодаря вкладу сомитов, а какие — происходят из материала боковой пластинки. Пищей для размышления служили прямые наблюдения на гистологических срезах, а также в ряде случаев — эксперименты с маркированием клеточных пластов частицами угля или графита (критику метода см., например, Christ et al., 1977). Не вдаваясь в подробности этой дискуссии, отмечу, что в настоящее время вопрос о происхождении всех частей свободной конечности, а также элементов стенки тела практически решен, не считая отдельных моментов, которые имеют для настоящей работы важное значение. Начало изучению проблемы положили работы Лё Дуарэн (Le Douarin, 1969, 1973a), разработавшей методику витального маркирования тканей у эмбрионов птиц. Методика была основана на том факте, что клетки домашней курицы и японского перепела окрашиваются различно при обработке по Фёльгену (Le Douarin, 1973b) — в ядрах клеток перепела данная окраска выявляет крупные глыбки гетерохроматина, ассоциированные с ядрышком. Подобных структур нет в ядрах клеток домашней курицы, а потому они выглядят на срезах гораздо менее яркими. Такое существенное различие в окраске тканей двух видов птиц, их относительно близкое систематическое положение и сходное строение позволили использовать эти виды для создания межвидовых химер. Маркированные чужеродными клетками, но нормально развивающиеся структуры будут легко выявлены на гистологических срезах. Пересадки можно осуществлять в обе стороны, причем с несколько различным результатом (Chevallier et al., 1977), но чаще пересаживают ткани от перепела к курице. В последние годы для более точного выявления перепелиных клеток в куриных эмбрионах наряду с окраской по Фёльгену используют окраску антителами, связывающимися со специфическими маркёрами клеточных мембран перепела (Huang et al., 1997). Исследования с применением этой методики привели к следующим результатам. Было установлено, что в эмбриогенезе птиц клетки дермамиотомов выселяются в почку конечности и дифференцируются в мышцы (Chevallier et al., 1977; Christ 89 et al., 1977; Jacob et al., 1978). Начало этому процессу, по-видимому, дает контакт мезодермы боковой пластинки, презумптивной мезенхимы почек конечностей, с вентральными концами дермамиотомов и стимуляция клеток к выселению посредством неустановленных пока факторов (Hayashi and Ozawa, 1995). Миогенные клетки детерминируются раньше скелетогенных (Wachtler et al., 1982) и мигрируют одиночно и группами в образующуюся почку конечности вдоль коллагеновых волокон (Jacob et al., 1978). Эти клетки способны к активной миграции, тогда как клетки, впоследствии дающие хрящ скелетных элементов пояса и свободной конечности, образуют хрящ in situ, не демонстрируя никаких признаков миграционного состояния (Wachtler et al., 1982). До попадания на место окончательной дислокации миогенные клетки, однако, не экспрессируют маркёров мышечной дифференцировки и не имеют каких-либо характерных структур, которые бы позволили идентифицировать их как миобласты (Jacob et al., 1978). Важно, что производными этой группы клеток являются только мышцы, хотя эндотелий кровеносных сосудов свободной конечности и пояса также происходит из сомитов. Вся же соединительная ткань конечности, включая сухожилия и ткань, окружающую отдельные мышечные волокна (epimysium), а также скелетные элементы свободной конечности, происходят из мезодермы боковой пластинки (Chevallier et al., 1977; Christ et al., 1977). Аналогичная ситуация имеет место и на боку эмбриона между почками передних и задних конечностей (Christ et al., 1983), — там дермамиотомы дают все мышцы, а соединительная и скелетная ткани слагаются клетками внесомитного происхождения. Так как традиционно пояс конечности относили к полю почки конечности, то отсюда следовало, что все скелетные элементы грудного и тазового поясов должны происходить из мезодермы боковой пластинки. Тем неожиданней наблюдения Кини с соавторами (Kieny et al., 1972). Эти исследователи проводили на куриных эмбрионах эксперименты по удалению параксиальной мезодермы, как сегментированной, так и несегментированной, а также по замене параксиальной мезодермы мезодермой с других кранио-каудальных уровней или тканью внесомитного происхождения (участки кишки, нервной трубки или соматоплевры). Их эксперименты, продемонстрировавшие раннюю регионализацию соматической (параксиальной) мезодермы (развитие ребер в шейных сегментах после трансплантации параксиальной мезодермы из грудного отдела в шейный и неразвитие ребер при обратной операции), стали классическими (Gilbert, 2000). При этом побочным результатом последнего эксперимента стало то, что вместе с недоразвитием ребер наблюдалось также почти полное отсутствие лопатки, scapula. Более того, при замене параксиальной мезодермы на уровне грудных сегментов тканью из внесомитного источника также недоразвивались или полностью отсутствовали ребра и лопатка. В тех случаях, когда операции затрагивали 26-й и более каудальные сегменты, аналогичные изменения происходили и в тазовом поясе. Действительно, на приводимых фотографиях хорошо видно отсутcтвие краниальной части ilium, в других же случаях авторы прямо указывают на его полное недоразвитие или истончение в зависимости от типа эксперимента, тогда как остальные элементы тазового пояса были слабо затронуты операцией. На тот момент сомитное или соматоплевральное происхождение scapula и ilium не были точно известны, правда вопрос о происхождении мезодермального материала авторы (Kieny et al., 1972) ставили только по отношению к лопатке, так как большая часть их экспериментов затрагивала шейные и грудные сегменты. Проведя подробные эксперименты по трансплантации между перепелом и курицей участков 90 соматоплевры и осевой мезодермы, Шевалье (Chevallier, 1977) пришел к выводу о том, что лопатка является производным сомитов. Его исследование, хотя и в меньшей степени, но касалось и тазового пояса. Оказалось, однако, что весь тазовый пояс содержал только куриные клетки при трансплантации осевой мезодермы на уровне будущих 24–32-го сегментов и только перепелиные — при трансплантации соматоплевры соответствующего уровня. Не вдаваясь в более детальные подробности проведенных экспериментов, здесь стоит отметить, что тазовому поясу в обеих работах уделялось меньшее внимание: отводилось меньшее число экспериментов и операций с привлечением поясничных и крестцовых сегментов, ставилось меньшее число контролей, имелись и расхождения в методике исследования осевой мезодермы более краниальных и более каудальных уровней. Тем не менее стал очевиден тот факт, что по крайней мере у птиц scapula в отличие от остального пояса передних конечностей имеет сомитное, а не соматоплевральное происхождение. Этот факт подтвердили и более поздние исследования. Опираясь на данные Шевалье, Хуан с соавторами (Huang et al., 2000) в работе по трансплантации целых сомитов и их частей от перепела к курице ясно показал, что лопатка происходит из двух источников. Та ее часть, которая слагает гленоидную впадину, имеет, как и остальной пояс, соматоплевральное происхождение, тогда как «саблевидная» ее часть, тянущаяся от гленоидной впадины назад, происходит из сомитов. При этом последняя является производным дермамиотомов, т. е. тех частей сомитов, которые ранее были признаны источниками только мускулатуры как эпаксиальной, так и гипаксиальной. Это было первое свидетельство того, что дермамиотомы способны давать хрящ вместо мышц in vivo, что подразумевает дифференцировку клеток в несвойственном для них направлении или даже дедифференцировку с изменением их последующей судьбы. Кроме этого, было уточнено «мозаичное» происхождение лопатки — ее пластина состоит из последовательных участков, сложенных клетками, мигрировшими из дермамиотомов с 17-го по 24-й. Несколько работ по удалению сомитов заслуживают нашего дальнейшего внимания. Бурке (Burke, 1991a, b) обнаружила, что при удалении шейных сомитов у черепахи Chelydra serpentina лопатка недоразвивается. Аналогичные данные были получены в ходе экспериментов на курице, тогда как удаление сомитов у аксолотля не приводит к какому-либо заметному нарушению ее развития. Эти факты, а также сравнительно далекое родство между птицами и черепахами позволили автору заключить, что выводы Шевалье и других исследователей о сомитном происхождении scapula можно распространить по крайней мере на амниот. В то же время следует отметить, что никаких других исследований для выяснения мезодермальных источников ilium предпринято не было, и если сомитное происхождение лопатки не вызывает сомнения, то вопрос о происхождении ilium остается открытым. Интерес к этому вопросу становится особенно понятным при сравнении поясов передних и задних конечностей. Действительно, как scapula, так и ilium занимают наиболее проксимальное положение в поясе, причем на уровне гипаксиальной мускулатуры. Более того, ilium напрямую контактирует с осевым скелетом, развивающимся из склеротомов. 91 6.2. ЭКСПЕРИМЕНТЫ IN OVO НА КУРИНЫХ ЭМБРИОНАХ Для проверки гипотезы о влиянии почки задней конечности на формирование крестцового окна, тазового пояса и крестцовых ребер (или отростков) был проведен эксперимент по односторонней ампутации ранней почки конечности эмбриона курицы на стадии 17. Так как почка конечности обладает небольшой степенью регуляционной способности и может частично восстанавливаться, то производили также и более сложный эксперимент — удаление эктодермы боковой пластинки на уровне презумптивной почки конечности на стадии 16 и у более молодых эмбрионов вплоть до стадии 12, когда крестцово-тазовая область только начинает формироваться. Этот эксперимент также имел целью проверить, является ли тазовый пояс всего лишь проксимальной зоной «поля» конечности и подчиняется ли развитие его скелетных элементов общепринятой модели «зоны прогресса», применяемой к более дистальным отделам скелета свободной конечности. Три эксперимента — по одностороннему удалению крестцовых сомитов, по удалению боковой пластинки на уровне крестцовых сомитов и по трансплантации верхней части эпителизованных крестцовых сомитов (презумптивных дермамиотомов) от перепела к курице — были призваны определить степень участия мезодермы сомитов и боковой пластинки в формировании таза и, в частности, ilium. Предполагая частичное участие мезодермы сомитов в развитии восходящей части ilium, в первом из названных экспериментов я ожидал получить эффекты, аналогичные известным ранее из литературы (Kieny et al., 1972; Burke, 1991b), заключающиеся в недоразвитии alae ilii подвздошного элемента таза. При операции на боковой пластинке, напротив, ожидалось, что именно верхняя часть таза (наиболее дорсально расположенная часть ilium) разовьется несмотря на удаление мезодермы презумптивной конечности и основной части тазового пояса. В последнем эксперименте была произведена попытка подтвердить возможное происхождении части клеточного материала, идущего на строительство ilium, из дермамиотомов сомитов. 6.2.1. Влияние удаления почки задней конечности У эмбрионов курицы, подвергшихся одностороннему удалению почки задней конечности на стадиях 17–18, конечность, как правило, не развивается, тогда как на неоперированной стороне, служащей контролем, развитие конечности происходит нормально. Из успешно прооперированных эмбрионов (см. гл. 1) гистологически исследованы 16, находящихся на стадиях 29–32. Далее приводятся описания для оперированной стороны. Средние и дистальные элементы скелета свободной конечности — зейгоподий и аутоподий — всегда отсутствуют и, как правило, отсутствует femur. Если femur имеется (N=3), то она сильно редуцирована и не имеет нормальной связи с тазом. Acetabulum либо не выражена совсем, либо недоразвита (рис. 35, а, в, г, з). Все три хрящевых элемента таза, как правило, слиты и имеют ненормальную форму. В двух случаях отсутствует pubis. Изменено положение тазового пояса по отношению к позвоночнику. Acetabulum при наличии рудиментарного femur отодвинута от осевых органов латерально. Нарушено положение половины пояса на оперированной стороне и относительно брюшной полости, которая в большей степени выпячена вбок. Половина таза оказывается наклоненной к продольной оси эмбри92 она более полого, чем на контрольной стороне (рис. 35, д–з). Особенно хорошо это видно при рассмотрении положения ilium. Его крылья наклонены к осевым органам (сагиттальной плоскости) под бóльшим углом и не достигают уровня верхнего края спинного мозга. Ilium более узкий, чем в норме. Вперед от уровня acetabulum ala preacetabularis ilii распространяется слабо и не достигает последнего грудного ребра (рис. 35, а, в, д– з). Передний край крыла расположен на уровне позвонка β. Ala postacetabularis ilii чаще развито нормально (N=13) и своим задним краем достигает лимфатического сердца и последнего позвонка synsacrum, либо укорочено на длину одного позвонка (N=3). Обычно оно дальше отстоит от поперечных отростков или ребер synsacrum (рис. 35, г, з). Иными словами, задний край ilium не подходит так близко к продольной оси тела эмбриона, как на контрольной стороне. У двух эмбрионов недоразвиты парапофизы позвонков α и β. В остальном крестец нормальный. Интересно, что поперечные отростки и ребра позвонков a–d слиты своими дистальными краями, несмотря на то что сильно не достигают ilium, тогда как при нормальном развитии их слияние осуществляется только после достижения ими подвздошного элемента. У всех эмбрионов отсутствует мускулатура таза и свободной конечности, за исключением небольших ее порций спереди и сзади от acetabulum. Мышцы (m. iliotibialis et mm. iliotrochanterici I–III), которые в норме крепятся снаружи на преацетабулярной части ilium, у эмбрионов, у которых ilium уменьшен в размерах, занимают приблизительно его место (рис. 36, ж). Наиболее разнообразно операция сказывается на строении pubis: 1) он отсутствует целиком (N=2); 2) не развита только его проксимальная часть, тогда как дистальная, значительно удаленная от acetabulum, имеется и приросла к ischium (N=3); 3) pubis состоит из двух самостоятельных частей (N=2) — проксимальной, приросшей к ilium и дистальной, свободной, либо сросшейся с ischium по всей своей длине (рис. 35, в, г). Ни у одного эмбриона не встречена ситуация, когда отсутствует дистальная половина pubis при сохранении проксимальной. Дистальный фрагмент pubis при этом смещен дорсально относительно своего нормального положения. 6.2.2. Влияние удаления эктодермы боковой пластинки в районе презумптивной почки задней конечности Восемнадцать успешно прооперированных эмбрионов подвергли гистологическому исследованию. Приводятся описания крестца и таза для оперированной стороны. Во всех случаях отсутствуют все элементы свободной конечности, включая femur. При удалении эктодермы на стадиях 16–17 (ранняя почка задней конечности) строение тазового пояса сходно с таковым после одностороннего удаления почки конечности. При более ранних операциях уменьшается число хрящевых элементов таза и их размеры; развивающиеся элементы имеют неправильную форму. Их взаиморасположение в целом сохраняется, но при этом они могут быть заметно смещены латерально по сравнению с контрольной стороной (рис. 36, б, в, г). В ряду эмбрионов от прооперированных на стадиях 16 к прооперированным на стадии 12 первым исчезающим элементом, не находимым на гистологических срезах или тотальных препаратах в виде хряща, является pubis (табл. 2). У эмбрионов этого ряда всегда сохраняется дистальный участок ilium, по расположению соответ93 Таблица 2. Результаты удаления эктодермы боковой пластинки у эмбрионов курицы. Указано число эмбрионов, обладающих тем или иным набором элементов таза после операции на разных стадиях развития Стадия операции 12 13 14 15 16 Ilium, ischium, pubis 2 2 Ilium, ischium 1 3 1 2 Ilium 2 3 1 1 ствующий ala postacetabularis ilii (рис. 36, д, е). Ни один из эмбрионов, прооперированных на стадии 12, не демонстрировал полного отсутствия таза (рис. 36, ж). Напротив позвонков с β по f даже при отсутствии части таза формируется крестцовое окно. Интересно, что слияние дистальных концов ди- и парапофизов птиц не зависит от наличия или отсутствия контакта с подвздошным элементом таза. В экспериментах по удалению почки конечности или эктодермы боковой пластинки, когда таз оказывался недоразвитым и ilium был существенно меньшего размера, чем в норме, либо далеко не подходил к поперечным отросткам, последние сливались своими дистальными концами и формировали общий дистальный хрящ. 6.2.3. Влияние удаления боковой пластинки У шести успешно прооперированных эмбрионов, подвергнутых гистологическому исследованию, отсутствовала брюшная стенка на оперированной стороне на уровне от грудной клетки до отверстия клоаки, были видны внутренности, которые, однако, располагались компактно; полость тела, таким образом, открыта и немного, а иногда значительно асимметрична (рис. 37, а). В пяти из шести случаев таз хотя бы частично присутствует и хорошо прокрашивается альцианом, есть крестцовое окно. У двух эмбрионов, у которых замещения удаленной ткани боковой пластинки чужеродным материалом не производили, произошло частичное восстановление мезодермы (определено по развитию стенки полости тела). У таких эмбрионов частично развит ilium, а также имеются густые скопления мезенхимы или округлые хрящи в районе таза, которые нельзя с уверенностью отождествить с каким-либо из его элементов. У трех других эмбрионов, у которых при операции удаленная ткань была замещена чужеродным материалом, восстановления боковой пластинки и стенки тела не произошло, но образовался хорошо развитый, овальный в проекции хрящ, занимающий положение ilium (рис. 37, а), либо расположенный немного вентральнее обычного (рис. 37, б ), и который я тем не менее интерпретирую как ilium. Его ширина равна двум–трем позвонкам. Позвонки synsacrum во всех случаях развиты нормально. Таким образом, после удаления боковой пластинки на стадии ранней почки конечности в районе таза всегда развивается небольшой хрящ, который можно сопоставить по форме и расположению с рудиментарным ilium. 94 6.2.4. Влияние удаления серии крестцовых сомитов Ни у одного из пяти успешно прооперированных эмбрионов не обнаружено никаких аномалий в дистальных отделах конечности или нижней части таза. В случаях, когда произошло частичное восстановление ткани сомитов, наблюдались отклонения в строении осевого скелета и мускулатуры (рис. 38, а–г). Неправильно развивалась или не развивалась вовсе эпаксиальная мускулатура. Невральные дуги имели меньший диаметр и неправильную форму. Между невральными дугами, развившимися из подвергнутых операции сомитов, лишь частично формировались спинномозговые ганглии, которые оказывались вдвое-втрое меньшего размера, чем в норме. На трех–пяти невральных дугах развивались дополнительные поперечные отростки, опущенные по дуге очень низко по сравнению с диапофизами и занимающие, скорее, положение парапофизов, которые в норме не развиваются в этой «арабской» области synsacrum. Эти поперечные отростки сливались дистально друг с другом, как обычно сливаются поперечные отростки на позвонках «латинской» серии сложного крестца, и немного не достигали ilium. По крайней мере у трех исследованных эмбрионов были замечены аномалии ilium, которые выражались в прерывистости хряща в верхней его части. Наибольшие изъяны приходились на сегменты, где невральные дуги и ганглии были в бльшей степени повреждены, т. е. аномалии вдоль ilium располагались сегментарно. Однако у одного эмбриона, у которого повреждение сомитов достигло наибольшей степени, отсутствовали полностью две невральные дуги и практически отсутствовали пять спинномозговых ганглиев, а дополнительных поперечных отростков не формировалось, ilium тем не менее не имел периодически повторяющихся повреждений на своем дорсальном крае и близко прилежал к позвоночнику и спинному мозгу (рис. 38, д ). Хотя я не ставил такой задачи, данный эксперимент позволяет предположить, что наличие или отсутствие парапофизов на крестцовых позвонках птиц связано с бóльшим или меньшим развитием спинномозговых ганглиев. Действительно, как раз напротив позвонков «арабской» серии развиваются особенно крупные ганглии, связанные с нервами крестцового нервного сплетения, которые соприкасаются краями (у курицы) или даже объединяются без четко выраженной морфологической границы (у дрозда). При этом ниже уровня диапофизов, вблизи невральных дуг и тел позвонков не остается свободного пространства для сосредоточения скелетогенной мезенхимы, которая образует зачатки ребер и поперечных отростков много позднее формирования ганглиев. Гистологическое исследование эмбрионов курицы, перепела и дрозда, которые различаются числом позвонков «арабской» серии, показало, что число позвонков, лишенных парапофизов коррелирует с числом крупных ганглиев крестцового сплетения. Проведенный мною эксперимент по одностороннему удалению серии крестцовых сомитов у эмбрионов курицы также подтверждает высказанное предположение. В этом эксперименте удалению подверглись сомиты, дающие краниальные позвонки synsacrum, в том числе и позвонки «арабской» серии. При недоразвитии или полном отсутствии ганглиев на оперированной стороне эмбриона образовалось пространство, которое заняли клетки частично восстановившихся склеротомов. В некоторых сегментах они дали не только невральные дуги, но и дополнительные парапофизы, которые отсутствовали на контрольной стороне, где ганглии оставались крупными. 95 6.2.5. Результаты трансплантации верхней части крестцовых сомитов от японского перепела к домашней курице Успешно прооперированных эмбрионов оказалось девять, два из них участвовали в эксперименте на стадии 17/18 и семь — на стадии 18/19. У одного эмбриона первой группы на оперированной стороне ilium состоял из двух независимых частей — нижней, входящей в состав acetabulum, и верхней, соответствующей той части ilium контрольной стороны, которая осуществляет контакт с поперечными отростками позвонков. Нижний хрящ ilium на стороне операции и весь ilium контрольной стороны состояли только из клеток хозяина (курицы), тогда как верхний хрящ на оперированной стороне состоял только из клеток трансплантата (перепела) (рис. 40, а–г). Также перепелиного происхождения оказались эпаксиальная мускулатура на оперированной стороне и соединительная ткань, окружающая верхний «перепелиный» хрящ. Важно отметить, что ряд клеток перепела выявлен в составе хряща невральных дуг напротив места операции. Это может означать, что de facto была произведена пересадка как дермамиотома, так и части склеротома. У второго эмбриона, оперированного при тех же условиях, весь тазовый пояс состоял из клеток курицы. Ilium, однако, был уменьшен в размере и не достигал верхнего края спинного мозга, аналогично «куриному» ilium первого эмбриона (рис. 39, а, в) Место его верхней части занимала неупорядоченная мышечная ткань перепелиного происхождения. При операции на более поздней стадии, ни у одного эмбриона перепелиные клетки, выявляемые с помощью специфических антител, не были обнаружены в хряще таза. Они встречались лишь в мускулатуре, соединительной ткани и оболочках нервов (рис. 39, д–ж). Следует отметить, что бóльшая часть метки оказалась в эпаксиальной мускулатуре, тогда как мышцы дистальных отделов конечности, происходящие из гипаксиального домена дермамиотома, содержали лишь отдельные перепелиные клетки (рис. 40, ж). Это обстоятельство, а также то, что перепелиными оказались шванновские клетки оболочек нервных стволов, которые мигрируют из нервного гребня сравнительно поздно, после начала разворота эпителизованного сомита, означает, что в данном варианте эксперимента de facto была произведена пересадка не всего презумптивного дермамиотома, а в основном его эпаксиального домена. Суммируя результаты данного эксперимента, можно заключить, что при пересадке презумптивной эпаксиальной мускулатуры клетки донора не попадают в ilium, и таз развивается нормально. При пересадке презумптивной эпаксиальной и гипаксиальной мускулатуры, а также части склеротома клетки донора могут попадать в верхнюю, ближайшую к осевому скелету, часть подвздошного элемента таза. Таз хозяина, а именно ilium, развивается при этом неполно. 6.3. НЕЗАВИСИМОСТЬ И КООРДИНИРОВАННОСТЬ РАЗВИТИЯ КРЕСТЦА И ТАЗА АМНИОТ Еще более ста лет назад сравнительными анатомами была замечена корреляция между размером конечностей, устройством таза и наличием крестца в ряду чешуйчатых рептилий, демонстрирующем различную степень редукции конечностей (Sewertzoff, 1931). В настоящем разделе на основании проведенных экспериментов, 96 а также обширных данных сравнительной и экспериментальной эмбриологии, полученных другими авторами, рассматриваются морфогенетические связи между скелетом свободной конечности, тазом и крестцом. На основе проведенного анализа обсуждается вопрос, действительно ли крестец, таз и конечности образуют жестко связанную систему, или этот скелетный комплекс состоит из нескольких относительно независимо развивающихся частей. 6.3.1. Крестец, таз и свободная конечность развиваются независимо Удаление почки конечности или эктодермы боковой пластинки у эмбрионов кур в моих экспериментах не сказывалось на строении крестца и приводило лишь к сравнительно небольшим дефектам таза. Прежде всего это было недоразвитие femur и acetabulum. Скорее всего, такой эффект операции следует связывать с неразвитием capitulum femoris и отсутствием подвижности скелетных элементов из-за неразвития всей мускулатуры свободной конечности и части тазовой мускулатуры. Действительно, у Splotch мутантов, у которых мускулатура конечности вообще не формируется, acetabulum не выражено либо вследствие ограниченной подвижности скелетных элементов относительно друг друга, либо вследствие того, что мышцы уже не разграничивают их (Tremblay et al., 1998). Как правило, такие элементы скелета у Splotch мутантов слиты. Действительно, более ранние эксперименты на парализованных куриных эмбрионах показывают, что суставы не формируются при раннем и демонстрируют деградацию при позднем параличе (Mitrovic, 1982). Удаление capitulum femoris, всей свободной конечности или смещение головки бедренной кости из вертлужной впадины, даже при поздней операции на крысятах в возрасте от четырех до двадцати дней, приводили к дисплазии тазобедренного сустава (Harrison, 1961). Иными словами, недоразвитие acetabulum — это не прямое следствие влияния почки конечности в раннем онтогенезе, а результат отсутствия подвижности в суставе и/или прямого контакта capitulum femoris с дном acetabulum. Ту же этиологию, возможно, имеет и пологий наклон всего таза и, в частности, крыльев ilium на оперированной стороне при ампутации конечности или головки бедра у крысят (Harrison, 1961), а также почки конечности или эктодермы у куриных эмбрионов (настоящее исследование), так как отсутствие бедра и части мышц не создает, соответственно, бокового упора и натяжений для нормальной ориентации вертикальной пластины таза в районе acetabulum. Харрисон (Harrison, 1961) связывал с отсутствием головки femur и укорочение всей os innominatum у крысы из-за коллапса сустава. Сюда следует добавить и возможность замедления роста частей таза на оперированной стороне, например ala preacetabularis ilii у курицы, вызванные самим оперативным вмешательством. Частичные дефекты нижней части таза при удалении ранней почки конечности у цыпленка могут быть связаны и с прямым удалением части мезенхимы пояса вместе с почкой конечности, так же как и в экспериментах с удалением боковой пластинки (см. также дискуссию о культивировании почки конечности на хориоаллантоисе). Замечательны расхождения в результатах при удалении почки конечности в моих экспериментах и в экспериментах, проведенных ранее другим автором (Spurling, 1923). В работе последнего у исследованных эмбрионов после ампутации почки задней конечности большему повреждению подвергались ischium и постацетабулярная часть ilium, в меньшей степени — вертлужная впадина и pubis. Напротив, в моих экс97 периментах наибольшему нарушению подвергались pubis и преацетабулярная часть ilium, хотя операции были проведены на той же стадии развития (ст. 17). Это можно объяснить возможными незначительными различиями в технике операции: наклоном инструментов, направлением разреза (спереди назад или сзади вперед) при удалении почки конечности, степенью повреждения окружающей мезодермы боковой пластинки. Более того, у Спёрлинга (Spurling, 1923) результаты операции по удалению почки задней конечности более напоминали те результаты, которые были получены в настоящем исследовании при удалении боковой пластинки или почки конечности со значительным участком окружающей латеральной мезодермы. Тем не менее из данных другой работы (Rogulska, 1965) следует, что при определенных обстоятельствах (позднее время операции — ст. 20–23, различные направления линии среза) можно добиться такого проведения ампутации, при котором будут удалены зачатки скелетных элементов свободной конечности, но тазовый пояс окажется в результате совершенно неповрежденным. Все эти данные свидетельствуют о том, что дефекты в тазовом поясе, возникающие при удалении почки задней конечности, относятся к результатам удаления вместе с почкой участков зачатка самого пояса. Последний в отсутствие почки задней конечности может продолжать свое нормальное или почти нормальное развитие. Напомню также про limbless мутантов кур (Prahlad et al., 1979) и legless мутантов мышей (Noramly et al., 1996). На этих аномальных животных природой были поставлены более чистые эксперименты, при которых не происходило случайного механического повреждения соседних тканей, как в эспериментах, описанных выше. У безногих кур формируются нормальные таз и крестец в отсутствие всех отделов свободной конечности. У безногих мышей таз также развивается нормально. Таким образом, развитие нормального таза и крестца принципиально возможно в отсутствие почки конечности, а незначительные дефекты, такие как дисплазия тазобедренного сустава, укорочение и нехарактерное расположение таза в пространстве, изъяны в хрящевых элементах, могут быть результатами вторичными (отсутствия femur, подвижности) или побочными (повреждения или удаления в ходе ампутации, замедления роста после операции). В начале данной главы я отметил, что складывается впечатление, что развитие таза не зависит ни от наличия АЭГ, ни от наличия ЗПА. Результаты экспериментов с удалением эктодермы боковой пластинки согласуются с этим впечатлением и позволяют развить его далее. Действительно, если удалять эктодерму на все более ранних стадиях, то развитие таза прекращается все раньше и он становится все менее полно сформированным. Однако в таком ряду операций последовательность исчезновения элементов таза не соответствует той, в какой они возникают в онтогенезе. Особенно интересно отметить, что pubis исчезает сначала в своей проксимальной (ацетабулярной) части. Иными словами, в развитии таза не наблюдается соответствия общепринятой моделе «зоны прогресса» (Summerbell, 1974; Summerbell and Lewis, 1975), приложимой, таким образом, только лишь к отделам свободной конечности. Эту модель развития нельзя автоматически экстраполировать на скелетные элементы, развивающиеся проксимальнее femur. Все эти факты говорят о том, что развитие таза, хотя и зависит от эктодермальных сигналов, сами эти сигналы, возможно, отличны от тех, которые необходимы для развития свободной конечности. В пользу такого предположения говорят и различия в наборе генов, экспрессирующихся в почке конечности и в области таза. В настоящем исследовании при удалении почки конечности, эктодермы боковой 98 пластинки или всей латеральной мезодермы в области почек задних конечностей даже в тех случаях, когда тазовый пояс оказывался сильно недоразвитым, крестец оставался практически нормальным. Лэйнг (Laing, 1982) описал недоразвитие крестца у кур с парализованными ногами, прежде всего касаясь поперечных отростков позвонков. Хотя он не уточнял, каких именно, но речь шла, судя по рисункам, о первых (поясничных) позвонках synsacrum. Тем не менее я не обнаружил у эмбрионов, у которых мною были удалены почки конечностей или эктодерма, редукции диа- или парапофизов. Дело в том, что я исследовал оперированных эмбрионов на стадиях 29–31, а Лэйнг — на этих и более поздних стадиях. Он отмечал, что до стадии 31 развитие отростков идет нормально, а затем затормаживается, и связывал это с отсутствием мышц и, соответственно, подвижности в области таза и крестца. Иными словами, даже если отсутствие таза и сказывается у эмбрионов кур на строении крестца, то этот эффект возникает поздно в онтогенезе, а может быть и не всегда. Другие исследователи также не подтверждают наблюдения Лэйнга; по их данным крестец развивается после ампутации почки конечности нормально во всех случаях, независимо от стадии, на которой производили анализ результатов операции (Spurling, 1923; Rogulska, 1965). Более того, уместно отметить, что позвонки, о которых идет речь в обсуждаемой статье Лэйнга, хотя и входят в состав synsacrum, по сути дела к крестцу не относятся (см. выше). При удалении эктодермы боковой пластинки у самых ранних эмбрионов, когда крестцово-тазовая область еще только формируется (стадии 11–12), как я уже отмечал, можно было добиться почти полной редукции таза, который представлял небольшой хрящевой ilium, если и контактирующий, то лишь с частью поперечных отростков synsacrum. Тем не менее весь крестец у таких эмбрионов развивался нормально, если зачатки позвонков не были повреждены во время операции механически. С другой стороны, известна врожденная аномалия у человека, когда недоразвивается вся нижняя часть позвоночника, начиная от заднепоясничных позвонков (Andrish et al., 1979). При такой аномалии половины таза противоположных сторон развиты практически нормально, за исключением того, что опираются друг на друга, а краниальными своими краями прирастают к телам и невральным дугам поясничных позвонков. Иными словами, отсутствие крестца не мешает в данном случае развитию таза. Таким образом, и этот пример свидетельствует о том, что крестец и таз могут развиваться относительно независимо друг от друга. 6.3.2. Формирование крестцового окна не связано с наличием почки конечности или денервацией осевых мышц Согласно гипотезе Борхвардта (1995), мускулатура почек конечностей привлекает к себе отростки нейронов из соответствующих (лежащих напротив почек конечностей) сегментов спинного мозга, которые осуществляют ее иннервацию. В результате нейронов не хватает для всей осевой мускулатуры, и гипаксиальные мышцы, не получая иннервации, разрушаются, освобождая место для скелетогенной мезенхимы крестцового окна. Хотя в обсуждаемой статье упоминалось разрушение мышцы как гистологической структуры, фактически эта гипотеза предполагает в качестве одного из вариантов развития событий участие в развитии крестцово-тазового сочленения механизмов, являющихся ключевыми в нейротрофической теории (см. подроб99 нее: Raff et al., 1993), в частности программированной гибели клеток или апоптоза в результате неполучения ими трофических факторов (или факторов выживания). Однако в данном конкретном случае речь шла не о конкуренции нейронов за мышечные цели, а наоборот — о конкуренции мышечных клеток (миомеров и почки конечности) друг с другом за нейроны. Поначалу эта гипотеза находила подтверждение в фактах сравнительной анатомии. Действительно, в ряду чешуйчатых рептилий наибольшего размера крестцовое окно достигает у ящериц с нормально развитыми конечностями и, соответственно, крупными почками конечностей. Крестцовое окно меньшего размера у безногих ящериц сочетается с почкой задней конечности меньшего размера, АЭГ которой быстро претерпевает редукцию (Рэйно и др., 1993; Raynaud, 1985). Мезенхима почки конечности под АЭГ гибнет и почка конечности рано прекращает свое развитие. У змей, лишенных конечностей во взрослом состоянии, таких как обыкновенная гадюка, V. berus (Borkhvardt and Malashichev, 2000), или водяной уж, Tropidonotus tessellata, (Raynaud, 1968), почки конечностей практически отсутствуют, АЭГ не развивается, а крестцовое окно не формируется. Рэйно с соавторами (Raynaud et al., 1977) наблюдали у эмбрионов змей и безногих ящериц гибель нейронов вентральной латеральной моторной колонны, которые у настоящих ящериц иннервируют мускулатуру конечностей. Однако не все нейроны гибли: небольшая, неупорядоченная в колонну, часть оставалась и, как предположили авторы статьи, могла переключаться на другие мышечные мишени. Развивая мысль авторов далее, в согласии с гипотезой Борхвардта (1995), мы предположили, что у безногих рептилий моторные нейроны иннервируют гипаксиальные мышцы крестцовых сегментов, предотвращая их гибель и разрушение (Malashichev and Borkhvardt, 1998). Следует, однако, отметить, что несмотря на то что факт гибели клеток в мезодерме почек конечностей и нервной системе, а на более поздних этапах онтогенеза и в некоторых тазовых мышцах у безногих ящериц хорошо известен (Raynaud et al., 1975; Raynaud et al., 1977), никем не показано обратного — что у ящериц с нормально развитыми конечностями действительно наблюдается апоптоз в гипаксиальных миомерах. Клеточная гибель свойственна многим развивающимся структурам, в том числе дермамиотомам и их производным. Проведенное недавно тотальное картирование апоптоза у куриного эмбриона (Hirata and Hall, 2000) не выявило никаких следов усиленной гибели клеток в крестцовых миотомах по сравнению с предкрестцовыми вплоть до стадии 26 (более старшие возрасты не исследованы). Вообще же апоптоз в дермамиотомах наблюдали между стадиями 14 и 20. Из более поздних событий хорошо известен лишь факт дегенерации после вылупления цыпленка m. complexus, служащей для специфичных движений шеей при вылуплении из яйца (Hayes and Hikida, 1976). Таким образом, гибель клеток в крестцовой мускулатуре не отмечена исследователями и у птиц. В то же время не очень понятно, почему вообще может сложиться ситуация, когда нейронов не хватило бы на одновременную иннервацию как осевых мышц, так и мышц конечности, поскольку исходно в онтогенезе число нейронов как минимум двукратно превосходит то число, которое реально требуется для иннервации всех мышечных мишеней в каждой конкретной области тела (Raff et al., 1993). Если предположить, что одновременно развиваются как мышцы конечности, так и гипаксиальные мышцы крестцовых сегментов, то это вовсе необязательно должно приводить к конкуренции мышечных клеток за нейроны. Если приложить это утвер100 ждение к вышеприведенному примеру с безногими рептилиями, то сохраняющиеся в моторной колонне нейроны у этих животных могут иннервировать не «выживающую» осевую мускулатуру, а частично сохраняющиеся мышцы тазовой области и копулятивных органов. В литературе нет также указаний на то, что мышечные волокна in vivo испытывают нехватку нейронов и конкуренцию за них у каких-либо из модельных объектов биологии развития. Более того, у амниот, особенно у млекопитающих, развитие мускулатуры разных уровней по кранио-каудальной оси тела, а также осевой мускулатуры и мускулатуры конечностей, достигает большой степени синхронизации (Вальштрем, 1953). Время закладки ряда соматических мышц не сказывается на сроках начала их дифференцировки. При этом денервация эмбриональной мышцы (у новорожденных крысят), в отличие от денервации мышцы взрослых млекопитающих, не приводит к ее атрофии и не задерживает ее гистологическую дифференцировку (Вальштрем, 1953). Влияние же иннервации сказывается только после рождения, на стадиях окончательной биохимической и функциональной дифференцировки, в результате чего уже сформированное, но еще нефункционирующее мышечное волокно становится быстро или медленно сокращающимся, утомляющимся или не подверженным утомлению (Карлсон, 1983). У всех исследованных мною амниот формирование крестцового окна в миомерах происходит в то время, когда дифференцирующаяся осевая мускулатура находится еще на стадиях упорядоченных рядов миобластов или миотуб, т. е., по-видимому, до наступления критической стадии, когда отсутствие иннервации могло бы привести к остановке дифференцировки или даже к гибели клеток. Таким образом, имеющиеся в нашем распоряжении в настоящее время факты не говорят в пользу предположения о том, что гибель мышечных клеток в области крестца действительно имеет место, а тем более что она вызвана недостаточной иннервацией. Расширение круга объектов для сравнительного исследования развивает сомнения в отношении роли в формировании крестцового окна не только нервной системы и мускулатуры конечностей, но и почек конечностей вообще. У эмбрионов курицы почки конечностей достаточно крупные и лежат напротив примерно шести-семи сомитов, принимая нейроны от еще большего их числа. У цыпленка формируется действительно большое крестцовое мезенхимное окно. Однако у эмбрионов мутантных кур, limbless, лишенных конечностей (Prahlad et al., 1979), почка конечности, хотя и формируется, не имеет АЭГ ни на одной из стадий и очень быстро дегенерирует, задолго до развития в ней упорядоченной мускулатуры. Несмотря на это крестец и таз у мутантных кур развиваются нормально и не претерпевают никакой редукции. Этот факт скорее всего свидетельствует о том, что гипаксиальные мышцы в районе крестца у таких кур отсутствуют, как и у кур дикого типа. Наконец, представленные экспериментальные данные также отвергают какую бы то ни было роль почек конечностей в формировании крестцового окна у амниот. При одностороннем удалении ранней почки конечности или эктодермы боковой пластинки до формирования почки конечности, т. е. задолго до времени, когда нейроны могут установить связь с мышцами конечности, таз и крестец часто развивались нормально (см. также работы по ампутации конечности: Spurling, 1923; Rogulska, 1965). Даже при частичном или почти полном недоразвитии таза я наблюдал формирование крестцового окна, т. е. при недоразвитии таза и отсутствии почки конечности не происходило «сохранения» гипаксиальных частей крестцовых миомеров, что окончательно отвергает гипотезу Борхвардта (1995). 101 6.3.3. Мезодермальные источники для развития ilium и механизм развития крестцового окна остаются невыясненными Как уже было отмечено ранее, хрящ лопатки, по крайней мере, у птиц (Chevallier, 1977; Huang et al., 2000) и черепах, но не у саламандр (Burke, 1991a, b), развивается как производное гипаксиальной части грудных (у птиц) или шейных (черепахи) дермамиотомов, которые в остальных сегментах тела дают исключительно мышцы (Chevallier et al., 1977; Christ et al., 1977; Christ et al., 1983). Так как scapula по занимаемому положению относительно остального пояса передних конечностей и осевого скелета соответствует ilium в тазовом поясе, можно предположить, что и верхняя часть тазового пояса развивается как производное дермамиотомов, т. е. благодаря дедифференцировке миогенных клеток и их вторичного обращения на путь дифференцировки в хрящ. Такое предположение подразумевает механизм формирования крестцового окна в миомерах, а также возможность развития из материала дермамиотома ilium, а возможно, и крестцовых поперечных отростков и ребер. Последний факт, однако, проверить очень трудно из-за близости расположения клеток дермамиотома и склеротома в сомите. Недавнее исследование мутантов мышей, не имеющих гена Emx2 (Emx2 −/− ), дополнительно показало интересную связь между scapula и ilium (Pellegrini et al., 2001). Ген Emx2 экспрессируется в основаниях почек конечностей, как передних, так и задних. У Emx2 −/− мышей наблюдается отсутствие длинной пластины scapula, происходящей из дермамиотомов, при сохранении соматоплевральной части, слагающей гленоидную впадину. У таких мышей отсутствует ala ilii, а крестцовые диапофизы почти не расширены дистально, недоразвиты. Более того, известно, что ген Emx2, отвечающий за развитие scapula и ilium (Pellegrini et al., 2001), экспрессируется в регенерационной бластеме тритона (Beauchemin et al., 1998). Хотя его точная функция при регенерации конечности тритона неясна, именно в регенерационной бластеме наблюдается дедифференцировка миотуб и мышечных волокон, когда происходит репрограммирование уже вполне дифференцированных мышечных клеток и дальнейшее формирование скелетных структур de novo (Brockes and Kumar, 2002). При этом многоядерные миотубы и мышечные волокна вступают в клеточный цикл и претерпевают сначала преобразование в моноядерные мезенхимные клетки (Beauchemin et al., 1998). Интересно, что экстракт из регенерационной бластемы тритона может вызывать дедифференцировку миотуб даже у млекопитающих (McGann et al., 2001). Возможно, что именно транскрипционный фактор Emx2 может оказаться ответственным за дедифференцировку мышц как при регенерации конечности амфибий, так и при формировании крестцового окна и развитии scapula, ilium, а возможно, и поперечных отростков (по крайней мере, у некоторых животных, у которых они особенно развиты). Для решения вопроса о происхождении ilium (из дермамиотомов или из соматоплевры) мною были проведены три эксперимента: удаление серии крестцовых сомитов, удаление боковой пластинки на уровне почек задних конечностей и пересадка серии крестцовых дермамиотомов (верхней части эпителизованных сомитов) от перепела к курице. Первый эксперимент показал, что удалить сомит полностью очень трудно, и, как правило, небольшая часть склеротома остается и формирует рудиментарные дуги и поперечные отростки, однако весь или бóльшая часть дермамиотома оказываются 102 удаленными. У 50% успешно прооперированных эмбрионов наблюдались дефекты (изъяны в хрящевой пластине) ilium, аналогичные полученным ранее другими авторами (Kieny et al., 1972). Напротив, полное удаление боковой пластинки не привело к полному недоразвитию таза, и проксимо-каудальная часть ilium, соответсвующая ala postacetabularis ilii, каждый раз сохрянялась. Справедливости ради следует отметить, однако, что дефект ilium при удалении боковой пластинки был тем не менее существенным. При пересадках от перепела к курице презумптивной эпаксиальной мускулатуры донорский материал ни разу не был обнаружен в составе хрящей таза, и клетки перепела слагали исключительно эпаксиальную мускулатуру. При пересадках всего дермамиотома куриный хрящ ilium у двух удачно прооперированных эмбрионов не достигал позвоночника. У одного из них хрящ ilium состоял из двух частей — ацетабулярной, сложенной куриными клетками (клетки хозяина), и верхней, состоящей из клеток перепела (трансплантат). Все вместе эти три эксперимента по ампутации сомитов или боковой пластинки, а также по трансплантации дермамиотомов свидетельствуют о принципиальной возможности происхождения ilium из двух мезодермальных источников — соматоплевры и дермамиотомов. Такое предположение противоречит некоторым аналогичным экспериментам, проведенным ранее (Chevallier, 1977). По всей видимости, однозначный ответ на вопрос о происхождении ilium давать преждевременно, и требуется дальнейшее углубленное изучение вопроса. Следует отметить относительно малое число проведенных мной трансплантаций, которые могли бы дать наиболее достоверные результаты, а также некоторые технические особенности проведения операций. Из-за близости материала сомитов (особенно гипаксиальных частей дермамиотомов) и края боковой пластинки всегда остается вероятность того, что при удалении сомита могут быть удалены некоторые клетки наиболее проксимальной зоны боковой пластинки, а при удалении боковой пластинки, некоторые клетки, которые в норме дают ilium, могли, наоборот, остаться неудаленными. К этому следует добавить, что удаление почки конечности или соматоплевры может сопровождаться значительными и не всегда одинаковыми нарушениями в тазовом поясе. Такие повреждения ilium при удалении боковой пластинки должны убеждать, скорее, в соматоплевральном происхождени ilium, как и всего остального пояса, нежели в происхождении из сомитов. Иными словами, если дедифференцировка миогенных клеток в области презумптивной лопатки практически доказана (Huang et al., 2000), то в отношении ilium дедифференцировка клеток дермамиотомов является лишь смелой гипотезой. В дальнейшем для окончательного решения вопроса о происхождении ilium стоит в бóльшей степени опираться на результаты трансплантаций как несколько более точные по сравнению с ампутациями. Более детальные эксперименты по пересадке индивидуальных сомитов и их частей, а также гомотрансплантации материала боковой пластинки от перепела к курице могли бы дать точный ответ на вопрос: происходит ли ilium из дермамиотомов или нет, а следовательно, имеет ли место дедифференцировка клеток дермамиотомов, исходно коммитированных к развитию в мышцы, но изменяющих дальнейшую свою судьбу? Дополнительным свидетельством дедифференцировки мог бы послужить повышенный уровень включения бромдиоксиуридина (BrdU), показывающий, что мышечные клетки дермамиотомов на стадии дифференцировки действительно заново входят в клеточный цикл. Решив вопрос об источнике строительного материала для ilium, можно было бы не задумываясь говорить и об источнике мезенхимы крестцового окна, в зоне 103 которого ilium и развивается, так как преемственность клеточных линий была бы очевидной. В случае, если ilium происходит из сомитов путем дедифференцировки мышечных клеток, это означало бы, что источником мезенхимы при формировании крестцового окна являются сами миомеры. Борхвардт (1995), кстати, не исключал и даже прямо указывал на такую возможность. Если ilium происходит из мезодермы боковой пластинки, это означало бы, что мезенхима крестцового окна (по крайней мере, той его части, которая дает ilium) также происходит из боковой пластинки, а формирование крестцового окна идет иным способом, чем дедифференцировка. Например, это могли бы быть гибель миогенных клеток (см. выше) или их эмиграция. При обсуждении механизма формирования крестцового окна нельзя, однако, оставлять в стороне и механико-топографические изменения в онтогенезе. Данные настоящего исследования показывают, что у эмбрионов млекопитающих и птиц крестцовые дермамиотомы не растут вниз единым пластом, так же, как это происходит с предкрестцовыми и хвостовыми дермамиотомами. Таким образом, уже с ранних стадий развития миомеры как бы «обходят» зону крестцового окна, оставляя ее свободной для скопления скелетогенной мезенхимы, которая происходит из боковой пластинки. Интересно заметить, что источником мезенхимы крестцового окна могли бы быть и склеротомы, по крайней мере у рептилий и млекопитающих, у которых развиваются мощные крестцовые диапофизы или ребра. Впрочем, и у птиц именно в крестцовых склеротомах наблюдается минимальная гибель клеток по сравнению с любыми предкрестцовыми уровнями (Hirata and Hall, 2000). Это может приводить впоследствии к накоплению бóльшего числа клеток, слагающих, в частности, и поперечные отростки позвонков. 6.3.4. Верхняя и нижняя части таза имеют несколько различные закономерности развития и эволюции В том, что крестцово-тазовый скелетный комплекс представляет собой жестко скоррелированную систему, несмотря на отсутствие прямых морфогенетических связей между его элементами, убеждают примеры редукции конечностей (см. например: Sewertzoff, 1931). Однако не все так просто. Существует по крайней мере два варианта их редукции. Один вариант, который демонстрируют чешуйчатые рептилии и который наиболее часто служит примером для эволюционных рассуждений, заключается в редукции конечностей начиная с их дистальных концов, с сохранением полного набора элементов таза у форм, у которых редукция еще не достигла своего максимума. В ряду рептилий, от четвероногих к полностью лишенным конечностей и поясов, последним из элементов таза исчезает ilium. Такой порядок редукции конечности и тазового пояса у чешуйчатых рептилий коррелирует с удлиннением тела (Stokely, 1947) и изменением границ экспрессии Hox -генов (Cohn and Tickle, 1999). Действительно, Hox -гены отвечают не только за регионализацию параксиальной мезодермы (Kessel and Gruss, 1991; Burke et al., 1995), но также и за регионализацию мезодермы боковой пластинки и положение почек конечностей (Cohn et al., 1997). У питонов весь позвоночник впереди клоаки состоит из позвонков, демонстрирующих черты грудных, а в параксиальной мезодерме экспрессируется набор Hox -генов, характерных именно для этого отдела позвоночника (Cohn and Tickle, 1999). Авторы цитируемой статьи не обнаружили каких-либо ограниченных зон экспрессии Hox -генов, которые бы маркировали зону 104 передних конечностей; соответственно, у питонов передние конечности и не развиваются. Таким образом, изменение зон экспрессии Hox -генов в ранней эволюции змей могло непосредственно привести как к отстутствию почек передних конечностей, так и к морфологическому преобразованию туловищных позвонков. С другой стороны, расширение зоны экспрессии некоторых Hox -генов в туловище начиная от его задней границы имело следствием и расширение зоны поляризующей активности, которая у питонов не локализована каудально в почке задней конечности, как у других позвоночных, а расширяется на всю почку (Cohn and Tickle, 1999). По мнению авторов, это преобразование и могло привести, в частности, к невозможности правильного формирования апикального эктодермального гребня и соответствующих регуляторных градиентов внутри почки задней конечности и как следствие к недоразвитию свободной задней конечности у примитивных змей типа современных Boidae. В качестве гипотезы авторы предположили, что у высших змей произошла дальнейшая унификация экспрессии Hox -генов вдоль позвоночника и расширение зоны грудных (несущих ребра) позвонков, что привело в дальнейшей эволюции к потере и задних конечностей вместе с тазовым поясом. Интересно отметить, что в приведенную схему эволюции безногости у Squamata укладываются и наши данные о развитии крестца (клоакального отдела позвоночника у Vipera) и таза в серии чешуйчатых рептилий с хорошо развитыми и рудиментарными конечностями. Действительно, отмеченные выше корреляции между размерами почек задних конечностей, степенью разрушения крестцовых миомеров (размерами крестцового окна) и числом крестцовых позвонков находят удовлетворительное объяснение. Изменение паттерна экспрессии Hox -генов в туловищной области стало, вероятнее всего, ранним и самым общим фактором, который и обеспечил координированность всех перечисленных преобразований в скелете. Такое заключение не поддерживает наше мнение, приведенное в одной из предыдущих публикаций, о том, что почка задней конечности способствует формированию крестцового окна в миомерах и тем самым сама создает себе опору на осевом скелете (Borkhvardt and Malashichev, 2000), а найденные морфологические корреляции находят более универсальное объяснение, так как имеют более раннюю и общую причину (изменение экспрессии Hox –генов). Иной способ редукции конечностей, по-видимому, демонстрируют ихтиозавры. У них задняя конечность сохраняется в виде плавника, не наблюдается сильного удлиннения тела, но при этом связь таза с позвоночником утрачивается за счет редукции ilium (см. гл. 1). Согласно современным взглядам на эволюцию змей, самые примитивные из них были морскими животными, напоминающими мозазавров (Caldwell and Lee, 1997; Fraser, 1997). Этой стадии эволюции змей соответствует состояние, наблюдаемое у примитивной, но не самой древней из известных ископаемых змей — Pachyrhachis problematicus из нижнего сеномана (мел) Израиля (Caldwell and Lee, 1997), у которой были хорошо развиты таз и свободные конечности вплоть до тарзалий. Следует, однако, отметить, что, судя по приводимым в работе рисункам, единственное «крестцовое» (в интерпретации авторов статьи) ребро было вильчатым на дистальном конце, что свойственно лимфапофизам передних хвостовых позвонков современных рептилий, так что в наличии крестца и связи таза с позвоночником у этого животного стоит усомниться. Более того, у Pachyrhachis, в отличие от всех Squamata, astragalus и calcaneum раздельны (Fraser, 1997), что наводит на мысль, что этот вид не обязательно является непосредственным предком современных змей, а может быть самостоятельной груп105 пой или представителем мозазавров. Если последние два рассуждения о крестце и положении Pachyrhachis верны, то вряд ли возможно рассматривать именно этот вид как ранний этап эволюции безногих Squamata, и он не очень удачно ложится в схему интерпретации онтогенетических данных, предложенную Коном и Тикл (1999), а более напоминает вариант редукции конечностей, свойственный ихтиозаврам, — редукция крестцово-тазового сочленения при сохранении скелета свободной конечности. У китов интерпретации состава таза разноречивы, но чаще его считают состоящим в основном из ischium, по причине его связи с crura penis или clitoridis, а также с m. ischiocavernosus (Hosokawa, 1951). Эта связь может быть результатом эволюции таза в направлении к новой функции поддержки половых органов (Яблоков, 1963). При этом в первую очередь утрачиваются подвздошный элемент и связь с позвоночником, как у ихтиозавров и Pachyrhachis. Таким образом, при редукции задних конечностей у водных амниот происходит сначала редукция крестцово-тазового сочленения, а затем нижней части таза и скелета свободной конечности, а у наземных Squamata — редукция дистальных отделов свободной конечности и нижней части таза, а затем крестцово-тазового сочленения, что в определенной степени подкрепляет мои предыдущие рассуждения о возможно различных источниках скелетогенной мезенхимы ilium и остального таза, не связанного непосредственно с позвоночником. Приведенные выше описания эволюции безногости в некоторых группах водных тетрапод, когда сначала утрачивалась связь таза с позвоночником, а только потом редукции подвергались и остальные элементы системы таз–конечность, напоминает нам и об отсутствии связи таза с позвоночником у ранних амфибий, что может свидетельствовать о том, что ilium по крайней мере в своей восходящей части мог эволюционировать независимо от остального таза. Можно привести и ряд других примеров относительной независимости эволюции ilium и нижней части таза (ischium и pubis). У динозавров опистопубия достигается в разных группах при сочетании с различными типами устройства крестцово-подвздошного сочленения. Например, у Dromaeosauridae (Theropoda, Saurischia) разворот pubes назад происходит без нарушения долихоилии (Барсболд, 1983). Наконец, как ясно из предшествующего обсуждения, и в развитии ilium наблюдаются отличия от развития других частей тела. Имеется определенная вероятность того, что мезенхима, слагающая ilium и остальной таз происходит из разных мезодермальных источников (сомиты и боковая пластинка), а потому может отличаться по своим свойствам и онтогенетической «истории» дифференцировки. Об этом свидетельствуют следующие факты: мне не удалось добиться полного недоразвития ilium при удалении эктодермы над боковой пластинкой, в то время как весь остальной пояс не развивался, удаление крестцовых сомитов сказывалось на строении ilium, но не остального таза. По крайней мере один из генов (Emx2 ), экспрессирующихся в мезенхиме ilium, не экспрессируется в остальном тазе, тогда как в районе стыка pubis и ischium экспрессируется ген Pax1, который не экспрессируется в районе ilium. Таким образом, можно предполагать, что крестец, таз и свободная конечность представляют собой модульную структуру, части которой имеют собственные программы развития, а потому эволюционировали, возможно, в большой степени независимо друг от друга, тогда как скоррелированность их развития зависит от более общих и ранних факторов онтогенеза. 106 * * * Выражаю глубокую благодарность моему учителю — профессору Валентину Германовичу Борхвардту как за мое научное образование, так и за участие советом и контролем в настоящей работе. Я благодарен многим людям, оказавшим разнообразную техническую и интеллектуальную помощь и моральную поддержку, прежде всего сотрудникам и студентам кафедры зоологии позвоночных Санкт-Петербургского государственного университета, где выполнялась работа, — Н. В. Балеевой, М. А. Левиной; сотрудникам ЗИН РАН, который являлся в последние годы моим вторым «домом», — Н. Б. Ананьевой, И. Г. Данилову, Р. Г. Халикову, К. Д. Мильто; персоналу Института Анатомии Фрайбургского университета (Германия), где были поставлены эксперименты, в особенности Б. Кристу (B. Christ), Ф. Эехальту (F. Ehehalt), А. Гамелю (A. Gamel), С. Конради (S. Konradi), Э. Гимбель (E. Gimbel) и М. Шютоф (M. Schütoff). Мне было бы трудно в процессе работы обойтись без помощи сотрудников других организаций, предоставивших материалы или возможность работы на своем оборудовании, а именно Е. Р. Гагинской и Т. А. Волкович, (БиНИИ СПбГУ), В. Г. Семенова и Е. Н. Крючковой (СПб ГУП «Зоопарк»), а также А. Бауэра (A. Bauer, Villanova University, PA, USA) и Б. Бартоломью (B. Bartholomew, Bibliomania!, UT, USA), помогавших с реактивами и современной литературой. Мне оказали неоценимую помощь в работе над рукописью советы Г. О. Черепанова, Е. Е. Коваленко, Ф. Я. Дзержинского и А. К. Дондуа, взявших на себя труд критического ее прочтения, а также замечания Э. И. Воробьевой, С. В. Смирнова, А. Н. Кузнецова, Н. Б. Ананьевой, И. Г. Данилова, И. П. Комаровой, М. Ф. Ковтуна, приславших отзывы на автореферат кандидатской диссертации. Настоящее исследование проведено при финансовой поддержке РФФИ, Конкурсного центра фундаментального естествознания Минобразования РФ, Министерства Науки и Технологий РФ, ГЦП «Интеграция», DAAD, EMBO. ЛИТЕРАТУРА Анисимова Е. В. Строение, развитие и изменчивость крестцово-тазовой области обыкновенного тритона (Triturus vulgaris L.) // Вестн. Ленингр. ун-та. 1990. Сер. 3. Вып. 1 (№ 3). С. 3–10. Ахмедов Н. М., Саркисова Л. М. Возрастные особенности линейных промеров посткраниального скелета диких (Capra cylindricornis Blyth., C. aegagrus Erx.) и домашних (C. hircus L.) коз // III Всесоюзная школа «Экология и охрана горных видов млекопитающих». М., 1987. С. 11–12. Барсболд Р. Хищные динозавры мела Монголии // Тр. Совм. Советско-монгольской эксп. 1983. Т. 19. С. 1–120. Богданович И. А. Аппарат наземной локомоции тетеревиных и других курообразных. Морфоэкологическая характеристика // Вестн. зоол. 1997. Отд. вып. 3. С. 3–152. Борхвардт В. Г. Морфогенез и эволюция осевого скелета. Л., 1982. 144 с. Борхвардт В. Г. О слиянии шейных позвонков млекопитающих // Архив анат., гистол. и эмбриол. 1985. Т. 89, № 12. С. 20–28. Борхвардт В. Г. Закономерности развития хрящевых элементов в онтогенезе позвоночных // Журн. общ. биол. 1991. Т. 52, № 5. С. 746–758. Борхвардт В. Г. О происхождении грудины тетрапод // Вестн. С.-Петерб. ун-та. 1992. Сер. 3. № 3. С. 3–11. Борхвардт В. Г. О формировании крестцово-подвздошного скелетного комплекса в онтогенезе тетрапод // Зоол. журн. 1995. Т. 74, № 5. С. 84–94. Борхвардт В. Г., Коваленко Е. Е. Роль механических взаимодействий в развитии миомеров и осевого скелета анамний // Вестн. Ленингр. ун-та. 1985. Сер. 3. № 3. С. 3–10. Браун В. А., Горышин Н. А. Климатические камеры с программированием фотопериодических и температурных ритмов для экологических исследований // Вестн. Ленингр. ун-та. 1978. Сер. 3. № 3. С. 26–34. Вальштрём Е. А. О координации темпов развития соматической мускулатуры в онтогенезе млекопитающих: Автореф. дис. . . . канд. биол. наук. Л., 1953. Великий В. Некоторыя добавленiя къ гистологiи, анатомiи и физiологiи лимфатическихъ сердецъ. С.-Петербургъ, 1884. 32 с. Гамбарян П. П., Дукельская Н. М. Крыса. М.: Советская наука, 1955. 254 с. Гуртовой Н. Н., Дзержинский Ф. Я. Практическая зоотомия позвоночных. Птицы, млекопитающие. М.: Высшая школа, 1992. 414 с. Гуртовой Н. Н., Матвеев Б. С., Дзержинский Ф. Я. Практическая зоотомия позвоночных. М.: Высшая школа, 1978. 407 с. Дзержинский Ф. Я. Сравнительная анатомия позвоночных животных. М.: «ЧеРо», 1998. 208 с. Дондуа А. К. Роль кластерных гомеобокссодержащих генов в морфогенезе животных // Онтогенез. 1997. Т. 28, № 1. С. 3–17. Дыбан А. П., Пучков В. Ф., Баранов В. Ф., Самошкина Н. А., Чеботарь Н. А. Лабораторные млекопитающие: мышь, Mus musculus, крыса, Rattus norvegicus, кролик, Oryctolagus cuniculus, хомячок, Cricetus griseus // Детлаф Т. А. (ред.) // Объекты биологии развития. М.: Наука, 1975. C. 505–567. Кабак С. Л. Эмбриональное развитие тазобедренного сустава белой крысы // Вестн. зоол. 1978, № 6. С. 69–71. Карлсон Б. Основы эмбриологии по Пэттену. М.: Мир, 1983. 390 c. Коваленко Е. Е. Строение крестцово-уростильного отдела в семействе Pipidae (Amphibia, Anura) // Зоол. журн. 1999. Т. 78, № 1. С. 57–68. Коваленко Е. Е., Анисимова Е. В. Особенности строения и развития крестцово-уростильной области бесхвостых амфибий // Зоол. журн. 1987. Т. 66, № 4. С. 557–566. Маршал М. А. Лягушка. 1896. 108 Мирецкий О. Лягушка и другие земноводные на занятиях по биологии. Москва-Смоленск, 1934. Рэйно А., Кан П., Дюпра А. М. Механизмы регрессии в развитии конечности у эмбрионов змееобразных рептилий. Роль уменьшения синтеза ДНК в мезодерме почки конечности // Онтогенез. 1993. Т. 24, № 6. С. 73–78. Сапин М. Р., Билич Г. Л. Анатомия человека. М.: Высшая школа, 1989. 544 с. Северцов А. Н. Очерки по истории развития мускулов, нервов и скелета конечностей низших Tetrapoda. К теории пятипалой конечности позвоночных // А. Н. Северцов. Собрание сочинений. М.-Л.: АН СССР, 1950. C. 7–250. Селянский В. М. Анатомия и физиология сельскохозяйственной птицы. М.: Колос, 1968. 336 c. Татаринов Л. П. Новая черепаха семейства Baenidae из нижнего эоцена Монголии // Палеонтол. журн. 1959. № 1. С. 100–113. Татаринов Л. П. Морфологическая эволюция териодонтов и общие вопросы филогенетики. М.: Наука, 1976. 260 с. Терентьев П. В. Лягушка. М.: Советская наука, 1950. 345 с. Терентьев П. В., Дубинин В. Б., Новиков Г. А. Кролик. М.: Советская наука. 1952. 364 с. Шимкевич В. Курсъ сравнительной анатомiи позвоночныхъ животныхъ. С.-Петербургъ и Москва: Изданiе т-ва М. О. Вольфъ. 1905. 511 с. Шмальгаузен И. И. Основы сравнительной анатомии. М.: Учпедгиз, 1938. 488 с. Шмальгаузен И. И. Происхождение наземных позвоночных. М.: Наука, 1964. 272 с. Яблоков А. В. К проблеме рудиментарных органов (с примерами из исследований морских млекопитающих) // Зоол. журн. 1963. Т. 42, № 3. С. 441–450. Akita K. An anatomical investigation of the muscles of the pelvic outlet in Iguanas (Iguanidae Iguana iguana) and Varanus (Varanidae Varanus (dumerillii)) with special reference to their nerve supply // Ann. Anat. (Anat. Anz.). 1992. Vol. 174. P. 119–129. Akita K., Sakamoto H., and Sato T. Muscles of the pelvic outlet in the fowl (Gallus gallus domesticus) with special reference to their nerve supply // J. Morphol. 1992. Vol. 214. P. 179–185. Amer K. W. F. I., and Mohammed F. A. The synsacrum, pygostyle and pelvic girdle in some common Egyptian birds // Bull. Zool. Soc. Egypt. 1981. Vol. 30. P. 37–52. Andrish J., Kalamchi A., and MacEwen G. D. Sacral agenesis: a clinical evaluation of its management, heredity, and associated anomalies // Clin Orthop. 1979, N 139. P. 52–57. Bagnall K. M., Sanders E. J., Higgins S. J., and Leam H. The effects of somite removal on vertebral formation in the chick // Anat. Embryol. 1988. Vol. 178. P. 183–190. Barkow H. Syndesmologie der Vögel. Breslau: Nischkowsky, 1856. 41 p. Baumel J. J., King A. S., Lucas A. M., Breazile J. E., and Evans H. E. Nomina Anatomica Avium (An Annotated Anatomical Dictionary of Birds). London, New York, Toronto, Sydney, San Francisco, Academic Press, 1979. 637 p. Bauer A. M. Systematics, biogeography and evolutionary morphology of the Carphodactylini (Reptilia: Gekkonidae). Ph. D. dissertation. University of California, Berkeley (Zoology). 1986. 869 p. Beauchemin M., Del Rio-Tsonis K., Tsonis P. A., Tremblay M., and Savard P. Graded expression of Emx-2 in the adult newt limb and its corresponding regeneration blastema // J. Mol. Biol. 1998. Vol. 279, N 3. P. 501–511. Boas J. E. V. Kreuzbein, Becken, und Plexus lumbosacralis der Vogel // Mem. l’Acad. Roy. Sci. Lettr. Danemark. 1933. Vol. 5, N 1. P. 1–74. Borkhvardt V. G., and Malashichev Y. B. Correlative changes during early morphogenesis of the sacroiliac complex in squamate reptiles // Ann. Anat. (Anat. Anz.). 2000. Vol. 182, N 5. P. 439–444. Bradley S. J. An analysis of self-differentiation of chick limb buds in chorio-allantoic grafts // J. Anat. 1970. Vol. 170, N 3. P. 479–490. Brockes J. P., and Kumar A. Plasticity and reprogramming of differentiated cells in amphibian regeneration // Nature Reviews Mol. Cell Biol. 2002. Vol. 3. P. 566–574. Browne M. J. A study of the sacral autonomic nerves in a chick and a human embryo // Anat Rec. 1953. Vol. 116, N 1. P. 189–199. Budras K.-D., and Rautenfeld D. B. Zur funktionellen und topographischen Anatomie des Lymphherzens und Lymphgefaßsystems im Beckenbereich bei Wasser- und Laufvögeln // Anat Anz. 1984. Vol. 156. P. 231–240. Burck H.-C. Histologische Technik. Stuttgart-New York: Georg Thieme Verlag, 1988. Burke A. C. Proximal elements of the vertebrate limb: evolutionary and developmental origin of the pectoral girdle // Hinchliffe J. R., ed. Developmental Patterning of the Vertebrate Limb. N.-Y.: Plenum Press, 1991a. P. 385–394. Burke A. C. The development and evolution of the turtle body plan: inferring intrinsic aspects of the evolutionary process from experimental embryology // Am. Zool. 1991b. Vol. 31. P. 616–627. 109 Burke A. C., Nelson C. E., Morgan B. A., and Tabin C. Hox genes and the evolution of vertebrate axial morphology // Development. 1995. Vol. 121. P. 333–346. Bystrow A. P. Kotlassia prima Amalitzky // Bull. Geol. Soc. Am. 1944. Vol. 55. P. 379–416. Caldwell M. W., and Lee M. S. Y. A snake with legs from the marine Cretaceous of the Middle East // Nature. 1997. Vol. 386. P. 705–709. Callery E. M., and Elinson R. P. Opercular development and ontogenetic re-organization in a directdeveloping frog // Development, Genes and Evolution. 2000. Vol. 210. P. 377–381. Capecchi M. R. The new mouse genetics: altering the genome by gene targeting // Trends in Genetics. 1989. Vol. 5, N 3. P. 70–76. Capecchi M. R. Targeted gene replacement // Scientific American. 1994. Vol. 270, N 3. P. 34–38. Chandraraj S. Failure of articular process (zygapophyseal) joint development as a cause of vertebral fusion (blocked vertebrae) // J. Anat. 1987. Vol. 153. P. 55–62. Chen P.-J., Dong Z.-M., and Zhen S.-N. An exceptionally well preserved theropod dinosaur from the Yixian Formation of China // Nature. 1998. Vol. 391. P. 147–152. Chevallier A. Origine des ceintures scapulaires et pelviennes chez l’embryon d’oiseau // J. Embryol. Exp. Morphol. 1977. Vol. 42. P. 275–292. Chevallier A., Kieny M., and Manger A. Limb-somite relationship: origin of the limb musculature // J. Embryol. Exp. Morphol. 1977. Vol. 41. P. 245–258. Christ B., Jacob H. J., and Jacob M. Experimental analysis of the origin of the wing musculature in avian embryos // Anat. Embryol. 1977. Vol. 150. P. 171–186. Christ B., Jacob M., and Jacob H. J. On the origin and development of the ventrolateral abdominal muscles in the avian embryo. An experimental and ultrastructural study // Anat. Embryol. 1983. Vol. 166. P. 87–101. Clack J. A. A new Early Carboniferous tetrapod with a melange of crown-group characters // Nature. 1998. Vol. 394, N 6688. P. 66–69. Clack J. A. The origin of tetrapods // Heatwole H. and Carroll R. L., eds. Amphibian Biology. Chipping Norton: Surrey Beatty & Sons, 2000. P. 979–1029. Clack J. A., and Carroll R. L. Early Carboniferous Tetrapods // Heatwole H. and Carroll R. L., eds. Amphibian Biology: Chipping Norton, Surrey Beatty & Sons. 2000. P. 1030–1043. Cligny M. A. Vertèbres et coeurs lymphatiques des Ophidiens. Lille: Imprimerie L. Danel, 1899. Coates M. I. The Devonian tetrapod Acanthostega gunnari Jarvik: postcranial anatomy, basal tetrapod interrelationships and patterns of skeletal evolution // Trans. Royal Soc. Edinburgh: Earth Sci, 1996. Vol. 87. P. 363–421. Cohn M. J., and Tickle C. Developmental basis of limblessness and axial patterning in snakes // Nature. 1999. Vol. 399, N 6735. P. 474–479. Cohn M. J., Patel K., Krumlauf R., Wilkinson D. G., Clarke J. D. W., and Tickle C. Hox9 genes and vertebrate limb specification // Nature. 1997. Vol. 387. P. 97–101. Dal Sasso C., and Signore M. Exceptional soft-tissue preservation in a theropod dinosaur from Italy // Nature. 1998. Vol. 392, N 6674. P. 383–387. Das P., and Mohanty-Hejmadi P. Vitamin A mediated limb deformities in the common Indian toad, Bufo melanostictus (Schneider) // Indian J. Exp. Biol. 2000. Vol. 38, N 3. P. 258–264. Dournon C., Bautz A., Membre H., Lauthier M., and Collenot A. Expression of hindlimb abnormalities under rearing temperature effects during the larval development of the salamander Pleurodeles waltl (urodele amphibian) // Dev. Growth Differ. 1998. Vol. 40, N 5. P. 555–565. Dragomirowa N. Über die abhangige Entwicklung von Sacralwirbel und Urostyl bei den Axolotl // Zool. Jahrb., Abt. Zool. Physiol. 1935. Bd. 54. Hf. 3. S. 249–266. du Toit P. J. Untersuchungen über das Synsacrum und den Schwanz von Gallus domesticus nebst Beobachtungen über Schwanzlosigkeit bei Kaulhuhnern. Ein Beitrag zur Frage nach der Homologie der Wirbel und Wirbelregionen // Jen. Zeitschr. Naturwissenschaft. 1913. Vol. 49, N.f. B. 42. Hf. 2. S. 149– 312. Dufaure J. P., and Hubert J. Table de développement du lézard vivipare, Lacerta vivipara Jacquin // Arch. Anat. Micr. Morph.exp. 1961. T. 50. P. 309–327. El-Toubi M. R. The osteology of the lizard Scincus scincus (Linn.) // Bull. Fac. Sci., Egyptian Univ. 1938. Vol. 14. P. 1–39. El-Toubi M. R. Sacral ribs of Lacertilia // Nature. 1947. Vol. 159. P. 342. El-Toubi M. R., and Khalil A. Caudal ribs in Geckos // Nature. 1950. Vol. 166. P. 1120. Emerson S. B. Frog postcranial morphology: identification of a functional complex // Copeia. 1982. Vol. 1982, N 3. P. 603–613. 110 Favier B., Rijli F. M., Fromental-Ramain C., Fraulob V., Chambon P., and Dolle P. Functional cooperation between the non-paralogous genes Hoxa-10 and Hoxd-11 in the developing forelimb and axial skeleton // Development. 1996. Vol. 122. P. 449–460. Fraser N. C. Genesis of snakes in exodus from the sea // Nature. 1997. Vol. 386. P. 651–652. Fromental-Ramain C., Warot X., Lakkaraju S., Favier B., Haack H., Birling C., Dierich A., Dolle P., and Chambon P. Specific and redundant functions of the paralogous Hoxa-9 and Hoxd-9 genes in forelimb and axial skeleton patterning // Development. 1996. Vol. 122. P. 461–472. Galis F. Evolutionary history of vertebrate appendicular muscle // BioEssays. 2001. Vol. 23. P. 383– 387. Galton P. M. Ornithischian dinosaurs and the origin of birds // Evolution. 1970. Vol. 24. P. 448–462. Gasc J.-P. Les rapports anatomiques du membre pelvien vestigial chez les squamates serpentiformes // Bull. Mus. Nat. Hist. Natur. Ser. 2. 1966. Vol. 38, N 2. P. 99–110. Gasc J.-P. Les rapports anatomiques du membre pelvien vestigial chez les squamates serpentiformes. I. Anguis fragilis (Anguidae, Lacertilia) et Python sebae (Boidae, Ophidia) // Bull. Mus. Nat. Hist. Natur. Ser. 2. 1965(1966). Vol. 37, N 6. P. 916–925. Gasc J.-P., and Renous S. La région pelvi-cloacale de Dibamus (Sqamata, Reptilia). Nouvelle contribution a sa position systematique // Bull. Mus. Nat. Hist. Natur. Ser. 4. 1979. Vol. 1. Section A, N 3. P. 659–684. Gaunt S. J. Conservation in the Hox code during morphological evolution // Int. J. Dev. Biol. 1994. Vol. 38. P. 549–552. Gegenbaur C. Beiträge zur Kenntnis des Beckens der Vögel // Jenaische Zeitschr. 1871. Bd. 6. S. 157– 220. Geist N. R., and Jones T. D. Juvenile skeletal structure and the reproductive habits of dinosaurs // Science. 1996. Vol. 272. P. 712–714. Gerard M., Chen J.-Y., Gronemeyer H., Chambon P., Duboule D., and Zakany J. In vivo targeted mutagenesis of a regulatory element required for positioning the Hoxd-11 and Hoxd-10 expression boundaries // Genes Development. 1996. Vol. 10. P. 2326–2334. Gilbert S. F. Developmental Biology. Sunderland: Sinauer Associates Inc. Publishers, 2000. 750 p. Gispert E., Ventura J., and Lopez-Fuster M. J. El sistema arterial del topillo rojo, Clethrionomys glareolus (Schreber, 1780) (Rodentia, Arvicolidae): origen, distribución y variaciones de las arterias abdominales y pelvicas // Bol. R. Soc. Esp. Hist. Nat. (Sec. Biol.). 1994. Vol. 91, N 1–4. P. 57–64. Goffin J., and Plets C. Unusual combination of anomalies of lumbar nerve roots // Acta Anat. 1987. Vol. 128. P. 161–163. Gregory W. K. Evolution Emerging: New York: Macmillan, 1951. 1749 p. Haines L., and Currie P. D. Morphogenesis and evolution of vertebrate appendicular muscle // J. Anat. 2001. Vol. 199, N 1–2. P. 205–209. Hamburger V., and Hamilton H. L. A series of normal stages in the development of the chick embryo // J. Morphol. 1951. Vol. 88. P. 49–92. Hammond W. C., and Yntema C. L. Depletions in the thoraco-lumbar sympathetic system following removal of the neural crest in the chick // J. Comp. Neur. 1947. Vol. 86. P. 237–253. Harrison T. J. The influence of the femoral head on pelvic growth and acetabular form in the rat // J. Anat. 1961. Vol. 95, N 1. P. 12–24. Hayashi K., and Ozawa K. Myogenic cell migration from somites is induced by tissue contact with medial region of the presumptive limb mesoderm in chick embryos // Development. 1995. Vol. 121. P. 661– 669. Hayes V. E., and Hikida R. S. Naturally-occurring degeneration in chick muscle development: ultrastructure of the M. complexus // J. Anat. 1976. Vol. 122, N 1. P. 67–76. Hinchliffe J. R., and Johnson D. R. Growth of cartilage. Hall B. K., ed. Cartilage. New York: Acad. Press., 1983. P. 255-295. Hirata M., and Hall B. K. Temporospatial patterns of apoptosis in chick embryos during the morphogenetic period of development // Int. J. Dev. Biol. 2000. Vol. 44. P. 757–768. Hodler F. Untersuchungen über die Entwicklung von Sacralwirbel und Urostyl bei den Anuren. Ein Beitrag zur Deutung des anuren Amphybientypus // Rev. Suisse Zool. 1949a. V. 56. Hft. 4, N 39. P. 747–790. Hodler F. Zur Entwicklung der Anurenwirbelsaule. Eine morphologisch-entwicklungs-physiologische Studie // Rev. Suisse Zool. 1949b. V. 56. P. 327–330. Hoffstetter R., and Gasc J.-P. Vertebrae and ribs in modern reptiles. Bellairs A. d. A., and Parsons T. S., eds. Morphology A. Biology of the Reptilia. London and New York: Academic Press., 1969. P. 201-310. 111 Holder L. A. The comparative morphology on the axial skeleton in the Australian Gekkonidae // J. Linn. Soc. — Zool., London. 1960. Vol. 44. P. 300–335. Holmes R. Palaeozoic temnospondyls. Heatwole H., and Carroll R. L., eds. Amphibian Biology. Chipping Norton: Surrey Beatty & Sons, 2000. P. 1081–1120. Hosokawa H. On the pelvic cartilages of the Balaenoptera foetuses, with remarks on the specifical and sexual difference // Sci. Rep. Whales Res. Inst. Tokyo. 1951. Vol. 5. P. 5–15. Hou L.-H., Zhou Z.-H., Martin L. D., and Feduccia A. A beaked bird from the Jurassic of China // Nature. 1999. Vol. 377. P. 616–618. Huang R., Zhi Q., Ordahl C. P., and Christ B. The fate of the first avian somite // Anat. Embryol. 1997. Vol. 195. P. 435–449. Huang R., Zhi Q., Patel K., Wilting J., and Christ B. Dual origin and segmental organization of the avian scapula // Development. 2000. Vol. 127. P. 3789–3794. Hubert J., and Dufaure J. P. Table de développement de la vipère aspic, Vipera aspis L // Bull. Soc. zool. France. 1968. T. 91. P. 779–788. Hutchinson J. R. The evolution of pelvic osteology and soft tissue on the line of extant birds (Neornithes) // Zool. J. Linn. Soc. London. 2001. Vol. 131. P. 123–168. Hutchinson, J. R., and Chiappe, L. M. The first known Alvarezsaurid (Theropoda: Aves) from North America // J. Vert. Paleontol. 1998. Vol. 18, N 3. P. 447–450. Jacob H. J., Christ B., and Jacob M. On the migration of myogenic stem cells into the prospective wing region of chick embryos. A scanning and transmission electron microscope study // Anat. Embryol. 1978. Vol. 153. P. 179–193. Ji Q., Currie P. J., Norell M. A., and Ji S.-A. Two feathered dinosaurs from northeastern China // Nature. 1998. Vol. 393. P. 753–761. Kamel A. E. Sacral ribs of Lacertilia // Nature. 1951. Vol. 168. P. 660–661. Kamel A. E. On the development of the ribs in the sacral region of a reptile Chalcides ocellatus (Forskal) // Publ. l’Inst. Fouad 1er du Desert. 1952. Vol. 1. P. 1-77. Kant R., and Goldstein R. S. Plasticity of axial identity among somites: cranial somites can generate vertebrae without expressing HOX genes appropriate to the trunk // Dev. Biol. 1999. Vol. 216. P. 507– 520. Kessel M., and Gruss P. Homeotic transformations of murine vertebrae and concomitant alteration of Hox codes induced by retinoic acid // Cell. 1991. Vol. 67. P. 89–104. Kieny M., Mauger A., and Sengel P. Early regionalization of the somitic mesoderm as studied by the development of the axial skeleton on the chick embryo // Dev. Biol. 1972. Vol. 28. P. 142–161. Kmita M., and Duboule D. Organizing axes in time and space; 25 years of colinear tinkering // Science. 2003. Vol. 301. P. 331–333. Kobayashi Y., Lu J.-C., Dong Z.-M., Barlsbold R., Azuma Y., and Tomida Y. Herbivorous diet in an ornithomimid dinosaur // Nature. 1999. Vol. 402. P. 480–481. Kondo T., Dolle P., Zakany J., and Duboule D. Function of posterior HoxD genes in the morphogenesis of the anal sphincter // Development. 1996. Vol. 122. P. 2651–2659. Kovalenko E. E. The compound sacrum in individual variability of common platanna (Xenopus laevis) // Russ. J. Herpetol. 1994. Vol. 1. P. 172–178. Kovalenko E. E. On some sacral anomalies in laboratory common platanna (Xenopus laevis) // Russ. J. Herpetol. 1995. Vol. 2. P. 170–173. Kovalenko E. E., and Kovalenko Y. I. Certain pelvic and sacral anomalies in Anura // Russ. J. Herpetol. 1996. Vol. 3. P. 172–177. Krumlauf R. Hox genes in vertebrate development // Cell. 1994. Vol. 78. P. 191–201. Laing N. G. Abnormal development of vertebrae in paralyzed chick embryos // J. Morphol. 1982. Vol. 173, N 2. P. 179–184. Laurin M. Seymouriamorphs // Heatwole H., and Carroll R. L., eds. Amphibian Biology. Chipping Norton: Surrey Beatty & Sons, 2000. P. 1064–1080. Le Douarin N. M. Particularités du noyaux interphasique chez la caille japonaise (Coturnix coturnix japonica). Utilization de ces particularités comme «marquage biologique», dans les recherches sur les interactions tissulaires et les migrations cellulaires au cours de l’ontogenèse // Bull. Biol. Fr. Belg. 1969. T. 103. P. 435–452. Le Douarin N. M. A biological cell labelling technique and its use in experimental embryology // Dev. Biol. 1973a. Vol. 30. P. 217–222. Le Douarin N. M. A Feulgen-positive nucleolus // Exp. Cell Res. 1973b. Vol. 77. P. 459–468. Levi-Montalcini R. The origin and development of the visceral system in the spinal cord of the chick embryo // J. Morphol. 1950. Vol. 86. P. 253–283. 112 Lombardo A., and Slack J. M. W. Abdominal B -type Hox gene expression in Xenopus laevis // Mech. Dev. 2001. Vol. 106. P. 191–195. Low J. W. Contributions to the development of the pelvic girdle. I. The pelvic girdle in the batrachian Menopoma alleghaniense Harlan // Proc. Zool. Soc. London. 1926. N 3. P. 913–929. Low J. W. Contributions to the development of the pelvic girdle. II. The pelvic girdle in the batrachian Hynobius nebulosus s. Ellipsoglossa nebulosa Dum et Bibr // Proc. Zool. Soc. London. 1927. N 3. P. 865–876. Low J. W. Contributions to the development of the pelvic girdle. IV. The pelvic girdle and its related muscles in the Batrachian Amphiuma means Gardner // Proc. Zool. Soc. London. 1929a. N 3. P. 463–468. Low J. W. Contributions to the development of the pelvic girdle. III. The pelvic girdle and its related musculature in monotremes // Proc. Zool. Soc. London. 1929b. N 17. P. 245–264. Mabee P. M., Crotwell P. L., Bird N. C., and Burke A. C. Evolution of median fin modules in the axial skeleton of fishes // J. Exp. Zool. 2002. Vol. 294. P. 77–90. Malashichev Y. B. Evolutionary changes of the pelvic girdle in Tetrapoda — evidence from ontogenetic studies. Int. Symp. The Origins of Animal Body Plans and Their Fossil Records, Early Life Research Center, Kunming. 1999a. P. 27–30. Malashichev Y. B. Relative sizes of body compartments and definitive shape of skeletal elements // Abstracts / Symposium «The Developmental Basis of Evolutionary change». Chicago, May 13–15, 1999b. P. 40. Malashichev Y. B. Sacrum and pelvic girdle development in Lacertidae // Russ. J. Herpetol. 2001. Vol. 8, N 1. P. 1–16. Malashichev Y. B., and Borkhvardt V. G. The state of sacral myomeres in embryos of reptiles with normal and reduced limbs // Program and Abstracts / 9th OGM of the Societas Europaea Herpetologica, Chambery, France, 25–28 August 1998. P. 19. Malashichev Y. B., and Borkhvardt V. G. Hypaxial muscles degeneration in the formation of the sacroiliac complex of Amniota // Develop. Growth Differ. 2001. Vol. 43 (Suppl.). P. S136. Malashichev Y. B., and Pawlowska-Indyk A. Temperature dependent variability and sacrum features displacement in Bombina variegata (Anura: Discoglossidae) // Herpetology’97, Prague, Czech Republic. 1997. P. 134. Marshall A. M. The Frog: An Introduction to Anatomy, Histology, and Embryology. Manchester: J. E. Cornish, 1888. VIII, 146 p. McGann C. J., Odelberg S. J., and Keating M. T. Mammalian myotube dedifferentiation induced by newt regeneration extract // Proc. Natl. Acad. Sci. USA. 2001. Vol. 98, N 24. P. 13699–13704. McGowan C., and Motani R. Ichthyopterygia. Handbook of Paleontology. München: Verlag Dr. Friedrich Pfeil, 2003. P. 1–175. Mitrovic D. Development of the articular cavity in paralyzed chick embryos and in chick embryo limb buds cultured on chorioallantoic membranes // Acta Anat. 1982. Vol. 113. P. 313–324. Mivart G., and Clarke R. On the sacral plexus and sacral vertebrae of lizards // J. Linn. Soc. (London). 1877. Vol. 13. P. 370–373. Mlynarski M., and Madej Z. The rudimentary limbs in Aniliidae (Serpentes) // Brit. J. Herpetol. 1961. Vol. 3. P. 1–6. Moodie R. L. The sacrum of Lacertilia // Biol. Bull. 1907. Vol. 13. P. 84–93. Moon A. M., and Capecchi M. R. Fgf8 is requeired for outgrowth and patterning of the limbs // Nat. Genet. 2000. Vol. 26. P. 455–459. Müller G. B., Streicher J., and Muller R. J. Homeotic duplication of the pelvic body segment in regenerating tadpole tails induced by retinoic acid // Dev. Genes Evol. 1996. Vol. 206. P. 344–348. Neyt C., Jagla K., Thisse C., Thisse B., Haines L., and Currie P. D. Evolutionary origins of vertebrate appendicular muscle // Nature. 2000. Vol. 408. P. 82–86. Nickel R., Schummer A., Seiferke E., Siller W. G., and Wight P. A. L. Anatomy of the domestic birds. New York–Heidelberg–Berlin: Springer Verlag, 1977. Noramly S., Pisenti J., Abbott U., and Morgan B. A. Gene expression in the limbless mutant: polarized gene expression in the absence of Shh and an AER // Dev. Biol. 1996. Vol. 179. P. 339–346. Novas F. E., and Puerta P. F. New evidence concerning avian origins from the Late Cretaceous of Patagonia // Nature. 1997. Vol. 387, N 6631. P. 390–392. Ordahl C. P., and Christ B. Avian somite transplantation: a review of basic methods // Meth. Cell Biol. Vol. 52. P. 3–27. Orsi A. M., Pinto e Silva P., de Abreu M. A. F., and Dias S. M. Arteres viscerales pelviennes chez le lapin (Oryctolagus cuniculus) // Acta Anat. 1979. Vol. 104. P. 72–78. Pellegrini M., Pantano S., Fumi M. P., Lucchini F., and Forabosco A. Agenesis of the scapula in Emx2 Homozygous mutants // Dev. Biol. 2001. Vol. 232. P. 149–156. 113 Prahlad K. V., Skala G., Jones D. G., and Briles W. E. Limbless: a new genetic mutant in the chick // J. Exp. Zool. 1979. Vol. 209. P. 427–434. Raff M. C., Barres B. A., Burne J. F., Coles H. S., Ishizaki Y., and Jacobson M. D. Programmed cell death and the control of cell survival: lessons from the neural system // Science. 1993. Vol. 262. P. 695–700. Rahmani, T. M. Z. Morphogenesis of the rudimentary hind-limb of the glass snake (Ophisaurus apodus Pallas) // J. Embryol. exp. Morphol. 1974. Vol. 32. P. 431–443. Raynaud A. Le developpement de la region cloacale et des ebauches phalliques, chez l’embryon de Couleuvre tessellee (Tropidonotus tessellata Laur.) // C. r. Acad. Sci., Paris. 1968. Vol. 266. P. 1593–1595. Raynaud A. Development of limbs and embryonic limb reduction // Gans C., and Billett F., eds. Biology of the Reptilia. New York: Wiley. 1985. P. 59–148. Raynaud A., Gasc J.-P., Renous S., and Pieau C. Etude comparative, embryologique et anatomique, de la région pelvi-cloacale et de sa musculature chez le l´ezard vert (Lacerta viridis Laur.) et l’Orvet (Anguis fragilis L.) // Mem. Mus. nation. Hist. nat., Paris. Nouv. Ser., Ser. A, Zool. 1975. T. 95. P. 1–62. Raynaud A., Clairambault P., Renous S., and Gasc J.-P. Organisation des cornes ventrales de la moelle épinière, dans les régions brachiale et lombaire, chez les embryons de Reptiles serpentiformes et de Reptiles à membres bien developpees // C. r. Acad. Sci., Paris, Ser D. 1977. T. 285. P. 1507–1509. Raynaud A., Kan P., Bouche G., and Duprat A.-M. Facteur de croissance des fibroblastes (FGF-2) et retard d-involution des membres posterieurs de l’embryon d’orvet (Anguis fragilis L.) // C R Acad Sci Paris, Sciences de la vie. 1995. T. 318. P. 51–56. Rieppel O. Studies on skeleton formation in reptiles. III. Patterns of ossification in the skeleton of Lacerta vivipara Jacquin (Reptilia, Squamata) // Fieldiana, Zoology. 1992. Vol. New ser., 68. P. 1–25. Rieppel O. Studies on skeleton formation in reptiles. Vol. Patterns of ossification in the skeleton of Alligator mississipiensis Daudin (Reptilia, Crocodylia) // Zool. J. Linn. Soc. London. 1993. Vol. 109. P. 301–325. Rieppel O. Studies on the skeleton formation in reptiles. Patterns of ossification in the skeleton of Lacerta agilis exigua Eichwald (Reptilia, Squamata) // J. Herpetol. 1994. Vol. 28. P. 145–153. Roberts D. Y., Johnson R. L., Burke A. C., Nelson C. E., Morgan B. A., and Tabin C. Sonic hedgehog is an endodermal signal inducing Bmp-4 and Hox genes during induction and regionalization of the chick hindgut // Development. 1995. Vol. 121. P. 3161–3174. Roček Z., and Rage J.-C. Anatomical transformations in the transition from temnospondyl to proanuran stages // Heatwole H., and Carroll R. L., eds. Amphibian Biology. Chipping Norton: Surrey Beatty & Sons. 2000a. P. 1274–1282. Roček Z., and Rage J.-C. Tertiary Anura of Europe, Africa, Asia, North America, and Australia // Heatwole H., and Carroll R. L., eds. Amphibian Biology. Chipping Norton: Surrey Beatty & Sons. 2000b. P. 1332–1387. Rogulska T. The development of the pelvic girdle of the chick embryo (Gallus domesticus L.) after the extirpation of the posterior limb bud // Zool. Pol. 1965. Vol. 15, N 1. P. 65–76. Romer A. S. The development of tetrapod limb musculature — the thigh of Lacerta // J. Morphol. 1942. Vol. 71. P. 251–298. Romer A. S. Osteology of the Reptilia. Chicago: The University of Chicago Press, 1956. Romer A. S. The appendicular skeleton of the Permian embolomerous amphibian Archeria // Contributions Mus. Paleont. Univ. Michigan. 1957. Vol. 13, N 5. P. 103–159. Ros M. A., Dahn R. D., Fernandez-Teran M., Rashka K., Caruccio N. C., Hasso S. M., Bitgood J. J., Lancman J. J., and Fallon J. F. The chick oligozeugodactyly (ozd) mutant lacks sonic hedgehog function in the limb // Development. 2003. Vol. 130. P. 527–537. Rowe D. A., and Fallon J. F. The proximodistal determination of skeletal parts in the developing chick leg // J. Embryol. exp. Morphol. 1982. Vol. 68. P. 1–7. Sabatier A. Comparaison des ceintures et des membres antérieurs et postérieurs dans la Série des vertébrés. Montpellier: C. Coulet; Paris: Delahaye et Lecrosnier, 1880. 437 p. Saint-Girons H. Comparative data on lepidosaurian reproduction and some time tables // Gans C., and Billett F. A., eds. Biology of the Reptilia. Chichester: John Wiley and Sons, 1985. P. 35-58. Sewertzoff A. N. Studien über die Reduktion der Organe der Wirbeltiere // Zool. Jahrb. (Anat.). 1931. Bd. 53. S. 611–699. Small K. M., and Potter S. S. Homeotic transformations and limb defects in Hox A11 mutant mice // Genes Development. 1993. Vol. 7. P. 2318–2328. Smirnov S. Vol. Paedomorphic origin of the anurans: a new approach to prove it // Russ. J. Herpetol. 1999. Vol. 6. P. 118–124. Smith D. M., and Tabin C. J. BMP signaling specifies the pyloric sphincter // Nature. 1999. Vol. 402. P. 748–749. 114 Smithson T. Anthracosaurs // Heatwole H., and Carroll R. L., eds. Amphibian Biology. Chipping Norton: Surrey Beatty & Sons, 2000. P. 35–58. Spurling R. G. The effect of extirpation of the posterior limb bud on the development of the limb and pelvic girdle in chick embryos // Anat. Rec. 1923. Vol. 26. P. 41–56. Stephenson N. G. The comparative osteology of Australian geckos and its bearing on their morphological status // J. Linn. Soc. — Zool., London. 1960. Vol. 44. P. 278–299. Stokely P. S. Limblessness and correlated changes in the girdles of a comparative morphological series of lizards // Amer. Midl. Natur. 1947. Vol. 38, N 3. P. 725–754. Streicher J., Truong T. P. T., Strauss B., Donat M. A., Waninger W. J., Meng S., and Muller G. B. Pelvis development in R. temporaria: A 4D analysis // J. Morphol. 2001. Vol. 248, N 3. P. 289. Suemori H., and Noguchi S. Hox C cluster genes are dispensable for overall body plan of mouse embryonic development // Dev. Biol. 2000. Vol. 220. P. 333–342. Summerbell D. A quantitative analysis of the effect of excision of the AER from the chick limb-bud // J. Embryol. exp. Morphol. 1974. Vol. 32, N 3. P. 651–660. Summerbell D., and Lewis J. H. Time, place and position value in the chick limb-bud // J. Embryol. exp. Morphol. 1975. Vol. 33, N 3. P. 621–643. Tickle C., and Munsterberg A. Vertebrate limb development — the early stages in chick and mouse // Curr. Opin. Gen. Dev. 2001. Vol. 11. P. 476–481. Thomas K. R., and Capecchi M. Site-directed mutagenesis by gene targeting in mouse embryoderived stem cells // Cell. 1987. Vol. 51. P. 503–512. Tremblay P., Dietrich S., Mericskay M., Schubert F. R., Li Z., and Paulin D. A crucial role for Pax3 in the development of the hypaxial musculature and the long-range migration of muscle precursors // Dev. Biol. 1998. Vol. 203. P. 49–61. Trueb L. Bones, frogs, and evolution // Vial J. L., ed. Evolutionary biology of the anurans. Columbia: University of Missouri Press. 1973. P. 65–132 in: Trueb L. Historical constraints and morphological novelties in the evolution of the skeletal system of pipid frogs (Anura: Pipidae) // Tinsley R. C., and Kobel H. R., eds. The Biology of Xenopus. Oxford: Clarendon Press. 1996. P. 349-377. Trueb L., Pugener L. A., and Maglia A. M. Ontogeny of the bizarre: An osteological description of Pipa pipa (Anura: Pipidae), with an account of skeletal development in the species // J. Morphol. 2000. Vol. 243. P. 75–104. Trumble H. C. The plan of the visceral nerves in the lumbar and sacral outflows of the autonomic nervous system // Brit. J. Surgery. 1934. Vol. 21, N 84. P. 664–676. Ventura J., and Lopez-Fuster M. J. The arterial system of the abdominal viscera and the pelvis of the dormouse, Eliomys quercinus (Gliridae, Rodentia) // Ann. Anat. (Anat. Anz.). 1994. Vol. 176. P. 327–331. Ventura J., Lopez-Fuster M. J., and Gispert E. The abdominal arterial pattern of the northern water vole, Arvicola terrestris (Mammalia, Rodentia) // Zool. Jb. Anat. 1993. Vol. 123. P. 97–102. Ventura J., Lopez-Fuster M. J., and Gispert E. Arterial supply of the pelvic region in the fossorial form of the northern vole, Arvicola terrestris (Mammalia, Rodentia) // Zool. Pol. 1994. Vol. 39, N 1-2. P. 59–68. Wachtler F., Christ B., and Jacob H. J. Grafting experiments on determination and migratory behaviour of presomitic, somitic and somatopleural cells in avian embryos // Anat. Embryol. 1982. Vol. 164. P. 369–378. Wahba G. M., Hostikka S. L., and Carpenter E. M. The paralogous Hox genes Hoxa10 and Hoxd10 interact to pattern the mouse hindlimb peripheral nervous system and skeleton // Dev. Biol. 2001. Vol. 231. P. 87–102. Walker A. D. Evolution of the pelvis in birdstand dinosaurs // Andrews S. M., Miles R. S., and Walker A. D., eds. Problems in Vertebrate Evolution. Linnean Society Symposium Series, No 4. London: Academic Press. 1979. P. 319–357. Wassersug R. J. A procedure for differential staining of cartilage and bone in whole formalin-fixed vertebrates // Stain Techn. 1976. Vol. 51, N 2. P. 131-134. Wassif K., Amer F. I., and Mohammed F. A. The synsacrum, pygostyle and pelvic girdle in some common Egyptian birds // Bull. Zool. Soc. Egypt. 1980. Vol. 30. P. 37–51. Webber R. H. Some variations in the lumbar plexus of nerves in man // Acta Anat. 1961. Vol. 44. P. 336–345. Wellborn V. Comparative osteological examinations of Geckonids, Eublepharids and Uroplatids // Herpetological Translations. 1997. Vol. 1. P. 1–101. Werner Y. L. The ontogenetic development of the vertebrae in some gekkonoid lizards // J. Morphol. 1971. Vol. 133. P. 41–92. 115 Wiedersheim R. Grundriss der vergleichenden Anatomie der Wirbelthiere. Jena: Verlag von Gustav Fischer. 1898. 560 p. Wilting J., Neeff H., and Christ B. Embryonic lymphangiogenesis // Cell Tissue Res. 1999. Vol. 297. P. 1–11. Wilting J., Kurz H., Brand-Saberi B., Steding G., Yang Y.-X., Hasselhorn H. M., Epperlein H. H., and Christ B. Kinetics and differentiation of somite cells forming the vertebral column: studies on human and chick embryos // Anat. Embryol. 1994. Vol. 190. P. 573–581. Wozniak W., and Skowronska U. Comparative anatomy of pelvic plexus in cat, dog, rabbit, macaque and man // Anat. Anz. 1967. Vol. 120. P. 457–473. Xu X., Zhou Z., Wang X., Kuang X., Zhang F., and Du X. Four-winged dinosaurs from China // Nature. 2003. Vol. 421. P. 335–340. Zakany J., and Duboule D. Hox genes and the making of sphincters // Nature. 1999. Vol. 401. P. 761–762. СПИСОК УСЛОВНЫХ ОБОЗНАЧЕНИЙ НА РИСУНКАХ На всех фотографиях фронтальных и парасагиттальных срезов голова эмбриона слева, если не указано иначе. Окраска срезов гематоксилином и эозином, если не указано иначе. ac — arteria caudalis acet — acetabulum ad — aorta dorsalis ah — arteria hypogastrica ai — arteria ischiadica ai — arteria ischiadica aic — arteria iliaca communis aie — arteria iliaca externa aii — arteria iliaca interna aoi — ala ossis ilii apo — ala postacetabularis ilii apr — ala preacetabularis ilii cdl — crista dorsolateralis cf — capitulum femoris ci — crista iliaca cid — crista iliaca dorsalis coi — corpus ossis ilii eis — epiischium ep — epipubis f — femur fa — foramen acetabuli fac — foramen acetabuli fii — foramen ilioischiadicum fip — fenestra ischiopubica fob — foramen obturator his — hypoischium i — ilium is — ischium lis — lamina ischiadica; mtp — musculus transversus pubis no — nervus obturatorius nt — nervus tibialis p — pubis pc — processus cranialis pife — musculus pubo-ischio-femoralis externus pifi — musculus pubo-ischio-femoralis internus pls — plexus sacralis ppp — processus pectinealis pubicus prob — processus obturatoris t — tibia ti — tuber ilii tp — tuber pubicus vc — vena caudalis vcp — vena cava posterior а — аллантоис; зп — зачаток пояса зф — золотая фольга к — кишка кд — крестцовый диапофиз кз — крестцовая зона кл — клоака клз — клоакальная зона км, км1, км2 . . . — крестцовые миомеры кнд, кнд1, кнд2 . . . — крестцовые невральные дуги ко — крестцовое окно кп, кп1, кп2 . . . — крестцовые позвонки кр, кр1, кр2 . . . — крестцовые ребра лп — лимфатический проток лс — лимфатическое сердце мн — метанефрос нг — нервный (спинномозговой) ганглий нд — невральная дуга нт — нервная трубка пкм — предкрестцовый миомер пм — поясничный миомер пт — полость тела сн — спинномозговой нерв х — хорда хм — хвостовой миомер хп — хвостовая почка шк — шванновские клетки. 117 ПОДПИСИ К РИСУНКАМ Рис. 1. Схемы операций на куриных эмбрионах. а — удаление почки задней конечности; б — удаление боковой пластинки; в — удаление эктодермы боковой пластинки и замещение ее золотой фольгой; г — удаление серии крестцовых сомитов. Scheme of operations on the chick embryos. а — hind limb bud ablation; б — lateral plate ablation; в — ablation of the ectoderm over the lateral plate mesoderm; г — ablation of a series of sacral somites. Рис. 2. Последовательные стадии операции по удалению эктодермы боковой пластинки. а — произведены разрезы по трем сторонам прямоугольного лоскута эктодермы, предполагаемого к удалению; б — призведены все четыре разреза; в — эктодерма удалена; г — удаленный пласт эктодермы заменен листом золотой фольги. Эмбрион подкрашен нильским голубым для лучшей визуализации тканей и органов. Стрелки указывают на правый 25-й сомит. Consequtive stages of the operation with ectoderm removal over the lateral plate mesoderm. а — three cuts have been made along the sides of the rectangular ectoderm area presumed for ablation; б — all four cuts have been made; в — ectoderm is removed; г — the hole in the ectoderm is filled in with the gold foil of appropriate size. The embryo was counterstained with the Nill blue for better visualization of tissues. Arrows point to the right 25th somite. Рис. 3. Схема операции по трансплантации серии крестцовых дермамиотомов (верхних половин эпителизованных сомитов) от перепела (справа) — к курице (слева). The scheme of transplantation of a series of sacral dermomyotomes (upper halves of the epithelialized somites) from quail (right) to chick (left) embryos. Рис. 4. Представления о составе сложного крестца птиц по данным разных авторов. а — Du Toit, 1913; Nickel et al., 1977; б — Wassif et al., 1980; в — Селянский, 1968; г — Burke et al., 1995; д — Гуртовой, Дзержинский, 1992; е — Baumel et al., 1979. Зеленые квадраты — грудные позвонки, желтые — поясничные, желто-серые — пояснично-крестцовые, белые — крестцовые, синие — хвостовые. Chick synsacrum composition in terms of different authors. а — Du Toit, 1913; Nickel et al., 1977; б — Wassif et al., 1980; в — Seljansky, 1968; г — Burke et al., 1995; д — Gurtovoj, Dzerzhinsky, 1992; е — Baumel et al., 1979. Green boxes — thoracic, yellow — lumbar, yellowishgrey — lumbo-sacral, white — sacral, blue — caudal vertebrae. Рис. 5. Тотальные ализариновые препараты молодых L. agilis (a) и взрослых Z. vivipara (б ), L. agilis (в), D. saxicola (г). Вид сверху (а, б ) и снизу (в, г). а — показаны отдельные центры окостенения в первой паре крестцовых ребер; б — аномальная особь с асимметричным крестцом; в, г — дополнительные окостенения в нижней части таза: у L. agilis нет epipubis, остальные кальцинированные хрящи короткие по сравнению с D. saxicola. 118 Alizarin whole-mounts of juvenile L. agilis (a) and adult Z. vivipara (б ), L. agilis (в), D. saxicola (г). View from above at а, б, veiw from bottom at в, г. а — Separate centers of ossification in the first pair of the sacral ribs; б — anomalous specimen with the asymmetric sacrum; в, г — additional elements in the lower part of the pelvic girdle: no epipubis in L. agilis, other calcified cartilaginous elements are shorter if compared to D. saxicola. Рис. 6. Фронтальный срез аномального эмбриона Z. vivipara перед вылуплением с дополнительным крестцовым ребром на одной стороне тела. Второе крестцовое ребро — самое крупное. Лимфатическое сердце не изменило своего положения, тогда как лимфатические протоки смещены на один сегмент назад. Frontal view into the embryo of Z. vivipara before hatching with additional sacral rib at the left side of the body. The second sacral rib is the biggest one. The position of the lymphatic heart on the side of the anomaly is not changed, while the lymphatic affluents are displaced one segment caudad. Рис. 7. Строение крестца и таза птиц. а, в — G. domesticus, б — T. pilaris. Вид снизу (а, б ) и сбоку (в). The structure of the bird sacrum and pelvis. а, в — G. domesticus, б — T. pilaris. View from bottom (а, б ) and laterally (в). Рис. 8. Крестец (а) и таз (б ) молодой крысы, сухой скелет. 1–4 — крестцовые позвонки. Sacrum (а) and pelvis (б ) of a young rat, dry skeleton. 1 to 4 show corresponding sacral vertebrae. Рис. 9. Маркёры крестцовых сегментов L. agilis. Парасагиттальные срезы эмбрионов на стадиях 31 (а) и 32–33 (б ). Крестец маркируют аллантоисная артерия (здесь — a. iliaca interna), место сужения аорты в хвостовую артерию, клоака и лимфатическое сердце (в плоскость срезов не попало). Под клоакой — место расположения будущего симфиза ischium (∗∗∗ ). Markers of sacral segments in L. agilis. Parasagittal sections through the embryos at stages 31 (а) and 32–33 (б ). The sacrum is marked by: the allantoic artery (here — a. iliaca interna), the place of aortic narrowing in the passage to caudal artery, the cloaca and the paired pelvical lymphatic heart (not in the section plane). The position of the prospective place of ischiadic symphisis is marked by asterisks (∗∗∗ ). Рис. 10. Маркёрные структуры крестца крысы. Парасагиттальные (а, в) и поперечный (б ) срезы на стадиях 17–18. Marker structures of the rat sacrum. Parasgittal (а, в) and transverse (б ) sections at stages 17–18. Рис. 11. Маркёры крестцовой области позвоночника птиц. Фронтальный (а) и парасагиттальные срезы эмбрионов G. domesticus (б, в, е) и C. japonicus (г); тройная окраска хрящей, костей и нервов — тотальный препарат без удаления кровеносных сосудов (д ). 119 Markers of the sacral zone in the bird vertebral column. Frontal (а) and parasagittal sections through embryos of G. domesticus (б, в, е) and C. japonicus (г); triple alizarine-alcian-sudan staining for cartilage, bone and nerves — whole-mount preparation of the eviscerated chick, big blood vessels were not removed (д ). Рис. 12. Маркёры крестцовой области позвоночника у T. pilaris. а — левая аллантоисная (здесь — a. ischiadica) артерия по диаметру больше правой; б, в — лимфатическое сердце расположено в первом хвостовом сегменте сзади и латеральнее окончания ilium и позади ответвления от аорты внутренней подвздошной артерии, a. iliaca interna. Markers of the sacral zone of the vertebral column in T. pilaris. а — the left allantoic artery (here — a. ischiadica) has a greater diameter than the right one. б, в — the lymphatic heart is in the first caudal segment, caudad and laterally to the end of the ilium, and caudad to the branching of the a. iliaca interna from the dorsal aorta. Рис. 13. Крестцово-клоакальная область у чешуйчатых рептилий. Схема отношений крестца, лимфатического сердца и ilium (по: Gasc et al., 1975 с изменениями). Sacro-cloacal zone in squamate reptiles. The scheme illustrating the relationship between the sacrum, lymphatic heart and the ilium. After Gasc et al., 1975 with changes. Рис. 14. Положение зон экспрессии Hox -генов относительно позвонков у мыши, курицы и шпорцевой лягушки. Мышь и лягушка использовались в качестве эталонов для определения положения крестца в synsacrum курицы. Квадраты с номерами — позвонки: зеленые — грудные, красные — поясничные, желтые — крестцовые, голубые — хвостовые или уростиль. Зоны экспрессии Hox -генов даны по разным источникам: зеленый цвет — Favier et al., 1996, Fromental-Ramain et al., 1996; красный — Burke et al., 1995; синий — Kessel and Gruss, 1991 и цит. в этой работе статьи; голубой — Yamamoto et al., 1998; желтый — Gerard et al., 1996 для Hoxd10 и Hoxd11, Small and Potter, 1993 для Hoxa11 ; фиолетовый — Lombardo and Slack, 2001. Более тонкая линия означает проходящую слабую экспрессию. Zones of expression of Hox -genes in relation to the prospective vertebrae in the mouse, chick and Xenopus. The mouse and the frog were used as models to define the sacral zone position within the chick synsacrum. Boxes with numbers are vertebrae: green — thoracic, red — lumbar, yellow — sacral, blue — caudal and the urostyle. Zones of expression of Hox -genes were collected from the following sources: green zones — after Favier et al., 1996, Fromental-Ramain et al., 1996; red — Burke et al., 1995; deep blue — Kessel and Gruss, 1991 and references therein; blue — Yamamoto et al., 1998; yellow — Gerard et al., 1996 for Hoxd10 and Hoxd11, Small and Potter, 1993 for Hoxa11 ; violet — Lombardo and Slack, 2001. Thinner line means transient weak expression. Рис. 15. Положение морфологических и генетических маркёров крестца относительно synsacrum птиц. Показаны передние границы зон экспрессии Hox–генов, границы synsacrum, нервных сплетений, положение мест ответвления магистральных артерий тазовой области от аорты, положение лимфатического сердца, а также предположительные границы крестца, зон поясничных и грудных позвонков. Обозначения позвонков по Boas, 1933. The position of morphological and genetic markers of the sacrum in relation to the bird synsacrum. The cranial borders of expression of Hox -genes, borders of the synsacrum, nerve plexuses, places of branching of the magistral arteries in the pelvic region, the position of the lymphatic heart, as well as suggested borders of the bird sacrum, zones of the lumbar and thoracic vertebrae are shown. Vertebrae are numbered following Boas (1933). 120 Рис. 16. Соответствие крестцовых отделов позвоночника тетрапод, выявленное с помощью ряда морфологических маркёров — положения парных тазовых лимфатических сердец (овалы); положения arteria iliaca communis и ее гомологов (горизонтальные отрезки; аллантоисная артерия выделена толстой линией); положения выходов спинномозговых нервов, входящих в plexus sacralis (наклонные отрезки). Прямые сплошные линии соединяют передние и задние границы крестцовых зон, пунктирная линия обозначает приблизительную границу передне-крестцовой и задне-крестцовой зон. Буквы и цифры вдоль схематического изображения позвоночника птиц обозначают позвонки трех различных морфологических серий в составе synsacrum. Фигурная скобка показывает положение так называемых «истинно-крестцовых» позвонков, которые в настоящей работе рассматриваются как позвонки задне-крестцовой серии, не гомологичные двум позвонкам примитивного крестца. Передние позвонки synsacrum крестцовыми не являются. Correspondence of sacral regions in the vertebral column of tetrapod animals, revealed with the help of morphological markers — paired pelvical lymphatic heart (ovals); branching of the a. iliaca communis and its homologues (horizontal lines; the allantoic artery is shown by the thick lines); the position of the spinal nerves of the plexus sacralis (inclined lines). The strait filled lines connect the cranial and caudal borders of the sacral zones in different animals, the dashed line corresponds to the approximate border between the fore- and the hind sacral zone in the chick (homologues of the first and the second sacral vertebrae in the basal two-vertebrae sacrum). Letters and numbers along the schematic vertebral column of birds correspond to the vertebrae of three different morphological series within the synsacrum. The brace shows the position of the so-called «primary or true sacral» vertebrae, which are considered in this work simply as some vertebrae of the hind-sacral zone in the synsacrum not homologous to the two vertebrae of the primitive sacrum. The most cranial vertebrae of the synsacrum are not sacral. There are no caudal vertebrae within the synsacrum. Рис. 17. Образование крестцового окна у L. agilis. а, б — на стадиях 31–32 в районе первой крестцовой миосепты накапливается мезенхима на месте гипаксиальных частей первого и второго крестцовых миомеров; в — крестцовое окно на стадии 32 увеличилось, мезенхимные клетки, наполняющие его, выделяются на общем фоне окружающей мезенхимы; г — на стадии 34 в зоне крестцового окна видны крестцовые ребра и ilium, также показана сохранившаяся часть второго крестцового миомера. а — фронтальный срез, б–г — парасагиттальные срезы. The formation of the sacral gap in myomeres in L. agilis. а, б — the mesenchymal cells concentrate at the place of hypaxial parts of the first and the second sacral myomeres in the region of the first sacral myoseptum at stages 31–32; в — sacral gap is increased in size at stage 32, the mesenchymal cells of the sacral gap look differently from the surrounding mesenchyme; г — sacral ribs and the ilium intrude into the zone of the sacral gap at stage 34, a part of the second sacral myomere persists at this stage as well. а — frontal section, б–г — parasagittal sections. Рис. 18. Закладка пояса у L. agilis на стадии 32 (а) — мезенхима крестцового окна не имеет четкой границы с мезенхимой почки конечности. Развитие крестца и таза у веретеницы, A. fragilis: б, г — сагиттальные срезы; в, д — фронтальные срезы на стадиях 32 (б), 33 (в) и 36 (г, д ). Крестцовое окно ограничено сильно скошенным первым крестцовым миомером кранио-латерально и лимфатическим сердцем каудально. Единственное крестцовое ребро растет в крестцовом окне. е — парасагиттальный срез через клоакальную область эмбриона гадюки, Vipera berus на стадии 36. Early girdle formation in L. agilis at stage 32 (а) — the mesenchyme of the sacral gap is not separated from the limb bud mesenchyme. Development of the sacrum and pelvis in the Slow-worm, A. fragilis: б, г — sagittal sections; в, д — frontal sections at stages 32 (б ), 33 (в) and 36 (г, д ). The sacral gap is bounded by the oblique first sacral myomere cranio-laterally and the lymphatic heart caudally. The only sacral rib grows within the sacral gap. е — A parasagittal section through the cloacal region of the adder embryo, Vipera berus at stage 36. 121 Рис. 19. Формирование крестцового окна у курицы. а — сагиттальный срез на стадии 26 — все туловищные миомеры одинаковые; окраска антителами к α-десмину; б, в — фронтальные срезы на стадиях 28–29, на б — голова вверху — при приближении к крестцовому окну миомеры истончаются медио-латерально, напротив будущего крестца гипаксиальные мышцы отсутствуют; г — парасагиттальный срез на стадии 30 — сформировано крестцовое окно в миомерах, у крестцовых миомеров отсутствуют гипаксиальные части, их место занимает мезенхима крестцового окна, в котором развивается ilium. Белые линии обозначают границы миомеров. Sacral gap formation in the chick. а — a parasagittal section at stage 26 — all the trunk myomeres are equal in size; anti-α-desmin antibodies staining; б, в — frontal sections at stages 28–29; in б — the head is above — by approaching the sacral gap the myomeres are becoming thinner medio-laterally, there are no muscles opposite the future sacrum; г — a parasagittal section at stage 30 — the sacral gap in the myomeres is formed, there are no hypaxial parts of the sacral myomeres, there place is occupied with the mesenchymal cells of the sacral gap, where ilium is developing. White lines mark the borders of the myomeres. Рис. 20. Крестцовое окно у G. domesticus. На поперечных срезах через грудную (а), крестцовую (б ) и хвостовую (в) области показана степень развития мускулатуры; в крестцовой области гипаксиальная мускулатура отсутствует. Черная двухголовчатая стрелка показывает дорсо-вентральную протяженность миомера, белая линия — условную границу между гипаксиальной и эпаксиальной мускулатурой. The sacral gap in G. domesticus. On transverse sections through the thoracic (а), sacral (б ) and caudal (в) regions the different extent of development of the musculature is shown; note the lack of the hypaxial muscles in the sacral region. The black two-head arrow shows the dorso-ventral length of the myomere, the white line — the relative border between the hypaxial and the epaxial muscles. Рис. 21. Формирование крестцового окна и ранняя закладка пояса у крысы. Парасагиттальные срезы на стадиях 18 (а), 19 (б ) и 17 (в). The formation of the sacral gap and the early development of the pelvic girdle in rat. Parasagittal sections at stages 18 (а), 19 (б ) and 17 (в). Рис. 22. Развитие крестцово-подвздошного комплекса у L. agilis. а — на стадии 32/33 имеются самостоятельные закладки крестцовых ребер; б — на стадии 35 видно отношение крестцовых ребер, крестцового окна и ilium, срез прошел через границу первого и второго крестцовых сегментов — задний край первого крестцового ребра налегает на передний край второго; в — хрящевое первое крестцовое ребро четко отделено от невральной дуги даже на стадии 36; г — на этой же стадии между дистальными краями крестцовых ребер виден мезенхимный «мостик» (показан тремя короткими стрелками), прерываемый снизу лимфатическим протоком; контакта с ilium нет. Фронтальные (а) и поперечные (б, в и г) срезы. Development of the sacro-iliac complex in L. agilis. а — the separate cartilaginous anlagen of the sacral ribs are formed at stages 32–33. б — the relationship between the sacral ribs, sacral gap and ilium are shown at stage 35, the section through the border of the first and the second sacral segments — the caudal edge of first sacral rib overlap the cranial edge of the second one; в — the cartilaginous frist sacral rib is clearly separated from the corresponding neural arch even at stage 36. г — There is a mesenchimal «bridge» (shown by three short arrows), interrupted by a lymphatic affluent from below, is clearly seen at this stage between the distal edges of the ipsilateral sacral ribs; there are no contact between the ilium and the ribs. Frontal (а) and transverse (б, в and г) sections. Рис. 23. Рост хрящевых элементов нижней части таза у L. agilis. а, б — отношение таза и полости тела на стадии 34, парасагиттальные срезы; б — показаны проекции acetabulum (черная звездочка), симфизов и направлений роста pubes и ischia (соответственно слева направо — светлые звездочки и стрелки); в — район симфизов на стадии 35, окраска азаном; г — поперечный срез каудальнее симфиза pubes, стадия 38, стрелки показывают продольный коллагеновый тяж. 122 Growth of the cartilaginous elements in the ventral part of the pelvis in L. agilis. а, б — the relationship between the pelvis and the visceral cavity at stage 34, parasagittal sections; б — the projection of the acetabulum (filled asterisk), symphyses and the directions of pubes and ischia growth (correspondingly from left to right — empty asterisks and arrows) to the parasagittal plane are shown); в — the region of symphyses at stage 35, azan staining; г — a transverse section caudad to the pubic symphysis, stage 38, arrows point to the longitudinal callagenous fibers at the ventral midline of the embryo. Рис. 24. Окостенение таза у L. agilis на стадиях 38–39. а — ilium покрыт мощной костной манжеткой и отслаивается от окружающих тканей, в том числе — молодого хряща дистальных концов крестцовых ребер; б — pubis гораздо более зрелый, чем ischium, в котором еще не наблюдается признаков начала костеобразования. Фронтальный (а) и парасагиттальный (б ) срезы. Pelvis ossification in L. agilis at stages 38–39. а — Ilium is covered with the thick membrane bone and defoliate from the surrounding tissues in sections, note gaps between the ilium and the early cartilage of the distal ends of sacral ribs; б — pubic cartilage is much more mature than that of the ischium, where no any track of osteogenesis is observed. Frontal (а) and parasagittal (б ) sections. Рис. 25. Ранний зачаток таза курицы (а) лежит у задней стенки полости тела и ограничен спереди и сзади нервами крестцового сплетения; б — просветленный тотальный препарат на стадии 36, окраска альциановым синим — показаны закладки крестцовых ребер и отростков; фронтальный (в) и парасагиттальный (г) срезы в области позвонков «латинской» серии — на месте парапофизов развиты крупные спинномозговые ганглии. The early chick pelvis (а) anlage lies close to the hind wall of the visceral cavity and bounded frontally and caudally by the nerves of the sacral plexus. б — Whole-mount alcian blue preparation of the embryo at stage 36 — anlagen of the sacral ribs and transverse processes are shown at frontal (в) and parasagittal (г) sections through the region of the vertebrae of «Latin» series — note large spinal ganglia at the place where in other regions of the synsacrum parapophyses develop (there are no parapohyses in «Latin» series of synsacral vertebrae). Рис. 26. Развитие хрящевого ilium курицы — альциановые препараты. Красными двунаправленными стрелками показана длина подвздошного элемента. На стадии 32 дано сравнение степени развитости ilium у курицы и перепела. Cartilaginous chick ilium development — alcian blue whole-mount preparations. Red two-headed arrows show the length of the ilium. A comparison of the extent of ilium development in chick and quail is given for stage 32. Рис. 27. Ранние стадии развития хрящевого pubis и его положение относительно полости тела у эмбриона курицы на стадиях 28 (а), 29 (б ), 30 (в, г) — парасагиттальные срезы. Early stages of cartilaginous pubis development and its relation to the visceral cavity in chick embryos at stages 28 (а), 29 (б ), 30 (в, г) — parasagittal sections. Рис. 28. Поздние стадии роста pubis (стадия 34) у эмбриона курицы. Все три элемента таза растут в ограниченном пространстве между задней стенкой полости тела и загибом каудальной части эмбриона курицы. Красными стрелками показаны направления роста элементов таза от acetabulum (проекция acetabulum показана красной звездочкой). Окраска альциановым синим и антителами к десмину, парасагиттальные срезы. 123 Late stages of pubis outgrowth (stage 34) in the chick embryo. All the three pelvic elements grow in the limited space between the caudal wall of the visceral cavity and the caudal end of the trunk. Red arrows show the directions of growth of the pelvic elements starting from acetabulum (acetabulum projection to the parasagittal plane is shown with the red asterisk). Staining with alcian blue and antiα-desmin antibodies on parasagittal sections. Рис. 29. Pubis и ischium. а — положение элементов нижней части таза по отношению к полости тела, фронтальный срез эмбриона курицы на стадии 31/32; б — различная степень дифференцировки pubis и ischium у перепела, парасагиттальный срез на стадии 36. Pubis и ischium. а — the position of the elements of the ventral part of the chick pelvis in relation to the visceral cavity, frontal section through an embryo at stage 31–32; б — difference in the maturation rate of pubis and ischium in quail, a parasagittal section at stage 36. Рис. 30. Нервные ганглии при позвонках «латинской» серии T. pilaris (а), слияние ткани двух средних ганглиев (б ); фронтальные срезы. Neural ganglia near to vertebrae of the «Latin» series in T. pilaris (а), fused two middle ganglia in the region (б ); frontal sections. Рис. 31. Развитие крестцово-подвздошного комплекса крысы. Парасагиттальные (а, б ) и поперечный (в) срезы на стадиях 18 (а) и 20 (б, в). Development of the sacro-iliac complex in rat. Parasagittal (а, б ) and transverse (в) sections at stages 18 (а) and 20 (б, в). Рис. 32. Развитие нижней части таза крысы. а–в — парасагиттальные срезы на стадиях 17/18 (а), 18 (б ), 19 (в); г, д — фронтальные срезы на стадиях 19 (г) и 21 (д ). Pubis и ischium развиваются в замкнутом обширной брюшной полостью и окончанием эмбриона пространстве, образуя общее сращение раньше симфиза, таз при этом принимает опистопубическую форму. Development of the ventral part of the pelvis in rat. а–в — parasagittal sections at stages 17–18 (а), 18 (б ), 19 (в); г, д — frontal sections at stages 19 (г) and 21 (д ). Pubis and ischium develop in the limited space between the visceral cavity and the end of the trunk of the embryo, forming ipsilateral fusion before the symphyses between the contralateral counterparts, forming the opisthopubic pelvis. Рис. 33. Окостенение крестцово-тазового комплекса у крысы. Тотальные альциановые и ализариновые препараты новорожденного крысенка. а — вид снизу; б — вид сбоку. Ossification of the sacro-pelvic complex in rat. Whole-mount alcian blue and alizarin red preparations of the rat pups. а — bottom view; б — lateral view. 124 Рис. 34. Реконструкции соотношения полости тела и скелета у ящеротазовых (a) и птицетазовых (б, в) динозавров. а — Ornithomimus sp. обладал трехлучевым тазом с pubis, направленным вперед. Полость тела сравнительно небольшая и дальше симфиза pubes не распространяется. Ботинок формируется в углу между полостью тела, покровами и соединительной тканью между pubes и ischia; б — Hypsilophodon foxi c опистопубическим тазом обладал огромной полостью тела; в — Anatosaurus annectens показан в беге. На самом деле полость тела могла быть и большей, чем на реконструкции, что, возможно, не способствовало такому типу локомоции. Reconstruction of the relationship between the visceral cavity and the pelvis in saurischian (a) and ornithischian (б, в) dinosaurs. а — Ornithomimus sp. posessed triradial pelvis with the cranially directed pubis. The visceral cavity is relatively small and does not distribute caudad the pubic symphysis. The boot forms in the corner between the caudal wall of the visceral cavity, ventral body wall and the connective tissue between the bubes and ischia; б — Hypsilophodon foxi with the opisthopubic pelvis posessed very large visceral cavity; в — Anatosaurus annectens running. The actual size of the visceral cavity could be much greater, than the figure shows; this may not favor such a type of locomotion. Рис. 35. Результаты ампутации почки задней конечности у эмбриона курицы на стадии 17. а, в, г — тотальные альциановые препараты, красные стрелки указывают протяженность ilium на контрольной и оперированной сторонах; на в и г отсутствует проксимальная часть pubis; б — фронтальный срез тазовой области; д–з — поперечные срезы оперированного эмбриона на уровне позвонков d, g, a, 4. Стрелки указывают различия между оперированной (слева) и контрольной (справа) сторонами. Окраска срезов альцианом и антителами к десмину. Results of hind limb bud ablation in chick embryos at stage 17. а, в, г — whole-mount alcian blue preparations, red arrows show the length of the ilium on the control and the operation sides; at в and г the proximal part of the pubis is absent; б — a frontal section through the pelvic region; д–з — transverse sections of the operated embryo at the level of vertebrae d, g, a, 4 correspondingly. Arrows point to the differences between the operated (left) and the control (right) sides. Alcian and anti-αdesmin antibodies staining. Рис. 36. Результаты удаления эктодермы боковой пластинки у эмбриона курицы. Фронтальный (а) и поперечные (б–г, ж) срезы оперированных эмбрионов на стадиях 17 (а), 16 (б–г; срезы одного и того же эмбриона впереди, на уровне и позади acetabulum) и 12 (ж); д, е — тотальные альциановые препараты эмбрионов, оперированных на стадиях 15 и 14. Черно-белые стрелки показывают некоторые различия между сторонами. На поперечных срезах оперированная сторона слева, на остальных фотографиях — сверху. Results of ablation of the ectoderm over the lateral plate mesoderm in chick embryos. Frontal (а) and transverse (б–г, ж) sections through the embryos operated at stages 17 (а), 16 (б–г; sections through one and the same embryo craniad, at the level of, and caudad to the acetabulum correspondingly) and stage 12 (ж). д, е — whole-mount alcian blue preparations of the embryos operated at stages 15 and 14. Black-and-white arrows show some differences between the sides. At the transverse sections the operated side is on the left, at the rest of the figures the operated side is above. Рис. 37. Результаты удаления боковой пластинки. Ilium сохраняется. Окраска альциановым синим и антителами к десмину. Поперечные срезы — оперированная сторона слева. Results of the lateral plate ablation. Ilium persists. Staining as on Fig. 35. Transverse sections, the operated side is on the left. 125 Рис. 38. Результаты удаления серии крестцовых сомитов. а, б — фронтальные срезы на разных уровнях одного эмбриона, голова вверху, оперированная сторона справа; г — тот же, в — другой эмбрион, увеличено, фронтальные срезы. Черно-белые стрелки показывают на аномалии ilium, красные — на дополнительные поперечные отростки. Обращают на себя внимание уменьшенные ганглии на оперированной стороне. д — Результат полного удаления сомитов — отсутствуют две невральные дуги, уменьшены ганглии на оперированной стороне (показано красными стрелками), ilium при этом нормальный. Окраска альциановым синим и антителами к десмину. Results of the partial ablation of a series of sacral somites. а, б — frontal sections at different levels through the same embryo, the head is above, the operated side is on the right; г — the same, and в — another embryo enlarged, frontal sections. Black-and-white arrows show the anomalies of the ilium, red arrows point to the additional transverse processes of the sacrum. Note the diminished spinal ganglia at the operated side. д — The result of the full somitic ablation — two neural arches are absent, spinal ganglia are diminished at the operated side (shown by the red arrows), the ilium is normal. Staining as on Fig 35. Рис. 39. Результаты пересадки дермамиотомов от перепела к курице на стадиях 16 (а–г) и 18 (д–ж). а, в — окраска антителами к десмину и альцианами; в, г — окраска по Фёльгену; д–ж — окраска антителами к антигенам перепела (голубые ядра) и к десмину (красные ядра). Оперированная сторона слева, красные прямоугольники на а и в — зоны, показанные увеличенно при другой окраске на б и г (см. Материал и Методика). Красные стрелки указывают на глыбки гетерохроматина в ядрах перепела. ж — район коленного сустава. Results of dermomyotome transplantation from quail to chick embryos at stage 16 (а–г) and stage 18 (д–ж). а, в — alcian green, alcian blue and anti-α-desmin antibodies staining; в, г — Foelgen staining, д–ж — staing with anti-quail antibodies (cells with blue nuclei) and anti-α-desmin antibodies (cells with red nuclei normally counterstained with neutral red). The operated side is on the left, red rectangulars at а and в are zones shown enlarged at б and г (see Materials and Methods). Red arrows point to the heterochromatin in quail nuclei. ж — knee joint region as a control of staining. Научное издание Егор Борисович Малашичев СТРОЕНИЕ И РАЗВИТИЕ КРЕСТЦОВО-ТАЗОВОГО КОМПЛЕКСА АМНИОТ Редактор И. Ю. Попов Обложка художника Е. А. Соловьевой Верстка Е. М. Воронковой Лицензия ИД № 05679 от 24.08.2001 Подписано в печать 00.00.2006. Формат 70×100 1 /16 . Бумага офсетная. Печать офсетная. Усл. печ. л. 00,00. Заказ № Издательство СПбГУ. 199004, С.-Петербург, В.О., 6-я линия, 11/21 Тел. (812) 328-96-17; факс (812) 328-44-22 E-mail: editor@unipress.ru www.unipress.ru По вопросам реализации обращаться по адресу: С.-Петербург, 6-я линия В. О., д. 11/21, к. 21 Телефоны: 328-77-63, 325-31-76 E-mail: post@unipress.ru Типография Издательства СПбГУ. 199061, С.-Петербург, Средний пр., 41 "Structure and development of the sacro-pelvic complex in Amniota" by Yegor B. Malashichev Since the first tetrapodes conquered the Earth the sacro-pelvic skeletal complex evolved and reached great structural variety in amniots. It is as simple as one can find in legless lizards or snakes with vestigial or no limbs (no sacro-pelvic complex in the latter case) on the one hand and as complicated as in dinosaurs or modern birds on the other. Studying this fascinating diversity of structures and developmental processes using a comparative approach supported by experimental invasive techniques applied to avian species reveals some developmental mechanisms involved in formation and evolution of this part of the postcranial skeleton. Chapter 1. Materials and Methods. The subjects for the comparative study included Lacerta agilis, Zootoca vivipara, Podarcis muralis, Darevskiya saxicola (Lacertidae, Squamata, Reptilia); Anguis fragilis (Anguidae, Squamata, Reptilia), Vipera berus (Viperidae, Squamata, Reptilia); Gallus domesticus, Coturnix japonicus (Galliformes, Aves); Turdus pilaris (Passeriformes, Aves); Rattus norvegicus (Muridae, Rodentia, Mammalia). In this work comparisons both between the closely related species of squamate reptiles and between the species of three major clades of modern amniotes are used. Embryos were classified by stages according to tables of normal development of Z. vivipara (Dufaure and Hubert, 1961); V. aspis (Hubert and Dufaure, 1968); G. domesticus (Hamburger and Hamilton, 1951); R. norvegicus (Dyban et al., 1975). Chick embryo manipulations for in ovo surgery were made according to techniques described in Ordahl and Christ (1998). The following operations were performed: hind limb bud ablation at stages 17–19 HH, removal of the lateral plate at the hind limb bud level at stage 17, removal of the ectoderm over the lateral plate mesoderm at the hind limb bud level at stages 12–16, removal of a series of sacral somites at stage 17, and quail-to-chick transplantation of 2 somites 26–32 at stages 17–19. Operations were made on the right side of the embryo. The embryos were cut serially in three projections and stained by different histological and immunohistochemical techniques on slides or in whole-mounts. Embryos of all the available ages from the early hind limb bud stage until hatching or birth were used. Paraffin sections were usually stained with hematoxylin-eosinalcian blue or anti-α-desmin antibodies, alcian blue and nuclear red. Chimerical embryos were stained after Fölgen and hematoxilin-alcian blue-alcian green in parallel sections, or with anti-quail-antibodies, anti-α-desmin antibodies, and nuclear red. Whole-mount praparations were made according to several techniques (Wassersug, 1976; Kessel and Gruss, 1991; Kant and Goldstein, 1999; Bauer, 1986) with alcian blue, alizarin red and sudan black to visualize cartilage, bone and nerves. Comparative collections of embryos, adults and histological sections stored at the Department of Vertebrate Zoology, St. Petersburg State University were used in addition to the author’s materials. Experiments were made in the Institute of Anatomy, Freiburg University, Germany. Chapter 2. Structure of the sacro-pelvic skeletal complex. In the first section of this Chapter a concise summary of the structural diversity of sacrum and pelvic girdle in vertebrates from Sarcopterygii and early extinct tetrapods to modern birds and mammals is given and evolutionary changes in the sacro-pelvic skeletal complex are briefly discussed. Initially, the pelvic girdle constituted of a single plate without apparent connection to the vertebral column. Late Devonian tetrapodes were the first, in which the direct connection of the vertical ala ilium to at least one sacral rib has been established, while the caudal process, which anchored the pelvis in the tail musculature, still preserved in a few groups, but decreased in size gradually. In Ichthyostegidae, the pubic part of the girdle did not ossify, as also it did not in some anthracosaures and modern anurans. In the later two groups the cartilaginous pubis might be considered as a juvenile characteristic as a result of paedomorphosis. 3 In reptiles the ilium increased in size and its wings stretched along the vertebral column. The number of sacral vertebrae increased, as well, first to two and later to a half a dozen or more vertebrae in Archosauria. A rule can be deduced that the direction (cranial or caudal) of the ilium corresponds to the side, where more vertebrae are recruited to form the sacrum, but the process of inclusion of more vertebrae to the sacrum was initiated in the caudal direction and only later involved presacral segments. The sacral vertebrae of reptiles possess specialized sacral ribs to form a sacro-pelvic joint. The presence of sacral ribs was, however, questioned sometimes at least for Lacertilia. Two different modes of evolutionary reduction of limb and girdle skeleton exist. Squamate reptiles loose their free limbs and distal limb skeleton first, then the reduction involves more proximal elements, the lower part of the girdles (pubis and ischium), with the ilium being the most stable element in evolution and undergoing less reduction. Contrary to squamates, ichthyosaurs reduce the ilio-sacral joint and the ilium first, while the distal limb skeleton and the lower part of the pelvis usually preserves. In dinosaurs and birds two general patterns of the pelvic bones can be found–the prepubic and the opistopubic. In the first case, like in most Saurischia, the pubic bone is directed cranially, like in other reptiles, while in the second case, like in Ornitischia, some advanced Saurischia and birds, the pubic bones turn caudad along the ischia and sometimes develop additional praepubic processes directed craniad. Several hypotheses on the mechanisms of this evolutionary change are discussed. Similarly, about six different views existing on the homology of vertebrae composing the synsacrum of birds and their ancestors are considered. The structure of the sacro-pelvic skeletal complex in the line leading to modern mammals is briefly discussed. Special attention is given to marsupial bones, opistopubic condition in the lower part of the girdle, and a unique ischiosacral connection in Xenarthra. 4 In the second part of Chapter 2, the structure of the sacrum and pelvis in the subjects of the current work is described in more details. For more data on lacertilian sacro-pelvic joint see Raynaud et al., 1975, Malashichev, 2001. The synsacrum of birds (Gallus, Coturnix, and Turdus) is described according to the scheme by Boas (1933). According to this nomenclature, the first four vertebrae (the last thoracic one and synsacro-lumbars) are named α to δ, the rest of the synsacral vertebrae are divided into two groups, the cranial group without parapophises is marked with the arabic numerals, the caudal group (with both parapophises and diapophises) is marked with Latin letters. These three groups of synsacral vertebrae are named here “Greek”, “Arabic”, and “Latin” series of vertebrae correspondingly. Chapter 3. Markers of the sacral vertebrae and sacral evolution in Tetrapoda. The first section of this Chapter contains information on the embryo structure at stages from the beginning of the hind limb bud formation and later in L. agilis, R. norvegicus, and G. gallus domesticus. The description is unified to the scheme: arterial system of the pelvic region (major vessels and places of bifurcations); position of visceral organs and the walls of the visceral cavity, lymphatics, and neural plexuses. The second section summarizes the information on the marker structures of the sacrum in all amniotic groups. These structures are: 1) paired pelvic lymphatic heart; 2) the place of contraction of the aorta dorsalis into caudal artery and the branching of the paired allantoic artery or homologous; 3) spinal nerves inserting lombosacral and pelvic plexuses; 4) the place of narrowing of the visceral cavity into the rectal/cloacal part, the fore- and the hind borders of the cloaca (if present). In lizards, the lymphatic heart is positioned in the first caudal segment. In limbless lizards, which have only one sacral vertebra, the lymphatic heart is greater in size and is positioned in two first caudal segments. In adder, which has no sacrum, the lymphatic heart stretches along five cloacal axial segments, marking 5 the transition zone between typical trunk to typical caudal vertebrae. The lymphatic heart and its affluents of the squamate reptiles by size and position correlate with the structure (and presence) of the sacral part of the vertebral column, being the markers of the caudal border of the sacrum. In bird embryos the lymphatic heart lies near to transverse processes of the first free caudal vertebra, marking the border between the synsacrum and the tail. Comparison of birds with squamate reptiles and anurans allow us to conclude that the first free caudal vertebra is the first caudal, and there are no true caudal vertebrae composing the synsacrum by fusion with vertebrae of other types. The allantoic artery of lizards branches from the dorsal aorta under the first sacral vertebra; in rat this branching takes place under the last lumbar, because under the first sacral there is a huge venous anastomosis. The branching of arteries of the pelvic outlet in birds is substantially different. The base of the allantoic artery (a. ischiadica here) is opposite to the mid-synsacrum, while its branches in reptiles and mammals (a. iliaca interna et externa) have their own places of origin directly on the aorta dorsalis at the level of the transition from the vertebrae of the “Greek” series to “Arabic” of the synsacrum and at the level of the last synsacral vertebra (transition to caudals) correspondingly. These three arteries are homologous to the allantoic artery of the reptiles and mammals and indicate the borders of the sacrum within the synsacrum of birds. In lizards, the roots of nerves of the lumbar plexus are connected to the presacral vertebrae; the nerves of the sacral plexus are connected to the sacral vertebrae. In domestic chick the border between the two plexuses marks the transition between the “Greek” and “Arabic” series of vertebrae of the synsacrum. In mammals all the sacral vertebrae due to their relation to nerves correspond to the sacrum of lizards. Similar conclusions are reached when considering the distribution of the pelvic plexus of the autonomic simpatic nerves. The caudal wall of the body cavity and the cranial edge of the cloaca (if any) in embryos of all amniotes is positioned under or a bit caudad to the place of the 6 branching of the allantoic artery and in all cases under the most cranial vertebrae of the sacrum or under the “Arabic” series of vertebrae in birds. The caudal border of the cloaca in lizards and birds, or the anal opening in rat embryos correspond to the caudal edge of their sacral regions. The third section of Chapter 3 discusses the module evolution of the sacrum in amniotes. Hox-genes, which in mice mark the sacral axial somites, express in chick embryo in the zone of the presumed “Arabic” and “Latin” vertebrae. In the zone of “Greek” series of vertebrae of the chick express the Hox-genes, which are responsible for development of the lumbar vertebrae in mice. The cranial borders of expression of different sets of Hox-genes in chick not only coincide to the borders of the different groups of vertebrae, but also support the borders of the “true” sacrum, revealed with the morphological markers. There is a widely distributed notion that two sacral vertebrae are homologous also to the two vertebrae within the bird synsacrum, which takes the middle position and have sacral ribs; they are usually noted in anatomical literature as “primary sacrals”. The comparative analysis shows that the structure of the synsacrum is variable and it is difficult to find two identical vertebrae, which would be definitely different from others. The morphological markers of the sacrum also show that to the two-vertebra sacrum of reptiles and the whole sacrum of mammals correspond two vertebral series (“Arabic” and “Latin”) within the synsacrum of birds. The first could be a homologue of the first sacral vertebrae of reptiles, the second series – homologue of the second sacral vertebra of the primitive sacrum. The sacrum of amniotes is a module system, each module consisting of one or more vertebrae. The term “primary sacrals” should be therefore refuted. Chapter 4. Sacral gap in myomeres and the sacro-iliac joint. Traditionally, sacrum is defined as the region of the vertebral column, which connect the axial skeleton to the pelvic girdle, however, there is no definition of the sacral vertebra in the literature. The main characteristic (connection of the 7 vertebra to the ilium) is not always working. Mivart and Clarke (1877) used a number of different features and characteristics, but had to give two separate definitions, one for birds, and the other one for reptiles, amphibians and mammals. Here I show, that a unique characteristic of the sacral vertebra, useful for all vertebrate groups is possible to give. There is a positive correlation between the size of the sacral gap in myomeres and the number of vertebrae, composing the sacrum in the given species. Although the mode of formation of the sacral gap is different in different groups (widening of the sacral myoseptum in amphibians, emigration or destruction of muscles in reptiles, and low formation rate of hypaxial myomeres in birds and mammals) the result—formation of the gap in the row of hypaxial muscles between the lumbar and caudal segments (at the level of sacrum) is a crucial factor for development of the large sacral transverse processes (or ribs) and the alae ilii. The absence of muscles here is an advantage for the cartilaginous elements to establish a contact. In lizards the sacral gap is observed in two segments, in limbless lizard—in only one segment, which correspond to the only sacral vertebra. In the adder the sacral gap is not formed. In rat it occupies the hypaxial level of four segments, which also corresponds to the sacral level. In birds the sacral gap is huge and occupies eight to ten segments, but displaced to the caudal level of the synsacrum, i.e., corresponds to the level of the true sacrum, which is defined by the morphological and genetical markers. In other words, we can define the sacral vertebra as the vertebra, which transverse processes or ribs develop in the sacral gap, i.e. the mesenchymal field on the place of absent hypaxial muscles in the given axial segment. In Chapter 4 the possible mechanisms of formation of the sacral gap are described and discussed. Chapter 5. Development of cartilaginous and osseous elements of the sacro-pelvic complex. 8 The first four sections of this Chapter describe in details the process of growth and development of all the cartilaginous and osseous elements in the sacral region of the spine and the pelvic girdle in L. agilis, G. gallus, C. japonicus, T. pilaris, and R. norvegicus. Particular attention in the descriptions are given to the initial and final position of the region of the prospective acetabulum, the number of mesenchymal and cartilaginous anlagen of the pelvis, the order of chondrification and ossification of all the elements of the sacrum and pelvic girdle, the form of the pelvis. This information is further analyzed in sections 5 and 6. In lacertid lizards the shorter is the embryonic period, the faster is the ossification of the sacrum and pelvis, and the more additional calcified cartilages (e.g., hypoischium, epiischium) develop. The similar situation takes place in birds. The praecocial Gallus and Coturnix demonstrate the complete ossification of the sacro-pelvic complex at hatching. In embryos of Turdus, the altricial bird, there is even no trace of ossification of the sacro-pelvic complex at the time of hatching. In squamate reptiles, crocodiles (Rieppel, 1993), and birds the first elements to chondrify and ossify are neural arches and the vertebral bodies, the next are the ilium and pubis. Ischium and sacral ribs are late in development. The last to calcify and ossify are different additional cartilages. In mammals the cartilaginous pubis and ischium appear in the same order as in sauropsids; however, the ossification pattern is different—ischium ossifies earlier than pubis. It is probable that this difference in order of ossification of pelvic elements is the difference between the sauropsid and theropsid lines of amniotes. While mammals retain the original pattern, characteristic to early tetrapodes and modern amphibians, the pattern of ossification in sauropsid clade was modified. It is usually accepted that the mature transverse processes of the sacral vertebrae, which attach to the pelvic bones are true transverse processes in mammals, or sacral ribs in reptiles; the birds are characterized by the presence of both types. However the presence of sacral ribs in some squamate reptiles was subjected to question more than once. The reasons for those opinions were the 9 absence of definite borders between the neural arches and the ribs, as well as the absence of the separate ossification centers. In all lizard species, which were in my disposal the autonomic anlagen of sacral ribs were present at stages of mesenchyme, and the border between the neural arch and the sacral rib was preserved at least for some time after chondrification. At least in the first sacral rib the separate ossification center was found in L. agilis. In embryos of birds and in the rat embryos the process of fusion of the sacral vertebrae starts with the approach to each other and shortening of the vertebrae. The first contact and fusion takes place in neural arches then fuse the vertebral bodies. In mammalian embryos the vertebral fusion starts from the first and second sacral vertebrae and goes caudad, in birds the first fusion is observed in the middle of the synsacrum (but not between the “primary sacrals”) and then fusions distributes caudad and craniad. Similarly, in phylogeny of the lineage leading to birds and dinosaurs we observe the gradual involvement of the vertebrae from the more caudal and more cranial regions of the vertebral column. The last section of Chapter 5 considers the mechanical role of the visceral cavity in the development of the lower part of the pelvic girdle. In comparison to the ilium, the development of the lower part of the pelvic girdle (ischium and pubis) takes place in different spatial conditions, particularly in relation to the growing visceral cavity. In embryos of squamate reptiles with the elongated body the visceral cavity is relatively small and slowly increases in size in the course of development. Its caudal wall is gently sloping and smoothly proceeds to the narrow rectal part in front of the cloaca. In birds and mammals the visceral cavity wal is almost vertical at the time of appearance of cartilaginous pubis and ischium. The volume of the cavity increases dramatically over time and the lower part of the caudal wall more and more turns caudad is such a way that at later stages of development the caudal wall of the visceral cavity is directed obliquely caudad. In addition, the pelvic girdle of lizards develops at the base of the hind limb buds and the contralateral acetabuli appear to be widely separated. Pubis growths 10 down and forward, and later also lateral and ventral to the visceral cavity along the slightly sloping caudal wall of the latter. In birds and mammals the pelvic anlagen is positioned much more medially, almost over and behind the visceral cavity. In birds, the pubis grows slightly ahead of the acetabulum, but shortly reaches the vertical caudal wall of the cavity and turns to grow along this wall. In mammals the pubis grows down along the visceral cavity wall from the very beginning of its development. Therefore, the form of the pelvic girdle is determined by the relative position of the early pelvic anlagen, the size and the form of the visceral cavity and the position and inclination of its caudal wall. In the result of these differences between the squamate reptiles, and birds and mammals two different forms of the pelvic girdle are established in embryogenesis—prepubic and opisthopubic. This section also discusses the possible use of ontogenetic data in palaeontological reconstructions, and the author makes some predictions on the volume of the visceral cavity in the extinct archosaurs. Chapter 6. Experimental analysis of the avian pelvis development. The first section of the Chapter 6 discusses the known data on the role of the limb buds, and organizing centers, zone of polarizing activity and apical ectodermal ridge in the limb development, as well as contribution of somites to the skeleton and muscles of the free limb. It is concluded that the pelvic girdle develops independently from these centers, while whether it fits to the widely accepted progress zone model of the limb bud outgrowth is not studied. On the other hand the somites give rise not only to the muscle of the free limbs, but also contribute to the scapula, the most proximal element of the shoulder girdle, while the rest of the girdle is of somatopleural origin (Chevallier, 1977). Whether the ilium, the most proximal element of the pelvic girdle, has also dual origin, is questioned. The second section describes the results of a number of experiments on chick embryos. To test the hypothesis on the influence of the early limb bud on the formation of the sacral gap in myomeres, pelvic girdle and the sacrum the limb bud 11 was ablated on stages 17 (Hamburger and Hamilton, 1951), while the somatopleural ectoderm was removed on stages 12 to 16. Other experiments was aimed to determine the degree of participation of the somitic mesoderm and somatopleure in formation of the pelvic girdle, in particular, the ilium. Amputation of the hind limb bud leads to the absence of the skeleton of free limb, including femur. Acetabulum is not formed or malformed. The position of the iliac wings is changed, the pelvis develops, but with slight defects. The sacral gap is formed and the sacrum develops normally. After extirpation of the ectoderm over the lateral plate mesoderm at stage 16 the structure of the pelvic girdle is similar to that after extirpation of the limb bud. The earlier is the operation, the more defects in the pelvis are observed. The form and the quantity of the elements is changed. The first element to disappear is pubis, but even after operation at stage 12 the ilium rudiment preserves. Extirpation of the lateral plate mesoderm leads to malformation and almost complete absence of the pelvic girdle, however, some rudiments of the ilium still could be found. After extirpation of the sacral somites the neural arches on the operated side are not formed, spinal ganglia are substantially smaller than normally. Sometimes, some slight defects were found in the ilium. Pilot experiments with quail-to-chick chimeras (7 embryos) did not show definitely the contribution of the somites to the upper part of the ilium. However in one embryo, the ilium was hybrid and consisted of two (quail and chick) parts. An intensive analysis of the original and literature data, both descriptive and experimental is undertaken in the last, third section of Chapter 6. The sacrum, pelvic girdle and the skeleton of the free limb represent a correlated system. This view is supported by the correlated reduction of these skeletal parts in limbless animals. On the other hand, the experimental and comparative data show explicitly, that all these parts develop in much extent autonomously. There is no direct influence of the amniotic limb bud on the development of the pelvic girdle or the sacrum, the pelvis can develop in the absence of either sacrum or the free limb skeleton and vice versa, the upper part of the pelvic girdle (ilium) develops in 12 different morphogenetic conditions than the lower part of the pelvic girdle (ischium and pubis). The mechanisms of the formation of the sacral gap in myomeres and the detailed developmental pathways leading to the formation of the pelvic girdle, as well as the embryonic origin of the ilium anlagen is yet to be shown.