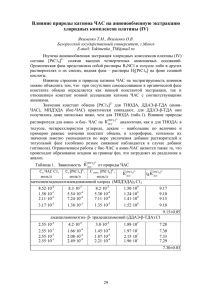
ГЕОХИМИЯ
advertisement

ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ Государственное образовательное учреждение высшего профессионального образования «ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ» __________________________________________________ Н.М. Недоливко ГЕОХИМИЯ Учебное пособие ИЗДАТЕЛЬСТВО ТПУ Томск 2005 1 УДК 550.4: 551.3 Н 42 Недоливко Н.М. Н 42 Геохимия: учебное пособие. 102 с. Томск: Изд-во ТПУ, 2005. В учебном пособии изложены общие принципы и задачи геохимии, приведены сведения об основных геохимических классификациях элементов, о распространенности химических элементов в земной коре, о формах нахождения элементов в природе. Дана физико-химическая характеристика геологических процессов, рассмотрены факторы миграции элементов в геологических процессах и основные закономерности поведения химических элементов в процессах выветривания и осадкообразования (в седиментогенезе, диагенезе и катагенезе). Охарактеризованы геохимические процессы преобразования нефти и вмещающих нефть пород в зонах водонефтяных контактов, особое внимание уделено основам методик проведения геохимических исследований. Пособие предназначено для студентов вузов нефтегазового профиля, специальностей «Геология нефти и газа», а также для студентов, аспирантов и других специалистов, занимающихся научными исследованиями в области нефтяной геологии. УДК 550.4: 551.3 Рекомендовано к печати Редакционно-издательским советом Томского политехнического университета Рецензенты Доктор геолого-минералогических наук, профессор заведующий лабораторией геохимии нефти ОАО «ТомскНИПИнефть ВНК», И.В. Гончаров Доктор геолого-минералогических наук, профессор заведующий кафедрой петрографии Томского государственного университета, А. И. Чернышов Томский политехнический университет, 2005 Оформление. Издательство ТПУ, 2005 2 ВВЕДЕНИЕ Настоящее учебное пособие отвечает программе курса учебной дисциплины «Геохимия», читаемого для студентов 3-го курса, обучающихся по специальности 130304 «Геология нефти и газа». Курс «Геохимия» входит в перечень естественнонаучных дисциплин стандарта (ГОС ВПО) подготовки дипломированного специалиста по направлению 130300 «Прикладная геология». В нем геохимия рассматривается как одна из фундаментальных проблем естествознания, решение которой имеет большое практическое значение; показана связь дисциплины с другими направлениями геологической науки, подчеркивается увеличение роли геохимии при исследовании нефтегазоносных толщ. Дисциплина имеет цель дать основы знаний закономерностей распространенности, распределения и поведения химических элементов в природе. Основные рассматриваемые в курсе проблемы: распространенность химических элементов в земной коре; геохимическая классификация элементов, формы нахождения элементов в природе, физикохимическая характеристика геологических процессов, факторы миграции элементов в геологических процессах; основные закономерности поведения химических элементов в процессах выветривания и осадкообразования (в седиментогенезе, диагенезе и катагенезе); представления о геохимических процессах преобразования нефти и вмещающих нефть пород в зонах водонефтяных контактов, основы методики проведения геохимических исследований, знакомство с новейшими методами исследования вещества и применение результатов геохимических исследований в качестве нефтегазопоисковых признаков. Прослеживаются геохимические аспекты осадкообразования, устанавливаются геохимические условия трансформации вещества при превращении осадка в породу, выявляются пути и механизмы преобразования коллекторов и покрышек под влиянием углеводородной залежи, объясняются причины возникновения отрицательных и положительных литогеохимических ореолов над углеводородной залежью. При написании учебного пособия использованы как опубликованные отечественные и зарубежные материалы, так и оригинальные разработки автора. Автор выражает благодарность за ценные советы и помощь в написании учебного пособия доценту кафедры минералогии и геохимии Томского государственного университета, кандидату геологоминералогических наук Юрию Васильевичу Индукаеву. 3 1. ГЕОХИМИЯ И ЕЕ МЕСТО СРЕДИ ДРУГИХ НАУК [4, 6, 26, 28] 1.1. Геохимия и ее место среди родственных дисциплин Термин "геохимия" введен К. Ф. Шенбейном в 1838 г. Согласно определению выдающегося русского ученого В. И. Вернадского, который по праву считается одним из основателей современной геохимии, "геохимия научно изучает химические элементы, т.е. атомы земной коры и, насколько возможно, всей планеты. Она изучает их историю, их распределение и движение в пространстве-времени, их генетические на нашей планете соотношения" (1927 г.). К этой формулировке довольно близко определение А.Е. Ферсмана: "Геохимия изучает историю химических элементов-атомов в земной коре и их поведение при различных термодинамических и физикохимических условиях природы". Геохимия – наука о распространенности, распределении (концентрации и рассеянии) и процессах миграции химических элементов и их стабильных изотопов в геосферах Земли Основные проблемы геохимии, вытекающие из этого определения, А.А. Сауков определил так: 1. Выявление закономерностей распределения отдельных химических элементов в различных оболочках Земли, выяснение качественного и количественного состава геосфер и причин, определяющих различную распространенность элементов. 2. Выяснение закономерностей миграции химических элементов в земной коре и причин неравномерного распределения их в различных участках земной коры. 3. Геохимия отдельных областей. Выяснение закономерностей в распределении элементов между отдельными геологическими системами в связи с их возрастом, тектоникой, составом и др. 4. Геохимия отдельных элементов. Изучение поведения того или иного атома при различных термодинамических условиях и на различных стадиях ее космической и геологической истории. Геохимия тесно связана с науками геологического профиля: минералогией, петрографией, литологией, учением о полезных ископаемых, а также с рядом других дисциплин – химией, физикой, астрофизикой, экологией и др. (рис. 1.1). 4 Астрофизика Космохимия Астрономия Экспериментальная физика Учение о полезных ископаемых Физика твердого тела Минералогия Кристаллография ГЕОХИМИЯ Кристаллохимия Физика Химия Термодинамика Физическая химия Математика Петрография Геология Математическая статистика Геофизика Литология Биология Почвоведение География Рис. 1.1. Место геохимии среди естественных дисциплин ГЕОХИМИЯ Геохимия литосферы Региональная геохимия Геохимия ландшафтов Геохимия литогенеза Биогеохимия Органическая геохимия Гидрогеохимия Геохимия процессов Аналитическая геохимия Физическая геохимия Изотопная геохимия Радиогеохимия Рис. 1.2. Отраслевая структура геохимии 5 В зависимости от решаемых задач, геохимия носит многоотраслевой характер (рис. 1.2) и подразделяется на: геохимию аналитическую, физическую, геохимию литосферы, геохимию процессов, региональную геохимию, гидрогеохимию, радиогеохимию, изотопную геохимию, радиогеохронологию, биогеохимию, органическую геохимию, геохимию ландшафта, геохимию литогенеза. 1.2. Геохимия литогенеза Для нефтяника одним из основных разделов геохимии является геохимия литогенеза. Геохимия литогенеза – раздел, изучающий химический состав и физико-химические условия формирования осадочных горных пород и руд, их эволюцию в ходе геологической истории, распространенность химических элементов в осадочных породах и гидросфере Геохимия литогенеза тесно связана общим объектом исследования с литологией. При реконструкции геохимических процессов используются данные стратиграфии, геотектоники, палеогеографии и океанологии, а также наблюдения над современными процессами выветривания, осадконакопления и данные экспериментального воспроизведения равновесных систем (карбонатных, фосфатных, солевых и др.) в качестве моделей процессов и реакций геологического прошлого, с внесением в них необходимых поправок на эволюционные изменения физико-химических условий осадочного породообразования. Геохимия литогенеза изучает процессы, протекающие при относительно низких температурах и давлениях, ограниченных интервалом в пределах между значениями, характерными для земной поверхности и верхней границы области регионального метаморфизма. Геохимия литогенеза охватывает изучением все стадии осадочного породообразования (литогенез), включая выветривание и мобилизацию исходных веществ в области денудации, их перенос реками в конечные водоѐмы стока (внутриматериковые, морские и океанические), накопление в толще формирующихся осадков и последующее изменение и перераспределение вещества в процессах диагенеза, катагенеза и эпигенеза. Геохимия литогенеза ставит своей целью установление количественных соотношений различных форм переноса элементов в виде ис6 тинных и коллоидных растворов, комплексных соединений, механических взвесей, сорбций на глинистых и др. минералах, равно как и выявление количественных закономерностей пространственного распределения элементов в водной среде и в толще осадков. Ведущее значение в геохимии литогенеза имеют представления о равновесиях между газами атмосферы, ионным составом вод океана и донными осадками (алюмосиликатные и карбонат-бикарбонатные равновесия), учение об осадочной дифференциации элементов и о зональном их распределении на площади бассейнов. В этой связи рассматривается проблема соотношения кларкового (рассеяние) и рудного (концентрация) процессов, решение которой представляет большой практический интерес при поисках скрытых рудных залежей. Значение различных типов химических реакций в образовании осадочных рудных месторождений неодинаково на разных стадиях литогенеза. При формировании месторождений кор выветривания (бокситы, железные и никелевые руды) ведущая роль принадлежит реакциям окисления и гидролиза; в образовании месторождений солей – реакциям осаждения (кристаллизации) из истинных растворов (галогенез); в образовании месторождений фосфоритов, самородной серы, железных, марганцевых и урановых руд – химико-биологическим процессам, сопровождаемым реакциями восстановления и диффузионного перераспределения веществ в поровых растворах. Осадочное породо- и рудообразование и типы обусловливавших их химических реакций в значительной степени предопределялись физико-географическими условиями, существовавшими на земной поверхности в тот или иной период геологического времени, режимом тектонических движений в пределах данного региона, интенсивностью вулканической деятельности и многими другими факторами. Геохимия литогенеза использует геохимические индикаторы при реконструкции фациальных и климатических условий седиментации, в частности солѐности вод древних бассейнов, их газового режима, глубины и температуры. Ими являются соотношения химически близких пар элементов и изотопные отношения кислорода, серы, углерода и др. Особое внимание уделяется изучению органического вещества, которое является не только источником горючих газов и нефтей, но и фактором, определяющим процессы восстановления и миграции поливалентных элементов, образования подвижных элементоорганических соединений и комплексов. Геохимия литогенеза имеет непосредственное отношение к проблеме геохимического баланса химических элементов во внешних оболочках Земли. Фундаментальной особенностью осадочных пород явля7 ется отчѐтливо выраженное различие между их составом и средним составом пород "гранитной" оболочки, представлявшей собой главный источник осадочного материала в течение последних 2–3 млрд лет земной истории. Различие заключается, прежде всего, в повышенном, против баланса, содержании в породах осадочной оболочки воды, углекислоты и органического углерода, а также S, Cl, F, В и др. "избыточных летучих". Другой важной особенностью осадочных пород является высокое содержание в них кальция, сдвиг отношения K/Na в пользу калия, более высокое отношение окисного железа к закисному, повышенное содержание сульфатной серы по сравнению с кристаллическими породами "гранитной" оболочки. Эти свойства наиболее отчѐтливо выражены в платформенных осадках, т. к. они представляют собой продукты наиболее глубокого выветривания и резко выраженной поверхностной дифференциации. Геосинклинальные осадки испытывали менее интенсивные изменения (особенно пески) и их состав приближается к составу материнских пород. Малой дифференцированности состава осадков противостоят в геосинклинальных областях глубокие их преобразования, связанные с погружением реакционноспособных минералов в области повышенных температур и давлений. КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Что такое геохимия? Исходя из формулировок разными авторами понятия «геохимия», составьте перечень задач, которые решает эта наука. 2. Какие проблемы решает геохимия, согласно представлениям А.А. Саукова? 3. На основе анализа рис. 1.1 поясните место геохимии среди естественных наук, обоснуйте связь геохимии с другими естественными науками. 4. На основе анализа рис. 1.2 докажите многоотраслевой характер геохимии; сформулируйте задачи, решаемые каждой отраслью. 5. Дайте определение понятию «геохимия литогенеза». Исходя из определения, установите, какие задачи решает геохимия литогенеза. 6. Какова цель геохимии литогенеза? Охарактеризуйте роль и особенности геохимии литогенеза. 7. В чем заключается проблема геохимического баланса химических элементов во внешних оболочках Земли? 8 2. РАСПРОСТРАНЕННОСТЬ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ В ЗЕМНОЙ КОРЕ. КЛАРКИ [4, 23] Одна из важнейших задач геохимии – определение распространенности химических элементов в земной коре. Собственно, с этих исследований во многом и началась геохимия как наука. Долгое время распространенность различных простых веществ невольно связывалась с их практическим применением. Впервые попытался оценить средний химический состав земной коры в 1815 г. английский минералог В. Филлипс на примере 10 элементов. Он определил количественную последовательность распространенности элементов и показал, что в неорганической природе резко преобладают кислород и оксиды кремния, алюминия и железа, подобно тому, как в живой природе «царствует» четверка элементоворганогенов: кислород, водород, углерод и азот (рис. 2.1). оксиды алюминия оксиды кремния неорганическая природа углерод кислород оксиды железа органическая природа азот водород Рис. 2.1. Схема химического состава земной коры, по В. Филлипсу Проанализировав более 5000 данных по химическому составу минералов и горных пород, американский геохимик Ф.У. Кларк в 1889 г. опубликовал первую сводную таблицу среднего химического состава земной коры. Спустя 20 лет он издал справочник с данными о составе горных пород, почв и вод, обобщив в нем работы почти 1000 исследователей. С помощью геолога Г. Вашингтона Ф.У. Кларк произвел классический расчет среднего содержания химических элементов в условном слое земной коры толщиной 16 км. Химический состав земной коры исследовался многими учеными, наиболее известны работы В.М. Гольдшмидта, А.Б. Ронова, А. Полдерваарта, А.А. Ярошевского, В.И. Вернад9 ского, А.Е. Ферсмана, А.П. Виноградова и др. Используя новейшие методы анализа (нейтронно-активационный, атомно-абсорбционный, люминесцентный и др.), из результатов многочисленных точных анализов минералов, пород и их смесей, из сопоставления распространенности отдельных пар элементов удалось определить содержание в земной коре почти всех элементов периодической системы. Распространенность элементов в земной коре определяют кларками. Термин предложен А.Е. Ферсманом в честь Ф.У. Кларка, впервые достаточно полно и точно оценившего химический состав земной коры. Кларк – это среднее содержание элементов в каком-либо образовании земной коры – литосфере, гидросфере и т.д., или даже в толще пород какого-либо района («местные кларки»). Кларк может быть выражен в единицах массы (%, г/т и др.), либо в атомных % Среднее содержание химических элементов в литосфере и в главных типах пород приведено в таблице 2.1. Из анализа таблицы следуют важные выводы. 1) Определяется ряд физической распространенности элементов в литосфере: O>Si>Al>Fe>Ca>Na>K>Mg>Ti>Mn>P>F>Ba>S>Sr>Cl>Z>Rb>V>Cr> Zn>Ce>Ni>Cu>Nd>Li>Y>La>C>Nb>N>Ga>Co>Pb, в котором уменьшение содержания химических элементов происходит слева направо. 2) Ведущими элементами вещества земной коры являются 8 элементов: O, Si, Al, Fe, Ca, Mg, Na, K. На долю остальных 84 элементов приходится менее 1 % массы земной коры. 3) Среди главнейших по распространенности элементов особая роль в земной коре принадлежит кислороду: его атомы составляют 47 % массы земной коры и почти 90 % объема важнейших породообразующих минералов (ортоклаз, альбит, анортит, кварц, диопсид, мусковит). 4) Одни элементы слагают основную массу горных пород, другие находятся в них в ничтожно малых количествах. 5) Земная кора сложена в основном легкими элементами, расположенными в периодической системе Д.И. Менделеева по Fe включительно. Элементы, следующие за Fe, в сумме составляют лишь доли процента. После железа, порядковый номер которого 26, нет ни одного химического элемента с кларком более 0,1 %. 10 6) Геохимическая особенность земной коры состоит в резко различной распространенности элементов, слагающих как кору в целом, так и различные типы пород. Таблица 2.1 Среднее содержание химических элементов в литосфере и в главных типах пород (по А.П. Виноградову, 1962), масс. % Эле менты Ультраосновные породы 1 2 Li Be B C N O F Na Мg А1 Si Р S Cl К Са Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Sr Y Zr -5 5·10 2·10-5 1·10-4 1·10-2 6·10-4 42,5 1·10-2 5,7·10-1 25,9 0,45 19 1,7·10-2 1·10-2 5·10-3 3·10-2 0,7 5·10-4 3·10-2 4·10-3 2·10-1 1,5·10-1 9,85 2·10-2 2·10-1 2·10-3 3·10-3 2·10-4 1·10-4 5·10-5 5·10-6 5·10-5 2·10-4 1·10-3 -8 3·10 Основные породы Средние породы 3 4 -3 1,5·10 4·10-5 5·10-4 1·10-2 1,8·10-3 43,5 3,7·10-2 1,94 4,5 8,76 24 1,4·10-1 3·10-2 5·10-3 8,3·10-1 6,72 2,4·10-3 9·10-1 2·10-2 2·10-2 2·10-1 8,56 4, 5·10-3 1,6·10-2 1·10-2 1,3·10-2 1,8·10-3 1,5·10-4 2·10-4 5·10-6 3·10-4 4,5·10-3 4,4·10-2 2·10-3 1·10-2 Кислые породы 5 -3 2·10 1,8·10-4 1,5·10-3 2·10-2 2,2·10-3 46 5·10-2 3 2,18 8,85 26 1,6·10-1 2·10-2 1·10-2 2,3 4,65 2, 5·10-4 8·10-1 1·10-2 5·10-3 1,2·10-1 5,85 1·10-3 5,5·10-3 3,5·10-3 7,2·10-3 2·10-3 1,5·10-4 2,4·10-4 5·10-6 4,5·10-4 1·10-2 8·10-2 -2 2,6·10 11 -4 4·10 5, 5·10-4 1,5·10-3 3·10-2 2·10-3 48,7 8·10-2 2,77 0,56 7,7 32,3 7·10-2 4·10-2 2, 4·10-2 3,34 1,58 3·10-4 2,3·10-1 4·10-3 2,5·10-3 6·10-2 2,7 5·10-4 8·10-4 2·10-3 6·10-3 2·10-3 1,4·10-4 1,5·10-4 5·10-6 1,7·10-4 2·10-2 3·10-2 3,4·10-3 2·10-2 Осадочные породы Средний состав литосферы 6 7 -3 6·10 3·10-4 1·10-2 1 -2 6·10 52,8 5·10-2 0,66 1,34 10,45 23,8 7,7·10-2 3·10-1 1,6·10-2 2,28 2,53 1·10-3 4,5·10-1 1,3·10-2 1·10-2 6,7·10-2 3,33 2·10-3 9,5·10-3 5, 7·10-3 8·10-3 З·10-3 2·10-4 6, 6·10-4 6·10-5 6·10-1 2·10-2 4,5·10-2 3·10-3 2·10-2 3,2·10-3 3,8·10-4 1,2·10-3 2,3·10-3 1,9·10-3 47,0 6,6·10-2 2,5 1,87 8,05 29,5 9,3·10-2 4,7·10-2 1,7·10-2 2,5 2,96 1·10-3 4,5·10-1 9·10-3 8,3 ·10-3 1·10-1 4,65 1,8·10-3 5, 8·10-3 4,7·10-3 8,3·10-3 1,9·10-3 1,4·10-4 1,7·10-4 5·10-6 2,1·10-4 1,5·10-2 3,4·10-2 2,9·10-3 1,7·10-2 Продолжение табл. 2.1 1 Nb Mo Ru Pd Ag Cd In Sn Sb Te J Cs Ва La Ce Pr Nd Pm Sm Eu Cd Tb Dy Ho Er Tu Yb Lu Hf Ta W Re Ir Pt Au Hg Tl Pb Bi Po Th U 2 3 -4 1·10 2·10-5 1,2·10-5 5·10-6 5·10-6 1,3·10-6 5·10-5 1·10-5 1·10-7 1·10-6 1·10-3 1·10-4 -6 1·10 -6 5·10 -5 1·10 1,8·10-6 1,5·10-5 -5 2·10 5·10-7 1·10-6 1·10-6 1·10-5 1·10-7 -7 5·10 3·10-7 4 -3 2·10 1,4·10-4 1,9·10-6 1·10-6 1,9·10-5 2,2·10-5 1,5·10-4 1·10-4 1·10-7 5·10-5 1·10-4 3·10-2 2, 7·10-3 4, 5·10-4 4·10-4 2·10-3 -4 5·10 1·10-4 5·10-4 8·10-5 2·10-4 1·10-4 2·10-4 2·10-5 2·10-4 6·10-5 1·10-4 4,8·10-5 1·10-4 7,1·10-8 -5 1·10 4·10-7 9·10-6 2·10-5 8·10-4 7·10-7 -4 3·10 5·10-5 5 -3 2·10 9·10-5 -6 7·10 2·10-5 1·10-7 3·10-5 6,5·10-2 -4 1·10 7·10-5 1·10-4 -5 5·10 1,5·10-3 1·10-6 -4 7·10 1,8·10-4 12 6 -3 2·10 1·10-4 1·10-6 5·10-6 1·10-6 2,6·10-5 3·10-4 2,6·10-5 1·10-7 4·10-5 5·10-4 8,3·10-2 6·10-3 1·10-2 1,2·10-3 4,6·10-3 -4 9·10 1,5·10-4 9·10-4 2,5·10-4 6,7·10-4 2·10-4 4·10-4 3·10-5 4·10-4 1·10-4 1·10-4 3,5·10-4 1,5·10-4 6,7·10-8 6,3·10-7 -7 4,5·10 8·10-6 1,5·10-4 2·10-3 1·10-6 -3 1,8·10 3,5·10-4 7 -3 2·10 2·10-4 -5 1·10 3·10-5 5·10-6 1·10-3 2·10-4 1·10-6 1·10-4 1,2·10-3 8·10-2 4·10-3 5·10-3 5·10-4 2,3·10-3 -4 6,5·10 1·10-4 6,5·10-4 9·10-5 4,5·10-4 1·10-4 2,5·10-4 2,5·10-5 3·10-4 7·10-5 6·10-4 3,5·10-4 2·10-4 -7 1·10 4·10-5 1·10-4 2·10-3 1·10-6 -3 1,1·10 3,2·10-4 2·10-3 1,1·10-4 1,3·10-6 7·10-6 1,3·10-5 2,5·10-5 2,5·10-4 5·10-5 1·10-7 4·10-5: 3,7·10-4 6, 5·10-2 2,9·10-3 7·10-3 9·10-4 3,7·10-3 -4 8·10 1,3·10-4 8·10-4 4,3·10-4 5·10-4 1,7·10-4 3,3·10-4 2,7·10-5 3,3·10-5 8·10-5 1·10-4 2,5·10-4 1,3·10-4 7·10-8 -7 4, 3·10 8,3·10-6 1·10-4 1,6·10-3 9·10-7 -3 1,3·10 2,5·10-4 Анализ распространения элементов по типам пород показывает, что соотношение основных породообразующих элементов в различных породах неодинаково (рис. 2.2). Mn 0,12% P 0,16% Ti 0,80% Mg 2,18% Na 3,00% K 2,30% Ca 4,65% P Mg 0,07% 0,56% Ti 0,23% Fe 5,86% O 46,04% P 0,14% Ti 0,90% Al 8,86% Si 26,02% Mg 4,50% K 0,83% Na 1,94% Fe 2,70% Al 7,70% Si 32,30% Ca 6,72% Mn 0,07% Fe 8,56% Ti 0,46% P 0,08% Mg 1,37% Na 0,67% K 2,33% Ca 2,59% Fe 3,41% Al 10,69% O 54,00% Si 23,99% Основные породы Mn 0,15% P Mg 0,02% 26,11% Al 8,76% Осадочные породы Mn 0,10% K 0,03% P 0,09% Ti 0,45% Na 0,57% O 42,84% Si 19,15% K 3,34% Кислые породы O 43,48% Ti 0,03% Ca 1,58% O 48,70% Средние породы Mn 0,20% Mn Na 0,06% 2,77% Si 24,34% Ca Mg Na 1,88% 2,51% 2,97% Fe K 4,67% 2,51% Al 8,08% O 47,15% Al 0,45% Ультраосновные породы Fe 9,93% Ca 0,71% Средний состав литосферы Si 29,60% Рис. 2.2. Соотношение кларков основных породообразующих элементов в горных породах и литосфере В ряду магматических пород (от ультраосновного состава до кислого) наблюдается последовательное увеличение содержания кислорода, кремния и калия. Одновременно с этим происходит снижение кон13 центраций Fe и Mg. В осадочных породах резко повышена роль кислорода и алюминия, высокое, по сравнению с ультраосновными и основными породами, содержание кремния. Связь отдельных элементов с породами определенного состава выражена в том, что существуют элементы, которые: в основных и кислых породах распространены примерно одинаково – Ga, Ge, Se, Ne, Re, Sr, Nb, Cd, In, Hf; в основных породах накапливаются в значительно больших количествах, чем в кислых – Cr, Sc, Ni, V, Co, Pt; содержание элементов в кислых породах заметно выше, чем в основных – Li, Be, Rb, TR, Ba, Tl, Th, U, Ta. КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Объясните разницу между понятиями «кларки» и «местные кларки». В каких единицах измеряются кларки? 2. Напишите ряд физической распространенности элементов в литосфере (10 элементов). 3. Каким образом связана распространенность элементов в литосфере с их положением в периодической таблице Д.М. Менделеева? 4. Какие выводы о распространенности элементов можно сделать из анализа табл. 2.1? 5. По табл. 2.1 установите по 10 наиболее распространенных элементов в разных типах пород. Заполните и проанализируйте табл. 2.2. Таблица 2.2 Наиболее распространенные элементы в породах разного генезиса ультраосновные элементы кларк основные элементы кларк Породы средние элементы кларк 14 кислые элементы кларк осадочные элементы кларк 3. ГЕОХИМИЧЕСКАЯ КЛАССИФИКАЦИЯ ЭЛЕМЕНТОВ [1, 7, 26] Геохимическая классификация элементов – классификация химических элементов, отражающая их группировку в соответствии с основными закономерностями поведения элементов в геологических процессах В основе геохимической классификации элементов лежит периодический закон Д.И. Менделеева. Общепринятыми геохимическими классификациями элементов, отражающими основные законы геохимии, являются классификации В.И. Вернадского (1922, 1927) и В.М. Гольдшмидта (1924). 3.1. Классификация В.И. Вернадского В основу своей классификации В.И. Вернадский положил 4 принципа, определяющих историю элементов в земной коре: химическую активность, участие в циклических процессах в биосфере, преобладание рассеянного состояния, высокую радиоактивность. Им были выделены следующие группы элементов: благородных газов (He, Ne, Ar, Kr, Xe); благородных металлов (Ru, Rh, Pd, Os, Ir, Pt, Au, Ag); циклических элементов (H, Na, K, Cu, Mg, Ca, Zn, B, Al, C, Si, Ti, Zr, Pb, N, V, P, O, S, Cr, Mo, F, Cl, Mn, Fe, Co, Ni и др.; рассеянных элементов (Li, Rb, Cs, Sc, Y, Ga, In, Tl, Br, J); сильнорадиоактивных элементов (Po, Rn, Ra, Ac, Th, Pa, U); элементов редких земель (La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu). 3.2. Классификация В.М. Гольдшмидта Еще в середине 20-х годов крупнейший геохимик из Норвегии В.М. Гольдшмидт предложил геохимическую классификацию элементов, опирающуюся на менделеевскую таблицу. Он связал ее также с закономерностями построения внешних электронных оболочек атомов и ионов. В основных чертах эта классификация сохранилась и в наши дни. В.М. Гольдшмидт подразделил все элементы на группы в соответствии с устойчивостью различных типов их соединений в природе. В основу были положены законы распределения элементов по трем прин15 ципиальным фазам метеоритов: силикатной (кислородной), сульфидной и металлической. «Эталоном», относительно которого классифицируются элементы, является Fe – элемент с высокой распространенностью, входящий в состав всех принципиальных фаз метеоритов. Согласно В.М. Гольдшмидту, химические элементы по устойчивости их соединений можно разбить на 4 геохимические группы, представленные на рис. 3.1. Химические элементы Литофильные (камнелюбивые) Халькофильные (меделюбивые) Сидерофильные (железолюбивые) Атмофильные (воздухолюбивые) Рис. 3.1. Схема классификации элементов, по В.М. Гольдшмидту 1. Литофильные элементы – это самая многочисленная группа, включающая 54 элемента (рис. 3.2), т.е. более половины элементов, существующих в природе. Дословно в переводе с греческого означает “камнелюбивые”. Они составляют основу большинства горных пород и легко образуют кислородсодержащие минералы. С точки зрения строения атомов литофильные элементы имеют характерный общий признак: на внешней электронной оболочке их ионов содержится 2 (Li) или 8 электронов. Литофильные элементы трудно восстанавливаются до элементарного состояния и преимущественно парамагнитны. В свободном состоянии в земной коре литофильные элементы существовать не могут. Обычно они связаны с кислородом и составляют основную массу силикатов и алюмосиликатов. Литофильные элементы встречаются в виде оксидов, фосфатов, сульфатов, боратов, карбонатов и галогенидов. Около 95 % земной коры состоит из соединений литофильных элементов. К числу литофильных В.В. Щербина относит: щелочные и щелочноземельные металлы, B, Al, Sc, лантаноиды и актиноиды, C, Si, Ti, Zr, Hf, P, V, Nb, Ta, O, Cr, W, галогены, Mn, возможно, Tc и At, Th, U и др. (Li, Be, B, F, Na, Mg, Si, Cl, K, Ca, Mn, Br, Rb, Sr, I, Cs, Ba, TR, As, Fr, Ra, Ac, Pa). 16 2. Следующая по численности группа – халькофильные элементы (“меднолюбивые” в переводе с греческого). Их девятнадцать, и свое название они получили в связи с определенными свойствами меди, на которую они похожи в своем геохимическом поведении. Эти элементы отчетливо проявляют склонность образовывать природные соединения с серой (сульфиды) и ее аналогами по группе периодической таблицы Д.И. Менделеева – селеном и теллуром. На внешней оболочке ионов халькофильных элементов содержится по 8 (S, Se, Te) или по 18 (у остальных) электронов. К халькофилам принадлежат такие элементы, как медь, серебро, золото, цинк, ртуть, германий, свинец, сера; к ним относятся также Ga, Ge, Cd, In, Tl, Po. В природе халькофильные элементы встречаются в виде сульфидов, селенитов, теллуридов, а также в самородном состоянии (Cu, Ag, Au, Hg, Pb, Zn, As, Sb, Bi, S, Te, Sn). 3. Сидерофильные элементы – ферромагнитны и парамагнитны. Сидерофилъных (или “железолюбивых”) элементов одиннадцать. Это элементы VIII группы периодической системы Д.И. Менделеева: семейство железа и семейство платиновых металлов, а также молибден и рений. На внешней оболочке их ионов содержится от 9 до 17 электронов. Они обнаруживают специфическое сродство к As и S [PtAs2, FeAs2, NiAs2, (Fe,Ni)S, MoS2, CoAsS и др.], а также к P, C, N. Почти все сидерофильные элементы встречаются в самородном состоянии. 4. Атмофильные элементы – элементы атмосферы. Всего 8 простых веществ, составляющих земную атмосферу, относится к атмофильным элементам (водород, азот, кислород и благородные газы – He, Ne, Ar, Kr, Xe, Rn). Их атомы или ионы содержат на внешней оболочке 2 или 8 электронов. Большинство из них имеет атомы с заполненными электронными оболочками, поэтому они с трудом вступают в соединения с другими элементами и в природе (кроме H) находятся главным образом в элементарном (самородном) состоянии. Часть элементов проявляет свойства, присущие элементам из разных групп: J, O, H проявляют атмофильные и литофильные свойства; P, W, Cr, Mn – литофильные и сидерофильные; Au, Mo, Re, Pd – халькофильные и сидерофильные; As, Sn, Tl, Pb – халькофильные и литофильные; Fe, Co, Ni, Ga, Ge, C, In – могут проявлять литофильные, сидерофильные и халькофильные свойства. 17 Периоды I группа Ряды II группа III группа IV группа V группа VI группа VII группа VIII группа H 1 1 2 2 3 3 1 2 He 1,0079 4,0026 водород гелий (H) Li литий 3 Be 4 5 6,939 9,0122 10,81 берилий B 6 C 7 12,01115 14,0067 бор углерод 8 O 9 F 10 15,9994 18,9984 20,183 азот кислород фтор N Na 11 Mg 12 13 Al 14 Si 15 P 16 22,9898 24,305 26,98154 28,086 30,97376 32,064 натрий магний алюминий кремний фосфор K 4 4 5 калий 29 63,54 19 Сa 20 Sc 21 Ti 39,102 40,08 44,956 кальций cкандий титан Cu 30 Zn 31 65,37 69,72 медь цинк 22 47,90 23 Сr 50,942 ванадий хром V Ga 32 Ge 33 As 34 72,59 74,9216 78,96 галлий германий мышьяк S 17 35,453 сера Атмофильные элементы Ne Сидерофильные элементы неон Cl 18 Ar 39,948 хлор аргон Литофильные элементы 24 Mn 25 Fe 26 Со 27 Ni 28 51,996 54,9380 55,847 58,9332 58,71 марганец железо кобальт никель Se 35 79,909 селен Примечание Br 36 Кr 83,80 бром криптон Халькофильные элементы элементы, полученные искусственным путем Rb 6 5 7 37 Sr 38 Y 39 Zr 40 41 Nb Mo 43 Ru 42 Tc 44 Rh 45 Pd 46 85,467 87,62 88,905 91,22 92,906 98,9062 95,94 101,07 102,905 106,4 рубидий стронций иттрий цирконий ниобий молибден технеций рутений родий палладий 47 107,87 серебро Cs 8 6 9 Ag цезий 79 196,967 48 112,40 Cd 49 In 50 114,82 118,69 кадмий индий Sn 51 Sb 52 Te 53 I 54 Xe 121,75 127,60 126,9044 131,30 олово сурьма теллур иод ксенон 55 Ва 56 La 57 – Lu 71 Hf 72 Та 73 W 74 Re 132,905 137,34 138,91 178,49 180,948 183,85 барий лантан гафний тантал вольфрам рений 75 Os 186,2 осмий Au 80 Hg 81 Tl 82 Pb 83 Bi 84 Po 85 200,59 204,37 207,19 208,980 <210> <210> золото ртуть таллий свинец висмут полоний At 86 <222> астат радон 107 <264> 108 <269> 87 Ra 88 Ас 89 -Lr 103 104 105 106 <223> <226> <227> <260> <261> <263> резерфордий дубний сиборгий борий франций радий актиний Fr 7 10 хассий 76 Ir 190,2 иридий 77 Pt 78 192,2 195,2 платина Rn 109 <268> мейтнерий Лантаноиды La 57 Ce 138,91 140,12 лантан церий 58 Pr 59 Nd 60 Pm 61 Sm 62 Eu 63 Gd 64 Tb 65 Dy 66 Ho 67 Er 68 Tm 69 Yb 70 Lu 71 140,907 144,24 <145> 150,35 151,96 157,25 162,50 164,93 167,26 168,934 173,04 174,97 158,924 празеодим неодим прометий самарий европий гадолиний тербий диспрозий гольмий эрбий тулий иттербий лютеций Актиноиды Ac 89 Th 90 Pa 91 U 92 93 94 Am 95 96 97 98 <227> 232,038 <231 238,03 <237> <242> <243> <243> <249> <249> нептуний плутоний америций кюрий берклий калифорний актиний торий проактиний уран 99 100 101 102 103 <254> <255> <256> <254> <257> эйнштейний фермий менделевий нобелий лоуренсий Рис. 3.2. Периодическая система элементов Д.И. Менделеева с классами элементов, по В.М. Гольдшмидту 18 3.3. Классификация элементов по их распространенности Существуют классификации, в основу которых положена распространенность элементов в земной коре. Границы классов часто условные. Большинство авторов придерживается разделения элементов по величине кларка на две группы. В группу главных элементов входят 12 элементов, кларк которых больше или близок к 1, все остальные составляют группу второстепенных элементов. Второстепенные элементы, в свою очередь, разделяются на редкие, рассеянные и радиоактивные элементы (рис. 3.3). ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ Главные Второстепенные (O, Si, Al, Fe, Ca, Mg, Na, K, C, P, Cl, Ti) (все остальные) Редкие Рассеянные Радиоактивные (кларк 10-1-3) (Li, Sc, Ga, Br, Rb, Y, Nb, Cs, Jn, Ta) (Pa, Ra, Ac, Fr, Rn, At) Рис. 3.3. Классификация элементов по величине кларка Главные элементы имеют высокие кларки, они слагают основную массу горных пород (O, Si, Al, Fe, Ca, Mg, Na, K, C, P, Cl, Ti) и являются своего рода «геохимическими диктаторами», определяя условия миграции других элементов (окислительно-восстановительные, щелочнокислотные и др.). Остальные элементы относятся к второстепенным. Все наиболее распространенные элементы располагаются в верхней части менделеевской таблицы и имеют сравнительно небольшие порядковые номера. В общем случае, по мере увеличения зарядов атомных ядер элементов, наблюдается уменьшение среднего содержания элементов в земной коре. Широко распространено понятие редкие элементы, но достаточно четкого определения оно не имеет. Обычно к этой 19 геохимической группе элементов относят те, кларк которых имеет порядок 10. Наиболее редкие – радиоактивные элементы – продукты радиоактивных последовательных превращений тория и урана, которые являются родоначальниками радиоактивных семейств (их кларки 1,3·10-3 и 2,5·10-4 %). Если оценить суммарные “ресурсы” протактиния, радия, актиния, франция, радона, астата, то в 16-метровой толще земной коры их окажется немногим более 1 млн т. Объясняется это тем, что торий и уран имеют очень большие периоды полураспада. Продукты их превращений, напротив, не долгоживущи и потому не успевают накапливаться в ощутимых количествах. Если обратиться к хронологии открытия химических элементов, то выяснится, что рассеянные элементы стали известны далеко не в первую очередь. Химический анализ должен был приобрести значительно большую “остроту зрения”, чтобы “разглядеть” незначительные примеси рассеянных элементов среди большой массы широко распространенных веществ. Огромную роль здесь сыграл спектральный анализ, открытый в 1859–1860 гг. КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Что такое геохимическая классификация элементов? В чем сходство и отличие геохимической классификации элементов от химической? 2. Дайте интерпретацию классификации химических элементов, предложенной А.Е. Ферсманом. 3. В чем суть классификации элементов В.М. Гольдшмидта? 4. Назовите литофильные элементы, дайте им характеристику. Какие минералы слагают литофильные элементы? 5. Назовите халькофильные элементы, дайте им характеристику. Какие минералы слагают халькофильные элементы? 6. Назовите сидерофильные элементы, дайте им характеристику. Какие минералы слагают сидерофильные элементы? 7. Назовите атмофильные элементы, дайте им характеристику. 8. На какие группы (и какие элементы входят в эти группы) по величине кларка можно разделить химические элементы? 9. Назовите элементы, которые имеют высокие кларки, слагают основную массу горных пород и являются геохимическими диктаторами, определяющими условия миграции других элементов (окислительно-восстановительные, щелочно-кислотные и др.). 20 4. ФОРМА НАХОЖДЕНИЯ ЭЛЕМЕНТОВ В ЗЕМНОЙ КОРЕ [23] От формы нахождения элемента в данной природной системе – образует ли он газообразные соединения, истинные или коллоидные растворы, находится ли его атом в природных водах, живых организмах, кристаллической решетке минералов и т.д. – зависит перенос и перераспределение химических элементов в земной коре, образование ореолов рассеяния, концентрация элементов и т.д. 4.1. Главнейшие формы нахождения элементов в земной коре Твердая земная кора на 99 % состоит из кислорода, кремния, алюминия, кальция, натрия, калия, магния, титана, серы, марганца и хлора. Составляющие 11 % массы литосферы Na, Ca, K, Mg, Cl, S в процессе выветривания сравнительно легко покидают кристаллические решетки минералов и образуют простые легко- и труднорастворимые соли (CaCO3, Na2SO4 и т.д.). Часть атомов этих элементов находится в природных водах в виде простых и комплексных ионов (Na+, Ca2+, SO42-, CO32- и т.д.), а часть поглощается организмами и коллоидными системами. В общем случае можно говорить о подвижной и инертной формах нахождения химических элементов. Под подвижной формой понимается такое состояние химического элемента в горных породах, почвах и рудах, находясь в котором, элемент легко может переходить в раствор и мигрировать; под инертной формой нахождения химического элемента понимается такое его состояние, находясь в котором, элемент в условиях данной обстановки обладает низкой миграционной способностью и не способен или почти не способен переходить в раствор При этом следует учитывать, что, находясь в одном и том же состоянии, элемент в одних условиях может быть подвижным, а в других – инертным. Например, гидроксиды железа в почвах и коре выветривания степных и пустынных районов инертны, а в кислой восстановительной среде таежных болот обладают высокой миграционной способностью. По степени подвижности можно выделить 8 главнейших форм нахождения химических элементов в земной коре (табл. 4.1). 21 Таблица 4.1 Формы нахождения и геологические обстановки Форма нахождения Газообразная Химические элементы и соединения O2, N2, CO2, H2S, CH4,Rn, He, Ar Легкорастворимые соли и их ионы в растворах NaCl, Na2SO4, Na2CO3, ZnSO4, Cu SO4, Na+, Cu2+ Труднорастворимые соли и их ионы в растворах CaCO3, CaSO4·2H2O, CuCO3·Cu(OH)2, PbSO4 Элементы в телах живых организмов (растения, животные, микроорганизмы) Белки, жиры, углеводы, витамины, органические соединения, состоящие в основном из C, H, O, N, в меньшей степени из S, P, K, Ca, Mg, Cu, Zn и др. Коллоидные осадки и растворы Гумус, коллоиды, гидроксиды Fe, Si, Mn, Al, глинистые минералы 2+ Адсорбированные Ca , Mg2+, Na+, Cu2+, ионы (преимущест- H+, Ni2+, Al3+ и др. в венно катионы) коллоидных минералах Межблочная форма в нарушениях кристаллов U Элементы в узлах кристаллических решеток устойчивых минералов Si, Al, Zr, Hf, W, Sn, Ta, Nb, Th, TR 22 Геологическая обстановка Атмосфера, природные воды, живое вещество, минералы (в урановых – He, в калиевых – Ar) Почвы, озера сухих степей и пустынь, кора выветривания, зона окисления сульфидных руд, континентальные отложения. Грунтовые воды районов с сухим климатом, подземные воды (рассолы), соляные месторождения Почвы, континентальные отложения степей и пустынь, кора выветривания, грунтовые воды, зона окисления сульфидных руд Ландшафты суши, особенно районов с теплым и влажным климатом (влажные тропические леса), в меньшей степени тайга, степи, тундра, пустыни. Поверхностные горизонты и прибрежные участки морей и океанов, микроорганизмы глубоких горизонтов подземных вод Почва, кора выветривания, илы водоемов Почвы, илы водоемов, кора выветривания, угли, торфа, углеродистокремнистые сланцы, глинистые осадочные породы, железные и марганцевые руды Горные породы Циркон, сфен, кварц, танталониобаты, в почвах и коре выветривания. Каолинит в коре выветривания, континентальных отложениях, в почвах Основываясь на генетическом признаке, В.И. Вернадский различал 4 формы нахождения химических элементов в земной коре: горные породы и минералы (в том числе природные воды и газы); магмы; рассеяние; живое вещество. 4.2. Истинные растворы Большинство легкорастворимых солей и их ионов образуют истинные растворы, т.е. однородные (гомогенные, или однофазные) системы переменного состава, состоящие из двух или более компонентов. Они образуются в результате растворения газов, жидкостей и твердых веществ в воде. С растворами связаны все физиологические и биохимические процессы, т.к. внутренней средой любого организма являются водные растворы. В истинных растворах (часто называемых просто растворами) растворенное вещество диспергировано до атомного или молекулярного уровня, размеры молекул и ионов и не превышают 1 нм. В форме истинных растворов мигрируют многие элементы, образующие легкорастворимые (NaCl, KCl, MgSO4, CaSO4, Na2SO4, ZnSO4 и др.) и труднорастворимые соли (CaCO3, MgCO3, NaCO3) и кремнезем. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени. 4.3. Комплексные ионы и недиссоциированные молекулы Большинство металлов в природных водах находится в виде гидроксокомплексов, полимерных ионов и комплексных соединений с анионами. Например, U в природных водах может присутствовать в виде следующих ионов: UO22+, UO2(OH)+, [UO2(CO3)2(H2O)2]2-, [UO2(CO3)3]4-, а также в виде недиссоциированных молекул UO2(OH)2. Карбонатные комплексы, сходные с урановыми, образуют медь, серебро, иттрий, редкие земли иттриевой группы и др. Особую группу комплексных соединений составляют хелаты, в которых молекула органического вещества как бы захватывает неорганический ион. Известны такие соединения для Fe, Cu, Zn, Mn и других металлов. В морской воде и в сильно минерализованных водах имеются комплексы типа [NaSO4]-. 23 Недиссоциированные молекулы широко распространены в природных водах. Так, например, в результате реакции диссоциации гидроксида трехвалентного железа: Fe(OH)3 ⇆ Fe3+ + 3OHприродные воды обогащаются ионами Fe3+. Вместе с тем, в водах часто преобладают не ионы Fe, а истинно растворенные молекулы недиссоциированной Fe(OH)3 – [Fe(OH)]2+, [Fe(OH)2]+ и [Fe(OH)3]. Недиссоциированные молекулы являются одной из важнейших форм миграции многих элементов. 4.4. Коллоиды и основные группы коллоидных минералов Коллоиды представляют собой дисперсные системы, которые содержат распределенные частицы с размерами 1–100 нм. Соединения Si, Al, Fe, Ti, Mn, составляющие около 84 % литосферы, в воде растворяются очень плохо. В связи с этим содержание их в природных водах, а также в организмах, ниже, чем у растворимых солей. В ходе выветривания эти элементы (а также As, Zr, Mo, V, Cr, Th, частично Cu, Sb, Zn, Ni, Co, Sn) легко образуют богатые водой коллоидные осадки (гели); мигрируют в коллоидной форме, часто в виде коллоидных растворов (золей); а со временем теряют часть воды и приобретают кристаллическую структуру. Поскольку элементов второй группы в земной коре значительно больше, чем в первой, среди твердых продуктов выветривания преобладают коллоиды и метаколлоиды (в отличие от коллоидов в метаколлоидах кристаллическая структура видна невооруженным глазом или обнаруживается под микроскопом), а простые соли играют подчиненную роль. Коллоидная миграция особенно характерна для влажного климата и кислых вод, богатых органическими веществами. В почвах и континентальных отложениях с сухим климатом много кальцита; воды имеют слабощелочную реакцию, не содержат или почти не содержат органических кислот. Все это не благоприятствует коллоидной миграции. Черные высокомолекулярные коллоидные органические вещества кислой природы называются гумусом. Он имеет отрицательный электрический заряд и способен адсорбировать катионы (Ca, Mg, Al, Cu, Ni, Co, Zn, Ag, Be, иногда H+ и др.). 24 Гумусовые вещества подвижны в щелочной среде. Они легко мигрируют в природных содовых водах (в солонцовых почвах, на участках разрушающихся нефтяных месторождений). В кислой среде, например, в болотах, гумусовые вещества также сравнительно легко мигрируют, придавая воде темно-бурую окраску. В нейтральной и слабощелочной среде миграционная способность гумуса низка; в этих условиях он остается на месте своего образования или мигрирует механическим путем в виде взвеси. К числу минеральных коллоидов относится гель кремнекислоты, имеющий также отрицательный заряд и обладающий способностью в связи с этим адсорбировать многие металлы (Cu, Co и др.). Этот гель характерен для многих почв, распространен в зоне окисления сульфидных руд, во многих осадочных породах. Типичными твердыми гелями кремнезема являются опалы (SiO2·nH2O). Халцедон и частично кварц относятся к метаколлоидам. Коллоидные и метаколлоидные гидроксиды Mn также имеют отрицательный заряд и легко поглощают из раствора Li, Cu, Ni, Co, Zn, Ra, U, Ba, W, Ag, Au, Ta и другие рудные элементы. Встречаются в виде черных налетов, примазок, дендридов, землистых масс во многих почвах, коре выветривания, болотных и озерных отложениях, древних водоносных горизонтах, осадочных рудах марганца. В минералогическом отношении это манганит (Mn2O3·nH2O), пиролюзит (MnO2), вернадит MnO2·H2O), вады (группа коллоидных минералов, состоящих из MnO2, ряда окислов других минералов и воды). Они часто содержат примеси SiO2, Al2O3 и др. Коллоидные и метаколлоидные силикаты, в том числе кристаллические (монтмориллонит, бейделлит, нонтронит, волконскоит; каолинит-галлуазит; гидрослюды; палыгорскит; смешанослойные минералы хлорит-вермикулит, гидрослюда-монтмориллонит) и аморфные (аллофан) глинистые минералы также имеют отрицательный заряд и способны поглощать катионы. Коллоидные и метаколлоидные гидроксиды железа наиболее характерны для кислых почв и всех проявлений кислого выветривания. Они легко диагностируются по ржавой и бурой окраске. Формы их выделения – бобовины, примазки, пленки. Эти минералы положительно заряжены и обладают способностью адсорбировать анионы. В них нередко обнаруживается V, P, As, U, Mo, In, B. Важнейший минерал группы – гидрогетит – FeO·OH·H2O. Значительно реже распространены коллоидные гидроксиды алюминия. Они образуются при выветривании и осадкообразовании в условиях влажного и жаркого климата, а также частично при сернокислот25 ном выветривании пород. Это минералы диаспор и бемит (Al2O3·nH2O) и гиббсит (Al2O3·3H2O), входящие в состав бокситов. В бокситах обнаруживаются примеси Ti, V, Ga, Sr, Ni, Ta, редко B и U. К числу метаколлоидных минералов относятся также некоторые оксиды титана (TiO2·H2O), циркония (бадделеит – ZrO2), олова («деревянное олово» – SnO2), ванадия (навахоит – V2O5·3H2O и др.), вольфрама (тунгстит – WO3·H2O), урана (настуран – kUO2·bUO3·mPbO). Известны коллоидные и метаколлоидные карбонаты (разновидности кальцита, магнезита, сидерита, смитсонита и др.), сульфаты (барит и др.), фосфаты, ванадаты. КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Что такое подвижная и инертная формы нахождения химических элементов? 2. Охарактеризуйте 8 наиболее распространенных форм нахождения элементов и геологические обстановки, в которых они существуют. 3. Какие основные формы нахождения химических элементов в земной коре по генетическому признаку выделил В.И. Вернадский? 4. Для каких обстановок и почему особенно характерна коллоидная миграция? 5. В какой форме переносятся глинистые минералы, кремнезѐм, органическое вещество, соединения Fe, Mn, P, V, Cr, Ni, Co и др.? 6. В какой форме мигрируют хлориды, сульфаты, карбонаты, частично соединения Fe, Mn, P? 7. В какой форме мигрируют соли и их ионы: NaCl, Na2SO4, Na2CO3, ZnSO4, CuSO4, Na+, Cu2+? 8. В какой форме и почему мигрируют соли и их ионы: CaCO3, CaSO4·2H2O, CuCO3·Cu(OH)2, PbSO4? 9. Что такое истинные растворы? Какие элементы мигрируют преимущественно в ионной форме? 10. Что такое комплексные ионы и недиссоциированные молекулы? 11. Назовите элементы, которые способны легко образовывать коллоиды и мигрировать в этой форме. 12. Что такое золи, гели? 13. В чем состоит отличие коллоидов от метаколлоидов? 14. Что такое гумус? Охарактеризуйте особенности поведения гумусовых веществ в природе. 15. В чем отличие отрицательных и положительных коллоидов? 26 5. ОСНОВНЫЕ ЗАКОНЫ МИГРАЦИИ И РАССЕЯНИЯ ЭЛЕМЕНТОВ. ВИДЫ И ТИПЫ МИГРАЦИИ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ [1, 2, 23] Миграция химических элементов – это перенос и перераспределение химических элементов в земной коре и на поверхности Земли Миграция элементов лежит в основе непрерывно протекающего процесса круговорота веществ на Земле. А.И. Перельман выделил 4 основных вида миграции химических элементов: 1. Механическую миграцию (водная, воздушная, гравитационная). 2. Физико-химическую миграцию (водную и воздушную). 3. Биогенную миграцию. 4. Техногенную миграцию. Механическая миграция (механогенез) подразумевает механическое перемещение химических элементов без изменения форм их нахождения (перемещение обломков минералов в поверхностных водах и атмосфере, воды рек, газы атмосферы и т.д.). Физико-химическая миграция включает миграцию и сопровождающие ее химические реакции для таких форм нахождения элементов, как водные растворы и газовые смеси. К ним же относятся диффузия, процессы радиоактивного распада, сорбции, явления изоморфизма. Биогенная миграция объединяет всю миграцию химических элементов, связанную с жизнедеятельностью организмов (растительных и животных). Техногенная миграция вызвана деятельностью людей и перемещением химических элементов при проведении хозяйственной (и другой) деятельности. 5.1. Внутренние и внешние факторы миграции элементов Выделяют внутренние и внешние факторы (рис. 5.1), определяющие миграционную способность элементов. Такое деление факторов было предложено А.Е. Ферсманом (1994 г.). К внутренним относятся факторы, связанные с химическими свойствами самих элементов. Важнейшими их них являются электростатические (кристаллизационные) свойства ионов, свойства связей соединений, химические 27 свойства соединений, гравитационные свойства атомов и радиоактивный распад ядер атомов. Факторы миграции Внутренние Внешние Строение атома Размер Температура pH Валентность Другие Давление Eh Рис. 5.1. Основные факторы миграции элементов Электростатические (кристаллизационные) свойства ионов учитываются при миграции элементов, мигрирующих в виде свободных ионов. Такая миграция характерна для водных растворов, газовых смесей, живого вещества, в которых миграция осуществляется в виде комплексных соединений, истинных растворов и т.д. Свойства связей соединений характеризуют способность противостоять усилиям, направленным на их разрушение. Они обусловливаются особенностями внутреннего строения соединений, энергией кристаллической решетки, твердостью минералов, спайностью и т.д. Химические свойства соединений определяют их устойчивость: известно, что оксиды, карбонаты, сульфаты (т.е. кислородные соединения) более устойчивы, чем сульфиды. Гравитационные свойства атомов оказывают влияние при перемещении элементов в процессах кристаллизации, выветривания, седиментации: каждый атом притягивается с силой, пропорциональной его массе. Радиоактивный распад ядер атомов играет роль при миграции радиоактивных элементов. В земной коре имеется 17 долгоживущих радиоактивных изотопов, наибольшее число изотопов имеют Rb, Th, K и U. К внешним факторам миграции относятся факторы, зависящие от свойств среды, в которой осуществляется миграция химических элементов. Важнейшими внешними факторами миграции являются температура, давление, степень электролитической диссоциации, концентрация 28 водородных ионов, наличие (или отсутствие) в среде свободного кислорода. Температура во многом определяет миграционную способность элементов. Так, с увеличением температуры раствора увеличивается скорость химических реакций, взаимная растворимость элементов, повышается миграционная способность. Биологическая миграция может осуществляться только в строго определенном интервале температур, обусловленном процессами существования организмов. Давление играет большую роль в миграции элементов, особенно в расплавах, растворах и газовых смесях. С изменением давления может происходить изменение фазового состояния вещества без изменения температуры, возможно изменение скорости течения реакций и даже ее направления; возрастание давления способствует изоморфному вхождению элементов в чужие кристаллические решетки. Степень электролитической диссоциации определяется свойствами растворителя и растворенного в расплавах и растворах вещества и зависит как от температуры, так и от концентрации вещества. Концентрация водородных ионов (или pH среды) характеризует ее кислотность – щелочность, контролирует осаждение из растворов химических элементов, их соединений и коагуляцию коллоидов. Наличие (или отсутствие) в среде свободного кислорода так же, как и кислотность-щелочность среды влияет на ход миграции элементов, определяет их растворимость или осаждение, способствует формированию тех или иных соединений. 5.2. Кислотность-щелочность среды Концентрация водородных ионов определяет pH среды и характеризует кислотно-щелочные свойства природных растворов (среды миграции). Вода – слабый электролит, диссоциирующий на ионы Н+ и ОНпри любых температурах, однако, обычно степень диссоциации очень мала. При температуре 22˚ C в 1 литре дистиллированной воды содержится 10-7 молей ионов водорода и столько же ионов гидроксила. Содержание ионов Н+ определяет меру кислотности воды. В щелочных водах – [Н+]<10-7, а в кислых – [Н+]>10-7. Для удобства обозначения принято степень кислотности-щелочности среды характеризовать не концентрацией водородных ионов (10-7, 10-12, 10-2 и т.д.), а показателем pH. Показатель pH – отрицательный логарифм концентрации ионов Н+, выраженный в граммах на литр 29 Он представляет собой количественное соотношение в воде ионов Н и ОН-, образующихся при диссоциации воды. Если в воде пониженное содержание свободных ионов водорода (рН>7) по сравнению с ионами ОН-, то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН<7) – кислую. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга. В таких случаях вода нейтральна и рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению уровня pH. Чем меньше или больше удаление значения pH от 7, тем более увеличиваются кислотные или щелочные свойства среды. + PH=7 КИСЛАЯ НЕЙТРАЛЬНАЯ ЩЕЛОЧНАЯ Кислотность-щелочность среды контролирует миграционную способность элементов, их осаждение из растворов, коагуляцию коллоидов и т.д. Изменение концентрации водородных ионов влияет на подвижность многих металлов и их ионов. Большинство химических элементов образует наиболее растворимые соединения в сильно кислых средах и менее растворимые – в нейтральных. Кислые и слабо кислые воды (pH< 6) благоприятны для миграции: Ca, Sr, Ba, Ra, Cu, Zn, Cd, Cr3+, Fe2+, Mn4+, Ni, многие из этих элементов слабоподвижны в щелочных водах. В щелочных водах (pH>7) подвижны: 6+ Cr , Se, Mo, V5+, As, Ni2+, Co2+, Zn2+, Mn2+, Ag+, Cd2+, Pb2+, Y3+, La3+. Только в сильно кислых водах существуют катионы Fe3+, Al3+, Co3+, Cr3+, Bi3+, Sn2+, Th4+, Zr4+, Ti4+, Sb3+, Sc3+, в природных водах они имеют низкую миграционную способность и выпадают в осадок. Так, осаждение гидроксида Fe3+ происходит при pH=2, а Mg2+ – при pH=10,5, что свидетельствует о высокой миграционной способности Fe3+ в сильно кислой среде, снижающейся по мере увеличения щелочных свойств (пленки и налеты гидроксида железа в болотных илах), и высокой подвижности Mg2+ в слабо щелочной и щелочной среде. Щелочность среды во многом определяет также миграцию глинозема и кремнезема: Al3+ при pH=5–9 практически нерастворим (осаждение его происходит при pH=4,1); в то время как Si4+ при pH =5–9 становится очень активным. 30 5.3. Типоморфные элементы и соединения водной миграции Хорошо растворимые в воде элементы и соединения (кальций, магний, натрий, хлор-ион, сульфат-ион, гидрокарбонат-ион и др.) в случаях высоких концентраций в значительной степени определяют щелочно-кислотные условия природных вод. Их присутствие определяет обстановки водной миграции, поэтому их называют типоморфными элементами или типоморфными соединениями. Существует ряд обстановок водной миграции, каждая из которых характеризуется несколькими типоморфными ионами и соединениями. Главнейшими типами обстановок водной миграции, по составу водных мигрантов, А.И. Перельман назвал следующие: 1. Сильнокислая (pH<4); типоморфные ионы: Н+, местами SO42-, Fe3+, Al3+, Zn2+, Cu2+ и др. 2. Кислая (pH<6,5 и >4); типоморфные ионы: Н+, анионы органических кислот. 3. Нейтральная и слабощелочная, гидрокарбонатно-кальциевая (pH=6,5–8,5); типоморфные ионы: Ca2+, НCO3-. 4. Нейтральная и слабощелочная, хлоридно-сульфатная (pH=7–8); типоморфные ионы: Na+, Cl-, SO42-. 5. Гипсовая, нейтральная и слабощелочная; типоморфные ионы: 2+ Ca , SO42-. 6. Содовая, щелочная (pH>8,5); типоморфные ионы и соединения: НCO3 , OН-, SiO2, Na+. 5.4. Окислительно-восстановительный потенциал среды Изменение окислительно-восстановительных условий обусловлено способностью элементов отдавать (окисление) или принимать (восстановление) электроны и связано с наличием (или отсутствием) в среде важнейшего окислителя – свободного кислорода (атмосферного или растительного). Мерой окисления или восстановления вещества является окислительно-восстановительный потенциал Еh, измеряемый в милливольтах (вольтах): среда окислительная – при положительных значениях Еh; восстановительная – при отрицательных значениях Еh. Чем выше абсолютная величина Еh, тем выше степень окисления или восстановления. Окислительная, или кислородная, обстановка образуется в поверхностных или близповерхностных условиях (верхние части литосфе31 ры, гидросфера, атмосфера, биосфера), где кислорода много. Окислителями являются также элементы и ионы, способные принимать электроны: Fe3+, Mn4+, S6+, Cr6+, Ce6+, Mo6+, N5+, V5+, As5+. Породы, образованные в окислительной обстановке имеют бурую, красную, оранжевую, желтую окраску или оттенок за счет окисного железа (Fe3+): Fe2+ ⇆ Fe3+ + ē. Значения Eh для окислительной обстановки: в щелочной среде – Еh >0,15 (до 0,6–0,7 в); в кислой – Еh>0,4–0,5 в. Окислительная обстановка способствует накоплению катионогенных элементов переходной валентности (Fe, Mn, Co) и увеличению растворимости анионогенных элементов (V, Mo, U, Re, S). Восстановительная обстановка образуется, если доступ кислорода в горные породы ограничен или процессы протекают в бескислородных условиях. Восстановителями являются Fe2+, S2-, Mn2+, Cr3+, V3+ и многие органические соединения. Щелочные и щелочноземельные металлы (Na, K, Ca) легко теряют свои валентные электроны (значительно легче водорода) и переходят в состояние положительно заряженного иона (катиона). Эти элементы являются сильными восстановителями, они разлагают воду, выделяя из нее водород. Восстановительная обстановка может быть двух типов: восстановительная без сероводорода (глеевая) и восстановительная сероводородная. Восстановительная обстановка без сероводорода (глеевая) характеризуется тем, что воды не содержат свободного кислорода и других сильных окислителей, но содержат углеводороды (метан), растворенные органические соединения (гуминовые кислоты, спирты), двухвалентное железо, СО2, водород. Для пород этой обстановки характерна сизая, серая и зеленоватая окраска. В этих условиях легко мигрируют железо и марганец (в форме 2+ Fe и Mn2+). В кислой среде – Еh<+0,15 в, в щелочной – Еh<+0,4, +05 в. Глеевая обстановка способствует разложению алюмосиликатов и железистых силикатов. В отличие от окислительной обстановки, в глеевой увеличивается миграционная способность катионогенных и уменьшается миграционная способность анионогенных элементов. Сероводородная восстановительная обстановка характеризуется восстановительными бескислородными условиями с сероводородным 32 заражением: H2S, HS-, S2-, местами в водах много метана и других углеводородов. Обстановка преимущественно со щелочными условиями; величина Еh часто ниже 0, до –0,5 и –0,6 в. Для пород этой обстановки характерно присутствие запаха сероводорода и черные, серые, реже зеленые окраски. В этой обстановке многие металлы не мигрируют, так как образуют труднорастворимые сульфиды. 5.5. Геохимические барьеры Геохимические барьеры возникают на всех стадиях литогенеза и при наложено-эпигенетических процессах. Геохимическими барьерами называют участки земной коры, на которых в направлении миграции элементов одна устойчивая геохимическая обстановка на относительно коротком расстоянии сменяется другой Концентрация элементов на геохимических барьерах может быть вызвана различными причинами: поглощением организмами, изменением давления, химических условий и др. А.И. Перельман подразделил природные барьеры на три основных класса: механические, биогеохимические и физико-химические. Механические барьеры представляют собой участки резкого уменьшения интенсивности механической миграции, когда форма нахождения элементов не меняется, но они перемещаются в пространстве (нахождение элементов в минеральной или коллоидной форме). Биохимические барьеры представляют собой накопление химических элементов растительными и животными организмами. Они образуются в результате биогенной миграции, при этом изменяется форма нахождения элемента без его существенного перемещения. Физико-химические барьеры образуются при изменении физико-химической обстановки. Чаще всего образование физикохимических барьеров обусловлено изменением кислотно-щелочных и окислительно-восстановительных условий среды. Накопление химических элементов на барьерах, как правило, приводит к их аномальным концентрациям. В случаях, если генетически связанные геохимические барьеры разных классов накладываются друг на друга, образуются комплексные геохимические барьеры. 33 При резком изменении концентрации водородных ионов на пути мигрирующего потока образуются щелочные или кислые барьеры. Щелочной барьер образуется на участках резкого повышения значения pH, если кислая обстановка сменяется щелочной, слабощелочная – резкощелочной или сильнокислая – слабокислой. Щелочной барьер образуется при резком повышении значения pH pH=1 pH=5,5 Сильнокислая Слабокислая pH=7 pH=10 pH=8,5 Резкощелочная Нейтральная Слабощелочная * Стрелкой обозначено направление миграции растворов Щелочные барьеры имеют большое значение для концентрации металлов, так как металлы (за исключением U, Mo и др.) легче мигрируют в кислой обстановке, чем в щелочной. На щелочных барьерах из водных растворов осаждаются: карбонаты; гидроксиды; фосфаты; арсенаты; ванадаты. Примеры: 1. На водонефтяных контактах за счет бактериального окисления нефти воды обогащаются органическими кислотами. 2. Повышение кислотности вод, мигрирующих от этого контакта, сопровождается активным растворением карбонатов коллектора. 3. На образующихся щелочных барьерах начинается осаждение Al и Ca, формируется каолинит и вторичный кальцит. Кислые геохимические барьеры формируются, когда нейтральные или щелочные условия скачкообразно меняются на слабокислые, а также при довольно резкой смене слабокислой обстановки на сильнокислую или даже при резкой смене сильнощелочных условий слабощелочными. Кислый барьер образуется при резком понижении значения pH pH=1 pH=5,5 Сильнокислая Слабокислая pH=7 pH=10 pH=8,5 Нейтральная Слабощелочная Резкощелочная * Стрелкой показано направление миграции растворов 34 На кислых барьерах чаще концентрируются анионогенные химические элементы: Si, Ge, Mo и др. В зависимости от характера изменения окислительновосстановительных условий выделяют три типа барьеров: кислородный (окислительный) барьер; восстановительный (глеевый) барьер; восстановительный сероводородный барьер. Кислородные (окислительные) барьеры наиболее распространены. Они образуются на фоне резкого повышения значения Eh, на участках резкой смены восстановительных условий окислительными, когда миграционные потоки с бескислородными водами (глеевыми или сероводородными) попадают в зоны со свободным кислородом, а также при смене резковосстановительных условий слабовосстановительными и слабоокислительных – резкоокислительными. Окислительный барьер образуется при резком повышении значения Eh Eh=-0,6 Eh=-0,3 Резковосстановительная Eh=0 Слабовосстановительная Eh=+0,3 Eh=+0,6 Слабоокислительная Резкоокислительная * Стрелкой показано изменение Eh среды В кислой обстановке на кислородных барьерах осаждаются элементы с переменной валентностью Fe, Mn, Co. Они образуют минералы: гематит (Fe2O3), гидрогематит (Fe2O3·nH2O), гетит (HFeO2), гидрогетит (HFeO2·nH2O), пиролюзит (MnO2), асболан (Со). В щелочной обстановке железо малоподвижно, а марганец хорошо мигрирует. На кислородных барьерах вследствие этого осаждаются преимущественно марганецсодержащие минералы: пиролюзит (MnO2), псиломелан (m MnO·MnO2·nH2O), манганит (Mn2+Mn4+O2[OH]2) и др. На кислородных барьерах может концентрироваться сера и селен. Примеры: 1. Хлопья серы при выходе на поверхность сероводородных источников. 2. Железные шляпы при окислении сульфидных месторождений. 3. Пленки гидроксидов железа при выходе родниковых вод. 4. Пленки гидроксидов марганца в водопроницаемых породах и болотных почвах в степной и пустынной зоне. 35 Восстановительные геохимические барьеры возникают на участках резкой смены окислительной обстановки восстановительной или же в участках смены слабовосстановительных более восстановительными средами. При этом щелочно-кислотное состояние вод может быть различным. Восстановительные геохимические барьеры делятся на: глеевые, сульфидные (сероводородные). Восстановительный барьер образуется при резком понижении значения Eh Eh=-0,6 Eh=-0,3 Резковосстановительная Eh=0 Слабовосстановительная Eh=+0,3 Eh=+0,6 Слабоокислительная Резкоокислительная * Стрелкой показано изменение Eh среды Глеевые барьеры возникают на участках резкой смены окислительной обстановки глеевой или же на контакте слабоглеевой и резкоглеевой сред. На глеевых барьерах осаждаются железо, цинк, свинец и другие халькофильные элементы с постоянной валентностью. Возможно осаждение: урана (U6+→ U4+), селена (Se4+→ SeO →Se2-), меди, серебра, молибдена и др. Примеры: 1. Краевые части болот (из поверхностных кислородных вод, при смене окислительной обстановки глеевой осаждаются: U, Cu, Ag, Mo, Cr, V, As). 2. Участки разложения органических веществ без доступа кислорода или при его недостаточном поступлении (образуются метан и др. углеводороды, растворенные органические соединения Fe2+ и H2). 3. Зоны поступления по разломам водорода. Сульфидные (сероводородные барьеры) также образуются при резком понижении значения Eh, но с участием H2S (в виде газа или водного раствора). Происходит осаждение химических элементов, поступающих с кислородными и глеевыми водами, имеющими разные кислотно-щелочные характеристики. В зонах сероводородного заражения (глубинный сероводород, сероводород при бактериальном разложении органического вещества в диагенезе и в зонах водонефтяных контактов) происходит взаимодействие H2S с растворенными солями и самородными металлами, при этом образуются труднорастворимые сульфиды. 36 КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Что такое геохимические барьеры? На какие классы они делятся? 2. При каких условиях формируются щелочные геохимические барьеры? 3. При каких условиях формируются кислые геохимические барьеры? 4. В какой обстановке легко мигрируют железо и марганец (в форме Fe2+ и Mn2+), воды содержат углеводороды (метан), растворенные органические соединения, СО2, водород. 5. Дайте характеристику кислородных барьеров. 6. На какие группы делятся барьеры восстановительные, при каких условиях они формируются? 7. Назовите обстановку, в которой многие металлы не мигрируют, так как образуют труднорастворимые сульфиды, и для которой характерны черные, серые, реже зеленые окраски. 8. К какой группе (окислители или восстановители) и почему относятся элементы: Fe3+, Mn4+, S6+, Cr6+, Ce6+, Mo6+, N5+, V5+? 9. Какая обстановка способствует накоплению катионогенных элементов переходной валентности (Fe, Mn, Co) и увеличению растворимости анионогенных элементов (V, Mo, U, Re, S)? 10. Как по окраске пород можно определить обстановки их образования? 11. К какой группе по окислительно-восстановительным свойствам относятся органические соединения; Fe2+, S2-, Mn2+, Cr3+, V3+? 12. При каких значениях Eh формируются хлопья серы при выходе на поверхность сероводородных источников; железные шляпы; пленки гидроксидов железа при выходе родниковых вод; пленки гидроксидов марганца в водопроницаемых породах? 13. Какие барьеры образуются на участках резкой смены восстановительных условий окислительными? 14. На каких барьерах в кислой обстановке осаждаются минералы: гематит (Fe2O3), гидрогематит (Fe2O3·nH2O), гетит (HFeO2), гидрогетит (HFeO2·nH2O), пиролюзит (MnO2), асболан (Со)? 15. На каких барьерах в щелочной обстановке осаждаются марганецсодержащие минералы: манганит (Mn2+·Mn4+O2 [OH]2), псиломелан (m MnO·MnO2·nH2O), пиролюзит (MnO2)? 16. Какие геохимические барьеры образуются в участках смены слабовосстановительных более восстановительными средами? 37 6. СТАДИИ ЛИТОГЕНЕЗА [28, 29] Под литогенезом понимают совокупность процессов образования и последующих изменений осадочных горных пород Образование осадков, из которых возникают осадочные горные породы, происходит на поверхности земли и в водных бассейнах в результате комплекса механических, физических, биологических и химических превращений. В цикле литогенеза различают следующие стадии: гипергенез, седиментогенез, диагенез, катагенез и метагенез. Положение различных зон литогенеза в разрезе верхней части земной коры показано на рис. 6.1. Дождевые осадки рН=7 Средний уровень океана Океан рН=8 рН<7 Зона диагенеза Зона катагенеза Зона гипергенеза Озерные воды рН=5-7 Метеорные воды pH=7-9 Eh=0 Смешанные Погребенные воды рН>9 воды (соленые) Движение H2O рН=8 Н2О 9 зм фи р мо та е М Рис. 6.1. Схема расположения различных зон литогенеза в разрезе верхней части земной коры, по Р.У. Фербриджу Гипергенез – образование и мобилизация исходного вещества осадков в процессе физического и химического разрушения материнских пород и его перенос к месту захоронения. Седиментогенез – поступление осадков в конечные водоемы стока и окончательное осаждение. Диагенез – физико-химическое уравновешивание насыщенного водой осадка, завершающееся преобразованием его в осадочную горную породу. 38 Катагенез (иногда называют эпигенез) – дальнейшее изменение породы по мере увеличения глубины ее захоронения под влиянием возрастающих температуры и давления, а в некоторых случаях и воздействия водных растворов и газов. Метагенез (или собственно метаморфизм) – последующее преобразование состава пород при дальнейшем их погружении. Многие исследователи (Н.М. Страхов, Н.В. Логвиненко и др.) к литогенезу относят только гипергенез, седиментогенез и диагенез, а метагенез рассматривают как самостоятельную стадию между катагенезом и метаморфизмом. Попадая на большие глубины (в результате длительного опускания), в условиях повышенного давления и повышенной температуры осадочные породы подвергаются различным, в том числе и химическим, изменениям. Выходя на поверхность земли (при поднятии) эти породы выветриваются и вновь попадают в зону гипергенеза (рис. 6.2). Гипергенез в недрах. Сначала анаэробный, затем аэробный Остаточные породы Гипергенез (выветривание) на поверхности. Денудация Перенос исходного для осадков вещества , Диагенез преобразование осад ка в пород у T = 10-25 С 0 Прерванный цикл Катагенез изменение пород под влиянием температуры и давления T = 300-350 С 0 Укороченный цикл Метагенез (метаморфизм) коренное преобразование пород T = 500-8000 С Полный цикл Ультраметагенез (ультраметаморфизм) - расплавление, переход в магму Рис. 6.2. Общая схема стадий литогенеза, по Н.Б. Вассоевичу 39 Опу скание П о д н я ти е ведущее к завершению цикла литогенеза Седиментогенез (образование осадка) Учитывая разночтения в определении границ стадий литогенеза, была разработана обобщенная схема стадий, подстадий (этапов) и градаций литогенеза (по Н.Б. Вассоевичу, с учетом данных Н.В. Лопатина, А.Э. Конторовича, С.Г. Неручева, В.И. Ручнова, В.В. Чернышова и др.). Она имеет следующий вид (табл. 6.1). Таблица 6.1 Градация МК1 (1) МК2 (1,5) МК3 (0,9) МК4 (0,9) Глубина 2,7–8 км. Температура 210–280˚ С МК5 (0,5) АК1 (2,5) Подстадия апокатагенеза – АК Отвечает стадии «метаморфизма» каменных углей от АК2 (3,5) «Т» до «А» включительно АК3 (8) Глубина 5–15 км. Температура 300–350˚ С АК4 (11) Стадия метагенеза (регионального метаморфизма). Графитизация Подстадия мезокатагенеза – МК Соответствует степени углефикации по шкале для Донбасса от «Д» до «ОС» включительно Градация Стадия катагенеза Градация Стадия седиментогенеза Подстадия аэробного диагенеза Стадия диагенеза Глубина 100–200 м. Температура 10–25˚ С Подстадия анаэробного диагенеза ПК1 (0,5) Подстадия протокатагенеза – ПК Соответствует буроугольному этапу углефикации ПК2 (1) Глубина 1–3 км. Температура 50–70˚ С ПК3 (1,5) Геохимические процессы, протекающие на различных стадиях литогенеза, ведут к образованию, а затем и преобразованию осадочных толщ, определяют условия существования пород, их химический и минералогический состав, структуру, коллекторские свойства и многие другие особенности, с которыми связано формирование и размещение в осадочных толщах месторождений нефти, газа и других полезных ископаемых. Именно с определенными стадиями и зонами литогенеза связаны главная стадия (фаза) и зона нефте- и газообразования. КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Назовите и охарактеризуйте стадии образования и преобразования осадочных горных пород. Проанализируйте табл. 6.1. 40 2. Чем отличается схема зон (стадий) литогенеза, предложенная Р.У. Фербриджем, от схемы Н.Б. Вассоевича? Сформулируйте понятия: «прерванный цикл», «укороченный цикл», «полный цикл». 7. ГЕОХИМИЯ ГИПЕРГЕНЕЗА [6, 22] Геохимия гипергенеза – наука о совокупности процессов, приводящих к разрушению одних минералов и горных пород и образованию других в поверхностных частях земли под действием факторов, характерных для атмосферы, гидросферы и биосферы На стадии гипергенеза происходит: 1) изменение ранее образовавшихся горных пород, 2) образование особых типов пород (остаточных), минуя стадию седиментогенеза, и 3) формирование исходного материала для осадков, превращающихся затем в осадочные горные породы. Гипергенез является начальной стадией прогрессивного литогенетического цикла, предысторией седиментогенеза. Характерной его особенностью является то, что он осуществляется в термобарических условиях, свойственных земной поверхности. При этом в рамках гипергенеза, согласно Н.М. Страхову и Н.В. Логвиненко, можно выделить 4 этапа: 1 – этап преобладания процессов механического разрушения пород; 2 – усиления процессов химического разложения, которые протекают преимущественно в щелочных условиях и приводят к образованию гидрослюд и гидрохлоритов; 3 – этап господства химического разложения, протекающего преимущественно в нейтральных и кислых условиях с образованием минералов группы каолинита, монтмориллонита и др.; 4 – этап завершения процессов химического разложения, гидролиза силикатов с образованием охр, бурых железняков и латеритов. Ведущая роль в гипергенезе (особенно в областях гумидного климата) принадлежит химическому изменению пород, т.е. химическому выветриванию. 7.1. Химическое выветривание горных пород Минералы глубинных зон Земли, попадая на ее поверхность, превращаются в минералы, устойчивые на земной поверхности, сложные соединения трансформируются в более простые. 41 Процесс химического преобразования горных пород в поверхностных термодинамических условиях называется химическим выветриванием Факторами химического выветривания являются: вода, кислород, углекислый газ, а также гуминовые и минеральные кислоты. Процессы химического выветривания преобладают во влажных тропиках и субтропиках, влажной экваториальной и умеренно влажной зонах, особенно при равнинном рельефе и наличии богатой растительности. В результате химического выветривания осуществляется вынос катионов, изменение кристаллической решѐтки; а также осуществляется полный распад вещества. При этом большое количество вещества переходит в коллоидные и истинные растворы. На месте залегания материнских пород возникает кора выветривания, образуются новые, устойчивые в условиях поверхности Земли, минералы, коллоидные и истинные растворы. Кора выветривания – континентальная геологическая формация, образовавшаяся на земной поверхности в результате изменения исходных горных пород под воздействием жидких и газообразных атмосферных и биогенных агентов Процессы, протекающие в коре выветривания, можно разделить на следующие группы: 1. Миграция химических элементов в коре выветривания складывается из выщелачивания и аккумуляции. В результате гидролитического разложения горных пород и воздействия агрессивных органических и неорганических компонентов, растворенных в воде, при образовании кор выветривания наиболее подвижные породообразующие элементы (Na, K, Ca, Mg, Si) выносятся, а менее подвижные (Fe, Al, Ti, Zr и др.) накапливаются. В корах выветривания аккумулируются также вещества, поступающие из атмосферы: кислород, вода, CO2, хлор и сера. 2. Кора выветривания – это область широкого развития процессов окисления. Окисление – процесс передачи электронов атомами, входящими в минерал, кислороду. В корах выветривания окисление идет преимущественно в водной среде, а элементы с переменной валентностью переходят к ее более высокому состоянию. Железо, марганец и сера в изверженных породах находятся в основном в двухвалентной форме (Fe2+, Mn2+, S2-), а в коре выветривания, окисляясь, дают соединения Fe3+, Mn4+, S6+ (Fe2O3, MnO2, CaSO4 и т.д.). 42 Часто процесс окисления идет ступенчато, с образованием промежуточных минералов: FeS2 → FeSO4 → Fe2(SO4)3 → Fe(OH)3. 3. Не менее характерны и процессы гидратации. Гидратация – процесс присоединения воды к минералам. Почти все вторичные минералы, в том числе и коллоидные, содержат воду (гидратную, кристаллизационную и т.д.), в то время как в большей части первичных минералов ее нет. В зоне гипергенеза гидратация может проходить самостоятельно: 2Fe2O3 + 3H2O → 2Fe2O3 · H2O. 4. Гидролиз – один из наиболее распространенных процессов изменения минералов в зоне гипергенеза, так как путем гидролиза разрушаются силикаты и алюмосиликаты, которые слагают половину объема внешней части континентальной земной коры. Его можно рассматривать как обменное разложение вещества под влиянием гидролитической диссоциации воды, как реакцию между ионами воды (Н+ и ОН-) и ионами минералов, сопровождающуюся разрушением одних и образованием других минералов. Наиболее характерен пример гидролиза полевых шпатов с образованием каолинита: 2K[AlSi3O8] + 3H2O → 2 KOH + H2Al2Si2O8 · H2O + 4SiO2. Интенсивность процесса гидролиза, которому сопутствуют растворение и гидратация, зависит от климатических условий: в умеренном климате гидролиз протекает до стадии образования гидрослюд; во влажном теплом климате – до стадии образования каолинита; в субтропическом – до стадии образования латерита. 5. Карбонатизация – процесс взаимодействия ионов [CaCO3]2- и [НCO3]- с минералами. Карбонатизации предшествует растворение минералов, а затем из растворов, обогащенных продуктами растворения, синтезируются карбонаты: Ca2Al2Si2O8 + 2 H2O + CO2 → H2Al2Si2O8 · H2O + CaCO3. анортит каолинит кальцит Все катионы К, Na, Са при взаимодействии с углекислотой образуют истинные растворы карбонатов (СаСО3, Na2CО3, К2СО3) и бикар43 бонатов. В условиях влажного и теплого климата карбонаты выносятся за пределы места их образования. В условиях сухого климата и недостатка влаги карбонаты остаются на месте, образуя твердую корку, или выпадают из раствора на некоторой глубине от поверхности. 6. Восстановление – процесс в зоне гипергенеза редкий, контролируется локальными участками с обилием органического вещества и бактерий и недостатком кислорода: 2Fe2O3 · 3H2O +С → 4FeO +СO2 + 3H2O, FeO +СO2 →FeCO3. 7. Диализ – процесс разделения раствора на коллоидный и истинный. Мембранами служат глинистые породы. 7.2. Зональность коры выветривания. Коры выветривания по магматическим породам Поскольку проявление агрессивных свойств просачивающихся вод с глубиной уменьшается, кора выветривания приобретает зональное строение: от коренных, слабо измененных пород до интенсивно выветрелых вблизи дневной поверхности. Под зоной коры выветривания понимают часть коры, обладающую определенным минеральным составом, физическими свойствами и структурно-текстурными особенностями Обычно химическое выветривание (за редким исключением) начинается в щелочных условиях среды и по мере формирования профиля выветривания переходит в кислую фазу. Воздействие на породы воды, содержащей углекислоту, приводит к выносу оснований, гидратации и растворению. Очередность и интенсивность выноса элементов определяются растворимостью соединений и свойствами химических элементов. Согласно миграционным рядам элементов Б.Б. Полынова и А.И. Перельмана: к энергично выносимым из коры выветривания элементам и соединениям относятся: Cl (Br, J), S; к легко выносимым – щелочные и щелочно-земельные металлы (Ca, Na, Mg, K), а также F и SiO2 силикатов; к подвижным – P, Mn, Co, Ni, Cu; 44 к инертным (слабо подвижным) – Fe, Al, Ti; к практически неподвижным – SiO2 окислов. По минеральному составу, отражающему геохимические процессы в коре выветривания, выделяют 4 минерально-геохимические зоны (рис. 7.1). В зависимости от состава исходных пород зоны слагаются различными минеральными ассоциациями. В разрезе они сменяют друг друга в следующей последовательности (снизу вверх по разрезу): 4. Гидроксидов и оксидов; 3. Глинистых минералов; 2. Выщелачивания; 1. Дезинтеграции; Материнские породы. 45 Почвенно-растительный слой Гидрослюдистый горизонт Каолиновый горизонт Зона гидроксидов и оксидов Зона глинистых минералов Зона выщелачивания Зона дезинтеграции пород Материнские (коренные) породы Рис. 7.1. Строение полного профиля коры выветривания Совокупность зон образует профиль коры выветривания Различают три типа профилей коры выветривания: 1) полный – включает все 4 минерально-геохимических зоны; 2) сокращенный – отсутствует 1 или 2 промежуточные зоны; 3) неполный – отсутствуют 1, 2 или 3 верхние зоны. Название профиля дается по наиболее развитой минеральной зоне (гиббситовый, каолинитовый, нонтронитовый и др.), либо по совокупности слагающих зон (например, полный кералито-нонтронитоохристый или сокращенный кералито-охристый). 46 Полный профиль коры выветривания по ультраосновным породам (серпентинитам) имеет следующий вид: 4. Гидроксидов и оксидов – охры (гетит, лимонит и др.); 3. Глинистых минералов – обохренные нонтрониты, – нонтрониты, – нонтронитизированные серпентиниты; 2. Выщелачивания – выщелоченные серпентиниты; 1. Дезинтеграции – дезинтегрированные серпентиниты; Материнские породы – серпентиниты. Механизм выветривания серпентинитов представляется следующим образом. В процессе химического выветривания в кислой обстановке (рН=4–5) при высоком окислительном потенциале серпентин разлагается: первым выносится Mg, затем начинает мигрировать несколько менее подвижное Fe, которое не выносится за пределы коры выветривания, как Mg, а накапливается в нижних зонах. При дальнейшем изменении серпентинитов и другие входящие в них минералы гидратируются, замещаясь глинистыми продуктами выветривания. В конечном итоге серпентин превращается в нонтронит; ромбические пироксены, замещаясь пеннином, дают начало гематиту и лимониту; первичный магнетит также замещается гематитом: 1) 2Mg2Fe2+[Si2O5](OH)4+2 OH+nH2O → Серпентин 2) Раствор → Fe23+[Si4O10](OH)2·nH2O+4Mg(OH)2; Нонтронит 3) Раствор 4(Mg,Fe)[SiO3]+Mg(OH)2+Al(OH)3→ Ромбический. пироксен Раствор → (Mg,Fe)5Al[AlSi3O10](OH)2+SiO2. Пеннин Полный профиль коры выветривания по основным породам представлен зонами: 4. Гидроксидов и оксидов – охры (гетит, лимонит, др.); 3. Глинистых минералов – монтмориллонитизированные долериты, хлорит-монтмориллонитизированные долериты; 2. Выщелачивания – выщелоченные долериты; 1. Дезинтеграции – дезинтегрированные долериты; Материнские породы – долериты неизмененные. 47 В процессе химического выветривания в кислой обстановке (рН=3–4) при высоком окислительно-восстановительном потенциале темноцветные минералы разлагаются, переходят сначала в хлорит и лептохлорит, затем последовательно замещаются монтмориллонитом, магнетит переходит в гематит. В нижней зоне отмечаются новообразования вада и опала, а в самых низах разреза – доломита и магнезита. Выветрелые перидотиты в отличие от выветрелых серпентинитов редко бывают обохрены. Поэтому и сопровождающие железо Ni, Co, Mn промышленных концентраций обычно не образуют. Профиль коры выветривания по средним породам имеет следующий вид: 4. Гидроксидов и оксидов – лимонит, гидроксиды марганца; 3. Глинистых минералов – каолинитовая зона; монтмориллонит-каолинитовая зона; каолинит-монтмориллонитовая зона; хлорит-монтмориллонит-каолинитовая зона; 2. Выщелачивания – выщелоченные плагиопорфиры; 1. Дезинтеграции – дезинтегрированные плагиопорфиры; Материнские породы – плагиопорфиры. В хлорит-монтмориллонитовой-каолинитовой зоне выветрелых плагиопорфиров в тяжелой фракции много зерен амфибола, магнетита, ильменита. В каолинит-монтмориллонитовой и монтмориллониткаолинитовой зонах они замещаются железистым хлоритом, лимонитом и лейкоксеном, а в верхней частях этой зоны отмечается широкое развитие гидроксидов марганца. В каолинитовой зоне тяжелые минералы представлены лишь лимонитом. В легкой фракции снизу верх фиксируется постепенное уменьшение содержания пеннина с параллельным увеличением содержания лептохлорита. В этом же направлении уменьшается содержание плагиоклаза и увеличивается содержание кварца. Наиболее интенсивно снизу вверх уменьшается содержание щелочей (Na, K), менее резко Ca, Fe2+ и SiO2; Mg, Mn, Cr выщелачиваются в нижней части разреза, накапливаясь в верхней, а Ti и Ni, наоборот, накапливаются внизу. Значительно увеличивается снизу вверх содержание Fe3+ и очень слабо – Al. С корой выветривания плагиопорфиров связаны месторождения каолинов. В процессе химического выветривания плагиопорфиров в резко окислительной обстановке и кислой среде (рН=4–5) амфибол пе48 реходит в хлорит, затем замещается монтмориллонитом и лимонитом; плагиоклазы серицитизируются и каолинитизируются; гидрослюда и монтмориллонит переходят в каолин; магнетит замещается гематитом, а затем – лимонитом: ильменит лейкоксенизируется, биотит преобразуется в гидрослюду. В отличие от выветрелых гипербазитов, здесь нацело вынесены щелочи, щелочные земли и Mg: NaCa2(Mg,Fe)4(Al,Fe)[(Si,Al)4O11]2(OH)2+H2O+CO2+Mg(OH)2→ Роговая обманка Раствор →Mg5Al[AlSi3O10](OH)8+NaOH+Ca(OH)2→ Пеннин → (Na,Ca)( Mg,Fe)2[(Si,Al)4O10](OH)2·nH2O+3Mg(OH)2; Монтмориллонит Раствор pNaAlSi3O10·gCaAl2Si3O8+CO2+H2O→Al2[Si2O5](OH)4+Na2CO3+CaCO3. Плагиоклаз Раствор Каолин Раствор Кора выветривания по кислым породам имеет вид: 4. Гидроксидов и оксидов – кварц, гидроксиды железа; 3. Глинистых минералов – каолинитовая подзона, гидрослюдисто-каолинитовая подзона; 2. Выщелачивания – граниты выщелоченные; 1. Дезинтеграции – граниты дезинтегрированные; Материнские породы – граниты неизмененные. В коре выветривания гранитоидов снизу вверх интенсивно уменьшается содержание Na, K, Mg, Fe2+, SiO2. Титан и марганец, выщелачиваясь в верхней части, накапливаются в нижней. В верхней части значительно увеличивается содержание Al, отчасти Fe3+. С этой корой связаны месторождения каолинов и редких элементов. В процессе химического выветривания гранитоидов в окислительной обстановке при pH=3–4 плагиоклазы серицитизируются, биотит переходит в гидрослюду и гидрогетит. Пеннин, заместивший пироксены и амфиболы, – в монтмориллонит; гидрослюда – в каолинит; магнетит – в гематит, замещающийся затем гетитом: pNaAlSi3O10·gCaAl2Si3O8+K2CO3+H2O→KAl2[Si3O10](OH)2+NaCO3+CaCO3; Плагиоклаз Раствор Серицит Раствор K(Mg,Fe)3[AlSi3O10](OH)2+H2O+H+→(K,H3O)[AlSi3O10](OH)2·nH2O+ 49 Биотит Гидробиотит +Al(OH)3+CO2→(K,H3O)Al2[AlSi3O10](OH)2·nH2O+Fe(OH)3+MgCO3; Раствор Гидромусковит Раствор (K,H3O)Al2[AlSi3O10](OH)2·nH2O+СO2+H2O→Al2[Si2O5](OH)4+K2СO3; Гидромусковит Каолин Fe2O3+H2O→Fe2O3·H2O. 2Fe3O4+O→3Fe2O3; Магнетит Раствор Гематит Гематит Гетит В кислых породах, подвергшихся выветриванию, как и в коре выветривания основных пород, почти нацело выносятся щелочи и щелочные земли, Fe2+, Ni, Co и менее значительно Si, накапливаются Al, Si и малые элементы. Обызвесткование здесь отсутствует, а каолин свободен от малых элементов. КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Дайте определение понятию «геохимия литогенеза». 2. Сформулируйте задачи, которые решает геохимия литогенеза. 3. Что такое химическое выветривание? Назовите его факторы. 4.Что такое кора выветривания? Назовите причины возникновения зональности в коре выветривания. 5. Как образуется профиль коры выветривания, какие типы профиля выветривания выделяют? 6. Приведите схему зональности коры выветривания. 7. Назовите процессы, протекающие в коре выветривания? 8. Охарактеризуйте окислительные и восстановительные процессы, протекающие в коре выветривания. 9. В чем заключается различие в процессах гидролиза, диализа и гидратации? 10. По каким материнским породам развивается кора выветривания, проиллюстрированная реакцией: 2Mg2Fe2+[Si2O5](OH)4+2OH+nH2O→Fe23+[Si4O10](OH)2·nH2O+4Mg(OH)2? 11. По каким материнским породам развивается кора выветривания, проиллюстрированная реакцией: NaCa2(Mg,Fe)4(Al,Fe)[(Si,Al)4O11]2(OH)2+H2O+CO2+Mg(OH)2→ →Mg5Al[AlSi3O10](OH)8+NaOH+Ca(OH)2→ → (Na,Ca)( Mg,Fe)2[(Si,Al)4O10](OH)2·nH2O+3Mg(OH)2? 50 12. По каким материнским породам развивается кора выветривания, проиллюстрированная реакцией: pNaAlSi3O10·gCaAl2Si3O8+CO2+H2O→Al2[Si2O5](OH)4+Na2CO3+CaCO3? 13. Проследите изменение условий и назовите подвижные и неподвижные химические элементы в зоне гипергенеза. Приведите ряд подвижности элементов и соединений в коре выветривания. 14. Какова направленность изменения кислотности-щелочности среды при химическом выветривании? 8. ГЕОХИМИЯ СЕДИМЕНТОГЕНЕЗА [29] Согласно Н.М. Страхову, седиментогенез представляет собой «совокупность явлений, протекающих на поверхности Земли 51 и приводящих к возникновению новых осадочных образований за счет переработки ранее существовавших твердых минеральных масс» Состав и свойства поступающего в бассейны седиментации материала зависят от многих причин: от состава растворов, поступивших из зоны гипергенеза, от степени подвижности элементов, от условий их трансформации и осаждения (свойства и состав среды седиментации и др.). Со стадией седиментогенеза связано формирование многих месторождений полезных ископаемых осадочного происхождения (железа, алюминия, фосфора и др.). При этом транспортировка и осаждение элементов и их соединений контролируется геохимическими условиями, как на путях миграции, так и в бассейне седиментации. Важная роль при этом принадлежит свойствам вод, в которых осуществляется миграция и осаждение материала. 8.1. Химический состав наземных вод Наземные внутриматериковые воды являются основным путем миграции химических элементов и условием поступления их в бассейн осадконакопления. Колебания химического состава наземных внутриматериковых вод проявляются как в масштабах всей суши, так и в пределах отдельных континентов, регионов, водоемов, озер. Контрастность зависит от агрегатного состояния воды (лед, пар, жидкая вода и т.д.), от температуры, солености, pH и т.д. Сопоставление химического состава вод океанов и рек показывает, что в реках накапливаются Be, Fe, Zr, Cr, Pb, Al, Ti, Mn, Ni, Si, Co, Zn, Th, Cu – элементы, отражающие влияние состава земных пород, подвергающихся речной эрозии. Главными катионами внутриматериковых вод являются Ca, Na, Mg, (Fe, Al), K, а анионами – CO3, SO4, SiO2, Cl, NO3. Миграция элементов в континентальных условиях связана в основном с потоковым режимом аллювиальных фаций и осуществляется в условиях низких значений pH, высоких значений Eh при постоянном промывном режиме, при котором соли K, Na, Ca и даже Mn и Fe выносятся за пределы речного осадконакопления в конечные водоемы стока. В отложениях гумидных зон накапливаются компоненты со сложными формами миграции, переносимые частью в составе кластического материала, частью в виде растворов истинных и коллоидных. Таковы соединения Fe, Mn, P и малых элементов, входящих в III и II группы: V, Cr, Ni, Co, Cu, Ba, Sr, Be, Ga и др. В континентальных условиях эти 52 элементы перемещаются в реках частью в составе взвесей, частью в виде растворов. Соотношение между взвешенной и растворенной формами (по Н.М. Страхову, для Черноморского бассейна) может быть представлено следующим рядом: V [Cr, Co, Be, Ga] Fe, Mn, P [Pb, Sn] Ba Cu Sr, где последующий член ряда все в большей степени мигрирует в виде раствора и в меньшей – в виде взвеси. Так,V и Cr принадлежат к группе, в переносе которой растворы практически не имеют места, они мигрируют в основном в виде взвесей и обогащают более крупнообломочные породы. Перенос Fe, Mn и Ni осуществляется как в виде взвесей, так и за счет растворов, и максимум концентрации этих элементов (а также Cu, P, Co, Ca) смещается в более тонкопелитовую фракцию. 8.2. Состав океанической воды В составе океанической воды отмечается более 70 элементов таблицы Д.И. Менделеева, но преобладают 5 элементов – O, H, Cl, Mg, Na. Всего в океане растворено 5·1022 г солей. В силу большой растворимости соединений Na+, Li+, Mg2+, Cl-, SO42- и им подобных, морские воды обогащены этими катионами и анионами по сравнению с речными. Труднорастворимые соединения типа CaCO3, BaSO4, Fe(OH)3 и их аналоги быстро осаждаются. Тяжелые элементы Cu, Zn, Pb, Mo, Hf, TR, U сорбируются органическим веществом, гидратами железа и марганца, фосфатами кальция, силикатами, и поэтому их содержание в воде океанов оказывается более низким, чем это следует из их растворимости. В процессе фотосинтеза поверхностные слои воды обогащаются кислородом и обедняются углекислотой. Организмы, населяющие верхние слои океана, извлекают из морской воды Si, Ca, Mg, K, Br, I, P, N, V, Zn, Cu, Co, Ni и др. и огромные массы CaO и SiO2, нитратов и фосфатов (в области проникновения солнечного света фосфаты и нитраты в морской воде отсутствуют, а содержание CaO и SiO2 также растет с глубиной). Отмирая и разлагаясь, биогенные продукты обогащают конкреции дна Cu, Zn, Ni, Co, Ag, Tl, Pb и др. Геохимическая история отдельных элементов в истории Земли тесно связана с континентами, напротив, существование других элементов чаще всего контролируется осадками конечных водоемов стока. Одни элементы осаждаются преимущественно химическим путем, в осаждении других принимает существенное участие живая природа. 53 В качестве таких элементов рассмотрим геохимическое поведение элементов триады Al – Fe – Mn и тетрады P – SiO2 – CaCO3 – MgCO3. 8.3. Геохимия триады рудных элементов Al – Fe – Mn Алюминий, железо и марганец образуют рудную триаду со сходным геохимическим поведением. Их объединяет следующее: 1. Они накапливаются в коре выветривания, сформированной в гумидной зоне. В тропической влажной зоне алюмосиликаты (основные источники Al) в ходе выветривания гидратируются, затем замещаются каолинитом. В дальнейшем разложение каолинита приводит к формированию свободных гидроксидов Al2O3 и Fe2O3. Возникает латеритный тип бокситов и железных руд. То же самое происходит и в корах выветривания железных и марганцевых руд (Fe и Mn), конечными продуктами выветривания которых являются железные и марганцевые «шляпы». 2. Они накапливаются в аллювиальных отложениях гумидных зон. По геохимической подвижности элементы триады выстраиваются в ряд: Al Fe Mn, в котором миграционная способность увеличивается слева направо, т.е. менее подвижен Al, более подвижно Fe и наибольшей подвижностью обладает Mn. В соответствии с миграционной способностью локализация руд носит дифференцированный характер: алюминиевые руды (гидраргиллит, гидраргиллит-бемитового состава) распространены в верховьях потока и его верхних веточках; железные руды (гидрогетит и гидрогетит-шамозит-сидеритового состава) накапливаются ниже по долине реки вплоть до ее устья; марганцевые руды распространены в окончаниях рек, дельтовых зонах, подводных частях дельтового комплекса. 3. Наибольшее распространение руды Al, Fe и Mn получили в конечных водоемах стока (озерах и морях). Озерные бокситовые, железные и марганцевые руды тяготеют к прибрежной зоне бассейнов. Тяготение к периферической части еще резче проявляется в локализации морских бокситов, железных и марганцевых руд. Они распространены главным образом в зоне шельфа и реже (преимущественно марганцевые руды) в начале континентального склона, приурочены к заливам, бухтам, островным участкам моря и формируются в относительно мелководных водоемах с невысокой динамикой воды. При этом алюминиевые руды тяготеют к континентам, к 54 их береговым зонам; профиль оолитовых железных руд резко сдвинут в сторону моря, а марганцевые руды еще далее смещаются в открытое море, заходя во внутренние части осадочных морских формаций. Осаждение алюминия, железа и марганца осуществляется хемогенным путем и подчиняется химическим законам. При наличии индивидуальных черт в механизме рудообразования у рудной триады сохраняются общие черты: 1. Образование руд связано с выносом материала с континента. Запасы Al, Fe и Mn в морских водах ничтожны, и в рудообразовании они практически не принимают участия. 2. Рудная триада Al – Fe – Mn является моноклиматической, специфически гумидной. Только гумидные условия обеспечивают достаточную подвижность Al, Fe и Mn в коре выветривания, вследствие чего отмечается строгая привязанность рудных накоплений триады к гумидным поясам. 8.4. Геохимия тетрады P – SiO2 – CaCO3 – MgCO3 Фосфор, кремнезем, карбонаты кальция и магния (CaCO3 и MgCO3) образуют генетически тесно связанную тетраду, по геохимической подвижности в гумидной зоне выстраивающуюся в ряд: Al Fe Mn P SiO2 CaCO3 MgCO3. Подвижность группы во много раз больше, чем у группы Al – Fe – Mn, лишь фосфор близок по подвижности к марганцу. В силу своей высокой подвижности все члены тетрады вовсе не задерживаются в коре выветривания континентов и в путях переноса (реки – дельтовые зоны) и накапливаются лишь в конечных водоемах стока. Геохимическая история тетрады P – SiO2 – CaCO3 – MgCO3 теснейшим образом связана с живой природой, в одних случаях (Р) она подготавливает химическое осаждение, в других (CaCO3) действует как главный осадитель, в третьих (SiO2 и MgCO3) выступает как единственный осадитель. Эти накопления не являются специфичными только для гумидных зон, а характерны и для зоны аридной, т.е. они биклиматичны. Фосфор накапливается в условиях гумидного и аридного климата. На континенте в гумидном климате его образования связаны с костеносными породами и гуано животных (в первую очередь летучих мышей) пещер. Но основной цикл накопления фосфора связан на континенте с отложениями низинных болот (вивианит), реже с озерными 55 осадками (вивианит и фосфориты). В аллювиальных фациях фосфор редок и сохраняется только в случаях близко размываемых прибортовых торфяников, обогащенных фосфором. Переносится и осаждается Р на континенте совместно с Fe. В морских отложениях как гумидного, так и аридного (главный генератор фосфатных руд) климата фосфор накапливается в виде фосфоритов. Форма их нахождения – желваки (конкреции), иногда сцементированные в сплошную плиту, фосфатные ракушняки. В связи с тем что основными аккумуляторами фосфора являются живые организмы, после отмирания которых и накапливаются фосфатные отложения, последние обычно приурочены к открытым частям морских побережий. СаСО3 в речных водах гумидных зон повсеместно находится в состоянии резкого недосыщения и поэтому не накапливается ни в движении, ни в аллювии, ни дельтовых зонах. Единственными областями, где идет накопление карбоната кальция, являются конечные водоемы стока. Прежде всего это моря, где в теплом климате и, как правило, в удаленных от берега участках дна образуются карбонатные морские формации гумидных поясов. В озерах гумидных поясов, имеющих мягкую воду, карбонат кальция также не накапливается. Накопление СаСО3 связано с озерными обстановками с жесткой водой переходных (от гумидной к аридной) зон. В них карбонат кальция накапливается только в полосе подводных зарослей и прибрежной мелководной отмели и представлен озерным мелом или мергелем. Поэтому в северных морях и пресных озерах химическая садка карбоната кальция исключена из седиментационного процесса, так как при низких температурах воды богаты свободной углекислотой, что делает их недонасыщенными СаСО3. Осаждение карбонатов кальция здесь осуществляется лишь огранизмами, извлекающими кальций из воды для строения раковин. Интенсивная садка кальцита является характерным процессом именно аридных зон. При приближении к засушливым областям и при увеличении температуры во всех типах водоемов накопление СаСО3 усиливается. При этом в аридной зоне СаСО3 накапливается, начиная от коры выветривания через делювий, пролювий, аллювий и т.д. вплоть до отложений конечных водоемов стока. В слабоминерализованных водах аридных водоемов (где нет речного стока) карбонатные образования накапливаются даже вблизи берегов. MgСО3 также биклиматичен: осаждение его осуществляется как в гумидных, так и в аридных условиях, но скорее тяготеет именно к аридным зонам. В гумидных зонах соединения углекислого магния резко недосыщают все типы природных вод, и осаждение их из растворов происходит здесь только биогенным путем и в тесном соседстве с 56 CaCO3. Причем организмы, накапливающие MgСО3, обитают исключительно в морских бассейнах и чаще всего в рифовых мелководных отложениях. В осадках рек, пресных озер и опресненных водоемов накопления MgСО3 не происходит. В исключительно редких случаях и очень локально (при pH=9 и выше) возможна химическая садка основной соли углекислого магния [nMgCO3·mMg(OH)2·pH2O], который затем превращается в доломит. В аридных условиях углекислый магний накапливается в виде доломита, часто с ничтожной (1–3 %) примесью кальцита, либо вовсе без него. Поскольку осолонение водоемов в аридной зоне приводит к быстрому вымиранию фауны биогенное осаждение MgСО3 (преобладающее в гумидной зоне) сменяется на химическое, которое резко превалирует. При высокой минерализации морской воды садка доломита интенсифицируется, образуются пластовые доломиты; при низкой минерализации химическое осаждение MgСО3 идет параллельно с садкой CaСО3, образуются «пятнистые» глинисто-кальцит-доломитовые илы. SiО2. Воды гумидных зон резко недосыщены SiО2. Несмотря на высокую растворимость SiО2 (в гумидной зоне при pH=7–8 и Т=0–25° С растворимость SiО2 ~ CaCO3 и составляет 100–120 мг/л), содержание кремнезема в воде невысокое (на порядок меньше, чем растворимость) и составляет 10–15, реже 20 мг/л. Кремнезем в природные воды поступает за счет растворения кварца, опала, силикатов и алюмосиликатов. Эти процессы идут медленнее, чем растворение карбонатов. Вследствие недонасыщенности вод кремнеземом, химическое осаждение его в гумидной зоне исключено, и возможно только его биогенное извлечение. Растворимость SiО2 растет с повышением температуры и увеличением pH, что в гумидной зоне реализуется не в достаточной мере. При резкой недосыщенности SiО2 природных вод, естественно, что в речных водах осаждение кремнезема не происходит, т.е. так же как и для CaCO3 и MgCO3 реки являются транзитными каналами. Лишь в конечных водоемах стока – озерах и морях осуществляется садка SiО2. Осаждение кремнезема в озерах связано с диатомовыми водорослями и кремниевым скелетом губок. При этом с утонением осадка содержание кремнезема в озерах увеличивается. В морях и океанах кремниевые диатомовые илы тяготеют к прибрежной полосе и области высоких широт с низкими температурами воды, радиоляриевые илы смещаются в тропические области. Генерация твердой фазы кремнезема, подобно химическому осаждению фосфатов и карбонатов, не связана с подтоком речных вод и не возникает прямо за счет выносимого ими материала. Непосредственным 57 источником SiO2, P, карбонатов является сама водная масса океанов, реки лишь только пополняют их. Кремнистые отложения гораздо ближе подвинуты к берегу, по сравнению с карбонатами. SiО2 и CaCO3 характеризуются противоположным отношением к климатическому режиму. В то время как CaCO3 в пределах гумидной зоны тяготеет к низким широтам с теплым климатом, SiО2, напротив, явно приурочен к более высоким широтам с холодным климатом. SiО2 также биклиматический компонент, накапливающийся как в гумидном, так и в аридном климате. КОНТРОЛЬНЫЕ ВОПРОСЫ 1. В чем особенности химического состава наземных и океанических вод? 2. Что означает приведенный ряд: V [Cr, Co, Be, Ga] Fe, Mn, P [Pb, Sn] Ba Cu Sr? 3. В чем заключается сходство геохимического поведения в триаде Al – Fe – Mn? 4. Что объединяет элементы и соединения P – SiO2 – CaCO3 – MgCO3 в тетраду? 5. Чем отличается поведение элементов триады Al–Fe–Mn от поведения элементов терады P – SiO2 – CaCO3 – MgCO3 ? 6. Расположите элементы и соединения в порядке возрастания их подвижности: SiO2, Mn, Al, MgCO3, P, Fe, CaCO3. 7. Обоснуйте последовательность размещения руд в соответствии с миграционной способностью в ряду Al – Fe – Mn? 8. Существование каких элементов связано с живой природой? 9. Какие элементы осаждаются только химическим путем? 10. В чем отличие поведения CaCO3 от MgCO3? 11. В чем отличие поведения Al от Fe и Mn? 12. В чем отличие поведения CaCO3 от SiO2? 13. Охарактеризуйте особенности накопления фосфора в условиях аридного и гумидного климата. 9. ГЕОХИМИЯ ДИАГЕНЕЗА [9, 15, 17, 18, 24, 28, 29] Только что возникший осадок представляет собой неуравновешенную систему реакционноспособных веществ, которая путем хими58 ческих преобразований постепенно переходит в физико-химически уравновешенную систему и становится породой. Стадия физико-химического уравновешивания первичных компонентов осадка в термодинамических условиях поверхности Земли называется диагенезом Геохимия диагенеза исследует процессы миграции (в том числе рассеяния и концентрации) химических элементов, протекающие в формирующихся осадочных породах. При диагенезе существует три главных неуравновешенных между собой системы: вода, органическое вещество, осадок. 9.1. Особенности преобразования вод при диагенезе Одной из важнейших особенностей осадков всех водоемов является их высокая влажность, варьирующая в зависимости от механического состава грунтов в широких пределах (19 % – в песках Каспия, до 86 % – в илах Калифорнийского залива и до 95 % и выше – в озерах Европейской части России, богатых органическим веществом). С влажностью осадка связано наличие весьма обильного и разнообразного бактериального мира. Характерной особенностью осадков, как физико-химической системы, является своеобразный солевой состав пропитывающего их раствора (иловых вод), резко отличный от наддонной воды. Соленость иловых вод может достигать 1180–1200 мг-экв/л. Иловые растворы обогащены Cl-, SO42- (сульфат-ионом), соединениями щелочного резерва (ионы HCO3- + CO32-), катионами: Ca2+ и Mg2+ (содержание их в иловых водах всегда понижено сравнительно с исходной наддонной водой), K+ и Na+ (концентрация которых всегда повышена против содержания их в наддонных водах). За счет разложения азотсодержащих органических веществ иловые воды обогащены NH4+. Кроме того, иловые воды обогащены Fe, P, Si, Mn, Al2O3 и некоторыми малыми элементами (V, Cr, Ni, Sr, B и др.). С глубиной гидрохимический тип иловых вод меняется, воды метаморфизуются. Метаморфизация основного солевого состава иловых вод может идти 2 путями: 1. Метаморфизация гидрокарбонатного типа. Решающее значение имеет органическое вещество, обусловливающее редукцию сульфат59 иона (SO42-), некоторую роль играет выветривание терригенных минералов под влиянием генерируемой CO2, что влечет обогащение иловых растворов K+ и Na+. Десульфатизация ведет к тому, что иловая вода сильно обогащается гидрокарбонатами Ca, Mg, Na, NH4; ее щелочной резерв резко увеличивается. 2. Метаморфизация хлор-кальциевого типа. Здесь десульфатизация не сопровождается увеличением щелочного резерва, но резко меняется состав хлоридной части воды. Решающее значение здесь имеет состав глинистых минералов, способных к обмену Са2+ на Na+ (и K+). 9.2. Химическое преобразование органического вещества Преобразование отмершего органического вещества претерпевает несколько этапов: ранний этап диагенеза связан с разложением и высвобождением седиментогенных и органических соединений. Автолиз мертвых клеток или ферментативное расщепление основных биохимических групп органического вещества – белков, жиров и углеводов заключается в гидролизе органического вещества, т.е. в присоединении воды к их сложным молекулам. В результате этого крупные молекулы расщепляются на простые, типа кислот и спиртов; жиры расщепляются на жирные кислоты и глицерин; углеводы – на моносахариды; белки – на аммиак. Разложение микроорганизмами (бактериями и грибками), которые питаются продуктами автолиза или ферментативно разрушают отмершие организмы. Наиболее распространены: гнилостные бактерии, разрушающие белки с выделением NH3 и H2S; анаэробного брожения клетчатки, гемицеллюлозы, сахаров; бактерии, окисляющие УВ (метан, этан, пропан, гексан) и водород; денитрификаторы и нитрификаторы; бактерии, усвояющие азот; десульфатизаторы; бактерии молочнокислого, уксуснокислого брожения; тиобактерии; железобактерии. В итоге анаэробного сбраживания грунтовые растворы обогащаются продуктами распада CO2, H2, NH3, CH4, H2S, аминокислотами и др. Биохимическое разложение органического вещества начинается сразу после отмирания бионтов еще в фотическом слое, но наиболее ин60 тенсивно протекает в поверхностном слое осадка. Поэтому диагенез – это биогенная стадия преобразования осадка. Ранний диагенез называют микробиальной стадией осадка, так как именно деятельность микроорганизмов определяет в раннем диагенезе практически все протекающие процессы. В позднем диагенезе органического вещества также испытывает преобразования, связанные с микробиальной деятельностью. В поверхностном слое рыхлого осадка можно выделить четыре компонента: минеральная часть, костное органическое вещество (остатки отмерших животных и растений), поровые воды, живые организмы бентоса. Процесс разложения органики протекает по-разному в зависимости от окислительно-восстановительных условий в осадке, в то же время количество и качество органического вещества формирует окислительно-восстановительный потенциал осадка. Окислительновосстановительную обстановку среды осадконакопления определяет степень изолированности этой среды от прямого доступа свободного кислорода и деятельность микрофлоры, зависящая от количества и качества органического вещества, присутствующего в осадке. 9.2.1. Преобразование органического вещества в окислительной обстановке В окислительных обстановках разрушение органического вещества описывается схематическим уравнением аэробного окисления: С6Н12О6 + 6О2 = 6СО2 + 6Н2О. Бактерии используют молекулярный кислород и окисляют органическое вещество до СО2 и воды. В условиях продолжающегося доступа кислорода и низкой продуктивности органическое вещество может израсходоваться полностью, например в хорошо аэрируемых песчаных осадках, в которых практически отсутствует органика. Процессы разложения органики интенсивны в том случае, когда до полного сгорания существуют окислительные и резко окислительные условия диагенеза: при низких концентрациях органического вещества, обычно ниже 0,5 %, значения Eh положительные (+ 200 мВ). Разложение бактериями падающих сверху остатков планктонных организмов и бентоса приводит к тому, что в результате органическое вещество убывает, а растворы обо61 гащаются нерастворенным органическим веществом, растет их окисляемость. 9.2.2. Преобразование органического вещества в восстановительной обстановке Восстановительная обстановка устанавливается в следующих случаях: 1) при отсутствии кислорода в осадке; 2) при потреблении микроорганизмами поступающего извне кислорода быстрее, чем он может диффундировать в осадок; 3) при высоком содержании органики, когда весь свободный кислород израсходован полностью. Она выражается в низких и отрицательных значениях окислительновосстановительного потенциала Eh и легче возникает в тонкозернистых осадках: глинах, алевритах, тонких карбонатных илах. В восстановительных условиях скорость деструкции органики резко снижается, разрушение органического вещества идет только за счет анаэробных гетеротрофных бактерий. В анаэробном разрушении органического вещества выделяется две стадии: I. На первой – гетеротрофная группа анаэробных бактерий (первичных анаэробов) подвергает ферментативному гидролизу и брожению основные классы органических соединений (белки, липиды, полисахариды) с образованием низших жирных кислот, спиртов, альдегидов, кетонов, СО2 и Н2О. II. На второй стадии анаэробной деструкции эти метаболиты служат субстратами для вторичных анаэробов – сульфатредуцирующих и метанобразующих бактерий. Анаэробное разрушение органических веществ идет по схеме: I. II. С6Н12О6 + 6Н2О = 6СO2 + 12Н2, далее СО2 + 4Н2 → СН4 + 2Н2О. В результате в анаэробных природных экосистемах в процессе деструкции органического вещества происходит потребление низкомолекулярных органических соединений. При этом первая стадия анаэробного разложения, как правило, опережает вторую, поэтому в иловых водах осадков накапливается некоторое количество простых веществ (кислот, спиртов, альдегидов, кетонов и др.). 9.3. Химическое превращение минеральных твердых фаз В ходе диагенеза мы по существу имеем несколько геохимических обстановок. 62 Придонные воды имеют слабо кислую среду, отличаются высокими значениями Eh, высоким содержанием O2, CO2 и SO4. Грунтовые растворы верхнего слоя осадка (глубина 20–40 см), благодаря химическому преобразованию органического вещества и обогащению продуктами распада (CO2, H2, NH3, CH4, H2S, аминокислотами и др.), обладают повышенной кислотностью. За счет реакции СО2 с СaСО3, обычно находящегося в осадках, и дополнительного перевода его в раствор в виде Ca(HCO3)2, накапливается углекислый аммоний. Исчезновение свободного кислорода приводит к тому, что среда из окислительной становится восстановительной, и Eh падает до 0 и отрицательных значений. Начинается редукция богатых кислородом минеральных соединений, способных восстанавливаться и отдавать часть О2 или даже всю его массу. В первую очередь в еще кислородной обстановке восстанавливаются MnO2 и Fe2O3, переходя в соли закиси. Обладая высокой растворимостью, они находятся в растворах. По мере погружения осадков в строго анаэробной среде благодаря сульфатредуцирующим бактериям, осуществляется разложение SO4, находящегося в составе сульфатов: CaSO4 + HCO3 H2S + CaCO3 + CO2, а растворы еще более обогащаются сероводородом и углекислым газом. 9.4. Этапы диагенеза и зональность диагенетического минералообразования В соответствии с особенностями превращения вещества при диагенезе Н.М. Страхов выделил следующие этапы диагенеза. Самый ранний этап (окислительный) протекает в верхнем слое осадка, находящемся в окислительной или нейтральной обстановке. В бассейнах с нормальным кислородным режимом толщина этого слоя 10–15 см (до 0,5 м); с дефицитом кислорода – слой не превышает нескольких сантиметров или отсутствует. На этом этапе образуются железомарганцевые конкреции, фосфориты, цеолиты; продолжительность его от нескольких дней до тысячелетий. Второй этап (восстановительный) протекает в осадках до глубин 10 м и характеризуется восстановлением сульфатов, железа и марганца. Для третьего этапа характерно прекращение бактериальной деятельности, перераспределение новообразованных минералов, формирование конкреций, локальная цементация и перекристаллизация ранее 63 образовавшихся минералов. Образование новых минеральных фаз носит зональный характер и осуществляется на разных этапах по-разному. С самым ранним этапом диагенеза связано окислительное минералообразование (зона железо-марганцевых конкреций и глауконита). Процессы преобразований осадка протекают в кислой среде, создаваемой повышенными концентрациями органического вещества. Это способствует растворению карбонатов и фосфатов. По мере увеличения глубины, исчезает из системы свободный кислород, среда из окислительной становится восстановительной, Eh падает до 0 и отрицательных значений. Начинается редукция богатых кислородом минеральных соединений, способных восстанавливаться и отдавать часть О2 или даже всю его массу. В первую очередь в еще кислородной обстановке восстанавливаются MnO2 и Fe2O3, переходя в соли закиси: Fe2O3 →FeO·nH2O, Mn3O4 →MnO·nH2O, P2O5 →PO4·nH2O. Обладая высокой растворимостью, они находятся в растворах. Со вторым этапом диагенеза связано восстановительное минералообразование, которое протекает по схемам: FeO →FeS2, CaO →CaCO3, MgO →MgCO3. Идет переработка минералов окислительной зоны, с увеличением глубины образуются: силикаты Fe и Mn → карбонаты → сульфиды. По мере погружения осадков в строго анаэробной среде, благодаря сульфатредуцирующим бактериям, осуществляется разложение SO4, находящегося в составе сульфатов. В результате реакции CaSO4 + HCO3 H2S + CaCO3 + CO2 растворы еще более обогащаются сероводородом и углекислым газом. В участках, содержащих органическое вещество, при участии бактерий и избытка H2S, железо, первоначально присутствовавшее в виде FeO(OH), сначала восстанавливается до Fe(OH)2: FeO(OH) + CH4 + 2H2O Fe(OH)2 + CO2 + 7H, FeO(OH) + 1/6 C6H12O6 + H2O Fe(OH)2+ CO2 + 3H. 64 Затем, при воздействии на оксиды и гидроксиды железа H2S, железо полностью восстанавливается до FeS и FeS2. Главные минералы, образующиеся в этих условиях, представлены сульфидами – марказитом (нейтральные и кислые условия) и пиритом (слабощелочные условия). Третий этап диагенеза. С восстановительными обстановками при дальнейшем уплотнении пород связан этап перераспределения вещества. Уплотнение пород и выпадение из растворов новых минералов приводит к тому, что единые по составу воды разбиваются на ряд самостоятельных несмешивающихся участков. Диффузионные токи приводят к повышению концентрации веществ на отдельных участках. При этом нового подтока вещества не происходит, а идет перераспределение компонентов внутри системы. Образуются диагенетические конкреции и минеральные псевдоморфозы по остаткам растений и животных. Таким образом, геохимические процессы существенно различны для разных этапов диагенеза. На раннем этапе диагенеза процессы сохраняют в основном гипергенный тип: преобладает кислородное окисление, растворение и перекристаллизация, перемещение под действием течений воды, а также различные изменения, обусловленные жизнедеятельностью придонных макро- и микроорганизмов. На позднем этапе – важнейшим условием миграции химических элементов является исчезновение свободного кислорода. 9.5. Диагенетическое преобразование карбонатных пород Карбонатные породы как коллекторы нефти и газа уверенно конкурируют с терригенными образованиями. По различным данным от 50 до 60 % современных мировых запасов углеводородов приурочено к карбонатным породам. В связи с этим изучение постседиментационных изменений карбонатных пород имеет не только научный интерес, но представляет и большое практическое значение: во-первых, без умения правильно и достоверно разграничивать седиментационные и постседиментационные особенности в ряде случаев невозможно правильно восстанавливать условия осадконакопления; во-вторых, эти изменения оказывают существенное, а часто и определяющее влияние на коллекторские свойства карбонатных пород. Диагенез карбонатных осадков – это одна из наиболее сложных проблем в изучении. Под диагенезом карбонатных осадков понимается превращение их в породу, равновесную термодинамическим 65 условиям верхних слоев литосферы При диагенезе широко проявлен процесс перекристаллизации седиментогенных карбонатных минералов, отмечается растворение и появление новых аутигенных карбонатных и некарбонатных минералов. Перекристаллизация – процесс укрупнения размеров кристаллов без изменения их минерального состава. При диагенезе седиментогенного тонкодисперсного карбонатного осадка в первично пористых и проницаемых органогенных, обломочных и оолитовых илах образуются кальцитовые щетки, каемки регенерации и крустификационные цементы. Часто перекристаллизация сопровождается замещением кальцита доломитом. Появление новых аутигенных карбонатных минералов и их перекристаллизация. В седиментогенезе среди карбонатных минералов установлены арагонит, низкомагнезиальный кальцит (MgCO3 до 3 %) и магнезиальный кальцит (MgCO3 от 3 % и более). При диагенезе возможен следующий ряд замещений: 1. Арагонит – магнезиальный кальцит (промежуточная метастабильная фаза) – низкомагнезиальный кальцит. 2. Арагонит – низкомагнезиальный кальцит. 3. Магнезиальный кальцит – низкомагнезиальный кальцит. 4. Магнезиальный кальцит – доломит – CaMg(CO3)2. Появление новых аутигенных некарбонатных минералов. Образованные при диагенезе некарбонатные минералы составляют парагенетические ряды последовательного образования. Их образуют гидроксиды железа («рубашки» на обломочных частицах и органических остатках), фосфаты кальция (выделения неправильной и округлой формы), анатаз (мелкие кристаллы), глауконит (неправильной формы зерна в полостях скелетных остатков), пирит (скопления, приуроченные к остаткам организмов, растительным тканям, глинистым прослоям, обогащенным органическим веществом, отдельные зерна и агрегаты). Растворение карбонатов при диагенезе связано с понижением рН кислых вод за счет углекислоты, выделившейся в результате жизнедеятельности организмов. Важнейшее условие для сохранения и накопления карбонатов – щелочная среда (pH>8) и ограниченное количество углекислоты в воде. В природных водах существует подвижное равновесие: CaCO3 + CO2 + H2O ⇆ Ca(HCO3)2. При избытке CO2 кальцит переходит в бикарбонат кальция – 66 Ca(HCO3)2, легко растворимый даже в слабощелочной среде. Удалению углекислоты способствуют повышение температуры, понижение давления, поглощение углекислоты водорослями, волнения. Рассмотренные преобразования ведут к появлению новообразованных структур, появлению устойчивых карбонатных минералов и в целом к литификации осадка. Момент полной литификации карбонатных осадков большей частью исследователей принимается за границу между диа- и катагенетической стадиями. КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Что такое диагенез? Охарактеризуйте этапы диагенеза, по Н.М. Страхову. 2. Что происходит с органическим веществом в стадию диагенеза? 3. Как происходит преобразование вод при диагенезе? 4. Как меняются геохимические условия при погружении осадка и увеличении геостатической нагрузки? 5. В каких условиях протекает разрушение органического вещества, описываемое схематическими уравнениями: С6Н12О6 + 6О2 = 6СО2 + 6Н2О, С6Н12О6 + 6Н2О = 6СО2 + 12Н2? 6. Обоснуйте, с каким этапом диагенеза связаны эти реакции: Fe2O3 →FeO · n H2O Mn3O4 →MnO · n H2O P2O5 →PO4 · n H2O Этап диагенеза_____________ FeO →FeS2 CaO →CaCO3 MgO →MgCO3 Этап диагенеза_____________ 7. Как происходит преобразование минеральной части песчаных пород на различных этапах диагенеза? 8. Назовите минералы-индикаторы окислительного и восстановительного этапов диагенеза. 9. Какие процессы осуществляются при диагенезе карбонатных осадков? 10. Охарактеризуйте эти процессы преобразования карбонатных осадков при диагенезе. 11. Проанализируйте, как влияют диагенетические преобразования терригенных и карбонатных осадков на формирование коллекторских свойств пород. 10. ГЕОХИМИЯ КАТАГЕНЕЗА 67 [9, 11, 14, 15, 17, 18, 23, 24, 28, 29] По мере возрастания геостатической нагрузки и температур с глубиной возрастает и степень преобразования горных пород: стадию диагенеза сменяет стадия более глубокого изменения органического вещества, поровых вод и минеральной части, называемая катагенезом, иногда (Л.В. Пустовалов, Г.Н. Перозио и др.) именуемая эпигенезом. Катагенез – направленный по действию комплекс постдиагенетических процессов, протекающих в осадочных породах вплоть до их превращения в метаморфические породы Особенностью катагенеза является продолжающееся и длительное изменение нестойких минералов в породах (главным образом слюд и полевых шпатов, а также всех фемических минералов), формирование вторичных глинистых и карбонатных цементов. Основными факторами катагенеза являются: температура (от 25 до 200±25° С), давление (в диапазоне от 10 до 200 МПа), состав поровых вод, а также геологическое время. В катагенезе преимущественное значение имеют процессы химические: коллоидная фаза раскристаллизовывается либо растворяется, трансформируются кристаллические решетки, одни минеральные фазы замещаются другими, в одних участках происходит растворение минералов, в других – синтез новых минералов. В катагенезе, как и в диагенезе, имеется три неравновесные по отношению друг к другу системы: вода (поровые растворы), порода, органическое вещество. По степени преобразования минерального вещества выделяют два этапа катагенеза: ранний и поздний; по степени преобразования органического вещества (согласно углемарочной петрографии) – три: протокатагенез, мезокатагенез, апокатагенез. 10.1. Формирование вод (поровых растворов) при катагенезе Формирование вод при катагенезе отличается от формирования диагенетических вод тем, что растворы в систему не поступают извне, а формируются в самой системе. Образование растворов связано, главным образом, с отжимом вод из уплотняющихся пород: при переслаивании глинистых, песчаных и алевритовых пород миграция вод осуще68 ствляется из глинистых пород в песчаные и алевритовые породы, которые имеют жесткий обломочный каркас, препятствующий уплотнению, и содержат свободные поры. Состав поровых вод при катагенезе зависит от состава преобразованных при диагенезе вод и состава уплотненного при диагенезе осадка. Поровые воды, отжимаемые из глин, обогащены кремнеземом, глиноземом, алюмокремниевыми коллоидами, катионами Mg2+, Fe2+, K+ (рис. 10.1). Рост температуры и давления Каолинит PH=7 Гидрослюда Каолинит Ранний катагенез Гидрослюда Хлорит Вода 3+ 2+ Al Fe2+ Mg 4+ 2+ + Si Ca K Кварц Альбит Поздний катагенез Карбонаты PH >8 Растворение, замещение, синтез, перекристаллизация Слюда Диоктаэдрическая слюда Рис. 10.1. Схема изменения глинистых и песчаных пород при катагенезе 69 Поровые воды содержат также ионы бикарбоната кальция и Ca2+, поступившие при растворении седиментогенных карбонатов и обогащены малыми элементами (за счет высвобождения их из глинистых минералов при каолинитизации хлорита, гидрослюд, монтмориллонита). Отжим происходит в прилегающие пласты-коллекторы. Растворы, отжатые из глин, неравновесны по отношению к проницаемым породам, в которые они поступают, и растворяют их компоненты, дополнительно обогащаясь щелочными и щелочноземельными элементами. Благодаря постоянному подтоку вещества из глинистых пород и поступлению элементов из растворяющихся компонентов песчаников, поровые воды постепенно приобретают щелочную реакцию (pH>8), хотя на ранних этапах, а также в отдельных участках на всех этапах катагенеза возможно существование вод, имеющих кислую реакцию. Поступление элементов и их соединений в поровые растворы способствуют тому, что растворы со временем становятся перенасыщенными отдельными элементами, которые начинают синтезироваться в виде новых минеральных фаз, формируя вторичные цементы. Подток вещества и повышенные температуры способствуют перекристаллизации диагенетических и седиментогенных тонкокристаллических минеральных фаз, образуются более крупнокристаллические модификации. 10.2. Изменение минеральной части Наиболее изучены геохимические изменения, протекающие в осадочных породах терригенных толщ. Они фиксируются с помощью различных аналитических методов (химических, рентгеновских, спектральных, термических, микрозондовых, и др.), а также минералогическим и петрографическим путем по изменению глинистых минералов и по появлению разного рода цементов в зернистых породах. Состав катагенетических минеральных ассоциаций формируется в зависимости от особенностей осадка, преобразованного при диагенезе, состава поровых вод, наличия или отсутствия органического вещества и других факторов. В раннем и позднем катагенезе по характеру изменения минеральной части песчаных пород выделяют по 2 этапа: в раннем: 1) этап глинизации и 2) этап карбонатизации; в позднем: 1) этап развития кварца и альбита и 2) этап формирования Fe-Mg-хлорита и диоктаэдрической гидрослюды. С этапом глинизации связано образование новых минералов (рис. 10.2) за счет: 70 растворения и замещения минералов, неустойчивых при катагенезе; за счет синтеза из растворов, обогащенных элементами. В первом случае пластинки неустойчивых в катагенезе слюд за счет интенсивного насыщения межслойной водой и различными катионами, набухают, увеличивают свой объем в несколько раз (предел – размер порового пространства), гидратизируются, расщепляются (рис. 10.2, А), замещаются хлоритом (рис. 10.2, Б), гидрослюдой, каолинитом и сложными смешанослойными образованиями типа хлоритвермикулит. Замещение сопровождается новообразованиями сидерита, магнетита, титанистых минералов. На более позднем этапе образуются пленочные гидрослюдистые цементы (рис. 10.2, В). А А В Б Г Рис. 10.2. Изменение глинистых минералов при катагенезе. Шлифы, увеличение 126, николи скрещены Парагенез для пород различных комплексов отличен: в морских водоемах биотит замещается хлоритом и гидрослюдой; в опресненных лагунных и континентальных – монтмориллонитом и каолинитом. При внутрислойном растворении слюд в связи с увеличением щелочности растворов (до pH>8–9) местами отмечается коррозия обло71 мочных минералов: полевых шпатов, пироксенов, амфиболов, кварца. Происходит дальнейшее разложение полевых шпатов с образованием гидрослюд и каолинита, осуществляется вынос катионов и кремнезема в раствор. За счет растворения обломочного материала и замещения одних минеральных фаз другими поровые растворы обогащаются катионами: Na+ (каолинитизация полевых шпатов); K+, Na+, Fe2+, Fe3+, Mg2+, Ca2+ (альбитизация плагиоклазов) и анионами НСO3-, а также TiO2, SiO2 (каолинитизация гидрослюд, хлорита, монтмориллонита, слюд). В этап глинизации при pH=5–7 из циркулирующих в поровом пространстве растворов осуществляется синтез каолинита (рис. 10.2, Г), часто минерал замещает слюды. Поровый каолинит особенно характерен для пород с повышенным гранулометрическим составом: в глинистых цементах полиминерального состава в проницаемых юрских песчаных породах юго-востока Западной Сибири каолинит (55–90 %) доминирует над гидрослюдами (5–20 %), хлоритом (0–20 %) и смешанослойными образованиями типа гидрослюда-монтмориллонит (0–10 %). С этапом карбонатизации связано развитие в песчаных породах карбонатной цементации (рис. 10.3). А Б В Г Рис. 10.3. Образование карбонатных цементов в песчаниках при катагенезе. Шлифы, увеличение 126, николи скрещены 72 Она осуществляется при повышенной щелочности среды (pH >7) и высоком содержании катионов Fe2+, Fe3+, Mg2+, Ca2+. В зависимости от подвижности элементов и их концентрации из растворов синтезируются последовательно сидерит, доломит, кальцит или изоморфнозамещенные карбонаты сложного состава. В песчаниках наиболее развиты цементы сидеритового и кальцитового составов. Сидерит встречается в диагенезе в виде пелитоморфной (рис. 10.3, А), мелкокристаллической (рис. 10.3, Б) и сферолитовой (рис. 10.3, В) модификаций. Кальцит образует цементы порового и пойкилитового типов (рис. 10.3, Г). Цементы, сложенные доломитом и другими карбонатными минералами, встречаются гораздо реже. Поздний катагенез связан с изменением нестойких обломочных компонентов (кварца, полевых шпатов), появлением новых парагенетических ассоциаций минералов и формированием вторичных структур. С этапом развития кварца и альбита связано появление регенерационных каемок, нарастающих на обломках, придавая им остроугольную или извилистую, приспособленную к поровому пространству конфигурацию. Рис. 10.4. Регенерированные зерна кварца и полевого шпата в песчаниках. Шлифы, увеличение 126, николи скрещены Аутигенный кварц является сквозным минералом катагенеза, он нарастает на обломках на ранних этапах в свободном поровом пространстве, образуя кристаллографические элементы: грани, ребра, вершины кристаллов (рис. 10.4); в этап карбонатизации при коррозии карбонатами обломочных зерен и обогащении поровых растворов кремнекислотой; и на позднем этапе, связанном с уплотнением песчаных пород, частичным растворением обломочного материала на стыках контактирующих зерен и переотложением его на месте в виде регенерационных каемок. 73 При усилении катагенеза близкорасположенные кварцевые обломки срастаются при регенерации, образуя плотные агрегаты с кварцитовидной структурой. При обычных температурах кремнезем растворяется в воде при pH, превышающих 9; при низких значениях pH=3–6 он осаждается. С повышением температуры растворимость кремнезема возрастает. При катагенезе на стыках кварцевых зерен, давящих друг на друга, температура повышается, зерна частично растворяются. Вблизи растворяющихся зерен повышается кислотность. В условиях закрытости системы кремнезем осаждается на месте, образуя кварцевые оторочки. Аутигенные полевые шпаты также нарастают на зерна плагиоклазов в виде тонких каемок толщиной до 0,01–0,02 мм, (альбитизация плагиоклазов) реже образуют отдельные кристаллы. Механизм образования ортоклаза из гидрослюды (мусковита и его деградированной разновидности – иллита) при потере глинозема и дегидратации, по Г. Ларсену и Д. Чилингару, иллюстрирует реакция: K2O · 3K2O3 · 6SiO2 · 2H2O ⇆ K2O · Al2O3 · 6SiO2 + 2H2O + 2 Al2O3. На этапе формирования Fe-Mg-хлорита и диоктаэдрической гидрослюды происходит образование гидрослюды и хлорита аутигенного происхождения за счет раскристаллизации первичного гидрослюдисто-хлорит-глинистого цемента. Гидрослюды совместно с хлоритом образуют волокнистые, ориентированные послойно агрегаты. С увеличением глубины залегания формируются гидрослюдистые и хлоритовые пленочные цементы, затем вокруг обломочных зерен появляются зачатки щеточек из гидрослюдистых чешуек, а с глубины свыше 3000 м пластинки приобретают струйчатый характер, замещая как цементирующий материал, так и обломки. В ходе стадиальных изменений при увеличении пластовых давлений и температур происходит необратимое изменение емкостных и фильтрационных свойств пород-коллекторов. Экранирующие параметры покрышек также ухудшаются по мере уплотнения пород и потери пластичности, так как при этом увеличивается их способность к растрескиванию. Таким образом, за счет стадиальных изменений свойства коллекторов и покрышек сближаются, и в итоге возрастает вероятность перетока углеводородов вверх по разрезу, реализующаяся в этапы тектонической деятельности. 74 10.3. Преобразование карбонатных пород при катагенезе Характерной особенностью катагенетической стадии преобразования карбонатных пород является широкое развитие минеральных новообразований карбонатных и некарбонатных минералов, значительно превосходящих (по числу минеральных видов и объему выделившегося материала) диагенетические. В стадию катагенеза выделяются: полевые шпаты, каолинит, халцедон, кварц, сульфиды, гидроксиды железа, гидрослюда, глауконит, сепиолит, палыгорскит, флюорит, барит, ангидрит и карбонатные минералы (кальцит и доломит, цеолиты). Полевые шпаты образуются ранее других в щелочной среде при взаимодействии глинистого алюмосиликатного вещества осадка со щелочами, адсорбированными из морской воды, в виде кайм или отдельных кристаллов. Каолинит продуцируется по мере расходования щелочи, развиваясь по седиментогенному кальциту и в пустотах. Кремнезем синтезируется после каолинита, при истощении глинозема, в результате растворения органогенного кремнезема и гидрогелей SiO2, поступивших в осадок, образует регенерационную кайму на кварце и замещает скелетные остатки организмов. В сильнокислой среде идет осаждение сульфидов (пирит, марказит, сфалерит) в виде различных модификаций. Гидрослюды в качестве аутигенных образований встречаются редко, выделяясь в пустотах или развиваясь метасоматически по катагенетическому кальциту или ранее образовавшимся минералам. Глауконит заполняет пустоты выщелачивания, трещинки, стилолитовые швы, замещает катагенетический кальцит. Магнезиальные силикаты заполняют пустоты выщелачивания и образуют метасоматические выделения. Флюорит образует кристаллы и зернистые скопления в порах карбонатных пород, псевдоморфозы по органогенным остаткам, заполняет небольшие трещинки. Барит встречается в порах и образуется метасоматическим путем. Сульфаты кальция (гипс и ангидрит) замещают многие аутигенные минералы, заполняют поры, каверны и трещины в породах. В катагенетической стадии процессы растворения происходят неоднократно. Они затрагивают седиментогенный карбонатный материал, диагенетические карбонатные минералы, проявляются в случаях выщелачивания и собственно катагенетических минералов (например, на ангидрите и гипсе). 75 10.4. Образование углеводородных флюидов в зоне катагенеза Катагенез является не только ведущим процессом в изменении свойств самих пород нефтегазоносных отложений, но и в преобразовании рассеянного органического вещества, генерации нефти и газа, что во многом определяет закономерности распределения углеводородов в земной коре. При погружении осадков на глубину под действием температуры и давления, а также каталитического влияния вмещающих пород меняется как общий баланс рассеянного органического вещества, так и состав его отдельных компонентов (рис. 10.5). Углеводы Протеины Липиды Диагенез конденсация Фульминовая и гуминовая кислоты, гумин Хемофоссилии Вы св о божд ение захва ченн ых м Термальное разложение о лек ул Кероген Катагенез Небольшое изменение полимеризация, ные нен зме ы Неи олекул м Микробиальное разложение, Углеводороды с низкой и средней молекулярной массой Крегинг Высокомолекулярные углеводороды Лигнин Метагенез Метан + легкие углеводороды Остаточный углерод Рис. 10.5. Схема преобразования органического вещества на разных стадиях литогенеза, по М.Р. Лидеру 76 Для катагенной стадии преобразования органического вещества можно выделить два типа процессов: глубокие и направленные изменения физико-химических свойств и химической структуры органического вещества и углеводородов; эмиграцию веществ, в том числе продуктов катагенного превращения органического вещества (углеводороды, диоксид углерода, аммиак, сероводород и т. п.). Общей направленностью изменений органического вещества в катагенезе является обогащение его углеродом (обуглероживание) с выходом жидких, газообразных новообразований (УВ, CO2, H2O) и перераспределение водорода и особенно гетероэлементов: азота, смол и кислорода. Под влиянием температуры, давления и катализа происходит увеличение доли битумоидов в рассеянном органическом веществе осадочных пород. Наиболее распространенной шкалой катагенных преобразований является схема Н. Б. Вассоевича (табл. 6.1), по которой выделяются три этапа: прото-, мезо- и апокатагенез (ПК, МК и АК), в которых выделяются подэтапы: для протокатагенеза – ПК1, ПК2, ПК3; для мезокатагенеза – МК1, МК2, МК3, МК4, МК5; для апокатагенеза – АК1, АК2, АК3, АК4. Число градаций в каждом подэтапе определяется числом классов гумусовых углей, выделяемых по степени их метаморфизма. Процесс преобразования органического вещества в катагенезе длительный и стадийный, с подстадией мезокатагенеза связано образование жидких и газообразных углеводородов. Новообразование и преобразование углеводородов и пред-углеводородов на этапах раннего катагенеза путем слабого термолиза и (или) термокатализа развивается сначала медленно, но в начале среднего катагенеза быстро усиливается. В результате образуется много углеводородов, главным образом тех, которые входят в состав керосина и бензина. С этими этапами катагенеза, которые протекают при мощности покрывающих отложений в 2–4 км и температурами в пределах 80–150° C, связана главная фаза нефтеобразования (ГФН). В ГФН одновременно с новообразованием углеводородов, значительно увеличивается содержание в породах микронефти, происходит ее созревание, широко развиваются процессы десорбции микронефти, ее отрыва от материнской органики и от минеральных компонентов породы, осуществляется интенсивная миграция путем усиленного растворения в воде и/или в сжатых газах. Главная фаза нефтеобразования развивается в течение длительного отрезка време77 ни, сильно варьирующего в разных районах в зависимости от типов органического вещества и вмещающих пород, темпов опускания, перерывов в отложениях (из-за перемены знака движения), от геотермического градиента (точнее от геотермической истории бассейна). Отвечающая ГФН в недрах Главная зона нефтеобразования (ГЗН) располагается в интервале трех подзон катагенеза, или градаций – МК1, МК2, МК3. В ГЗН во время развития ГФН и происходит рождение собственно нефти. Генерируются в большом количестве гомологи метана С2–С3 и жидкие легкие углеводороды, составляющие бензиновую и керосиновую фракции нефти. Микронефть становится по своему составу все более сходной с нефтью (макронефтью), происходит ее «созревание». В зоне мезокатагенеза (МК4) и апокатагенеза (АК1–АК4) в переходной зоне – МК4–АК1 – (палеоглубины около 4 км) генерация битумоидных компонентов в органическом веществе затухает, однако концентрация гомологов метана, в меньшей степени самого метана, достигает максимума. На этом этапе С.Г. Неручев, Е.А. Рогозина выделяют главную зону газообразования (ГЗГ). КОНТРОЛЬНЫЕ ВОПРОСЫ 1. В чем суть катагенеза? 2. Назовите основные факторы катагенеза. 3. При каких условиях осуществляется преобразование и новообразование минеральных фаз при катагенезе? 4. За счет чего и каким образом формируются поровые растворы при катагенезе? Какими элементами и соединениями они обогащаются за счет растворения обломочного материала? 5. Назовите основные этапы преобразования минеральной части терригенных пород при катагенезе. 6. Как процессы, протекающие при катагенезе, влияют на коллекторские свойства пород? 7. Какие этапы катагенеза, согласно шкале катагенных преобразований Н. Б. Вассоевича, выделяют? 8. Что происходит с органическим веществом при катагенезе? 9. С какими этапами катагенеза связана главная фаза (зона) нефтеобразования? 10. С какими этапами катагенеза связана главная зона газообразования? 11. Какие минеральные новообразования образуются при катагенетическом изменении карбонатных пород? 78 11. ГЕОХИМИЯ ПРОЦЕССОВ, СВЯЗАННЫХ С ПОСТУПЛЕНИЕМ НЕФТИ В КОЛЛЕКТОР [1, 3, 12, 13, 19, 20, 24, 27] 11.1. Внестадиальные процессы, улучшающие качество коллектора На этапах роста тектонических структур, когда из нижележащих горизонтов чехла или из фундамента поступают растворы, обогащенные агрессивными компонентами, в первую очередь углекислотой, происходят внестадиальные (наложенные или эпигенетические) изменения горных пород. При этом улучшение коллекторских свойств пород, находящихся на определенной стадии катагенеза, возможно в результате двух типов изменений: 1) растворения и выноса каких-либо компонентов породы, приводящих к увеличению общей пористости; 2) перераспределения материала без его выноса, в результате которого происходит увеличение размера пор, улучшение их сообщаемости, а значит увеличение проницаемости и эффективной пористости при сохранении общей пористости. Первый путь – простое выщелачивание отдельных минералов агрессивными растворами и переотложение растворенных компонентов за пределами зоны выщелачивания – является основным в карбонатных породах, где динамическое равновесие реакции CaCO3 + CO2 ⇆ Ca2+ + 2HCO3может нарушаться в зависимости от содержания в растворе CO2, и происходит то растворение известняков, то новообразование кальцита. Второй путь наиболее характерен для песчаников. Для силикатов и алюмосиликатов, входящих в состав песчаных пород, простое выщелачивание не может происходить в заметных масштабах. Им свойственен иной тип процесса: замещение одних минералов другими, в ходе которого растворяется и может быть вынесена часть компонентов. Каолинизация является самым важным из наложенных процессов, приводящих к возникновению вторичной емкости, поскольку при замещении каолинитом большинства алюмосиликатов и силикатов происходит растворение примерно половины химических компонентов: 2Na[AlSi3O8] +3H2O +2CO2 →Al2[Si2O5](OH)4 + 2Na+ + 2HCO3- + 4SiO2. Альбит Каолинит 79 Замещение каолинитом слоистых силикатов (гидрослюд, хлорита, монтмориллонита и слюд) в нефтегазоносных толщах проявлено гораздо шире, чем замещение альбита каолинитом: Al2,84Fe2+Fe0,143+Mg0,89Ti0,14Ca(Na+K)0,07[(Si3,70Al0,30)O10][O2,94(OH)5,06] + Хлорит 2,19H2O + 3,16CO2 → 1,57Al2[Si2O5](OH)4 + 0,14 TiO2+ 0,07(Na+K) + Каолинит + 1,89Fe2+ + 0,14Fe3+ + Mg2+ + 0,16Ca2+ + 0,56 SiO2 + 3,16 HCO3-. Процесс каолинизации и вынос кремнезема и катионов щелочных и щелочноземельных металлов осуществляется в кислой среде. 11.2. Преобразование коллекторов в зоне нефтенасыщения Поступающая в коллектор нефть находится в неравновесии с поровыми растворами и минеральной фазой коллектора. На контакте с пластовыми водами нефть, как и всякое другое органическое вещество, подвергается окислению, благодаря бактериологическим и химическим процессам. Окисляющаяся нефть генерирует углекислый газ, органические кислоты, спирты, альдегиды и др. Продукты окисления нефти, поступая в поровые растворы, способствуют резкому повышению их кислотности и понижению pH, формируется кислый барьер. На кислом барьере из поровых растворов осаждаются элементы, ранее растворенные, например Si, который образует регенерационные каемки на кварцевых обломках. Кислые агрессивные растворы интенсивно растворяют неустойчивые, при понижении pH, минералы: карбонаты, алюмосиликаты, силикаты и др. При этом растворение трудно растворимых алюмосиликатов и силикатов происходит частично и сопровождается замещением одних минералов другими, происходит перераспределение материала без его выноса. Хорошо растворимые карбонаты могут быть полностью растворены, а продукты их выщелачивания вынесены за пределы зоны растворения, что увеличивает общую пористость коллектора. При растворении минералов коллектора в раствор переходят большие количества кремнезема, щелочных и щелочноземельных элементов, железа и др. В условиях гидрогеологической закрытости, когда вынос растворенных компонентов сильно затруднен, катионы пересыщают растворы, начинается осаждение элементов в виде новых минеральных фаз. 80 По мере заполнения ловушки углеводородами и вытеснения воды из порового пространства геохимические преобразования в нефтенасыщенной части коллектора прекращаются. 11.3. Преобразования пород в зонах водонефтяных контактов В случаях, когда ловушка заполняется не до замка, на уровнях стабилизации ВНК интенсивно протекают процессы преобразования коллектора (рис. 11.1). Битумсодержащая подзона растворения Нефтенасыщенная зона Растворение углекислотой, сопровождающей мигрирующую нефть, и продуктами окисления нефти на контакте с поровой водой. Ограниченное минералообразование, прерванное вытеснением нефтью поровых вод Окисление нефти, восстановление сульфатов, образование пирита, растворение обломков и цемента производными окисляющейся нефти Подконтурная область полного водонасыщения В Безбитумная подзона растворения Б Г Зона цементации На фоне снижения кислотности синтез минералов из растворов, поступивших из зоны растворения: кварца (В) и карбонатов (Г) А Падение кислотности Растворение (А) кислыми агрессивными растворами, поступившими из битумсодержащей подзоны, синтез каолинита (Б) Переходная зона водонефтяного контакта Рис. 11.1. Схема изменения коллектора, не полностью заполненного нефтью. Шлифы, увеличение 126, николи скрещены 81 Под действием бактерий на водонефтяном контакте образуются органические кислоты и другие продукты окисления нефти, контактирующей с водой (спирты, перекиси, альдегиды, кетоны и их производные). Их может быть настолько много, что кислые воды, мигрирующие от этого контакта, начинают растворять сульфаты, карбонаты, кварц, полевые шпаты и др. Растворенные компоненты, поступая в поровые воды, повышают щелочность миграционного водного потока. В условиях повышения значения pH в приконтурной зоне ВНК возникают щелочные барьеры: на них начинаются процессы каолинитизации. В результате растворения и каолинитизации под ВНК образуется зона разуплотнения (растворения) пород, подразделяющаяся на две подзоны: битумсодержащую и безбитумную. Первая отражает область непосредственного окисления углеводородов в среде, содержащей нефть и подвижные воды, и приурочена к переходной части ВНК. Вторая расположена ниже, формируется в сугубо водонасыщенной среде и отвечает области диффузии в подошвенных водах агрессивных продуктов окисления нефтей. В битумсодержащей подзоне растворения отмечается очень частая ассоциация окисленного битума и пирита. Пиритизация органического вещества осуществляется благодаря образованию сероводородных эпигенетических барьеров, на которых идет осаждение пирита. В результате термического (при температурах более 100˚ С) разложения углеводородов (в частности, метана) в присутствии сульфатов протекают следующие реакции: CaSO4+CH4 →CaCO3+H2O+H2S↑, 2H2S + Fe2+ →FeS2 + 2H2↑. Основным источником железа для этих барьеров являются захороненные железосодержащие воды и растворенные компоненты темноцветных минералов; серы – растворенные за счет сульфатредукции сульфаты. 11.4. Преобразование пород в законтурной зоне В нефтегазоносных толщах, где изменение пород происходит в условиях гидрогеологической закрытости, переходящие в раствор SiO2 и разнообразные компоненты не могут быть вынесены за пределы пласта и отлагаются в тех же пластах, образуя цементы и формируя зону цементации. Дальнейшее переотложение продуктов растворения и формирование зоны цементации связано с увеличением щелочности среды. По мере насыщения растворов щелочами и удаления от зон растворения 82 кислотность падает, образуются щелочные восстановительные барьеры, на которых в зависимости от pH среды происходит осаждение кварца, а с увеличением щелочности – карбонатов Fe, Mg, Ca в виде регенерационных новообразований, конкреционных стяжений, вторичных цементов. Образование этих минералов происходит в разных участках пласта в зависимости от геохимических условий, что и определяет возникновение минералогической зональности. 11.5. Изменение микроэлементного состава осадочных пород в зоне влияния углеводородной залежи. Положительные и отрицательные аномалии В настоящее время система залежь–пластовые воды–вмещающие (перекрывающие) породы рассматривается как физическая массообменная система, создающая диффузионный поток флюидов к поверхности, компоненты которого являются «прямыми» признаками нефтегазоносности недр и фиксируются на разных уровнях разреза методами традиционной нефтегазопоисковой геохимии. В миграционный поток кроме элементов, мигрирующих в газообразной форме, включаются и минеральные компоненты (элементы в ионной, комплексной и коллоидной формах). Они являются продуктом химического обмена в системе, результатом нарушения минерального и ионного равновесия под влиянием миграционного потока от залежей, вызывающего изменение физикохимических параметров среды. Существенные геохимические изменения происходят не только в залежах, но и в значительном объеме вмещающих и перекрывающих пород. Нарушение первичного литогеохимического профиля распределения микроэлементов под влиянием залежи происходит в результате диффузионного или фильтрационного внедрения в перекрывающие и подстилающие породы миграционного флюида. Он содержит углеводородные и неуглеводородные компоненты, нарушающие минеральное и ионное равновесие, образуя устойчивую восстановительную среду, в которой и происходит перераспределение микроэлементов, особенно поливалентных, неподвижных и слаборастворимых в нейтральных и окислительных условиях (высокое валентное состояние) и мобильных в восстановительной обстановке (низкое валентное состояние). Над углеводородными залежами формируются многочисленные и разнообразные геохимические барьеры (сероводородные, кислые, щелочные, сорбционные, биогенные). Образование их связано с бактериальным разложением углеводородов и высвобождением из залежи газообразных продуктов (углеводороды, Н2, СО2, инертные газы). Происхо83 дящие на таких участках окислительно-восстановительные реакции (с участием бактерий, разлагающих углеводороды) могут увеличивать подвижность восстанавливающихся элементов переменной валентности, часто приводя к их «отгонке» из центральных частей участков. В результате в почве образуются аномалии перераспределения. Размеры аномалий – n·100 км2. Аномалии отдельных элементов могут не совпадать и быть разобщенными, хотя вместе они образуют единое вторичное литохимическое поле (рис. 11.2). Ассоциации элементов, образующих аномалии в районах нефти и газа, определяются первичным наличием подвижных элементов, способных перемещаться и концентрироваться на соответствующих барьерах. Cu Zn Mn Mo Ba Mn Ba Mn Pb 1 2 3 Co 4 Рис. 11.2. Вторичное литохимическое поле над месторождением нефти и газа, Краснодарский край (по В.А. Алексеенко, 2000) 1 – литогеохимические аномалии в почвах; 2 – населенные пункты, 3 – граница поля рассеяния, 4 – проекция на дневную поверхность нефтяных и газовых месторождений Наиболее контрастные распределения элементов будут выражены во внешней зоне ореола геохимически измененных пород, на границе зон свободного водогазообмена и геохимически восстановленных пород. С одной стороны, здесь повышенные концентрации мобилизованных под влиянием залежи микроэлементов и элементов, выпавших в осадок с вторичными минеральными образованиями на кислородном барьере (Fe, Co, Mn), будут совпадать с контуром геохимически измененных пород. С другой стороны, элементы, подвижные в окислительных условиях (Zn, Ni, Cu, Pb, Co, U, V, Mo, Se, Re), на восстановительном барьере, т. е. на внешнем контуре восстановленных пород, дадут повышен84 ные концентрации, хотя эти элементы являются «местными», а не привнесенными. По особенностям распределения элементов аномалии могут быть положительные и отрицательные. Первые отличаются повышенными концентрациями элементов-индикаторов, вторые – пониженными. Для выявления аномалий необходимо определить величину минимального (максимального) аномального содержания относительно фона. Выявление аномалий проводится с помощью картирования распределения элементов, для этого на карты выносятся либо все значения проб, либо значения равные или превышающие концентрации фона, а затем производится интерпретация карт. При выделении отрицательных аномалий выносятся пробы с содержаниями, которые равны или меньше рассчитанных аномальных. Для каждого элемента удобнее составлять отдельную карту, а затем делать одну сводную, на которой кроме отдельных аномалий различных элементов (соединений) следует выделять аномальные зоны. Они представляют собой участки с пространственно сближенными аномалиями ряда элементов, образование которых (аномалий) вызвано одними и теми же причинами. Для оценки поисковой значимости можно выделить следующие группы элементов, которые можно рассматривать как индикаторы нефтегазоносности в нефтегазоносных бассейнах (НГБ). В песчано-алевритовых породах – Cr, V, Ni, Cu, Co, Mn, Ga, Sr, Ba (в кларковые содержания Cr, V, Ni, Cu, Sr – повышенные, а Mn, Ga, Co – пониженные). В карбонатных – Cr, V, Ni, Ti, Sr, Zr, Ba (в НГБ кларковые содержания Cr, Ni, Sr, Zr, Ba – повышенные, а V, Ti – пониженные). В глинистых – B, Mn, Ni, Rb, Ga, Ba (в НГБ кларковые содержания B, Mn, Ni, Rb, Ba V – пониженные, а Ga – повышенные). Аномалии значительно усиливаются, если использовать соотношения пар микроэлементов: V/Ni, V/(Cu+Co), Ni/(Cu+Co). В зоне влияния углеводородной залежи отмечены следующие ассоциации химических элементов: в почвах: Pb, Zn, Mn, Cu, Ba, Co, Ni, Cr; в водах: J, Cu, Mo, Ag (CO2, H2S, бензол); в растениях – Pb, Zn, Co, Mn, Ni, Ba, Cr. КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Какие условия определяют возникновение геохимической и ми- нералогической зональности в разных участках пласта нефтенасыщенного коллектора? 85 2. Как меняются геохимические условия, какие геохимические преобразования происходят в коллекторе с приходом нефти? 3. Как меняются щелочно-кислотные условия с обогащением поровых вод продуктами окисления нефти? 4. Охарактеризуйте геохимическую зональность, образующуюся в зоне ВНК. Какие зоны образуются при неполном заполнении нефтью ловушки на водонефтяном контакте, по Р.С. Сахибгарееву? 5. При каких условиях осуществляется в недрах окисление нефти? 6. В какой среде осуществляется процесс каолинизации и вынос кремнезема и катионов щелочных и щелочноземельных металлов, обусловленный действием агрессивных растворов в зоне ВНК? 7. Назовите последовательность изменения геохимических обстановок и минералообразования по мере удаления от зоны ВНК. 8. Какие процессы осуществляются по мере заполнения ловушки углеводородами под воздействием продуктов неполного окисления нефти (спирты, кислоты, перекиси, альдегиды, кетоны и производные этих компонентов) на уровнях стабилизации ВНК? 9. Какова главная роль реакции замещения хлорита каолинитом в нефтенасыщенных коллекторах (по Б.А. Лебедеву)? 10. Какие геохимические барьеры образуются над углеводородными залежами благодаря бактериальному разложению углеводородов и высвобождению из залежи газообразных продуктов? 11. Выпишите в таблицу ассоциации химических элементов в соответствии со средой, в которой они накапливаются над углеводородной залежью. Среда почвы воды растения Элементы 12. Что такое вторичное геохимическое поле, какими особенностями оно характеризуется? 13. Что такое положительные и отрицательные аномалии? Приведите примеры аномалий, сформированных над залежью нефти. 14. Какими причинами обусловлено значительное понижение концентрации урана с одновременным увеличением содержания Th и K над залежью нефти? 86 12. МЕТОДЫ ИССЛЕДОВАНИЯ ВЕЩЕСТВА [8, 15, 16, 25] В настоящее время разработаны многочисленные методы определения содержания элементов в геохимических пробах в зависимости от форм нахождения элементов (минеральная форма, водные растворы, газовые смеси, и т.д.). При геохимических исследованиях в различных соотношениях применяются следующие анализы: элементный качественный, силикатный, спектральный, атомно-абсорбционный, хроматографии, рентгенофлюоресцентный, калориметрический, радиометрический, газовый и др. 12.1. Элементный качественный анализ Метод может быть основной целью или первым этапом при количественном анализе объектов неизвестного состава. Он проводится после петрографических исследований осадочных пород для корреляции разрезов, выяснения геохимических условий образования пород, характера процессов (окисления-восстановления, щелочности-кислотности), закономерностей распределения слагающих элементов горных пород. Он направлен на обнаружение компонентов (химических элементов, молекулярных соединений, ионов одного химического состава, но разной зарядности, минералов и др.). Элементный качественный анализ проводится химическими методами с использованием реакций обнаружения, характерных для неорганических ионов в растворах или для атомов органических соединений (после разложения органических соединений до устойчивых неорганических продуктов). Реакции обычно сопровождаются изменением окраски раствора, образованием осадков или газообразных продуктов. В зависимости от количества анализируемого вещества различают макроанализ (1–0,1 г), полумикроанализ (0,1–0,01 г), микроанализ (0,01–0,001 г) и ультрамикрохимический анализ (0,0001 г). 12.2. Количественный химический (силикатный) анализ Количественный химический (силикатный) анализ направлен на определение содержания или количественных соотношений элементов, функциональных групп, соединений или фаз (SiO2, ТiO2, Аl2О3, Fе2O3, FeO, MnO, MgO, CaO, Na2O, К2О, S, P2O5, H2O, CO2) в горных породах и нерудных минералах. В зависимости от количества анализируемого вещества технику выполнения анализа подразделяют на макро- (>10-1 г), 87 полумикро- (10-2–10-1 г), микро- (10-3–10-2 г), ультрамикро- (10-6 г) и субмикро- (10-9 г) анализ. Химический количественный анализ характеризуется высокой точностью. Относительная погрешность химических методов обычно составляет 0,05–0,2 %. 12.3. Спектральный количественный анализ Может быть использован для определения элементов, содержание которых в пробе невелико (не превышает 1 %). Основой спектрального анализа является возможность измерения длины волны и интенсивности излучения, испускаемого атомами, молекулами, ионами вещества в источниках света. Определение содержания отдельных элементов производится путем измерения и сравнения интенсивности их линий в спектре, полученном при введении порошка пробы в зону дугового разряда, либо помещая пробы в канал угольного электрода, либо нанося материал на поверхность подвижного электрода, либо вводя пробу в разряд воздушной струей. Преимущество спектрального анализа заключается в том, что он позволяет проводить определение в исследуемых объектах свыше 70 элементов (подавляющее большинство металлов, включая редкие земли) без существенного изменения методики работ. Он позволяет определить содержание элементов при очень низких концентрациях их в пробах (10-3–10-5 %). С помощью спектрального анализа возможно одновременное определение большого числа элементов без увеличения объема пробы. Кроме того, метод не требует сложной предварительной пробоподготовки. К недостаткам метода можно отнести наложение линий на спектрограммах, мешающих определению больших содержаний (более 1 %), а также невозможность учесть путем расчета влияние на результаты анализа общего химического состава проб и формы соединений определяемого элемента. 12.4. Атомно-абсорбционная спектрофотометрия Метод атомно-абсорбционной спектрофотометрии основан на способности атомов избирательно поглощать электромагнитное излучение определенной длины волны (или длин волн). В целях количественных определений атомно-абсорбционный анализ проводят на специальных приборах – абсорбционных спектрофотометрах. Пробу растворяют, раствор помещают в камеру атомно88 абсорбционного спектрофотометра, где он в виде аэрозоля подается в пламя горелки (пламя имеет температуру порядка 3000˚ С). Молекулы солей диссоциируют на атомы, которые могут поглощать свет. Пар, содержащий определяемый элемент, освещается источником света, обычно лампой, с катодом того элемента, который подлежит определению. Поглощение пропорционально концентрации элемента в паре. Измеряя энергию, дошедшую до детектора, можно количественно определить содержание элемента. Метод атомно-абсорбционной спектрофотометрии применяют для определения как следовых (10-6–10-8 %) содержаний элементов, так и для макроколичества. Метод позволяет определять примерно 70 элементов, в том числе Au, Pt, Pd, Hg, Cd, Tl, Fe, Mn, Co, Ni, Cu, Ag, Zn, Pb, Li, In, Bi, Sb, As, Cr, Ni, V, Pb, Be и других элементов. 12.5. Микрозондовый анализ Основным аналитическим методом изучения химического состава минералов, твердофазных и расплавных включений является микрозондовый анализ, проводимый при помощи энергодисперсионной микрозондовой приставки к электронному сканирующему микроскопу. Минералы анализируются в "точке" (фокусировка пучка – 3х3 микрона). Для химического анализа используется режим отраженных электронов при стандартном рабочем напряжении 15 кВ. При анализе минеральных фаз и расплавных включений определяются основные петрогенные компоненты: Si, Al, Ti, Fe, Mn, Mg, Ca, Na, K, анализируется также Cr, Ni, P, Cl, S. Относительные ошибки при микрозондовом анализе составляют при содержании элемента: от 1 до 5 % – 10 % отн., от 5 до 10 % – 5 % отн., более 10 % – 2 % отн. 12.6. Нейтронные методы Нейтронно-активационный анализ (НАА) – наиболее чувствительный метод химического анализа многих элементов периодической таблицы. Только легкие элементы (бор, кислород, азот и углерод) не образуют изотопов, пригодных для исследования НАА. Метод основан на анализе радиоактивных изотопов, образующихся в образце под воздействием облучения тепловыми нейтронами. Наиболее распространенным является анализ γ-излучения образовавшихся изотопов с энергией квантов от 0,1 до 2,5 МэВ. Излучение регистрируется литиево-германиевым детектором, анализируется многоканальным анализатором. 89 Для идентификации изотопа, излучение которого регистрируется при НАА, определяют период его полураспада и энергию γ-квантов. Для измерения концентрации конкретного элемента необходимо знать ряд параметров: дозу излучения за определенный период времени, эффективность излучателя и детектора для данного пика спектра γ-излучения, поток тепловых нейтронов, время облучения, продолжительность выдержки образца после облучения и другие параметры. Инструментальный нейтронно-активационный анализ (ИНАА) горных пород, руд, минералов, углей, почв, нефтей и нефтепродуктов, сухих остатков природных вод, золы, растительных объектов позволяет определить содержание элементов: Na, Co, Sr, Sb, Sm, Hf, К, Ni, Rb, Cs, Eu, Та, Ca, Zn, Zr, Ba, Gd, W, Sc, As, Mo, La, Tb, Au, Cr, Se, Ag, Ce, Yb, Th, Fe, Br, Cd, Nd, Lu, U. Комплексным анализом методом запаздывающих нейтронов (МЗН) на уран и инструментальным нейтронно-активационным в представительных пробах массой 5–10 г в одной навеске (горных пород, руд, минералов, углей, почв, золы, растительных объектов) можно определить содержание элементов: U, Th, Au, La, Sm, Eu, Cr, Fe, Co, Ni, W, As, Sb, Na и др. 12.7. Изотопные методы Суть изотопных методов заключается в определении качественного состава и количественных соотношений радиоактивных элементов и отдельных изотопов по их радиоактивному излучению или по продуктам их ядерных превращений. Изотопные методы имеют ряд преимуществ перед другими методами исследования: 1) возможность выполнения на основании различия радиоактивных свойств отдельных изотопов изотопного и элементарного анализа смеси без химического разделения; 2) возможность изучения веществ при сверхмалых их концентрациях; 3) возможность концентрирования радиоактивных изотопов от состояния крайнего разбавления до весовых количеств чистых соединений радиоактивных элементов. Специфические особенности: 1) ультрамалые количества радиоизотопов при различных химических операциях (осаждении, экстракции, электролизе, дистилляции и других) часто ведут себя не так, как в случае обычных аналитических концентраций; 2) отношение концентрации материнского вещества к образующимся продуктам распада обычно равно 1010–1015. Очень низкая концентрация продуктов распада обусловливает легкую потерю этих изотопов. 90 12.8. Хроматографические методы Газовая хроматография – метод разделения смесей веществ или частиц, основанный на различии в скоростях их перемещения в системе несмешивающихся и движущихся относительно друг друга фаз. Газовая хроматография используется для анализа летучих: CO2, CO, H2O, H2S, N2, H2, CH4 и других, которые встречаются во включениях в минералах. Метод имеет точность 2–4 % (для воды – 13–15 %). В данном методе используется в качестве рабочего тела фильтр, на который оседает, по мере испарения, газ. Это позволяет последовательно анализировать порции летучих газов, выделяющихся при разных температурах. Ионная хроматография используется для количественного анализа с высокой чувствительностью анионов F-, Cl-, NO3-, NO2-, Br- и катионов Li+, Na+, K+, NH4+, Ca2+, Sr2+, а также ионов органических кислот и оснований в водах различного происхождения и водных растворах. На первой стадии проводят разделение смеси компонентов в разбавленном растворе кислоты (основания), а затем избыток кислоты (основания) удаляют с целью повышения чувствительности определения разделенных ионов. Далее разделѐнные ионы определяются кондуктометрическим детектором. Метод газожидкостной хроматографии используется при определении содержания в горных породах компонентов нефтей, битумов и других органических соединений с пределом обнаружения менее 10-9 г во вводимом объеме. КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Назовите традиционные и новейшие аналитические методы геохимических исследований. 2. Какие методы применяются при определении содержания в горных породах компонентов нефтей, битумов и других органических соединений? 3. В чем суть метода атомно-абсорбционной спектрофотометрии? Для каких целей он применяется? 4. Какой вид хроматографических исследований используется для анализа летучих соединений: CO2, CO, H2O, H2S, N2, H2, CH4 и др., которые встречаются во включениях в минералах? 5. Как называется метод химических исследований, проводимый с использованием реакций обнаружения, сопровождающихся изменением окраски раствора, образованием осадков или газообразных продуктов? 91 13. КОМПЛЕКСНОЕ ПРИМЕНЕНИЕ ХИМИЧЕСКИХ И ФИЗИЧЕСКИХ МЕТОДОВ В НЕФТЯНОЙ ГЕОЛОГИИ [5, 10, 21, 30] 13.1. Высокоточная наземная магнитометрия, гамма-спектрометрия, рентгенорадиометрический и петрофизический методы исследования На закономерностях изменения физических свойств в зоне окисления над залежами и перераспределения различных минералов под влиянием миграции легких углеводородов из залежи и атмосферного кислорода с образованием мощного окислительно-восстановительного барьера в верхней части разреза (в диапазоне глубин 300–500 м) основаны физические методы: высокоточная наземная магнитометрия, гамма-спектрометрия по урану, торию и калию; рентгенорадиометрический и петрофизический анализы проб грунта. Над месторождениями наблюдается перераспределение геохимически активных естественных элементов. Гамма-спектрометрические исследования по урану, торию и калию, проведенные в Томской области, показали, что над залежью значительно понижается концентрация урана и увеличивается содержание тория и калия. Перераспределение радиоактивных элементов обусловлено особенностями окислительно-восстановительной обстановки в приповерхностной области над залежью. Вблизи поверхности эта область характеризуется резким окислительным барьером, на котором происходит окисление урана до наиболее подвижной формы и вынос урановых компонентов. Менее подвижные торий и калий концентрируются на участке интенсивного миграционного следа. Рентгенорадиометрический анализ проб поверхностного грунта (в участках проекции залежи углеводородов на дневную поверхность) обнаруживает: в области над залежами аномально высокие концентрации железа, титана и кальция, пониженные содержания марганца; в приконтурных зонах ураганные содержания кальция и аномально высокие урана, железа. Перераспределение железа и его магнитных минералов в надпродуктивном комплексе пород позволяет проводить магнитную съемку. При этом используются эффекты влияния залежей на аномальные маг92 нитные поля, которые проявляются в виде микромагнитных аномалий, представляющих собой участки резко дифференцированного по амплитуде высокочастотного магнитного поля, наложенного на плавно меняющийся фон средне- и низкочастотных аномалий. В верхней части геологических разрезов под воздействием вертикальных и субвертикальных миграционных процессов, как правило, над залежью и в зонах контакта ВНК с перекрывающими породами, формируются ореолы минеральных новообразований (сульфидные, гематитмаггемит-магнетитовые, карбонатизированные и др.), отражающиеся в различных геофизических полях. Большинство минералов, слагающих коллекторы, слабомагнитны, а нефть является диамагнетиком. Магнитные аномалии от залежей, связываемые с различием углеводородов и законтурных вод, а также пород-коллекторов в области залежи и вне ее составляют первые единицы нанотесла. На месторождениях нефти и газа, как правило, наблюдаются отрицательные локальные аномалии магнитного поля от единиц до сотен нанотесла, что является косвенным признаком наличия возможной залежи. Применение электроразведки для поисково-оценочных работ на нефть и газ основано на регистрации в геоэлектрическом разрезе неоднородностей, образовавшихся вследствие миграции углеводородов из залежи. Эти изменения захватывают значительные объемы вмещающих пород и доходят до приповерхностных слоев, что создает благоприятные условия для их регистрации методами электроразведки. Эпигенетические изменения в верхней части разреза приводят в большинстве случаев к повышению электрического сопротивления (до 10–40 раз) за счет вторичной карбонатизации, окварцевания и общей дегидратации пород. Сульфидизация в виде вкрапления вторичных сульфидов, которая наиболее интенсивна в эпицентральной части ореола, вызывает аномалии вызванной поляризации. 13.2. Литогеохимическая съемка по урану и алюминию Использование на нефтяных и газовых месторождениях Томской области ядерно-физических и изотопных методов исследования в комплексе с геологическими и гидродинамическими показало, что наиболее перспективные площади для постановки разведочного бурения образуются в участках перекрывания (совпадения) геохимических аномалий по урану и по стабильным изотопам углерода и кислорода и полей разуплотнения пород, имеющих повышенную гидропроводность. Концептуальной основой ядерно-литогеохимической съемки является положение о том, что углеводородные флюиды, диффундирующие 93 от нефтяной залежи по разуплотненным зонам, могут изменить окислительно-восстановительный потенциал пород и создать в приповерхностном горизонте благоприятную питательную среду для существования колоний микроорганизмов, ответственных за накопление урана. Литогеохимическая съемка проводится по верхнему от дневной поверхности глинистому горизонту. Образцы горных пород отбираются по сетке сейсморазведочных работ с забоев шнековых буровзрывных скважин: шаг опробования составляет 100 м, глубина 12–15 м, расстояние между профилями субмеридионального и субширотного направления 1,0–2,5 км. Определение содержания урана (U) в горных породах, проводимое на Томском исследовательском ядерном реакторе ИРТ-Т методом запаздывающих нейтронов, позволяет проводить измерения в диапазоне от 10–4 до 10–6 %. Содержание алюминия определяется по наведенной активности изотопа алюминия (28Al). В качестве эталона используется окись алюминия. Использование величины отношения соединений урана к глинозему (Al2O3) позволяет исключить влияние литологической изменчивости пород. По значениям модуля U/Al2O3 выделены 4 группы аномалий: 1) низкие со значениями модуля менее 0,18; 2) средние – 0,18–0,2; 3) повышенные – 0,22–0,24; 4) высокие – выше 0,24. После проведения ядерно-литогеохимических исследований строятся карты с полями аномалий, по которым выделяются участки высоких концентраций урана, и выдаются рекомендации по перспективам территории на нефть и газ. 13.3. Изотопная литогеохимическая съемка Поверхностная изотопная съемка по карбонатной составляющей пород также основана на вторичных эпигенетических изменениях пород в верхней части осадочного чехла над нефтяными и газовыми месторождениями, возникающими за счет миграции углеводородов из залежей. Углеводороды, мигрирующие от залежи в перекрывающие отложения, приводят к появлению минеральных новообразований, перераспределению элементов, изменению их химического и изотопного составов. Возникающие в результате этого длительного процесса локальные литохимические аномалии можно рассматривать как косвенные показатели наличия залежей нефти и (или) газа. Газовая съемка совмещается с изотопной и проводится пробоотборниками, заполненными сорбентами. В результате съемок картируются участки изотопных и газовых анома94 лий, что позволяет оценить перспективы нефтегазоносности территории, уточнить контуры нефтяных и газовых месторождений, ранжировать подготовленные к бурению структуры. На стадии поисково-оценочных и детальных геологоразведочных работ изотопно-геохимическими методами успешно решается прогнозная оценка новых нефтегазоносных территорий, включая локальный прогноз залежей углеводородов. Основной принцип изотопногеохимического метода поиска нефтяных месторождений заключается в обнаружении изотопных аномалий над продуктивными горизонтами. Наиболее легкий изотопный состав серы, углерода, кислорода, пород, углерода битумоидов и углерода вод фиксируется на границе залежи нефти и газа, и в вертикальном направлении по ходу миграции и рассеяния флюидов нефти и газа. Для вод изотопный состав углерода облегчается как в вертикальном, так и в горизонтальном направлении пропорционально расстоянию до залежи углеводородов. В непродуктивных отложениях направленного изменения изотопного состава серы, углерода, кислорода пород и углерода вод не фиксируется. Изотопный состав углерода органического вещества пород используется как косвенный критерий для определения нефтегенерационного потенциала пород. Высокий нефтегенерационный потенциал связан с аквагенным типом органического вещества; в нем изотопный состав 13C изменяется в пределах от –34 до –28 ‰. Умеренный потенциал связан со смешанным и окисленным типом органического вещества ( 13C варьирует от –28 до –26 ‰). В терригенном типе органического вещества, обладающем низким нефтегенерационным потенциалом, состав изотопа 13C находится в пределах от –26 до –24 ‰. Органическое вещество с высоким нефтегенерационным потенциалом характеризуется более легким изотопным составом углерода, повышенным содержанием водорода и битумоидных компонентов. Согласно теоретическим расчетам и результатам измерения изотопных составов эталонных коллекций карбонатов и карбонатных цементов разной степени преобразованности, установлены (ТО СНИИГГиМС) граничные значения изотопного критерия карбонатов (Кi). Они используются в качестве определения степени эпигенетического преобразования карбонатов: Кi от 0 до 0,13 – морские неизмененные карбонаты; 0,13 Ki < 0,24 – карбонаты слабо изменененные; Ki ≥ 0,24 – карбонаты интенсивно измененные. Результаты поверхностной изотопной геохимической съемки позволяют выделить на карте зоны неизмененных первичных карбонатных 95 составляющих пород, где в условиях отсутствия подтока углеводородных газов отсутствуют или слабо протекают вторичные процессы, а также перспективные участки территорий, имеющих изотопные аномалии – зоны со значительными вторичными изменениями карбонатных составляющих пород, которые обусловлены процессами образования и миграции углеводородов. 13.4. Гидрогеохимические показатели нефтеносности На основе гидрогеологических и гидрогеохимических исследований пластовых вод нефтяных и газовых месторождений: изучения палеогидрогеологии, гидродинамики, гидрогеотермии и изотопного состава разработан комплекс гидрогеологических показателей нефтегазоносности применительно к отдельным нефтегазоносным комплексам и районам. Как косвенный показатель нефтегазоносности может использоваться минерализация вод, хотя напрямую она не зависит от наличия залежей нефти и газа, но в пределах одного водоносного комплекса величина минерализации вод хорошо коррелирует с наличием углеводородов. То же самое можно сказать относительно брома, йода, аммония, гидрокарбонат-иона и бора. В перечень гидрогеохимических показателей можно также включить сульфат-ион, так как степень десульфирования вод возрастает с приближением к залежи. Высокоинформативными показателями являются водорастворенные газы (сумма тяжелых углеводородов и газонасыщенность) за исключением метана, а также тяжелые стабильные изотопы водорода и кислорода и стабильные изотопы углерода карбонатов вод. КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Какие косвенные методы литогеохимических исследований применяют в нефтегазовой геологии? 2. Какие гидрогеохимические показатели можно использовать для обнаружения залежей нефти и газа? 3. Комплексирование каких методов применяют для обнаружения полей над залежью нефти? Обоснуйте применение этих методов. 4. Что такое изотопная литогеохимическая съемка, в каких целях она применяется? 5. Какие результаты модно получить нейтронным и нейтронноактивационным анализом? 6. Что является концептуальной основой проведения ядерной литогеохимической съемки? 96 ЗАКЛЮЧЕНИЕ Изложенный в учебном пособии материал является лишь частью исследований геохимии литосферы. Он не объясняет многих процессов, протекающих в глубинных толщах земной коры, в частности связанных с образованием и существованием магматических пород. Он не претендует также на полный охват аспектов и проблем познания геохимической истории осадочных пород и их постседиментационных преобразований. В нем рассматриваются лишь геохимические процессы, протекающие в основном при гумидном седиментогенезе. Значительная роль при изложении отведена постседиментационным преобразованиям терригенных и карбонатных пород в стадиальном и внестадиальном литогенезе, как перспективных коллекторов нефти и газа. При этом за рамками изложенного остались многие вопросы, касающиеся особенностей геохимических процессов в аридном и нивальном типах литогенеза и при метагенезе. Цель данного пособия сводилась к тому, чтобы дать представление о многогранности, направленности, последовательности и преемственности изменения процессов осадко- и породообразования. Порядок изложения материала позволяет получить представления об основных особенностях миграции химических элементов в земной коре; выяснить причину рассеяния и концентрации отдельных элементов; понять ход процессов, протекающих в литогенезе: при образовании осадочного материала, на путях его транспортировки, в бассейне осадкообразования, а также при превращении осадка в породу; выяснить причину формирования того или иного геохимического фона, на который накладываются процессы, связанные с поступлением углеводородов в коллектор. В свете этих представлений основными разделами пособия для геологов-нефтяников являются разделы, посвященные преобразованию осадочных пород под влиянием углеводородной залежи, а также разделы, объясняющие причины формирования литохимических полей над залежью нефти. Контрольные вопросы, приведенные в конце каждого раздела, акцентируют внимание на опорные представления и ключевые моменты, позволяют систематизировать и осмыслить изложенный материал. Рекомендуемые литературные источники могут послужить опорной базой для дальнейшего углубленного изучения геохимических процессов литогенеза. 97 СПИСОК ЛИТЕРАТУРЫ 1. Алексеенко В. А. Экологическая геохимия: учебник. – М.: Логос, 2000. – 626 с. 2. Алексеенко В.А., Алексеенко Л.П. Геохимические барьеры: учебн. пособие. – М.: Логос, 2003. – 144 с. 3. Баженов В.А., Недоливко Н.М., Симанова И.Г. Вторичное минералообразование в покрышках месторождений углеводородов // Геология и геофизика. – Новосибирск, 1994. – № 10. – Т. 35. – С. 61–66. 4. Барабанов В. Ф. Геохимия. – Л: Недра, 1985. – 423 с. 5. Баранов С. А., Кривошеев Э. В., Меркулов В. П. Комплексные геофизические исследования при геологическом доизучении восточных районов Томской области – состояние и перспективы развития: материалы науч.-практич. конференции. – Новосибирск, СНИИГГиМС. – 2004. – С. 8–9. 6. Браунлоу А. Х. Геохимия: пер. с англ. – М: Недра, 1984. – 463 с. 7. Горная энциклопедия / Гл. ред. Е.А. Козловский. – М.: Сов. Энциклопедия, 1985. – Т. 2. – С. 15–22. 8. Гриффитс Дж. Научные методы исследования осадочных пород. – М.: Мир, 1971. – 422 с. 9. Диагенез и катагенез осадочных образований / Под ред. Г. Ларсена и Дж. Чилингара. – М.: Мир, 1971. – 464 с. 10. Жукова Т.А., Иванов В.Г., Трушкин В.В. Перспективы нефтегазоносности правобережья р. Оби Томской области по гидрогеохимическим и гидродинамическим данным: материалы науч.-практич. конференции. – Новосибирск: СНИИГГиМС. – 2004. – С. 55–57. 11. Коссовская А.Г., Шутов В.Д. Проблема эпигенеза // Эпигенез и его минеральные индикаторы. – М.: Наука, 1971. – С. 9–34. 12. Лебедев Б.А. Влияние эпигенетических процессов на параметры коллекторов и покрышек в мезозойских отложениях ЗападноСибирской низменности. – Л.: Недра, 1976. – 120 с. 13. Лебедев Б.А. Геохимия эпигенетических изменений. – М.: Недра, 1992. – 126 с. 14. Лидер М.Р. Седиментология. Процессы и продукты: пер. с анг. – М.: Мир, 1986. – 439 с. 15. Логвиненко Н.В., Сергеева Э.И. Методы определения осадочных пород: учебн. пособие для вузов. – Л.: Недра, 1986. – 240 с. 16. Методы изучения осадочных пород / Под ред. Н.М. Страхова. – М: Госгеолтехиздат, 1957. – Т. 1. – 612 с. 17. Недоливко Н.М. Аутигенное минералообразование в юрских отложениях юго-востока Нюрольской впадины и его влияние на фильт98 рационные и емкостные свойства песчаных пород // Геологическое и горное образование. Геология нефти и газа: материалы междунар. науч.технич. конференции. – Томск: Изд-во ТПУ, 2001. – С. 178–181. 18. Недоливко Н.М. Глинистые минералы юрского разреза восточной части Нюрольской впадины // Геологическое и горное образование: материалы междунар. науч.-технич. конференции. – Томск: Изд-во ТПУ, 2001 – С. 181–184. 19. Недоливко Н.М. Минеральные индикаторы стадиального и наложенного эпигенеза в песчаниках юго-востока Нюрольской впадины // Нефтегазовому образованию в Сибири – 50 лет: труды междунар. конференции. – Томск, 2002. – С. 84–90. 20. Недоливко Н.М., Жуковская Е.А., Баженов В.А. Карбонаты в юрских отложениях юго-восточной части Нюрольской впадины (Томская область) // Геология и геофизика. – Новосибирск, 2001. – № 3. – Т. 42. – С. 491–501. 21. Оценка перспектив нефтегазоносности разновозрастных отложений Томской области на основе изотопно-геохимических критериев / С.И. Голышев, Л.В. Лебедева, Н.Л. Падалко, Е.В. Черников, П.Ф. Яворов: материалы науч.-практич. конференции. – Новосибирск: СНИИГГиМС, 2004. – С. 35–37. 22. Перельман А. И. Геохимия элементов в зоне гипергенеза. – М.: Недра, 1972. – 288 с. 23. Перельман А. И. Геохимия эпигенетических процессов. – М.: Недра, 1968. – 331 с. 24. Перозио Г.Н. Эпигенез терригенных осадочных пород Западно-Сибирской низменности. – М.: Недра, 1971. – 160 с. 25. Питулько В.М., Резников И.Н., Ульянов Н.К. Литохимические методы съемки и поисков. – Л.: Недра, 1985. 26. Сауков А. А. Геохимия. – М: Наука, 1975. – 480 с. 27. Сахибгареев Р.С. Вторичные изменения коллекторов в процессе формирования и разрушения нефтяных месторождений. – Л.: Недра, 1989. – 260 с. 28. Справочник по литологии / Под ред. Н.Б. Вассоевича, В.Л. Либровича, Н.В. Логвиненко, В.И. Марченко. – М.: Недра, 1983. – 509 с. 29. Страхов Н.М. Основы теории литогенеза. – М.: Изд-во АН СССР, 1960. – Т. 2. – 550 с. 30. Технология прогноза и поисков месторождений нефти и газа в разновозрастных отложениях Томской области на основе комплексной интерпретации результатов поверхностной литогеохимической съемки и анализа полей напряженности горных пород / С.И. Голышев, А.С. Ив99 лева, Н.П. Падалко, К.Д. Парыгин и др.: материалы науч.-практич. конференции. – Новосибирск: СНИИГГиМС, 2004. – С. 34–35. 31. Япаскурт О.В. Предметаморфические изменения осадочных пород в стратисфере. Процессы и факторы. – М.: ГЕОС, 1999. – 260 с. 100 СОДЕРЖАНИЕ 1. 1.1. 1.2. 2. 3. 3.1. 3.2. 3.3. 4. 4.1. 4.2. 4.3. 4.4. 5. 5.1. 5.2. 5.3. 5.4. 5.5. 6. 7. 7.1. 7.2. 8. 8.1. 8.2. 8.3. 8.4. 9. 9.1. 9.2. 9.2.1. Введение……………………………………………………. Геохимия и ее место среди других наук........................... Геохимия и ее место среди родственных дисциплин…….. Геохимия литогенеза……………………………………….. Распространенность химических элементов в земной коре. Кларки……………………………………. Геохимическая классификация элементов…….……… Классификация В.И. Вернадского………………………… Классификация В.М. Гольдшмидта……………………….. Классификация элементов по их распространенности…… Форма нахождения элементов в земной коре…………. Главнейшие формы нахождения элементов в земной коре…………………………………………………... Истинные растворы…………………………………………. Комплексные ионы и недиссоциированные молекулы…... Коллоиды и основные группы коллоидных минералов….. Основные законы миграции и рассеяния элементов. виды и типы миграции химических элементов……….. Внутренние и внешние факторы миграции элементов…… Кислотность-щелочность среды…………………………… Типоморфные элементы и соединения водной миграции... Окислительно-восстановительный потенциал среды……. Геохимические барьеры……………………………………. Стадии литогенеза…………………………………………. Геохимия гипергенеза…………………………………….. Химическое выветривание горных пород………………… Зональность коры выветривания. Коры выветривания по магматическим породам ………………...……………… Геохимия седиментогенеза……………………………….. Химический состав наземных вод…………………………. Состав океанической воды…………………………………. Геохимия триады рудных элементов Al–Fe–Mn………….. Геохимия тетрады P – SiO2 – CaCO3 – MgCO3 …………… Геохимия диагенеза………………………………………... Особенности преобразования вод при диагенезе………… Химическое преобразование органического вещества…… Преобразование органического вещества в окислительной обстановке………………………………... 101 3 4 4 6 9 15 15 15 19 21 21 23 23 24 27 27 29 31 31 33 38 41 41 44 51 51 52 53 54 58 58 59 60 9.2.2. 9.3. 9.4. 9.5. 10. 10.1. 10.2. 10.3. 10.4. 11. 11.1. 11.2. 11.3. 11.4. 11.5. 12. 12.1. 12.2. 12.3. 12.4. 12.5. 12.6. 12.7. 12.8. 13. 13.1. 13.2. 13.3. 13.4. Преобразование органического вещества в восстановительной обстановке…………………………... Химическое превращение минеральных твердых фаз…… Этапы диагенеза и зональность диагенетического минералообразования ………………………..…………………... Диагенетическое преобразование карбонатных пород…… Геохимия катагенеза……………………………………… Формирование вод (поровых растворов) при катагенезе… Изменение минеральной части…………………………….. Преобразование карбонатных пород при катагенезе……... Образование углеводородных флюидов в зоне катагенеза……………………………………………………. Геохимия процессов, связанных с поступлением нефти в коллектор……………………… Внестадиальные процессы, улучшающие качество коллектора………………………………………… Преобразование коллекторов в зоне нефтенасыщения…... Преобразования пород в зонах водонефтяных контактов... Преобразование пород в законтурной зоне……………….. Изменение микроэлементного состава осадочных пород в зоне влияния углеводородной залежи. Положительные и отрицательные аномалии……………… Методы исследования вещества………………………… Элементный качественный анализ………………………… Количественный химический (силикатный) анализ……… Спектральный количественный анализ…………………… Атомно-абсорбционная спектрофотометрия……………… Микрозондовый анализ…………………………………….. Нейтронные методы………………………………………… Изотопные методы………………………………………….. Хроматографические методы………………………………. Комплексное применение химических и физических методов в нефтяной геологии…………….. Высокоточная наземная магнитометрия, гамма-спектрометрия, рентгенорадиометрический и петрофизический методы исследования………………… Литогеохимическая съемка по урану и алюминию………. Изотопная литогеохимическая съемка…………………….. Гидрогеохимические показатели нефтеносности………… Заключение…………………………………………………. Список литературы……………………………………….. 102 61 62 62 64 67 67 69 74 75 78 78 79 80 81 82 86 86 86 87 87 88 88 89 90 91 91 92 93 95 96 97 Недоливко Наталья Михайловна ГЕОХИМИЯ Учебное пособие Научный редактор кандидат физико-математических наук, доцент Б.Б. Квеско Редактор М.В. Сурикова Подписано к печати 15.06.2005. Формат 60х84/16. Бумага офсетная. Печать RISO. Усл. печ. л. 5,93. Уч.-изд. л. 5,37. Тираж 120 зкз. Заказ Цена свободная. Издательство ТПУ. 634050, г. Томск, пр. Ленина, 30. 103