ПОИСК ОПТИМАЛЬНОГО ВАРИАНТА КЛЕТОЧНОЙ ТЕРАПИИ
advertisement

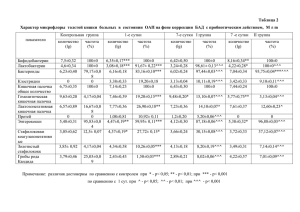
Оригинальные исследования 41 ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ Поиск оптимального варианта клеточной терапии критической ишемии конечностей в эксперименте О.В. Маслянюк, В.Н. Александров, В.С. Чирский, А.В. Кривенцов, А.Г. Максимов, В.П. Румакин, Л.И. Калюжная ФВГОУ ВПО «Военно-медицинская академия им. С.М. Кирова» МО РФ Search of an optimum variant of cell therapy of a critical limbs ischemia in experiment O.V. Maslyanyuk, V.N. Alexandrov, V.S. Chirsky, A.V. Kriventsov, A.G. Maximov, V.P. Rumakin, L.I. Kalyuzhnaya Federal State Educational Institution of Higher Vocational Education «S. M.Kirov Military Medical academy» of the RF Ministry of Defense, Saint Petersburg Поиск пути введения клеток, обеспечивающего оптимальный ангиогенез в ишемизированной конечности, как цель исследования представляется актуальным, так как верный путь доставки клеточного материала при прочих равных условиях является основным условием эффективности клеточной терапии. На экспериментальной модели критической ишемии (методами ангиографии, оценки плотности капиллярной сети на гистологических срезах) показано, что клеточная терапия при любом пути введения клеток (внутримышечный, внутриартериальный, комбинированный) индуцирует ангиогенез, скорость развития которого и выраженность зависят от пути доставки клеток. Оптимальным вариантом клеточной терапии критической ишемии является комбинированный (внутримышечно-артериальный) метод введения клеток, объединяющий положительные стороны внутримышечного и внутриартериального путей. The search of new way of cell injection that can provide maximal angiogenesis in ischemic limbs is urgent aim of investigation for the right way of cell delivery other things being equal is the main request for cell therapy efficiency. On experimental model of critical ischemia (by angiographic method and evaluation of capillary density on histological sections) it was shown that cell therapy independently from the way of cell injection (intramuscularly, intra-arterialy and combined) induces angiogenesis, the rate and intensity of which depend on the way of cell delivery. The optimum variant of cell therapy of critical ischemia is combined (intramusculararterial) method of cell injection, uniting the advantages of intramuscular and intra-arterial ways. Ключевые слова: ангиогенез, клеточная терапия, критическая ишемия конечностей. Key words: angiogenesis, cell therapy, critical limbs ischemia. При невозможности или недостаточности хирургической реваскуляризации при критической ишемии конечностей терапевтический ангиогенез или «биологическое шунтирование» может оказаться весьма эффективным методом восстановления кровообращения в ишемизированной конечности [1]. Однако клеточная терапия критической ишемии мононуклеарной фракцией аутогенного костного мозга (как наиболее часто используемого клеточного материала) эффективна не всегда. Описаны отрицательные (усиление болей) результаты или отсутствие положительной динамики. Полагаем, что эффект клеточной терапии критической ишемии предопределен методом введения клеточного материала. Как правило, клетки доставляются посредством множественных инъекций в ишемизированные мышцы. Мозаичный характер ишемии при этом не учитывается, что, на наш взгляд, лимитирует эффективность данного пути введения. Вне участков ишемии VEGF-зависимая пролиферация введенных предшественников эндотелиоцитов и реактивность моноцитов, детерминированные рН тканевой жидкости скелетных мышц, ограничены. В этой связи, представлялось обосно- ванным провести сравнительный анализ эффективности клеточной терапии критической ишемии при разных способах доставки клеток. Цель исследования. Найти путь введения клеточного материала, обеспечивающий оптимальный ангиогенез в ишемизированной конечности. Материал и методы В качестве экспериментальных животных использовали 57 самцов крыс породы Вистар массой 250–300 г, из которых 3 служили донорами клеток. Содержание и использование животных соответствовало правилам, принятым в учреждении, рекомендациям национального совета по исследованиям, национальным законам. 54 крысам была выполнена перевязка правой бедренной артерии под неингаляционным наркозом (тиопентал натрий 80 мг/кг внутрибрюшинно). Выделенную артерию перевязывали на уровне пупартовой связки. Для оценки местной и общей реакции на некроз тканей ишемизированной конечности за животными было установлено динамическое наблюдение. Местную реакцию оценивали по состоянию операционной e-mail: blastik@mail.ru Клеточная трансплантология и тканевая инженерия Том VI, № 3, 2011 42 Оригинальные исследования раны, цвету кожных покровов конечности, степени отека (как отношение длины окружности поврежденной конечности к здоровой на уровне 1/2 бедра) и нарушению функции. Общую реакцию – по внешнему виду, поведению животных (состояние волосяного покрова, двигательная активность, прием пищи и воды), ректальной температуре, индексу сдвига лейкоцитов крови (ИСЛК), который рассчитывали по способу Н.И. Яблучинского с соавт.: ИСЛК равен отношению суммы гранулоцитов к общему количеству мононуклеарных клеток, входящих в лейкоцитарную формулу [2]. Указанные показатели исследовали у 5 животных случайной выборки каждые 10-е сут. после перевязки бедренной артерии. Восстановление показателей до уровня, характерного для интактных животных, было принято как оптимальное условие для трансплантации клеток. Клеточную терапию проводили на 30-е сут. после перевязки бедренной артерии при отсутствии местных и общих признаков воспаления. В качестве клеточного материала использовали мононуклеарную фракцию костного мозга бедренных и большеберцовых костей, выделенную на градиенте перколла (плотность 1,077). Количество мононуклеаров после трехкратного отмывания в 0,9% забуференном растворе натрия хлорида составляло 96%, жизнеспособность в тесте с трипановым синим – 97%. Вводили 4×106 клеток в объеме 200 мкл 0,9% забуференного раствора натрия хлорида. В зависимости от способа доставки клеток животные целевой (реципиенты клеток донора) и контрольной (не получившие клеток) групп были разбиты на 3 подгруппы (табл.1). Всех животных готовили к данному этапу эксперимента так же, как и при перевязке бедренной артерии (наркоз, фиксация, выделение артерии) за исключением подгруппы «внутримышечного введения», в случае которой артерию не выделяли. При внутримышечном введении клетки инъецировали в объеме 20 мкл десятью уколами на глубину до 5 мм в мышцы ишемизированной конечности. При внутриартериальном – клетки вводили однократно в объеме 200 мкл в центральный конец перевязанной артерии. При комбинированном – животные получали 100 мкл клеточной взвеси внутриартериально и 100 мкл посредством 5 инъекций в объеме 20 мкл каждая в ишемизированные мышцы. Животных контрольной группы подвергали идентичным манипуляциям кроме трансплантации клеток – им, способами, описанными для животных целевой группы, вводили равный объем забуференного 0,9% раствора натрия хлорида. На 10, 20 и 30-е сут. после проведения клеточной терапии у 3 животных каждой подгруппы целевой и контрольной групп исследовали общее состояние, а также содержание цитокинов (ИЛ-6 – как провоспалительный, ИЛ-10 – как противовоспалительный цитокины) в сыворотке крови с помощью иммуноферментного анализа (OptEIA; BDBiosciences). Для визуализации сосудов поврежденной конечности проводили ангиографию. Рентгенконтрастный препарат (Омнипак 240) вводили в объеме 1,5–2,0 мл после лапаротомии, пункции и катетеризации брюшного отдела аорты крысы. Рентгенограммы получали на аппарате «Арман» по стандартной методике. После выведения животных из эксперимента забирали конечности для гистологического и электронномикроскопического исследований. В гистологических препаратах оценивали удельную площадь микроциркуляторного русла. Реактивность эндотелиальных клеток оценивали по данным электронной микроскопии. Результаты и обсуждение Состояние животных на 10-е сут. после перевязки бедренной артерии оценивалось как удовлетворительное. Операционные раны заживали первичным натяжением. Ишемизированные конечности были отечны, с ограниченной функцией, кожные покровы цианотичны. Шерсть чистая и гладкая. Животные активно передвигались, потребляли корм и воду. Температура тела оставалась в пределах нормы. ИСЛК – увеличен до 0,26±0,04. На 20-е сут. сохранялся небольшой отек конечностей, в анализе крови отмечался сдвиг лейкоцитарной формулы влево. К 30-м сут. животные по всем указанным показателям не отличались от интактных (табл. 2). Таким образом, у крыс в динамике экспериментальной ишемии конечности вследствие перевязки бедренной артерии можно условно выделить 3 периода: начальный (первые 10 сут. после перевязки артерии), характеризующийся преимущественно местными реакциями, переходный (с 10-х по 20-е сут.), когда доминируют общие реакции, и период хронической ишемии (спустя 20 сут. после перевязки). Реакция животных на трансплантацию не была системной, судя по неизменной температуре тела (табл. 3), и, очевидно, ограничивалась лишь клеточным ответом в виде увеличения ИСЛК (табл. 4). Таблица 1. Распределение экспериментальных животных на подгруппы в зависимости от метода введения клеток Подгруппы животных (число животных в подгруппе) Группа Внутримышечное введение Внутриартериальное введение Комбинированное введение Целевая, n = 27 9 9 9 Контрольная, n = 27 9 9 9 Клеточная трансплантология и тканевая инженерия Том VI, № 3, 2011 43 Оригинальные исследования Таблица 2. Динамика общих и местных признаков воспаления в послеоперационном периоде Показатель Сутки после операции температура тела, °С ИСЛК отек, % 10-е 36,9±1,1 0,26±0,04 10±3 20-е 37,6±1,0 0,43±0,05* 6±2 30-е 37,1±0,2 0,17±0,02 0 Примечание: В норме температура тела у крыс 37–38°С, ИСЛК 0,19±0,02. * – статистически значимое различие между значениями показателя в целевой/контрольной группах по отношению к норме, р < 0,05. Таблица 3. Температура тела животных после клеточной терапии в зависимости от группы и метода введения клеток Контрольная группа, температура тела, °С Сроки, сут. Целевая группа, температура тела, °С Внутримышечное введение Внутриартериальное введение Комбинированное введение Внутримышечное введение Внутриартериальное введение Комбинированное введение 10-е 37,4±0,2 37,3±0,3 37,2±0,5 37,2±0,3 37,3±0,4 37,2±0,4 20-е 37,2±0,3 37,2±0,4 36,8±0,4 36,5±0,4 37,1±0,3 37.8±0,4 30-е 37,1±0,3 37,1±0,1 37,1±0,5 37,1±0,2 37,3±0,3 37,0±0,5 Таблица 4. ИСЛК после трансплантации клеток в зависимости от группы и метода введения клеток Контрольная группа, ИСКЛ Сроки, сут. Целевая группа, ИСКЛ Внутримышечное введение Внутриартериальное введение Комбинированное введение 10-е 0,29±0.02 0,28±0,03 0,33±0,03 20-е 0,13±0,01 0,15±0,02 30-е 0,15±0,02 0,11±0,01 Внутримышечное введение Внутриартериальное введение Комбинированное введение 0,44±0,02* 0,32±0,03 0,36±0,03 0,16±0,03 0,19±0,03* 0,41±0,04* 0,34±0,02* 0,16±0,02 0,25±0,04* 0,24±0,02* 0,27±0,02* Примечание: * – статистически значимое различие между значениями показателя в целевой группе по отношению к норме, р<0,05. При внутримышечном введении быстро возникавшее увеличение и столь же быстрое снижение ИСЛК предположительно было связано с преимущественным участием перераспределительного механизма, инициированного болевой и неболевой афферентацией из мест введения клеток, а, значит, сопровождаемой усиленной продукцией кортизола и катехоламинов. При внутриартериальном и комбинированном путях отсроченное повышение и постепенное снижение ИСЛК предполагало ведущее участие иммунных механизмов – активированных клетками донора моноцитов-макрофагов реципиента, причем, с преобладанием секреции не провоспалительного (ИЛ-6), а противовоспалительного цитокина (ИЛ-10) (табл. 5), а также, возможно, ряда других (например ИЛ-1, гранулоцитарно-макрофагального колониестимулирующего фактора, обуславливающих пролиферацию и дифференцировку клеток миелоидного ростка). Анализ ангиограмм в динамике посттрансплантационного периода продемонстририровал существенное различие как в скорости нарастания числа коллатералей в ишемизированных конечностях животных целевой и контрольной групп, так и в их числе, что было особенно заметно на 30-е сут. наблюдения. В контрольной группе животных независимо от пути введения клеток лишь на 30-е сут. обнаруживались единичные коллатерали (рис.1). Ангиографическим данным в полной мере соответствовали результаты микроскопического анализа образцов тканей ишемизированных конечностей, где на всех сроках наблюдения доминировали признаки ишемического некроза и перифокального воспаления мышечной ткани. Первые проявления ангиогенеза определялись только на 30-е сут.. Напротив, у всех животных целевой группы независимо от пути доставки клеток уже на 10-е сут. после их введения обнаруживались коллатерали, а к 30-м сут. – выраженное коллатеральное кровообращение (рис. 2А, Б, В). Клеточная трансплантология и тканевая инженерия Том VI, № 3, 2011 44 Оригинальные исследования Таблица 5. Уровень ИЛ-6 и ИЛ-10 (пг/мл) после трансплантации клеток в зависимости от группы и метода введения клеток Контрольная группа Сроки, сут. Внутримышечное введение Внутриартериальное введение Целевая группа Комбинированное введение Внутримышечное введение Внутриартериальное введение Комбинированное введение ИЛ-6 ИЛ-10 ИЛ-6 ИЛ-10 ИЛ-6 ИЛ-10 ИЛ-6 ИЛ-10 ИЛ-6 ИЛ-10 ИЛ-6 ИЛ-10 10-е 3,5±1,0 5,2±1,0 4,0±0,4 4,7±1,4 3,5±0,7 4,7±0,8 3,6±0,5 5,6±0,8 3,3±0,7 10,3±1,5* 4,2±1,5 7,2±0,4* 20-е 4,4±1,1 4,2±2,0 3,6±1,2 4,9±1,3 3,4±0,8 5,3±2,0 4,1±1,2 4,1±2,2 5,7±1,7 5,8±2,7 3,8±1,2 4,8±1,1 30-е 5,1±1,4 6,2±2,2 4,2±1,3 3,9±1,8 2,8±1,2 4,7±0,9 4,7±2,2 4,8±1,8 4,3±1,3 3,9±1,9 3,3±0,7 4,7±1,4 Примечание: Содержание ИЛ-6 у крыс в норме 6±2 пг/мл; содержание ИЛ-10 – 7±3 пг/мл. * – статистически значимое различие между значениями показателя в целевой группе по отношению к норме, р < 0,05. Рис. 1. Ишемизированная конечность крысы контрольной группы (подгруппа – внутриартериальное введение) на 30-е сут. эксперимента. Ангиограмма: 1 – уровень перевязки бедренной артерии; 2 – коллатерали А Б В Рис. 2. Ишемизированная конечность крыс целевой группы на 30-е сут. после введения клеток. Артериограммы. Подгруппы: А – внутриартериальное введение; Б – внутримышечное; В – комбинированное; 1 – уровень перевязки бедренной артерии; 2 – коллатерали Рис. 3. Эндотелиоцит образца ткани ишемизированной конечности крысы, подгруппа с комбинированным введением клеток, 30-е сут.: 1 – крупное ядро с неровными контурами, содержащее небольшое количество конденсированного хроматина; 2 – ядрышко; 3 – базальная мембрана; 4 – просвет капилляра; 5 – эритроцит в просвете капилляра. Электронная микроскопия. Ув. ×12000 Клеточная трансплантология и тканевая инженерия Том VI, № 3, 2011 45 Оригинальные исследования Заключение Экспериментальная ишемия конечности у крыс, воспроизведенная на уровне бедренной артерии, на наш взгляд, является адекватной моделью хронической ишемии конечности человека. Протекая без выраженных местных и общих реакций первые 20 дней, к 30-м сут. она принимает характер хронической ишемии, когда только дополнительные исследования, включая ангиографию, исследования микроциркуляторного русла и реактивности эндотелиальных клеток позволяют ее диагностировать. Клеточная терапия мононуклеарной фракцией костного мозга не сингенных, а лишь этой же популяции крыс-доноров, как оказалось, совершенно безопасная для животных, существенно меняет ситуацию от состояния эндотелиоцита до всего микроциркуляторного русла. У животных – реципиентов клеток, в отличие от контрольных, не только достоверно увеличивается плотность капилляров на единицу площади (табл. 6), но также появляется заметное коллатеральное кровообращение. Все это подтверждает ограниченную способность собственно ишемии и гипоксии к инициации репаративной регенерации сосудов без достаточного числа эффекторов этой регенерации – эндотелиоцитов и их предшественников. Только трансплантация этих клеток в составе мононуклеарной фракции костного мозга обеспечивает условия, необходимые для новообразования сосудов в зоне ишемии. Однако скорость ангиогенеза как принципиальный показатель эффективности клеточной терапии критической ишемии и конечный полезный ее результат зависят от метода введения клеточного материала. Оптимальным вариантом доставки клеток по критерию скорости ангиогенеза и его конечному уровню является комбинированный метод введения клеток, объединяющий в себе выгодные стороны внутримышечной и внутриартериальной доставки клеточного продукта (рис. 4). Его «внутримышечная» составляющая обеспечивает, очевидно, формирование местных многоклеточных долговременных и отсроченных по времени развития очагов ангиогенеза, взаимодействующих в процессе артериогенеза с «внутриартериальной» составляющей, представленной региональными «малоклеточными», быстро созревающими очагами. 12 10 Удельная площадь, % На гистологических препаратах ишемизированных конечностей животных целевой группы в этот же период наблюдения определялся активный ангиогенез, проявлявшийся образованием новых капилляров. Наиболее выраженным он был в группе с комбинированным введением клеток, где, в отличие от групп с внутриартериальным (умеренное количество пролиферирующих капилляров по периферии очага некроза, множественные микропролифераты капилляров в краевых зонах некроза, единичные пролиферирующие капилляры в окружающей мышечной ткани) и внутримышечным (умеренно выраженная зона из кровеносных сосудов капиллярного типа с формированием небольших «клубков», небольшие «грозди» пролиферирующих капилляров в окружающей мышечной ткани), вокруг зоны некроза определялись массивные «грозди» кровеносных сосудов с набухшим гиперхромным эндотелием (рис. 3). 8 6 4 2 0 в/м в/а 10-е сут. 20-е сут. в/м + в/а 30-е сут. Рис. 4. Динамика нарастания удельной площади микроциркуляторного русла в зависимости от метода введения клеточного материала. Пути введения: в/м – внутримышечный; в/а – внутриартериальный; в/м + в/а – комбинированный Таблица 6. Удельная площадь (%) микроциркуляторного русла мышц конечности животных целевой и контрольной групп после трансплантации Сроки, сут. Внутримышечное введение Внутриартериальное введение Комбинированное введение контрольная группа целевая группа контрольная группа целевая группа Контрольная группа Целевая группа 10-е 3,3±0,3 5,2±1,5* 2,3±0,7 3,0±0,7 4,0±1,0 6,7±1,0* 20-е 3,2±0,2 6,7±1,7* 3,1±0,3 7,8±0,8* 1,7±0,8 6,7±0,7* 30-е 3,8±1,0 9,5±2,2* 3,0±0,3 8,3±1,7* 2,8±0,8 9,7±1,0* Примечание: * – статистически значимое различие между значениями показателя в целевой и контрольной группах, р < 0,05. ЛИТЕРАТУРА: 1. Белевитин А.Б., Хубулава Г.Г., Сазонов А.Б. и др. Использование аутологичных стволовых клеток для стимуляции артериогенеза при критической ишемии конечностей. Вестник Российской Военно-медицинской академии 2008; 3(23): 176–9. 2. Масютин В.А., Широков Д.М., Пивоварова Л.П. и др. Оценка лабораторных данных в критических состояниях. СПб: СПбГП, 1999. Поступила 03.04.2011 Клеточная трансплантология и тканевая инженерия Том VI, № 3, 2011