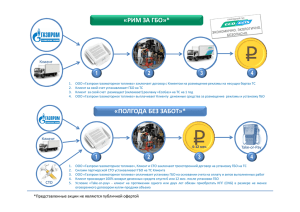
Генетика окислительного стресса
advertisement

Светлой памяти Е.П. Гуськова посвящается К 70-летию со дня рождения ФГОУ ВПО «ЮЖНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ» НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ БИОЛОГИИ СЕВЕРО-КАВКАЗСКИЙ НАУЧНЫЙ ЦЕНТР ВЫСШЕЙ ШКОЛЫ ГЕНЕТИКА ОКИСЛИТЕЛЬНОГО СТРЕССА Ростов-на-Дону Издательство СКНЦ ВШ ЮФУ 2009 УДК 575.224:582.998.2 ББК Е04 Г34 Издание подготовлено в рамках национального проекта «Развитие сети национальных университетов 2007–2010» Рекомендовано в печать комиссией Ученого Совета НИИ биологии ЮФУ 05.12.2007. Рецензенты: доктор биологических наук, профессор Московского государственного университета им. М.В. Ломоносова М.М. Асланян доктор биологических наук, главный генетик Ростовской области С.С. Амелина В подготовке монографии приняли участие сотрудники НИИ биологии ЮФУ: Е.П. Гуськов, Т.П. Шкурат, Т.В. Вардуни, Е.В. Машкина, И.О. Покудина, Е.И. Шиманская, Г.Е. Гуськов, Н.И. Беличенко, А.А. Александрова Г 34 Генетика окислительного стресса. – Ростов н/Д: Изд-во СКНЦ ВЩ ЮФУ, 2009. – 156 с. ISBN 978-5-87872-476-0 Монография обобщает данные об эффектах действия повышенного давления кислорода на генетический аппарат растений, животных и человека; в ней рассмотрены вопросы модификации мутагенного эффекта гипербароксигенации, преадаптации к окислительному стрессу. Монография рекомендована для биологов, врачей терапевтов, врачей гипербарических центров и клиник, студентов медицинских и биологических факультетов университетов. ISBN 978-5-87872-476-0 УДК 575.224:582.998.2 ББК Е04 © НИИ биологии ЮФУ, 2009 © Издательство СКНЦ ВШ ЮФУ, 2009 ВВЕДЕНИЕ Относительно короткую историю кислородного мутагенеза можно условно характеризовать тремя периодами. Первый этап охватывает пионерские работы по установлению генотоксического эффекта чистого кислорода при высоких давлениях на микроорганизмах, растениях, в культуре ткани, и связан в первую очередь с такими именами как Моутшен-Дахмен (Moutschen-Dahmen et al., 1959; 1962), Фенн (Fenn et al., 1957), Конгер (Conger, 1951) и Гершман (Gerschman, 1959). Завершением этого этапа стала гипотеза о том, что эффекты кислорода под повышенным давлением опосредованы через свободнорадикальные процессы. Второй этап характеризуется установлением генетических эффектов повышенной концентрации кислорода при нормальном давлении. Это послужило стимулом для исследований, посвященных изучению генотоксического эффекта активных форм кислорода (АФК). При этом было показано, что АФК индуцируют повреждение генома не только при повышенных концентрациях кислорода и после гипероксии, но и после воздействия целого ряда физических и химических мутагенов практически на любом уровне организации, а также при ряде патологических состояний человека – инсульт, ишемия, рак, болезнь Альцгеймера и др. (Halliwell, Gutteridge 1999; Beal, 2002; Ogino, Wang, 2007, Dumont et al., 2009), при психо-эмоциональном стрессе. Данный этап знаменателен тем, что Брюс Эймс ввел термин «окислительный стресс» (Ames, 1983), под которым мы понимаем нарушение динамического равновесия в системе «прооксидант–антиоксидант». Окислительный стресс индуцирует патофизиологические процессы (Halliwell, 1998; Sahnoun et al., 1998), а также может индуцировать повреждения ДНК, инактивировать ферменты и гормоны, приводить к деструкции мембран и в конечном итоге вызвать гибель клетки. Как показано в последнее время, преждевременное старение, гибель клеток и канцерогенез могут быть связаны с окислительным повреждением теломерных участков хромосом, дыхательной цепи митохондрий и других мембраных структур клетки (Bunout, Cambiazo, 1999; Ishii, 2007). Третий этап связан с изучением отдаленных генетических последствий окислительного стресса и феномена предадаптации. Этот этап характеризуется выдвижением ряда плодотворных гипотез о возможных механизмах токсического и мутагенного действия кислорода, среди которых особого внимания заслуживают гипотезы источников дополнительного радикалообразования (Лукаш, Внуков, 1985; Meneghini, 1987) и протекторного катаболизма (Гуськов, Лукаш, 1986; Гуськов, 1989; Кения и др., 1993; Гуськов и др., 2004). Согласно гипотезе дополнительного радикалообразования, металлопротеины могут быть дополнительным центром образования свободных радикалов в клетке. Гипотеза протекторного катаболизма постулирует защитное действие низкомолекулярных азотсодержащих катаболитов, образующихся в результате гибели неустойчивых к гипероксии клеток. Данная гипотеза оценивает нестабильность генома при окислительном стрессе как адаптивную норму (Гуськов, Шкурат, 1989б; Гуськов и др., 2004). Несмотря на обилие полученных фактов, зачастую противоречащих друг другу, начинает вырисовываться концепция, которая объединяет исследователей разных специальностей – биохимиков, цитологов, эмбриологов, врачей и др. Консолидирующей идеей является представление о том, что инициальным механизмом возникновения патологий 5 внутриклеточных процессов, является нарушение динамического равновесия взаимодействия про- и антиоксидантных систем. Важный элемент этой концепции – градуальность последовательных этапов, приводящих к возникновению патологии клетки. Генетические процессы являются центральным звеном между обратимыми метаболитическими процессами и процессами, приводящими к гибели клетки. В этой связи остается немало не решенных проблем частного и общего характера. В данной работе обобщены исследования об изучении мутагенного действия кислорода на растения, животных и человека, о поиске веществ, способных защитить клетку и организм от токсического действия свободных радикалов, и феномене предадаптации организмов к окислительному стрессу. Глава 1. КИСЛОРОД И ЕГО АКТИВНЫЕ МЕТАБОЛИТЫ Датой открытия кислорода считают 23 марта 1775 г., когда на заседании Лондонского Королевского Общества было зачитано письмо об открытии нового газа – «дефлогистонизированного воздуха». Автором письма был королевский министр Джозеф Пристли (1733–1804). Фактически же кислород был открыт несколько раньше шведским фармацевтом Карлом Вильгельмом Шееле (1742–1786), который он назвал «прозрачным воздухом», затем «огненным воздухом». Публикация Шееле об этом открытии появилась только в августе 1777 г. В том же году Антуан Лорен Лавуазье (1743–1794) показал, что воздух, из которого удален кислород, не пригоден для жизни. Он же раскрыл механизм окисления, доказав, что оксиды имеют больший вес, чем соответствующие металлы, что явилось ударом по теории флогистона. Именно Лавуазье принадлежит современное название кислорода, произведенное от греческих корней oxys и ginomae, что значит «рождающий кислоту». Удивителен тот факт, что элемент воздуха, наиболее необходимый для жизни, был открыт позднее, чем другие составляющие воздух газы. Все аэробные организмы, в том числе и человек, эволюционно приспособлены к существованию в воздушной среде с 21 %-ным содержанием кислорода. Кислород – один из наиболее распространенных элементов на нашей планете. Земная кора на 62,5 % состоит из этого элемента. Кислород занимает важнейшее место во всех биологических процессах. Окислительные реакции, протекающие в организмах, являются главным источником энергии. Свободные радикалы кислорода могут действовать как вторичные клеточные мессенджеры, участвуя в метаболизме арахидоновой кислоты и простогландинов. Процесс фагоцитоза протекает с участием радикалов кислорода и оксида азота. С другой стороны, еще с конца 19 века известно, что чистый кислород токсичен для животных и человека. Известны шесть изотопов кислорода – 14О, 15О, 16О, 17О, 18О, 19О, три из которых (16О, 17 О, 18О) содержатся в атмосферном воздухе. Различают четыре аллотропные модификации кислорода: атомарный кислород (О), обычный молекулярный кислород (О2), озон (О3) и четырехатомное соединение кислорода (О4). Атомарный кислород образуется в заметных количествах только при температуре выше 1 500 °С, когда молекулы О2 начинают диссоциировать. Четырехатомное соединение обнаруживается при высоких давлениях и низких температурах, когда кислород переходит в жидкое состояние. Атом кислорода обладает 8 электронами, которые располагаются на 5 орбиталях. Из них 2 последние орбитали имеют только по 1 электрону. Эти два неспаренных электрона обусловливают двухвалентность кислорода. Кислород является хорошим акцептором электронов и сильным окислителем. Присоединение электронов сопровождается освобождением довольно большого количества энергии. Из всех известных элементов только фтор является более сильным окислителем, чем кислород. Это одна из возможных причин значения кислорода в процессах энергообмена. Поступает в организм и участвует в реакциях окисления молекулярный кислород. Он имеет два неспаренных -электрона, которые принадлежат одновременно двум атомам кислорода, входящим в молекулу. По своему строению молекула кислорода напоминает свободный радикал, повышенная химическая активность которого обусловлена состоянием возбуждения молекулы. В отличие от свободных радикалов молекула кислорода характеризуется высокой стабильностью, т.е. возбужденное состояние молекулы кислорода является также и ее основным состоянием. 7 Кислород обладает свойствами парамагнетизма. Магнитный момент молекулы кислорода довольно велик и равен 2 магнетонам Бора. Сент-Дьердьи на этом основании объясняет факт относительной независимости скорости реакции между кислородом и цитохромоксидазой от концентрации кислорода. Он рассчитал, что радиус магнитного поля молекулы кислорода, в пределах которого он эффективно снижает энергию активации, достигает 100х. Так как диаметр молекулы кислорода составляет около 4х, то даже при очень низкой концентрации кислорода в среде магнитные поля его молекул будут перекрывать друг друга и обеспечивать высокую скорость соответствующих реакций. Молекулярный кислород не вступает в прямые неферментативные реакции с большинством органических соединений, для его активации нужны ферментативные процессы. Главные ферменты метаболизма кислорода у млекопитающих: оксидазы и оксигеназы, но в каталитических центрах этих ферментов кислород испытывает превращения до конечных соединений, не выделяясь в среду и не подвергая опасности органические макромолекулы клетки. Повреждающими же агентами являются активные формы кислорода, образующиеся в ряде физико-химических процессов в организме. Активные формы кислорода (АФК) образуются в организме и клетке при одноэлектронном восстановлении молекулярного кислорода до воды (Fridovich, 1974; 1982). Особенность АФК – их высокая реакционная способность. Этим они отличаются от молекулярного кислорода, который не вступает в прямые неферментативные реакции (Fridovich, 1974; 1982). К АФК относятся гидроксильный (·ОН), алкоксильный (RO·), пероксильный (ROO·) радикалы, супероксидный анион-радикал (·О2–), а также синглетный кислород (1О2), который по сути не является свободным радикалом. Из других АФК важную роль играют перекиси и радикалы липидов, а также оксиь азота. Пять возможных видов АФК образуются в результате последовательного присоединения электронов к молекуле кислорода (рис. 1.1). Для образования АФК кислород должен быть активирован. Такая активация возникает двумя путями. Первый – фотодинамический, который заканчивается образованием синглетного кислорода. Второй сопровождается форe Ɉ2 мированием супероксид-аниона и гидроксильного радикала. Процесс радикалообразования ɤɤɚɥ усиливается в присутствии металлов переменной валентности, таких как железо, медь, и специфических ферментов – монооксигеназ и других оксидаз (Sahnoun et al., 1997). 1 ·Ɉ2– Степень реактивности разных форм Ɉ2 e кислорода различна и зависит не только от 2H + химической природы радикала, но и от хаɤɤɚɥ рактера среды. Наиболее активной формой считают гидроксильный радикал, за ним сле1 H2 Ɉ2 Ɉ2 дует протонизированная форма супероксиданиона (·ОН), который при физиологических + значениях рН образуется в ограниченных коɇ личествах. Супероксид-анион малоактивен в HO· водных растворах, но эффективно окисляет липидные слои клеточных мембран. Как было ɇ2Ɉ показано, в некоторых ситуациях in vitro пеРис. 1.1. Активные радикалы кислорода роксильный радикал оказывается более мощ8 ным деструктором белковых полимеров, чем гидроксил и супероксид (Kitterige, Wilson, 1984 a, b). Источником синглетного кислорода может служить супероксид-анион при спонтанной дисмутации двух молекул, в результате которой образуется пероксид водорода. Реакция пероксида водорода или гидроксильного радикала с избыточным ·О–2 также может продуцировать синглетный кислород: H 2 O 2 O 2 OH OH 1O 2 (1.1) OH OH 1O 2 2·OH O 2 (1.2) Синглетный кислород может также образовываться после спонтанной дисмутации перекиси водорода: H 2 O 2 H 2 O 2 2H 2 O 2 1O 2 (1.3) Вероятно, что синглетный кислород может формироваться в процессе расщепления перекиси водорода пероксидазой. Из всех радикалов АФК перекись водорода является самой устойчивой в растворах молекулой. Она образуется при восстановлении супероксид-аниона в реакции дисмутации и может возникать не только радикальным, но и безрадикальным путем. Действие перекиси водорода рассматривается параллельно с эффектами, которые вызывает супероксид-анион, так как он является предшественником перекиси. В свою очередь супероксид-анион как промежуточный продукт образуется в реакциях с участием ксантиноксидазы, цитохрома Р450, микросомальных моноксигеназ. Все АФК могут претерпевать взаимные превращения, которые зависят от присутствия металла с переменной валентностью или от конкретного фермента. АФК также могут вызывать образование вторичных реактивных продуктов, таких как липидные пероксиды. Вступают в реакцию с органическими соединениями, инициируя цепные свободнорадикальные процессы: R инициирование RH (1.4) ROO продолжение цепи R +O 2 (1.5) ROO RH ROOH R (1.6) Далее процесс может ветвиться, если не происходит реакция обрыва: 2R R–R (1.7) ROOR R·+ROO (1.8) ROOR O 2 2ROO· (1.9) Реакции (1.7)–(1.9) в упрощенном виде показывают продукты рекомбинации радикалов, которые образуются под давлением кислорода. 9 Не все образованные радикалы продолжают участвовать в цепных реакциях. Часть их рекомбинирует с образованием неактивных продуктов. Возможен и обрыв цепи реакции при взаимодействии радикалов с антиоксидантом. АФК способны взаимодействовать с различными клеточными макромолекулами, такими как ДНК, белки и липиды мембран, что приводит к возникновению большого числа окисленных продуктов (рис. 1.2). Ɋɟɚɤɬɢɜɧɵɟɮɨɪɦɵɤɢɫɥɨɪɨɞɚ ɋɜɨɛɨɞɧɵɟɪɚɞɢɤɚɥɵ Ⱥɤɬɢɜɧɵɟɢɧɬɟɪɦɟɞɢɚɬɨɪɵ ɅɂɉɂȾɕȻȿɅɄɂ ȾɇɄ ɨɤɢɫɥɟɧɢɟ ɨɤɢɫɥɟɧɢɟɬɢɨɥɨɜ ɩɪɹɦɚɹɚɬɚɤɚ ɜɢɬɚɦɢɧɚȿɩɨɹɜɥɟɧɢɟɤɚɪɛɨɧɢɥɨɜɧɭɤɥɟɨɩɪɨɬɟɢɞɨɜ ɩɟɪɟɤɢɫɢ ɥɢɩɢɞɨɜɧɚɪɭɲɟɧɢɟ ɬɪɚɧɫɩɨɪɬɚ ɪɚɡɪɭɲɟɧɢɟ ɢɨɧɨɜ ɫɜɹɡɵɜɚɧɢɟ&X2+ ɢ)H2+ ɫȾɇɄ ɝɟɧɟɪɢɪɨɜɚɧɢɟ·Ɉɇ ɦɟɦɛɪɚɧɋɚ2+ ɦɨɞɢɮɢɤɚɰɢɹ ɢɡɦɟɧɟɧɢɟ ɨɫɧɨɜɚɧɢɣ, ɮɭɧɤɰɢɣ ɞɟɝɪɚɞɚɰɢɹ ɪɟɰɟɩɬɨɪɨɜ ɚɤɬɢɜɚɰɢɹɷɧɞɨɧɭɤɥɟɚɡ ɞɟɡɨɤɫɢɪɢɛɨɡɵ Рис. 1.2. Пути разрушения генетического материала клетки в результате окислительного стресса (Halliwell, 1998; 1999) Перекись водорода, супероксид-анион и уже всеми признанный мессенджер NO представляют собой окислительно-восстановительные сигнальные молекулы. Среди гипотетических мишеней действия перекиси водорода первыми рассматриваются тиоловые группы. Предполагается также, что перекись водорода участвует в регуляции фосфорилирования белков. С другой стороны, показано, что в малых концентрациях перекись индуцирует синтез более 30 белков, 9 из которых находятся под контролем гена oxy R (Storz et al., 1990). Авторы полагают, что ген oxy R связан с белком, имеющим активный сайт, который «ловит» окислители, из-за чего меняется конформация белка. В результате этого комплекс белок–ген диссоциирует, и белок связывается с другими генами, находящимися под его контролем. 10 Анализируя данные научной литературы, можно сделать вывод, что основной причиной генотоксичного эффекта гипероксии является формирование кислород-зависимых свободных радикалов. Все известные АФК способны взаимодействовать непосредственно с ДНК. Эндогенные и экзогенные источники активных форм килорода представлены на рисунке 1.3. ɂɋɌɈɑɇɂɄɂ ȺɎɄ ɗɤɡɨɝɟɧɧɵɟ Ɋɚɞɢɚɰɢɹ ɍɥɶɬɪɚɮɢɨɥɟɬ ɍɥɶɬɪɚɡɜɭɤ ɉɪɨɞɭɤɬɵ Ʌɟɤɚɪɫɬɜɚ ɉɨɥɥɸɬɚɧɬɵ Ʉɫɟɧɨɛɢɨɬɢɤɢ Ɍɨɤɫɢɧɵ ɗɧɞɨɝɟɧɧɵɟ Ʉɥɟɬɤɢ (ɧɟɣɬɪɨɮɢɥɵ) Ɏɟɪɦɟɧɬɵ, ɩɪɨɞɭɰɢɪɭɸɳɢɟ ȺɎɄ (ɧɚɩɪɢɦɟɪ, NO ɫɢɧɬɟɬɚɡɚ, ɇȺȾɎāɇ-ɨɤɫɢɞɚɡɚ) Ɏɟɪɦɟɧɬɵ, ɤɨɫɜɟɧɧɨ ɩɪɨɞɭɰɢɪɭɸɳɢɟ ȺɎɄ (ɧɚɩɪɢɦɟɪ ɤɫɚɧɬɢɧɨɤɫɢɞɚɡɚ) Ɇɟɬɚɛɨɥɢɡɦ (ɦɢɬɨɯɨɧɞɪɢɢ, ɩɟɪɨɤɫɢɫɨɦɵ, ɗɉɋ, ɩɥɚɡɦɚɬɢɱɟɫɤɚɹ ɦɟɦɛɪɚɧɚ) Ȼɨɥɟɡɧɢ (ɢɲɟɦɢɹ, ɞɢɚɛɟɬ, ɩɨɪɮɢɪɢɹ, ɚɬɟɪɨɫɤɥɟɪɨɡ, ɪɚɤ ɢ ɞɪ.) Ⱥɤɬɢɜɧɵɟ ɮɨɪɦɵ ɤɢɫɥɨɪɨɞɚ Рис. 1.3. Экзогенные и эндогенные источники активных форм кислорода (Kohen, Nyska, 2002) Экзогенные источники. Усиление образования свободных радикалов может быть вызвано воздействием на организм рентгеновского или -излучения, ультрафиолета, ультразвука, токсических химических веществ, гипероксии и т.п. Эндогенные источники. Среди эндогенно образующихся в клетках свободных радикалов кислорода первичным является супероксид – продукт одноэлектронного восстановления молекулярного кислорода. Образование супероксид-анион радикала происходит в ходе многочисленных ферментативных и неферментативных реакций, протекающих в субклеточных органеллах и цитоплазме. Перекись водорода – вторичный продукт одноэлектронного восстановления О2. Она образуется при спонтанной или ферментативно опосредуемой дисмутации супероксид-анионов. Возможна и прямая продукция перекиси некоторыми оксидазными ферментами, например, аминоацидоксидазой. Клетки. Макрофаги, входящие в состав клеточной системы иммунитета, мигрируют в очаг воспаления, где они активизируются и с помощью НАДФН-оксидазы генерируют из молекулярного кислорода супероксид-анион, а затем гидропероксид (с помощью 11 СОД) и гипохлорит (в результате миелопероксидазной реакции). Таким образом, создаются условия для ликвидации инфекции. Ферменты, непосредственно продуцирующие АФК. Многие ферменты обладают способностью генерировать свободные радикалы кислорода. Например, фермент NOсинтаза, содержащаяся в фагоцитах, нейронах и гладкомышечных клетках кровеносных сосудов продуцирует оксид азота NO. Ферменты, косвенно продуцирующие АФК. Среди этих ферментов наиболее изученным является ксантиноксидаза. Ксантиноксидаза представляет собой НАД-зависимую дегидрогеназу, не образующую свободнорадикальных интермедиатов. При ишемии протеолитическая модификация ксантиндегидрогеназы преобразуется в ксантиноксидазу, катализирующую превращения гипоксантина. Ксантиноксидаза в качестве акцептора электронов использует молекулярный кислород с образованием супероксид-аниона (McCord, Roy, 1985). Помимо ксантиноксидазы, и другие ферменты, например, дигидрооротатдегидрогеназа, альдегидоксидаза, триптофандиоксигеназа в ходе своего каталитического цикла продуцируют супероксид-анион. Модуляция активности этих ферментов, изменение концентрации кофакторов, субстратов и кислорода сопровождаются изменением скорости продукции ими АФК. Метаболизм. В конечном пункте электроннотранспортной цепи митохондрий (содержащем цитохромоксидазу) происходит восстановление молекулярного кислорода до воды (Chance et al., 1979). Этот процесс не сопровождается генерацией свободнорадикальных интермедиатов кислорода. Однако в некоторых пунктах электроннотранспортной цепи создается реальная возможность «утечки» отдельных электронов прямо на кислород с образованием супероксид-аниона. Главным источником продукции супероксида является участок дыхательной цепи, содержащий убихинон-цитохром b. НАДНдегидрогеназа и дигидрооротатдегидрогеназа также являются аутоокисляемыми переносчиками электронов. Главным источником продукции супероксид-радикала в микросомах и ядерных мембранах является аутоокисление цитохромов Р450 и b5. Дополнительное количество супероксид-радикала продуцируется микросомальными флавинсодержащими оксидазами. Пероксисомы являются источником образования в клетках перекиси водорода, главным образом, из-за высокого содержания в них оксидаз (ацидоксидаза, уратоксидаза, ацил-КоА-оксидаза), ни одна из которых не генерирует супероксид-анион (Masters, Holmes, 1977). Продукция свободных радикалов кислорода с помощью липооксигеназы и циклооксигеназы – ферментов, связанных не только с микросомальными, но и плазматическими мембранами, представляет особый интерес по той причине, что субстратом действия этих ферментов является арахидоновая кислота, а продуктами ее метаболизма – такие биологически активные соединения, как простагландины, тромбоксаны, лейкотриены. Таким образом, процесс утилизации клеткой кислорода сопряжен с образованием свободнорадикальных интермедиатов. Предполагается, что около 5 % потребляемого тканями молекулярного кислорода подвергается одноэлектронному восстановлению до супероксидного анион-радикала с последующим образованием и других АФК (Fridovich, 1981). Постоянное образование прооксидантов в живых организмах уравновешенно их дезактивацией ферментативными и неферментативными антиоксидантами (АО). Для поддержания гомеостаза необходима непрерывная регенерация антиоксидантной способности. К настоящему времени известен довольно широкий спектр систем, генерирующих АФК, распространенных в различных клеточных и тканевых системах живых организ12 мов: в соединительной ткани, эндотелии, фагоцитирующих клетках, гепатоцитах, клетках коры надпочечников, некоторых видах нервной и мышечной ткани и т.д. у животных (Владимиров Ю.А., Шерстнев., 1989; Babior et al, 1973; Babior, 1999; Furukawa et al, 1992; Goeptar et al, 1995; O’Donnel, Azzi, 1996), а также у фотосинтезирующих водорослей, в зеленых листьях растений и в некоторых других растительных тканях (Доскоч и др., 1969; Elstner, Heupel, 1974; Шульцман и др., 1976; Hirayama et al, 1996; Самуилов и др., 2000; Kasahara et al, 2002). Оксидазные комплексы непосредственно локализованы в мембранных образованиях клеток (плазматическая мембрана, эндоплазматический ретикулум, мембраны фагосом, граны хлоропласта и т.д.). Ответственными за генерацию АФК и в то же время чувствительными к их воздействию в организме животных являются также фотобиологические системы, такие как зрительная (фоторецепторные мембраны палочек и колбочек сетчатки, хрусталик), светочувствительные пигментные системы кожи, в которых развиваются фотодинамические процессы (Kagan et al, 1973; Братковская и др., 1981; Островский и др., 1987; Kagan et al, 2002). На сегодняшний день прослежены возможные пути вовлечения АФК в регуляцию трансдукции сигнала в клетке, процессов экспрессии генов, клеточной дифференцировки, индивидуального развития, старения, апоптоза, некроза и др. (Allen, Balin, 1989; Del Bello еt al, 1999; Воейков, 2002). Однако до сих пор еще не поняты до конца конкретные механизмы вовлечения свободнорадикальных производных в метаболические и патологические процессы. В результате многоэтапной и разносторонней адаптации на всех уровнях построения живого организма, прежде всего на клеточном, сложилась многоцелевая адаптивная система, каждая подсистема которой использует свободный О2 и продукты его метаболизма для выполнения конкретных специальных функций. В клетке такими О2-обусловленными и О2-зависимыми стали подсистемы: многоуровневая антиоксидантная, митохондриальная, микросомальная, липо- и циклооксигеназные; модификации физиологической регуляции структуры и функции мембран; регуляции активности мембраносвязанных и зависимых от легкоокисляемых фосфолипидов энзимов; индукции экспрессии генов на уровне транскрипции; О2-депонирующая, АФК-продуцирующая в эффекторных и неэффекторных клетках; АФК-зависимой регуляции нормального воспалительного процесса и ряд других. Особое место занимают процессы с участием АФК, отвечающие за поддержание жизнедеятельности организмов в окружающей среде, за их адаптивные реакции, за надежность работы защитных систем организма (иммунная, система детоксикации), т.е. процессы, которые могут обеспечивать определенный гомеостаз, физиологический статус и взаимоотношения организмов в биоценозах (Fridovich, 1974; Bingham, 1991; Regoli et al, 2002). Таким образом, реакции с участием АФК в живых системах могут быть основой для оценки различных изменений физиологического состояния организмов, в том числе и после воздействия внешних факторов физической и химической природы. 13 Глава 2. ОКИСЛИТЕЛЬНЫЙ СТРЕСС И ДНК Окислительные модификации. Все окислительные модификации ДНК под действием АФК могут быть разделены на три группы – повреждение оснований, повреждение дезоксирибозы и появление новых ковалентных связей («сшивок»). Повреждение оснований. Все основания, входящие в состав нуклеиновых кислот, подвержены окислительной модификации, хотя и в неодинаковой степени. Пиримидины очень подвержены окислению в положении С5–С6. Группа соединений, называемая тиминовыми гликолями и состоящая из изомеров 5,6-дигидрокси-5,66-дигидротимина, составляет значительную часть продуктов повреждений, возникающих в нативной ДНК при действии химических окислителей, радиации и ультрафиолетового света. При действии перекиси в основном образуется цитозин, гидрогенизированный в положении С5–С6. При этом цитозиновые гликоли могут подвергаться гидролитическому дезаминированию, образуя производные урацила, который предпочтительно образует пару с аденином, тем самым создавая возможность для замены Ц:Г на А:Т. Возможно раскрытие двойной связи С5–С6 (Girault et al., 1997). Окислительное воздействие на пурины довольно часто приводит к разрыву соединенного с пиримидиновым имидазольного кольца с образованием формамидпиримидиновых остатков (Dizdaroglu, 1992). Среди продуктов окислительных смодификаций пуринов наибольшее внимание в настоящее время привлекают 8-оксигуанин (8oxoG) и его таутомерная форма – 8-гидроксигуанин. Образование 8oxoG происходит постоянно, возрастает при самых разнообразных воздействиях и рассматривается как показатель окислительного стресса (Shigenaga et al., 1989). 8oxoА также образуется, но в значительно меньших количествах (Dizdaroglu, 1992). Под действием кислородных радикалов может происходить дезаминирование гуанина и аденина, что ведет к появлению ксантина и гипоксантина в составе ДНК с выраженным мутагенным действием (Tchou et al., 1994). Чувствительность оснований к АФК зависит от окружения. Так, по чувствительности к окислительному стрессу, генерируемому реакцией Фентона в растворе, дЦМФ намного превосходит остальные дНМФ, но в составе ДНК наиболее чувствительным оказывается тимидин (Luo et al., 1996). Повреждение дезоксирибозы. Окислительной атаке АФК дезоксирибоза подвержена в положении С1, что ведет к появлению участка без основания (АР-участка), и С4, что вызывает фрагментацию дезоксирибозы (Dizdaroglu et al., 1977, Beesk et al., 1979). АФК могут непосредственно вызывать однонитиевые разрывы в ДНК, разрывая сахарофосфатную связь. Если в обеих цепях ДНК АР-участки располагаются друг против друга или фрагментация дезоксирибозы произошла вблизи, то появляются двунитиевые разрывы ДНК (Povirk et al., 1988). Поперечные сшивки. Окислительный стресс, продуцируемый в модельных системах различными способами, вызывает образование ковалентных связей между ДНК и белками (Distel, Schussler, 1997), а также между соседними пуриновыми и пиримидиновыми остатками (Carmichael et al., 1992). Последствия разного рода окислительных повреждений неодинаковы. Так, например, тиминовые гликоли и формамид пиримидин блокируют репликацию ДНК – они цитотоксичны, но их мутагенный потенциал ограничен. Напротив, 8oxoG очень мутагенен. Все известные АФК способны взаимодействовать непосредственно с ДНК, повреждая дезоксирибозо-фосфатные и ДНК-белковые связи, модифицируя пуриновые и пири14 мидивые основания (Dizdagoglu, 1991; Shigenaga, Ames, 1991). Модифицированные АФК основания в дальнейшем могут приводить к разрывам ДНК (Kuchino et al., 1987; Shubutani et al., 1991, Cheng et al., 1992). Гидроксильный радикал, являясь наиболее реакционноспособной формой, способен непосредственно взаимодействовать со всеми азотистыми основаниями ДНК, что приводит к потере азотистых оснований, возникновению AP-сайтов (Ере, 1991), может вызывать сшивки ДНК–ДНК, ДНК–белок (Gutteridge, Halliwell, 1988). Взаимодействуя со всеми четырьмя основаниями ДНК, гидроксил производит соответствующие продукты – 5-гидрометилурацил; 8-гидроаденин, тимидин гликоль и тимин глюколь (Dizdagoglu, 1991). Синглетный кислород в условиях in vitro преимущественно модифицирует гуанин и вызывает однонитиевые разрывы ДНК (Ере, 1991). Распределение мутаций при действии синглетного кислорода на клетки млекопитающих носит неслучайный характер. Около 98,4 % мутаций локализованы в Г–Ц парах нуклеотидов, причем половина из них представлены трансверсиями ГЦ–АТ, примерно 30 % – трансверсиями ГЦ–ЦГ (Olivera de, Ribeiro, 1992). В последние годы показано, что характерный продукт реакции синглетного кислорода с гуанином ДНК – 8-гидрооксигуанин (7,8-дигидро-8-оксигуанин) является биомаркером окислительного стресса (Floyd, 1990; Dennog et al.,1996, Hermanns et al., 1998). Однако возможен также механизм непрямого генотоксического эффекта. Супероксид-анион индуцирует аберрации хромосом и генные мутации (Emerit et al., 1982; Phillips et al., 1984). Прямой зависимости между концентрацией супероксид-аниона и уровнем разрывов ДНК не обнаружено (Hall et al., 1988). Это указывает на то, что супероксидный анион радикал не столько агент, непосредственно вызывающий повреждения генома, сколько ключевое звено многоэтапного процесса, приводящего в конечном итоге к возникновению мутаций (Середенин, Дурнев, 1990). В последние годы показана роль оксида азота в условиях окислительного стресса (Демченко, 1994) и высказана гипотеза модуляции АФК оксидом азота. Генотоксичность NO связана с прямым или опосредованным повреждением ДНК. Прямое повреждение ДНК включает образование модифицированных азотистых оснований, а также однонитиевые разрывы ДНК (Felley-Bosco, 1998). Опосредованный эффект NO включает в себя ковалентную модификацию аминов, белков, т.е. взаимодействие с тиоловыми группами с образованием нитрозолов (RS–NO) липидов (Stalmer,1994). Генотоксичный эффект при этом зависит от антиоксидантного статуса и содержания свободных металлов в клетке. Основными центрами возникновения активных метаболитов кислорода в клетке являются митохондрии, микросомы, пероксисомы, цитоплазматическая мембрана. С помощью окислительного индикатора ДНК –8OhdG было показано, что после действия гипероксии в митохондриальной ДНК регистрируется более чем в три раза больше повреждений, чем в ядерной (Agarwal, Sohal, 1994). По другим данным уровень повседневного окислительного повреждения митохондриальной ДНК, по меньшей мере, в 10 раз больше по сравнению с ядерной ДНК (Shigenaga et al., 1994). Одной из причин повышенной чувствительности митохондриальной ДНК к окислительному стрессу считают ее большую доступность для свободных радикалов из-за отсутствия гистонов (Yakes, Houten, 1997). Другой возможной причиной этого процесса может быть накопление в митохондриях пигмента липофусцина, который является основным внутриклеточным источником активных метаболитов кислорода (Wei et al., 1998). Повреждение генетических структур может быть опосредовано и мутагенными продуктами ПОЛ. В обзоре Vaca (1988) приведены многочисленные сведения о мутагенных эффектах продуктов перекисного окисления – малонового диальдегида, гидроперекисей 15 ненасыщенных жирных кислот и алкенов. Показано, что усиление спонтанного мутационного процесса сопровождается избыточным образованием АФК и продуктов ПОЛ (Гончарова, 1993). Генотоксичность продуктов ПОЛ может быть не только опосредована через образование АФК, но и является результатом прямого взаимодействия органических радикалов, возникающих из гидроперекиси липидов в присутствии ионов металлов с переменной валентностью, с ДНК (Vaca et al., 1988). Активные формы кислорода могут нарушать ионный гомеостаз, вызывать высвобождение Са из митохондрий, что влечет за собой активацию нуклеаз, так как многие из них металлозависимые. Внутриклеточное связывание ионов Са проникающим хелатором может предотвращать возникновение разрывов в ДНК и цитотоксический эффект при добавлении к клеткам перекиси водорода. Важнейшее значение для окислительного повреждения ДНК имеют ионы металлов переменной валентности, хелатированные ДНК (Luo et al., 1996; Henle et al., 1996). Более того, ионы железа, хелатированные нуклеотидами, способны восстанавливаться мембранными редокс-цепями. Такого рода хелатные комплексы вызывают окислительное повреждение ядерной ДНК при функционировании ядерных мембран (Пескин, 1997). Условия окислительного стресса – концентрация кислорода, вид АФК – влияют не только на количественный, но и на качественный спектр модификаций ДНК (Luo et al., 1996; Distel, Schussler, 1997; Henle et al., 1996). Другой механизм поражения ДНК в результате окислительного стресса связан с запуском серии метаболических процессов внутри клетки, которые приводят к активации ферментов – нуклеаз. Уже сказано, что окислительный стресс вызывает повышение уровня свободного внутриклеточного кальция, который, в свою очередь, активирует зависимые от кальция эндонуклеазы, запуская механизмы деградации ДНК по типу апоптоза – генетически запрограмированной гибели клеток. Помимо этого начальные, промежуточные и конечные продукты перекисного окисления липидов – диеновые конъюгаты (ДК), шиффовы основания (ШО), малоновый диальдегид также способны разрушать нуклеиновые кислоты. Многие окислительные повреждения ДНК представляют существенную опасность для жизнедеятельности, так как могут блокировать репликацию и транскрипцию, вызывать замену нуклеотидов. Эти повреждения привносятся в геном чуть ли не ежесекундно, и их число существенно увеличивается при разнообразных воздействиях. Количество окислительных повреждений в ДНК коррелирует со скоростью метаболизма и оценивается в 100 000 для одной клетки за день для крыс и в 10 000 для человека (Ames, Shigenaga, 1992), и это с учетом наличия многокомпонентной антиоксидантной системы! Работу по удалению окислительных повреждений выполняют гликозилазы, эндои экзонуклеазы. Если окислительные повреждения приводят к двунитиевым разрывам или к сшивкам цепей ДНК, то в действие включаются механизмы рекомбинации (Sancar, Smith, 1988). Подобные ферменты были обнаружены и в митохондриях (Tomkinson et al., 1990). Нарушение репарации митохондриальной ДНК или создание условий, в которых она не справляется со своей работой, приводит к развитию патологических состояний. Факторы внешней и внутренней среды, отклоняющиеся от привычных значений, провоцируют изменение антиоксидантных систем организма – оксидативный стресс. Повышенное давление кислорода в определенных режимах обработки также индуцирует окислительный стресс. Повреждающее действие гипербарической оксигенации (ГБО) было показано на животных, растениях и микроорганизмах более 50 лет назад. Высокая окислительная способность кислорода, необходимая для его функционирования в норме, при стрессе является причиной возникновения патологических состояний клеток, тканей, 16 органов и организма в целом. Поэтому основным моментом современных исследований является анализ причин, приводящих к переходу от физиологически контролируемых эффектов свободных радикалов кислорода к патологическим, а также проблема повышения устойчивости организма к окислительному стрессу. 2.1. Участие свободных радикалов кислорода в регуляции клеточного цикла Свободные радикалы и АФК участвуют в разнообразных процессах в клетках, включая их нормальную пролиферацию, старение, апоптоз, канцерогенез и некроз (Лю, 2002; Лю, 2003). Основные эффекты свободных радикалов обусловлены их способностью перестраивать физико-химическую систему регуляции клеточного метаболизма мембранами, изменять состав, структуру и функционирование мембран клеток (Бурлакова и др., 2001), модифицировать воздействие протеинфосфатаз, протеинкиназ и факторов транскрипции на сигнальные пути в клетках. Например, было сообщено (Гончар и др., 2003), что эпидермальный фактор роста, вызывающий временный, быстро проходящий подъем внутриклеточного уровня АФК, индуцировал в клетках карциномы человека А431 АФК-зависимую активацию транскрипционных факторов STAT1 и STAT3 путем их фосфорилирования по тирозину (Турпаев, 2002). Образование активных форм кислорода является одной из необходимых стадий в механизме такого биологического феномена как пролиферация клетки. Прежде всего имеются в виду липо- и циклооксигеназный сигнальные пути метаболизма полиненасыщенных жирных кислот с синтезом специфических биологически активных соединений, причастных к процессу. В частности, перекисные продукты арахидоновой кислоты являются мощными активаторами гуанилатциклазы и приводят к повышению внутриклеточного уровня циклического гуанозинмонофосфата (цГМФ), необходимого для пролиферации. Синтез простагландинов, тромбоксанов, простациклинов и лейкотриенов и поддержание их на необходимом физиологическом уровне осуществляются в норме ферментативно через стадии перекисных производных арахидоновой и эйкозатетраеновой кислот. В этих и других внутриклеточных процессах как нормальный метаболит обмена кислорода участвует ·О2–. К усилению продукции ·О2–, необходимого для митогенеза, причастна и НАДФН-оксидаза, как, например, в случае гиперплазии интимы венозных шунтов вследствие прямого воздействия ·О2– на пролиферацию клеток гладкой мускулатуры. Указанные выше биологически активные вещества, выходя за пределы клетки, выполняют различные функции сигнальных молекул, поскольку обладают специфическими биологическими свойствами. В норме АФК индуцируют опосредованно на уровне транскрипции экспрессию различных генов, в том числе некоторых протоонкогенов, причастных к транскрипции, синтезу ДНК и митогенезу (Naito et al., 1998; Mailand et al., 2000; Allen, Tresini, 2000; Бурлакова и др., 2001). Изменение экспрессии генов во время адаптивного стрессового ответа на АФК (Н2О2) обнаружено уже на уровне Saccharomyces cerevisiae. Как отмечают, у них Н2О2 стимулирует синтез 115 и репрессирует синтез 52 белков, идентифицировано же, соответственно, 71 и 44. На уровне целого генома D. melanogaster найдено изменение содержания транскриптов как функции старения у интактных мух и мух, обработанных паракватом – генератором свободных радикалов. Авторы этой работы (Zhou et al., 2000) подтверждают важную роль накапливающихся с возрастом свободных радикалов в регуляции уровня транскриптов при старении. 17 После определенной стимуляции клеток разных типов образованные ими АФК фактически признаются как «молекулы, участвующие во внутри-клеточной передаче полученного клеткой внешнего стимула» (Гамалей и др., 1996). При этом ·О2– в роли вторичного посредника при передаче сигнала кинетически более эффективен и химически более специфичен, чем Н2О2. В норме при митогенезе лимфоцитов стимуляция липооксигеназного пути приводит к образованию радикала ·ОН и активации им гуанилатциклазы. Митогенез отменяется ловушками свободных радикалов, ингибиторами липооксигеназы и гуанилатциклазы. Радикалы являются истинными вторичными посредниками митогенеза Т-лимфоцитов. Основные системы метаболической активации у лимфоцитов – системы обмена липидов и активности мембраносвязанных ферментов, ионного транспорта, циклических нуклеотидов, энергопродуцирующих реакций и репликации ДНК – требуют определенной концентрации свободных радикалов и повреждаются их избытком. В периодах S и М клеточного цикла снижается концентрация циклического аденозинмонофосфата (цАМФ), а уровень цГМФ, напротив, возрастает (Лю, 2002, 2003). Включаются механизмы регуляции деления с участием ·О2– и других АФК (Burdon, 1992, 1995; McCord, 1995; Burdon et al., 1996; Bhunia et al., 1997), в том числе липо- и циклооксигеназный пути метаболизма арахидоновой кислоты, причем ловушки свободных радикалов, СОД, каталаза, ингибиторы липооксигеназы и гуанилатциклазы отменяют митогенез (Burdon, 1992; Camberini, Leite, 1997). Необходимость АФК для фазы синтеза ДНК подтверждена на примере эмбриональных фибробластов крысы и полученных из них введением разных пар комплементирующих онкогенов трансформантов. Удаление ростовых факторов из среды культивирования коррелировало со снижением концентрации АФК в клетках, а при обратном введении сывортки – с повышением внутриклеточного уровня АФК, который был максимален при переходе клеток в S-фазу (Гамалей и др., 2001). Кстати, лактоферрин человека как Fe-связывающий гликопротеин и ингибитор свободнорадикальных процессов тоже подавляет пролиферацию клеток, блокирует их клеточный цикл (Damiens et al., 1998). Индуцировать пролиферацию клеток в эксперименте можно, умеренно повышая тем или иным способом образование перекисей липидов, например, скармливанием подопытным животным в избытке того же железа (Whittaker et al., 1992). Врéменные процессы активации и пролиферации клетки для своей реализации требуют, по-видимому, циклического возникновения умеренной гипероксии, повышенного на этот период пероксидативного напряжения и, соответственно, возрастания дисбаланса между прооксидантнами и антиоксидантами. Это отражает суть используемого в литературе термина «окислительный митогенез». Фактически это подтверждают и материалы обзора, авторы которого (Меньщикова, Зенков, 1997) после анализа многих публикаций пришли к заключению: «окислительный стресс средней интенсивности приводит к индукции клеточной пролиферации». Кроме того, представляется весьма вероятным, что такой стресс вообще распространен в биологическом мире и характерен в норме для совершенно далеких эволюционно видов. Например, показано, что у спор N. crassa вскоре после поглощения ими О2, т.е. в начале их прорастания, развивается даже гипероксидантное состояние. На это указывало образование АФК, установленное путем анализа зависимой от О2 хемилюминесценции, окисления белков и некоторых других проявлений (Владимиров Ю.А., 2004). Особенно наглядно временный характер окислительного митогенеза проявляется при регенерационных процессах. Так, после частичной гепатэктомии в процессе печеночной регенерации увеличиваются уровни липопероксидазы и ПОЛ, а содержание 18 арахидоновой и других полиненасыщенных жирных кислот уменьшается. Для подавления ПОЛ в ранней фазе регенерации может быть использован витамин А. ПОЛ, таким образом, признается одним из существенных факторов инициации регенерации печени (Владимиров Ю.А., 2004). В эмбриональных же и стволовых клетках интенсивная пролиферация происходит вообще непрерывно. Ключевую роль в создании условий для такого окислительного митогенеза играет, вероятнее всего, особенность митохондриальной базы указанных клеток: малое число митохондрий и относительно низкая степень их дифференцированности. Впоследствии, по мере развития, содержание митохондрий увеличивается за каждый клеточный цикл. С тех же «мито-хондриальных» позиций обсуждаются и некоторые более общие вопросы взаимоотношения пролиферации и дифференцировки клетки (Албертс, 1994). Глава 3. ГЕНЕТИЧЕСКИЕ ЭФФЕКТЫ ДЕЙСТВИЯ ОКИСЛИТЕЛЬНОГО СТРЕССА НА ГЕНОМ РАСТЕНИЙ Появление фотосинтезирующих организмов на эволюционной арене могло произойти только после возникновения систем, способных эффективно защищать их от токсического действия кислорода. Эта задача была решена несколькими путями – приобретением сети мембран, эффективно отводящих кислород от жизненно важных центров; использованием эндогенных и экзогенных химических соединений в качестве антиоксидантов, способных переводить в неактивное состояние кислород и его производные; возникновением ферментативных систем, катализирующих внутриклеточные превращения кислорода в безопасные для клетки производные. Все это и обеспечивает достаточно высокую устойчивость растений к повышенным концентрациям кислорода. Однако еще в 1963 г. было показано, что растения весьма чувствительны к избытку кислорода в среде. Более того, растительные организмы дают патологическую реакцию при таких концентрациях кислорода, которая не вызывает эффекта у нефотосинтезирующих микроорганизмов (Siegel et al., 1963). Анализ литературы свидетельствует, что данные по мутагенному действию ГБО на растения весьма немногочисленны и зачастую противоречивы, а работы, посвященные изучению механизмов генетического эффекта ГБО, в мировой литературе практически отсутствуют. Мутагенный эффект повышенного давления кислорода на клетки растений был впервые обнаружен в 50-х годах ХХ в. (Conger, Fairchald, 1951). Авторы поставили серию экспериментов на пыльце и бутонах Tradescancia palludosa. Было установлено, что перестройки хромосом в клетках растений возникают, если концентрация кислорода в атмосфере выше 20 %. Увеличение концентрации кислорода до 100 % вызывало более 90 % перестроек хромосом. Кроме того было показано, что давление само по себе не является мутагенным фактором. Кроме того, в серии опытов было показано, что на выход мутаций оказывает влияние время воздействия повышенной концентрации кислорода. Авторы высказали предположение, что появление перестроек хромосом связано с изменением метаболизма и истощением толерантности клеток к кислороду. В 60-х годах ХХ в. влияние гипербарической оксигенации на прорастающие семена ячменя и бобов интенсивно исследовали в лаборатории Erenberg (Erenberg et al., 1958; Moutschen-Dahmen et al., 1959; Moutschen et al., 1962), обрабатывая сухие семена бобов при 3 и 6 МПа от 3 до 28 дней. Анализ полученных результатов позволил выявить следующие закономерности: – кислород вызывает неспецифические разрывы по всей длине хромосом растений; – обработка семян ГБО вызывает появление хромосом типа «ламповых щеток», гиперокрашенных отдельных хромосом; – максимальный выход хромосомных перестроек регистрируется во втором митозе после действия ГБО; – не установлено линейной зависимости выхода хромосомных аберраций при увеличении давления кислорода или продолжительности времени его действия. Обсуждая результаты работы, авторы выявили сходные черты между механизмами действия гипербароксигенации и ионизирующей радиации. Оба мутагена, во-первых, вызывают неспецифические разрывы хромосом, которые практически случайно распре20 деляются по длине хромосомы, во-вторых вызывают точковые мутации у кишечной палочки, гороха и ячменя, в-третьих, разрывают молекулу ДНК. Эффект гипероксии снижается при введении сульфгидрильных соединений, так же хорошо как и от радиации. Однако многими из этих свойств обладают и некоторые химические мутагены. Например, N-нитрозометилуретан, этилуретан, митомицин С вызывают случайное распределение разрывов по длине хромосомы, разрывают молекулу ДНК и т. п. (Erenberg et al., 1958). Однако, несмотря на имеющееся сходство, механизмы действия кислорода и ионизирующей радиации существенно различаются. 3.1. Цитогенетические последствия гипербарической оксигенации в пролиферирующих тканях растений В целом, в единичных работах 50-х годов ХХ в. было изучено действие высоких давлений кислорода (3–6 МПа) на нефотосинтезирующие ткани растений. В то же время в литературе отсутствовали сведения о пороге давления кислорода, вызывающего деструкцию генетического аппарата и метаболизма клеток растений, о состоянии антиоксидантных систем растений в условиях гипероксии, возможности модификации генетического эффекта ГБО, видовой чувствительности растений. Новый всплеск интереса к действию повышенного давления кислорода на растительные объекты произошел в 70-е годы ХХ века. Была выполнена серия работ по выявлению минимальной мутагенной дозы ГБО, индуцирующей аберрации хромосом в растительных клетках. Первые эксперименты в данном направлении были выполнены на проростках лука Е.П. Гуськовым (Гуськов, 1975). В этой работе обработка корешков лука кислородом при 0,7 МПа в течение 3 ч вызывала появление перестроек хромосом (табл. 3.1). Таблица 3.1 Цитогенетический эффект гипербароксигенации (0,7 МПа – 3 ч) на клетках корневой меристемы растений Вариант Время роста п/д, ч контроль ГБО 6 12 24 48 Контроль ГБО 6 12 24 48 Контроль ГБО 6 12 24 48 Анафаз с АХр, абс. Проростки лука 1145 5 1785 20 1335 14 1935 36 1111 21 Проростки ячменя 1377 24 1070 47 1026 61 993 79 966 35 Проростки пшеницы 833 13 506 24 970 37 386 16 1102 59 Всего анафаз АХр ± m, % P 0,34 ± 0,17 1,12 ± 0,25 1,06 ± 0,28 1,86 ± 0,29 1,89 ± 0,93 <0,01 <0,05 <0,001 <0,001 1,74 ± 0,35 4,37 ± 0,62 5,94 ± 0,74 7,95 ± 0,85 3,62 ± 0,60 <0,001 <0,001 <0,001 <0,05 1,56 ± 0,42 4,74 ± 0,95 3,81 ± 0,62 4,15 ± 1,02 5,35 ± 0,68 <0,001 <0,001 <0,001 <0,001 21 Перестройки хромосом возникали через 6 ч после обработки. Их число достигало максимума через 24–48 ч, а через 72 ч снижалось до уровня контроля. В основном перестройки хромосом были представлены фрагментами и хроматидными мостами. В значительном количестве клеток были выявлены гепы. В данной работе впервые было сказано, что гипербароксигенацию следует рассматривать не как физический, а как химический мутагенный фактор, а механизм мутагенного эффекта повышенного давления кислорода следует искать в химических свойствах кислорода, который, как и большинство химических мутагенов, вызывает в клетке многоэтапные последовательные реакции, приводящие к становлению перестроек хромосом. Эксперименты по выявлению наиболее эффективного режима ГБО, индуцирующего аберрации хромосом, показали, что пребывание проростков ячменя в атмосфере чистого кислорода при нормобарии достоверно повышает уровень перестроек хромосом через 6 ч после окончания воздействия. Давление 0,2 МПа почти в 3 раза увеличивает уровень аберраций хромосом по сравнению с контролем. Увеличение давления до 0,4 МПа демонстрирует достоверное увеличение количества аберраций хромосом только через 48 ч после окончания обработки (Дворкина, 1979). Давление 0,7 МПа во всех исследуемых фиксациях вызывало достоверный рост количества клеток с нарушениями, в 3–5 раз по сравнению с контролем. Таким образом, наиболее эффективной дозой, вызывающей перестройки хромосом после однократной обработки в течение 1 ч, является давление 0,7 МПа кислорода. При увеличении времени обработки до 3 ч давление 0,2 МПа не изменяет уровень аберраций хромосом, полученный при 1-часовой экспозиции. Давление 0,4 МПа вызывало достоверный рост количества клеток с перестройками хромосом; максимальное значение числа аберраций было зафиксировано через 36 ч, т.е. в третьем митозе после обработки. Аналогичный результат – появление пика перестроек через 36 ч – зафиксирован и после воздействия 0,7 МПа кислорода (Дворкина, 1979). Полученные результаты позволили сделать вывод о том, что при использованных временных режимах давление 0,2 МПа не эффективно как мутагенный фактор, режим 0,4 МПа обладает значительным мутагенным эффектом после трехчасовой обработки. При 0,7 МПа как одно-, так и 3-часовая экспозиции демонстрируют сходные эффекты. Таким образом, был зарегистрирован минимальный и максимальный пороги давления, которые вызывают мутагенный эффект гипербароксигенации. Позднее было показано, что ГБО в режиме 0,7 МПа – 3 ч индуцирует перестройки хромосом в клетках пшеницы, ячменя, креписа (Гуськов и др., 1986а; Гуськов и др., 1989а). У всех перечисленных видов обнаружено, что максимум перестроек хромосом фиксируется не в первом, а в последующих митозах после окончания воздействия: во 2–3-м у лука и пшеницы и в 3–4-м у ячменя и креписа (см. табл. 3.1). Уровень перестроек хромосом в первом митозе всегда ниже, чем в последующих. Это свидетельствует против гипотезы прямого поражения генома клеток растений в результате контакта с кислородом. Нарастание перестроек хромосом опосредовано метаболизмом. Короткоживующие радикалы кислорода индуцируют перестройки хромосом в первом митозе, т.е. незадержанный цитогенетический эффект ГБО указывает на прямой эффект кислорода или его реактивных форм, которые могут поражать генетический материал клетки непосредственно. Однако основной вклад в цитогенетический эффект вносят вторичные свободно-радикальные продукты. Е.П. Гуськовым с соавторами (Гуськов и др., 1986а; 1986б) было высказано предположение, что степень пролонгирования действия ГБО может зависеть от длины клеточного цикла. Так, на ячмене было показано, что уровень перестроек хромосом, индуцированных 22 ГБО, достоверно превышает контроль на протяжении четырех последующих циклов после окончания обработки. Если воздействие изменяет метаболизм клетки так, что внутриклеточная среда обладает цитогенетической активностью в течение определенного времени, например 48 ч, то растение с более длительным клеточным циклом нормализует обмен в течение двух митотических циклов, в то время как клетки ячменя за это время проходят 4 деления. Многие исследователи считают перекисное окисление липидов одной из причин старения. Так как влияние старения на цитогенетический эффект ГБО ранее не исследовалось, Е.П. Гуськовым с соавторами был поставлен эксперимент на семенах ячменя, хранившихся в течение трех лет в лабораторных условиях (Гуськов и др., 1986а). Спонтанный уровень перестроек хромосом в меристематических тканях проростков старых семян значительно выше, чем в клетках свежих семян (табл. 3.2). После обработки ГБО не наблюдается значительного повышения уровня перестроек хромосом относительно контроля. Таким образом, чувствительность меристемы свежих и старых семян к ГБО практически одинакова, и кислород не стимулирует увеличения относительного количества перестроек хромосом в старых семенах. То есть ГБО-мутагенез как бы «накладывает» свой эффект на имеющий место метаболизм вне зависимости от физиологического состояния семян. Некоторые закономерности предыдущего эксперимента сохраняются и для старых семян – абсолютное большинство перестроек хромосом представлено одиночными или парными фрагментами во всех сроках фиксации, т.е. в течение четырех митотических циклов после окончания воздействия ГБО. Таблица 3.2 Цитогенетический эффект ГБО (0,4 МПа – 3 ч) в клетках меристемы ячменя Время роста п/д, ч Всего анафаз Анафаз с АХр, абс. Свежеубранные семена 6 1231*/967 12/57 12 933/953 13/43 24 1070/459 8/25 36 1208/919 9/69 48 1120/693 12/33 АХр ± m, % 0,97 ± 0,28 5,89±0,76 1,39±0,38 4,51±0,67 1,07±0,26 5,45±1,12 0,75±0,26 7,5±0,87 1,07±0,31 4,76±0,81 P <0,001 <0,001 <0,001 <0,001 <0,001 Стареющие семена 6 1039/1736 39/191 12 1040/978 34/98 24 985/1230 29/129 36 1059/997 26/97 48 1012/1020 24/102 3,75 ± 0,59 11,0±0,75 3,27±0,55 10,0±0,96 2,94±0,53 10,5±0,87 2,46±0,47 9,73±0,94 2,37±0,47 10,0±0,94 <0,001 <0,001 <0,001 <0,001 <0,001 * В числителе – контроль; в знаменателе – опыт. 23 В то же время, воздействие повышенного давления кислорода (0,4 или 0,7 МПа) в течение 3 ч не индуцирует увеличения уровня хромосомных перестроек у подсолнечника (табл. 3.3). Цитогенетический эффект на подсолнечнике обнаружен только после действия ГБО в режиме 0,7 МПа – 9 ч, причем максимальное количество аберраций хромосом, зафиксированное после действия ГБО, приходится на 51 ч роста. Это еще раз подтверждает то, что повреждения в ядерном генетическом материале индуцирует не сам кислород и его свободные радикалы, а вторичные продукты – эндогенные метаболиты активных форм кислорода. Таблица 3.3 Цитогенетический эффект гипербарической оксигенацией на корневой меристеме проростков подсолнечника линии 3629 Вариант Контроль ГБО 0,7 МПа–3 ч ГБО 0,7 МПа–9 ч Время роста, ч 27 39 51 63 27 39 51 63 27 39 51 63 Всего анафаз 598 899 880 821 458 517 657 687 106 1216 1041 1009 Анафаз с АХр±m, % 1,5±0,50 2,2±0,49 1,7±0,44 1,6±0,44 1,1±0,49 2,1±0,63 2,6±0,62 1,9±0,52 4,7±2,06 5,3±0,64 7,1±0,79 4,1±0,62 Р > 0,05 > 0,05 > 0,05 > 0,05 > 0,05 <0,001 <0,001 <0,001 При исследовании цитогенетического эффекта ГБО на подсолнечнике обработке подвергали проростки инбредной линии 3629 и пластомного хлорофильного мутанта en:chlorinа-5. Анализ показал, что линии, различающиеся по цитоплазматическому геному, обладают разной устойчивостью к ГБО (рис. 3.1). ГБО в режиме 0,7 МПа – 3 часа не индуцирует аберраций хромосом в корневой меристеме проростков линии 3629 и пластомного мутанта. Увеличение времени экспозиции до 9 часов приводит к тому, что ГБО индуцирует повышенный уровень аберраций хромосом в клетках корневой меристемы проростков подсолнечника (рис. 3.1). Однако у исходной линии генотоксичный эффект ГБО более длителен и постоянно повышается на протяжении 48 ч после окончания воздействия, тогда как у пластомного мутанта уровень перестроек хромосом к третьей фиксации нормализуется. Известно, что становление мутаций – это сложный многоэтапный процесс, зависящий от многих факторов, в том числе и от физиологического состояния организма. При нормальных условиях жизнедеятельности в клетке поддерживается равновесие между скоростью образования активных форм кислорода и скоростью их детоксикации компонентами антиоксидантной защиты (Alscher et al., 2002; Mittler, 2002). Растения, являющиеся продуцентами атмосферного кислорода, в процессе интенсивного фотосинтеза испытают в естественных условиях состояние эндогенной гипероксии. В течение миллионов лет растения параллельно с процессом фотосинтеза формировали и совершенствовали эндогенные механизмы антиоксидантных систем, обеспечивающих защиту генетического аппарата клеток от цитотоксического, цитостатического и мутагенного эффектов кислорода. 24 а б Рис. 3.1. Уровень аберраций хромосом в клетках корневой меристемы проростков подсолнечника линии 3629 (а) и пластомного мутанта en:chlorinа-5 (б) после действия ГБО: –––– – контроль; – –■– – – ГБО 0,7 МПа–3 ч; ––▲–– – ГБО 0,7 МПа–9 ч; *** – достоверные отличия по сравнению с контролем P < 0,001 Анализ цитогенетического эффекта ГБО на ткани листа высших растений показал, что ГБО в режиме 0,7 МПа в течение 3 ч не вызывает цитогенетических нарушений в клетках меристемы зеленых листьев пшеницы (табл. 3.4). Уровень перестроек хромосом во всех фиксациях после окончания воздействия не превышает контрольный (Гуськов и др., 1989а). Таким образом, режим ГБО, эффективно индуцирующий аберрации хромосом в клетках корневой меристемы, не является мутагенным фактором для клеток листовой ткани. Таблица 3.4 Цитогенетический эффект ГБО (0,7 МПа – 3 ч) в меристематической ткани первого листа пшеницы и кукурузы Вариант Контроль ГБО Контроль ГБО Контроль ГБО Время п/д, ч АХр ± m, % Зеленый лист пшеницы 2,36±0,44 3 2,57±0,34 16 2,71±0,51 40 2,39±0,42 Этиолированный лист пшеницы 2,88±0,37 3 4,98±0,65 16 5,59±0,66 40 5,74±0,77 Зеленый лист кукурузы 1,18±0,34 3 1,3±0,48 16 1,7±0,43 40 2,42±0,47 Р > 0,1 > 0,1 > 0,1 <0,001 <0,001 <0,001 > 0,1 > 0,1 <0,05 Данные, представленные в таблице 3.4, свидетельствуют о существовании в листе мощных защитных систем от токсического действия кислорода, в которых существенную роль должна играть активация внутриклеточных ферментативных протекторов, в частности СОД, каталазы и пероксидазы (Halliwell, 1978; Elstner, 1982). 25 В таблице 3.5 представлены данные о динамике изменения активности антиоксидантных ферментов в тканях листа пшеницы после действия ГБО. Воздействие гипербароксигенации не влияет на активность СОД (табл. 3.5) (Гуськов и др., 1989а) и в то же время индуцирует повышение суммарной пероксидазной активности. Активность каталазы в тканях листа пшеницы после ГБО увеличивается вдвое. Таблица 3.5 Динамика изменения активности антиоксидантных ферментов в тканях листа пшеницы после действия ГБО (0,7 МПа–3 ч) Вариант Время п/д, ч Контроль ГБО 3 16 40 Контроль ГБО 3 16 40 Активность СОД, отн. ед/мг белка СПА, экст/ мг белка Зеленый лист 4,4±0,41 21,6±1,45 3,7±0,37 25,3±1,93 4,8±0,22 36,1±1,09 4,0±0,23 40,6±1,94 Этиолированный лист 24,8±1,53 22,1±1,89 31,5±1,81 29,2±1,44 Активность каталазы, отн.ед / мг белка Р > 0,05 <0,001 <0,001 12,4±0,68 12,5±1,23 19,3±0,61 20,3±0,87 > 0,05 > 0,05 <0,001 <0,001 > 0,05 > 0,05 > 0,05 19,9±0,94 32,6±0,64 56,8±11,4 77,4±9,33 > 0,05 <0,001 <0,001 <0,001 Р Уровень перестроек хромосом в этиолированных листьях выше, чем в зеленых, и достоверно отличается от контрольного (см. табл. 3.4). При этом активность каталазы в этиолированных листьях после действия ГБО возросла в 4 раза (см. табл. 3.5). Можно сделать вывод, что «первая» ферментативная система защиты не может полностью обеспечить инактивацию мутагенных продуктов. Должны существовать иные пути, предохраняющие от токсического действия кислорода, связанные с функциональными особенностями зеленого листа, процессами, происходящими только в условиях освещенности. Таким образом, фотосинтезирующие ткани растений более устойчивы к деструктивному действию ГБО, чем этиолированные листья и корни. Одним из механизмов, защищающих от токсического действия кислорода в условиях освещенности может быть фотодыхание, ярко выраженное у С3-растений, у которых СО2 и кислород прямо взаимодействуют в клетках мезофилла листа с РБФК и между ними имеет место типичное конкурентное взаимодействие. У С4-растений процесс фотодыхания выражен слабо и можно предположить, что степень чувствительности листовой ткани таких растений к кислороду будет выше. Для проверки данного предположения был проведен анализ цитогенетического эффекта ГБО на зеленую листовую ткань проростков кукурузы. В отличие от пшеницы уровень перестроек хромосом в листе кукурузы через 40 ч после окончания воздействия вдвое превышает исходный (табл. 3.4). Вероятно, это связано с низким уровнем фотодыхания у С4-растений (Гуськов и др., 1989а). Листовая меристема кукурузы не справляется с повышенной концентрацией кислорода, в то время как меристема зеленых листьев пшеницы стабильно сохраняет контрольный уровень перестроек хромосом. Это можно объяснить тем, что пшеница, обладающая интенсивным уровнем фотодыхания, способна более эффективно утилизировать молекулярный кислород. В процесс фотодыхания вовлекается три органеллы клетки – хлоропласты, пероксисомы и митохондрии, причем в каждой из них метаболизм молекулярного кислорода 26 занимает центральное положение. Перечисленные факты свидетельствуют о существовании весьма сложного опосредованного действия ГБО на клетки растений, и объяснить механизм его генетических эффектов только прямым взаимодействием со свободными радикалами различных компонентов клетки не представляется возможным. Кислород проникает в клетку по каналам, ограниченным различными мембранами, подвергаясь при этом инактивации и альтерации молекулярными компонентами клетки, затрудняющими доступ кислорода или его реакционноспособных форм к внутриядерным структурам. По мнению ряда авторов, система клеточных мембран возникла в процессе эволюции для защиты генетического материала от токсического действия кислорода (Sagan, Margulis, 1967; Руттен, 1973). Было показано, что ядерная мембрана в отличие от мембран других органелл эукариотической клетки более устойчива к переокислению из-за особенностей фосфолипидного состава (Афанасьев, Мысник, 1973). Нарушение целостности кариолеммы в течение первого после ГБО митоза создает возможность атаки хромосом ферментами, высвободившимися из лизосом. Последствия этой атаки регистрируются в виде значительного количества фрагментов хромосом, которые регистрируются во втором митозе после ГБО (Гуськов, 1975). Для выявления ультраструктурных изменений в клетках растений после ГБО проростки пшеницы, обработанные 0,7 МПа в течение 3 ч через 3, 6 и 24 ч после воздействия фиксировали в 2,5 %-ном глутаральдегиде, затем 1 %-ном ОsO4. Сопоставление данных, полученных при электронно-микроскопическом исследовании клеток меристемы пшеницы в разное время после окончания действия ГБО, показывает изменение их ультраструктуры по сравнению с контролем уже через 3 ч. К 24 ч изменения усиливаются и затрагивают различные органоиды клетки – увеличиваются размеры митохондрий и количество крист, усиливается потемнение матрикса пропластид. Белок-синтезирующая система через 3 ч после действия ГБО тоже изменена – число свободно рассеянных рибосом несколько уменьшено по сравнению с контролем, а через 24 ч после окончания ГБО резко возрастает количество полисом, появляется шероховатый эндоплазматический ретикулум. Обращает на себя внимание факт локализации в околоядерной зоне мелких электронно-плотных гранул, наблюдаемых через 24 ч после ГБО. Зоной локализации таких включений являются либо кариолемма, либо, в меньшей степени, зона наружной цитоплазматической мембраны (Гуськов и др, 1985а). Неслучайный характер распределения электронно-плотных гранул несомненно указывает на то, что они являются одним из морфологических выражений внутриклеточных метаболитических изменений, развивающихся после ГБО. Хотя природа и химический состав гранул, наблюдаемых на электронограммах, не исследованы, нет сомнений, что они формируются в цитоплазме, а затем фиксируются на кариолемме и плазматической мембране. По-видимому, это одна из возможных причин отсутствия четко определяемой зависимости между появлением перестроек хромосом и величиной давления или продолжительностью его воздействия. 3.2. Влияние ГБО на пролиферативную активность клеток растений. Цитостатический эффект ГБО Ранее было показано, что повышение парциального давления кислорода в среде и его повышенное давление изменяют многие функции живых организмов – вызывают задержку роста, деления и метаболизма клеток животных в культуре (Cooper et al., 1958). Выращивание L-клеток в среде, содержащей в атмосфере 50 % кислорода при 0,1 МПа, задерживает деление клеток на 24 ч (Fisher, 1960). Повышенное парциальное давление кис27 лорода в атмосфере среды препятствует процессам регенерации у червей, нарушает развитие вискулярной системы куриного эмбриона (Allen, 1961). О том, что ответственным за задержку роста и развитие тканей является именно кислород, а не атмосферное давление, говорят многочисленные факты. Так, обработка семян растений в течение нескольких недель в атмосфере азота при 60 МПа не вызывает перестроек хромосом, в то время как гораздо более низкое давление кислорода – 0,7 МПа – вызывает мутагенный эффект (Moutschen-Dahmen et al., 1959). Яйца морских ежей способны делиться при гидростатическом давлении 3 МПа, но деление зиготы морского ежа задерживается по сравнению с нормой на 400–500 % в среде под давлением кислорода 0,75–0,8 МПа (Rosenbaum, Wittner, 1960). Таким образом, наблюдается общая реакция клеток различных организмов на воздействие повышенного давления кислорода – задерживается деление клеток. Естественно и предположение о том, что механизм задержки клеточного деления должен быть общим, в связи с чем рядом авторов обращено внимание на сходство действия ГБО и ионизирующей радиации (Gerschman et al., 1954). В работе Розенбаума и Витнера (Rosenbaum, Wittner, 1960) было выдвинуто предположение о сходстве механизмов задержки деления клеток после воздействия ГБО и радиации вследствие окисления сульфгидрильных групп белков по схеме: 2R SH O 2 R S S R H 2O Образующиеся дисульфидные мостики инактивируют белки и нарушают структуру митотического веретена. Согласно этой схеме, митотический блок должен наступать в фазе G2 или в митозе. Одна из первых работ, посвященных выявлению стадии клеточного цикла, чувствительной к действию повышенного содержания кислорода в среде, была выполнена на клетках Hela (Drew et al., 1964). С помощью радиоавтографии было установлено, что кислород ингибирует синтез ДНК и удлиняет фазу G2. В более поздних работах было показано, что в куриных фибробластах и фибробластах человека, культивируемых при повышенном содержании кислорода в среде, возникает блок на стадиях G1 и G2 (Balin et al., 1977). Эти результаты не укладываются в гипотезу, объясняющую задержку деления клеток окислением сульфгидрильных групп белков в клетках митотического аппарата. Кроме того, существует ряд косвенных данных, противоречащих этой гипотезе. Так, после обработки ГБО в клетках растений не накапливаются K-митозы (MoutschenDahmen et al., 1959). Розенбаум и Витнер (Rosenbaum, Wittner, 1960) считают, что окисление сульфгидрильных групп должно инактивировать жизненно важные белки клетки, такие как алкогольдегидрогеназа, лактатдегидрогеназа и другие. Это должно приводить к изменению метаболизма клетки и отражаться на течении клеточного цикла. Однако было показано, что индуцированное кислородом ингибирование клеточной пролиферации не связано с общим окислением сульфгидрильных групп ферментов, потому что в состоянии ингибированной пролиферации в клетках значительно стимулируется гликолиз (Balin et al., 1977). Таким образом, хотя эффект, вызываемый повышенным давлением кислорода, сходен для всех тканей животных, механизм торможения клеточного цикла все еще непонятен. С этой точки зрения представляет интерес реакция растительной ткани на ГБО, так как ее метаболизм значительно отличается от метаболизма животной ткани и может дать сведения об общих чертах действия ГБО на живую клетку, тем более, что растительные клетки почти не изучены в отношении этого агента (Siegel et al., 1963). Практически у всех видов растений ГБО, помимо индукции аберраций хромосом, резко снижает пролиферативную активность меристематических клеток сразу после 28 окончания воздействия. Для клеток корневой меристемы проростков пшеницы, креписа, ячменя, подсолнечника выявлена сходная динамика пролиферации тканей: в первые сроки после ГБО наблюдается резкий спад митотической активности клеток, которая впоследствии нормализуется. В то же время степень снижения митотического индекса (МИ) зависит от используемого режима ГБО, а пороговая величина ГБО, вызывающая цитогенетический эффект, видоспецифична. Угнетение пролиферации в первые часы после действия ГБО может быть следствием возникновения блока в клеточном цикле. Для выявления фазы клеточного цикла, в котором возникает блок, клетки корневой меристемы пшеницы цитофотометрировали. Цитофотометрические исследования позволили получить результаты, дающие возможность выявить время наступления митотического блока. Контрольная популяция клеток, зафиксированная в разные сроки после начала проращивания, не показывает статистически достоверных различий между сроками, а распределение по плотности близко к нормальному (Гуськов и др., 1982б). В случае обработки ГБО при 0,7 МПа в течение 1,5 ч имеет место резкое уменьшение количества клеток с высокой оптической плотностью, причем оно сохраняется на протяжении 3 ч. При увеличении времени воздействия до 3 ч, через час после окончания обработки наблюдали еще более резкое снижение количества тетраплоидов, однако к 3 ч после ГБО наступает некоторая нормализация синтеза ДНК и распределение клеток по оптической плотности статистически не отличается от распределения, наблюдаемого в тот же срок после 1,5 ч воздействия. Эти данные наводят на мысль, что митотический блок после гипербарической оксигенации возникает до стадии синтеза ДНК. Очевидно, что более поздние стадии, в том числе и митоз, не являются мишенью для ГБО, и клетки, находящиеся в постсинтетической фазе, в течение времени пребывания в барокамере, проходя цикл, накапливаются в фазе G1, не переходя в S-период. После прекращения воздействия наблюдается некоторая синхронизация, и большинство клеток за 6–8 ч проходят стадию S–G2 и одновременно вступают в митоз, на что указывает увеличение митотического индекса именно в эти сроки фиксации после окончания обработки. Однако блок синтеза ДНК – явление обратимое. Блок синтеза ДНК занимает не более ¼ общей длительности клеточного цикла и не препятствует вступлению клеток в последующие митозы, в которых фиксируется максимальное количество перестроек хромосом. Степень подавления пролиферативной активности коррелирует с уровнем ненасыщенных жирных кислот: чем выше содержание последних, тем более ярко выражено падение митотического индекса. Наиболее чувствительными к действию ГБО оказались клетки проростков подсолнечника – в первые сроки после окончания обработки МИ резко снижается (более чем в 3 раза по сравнению с контролем). Менее чувствительными оказались проростки пшеницы, в клетках которых не наблюдали ни значительного угнетения активности пролиферации в первые сроки фиксации, ни превышения митотической активности по сравнению с контролем через 6–8 ч после окончания ГБО. Кислород при повышенном давлении вызывает цитогенетические последствия опосредованно, через изменение клеточного метаболизма. Самым общим эффектом ГБО является активация процессов ПОЛ (Владимиров Ю.И., Арчаков, 1972), что приводит к увеличению содержания свободных радикалов в растительных тканях. Первичной мишенью повреждений могут быть клеточные мембраны. Жирнокислотный состав липидов мембран, определяемый генотипом, детерминирует степень резистентности организма. Известно, что мембраны зародышевых корешков засухоустойчивых растений менее восприимчивы к действию активных форм кислорода (Leprince et al., 1990). 29 Характер изменений митотического индекса после действия ГБО (0,7 МПа – 3 ч) у двух линий подсолнечника (3629 и en:chlorinа-5) сходен – повышенное давление кислорода снижает пролиферативную активность меристематических клеток (рис. 3.2). Однако восстановление интенсивности митотических делений у исходной линии происходит через 48 ч., а у пластомного мутанта – через 24 ч после окончания обработки. а б Рис. 3.2. Пролиферативная активность клеток корневой меристемы проростков подсолнечника линии 3629 (а) и пластомного мутанта en:chlorinа-5 (б) после действия ГБО: –––– – контроль; – –■– – – ГБО 0,7 МПа–3 ч; ––▲–– – – ГБО 0,7 МПа–9 ч; *** – достоверные отличия по сравнению с контролем P < 0,001 Обработка ГБО в течение 9 ч ингибирует пролиферативную активность клеток обеих исследуемых линий. Но если для линии 3629 МИ снижается на 72 %, то МИ в корневой меристеме проростков линии en:chlorinа-5 уменьшился на 35 %. У данного пластомного мутанта не обнаружено и значительного подъема МИ во втором клеточном цикле после воздействия, как это было показано на линии 3629, а также на других видах растений. Этим, вероятно, можно объяснить продленность выхода аберраций хромосом после воздействия ГБО у линии 3629 и появление высокого уровня АХр у chlorine-5 на ранних сроках фиксации. Особенности реакции меристематических клеток пластомного мутанта на действие ГБО могут быть обусловлены изменениями в жирнокислотном составе липидов данного мутанта. Было показано, что некоторые пластомные мутанты подсолнечника отличаются от инбредной линии 3629 повышением уровня линоленовой кислоты, понижением содержания линолевой кислоты. При этом уровень пальмитиновой кислоты во фракции свободных полярных липидов листьев у мутантов выше по сравнению с линией 3629 (Лысенко, 1993). 3.3. Модификация цитогенетического эффекта ГБО Одним из возможных подходов к выяснению причин продленного мутагенеза после действия ГБО является модификация генетического эффекта химическими соединениями. При использовании азида натрия, который является гасителем синглетного кислорода, показано, что предобработка проростков снижает мутагенный эффект ГБО, а постобработка усиливает его, т.е. наблюдается противоположный эффект (Гуськов и др., 1982). Возможно, что механизм подавления вторичных продуктов, образуемых ГБО в клетках, также эффективен как и гашение инициальных радикальных процессов. Использование стабильных радикалов, обладающих специфичностью реакции с определенными типами 30 короткоживущих радикалов и не имеющих собственной мутагенной активности перспективно для изучения механизмов ГБО-мутагенеза. Таким соединением был избран нитрон. Известно, что стабильные нитроксильные радикалы обладают способностью ингибировать свободнорадикальные процессы и снижают скорость поглощения кислорода (Balin et al., 1977). Нитрон не индуцирует аберраций хромосом в клетках корневой меристемы проростков ячменя (табл. 3.6). Как видно из данных, представленных в таблице 3.6, предобработка проростков ячменя нитроном (0,05 %) до воздействия ГБО не полностью подавляет индукцию аберраций хромосом. Более того, предобработка нитроном усиливает выход фрагментов и снижает количество перестроек обменного типа, что косвенно указывает на снижение эффективности процессов репарации. Таблица 3.6 Модификация цитогенетического эффекта ГБО (0,4 МПа–3 ч) нитроном Вариант Контроль ГБО Нитрон Нитрон–ГБО ГБО–нитрон АХр ± m, % 3,75±0,59 11,0±0,75 3,75±0,53 8,73±0,63 4,37±0,65 Р <0,001 > 0,05 <0,001 <0,05 МИ ± m, % 6,68±0,39 9,23±0,46 6,71±0,94 6,61±0,34 3,95±0,24 Р <0,001 > 0,05 > 0,05 <0,01 Постобработка нитроном практически полностью снимает цитогенетический эффект ГБО. Полученные результаты можно интерпретировать следующим образом. Нитрон способен вступать в реакцию с гидроксильными и пероксильными радикалами с образованием нитроксильного радикала. Нитрон не вступает в реакцию с супероксидным радикалом и синглетным кислородам (Левин и др., 1982). Можно предположить, что при предобработке корешков ячменя нитроном тенденция к снижению уровня перестроек хромосом связана с инактивацией гидроксильного радикала, а дальнейшее развитие процессов, приводящих к возникновению перестроек хромосом, видимо, связано с активностью других типов радикалов кислорода, либо с иными процессам, не контролируемыми нитроном. Поскольку постобработка нитроном практически снимает мутагенный эффект ГБО, было высказано предположение, что нитрон способен обрывать цепь свободнорадикальных реакций, приводящих к образованию вторичных продуктов окисления (Гуськов и др., 1986а). Подобные результаты подтверждают предположение о том, что ГБО-мутагенез является многоступенчатым процессом внутриклеточных взаимодействий, приводящих к появлению перестроек хромосом. Таким образом, использование веществ-модификаторов, которые являются гасителями «ловушками» первичных радикальных продуктов, эффективно снижает цитогенетический эффект ГБО в случае предобработки, а вещества, гасящие вторичные радикалы, эффективнее использовать в варианте постобработки. 3.4. Влияние ГБО на мутагенный эффект нитрозометилмочевины С момента открытия И.А. Рапопортом мутагенного эффекта нитрозометилмочевины (НММ) на биологических объектах прошло уже несколько десятилетий, однако механизм действия этого агента по-прежнему не полностью ясен. Ранее было показано, 31 что НММ в концентрациях 0,01–0,015 % эффективно индуцирует внеядерные мутации у подсолнечника (Белецкий и др., 1969; Усатов и др., 1995). С увеличением концентрации мутагена до 0,02 % и выше возникают ядерные хлорофилльные мутации и аберрации хромосом (Белецкий, 1989; Гуськов и др., 2001а). Широкий спектр действия НММ некоторые авторы объясняют тем, что этот агент обладает комплексным действием на макромолекулы, при этом основной вклад в мутагенный эффект вносят реакции взаимодействия продуктов распада мутагена с биополимерами, а не прямой атаки НММ молекул ДНК (Серебряный и др., 1988). Развитие окислительного стресса и интенсификация процессов перекисного окисления липидов являются неспецифической реакцией организма на действие стрессорных факторов различной природы. Избыточная генерация активных форм кислорода и накопление продуктов ПОЛ могут либо непосредственно индуцировать мутации, либо изменять чувствительность клеток к другим мутагенам (Blokhina et al., 2003; Guetens et al., 2002). Поэтому было проведено исследование влияния гипербарической оксигенации на генетические последствия действия НММ на подсолнечник Helianthus annuus L. Алкилирующий мутаген НММ индуцирует как точковые мутации в хлоропластной ДНК, так и перестройки ядерного генетического материала. Различные генетические последствия обработки семян НММ зависят от используемой концентрации. Обработка проростков подсолнечника НММ в концентрации 0,015 % не изменяет уровень перестроек хромосом в клетках корневой апикальной меристемы, однако пролиферативная активность клеток резко снижена на протяжении 48 ч после окончания воздействия (табл. 3.7, рис 3.3). 14 12 * 10 8 % * 6 * * * * * * 4 * * * * * * * * * * * * * 2 0 27 39 51 63 ȼɪɟɦɹ ɪɨɫɬɚ, ɱ 1 2 3 4 5 6 7 8 Рис. 3.3. Митотический индекс клеток корневой меристемы проростков подсолнечника после действия НММ и ГБО: 1 – контроль; 2 – НММ (0,015 % – 3 ч); 3 – НММ (0,03 % – 3 ч); 4 – ГБО (0,7 МПа – 3 ч); 5 – ГБО (0,7 МПа – 9 ч); 6 – ГБО (0,7 МПа – 3 ч) + НММ (0,015 %); 7 – ГБО (0,7 МПа – 3 ч) + НММ (0,03 %); 8 – НММ (0,03 %) + ГБО (0,7 МПа – 3 ч); * – достоверные отличия по сравнению с контролем 32 Таблица 3.7 Модификация цитогенетического эффекта НММ гипербарической оксигенацией на корневой меристеме проростков подсолнечника линии 3629 Вариант Контроль НММ 0,015 % НММ 0,03 % ГБО 0,7 МПа–3 ч ГБО 0,7 МПа–9 ч ГБО (0,7 МПа–3 ч) + НММ (0,015 %) ГБО (0,7 МПа–3 ч) + НММ (0,03 %) НММ (0,03 %) + ГБО (0,7 МПа–3 ч) Время роста, ч Всего анафаз 27 39 51 63 27 39 51 63 27 39 51 63 27 39 51 63 27 39 51 63 27 39 51 27 39 51 63 27 39 51 63 598 899 880 821 898 1126 736 841 784 962 956 791 458 517 657 687 106 1216 1041 1009 1109 450 1168 569 664 543 690 561 493 262 552 Анафаз с аберрациями ± m, % 1,5±0,50 2,2±0,49 1,7±0,44 1,6±0,44 1,1±0,35 1,2±0,32 1,9±0,50 1,1±0,36 4,1±0,71 6,1±0,77 4,4±0,66 3,0±0,61 1,1±0,49 2,1±0,63 2,6±0,62 1,9±0,52 4,7±2,06 5,3±0,64 7,1±0,79 4,1±0,62 1,3±0,34 5,6±1,08 2,3±0,44 4,6±0,88 6,0±0,92 5,7±0,99 6,5±0,94 4,6±0,88 5,9±1,06 3,1±1,07 3,3±0,76 Р > 0,05 > 0,05 > 0,05 > 0,05 <0,01 <0,001 <0,001 > 0,05 > 0,05 > 0,05 > 0,05 > 0,05 > 0,05 <0,001 <0,001 <0,001 > 0,05 <0,01 > 0,05 <0,01 <0,001 <0,001 <0,001 <0,01 <0,01 > 0,05 > 0,05 Мутаген в концентрации 0,03 % индуцирует повышенный уровень аберраций хромосом уже через 12 ч после окончания обработки, т.е. НММ в данной концентрации является мутагеном прямого действия с «не задержанным» эффектом. В то же время продленный выход аберраций хромосом (на протяжении 36 ч после окончания обработки) указывает на существенный вклад внутриклеточных продуктов метаболизма НММ в индукцию повреждений ядерной ДНК. ГБО в режиме, не индуцирующим аберрации хромосом у подсолнечника (0,7 МПа – 3 ч), модифицирует цитогенетический эффект НММ. Совместное действие НММ и ГБО (независимо от варианта) оказывает значительный синергический эффект на пролиферативную активность клеток корневой апикальной меристемы проростков. Влияние комбинированного действия НММ и ГБО на индукцию аберраций хромосом неоднозначно 33 и зависит от последовательности действия физического и химического агентов. В варианте действия ГБО перед обработкой мутагеном в концентрации 0,015 % через 24 ч после окончания воздействия уровень аберраций хромосом достоверно выше по сравнению не только с контролем, но и с действием одной НММ. Более того, предобработка ГБО пролонгирует цитогенетическое действие НММ в концентрации 0,03 % (через 48 ч после окончания воздействия уровень перестроек хромосом достоверно выше по сравнению с действием одного мутагена). В то же время постобработка ГБО не увеличивает уровень перестроек хромосом, индуцируемых НММ, а к третьей фиксации (51 ч роста) уровень аберраций хромосом не отличается от контрольных значений. Таким образом, результаты цитогенетического анализа свидетельствуют, что только предварительное воздействие гипербарической оксигенации способно усиливать генотоксичный эффект НММ. НММ как эффективный индуктор мутаций пластидной и митохондриальной ДНК, вероятно, способна непосредственно нарушать структуру генетического материала органелл цитоплазмы или формировать вторичные мутагенные продукты, обладающие специфической активностью. Количественная оценка появления внеядерных хлорофилльных мутантов подсолнечника после комбинированного воздействия НММ и ГБО на его проростки может дать основание для прояснения этой проблемы. В связи с этим была изучена частота хлорофилльных мутаций у подсолнечника после действия НММ и ГБО и определена их генетическая природа. Для модификации мутагенного эффекта НММ был выбран режим ГБО (0,4 МПа), не индуцирующий повреждений в ядерном генетическом материале. Анализ растений М1 показал, что НММ снижает всхожесть проростков подсолнечника на 14 % по сравнению с контролем и индуцирует появление в М1 пестролистных растений с частотой 38,6 % (табл. 3.8). Данные пестролистные формы не являются морфозами, о чем свидетельствуют результаты анализа растений М2. ГБО не снижает выживаемости растений и не индуцирует хлорофильных аномалий как в М1, так и в М2. Однако воздействие ГБО перед обработкой проростков НММ достоверно повышает количество пестролистных форм в М1 и М2, в то время как действие ГБО одновременно с НММ или после обработки мутагеном не изменяет частоту пестролистности, индуцируемой НММ. Таблица 3.8 Частота внеядерных пестролистных мутаций у подсолнечника Helianthus annuus L. после обработки проростков НММ (0,015 %) и ГБО (0,4 МПа) Вариант Выживаемость, % Частота пестролистных растений в М1 ± m, % Количество семей М2 всего с пестролистными растениями ± m, % Контроль 78 0 117 0 НММ (12–15 ч) 67 38,6±4,84 101 35,6±4,76 ГБО (3–6 ч) 84 0 126 0 ГБО (9–12 ч) 85 0 128 0 ГБО (12–15 ч) 88 0 132 0 ГБО (18–21 ч) 87 0 131 0 ГБО (3–6 ч)+НММ (12–15 ч) 77 63,5±4,49*** 116 60,3±4,54 *** ГБО (9–12 ч)+НММ (12–15 ч) 79 59,7±4,49** 119 57,1±4,54** ГБО (12–15 ч)+НММ (12–15 ч) 74 38,7±4,62 111 36,9±4,58 НММ (12–15 ч) + ГБО (18–21ч) 75 34,5±4,47 113 35,4±4,49 Примечание: ** – достоверные отличия при Р < 0,01; *** – достоверные отличия по сравнению с действием одной НММ при P<0,001. 34 Следует отметить, что индуцированные пестролистные мутанты удовлетворяют основным критериям внеядерной наследственности (Белецкий и др., 1990). Для них характерно однородительское материнское наследование мутантного признака, неменделевское расщепление в потомстве при самоопылении на зеленые, пестрые, желтые или белые проростки. Следовательно, предобработка ГБО увеличивает частоту пластидных мутаций, индуцируемых НММ. Одной из возможных причин усиления генотоксичного эффекта НММ гипербарической оксигенацией может быть индукция свободнорадикальных процессов после действия ГБО. Свободные радикалы способны не только повреждать ДНК, но и влиять на пролиферативную активность клеток – торможение пролиферации происходит при повышении концентрации свободных радикалов и снижении антиоксидантной емкости тканей (Бурлакова и др., 1982). Изменение уровня свободнорадикальных продуктов в клетках и тканях может играть ведущую роль в устойчивости или чувствительности генетического аппарата к внешним воздействиям. Для оценки окислительного напряжения в тканях после действия НММ и ГБО был проведен модельный эксперимент. У проростков подсолнечника после обработки НММ и ГБО определяли интенсивность хемилюминесценции и активность ключевых антиоксидантных ферментов – СОД и каталазы. Несмотря на то, что прорастание семян сопровождается резкой активацией окислительно-восстановительных реакций, что может приводить к повышению внутриклеточной концентрации свободных радикалов, в контроле показатели хемилюминесценции в клетках корневой апикальной меристемы проростков на протяжении 39 ч развития остаются стабильными (табл. 3.9). Вероятно, это связано с активацией первичного ферментативного звена антиоксидантной защиты, так как в клетках корневой меристемы проростков за этот временной интервал активность каталазы достоверно повышается (табл. 3.10). Таблица 3.9 Уровень быстрой вспышки хемилюминесценции (мм) в системе люминол–Н2О2 в корневой меристеме проростков подсолнечника Время роста, ч 6 15 30 39 Контроль 70,5±7,43 80±4,89 80,2±2,36 69,5±1,5 НММ 0,015 % – 70,8±3,84 – 72,7±2,97 НММ 0,03 % – 97±6,62* – – ГБО 0,4 МПа (3–6 ч) 78,8±7,20 86,5±7,29 83,2±9,88 – ГБО 0,4 МПа (12–15 ч) – 81,8±1,47 – 79,6±5,56 ГБО (3–6 ч) + НММ (0,015 %) – 81,6±2,28^ – 82,3±1,45***^^ ГБО (12–15 ч) + НММ (0,015 %) – 75,0±9,87 – 92+5,70 ***^^ Примечание: * – достоверные отличия по сравнению с контролем при Р < 0,05; *** – достоверные отличия по сравнению с контролем при P<0,001; ^ – достоверные отличия по сравнению с действием одной НММ при P<0,05; ^^ – достоверные отличия по сравнению с действием одной НММ при P<0,01. Вариант Воздействие НММ в концентрации 0,015 % также не изменяет уровень хемилюминесценции у проростков подсолнечника. В то же время сразу после действия мутагена активность СОД резко снижается, а активность каталазы остается на уровне контроля, что, вероятно, и предотвращает усиление свободно-радикальных реакций окисления и зарождение цепного процесса ПОЛ. Использование НММ в концентрации 0,03 % приводит к увеличению высоты быстрой вспышки хемилюминесценции, которое сопровождается 35 Таблица 3.10 Активность каталазы и СОД в корневой меристеме проростков подсолнечника, ед/мг белка Время роста, ч 6 15 30 39 СОД 30,1±6,94 50,7±9,42 31,1±3,36 25,8±4,06 Контроль Каталаза 4,8±0,62 6,6±0,51 8,4±1,18 9,6±0,82 СОД – 10,1±1,33*** – 41,2±1,85*** НММ 0,015 % (12–15 ч) Каталаза – 7,1±0,31 – 15,0±0,86*** СОД – 3,8±1,61*** – – НММ 0,03 % Каталаза – 5,1+0,29* – – СОД 4,6±0,84*** 47,2±5,48 3,5±0,6*** 41,3±5,69* ГБО (3–6 ч) Каталаза 7,6±0,63** 3,3±0,34*** 11,2±0,78* 5,6±0,39*** СОД – 6,6±2,4*** – 36,4±6,23 ГБО (12–15 ч) Каталаза – 5,5±0,21 * – 9,7±1,54 СОД – 17,7±3,02***^ – 50,5±12,85 ГБО (3–6 ч) + НММ (0,015 %) Каталаза – 4,0±0,17***^^^ – 6,5±0,85*^^^ СОД – 2,3±0,29***^^^ – 38,4±7,69 ГБО (12–15) + НММ (0,015 %) Каталаза – 4,3±0,60**^^^ – 6,4±0,61**^^^ Примечание: * – достоверные отличия по сравнению с контролем при Р < 0,05; ** – достоверные отличия по сравнению с контролем при P<0,01; *** – достоверные отличия по сравнению с контролем при P<0,001; ^ – достоверные отличия по сравнению с контролем при P<0,05; ^^^ – достоверные отличия по сравнению с действием одной НММ при P<0,001. Вариант Фермент ингибированием активности как каталазы, так и СОД. Таким образом, в данном эксперименте установлено, что НММ может нарушать динамическое равновесие в системе про- и антиоксиданты у подсолнечника, активируя свободно-радикальные реакции, что, в свою очередь, приводит к дополнительным повреждениям генетических структур, индуцируемых свободными радикалами, природа которых неясна, так как квантово-химическая структура НММ не предусматривает возможного образования основных активных форм кислорода, в том числе гидроксильного радикала и супероксид-аниона. ГБО в режиме 0,4 МПа–3 ч (с 3-го по 6-й ч роста) не изменяет уровень хемилюминесценции в клетках корневой меристемы проростков, как сразу, так и через 24 ч после окончания воздействия (табл. 3.9). При этом непосредственно после действия происходит ингибирование активности СОД (на 85 %), в то время как активность каталазы повышается на 58 %. Через 9 ч после воздействия активность СОД достигает контрольного уровня, но активность каталазы достоверно ниже по сравнению с контролем. Таким образом, ГБО в данном режиме вызывает нарушение сопряженного действия СОД и каталазы, однако это не приводит к активации хемилюминесценции, возможно, за счет эффективной работы других звеньев антиоксидантной защиты, в том числе и низкомолекулярных. После действия ГБО с 12-го по 15-й ч роста корешков наблюдали снижение активности СОД, а через сутки после окончания обработки активность ключевых антиоксидантных ферментов не отличалась от контрольных значений. Обработка проростков ГБО и НММ в концентрации 0,015 % индуцирует увеличение быстрой вспышки хемилюминесценции через 24 ч после окончания воздействия. При этом происходит снижение активности как СОД, так и каталазы. Через сутки после воздействия активность СОД достигла контрольных значений, однако активность каталазы оставалась сниженной по сравнению как с контролем, так и с действием одной НММ. 36 Увеличение интенсивности хемилюминесценции через сутки после окончания обработки ГБО и НММ еще раз указывает на то, что индуцированные свободные радикалы формируются как вторичные долгоживущие продукты внутриклеточного метаболизма с задержанным эффектом. Повышение эффективности мутагенеза НММ после воздействия гипербарической оксигенации может быть связано с нарушением работы антиоксидантных ферментов. Результаты модельного эксперимента свидетельствуют, что обработка ГБО не индуцирует повышения уровня гидроксильного радикала в тканях проростков подсолнечника, хотя после предобработки ГБО к моменту воздействия мутагена в тканях корневой меристемы наблюдается дисбаланс в работе ключевых антиоксидантных ферментов – СОД и каталазы (см. табл. 3.9, 3.10). При отсутствии дополнительного внешнего воздействия это не приводит к интенсификации свободно-радикальных реакций, кластогенным последствиям и появлению хлорофилльных мутантов. Однако последующее воздействие НММ значительно повышает частоту пластидных хлорофильных мутаций. При одновременном воздействии НММ и ГБО генотоксичный эффект алкилирующего мутагена не изменяется, хотя активность антиоксидантных ферментов также снижена. При этом частота индуцированных внеядерных хлорофилльных мутантов соответствует частоте, которую индуцирует только НММ (см. табл. 3.8). Отсутствие синергического эффекта при одновременной обработке и усиление эффекта НММ после предобработки ГБО указывает на существование специфического механизма взаимодействия ГБО и НММ. Несомненно, что модификация эффекта НММ связана с возникновением мутагенных продуктов метаболизма, реализация которых требует определенного времени. Причины вторичных изменений связаны с появлением и накоплением продуктов метаболизма НММ и их взаимодействием с активными формами кислорода. В процессе метаболизма нитро-, нитрозо- и других азотсодержащих соединений в клетках инициируется образование оксида азота NO. Увеличение его концентрации может быть обусловлено и активацией NO-синтазы, которая у растений локализуется в пероксисомах (Corpas et al., 2001). По данным литературы известно, что увеличение продукции NO происходит при действии кратковременных или умеренных стрессов, в том числе и при оксидативном стрессе (Duval et al., 1995). NO способен взаимодействовать с супероксидным радикалом (концентрация которого в тканях после действия ГБО и ингибирования СОД может повышаться) с образованием высоко токсичного пероксинитрита: O 2 NO ONOO Пероксинитрит является источником возникновения другого высоко токсичного радикала – гидроксильного (Beckman et al., 1990; Freeman, 1994), повышение концентрации которого мы и зафиксировали по увеличению интенсивности хемилюминесценции через 24 ч после действия ГБО и НММ (см. табл. 3.9). Однако, если гидроксильный радикал практически мгновенно вступает в реакции с биополимерами, то пероксинитрит, так же как и оксид азота, обладают достаточным для миграции в ткани временем жизни: ONOO H ONOOH HO NO 2 Как NO, так и пероксинитрит способны ингибировать многие ферменты, в том числе СОД, глутатионпероксидазу (Troy et al., 1996; Asahi et al., 1995). В присутствии пероксинитрита возникают радикалы глутатиона, способные индуцировать процессы перекисного окисления липидов. Таким образом, происходит нарушение функционирования различных звеньев антиоксидантной защитной системы. 37 Известно ингибирующее влияние данных соединений на ферменты цикла Кребса, ферменты дыхательной цепи митохондрий, содержащие в активных центрах железосерные группы, что приводит к подавлению синтеза АТФ, снижению пролиферативной активности клеток (Lepoivre et al., 1991; Punjabi et al., 1992; Szabo et al., 1996). Этим можно объяснить ингибирующий синергический эффект комбинированного действия ГБО и НММ на пролиферацию клеток корневой апикальной меристемы проростков подсолнечника. Чувствительность клеток к мутагену зависит от их физиологического состояния, в частности от стадии клеточного цикла и степени синхронизации митотических делений. Ранее было показано, что с 3-го по 9-й ч прорастания семян подсолнечника происходит интенсивный синтез как ядерной, так и хлоропластной ДНК (Усатов и др., 1990). Воздействие ГБО в данный временной интервал может существенно повысить чувствительность генетического аппарата клеток к внешним воздействиям, поскольку известно, что гипербарическая оксигенация тормозит митотический цикл на стадии G1–S, но при этом происходит синхронизация делений меристематических клеток (Гуськов, Шкурат, 1985; Гуськов и др., 1985б). Последующее воздействие мутагена реализуется на стадии S– G2, когда генетический аппарат клетки наиболее чувствителен к внешним воздействиям. Увеличение концентрации NO и пероксинитрита усиливает и продлевает цитостатический эффект. Более того, оксид азота и его производные способны непосредственно индуцировать повреждения в ДНК, ингибировать ДНК-лигазу, влиять на процессы репликации ДНК (Salgo et al., 1995; Inoue, Kawanishi et al., 1995; deRojas-Walker et al., 1995; Graziewicz et al., 1996). Высокая проникающая и реакционная способность NO и пероксинитрита, их ингибирующее влияние на многие ключевые ферменты метаболизма, содержащие железосерные группы, могут как прямо, так и опосредованно индуцировать повреждения в ядерной ДНК и в ДНК цитоплазматических органелл. 3.5. Окислительный стресс и устойчивость растений к внешним экстремальным воздействиям В меняющихся условиях среды на воздействие экстремальных факторов растение отвечает каскадом реакций, поддерживающих жизнеспособность организма. Первичная стрессорная реакция направлена на оперативное снижение негативных последствий воздействия, в то время как долговременная адаптация формируется на фоне сохраняющегося действия экстремальных факторов и направлена на поддержание жизнедеятельности организма как целостной системы (Селье, 1977). Очевидно, что степень устойчивости организма зависит от адаптивного потенциала, который, в свою очередь, определяется его генотипом. Хотя геномы пластид и митохондрий имеют незначительную информационную емкость по сравнению с ядерным, однако функционально они непосредственно связаны с важнейшими процессами жизнеобеспечения автотрофов – внутриклеточным дыханием и фотосинтезом, а эти функции, в свою очередь, более чем какие-либо другие, определяют адаптивность реакции растений на стресс. Поскольку пластиды и митохондрии играют ключевую роль в поддержании окислительного гомеостаза растительной клетки, мы провели сравнительный анализ действия ГБО на линии подсолнечника. Для оценки окислительного напряжения в тканях растений после действия ГБО был поставлен модельный эксперимент. Сравнительный анализ действия ГБО (0,4 МПа–3 ч) мы провели на следующих трех линиях – исходная линия 3629, индуцированный НММ пластомный мутант en:chlorinа-7 и индуцированный НММ ревертант r-en:chlorinа-7. Данный ревертант характеризуется полным 38 восстановлением содержания пигментов, показателей габитуса до уровня исходной линии 3629, восстановлением структуры хпДНК (Triboush et al., 1999). Анализ уровня хемилюминесценции показал, что в контроле интенсивность свободно-радикальных реакций в клетках корневой апикальной меристемы проростков трех генетически различных линий подсолнечника находится на одном уровне (табл. 3.11). Таблица 3.11 Уровень быстрой вспышки (мм) хемилюминесценции в системе люминол–Н2О2 в корневой меристеме проростков подсолнечника Время роста, ч 6 15 3629 70,5±7,43 80±4,89 Контроль En-chl-7 77,8±6,3 79,1±4,52 r-en-chl-7 88,7±6,72 79,4±4,78 3629 78,8±7,20 86,5±7,29 ГБО 0,4 МПа En-chl-7 87,5±4,25 87,0±6,11 (3–6 ч) r-en-chl-7 98,7±7,09 85,8±7,38 * – достоверные отличия по сравнению с контролем при Р < 0,001. Вариант Линия 30 80,2±2,36 83,1±2,82 72,2±7,11 83,2±9,88 119±8,67*** 104,3±10,85 Сохранение постоянного уровня свободно-радикальных продуктов в тканях корня проростков подсолнечника трех линий обеспечивается за счет активации первичного ферментативного звена антиоксидантной защиты. Так, в клетках корневой меристемы проростков всех трех линий с 6-го по 39-й ч роста активность каталазы достоверно повышается (табл. 3.12). Необходимо отметить, что у мутанта en-chlorina-7 активность каталазы через 6 ч роста не отличается от таковой для линии 3629. Однако в дальнейшем увеличение активности данного фермента у пластомного мутанта происходит в меньшей степени и к 39 часам роста этот показатель достоверно ниже по сравнению с линией 3629. У ревертанта r-en-chlorina-7 отмечена обратная тенденция: в первые 6 ч роста активность каталазы ниже, чем у линии 3629 и en-chlorina-7, но уже к 15-му ч роста ревертант не отличается от линии 3629, а к 39-му ч прорастания активность каталазы у ревертанта достоверно выше по сравнению с линией en-chlorina-7 и не отличается от 3629. Таким образом, реверсия в хпДНК у ревертанта коррелирует с восстановлением активности данного антиоксидантного фермента. Таблица 3.12 Активность каталазы и СОД в корневой меристеме проростков подсолнечника при нормальных условиях прорастания, ед/мг белка Время роста, ч 6 15 30 СОД 30,1±6,94 50,7±9,42 31,1±3,36 3629 Каталаза 4,8±0,62 6,6±0,51 8,4±1,18 СОД 12,6±1,92 * 34,7±4,55 28,0±5,58 En:chlorina-7 Каталаза 4,7±0,27 5,5±0,49 5,8±0,82 СОД 14,8±2,06 * 55,5±10,8 25,3±3,62 r-en:chlorina-7 Каталаза 3,25±0,49 * 5,8±0,87 6,9±0,43 * – достоверные отличия по сравнению с линией 3629. Линия Фермент 39 25,8±4,06 9,6±0,82 40,0±7,99 6,9±0,52 * 17,9±1,87 8,8±0,8 Воздействие ГБО на проростки подсолнечника в течение 3 ч (с 3-го по 6-й ч прорастания) не изменяет уровень быстрой вспышки хемилюминесценции в корневой апикальной меристеме проростков исходной линии 3629 и ревертанта r-en:chlorinа-7, как сразу 39 после действия, так и через 24 ч после окончания обработки (см. табл. 3.11). Однако при этом активность СОД в проростках обеих линий достоверно снижается, а активность каталазы повышается по сравнению с контролем (рис. 3.4, а–в). а б в Рис. 3.4. Динамика изменения активности СОД и каталазы (в % от контроля) в клетках корневой меристемы проростков подсолнечника различных линий после действия ГБО в режиме 0,4 МПа–3 ч (с 3-го по 6-й ч прорастания): а – линия 3629; б – en:chlorina-7; в – r-en:chlorina-7; * – достоверные отличия по сравнению с контролем при Р < 0,05; ** – при Р < 0,01; *** – при Р < 0,001 40 У пластомного мутанта en:chlorinа-7 действие повышенного давления кислорода индуцирует чрезмерное повышение активности каталазы, что не предотвращает активации свободно-радикальных реакций. В результате высота быстрой вспышки хемилюминесценции через сутки после воздействия достоверно превышает контрольные значения. Активность СОД в этот же период времени снижена (см. табл. 3.11, рис. 3.4, б). Таким образом, в данном модельном эксперименте показано, что уже в клетках корневой меристемы проростков наличие мутации в хпДНК может оказывать влияние на особенности ответной реакции растительных клеток на внешние стрессовые воздействия, в данном случае – увеличение концентрации и давления кислорода во внешней среде. Следующий модельный эксперимент был проведен для оценки реакции тканей листа на действие ГБО. В эксперименте использовали проростки на стадии развития первой пары настоящих листьев, сформировавшихся при искусственном освещении. Обработку ГБО проводили в режиме 0,7 МПа – 8 ч Воздействие ГБО на проростки линии 3629 индуцирует снижение активности СОД и каталазы, которое сохраняется на протяжении суток после окончания обработки. Следствием этого является повышение светосуммы хемилюминесценции (что отражает истощение антиоксидантной емкости), а также накопление МДА в тканях листа через 24 ч после воздействия (рис. 3.5, а). Те же самые закономерности ответной реакции выявлены и для пластомного мутанта en:chlorinа-7 (рис. 3.5, б). Первичная стрессовая реакция ревертанта на действие ГБО сходна с другими линиями – сразу после действия гипербарической оксигенации происходит снижение активности каталазы и СОД. Однако через 24 ч после воздействия активность СОД повышается, а каталазы не отличается от контроля. Показатели хемилюминесценции и уровень МДА при этом не отличаются от контроля (рис. 3.5, в). Неспецифическим ответом организма на действие внешних экстремальных факторов является развитие стресс-реакции. Пусковым механизмом стресса, как правило, выступает нарушение динамического равновесия в системе прооксиданты–антиоксиданты, что приводит к активации процессов ПОЛ (Loggini et al., 2002; Mittler, 2002; Blokhina et al., 2003: Khanna-Chopra et al., 2004). Свободные радикалы и запускаемые ими контролируемые процессы перекисного окисления липидов выполняют жизненно важные функции: они необходимы для экспрессии генов, запуска клеточных делений и дифференцировки клеток, формирования новых и разрушения «старых» мембранных структур клетки, защиты от патогенов и других стрессовых воздействий (Yeh et al., 1999; Hancock et al., 2001; Mittler, 2002; Coster et al., 2002; Neill et al., 2002). Таким образом, контрольный уровень ПОЛ является естественным физиологическим показателем, который характеризуется как межвидовыми, так и межлинейными различиями. Однако некоторая часть пула свободно-радикальных процессов индуцирует стохастические неконтролируемые реакции перекисного окисления, возможность развития которых определяется активностью антиоксидантной системы. Уровень активности ферментативных антиоксидантов может служить косвенным показателем степени резистентности растительного организма к стрессовым воздействиям (Mittova et al., 2002). Уровень активности антиоксидантных ферментов, а также их изоферментный состав ранее были предложены в качестве тест-системы для оценки устойчивости растений к различным стрессорным воздействиям. На пластомном солеустойчивом мутанте подсолнечника enchlorina-3 было показано, что в нормальных условиях уровень СПА у данного мутанта значительно выше по сравнению с неустойчивой линией 3629 (Белецкий и др., 1990). При сульфатном засолении у мутанта СПА не изменяется, в то время как у растений линии 3629 отмечены резкие изменения в активности фермента. Активность СОД при засоле41 а б в Рис. 3.5. Изменение показателей хемилюминесценции, уровня МДА и активности антиоксидантных ферментов (в % от контроля) в тканях листа проростков подсолнечника различных линий после действия ГБО в режиме 0,7 МПа–8 ч: а – линия 3629; б – en:chlorina-7; в – r-en:chlorina-7; * – достоверные отличия по сравнению с контролем при Р < 0,05; ** – при Р < 0,01; *** – при Р < 0,001 42 нии у неустойчивых линий либо не изменяется, либо снижается, а у солеустойчивых (enchlorina-3, en-chlorina-6) – повышается (Белецкий и др., 1990). Подобные факты указывают на то, что устойчивость к стрессовым воздействиям может зависеть от способности организма контролировать интенсивность свободнорадикальных реакций и процессов перекисного окисления липидов. Жизнедеятельность растительной клетки находится под контролем трех генетических систем – ядерного генетического материала, хлоропластной и митохондриальной ДНК. Несмотря на небольшую информационную емкость генетический аппарат цитоплазматических органелл может обеспечивать устойчивость растительных организмов к стрессовым воздействиям. Митохондриальный мутант Nicotiana sylvestris характеризуется низким содержанием активных форм кислорода в тканях листьев, измененным характером экспрессии некоторых антиоксидантных ферментов и повышенной резистентностью к стрессовым воздействиям (Dutilleul et al., 2003; Noctor et al., 2004). Функциональная специфичность пластид и митохондрий определяет наличие повышенной концентрации свободных радикалов в этих органеллах по сравнению с ядром (Fridovich, 1986; Halliwell, Gutteridge, 1986, Raven et al., 1994a, 1994b; Allen J.F., Raven, 1996). Таким образом, в процессе переноса генов из органелл в ядро, сформировались хлоропластный и митохондриальный наборы генетического материала, экспрессия которых осуществляется в условиях повышенной концентрации активных форм кислорода (Allen J.F., Raven, 1996). Это может приводить к увеличению частоты возникающих в хлоропластной и митохондриальной ДНК мутаций, индуцируемых свободно-радикальными продуктами. С другой стороны, уровень экспрессии генов хпДНК и мтДНК прямо зависит от окислительного потенциала переносчиков электронов как фотосинтетических систем хлоропластов, так и ферментов дыхания (Allen J.F., 1993a, b). Показано, что изменение окислительного напряжения проявляется в изменении набора синтезируемых изолированными хлоропластами и митохондриями белков, а также влияет на синтез мтДНК и РНК (Allen J.F., 1995; Konstantinov et al., 1995). Подобные условия обеспечивают зависимую от концентрации активных форм кислорода регуляцию экспрессии митохондриальных и пластидных генов, что может способствовать уменьшению продукции свободных радикалов в клетке в целом (Allen J.F., Raven, 1996) и таким образом снизить частоту возможных мутаций в ядерном генетическом материале. Способность пластид и митохондрий контролировать окислительно-восстановительный гомеостаз является одной из определяющих характеристик в формировании резистентности растений к действию экстремальных факторов среды. Можно предположить, что растительный организм будет одинаково устойчив или не устойчив ко всем факторам, изменяющим прежде всего окислительно-восстановительный баланс в растительной клетке. Скрининг коллекции хлорофильных мутантов подсолнечника на устойчивость к окислительному стрессу показал, что реакция мутантных линий на экстремальное воздействие не одинакова. Нами был проведен модельный эксперимент для оценки активности СОД и каталазы в тканях проростков подсолнечника в контроле и после воздействия ГБО (0,7 МПа–4 ч). Как видно из данных таблицы 3.13, уровень активности СОД в тканях проростков исходной линии 3629 и частичного ревертанта pr6-en:chlorina-7 с измененными митохондриями наибольший среди изученных линий. У пластомных мутантов подсолнечника уровень активности супероксиддисмутазы достоверно ниже по сравнению с линией 3629. В то же время активность каталазы у пластомных мутантов chlorina находится на одном уровне с показателем исходной зеленой линии. Ядерный мутант n:chlorina-1 характеризуется повышенной активностью каталазы (табл. 3.13). 43 Таблица 3.13 Активность антиоксидантных ферментов – СОД и каталазы в корневой меристеме проростков подсолнечника, ед/мг белка Контроль ГБО 0,6 МПа (0–4 ч) каталаза СОД каталаза СОД 3629 4,8±0,6 30,1±6,9 7,9±0,4*** 11,3±2,5* N:chlorina-1 8,1±0,2+++ 15,3±3,1 9,9±0,5***++ 23,1±4,6 + En:chlorina-3 3,3±0,1+ 12,6±1,8+ 3,6±0,4+++ 12,0±2,1 En:chlorina-5 4,0±0,8 13,5±2,5+ 7,9±0,1*** 16,6±2,6 En:chlorina-6 5,1±0,3 15,5±6,3 6,0±0,1*+++ 10,2±2,5 En:chlorina-7 4,7±0,3 12,6±1,9+ 6,6±0,5***+ 9,9±1,9 pr6-en:chlorina-7 6,9±0,4 35,6±4,8 2,7±0,5***+++ 8,2±3,6*** r-en:chlorina-7 3,2±0,5+ 14,8±2,1+ 5,9±0,5***++ 7,4±1,4** Сорт Донской 6,6±1,0 17,3±2,1 8,3±0,4 33,7±7,9*+ Примечание: * – достоверные отличия по сравнению с контролем при P<0,05; ** – достоверные отличия по сравнению с контролем при P<0,01; *** – достоверные отличия по сравнению с контролем при P<0,001; + – достоверные отличия по сравнению с линией 3629 при P<0,05; ++ – достоверные отличия по сравнению с линией 3629 при P<0,01; +++ – достоверные отличия по сравнению с линией 3629 при P<0,001. Линия После действия повышенного давления кислорода активность СОД была снижена у растений трех линий: 3629, pr6-en:chlorina-7, r-en:chlorina-7 (на 63, 77 и 50 %, соответственно), а у пластомных хлорофильных мутантов оставалась на уровне контрольных значений (табл. 3.13). Активность каталазы у всех линий, за исключением частичного ревертанта pr6-en:chlorina-7, после действия повышенного давления кислорода достоверно увеличивалась. Одной из неспецифических реакций на стрессовое воздействие является изменение пролиферативной активности клеток. Стрессовые факторы, как правило, вызывают реакцию защитного торможения метаболизма, в том числе подавление деления и линейного роста клеток (Lepoivre et al., 1991; Alves, Setter, 2004; Gimener-Abian et al., 2004). Анализ пролиферативной активности клеток корневой апикальной меристемы проростков подсолнечника в контроле показал, что у исходной линии 3629 первые митотические деления наблюдаются к 48 ч роста. Максимальный уровень МИ зафиксирован через 68 ч после начала проращивания семян. У ядерного мутанта n:chlorinа-1 начало делений приходится на 26 ч, а наибольшая пролиферативная активность была отмечена в тоже время, что и у линии 3629. При этом значение МИ ниже по сравнению с исходной линией. Пластомный мутант en:chlorinа-5 в контроле характеризуется более ранним началом пролиферации – первые деления отмечены на 26 ч роста. Через 34 ч роста МИ равен 3,3 %; в дальнейшем МИ изменяется волнообразно. Наибольший показатель МИ отмечен для проростков частичного ревертанта pr6-en:chlorina-7. Анализ МИ в корневой апикальной меристеме проростков подсолнечника, обработанных ГБО показал, что гипербарическая оксигенация подавляет митотическую активность клеток. У пластомного мутанта en:chlorinа-5 МИ в отдаленные сроки после действия ГБО (56 ч роста) превышает контрольный уровень в 2 раза. Высокую пролиферативную активность после действия ГБО проявил и частичный ревертант pr6-en:chlorina-7. Стресс-факторы вызывают неспецифическую реакцию защитного торможения метаболизма, которая включает в себя и подавление процессов деления и роста клеток. В регуляции деления клеток существенную роль играют свободно-радикальные реакции, продукты которых оказывают ингибирующее влияние на интенсивность деления (Бурлакова 44 и др., 1982; Brar et al., 1999). С другой стороны, было показано, что накопление перекиси водорода и создание определенного окислительно-восстановительного потенциала необходимы для начала пролиферации и дифференцировки Neurospora crassa (Hansberg et al., 1993). Низкие дозы активных форм кислорода стимулируют рост фибробластов и клеток эпителия (Murrell et al., 1990). При ингибировании скорости образования супероксид-анион радикала происходит подавление роста проростков пшеницы растяжением (Шорнинг и др., 2000). Анализ морфометрических характеристик контрольных растений и растений, обработанных на ранних стадиях прорастания семян, показал, что повышенное давление кислорода достоверно снижало интенсивность роста проростков только исходной линии 3629, ядерного мутанта n:chlorina-1 и сортовых растений. Высота хлорофильных пластомных мутантов, обработанных ГБО, на стадии формирования 3–4-й пары листьев не отличалась от контроля, а у пластомного мутанта en:chlorina-5 даже достоверно превышала контрольные значения (табл. 3.14). Таблица 3.14 Всхожесть семян, обработанных на ранних этапах прорастания повышенным давлением кислорода, и высота растений подсолнечника на стадии развития 3–4-й пары листьев ГБО 0,7 МПа (0–4 ч) всхожесть, % высота, см 3629 85,3 69,3 * 10,1±0,3*** n:chlorina-1 73,3 57,3 7,6±0,3 + ** en:chlorina-3 78,7 84 7,0±0,2 + en:chlorina-5 78,7 69,3 7,9±0,2 +*** en:chlorina-6 56,0 34,0 7,7±0,5 + en:chlorina-7 74,7 56,0 7,5±0,4 + pr6-en:chlorina-7 62,7 61,3 8,7±0,3 + r-en:chlorina-7 80 56,0 * 10,7±0,4 Сорт Донской-99 89,3 78,7 14,4±0,4 + *** Примечание: * – достоверные отличия по сравнению с контролем при P<0,05; ** – достоверные отличия по сравнению с контролем при P<0,01; *** – достоверные отличия по сравнению с контролем при P<0,001; + – достоверные отличия по сравнению с линией 3629 при при P<0,05. Линия Контроль Таким образом, данные полевых наблюдений согласуются с результатами цитогенетического анализа. Степень активации клеточных делений в отдаленные сроки после действия ГБО коррелирует с ростом растений на стадии формирования 3–4-й пары листьев. Восстановление МИ после действия ГБО до контрольных значений у частичного ревертанта и сортовых растений подтверждается данными о сходной высоте контрольных и обработанных ГБО растений. Снижение МИ у ядерного мутанта приводит к отставанию в росте растений. Двукратное повышение МИ у пластомного мутанта en:chlorina-5 согласуется с увеличением высоты растений относительно контроля. Обобщая полученные данные, можно сделать вывод, что реакция растений подсолнечника на действие повышенного давления кислорода неодинакова. Выявлены различия между линиями различной генетической природы. Повышенная чувствительность исходной инцухт-линии 3629, вероятно, вызвана высокой степенью гомозиготности ядерных аллелей, что, как известно, снижает адаптивный потенциал организма в изменившихся условиях среды. В то же время высокая степень гетерозиготности генетического материала растений подсолнечника сорта Донской-99 обеспечивает их повышенную устойчивость к повышенному давлению кислорода. 45 Наиболее устойчивыми формами оказались пластомный мутант en:chlorina-5 и частичный ревертант с измененной структурой митохондриальной ДНК pr6-en:chlorina-7. У пластомного мутанта en:chlorina-5 после стрессового воздействия активность СОД не изменяется при одновременном повышении активности каталазы. Реакция на клеточном уровне проявляется в активации деления клеток корневой апикальной меристемы в отдаленные сроки после действия ГБО. На уровне целого организма было зафиксировано увеличение высоты растений по сравнению с контролем. Особый интерес вызывает частичный ревертант pr6-en:chlorina-7. Несмотря на снижение активности антиоксидантных ферментов после воздействия ГБО, всхожесть семян данной линии наибольшая среди мутантных форм, а высота растений после действия ГБО не отличается от контроля. Из данных литературы известно, что устойчивость к стрессовому фактору не всегда коррелирует с повышенной активностью антиоксидантных ферментов. На Arabidopsis показано, что устойчивые к окислительному стрессу мутанты ore1, ore3, ore9 характеризуются сниженной, по сравнению с диким типом, активностью антиоксидантов (Woo et al., 2004). В нашем случае у частичного ревертанта pr6-en:chlorina-7 исходный уровень активности СОД и каталазы не отличается от исходной линии 3629. Однако после действия ГБО происходит ингибирование как СОД, так и каталазы. Возможно, что в данном случае активно функционируют другие звенья защитной системы, в том числе и низкомолекулярные антиоксиданты. В частности, показано, что α-токоферол эффективно деактивирует активные формы кислорода. Особенно важна роль низкомолекулярных антиоксидантов в цитоплазматических органеллах, где высока концентрация активных форм кислорода. Показано, что α-токоферол локализуется, в частности, в оболочке хлоропластов, в мембранах тилакоидов, в пластоглобулах (Munne-Bosch, 2005). Для оценки адаптивного потенциала данной линии подсолнечника нами была проведена повторная обработка семян растений М1 гипербарической оксигенацией в режиме 0,7 МПа – 10 ч Анализ всхожести семян показал, что первичное воздействие ГБО в данном режиме не снижает всхожести семян частичного ревертанта pr6-en:chlorinа-7. Количество взошедших семян М2 у частичного ревертанта было максимальным, достоверно превышая показатель для необработанных семян. Вторичная обработка семян М2 гипербарической оксигенацией в режиме 0,7 МПа – 10 ч у линии 3629 достоверно снижает всхожесть семян не только по сравнению с контролем, но и по сравнению с первичным воздействием ГБО. Повторное воздействие ГБО повышает показатель всхожести семян частичного ревертанта pr-en:chlorinа-7. Можно предположить, что первичное воздействие ГБО (4 ч) в первые часы прорастания семян способствовало отбору наиболее резистентных к увеличению концентрации кислорода во внешней среде клеток и/или клеточных органелл и прежде всего митохондрий, что обеспечило интенсивный рост растений М1, высокую всхожесть семян М2, а также резистентность к повторным воздействиям ГБО в более «сильном» режиме. Таким образом, измененная структура как митохондриальной, так и хлоропластной ДНК может быть основой для повышения резистентности растительного организма к внешним стрессовым воздействиям. Толерантность растительного организма на стадии прорастания минимальна и не всегда соответствует общей толерантности взрослого растения. Однако воздействие на ранних этапах прорастания оказывает влияние на сравнительно небольшое количество клеточных органелл, что повышает вероятность фенотипического проявления устойчивости, обусловленной цитоплазматическими ДНК-содержащими органеллами. Гетерогенность и многокопийность хлоропластной ДНК приводят к тому, что в клетке одновременно существует несколько типов органелл с различной адаптационной емкостью. 46 Проявление вариабельности генетических систем возможно только при действии стресса (Fender, O`Connell, 1990; Joshi et al., 1997; Kumar et al., 1999; Burke, 2001). Стрессовое воздействие может обеспечивать эффективную рассортировку органелл и возникновение тканей, органов и организмов с измененной нормой реакции. При действии экстремальных факторов среды получают преимущества те клетки, в которых пластиды и митохондрии адаптированы к более высоким концентрациям свободно-радикальных продуктов. Все перечисленные факты свидетельствуют о существовании весьма сложного опосредованного действия ГБО на клетки растений, и объяснить механизм его генетических эффектов только прямым взаимодействием различных компонентов клетки со свободными радикалами пока не представляется возможным. Вероятно, аналогии, проводимые между механизмами действия радиации и ГБО, весьма упрощены. Облучение организмов приводит, в первую очередь, к становлению эффекта прямого поражения генетического аппарата клеток действием проникающей радиации, в то время как кислород, в силу своих химических особенностей, проникает в клетку по каналам, сформированным различными мембранами, подвергаясь при этом инактивации и альтерации молекулярными компонентами клетки. Это резко уменьшает доступ кислорода или его реакционноспособных форм к внутриядерным структурам и является одной из причин отсутствия четко определяемой зависимости между появлением перестроек хромосом и степенью давления или продолжительностью его воздействия. По результатам проведенных экспериментов можно предположить, что воздействие ГБО на ранних стадиях прорастания семян способствует формированию длительной адаптации растительного организма, которая осуществляется за счет модификации функционального состояния макромолекул, изменения дифференциальной активности генетического аппарата (Кузнецов и др., 1990) и/или соматического отбора ДНК-содержащих органелл, резистентных к увеличению концентрации кислорода во внешней среде. 47 Глава 4. ГЕНЕТИЧЕСКИЕ ПОСЛЕДСТВИЯ ГИПЕРБАРИИ И ГИПЕРБАРИЧЕСКОЙ ОКСИГЕНАЦИИ 4.1. Цитогенетические последствия ГБО в соматических и генеративных тканях животных при моделировании терапевтических режимов ГБО Гипербарическая оксигенация завоевала прочные позиции в медицине как важный, а в некоторых случаях единственный способ лечения различных заболеваний. Достижения гипербарической медицины в нашей стране и за рубежом широко освещены в печати. В условиях гипероксии проводят хирургические операции, снимают ишемическую болезнь сердца, улучшают состояние больных после инфаркта миокарда, усиливают эффекты радио- и химиотерапии опухолей и пр. Режимы ГБО подбирают в клинике строго индивидуально; как правило, в практике используют режимы от 0,1 до 0,4 МПа в зависимости от характера и тяжести заболевания однократно или в течение нескольких, обычно от 5 до 10, 40 или 60-минутных ежедневных сеансов. Физиологические, патофизиологические, биохимические и клинические аспекты действия гипербарического кислорода на организмы экспериментальных животных и человека легли в основу ряда фундаментальных руководств и трудов конгрессов и совещаний по гипербарической медицине. Показано, что терапевтические эффекты ГБО могут быть связаны с: – увеличением концентрации кислорода во всех тканях; – способностью убивать микроорганизмы; – стимуляцией иммунных механизмов; – стимуляцией антиоксидантной системы. Однако фундаментальные работы, посвященные генетическим аспектам последствий пребывания организма в разных режимах давлений ГБО, практически отсутствуют. Чтобы устранить этот пробел, на лабораторных животных были поставлены эксперименты, моделирующие условия клинического использования ГБО (Гуськов, Шкурат, 1985; Шкурат и др., 1991, 1992; Shkurat, Shimanskay, 1993; Гуськов м др., 1986а; Гуськов и др., 1989б, 1989в). В таблице 4.1 приведены результаты действия терапевтических режимов ГБО на клетки костного мозга. Как видно из таблицы, обработка животных в режиме 0,12 МПа–1 ч, как в течение 4, так и в течение 10 сеансов, не вызывает достоверного увеличения выхода АХр. В то время как увеличение параметра давления до 0,2 МПа приводит к достоверному повышению числа клеток с АХр уже после 4 сеансов. С увеличение количества сеансов увеличивается число клеток с перестройками хромосом. Давление кислорода 0,12 МПа не увеличивает количество клеток с АХр, однако изменяет их спектр. Так, после 4 сеансов ГБО увеличивается число клеток с хромосомными мостами на 10 %, а после 10-го сеанса на 60 % по сравнению с контролем. При 0,2 МПа увеличение АХр идет по типу спонтанного, однако, после 10-го сеанса регистрируется повышенное число клеток с хроматидными мостами. В таблице 4.2. представлены результаты цитогенетического анализа половых клеток крыс-самцов, подвергшихся различным режимам ГБО-терапии. 48 Таблица 4.1 Цитогенетические последствия в клетках костного мозга крыс, подвергшихся сеансам ГБО-терапии № животного Общее кол-во анафаз АХр – 1 2 3 Всего 300 300 400 1000 1 2 4 7 1 0 1 2 1 2 3 Всего 500 250 300 1050 10 5 3 18 2 0 1 3 1 2 Всего 320 250 570 8 14 22 2 0 2 1 2 3 4 Всего 500 500 500 500 2000 8 5 13 7 33 2 0 0 0 2 1 2 3 Всего 585 500 500 1585 26 28 20 74 3 0 3 6 –=– Z Контроль 2 1 1 2 0,12 МПа 4 сеанса 0 4 1 1 0 0 1 5 0,2 МПа 4 сеанса 2 2 3 5 5 7 0,12 МПа 10 сеансов 0 0 0 1 0 0 0 0 0 1 0,2 МПа 10 сеансов 0 15 16 3 0 10 16 28 X –X– АХр±m, % Р 1 1 2 0 0 0 1,3±0,7 0,7±0,5 1±0,5 0,7± 0,38 2 3 2 7 2 1 0 3 2,0±0,62 2,0±1,27 1,3±0,57 1,7±0,78 >0,1 2 4 6 0 0 0 2,5±0,87 5,6±1,45 3,9±0,81 <0,001 6 3 13 7 29 0 1 0 0 1 1,6±0,56 1,0±0,44 2,6±0,71 1,4±0,52 1,6±0,28 <0,01 8 9 4 21 2 0 1 3 4,4±0,85 5,6±0,97 4,0±0,88 4,7±0,53 <0,001 Таблица 4.2 Цитогенетические последствия в половых клетках крыс после обработки различными режимами ГБО-терапии № варианта Число анафаз в 1-м мейозе С АХр АХр±m, % 1 2 3 Всего 210 300 250 760 3 1 2 6 1,4±0,8 0,3±0,32 0,8±0,56 0,8±0,32 1 2 3 350 240 380 3 3 9 0,9±0,71 1,3±0,72 2,4±0,79 Число анафаз Рк во 2-м мейозе Контроль 400 300 300 1000 0,12 МПа 4 сеанса 270 355 520 С АХр АХр±m, % 10 3 4 17 2,5±0,78 1,0±0,57 1,3±0,65 1,7±0,4 5 13 12 1,9±0,9, 3,7±0,9 2,3±066 Рк Р1–2 <0,01 >0,5 >0,5 49 Окончание табл. 4.2 Число анафаз АХр±m, С АХр Рк С АХр Рк Р1–2 во 2-м % мейозе 4 6 1,7±0,69 522 3 0,6±0,3 <0,05 5 5 1,2±053 443 20 4,5±0,46 <0,01 <0,01 Всего 26 1,5±0,29 2110 81 2,5±0,34 >0,5 0,2 МПа 4 сеанса 1 536 6 1,2± 0,47 410 26 6,8±1,2 <0,01 <0,001 2 454 2 0,4±0,3 647 34, 5,3±0,9 <0,01 <0,001 3 347 2 0,6±0,4 472 2 0,4±0,3 >0,5 Всего 1337 10 0,7±0,2 >0,5 1529 62 4,1±0,5 <0,001 <0,001 0,12 МПа 10 сеансов 1 390 4 1,0±0,5 480 1 0,2±0,2 >0,5 2 440 7 1,6±0,6 573 16 2,8±0,7 <0,01 >0,5 3 480 15 3,1±0,8 530 52 9,8±1,3 <0,01 <0,001 Всего 1310 26 2,0±0,4 <0,05 1583 69 4,4±0,5 <0,001 <0,001 0,2 МПа 10 сеансов 1 400 4 1,0±0,5 590 8 0,4±0,3 >0,5 2 400 1 0,3±0,2 470 3 0,6±0,4 >0,5 3 420 2 0,5±0,3 566 22 3,9±0,8 <0,001 Всего 1220 7 0,6±0,2 >0,5 1626 33 2,0±0,3 <0,001 <0,001 Примечание: Рк – достоверные отличия по отношению к контролю; Р1–2 – достоверные отличия между уровнем АХр первого и второго мейотического деления. № варианта Число анафаз в 1-м мейозе 334 430 1724 АХр±m, % Как видно из представленных результатов, все исследуемые режимы ГБО-терапии вызывают аберрации хромосом в половых клетках крыс. При этом их уровень в сперматоцитах II порядка значительно выше чем в сперматоцитах I порядка и сперматогониях. Исключение составляет режим 0,12 МПа 4 сеанса при котором не регистрируются достоверные отличия в образовании АХр. Во всех вариантах опыта регистрировали достаточно широкие пределы варьирования клеток с АХр во втором мейотическом делении у разных животных. Во всех вариантах опыта между минимальными и максимальными значениями регистрировались достоверные отличия (Р<0,001). После давления 0,12 МПа у животных, прошедших 4 сеанса, спектр АХр практически не отличается от спонтанного. Увеличение числа сеансов до 10 сопровождается увеличением клеток с фрагментами хромосом. Совершенно иная картина наблюдается во 2-м мейотическом делении. Увеличение аберрантных клеток связано с увеличением хроматидных мостов и клеток с множественными хромосомными аберрациями. Анализируя клетки с множественными хромосомными аберрациями, мы обратили внимание на тот факт, что в этих клетках практически отсутствуют множественные фрагменты хромосом и в основном они связаны с наличием двух, реже трех хроматидных мостов (рис. 4.1, а, б). Сравнивая индивидуальную чувствительность соматической ткани (костный мозг) и генеративной, мы провели факторный анализ. В таблице 4.3 представлены результаты факторного анализа индивидуальной чувствительности различных тканей крыс на воздействие ГБО-терапии. 50 а б Рис. 4.1. Анафазы с хроматидными мостами семяродного эпителия крыс, прошедших курс ГБО – 0,2 МПа–1ч: а – 4 сеанса; б – 10 сеансов Таблица 4.3 Факторные нагрузки на различные этапы сперматогенеза крыс после воздействия ГБО Этапы сперматогенеза Костный мозг Мейоз (1-е деление) Мейоз (2-е деление) Фактор 1-й 0,5702 0,1724 0,4358 2-й 0,2136 0,5987 0,3751 На первый фактор приходится 93 % от общей дисперсии, а на второй – 7 %. Мы определяем первый фактор как фактор «повреждения хроматид» и выделяем его как наиболее ведущий в ответе на воздействие гипербарической оксигенации при моделировании терапевтических режимов. В таблице 4.4 приведены результаты сравнительного анализа цитогенетических последствий в клетках костного мозга различных животных. Как видно из данных таблицы 4.4, крысы более чувствительны к воздействию кислорода, чем мыши. Использование чистых линий как крыс так и мышей не приводило к значительному индивидуальному разбросу АХр внутри каждого из вариантов. В случае использования беспородных животных и крыс линии Вистар у некоторых животных после действия ГБО уровень АХр в пролиферирующих тканях не отличался от спонтанного, в то время как у других значительно его превышал. У мышей линии СВА×С7BL/6 не были зафиксированы достоверные отличия между результатами контроля и опыта не только в клетках костного мозга, но также и в генеративных клетках (табл. 4.5). 51 Таблица 4.4 Уровень аберраций хромосом в клетках костного мозга различных животных после обработки их терапевтическими режимами повышенного давления кислорода Животные Вариант Контроль 0,2МПа–5 с Контроль Время АХр±m, % 0,4±0,25 Мыши линии CBAxC7BL/6 24 ч 0,6±0,18 1,1±0,26 Беспородные 24 ч 11,1±1,38 мыши (белые) 0,2 МПа–5 с 5 сут. 1,2±0,34 Контроль 0,7±0,38 Крысы линии 0,2 МПа – 4 с 24 ч 3,9±0,81 Вистар (белые) 0,2 МПа – 10 с 24 ч 4,7±0,53 Контроль 3,7±0,54 Беспородные бе24 ч 16,1±1,38 лые крысы 0,2 МПа–5с 5 сут. 7,4±1,05 Примечание: Р – достоверные отличия по отношению к собственному контролю. Р >0,1 <0,001 >0,1 <0,001 <0,001 < 0,01 < 0,01 Таблица 4.5 Цитогенетические последствия в генеративной ткани мышей линии CBA×C7BL/6 после обработки терапевтическими режимами ГБО № варианта Число анафаз в 1-м мейозе С АХр АХр ± m, % 1 300 2 0,7±0,5 2 230 2 0,9±0,6 Всего 530 4 0,8±0,4 1 114 0 0 2 177 2 3 160 4 5 Число анафаз Рк во 2-м мейозе Контроль 200 С АХр АХр ±m, % 1 0,5±0,2 260 2 0,8±0,6 460 3 0,7±0,2 161 0 0 1,1±0,78 212 1 0,5±0,5 0 0 145 3 2,0±1,20 250 2 0,4±0,39 200 2 1,0±0,70 303 2 0,7±0,48 200 1 0,5±0,49 6 270 2 0,7±0,47 >0,1 254 2 0,8±0,55 Всего 1274 8 0,6±0,22 >0,1 1172 9 0,8±0,26 1 150 2 1,3±0,92 190 1 0,5±0,51 2 128 0 0 167 0 0 3 148 0 0 232 0 0 4 500 3 0,6±0,35 200 0 0 5 358 2 0,6±0,41 250 3 1,2±0,7 6 320 0 0 223 2 0,9±0,6 Всего 1604 7 0,4±0,16 1262 6 0,4 ±0,2 >0,1 Рк Р1–2 >0,1 0,12 МПа–1 ч, 5 сеансов >0,1 >0,1 0,2 МПа–1 ч, 5 сеансов >0,1 Примечание: Р – достоверные отличия по отношению к собственному контролю. 52 >0,1 >0,1 Различия в реакции генома на повышенное воздействие кислорода, наблюдаемое в наших экспериментах, возможно являются проявлением различной видовой чувствительности к окислительному стрессу, которые определяются генетически детерминированными свойствами клеточных мембран и функциональным состоянием про- и антиоксидантных систем. В наших исследованиях на животных показана способность терапевтических режимов индуцировать повышенный уровень АХр в анафазах пролиферирующих тканей. Для более детального анализа цитогенетических последствий воздействия ГБО в некоторых случаях был проведен метафазный анализ. Условия проведенных эксперимента и полученные нами данные представлены в таблице 4.6. Таблица 4.6 Распределение уровня поврежденных метафаз (из 600 проанализированных) при фракционированной и пролонгированной обработке ГБО (0,2 МПа) Условия опыта 1ч 5ч 5ч 1ч, 5 сеансов 1ч, 5 сеансов 1ч, 10 сеансов 10 ч 10 ч Контроль Время после обработки, сут. Метафазы с перестройками m, % Разрывы центромер Полиплоиды, % 1 1 5 1 5 1 1 10 4,5 0,8 5,8 0,9 10,8 1,3 33,3 1,9 16,6 1,5 37,5 1,9 9,3 1,1 14,8 1,4 4,7 0,8 1,5 2,5 18,3 5,6 14,6 7,8 31,0 2,7 0 0 0,5 3,4 4,0 1,0 3,5 0,5 0 0 Анализ метафазных пластинок костного мозга крыс позволяет выявить некоторые особенности возникновения перестроек хромосом, обусловленные временем воздействия изучаемого фактора. Так, обработка животных 0,2 МПа в течение 1 или 5 ч не вызывает у животных увеличения количества аберраций по сравнению с контролем. Однако продление экспозиции до 10 ч приводит к достоверному их увеличению через 24 ч после окончания сеанса. Высокий уровень перестроек сохраняется у этих животных в течение последующих 10 суток, что указывает на наличие механизмов, поддерживающих процесс деструкции генетического материала в течение столь длительного времени (Гуськов и др., 1989 г). Через 5 дней после 5-часовой экспозиции животных при 0,2 МПа уровень перестроек хромосом вдвое превышает контроль и не отличается по количеству аберраций от 10-часовой экспозиции. Фракционирование дозы дает совсем иную картину цитогенетических последствий ГБО. Ежедневные 1-часовые сеансы вызывают резкий подъем количества клеток, несущих аберрации, причем он составил 30 % от общего числа клеток независимо от количества проведенных сеансов (5 или 10). Спустя 5 дней после окончания сеансов уровень аберраций снижается, однако продолжает сохраняться на весьма высоком уровне по сравнению с контролем. При этом количество перестроек соответствует уровню, зафиксированному через 10 суток после однократного воздействия в течение 10 ч ГБО. Таким образом, фракционирование ГБО вызывает более сильный цитогенетический эффект, чем однократная пролонгированная обработка. 53 Непрерывная обработка животных в течение 5 и 10 ч вызывает увеличение общего числа анафаз с повреждениями, в то время как сразу после окончания фракционирования дозы, наряду с увеличением общего количества перестроек, возрастает количество клеток с множественными аберрациями. Увеличение количества аберрантных метафаз и клеток-мишеней идет по типу неспецифического усиления кластогенеза. После фракционирования дозы фиксируются перестройки хромосом, в основном обменного типа – дицентрики, транслокации (чаще робертсоновские), центрические кольца, а после пролонгированной обработки – увеличивается относительная частота хромосомных разрывов. Спустя несколько суток после окончания ГБО обращает внимание резкое увеличение количества хроматидных разрывов, в то время как частота перестроек обменного типа практически не меняется. Такое увеличение аберраций данного типа достаточно неожиданно и причины его требуют серьезного анализа. Характер аберраций после пролонгированного и однократного воздействия ГБО свидетельствует о сложной кинетике их становления. Первичная индукция перестроек хромосом инициируется сходными или идентичными механизмами, обусловленными ГБО, но последующие этапы становления перестроек, особенно спустя некоторое время после окончания воздействия, вероятно, имеют различную природу после однократного и фракционированного воздействия. Усиление цитогенетического эффекта ГБО фракционированием может быть связано с принудительными колебательными процессами метаболизма в тканях и клетках животных. Известно, что живые системы содержат значительное количество прооксидантов. Повышенное давление кислорода приводит их в активное состояние, которое до некоторой степени нейтрализуется при длительной экспозиции включением защитных механизмов, в частности существенная роль отводится восстановленным тиолам и СОД. Возможно, что ежедневная обработка в течение нескольких суток включает системы переокисления, однако они являются недостаточными для запуска механизма защиты. Ранее было показано, что если СОД вводили через 8 ч. после действия цитостатиков, способных активировать процессы радикалообразования, то ее защитное действие не проявлялось (Greenlund et al., 1995). Вполне возможно, что одинаковый уровень перестроек хромосом после 5 и 10 сеансов связан с наступлением определенного равновесия между окислительно-восстановительными реакциями, после которого увеличение числа сеансов не увеличивает мутагенного эффекта. В пользу этого предположения свидетельствует и снижение уровня перестроек хромосом спустя некоторое время после окончания фракционирования. Таким образом, лабораторные исследования выявили следующие терапевтические режимы ГБО: – при давлении 0,12 МПа не индуцируют мутагенного эффекта в соматических и генеративных клетках животных; – увеличение давления до 0,2 МПа уже через 4 сеанса приводит к достоверному увеличению выхода АХр в клетках костного мозга и сперматоцитах второго порядка; – реакция на ГБО зависит от индивидуальных и видовых особенностей организма; генотип мышей более устойчив к действию окислительного стресса по сравнению с крысами; – фракционирование дозы дает более значительный эффект, чем однократная обработка в течение того же времени; – метафазный анализ выявил, помимо обычно встречающихся АХр, необычные, ранее не описанные изменения в морфологии хромосом – круглые неокрашенные тельца, 54 располагающиеся чаще в районах центромер и названные нами «линзами». Встречались метафазы с преждевременной конденсацией хроматид, нерасхождением хроматид, хромосомами с концевыми слияниями (юнионами), а также эндоредупликации; – после однократной обработки спустя значительное количество времени наблюдается тенденция к усилению эффекта; – усиление эффекта наблюдается за счет возрастания хроматидных разрывов в клетках костного мозга и хроматидных обменов в семенниках. Полученные данные свидетельствуют о неоднозначном и достаточно сложном процессе формирования мутаций в условиях активизации широкого спектра активных метаболитов кислорода. 4.2. О возможных механизмах цитогенетического эффекта ГБО на организм животных Постулат об общности механизмов первичного поражения ионизирующей радиации и ГБО, высказанный первоначально на основе сходства физиологических реакций организма на эти агенты (Gerschman et al., 1954), получил свое развитие в модельных и системных экспериментах, изучавших биохимическую и физико-химическую кинетику поражения биополимеров и вклад этих процессов в развитие токсического эффекта кислорода. Показано, что после ГБО, как и после радиационного воздействия, появляются свободные радикалы, способные эффективно рвать нить ДНК. Свободные радикалы инициируют процессы перекисного окисления, приводящие к разрушению мембран клетки и деструкции метаболизма (Kjekshus et al., 1980). Однако даже априорный анализ первичного действия этих факторов на клетку свидетельствует о существенных их различиях. В литературе существует большое количество сведений о действии квантов энергии на различные компоненты клетки. Физиологическая теория радиационного поражения не опровергла, а дополнила и расширила теорию мишени (Лобашев, 1975; ТимофеевРессовский, 1980). Несомненно, что пострадиационная гибель делящихся тканей обусловлена, в первую очередь, прямым попаданием ионизирующих частиц в ядра клеток облученного. Кислород и его агрессивные радикалы, именно благодаря своей агрессивности, активно вступают во взаимодействие с различными компонентами сильно развитой сети внутриклеточных мембран, что в значительной степени понижает опасность прямого контакта свободных радикалов с генетическим материалом клетки, поэтому степень деструкции ДНК, видимо, зависит от внутриклеточного напряжения кислорода и в большей степени должна коррелировать не с уровнем давления кислорода, а временем пребывания организма в его среде. В этой связи при действии ГБО важнейшая компонента радиации – разрушение генетического материала прямым попаданием квантов энергии в ядро – вероятно, не имеет места. На многочисленных организмах показано, что цитостатический эффект ГБО в различных тканях зависит от их особенностей потребления кислорода. Так, ГБО снижает число колоний опухоли в легочной ткани, однако те же режимы практически не эффективны для опухолей молочных желез (Shewell, Thompson, 1980). Особенности строения и функционирования отдельных систем организма позволяют свести до минимума возможность прямого контакта ГБО и его интермедиаторов с генетическим аппаратом. В этой связи кратковременные высокие давления более токсичны для периферических систем организма, а длительные низкие давления более опасны для глубинных структур целостного организма. Однако против представления о непосредственном контакте ГБО с хроматином как основной непосредственной причиной индукции перестроек хромосом 55 свидетельствуют результаты выше описанных экспериментов. Так, было показано, что воздействие 0,25 МПа в течение 1 и 5 ч не вызывает цитогенетического эффекта в первые сроки фиксации после ГБО в клетках костного мозга или роговице. Генетические последствия значительно отдалены от окончания сеанса. В то же время фракционирование дозы по 1 ч в течение 5 сут. вызывает значительный подъем уровня перестроек. Логично предположить, что концентрация кислорода в крови должна зависеть от продолжительности сеанса, и следовало бы ожидать большего эффекта ГБО после пролонгированного, нежели после фракционированного эффекта, и именно такие результаты были получены при сравнении однократного и фракционированного действия малых доз радиации (Киссельгоф, 1975; Косиченко и др., 1984). Это свидетельствует еще об одном весьма существенном различии генетических механизмов поражения после ГБО и радиации. После фракционирования дозы ГБО в действие вступают более мощные механизмы индукции хромосомных аберраций, чем после пролонгированной обработки. Значительную трудность для интерпретации представляет факт усиления цитогенетических последствий ГБО в отдаленные сроки после однократного воздействия. Поскольку по изложенным выше соображениям возможность прямого действия кислорода на клетки костного мозга не велика, можно полагать, что перестройки хромосом, особенно хроматидные разрывы возникают в результате каких-то опосредованных процессов. Нет сомнения в том, что в отдаленные сроки после ГБО измененный под его воздействием метаболизм приводит, с одной стороны, к накоплению каких-то продуктов, вызывающих цитогенетический эффект, в частности перекисей или продуктов перекисного окисления, с другой стороны – обусловливает нарушение репаративных систем, изменение энергетики, дефицит соединений, необходимых для нормального метаболизма, изменение активности ферментов и т.д. (Кричевская и др., 1980). В частности, было показано, что после ГБО изменяется уровень ряда гормонов у животных, а измененный гормональный статус может быть причиной увеличения мутабильности хромосом в клетках периферической крови (Лебедева, Скорова, 1985). Исследования, проведенные на кафедре биохимии РГУ, показали, что воздействие на животных 0,3 МПа ГБО в течение 60 мин вызывает значительное увеличение гистамина в крови. Увеличение экспозиции до 120 мин сглаживает индивидуальные различия по уровню содержания гистамина, а общая гистаминемия составляет 240 % по отношению к контролю, причем эта концентрация сохраняется в кровеносном в течение значительного времени (Ходакова и др., 1980). В то же время в модельных экспериментах на фибробластах было показано, что повышенная концентрация гистамина, соответствующая той, которая выявляется у человека, попавшего в условия стресса, оказывает весьма значительный цитогенетический эффект (Керкис, Скорова, 1977). Возможно, что наблюдаемый после ГБО мутагенез имеет в своей основе и эту причину. Весьма правомерно выглядит гипотеза активации лизосомальных ферментов после воздействия ГБО (Гуськов, 1975; Гуськов и др., 1985б). Эта гипотеза была предложена и для объяснения повышения частоты аберраций после введения химических соединений, вызывающих лабилизацию мембран лизосом (Cohen, Hirschorn, 1971). Ранее было показано, что активация лизосомальных ферментов усиливает мутационный процесс, а стабилизация мембран лизосом снижает его (Allison, Paton, 1965; Aula, Nichols, 1968). Добавление экзогенных ДНКаз вызывает поломки хромосом в культуре легочных клеток человека, и разрывы фиксируются значительное время спустя после окончания обработки (Paton, Allison, 1970, 1974). Освобождение гидролаз после ГБО было показано на разных тканях животных (Лукаш и др., 1975; Кричевская и др., 1980). 56 Возможно, что повышение концентрации гидролаз в крови после ГБО также может быть причиной поддержания высокого уровня перестроек хромосом в отдаленные сроки воздействия после ГБО. То, что ГБО демонстрирует свойства непрямого мутагена, а опосредуется и активируется метаболизмом, в большей степени сближает его с химическими мутагенами, чем с радиацией. Резюмируя сказанное выше, следует еще раз подчеркнуть данные, полученные в наших экспериментах, которые противоречат гипотезе общности механизмов действия радиации и ГБО на генетический аппарат: а) выход перестроек хромосом, возникших de novo, продолжается значительное время спустя после окончания ГБО; б) уровень их практически не зависит от давления и времени воздействия; в) фракционирование дозы вызывает более сильный эффект, чем однократная обработка в течение того же времени, а однократная обработка обусловливает усиление цитогенетического эффекта во времени за счет увеличения частоты хроматидных разрывов, а не за счет перестроек обменного типа. 4.3. Действие ГБО на клетки периферической крови человека Описанные выше эксперименты на животных четко свидетельствуют о том, что ГБО, моделирующая клинические ситуации, вызывает достоверный цитогенетический эффект в клетках костного мозга крыс. Безусловно, полученные результаты требуют дальнейшего анализа и поисков конкретных механизмов действия ГБО на клетки млекопитающих. Тем не менее важность полученных результатов в значительной мере зависит от степени их соответствия потребностям практики и, в частности, медицинской. Несмотря на самое широкое применение метода ГБО в клинике, до настоящего момента в литературе отсутствуют сведения о влиянии ГБО на генетический аппарат клеток человека. В этой связи, прежде чем продолжить исследования действия ГБО на модельных объектах, возникла настоятельная необходимость проверить последствия его действия у лиц, проходивших сеансы ГБО-терапии. 4.3.1. Цитогенетические последствия ГБО-терапии Материалом для анализа служила кровь больных в возрасте от 28 до 59 лет, страдавших различными заболеваниями. Все пациенты проходили курс ГБО-терапии в Областной больнице г. Ростова-на-Дону (зав. отд. О.М. Золотарев) и городской больнице № 20 г. Ростова-на-Дону (зав. отд. Г.Г. Жданов) в режиме 0,15–0,2 МПа, 9–10 сеансов по 50–60 мин ежедневно в барокамере «ОКА-МТ». Время компрессии и декомпрессии – 15 мин. Кровь для исследования брали до первого сеанса ГБО (контроль), и после последнего сеанса; у некоторых пациентов также и после 3-го сеанса. Кровь культивировали по стандартной методике Мурхеда (1960). Фиксировали культуру через 72 и 96 ч после введения фитогемагглютинина. Полученные данные, представленные в таблице 4.7, показывают, что уровень перестроек хромосом в контроле совпадает с данными литературы по спонтанному мутационному процессу (Бочков и др., 1972; Gundy, Varga, 1983; Richardson et al., 1984). Нами не было обнаружено достоверных различий в контроле между пациентами в зависимости от пола, возраста или характера заболевания. После ежедневного сеанса ГБО 1,14–0,15 МПа, 40 мин в течение 10 сут. уровень аберраций в клетках лимфоцитов периферической крови значительно возрос и почти достиг того уровня, который зарегистрирован на костном мозге у животных (Guskov et al., 1997; Kazantseva et al., 1997). Это указывает 57 на сопоставимость результатов цитогенетического анализа последствий ГБО, полученных на экспериментальных животных и на человеке. В процессе анализа у пациентов были обнаружены индивидуальные вариации чувствительности к ГБО как по уровню аберраций, так и по их характеру (Гуськов и др., 1989 г). В метафазах пациента А-ова обнаружены метафазы с множественными хроматидными пробелами, у С-вой свыше 60 % аберраций было представлено обменами хромосом. Хроматидные обмены после ГБО отмечены у трех пациентов. Таблица 4.7 Перестройки хромосом в культуре лимфоцитов периферической крови у пациентов, прошедших курс ГБО-терапии (Гуськов и др., 1990б) Метафазы Доля Вариант Количество Количество с переповреждеисследоваметафаз перестроек стройками ний ния m, % на 1 кл. Контроль 448 66 1,33 0,56 0,76 ГБО (10 778 157 20,05 1,43 1,28 сеансов) хроматидные Разрывы 25 Тип перестроек хромосомные разрывы 55 обмены 46,5 20,7 23,8 20 У всех больных были обнаружены полиплоидные клетки. Характерно, что, как правило, в аберрантных метафазах встречается более чем одно нарушение. Так как ни в отечественной, ни в мировой литературе нет данных ни о цитогенетических, ни о популяционных последствиях ГБО-терапии, представленные здесь предварительные данные внушают серьезную тревогу в отношении неограниченных возможностей применения ГБО-терапии и, судя по полученным цитогенетическим результатам, по способности вызывать перестройки их вполне можно сопоставить с ионизирующей радиацией. Полученные нами клинические результаты требуют проведения широкомасштабных исследований в этой области медицины, накопления результатов и выявления конкретных механизмов, знание которых поможет в поисках эффективных протекторов от неблагоприятных последствий ГБО-терапии. Следует отметить, что повышение уровня перестроек хромосом выявлено на фоне общего объективного улучшения самочувствия пациентов после окончания курса оксибаротерапии. В результате проведенного лечения состояние 4 больных значительно улучшилось. У больного с язвенной болезнью исчезли боли и отмечено заживление язвенного дефекта, что подтверждено данными фиброгастроскопии, инфекционный репаратит протекал у него в легкой форме. У больных с церебральным ревмоваскулитом и нарушением мозгового кровообращения исчезли головные боли и головокружения, стабилизировалась гемодинамика, а у больного с облитерирующим атеросклерозом нижних конечностей исчезли боли в покое и значительно уменьшились при ходьбе, нормализовался сон. Положительного эффекта не получено только при бронхиальной астме, возможно, ввиду отмены кортикостероидных гормонов, которые больной получал длительное время. Для оценки длительности сохранения последствий ОБТ у 4 пациентов была взята кровь для цитогенетического анализа через 9 месяцев после проведенного курса лечения. После окончания курса ОБТ у 3 доноров сохраняется достоверное увеличение количества клеток с аберрациями по сравнению с контролем, причем, как и сразу после окончания курса, перестройки хромосом представлены главным образом разрывами, а не обменами. 58 4.3.2. Индивидуальная чувствительность к действию ГБО периферической крови интактных доноров Проблема индивидуальной чувствительности к ГБО является также важной клинической проблемой, поиски критериев чувствительности к ГБО сегодня оказались на передовом рубеже ГБО-терапии (Лукаш и др., 1975). Предварительные сведения об индивидуальной чувствительности разных пациентов к действию ГБО, представленные в предыдущем разделе, нуждаются в дальнейшем уточнении, так как она может зависеть и от внешних и от внутренних факторов. Для оценки индивидуальных различий в чувствительности к ГБО была взята периферическая кровь у 7 практически здоровых мужчин в возрасте от 20 до 40 лет. Цельную кровь обрабатывали при 0,7 МПа кислородом в течение 1 ч. Результаты цитогенетического анализа представлены в таблице 4.8. Таблица 4.8 Распределение уровня поврежденных метафаз в различных клеточных линиях лимфоцитов крови доноров после обработки ГБО Испытуемый 1 2 3 4 5 6 7 Варианты исследования контроль 0,7 МПа–1 ч контроль 0,7 МПа–1 ч контроль 0,7 МПа–1 ч контроль 0,7 МПа–1 ч контроль 0,7 МПа–1 ч контроль 0,7 МПа–1 ч контроль 0,7 МПа–1 ч КолиМетафазы чество с перестройанализир. ками m, % метафаз 100 0 123 11,0 2,8 100 0 42 17,5 6,5 100 2,0 1,4 83 15,6 4,1 77 6,5 2,8 138 11,6 2,7 100 0 85 12,8 3,6 100 6,4 2,4 100 18,0 3,8 100 0 100 19,9 3,9 Ср. доля поврежд. на 1 кл. 0 1,66 0 1,57 1,0 1,33 1,1 1,63 0 2,0 1,1 1,6 0 1,8 АХр, от общего числа обменно го типа 0 39 0 76,6 50 37,5 16,6 33,5 0 0 33,5 50,0 0 0 разрывы Полиплоидные клетки, % 0 61 0 23,4 50 62,5 83,4 66,5 0 100 66,5 50,0 0 100 0 0 0 0 0 0 0 2,9 0 0 0 0 0 0 Как видно из таблицы, у трех доноров оказался относительно высокий процент перестроек в контроле и варьировал от 2 до 6 %. После обработки крови ГБО у всех клеточных популяций количество перестроек резко возрастало, однако достоверных различий между вариантами не обнаружено. Обращает внимание то, что у двух доноров полностью отсутствовали аберрации обменного типа. В этих же вариантах отмечена самая высокая доля повреждений на одну аберрантную клетку. У одного из доноров 80 % клеток в большинстве метафазных хромосом несли множественные хроматидные пробелы. У одного из доноров после обработки лимфоцитов ГБО в диплоидных клетках количество нарушений не отличалось от контроля, несшего 6 % перестроек, и в то же время выявлены полиплоидные клетки со множественными перестройками хромосом. Для всех исследованных индивидуумов характерно высокое содержание разрывов хромосом, составившее 50 % от общего числа аберраций. Таким образом, можно резюмировать, что обработка крови in vitro у доноров разных генотипов не обнаруживает существенных различий по уровню перестроек хромосом, а различия по характеру перестроек не столь существенны, чтобы 59 по ним можно было судить о специфической реакции нормальных клеток генетически разного происхождения на ГБО. Схема формирования индивидуального ответа генома на воздействие гипероксий приведена на рисунке 4.2. ȽɂɉȿɊɈɄɋɂə ɋɜɨɛɨɞɧɵɟɪɚɞɢɤɚɥɵɤɢɫɥɨɪɨɞɚ Ⱥɬɚɤɚɉɟɪɟɤɢɫɧɨɟɨɤɢɫɥɟɧɢɟ ɧɭɤɥɟɨɩɪɨɬɟɢɞɨɜɥɢɩɢɞɨɜɦɟɦɛɪɚɧȻɟɥɤɢ ɊɚɡɪɭɲɟɧɢɟɦɟɦɛɪɚɧɆȾȺȺɧɬɢɨɤɫɢɞɚɧɬɵȺɤɬɢɜɚɰɢɹ ɷɧɞɨɧɭɤɥɟɚɡ ɂɧɬɟɪɮɚɡɧɨɟ Ɇɢɬɨɯɨɧɞɪɢɢ əɞɪɨ ɗɌɐ ȼɧɟɷɪɢɬɪɨɰɢɬɚɪɧɵɣ ɝɟɦɨɝɥɨɛɢɧ ɋɜɨɛɨɞɧɵɟ ɪɚɞɢɤɚɥɵ Ⱦɨɩɨɥɧɢɬɟɥɶɧɵɣ ɢɫɬɨɱɧɢɤɚɧɬɢɨɤɫɢɞɚɧɬɨɜ ɉɨɜɪɟɠɞɟɧɢɟ ɦɢɬɨɬɢɱɟɫɤɢɯɯɪɨɦɨɫɨɦ Ⱥɩɨɩɬɨɡ ɇɟɤɪɨɡ ɍɫɬɨɣɱɢɜɨɫɬɶɑɭɜɫɬɜɢɬɟɥɶɧɨɫɬɶ ɂɧɞɢɜɢɞɭɚɥɶɧɵɟɝɟɧɨɬɢɩɢɱɟɫɤɢɟɨɫɨɛɟɧɧɨɫɬɢ Рис. 4.2. Схема формирования индивидуального ответа генома на воздействие гипероксии 60 4.4. Влияние гипербарии на геном человека Пребывание человека в ситуациях, которые являются для организма необычными, т. е. эволюционно новыми, как правило, вызывает в организме стрессовую реакцию. Последствия этой реакции можно выявить на различных уровнях – от молекулярного до системного. К таким эволюционно новым ситуациям можно отнести пребывание человека в измененной газовой атмосфере. Освоение мирового океана практически невозможно без длительного пребывания человека под давлением. Среди многочисленных факторов водолазного спуска, влияющих на развитие патологических процессов в организме, основное место занимает молекулярный кислород. В эксперименте принимали участие две группы доноров: практически здоровые мужчины в возрасте 18 лет, не имевшие опыта подводных погружений; профессиональные водолазы в возрасте от 25 до 35 лет, имевшие стаж подводных работ 5–15 лет и общее число спусковых часов от 700 до 7 600, которые погружались последний раз более чем за год до проведения исследований. Исследовали число аберраций хромосом в клетках лимфоцитов периферической крови до и после экспериментальных погружений (Шкурат, 1999). Результаты анализа цитогенетических последствий пребывания испытуемых, ранее не принимавших участия в водолазных спусках, в условиях повышенного давления кислорода, приведены в табл. 4.9. Таблица 4.9 Частота лимфоцитов крови с хромосомными аберрациями у практически здоровых испытуемых в условиях повышенного давления кислорода, % Испытуемый До погружения (контроль) 1 2 3 4 5 6 7 4,0 ± 2,3 6,6 ± 2,5 9,0 ± 2,9 6,0 ± 2,1 3,0 ± 2,4 4,4 ± 1,3 0 In vivo ( 0,25 МПа, 20 мин) через 20 мин через 1 год после после погружения погружения 13,0 ± 3,2 6,0 ± 2,3 21,0 ± 4,2 9,0 ± 2,8 17,0 ± 4,0 12,3 ± 4,6 26,0 ± 3,4 20,6 ± 3,0 10,0 ± 1,4 8,0 ± 2,2 24,0 ± 2,6 21,2 ± 6,6 16,3 ± 3,2 2,7 ± 1,6 Число аберраций хромосом в лимфоцитах периферической крови, взятой до погружения, варьирует в пределах спонтанной нестабильности хромосом, известных из данных литературы (Бочков и др., 1972; Gundy, Varga, 1983; Joenje, Oostra, 1986.) После пребывания в среде чистого кислорода у всех испытуемых зарегистрировано достоверно увеличенное число клеток с аберрациями, которое сохраняется у некоторых индивидуумов в течение года. Как видно из таблицы 4.10, число клеток с аберрациями хромосом в контрольных пробах у профессиональных водолазов не зависело от времени (ч), проведенного на грунте, и не отличалось от интактного контроля. После окончания погружения у всех испытуемых число клеток с аберрациями хромосом значительно возросло и варьировало в широких пределах – от 10 до 71 %. Результаты, приведенные в табл. 4.10, демонстрируют некоторую тенденцию к повышению нестабильности генома у людей, которые провели на грунте более 1000 ч, хотя прямой зависимости между временем пребывания на грунте и числом клеток с аберрациями не прослеживается. 61 Ƚɢɩɟɪɛɚɪɢɹ ɁɚɦɤɧɭɬɨɟɉɨɧɢɠɟɧɢɟpO2 ɂɧɟɪɬɧɵɟȼɵɫɨɤɨɟ ɩɪɨɫɬɪɚɧɫɬɜɨɬɟɦɩɟɪɚɬɭɪɵɝɚɡɵɞɚɜɥɟɧɢɟ Ⱥɡɨɬɧɵɣ ɋɬɪɟɫɫȽɢɩɨɤɫɢɹɇɋȼȾɧɚɪɤɨɡ ȺɎɄ ɂɡɦɟɧɟɧɢɟɦɟɬɚɛɨɥɢɡɦɚ Ʌɢɩɢɞɵȼɨɞɧɨ-ɫɨɥɟɜɨɣȻɟɥɤɢ ɛɚɥɚɧɫɞɟɝɪɚɞɚɰɢɹ ɍɫɢɥɟɧɢɟɉɈɅɇɚɪɭɲɟɧɢɟɆɟɬɚɥɥɨɩɪɨɬɟɢɧɵ ɦɟɬɚɛɨɥɢɡɦɚɋɚ «ȼɨɞɧɨ-ɝɟɥɢɟɜɚɹ Ƚɟɧɟɪɢɪɨɜɚɧɢɟ ɤɨɪɪɨɡɢɹªɦɟɦɛɪɚɧɈɇ. Ɏɟɪɦɟɧɬɵ ɗɌɐɞɟɝɪɚɞɚɰɢɹ ȾɇɄ ɋɬɟɩɟɧɶɝɢɞɪɨɮɨɛɧɨɫɬɢɉɨɥɢɦɨɪɮɢɡɦ ɢɭɩɨɪɹɞɨɱɟɧɧɨɫɬɢɦɟɦɛɪɚɧɛɟɥɤɨɜ ɂɧɞɢɜɢɞɭɚɥɶɧɵɟɝɟɧɨɬɢɩɢɱɟɫɤɢɟɨɫɨɛɟɧɧɨɫɬɢ Рис. 4.3. Схема формирования индивидуального ответа генома на воздействие гипербарии 62 Таблица 4.10 Частота лимфоцитов крови с хромосомными аберрациями у водолазов с разным стажем подводных работ, % Общий стаж работы под водой у разных водолазов 700 ч 800 ч 1000 ч 2 500 ч 4 000 ч 7 000 ч 7 600 ч 1-й водолаз 2-й водолаз 3-й водолаз 4-й водолаз До погружения (контроль) 0 6,4 ± 3,5 2,1 ± 0,6 6,9 ± 2,5 4,3 ± 2,0 0 6,5 ± 2,8 7,6 ± 4,0 4,5 ± 3,3 7,0 ± 2,9 In vivo (1,1МПа, воздух) 11,6 ± 2,7 10,0 ± 6,3 41,0 ± 5,9 23,0 ± 4,2 20,3 ± 2,9 18,6 ± 4,0 27,6 ± 4,1 71,0 ± 7,6 28,3 ± 4,5 56,0 ± 7,6 Через 3 месяца После погружения – – 9,0 ± 2,86 – 20,1 ± 2.5 – 21.2 ± 4.2 20,4 ± 3,0 – – Число клеток с АХр после пребывания в условиях сжатого воздуха увеличилось в среднем у всех участников практически вдвое, по сравнению с группой, которая подвергалась на протяжении этого же времени воздействию чистого кислорода. При этом увеличилось число клеток со множественными аберрациями хромосом. Сохранение большого числа аберраций хромосом спустя продолжительное время после окончания погружений может иметь не благоприятные последствия для целостного организма, связанные со снижением иммунной резистентности, в связи с уменьшением числа нормально функционирующих лимфоцитов, а также с возможностью повышения риска малигнизации клеток из-за персистирования аберраций обменного типа. Таким образом, полученные результаты свидетельствуют о том, что интактная популяция человека характеризуется значительной вариабельностью реакции генома соматических клеток на повышенное давление кислорода и воздуха. В связи с этим возникает необходимость использования тестов, позволяющих выявить группу повышенного генетического риска с высокой чувствительностью генома к экстремальным факторам среды. Одним из таких тестов может быть оценка числа аберраций хромосом клеток периферической крови, обработанной in vitro повышенным давлением кислорода, который способен дать прогноз индивидуальной чувствительности организма к некоторым факторам водолазного спуска до погружения. Схема формирования индивидуального ответа генома на воздействие гипербарии приведена на рисунке 4.3. 4.5. Сравнительная чувствительность генеративной и соматической тканей к действию мутагенов Анализируя результаты последействия ГБО на генеративную ткань, можно предполагать несколько причин отсутствия неблагоприятного эффекта данного мутагена на сперматогенез. Во-первых, генеративная система мощно защищена гематотестикулярным барьером, который препятствует проникновению мутагена или его производных, способных нарушить целостность генетического аппарата. Следующая причина, возможно, связана с усилением репаративных процессов. Кроме того, объясняя факт отсутствия специфических эффектов в гонадах, нельзя исключить зиготический отбор, эффективность которого была показана при исследовании радиационного воздействия на млекопитающих. Так, гамма-лучи в дозе 100 рад убивают свыше 95 % дифференцирующихся сперматогониев у мышей, но стерильности самцов при этом не наблюдали (Oakberg, 1957), в то время как 63 облучение спермы и оплодотворение ею in vitro вызывает аберрации хромосом экспоненциально дозе (Matsuda et al., 1985). Нами показано, что ГБО не индуцировала доминантных леталей и не оказывала гонадотоксического действия, что проявилось в отсутствии роста эмбриональной смертности, а также в том, что ни один из функциональных и морфологических показателей сперматогенеза у опытных животных не изменился после окончания сеансов. Эксперименты, проведенные на бараньих сперматозоидах, свидетельствуют об их высокой устойчивости к ГБО. Авторы установили, что давление кислорода 0,5 и 0,7 МПа значительно укорачивает время подвижности сперматозоидов, в то время как аналогичные условия гипербарии в атмосфере чистого азота показывают результаты, не отличающиеся от условий нормобарии и нормоксии; давление 0,3 МПа и ниже вообще не оказывает влияния ни на один из изученных авторами показателей. Отсюда следует, что возможность ДНК-тропного эффекта кислорода на сперматозоиды в режимах, используемых в наших экспериментах, практически исключена. Чувствительность генетического аппарата клеток к мутагенам окружающей среды определяется многими факторами. Выделяют несколько системных типов чувствительности – видовая, онтогенетическая, индивидуальная и тканевая. Сложность интерпретации результатов, полученных после воздействия мутагенов, их экстраполяции на другие объекты или разные ткани одного объекта в каждом конкретном случае связана со многими причинами: возможностью прямого контакта мутагена с ДНК; образованием вторичных мутагенных продуктов; антиметаболическим эффектом веществ, специфически ингибирующий синтез ДНК; включением репаративных процессов; истощением систем защиты и т.д. Видовые различия реакции на мутаген определяются особенностями метаболизма и вызывают противоречивые суждения токсикогенетиков об опасности исследуемого фактора. Так, инсектицид 1,2-дибромо-3-хлорпропан (ДБХП) оказался мутагеном для человека, крыс, но не для мышей. Сравнение чувствительности клеток костного мозга китайского хомячка и мышей к действию тиоТЭФ выявило вдвое большую чувствительность мыши по сравнению с хомячком (Шрам, 1977). Взаимосвязь увеличения количества аберраций в клетках животных с их возрастом хорошо освещена в литературе. Эксперименты, в которых исследовали структурные нарушения хромосом после слияния клеток спермы человека с яйцеклетками хомячка, показали, что максимальный уровень аберраций обнаружен в клетках наиболее пожилого донора (Brandriff et al., 1985). В той же работе отмечены еще два интересных факта – количество аберраций в повторных исследованиях сохраняется через 14 и 16 месяцев и строго индивидуально для каждого донора. Различия в индивидуальной чувствительности к мутагену могут дать неадаптивную информацию о степени его эффективности. Испытание противоглистного препарата никлозамина на лимфоцитах человека показало увеличение уровня аберраций у 3 из 5 больных и неоднозначное влияние препарата на культуру лимфоцитов разных доноров (Ostrosky-Wegman, 1986). В другой работе, выполненной в Калифорнийском университете, показано, что между уровнями аберраций в лимфоцитах периферической крови человека и спермиях прямой связи не обнаружено. Отсутствие четких корреляций в тканевой чувствительности ставит исследователей в затруднительное положение в тех ситуациях, когда по уровню соматических мутаций возникает необходимость прогнозировать последствия эффекта мутагена в популяции, хотя подходы разрабатываются и в некоторых случаях оправдываются, как, например, в случае прогноза мутагенности гикантона. Антигистоматозный препарат гикантон, который вызывает мутации в тестах Эймса и со64 матических клетках человека, по расчетным методам не должен быть опасным для генеративной ткани. В экспериментах на животных показано, что он действительно не вызывает доминантных леталей у мышей (Oakberg, 1974). В последних работах, посвященных мутагенному эффекту ранее упоминавшегося ДБХП, вызывающего нарушения эпителия семенников, олиго- и азооспермию, показано, что при обследовании семей лиц, контактирующих с этим мутагеном, не было обнаружено каких-либо нарушений генотипа у обследованных потомков или пороков их развития (Potashnik, Abeliovich, 1985). В то же время у 7 лиц, работавших в нефтехимической промышленности, была выявлена четкая корреляция между структурным изменением хромосом периферической крови и их репродуктивным неблагополучием (Цонева, 1985). Совсем иная картина описана Шрамом (1977), когда мутагенное влияние тиоТЭФ было исследовано на трех типах тканей разными методами, в том числе с использованием теста, выявляющего доминантные летали, при этом последний оказался вдвое чувствительнее цитогенетического анализа в костном мозге. Окислительный стресс сопровождает многие процессы в клетке и организме. Окислители составляют большую группу мутагенов, эффект которых может быть модифицирован различными факторами. Прогнозировать последствия действия окислителей можно только на базе понимания механизмов прямого и опосредованного влияния мутагена на все процессы, происходящие в клетке: от начала поражения ДНК до элиминации неблагоприятных последствий. Как было сказано ранее, присутствие металлов с переменной валентностью усиливает кластогенный эффект ГБО и других окислителей – в присутствии перекиси водорода комплекс ДНК–Fe2+ подвергается усиленной самодеструкции (Rozenberg-Arska, 1985). Данные литературы свидетельствуют о том, что возможность проникновения металлопротеинов в семенники весьма ограничена, и это снижает риск усиления кластогенности генеративной ткани после воздействия окислительного стресса на организм защитной функции. Защитная функция гематотестикулярного барьера препятствует проникновению феррина в семенные канальцы (Dym, Fawcett, 1970) и в то же время позволяет проникать в жидкость семени и лимфы семенников таким антиоксидантам, как мочевина и этанол. Можно предположить следующее объяснение некоторым широко известным фактам, свидетельствующим о различной чувствительности тканей к мутагенам. Как при радиационном, так и при химическом воздействиях на животных уровень аберраций хромосом в соматических клетках обычно значительно выше, чем в половых. Окислительный стресс в живых системах вызывает формирование радикалов и перекиси кислорода. Присутствие в крови железосодержащих компонентов стимулирует деструкцию ДНК, визуализируемую как цитогенетические нарушения в клетках. Продукты распада биополимеров (аммиак, мочевина, мочевая кислота) обладают свойствами антиоксидантов, которые могут осуществлять протекторную функцию по отношению к другим типам тканей, в частности генеративной. Об этом и свидетельствуют различные степени деструкции разных тканей после воздействия ГБО. Такая концепция объясняет высокий уровень аберраций хромосом в клетках периферической крови лиц, прошедших курс оксигенобаротерапии, с одной стороны, и благоприятный исход лечебного эффекта ОБТ. Есть основания полагать, что цитогенетические эффекты ГБО в соматических тканях, вероятно, не отражают факт реальной генетической опасности ГБО, а свидетельствуют об адаптивной реакции на окислительный стресс. 65 Исследование механизмов генетического действия окислителей и ГБО, в частности, имеет весьма краткую историю по сравнению с историей изучения радиационного мутагенеза. В связи с этим есть немало оснований отнести к проблеме, стоящей перед исследователями ГБО, слова академика Н.М. Эммануэля: «Несмотря на значительные успехи, достигнутые в понимании механизма действия ионизирующей радиации на живые организмы, по-прежнему остро ощущается неполнота существующих представлений о природе первичных пусковых стадий лучевого поражения. Именно эти стадии, связанные с развитием свободно-радикальных реакций, приводят к изменениями на молекулярном и более высоких уровнях организации живых систем» (Эммануэль, 1984, с. 707). Подводя некоторые итоги, следует напомнить основные результаты, полученные нами на млекопитающих: – увеличение давления от 0,15 до 0,7 МПа не приводит к линейному увеличению количества перестроек, но повышение давления увеличивает силу первичного ответа; – количество повреждений на клетку всегда выше после ГБО, если количество поврежденных метафаз не отличается от контроля; – начиная со второго митоза после обработки in vitro и более поздних фиксаций in vivo уровни перестроек хромосом достоверно отличаются от контроля; – характер перестроек хромосом после ГБО in vitro и in vivo отличается, однако усиление мутагенного эффекта осуществляется за счет разрывов хромосом, возникших de novo; – при одном и том же давлении кислорода фракционирование дозы ГБО сразу после окончания воздействия вызывает больший мутагенный эффект, чем пролонгированная обработка; – клинические сеансы ГБО вызывают значительное повышение уровня аберраций хромосом в клетках периферической крови человека; – ГБО-мутагенез проявляет своеобразие в том, что перестройки хромосом продолжают возникать значительное время спустя после окончания воздействия данного агента на организм; – терапевтические сеансы ГБО не вызывают у самцов крыс гонадотоксического эффекта и не влияют на репродуктивную функцию животных. Каковы бы ни были конкретные причины длительного мутагенеза, они не способны ответить на один из наиболее важных вопросов, который стоит перед исследователями ГБО: являются ли цитогенетические эффекты ГБО проявлением патологических процессов в системе или они носят адаптивный характер? 66 Глава 5. МОДИФИКАЦИЯ ГЕНЕТИЧЕСКИХ ПОСЛЕДСТВИЙ ОКИСЛИТЕЛЬНОГО СТРЕССА НИЗКОМОЛЕКУЛЯРНЫМИ АНТИОКСИДАНТАМИ Клеточный гомеостаз обеспечивается большим числом систем, что является непременным условием для жизнедеятельности клетки. ДНК – высоко реактогенная структура, отдельные компоненты которой (пуриновые и пиримидиновые основания, фосфатные группы, дезоксирибозные сахара) подвергаются эндо- и экзогенным воздействиям. Установлено, что более 10 000 повреждений ДНК появляются в одной клетке млекопитающих в течение дня только от одних продуктов метаболизма (Lindahl, 1993). Депуринизация (потеря пурина) происходит до 20 000 раз в день (Frederico et al., 1990). Дезаминирование аденина, гуанина и цитозина также достаточно частое событие в клетках млекопитающих. Одним из основных эндогенных повреждающих компонентов являются свободнорадикальные процессы (образование ·O2–, ·OН, H2О2), уровень которых в организме возрастает, например, при стрессе. Именно с атакой свободных радикалов связывают возникновение и развитие таких тяжелых заболеваний человека, как атеросклероз, приводящий к инсультам, инфарктам, а также возникновение опухолевой патологии. Несмотря на короткое время жизни свободных радикалов, они могут вызывать повреждения наследственных и других структур клетки различными путями: автоокислением мембран липидов, инактивацией ферментов, непосредственным изменением структуры ДНК. Кислород является метаболитическим мутагеном, и первичные процессы химического окисления биополимеров инициируют образование вторичных и третичных продуктов, обладающих долговременным генотоксическим эффектом. Образование активных метаболитов кислорода является одним из наиболее значимых генотоксических факторов окружающей среды. На основании данных о способности антиоксидантов различной химической природы подавлять уровень естественного мутирования, был сделан вывод о роли свободных радикалов в возникновении спонтанных мутаций (Гончарова, 1993). Изучение влияния свободных радикалов кислорода, генерируемых в модельных химических системах или живыми фагоцитирующими клетками, на генетические структуры показало, что АФК, взаимодействуя непосредственно с ДНК, вызывают повреждения дезоксирибозофосфатных и ДНК-белковых связей, образование апуриновых и апиримидиновых сайтов, окисляют пуриновые и пиримидиновые основания, модифицируют их, что в дальнейшем может приводить к одиночным и парным разрывам ДНК, т.е. АФК вызывают первичные повреждения ДНК, лежащие в основе образования генных и хромосомных мутаций (Dizdarоglu, 1991; Shigenaga, Ames, 1991, Kuchino et al., 1987; Shubutani et al., 1991; Cheng et al., 1992). Считают, что АФК вызывают больше мутаций, чем другой класс мутагенов – алкилирующие и линейные (прежде всего лейкотриены) (Варфоломеев, 1996). Эти наблюдения явились основанием для предположения о том, что продукция супероксидного анион-радикала и последующее образование гидроксильного радикала могут быть существенным фактором мутагенеза (Dizdaroglu, 1991). Сегодня достоверно доказано, что активные формы кислорода способны индуцировать различные мутации различных категорий у эукариот (Emerit et al., 1982, Emerit et al., 1985, Hall et al., 1988). 67 5.1. Механизмы защиты от токсического действия кислорода и его активных форм Молекулярный кислород, будучи сильным окислителем, с одной стороны благоприятен для живых организмов в качестве конечного акцептора электронов при дыхании, а с другой – опасен для них как предшественник АФК, разрушающих важнейшие компоненты клетки. Даже незначительное повышение концентрации кислорода в клетке приводит к увеличению уровня АФК. Для уменьшения вредоносных свойств кислорода клетка располагает многоуровневой системой защиты, призванной предотвратить образование АФК. Многоклеточные организмы обычно используют несколько типов защиты (рис. 5.1). Ɇɟɯɚɧɢɡɦɵ ɪɟɩɚɪɚɰɢɢ ɉɪɟɜɟɧɬɢɜɧɵɟ ɦɟɯɚɧɢɡɦɵ ɏɟɥɚɬɢɪɨɜɚɧɢɟ ɦɟɬɚɥɥɨɜ Ɏɢɡɢɱɟɫɤɚɹ ɡɚɳɢɬɚ ɋɧɢɠɟɧɢɟ ɜɟɧɬɢɥɹɰɢɢ ɥɟɝɤɢɯ, ɫɭɠɟɧɢɟ ɤɪɨɜɟɧɨɫɧɵɯ ɫɨɫɭɞɨɜ Ɂɚɳɢɬɧɵɟ ɦɟɯɚɧɢɡɦɵ ɨɬ ɨɤɢɫɥɢɬɟɥɶɧɨɝɨ ɫɬɪɟɫɫɚ Ⱥɧɬɢɨɤɫɢɞɚɧɬɧɚɹ ɡɚɳɢɬɚ Ⱥɧɬɢɨɤɫɢɞɚɧɬɧɵɟ ɮɟɪɦɟɧɬɵ ɉɪɨɞɭɤɬɵ ɤɚɬɚɛɨɥɢɡɦɚ Ɇɨɱɟɜɚɹ ɤɢɫɥɨɬɚ, ɦɨɱɟɜɢɧɚ, ɛɢɥɢɪɭɛɢɧ ɇɢɡɤɨɦɨɥɟɤɭɥɹɪɧɵɟ ɚɧɬɢɨɤɫɢɞɚɧɬɵ ɋɨɟɞɢɧɟɧɢɹɤɨɦɩɥɟɤɫɨɧɵ Ƚɢɞɪɨɮɨɛɧɨɦɟɦɛɪɚɧɧɨɬɪɨɩɧɵɟ ɫɨɟɞɢɧɟɧɢɹ ɋɢɧɬɟɡɢɪɭɟɦɵɟ ɤɥɟɬɤɨɣ ɗɤɡɨɝɟɧɧɵɟ ɢɫɬɨɱɧɢɤɢ Ƚɢɫɬɢɞɢɧ, ɞɢɩɟɩɬɢɞɵ, ɝɥɸɬɚɬɢɨɧ, ɝɨɦɨɤɚɪɧɨɡɢɧ Ɍɨɤɨɮɟɪɨɥ, ɤɚɪɨɬɢɧɵ, ɚɫɤɨɪɛɢɧɨɜɚɹ ɤɢɫɥɨɬɚ Рис. 5.1. Классификация защитных механизмов клетки от окислительного стресса (Kohen, Nyska, 2002) Ферментные системы антиокислителей. В процессе эволюции во всех типах клеток для защиты от АФК выработались специализированные системы ферментативных антиоксидантов (АО), к которым относятся: супероксиддисмутаза (СОД), катализирующая реакцию дисмутации супероксид-аниона в перекись водорода; каталаза, разлагающая перекись; глутатионзависимые пероксидазы и трансферазы, удаляющие органические перекиси (Fridovich, 1989; Wendel, 1987). Ферментативные АО характеризуются: высокой специфичностью действия, направленной против определенных АФК; специфичностью клеточной и органной локализации, а также использованием в качестве катализаторов металлов, к которым относятся Cu, Zn, Mn, Fe, Se (Wendel, 1987). Уровень внутриклеточных ферментативных АО находится под генетическим контролем. Показано, что повышение внутриклеточной концентрации супероксид-аниона 68 или перекиси водорода сопровождается активацией транскрипции генов, соответственно, soxRS- или oxyR-областей ДНК (регулоны этих генов активируются окислением). Воздействия, приводящие к наработке АФК, индуцируют синтез ферментативных АО. В нормальных условиях у человека содержание ферментативных АО постоянно и мало зависит от пола, возраста, массы тела и других физиологических параметров (Guemoгri et al., 1991). СОД находится в цитозоле и межмембранном пространстве эукариот, она является внутриклеточным энзимом и в межклеточных жидкостях быстро разрушается. СОД существенно ускоряет реакцию дисмутации супероксид-анионов (Fridovich, 1989; Wendel, 1987). Несмотря на высокую специфичность фермента, в определенных условиях Cu-СОД может взаимодействовать с перекисью и выступать в качестве прооксиданта, инициируя образование О и ОН. Интересно отметить, что как в случае снижения так и в случае повышения содержания СОД, начинают развиваться патологические процессы. В первом – вследствие недостаточной защиты от АФК, во втором – в результате усиления цитотоксического действия перекиси, образующейся при дисмутации кислорода. СОД снижает спонтанный и индуцированный метилметансульфонатом уровень хромосомных аберраций в лимфоцитах человека, а также уменьшает цитогенетическое и мутагенное действие блеомицина по тесту генных мутаций в культуре клеток китайского хомячка (Nordenson et al., 1976). Каталаза представляет собой гемсодержащий фермент, локализованный преимущестенно в пероксисомах клеток (Биленко, 1989). Максимальное содержание каталазы обнаружено в эритроцитах, а также в печени и почках; концентрация ее в мозге, щитовидной железе, гонадах мала (Абрамова, Оксенгендлер, 1985). Разложение перекиси каталазой осуществляется в два этапа (Биленко,1989; Wendel, 1987). При этом в окисленном состоянии каталаза может работать как пероксидаза, катализируя окисление спиртов или альдегидов. Кроме того, каталаза может выступать источником образования АФК: около 0,5 % кислорода, образующегося в результате разложения перекиси, возникает в возбужденном синглетном состоянии. Для инактивации перекиси в клетках существует еще один важный фермент – Seсодержащая глутатионпероксидаза (ГПО), локализованная в цитозоле и митохондриях всех клеток млекопитающих (Биленко, 1989; Wendel, 1987). ГПО катализирует реакцию окисления глутатиона (GSH). Помимо перекиси ГПО может разлагать гидроперекиси липидов. Сродство ГПО к перекиси выше, чем у каталазы, поэтому она более эффективно работает при низких концентрациях субстрата, а при высоких концентрациях ключевая роль принадлежит каталазе. В клетках млекопитающих также выявлено семейство мультифункциональных белков – глутатионтрансфераз (ГТ), использующих глутатион для защиты клеток от ксенобиотиков и продуктов ПОЛ посредством их восстановления. ГТ локализованы преимущественно в цитозоле клеток (Кулинский, Колесниченко, 1993). ГТ восстанавливают также гидропероксиды мононуклеотидов и ДНК, участвуя тем самым в их репарации (Кулинский, Колесниченко, 1993). Кроме того, ГТ конъюгируют с GSH, чем способствуют выведению из организма токсичных продуктов ПОЛ. Таким образом, ГТ являются важным компонентом антиоксидантной защиты, функционирующим на стадии удаления образующихся при окислительном стрессе метаболитов. В последние годы показано, что важную роль в редокс-регуляции играют пероксиредоксины. Пероксиредоксины, или тиоредоксиновые пероксидазы (Рrхs), включают в себя большое семейство многофункциональных тиолсодержащих пероксидаз, обнаруженных в большом числе живых организмов – от бактерий до млекопитающих (Hofmann et al., 69 2002, Wood et al., 2003). Рrхs относятся к антиоксидантным ферментам, главной функцией которых является восстановление и детоксикация Н2О2, органических гидропероксидов и пероксинитрита. Как антиоксидантные ферменты пероксиредоксины выполняют ту же функцию, что каталазы и глутатионзависимые пероксидазы, однако их каталитическая активность значительно ниже, чем у последних. Тем не менее, ряд данных свидетельствует о важной роли Рrхs в антиоксидантной защите клеток разных типов (Seaver, Imlay, 2001, Immenschuh, Baumgart-Vogt, 2005). СОД, церулоплазмин, пероксидаза, каталаза, глутатион-зависимая группа, обеспечивающие комплексную антирадикальную защиту биополимеров, расположены в различных тканевых структурах и клеточных компартментах. Это связано с тем, что они слабо проникают через мембраны и тканевые барьеры из-за высокой молекулярной массы. Низкомолекулярные антиоксиданты. Кроме высокомолекулярных соединений – ферментов и белков, способных связывать ионы Fe и Cu, являющиеся катализаторами свободнорадикальных процессов (альбумины крови, трансферрин, ферритин, лактоферрин), в антирадикальную систему защиты клетки входит большое количество низкомолекулярных компонентов, активных в водной (некоторые аминокислоты, полиамины, мочевина, мочевая кислота, глутатион, аскорбиновая кислота, карнозин) (Кения и др., 1993; Fiaschi et. al 2005, Aycicek et. al., 2007) и липидной фазах (фенольные антиоксиданты, каротиноиды и витамины А и Е, билирубин, серосодержащие соединения) (Капитанов, Пименов, 1996; Koyu et al., 2005; Ostman et al., 2009). Низкомолекулярные антиоксиданты свободно мигрируют в клеточной и тканевой средах, их концентрации в организме значительно выше, чем АФК. Известны многочисленные биохимические процессы, идущие с участием глутатиона, аскорбата, аминокислот, напрямую не связанные с их антиоксидантными свойствами. Тканевой уровень низкомолекулярных антиоксидантов определяется соотношением активности ферментных систем их образования и метаболических превращений, транспорта и выведения из организма (мочевина, урат) (Кения и др., 1993). Гидрофобные антиоксиданты защищают мембраны, перехватывают свободные радикалы, восстанавливают АФК и продукты оксидативной модификации. Гидрофильные антиоксиданты находятся в водной фазе клетки, защищают вещества гиалоплазмы и матрикса митохондрий, регулируют интенсивность свободнорадикальных процессов в тканях и обеспечивают их участие в других метаболитических путях (Владимиров Ю.И., Арчаков, 1972). Механизм действия всех этих низкомолекулярных веществ состоит в том, что они подставляют себя под удар реактивных производных кислорода и, окисляясь, прерывают опасную для клетки цепь реакций. Экзогенные источники. Значительная роль в защитном эффекте от АФК принадлежит «классическим» витаминам – -токоферолу, аскорбиновой кислоте, -каротину. Показана их способность снижать уровень окислительных повреждений при различных патологических состояниях человека (Van Poppel, VandenBerg, 1997; McCall, Frei, 1999). Антиоксидантный потенциал липидной фазы представлен двумя основными классами низкомолекулярных соединений: ретинолом и его предшественниками, а также токоферолами и близкими к ним по строению витамином К и убихинонами, которые обладают комплексной антирадикальной активностью. Наиболее адекватными их мишенями являются полиненасыщенные жирные кислоты – линолевая, альфа-линоленовая, арахидоновая (Кения и др., 1993). α-Токоферол способен реагировать с супероксид-анионом и синглетным кислородом, вызывая обрыв цепи свободно-радикального окисления в результате взаимодействия 70 с перекисными радикалами. При этом токоферолы обладают относительно устойчивой фенольной формой и достаточно высокой константой взаимодействия с пероксильными радикалами (Храпова, 1982, Hong et al., 2009). Около 50 % клеточного токоферола локализовано в ядре, 30 % – в мембранах митохондрий, 20 % – в микросомальной мембране. В физиологических концентрациях он является регулятором тканевого дыхания, а антиоксидантные свойства его проявляются при 10–15-кратном повышении этих доз (Иванов, Тарусов, 1976). Активность токоферолов обусловлена такими специфическими особенностями токоферольных радикалов, как двойное влияние на скорость окисления (про- и антиоксидантное действие); субстратспецифичность – увеличение тормозящего действия в субстратах с высокой степенью ненасыщенности; синергизм с веществами, имеющими подвижный атом Н, такими как аскорбиновая и другие двухосновные кислоты, тиолы, убихинолы, фосфолипиды, и восстанавливающими активные фенольные формы токоферольных радикалов. -Токоферол является универсальным антимутагеном. Добавление в культуральную среду значительно снижает хромосомные аберрации, индуцированные бензо(а) пиреном in vitro в соматических и репродуктивных клетках китайского хомячка (Smalls, Patterson,1982). -Токоферол проявлял также значительный антимутагенный эффект в случае ионизирующей радиации (Иванов, 1976, Алекперов, 1979, Алиев и др., 1985) в клетках печени крыс, подвергнутых действию гипербарической оксигенации. Введенный крысам в желудок -токоферол предупреждает снижение содержания цитохрома Р450, уровня общих фосфолипидов, холестерина, скорости окисления НАДФН и скорости метаболизма субстратов (Смирнов и др., 1984; Воронов, 1984). Защитный эффект -токоферола наблюдали при действии токсических режимов ГБО на клетки крови (Mengel, 1972) и семенники (Goldstein, Modric, 1994). Пятикратное введение -токоферола перед сеансом ГБО снижало уровень перестроек хромосом в метафазах костного мозга крыс до спонтанного (Гуськов, Шкурат, 1984, 1989б). M. Конопачка использовал метод ДНК-комет, чтобы проследить воссоединение разрывов ДНK, вызванных γ-лучами. Витамин Е в комбинации с витамином С (1 мг/мл) и β-каротином (5 мг/мл) ускорил восстановление; за 90 мин 80 % разрывов были восстановлены в сравнении с 50 % в контроле (Konopacka, Rzeszowska-Wolny, 1998). При избытке токоферола образующиеся его радикалы действуют как прооксиданты – продолжают цепи, разрыхляют мембраны и могут усиливать лучевое поражение (Tocopherol..., 1989). Основной структурой витамина А и его провитаминов (β-каротина и других каротиноидов), обусловливающей их антиоксидантную активность, является наличие системы сопряженных, чередующихся одинарных и двойных связей между атомами углерода. Из 600 известных ныне каротиноидов менее 10 % проявляют А-витаминную активность, т.е. способны превращаться в витамин А (Bendich, Olson, 1989). Всесторонне изучены антиоксидантные свойства каротиноидов – природных пигментов, синтезируемых растениями и микроорганизмами, основная функция которых состоит в защите структур растительной клетки от повреждающего действия свободных радикалов, образующихся в процессе фотосинтеза. (Капитанов, Пименов, 1996). Наиболее известным и широко распространенным каротиноидом является β-каротин, который также как α-каротины и β-криптоксантин, может быть превращен оксигеназой в витамин А (ретинол) и через печень транспортироваться в другие ткани вместе с ретинолсвязанными белками (Bates, 1995; Khan et al., 2008). Обнаруженные антиоксидантные свойства каротиноидов свидетельствуют об их возможном участии во многих внутриклеточных реакциях. В основе этого лежит их вы71 сокая неспецифическая реакционная способность и тропность к свободным радикалам (Krinski, 1994). Установленная антиоксидантная активность β-каротина и других каротиноидов позволяет объяснить их роль в торможении процессов ПОЛ и определяет такие их биологические функции, как ингибирование мутагенеза и трансформации про- и эукариотических клеток, предотвращение предраковых и возрастных повреждений у многоклеточных организмов (Gilca et al., 2007). Общее звено для подавляющего большинства биохимических процессов, в которых принимают участие каротиноиды, – свободнорадикальная модификация макромолекул и биологических структурных компонентов мембран. Особенность строения каротиноидов – наличие у них цепочки двойных сопряженных связей С=С, в которой -электроны делокализованы по всей длине. Энергетические характеристики этой молекулярной структуры определяют ее антиоксидантные свойства, суть которых заключается в возможности передачи возбужденного неспаренного электрона с ·О2–, или пероксирадикала, на молекулу каротиноида (Palozza, Krinsky, 1992). На уровень антиоксидантной активности каротиноидов оказывают влияние длина полиеновой цепочки и их кольцевые группы. Расположение крайних двойных связей в кольцевых структурах β-каротина приводит, вследствие пространственных ограничений между метильными группами в кольце и главной полиеновой цепью, к нарушению единства основной структуры делокализованных -электронов (Бриттон, 1986). Поэтому каротиноид ликопин, имеющий также 11 центральных ненасыщенных двойных связей, но в виде планарной структуры, обладает более сбалансированной -электронной системой с относительно более низким триплетным уровнем возбуждения, что и определяет почти двукратное увеличение его антиоксидантной активности по сравнению с β-каротином (Palozza, Krinsky, 1992, Rousseau et al., 1992, Scolastici et al., 2008). Однако при встраивании каротиноида в клеточные или субклеточные структуры большое значение приобретает степень его сродства к соответствующим фосфолипидам и липопротеинам, определяющая различия в локализации молекулы каротиноида и влияющая на эффективность ее контакта с возникающими радикалами (Lazrak et al., 1987). В организме человека витамин А обнаруживают в трех формах (ретинол, ретиналь, ретиноевая кислота) в зависимости от степени окисления углеродного атома С15. Он поступает в организм в виде каротиноидов растительной пищи либо свободного ретинола и его эфиров (Коровина и др., 2003). Антиоксидантные функции витамина А заключаются в защите любых биологических мембран от повреждения активными формами кислорода. Основными точками приложения физиологического действия ретиноидов являются биологические мембраны, синтез и метаболизм гликопротеинов, хроматин ядра. Физиологическая роль витамина А в организме связана с процессами размножения и роста, дифференцировки эпителиальной и костной ткани, в поддержании иммунологического статуса, а также в осуществлении зрительной функции – фоторецепции (Тутельян и др. 2002). Недостаточность витамина А приводит к нарушениям, в основе которых лежит генерализованное поражение эпителия, выражающееся в его метаплазии и кератинизации. Показано, что предобработка репаративно-дефектных клеток ретинолом снижает повреждающее действие мутагена в лимфоцитах больных с синдромом Элерса–Данлоса, гомоцистинурией. Хорошо описаны антиоксидантные свойства флавоноидов, относящихся к группе витамина Р. Наиболее изученными из них являются кверцитин и рутин, способные за счет ортогидроксилов фенольного кольца С быть донорами водорода. Биофлавоноиды гасят 72 супероксидный анион-радикал, проявляют антиатерогенное, гипохолестеринемическое действие. По своей химической структуре флавоноиды являются полифенолами и поэтому могут выступать в качестве классических антиоксидантов, взаимодействуя со свободными радикалами с образованием неактивных феноксильных радикалов. Особенно важно для антиоксидантной активности флавоноидов свойство гидроксилированных флавоноидов связывать ионы металлов переменной валентности, образуя стабильные комплексы, в связи с ролью ионов железа в инициировании свободно-радикальных процессов. Из биофлавоноидов наиболее изучены антиоксидантные свойства кверцитина и рутина, способных за счет ортогидроксилов фенольного кольца С быть донорами водорода. Биофлавоноиды гасят супероксидный анион-радикал, проявляют антиатерогенное, гипохолестеринемическое действие. Антирадикальный и хелатирующий эффект рутина, показан в опытах на микросомах сердца быка и лецитиновых липосомах (Дорожко и др., 1988). Биофлавоноиды в то же время проявляют антимутагенную и гепатопротекторную активность. Основным источником флавоноидов служат растительные продукты. Препараты растительных фенольных соединений успешно применяются в качестве средств профилактики атеросклероза, антигипоксантов, антиаллергических средств, они снижают токсические эффекты противотуберкулезных препаратов и тетрациклиновых антибиотиков. Эти препараты применяют при лечении лучевых поражений (Gates et al., 2007; Liang et al., 2008; Min et al., 2008). Антиоксидантные свойства витамина С (аскорбиновая кислота) хорошо известны с 50-х годов XX в. Он является наиболее важным антиоксидантом межклеточных жидкостей, присутствует во всех органах и тканях человека, наиболее высокие концентрации его содержатся в иммунокомпетентных клетках, в лейкоцитах, например, ее концентрация на порядок выше, чем в плазме (Жумабаева и др., 2002). Этот витамин не синтезируется и не имеет депо в организме человека, оказывает влияние на ряд важных биохимических процессов в организме, таких как синтез коллагена и проколлагена, монооксигеназные реакции гидроксилирования в мозге. Аскорбиновая кислота обладает чрезвычайно широким спектром антиоксидантных свойств: обезвреживает НОС1, восстанавливает -токоферильный радикал, тем самым возвращая α-токоферолу антиоксидантные свойства, а также тиильный (RS·) и тиопероксильный (RSО2·) радикалы (Blokhina et al., 2003). Аскорбиновая кислота превосходит другие антиоксиданты плазмы в защите липидов от перекисного окисления, так как только это соединение достаточно реакционноспособно, чтобы эффективно ингибировать инициацию ПОЛ (Меньщикова, Зенков, 1993). Антиоксидантные свойства аскорбиновой кислоты основаны на функционировании одноэлектронных циклических переходов между дигидро-, семигидро- и дегидроаскорбатными формами, чему способствуют подвижные протоны. Скорость этих превращений зависит от металлов переменной валентности других пар окислитель–восстановитель и рН (Sevanian et al., 1985, Premkumar et al., 2007). Восстановленная форма характеризуется способностью непосредственно взаимодействовать с АФК, а также участием в восстановлении других низкомолекулярных антиоксидантов (токоферол, глутатион) (Frei, 1994). Показано, что аскорбат – наилучший тушитель супероксидного аниона (Сперанский и др., 1990, Fuchs, et al. 1988), он также является ингибитором пергидроксильного радикала, синглетного кислорода, гидроксильного радикала, перекисного и алкоксильного радикалов (Lissi E. A. et al., 1988). Н2О2 может восстанавливаться аскорбатом как непосредственно, так и с помощью фермента аскорбатпероксидазы, кофактором которого он является. Витамины A, C, D, F при окислении и аутоокислении образуют промежуточные радикальные формы, которые могут выполнять роль инициаторов окисления и ускорять 73 ПОЛ, увеличивая скорость зарождения цепных реакций в мембранах (Храпова, 1982). В обменных реакция радикалы аскорбата вступают в реакции с перекисью, образуя активные метаболиты. Это может объяснить наблюдаемый в ряде случаев генотоксический эффект витамина С (Weitberg, 1987). Действие каждого витаминного препарата многокомпонентно. Так, аскорбиновая кислота способна ингибировать реакции нитрозилирования, нейтрализовать свободнорадикальные процессы, стабилизировать структуру ДНК и др. Для ретинола характерна способность к ингибированию клеточной репликации, что изменяет продолжительность клеточного цикла и оптимизирует условия для репарации повреждений. Комбинированное действие витаминных препаратов носит, очевидно, синергический, аддитивный, антогонистический характер взаимодействия. Например, синергизм проявляется при использовании витаминов А и Е; оптимум действия витамина Е необходим для протекторного эффекта витамина А. Более того, витамин Е действует аддитивно с соединениями селена (Засухина, Синельщикова, 1993). Низкомолекулярные антиоксиданты, синтезируемые клеткой. Важную роль в антиоксидантной защите организма играют легко окисляющиеся пептиды, в состав которых входят SH-содержащие аминокислоты: глутатион, цистеин, цистин и метионин. SHсодержащим соединениям принадлежит ведущая роль защиты от радикала ОН – это важные компоненты поддержания окислительно-восстановительного гомеостаза в клетках. При различных стрессовых воздействиях наблюдается обратимая окислительная модификация SH-групп, приводящая к увеличению количества дисульфидных групп (Биленко, 1989). Такая модификация изменяет состояние клеточных мембран, их проницаемость и адгезивные свойства, влияет на активность ферментов и клеточную пролиферацию. Поэтому соотношение окисленных и восстановленных SH-групп и их способность к окислительной модификации (буферная емкость) служат важными критериями неспецифической резистентности организма. Показано, что SH-содержащие соединения подвергаются окислению в первую очередь. Это предохраняет от окисления другие группы и молекулы (Arnhold et al., 1991). Глутатион, стоящий на первом месте по содержанию в клетках эукариот, где его концентрация достигает миллимолярных значений, занимает особое положение. Он представляет собой трипептид (L-γ-глутамил-L-цистеинилглицин), особым свойством которого является наличие γ-глутамильной связи и свободной сульфгидрильной (SН-) группы, которая может служить донором электронов, придавая глутатиону свойства восстановителя и способность удалять свободные радикалы. Поэтому данному трипептиду часто приписывается роль главного водорастворимого антиоксиданта (Зенков и др., 2001). Восстановленный глутатион (GSH) и комплекс GSH-зависимых ферментов работают во всех частях клетки, включая ядро, митохондрии и зндоплазматическую сеть. Известный антиоксидантный эффект Se также в основном опосредован глутатионпероксидазами (Кулинский, Колесниченко, 1993). Антиоксидантные свойства глутатиона определяются как непосредственным взаимодействием с АФК и обменными реакциями с дисульфидными связями, так и функционированием ряда ферментов глутатионового цикла, из которых основные – глутатионпероксидаза (Shin et al., 2008) и глутатион-8-трансфераза (Weiss, 1986, Yoshihara et al., 2009). Глутатион перехватывает радикалы с образованием GS-радикала и последующей димеризацией в дисульфид (GSSG), хорошо улавливает гидроксильный радикал и синглетный кислород. Мембраны клеток млекопитаюших плохо проницаемы для глутатиона, поэтому основную потребность в нем клетки удовлетворяют за счет эндогенного синтеза, кото74 рый осуществляется двумя ферментами – γ-GCS и глутатионсинтазой. Лимитирующим и регулирующим звеном синтеза глутатиона является образование γ-глутамилцистеина из соответствующих аминокислот γ-GСS (Mulcahy et al., 1997). Глутатионовый статус ткани играет важную роль при гипероксических состояниях. Когда концентрация кислорода в системе оказывается ниже, чем содержание глутатиона, происходят обрыв цепи и регенерация радикалов в исходную молекулу RH. Однако при увеличении концентрации кислорода развивается цепная реакция окисления, и глутатион выступает в качестве ограничителя свободно-радикального окисления. Показано, что глутатион оказывает протекторное действие при 0,4–0,7 МПа кислорода, отдаляя наступление судорожного приступа и повышая продолжительность жизни животных. При более низких давлениях (0,3 МПа) глутатион обладал обратным действием. В то же время кислород-зависимое окисление глутатиона может вызывать токсические последствия. Инкубация эритроцитов в присутствии глутатиона индуцировала повышение ПОЛ и гемолиз в результате окисления тиоловых групп белков и гемоглобина. Одна из основных антиоксидантных функций GSH заключается в восстановлении метгемоглобина: на долю глутатиона приходится 12 % метгемоглобинвосстанавливающей способности клетки (Рябов, Шостка, 1973). Роль GSH не ограничивается формированием основного низкомолекулярного антиоксидантного потенциала эритроцитов и кроветворных клеток, что позволяет противостоять гемоглобин- и ферментзависимой генерации АФК. Кроме того, клеточный GSH участвует в поддержании пула восстановленного аскорбата – антиоксиданта, осуществляющего защиту элементов системы крови извне. Перенос восстановленных эквивалентов с GSH на аскорбат осуществляется ферментом глутатиондегидроаскорбатредуктазой (Богданова и др., 1987, Weiss, 1986). Продукты катаболизма. Исследования последних десятилетий выявили антиоксидантные свойства у целого ряда веществ, основные (или считаемые таковыми) функции которых, по существующим представлениям, не связаны с защитой от кислорода. В поддержании антиоксидантного гомеостаза важную роль играют низкомолекулярные азотсодержащие метаболиты – аммиак, полиамины, аминокислоты, пептиды, мочевина, мочевая кислота, являющиеся эффективными ловушками свободных радикалов (Cohen et. al., 1984, Lissi et.al., 1988). Очевидно, они являются частью сложного комплекса антирадикальной защиты, причем доминирующая роль в конкретных структурах и ситуациях может принадлежать разным элементам. Основной продукт катаболизма нуклеиновых кислот у приматов – мочевая кислота – обладает выраженными антиоксидантными свойствами (Nadeem, Masood, Siddiqui, 2008). Известно, что линии дрозофилы, неспособные синтезировать мочевую кислоту, проявляют сверхчувствительность к параквату, ионизирующей радиации и гипероксии. Двойные мутанты, дефицитные по медно-цинковой супероксддисмутазе и урату, являются синтетическими леталями (Hilliker et al., 1992). В модельных системах мочевая кислота защищает ДНК от действия активных форм кислорода (Miura et al., 1993). Мочевая кислота содержится в крови в достаточных количествах, чтобы эффективно акцептировать синглетный кислород, гидроксильный радикал, ингибировать ПОЛ, восстанавливать метгемоглобин с образованием радикала урата (Ames et al., 1981; Lissi et al., 1988), ингибировать свободнорадикальное повреждение ДНК (Cohen et al., 1984). Кроме того, аминогруппы эффективно связывают ионы Fе, образуя стабильные комплексы (Lissi et al., 1988). Мочевая кислота по своим свойствам близка к енольным антиоксидантам и может выступать синергистом с радикалами -токоферола и аскорбиновой кислоты. Уровень ее в плазме у человека составляет около 300 мкМ, что значительно выше, 75 чем уровень аскорбата, одного из основных антиоксидантов у человека (Ames et al., 1981). В физиологических условиях при рН 7,4 мочевая кислота находится преимущественно в анионной форме и образует радикалы с локализацией неспаренного электрона в пятичленнике пиримидиновой структуры. Увеличение тканевой концентрации урата при окислительном стрессе рассматривается как компенсаторный механизм (Гуськов, 1989; Кения и др., 1993). Мочевина легко проходит через гистогематические барьеры. Тем не менее в ряде органов поддерживается более высокая концентрация мочевины, чем в крови, что определяется способностью мочевины связываться с биомолекулами. Интраперитонеальная инъекция мочевины крысам отдаляет судороги и снижает смертность при острой форме кислородного отравления. В физиологических концентрациях мочевина образует комплексы с концевыми карбоксильными группами белков, что может сокращать число железо-содержащих центров и уменьшать атакуемость полипептидных цепей (Кричевская и др., 1980). Накопление мочевины в тканях организмa в неблагоприятных условиях можно рассматривать как реализацию ее антиоксидантных функций. Мочевая кислота является конечным продуктом обмена пуринов у приматов, птиц, рептилий вследствии Uox-мутаций. Однако у многих других позвоночных она подвергается дальнейшему расщеплению, и экскреторным продуктом является аллантоин – низкомолекулярное гетероциклическое соединение, широко распространенное в природе, синтезируется у большинства видов растений и животных, за исключением гоминид. Концентрация аллантоина в плазме крови млекопитающих составляет 50–150 мМ, а у человека, по данным разных авторов, на порядок ниже: 2,44 М (Lagendijk et al., 1995); 4,4–7,6 М (Hirota et al., 1983); 18,9–37,9 М (Archibald, 1944). Аллантоин поступает в организм приматов либо с экзогенными продуктами, содержащими данную молекулу, либо возникает эндогенно в результате атаки молекулы мочевой кислоты свободными радикалами (Ogihara et al., 1998). Немногочисленные работы посвящены количественному определению аллантоина при различных состояниях, сопровождающихся развитием окислительного стресса после физических нагрузок (Räsänen et al., 1993; Guskov et al., 1990; Mikami et al., 2000), при ревматоидном артрите (Yardim-Akaydin et al., 2004), инфаркте миокарда (Kock et al., 1994), синдроме Дауна (Zitanova et al., 2004). При этом было показано, что уровень аллантоина – более чувствительный показатель окислительного стресса, чем концентрация глутатиона и цистеина (Guskov et al., 1990). Антиоксидантные и антимутагенные свойства аллантоина исследованы в цикле работ, проведенных под руководством Е.П. Гуськова, также показана его роль как витаминоподобного регулятора многих биологических процессов у человека (Гуськов и др., 2002; 2004; Шестопалов и др., 2006). В модельных экспериментах оценивали влияние различных концентраций аллантоина, в диапазоне от 10–2 до 10–9 М, на уровень Fe-индуцируемой хемилюминесценции (ХЛ) как показателя соотношения активности про- и антиоксидантных систем (рис. 5.2). Интенсивность свободно-радикальных процессов определяли по высоте быстрой вспышки, длине латентного периода, светосумме (за 500 с) и высоте медленной вспышки. Как видно из результатов, представленных на рисунке, было зарегистрировано дозазависимое влияние аллантоина на уровень всех показателей, характеризующих интенсивность ХЛ. Показано, что максимальное тушение ХЛ-ответа, как по скорости развития ответа, так по светосумме и высоте вспышки, зарегистрировано при концентрации аллантоина 76 в диапазоне от 10–4 до 10–7 М. При этом высота быстрой вспышки уменьшается на 80– 100 %, светосумма снижается на 70–100 %, высота медленной вспышки уменьшается на 83–100 %, латентный период удлиняется на 100 %. Рис. 5.2. Влияние аллантоина на уровень Fe-индуцируемой ХЛ: 1 – высота быстрой вспышки; 2 – высота медленной вспышки; 3 – латентный период до начала развития медленной вспышки; 4 – светосумма (500 с) Учитывая результаты, полученные в модельном эксперименте, в нашей дальнейшей работе мы использовали аллантоин в концентрации 10–6 М. Была показана эффективность аллантоина в качестве антиоксиданта в реакциях его радикальной атаки активными формами кислорода и его влияние на биохимические последствия пребывания крыс в условиях окислительного стресса, индуцированного ГБО (0,5 МПа О2) в течение 2 ч (Гуськов и др., 2001б). Предварительное введение аллантоина животным (за 1, 12 и 24 ч до обработки ГБО) приводит к существенному снижению интенсивности процессов ПОЛ в эритроцитах, мозге, легких, печени и почках крыс (табл 5.1). По сравнению с гипероксией достоверное падение уровня МДА в тканях составляет в среднем 46–72 %, этот показатель существенно снижается в мозге и почках – на 72 % (P0,001), и 68 % (P0,001), соответственно. Содержание конечных продуктов ПОЛ–ШО при окислительном стрессе на фоне введения аллантоина также снижается, по сравнению с гипероксией во всех тканях. Для оценки влияния аллантоина на антиоксидантный статус организма при окислительном стрессе исследовали активность сопряженных ферментов антиоксидантной защиты – СОД и каталазы в эритроцитах, мозге, легких, печени и почках крыс. Как видно из результатов (табл. 5.2), в присутствии аллантоина восстанавливается активность и скоординированность ферментативной антиоксидантной системы во всех исследованных тканях. Эти результаты подтверждают гипотезу о том, что промежуточные продукты катаболизма пуриновых оснований являются антиоксидантами (Гуськов, Шкурат, 1989б). Важно отметить, что даже в очень высоких концентрациях аллантоин не оказывает ни цитотоксического, ни цитостатического эффектов, а антиоксидантным и антимута77 Таблица 5.1 Содержание малонового диальдегида (нмоль/мг белка) и шиффовых оснований (ед.фл./мг белка) в эритроцитах и тканях крыс при действии повышенного давления кислорода и предварительного введения аллантоина Ткань Показатель ПОЛ Контроль Контроль+ Аллантоин ГБО Аллантоин+ГБО МДА 3,050,29 3,380,26 4,680,12 1,410,11 >0,1 <0,001 <0,001 Р1 Эритроциты <0,001 Р2 ШО 3,440,36 Р1 2,860.47 5,430,62 3,490,36 >0,1 <0,05 >0,1 <0,05 Р2 МДА 15,701,39 Р1 Мозг 17,700,73 24,902,47 6,950,76 >0,1 <0,01 <0,001 <0,001 Р2 ШО 2,090,20 Р1 2,260,47 3,850,58 1,450,28 >0,1 <0,05 0,05<Р<0,1 Р2 МДА <0,01 16,930,82 Р1 Легкие 14,234,72 24,242,45 9,450,75 >0,1 <0,05 <0,001 <0,001 Р2 ШО 1,850,23 2,220.28 Р1 2,800,27 1,180,21 <0,001 <0,05 Р2 МДА <0,001 13,840,69 Р1 Печень 11,110,81 19,840,97 8,000,72 <0,05 <0,001 <0,001 Р2 ШО <0,001 2,030,21 Р1 1,930.26 4,120,79 2,210,19 >0,1 <0,05 >0,1 Р2 МДА <0,001 15,831,29 Р1 Почки 15,551,58 30,151,64 9,550,65 >0,1 <0,001 <0,001 <0,001 Р2 ШО Р1 Р2 1,870,26 1,970.13 2,810,26 2,070,35 >0,1 <0,05 >0,1 >0,1 Примечание: Р1 – достоверность различий по сравнению контролем; Р2 – достоверность различий по сравнению ГБО; МДА – малоновый диальдегид; ШО – шиффовы основания. 78 Таблица 5.2 Активность ферментов антиоксидантной защиты СОД и каталазы в тканях (ед/мг белка) и эритроцитах (ед/мг Hb) крыс после введения аллантоина и ГБО Ткань Показатель Контроль Контроль+ Аллантоин ГБО Аллантоин+ ГБО СОД 3,520,44 3,650,58 1,660,49 3,530,51 >0,1 <0,001 >0,1 Р1 Эритроциты Р2 Каталаза <0,05 28,22,48 Р1 25,333,40 17,632,0 16,580,32 >0,1 <0,001 <0,001 Р2 СОД >0,1 2,580,40 Р1 Мозг 2,270,28 1,040,14 2,00,26 >0,1 <0,001 >0,5 Р2 Каталаза <0,01 3,160,43 Р1 3,000,26 5,600,80 2,670,06 >0,1 <0,05 >0,05 <0,001 Р2 СОД 1,570,13 Р1 Легкие 1,600,22 0,740,28 1,960,28 >0,1 <0,05 >0,1 Р2 Каталаза <0,001 5,670,66 Р1 4,600.30 7,430,24 4,420,31 >0,1 <0,05 >0,1 <0,001 Р2 СОД 2,700,30 Р1 Печень 2,11026 1,090,46 2,260,52 >0,1 <0,01 >0,1 Р2 Каталаза <0,05 3,480,37 Р1 3,430,25 5,990,53 2,650,28 >0,1 <0,001 >0,1 Р2 СОД <0,001 2,330,35 Р1 Почки 2,950,17 1,030,20 1,820,35 >0,1 <0,001 >0,1 Р2 Каталаза Р1 Р2 0,05<Р<0,1 5,010,40 4,190,13 6,200,24 4,580,22 >0,1 <0,05 >0,1 <0,001 Примечание: Р1 – достоверность различий по сравнению контролем; Р2 – достоверность различий по сравнению с действием ГБО. Предварительное введение животным смеси аллантоина и ПАБК приводит к значительному и выраженному в равной степени снижению уровня МДА и ШО в эритроцитах и тканях крыс при ГБО, в среднем на 61–69 % и 54–74 %, соответственно, по сравнению с гипероксией. Уровень ПОЛ при применении аллантоина, ПАБК и особенно их смеси не только нормализуется, а снижается ниже нормы. 79 генным действием обладают концентрации, соответствующие физиологическим количествам его содержания в крови человека – 6,5·10–6 М (Гуськов и др., 2004). Для оценки соответствия биологических эффектов аллантоина и механизмов его протекторного действия были проведены квантово-химические расчеты ключевой стадии реакции его радикальной атаки некоторыми активными формами кислорода, которые полностью подтверждают эффективность аллантоина в качестве антиоксиданта в реакциях его радикальной атаки АФК (Гуськов и др., 2002, 2004). Концентрация антиоксидантов в организме может не соответствовать силе стрессорного воздействия и их истощение может вывести систему на уровень необратимых изменений. Поэтому значительную часть антиоксидантов организм получает экзогенно, и их целенаправленный прием может повысить устойчивость организма к окислительному стрессу. Несмотря на значительное количество искусственно синтезированных антиоксидантов, не имеющих аналогов в природе, приоритет в биомедицинских исследованиях по-прежнему отдают препаратам природного происхождения, несомненно имеющим целым рядом преимуществ. К таким веществам относятся аллантоин и ПАБК, обладающие целым рядом очевидных достоинств: они нетоксичны, не накапливаются в организме, выводятся с биологическими жидкостями после достижения пороговых концентраций, увеличивают поливалентность биохимических путей их утилизации и выполняют функции дополнительных тушителей в свободнорадикальных реакциях, при этом активизируют общий метаболизм, занимая новые участки в биохимических процессах. Физиологически активное вещество ПАБК (парааминобензойная кислота) является природным соединением, известным как витамин Н1, обладает поливалентным действием на различные звенья внутриклеточного метаболизма, обладает способностью стимулировать некоторые жизненно важные процессы в клетках про- и эукариот, а также защищает их геном от действия различных мутагенов (Васильева, 1980; 1984; Васильева и др., 1982; Акберова и др., 1998). У млекопитающих и приматов отсутствуют системы, контролирующие синтез ПАБК. Млекопитающие получают ПАБК из экзогенных источников. В экспериментах по изучению влияния ПАБК на антиоксидантный статус организма животных при ГБО-индуцированном окислительном стрессе показано, что введение животным ПАБК приводит к снижению уровня продуктов ПОЛ (МДА и ШО) в эритроцитах и тканях крыс. Кроме того, выявлено, что введение ПАБК перед сеансом ГБО приводит к повышению активности СОД в эритроцитах, мозге, легких крыс на 166 % (P0,001), 160 % (P0,01) и 309 % (P0,001), соответственно, по сравнению с гипероксией (Покудина, 2002). В работах, направленных на поиски соединений, способных защитить организм от деструктивного воздействия на организм АФК, проведенных под руководством Е.П. Гуськова, показаны протекторные свойства компаунда аллантоина и ПАБК на биохимические и генетические показатели в тканях животных, подвергшихся окислительному стрессу, свидетельствующие о синергическом эффекте этих соединений. Из результатов экспериментов следует, что в условиях окислительного стресса аллантоин ПАБК и их смесь существенно снижают интенсивность процессов ПОЛ (рис. 5.3, а, б), нормализует содержание МДА и ШО в эритроцитах и тканях животных. 80 35 * 30 * 25 * * ɧɆɨɥɶ/ɦɝ ɛɟɥɤɚ20 * 15 10 * * * * * * * * * 5 * * * * ** 0 ɷɪɢɬɪɨɰɢɬɵ ȽȻɈ ɥɟɝɤɢɟ Ⱥ+ȽȻɈ ɩɨɱɤɢ ɉȺȻɄ+ȽȻɈ а Ⱥ+ɉȺȻɄ+ȽȻɈ 6 * 5 ɟɞ.ɮɥ./ɦɝ ɛɟɥɤɚ * * 4 * 3 * 2 * * * * 1 * 0 ɷɪɢɬɪɨɰɢɬɵ ȽȻɈ ɥɟɝɤɢɟ Ⱥ+ȽȻɈ ɉȺȻɄ+ȽȻɈ ɩɨɱɤɢ Ⱥ+ɉȺȻɄ+ȽȻɈ б Рис. 5.3. Влияние аллантоина и ПАБК на уровень МДА (а) и ШО (б) в эритроцитах и тканях животных при ГБО(0,5 МПа–2 ч): * – достоверные различия по сравнению с контролем (интактными животными) (Р<0,01–0,001) Полученные в экспериментах результаты также показали, что аллантоин, ПАБК и их смесь восстанавливают активность внутриклеточной ферментативной антиоксидантной системы крови и тканей, нормализуя работу СОД и каталазы (рис. 5.4, а, б). На фоне введения животным смеси аллантоина и ПАБК перед ГБО регистрируется активация СОД в тканях, составляющая в среднем 95–170 % относительно гипероксии. Сочетание ПАБК с аллантоином предотвращает чрезмерную активацию СОД в легких и отсутствие нормализации функционирования фермента в печени и почках при окислительном стрессе, которые наблюдались в случае введения животным перед сеансом ГБО только ПАБК. Компаунд исследуемых веществ нормализует также активность каталазы в тканях животных, достоверных изменений ее уровня по сравнению с контролем не зарегистрировано. 81 4,5 4 3,5 * 3 ɟɞ/ɦɝ ɛɟɥɤɚ 2,5 * 2 * * * 1,5 * * 1 * * 0,5 0 ɷɪɢɬɪɨɰɢɬɵ ȽȻɈ ɥɟɝɤɢɟ Ⱥ+ȽȻɈ ɉȺȻɄ+ȽȻɈ ɩɨɱɤɢ а Ⱥ+ɉȺȻɄ+ȽȻɈ 35 30 25 ɟɞ/ɦɝ ɛɟɥɤɚ 20 * * * 15 10 * * 5 * * * 0 ɷɪɢɬɪɨɰɢɬɵ ȽȻɈ Ⱥ+ȽȻɈ ɥɟɝɤɢɟ ɉȺȻɄ+ȽȻɈ ɩɨɱɤɢ Ⱥ+ɉȺȻɄ+ȽȻɈ б Рис. 5.4. Влияние аллантоина и ПАБК на активность СОД (а) и каталазы (б) в эритроцитах и тканях животных при ГБО(0,5 МПа–2 ч): * – достоверные различия по сравнению с контролем (интактными животными) (Р< 0,01–0,001) Причем применение только аллантоина не нормализовало активность фермента в эритроцитах (на 40 % ниже нормы), а введение только ПАБК оказывается недостаточным для нормализации работы каталазы в эритроцитах и печени, где активность фермента остается на 39 и 49 % ниже интактного контроля. В модельных экспериментах было установлено, что аллантоин в конечной концентрации 10–11 М снижал интенсивность Fe2+-индуцированной ХЛ на 12 %. Это снижение наблюдали при повышении его концентрации вплоть до 10–6 М, при которой оно достигает 19 %. ПАБК в конечных концентрациях от 10–1 до 10–5 М практически полностью ингибировала ХЛ-ответ, в концентрациях от 10–6 до 10–9 М интенсивность свечения пробы практически не отличалась от контроля. Применение смеси аллантоина и ПАБК в равных молярных отношениях пока82 зало, что мощный антиоксидантный эффект выявляется при их конечных концентрациях от 10–6 до 10–7 М. Это подтверждает, что в системе аллантоин–ПАБК п-аминобензойная кислота может выступать в качестве донора электрона для аллантоина и тем самым поддерживать шунтирующий антиокислительный эффект аллантоина (Гуськов и др., 2004). Структурные антиоксиданты. Активность процессов ПОЛ в мембранах и липопротеидах сыворотки существенно зависит от их структурной организации. Соединения, называемые структурными антиоксидантами (токоферолы, стероиды, эйкозаноиды) снижают активность ПОЛ посредством стабилизации мембран и липопротеидных комплексов (Афанасьев, Боронихина, 1987). Анализ данных литературы показал, что эффективность защитных систем зависит не только от уровня кислородной интоксикации, но и от состояния внутриклеточной среды (рН, концентрация антиоксидантов). При этом в зависимости от концентрации антиоксидантов действуют различные механизмы защиты: – обменные реакции ингибиторов со свободными радикалами; – взаимодействие с клеточными рецепторами; – изменение текучести липидов мембран; – непосредственное влияние на активность ферментов; – влияние на лиганд-белковые отношения через параметрический резонанс (Бурлакова, 1998). Таким образом, в живых организмах антиоксидантная защита представлена различными веществами и системами, которые находятся во взаимокомпенсаторных отношениях. Как правило, снижение концентрации или активности одних АО приводит к соответствующему изменению других, благодаря чему сохраняется общая активность радикальных окислительных процессов. АО работают в комплексе. Как ферментативные системы специализированы на разных этапах восстановления кислорода, так и для ингибиторов органических радикалов существует цепочка взаимопревращений, в результате которой образуется менее активная форма радикала. При этом можно говорить о своеобразных антиоксидантных цепях переноса электронов, эффективность функционирования которых определяется работой всех компонентов. 5.2. Антимутагенные эффекты антиоксидантов Генетический аппарат – одна из наиболее уязвимых мишеней самых разных деструктивных факторов, в том числе и окислительного стресса. Подсчитано, что за 70 лет жизни человека организм производит около одной тонны радикалов кислорода, хотя только 2–5 % вдыхаемого с воздухом кислорода превращается в его токсические радикалы. В клетке крысы может возникать до 104 вызванных активными формами кислорода повреждений ДНК в день, и при постоянных условиях до 10 % молекул белка могут иметь карбонильные модификации (Ames, 1989). Подавляющее большинство из них нейтрализуется еще до того, как успевают повредиться те или иные компоненты клетки. Так, из каждого миллиона образующихся супероксидных радикалов от ферментной защиты ускользает не более четырех (Анисимов, 2003). Превышение скорости продукции АФК над скоростью их детоксикации может приводить к повреждению и гибели клеток, вызванному окислительным стрессом (Октябрьский, Смирнова, 2007). АФК индуцируют цепные реакции ПОЛ, приводящие к накоплению в клетке и организме гидроперекисей ненасыщенных жирных кислот, алкенов, алканов и МДА, вызывающих ДНК-повреждающие и мутагенные эффекты. Именно этот эффект скорее всего лежит в основе генерализованного характера мутагенного действия локальных источников АФК, так как транспорт радикальных продуктов одноэлектронного восстановления кислорода маловероятен из-за высокой реакционной способности (Владимиров Ю.И., Арчаков, 1972, Коркина и др, 1989, Halliwell, Gutteridge, 1984). 83 В экспериментах, с помощью которых можно количественно определить уровень продуктов, обладающих мутагенной активностью, были исследованы ткани животных, подвергавшихся ГБО-индуцированному окислительному стрессу. Генотоксичность тканей оценивали по интенсивности ДНК- репарационного SOS-ответа клеток E. coli РТ-1 в присутствии гомогенатов тканей. Показано, что окислительный стресс (ГБО при 0,5 МПа–2 ч) у крыс сопровождается накоплением в тканях метаболитов, обладающих генотоксичными и цитотоксическими эффектами и влияющих на интенсивность биолюминесценции в SOS-lux тесте: наибольшее их количество зарегистрировано в тканях мозга и почек, в печени и легких –количество незначительно. После сеанса ГБО в режиме 0,7 МПа (до судорог) генотоксичность гомогенатов всех исследованных тканей достоверно увеличивается по сравнению с тканями интактных животных (табл. 5.3). Таблица 5.3 Зависимость фактора индукции SOS-ответа (Ic), индуцируемого гомогенатами тканей крыс от воздействия ГБО и предварительного введения аллантоина Вариант опыта Ткань контроль ГБО (0,5 МПа–2 ч) аллантоин + ГБО (0,5 МПа–2 ч) Мозг 0,970,064 0,600,011 0,980,081 Р1 >0,1 0,05 >0,1 >0,1 0,05 Р2 Легкие 1,3070,036 0,9220,007 0,9490,097 Р1 >0,1 >0,1 >0,1 >0,5 >0,05 Р2 Печень 1,2750,062 1,1240,047 0,9250,088 Р1 >0,1 >0,1 >0,1 >0,05 >0,1 Р2 Почки 1,110,09 0,680,076 1,0290,071 Р1 >0,1 0,05 >0,5 >0,1 0,05 Р2 Примечание: Р1 – достоверность различий по сравнению контролем; Р2 – достоверность различий по сравнению с действием ГБО. Анализ величины изменений показателей интенсивности ПОЛ (МДА и ШО) и фактора индукции свечения в SOS-lux тесте, характеризующего степень повреждения ДНК, выявил однонаправленность их изменений, что позволяет говорить о сопоставимости биохимических показателей и степени генотоксичности тканей животных после окислительного стресса. Изучение влияния предварительного, перед обработкой ГБО, введения животным аллантоина на накопление в тканях крыс генотоксичных метаболитов показало, что оно предотвращает накопление во всех исследованных тканях метаболитов, обладающих цито- и генотоксичными свойствами, при этом их уровень соответствует контролю (Покудина, 2002). Генотоксический и мутагенный эффект АФК могут быть реализованы на разных уровнях организации клетки. Значительный экспериментальный материал, полученный при исследовании влияния антиоксидантов на индуцированный мутагенез в различных тест-системах, позволяет констатировать очевидную взаимосвязь между антиоксидантны84 ми и антимутагенными свойствами природных и синтетических соединений (Алекперов, 1984, Дурнев, Середенин, 1993). Защитное действие ингибиторов свободно-радикальных реакций может быть связано не только с их способностью понижать уровень свободных радикалов, но также с влиянием антиоксидантов на системы репарации, подавляя спонтанный и индуцированный мутационный процесс. Понимание механизмов генотоксического эффекта позволяет целенаправленно апробировать химические соединения, обладающие способностью снижать их токсические эффекты, блокируя конкретные этапы развития патобиохимических процессов. Существенную роль в защите могут играть соединения, индуцирующие синтез и/или повышающие активность антиоксидантных ферментов, репарагены и стабилизаторы нативной структуры нуклеиновых кислот. Последняя группа соединений является наименее изученной в качестве протекторов от окислительного стресса. В то же время именно эта группа низкомолекулярных химических агентов может оказаться весьма эффективной для минимизации генотоксических эффектов при окислительном стрессе. В работе для определения частоты устойчивых к рифампицину мутантов использовали штамм E. coli PT-1, который сконструирован на основе штамма С 600, и трансформирован плазмидой pPLS-1, несущей Lux-оперон под контролем SOS-промотора. Были исследованы нетоксичные концентрации перекиси водорода и аллантоин в дозе 10–6 М, которая оказалась максимально эффективной в предварительных модельных экспериментах (табл. 5.4). Таблица 5.4 Частота Rifr-мутантов у E. coli после обработки перекисью водорода и аллантоином Концентрация Н2О2, М 0 10–7 10–6 Количество Rif r-мутантов / 107клеток без аллантоина в присутствии аллантоина 2,4±0,38 1,2±0,26 * 3,2±0,32 1,08±0,29 17,2±0,28* 1,0±0,17 * – отличия от контроля статистически достоверны, Р< 0,05. Как видно из результатов, представленных в таблице, обе концентрации перекиси водорода индуцируют мутации у тестерного штамма E. coli. Культивирование бактерий с аллантоином, введенным за 1,5 ч до обработки перекисью, снижает частоту возникновения мутантов во всех вариантах опыта. Примечательно, что частота мутантов в присутствии аллантоина без перекиси в два раза ниже фоновой частоты. Антимутагенное действие аллантоина было показано также на луке Allium cepa L. после обработки проросших корешков перекисью водорода. В клетках корневой меристемы регистрировали митотический индекс и уровень аббераций хромосом (АХр) с помощью анафазно-телофазного метода. Как видно из таблицы 5.5, перекись водорода снижает частоту клеточных делений и повышает долю абберантных клеток. Обработка проросших корешков лука аллантоином в концентрации 10–6 – 10–5 (фиксация через 18 ч) снижает уровень АХр, индуцированный перекисью водорода. В пределах этих концентраций отмечена тенденция к нормализации митотического индекса. Через 48 ч после действия перекиси водорода уровень АХр снижается, если проростки были предварительно обработаны аллантоином в концентрации 10–6, 10–5, 10–3 М. (Гуськов и др., 2004). 85 Аллантоин нивелирует H2O2-индуцированный мутагенез, вероятно препятствуя восстановлению перекиси в гидроксильный радикал, или инактивируя последний, и снижает токсичность высоких концентраций H2O2 (Гуськов Е.П. и др., 2002). Неспецифический SOS-ответ играет центральную роль в защите клеток E. coli от воздействия различных генотоксических агентов и включает одновременную координированную экспрессию 20 генов. В наших экспериментах влияние аллантоина на уровень активности репарационных систем оценивали методом биолюминесцентного анализа SOS-ответа клеток E. coli, индуцированного перекисью водорода. Повреждение ДНКтестерного штамма ведет к индукции свечения. Раствор аллантоина необходимой концентрации (150 мкл) вводили в 3 мл суспензии бактерий за 1,5 ч до обработки перекисью, одновременно с ней и через 1,5 ч после инкубации с перекисью в течении 1,5 ч В качестве контроля для учета спонтанного уровня биолюминесценции E. coli в культуральную среду вносили аликвоты дистиллированной воды. Данные по влиянию аллантоина на перекисную SOS-индукцию представлены в таблице 5.6. Введение в бактериальную культуру перекиси водорода приводит к индукции мощного SOS-ответа по сравнению с фоновым. Предварительное инкубирование бактериальной культуры с аликвотами аллантоина в течение 1,5 ч до обработки перекисью водорода полностью нивелирует ее эффект, снижая величину фактора индукции до уровня контроля. При введении аллантоина в суспензию клеток E. coli через 1,5 ч после обработки Н2О2, происходит незначительное снижение величины SOS-ответа. При одновременном введении аллантоина и перекиси изменения величины фактора индукции не зарегистрировано. Тушение аллантоином как мутагенеза, так и SOS-ответа, развивающегося под действием перекиси водорода, указывает на способность этого вещества непосредственно защищать ДНК от деструктивного действия гидроксильного радикала, что характерно и для мочевой кислоты (Гуськов и др., 2002). Сопоставление антимутагенной активности аскорбиновой кислоты и аллантоина показало, что оба вещества подавляют генотоксическое действие перекиси водорода в использованной системе, при этом последний является более эффективным протектором клеточной ДНК от АФК. Результаты по влиянию исследованных соединений на индуцированный перекисью водорода SOS-ответ представлены в таблице 5.7. Показатель антимутагенного потенциала (А, %) рассчитывали как процент уменьшения генотоксической активности перекиси водорода в присутствии изучаемой пробы. Максимальная активность регистрируется для аллантоина в концентрации 10–4 М, а для аскорбата – 10–2 М. Кроме того, антимутагенная активность аллантоина сохраняется и при его малых концентрациях, в которых аскорбат начинает усиливать SOS-индукцию, вызванную перекисью (Гуськов и др., 2004). Таким образом, исследование способности аллантоина модифицировать генотоксические эффекты активных форм кислорода, влиять на процессы мутагенеза и SOSиндукции, запускаемые у E. coli перекисью водорода, показало, что аллантоин представляет собой один из универсальных антимутагенов, в основе механизма действия которого лежит каскадная инактивация метаболитов, токсичных для генома. Установлена роль АФК в мутагенном действии различных ксенобиотиков. Систематический анализ исследований по этому вопросу позволил сделать вывод о том, что имеются мутагены, оказывающие повреждающее действие за счет нарушения клеточного гомеостаза, прежде всего процессов образования свободных радикалов кислорода и перекисного окисления липидов (Дурнев, Середенин, 1990). 86 Таблица 5.5 Цитогенетические последствия в клетках корневой меристемы лука после обработки аллантоином и перекисью водорода Общее Число число АХр m, % АХр анафаз Вариант Контроль 1156 18 Р 1,5± 0,35 Митотический индекс m, % 8,48 ± 0,83 Р Через 18 ч после обработки Н2О2 0,05 М Н2О2 Алл 10–2 М + 0,05 М Н2О2 1142 560 73 43 Алл 10–3 М +0,05 М Н2О2 571 32 Алл 10–4 М + 0,05 М Н2О2 1095 57 Алл 10–5 М + 0,05 М Н2О2 937 27 Алл 10–6 М + 0,05 М Н2О2 1054 33 Алл 10–7 М + 0,05 М Н2О2 976 40 6,39 ± 0,72 Р1<0,001 7,68 ± 1,12 Р1<0,001 Р2>0,1 5,60 ± 0,96 Р1<0,001 Р2>0,1 5,20 ± 0,67 Р1<0,001 Р2>0,1 2,88 ± 0,55 Р1<0,05 Р2<0,001 3,13 ± 0,55 Р1<0,01 Р2<0,001 4,09 ± 0,63 Р1<0,01 Р2<0,001 6,32 ± 0,41 Р1<0,01 6,51 ± 0,74 Р1<0,05 Р2>0,1 5,60 ± 0,65 Р1<0,01 Р2>0,1 7,15 ± 0,67 Р1>0,1 Р2>0,1 8,30 ± 0,77 Р1>0,1 Р2<0,01 8,20 ± 0,84 Р1>0,1 Р2<0,01 8,50 ± 0,84 Р1>0,1 Р2<0,01 Через 48 ч после обработки Н2О2 0,05 М Н2О2 Алл 10–2 М + 0,05 М Н2О2 1090 426 77 31 Алл 10–3 М + 0,05 М Н2О2 1234 51 Алл 10–4 М + 0,05 М Н2О2 938 53 Алл 10–5 М + 0,05 М Н2О2 869 37 Алл 10–6 М + 0,05 М Н2О2 1001 40 7,06 ± 0,78 Р1<0,001 7,28 ± 1,26 Р1<0,001 Р2>0,1 4,13 ± 0,58 Р1<0,001 Р2<0,001 5,39 ± 0,72 Р1<0,001 Р2>0,1 4,26 ± 0,68 Р1<0,001 Р2>0,01 4,00 ± 0,62 Р1<0,001 Р2<0,001 7,50 ± 0,91 7,45 ± 0,75 Р1>0,1 Р2>0,1 Р1<0,05 Р2>0,1 Р1>0,1 Р2>0,1 Р1>0,1 Р2>0,1 Р1>0,1 Р2>0,1 6,17 ± 0,74 7,98 ± 0,72 7,07 ± 0,25 7,74 ± 0,73 Примечание: Р1 – достоверные отличия по сравнению с контролем; Р2 – достоверные отличия по сравнению с H2O2. Таблица 5.6 Индукция SOS-ответа (Ic) E. coli перекисью водорода в присутствии аллантоина Варианты опыта Без Н2О2 За 1,5 ч до обработки Н2О2 Одновременно с Н2О2 Через 1,5 ч после обработки Н2О2 Контроль (Н2О) 1 1 1 1 8,910,10 5,90,31 5,140,14 0,950,12 5,400,06 4,120,06 0,01 0,001 Н2О2 Аллантоин Р1 Р2 1,070,11 0,001 0,01 Примечание: Р1 – достоверность различий по сравнению контролем; Р2 – достоверность различий по сравнению с действием Н2О2. 87 Таблица 5.7 Индукция SOS-ответа E. сoli перекисью водорода в присутствии аллантоина и аскорбиновой кислоты Концентрация, М 0 10–12 10–11 10–10 10–9 10–8 10–7 10–6 10–5 10–4 10–3 10–2 Аллантоин Аскорбат А, % фактор идукции А, % фактор индукции 39 36 75 75 75 86 82 86 93 64 75 141 ± 9,0 83 ± 5,2 92 ± 8,5 37 ± 2,2 37 ± 2,2 37 ± 2,2 22 ± 3,1 24 ± 3,2 22 ± 2,1 9 ± 2,8 51 ± 5,4 35 ± 3,3 –403 –120,5 –140 –226 40 54 50 65,5 49 73 95,5 158 ± 11,2 638 ± 40,7 190 ± 12,6 221 ± 24,2 356 ± 41,3 95 ± 6,3 73 ± 6,4 79 ± 5,6 55 ± 4,2 80 ± 7,1 43 ± 3,3 7 ± 1,2 Важно отметить следующее: несмотря на то, что вклад отдельной АФК или конкретного продукта ПОЛ в индукцию мутаций неясен, очевидно, что с точки зрения подходов, принятых в фармакологии, поиск антимутагенных средств против ксенобиотиков, мутагенные свойства которых опосредованы избыточным образованием АФК, следует проводить среди соединений, имитирующих СОД-подобную активность, а также хелаторов металлов и веществ, снижающих содержание гидропероксида водорода. В их число, в частности, входят соединения, у которых ранее были выявлены антимутагенные свойства: производные 3-оксипиридина, 1,4-дигидропиридина, 1,4-бензо-диазепина, 2-меркаптобензимидазола, природные флавоноиды (Дурнев, Гусева, 1991, Середенин, Дурнев, 1990). Вместе с тем АФК являются необходимыми компонентами нормального метаболизма клетки, в которой существует четкий баланс между индукторами и промоторами свободнорадикальных процессов (Афанасьев, 1988), поэтому вмешательство в механизм поддержания окислительно-восстановительного гомеостаза может приводить к негативным последствиям даже в том случае, если использовано физиологическое вещество. Многочисленные подтверждения этого положения получены при изучении низкомолекулярных компонентов антиоксидантной системы и синтетических антиоксидантов в качестве модификаторов индуцированного мутагенеза (Алекперов, 1984, Kinchi et al, 1984). Во многих случаях эти соединения проявляли, концентрационно- и дозозависимую инверсию протекторного действия в мутагенное или мутагенпотенцирующее (Дурнев, Середенин, 1990). Особенно часто инверсия эффекта наблюдается у соединений фенольной природы, например у синтетических антиоксидантов, используемых в качестве пищевых добавок; 2,6-дитрет-бутил-4-окситолуола, бутилированного 4-окси-анизола (Degre, Saheb, 1982, Matsuoka et al, 1989). Важным также является разнонаправленность изменений антиоксидантного статуса в различных органах (Doğru-Abbasolu et al., 1997; Papa, Skulachev, 1997), что соответствует и различной чувствительности к химическим канцерогенам и ионизирующему облучению. Для большинства антимутагенов, относящихся к классу антиоксидантов, характерна многофункциональность, что определяет множественность механизмов их действия при химическом мутагенезе, равно как и изменение эффектов в зависимости от мутагенов, тест-систем и внутриклеточной среды. Спектр генетической активности антиоксидантов включает и антимутагенное, и комутагенное действие. Одной из причин последнего является их прооксидантный потенциал. 88 Известно, что аскорбиновая кислота существенно снижает как спонтанный уровень повреждений ДНК, так и уровень повреждений при различных патологических состояниях, индуцированных окислительным стрессом (Halliwell, 1998; Rossman, Goncharova, 1998; McCall, Frei, 1999). Она является также ингибитором эндогенного образования генотоксикантов, модифицирующих мутагенез и канцерогенез на внеклеточном уровне (Худолей и др.,1996). В то же время показано, что при определенных условиях аскорбиновая кислота способна усиливать как рекомбинационные процессы, индуцируемые ГБО у дрожжей, так и летальное действие этого агента (Гуськов и др., 1985б). В экспериментах на дрозофиле показано, что защитный эффект антиоксидантов проявляется преимущественно в условиях, сводящих к минимуму или полностью исключающих их химическое или физическое взаимодействие с мутагеном. Следовательно, защитный потенциал антиоксидантов может реализоваться опосредованным путем, и этот механизм наиболее предпочтителен для целостного организма. Среди таких механизмов самое пристальное внимание привлекает подавление метаболической активации промутагенов/проканцерогенов, индукция глутатион-S-трансферазы, обезвреживающей электрофилы, подавление продукции и перехват свободных радикалов кислорода. Все они предотвращают или ограничивают образование первичных повреждений ДНК и имеют огромное значение для профилактики злокачественных новообразований (Kuzhir T., 1999). Антимутагенный эффект фолиевой кислоты связывают с ее участием в метилировании ДНК (VanPoppel, VandenBerg, 1997). Она снижает число спонтанных мутаций как на растительных, так и на животных объектах и мутаций, индуцированных ГБО (Гуськов, Шкурат, 1989а; Guskov et al., 1994), радиацией и алкилирующими соединениями, активно участвует в репарации ДНК на ранних этапах эмбриогенеза человека, существенно снижает риск возникновения онкологических заболеваний в зрелом возрасте (VanPoppel, VandenBerg, 1997). Известна антимутагенная активность разных витаминных препаратов по отношению к мутагенам различной природы. Для оценки антимутагенной активности в большинстве опубликованных исследований использованы цитогенетические тесты. При этом было выявлено, что витамины обладают определенной специфичностью действия по ряду критериев. Они проявляют избирательную активность по отношению к различным мутагенным воздействиям. Обнаружено также, что витаминные препараты обладают различиями в способности влиять на формирование индуцированных мутагенами разрывов ДНК (Gebhart еt al., 1985). Так, оптимальный защитный эффект на уровне ДНК был получен при комбинированном воздействии аскорбиновой кислоты и ретинола при использовании в качестве мутагена хлористого кадмия, в то время как каждый витаминный препарат обладал более низкой активностью (Артамонова и др., 1994). Синергизм тиолов, порфириновых производных, полифенолов с витаминами (например, токоферолом) расширяют эффективность клеточной антиоксидантной защиты (Dimascio et al., 1991). В различных генетических тестах хорошо показаны также антигенотоксичные и антиканцерогенные свойства таких компаундов (Ferguson, Philpott, Karunasinghe, 2004) Вероятно они входят в протекторную систему организмов от естественных и исскуственных мутагенов, непрерывно влияющих на генетический материал и другие компоненты клеток. В некоторых исследованиях у γ-облученных мышей наблюдалось значительное сокращение частоты микроядер в полихромных эритроцитах костного мозга и в эпителиаль89 ных клетках мочевого пузыря на фоне введения смеси витамина С, β-каротина и витамина Е (Kornhauser et al., 1994). Прием витамина С в сочетании с витамином Е и β-каротином ежедневно в течение 20 недель группами курящих и некурящих (мужчин в возрасте 50–59 лет) привел к значительному снижению степени эндогенного окисления пиримидина в лимфоцитах ДНК, что доказывает антиоксидантную защиту in vivo (Duthie et al., 1996). Антимутагенная активность ПАБК в клетках E. coli связана с двумя событиями: формированием комплекса с ДНК и стимуляцией фермента ДНК-полимеразы. На Е. соli была показана способность ПАБК снижать летальные и мутационные эффекты УФ и гамма-облучения (Васильева и др., 1984). Репарагенные свойства ПАБК впервые были показаны в экспериментах на Е. соli, в которых она оказывала ингибирующее влияние на мутагенные эффекты нитрозопроизводных мочевины и ряда других мутагенов (Васильева и др., 1982). Показаны также антимутагенные эффекты ПАБК при окислительном стрессе, индуцированном ГБО (Гуськов и др., 1992). В экспериментах in vitro было исследовано влияние аллантоина, ПАБК и их смеси на повреждения ДНК у E. coli при окислительном стрессе, индуцированном перекисью водорода. Как видно из результатов наших исследований, представленных в таблице 5.8, обнаружены мощные антиоксидантные свойства аллантоина и его смеси с ПАБК: инкубация тестерных бактерий с аликвотами аллантоина, ПАБК и их смеси в течении 1,5 ч перед обработкой Н2О2, достоверно снижает величину Ic до уровня контроля во всех вариантах опыта. Таблица 5.8 Зависимость фактора индукции SOS-ответа (Ic) E. coli РТ-1 от обработки перекисью водорода, аллантоином и ПАБК Ic в зависимости от времени добавления аллантоина и ПАБК в культуру E. сoli Варианты опыта Контроль ( Н2О) без Н2О2 за 1,5 ч до обработки Н2О2 одновременно с Н2О2 через 1,5 ч после обработки Н2О2 1 1 1 1 8,91±0,10 5,9±0,31 5,14±0,14 Н2О2 Аллантоин 1,070,17 0,950,12 5,400,06 4,120,06 Р1 >0,1 >0,1 0,01 0,001 0,001 >0,1 0,01 Р2 ПАБК 0,950,12 1,450,15 5,090,25 5,090,25 Р1 >0,5 >0,1 0,001 0,01 0,001 >0,5 >0,1 Р2 Аллантоин+ПАБК 1,080,37 1,590,29 6,20,75 5,50,23 Р1 >0,1 >0,05 0,05 0,01 0,01 >0,1 >0,1 Р2 Примечания: Р1 – достоверность различий по сравнению контролем; Р2 – достоверность различий по сравнению с действием Н2О2. Протекторные свойства аллантоина, ПАБК и их смеси для E. coli исследовались также в условиях ГБО-индуцированного (0,5 МПа–2 ч) окислительного стресса. Исследуемые вещества добавляли в суспензию тестерных бактерий за 1,5 ч до сеанса ГБО, непосредственно перед сеансом и сразу после него. Результаты представлены в таблице 5.9. Как видно из таблицы, наибольший эффект по нивелированию цитотоксического действия ГБО на клетки E. coli, обнаружен при предварительной инкубации бактериальной куль90 туры с аллантоином, ПАБК и их смесью в течении 1,5 ч, что выражается в нормализации ДНК-репарационных процессов. Величина фактора индукции биолюминесценции, при этом находится на уровне контрольных значений. Таблица 5.9 Зависимость фактора индукции SOS-ответа (Ic) E. coli РТ–1, от обработки ГБО (0,5 МПа–2 ч), аллантоина и ПАБК Ic в зависимости от времени добавления аллантоина и ПАБК в культуру E. сoli Варианты опыта Контроль (Н2О) без ГБО за 1,5 ч до обработки ГБО одновременно с ГБО через 1,5 ч после обработки ГБО 1 1 1 1 0,44±0,017 0,54±0,07 0,65±0,15 ГБО Аллантоин 1,070,12 0,940,084 0,520,015 0,540,015 Р1 >0,1 >0,1 0,001 0,01 0,05 >0,1 >0,5 Р2 ПАБК 0,950,01 0,930,044 0,560,012 0,530,59 Р1 >0,1 >0,05 0,001 0,05 0,01 >0,1 0,01 Р2 Аллантоин+ПАБК 1,080,12 0,930,037 0,670,007 0,610,03 Р1 >0,1 >0,1 0,001 0,01 0,01 0,01 >0,5 Р2 Примечание: Р1 – достоверность различий по сравнению контролем; Р2 – достоверность различий по сравнению с действием ГБО. Полученные результаты свидетельствуют о синергическом эффекте аллантоина и ПАБК, их смесь гораздо эффективнее, чем применение каждого вещества отдельно, активирует процессы репарации ДНК в клетках E. сoli, нивелирует мутагенное и токсическое действие перекиси водорода и ГБО, что позволяет говорить о системной организации антиоксидантной системы и своеобразных антиоксидантных цепях переноса электронов, эффективность функционирования которых определяется работой всех компонентов. 91 Глава 6. СВОБОДНОРАДИКАЛЬНЫЕ И МУТАЦИОННЫЕ ПРОЦЕССЫ У ЖИВОТНЫХ, ПРЕАДАПТИРОВАННЫХ К ОКИСЛИТЕЛЬНОМУ СТРЕССУ Проблема повышения устойчивости организма к воздействию экстремальных факторов среды является весьма существенной, поскольку расширяет спектр исследований природы от космоса до глубин океана. В качестве одного из способов повышения устойчивости организма к воздействию экстремальных факторов была предложена предварительная обработка организма малыми дозами токсического агента, которая получила название предварительной адаптации, или преадаптации. Согласно концепции, сформулированной Риджером с соавторами, предобработка организма малыми дозами мутагенов или стрессорных агентов повышает устойчивость клеток к последующим мутагенным воздействиям (Rieger et al., 1975). Феномен повышения устойчивости организма в результате преадаптации получил название адаптивного ответа. Показана неспецифичность феномена адаптивного ответа для различных факторов, условий воздействия (in vivo и in vitro) и объектов (микроорганизмы, растения и животные) (Спитковский, 1992; Joiner е.а., 1999; Опритов и др., 1999; Моргун и др., 2003; Васильева, 2004). Ранее было показано, что предварительное воздействие малых доз может повышать устойчивость организма к более сильным воздействиям в результате преадаптации метаболических систем организма, приобретенной в процессе реакции на первичное воздействие (Гаркави и др., 1990). В то же время, онтогенетический аспект этого явления ранее практически не был освещен в научной литературе. Немногочисленные исследования, посвященные этой проблеме и выполненные на низших позвоночных (Тимофеева, 1997; Timofeeva, Shkurat, 1996), оказались недостаточными для анализа механизма установления устойчивости ювенильных форм, обработанных низкими дозами агентов, к экстремальным воздействиям, которым подвергается организм во взрослом состоянии. Однократное воздействие гипербарической оксигенации на ранних этапах онтогенеза Xenopus laevis изменяет способность антиоксидантных систем взрослого организма реагировать на окислительный стресс, причем малые давления (0,2 МПа) способствуют биохимической адаптации, в то время как высокие (0,7 МПа) приводят к дисбалансу и ингибированию систем, ответственных за антиоксидантную защиту. Эти данные свидетельствуют о формировании онтогенетического импринтинга после адаптивного воздействия окислительного стресса (Гуськов и др., 1997; 1999; 2002). 6.1. Генетико-биохимические особенности реакции тканей взрослых особей амфибий на окислительный стресс после предварительной их обработки ГБО на ранних стадиях развития В работах, выполненных в НИИ биологии ЮФУ в конце ХХ в., были установлены некоторые закономерности в изменении уровня аберраций хромосом у взрослых амфибий после предварительной обработки ГБО на ранних стадиях развития и их взаимосвязь с перекисным окислением липидов и состоянием антиоксидантной системы в процессе развития Хenopus laevis ( Гуськов и др., 1997; Тимофеева,1997; Гуськов и др., 2001б). В этих работах было показано увеличение уровня АХр на ранних стадиях зародышевого развития (табл. 6.1). 92 Таблица 6.1 Уровень аберраций хромосом на разных стадиях онтогенеза Xenopus laevis в норме и после воздействия ГБО Время после ГБО, ч Общее число анафаз Анафазы с аберрациями хромосом АХрm, % типы аберраций хромосом – = Z X –X– 8-я стадия развития Контроль 194 12 5 2 2 0 3 6,2 1,73 1 423 12 2 4 5 0 1 2,8 0,80 24 731 36 6 7 11 2 10 9,9 0,79 24-я стадия развития Контроль 535 22 7 5 3 4 3 4,1 0,85 1 575 18 9 3 6 0 0 3,1 0,72 24 845 37 14 10 5 3 5 4,4 0,70 35-я стадия развития Контроль 639 24 10 8 2 1 3 3,8 0,75 1 485 8 3 2 0 2 1 1,6 0,57 24 1089 19 10 4 3 2 0 1,7 0,39 40-я стадия развития Контроль 1212 12 7 1 3 1 0 0,9 0,26* 1 1151 21 13 3 3 1 1 1,8 0,39 24 2261 71 14 10 35 11 1 3,1 0,36* 50-я стадия развития Контроль 662 9 6 1 2 0 0 1,4 0,47 1 1522 51 23 11 10 2 5 3,4 0,46* 24 2996 98 55 14 13 2 14 3,3 0,33* * Р < 0,001 – отличия опытных вариантов по сравнению с контролем и контрольных вариантов по сравнению с 8-й стадией. общее число АХр Основной вклад в становление аберраций хромосом на всех исследуемых стадиях раннего развития зародыша амфибии вносили одиночные и множественные фрагменты (Тимофеева, 1997). Такого рода перестройки чаще всего приводят к гибели клетки. Гибель клеток при их миграции, образовании различных полостей, закрытии трубок, соединений и разделении зачатков органов является одной из основных особенностей развития многоклеточных организмов. О генетической детерминированности этого процесса свидетельствует тот факт, что гибель клеток происходит на одной и той же стадии развития и в определенных участках эмбриона (Конюхов, 1973). У млекопитающих уже на стадии бластоцисты погибает 6–8 клеток, что составляет в среднем 10 % всех клеточных элементов зародыша. В ходе формирования органов число гибнущих клеток в эмбриогенезе еще более значительно (Конюхов, 1973). Ранее было показано, что у млекопитающих частота хромосомных аберраций неодинакова на разных стадиях онтогенеза. J. Boue и A. Boue (1974) на основе цитогенетического анализа материала 1 205 спонтанных абортов показали, что частота хромосомных аномалий резко изменяется в зависимости от срока прерывания беременности: на второй неделе она составляет 7,8 %, на третьей – 60, на четвертой – 61 % (в среднем до 14 недель беременности – 66 %). В цитогенетическом исследовании Дж. Боуэ с соавторами (Boue et al., 1976), наиболее полно охватившем материал поздних спонтанных абортов, пока93 зано, что в период с 8-й по 27-ю недели беременности частота хромосомных аномалий значительно ниже по сравнению с этим показателем для более ранних сроков и в среднем составляет около 30 % (Бочков, Чеботарев, 1989). В работах В.В. Кошелевой о влиянии ксенобиотиков на эмбриогенез радужной форели было отмечено, что форель на ранних стадиях постэмбрионального развития более чувствительна к загрязнению, чем в эмбриональный период (Кошелева, 1988). Существуют данные, из которых вытекает, что гаструляция, нейруляция и закладка осевого комплекса, т.е. очень сложные формообразовательные процессы, включающие в себя первичную индукцию, детерминацию и клеточную дифференцировку, отбор клонов клеток и строго синхронизированную их пролиферацию, морфогенетические движения, могут осуществляться у зародышей млекопитающих и при наличии клеток с частично утраченной генетической информацией. Однако хромосомные мутации летальны для млекопитающих во время органогенеза (Дыбан, Баранов, 1978). Данные закономерности прослеживаются и в раннем развитии зародышей амфибий. Сопоставление результатов исследований уровня аберраций хромосом и выживаемости животных в контроле и после воздействия ГБО, полученные Тимофеевой (1997), указывает на то, что именно 50-я стадия личинки, стадия активного органогенеза, является критической в развитии амфибий. Именно на этой стадии происходит падение выживаемости личинок в контроле. Если до 50-й стадии при нормальном процессе развития выживает 90 % личинок, то после 50-й стадии до метаморфоза доходит только 70 %. Аналогичная картина наб людается и у зародышей, обработанных повышенным давлением кислорода: в период прохождения личинкой стадий активного органогенеза выживаемость животных резко падает. По данным разных авторов, высокий уровень спонтанного мутационного процесса в раннем эмбриогенезе амфибий может зависеть от взаимодействия комплекса разнообразных причин. В возникновении спонтанных мутаций не последняя роль принадлежит активным формам кислорода и продуктам ПОЛ. В этой связи высокий уровень спонтанного мутагенеза на предличиночных стадиях может быть следствием повышенного содержания в этот период развития продуктов ПОЛ, в том числе МДА (табл. 6.2). Установлена достаточно высокая положительная корреляционная зависимость между уровнем вторичных продуктов ПОЛ, главным образом МДА, и выходом АХр в клетках костного мозга крыс (Шкурат и др., 1993). Изменение уровня естественного мутирования в ходе раннего онтогенеза амфибий согласовывается с данными И.В. Тимофеевой (1997) о динамике свободно-радикального ПОЛ в гомогенатах Xenopus laevis на различных стадиях развития. В процессе исследований автором было получено высокое содержание первичных продуктов окисления на эмбриональных этапах развития лягушки. Одна из причин – высокое содержание в развивающемся яйце эндогенных липидов, являющихся субстратом перекисного окисления (Руднева-Титова, Жерко, 1994). О.П. Мелеховой показано, что в эмбриональных клетках на ранних этапах развития зародыша наиболее активное радикалообразование обнаруживается в ядрах и желточных гранулах (Мелехова, 1976). В интенсивно идущих в эмбриогенезе процессах утилизации желтка определенную роль может играть ПОЛ, поскольку желток представляет собой фосфолипидный комплекс. Субстратом ПОЛ в ядрах могут быть ненасыщенные жирные кислоты липидов транскрипционно активного хроматина (Губский и др., 1990), максимальное содержание которого наблюдается в поздней бластуле и в начале органогенеза. Учитывая эти факты, становится понятным увеличенное по сравнению с личиночными стадиями количество 94 клеток с аберрациями хромосом на стадиях эмбриогенеза. Действительно, образование реактивных продуктов свободнорадикальных реакций в непосредственной близости с генетическим материалом должно приводить к разрывам ДНК, которые вносят определенный вклад в становление аберраций. Таблица 6.2 Динамика МДА в гомогенатах Xenopus laevis на разных стадиях развития после действия ГБО (0,7 МПа–1 ч) (Тимофеева, 1997), нмоль/мг белка Стадия Инкубация ЭМБРИОНАЛЬНЫЕ нет 8-я есть нет 24-я есть нет 35-я есть нет ЛИЧИНОЧНЫЕ 40-я есть нет 50-я есть нет 62-я есть Контроль 1331,7 24,88 715,4 13,27 272,3 86,47 188,5 17,07 272,3 86,47 188,6 13,07 108,4 22,76 39,7 11,58 92,6 5,01 192,2 23,23 81,0 15,40 84,9 20,33 ГБО–1 ч п/д 949,8 56,41 (P<0,01) 575,4 75,75 (P>0,1) 272,3 86,47 (P>0,1) 188,6 16,03 (P>0,1) 241,2 68,94 (P>0,1) 211,7 28,06 (P>0,1) 40,1 5,54 (P<0,05) 16,3 1,85 (P>0,1) 45,6 10,58 (P<0,02) 43,7 6,24 (P<0,01) 71,9 6,38 (P>0,1) 67,1 1,30 (P>0,1) ГБО–24 ч п/д 663,5 58,63 (P<0,001) 404,3 38,54 (P>0,1) 164,6 48,02 (P>0,1) 138,8 57,16 (P>0,1) 162,9 50,51 (P>0,1) 134,7 14,35 (P>0,1) 51,6 2,26 (P<0,05) 20,3 1,69 (P>0,1) 54,4 5,32 (P<0,01) 48,0 2,57 (P<0,01) 86,2 8,17 (P>0,1) 64,0 6,34 (P<0,001) Аберрации хромосом, как правило, ведут к гибели клетки, причем этот тип клеточной гибели происходит по типу апоптоза, является физиологическим процессом, противоположным митозу и, как считают в настоящее время, программированным (Новиков, 1996). Большую роль в эмбриональной программированной клеточной гибели (ПКГ) некоторые исследователи отводят продукции свободных радикалов. Изучение эмбрионов на ранних этапах развития показало, что ПКГ происходит уже через 15 ч после зачатия в период бластогенеза. При этом в жидкости бластоцеля обнаружено высокое содержание перекиси водорода, вызывающего апоптическую гибель клеток (Pierce et al., 1989). Эту гипотезу также подтверждают свойства белка Bcl-2, который является основным супрессором клеточной гибели (Korsmeyer, 1992). Показано, что Bcl-2 является мембранным белком митохондрий, плазматической и ядерной мембран (Hockenbery et al., 1993) и обладает антиоксидантным свойством. Он не влияет на выработку активных форм кислорода (Korsmeyer et al., 1995), но подавляет пероксидацию липидов, действуя как нереактивная свободнорадикальная ловушка (Hockenbery et al., 1993). 95 Клеточная гибель в эмбриогенезе изучается еще с начала прошлого столетия. С тех пор многочисленные исследования выявили, что гибель клеток в процессе развития – нормальное и повсеместное явление. Однако биологический смысл и причина возникновения этого явления являются фундаментальными вопросами биологии развития, ответы на которых до сих пор остаются открытыми. Результаты, полученные на двумерной компьютерной модели клеточной селекции, позволили выдвинуть гипотезу о хаотичности процесса клеточных генераций в развитии, для упорядочения которого в морфогенезе требуется клеточная гибель (Michaelson, 1991). Исследователи, занимающиеся изучением развития нервной системы, предполагают, что в целом в основе эмбрионального перепроизводства клеток и последующей их гибели лежат принципы надежности обеспечения данной функции, отбора и «обучения» (Brown, 1994; Raff, 1993). Описанные выше гипотезы были дополнены И.В. Тимофеевой (1997). Изменение уровня свободнорадикальных процессов может служить сигналом к апоптозу, т.е. запускать программированную клеточную гибель. Гибнет та часть клеток, в которых уровень свободнорадикальных процессов превосходит антиоксидантную емкость. Гибнущая популяция клеток – поставщик как веществ для энергетического и пластического обмена, так и низкомолекулярных антиоксидантов (Гуськов, Лукаш, 1986). Судя по результатам, в активно делящихся клетках эмбриона наблюдается дефицит ферментативных антиоксидантов. Следовательно, система апоптоза представляет собой неспецифическую защиту от свободных радикалов активно пролиферирующих клеток. В работе О.П. Мелеховой описано, что при переходе к периоду терминальной дифференцировки (стадии личинки) вступает в действие новая метаболическая система: по мере развития яйца повышается число митохондрий и содержание в них цитохромоксидазы, радикалообразование из ядер и желточных гранул перемещается в митохондрии (Мелехова, 1976). В это время резкое возрастание активности СОД и каталазы способствует защите клеточных мембран от кислородных радикалов в период активного органогенеза. Очевидно, различная «биологическая стратегия» клеток зародыша на эмриональных и личиночных стадиях развития определяет и их ответную реакцию на окислительный стресс. Эмбриональные стадии развития шпорцевой лягушки демонстрируют устойчивость к воздействию кислорода под давлением (Тимофеева, 1997; Гуськов и др., 2001б). Таким образом, в раннем онтогенезе Xenopus laevis, от стадии средней бластулы до начала метаморфоза, наблюдали уменьшение содержания первичных и вторичных продуктов ПОЛ, накопление конечных продуктов ПОЛ, увеличение активности антиоксидантных ферментов и уменьшение уровня спонтанных нарушений хромосом. При этом эмбриональные, или стадии предличинки, и личиночные стадии достаточно четко делятся не только по морфологическим признакам, но и по исследованным нами цитогенетическим и биохимическим показателям. Феномен преадаптации Xenopus laevis был продемонстрирован на двухлетних лягушках, которые в раннем онтогенезе на стадии зародышевого развития (вылупления личинки, стадия 35) были обработаны различными режимами гипербарической оксигенации (0,2 МПа – 1 ч и 0,7 МПа – 1 ч), а затем во взрослом состоянии перенесли вторичную обработку ГБО (табл. 6.3). У животных, обработанных повышенным давлением кислорода на стадии вылупления личинки в режиме 0,2 МПа – 1 ч (группа «В»), во взрослом состоянии зарегистрирована повышенная активность ферментов антиоксидантной защиты именно в мозге, легких и крови по сравнению с интактным контролем. 96 Таблица 6.3 Влияние ГБО на интенсивность ПОЛ и активность антиоксидантных ферментов в различных тканях взрослых особей Xenopus laevis Показатели Органы, ткани ДК, нмоль/мг лип. ШО, ед/мг белка СОД, ед/мг белка каталаза, ед/мг белка Интактные животные (А) Мозг 6,5 0,45 4,6 0,87 16,8 1,79 44,8 3,57 Легкие 6,3 1,00 4,1 1,03 5,6 1,16 210,7 13,89 Печень 15,6 0,95 13,9 0,65 51,6 3,56 84,5 5,55 Мышцы 20,6 3,06 3,9 0,69 49,9 3,65 42,2 3,23 Кровь 9,9 1,09 12,8 1,11 1,0 0,12 34,0 4,70 0,7 МПа–1 ч (Б) Мозг 33, 4 9,65 19,0 2,82* 17,0 4,31 38,7 7,74 Легкие 3,8 0,37 17,8 3,53 14,8 4,02 121,4 10,11 Печень 18,4 1.94 14,6 1,83 42,3 2,90 78,8 7,08 Мышцы 35,2 7,65 5,2 0,89 41,3 3,14 48,4 4,62 Кровь 11,7 2,42 19,6 2,94 2,4 0,49 21,5 3,74 ГБО 0,2 МПа–1 ч на 35-й стадии развития (В) Мозг 9,0 1,64 10,4 1,67 25,5 2,34 112,0 5,50* Легкие 14,6 1,29* 17,6 1,47 34,5 1,52* 144,8 6,85 Печень 19,3 0,61 4,2 0,65* 35,3 1,48 60,3 3,57 Мышцы 20,7 1,32 7,3 2,02 16,4 1,93* 36,6 1,32 Кровь 5,7 0,58 12,8 1,14 2,0 0,17 43,0 2,30 ГБО 0,2 МПа–1 ч на 35-й стадии развития+ через 2 года обработка ГБО 0,7 МПа–1 ч (Г) Мозг 8,4 1,34 12,5 1,87 31,5 2,87 113,2 15,52 Легкие 17,6 2,41 10,3 2,33 28,3 2,27 198,3 14,35 Печень 27,4 2,41 6,2 1,35* 29,6 2,00* 50,9 4,30 Мышцы 27,2 2,39 5,3 0,74 15,9 2,25* 42,2 3,57 Кровь 7,2 1,22 20,8 2,85 1,7 0,08 22,0 0,74^ ГБО 0,7 МПа–1 ч на 35-й стадии развития (Д) Мозг 8,3 1,69 24,1 2,55* 22,1 5,13 99,7 11,99 Легкие 16,4 1,37* 9,6 1,14 13,2 2,77 141,5 10,73 31,2 9,79 2,9 0,85 Печень 19,4 2,27 17,5 2,0 38,7 2,54 62,5 4,37 Мышцы 21,5 2,19 5,5 0,88 21,0 2,53* 49,6 4,44 Кровь 7,0 1,49 19,8 1,83 2,3 0,27 34,2 3,17 ГБО 0,7 МПа–1 ч на 35-й стадии развития + через 2 года обработка ГБО 0,7 МПа–1 ч (Е) Мозг 32,5 4,58*^ 22,1 2,30 22,3 2,34 109,1 10,71* Легкие 5,3 1,29^ 6,6 2,04 56,2 4,4* 191,6 22,8 31,5 1,54*^ 36,0 8,60 19,2 2,32 Печень 21,4 2,62 18,6 2,39 39,7 3,77 75,9 5,78 Мышцы 18,2 2,55 5,6 1,38 24,3 4,37 44,0 3,72 Кровь 10,9 1,37 19,4 2,55 2,2 0,25 30,6 2,24 Примечание: * – достоверные отличия по сравнению с интактным контролем (P<0,001); ^ – достоверные отличия по сравнению с вариантом ГБО 0,7 МПа – 1 ч (P<0,001); ДК – диеновые конъюгаты; ШО – шиффовы основания. 97 Несмотря на повышенную интенсивность ПОЛ и активность антиоксидантных ферментов в мозге, легких и крови предобработанных животных, у них, по-видимому, устанавливается новое стационарное состояние, характеризующееся определенным балансом между уровнем свободнорадикальных процессов и системой антиоксидантной защиты. После вторичного воздействия ГБО у амфибий, предобработанных на стадии 35 кислородом в режиме 0,2 МПа, в тканях, наиболее чувствительных к ГБО – мозге, крови и легких, не произошло изменений в содержании продуктов ПОЛ и активности ферментов антиоксидантной защиты. Таким образом, у лягушек, предобработанных кислородом на ранних стадиях развития в режиме 0,2 МПА – 1 ч, сохраняется равновесие между интенсивностью ПОЛ и уровнем антиокислительной активности в ответ на повторное действие ГБО. Несмотря на то, что направленность изменений исследуемых биохимических показателей у животных, предобработанных ГБО на ранней стадии онтогенеза в режимах 0,2 и 0,7 МПа была сходной, ответные реакции на вторичную обработку ГБО существенно отличались. Во-первых, вторичное воздействие гипероксии на животных, предобработанных 0,7 МПа кислорода на стадии 35, приводило к 50 % летальности животных. Вовторых, наблюдалась резкая интенсификация перекисного окисления липидов мозга. В-третьих, по чувствительности легких после вторичной обработки животные группы «Е» в своем ответе на окислительный стресс также разделились на две подгруппы. В первой подгруппе не наблюдалась интенсификация процессов ПОЛ, во второй – количество ДК возросло на 92 % по сравнению с группой «Д». В обеих подгруппах значительно повышается активность СОД (на 318 и 517 % по сравнению с соответствующим контролем, что на 884 и 242 % выше, чем у интактных животных). Таким образом, на фоне достаточно резкого повышения активности СОД у всех организмов у одних обнаружено ингибирование ПОЛ, у других – активация этого процесса, что указывает на индивидуальную чувствительность животных к окислительному стрессу. Результаты экспериментов свидетельствуют о том, что предобработка амфибий на стадии личинки более низкими дозами стрессирующего агента оставляет длительный метаболический след в тех системах взрослого организма, которые характеризуются высоким уровнем обменных процессов. Предобработка малым давлением кислорода, судя по содержанию продуктов ПОЛ, резко снижает интенсивность свободнорадикальных процессов после повторного действия ГБО по сравнению с неадаптированными животными в наиболее чувствительной к кислородной интоксикации нервной ткани. Преадаптация животных экстремальным давлением кислорода не дает подобного эффекта. Эти данные свидетельствуют о формировании онтогенетического импринтинга после адаптивного воздействия окислительного стресса. Таким образом, в процессе перехода от эмбрионального к личиночному состоянию, предетерминированные клетки, не обладавшие тканевой специфичностью, меняют генетическую программу и проходят этапы, позволяющие им реализоваться в дифференцированную ткань. Реализуемая программа органогенеза формирует личиночные структуры, дальнейший онтогенез которых фиксируется как органоспецифические ткани, утерявшие свою тотипотентность. Именно к этому моменту относится формирование кровеносной системы и кроветворной ткани, которая обеспечивает переход от относительно аноксического состояния к активному кислородному дыханию, осуществляемому эритроцитами. Отмечая стадию 50 как критическую в ответной реакции на окислительный стресс, И.В. Тимофеева (1997) подчеркивает особое состояние антиокислительной системы личинок в этот период. На исследуемой стадии автор выявил существенный прирост МДА (на 50 и 35 %, соответственно) при инкубации гомогенатов туловища и хвостового отде98 ла, что может свидетельствовать о недостаточной емкости антиокислительной системы, и вносит определенный вклад в инициацию ПОЛ при окислительном стрессе на стадии 50 зародышевого развития. Также было предположено влияние свободнорадикальных процессов, активизирующихся после ГБО, на количество аберрантных анафаз, которое на стадиях 40 и 50 развития личинки после воздействия ГБО более чем в 2 раза превышало количество их в контроле. Причем высокий уровень аберраций хромосом на стадии 50 наблюдался через 1 ч после действия ГБО и сохранялся через 24 ч после воздействия, а на стадии 40 в течение указанного времени он возрастал. Это говорит о том, что при окислительном стрессе свободные радикалы не только непосредственно действуют на хроматин, инициируя разрывы ДНК, но и вызывают глубокие изменения в метаболических процессах дифференцирующейся клетки. После действия окислительного стресса на зародыши Xenopus laevis отмечена активация начальных этапов ПОЛ на стадии 50, которую можно рассматривать как критическую в возникновении чувствительности к кислороду. Активация конечных этапов ПОЛ обнаружена только на стадии завершения метаморфоза (стадия 62), что свидетельствует о нескомпенсированном усилении свободнорадикального окисления липидов в процессе раннего развития Xenopus laevis, являющегося важнейшим звеном в развитии кислородной интоксикации. Тот факт, что для гипербарооксигенации характерен продленный как цитотоксический, так и цитогенетический эффект, говорит о глубоких метаболических сдвигах после подобного воздействия. Повышенный уровень интенсивности ПОЛ, пониженная активность антиоксидантных ферментов говорят о стрессорном состоянии, в котором находится организм даже спустя сутки после воздействия ГБО. Нарушение генетического материала в данном случае уже нельзя объяснить только реактивным действием активных форм кислорода и его метаболитов (Тимофеева, 1997). В повреждении ДНК в отдаленные сроки после действия окислительного агента принимают участие нуклеазы, активирующиеся ионами кальция, который находится в клетке при окислительном стрессе в избытке (Halliwell, Aruoma, 1991). Именно на стадиях органогенеза отмечают повышенную чувствительность хроматина к Ca/Mg-зависимой эндонуклеазе. На основании проведенного анализа результатов исследований динамики активности ферментов в онтогенезе были сделаны выводы, имеющие существенное значение для характеристики возрастных изменений активности ферментов и их механизмов. Так, обнаружена обратная зависимость между исходным уровнем активности фермента и адаптивным эффектом в процессе онтогенеза, т.е. значение возраста оказывается большим тогда, когда активность фермента в тот или иной период онтогенеза ниже, чем в других. Подобная зависимость видна при сопоставлении данных об исходном уровне активности и о глубине адаптивных изменений гексокиназы, аспартатаминотрансферазы, аргиназы, аланинаминотрансферазы, протеолитических и других ферментов (Adelman, 1975; Парина, Калиман, 1978). Эта же закономерность прослеживается при изучении адаптивных реакций ферментов в различных тканях животных одного и того же возраста. Интенсификация активности исследуемых ферментов после воздействия ГБО зависит от исходного уровня в контроле (Тимофеева, 1997). В пионерских работах, посвященных реакциям организма на по вышенное давление кислорода Поль Бер показал, что холоднокровные животные обладают высокой степенью устойчивости к повышенному давлению кислорода. Различные органы и ткани имеют не одинаковую чувствительность к токсическому действию кислорода, что по-видимому, за99 кономерно как для теплокровных, так и для пойкилотермных животных (Садекова, 1991; Моргулис, 1992). В многочисленных экспериментах, проведенных на млекопитающих, было показано, что в условиях гипероксии в субклеточных фракциях различных тканей – крови, мозга, легких – обнаружена интенсификация ПОЛ как первичная реакция на окислительный стресс, уровень которого зависит от типа тканей (Кричевская и др., 1980; Кричевская и др., 1987; Милютина и др., 1994). В экспериментах на Xenopus самыми устойчивыми к окислительному стрессу оказались мышечная ткань и печень, а наиболее чувствительным – мозг. В крови и легких наблюдали увеличение активности супероксиддисмутазы, активность каталазы была несколько снижена. Незначительные изменения уровня первичных продуктов ПОЛ могут быть связаны с резкой активацией СОД. В то же время, обнаруженная дискоординация в функционировании сопряженных антиоксидантных ферментов – СОД и каталазы – может привести к дополнительной интенсификации ПОЛ, так как происходит недостаточно эффективная утилизация Н2О2, которая является источником одной из самых цитотоксически активных форм кислорода – гидроксильного радикала. Это подтверждается существенным накоплением конечных продуктов ПОЛ – шиффовых оснований. Известно, что ответом на любое стрессорное воздействие является развитие адаптационных реакций, в которых прослеживается два этапа: срочная и долговременная адаптация. Срочная адаптационная реакция возникает непосредственно после начала действия раздражителя, мобилизует все резервные возможности организма, и неотъемлемым ее компонентом является стресс-реакция (Меерсон, 1993). Одно из проявлений стрессреакции – интенсификация свободно-радикальных процессов, в том числе повышение содержания продуктов ПОЛ, которые рассматриваются в качестве «первичного медиатора» стресса (Барабой, 1991). При экстремальных воздействиях ПОЛ становится одним из повреждающих факторов стресса, что зависит только от силы и продолжительности воздействия стресс-фактора, способного «пробить» барьеры антиоксидантной защиты. Переход от срочной адаптации к долговременной осуществляется путем активации синтеза нуклеиновых кислот и белков, ответственных за устойчивую адаптацию, в том числе увеличение синтеза антиоксидантных ферментов. Показано, что уровень внутриклеточных ферментативных антиоксидантов находится под генетическим контролем, и модуляторами синтеза этих ферментов являются активные формы кислорода (Demple, Amabile-Cuevas, 1991). Таким образом, в раннем онтогенезе, в малодифференцированных, активно пролиферирующих и синтезирующих ДНК клетках происходит генетически детерминированная активация синтеза этих ферментов, и создание «структурного следа» долговременной адаптации (Меерсон, 1993). Но если у взрослых особей долговременная адаптация возникает постепенно, в результате длительного или многократного действия на организм факторов стресса, то может ли она развиться после однократного стрессорного воздействия на ранних стадиях онтогенеза. Каковы должны быть параметры стрессорного воздействия, чтобы адаптационный ответ был устойчивым? Результаты свидетельствуют о том, что однократное воздействие повышенного давления кислорода на личинки стадии 35 изменяет антиоксидантный метаболизм, который сохраняется во взрослом состоянии, т.е. информация, полученная презумптивными клетками в ювенильном периоде, сохраняется после прохождения всех стадий дифференцировки. Воздействие повышенного давления кислорода на личиночных стадиях индуцирует повышение активности ферментов антиоксидантной защиты в тканях взрослых животных. Причем если в легких и крови – за счет индукции активности СОД, то в мозге – за счет повышенной активности каталазы. Однако в тех же тканях интенсивнее идут 100 и свободнорадикальные процессы, о чем говорит повышенное содержание продуктов ПОЛ. При этом, если после обработки ГБО в режиме 0,2 МПа в мозге регистрировали повышенное содержание только ШО, а в легких – только ДК, то после обработки личинок ГБО в режиме 0,7 МПа у взрослых лягушек в мозге наблюдали повышение содержания ШО в 4 раза, а в легких – повышенное количество и ДК и ШО. Накопление ШО после токсического режима ГБО наблюдали и в крови уже взрослых лягушек. В то же время, несмотря на повышенную активность ПОЛ и антиоксидантных ферментов, по-видимому, существует определенный баланс между свободнорадикальными процессами и системой антиоксидантной защиты. После вторичного воздействия ГБО у амфибий, предобработанных на стадии 35 развития кислородом в режиме 0,2 МПа, в тканях, которые обнаружили наиболее значительные изменения после обработки интактных взрослых животных, изменений в содержании продуктов ПОЛ и активности ферментов антиоксидантной защиты не произошло. Таким образом, у лягушек, преадаптированных к кислороду на ранних стадиях развития малой дозой, равновесие между интесивностью ПОЛ и уровнем антиокислительной активности практически не нарушено по сравнению с результатом однократной предварительной обработки (Гуськов и др., 1999). Мышечная ткань оказалась индифферентной к такого рода воздействиям. Помимо достаточно специфического метаболизма мышечной ткани, у ныряющих животных роль миоглобина в мышечных клетках не ограничивается резервированием и облегчением доставки кислорода митохондриями. Обладая пероксидазной активностью, он принимает непосредственное участие в реакциях детоксикации свободных радикалов, таким образом являясь одним из важнейших звеньев антиоксидантной системы в мышцах (Сокрут и др., 1990). В печени обнаружено значительное увеличение и первичных, и конечных продуктов ПОЛ, по-видимому, связанное с пониженным уровнем активности СОД и каталазы как до повторного воздействия ГБО, так и после него (Тимофеева, 1997). Адаптационные ответы на вторичную обработку ГБО в экспериментах на Xenopus существенно отличались друг от друга, несмотря на то, что общая картина по определяемым биохимическим показателям у животных, предобработанных ГБО на ранней стадии онтогенеза в режимах 0,2 МПа и 0,7 МПа, на первый взгляд, была одинакова. Если после предобработки ГБО в режиме 0,2 МПа наблюдалась устойчивая долговременная адаптация организма, в котором органы-мишени стали резистентны к повторному стрессорному воздействию, то у животных, предобработанных ГБО в режиме 0,7 МПа, ответная реакция весьма неоднозначна. Во-первых, вторичное воздействие гипероксии приводило к 50 %-ной летальности животных этой группы. Во-вторых, наблюдалась резкая интенсификация перекисного окисления липидов мозга. В-третьих, у выживших животных чувствительность легких к окислительному стрессу оказалась парадоксальной: так, на фоне достаточно резкого повышения активности СОД у всех организмов у некоторых обнаружено ингибирование ПОЛ, у других – активация этих процессов. Таким образом, устойчивая долговременная адаптация к окислительному стрессу у взрослых Xenopus laevis зависит от возраста адаптируемого организма, когда клетки органов-мишеней (в данном случае мозг, легкие и кровь) не потеряли способность к формированию клеточной и тканевой основы долговременной адаптации. Если для взрослого организма необходимо учитывать параметры интенсивности, продолжительности и кратности воздействия, то для развития устойчивой долговременной адаптации достаточно одиночного воздействия в раннем онтогенезе, интенсивность которого не истощала бы, а мобилизовывала и развивала адаптационные свойства организма. При этом тканью, 101 наиболее чувствительной к изменению режима преадаптации к окислительному стрессу и биохимически реактивной во взрослом состоянии, оказалась нервная ткань. Результаты экспериментов свидетельствуют о том, что предобработка низки ми дозами стрессирующего агента оставляет длительный метаболический след в системах организма, характеризующихся высоким уровнем обменных процессов. Таким образом, показано, что однократное воздействие гипербарической оксигенации на ранних этапах онтогенеза Xenopus laevis изменяет способность антиоксидантных систем взрослого организма реагировать на окислительный стресс, причем малые давления (0,2 МПа) способствуют биохимической адаптации, в то время как высокие (0,7 МПа) приводят к дисбалансу и ингибированию систем, ответственных за антиоксидантную защиту. Эти данные свидетельствуют о формировании онтогенетического импринтинга после адаптивного воздействия окислительного стресса (Гуськов и др., 1999). 6.2. Мутационные процессы у млекопитающих, преадаптированных к окислительному стрессу В начале 2000-х годов сотрудниками НИИ биологии ЮФУ эффект преадаптации был изучен на млекопитающих. Эксперимент проводили на белых крысах. В качестве «малой дозы» был выбран режим ГБО 0,2 МПа–1ч, поскольку в предыдущих исследованиях, выполненных на базе НИИ биологии РГУ, был показан преадаптирующий эффект именно этого режима (Брень, 1997; Тимофеева, 1997; Гуськов и др., 1999). В качестве стрессорного воздействия были использованы два режима ГБО. Первый – 0,7 МПа до судорог – позволяет оценить степень способности преадаптированных животных выдерживать окислительный стресс (по времени до наступления судорог). Второй – 0,5 МПа в течение 1 ч – не вызывает гибели животных, что позволяет изучать изменение основных показателей адаптации крыс к окислительному стрессу в динамике. Эксперимент проводился по схеме, представленной на рисунке 6.1. Основной причиной нарушения целостности ДНК при различных стрессорных воздействиях является прямое и опосредованное действие активных метаболитов кислорода. Поэтому степень мутагенного и кластогенного действия какого-либо фактора может служить критерием уровня, направленности и выраженности протекающих в организме процессов свободно-радикального окисления. С помощью SOS-lux теста было изучено влияние пребывания животных в условиях ГБО 0,5 МПа–1 ч на накопление в мозге, легких и печени генотоксичных метаболитов. Генотоксичность тканей оценивали по индукции ДНК-репарационного SOS-ответа клеток E. coli РТ-1 в присутствии гомогенатов тканей. Как видно из таблицы 6.4, сразу и через 24 ч после обработки непреадаптированных животных ГБО (группа III) в легких и печени было зарегистрировано накопление метаболитов, индуцирующих SOS-сигнал в клетках E. coli, количество которых достоверно отличается от их уровня у интактных животных. В группе преадаптированных животных (IV) через сутки после воздействия ГБО величина фактора индукции (Ic) SOS-репарации клеток E. coli, индуцируемого гомогенатами всех исследованных нами тканей, была в пределах контрольных значений. Таким образом, если после пребывания непредадаптированных животных в условиях ГБО в исследованных тканях обнаруживаются метаболиты, оказывающие влияние на формирование ДНК-репарационного SOS-ответа у клеток E. coli, то после воздействия низкой дозы ГБО на новорожденных животных действие стрессорного режима на взрослых животных не изменяет величину фактора индукции SOS-репарации. 102 Рис. 6.1. Схема постановки эксперимента: Первая постановка: I – интактные крысы; II – животные, обработанные сразу после рождения ГБО 0,2 МПа–1 ч и декапитированные через 6 месяцев; III – животные, обработанные в возрасте 6 месяцев ГБО 0,5 МПа–1 ч; IV – животные, преадаптированные в новорожденный период (0,2 МПа–1 ч) и обработанные через 6 месяцев ГБО 0,5 МПа–1 ч; Вторая постановка: I – интактные крысы; II – животные, обработанные ГБО 0,2 МПа–1 ч сразу после рождения и декапитированные через 1 год; III – животные, обработанные в возрасте 1 год ГБО 0,7 МПа до судорог; IV – животные, преадаптированные в новорожденный период (0,2 МПа–1 ч) и обработанные через 1 год ГБО 0,7 МПа до судорог Таблица 6.4 Индукция SOS-ответа E. coli РТ-1 (Ic) в присутствии гомогенатов тканей после пребывания крыс в условиях ГБО 0,5 МПа (n=10), усл. ед. Ткани Мозг Печень Легкие Группы I II III 0 ч III 24 ч IV 0 ч IV 24 ч 1,02 ± 0,05 1,14 ± 0,12 P=0 0,72 ± 0,04 P <0,001 0,91 ± 0,09 P=0 1,42 ± 0,15 P <0,05 1,19 ± 0,15 P=0 0,96 ± 0,03 1,27 ± 0,13 P <0,05 1,3 ± 0,05 P <0,001 2,0 ± 0,14 P <0,001 1,15 ± 0,09 P <0,1 1,01 ± 0,07 P=0 0,92 ± 0,04 1,36 ± 0,19 P <0,05 1,27 ± 0,03 P <0,001 1,78 ± 0,04 P <0,001 1,54 ± 0,15 P <0,001 1,21 ± 0,17 P=0 Примечание: Р – достоверность отличия от интактного контроля; 0 ч – сразу после действия ГБО; 24 ч – через сутки после действия ГБО. Анализ аберраций хромосом показал, что после действия токсической дозы ГБО (0,5 или 0,7 МПа) (группа III), регистрируется повышенный уровень аберраций хромосом в эпителиоцитах роговицы животных, который более чем в 2 и 3 раза, соответственно, превышает контрольные значения (табл. 6.5). Преадаптация новорожденных крыс низкой дозой ГБО (0,2 МПа–1 ч) приводит к существенному снижению исходного уровня аберраций хромосом после повторного воздействия ГБО в половозрелом возрасте (группа 103 IV – 0,7 МПа) и удерживает его на стационарном уровне сразу и через сутки после воздействия 0,5 МПа – 1 ч (группа IV). Таблица 6.5 Цитогенетические последствия в эпителиоцитах роговицы глаза крыс, подвергшихся действию гипербарической оксигенации (n=10) Всего анафаз, –=–, =, % –, % Х, % Z, % число % ГБО 0,2 МПа + 0,7 МПа I 2585 1 28 12 1 3 II 2780 3 50 11 4 4 III 2456 10 80 52 1 1 IV 2961 7 29 8 3 4 ГБО 0,2 МПа + 0,5 МПа I 1206 3 16 5 3 1 II 4806 2 22 3 6 3 III–0 ч 3246 10 82 37 11 6 III–24 ч 5636 9 80 24 18 16 IV–0 ч 4501 2 19 5 2 9 IV–24 ч 3377 1 22 3 1 3 Примечание: Р – достоверность отличия от интактного контроля. Группа –Х–, % АХр m, % 2 0 1 0 1,8 0,26 2,6 0,30 5,9 0,47 1,7 0,24 0 0 5 8 0 0 2,32 0,43 0,75 0,12 4,7 0,37 2,8 0.22 0,82 0,13 0,89 0,16 Р <0,001 <0,001 <0,001 <0,001 <0,001 Таким образом, используя один из основных критериев адаптивного ответа – уменьшение уровня аберраций хромосом после воздействия токсической дозы агента, если ему предшествует воздействие низких доз, получены данные о возможности повышения устойчивости животных к окислительному стрессу. Одним из причин кластогенной адаптации могут быть повышение емкости антиоксидантных систем и активация первичных катаболических процессов сразу после воздействия ГБО, которая расширяет норму реакции клеток и повышает адаптивные возможности организма (Гуськов, Лукаш, 1986). В зависимости от величины давления и времени обработки кислород может быть ингибитором или стимулятором митозов. У непреадаптированных животных после воздействия окислительного стресса, индуцированного ГБО в режиме 0,7 МПа до судорог (группа III), наблюдается подавление скорости пролиферации более чем в два раза (Р<0,001), а после 0,5 МПа–1 ч уровень пролиферации не изменяется сразу после окончания действия агента, через сутки же регистрируется его двукратное повышение (Р<0,01). В группе животных, преадаптированных к действию окислительного стресса в ранний период постнатального развития, после воздействия токсического режима ГБО–0,7 МПа (группа IV) скорость деления клеток снижается на 35 % (Р<0,05) по сравнению с преадаптированным контролем, однако она была увеличена более чем в полтора раза по сравнению с группой контроль – ГБО (III группа) (Р<0,01). В серии эксперимента, где повторное воздействие ГБО проводили в режиме 0,5 МПа–1 ч, у преадаптированных животных ни сразу, ни через сутки после действия уровень митотической активности не изменялся. Во всех вариантах эксперимента у животных, полученных от реципрокных скрещиваний, уровень аберраций хромосом находился в пределах спонтанного (1,7–2,6 %) (табл. 6.6). Сразу после действия ГБО 0,5 МПа–1 ч у потомков контрольных животных уровень АХр вырос в четыре раза и через сутки он по-прежнему оставался на высоком уровне. У потомков, полученных от скрещивания преадаптированной матери и интактного отца (♀ ПА х ♂ К), при воздействии ГБО 0,5 МПа не регистрировалось достоверного увеличения выхода аберраций хромосом в исследованные сроки после действия агента. У животных, 104 полученных от скрещивания интактной матери и преадаптированного отца (♀ К х ♂ ПА), сразу после действия повышенного давления кислорода не было зарегистрировано изменений уровня АХр по отношению к собственному контролю. Через сутки уровень хромосомных аберраций возрастал в 1,7 раза (Р<0,001). Таблица 6.6 Уровень аберраций хромосом ( %) в эпителиоцитах роговицы глаз потомков, полученных от реципрокных скрещиваний преадаптированных крыс и подвергшихся действию гипербарической оксигенации – 0,5 МПа–1 ч (n= 10) Вариант Линии потомков Контроль Контроль 1,7 ± 0,18 F1 ♀ ПА х ♂ К 2,5 ± 0,27 F1 ♀ К х ♂ ПА 2,6 ± 0,47 ГБО 0 ч ГБО 24 ч 6,7 ± 0,41 (P < 0,001) 2,3 ± 0,27 (P < 0,01) 5,4 ± 0,29 (P < 0,001) 1,9 ± 0,17 (P < 0,1) 4,3 ± 0,27 (P < 0,001) 2,4 ± 0,34 Примечание: Р – достоверность отличия от собственного контроля. Таким образом, показана возможность передачи устойчивости к стрессу от животных, однократно обработанных на ранней стадии онтогенеза низким режимом ГБО, своим потомкам. Более отчетливо это прослеживается в случае, когда преадаптированной была самка (материнский эффект). Передача признака, приобретенного в результате первичного однократного воздействия, в ряду клеточных поколений была впервые описана Нанни (Nаnney, 1958). У Paramecium aurelia серотологическими методами обнаружено несколько поверхностных антигенов, наследуемых в ряду агамных поколений, однако после температурного шока происходит трансформация, в результате которой меняются специфические свойства антигенов. Эти свойства также наследуются в течение нескольких делений до тех пор, пока не произойдет конъюгация. Годом позже Эфрусси (Ephrussi, 1959) описал «эпигенетическую изменчивость» у многоклеточных организмов и показал, что константное вегетативное наследование приобретенных признаков связано не с изменением генотипа, а с изменением детерминант цитоплазмы. Оленов (1965) предложил для обозначения этого явления термин «эпигеномная изменчивость». Эпигеномные изменения могут реализовываться на разных уровнях развития как результат изменения регуляции функций генов. Так, например, активность генов изменяется после метилирования ДНК, в результате которого проявляется геномный импринтинг (En Li et al., 1993; Surani, 1993), а также в результате модуляции синтеза специфических типов белков или модификаций трансляционных механизмов. Подобный эффект может быть получен в связи с изменением регуляторов фолдинга белков или их топографического распределения. Причиной эпигеномных состояний могут стать изменения количественных и качественных характеристик ДНК митохондрий, которые обычно возникают после воздействия на клетку стрессирующих агентов и т.д. В наших исследованиях обнаружено наследование кластогенной адаптации к окислительному стрессу по материнской линии. 105 Мы предполагаем, что повышенная устойчивость может формироваться благодаря генетически детерминированному повышению устойчивости митохондрий. Ранее было показано, что при проведении на протяжении 21 месяца пошаговой селекции культуры клеток HeLa к повышенному содержанию в дыхательной смеси кислорода, могут быть отобраны клетки, способные расти в атмосфере 80 % О2, являющейся летальной для нормальных клеток HeLa. По сравнению с нормальными клетками, в клетках, адаптированных к гипероксии, количество митохондрий было меньше. Они имели менее плотный матрикс и были в три раза больше на срезе и в два раза больше по объему, хотя размеры нормальных и адаптированных клеток были одинаковы. Это позволило авторам предположить, что устойчивость адаптированных к кислороду клеток не обеспечивается за счет более низкого производства ими АФК в условиях гипероксии. Уровень основных ферментов антиоксидантной защиты (СОД, каталазы и глютатионпероксидазы) был сходным у клеток обоих типов. Очевидно эти ферменты не играют значительной роли в повышении толерантности клеток HeLa к О2. Специфическая активность глюкозо-6фосфатдегидрогеназы – ключевого фермента для производства клеткой НАДФН – также не была связана со степенью устойчивости к кислороду (Joenje et al., 1985). Результаты этой работы позволяют предполагать, что повышение устойчивости адаптированных клеток к кислороду базируются либо на их способности контролировать генерацию или удаление внутриклеточных АФК, либо на способности этих клеток восстанавливать или замещать поврежденные клеточные компоненты. Для новорожденных животных была показана роль митохондрий в повышенной устойчивости к окислительному стрессу по сравнению с более взрослыми животными. Так, при изучении инактивации митохондриальной аконитазы и 8-ОНdG как индикаторов уровня митохондриального супероксида и окислительных повреждений ДНК, соответственно, было выявлено, что у взрослых животных (30 постнатальный день и более) уровень инактивации митохондриальной аконитазы и содержание 8-ОНdG увеличивались, чего не было зарегистрировано для незрелых крыс (12 и 21 постнатальные дни). При этом уровень MnSOD и CuZnSOD не изменялся ни у взрослых ни у незрелых организмов. Эти результаты позволили предположить, что митохондриальный окислительный стресс может быть ключевым фактором, который обеспечивает устойчивость развивающегося организма к АФК-индуцированному повреждению (Patel et al, 2003). Известно, что в митохондриях находится примерно 90 % клеточного кислорода, из них 2 % конвертируется в супероксидные радикалы (Boveris et al., 1972). В условиях гипероксии нарушение функционирования электрон–транспортной цепи митохондрий может приводить к повышению уровня свободных радикалов. Металлосодержащие белки дыхательной цепи митохондрий – один из основных источников эндогенных активных форм кислорода в клетке (Wallace, Melov, 1998). В связи с этим мы проанализировали митохондриальный геном крысы, используя базы данных «NCBI Mitochondria» и «Rat Genome Database». На ДНК митохондрий крысы локализованы гены, кодирующие следующие белки: Цитохромоксидазы – COX1, COX2, COX3; НАДФН-дегидрогеназы – ND1, ND6, ND4L; и Цитохром В – cytb. Частота спонтанных митохондриальных мутаций в 5–10 раз выше, по сравнению с ядерными, и при этом в условиях окислительного стресса наиболее часто регистрируются трансверсии (Cheng et al., 1992). Более того, показана способность повреждений в митохондриальной ДНК персистировать, т.е. сохранятся в ряду клеточных поколений, в 106 то время как повреждения ядерного генома эффективно репарируются (Fariss et al., 2005). Вероятность возникновения новых изоформ белковых молекул после действия ГБО достаточно велика. Особое значение при этом будут иметь те белки, которые участвуют в контроле уровня АФК. Возможно, в наших экспериментах материнский эффект устойчивости к окислительному стрессу может быть обусловлен появлением новых изоформ митохондриальных цитохромоксидаз. Таким образом, в результате проведенных исследований, мы предполагаем следующие возможные наследуемые механизмы адаптации новорожденных животных к окислительному стрессу: – геномный импринтинг материнских хромосом как следствие метилирования ДНК после окислительного стресса; – изменения сайтов локализации МГЭ, что может приводить к генетической экспрессии адаптивных признаков; – неспецифическая активация генов, контролирующих ROS- модулирующие ферменты в ядрах ооцитов; – формирование новых изоформ митохондриальных цитохромоксидаз; – селекция митохондрий в гетероплазматических клетках овариальных животных. Глава 7. ИСТОРИЯ ИЗУЧЕНИЯ ГЕНЕТИКИ ОКИСЛИТЕЛЬНОГО СТРЕССА Попытки объяснить механизм действия ГБО предпринимались неоднократно. Ниже представлены наиболее известные гипотезы мутагенного действия кислорода под повышенным давлением. 7.1. Исторические модели кислородного мутагенеза Conger, Fairchald (1951) показали, что увеличение концентрации кислорода от 50 до 100 % приводит к дозозависимому увеличению количества хромосомных разрывов, при этом нарушения в хромосомном аппарате клеток появляются только в том случае, если пыльца находится в барокамере не менее 1 часа. Это позволило сделать вывод о том, что эффект ГБО не связан с обычной диффузией кислорода в клетку и поражением ядра. В связи с этим было высказано предположение о том, что появление перестроек связано с изменением метаболизма, истощением лимита толерантности клеток к кислороду. В этой же работе они за два года до известной работы Р. Гершмана (Gershman et al., 1954) высказали идею об общности механизмов ионизирующей радиации и кислорода. «Идентичность эффекта кислорода и ионизирующей радиации на хромосомы, продукция кислородом тех же самых типов аберраций, что и радиация, свидетельствуют о том, что эти два агента действуют сходным образом. Как известно, радиация продуцирует активные радикалы в воде, из которых ОН и Н2О2 наиболее существенные в биологических эффектах. Кислород может вызывать эти эффекты в хромосомах через действие свободных радикалов, которые могут формировать какие-нибудь энзимные системы, имеющиеся у растений. Располагая ограниченными данными, мы считаем бесплодным спекулировать далее по этому поводу» (Conger, Fairchald, 1951). Эренберг с коллегами показали существование прямой зависимости цитогенетического эффекта как от времени обработки, так и давления кислорода (Erenberg et al., 1958; Moutschen-Dahmen et al., 1959). Авторы отметили ряд факторов, свидетельствующих в пользу общности механизмов действия радиации и ГБО: 1. Оба фактора вызывают неспецифические разрывы хромосом (одинаковые типы перестроек). 2. Оба агента разрывают молекулу ДНК. 3. Защитный эффект против радиационного поражения и кислородного отравления оказывают сульфгидрилсодержащие соединения. Однако ими были обнаружены факты и противоречащие этой гипотезе: 1. Необычное распределение перестроек хромосом в последовательности клеточных циклов. 2. Во втором митозе (а не в первом как при радиации) регистрируется максимум аберрантных метафаз и анафаз. 3. Нелинейный выход точковых мутаций. 4. Различия в спектрах индуцируемых мутаций. (Moutschen, Moutschen-Dahmen, 1962). В связи с этим позже Эренбергом было высказано предположение, что в норме ткани содержат системы, защищающие от кислорода. Когда эти системы насыщаются О2, возникают окисленные соединения, токсичные для генетического материала. В случае продления обработки токсичные формы вновь разрушаются кислородом (Erenberg et al., 1958). 108 О. Брауном была высказана гипотеза, которая связывала токсическое действие кислорода с истощением аминокислот и низкомолекулярных предшественников синтеза ДНК (Broun, 1980). В настоящее время механизмы токсичности кислорода связывают с образованием широкого спектра активных форм кислорода. АФК являются наиболее вероятными медиаторами кислородзависимых повреждений генома. Показана способность супероксид-аниона индуцировать АХр и сестринские хроматидные обмены (СХО) в лимфоцитах периферической крови человека (Emerit, 1982), генные мутации в локусе hprt фибробластов китайского хомячка (Phillips et al., 1984). Гидроксильный радикал является наиболее реакционноспособной формой, которая взаимодействует практически с любой молекулой-мишенью, в том числе и ДНК. Период жизни гидроксильного радикала чрезвычайно мал. Гидроксильный радикал индуцирует разрывы между водородными связями ДНК, потерю азотистых оснований (AP-сайтов) в большом количестве и непосредственно взаимодействует со всеми четырьмя основаниями ДНК (Ере, 1991). Синглетный кислород в условиях in vitro способен непосредственно взаимодействовать с ДНК, преимущественно модифицируя гуанин и вызывая разрывы однонитевой ДНК (Ере, 1991). Перекись водорода вызывает АХр и СХО в клетках млекопитающих. В отличие от гипероксии, где был обнаружен мутагенный эффект для hprt-локуса фибробластов китайского хомячка, Bradley и Erickson (1981) не обнаружили мутагенности перекиси водорода для hprt-локуса клеток линии V79. Согласно Дж. Такеру и У. Паркеру, для дрожжей перекись водорода является митохондриальным, а не ядерным мутагеном (Thaker, Parker, 1976). В последние годы обнаружена способность перекиси водорода активировать ядерный транскрипционный фактор каппа-В (NF-kB) (Schreck et al., 1991). Сейчас уже признана способность радикалов и АФК активировать транскрипцию генов. АФК активируют онкогены c-fos, c-myc, c-jun и, как предполагается, в результате этого они вызывают разрывы в ДНК (Amstad et al., 1992). Эти гены кодируют транскрипционные факторы, которые участвуют в индукции роста, дифференцировке и развитии клеток. Доказано, что концентрация АФК может определять активацию тех или иных генов, включая онкогены (Winrow et al., 1993). Показана активация нуклеоплазматической транскрипции в нейронах крыс после ГБО-терапии (Казанцева, 1993). Таким образом, АФК могут индуцировать различные типы окислительного стресса. Только гидроксильный радикал и синглетный кислород способны непосредственно взаимодействовать с ДНК. Супероксид-анион и перекись водорода сами не вступают в реакции с ДНК. Радикалы и ионы группы АФК чрезвычайно нестабильны (табл. 7.1). Таблица 7.1 Характерные значения времени жизни и радиусов диффузии АФК в биологических субстратах Формы АФК Синглетный кислород Гидроксильный радикал Супероксид-анион Алкоксильный радикал Перекись водорода NO Время жизни, с Радиус диффузии 10–12 10–9 <0,01 10–6 0,3 –6 10 Зависит от каталазы и глютатионпероксидазы 10–1 100 109 Один из возможных механизмов генотоксичности окислительного стресса, предложенный в последние годы, связан с источниками дополнительного радикалообразования. Например, перекись водорода вступает в реакции с двухвалентным железом, содержащемся как в ДНК, так и в металлопротеинах (ферритин, внеэритроцитарный гемоглобин). Переходы валентности металлов в присутствии перекиси водорода, супероксидного аниона или НАД(Ф) происходят с образованием гидроксильного радикала. Существуют данные, свидетельствующие об увеличении повреждении ДНК перекисью водорода в присутствии металлов переменной валентности (Mello-Filho et al., 1988). Однако отсутствуют решающие доказательства для объяснения генотоксического эффекта кислорода на основе гипотезы о едином механизме метаболизма перекиси водорода. В конце 80-х годов XX в. Е.П. Гуськовым была высказана гипотеза протекторного катаболизма при окислительном стрессе. Согласно этой гипотезе в условиях окислительного стресса часть клеток организма погибают для увеличения уровня антиоксидантов, так как продукты распада нуклеиновых кислот и белков являются мощными антиоксидантами. Антиоксидантный потенциал тканей организма при окислительном стрессе связан с протекторным действием низкомолекулярных азотсодержащих катаболитов, образующихся в результате гибели неустойчивых к гипероксии клеток. Основной продукт катаболизма нуклеиновых кислот – мочевая кислота обладает выраженными антиоксидантными свойствами. С другой стороны, смерть и старение клеток всегда сопровождаются повышенным уровнем аберраций хромосом. Нестабильность генома при окислительном стрессе оценивается автором как адаптивная норма (Гуськов, 1989). Анализируя данные литературы за период с 1960 по 1999 годы, используя базу данных ВИНИТИ, Филадельфийского научно-информационного центра (5 600 наименований журналов по естественным наукам), электронной библиотеки РФФИ и других издательств (Springer, Elsevier Science, Bethesda, Taylor&Francis, Wiley-Liss, Oxford и др.), а также результаты собственных исследований, мы сочли целесообразным свести факты о различных генетических эффектах гипероксии и гипербарии в следующие таблицы (табл. 7.2–7.3). Таблица 7.2 Краткий обзор исследований (1950–1999) мутагенного эффекта различных дыхательных газовых смесей Объект исследования Фибробласты легких китайского хомячка Фибробласты сирийского хомячка Лимфоциты периферической крови человека Тест АХр ГМ hprt locus ГМ hprt locus AXp Клетки млекопитающих Разрывы ДНК Лимфоциты человека 8HOG 110 Газовая Концентрация Давление, среда кислорода МПа Культура клеток Гипероксия Воздух Норма 60 % Гипероксия Воздух Норма 60 % Автор, год Sturrock, Nunn, 1978 Sturrock, Nunn, 1978 Воздух Гипероксия Норма Nussbaum et al., 1985 Кислород 100 % 0,3–0,7 Гуськов, Шкурат, 1985 Воздух Гипероксия Норма Joenje, Oostra, 1986 Норма Cacciuttolo et. al, 1993 0,2 МПа Speit et al., 1998 Воздух 200–400 % (жидкость растворенного в биокислорода реакторе) Кислород 100 % Продолжение табл. 7.2 Объект исследования Тест Газовая среда Концентрация Давление, кислорода МПа Феохромоцитомы крысы РС12 Фибробласты легкого мыши Эмбриональные фибробласты мыши Разрывы ДНК Воздух 50 % Норма Takahashi et al., 1998 8HOG Кислород 100 % Норма Waxman et al., 1998 Разрывы ДНК Гелиокс 20–80 % 1–5 МПа Djurhuus et al., 1998 Автор, год Бактерии Esherichia coli Wp-2s (дефект по эксцизионной репарации) Salmonella typhimurium TA100 ГМ Кислород 100 % 0,7 Водолазкин и др., 1987 ГМ Кислород 100 % 0,7 Водолазкин и др., 1987 Норма Гидростатическое Baden et al., 1981 0,7 Водолазкин и др., 1987 Бактерии ГМ Дрожжи (диплоидный штамм) ГМ, конверсии Гелий Грибы Кислород 100 % Растения Flagellate trichonympha Традесканция Лук Бобы Пшеница (полиплоидные формы) Ячмень Мыши Крысы Морские свинки Форель Лягушки Крысы (лимфоциты) Воздух 80 % Cleveland, 1949 АХр АХр CXO АХр Кислород Кислород Кислород Воздух 50–100 % 100 % 40–100 % 0% 3,1–6,1 Conger, Fairchild, 1951 Гуськов, 1975 Gutierrez, Lopez-Saez, 1982 Moutschen-Dahmen, 1959 АХр Кислород 100 % 0,4–0,7 Гуськов и др., 1981 АХр Кислород 100 % Животные Воздух Гипероксия Гелиокс Нормоксия Кислород 100 % 0,4–0,7 Гуськов и др., 1981 Норма 3,6 0,2–0,7 АХр Кислород 100 % 0,2–0,7 Yusa, 1981 Шкурат и др., 1993 Шиманская и др., 1991 Гуськов и др., 1985б; Шиманская и др., 1991 Генотоксичность Воздух 60–95 % Норма Han et al., 1996 Тримикс Нормоксия Гипероксия Нормоксия Гипероксия 3,3–21 мг/02 100 % 7,1 7,1 3,6; 7,1 Shkurat et al., 1996 Shkurat et al., 1996 Shkurat et al., 1996 Норма Liepelt et al., 1995 0,7 Гуськов и др., 1997 60–80 % Норма Vangala et al., 1998 АХр АХр Гелиокс Разрывы Вода (наДНК сыщенная) АХр Кислород ОРД Воздух 0,7 111 Окончание табл. 7.2 Газовая среда Концентрация Давление, кислорода МПа Человек Кислород 100 % 0,2 Кислород 100 % 0,15–0,2 Объект исследования Тест Здоровый Больные АХр АХр Водолазы АХр Воздух Гипероксия 3,1 Волонтеры ДНК повреждения Кислород 100 % 0,2 Автор, год Гуськов, Шкурат, 1985 Гуськов и др., 1990а Fox et al., 1984; Шиманская и др., 1991 Gröger, et al., 2007 Примечание: ГМ – генные мутации; АХр – аберрации хромосом; СХО – сестринские хроматидные обмены; ОРД – однонитиевые разрывы ДНК. Tаблица 7.3 Дыхательные газовые смеси, не обладающие мутагенным эффектом Объект исследования Тест Газовая среда Дрожжи (гаплоидный ГМ, конКислород штамм 1–7А-П192) версии Esherichia coli CM 871 Esherichia coli Wp-2 ГМ ГМ Кислород Кислород Бобы (семена) АХр Азот Drosophila (ClB) Мыши Крысы Морские свинки ГМ АХр АХр ДЛ АХр Больные АХр Концентрация Давление, кислорода, % МПа Грибы 100 Бактерии 100 100 Растения 0 Животные 100 100 100 100 Нормоксия Человек Кислород 100 Кислород Кислород Кислород Кислород Тримикс Автор, год 0,7 Водолазкин и др., 1987 0,4; 0,7 0,4; 0,7 Водолазкин и др., 1987 Водолазкин и др., 1987 3,1–6,1 Moutschen-Dahmen, 1959 0,7 ? 0,12 0,12; 0,15 0,3 3,6 Гуськов и др., 1993 Казанцева, 1993 Казанцева, 1993 Гуськов и др., 1990а Неопубл. данные 0,12–0,2 Чеботарев и др., 1991 Примечание: ГМ – генные мутации; АХр – аберрации хромосом; ДЛ – доминантные летали. Как видно из представленных таблиц, во всех экспериментах на культуре тканей в условиях гипероксии даже при нормальном давлении регистрируются как генные, так и хромосомные мутации. Мутагенный эффект для клеток культуры ткани обнаружен и для среды «гелиокс» при незначительном увеличении парциального давления кислорода. Бактерии проявили неодинаковую чувствительность к действию кислорода. У некоторых видов гипероксия и гипербария вызывают генные мутации (как правило, это штаммы с дефектами системы репарации или с дефектами клеточной стенки), в то же время обнаружены и устойчивые штаммы. Вероятно, устойчивость микроорганизмов к мутагенному действию гипероксии и гипербарии можно объяснить незначительным содержанием внутриклеточных прооксидантов. При действии изучаемых факторов на грибы 112 и растения отмечается усиление мутагенного эффекта с увеличением уровня плоидности организмов. У млекопитающих, в том числе и у человека, генетический эффект гипербарической оксигенации наблюдали, если давление было выше 0,15 МПа. Как в наших исследованиях, так и практически во всей изученной литературе показано, что кислород не вызывает мутации в генеративных клетках. Однако он обладает тератогенным эффектом (см. табл. 7.3). Что касается гипербарии, то ее токсическое действие на организм было впервые описано Полем Бэром в 1878 г. При этом он отмечал, что ведущим фактором в развитии патофизиологических синдромов является избыточное содержание кислорода. Бэр писал: «...жизнь есть тогда, когда клетка или организм способны регулировать содержание кислорода внутри себя» (Bert, 1873). С начала нашего века специалистами из разных стран были исследованы основы физиологических и медицинских проблем подводных погружений с учетом многофакторных условий гипербарической среды. Следует назвать имена исследователей, внесших огромный вклад в решение теоретических и практических проблем гипербарии, таких как К. Ламберстен, Л.А. Орбели, Е.М. Крепс, Г.Л. Зальцман, П. Беннетт. 7.2. ГБО-мутагенез и концепция протекторного катаболизма Генетические эффекты гипербарической оксигенации имеют ряд своеобразных особенностей. Мы показали, что гипербарическая оксигенация при небольших давлениях от 0,1 до 0,7 МПа и недлительных экспозициях оказывает слабый рекомбиногенный эффект на диплоидные штаммы дрожжей и не вызывает точковых мутаций у штаммов сальмонеллы и кишечной палочки, нормальных по системам репарации. Кроме того, аналогичные режимы ГБО не индуцировали рецессивных сцепленных с полом леталей у дрозофилы. Однако те же условия обработки вызывали достоверное увеличение количества аберраций хромосом в клетках меристемы разных видов растений, лимфоцитах периферической крови человека in vivo и in vitro и обусловливали перестройки хромосом в костном мозге крыс. Значительное увеличение количества аберрантных клеток после гипербарической оксигенации вызывает законную тревогу у исследователей, которые считают это проявлением фактора повышенного риска канцерогенеза (Fox et al., 1984). Однако еще одной характерной чертой ГБО-мутагенеза, отмеченной в наших экспериментах, является повышенная частота разрывов хромосом по сравнению с другими типами перестроек. Увеличение частоты разрывов и их продленность во времени после окончания воздействия фактора характерна и для ряда других химических соединений, главным образом для различных окислителей. Анализ литературы и результаты наших собственных экспериментов привели нас к необходимости объяснить эти явления на основе предлагаемой нами концепции протекторного катаболизма, основные положения которой сводятся к следующему: – избыточность на молекулярном и клеточном уровнях позволяет осуществлять без значительного ущерба для системы деструкцию части макромолекул и клеток, сохраняя общий уровень жизнеспособности; – в период действия на организм экстремальных факторов (или после этого воздействия) деструкции подвергаются наименее стабильные в данных условиях молекулы биополимеров и клеток, а соматический мутагенез отражает интенсивность этой деструкции; – продукты метаболизма, возникшие в результате деструкции, увеличивают резистентность организма к воздействию экстремального фактора, т.е. обеспечивают его адаптацию. 113 7.3. Избыточность как общее свойство биологических систем Потенциальная избыточность биологических систем на всех уровнях организации – от клетки до биосферы – является фундаментом, на котором построены все современные концепции эволюции органического мира (Lewis, 1980). На уровне минимальной системы она выражена в избыточности генетического кода, процессинге, амплификации генов, функциональной поливалентности белков, на макроуровне – в тотипотентности клеток, мультифункциональности органов, превышении репродуктивности над выживаемостью и т.д. Контролирующая функция естественного отбора снижает избыточность надорганизменных систем, замещая избыточность дивергентной специализацией. Взаимодействие между этими альтернативами определяет основные свойства и характеристики филумов (Симпсон, 1948; Bush, 1975). Смена организмоцентрической концепции эволюционного процесса Дарвина популяционно-генетической позволила выделить элементарные факторы эволюции, сформулировать некоторые принципы надындивидуальной эволюции, адаптации популяций и видов к условиям окружающей среды. На индивидуальном уровне структурная, функциональная и информационная избыточность живых систем позволяет им сохранить жизнеспособность даже после весьма значительных потерь нервной, соединительной, мышечной, легочной и других тканей, сохранение минимума позволяет обеспечить восстановление необходимого уровня избыточности как основы надежности системы. Проблема надежности биологических систем на основе лабильности эффективно разрабатывается Ленинградской школой генетиков (Инге-Вечтомов, 1971). Анализ механизмов надежности и адаптации показывает, что на молекулярном уровне их основой является избыточность систем или их поливариантность, но фенотипическое выражение последствий реакции на экстремальный фактор должно существенно различаться у монодинамических (одноклеточных) и полидинамических (многоклеточных) систем (ИнгеВечтомов, 1977). В таком аспекте особенно остро возникает проблема взаимоотношений между векторизованным средой мутационным процессом в популяциях и мутационным процессом в соматических клетках индивидуума. Кроме того, необходимо выявление связи между двумя уровнями изменчивости, реальности отражения индивидуального уровня соматической изменчивости на свойства и характеристики последующих поколений. Если для жизненных форм, которые облигатно или факультативно воспроизводят потомство вегетативным путем, такой проблемы, возможно, не существует (и для таких организмов, видимо, правомерна экстраполяция соматического мутагенеза на популяционный), то для видов, воспроизводящихся исключительно половым путем, эта проблема трудно разрешима на основе имеющейся к настоящему времени методологии. Взаимоотношения между избыточностью, надежностью и генетической изменчивостью весьма существенны для прогнозирования типа адаптационных изменений как единичной особи, так и эпигенетического потенциала структуры биосферы. Основная задача охраны окружающей среды – сохранение генетического потенциала биоса, предотвращение повышения темпа спонтанного мутационного процесса, индуцируемого искусственными факторами среды, сопутствующими эволюции цивилизаций. В большинстве стран химические соединения, применяемые в промышленности и быту, должны пройти скрининг на мутагенность, прежде чем получить разрешение на их производство. Однако значительное количество используемых для скрининга тест-систем зачастую дает противоречивую информацию о степени опасности мутагена. Такие тест114 системы как костный мозг и лимфоциты периферической крови некоторые исследователи считают достаточно информативными для оценки генетического риска (Gerhart, 1984; Richardson et al., 1984), некоторые же относят их к числу сомнительных (Miltenburger, 1984), а есть и такие, которые считают их практически непригодными для целей генетической токсикологии (Hess, Bernhard, 1984). Существует много причин негативного подхода к скринингу (одна из них – правомерность переноса данных, полученных на соматических клетках, на генеративную ткань, или данных, полученных на одноклеточных или низших многоклеточных – на человека). Правомерность экстраполяции результатов, полученных на модельных тест-системах, на оценку генетического риска для популяции, в частности человека, обсуждалась неоднократно. Данные экспериментов показали, что многие химические соединения обладают определенной специфичностью в отношении способности вызывать мутации на том или ином объекте (Журков, 1975; Сусков, Сазонова, 1983; Hess, Bernhard, 1984). Так, известно, что химические соединения, не показавшие эффективности на различных низших системах, оказались весьма активными мутагенами для человека, например, метронидазол, изоинозид (Куринный, Пилинская, 1976). Экстракт частиц, загрязняющих воздух, оказался мутагенным в тестах Эймса, и индуцировал сестринские хроматидные обмены, но оказался малоэффективным для индукции аберраций хромосом в лимфоцитах периферической крови (Krishna et al., 1984). У рабочих, контактирующих с дибромхлорпропаном, цитогенетический анализ не выявил перестроек в лимфоцитах, однако при анализе спермы было установлено влияние указанного вещества на процесс течения митоза (Kapp et al., 1979). Метатрексат, оказавший мутагенный эффект на разные низшие организмы, не вызвал увеличения уровня СХО у больных псориазом, получавших этот препарат в течение длительного периода – от 50 до 298 дней. Диазепам, введенный мышам, не индуцировал перестроек хромосом в клетках костного мозга мышей, но через 4 недели после введения вызвал аномалии в их спермиях (Sram, Kocisova, 1984). Проблема взаимоотношений между гибелью клеток, индукцией хромосомных аберраций, возникновением сестринских хроматидных обменов и точковых мутаций была смоделирована с помощью монофункциональных алкилирующих агентов, при этом было показано отсутствие причинных связей между этими параметрами. Таким образом, для значительного числа химических соединений, исходя из данных литературы, не удается найти корреляцию между способностью индуцировать мутации в половых клетках и уровнем аберраций в клетках соматических тканей (Шрамм, 1977). Типичная ситуация ошибочной экстраполяции alarm-мутагенеза на изменения в поколениях возникла при анализе мутагенных свойств кофеина, который проявил высокую активность в культуре ткани человека (Ostertag et al., 1965), но не вызвал транслокаций и доминантных леталей у мышей (Lyon et al., 1962). Позднее неправомерность переноса данных по кофеину, полученных в культуре, на человека была подробно обсуждена в печати (Ауэрбах, 1978). Одним из реальных выходов из создавшейся противоречивой ситуации явилось бы сравнение данных, полученных при мониторинге индивидуальной соматической изменчивости и мониторинге врожденных пороков. Анализ динамики объема генетического груза, по мнению ряда авторов, должен иметь катастрофический характер в результате влияния на людей мутагенов среды (Дубинин, 1984), однако в литературе есть сведения и более оптимистического плана. Существующий в Дании регистр хромосомных аномалий, выявленных в разных лабораториях, позволил на основании безвыборочных популяционных исследований сравнить частоты теоретически ожидаемых и фактически выявленных аномалий врожденных по115 роков на основе анализа кариотипов с аберрациями хромосом. Суммарно было выявлено лишь 39 % общего ожидаемого числа аберраций хромосом, а выявление случаев синдрома Кляйнфельтера и других типов аномалий половых хромосом составило только 10 % от теоретически ожидаемого количества. В отношении химических мутагенов можно было бы ожидать той же ситуации, которая сложилась после анализа многочисленных экспериментов в радиационной генетике и популяционных исследованиях на человеке. Мутагенный и цитогенетический эффекты ионизирующей радиации хорошо известны и не вызывают сомнений в опасности излучений на живые организмы. С 1946 по 1953 годы, после бомбардировки Хиросимы и Нагасаки, было обследовано более чем 70 000 беременностей. Как показали результаты, генетические эффекты у детей первого поколения не удалось обнаружить ни по одному из выбранных индикаторов. Цитогенетические исследования 7 000 детей, чьи родители пережили бомбардировку, не показали отличий от контроля ни по количеству, ни по типам аберраций хромосом, при этом анализ некоторых биохимических маркеров также не дал указаний на увеличение частоты мутаций (Hamilton, 1985). Хочется еще раз подчеркнуть, что высокий уровень аберраций хромосом, и в частности, разрывов, вызванных ионизирующей радиацией, зарегистрирован на самых различных объектах. Многие из этих противоречивых данных можно было бы примирить, исходя из представлений о характере наследования индуцированных соматических изменений и их связи с адаптивностью мутационного процесса на базе концепции протекторного катаболизма. Организм, сталкиваясь с неблагоприятными условиями, «включает» различные системы защиты, ограничивающие доступ агента к наиболее уязвимым своим точкам и восстанавливающие пораженные участки системы. Эти процессы могут осуществляться как за счет активации анаболических процессов, так и за счет усиления катаболизма, что обеспечивает нормализацию функций. Так, изнуряющие упражнения приводят к снижению веса печени экспериментальных животных на 12 %, коррелирующему с падением содержания белка в организме на фоне сниженной активности митохондриальных, микросомальных и цитозольных ферментов. Несколько позже отмечалась активация лизосомальных ферментов, причем в тканях было обнаружено повышенное количество аутофагирующих вакуолей и усиление свободной лизосомальной активности (Dohn et al., 1978). Аутофагия печени – неспецифическая адаптивная реакция организма на повышенную потребность энергии. Снижение веса печени, сопровождающееся снижением уровня содержания белка, следует рассматривать как результат функционирующей «аутофаголизосомальной системы» и осуществляется она на основе высокой степени избыточности клеток данного организма (Kasparek et al., 1982). Многочисленные исследования, проведенные как отечественными, так и зарубежными авторами, показывают, что защита организма, оказавшегося в экстремальных условиях, может осуществляться различными механизмами в зависимости от характера, силы и продолжительности воздействия агента. При кратковременном воздействии стабилизация системы может достигаться кратковременным спуртом анаболизма; хронические же напряжения повышают активность ферментов, осуществляющих катаболические процессы. Можно предполагать, что в процессе эволюции должны были сложиться системы, обеспечивающие адаптивность организма к хроническим стрессам или «тренировке». Поскольку наиболее общим ответом организма является включение процесса катаболизма, следует предположить существование в организме целостной и взаимосвязанной системы, регулирующей данный процесс. Не исключено, что эта система подобна иммунной и основная функция ее состоит в том, чтобы быть способной «включать» и «отключать» этот процесс. 116 Очевидно, что деструкция клеток связана с деградацией всех типов биополимеров, и начальная избыточность клеток, реагирующих на стресс самодеструкцией, должна поддерживаться в процессе эволюции для повышения индивидуальной приспособленности организмов, переживающих хронический стресс в пессимальных условиях, компенсируя ограничения видовой изменчивости при стабилизирующем отборе. Возможно, что именно лабильностью катаболических процессов можно объяснить широкое распространение добавочных хромосом у растений и животных. С этих позиций можно объяснить и своеобразный механизм адаптации лимонника китайского к неблагоприятным условиям существования – в осенне-зимний период у него появляются многоядерные клетки, которые исчезают с наступлением весны (Тульнова, 1984). 7.4. Окислительный стресс и аутоантиоксиданты Любая аэробная биологическая система, сталкиваясь с неблагоприятными условиями, вынуждена интенсифицировать дыхание и другие окислительные процессы, связанные с получением дополнительных энергетических ресурсов. Вместе с тем эти окислительные процессы инициируют свободнорадикальные реакции, которые служат основным инструментом деструкции клеток, происходящей в результате повреждения мембранных комплексов (Владимиров Ю.И., Арчаков, 1972; Fridovich, 1982). Присутствие кислорода стимулирует поражение клеток, вызванное воздействием различных агентов (Ауэрбах, 1978). Возникающая при этом необходимость адаптивной защиты от реактивных продуктов окисления осуществляется на основе избыточности клеточного материала, саморазрушение которого обеспечивает протекторный катаболизм. Продукты перекисного окисления сами, в свою очередь, могут поражать различные структуры клетки, в том числе и нуклеиновые кислоты. Суть концепции протекторного катаболизма заключается в том, что продукты саморазрушения клетки – конечные этапы катаболизма биомолекул, как правило, обладают способностью защищать от деструктивного эффекта активных форм кислорода. Свойства истинных антиоксидантов – ингибиторов свободнорадикальных процессов – проявляют аммиак (Saul, Archer, 1984) – конечный продукт азотистого метаболизма у аммонотелических организмов, мочевая кислота – продукт деградации пуринов и, следовательно, нуклеиновых кислот, билирубин (Robertson, Fridovich, 1982) – продукт распада гема. Мочевина – конечный элемент азотистого метаболизма, экскретируемый уреотелическими организмами, ингибирует свободнорадикальные процессы посредством блокирования окислительного перехода двухвалентного железа в трехвалентное. Вопрос о возникновении в эволюции конечных продуктов катаболизма – антиоксидантов – заслуживает специального рассмотрения. Здесь же можно отметить, что организмы, постоянно продуцирующие в качестве «отбросов» регуляторы перекисного окисления, очевидно, получали в аэробной среде эволюционное преимущество. Особенно это проявляется в условиях стресса, когда ускоренная деградация РНК и белков вследствие лабилизации мембран лизосом продуктами перекисного окисления приводит к увеличению «на выходе» концентрации ингибиторов свободнорадикальных процессов (аммиака, мочевины, мочевой кислоты) и блокирует деструктивные процессы в пределах цитоплазмы. Избыточность молекул биополимеров способствует выходу системы из непродолжительного стресса. Можно полагать, что длительное или многократное действие экстремального фактора исчерпывает возможности цитоплазматического протекторного катаболизма. 117 В этих условиях необратимому повреждению подвергаются ядерные структуры части соматических клеток, приводящие в конечном итоге к ядерной и клеточной аутофагии, деструкции биополимеров и возрастанию уровня ингибиторов свободнорадикальных процессов. Выход из стресса обеспечивается избыточностью соматических клеток. Можно полагать, что гибнут в этих условиях наименее устойчивые клетки, например, в меньшей степени обеспеченные естественными антиоксидантами, однако именно они становятся источником «катаболических антиоксидантов», способствующих выживанию организма в неблагоприятных условиях. 7.5. Механизмы alarm-мутагенеза при окислительном стрессе Токсический эффект повышенного давления кислорода был известен еще в прошлом веке, и последствия его воздействия на организм до сих пор представляют интерес в плане изучения его на различных уровнях организации – от молекулярного до системного (Кричевская и др., 1980; Gottlieb, 1981). Впервые организм млекопитающих встречается с гипероксической средой сразу в постнатальном периоде. Эмбрион существует в частично анаэробных условиях, и после рождения новорожденный переживает гипероксический стресс, заставляющий включаться мощные антиоксидантные системы протекторного катаболизма. Как показали Ц. Кришина, Мурти и Л. Сандлер, в это время индуцируется активность гемоксиназы, которая способствует быстрому разрушению красных клеток крови матери до билирубина (Krishina Murti, Sundler, 1982). При этом последний действует как эндогенный тушитель свободных радикалов, так и как супероксид или синглетный кислород, генерируемый организмом, находящимся в гипероксическом состоянии. Несомненно, что в течение онтогенеза организмы, сталкивающиеся с различными сильными окислителями, в частности с гипербароксигенацией, должны «включать» системы защиты от их повреждающего действия. Концепция протекторного катаболизма объясняет ряд явлений и фактов, полученных в эксперименте и не имеющих, на первый взгляд, единой общебиологической основы для трактовки. Прежде всего это относится к стимулирующим и защитным процессам, которые имеют место после воздействия низких доз радиации или химических мутагенов. Так, предобработка штамма сальмонеллы, несущего плазмиды, химическимb соединениями повышает их выживаемость к излучению, что отличает данный штамм от не имеющего плазмиды (Джонгалина, Зыкова, 1985); малые дозы мутагенов стимулируют выживаемость дрожжей, сельскохозяйственных растений (Митрофанов, Олимпиенко, 1980); малые дозы облучения стимулируют выклев науплиев артемии (Ивановский, Митрофанов, 1978). Несомненно, что в основе стимулирующего эффекта лежит избыточность структур биологических систем и, в первую очередь, избыточность генетического материала (Митрофанов, Олимпиенко, 1980). Исходя из концепции протекторного катаболизма, можно предполагать, что соматический мутагенез после оксигенации является адаптивной реакцией на данный стрессовый фактор и его основная функция связана с резким повышением концентрации уратов в среде за счет распада ДНК-мутабильных соматических клеток. Эта форма соматического мутагенеза адаптогенна, не имеет эволюционного будущего и представляет собой «alarm-мутагенез», сигнализирующий об опасности факторов окружающей среды. Так как в литературе до настоящего времени сведения о роли средовых факторов в увеличении цитогенетических аномалий у потомков лиц, контактировавших с неблагопри118 ятным фактором среды, весьма малочисленны, можно лишь предполагать, что подобная ситуация будет иметь место и при воздействии других типов мутагенов. О возможности существования для млекопитающих адаптогенного alarm-мутагенеза могут свидетельствовать данные о повышении уровня аберраций хромосом клеток периферической крови при резком изменении условий среды обитания. В этом свете вновь возникает проблема адекватности экстраполяции цитогенетических данных, полученных при анализе клеток крови или костного мозга, на генеративные клетки. Итак, исходя из вышеприведенных рассуждений, сущность alarm-мутагенеза, согласно концепции протекторного катаболизма, заключается в значительном увеличении содержания в организме антиоксидантов, в частности мочевой кислоты, за счет повышенного распада части популяции соматических клеток. Этот процесс, не связанный с изменением генеративных систем, несомненно, находит отражение в филогенезе. В связи с этим не лишено оснований предположение о том, что сохранение ядерных эритроцитов у птиц связано с необходимостью антиоксидантной защиты от гипероксии, возникающей при двойном дыхании. Кроме того, показано существование прямой зависимости между продолжительностью жизни и концентрацией такого антиоксиданта как урат для 22 видов приматов и 17 других видов млекопитающих. При этом концентрация урата в организме обусловлена различной интенсивностью процессов метаболизма. В то же время для другого антиоксиданта – аскорбата – такая корреляция не наблюдалась. С точки зрения изложенного нами принципа представленные данные объясняются тем, что подъем концентрации урата может осуществляться за счет alarm-мутагенеза как формы протекторного катаболизма, в то время как концентрация аскорбата может быть увеличена либо экзогенным введением, как у приматов, либо интенсификацией его синтеза, что требует дополнительных энергетических затрат для поддержания этого синтеза длительное время. Кроме того, аскорбат расходуется в ряде окислительно-восстановительных биохимических процессов, поэтому его уровень зависит от многих факторов. 3.6. Окислительный мутагенез и протекторный метаболизм Окислители представляют достаточно своеобразную и специфичную группу мутагенов, свойства которых еще не достаточно поняты и освещены в литературе. Следует вспомнить, что первые работы по индуцированному химическому мутагенезу связаны с использованием различных химических окислителей – неорганических солей и иодного раствора (Schiemann, 1912; Сахаров, 1932; Stubbe, 1938). Оксигенный мутагенез характеризуется рядом особенностей, отличающих его от других типов мутагенных факторов – отсутствие зависимости выхода аберраций хромосом от величины давления кислорода в широком интервале доз или времени его воздействия. При этом максимальный выход хромосомных перестроек при воздействии ГБО наблюдается не в первом, а во втором митозе после воздействия (Montsehen-Dahmen et al., 1959). Наши собственные данные показали, что однократная обработка крыс 0,25 МПа в течение 5 ч обусловила у животных меньший уровень хромосомных перестроек, чем фракционирование дозы по 1 ч в течение 5 сут., причем повышенный в сравнении с контролем уровень аберраций сохранялся в течение весьма длительного времени. При этом следует заметить, что большинство перестроек в отдаленные сроки воздействия представлены, как правило, фрагментами и концевыми делециями. Вместе с тем было обнаружено, что при одинаковой силе воздействия изучаемого фактора какие-либо различия в уровне общего числа перестроек хромосом в культуре крови и целостном организме практически отсут119 ствовали. Интересно отметить, что цитогенетический анализ крови лиц, подвергавшихся лечению терапевтическими дозами ГБО, показал значительное усиление соматического мутагенеза на фоне общего улучшения самочувствия. В то же время в проведенных нами эксперимента на тестерных штаммах E. coli и S. сerevisae дикого типа воздействие ГБО не обусловило достоверного увеличения выхода как прямых мутаций, так и реверсий. Кроме того, воздействие ГБО в режимах от 0,25 до 0,7 МПа также не вызвало повышения рецессивных сцепленных с полом мутаций у дрозофилы. Приведенные ранее результаты экспериментов на растениях и животных показывают, что индуцированный ГБО мутагенез на многоклеточных системах не выявляет четких закономерностей между концентрацией кислорода в среде и количеством индуцируемых перестроек, чего следовало ожидать, опираясь на гипотезу Ребекки Гершман (Gerschman et al., 1954). Если для одноклеточных организмов основной механизм транспорта – диффузия, то для многоклеточных, в частности позвоночных, возникают специализированные системы обмена и транспорта кислорода, и эти процессы, особенно в условиях повышенного давления, при количественном анализе функциональных моделей описываются весьма сложными зависимостями. Распространение кислорода по каналам клетки предполагает прямую зависимость между давлением кислорода и временем воздействия, степенью удаленности клеток и органов от основного источника акцепции и транспорта кислорода и уровнем аберраций хромосом. Как было показано выше, эти зависимости не соблюдаются при анализе перестроек хромосом млекопитающих, подвергавшихся воздействию ГБО. Кроме того, относительный уровень перестроек хромосом практически одинаков (через 24 ч после воздействия ГБО) в эпителии роговицы глаза, которая непосредственно контактирует с гипероксической средой в эксперименте и клетках костного мозга животных, которые находятся в более гипоксической среде. Одним из существенных доказательств адаптивности протекторного катаболизма являются факты, свидетельствующие об увеличении резистентности к повышенным давлениям кислорода у животных, преадаптированных к ним преэкспозицией в гипербарических условиях, вызывающих заметный цитотоксический и цитогенетический эффекты. Такие данные получены на дрозофиле (Klock, Winkle, 1979) и разных видах млекопитающих. Показано, что крысы в гипероксической атмосфере (0,15 МПа) живут 24 ч. Преэкспозиция животных при 0,08 МПа втрое увеличивает продолжительность их жизни, если их затем поместить в барокамеру при 0,15 МПа (Kravetz et al., 1980). Преэкспозиция крыс 0,2 МПа кислорода значительно увеличивает время их выживаемости при 0,7 МПа (Коробова, 1984). У обезьян преэкспозиция в условиях 80–100 % кислорода повышает количество делящихся клеток легочного эпителия и стимулирует иммунный ответ (Hackney et al., 1969), стимуляция иммунного ответа ГБО отмечена и у других животных, а также у человека (Фукс, Константинова, 1973; Лотовин и др., 1983; Houlihan, 1967). Причины этих фактов становятся понятными, если принять во внимание повышение концентрации эндогенных антиоксидантов за счет катаболизированных продуктов аберрантных соматических клеток. Вероятно, в системе эффективной защиты наиболее существенную роль играют ураты, которые способны предотвращать перекисное окисление липидов, инактивировать синглетный кислород и органические гидроперекиси, предотвращать лизис эритроцитов и защищать ДНК от деструкции свободными радикалами. Деструкция хромосом в результате соматического мутагенеза под действием окислителей приводит к повышению концентрации уратов в крови и они помимо защитных 120 функций выполняют обязанности стимуляторов общебиологических и специфических систем защиты. Показано, что разрушение клеток и освобождение нуклеиновых кислот стимулирует деление антителообразующих клеток, а продукты деградации ДНК стимулируют иммунный ответ (Merrit, Johnson, 1965; Brown, 1965; Brown, Nakanj, 1967). Протекторный катаболизм может быть основой для объяснения причин повышения резистентности организма к малигнизации тканей (Гаркави и др., 1979). Наиболее широко используемый в терапии онкологических заболеваний способ создания стресса – введение малых доз адреналина (Шихлярова, 1985) – одного из метаболических гормонов, вызывающего аберрации хромосом. 7.7. Аутодеструкция клеток и протекторный катаболизм Концепция протекторного катаболизма логично согласуется с фундаментальными работами, в которых предпринята попытка построить общую теорию адаптации (Чайдл, 1948; Корогодин, 1966; Туманов, 1979; Генкель, 1982; Мелехов, 1982; Шкорбатов, 1982). В этих работах значительное место уделяется участию процессов метаболизма в повреждении и восстановлении клеток. Следует особо отметить выдвинутый Е.Н. Мелеховым принцип регуляции повреждений клеток и участия в этих процессах защитного торможения обмена веществ. Реакция защитного торможения метаболизма неспецифически индуцируется разными факторами, имеет высокую скорость индукции, обратима, затрагивает ключевые реакции и является базой устойчивости системы (Мелехов, 1983, 1985). Очень интересна попытка автора доказать явление метаболического самоповреждения клеток, явно недопустимое с позиций номинализма. Тем не менее факты, свидетельствующие о правомерности подобной постановки вопроса, известны. Было показано, что гибель клеток кишечной палочки после УФ-облучения обусловлена существованием в клетке программы активного «саморазрушения». Инактивация хромосом и гибель клеток запрограммированны в rec A-зависимую «SOS»-последовательность событий после УФ-облучения и происходят во всех клетках, в которых не полностью репарирована ДНК (Salaj-Smic et al., 1988). У эукариотических организмов саморазрушение может быть вызвано активацией внутриядерных протеаз, принимающих участие в контроле синтеза ДНК (Schwartz,Weichselbaum, 1984). Внутриклеточная активация гидролаз отмечена и после ГБО (Skosey et al., 1981). Полученные нами данные также показывают, что аберрации хромосом возникают в результате метаболического самоповреждения. Так, были получены эндомитозные клетки периферической крови человека, обработанной in vitro 0,7 МПа – 1 ч. Фиксация проведена на 96-й ч культивирования. Сообразуясь с общепринятой классификацией «свежих» и персистирующих перестроек хромосом (Кунах, 1984), они могут быть расшифрованы следующим образом: индуцированные до S-фазы 1 митоза перестройки должны быть мультиплицированы в 4 хроматидах гомологичных хромосом; возникшие до S-фазы 2 митоза захватывают 2 хроматиды одной хромосомы, а единичные нарушения хроматиды возникают после S-фазы последнего цикла. Анализируемый кариотип содержит фрагменты, дефишенси, инверсии и юнионы. Обменные перестройки указывают на возникновение множественных разрывов, но для поддержания концепции более важен анализ характера разрывов – делеций и фрагментов хромосом. Можно отметить наличие 3 концевых делеций в хромосомах из группы А и по одному разрыву в группах С и Д. Эти разрывы возникли после S-фазы последнего митоза. На это указывают и одиночные разрывы с фрагментами 2 и 6 пар хромосом, т.е. разрывы появились или в G2стадии, или в митозе. То же можно сказать и о парных концевых фрагментах – они, в от121 личие от делетированных одиночных фрагментов, еще не успели резорбироваться. Таким образом, перестройки хромосом самоиндуцируются в сроки, весьма отдаленные во времени от окончания действия инициируемого фактора. Электронно-микроскопический анализ клеток костного мозга после ГБО выявляет в них «ядерные карманы» и пустоты в хроматине, которые могут быть результатом аутокариофагии. Наблюдаемые процессы являются одним из доказательств саморазрушения клеток в результате соматического мутагенеза или повышения пула эндогенных антиоксидантов, осуществляющих протекторный катаболизм системы. В последние годы представления о том, что реакция организма на изменение в нем концентрации окислителей не специфична, подвергаются все большим сомнениям. На молекулярном уровне показано, что окислители способны вызывать довольно специфические изменения метаболизма. В качестве ответа на метаболический стресс клетки начинают синтезировать сигнальные молекулы, названные алармонами, которые способны регулировать ответную реакцию клетки на воздействие (Alper, Ames, 1978). Алармоны обнаружены и в прокариотических, и в эукариотических клетках (Rapaport, Zamecnik, 1976). Они представляют собой аденилированные нуклеотиды, в частности диаденозинтетрафосфат. Показано, что появляющиеся в клетке аденилполифосфаты могут рассматриваться как специфическая реакция на окислительный стресс (Lee et al., 1983). Специфичность ответа была доказана при использовании разных типов окислителей – квинонов и ароматических окислителей, в частности, бензоквинона и параквата, неароматических реагентов с сульфгидрильными компонентами клетки, иодацетамида и хлорида кадмия, соединений, снижающих уровень глутатиона – диамид, перекись водорода, т-бутилгидропероксид (Alper, Ames, 1978). Характерно, что алармоны появляются в клетке не в результате мутаций структурных генов РНК-синтетазы или т-РНК, они являются чувствительным сайтом окисления и действуют как окислительные сенсоры (Bochner et al., 1984). Алармоны весьма чувствительны к концентрациям тяжелых металлов в клетке, и их присутствие значительно стимулирует синтез диаденилполифосфатнуклеотидов, изменяя активность различных ферментов, что приводит к дисбалансу метаболитов. Присутствие ионов тяжелых металлов, в частности, двухвалентного железа, повышенного содержания полинуклеотидов в среде вызывает стимуляцию индукции ·ОН-радикалов, причем мононуклеотиды таким эффектом не обладают (Floyd, 1983). В результате нарастания повреждений ДНК препаративные и специфические нуклеазы вызывают ферментативную деградацию генома, которая уже не уравновешена репаративным синтезом ДНК (Крутяков и др., 1983). Деконденсация хроматина не облегчает доступ эндонуклеаз к ДНК, несмотря на то, что репаративные системы продолжают функционировать в обычном режиме (Macgregor, Callar, 1973; Nakatsugawa et al., 1978). Морфологически они могут фиксироваться на уровне электронной и световой микроскопии (Moutschen, Moutschen-Dahmen, 1962). В результате окислительного стресса, даже спустя некоторое время, на уровне клетки фиксируется значительное количество разрывов хромосом. Такая реакция на окислительный стресс вызывает аlarm-мутагенез, истинный смысл которого заключается в том, чтобы обеспечить систему достаточным запасом природных антиоксидантов, индуцированных катаболизмом. Можно предположить такую схему протекторного катаболизма: стресс – свободнорадикальные процессы на мембранах – алармоны – активация внутриядерных металлов – кариоаутофагия – аларм-мутагенез – разрушение лизосом – цитофагия – увеличение гидролаз в сыворотке – усиление деструкции клеток – усиление мутационного процесса – усиление пролиферации – увеличение количества антиоксидантов – катаболитов – стабилизация и выход системы из стресса. 122 Такая система позволяет объяснить: – отсутствие нижнего порога воздействия окислителей, ответ идет по типу «все или ничего», поэтому ответ всегда максимален; – большую эффективность кратковременных воздействий неблагоприятного фактора по сравнению с пролонгированным; – усиление мутагенеза по мере удаления от начала воздействия; – большую чувствительность к окислителям системы in vivo по сравнению с in vitro; – защитный эффект экзогенной ДНК. Подводя итоги вышесказанному, следует отметить, что общебиологический смысл концепции протекторного метаболизма позволяет связать воедино и дать объяснения целому ряду фактов, ранее казалось бы не связанных между собой. Наличие резерва избыточности и усиление катаболизма при окислительном стрессе является адаптивной реакцией, в связи с чем соматический alarm-мутагенез также выполняет адаптивную функцию и является только показателем стрессовой ситуации, а не отражением патологических процессов в системе. С этой точки зрения от не может служить критерием чувствительности в генетической токсикологии. ЗАКЛЮЧЕНИЕ Приведенные результаты собственных экспериментов и анализ литературы приводят нас к представлению о том, что окислительный мутагенез является своеобразной формой мутагенеза, системной реакцией организма на факторы среды, затрагивающей звенья окислительного метаболизма, паратипической приспособительной реакцией на мутагены среды. Мутационный процесс носит не только эволюционный, но и модификационный характер. Как уже сказано раньше, для значительного числа природных и искусственно синтезированных химических мутагенов не удается найти корреляцию между способностью индуцировать точковые мутации, наследуемые в поколениях, и уровнем аберраций в соматических клетках (Шрамм, 1977). Изменения соматических клеток являются эпигенетическими по своей природе, и эффекты, наблюдаемые в культуре, не могут служить адекватными индикаторами мутагенных эффектов в генеративных тканях, так как эпигенетические изменения, как правило, не имеют эволюционных последствий. Изменения темпов соматического мутагенеза представляют собой приспособительный alarm-мутагенез – свидетельство стрессорной реакции организма на изменение среды, смысл которого заключается в высвобождении мощного резерва эндогенных антиоксидантов, увеличение пула которых позволяет системе поддерживать гомеостаз. Независимо от природы сигнала окислители запускают процессы самодеструкции клеток и поддерживают это состояние. С нашей точки зрения, соматический мутагенез не является патологическим процессом, более того, вероятно благодаря ему до некоторой степени снижается тяжесть протекания некоторых патологий, этиология которых связана с нарушением окислительновосстановительных реакций. Об этом свидетельствуют и последствия ГБО-терапии, после которой резко возрастает уровень перестроек хромосом на фоне улучшения самочувствия или снятия патологии. Конечные продукты катаболизма макромолекул, накапливающиеся после действия ГБО – мочевина, аммиак, мочевая кислота – осуществляют протекторную функцию системы в целом, и в частности герминальной системы, которая исходно имеет мощный механизм защиты от окислителей в форме гематотестикулярного барьера, имеющего повышенную проницаемость только для соединений с антиоксидантной активностью. Неспособность ГБО в проведенных нами экспериментах индуцировать точковые мутации подтверждает мнение о том, что повышение уровня перестроек хромосом после ГБО является отражением запуска системы протекторного катаболизма. В настоящее время наиболее существенной задачей, вытекающей из изложенной концепции, является изучение тонких механизмов индукции катаболизма, взаимодействие катаболитных антиоксидантов с индукторами стресса и возможностью регулировать и управлять протекторным катаболизмом, что даст возможность целенаправленно повысить резистентность организмов к экстремальным состояниям. При действии повышенного давления кислорода на организм животных, как in vivo, так и in vitro, максимальный выход аберраций хромосом регистрируется не сразу после окончания действия агента, а ко второму митотическому циклу, сохраняясь в ряду последующих клеточных поколений. При этом, в отличие от радиации, цитогенетический эффект повышенного давления кислорода в лимфоцитах человека не имеет линейной зависимости. Одной из причин отдаленного эффекта кислорода под давлением может быть сдвиг в динамической системе прооксиданты–антиоксиданты, связанный с накоплением вторичных активных метаболитов кислорода, активно взаимодействующих с наследствен124 ным аппаратом клетки. Сам кислород и его свободнорадикальные формы индуцируют однонитиевые разрывы ДНК и модифицируют основания непосредственно в момент проникновения в ядро (Dennog, et al.,1996). Однако показано, что уже в течение первого часа после окончания воздействия кислорода более 50 % первичных повреждений ДНК репарируется. Через 24 ч не обнаруживается 8-оксигуанина – продукта взаимодействия синглетного кислорода с ДНК (Speit et al., 1998). Таким образом, становление аберраций хромосом в отдаленные сроки может быть связано с накоплением и действием продуктов перекисного окисления липидов, в частности МДА. С другой стороны, атака ДНК ядер свободными радикалами, формирующимися в цитоплазме, может быть малоэффективна из-за защищенности хромосом ядерной мембраной. Митотические хромосомы являются более доступными для действия вторичных метаболитов по сравнению с интерфазными, прежде всего, из-за отсутствия ядерной оболочки. По мнению ряда исследователей, система мембран возникла в процессе эволюции для защиты генетического материала от токсического действия кислорода, появившегося в результате фотосинтетической деятельности сине-зеленых водорослей (Sagan, 1967; Руттен, 1973). Кроме того, было показано, что ядерная мембрана в отличие от мембран других органелл более устойчива к переокислению из-за особенностей фосфолипидного состава (Афанасьев, Мисник, 1973). Очевидно, что возможность непосредственного контакта хроматина с железосодержащими цитоплазматическими белками, а также продуктами ПОЛ плазматической и цитоплазматических мембран, возникает только при отсутствии кариолеммы (в митотических клетках). Поэтому в первом митозе после гипероксии аберрации хромосом могут не обнаруживаться (Чеботарев и др., 1991) и этим же можно объяснить то, что повышенный уровень перестроек хромосом в течение нескольких месяцев после окончания действия гипероксии и гипербарии обусловлен, прежде всего, хроматидными разрывами. Повышенный уровень аберраций хромосом сохранялся на протяжении 3 месяцев у животных после окончания многократной обработки низкими давлениями кислорода и через 9 месяцев у некоторых пациентов, прошедших курс ГБО-терапии. Пребывание животных в условиях многократной длительной гипербарии (3,6 МПа) также приводит к повышению уровня аберраций хромосом, который сохраняется на протяжении нескольких месяцев после окончания воздействия. Нами обнаружен факт повышенной нестабильности генома соматических тканей и в последующих поколениях животных (шпорцевых лягушек, мышей, морских свинок), родители которых подвергались воздействию как чистого кислорода, так и гипербарии. Различные органы и ткани обладают не одинаковой чувствительностью к токсическому действию кислорода и гипербарии (Садекова, 1991; Моргулис, 1992, Сапожников, 1992; Милютина и др., 1994). В многочисленных экспериментах, проведенных на крысах, было показано, что в условиях гипероксии в субклеточных фракциях крови, мозга, легких обнаружен различный уровень интенсификации ПОЛ как первичной реакции на окислительный стресс (Кричевская и др., 1980; 1987; Милютина и др., 1994). В условиях окислительного стресса также обнаружена различная скорость репарационных процессов, уровень которых зависит от типа тканей (Покудина, Прокофьев, 2000). Мы сочли целесообразным провести факторный анализ с целью определения более чувствительной ткани к действию гипербарии и гипероксии. Факторный анализ по выделению главной компоненты показал, что после действия длительной гипербарии ведущие позиции в индивидуальной изменчивости занимают клетки роговицы глаза и костного мозга, а после действия гипероксии клетки костного мозга и сперматоциты II порядка. 125 Сравнивая чувствительность соматических тканей к гипербарии и гипероксии, необходимо отметить существенную разницу во времени пребывания животных в этих условиях. В условиях гипероксии животные могут находиться не более 20 мин при давлении 0,7 МПа и не более 5 ч при давлении 0,2 МПа. Пребывание животных в гипербарической среде с учетом декомпрессии намного продолжительнее во времени, по сравнению с гипероксией и длится, как правило, несколько суток. При этом парциальное давление кислорода составляет не более 0,04 МПа (40–50 кПа), но экспозиция общего давления достаточно высока (1,1–10,1 МПа). При этом использование кислородно-гелиевой среды существенно изменяет механизм теплового баланса. Снижение температуры тела влечет за собой снижение интенсивности метаболических процессов, в частности тканевого кислородного обмена, т.е. приводит к гипоксии. Сравнивая цитогенетические эффекты, мы отмечаем наличие порога чувствительности соматических тканей животных как при гипероксии, так и при гипербарии. Так, нами не обнаружено повышения уровня аберраций хромосом у животных, подвергшихся действию гипероксии в режиме 0,12–0,15 МПа. Значимый цитогенетический эффект наблюдали при действии давления не менее 0,2 МПа. В условиях гипербарии (независимо от состава дыхательной смеси, но в условиях нормоксии) у животных, подвергавшихся действию давления 1,1, 3,5 и 7,0 МПа, в соматических тканях наблюдали практически равнозначное увеличение уровня аберраций хромосом. Существенное возрастание уровня перестроек хромосом регистрировали после погружения животных на глубину 1 000 м. При этом эпителиальные клетки роговицы глаза были повреждены более чем в 80 % случаев, а клетки костного мозга – более чем в 60 %. Интересным является факт снижения уровня АХр в соматических тканях животных, подвергшихся действию гипербарии в условиях незначительного повышения парциального давления кислорода. Очевидно, это связано с компенсаторными реакциями организма, такими как предотвращение развития гипоксических состояний при гипербарии. Пороговый эффект давления кислорода говорит об отсутствии мутагенного эффекта собственно кислорода, что связано с необходимостью устранения первичных барьеров антиоксидантной защиты, с одной стороны, и накоплением агрессивных кластогенных продуктов – с другой. Возможно, только при высоких концентрациях кислорода в клетке происходит увеличение внутриядерного пула свободных радикалов за счет модуляции валентности ДНК-связанного железа. Железо – важный катализатор свободно-радикальных реакций и перекисного окисления липидов. Показано, что гемоглобин является токсичным для нейронов спинного мозга, культивируемых in vitro в его присутствии (Regan, Guo, 1998). Железосодержащие белки усиливают свободно-радикальные реакции в условиях гипероксии, ишемии и целого ряда других патологических состояниях (Mohamed et al., 1996; D`Agnillo, Chang, 1998). Нарушение мембран эритроцитов, регистрируемое после действия гипебарической оксигенации, приводит к избыточному содержанию геминового и негеминового железа, которое является дополнительным источником радикалообразования и может существенно повысить уровень аберраций хромосом в лимфоцитах периферической крови и костном мозге. Большую чувствительность костного мозга к гипероксии можно объяснить созданием высокой концентрации кислорода в ткани при давлении, превышающем 0,2 МПа, а не давлением, которое в условиях гипербарии превышает данное в десятки раз. Пролонгацию кластогенного эффекта в клетках крови могут осуществлять фрагменты молекул гемоглобина, несущие геминовое железо. Таким образом, количество и скорость разрушения эритроцитарных мембран могут определять индуцированное коли126 чество аберраций хромосом в соматических тканях, а, следовательно, и устойчивость организма к окислительному стрессу. Другим источником дополнительного радикалообразования в клетке могут служить митохондрии. Металлосодержащие белки дыхательной цепи митохондрий – одни из основных источников эндогенных активных форм кислорода в клетке (Wallace, Melov, 1998). В условиях гипербарии и гипероксии нарушение функционирования электронтранспортной цепи митохондрий может приводить к повышению уровня свободных радикалов. Можно предположить, что митохондрии с пониженной способностью к утилизации кислорода потенциально могут быть кластогенны. Вероятно, кластогенной активностью обладает ряд митохондриальных белков – цитохромы и другие компоненты звеньев электронно-транспортной цепи, а также белки «автокиллеры». Показано, что именно через каскад событий, происходящих в митохондриях, происходит запуск апоптоза при окислительном стрессе (Скулачев, 1996; Lenaz, 1998; Lenaz et al., 1999). Выход цитохрома С в цитоплазму и открытие пор (которое сопровождается набуханием митохондрий, разрывом внешней мембраны и выходом белка в цитоплазму) является ключевым моментом запуска апоптоза. Как после действия гипероксии, так и после гипербарии наблюдали изменения ультраструктуры митохондрий, в том числе и набухание (Гуськов и др., 1985а). Было показано, что после действия гипероксии в митохондриальной ДНК регистрируется более чем в три раза больше повреждений по сравнению с ядерной ДНК (Agarwal, Sohal, 1994). Это может отражать степень поврежденности и гибели клеток, поскольку известно, что апоптоз, индуцированный окислительным стрессом, всегда сопровождается образованием большого количества фрагментов как ядерной, так и митохондриальной ДНК (Shaikh, 1997; Takahashi et al., 1998; Raaphorst et al., 1998). С другой стороны, в последние годы показан внутри- и межпопуляционный генетический полиморфизм митохондриальной ДНК (Cavalli-Sforza, 1998), что может быть одной из причин индивидуальной чувствительности животных и человека к действию экстремальных факторов. Обнаружен генетический полиморфизм и по митохондриальным металлосодержащим белкам, таким как цитохром Р450 и глутатион трансфераза (Wormhoudt et al., 1999). Возможно, что причиной устойчивости или чувствительности к ГБО животных и человека может быть наличие у них определенных аллельных форм митохондриальных белков. Мы предполагаем, что у индивидуумов, устойчивых к действию окислительного стресса, в большинстве поврежденных клеток запускаются реакции апоптоза, а у чувствительных – некроза. Если апоптоз – это контролируемая система – клетка поэтапно разбирает себя на составные молекулы, то некроз – это не контролируемая регуляторными системами клетки смерть, которая приводит к хаосу метаболитических процессов и увеличению литических ферментов. Поэтому при апоптозе происходит накопление конечных продуктов метаболизма, способных оказывать защитный эффект для других клеток при окислительном повреждении (Гуськов, Лукаш, 1986; Гуськов, 1989), что и обусловливает устойчивость организма в целом. Увеличение количества аберраций хромосом при больших гипербарических давлениях свидетельствует о том, что кластогенным эффектом обладает не столько молекулярный кислород и его свободные радикалы, сколько вторичные и третичные кластогенные продукты, т.е. собственно кислород недостаточно агрессивен по отношению к генетическому материалу клетки и не является мутагеном прямого действия. В этой связи эффективным защитным действием должны обладать соединения, купирующие действие 127 вторичных продуктов. Это должны быть препараты, работающие либо как фармакологические «мишени» для кластогенов, либо хелатирующие агенты, связывающие металлы с переменной валентностью. Установлено, что степень чувствительности к кислороду под давлением зависит от плоидности ткани и стадии клеточного цикла в период воздействия кислорода под повышенным давлением. Аберрации хромосом, возникающие после окислительного стресса затрагивают, главным образом, соматические ткани, и их можно рассматривать как адаптивный ответ на экстремальное воздействие. Окислительный стресс не вызывает доминантных летальных мутаций в генеративных клетках самцов млекопитающих. Показано, что внеэритроцитарный гемоглобин и его высокоактивные дериваты играют ведущую роль в становлении аберраций хромосом после воздействия кислорода под повышенным давлением. При этом индивидуальная устойчивость организма к действию кислорода и газовых смесей под повышенным давлением предопределена генотипическими особенностями, которые контролируют различные пути и скорости деградации антиоксидантных продуктов азотистого катаболизма. В отличие от гипероксии пребывание животных в гипербарических газовых средах является многофакторным экстремальным воздействием, которое приводит к различным патологическим эффектам. В условиях гипербарии реализуется экстремальное действие таких факторов как замкнутое пространство, понижение температуры, парциальное давление кислорода, высокое давление, инертные газы дыхательных смесей. Как показали наши исследования, стрессорное воздействие замкнутого пространства в барокамере на генетический аппарат клетки не является ведущим фактором. Интенсивность ПОЛ и уровень аберраций хромосом увеличиваются только после первого сеанса гипербарии и, как правило, к третьему сеансу нормализуются. Развивающуюся гипоксию в условиях гипербарии пытаются нормализовать с помощью увеличения парциального давления кислорода. Эффективность данного подхода проявляется в снижении уровня аберраций хромосом, обнаруженном в наших исследованиях, при однократном длительном воздействии гипербарии с повышенным парциальным давлением кислорода. Так же как и при гипероксии, реакция на гипербарию связана с индивидуальной чувствительностью организмов к данному фактору. Так, многократное гипербарическое воздействие выявляет группу животных с повышенной чувствительностью к исследуемому параметру. Эти результаты вновь заставляют обратить внимание на роль индивидуальной чувствительности генетического аппарата к стрессорным агентам. Экспериментальные результаты свидетельствуют о том, что при оценке чувствительности организма человека к гипербарическому воздействию по ряду значений биохимических и генетических показателей внутри случайной их выборки можно выделить устойчивые и чувствительные группы. Возможно, что также как и при гипероксии, в случае гипербарии чувствительность или устойчивость организма к данному фактору может определяться видоспецифичностью и полиморфизмом индивидуальных белков. Патологические эффекты гипероксии и гипербарии, наблюдавшиеся в наших экспериментах связаны со скоростью образования, временем существования и условий деструкции вторичных и третичных метаболитов с кластогенной активностью. Порог – устойчивость – чувствительность зависит от: – способности мембран препятствовать освобождению металлопротеинов; – способности цитоплазмы инактивировать кластогенные метаболиты; 128 – степени кластогенной активности комплексных метаболитов, которые могут отличаться как на видовом так и на индивидуальном уровне. Эти параметры определяют доза-зависимые пороговые эффекты с узким интервалом физиологически допустимых параметров между принудительным адаптивным ответом и летальным исходом организмов. Это объясняет высокую степень устойчивости одноклеточных организмов к гипероксии, в том числе и гаплоидных спермиев, а также отсутствие точковых мутаций у дрозофил после воздействия ГБО. В наших работах впервые показано, что однократное воздействие повышенного давления кислорода (0,2 МПа–1 ч) на новорожденных крыс изменяет внутриклеточный метаболизм тканей, в частности систем, ответственных за перекисное окисление липидов, и формирует качественно новое соотношение про- и антиоксидантных систем в организме, которое способно сохраняться длительное время. Впервые показано, что предварительное действие низкого режима ГБО (0,2 МПа–1 ч) на ранних стадиях постэмбрионального развития уменьшало выраженность стресс-индуцированного накопления продуктов перекисного окисления липидов во всех исследованных тканях после повторного воздействия ГБО (0,5 и 0,7 МПа) через 6 и 12 месяцев. Впервые показано, что преадаптированные в новорожденный период крысы обладают повышенной устойчивостью генома. Таким образом, впервые показано, что для формирования устойчивой долговременной адаптации к стрессу достаточно однократного воздействия ГБО (0,2 МПа–1 ч) в новорожденный период. Впервые показана возможность передачи устойчивости к окислительному стрессу от животных, однократно обработанных в новорожденный период низким режимом ГБО, своим потомкам, при этом более отчетливо данный процесс прослеживался в случае, когда преадаптированной была самка. Мы предполагаем следующие возможные наследуемые механизмы адаптации новорожденных животных к окислительному стрессу: геномный импринтинг материнских хромосом как следствие метилирования ДНК после окислительного стресса; изменение сайтов локализации мобильных генетических элементов может приводить к генетической экспрессии адаптивных признаков; неспецифическая активация генов, контролирующих АФК-модулирующие ферменты в ядрах ооцитов; формирование новых изоформ митохондриальных цитохромоксидаз; селекция митохондрий в гетероплазматических овариальных клетках животных. 129 ЛИТЕРАТУРА Абрамова Н.И., Оксенгендлер Г.И. Человек и противо-окислительные средства. М., 1985. Акберова С.И., Мусаев П.И., Магомедов Н.М. и др. Парааминбензойная кислота как антиоксидант // Докл. Академии наук. 1998. Т. 361. № 3. С. 419–421. Албертс Б., Брей Д., Льюис Дж. и др. Молекулярная биология. клетки. 2-е изд. М., 1994. 539 с. Алекперов У.К. Антимутагенез: Теоретические и прикладные аспекты. М., 1984. Алекперов У.К. Антимутагены и проблема защиты генетического аппарата. Баку, 1979. Алиев А., Ахундов В., Алекперов У. и др. Влияние предварительного хронического облучения и α-токоферола на частоту хромосомных аберраций в клетках костного мозга мышей, индуцированных острым воздействием γ-лучей // Радиобиология. 1985. Т. 25. № 1. С. 78–81. Анисимов В.Н. Молекулярные и физиологические механизмы старения. СПб., 2003. Артамонова Е.Ю., Синельщикова Т.А., Засухина Г.Д. Различия в антимутагенной активности витаминных препаратов в клетках человека при воздействии мутагенов различной природы // Генетика. 1994. Т. 30. № 11. С. 1556–1557. Ауэрбах Ш. Проблемы мутагенеза. М., 1978. Афанасьев И.Б. Свободнорадикальные ингибирторы и промоторы в билогических процессах // Кислородные радикалы в химии, биологии, медицине. Рига, 1988. С. 9–25. Афанасьев Ю.Д., Мисник Л.И. Мембранные структуры эпителиальных клеток при действии 100 % кислорода // Scripna med. 1973. Vol. 46. P. 391. Афанасьев Ю.И., Боронихина Т.В. Витамин Е: значение и роль в организме // Успехи современной биологии. 1987. Т. 104. С. 400–411. Барабой В.А. Механизмы стресса и перекисное окисление липидов // Успехи современной биологии. 1991. Т. 3. Вып. 6. С. 923–931. Белецкий Ю.Д. Искусственные мутации хлоропластов у высших растений. Ростов н/Д, 1989. Белецкий Ю.Д., Разорителева Е.К., Жданов Ю.А. Цитоплазматические мутации подсолнечника, индуцированные N-нитрозометилмочевиной // ДАН СССР. 1969. Т. 186. № 6. С. 1425–1426. Белецкий Ю.Д., Усатов А.В., Разорителева Е.К. Частота индуцированной N-нитрозоN-метилмочевиной внеядерной пестролистности у подсолнечника в зависимости от уровня репликации пластидной ДНК // ДАН СССР. 1990. Т. 313. № 3. С. 716–718. Биленко М.В. Ишемические и реперфузионные повреждения органов. М., 1989. Богданова И.А., Овчинников К.Г., Торбенко В.П., Герасимов А.М // Бюл. Эксперим. Биологии и медицины. 1987. Т. 103. № 13. С. 659. Бочков Н.П., Кулешов Н.П., Журков В.С. Анализ спонтанных аберраций в культуре лейкоцитов человека // Цитология. 1972. Т. 14. № 10. С. 1267–1273. Бочков Н.П., Чеботарев А.Н. Наследственность человека и мутагены внешней среды. М., 1989. Братковская Л.Б., Новиков К.Н., Шведова А.А. и др. Пиридиннуклеотидзависимые системы индукции перекисного окисления липидов в фоторецепторах сетчатки // Биологические науки. 1981. № 6. С. 21–26. Брень А.Б. Генетико-биохимические особенности преадаптации млекопитающих к окислительному стрессу: Дис. … канд. биол. наук. Ростов н/Д, 1997. 130 Бриттон Г. Биохимия природных пигментов. М., 1986. Бурлакова Е.Б. Биоантиоксиданты вчера, сегодня, завтра… // 5 Биоантиоксидант: Тез. докл. V Междунар. конф. М., 1998. С. 1–2. Бурлакова Е., Архипова Г., Голощапов А. и др. Мембранные липиды как переносчика информации // Биоантиокислители в регуляции метаболизма в норме и патологии. М., 1982. С. 74–83. Бурлакова Е.Б., Михайлов В.Ф., Мазурик В.К. Система окислительновосстановительного гомеостаза при радиационно-индуцируемой нестабильности генома // Радиац. биол. Радиоэкол. 2001. Т. 41. № 5. С. 489–499. Варфоломеев С.Д. Простагландины – новый тип биологических регуляторов // Соросовский образовательный журнал. 1996. Т. 1. С. 40–47. Васильева С.В. Автореф. дис. ... д-ра биол. наук. М., 1984. Васильева С.В. // Реализация наследственных геноформ. Паланга, 1980. С. 18. Васильева С.В., Давниченко Л.С., Рапопорт И.А. Усиление парааминбензойной кислотой процессов репарации ДНК в E. coli K-12 // Генетика. 1982. Т. 18. № 3. С. 381–391. Васильева С., Махова Е., Мошковская Е. Взаимосвязь экспрессии гена soxS с развитием адаптивной резистентности к индукторам SoxRS-регулона в клетках E. coli // Радиационная биология. Радиоэкология. 2004. Т. 44. С. 18–22. Владимиров Ю.А. Активные формы кислорода и азота: значение для диагностики, профилактики и терапии // Биохимия 2004. Т. 69. № 1. С. 5–8. Владимиров Ю.А., Шерстнев М.П. Хемилюминесценция клеток животных // ВИНИТИ, Итоги науки и техники. Сер. Биофизика. Т. 24. М., 1989. Владимиров Ю.И., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. М., 1972. Водолазкин Д.И., Чистяков В.А., Гуськов Е.П., Шерстнев К.Б. Деградация нуклеиновых кислот в условиях генерации супероксид-аниона в присутствии ионов меди // Молекулярная биология. 1987. Т. 21. С. 1664–1670. Воейков В.Л. Био-физико-химические аспекты старения и долголетия // Успехи геронтологии. 2002. Вып. 9. С. 54–66. Воронов Г. Протекторное действие α-токоферола при ишемическом и постишемическом повреждении гидроксилирующей функции печени крыс в эксперименте // Фармакологическая коррекция кислородзависимых патологических состояний: Тез. докл. 1-го Всесоюзн. Симпозиума (Москва, 9–10 октября, 1984). М., 1984. С. 111–112. Гамалей И.А., Клыбин И.В. Перекись водорода как сигнальная молекула // Цитология. 1996. Т. 38. № 12. С. 1233–1247. Гамалей И.А., Полозов Ю.С., Аксенов Н.Д. и др. Клеточный цикл и образование активных форм кислорода в фибробластах грызунов // Цитология. 2001. Т. 43. № 6. С. 595–601. Гаркави Л.Х., Квакина Е.Б., Уколова М.А. Адаптационные реакции и резистентность организма. Ростов н/Д, 1979. Гаркави Л.Х., Квакина Е.Б., Уколова М.А. Адаптационные реакции и резистентность организма. Ростов н/Д, 1990. Генкель П.А. Физиология жаро- и засухоустойчивости растений. М., 1982. Гончар И.В., Бурова Е.Б., Гамалей И.А. Никольский Н.Н. Активация рецептора EGF и факторов STAT в зависимости от окислительно-восстановительного статуса клеток А431 // Цитология. 2003. Т. 45. № 5. С. 478–487. Гончарова Р.И. Антимутагенез как генетический процесс // Вест. РАМН. 1993. № 1. С. 26–32. 131 Губский Ю.И., Левицкий Е.Л., Чабанный В.Н. Перекисное окисление липидов и параметры термоденатурации фракций хроматина печени крыс // Украинский биохимический журнал. 1990. Т. 62. № 2. С. 76–82. Гуськов Е.П. Генетические эффекты гипербарической оксигенации: Дис. … д-ра биол. наук. Ростов н/Д, 1989. Гуськов Е.П. Цитогенетический эффект повышенного давления кислорода на клетках корешков лука // Генетика. 1975. Т. 11. № 5. С. 147–149. Гуськов Е.П., Гуськова С.С., Шиманская Е.И., Шкурат Т.П. Влияние гипербарической оксигенации на соматические и генеративные клетки крыс // Цитология и генетика. 1990. Т. 24. № 2. С. 25–30. Гуськов Е.П., Дворкина Р. М., Беличенко Н.И. Действие азида натрия на становление перестроек хромосом после гипербароксигенации // IV съезд ВОГИС (Кишинев, 1–5 февраля 1982): Тез. Докл. Ч. 5. М., 1982а. С. 49. Гуськов Е.П., Дворкина Р. М., Беличенко Н.И. Модификация цитогенетического действия гипербароксигенации С-фенил-N-третбутилнитроном // Цитология и генетика. 1986а. Т. 20. № 4. С. 257–261. Гуськов Е.П., Дворкина Р.М., Беличенко Н.И. Эндогенные механизмы защиты клеток меристемы растений от генотоксичности гипербароксигенации // Цитология и генетика. 1989а. Т 24. № 3. С. 20–24. Гуськов Е.П., Дворкина Р.М., Гончаренко И.И. Действие гипербароксигенации на деление клеток проростков растений // Цитология. 1982б. Т. 24. № 3. С. 257–262. Гуськов Е.П., Клецкий М.Е., Корниенко И.В. и др. Аллантоин как тушитель свободных радикалов // Доклады Академии Наук. 2002. Т. 383. № 3. С. 105–107. Гуськов Е.П., Кощеева Т.А., Шкурат Т.П., Дашевский Б. Реакция клеток костного мозга мышей, пребывающих в условиях фракционированной гипербарии // Всес. конф. памяти Е.М. Крепса. Л., 1989б. Гуськов Е.П., Лукаш А.И. Онтогенез соматических клеток как система протекторного катаболизма // Человек и биосфера: сб. стат. Орджоникидзе, 1986. С. 39. Гуськов Е.П., Маркин Н.В., Усатов А.В., Машкина Е.В. Модификация действия нитрозометилмочевины на проростки подсолнечника тепловым шоком // Генетика. 2001а. Т. 37. № 3. С. 336–343. Гуськов Е.П., Милютина Н.П., Тимофеева И.В., Шкурат Т.П. Влияние гипербарической оксигенации на антиоксидантный статус Xenopus laevis после предварительной адаптации к кислороду // Онтогенез. 1999а. Т. 30. № 2. С. 91–96. Гуськов Е.П., Милютина Н.П., Тимофеева И.В., Шкурат Т.П. Специфичность биохимических реакций Xenopus laevis на окислительный стресс после предварительного воздействия гипербарической оксигенации // Доклады Академии наук. 1999б. Т. 365. № 4. С. 568–570. Гуськов Е.П., Покудина И.О., Шкурат Т.П. Исследование антимутагенного эффекта парааминобензойной кислоты в условиях окислительного стресса // Биоантиоксидант. М., 1992. Гуськов Е.П., Прокофьев В.Н., Клецкий М.Е. и др. Аллантоин как витамин // Доклады Академии наук. 2004. Т. 398. № 6. С. 1–6. Гуськов Е.П., Тимофеева И.В., Милютина Н.П. и др. Влияние гипербарической оксигенации на развитие Xenopus laevis // Онтогенез. 1997. Т. 28. № 5. С. 352–358. Гуськов Е.П., Федоренко Г. М., Шкурат Т.П. Ультраструктура клеток меристемы пшеницы в норме и после гипербароксигенации // Цитология. 1985а. Т. 27. № 1. С. 94–96. 132 Гуськов Е.П., Шиманская Е.И., Шкурат Т.П. и др. Роль эритроцитов в индукции аберраций хромосом повышенным давлением кислорода // Гипербарическая оксигенация: Тез. IV Симп. «Новое в практике и теории ГБО», Москва, 11–12 октября 1989 г. М., 1989в. Гуськов Е.П., Шкурат Т.П. Антиоксидантные эффекты предшественников фолиевой кислоты // Биоантиоксидант: Тез. 3-й Всес. конф. М., 1989а. Т. 1. С. 135–136. Гуськов Е.П., Шкурат Т.П. Влияние гипербарической оксигенации на включение Н3-тимидина в клетки фибробластов человека разной плоидности // Цитология и генетика. 1993. Т. 27. № 2. С. 47–53. Гуськов Е.П., Шкурат Т.П. Мутагенез соматических клеток как адаптивный процесс // Успехи современной биологии. 1989б. Т. 108. № 2. С. 163–172. Гуськов Е.П., Шкурат Т.П. Об участии α-токоферола в снятии цитогенетическоких последствий гипербарического стресса // Стресс, адаптация и функциональные нарушения: Тез. докл. Всесоюз. симп. Кишинев, 1984. С. 330. Гуськов Е.П., Шкурат Т.П. Цитогенетические последствия гипербарической оксигенации в ряду клеточных циклов лимфоцитов периферической крови человека // Генетика. 1985. Т. 21. № 8. С. 1361–1367. Гуськов Е.П., Шкурат Т.П., Камынина М.В. Цитологические последствия фракционированного и пролонгированного действия гипербарической оксигенации // Генетика. 1985б. Т. 21. № 10. С. 1693–1699. Гуськов Е.П., Шкурат Т.П., Милютина Н.П. и др. Влияние аллантоина на активность ферментов, регулирующих ROS-зависимый статус организма // Доклады Академии наук. 2001б. Т. 379. С. 398–401. Гуськов Е.П., Шкурат Т.П., Нечепуренко А.Э. Модификация цитогенетического эффекта, вызванного фолиевой кислотой // Фармакологическая коррекция кислородзависимых патологических состояний: Тез. докл. 1-го Всес. симп. М., 1984. С. 174–175. Гуськов Е.П., Шкурат Т.П., Нечепуренко А.Э. и др. Цитогенетические последствия длительной гипербарии // Совещание постоянной Всес. Комиссии по подводной физиологии и медицине, Ленинград, 2–4 марта 1988. Л., 1988. Гуськов Е.П., Шкурат Т.П., Палеев Н.Г. Один из возможных механизмов адаптации организмов к ГБО // Сб. Человек и биосфера: Сб. стат., Орджоникидзе, 1986б. С. 34–36. Гуськов Е.П., Шкурат Т.П., Шиманская Е.И. Прогнозирование отдаленных последствий ГБО // Гипербарическая оксигенация: Тез. IV симп. «Новое в практике и теории ГБО» 11–12 октября, 1989 г. М., 1989г. С. 178–179. Гуськов Е.П., Шкурат Т.П., Шиманская Е.И., Николаева Е. Способ определения индивидуальной чувствительности генома к ГБО // Изобретение. АС СССР № 246935. 1989д. Гуськов Е.П., Шкурат Т.П., Шиманская Е.И., Новикова Е.И., Жданов Г.Г. О цитогенетических последствиях ГБО-терапии // Человек и биосфера МТНС ГКНТ, Орджоникидзе, 1986в. С. 45–46. Гуськов Е.П., Шкурат Т.П., Шиманская Е.И., Янушевич С.В. Цитогенетические последствия оксигенобаротерапии // Космическая биология и авиакосмическая медицина. 1990б. № 4. С. 48–50. Дворкина Р.М. Зависимость доза-эффект при ГБО-мутагенезе // Тез. докл. Молекулярные механизмы генетических процессов: IV Всес. симп. М., 1979. С. 32–33. Демченко И.Т. Физиология экстремальных состояний // Успехи физиологических наук. 1994. Т. 25. № 2. С. 97–102. Джонгалина Н., Зыкова А. Модификация индуцированного мутагенеза бактерий малыми дозами химических мутагенов // Достижения микробиологии – практике: Тез. докл. VII съезда Всес. микробиол. общ-ва «Физиология, биохимия и организация микроорганизмов». Т. 3. Алма-Ата, 1985. С. 22. 133 Дорожко А.И., Бродский А.В., Афанасьев И.Б. Хелатирующее и антирадикальное действие рутина в процессе перекисного окисления липидов микросом и липосом // Биохимия. 1988. Т. 53. Вып. 53. С. 1660–1665. Доскоч Я.Е., Яковлев А.Р., Тарусов Б.Н. Спонтанная сверхслабая хемилюминесценция инбредных и гибридных линий растений // Биофизика. 1969. Т. 14. № 3. С. 561–564. Дубинин Н. Мутагены среды и наследственность человека // Успехи современной генетики. 1984. № 12. С. 3–29. Дурнев А.Д., Гусева Н.В., Кулакова А.В. Экологическая патология и фармакокоррекция. Т. 2. Чита, 1991. С. 22. Дурнев А.Д., Середенин С.Б. Роль свободных радикалов кислорода в мутагенных эффектах лекарств и других ксенобиотиков // Химико-фармацевтический журнал. 1990. Т. 24. № 10. С. 7–14. Дурнев А.Д., Середенин С.Б. Фармакологические проблемы поиска и применения антимутагенов // Вестник РАМН. 1993. № 1. С. 19–26. Дыбан А.П., Баранов В.С. Цитогенетика развития млекопитающих. М., 1978. Жумабаева Т.Т., Байдер Л. М., Алещенко А.В., Куроптева З.В. Аскорбиновая кислота и образование оксида азота в лейкоцитах // Биоантиоксидант: Тез. докл. VI Междунар. конф. (Москва, 16–19 апреля, 2002). М., 2002. С. 190. Журков В. Выявление возможных химических мутагенов в окружающей среде // Итоги науки и техники. Т. 2. Генетика человека. М., 1975. С. 117–161. Засухина Г.Д., Синельщикова Т.А. Мутагенез, антимутагенез, репарация ДНК // Вестник РАМН. 1993. № 3. С. 17–29. Зенков Н.К., Ланкин В.З., Меньшикова Е.Б. Окислительный стресс: биохимический и патофизиологический аспекты. М., 2001. Иванов И.И., Тарусов Б.Н. Свободнорадикальные цепные реакции в лпипдах биологических систем // Свободнорадикальное окисление липидов в норме и патологии. М., 1976. С. 105. Иванов И.Ф. О роли α-токоферола в поражающем эффекте пострадиационной гипероксии // Радиобиология. 1976. Т. 15. № 5. С. 737–776. Ивановский Ю., Митрофанов Ю. Стимуляция выплава науплиев Artemia salina гаммаоблучением // Радиобиология. 1978. Т. 18. С. 135–138. Инге-Вечтомов С. Идентификация некоторых групп сцепления у петергофских генетических линий дрожжей // Генетика. 1971. Т. 7. С. 113–119. Инге-Вечтомов С. Неоднозначность матричных процессов как фактор адаптации // Системы надежности клетки. Киев, 1977. С. 75–85. Казанцева Н.В. Гипербарическая оксигенация при сосудистых заболеваниях головного мозга (клинико-экспериментальное исследование): Автореф. … д-ра мед. наук. М., 1993. Капитанов А.Б., Пименов А.М. Каротиноиды как антиоксиданты // Успехи современной биологии. 1996. Т. 116. Вып. 2. С. 179–193. Кения М.В., Лукаш А.И., Гуськов Е.П. Роль низкомолекулярных антиоксидантов при окислительном стрессе // Успехи современной биологии. 1993. Т. 113. Вып. 4. С. 456–470. Керкис Ю., Скорова С. Исследование мутагенного эффекта гистамина и брадикинина в культуре клеток млекопитающих и человека // ДАН СССР. 1977. Т. 232. С. 478–481. Киссельгоф Е. Влияние длительного фракционированного облучения на обмен нуклеиновых кислот в костном мозге крыс // Радиобиология. 1975. Т. 15. С. 340–346. Конюхов Б.В. Генетический контроль клеточной дифференцировки // Успехи современной биологии. 1973. Т. 76. С. 171–188. 134 Коркина Л.Г., Черемисина 3. П., Суслова Г Б. и др. Каталитические свойства асбеста и его биологическая активность // Химико-фармацевтический журнал. 1989. № 8. С. 901–904. Коробова Л. Гистамин в крови и тканях при гипероксии: Автореф. дис. … канд. биол. наук. Харьков, 1984. Коровина Н.А., Захарова И.Н., Обыночная Е.Г. Применение антиоксидантов в педиатрической практике // Педиатрия. 2003. Т. 5. № 9. С. 67–74. Корогодин В.Н. Проблемы пострадиационного восстановления. М., 1966. Косиченко Л., Барская В., Торуа Р. Динамика аберраций хромосом в клетках костного мозга обезьян после пролонгированного облучения // Радиобиология. 1984. Т. 24. С. 528–530. Кошелева В.В. Воздействие фосфоксита-7 на молодь трески // Мат-лы 1-й Всес. конф. по рыбохозяйственной токсикологии. Рига, 1988. Ч.1. С. 91. Кричевская А.А., Лукаш А.И., Броновицкая З.Г. Биохимические механизмы кислородной интоксикации. Ростов н/Д, 1980. Кричевская А.А., Шерстнев К.Б., Милютина Н.П., Шерстнева И.Я. Перекисное окисление липидов и структурное состояние мембран субклеточных фракций мозга крыс в норме и при гипербароксигенации // Фундаментальные достижения биохимии Медицине: Тез. докл. Х Всесоюз. конф. по биохимии нервной системы. Горький, 1987. С. 148–149. Крутяков В.М., Белякова Н.В., Кравецкая Т.П., Нарычинский С.М. Роль структуры хроматина в репарации ДНК // Структурно- функциональные аспекты репликации и репарации ДНК. Пущино, 1983. С. 113–122. Кузнецов В.В., Хыдыров Б.Т., Рощупкин Б.В., Борисова Н.Н. Общие системы устойчивости хлопчатника к засолению и высокой температуре: факты и гипотезы // Физиология растений. 1990. Т. 37. Вып. 5. С. 987–996. Кулинский В.И., Колесниченко Л.С. Структура, свойства, биологическая роль и регуляция глутатионпероксидазы // Успехи современной биологии. 1993. Т. 113. Вып. 1. С. 107–122. Кунах В.А. Особенности структурного мутагенеза в популяциях культивируемых клеток растений // Успехи современной гентики. 1984. № 12. С. 30–62. Куринный П., Пилинская М. Исследование пестицидов как мутагенов внешней среды. Киев, 1976. Лебедева Л., Скорова С. О предельных явлениях при мутагенезе // ДАН СССР. 1985. Т. 282. С. 173–176. Левин В., Игнатьев Ю., Левина Т., Розанцев Э. Нитроксильные радикалы – эффективные ингибиторы окислительного процесса поликапроамида // Тез. докл. Всесоюз. конф. по нитроксильным радикалам (Черноголовка, 12–14 мая 1982). М., 1982. С. 79. Лобашев М. Физиологическая гипотеза мутационного процесса // Исследования по генетике. Вып. 6. Л., 1975. С. 3–15. Лотовин А.П., Морозов В.Г., Хавинсон В.Х., Долгий О.Д. К вопросу о клеточном и гуморальном иммунитете при гипероксии // Гипербарическая медицина: Мат-лы VII Междунар. конгр. (Москва, 3–6 сентября 1981). М., 1983. Т. 1. C. 83–84. Лукаш А.И., Внуков В.В. Внеэритроцитарный гемоглобин и продукты его деградации как фактор токсического эффекта кислорода // Вопросы мед. химии. 1985. № 6. С. 49–53. Лукаш А., Чихачев А., Карташева Л. Лизосомные ферменты ткани мозга при гипербарии и действии мочевины // Украинский биохимический журнал. 1975. № 6. С. 728–733. Лысенко В.С. Биохимические особенности формирования хлоридно-натриевой солеустойчивости у подсолнечника: Автореф. дис. … канд. биол. наук. Ростов н/Д, 1993. 135 Лю Б.Н. Пероксигеназные процессы и лейкогенез // Успехи современной биологии. 2003. Т. 123. № 2. С. 147–160. Лю Б.Н. Старение, возрастные паталогии и канцерогенез // Современные аспекты онкологии и радиологии: Сб. науч. тр., посвящённых 80-летию академика С.Б. Балмуханова. Алматы, 2002. С. 41–44. Меерсон Ф.З. Адаптационная медицина: концепция долговременной адаптации. М., 1993. Мелехов Е.И. О возможном принципе регуляции повреждений и защитной реакции клетки // Журн. общ. биол. 1983. Т. 44. № 3. С. 386–397. Мелехов Е.И. О функциях и механизмах реакции защитного торможения метаболизма // Проблемы физиологии и биохимии древесных растений: Тез. докл. Всес. конф., Красноярск, 20–23 сентября 1982 г. Красноярск, 1982. Т. 2. С. 104. Мелехов Е.И. Принцип регуляции скорости процесса повреждения клетки и реакция защитного торможения метаболизма // Журнал общей биологии. 1985. Т. 46. С. 174–189. Мелехова О.П. Свободнорадикальные процессы в эмбриогенезе // Онтогенез. 1976. Т. 7. № 2. С. 131–140. Меньщикова Е.Б., Зенков Н.К. Антиоксиданты и ингибиторы радикальных окислительных процессов // Успехи современной биологии. 1993. Т. 113. Вып. 4. С. 442–455. Меньщикова Е.Б., Зенков Н.К. Окислительный стресс при воспалении // Успехи соврем. биол. 1997. Т. 117. Вып. 2. С. 155–171. Милютина Н.П., Ананян А.А., Сапожников В. М., Новикова Е.И. Антиоксидантная система крови и модификация структурных свойств мембран эритроцитов в механизмах адаптации к измененным условиям газовой среды обитания // Современные проблемы биологии. Ростов н/Д, 1994. С. 79–88. Митрофанов Ю., Олимпиенко Г. Индуцированный мутационный процесс эукариот. М., 1980. 264 с. Моргулис Г.Л. Свободнорадикальные процессы в крови и ткани легких и состояние мембран эритроцитов при гипероксии и в постгипероксический период: Автореф. дис. ... канд. биол. наук. Ростов н/Д, 1992. Моргун В., Калиниченко В., Воронин Л., Каспранский Р. Теория и практика предадаптации к условиям космического полета // Организм и окружающая среда: адаптация к экстремальным условиям: Мат-лы рос. конф., Москва, 3–5 ноября 2003 г. М., 2003. С. 234–236. Новиков В.В. Растворимые формы дифференцировочных антигенов гемопоэтических клеток // Гематология и трансфузиология. 1996. № 6. С. 40–43. Октябрьский О.Н., Смирнова Г.В. Редокс-регуляция клеточных функций // Биохимия. 2007. Т. 72. Вып. 2. С. 158–174. Оленов Ю.М. Гены и эпигеномная изменчивость // Цитология. 1965. № 7. С. 285–302. Опритов В., Ретивин В., Лобов С. и др. Роль импульсной биоэлектрической активности в предадаптации клеток высших растений к действию стресс-факторов // Тез. II съезда биофизиков России. М., 1999. Островский М.А., Федорович И.Б., Донцов А.Е. Фотоокислительные процессы в структурах глаза. Защитная функция хрусталика и экранирующих пигментов // Биофизика. 1987. Т. 32. № 5. С. 896–909. Парина Е.В., Калиман П.А. Механизмы регуляции ферментов в онтогенезе. Харьков, 1978. С. 50–51. 136 Пескин А.В. Взаимодействие активного кислорода с ДНК // Биохимия. 1997. Т. 62. Вып. 12. 1997. С. 1571–1578. Покудина И.О. Модификация низкомолекулярными азотистыми катаболитами мутагенного эффекта окислительного стресса и их влияние на антиоксидантный статус клеток и тканей: Автореф. дис. … канд. биол. наук. Ростов н/Д. 2002. Покудина И., Прокофьев В. Антимутагенный эффект аллантоина и парааминобензойной кислоты от окислительного повреждения // Мат-лы 11-го съезда Вавиловского общества генетиков и селекционеров. СПб., 2000. Т. 2. С. 167–168. Руднева-Титова И.И., Жерко Н.В. Действие полихлорированных бифенилов на активность антиоксидантных ферментов и перекисное окисление липидов в мышцах и печени двух видов черноморских рыб // Биохимия. 1994. Т. 59. С. 34–44. Руттен М. Происхождение жизни. М., 1973. Рябов С.И., Шостка Г.Д. Молекулярно-генетические аспекты эритропоэза. Л., 1973. Садекова С.И. Влияние гипоксии, гипербарической оксигенации и их последовательного действия на микросомальное окисление и состояние мембран микросом: Автореф. дис. … канд. биол. наук. Ростов н/Д, 1991. Самуилов В.Д., Олескин А.В., Лагунова Е.М. Программируемая клеточная смерть // Биохимия. 2000. Т. 65. № 8. С. 1029–1046. Сапожников В.М. Перекисное окисление липидов и состояние мембран эритроцитов и микросом при многократном длительном действии факторов гипербарической гелиокислородной среды: Автореф. дис. ... канд. биол. наук. Ростов н/Д, 1992. Сахаров В. Йод как химический фактор, действующий на мутационный процесс у Dr. melanogaster // Биол жупнал. 1932. Т. 1. С. 1–8. Селье Г. Концепция стресса // Новое о гормонах и механизмах их действия. Киев, 1977. С. 22. Серебряный А. М., Сальникова Л.Е., Бахитова Л.М. и др. Специфичность мутагенного действия НММ и связь ее мутагенной активности с карбомоилирующими свойствами // Генетика. 1988. Т. 24. № 10. С. 1786–1793. Середенин С.Б., Дурнев А.Д // Клеточные механизмы реализации фармакологического эффекта. М., 1990. С. 273–296. Симпсон Дж. Формы и темпы эволюции. М., 1948. Скулачев В.П. Кислород в живой клетке: Добро и зло // Соросовский образовательный журнал. 1996. № 3. С. 4–10. Смирнов Ю., Абакумов Г., Лукиенко П. Коррекция -токоферолом повреждения монооксигеназной системы печени крыс при гипербароксигенации // Фармакологическая коррекция кислородзависимых патологических состояний: Тез. докл. I Всес. симп. (Москва, 9–10 октября, 1984). М., 1984. С. 196–197. Сокрут В.Н., Яблучанский Н.И., Зинкович И.И., Якубенко Е.Д. Кинетика миоглобина, креатинкеназы и аспартатаминотрансферазы при неосложненных и осложненных формах заживления экспериментального инфаркта миокарда // Патологическая физиология и экспериментальная терапия. 1992. № 1. С. 15–17. Сперанский С.Д., Неделькин А.Л., Сперанская Е.Ч., Зятьков И.Я. // Тез. III Всесоюз. совещ. по хемилюминесценции. Рига, 1990. С. 52. Спитковский Д. Концепция действия низких доз ионизирующей радиации на клетки и ее возможное использование для интерпретации медико-биологических последствий аварии на ЧАЭС // Радиац. Биол. Радиоэкол. 1992. Т. 32. С. 382–400. Сусков И., Сазонова Л. Мутагенные эффекты химических соединений у человека // Успехи современной генетики. 1983. Т. 11. С. 93–132. 137 Тимофеева И.В. Генетико-биохимические особенности реакции Xenopus laevis на окислительный стресс: Дис. … канд. биол. наук. Ростов н/Д, 1997. Тимофеев-Ресовский Н., Савич А., Шаляпов М. Введение в молекулярную радиобиологию (физико-химические основы). М., 1980. Тульнова Н. Цитогенетические показатели адаптации лимонника китайского к новым условиям существования // Экологическая генетика растений и животных. Кишинев, 1984. С. 23. Туманов И.И. Физиология закаливания и морозостойкости растений. М., 1979. Турпаев К.Т. Активные формы кислорода и регуляция экспрессии генов // Биохимия. 2002. Т. 67. № 3. С. 281–292. Тутельян В.А., Спиричев В.Б., Суханов Б.П., Кудашева В.А. Микронутриенты в питании здорового и больного человека. М., 2002. С. 82–898. Усатов А.В., Таран С.Ф., Гуськов Е.П. Зависимость пластидного мутагенеза, индуцированного N-нитрозо-N-метилмочевиной, от возраста прорастающих семянок подсолнечника в момент обработки // Генетика. 1995. Т. 31. № 2. С. 222–227. Усатов А.В., Таран С.Ф., Дмитриев В.В., Белецкий Ю.Д. Динамика включение 3 Н-тимидина в пластидную и ядерную ДНК зародышей на начальных этапах проращивания семянок подсолнечника // Цитология. 1990. Т. 32. № 3. С. 298–300. Фукс Б., Константинова И. Цитохимия иммуногенеза в ординарных и экстремальных условиях. М., 1973. Ходакова А., Менджерицкая Л., Коробова Л. Влияние гипероксии на концентрацию гистамина в тканях белых крыс // Вопросы медицинской химии. 1980. № 3. С. 331–334. Храпова Н.Г. О взаимодействии природных и синтетических антиоксидантов. Биоантиокислители в регуляции метаболизма в норме и патологии. М., 1982. С. 59–73. Худолей В.В., Мизгирев И.В., Майорова И.Г., Филов В.А. Современные представления о направленном поиске ингибиторов канцерогенеза // Успехи современной биологии. 1996. Т. 116. Вып 3. С. 332–345. Цонева М., Семенова М., Георгиева В. Исследование действия продуктов переработки нефти на репродукцию и кариотип у человека // Генетика и селекция. 1985. Т. 18. С. 91–98. Чайлд Ч.М. Роль организаторов в процессах развития. М., 1948. Чеботарев А.Н., Пахомов В.И., Дубинин П.Т. Снижение частоты аберраций хромосом после курса гипербарической оксигенации // Бюлл. экспер. биологии и медицины. 1991. Т. 111. № 5. С. 695–697. Шестопалов А.В., Шкурат Т.П., Микашинович З.И. и др. Алантоин – биологические свойства и функции // Успехи современной биологии. 2006. Т. 126. № 6. С. 611–617. Шестопалов А.В., Шкурат Т.П., Микашинович З.И. и др. Биологические функции аллантоина // Известия РАН. Серия биологическая. 2006. № 5. С. 541–545. Шиманская Е.И., Шкурат Т.П., Медведев Л.Г., Гуськов Е.П. Прогнозирование реакции генома соматических клеток водолазов на гипероксическую среду // Физиологический журнал. 1991. Т. 37. № 4. С. 119–123. Шихлярова А.И. О неспецифическом адаптационно трофическом влиянии малых доз адреналина: Автореф. дис. … канд. биол. наук. Ростов н/Д, 1985. Шкорбатов Т.Л. К построению общей теории адаптации // Журн. общ. биол. 1982. Т. 43. № 6. С. 775–787. Шкурат Т.П. Влияние факторов водолазного спуска на геном животных и человека // Возможности и перспективы использования индифферентных газов в водолазной практике, биологии и медицине: Сб. матер. конф. Москва, 16–17 ноября 1999 г. М., 1999. 138 Шкурат Т.П., Милютина Н.П., Нечепуренко А.Э. и др. Динамика перекисного окисления липидов и перестройки хромосом в различных тканях мышей после многократной гипербарии // Физиологический журнал. Киев. 1993. Т. 39. № 1. С. 91–98. Шкурат Т.П., Мостипан О.В., Шиманская Е.И. Реакция генома соматических клеток животных предадаптированных окислительным стрессом на гипероксию // VI Съезда ВОГиС (Минск, 23–27 ноября 1992 г.). Минск, 1992. Шкурат Т.П., Тимофеева И.В., Федоренко Г.М., Гуськов Е.П. Реакция костного мозга крыс на окислительный стресс // Цитология. 1991. Т. 33. № 5. С. 143. Шорнинг Б.Ю., Смирнова Е.Г., Ягужинский Л.С., Ванюшин Б.Ф. Необходимость образования супероксида для развития этиолированных проростков пшеницы // Биохимия. 2000. Т. 65. № 12. С. 1612–1617. Шрам Р. Сравнительная чувствительность теста на доминантные летали и цитогенетического анализа хромосомных аберраций в клетках костного мозга и сперматоцитах млекопитающих // Генетические последствия загрязнений окружающей среды. М., 1977. С. 132–140. Шульцман Ф. М., Петрусевич Ю. М., Тарусов Б.Н. Циркадные ритмы сверхслабой хемилюминесценции корней боба // Биофизика. 1976. Т. 21. № 4. С. 688–691. Эммануэль Н. Биофизические аспекты действия физических и химических факторов на живые организмы, защитные свойства антиоксидантов // Биофизика. 1984. Т. 29. С. 706–719. Adelman R.C. Disruptions in enzyme regulation during aging // Basic Life Sci. 1975. Vol. 6. P. 304–311. Agarwal S., Sohal R. DNA oxidative damage and life expectancy in houseflies // Proceedings of the National academy of sciences of the United States of America. 1994. Vol. 91. № 25. P. 12332–12335. Allen J.F. Control of gene expression by redox potential and the requirement for chloroplast and mitochondrial genomes // J. Theor. Biol. 1993. Vol. 165. P. 609–631. Allen J.F. Redox control of gene expression and the function of chloroplast genomes – an hypothesis // Photosynth. Res. 1993. Vol. 6. P. 95–102. Allen J.F. Thylakoid protein phosphorylation, state 1 – state 2 transitions, and photosystem stoichiometry adjustment: redox control at multiple levels of gene expression // Physiol. Plant. 1995. Vol. 3. P. 196–205. Allen J.F., Raven J.A. Free-radical-induced mutation vs redox regulation: costsand benefits of genes in organelles // J. Mol. Evol. 1996. Vol. 42. P. 482–492. Allen R.G. and Balin A.K. Oxidative influence on development and differentiation: an overview of a free radical theory of development // Free Radic. Biol. Med. 1989. Vol. 6. № 6. P. 631–661. Allen R.G. and Tresini M. Oxidative stress and gene regulation // Free Radic. Biol. Med. 2000. Vol. 28. № 3. P. 463–499. Allen S. Response of the developing vascular system of the chick embrio to hyperoxia // Federadion Proc. 1961. Vol. 20. P. 421–423. Allison A.C., Paton G.R. Chromosome damage in human diploid cells following activation of lysosomal enzymes // Nature. 1965. Vol. 207. P. 1170–1173. Alper M., Ames B. Transport of antibiotics and metabolite analogs by systems under cyclic AMP control positive selection of salmonella typhimurium cya and cip mutants // J. Bacteriol. 1978. Vol. 133. P. 149–157. Alscher R., Erturk N., Heath L. Role of superoxide dismutases (SODs) in controlling oxidative stress in plants // J. Exp. Bot. 2002. Vol. 72. P. 1331–1341. 139 Alves A.A., Setter T.L. Response of Cassava Leaf Area Expansion to Water Deficit: Cell Proliferation, Cell Expansion and Delayed Development // Ann. Bot. (Lond.). 2004. Vol. 4. № 4. P. 605–613. Ames B.N. Endogenous DNA damage as related to cancer and aging // Mutat. Res. 1989. Vol. 214. P. 41–46. Ames B.N. Which are the significant environmental mutagens and antimutagens // Mutat. Res. 1983. Vol. 13. P. 223–224. Ames B.N., Cathart R., Schwiers E., Hochstein P. Uric acid provides as antioxidant defence in humens against oxidant- and radical-caused aging and cancer // Proc. Natl. Acad. Sci USA. 1981. Vol. 78. № 11. P. 6858–6862. Ames B.N., Shigenaga M.K. Oxidants are a major contributor to aging // Ann. N.Y. Acad. Sci. 1992. Vol. 663. P. 85–96. Amstad P.A., Krupitza G., Cerutti P.A. Mechanism of c-fos induction by active oxygen // Cancer Res. 1992. Vol. 2. P. 3952–3960. Archibald R. Determination of citrulline and allation and demonstration of citrulline in blood plasma // Biol. Chem. 1994. Vol. 156. P. 121–142. Arnhold J., Hammerschmidt S., Arnold K. Role of functional groups of human plasma and luminol in scavenging of NaOCl and neutrophil-derived hypochlorous acid // Biochim. Biophys. Acta. 1991. Sep 23. Vol. 1097. P. 145–151. Asahi M., Fujii J., Suzuki K. et al. Inactivation of glutathione peroxidase by nitric oxide. Implication for cytotoxicity // J. Biol. Chem. 1995. Vol. 70. № 36. P. 21035–21039. Aula P., Nichols W.W. Lysosomes and virus induced chromosomes breaage // Exp. Cell. Res. 1968. Aug-Sep. Vol. 51. P. 595–601. Aycicek A., Iscan A., Erel O. et al. Oxidant and antioxidant parameters in the treatment of meningitis. // Pediatr. Neurol. 2007. Aug. Vol. 37. № 2. P. 117–120. Babior B.M. NADPH oxidase: an update // Blood. 1999. March 1. Vol. 93. № 5. P. 1464–1476. Babior B.M., Kipnes R.S., Cumitte J.T. Biological defense mechanisms: the production by leucocytes of superoxide, a potential antibactericidal agent // J. Clin. Invest. 1973. Vol. 52. № 3. P. 741–744. Baden J.M., Monk S.J., Halsey M.J. Effect of high helium and hydrostatic-pressure on bacterial mutation and growth // Toxicology Letters. 1981. Vol. 9. № 3. P. 201–206. Balin A., Goodman D., Rassmussen H., Cristofalo V. The effect of oxygen tension and vitamin E on lifespan of human diploid WI-38 cells // J. Cell Biol. 1977. Vol. 4. P. 58–67. Bates C.J. Vitamin A // Lancet. 1995. Vol. 345. P. 31–35. Beal M.F. Coenzyme Q10 as a possible treatment for neurodegenerative diseases // Free Radic. Res. 2002. Apr. Vol. 36. Р. 455–460. Beckman J., Beckman K., Chen J. et al. Apparent hydroxyl radical production by peroxynitrite: implications for endothelial injury from nitric oxide and superoxide // Proc. Natl. Acad. Sci USA. 1990. Vol. 7. P. 1620–1624. Beesk F., Dizdaroglu M., Schulte-Frohlinde D., von Sonntag C. Radiation-induced DNA strand breaks in deoxygenated aqueous solutions. The formation of altered sugars as end groups // Int. J. Radiat. Biol. Relat. Stud. Phys. Chem. Med. 1979. Dec. Vol. 36. № 6. P. 565–576. Bello B. del, Paolicchi A., Comporti M. et al. Hydrogen peroxide produced during gammaglutamyl transpeptidase activity is involved in prevention of apoptosis and maintenence of proliferation of U937 cells // FASEB J. 1999. Jan. Vol. 13. № 1. P. 69–79. Bendich A., Olson J.A. Bilogical actions of carotenoids // FASEB J. 1989. Vol. 3. № 8. P. 1927–1932. 140 Bert P. La barometric. Paris, 1873. Bhunia A.K., Han H., Snowden A., Chatterjee S. Redox-regulated by lactosylceramide in the proliteration of human aortic smooth muscle cells // J. Biol. Chem. 1996. Vol. 272. P. 15642–15649. Bingham E. Global pollution // Toxicol. Ind. Health. 1991. Sep. Nov. Vol. 7. № 5–6. P. 31–33. Blokhina O., Virolainen E., Fagerstedt K.V. Antioxidants, oxidative damage and oxygen deprivation stress: a review // Ann. Bot. (Lond.). 2003. Jan. Vol. 91. Spec №. P. 179–194. Bochner B.R., Lee P.C., Wilson S.W. et al. Appa and related adenylylated nucleotides are synthesized as consequence of oxygen stress // Cell. 1984. Vol. 37. P. 225–232. Boué A., Boué J. Chromosome abnormalities and abortion // Basic Life Sci. 1974. Vol. 4. P. 317–339. Boué J., Daketsé M.J., Deluchat C. et al. Identification by Q and G bands of chromosome anomalies in spontaneous abortion // Ann. Genet. 1976. Vol. 19. P. 233–239. Boveris A., Oshino N., Chance B. The cellular production of hydrogen peroxide // Biochem. J. 1972. Vol. 128. P. 617–630. Bradley M.O., Erickson L.C. Comparison of the effects of hydrogen peroxide and X-ray irradiation on toxicity, mutation, and DNA damage/repair in mammalian cells (V-79) // Biochim. Biophys. Acta. 1981. Vol. 54. P. 135–141. Brandriff B., Gordon L., Ashworth L. et al. Chromosomes of human sperm: variability among normal individuals // Hum. Genet. 1985. Vol. 70. № 1. Р. 18–24. Brar S., Kennedy T., Whorton A. et al. Requirement for Reactive Oxygen Species in SerumInduced and Platelet-Derived Growth Factor-Induced Growth of Airway Smooth Muscle // J. Biol. Chem. 1999. Vol. 74. P. 20017–20026. Broun G.B. Assessment of biomedical technology in the United States // Cah. Sociol. Demogr. Med. 1980. Vol. 20. P. 163–168. Brown W. Influence of nucleic acid degradation products on antibody synthesis. Molecular and cellular basis antibody formations // Prague Chechas. Acad. Sci. 1965. P. 525–534. Brown D.L., Hayward M. Key factors in improving surgical resources // Health Manage Forum. 1994. Vol. 7. P. 20–26. Brown W., Nakanj M. Antibody formation. Stimulation by polyadenylic and polycytidyle acids // Science. 1967. Vol.157. № 3190. P. 819. Bunout D., Cambiazo V. Nutrition and aging // Rev. Med. Chil. 1999. Jan. Vol. 127. № 1. P. 82–88. Burdon R.H. Released active oxygen species as intercellular signals: their role in regulation of normal amd tumor cell proliferation // Biol. Chem. Hoppe-Seyler. 1992. Vol. 373. № 9. Р. 739–740. Burdon R. Superoxide and hydrogen peroxide in relation to mammalian cell proliferation // Free Radic. Biol. Med. 1995. Vol. 18. P. 775–794. Burdon R.H., Gill V., Alliangana D. Hydrogen peroxide in relation to proliferation and apoptosis in BHK-21 hamster fibroplast // Free Radic. Res. 1996. Vol. 24. № 2. Р. 81–93. Burke J.J. Identification of genetic diversity and mutations in higher plant acquired thermotolerance // Physiol. Plantarum. 2001. Vol. 12. P. 167–170. Bush G.L. Model of animal speciation // Ann. Rev. Ecol. Syst. 1975. Vol. 6. P. 339–364. Cacciuttolo M.A., Trinh L., Lumpkin J.A., Rao G. Hyperoxia induces DNA damage in mammalian-cells // Free Radic. Biol. AND Med. 1993. Vol. 14. №. 3. P. 267–276. Carmichael P.L., Ni Shé M., Hewer A. et al. DNA adduct formation in mice following treatment with used engine oil and identification of some of the major adducts by 32P-postlabelling // Cancer Lett. 1992. Jun 15. Vol. 64. P. 137–144. 141 Cavalli-Sforza L.L. The DNA revolution in population genetics // Trends Genet. 1998. Vol. 14. P. 60–65. Chance B., Schoener B., Oshino R. et al. Oxidation-reduction ratio studies of mitochondria in freeze-trapped samples. NADH and flavoprotein fluorescence signals // J. Biol. Chem. 1979. Jun. 10. Vol. 254. № 11. Р. 4764–4771. Cheng K., Cahill D., Kasai H. et al. 8-Hydroxyguanine, an abundant form of oxidative DNA damage, causes G-T and A-C substitutions // Biol. Chem. 1992. Vol. 267. P. 166–172. Cleveland L. The whole life cycle of the chromosomes and their clase systems // Trans. Am. Phil. Soc. New series. 1949. Vol. 39. P. 1–100. Cohen A.M., Aberdroth R.E., Hochstein P. Inhibition of free radical – induce DNA damage by uric acids // Febs. Lett. 1984. Vol. 174. P. 147–150. Cohen M.M., Hirschhorn R. Lysosomal and non-lysosomal factors in chemically induced chromosome breakage // Exp. Cell. Res. 1971. Jan. Vol. 64. № 1. P. 209–217. Conger A., Fairchald L. Breakage of chromosomes by oxygen // Records Genet. Soc. Am. 1951. Vol. 21. P. 19. Cooper P., Burt A., Wilson J. Critical effect of oxygen tension on rate of growth of animal cells in continuous suspended culture // Nature. 1958. Vol. 182. P. 1508–1509. Corpas F., Barroso J., Del Ro L. Peroxisomes as a source of reactive oxygen species and nitric oxide signal molecules in plant cells // Trends. Plant. Sci. 2001. Vol. 6. № 4. P. 145–150. Coster L., Dorey S., Fritig B., Kauffmann S. A pharmacological approach to test the diffusible signal activity of reactive oxygen intermediates in elicitor-treated tobacco leaves // Plant. Cell. Physiol. 2002. Vol. 43. P. 91–98. D`Agnillo F., Chang T.M.S. Absence of hemoprotein-associated free radical events following oxidant challenge of crosslinked hemoglobin-superoxide dismutase catalase // Free radical biology and medicine. 1998. Vol. 24. № 6. P. 906–912. Damiens E., Mazurier J., el Yazidi I.E. et al. Effects of human lactoferrin on NK cell cytotoxicity against haematopoietic and epithelial tumor cells // Biochim. Biophys. Acta. 1998. Vol. 1402. P. 271–287. Degre R., Saheb S.A. // FEMS Microbiol. Lett. 1982. Vol. 14. P. 183–186. Demple B., Amabile-Cuevas C.F. Redox redux: The control of oxidative stress responses // Cell. 1991. Vol. 67. P. 837–839. Dennog C., Hartmann A., Frey G., Speit G. Detection of DNA damage after hyperbaric oxygen (HBO) therapy // Mutagenesis. 1996. Vol. 11. № 6. P. 605–609. DiMascio P., Murphy M.E., Sies H. Antioxidant defense systems – the role of carotenoids, tocopherols and thiols // Am. J. Clin. Nutr. 1991. Jan. Vol. 53. P. 194–200. Distel L.V., Schuessler H. The effect of serum albumin on the radiolysis of DNA studied by constant field electrophoresis and compared to alterations caused by low molecular weight OH scavengers // Int. J. Radiat. Biol. 1997. Vol. 71. P. 401–412. Dizdaroglu M. Chemical determination of free radical-induced damage to DNA // Free Radic. Biol. Med. 1991. № 10. P. 225–242. Dizdaroglu M. Oxidative damage to DNA in mammalian chromatin // Mutat Res. 1992. Vol. 275. P. 331–342. Dizdaroglu M., Schulte-Frohlinde D., von Sonntag C. Isolation of 2-deoxy-D-erythropentonic acid from an alkali-labile site in gamma-irradiated DNA // Int. J. Radiat. Biol. Relat. Stud. Phys. Chem. Med. 1977. Vol. 32. № 5. P. 481–483. Djurhuus R., Svardal A.M., Thorsen E. Toxicity of hyperoxia and high pressure on C3H/10T1/2 cells and effects on cellular glutathione // Undersea & Hyperbaric Medicine. 1998. Vol. 25. № 1. P. 33–41. 142 Doğru-Abbasoğlu S., Tamer-Toptani S., Uğurnal B. et al. Lipid peroxidation and antioxidant enzymes in livers and brains of aged rats // Mech. Ageing. Devel. 1997. Vol. 98. P. 177–180. Dohn G., Puente F., Smich C., Estge A. Changes in tissue protein levels as a result of endurance exercise // Life Sci. 1978. Vol. 23. P. 845–850. Drew R., Painter R., Feinendegen L. Oxygen inhibition nuclei acid synthesis in Hela S-3 cells // Exp. Cell. Res. 1964. Vol. 36. P. 297–309. Dumont M., Wille E., Stack C. et al. Reduction of oxidative stress, amyloid deposition, and memory deficit by manganese superoxide dismutase overexpression in a transgenic mouse model of Alzheimer’s disease // FASEB J. 2009. Vol. 23. P. 2459–2466. Duthie S.J., Ma A., Ross M.A., Collins A.R. Antioxidant supplementation decreases oxidative DNA damage in human lymphocytes // Cancer Res. 1996. Vol. 56. P. 1291–1295. Dutilleul C., Garmier M., Noctor G. et al. Leaf mitochondria modulate whole cell redox homeostasis, set antioxidant capacity, and determine stress resistance through altered signaling and diurnal regulation // Plant Cell. 2003. Vol. 15. P. 1212–1226. Duval D., Sieg D., Billings R. Regulation of hepatic nitric oxide synthase by reactive oxygen intermediates and glutathione // Arch. Biochem. Biophys. 1995. Vol. 316. № 2. P. 699–706. Dym M., Fawcett D.W. The blood-testis barrier in the rat and the physiological compartmentation of the seminiferous epithelium // Biol. Reprod. 1970. Vol. 3. P. 308–326. Elstner E. Oxygen activation and oxygen toxicity // Ann. Rev. Plant. Physiol. 1982. № 33. P. 73–96. Elstner E.F. and Heupel A. Involvement of the superoxide free radical ion in photosynthetic oxygen reduction // Z. Naturforsch. [C]. 1974. Sep-Oct. H 29C(9–10). S. 559–563. Emerit I., Keck M., Levy A. et al. Activated oxygen species at the origin of chromosome breakage and sister-chromatid exchanges // Mutat. Res. 1982. Vol. 103. P. 165–172. Emerit I., Khan S.H., Cerutti P.A. Treatment of lymphocyte cultures with a hypoxanthinexanthine oxidase system induces the formation of transferable clastogenic material // J. Free Radic. Biol. Med. 1985. Vol. 1. P. 51–57. En Li, Beard C., Jaenisch R. Role for DNA methylation in genomic imprinting // Nature. 1993. Vol. 366. P. 362–365. Epe B. Genotoxicity of singlet oxygen // Chemico-biological interaction. 1991. Vol. 80. № 3. P. 239–260. Ephrussi B. The cytoplasm and somatic cell variation // Journ. of Cellul. and Comparat. Physiology. 1959. Vol. 52. Supl. 1. P. 35–53. Erenberg L., Gustafsson A., Lunqvist U. Chemically induced mutation and sterility in barley // Acta Chem. Scand. 1958. Vol. 10. P. 492. Fariss M., Chan C., Patel M. et al. Role of mitochondria in toxic oxidative stress // Mol. Interv. 2005. № 2. P. 94–111. Felley-Bosco E. Role of nitric oxide in genotoxicity: implication for carcinogenesis // Cancer and Metastasis Reviews. 1998. Vol. 17. № 1. P. 25–37. Fender S.E., O`Connell M.A. Expression of the heat shock response in a tomato interspecific hybrid is not intermediate between the two parental responses // Plant. Physiol. 1990. Vol. 93. P. 1140–1146. Fenn W., Gerschman R., Gilbert D. et al. Mutagenic effects of high oxygen tension on Escherichia coli // Proc. Natl. Acad. Sci. USA. 1957. Vol. 43. P. 1027–1032. Ferguson L.R., Philpott M., Karunasinghe N. Dietary cancer and prevention using antimutagens // Toxicology. 2004. Vol. 198. Р. 147–159. 143 Fiaschi A.I., Cozzolino A., Ruggiero G., Giorgi G. Glutathione, ascorbic acid and antioxidant enzymes in the tumor tissue and blood of patients with oral squamous cell carcinoma // Eur. Rev. Med. Pharmacol. Sci. 2005. Vol. 9. Р. 361–367. Fisher A. Some effects of different tensions of oxygen on the respiration and growth of strain fibroblasts // Nature. 1960. Vol. 186. P. 315–316. Floyd R.A. Direct demonstration that ferrousion complexes of oil and triophosphate nucleotides catalyze hydroxyl free radical formation from hydrogen peroxide // Arch. Biochem. and Biophys. 1983. Vol. 25. № 1. P. 236–270. Floyd R. The role of 8-hydroxyguanine in carcinogenesis // Carcinogenesis. 1990. Vol. 11. P. 1447–1450. Fox D.P., Robertson F.W., Brown T. et al. Chromosome-aberrations in divers // Undersea Biomedical Research. 1984. Vol. 11. № 2. P. 193–204. Frederico L., Kunkel T., Shaw B. A sensitive genetic assay for the detection of cytosine deamination // Biochemistry. 1990. Vol. 29. Р. 2532–2537. Freeman B. Free radical chemistry of nitric oxide. Looking at the dark side // Chest. 1994. Vol. 105. Suppl. S79–S84. Frei B. Natural antioxidant in humen helth and disease. Boston, 1994. Fridovich I. Superoxide and evolution // Horiz. Biochem. Biophys. 1974. Vol. 1. P. 1–37. Fridovich I. Superoxide dismutase // Advances in Enzymology. 1986. Vol. 58. P. 61–97. Fridovich I. Superoxide dismutases. An adaptation to a paramagnetic gas // J. Biol. Chem. 1989. Vol. 264. P. 7761–7764. Fridovich I. Superoxide radical and superoxide dismutases // Oxygen and living processes / Ed. by D. Gilbert. N.Y., 1982. P. 250–272. Fridovich I. The biology of superoxide and of superoxide dismutases – in brief // Prog. Clin. Biol. Res. 1981. Vol. 51. P. 153–172. Fuchs D.A., Albers C. Effect of adrenaline and blood gas conditions on red cell volume and intra-erythrocytic electrolytes in the carp, Cyprinus carpio // J. Exp. Biol. 1988. Vol. 137. P. 457–476. Furukawa K., Tengler R., Nakamura M. et al. B lymphoblasts show oxidase activity in response to cross-linking of surface IgM and HLA-DR // Scand.J. Immunol. 1992. Vol. 35. P. 561–567. Gamberini M., Leite L.C.C. Proliferation of mouse fibroblasts induced by 1,2-dimethylhydrazine auto-oxidation: role or iron and free radicals // Biochem. Biophys. Res. Commun. 1997. Vol. 234. № 1. Р. 44–47. Gates M.A., Tworoger S.S., Hecht J.L. A prospective study of dietary flavonoid intake and incidence of epithelial ovarian cancer // Int. J. Cancer. 2007. Vol. 121. P. 2225–2232. Gebhart E., Wagner K., Grziwok K., Behnsen H. The action of anticlastogens in human lymphosyte culture and their modification by rat-liver S9 mix.11. Studies with vitamin C and E // Mutat. Res. 1985. Vol. 149. P. 83–94. Gerhart E. In vivo detection of mutagenicity in man // Bga. Chr. Inst. 1984. № 3. P. 67–90. Gerschman R. Oxygen effects on biological systems // Symp. Spec. Lect. XXI Inter. Cong. Physiol., Sciences Buenos Aires. 1959. P. 222–226. Gerschman R., Gilbert D., Nye S. et al. Oxygen poisoning and X-irradiation: a mechanism is common // Science. 1954. Vol. 119. P. 623–626. Gilca M., Stoian I., Atanasiu V., Virgolici B. The oxidative hypothesis of senescence // J. Postgrad. Med. 2007. Vol. 53. P. 207–213. Gimener-Abian M., Rozalen A., Carballo J. et al. HSP90 and Checkpoint-Dependent Lengthening of the G2 Phase Observed in Plant Cells under Hypoxia and Cold // Protoplasma. 2004. Vol. 223. № 2–4. P. 191–196. Girault I., Fort S., Molko D., Cadet J. Ozonolysis of 2’-deoxycytidine: isolation and identification of the main oxidation products // Free Radic. Res. 1997. Vol. 26. P. 257–266. Goeptar A.R., Scheerens H., Vermeulen N.P. Oxygen and xenobiotic reductase activities of cytochrome P450 // Crit. Rev. Toxicol. 1995. Vol. 25. P. 25–65. 144 Goldstein P., Modric T. Transgenerational, ultrastructural analysis on the antioxidative effects of tocopherol on early gametogenesis in Caenorhabditis elegans grown in 100 % oxygen // Toxicol. Appl. Pharmacol. 1994. Vol. 124. P. 212–220. Gottlieb S.F. Oxygen toxicity in unicellular organisms // Oxygen and living processes, interdisciplinary approach / Ed. by D. Gilbert. N.Y., 1981. P. 124–148. Graziewicz M., Wink D., Laval F. Nitric oxide inhibits DNA ligase activity: potential mechanisms for NO-mediated DNA damage // Carcinogenesis. 1996. Vol. 17. P. 2501–2505. Greenlund L.J., Deckwerth T.L., Johnson E.M. Jr. Superoxide dismutase delays neuronal apoptosis: a role for reactive oxygen species in programmed neuronal death // Neuron. 1995. Vol. 14. P. 303–315. Gröger M., Niederleithner H., Kerjaschki D., Petzelbauer P. A previously unknown dermal blood vessel phenotype in skin inflammation // J. Invest. Dermatol. 2007. Vol. 127. P. 2893–2900. Guemouri L., Artur Y., Herbeth B. et al. Biological variability of superoxide dismutase, glutathione peroxidase, and catalase in blood // Clin. Chem. 1991. Vol. 37. P. 1932–1937. Guetens G., de Boeck G., Highley M. et al. Oxidative DNA damage: biological significance and methods of analysis // Crit. Rev. Clin. Lab. Sci. 2002. № 4–5. P. 331–457. Gundy S., Varga L.P. Chromosomal aberrations in healthy persons // Mutat. Res. 1983. Vol. 120. P. 187–191. Guskov E.P., Kazantseva N.V., Shkurat T.P. Modifying effects of HBO-therapy in mace after radiation exposure // 13 International. Chromosome Conference. Numana, Ancona, 1997. Р. 89. Guskov E.P., Shkurat T.P., Azarova A.E. Modification of the cytogenetic effect of high oxygen pressure by folic and para-aminobenzoic acids // Inter. Confer. Praga, 1994. Guskov E.P., Shkurat Т.Р., Shimanskaya E.I., Guskova S.S. Genetics effects of GBO therapy // Mutat. Res. 1990. Vol. 241. P. 341–347. Gutierrez C., Lopez-Saez J. Oxygen dependence of sister-chromatid exchanges // Mutation Res. 1982. Vol. 103. P. 295–302. Gutterdge J.M.C., Halliwell B. The dexyribose assay: an assay both for «free» hydroxil radical and for site specific hydroxyl radicals production // Biochem. J. 1988. Vol. 253. P. 932–933. Hackney J., Collier C., Rounds D. Mechanism of pulmonary damage in oxygen poisoning // Drugs and Respiration. 1969. Vol. 11. P. 93–103. Hall A.H. Jr., Eanes R.Z., Waymack P.P. Jr., Patterson R.M. Accute effects of superoxide radical-generating system on DNA double-strand stability in Chinese hamster ovary cells. Determination by modified fluorometric procedure // Mutat. Res. 1988. Vol. 198. P. 161–168. Halliwell B. Biochemical mechanism accounting for the toxic action of oxygen on living organisms the Key role of superoxide dismutase // Cell. Biol. Int. Rep. 1978. № 2. P. 113–128. Halliwell B. Can oxidative DNA damage be used as a biomarker of cancer risk in humans? Problems, resolutions and preliminary results from nutritional supplementation Studies // Free Radic. Res. 1998. Vol. 29. № 6. P. 469–486. Halliwell B., Aruoma O.I. DNA damage by oxygen-derived species. Its mechanism and measurement in mammalian systems // FEBS Lett. 1991. Vol. 281. P. 9–19. Halliwell B., Gutteridge J.M.C. Free radicals in biology and medicine. Oxford, 1999. Halliwell B., Gutteridge J.M. Oxygen free radicals and iron in relation to biology and medicine: some problems and concepts // Arch. Biochem. Biophys. 1986. Vol. 246. P. 501–514. Halliwell B., Gutteridge I.M.C. Oxygen toxicity, oxygen radicals, transition metals and disease // Biochem. J. 1984. Vol. 219. P. 1–14. Hamilton H. Genetics and the atomic bombs in Hiroshima and Nagasaki // Amer. J. Med. Genet. 1985. Vol. 20. P. 541–548. 145 Han R.N.N., Buch S., Tseu I. et al. Changes in structure, mechanics, and insulin-like growth factor-related gene expression in the lungs of newborn rats exposed to air or 60 % oxygen // Pediatr. Res. 1996. Vol. 39. № 6. P. 921–929. Hancock J., Desikan R., Neill S. Role of reactive oxygen species in cell signaling pathways // Biochem. Soc. Trans. 2001. Vol. 29. P. 345–350. Hansberg W., Groot H. de, Sies H. Reactive oxygen species associated with cell differentiation in Neurospora crassa // Free Radic. Biol. Med. 1993. Vol. 14. № 3. P. 287–293. Henle E.S., Luo Y., Gassmann W., Linn S. Oxidative damage to DNA constituents by iron-mediated fenton reactions. The deoxyguanosine family // J. Biol. Chem. 1996. Vol. 271. P. 21177–21186. Hermanns R.C., Zwart L.L. de, Salemink P.J. et al. Urinary excretion of biomarkers of oxidative kidney damage induced by ferric nitrilotriacetate // Toxicol. Sci. 1998. Vol. 43. P. 241–249. Hess R., Bernhard H. The value of mutagenicity test results in risk assessment // Bga. Schr. Inst. 1984. № 3. P. 609–625. Hieda K. Oxygen-induced genetic changes in dry yeast cells // J. Bacteriol. 1982. Vol. 150. P. 963–965. Hilliker A.J., Duyf B., Evans D., Phillips J. Urate-null mutants of Drosophila melanogaster are hypersensitive of oxygen stress // Proc. Natl. Acad. Sci. USA. 1992. Vol. 89. № 5. P. 4343–4347. Hirayama S., Ueda R., Sugata K. Evaluation of active oxygen effect on photosynthesis of Chlorella vulgaris // Free Radic. Res. 1996. Vol. 25. № 3. P. 247–254. Hirota K., Kawase M., Ohmori S. High-performance liquid chromatographic method for the determination of plasma allantoin // J. Chromatogr. Vol. 277. P. 165–172. Hofmann B., Hecht H.I., Flohé L. Peroxiredoxins // Biol. Chem. 2002. Vol. 383. P. 347–364. Hong Z., Hailing L., Hui M., Guijie Z. Effect of vitamin E supplementation on development of reproductive organs in Boer goat // Anim. Reprod. Sci. 2009. Vol. 113. P. 93–101. Houlihan R., Levodni J., Gress M. Adaptation to increased oxygen tension at ambient pressure // Aerospase Med. 1967. Vol. 38. № 10. P. 995–999. Immenschuh S., Baumgart-Vogt E. Peroxiredoxins, oxidative stress, and cell proliferation // Antioxid. Redox Signal. 2005. Vol. 7. P. 768–777. Inoue S., Kawanishi S. Oxidative DNA damage induced by simultaneous generation of nitric oxide and superoxide // FEBS Lett. 1995. Vol. 371. P. 86–88. Ishii N. Role of oxidative stress from mitochondria on aging and cancer // Cornea. 2007. Vol. 26. S. 3–9. Joenje H., Gille J.J. P., Oostra A.B., van der Valk P. Some characteristic of hyperoxia – adapted HeLa cells. A tissue culture model for cellular oxygen tolerance // Lab. Invest. 1985. № 52. P. 420–428. Joenje H., Oostra A.B. Oxygen-induced cytogenetic instability in normal human lymphocytes // Hum. Genet. 1986. Vol. 74. P. 438–440. Joiner M., Lambin P., Marples B. Adaptive response and induced resistance // CR Acad. Sci. III. 1999. Vol. 322. P. 167–175. Joshi C.P., Kluveva N.Y., Morrow K.J., Nguyen H.T. Expression of a unique plastid localized heat shock protein is genetically linked to acquired thermotolerance in wheat // Theor. Appl. Genet. 1997. Vol. 95. P. 834–841. Kagan V.E., Kisin E.R., Kawai K. et al. Toward mechanism-based antioxidant interventions: lessons from natural antioxidants // Ann. N.Y. Acad. Sci. 2002. Vol. 959. P. 188–198. Kagan V.E., Schvedova A.A., Novikov K.N., Kozlov Yu.P. Licht-induced free radical oxidation of membrane lipids in photoreceptors of frog retina // Biochim. Biophys. Acta. 1973. Vol. 330. № 1. P. 76–79. Kapp R., Picciano D., Jacobson C. Y-chromosomal nondisjunction in dibromochloropropaneexposed worked // Mutat. Res. 1979. Vol. 69. P. 47–51. 146 Kasahara M., Kagawa T., Oikawa K. et al. Chloroplast avoidance movement reduces photodamage in plants // Nature. 2002. Vol. 420. P. 829–832. Kasparek G., Dohn G., Baraket H., Bames D. The role of lysosomes in exercise induced hepatic protein loss // J. Biochem. 1982. Vol. 302. P. 281–288. Kazantseva N.V., Shkurat T.P., Azarova A.E. et al. Effect of combination various doses of hyperbaric oxygenation and radio-activity on chromosomes aberration, humoral immunitet and free radical processes in mice // Undersea & Hyperbaric Medicine. 1997. Vol. 24. № 7. P. 60. Khan N., Asim M., Afaq F. et al. A novel dietary flavonoid fisetin inhibits androgen receptor signaling and tumor growth in athymic nude mice // Cancer. Res. 2008. Vol. 68. P. 8555–8563. Khanna-Chopra R., Sabarinath S. Heat-stable chloroplastic Cu/Zn superoxide dismutaze in Chenopodium murale // Bioch. Biophys. Res. Comm. 2004. Vol. 320. Iss 4. P. 1187–1192. Kinchi M., Irone T., Kada T. et al // Mutat. Res. 1984. Vol. 130. P. 367–368. Kitterige K., Wilson R. Uric acid substantially enhances the free radical-induced inactivation of alcohol dehydrogenase // FEBS Letters. 1984a. Vol. 178. P. 162–164. Kitterige K., Wilson R. Why enzyme inactivation connot be ruled out as an important contributory factor to oxygen effect // Inter. J. Radiation. Biology. 1984b.Vol. 45. P. 540. Kjekshus T., Ellekjaer E., Prinde A. The effect of free fatty acids on oxygen consumtion in man. The free fatty and hypothesis // Scand. J. Clin. Lab. Invest. 1980. Vol. 40. P. 63–70. Klock G., Winkle L. Reproductive adaptation in Drosophila exposed to oxigenenriched atmospheres // Aviat. Space Environ. Med. 1979. Vol. 50. P. 368–371. Kock R., Delvoux B., Sigmund M., Greiling H. A comparative study of the concentrations of hypoxanthine, xanthine, uric acid and allantoin in the peripheral blood of normals and patients with acute myocardial infarction and other ischaemic diseases // Eur. J. Clin. Chem. Clin. Biochem. 1994. Vol. 32. P. 837–842. Kohen R., Nyska A. Oxidation of biological systems: oxidative stress phenomena, antioxidants, redox reactions, and methods for their quantification // Toxicol Pathol. 2002. Vol. 30. P. 620–650. Konopacka M., Rzeszowska-Wolny J. Modifying effect of Vitamins C, E and b-carotene against DNA damage in mouse cells // Mutat. Res. 1998. Vol. 418. P. 57–63. Konstantinov Y.M., Lutsenko G.N., Podsosonny V.A. Genetic functions of isolated maize mitochondria under model changes of redox conditions // Biochem. Mol. Biol. 1995. Vol. 36. P. 319–326. Kornhauser A., Wamer W.G., Lambert L.A., Wei R.R. b-Carotene inhibition of chemicallyinduced toxicity in vivo and in vitro // Food Chem. Toxicol. 1994. Vol. 32. P. 149–154. Korsmeyer S.J. Bcl-2 initiates a new category of oncogenes: regulators of cell death // Blood. 1992. Vol. 80. P. 879–886. Korsmeyer S.J., Yin X.M., Oltvai Z.N. et al. Reactive oxygen species and the regulation of cell death by the Bcl-2 gene family // Biochim. Biophys. Acta. 1995. Vol. 1271. P. 63–66. Koyu A., Ozguner F., Caliskan S., Karaca H. Preventive effect of vitamin E on iron-induced oxidative damage in rabbit // Toxicol. Ind. Health. 2005. Vol. 21. P. 239–242. Kravetz G., Fisher A.B., Forman H.J. The oxygen-adapted rat model: Tolerance to oxygen at 1.5 and 2 ATA // Aviat. Space Environ. Med. 1980. Vol. 51. P. 775–777. Krinsky N.I. Natural antioxidants in human health and desease. Orlando, Fl., 1994. P. 239. Krishna G., Hath J., Ong T. Correlative genotoxicity studies of airborne particles in Salmonella typhimurium and cultured human lymphocytes // Envir. Mutagenes. 1984. Vol. 6. P. 585–592. Krishna Murti C., Sunder L., Hora Medal. Bilirubin – a model for study of an endogenous toxic chemical // Proc. Indian Natr. Sci. Acad. 1982. Vol. 48. P. 163–175. Kuchino Y., Mori F., Kasai H. et al. Misreading of DNA templates containing 8-hydroxydeoxyguanosine at the modified base and at adjacent residues // Nature. 1987. Vol. 327. P. 77–79. 147 Kumar G., Krishnaprasad B., Savitha M. et al. Enhanced expression of heat shock proteins in termotolerant lines of sunflower and their progenies selected on the basis of temperature induction response // Theor. Appl. Genetics. 1999. Vol. 99. P. 359–367. Kuzhir T. Antimutagens and chemical mutagenesis in systems of higher eukaryotes. Minsk, 1999. Lagendijk J., Ubbink J.B., Vermaak W.J. The determination of allantoin, a possible indicator of oxidant status, in human plasma // J. Chromatogr. Sci. 1995. Vol. 33. P. 186–193. Lazrak T., Milon A., Wolff G. et al. Comparison of the effects of inserted C40- and C50terminally dihydroxylated carotenoids on the mechnical of various phospholipid vesicles // Biochim. et Biophys. Acta. 1987. Vol. 903. P. 132–141. Lee D., Bochner B., Ames B. A heat – shock stress and the cell oxidation // Proc. Nat. Acad. Sci. USA. 1983. Vol. 80. № 24. P.7496–7500. Lenaz G. Role of Mitochondria in oxidative stress and ageing // Biochimica et Biophysica Acta-Bioenergetics. 1998. Vol. 1366. № 1–2. P. 53–67. Lenaz G., Bovina C., Formiggini G., Castellia G. Mitochondria, oxidative stress and antioxidant defences // Acta Biochimica Polonica. 1999. Vol. 46. № 1. P. 1–21. Lepoivre M. Raddassi K., Oswald I. et al. Antiproliferative effects of NO synthase products // Res. Immunol. 1991. Vol. 42. P. 580–583. Leprince O., Deltour R., Thorpe P. et al. The role of free radicals and radical processing systems in loss of desiccation tolerance in germinating maize (Zea mays L.) // New Phytologist. 1990. Vol. 116. P. 573–580. Lewis R. Evolution: a system of theories // Perspectives in biology and medicine. 1980. Vol. 23. № 1. P. 551–572. Liang S., Tang J., Shen Y.H. et al. Biflavonoids from Daphne feddei and their inhibitory activities against nitric oxide production // Chem. Pharm. Bull. (Tokyo). 2008. Vol. 56. P. 1729–1731. Liepelt A., Karbe L., Westendorf J. Induction of DNA strand breaks in rainbow-trout oncorhynchus-mykiss under hypoxic and hyperoxic conditions // Aquatic Toxicology. 1995. Vol. 33. № 2. P. 177–181. Lindahl T. Instability and decay of primary structure of DNA // Nature. 1993. Vol. 362. P. 709–715. Lissi E.A, Caceres T., Videla L.A. Visible chemiluminescence from rat brain homogenates undergoing autoxidation. II. Kinetics of the luminescence decay // Free Radic. Biol. Med. 1988. Vol. 4. P. 93–97. Loggini B., Scartazza A., Brugnoli E., Navari-Izzo F. Antioxidative defense system, pigment composition, and photosynthetic efficiency in two wheat cultivars subjected to drought // Plant. Physical. 1999. Vol. 119. P. 1091–1100. Luo Y., Henle E.S., Linn S. Oxidative damage to DNA constituents by iron-mediated fenton reactions. The deoxycytidine family // J. Biol. Chem. 1996. Vol. 271. P. 21167–21176. Lyon M., Phillips T., Searle A. A test for mutagenicity of caffeine in mice // Leitschr. Vererb. Lehre. 1962. Vol. 93. P. 7–13. Macgregor H., Callar H. The actions of enzymes on lampbrush chromosomes // Qart. J. Micosc. Sci. 1973. Vol.103. P.1962. Mailand N., Falck J., Lukas C. et al. Rapid destruction of human Cdc25A in response to DNA damage // Science. 2000. Vol. 288. P. 1425–1429. Masters C., Holmes R. Peroxisomes: new aspects of cell physiology and biochemistry // Physiol. Rev. 1977. Vol. 57. P. 816–882. Matsuda Y., Tobari I., Yamada T. Studies on chromosome aberrations in the eggs of mice fertilized in vitro after irradiation. II. Chromosome aberrations induced in mature oocytes and fertilized eggs at the pronuclear stage following X-irradiation // Mutat. Res. 1985. Vol. 151. P. 275–280. 148 Matsuoka A., Hirosava A., Natori S. et al. Mutagenicity of ptaquiloside, the carcinogen in bracken, and its related illudane-type sesquiterpus. II. Chromosomal aberration tests with cultured mammalian // Mutat. Res. 1989. Vol. 215. P. 179–185. McCall M.R., Frei B. Can antioxidant vitamins materially reduce oxidative damage in humans? // Free Radic. Biol. Med. 1999. Vol. 26. № 7–8. P. 1034–1053. McCord J.M. Superoxide radical: controversies, contradictions, and paradoxes // Proc. Soc. Exp. Biol. Med. 1995. Vol. 209. P. 112–117. McCord J.M., Roy R.S., Schaffer S.W. Free radicals and myocardial ischemia. The role of xanthine oxidase // Adv. Myocardiol. 1985. Vol. 5. P. 183–189. Mello-Filho A.C., Chubatsu L.S., Meneghini R. V79 Chinese-hamster cells rendered resistant to high cadmium concentration also become resistant to oxidative stress // Biochem. J. 1988. Vol. 256. P. 475–479. Meneghini F., Stellin L., Taraborrelli M., Parisio U. Adenocarcinoma of the amphicrine cells of the pancreas. Histopathology and pathogenetic hypotheses // Ann. Ital. Chir. 1987. Vol. 59. P. 249–257. Mengel C. The effects of HBO on red cells as related to tocopherol deficiency // Am.N.Y. Acad. Sci. 1972. Vol. 203. P. 163–171. Merrit K., Johnson A.G. Studies on the adjuvant of bacterial endotoxins on antibody formation. VI. Enhancement of antibody formation by nucleic acids // J. Immunol. 1965. Vol. 94 №. 3. P. 416. Mikami T., Kita K., Tomita S. et al. Is allantoin in serum and urine a useful indicator of exercise-induced oxidative stress in humans? // Free Radic. Res. 2000. Vol. 32. P. 235–244. Miltenburger H. Chromosome aberrations in somatic mammalian cells in vivo // Bga. Schr. Inst. 1984. № 3. P. 131–147. Min B.S., Thu C.V., Dat N.T. et al. Antioxidative flavonoids from Cleistocalyx operculatus buds // Chem. Pharm. Bull. (Tokyo). 2008. Vol. 56. P. 1725–1728. Mittler R. Oxidative stress, antioxidants and stress tolerance // Trends. Plant. Sci. 2002. Vol. 7. № 9. P. 405–410. Mittova V., Tal M., Volonita M., Guy M. Salt stress induces up-regulation of an efficient chloroplast antioxidant system in the salt-tolerant wild tomato species Lycopersicon pennellii but not in the cultivated species // Physiol. Plant. 2002. Vol. 115. P. 393–400. Miura T., Muraoka S., Ogiso T. Inhibitory effect of urate on oxidative damage induced by adriamycin-Fe3+ in the presence of H2O2 // Res. Commun. Chem. Pathol. Pharmacol. 1993. Vol. 79. № 1. P. 75–85. Mohammed F.M., Slivka S., Hallman M. Recombinant human erythropoetin: possible role as an antioxidant in premature // Pediatric Research., 1996. Vol. 40. № 3. P. 381–387. Moorchead P., Nowell P., Mellman W. Chromosome preparation of leucocytes cultured from human periphermal blood // Exp. Cell. Res. 1960. Vol. 20. P. 613–616. Moutschen J., Moutschen-Dahmen M. Quelques effects cytologigues gualitatifs de l`oxygene a haute pression // La Cellule. 1962. Vol. 62. P. 152–169. Moutschen-Dahmen M., Moutschen J., Erenberg L. Chromosome disturbances and mutation produced in plant seeds by oxygen at high pressures // Hereditas. 1959. Vol. 45. P. 230. Mulcahy R.T., Wartman M.A., Bailey H.H., Gipp J.J. Constitutive and -naphtoflavoneinduced expression of the human -glutamylcysteine synthetase heavy subunit gene is regulated by a distal antioxidant response element/TRE sequence // J. Biol. Chem. 1997. Vol. 272. P. 7445–7454. Munne-Bosch S. The role of alpha-tocopherol in plant stress tolerance // J. Plant. Physiol. 2005. Vol. 162. P. 743–748. 149 Murrell G., Francis M., Bromley L. Modulation of fibroblast proliferation by oxygen free radicals // Biochem. J. 1990. Vol. 265. № 3. P. 659–665. Nadeem A., Masood A., Siddiqui N. Oxidant-antioxidant imbalance in asthma: scientific evidence, epidemiological data and possible therapeutic options // Ther. Adv. Respir. Dis. 2008. Vol. 2. P. 215–235. Naito T., Matsuura A., Ishikawa F. Circular chromosome formation in a fission yeast mutant defective in two ATM homologues // Nature Genet. 1998. Vol. 20. P. 203–206. Nakatsugawa S., Ishizaki K., Sugahara T. The reduction in frequency of X-ray-induced sister chromatid exchanges in cultured mammalian cells during post-irradiation incubation in Hanks’ Balanced Salt Solution // Int. J. Radiat. Biol. Relat. Stud. Phys. Chem. Med. 1978. Vol. 34. P. 489–492. Nanney D. Epygenetic factors affecting mating type expression in certain ciliates // Cold Spring Harbor Symposium on Quantitative Biology. 1958. Vol. 23. P. 327–335. Neill S., Desikan R., Hancock J. Hydrogen peroxide signaling // Curr. Opin. Plant. Biol. 2002. Vol. 5. P. 388–395. Noctor G., Dutilleul C, De Paepe R., Foyer C. Use of mitochondrial electron transport mutants to evaluate the effects of redox state on photosynthesis, stress tolerance and the integration of carbon/nitrogen metabolism // J. Exp. Bot. 2004. Vol. 55. № 55. P. 49–57. Nordenson I., Beckman G., Beckman L. The effect of superoxide dismutase and catalase on radiation-induced chromosome breaks // Hereditas. 1976. Vol. 82. P. 125. Nussbaum R.L., Walmsley R.M., Lesko J.G. et al. Thymidylate synthasedeficient Chinese hamster cells: a selection system for human chromosome 18 and experimental system for the study of thymidylate synthase regulation and fragile X expression // Am. J. Hum. Genet. 1985. Vol. 37. P. 1192–1205. Oakberg E.F. Duration of spermatogenesis in the mouse // Nature. 1957. Vol. 180. P. 1137–1138. Oakberg E.F. Response of spermatogonia of the mouse to hycanthone: a comparison with the effect of gamma rays // Basic Life Sci. 1974. Vol. 4. P. 197–207. O’Donnell V.B., Azzi A. High rates of extracellular superoxide generation by cultured human fibroblasts: involvement of a lipid-metabolizing enzyme // Biochem. J. 1996. Vol. 318. Pt. 3. P. 805–812. Ogihara T., Kim H.S., Hirano K. et al. Oxidation products of uric acid and ascorbic acid in preterm infants with chronic lung disease // Biol. Neonate. 1998. Vol. 73. P. 24–33. Ogino K., Wang D.H. Biomarkers of oxidative/nitrosative stress: an approach to disease prevention // Acta Med. Okayama. 2007. Vol. 61. P. 181–189. Olivera R.C. de, Ribeiro D.T. Singlet oxygen induced mutation spectrum in mamalian cells // Nucl. Acids. Res. 1992. Vol. 20. № 16. P. 4319–4323. Ostertag W., Duisberg E., Sturman M. The mutagenic activity of caffeine in man // Mutat. Res. 1965. № 2. P. 293–296. Ostman B., Michaëlsson K., Helmersson J. et al. Oxidative stress and bone mineral density in elderly men: antioxidant activity of alpha-tocopherol // Free Radic. Biol. Med. 2009. Vol. 47. P. 668–673. Ostrosky-Wegman P., García G., Montero R. et al. Susceptibility to genotoxic effects of niclosamide in human peripheral lymphocytes exposed in vitro and in vivo // Mutat. Res. 1986. Vol. 173. P. 81–87. Palozza P., Krinsky N.I. Beta-Carotene and alpha-tocopherol are synergistic antioxidants // Arch. Biochem. Biophys. 1992. Vol. 15. P. 184–187. Papa S., Skulachev V.P. Reactive oxygen species, mitochondria, apoptosis and aging // Molec. Cell. Biochem. 1997. Vol. 174. P. 305–319. Patel H., Pietro E.D., MacKenzie RE. Mammalian fibroblasts lacking mitochondrial NAD+dependent methylenetetrahydrofolate dehydrogenase-cyclohydrolase are glycine auxotrophs // J. Biol. Chem. 2003. Vol. 278. P. 19436–19441. 150 Paton G.R., Allison A.C. Chromosome breakage by deoxyribonuclease // Nature. 1970. Vol. 227. P. 707–708. Paton G.R., Allison A.C. Further studies relating to the role of deoxyribonuclease in chromosome breakage // Z. Krebsforsch. Klin. Onkol. Cancer. Res. Clin. Oncol. 1974. Bd. 82. P. 239–246. Phillips B., James T., Anderson D. Genetic damage to CHO cells exposed to enzymically generated active oxygen species // Mutat. Res. 1984. Vol. 126. P. 265–271. Pierce J.H. Oncogenes, growth factors and hematopoietic cell transformation // Biochim. Biophys. Acta. 1989. Vol. 989. P. 179–208. Potashnik G., Abeliovich D. Chromosomal analysis and health status of children conceived to men during or following dibromochloropropane-induced spermatogenic suppression // Andrologia. 1985. Vol. 17. P. 291–296. Povirk L.F., Houlgrave C.W., Han Y.H. Neocarzinostatin-induced DNA base release accompanied by staggered oxidative cleavage of the complementary strand // J. Biol. Chem. 1988. Vol. 263. P. 19263–19266. Premkumar K., Min K., Alkan Z. The potentiating and protective effects of ascorbate on oxidative stress depend upon the concentration of dietary iron fed C3H mice // J. Nutr. Biochem. 2007. Vol. 18. P. 272–278. Punjabi C., Laskin D., Heck D., Laskin J. Production of nitric oxide by murine bone marrow cells. Inverse correlation with cellular proliferation // J. Immunol. 1992. Vol. 149. P. 2176–2184. Raaphorst G.P., Mao J., Yang H. et al. Evaluation of apoptosis in four human tumor cell lines with differing sensitivities to cisplatin // Anticancer Res. 1998. Vol. 18. P. 2945–2951. Raff H. Interactions between neurohypophysial hormones and the ACTH-adrenocortical axis // Ann. N.Y. Acad. Sci. 1993. Vol. 68. P. 411–425. Rapaport E., Zamecnik P. Presence of diadenosine 5ʹ,5ʹʹ-P1,P4-tetraphosphate (Ap,A) in mammalian cells in levels varying widely with proliferative activity of the tissue a possible positive pleotypic activator // Proc. Nat. Acad. Sci. USA. 1976. Vol. 73. P. 3984–3988. Räsänen L.A., Myllymäki T., Hyyppä S. et al. Accumulation of allantoin and uric acid in plasma of exercising trotters // Am. J. Vet. Res. 1993. Vol. 54. P. 1923–1928. Raven J.A., Johnston A.M., Parsons R., Kubler J.E. The influence of natural and experimental high O2 concentrations on O2-evolving phototrophs // Biol. Rev. 1994a. Vol. 69. P. 61–94. Raven J.A., Johnston A.M., Parsons R., Kubler J.E. The occurrence, and influence on photolithotrophs, of high O2 concentrations // Proc. R. Soc. Edinb. 1994b. Vol. 102B. P. 193–201. Regan R., Guo Y. Toxic effect of hemoglobin on spinal cord neurons in culture // J. Neurotrauma. 1998. Vol. 15. № 8. P. 645–653. Regoli F., Gorbi S., Frenzilli G. et al. Oxidative stress in ecotoxicology: from the analysis of individual antioxidants to a more integrated approach // Mar. Environ. Res. 2002. Vol. 54. P. 419–423. Richardson C.R., Howard C.A., Sheldon T. et al. The human lymphocyte in vitro cytogenetic assay: positive and negative control observations on approximately 30000 cells // Mutat. Res. 1984. Vol. 141. P. 59–64. Rieger R., Michaelis A., Schubert I. et al. Nonrandom intrachromosomal distribution of chromatid aberrations induced by X-rays, alkylating agents and ethanol in Vicia faba // Mutat. Res. 1975. Vol. 27. P. 69–79. Robertson P., Fridovich. A reaction of the superoxide radical with tetrapurroles // Arch. Biochem. Biophys. 1982. Vol. 213. P. 353–357. Rojas-Walker T. de, Tamir S., Ji H. et al. Nitric oxide induces oxidative damage in addition to deamination in macrophage DNA // Chem. Res. Toxicol. 1995. Vol. 8. P. 473–477. 151 Rosenbaum R., Witter H. The effects of hyperatmospheric oxygen concentrations on early clevsage in the sand Dollar ehinarachinius parma // Expl. Cell Res. 1960. Vol. 20. P. 416–427. Rossman T.G., Goncharova E.I. Spontaneous mutagenesis in mammalian cells is caused mainly by oxidative events and can be blocked by antioxidants and metallothionein // Mutat. Res. Fund. and Mol. Mech. of Mutag. 1998. Vol. 402. № 1–2. P. 103–110. Rousseau E.J., Davison A.J., Dunn B. Protection by beta-carotene and related compounds against oxygen-mediated cytotoxicity and genotoxicity: implications for carcinogenesis and anticarcinogenesis // Free Radic. Biol. Med. 1992. № 13. P. 407. Rozenberg-Arska M., Van Asbeck B.S., Martens T.F., Verhoef J. Damage to chromosomal and plasmid DNA by toxic oxygen species // J. Gen. Microbiol. 1985. Vol. 131. P. 3325–3330. Sagan L., Margulis L. On the origin of mitosing cells // J. Theoret. Biol. 1967. Vol. 1. P. 255–275. Sahnoun Z., Jamoussi K., Zeghal K.M. Free radicals and antioxidants: physiology, human pathology and therapeutic aspects (part II) // Therapie. 1997. Vol. 53. P. 315–339. Salaj-Smic E., Lers N., Trgovcević Z. Overproduction of single-stranded DNA-binding protein increases UV-induced mutagenesis in Escherichia coli // Mutat. Res. 1988. Vol. 208. P. 179–182. Salgo M., Stone K., Squadrito G. et al. Peroxynitrite causes DNA nicks in plasmid pBR322 // Biochem. Biophys. Res. Commun. 1995. Vol. 210. P. 1025–1030. Sancar G.B., Smith F.W. Construction of plasmids which lead to overproduction of yeast PHR1 photolyase in Saccharomyces cerevisiae and Escherichia coli // Gene. 1988. Vol. 64. P. 87–96. Saul R., Archer M. Oxidation of ammoniy and hydroxylamine to nitrate in the rat and in vitro // Carcinogenesis. 1984. Vol. 5. P. 77–81. Schiemann E. Mutations by Aspergillus niger // L. Ind. Abst. 1912. H. 8. S. 1–35. Schreck R., Rieber P., Baeuele P.A. Reactive oxygen intermediates as apparently widely used messengers in the activation of the NF-kappa B transcription factor and HIV-1 // EMBO J. 1991. Vol. 10. P. 2247–2258. Schwartz T., Weichselbaum R. Induction of sister chromatid exchanges by high levels of Burd is suppressed by the protease ingibitor antipain // Environ. Mutagenes. 1984. Vol. 6. № 3. P. 407. Scolastici C., Alves de Lima R.O., Barbisan L.F. et al. Antigenotoxicity and antimutagenicity of lycopene in HepG2 cell line evaluated by the comet assay and micronucleus test // Toxicol. In Vitro. 2008. Vol. 22. P. 510–514. Seaver L.C., Imlay J.A. Alkyl hydroperoxide reductase is the primary scavenger of endogenous hydrogen peroxide in Escherichia coli // J. Bacteriol. 2001. Vol. 183. P. 7173–7181. Sevanian A., Davies K.J., Hochstein P. Conservation of vitamin C by uric acid in blood // Free Radic. Biol. Med. 1985. № 1. P. 117–124. Shaikh A.Y., Xu J., Wu Y. et al. Melatonin protects bovine cerebral endothelial cells from hyperoxia-induced DNA damage and death // Neurosci. Lett. 1997. Vol. 229. P. 193–197. Shewell J., Thompson S.C. The effect of hyperbaric oxygen treatment on pulmonary metastasis in the C3H mouse // Eur. J. Cancer. 1980. Vol. 16. P. 253–259. Shigenaga M., Ames B. Assays for 8-hydroxy-2-deoxyguanosine: A biomarker of in vivo oxidative DNA damage // Free Radic. Biol. Med. 1991. № 10. P. 211–216. Shigenaga M.K., Gimeno C.J., Ames B.N. Urinary 8-hydroxy-2’-deoxyguanosine as a biological marker of in vivo oxidative DNA damage // Proc. Natl. Acad. Sci. USA. 1989. Vol. 86. P. 9697–9701. Shigenaga M.K., Hagen T.M., Ames B.N. Oxidative damage and mitochondrial decay in aging // Proc. Natl. Acad. Sci. USA. 1994. Vol. 91. P. 10771–10778. Shin E.J., Ko K.H., Kim W.K. et al. Role of glutathione peroxidase in the ontogeny of hippocampal oxidative stress and kainate seizure sensitivity in the genetically epilepsy-prone rats // Neurochem. Int. 2008. Vol. 52. P. 1134–1147. 152 Shkurat T.P., Belichenko N.I., Kazantzeva N. The effect of a combined action of radiation and high pressure of oxygen on the testis // 27 Annual meeting of the Eur. Soc. For Radiation Biology, France, 1996. Shkurat T.P., Shimanskay E.I. The mutagen action of air and oxygen under pressure // The III World Congress of the In Society for Adaptive Med. Japan, 1993. Shubutani S., Takeshita M., Grollman A. Insertion of specific bases during DNA synthesis past the oxidation damaged base 8-oxodG // Nature. 1991. Vol. 349. P. 431–434. Siegel S., Halpenn L., Davis G., Giumarro C. The general and comparative biology of experimental atmospheres and other stress conditions. Oxygen toxity in plant and animal forms at one atmosphere or less // Aerospace Med. 1963. Vol. 34. P. 1034–1037. Skosey J.L., Chow D.C., Nusinow S. et al. Effect of oxygen tension on human peripheral blood leukocytes: lysosomal enzyme release and metabolic responses during phagocytosis // J. Cell. Biol. 1981. Vol.88. № 2. P. 358–363. Smalls S., Patterson R. Reduction of benzo(a)pyrene induced chromosomal aberrations by DL-alpha-tocopherol // Biology. 1982. Vol. 28. P. 92–97. Speit G., Dennog C., Lampl L. Biological significance of DNA damage induced by hyperbaric oxygen // Mutagenesis. 1998. Vol. 13. № 1. P. 85–87. Sram R., Kocisova J. Mutagenic activity of diazepam // Activ. Nerv. Super. 1984. Vol. 26. P. 251–253. Stalmer J.S. Redox signaling: nytrosilation and related target interactions of nitric oxide // Cell. 1994. Vol. 79. P. 931–936. Storz G., Tartaglia L.A., Farr S.B., Ames B.N. Bacterial defenses against oxidative stress // Trends. Genet. 1990. Vol. 6. P. 363–368. Stubbe H., Germination J. Allfemeiner teil // Handb.B. Vererb. Wiss. 1938. Vol. 11. P. 429. Sturrock J., Nunn J. Chromosomal damage and mutations after exposure of Chiness hamster cells to high concentrations of oxygen // Mutat. Res. 1978. Vol. 57. P. 27–33. Surani M.A. Silence of the genes // Monthly Nature. 1993. Vol. 1. № 11. P. 40–41. Szabo C., Zingarelli B., O`Connor M., Salzman A. DNA strand breakage, activation of poly (ADP-ribose) synthetase, and cellular energy depletion are involved in the cytotoxicity of macrophages and smooth muscle cells exposed to peroxynitrite // Proc. Natl. Acad. Sci. USA. 1996. Vol. 93. P. 1753–1758. Takahashi H., Kosaka N., Nakagawa S. Alpha-tocopherol protects PC12 cells from hyperoxia-induced apoptosis // J. Neurosci. Res. 1998. Vol. 52. № 2. P. 184–191. Tchou J., Bodepudi V., Shibutani S. et al. Substrate specificity of Fpg protein. Recognition and cleavage of oxidatively damaged DNA // J. Biol. Chem. 1994. Vol. 269. P. 15318–15324. Thacker J., Parker W. The induction of mutation in yeast by hydrogen peroxide // Mutat. Res. 1976. Vol. 38. P. 43–52. Timofeeva I.V., Shkurat T.P. Influence of oxidant stress on nervous tissues of Xenopus laevis // 24 Congree of Yugoslavay Association of anatomicsts, Novi Sad, Yugoslavia, 1996. Tocopherol, oxygen and biomembranes: Proc. Int. Symp. Lake Jamanaco, 1977 / Ed. by G. Duve. Amsterdam. N.Y., 1989. Tomkinson A.E., Bonk R.T., Kim J. Mammalian mitochondrial endonuclease activities specific for ultraviolet-irradiated DNA // Nucleic Acids Res. 1990. Vol. 18. P. 929–935. Triboush S., Danilenko N., Ulitcheva I., Davydenko O. Location of induced Mutations and Reversions in the chloroplast genome of Helianthus annuus L. // Plant. Growth. Regulation. 1999. Vol. 27. Р. 75–81. 153 Troy C., Derossi D., Prochiantz A. et al. Downregulation of Cu/Zn superoxide dismutase leads to cell death via the nitric oxide-peroxynitrite pathway // J. Neurosci. 1996. Vol. 16. P. 253–261. Vaca C.E., Wilhelm J., Harms-Ringdahl M. Interactions of lipid peroxidation products with DNA // Mutat. Res. Rev. Genet. Toxicol. 1988. Vol. 195. P. 137–139. Vangala R.R., Kritzler K., Schoch G., Topp H. Induction of single-strand breaks in lymphocyte DNA of rats exposed to hyperoxia // Archives of toxicology. 1998. Vol. 72. № 4. P. 247–248. VanPoppel G., VandenBerg H. Vitamins and cancer // Cancer Letters. 1997. Vol. 114. № 1–2. P. 195–202. Wallace D., Melov S. Radical raging // Nat. Genet. 1998. Vol. 19. P. 105–106. Waxman A.B., Einarsson O., Seres T. et al. Targeted lung expression of interleukin-11 enhances murine tolerance of 100 % oxygen and diminishes hyperoxia-induced DNA fragmentation // J. Clin. Invest. 1998. Vol. 102. № 3. P. 643. Wei Y.H., Lu C.Y., Pang C.Y, Lee H.C. Roles of mitochondrial DNA mutation and oxidative damage in human aging // Current Science. 1998. Vol. 74. № 10. P. 887–893. Weiss S. Oxygen, ischemia and inflammation // Acta Physiol. Scand. 1986. Vol. 126. Suppl. 548. P. 9–57. Weitberg A.B. Effects of inhibitors of arachidonic acid metabolism and vitamin E on oxygen radical-induced sister chromatid exchanges // Carcinogenesis. 1987. Vol. 8. P. 1619–1620. Wendel A. Measurement of in vivo lipid peroxidation and toxicological significance // Free Radic. Biol. Med. 1987. № 3. P. 355–358. Whittaker P., Wamer W., Calvert R.J. // Trace Elem. Exp. Med. 1992. Vol. 5. № 4. P. 227–236. Winrow V.R., Winyard P.G., Morris C.J., Blake D.R. Free radicals in inflammation: second messengers and mediators of tissue destruction // Br. Med. Bull. 1993. Vol. 49. P. 506–522. Woo H., Kim J., Hong Gil Nam, Pyung Ok Lim. The delayed leaf senescence mutants of arabidopsis, ore1, ore3 and ore9 are tolerant to oxidative Stress // Plant and Cell Physiol. 2004. Vol. 45. P. 923–932. Wood Z.A., Schroder E., Harris J.R., Poole L.B. Structure mechanism and regulation of peroxiredoxnis // Trends Biochem. Sci. 2003. Vol. 28. P. 32–40. Wormhoudt L.W., Commandeur J.N., Vermeulen N.P. Genetic polymorphisms of human N-acetyltransferase, cytochrome P450, glutathione-S-transferase, and epoxide hydrolase enzymes: relevance to xenobiotic metabolism and toxicity // Crit. Rev. Toxicol. 1999. Vol. 29. P. 59–124. Yakes F.M., Van Houten B. Mitochondrial DNA damage is more extensive and persists longer than nuclear DNA damage in human cells following oxidative stress // Proc. Natl. Acad. Sci. USA. 1997. Vol. 94. P. 514–519. Yardim-Akaydin S., Sepici A., Ozkan Y. et al. Oxidation of uric acid in rheumatoid arthritis: is allantoin a marker of oxidative stress? // Free Radic. Res. 2004. Vol. 38. P. 623–628. Yeh L.H., Park Y.I., Hansalia R.J. et al. Shear-induced tyrosine phosphorylation in endothelial cells requires Rac 1dependent production of ROS // Am. J. Physiol. 1999. Vol. 276. P. 838–847. Yoshihara D., Fujiwara N., Ookawara T. et al. Protective role of glutathione S-transferase A4 induced in copper/zinc-superoxide dismutase knockout mice // Free Radic. Biol. Med. 2009. Vol. 47. P. 559–567. Yusa T. Chromosomal and teratogenic effects of oxygen in the mouse // Br. J. Anaesth. 1981.Vol. 53. P. 505–510. Zhou S. and Elledge S.J. The DNA damage response: putting checkpoints in perspective // Nature. 2000. Vol. 408. P. 433–439. Zitnanová I., Korytár P., Aruoma O.I. et al. Uric acid and allantoin levels in Down syndrome: antioxidant and oxidative stress mechanisms? // Clin. Chim. Acta. 2004. Vol. 341. P. 139–146. 154 ОГЛАВЛЕНИЕ ВВЕДЕНИЕ .......................................................................................................................................... 5 Глава 1. КИСЛОРОД И ЕГО АКТИВНЫЕ МЕТАБОЛИТЫ ............................................................. 7 Глава 2. ОКИСЛИТЕЛЬНЫЙ СТРЕСС И ДНК ............................................................................... 14 2.1. Участие свободных радикалов кислорода в регуляции клеточного цикла ................... 17 Глава 3. ГЕНЕТИЧЕСКИЕ ЭФФЕКТЫ ДЕЙСТВИЯ ОКИСЛИТЕЛЬНОГО СТРЕССА НА ГЕНОМ РАСТЕНИЙ ................................................................................................................... 20 3.1. Цитогенетические последствия гипербарической оксигенации в пролиферирующих тканях растений..................................................................................................................... 21 3.2. Влияние ГБО на пролиферативную активность клеток растений. Цитостатический эффект ГБО ........................................................................................................................... 27 3.3. Модификация цитогенетического эффекта ГБО .......................................................... 30 3.4. Влияние ГБО на мутагенный эффект нитрозометилмочевины ................................... 31 3.5. Окислительный стресс и устойчивость растений к внешним экстремальным воздействиям ......................................................................................................................... 38 Глава 4. ГЕНЕТИЧЕСКИЕ ПОСЛЕДСТВИЯ ГИПЕРБАРИИ И ГИПЕРБАРИЧЕСКОЙ ОКСИГЕНАЦИИ .............................................................................................................................. 48 4.1. Цитогенетические последствия ГБО в соматических и генеративных тканях животных при моделировании терапевтических режимов ГБО ......................................... 48 4.2. О возможных механизмах цитогенетического эффекта ГБО на организм животных........55 4.3. Действие ГБО на клетки периферической крови человека .......................................... 57 4.3.1. Цитогенетические последствия ГБО-терапии ...................................................... 57 4.3.2. Индивидуальная чувствительность к действию ГБО периферической крови интактных доноров ......................................................................................................... 59 4.4. Влияние гипербарии на геном человека ........................................................................ 61 4.5. Сравнительная чувствительность генеративной и соматической тканей к действию мутагенов ............................................................................................................................... 62 Глава 5. МОДИФИКАЦИЯ ГЕНЕТИЧЕСКИХ ПОСЛЕДСТВИЙ ОКИСЛИТЕЛЬНОГО СТРЕССА НИЗКОМОЛЕКУЛЯРНЫМИ АНТИОКСИДАНТАМИ ............................................... 67 5.1. Механизмы защиты от токсического действия кислорода и его активных форм........ 68 5.2. Антимутагенные эффекты антиоксидантов .................................................................. 83 Глава 6. СВОБОДНОРАДИКАЛЬНЫЕ И МУТАЦИОННЫЕ ПРОЦЕССЫ У ЖИВОТНЫХ ПРЕАДАПТИРОВАННЫХ К ОКИСЛИТЕЛЬНОМУ СТРЕССУ ........................... 92 6.1. Генетико-биохимические особенности реакции тканей взрослых особей амфибий на окислительный стресс после предварительной их обработки ГБО на ранних стадиях развития ................................................................................................................................. 92 6.2. Мутационные процессы у млекопитающих, преадаптированных к окислительному стрессу ................................................................................................... 102 Глава 7. ИСТОРИЯ ИЗУЧЕНИЯ ГЕНЕТИКИ ОКИСЛИТЕЛЬНОГО СТРЕССА ....................... 108 7.1. Исторические модели кислородного мутагенеза ....................................................... 108 7.2. ГБО-мутагенез и концепция протекторного катаболизма ......................................... 113 7.3 . Избыточность как общее свойство биологических систем ........................................ 114 7.4. Окислительный стресс и аутоантиоксиданты ............................................................. 117 7.5. Механизмы alarm-мутагенеза при окислительном стрессе ........................................ 118 3.6. Окислительный мутагенез и протекторный метаболизм ............................................ 119 7.7. Аутодеструкция клеток и протекторный катаболизм.................................................. 121 ЗАКЛЮЧЕНИЕ................................................................................................................................ 124 ЛИТЕРАТУРА ................................................................................................................................... 130 155 Научное издание ГЕНЕТИКА ОКИСЛИТЕЛЬНОГО ПРОЦЕССА Редактор Ю.А. Пехтерева Компьютерная верстка К.И. Ильченко Сдано в набор 13.03.2009. Подписано в печать 28.04.2009. Формат 60×84 1/16. Бумага офсетная. Печать офсетная. Усл.печ. л. 19,5. Уч.-изд. л. 9,17. Тираж 1100 экз. Издательство Северо-Кавказского научного центра высшей школы ЮФУ. 344006, г. Ростов-на-Дону, ул. Пушкинская, 140. Тел. 264–30–52.