Анализ вещества
advertisement
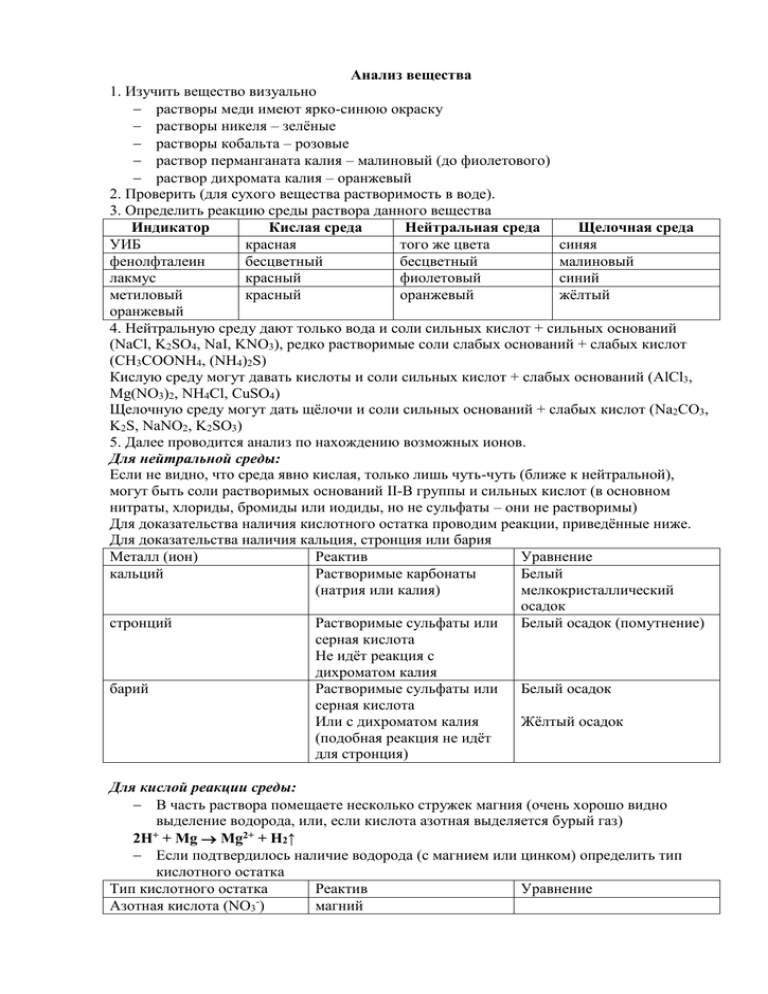
Анализ вещества 1. Изучить вещество визуально растворы меди имеют ярко-синюю окраску растворы никеля – зелёные растворы кобальта – розовые раствор перманганата калия – малиновый (до фиолетового) раствор дихромата калия – оранжевый 2. Проверить (для сухого вещества растворимость в воде). 3. Определить реакцию среды раствора данного вещества Индикатор Кислая среда Нейтральная среда Щелочная среда УИБ красная того же цвета синяя фенолфталеин бесцветный бесцветный малиновый лакмус красный фиолетовый синий метиловый красный оранжевый жёлтый оранжевый 4. Нейтральную среду дают только вода и соли сильных кислот + сильных оснований (NaCl, K2SO4, NaI, KNO3), редко растворимые соли слабых оснований + слабых кислот (CH3COONH4, (NH4)2S) Кислую среду могут давать кислоты и соли сильных кислот + слабых оснований (AlCl3, Mg(NO3)2, NH4Cl, CuSO4) Щелочную среду могут дать щёлочи и соли сильных оснований + слабых кислот (Na2CO3, K2S, NaNO2, K2SO3) 5. Далее проводится анализ по нахождению возможных ионов. Для нейтральной среды: Если не видно, что среда явно кислая, только лишь чуть-чуть (ближе к нейтральной), могут быть соли растворимых оснований II-В группы и сильных кислот (в основном нитраты, хлориды, бромиды или иодиды, но не сульфаты – они не растворимы) Для доказательства наличия кислотного остатка проводим реакции, приведённые ниже. Для доказательства наличия кальция, стронция или бария Металл (ион) Реактив Уравнение кальций Растворимые карбонаты Белый (натрия или калия) мелкокристаллический осадок стронций Растворимые сульфаты или Белый осадок (помутнение) серная кислота Не идёт реакция с дихроматом калия барий Растворимые сульфаты или Белый осадок серная кислота Или с дихроматом калия Жёлтый осадок (подобная реакция не идёт для стронция) Для кислой реакции среды: В часть раствора помещаете несколько стружек магния (очень хорошо видно выделение водорода, или, если кислота азотная выделяется бурый газ) + 2H + Mg Mg2+ + H2↑ Если подтвердилось наличие водорода (с магнием или цинком) определить тип кислотного остатка Тип кислотного остатка Реактив Уравнение Азотная кислота (NO3-) магний Серная кислота Растворимая соль бария Белый (нитрат или хлорид), мелкокристаллический гидроксид бария осадок Соляная кислота нитрат серебра Белый осадок Бромоводородная кислота нитрат серебра Светло-жёлтый осадок Йодоводородная кислота нитрат серебра Жёлтый осадок Ортофосфорная кислота нитрат серебра Шоколадный осадок Фтороводородная кислота Растворяет стекло (выдают в пластиковой посуде) – ни у кого нет. Уксусная кислота Специфический запах Сероводородная кислота Специфический запах тухлых яиц Если наличие водорода не подтвердилось проводим реакции на кислотный остаток (для остатка азотной кислоты приведена отдельная схема), а затем ищем катион (металл – слабого основания) Остаток азотной кислоты дифениламин Синее окрашивание раствора магний магнезон с гидроксидом натрия или калия алюминий хром Алюминон С растворимым гидроксидом натрия или калия Пероксид водорода в щёлочи железо (III) Роданид калия или аммония железо (II) Диметилглиоксим никель Диметилглиоксим в щелочной среде Отличить от железа можно концентрированным аммиаком кобальт марганец -нитрозо--нафтол Висмутат натрия цинк серебро дитизон Соли галогенов (хлорид, бромид или йодид) Синее окрашивание раствора Выпадает белый студенистый осадок, который при дальнейшем разбавлении не растворяется Красное окрашивание раствора Образуется творожистый осадок, который в дальнейшем растворяется Раствор окрашивается в яркий жёлто-оранжевый цвет Кроваво-красная окраска раствора Розово-красное окрашивание раствора Розово-красное окрашивание раствора Осаждение соли синезелёного цвета с дальнейшим её растворением Тёмно-красный осадок Малиновое окрашивание перманганата калия Ярко-красное окрашивание Мелкокристаллический осадок (белого, светложёлтого или жёлтого цвета) медь соответственно Концентрированный аммиак Осадок светло-голубого цвета с дальнейшим её растворением до тёмносинего раствора Для щелочной среды Доказать наличие OH- ионов можно с помощью сульфата (хлорида, нитрата) меди (оседает светло-голубой студенистый гидроксид меди (II)) Доказать наличие натрия или калия в условиях школы проводить очень сложно (будет осадок с гидротартратом калия) – её просто не проводят Доказать наличие остатка слабой кислоты можно по схемам, приведённым ниже: Сернистая кислота (SO32-) Несколько капель соляной Выделяется слабый запах кислоты SO2, запах пиротехники Азотистая кислота (NO2 ) Слабокислый раствор Обесцвечивание раствора перманганата калия Сероводород. кислота (S2-) Несколько капель соляной Специфический запах кислоты выделяющейся сероводородной кислоты – тухлых яиц Ортофосфорная кислота Нитрат серебра Шоколадный осадок (PO43-) Угольная кислота (CO32-) Несколько капель соляной Обильное выделение кислоты бесцветного газа без запаха 2 Кремниевая кислота (SiO3 ) Несколько капель соляной Студенистый осадок кислоты кремниевой кислоты Фтороводородная кислота (F-) Уксус. кислота (CH3COO-) Несколько капель соляной Специфический запах кислоты выделяющейся уксусной кислоты Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета. Практически все неметаллы имеют свой цвет: фтор – оранжево-желтый, хлор – зеленовато-желтый, бром – кирпично-красный, йод – фиолетовый, сера – желтая, фосфор может быть белым, красным и черным, а жидкий кислород – голубой. Все основные оксиды – твердые вещества, чаще нерастворимые в воде, окрашенные в различные цвета, например Cu2O –красного цвета, MgO – белого. белые это как правило: К,Ca,Na,Ba,Mg,Al Кислотные оксиды могут быть твердыми, жидкими и газообразными: Р2О5 – твердый, SiO2 – твердый, СО2 – газообразный, SO3 – жидкий. К воде относятся по-разному (Р2О5 – растворимый, SiO2 – нерастворимый). Поскольку это оксиды металлов, то они, как и основные оксиды, твердые вещества, мало или нерастворимые в воде. (Al2O3 – нерастворим в Н2О). Некоторые из них имеют характерную окраску (Fe2О3 – бурый).