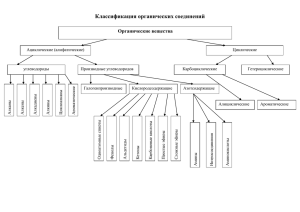
органическая химия. задачи и упражнения часть i. углеводороды
advertisement

Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Томский государственный архитектурно-строительный университет» Н.В. Субботина, О.А. Зубкова, Д.А. Коноплянский ОРГАНИЧЕСКАЯ ХИМИЯ. ЗАДАЧИ И УПРАЖНЕНИЯ ЧАСТЬ I. УГЛЕВОДОРОДЫ Учебное пособие Под редакцией Н.В. Субботиной Томск Издательство ТГАСУ 2011 УДК 547(075.8) ББК 24.2я7 С89 Субботина, Н.В. Органическая химия. Задачи и упражнения. Часть I. Углеводороды [Текст] : учебное пособие / Н.В. Субботина, О.А. Зубкова, Д.А. Коноплянский ; под ред. Н.В. Субботиной. – Томск : Изд-во Том. гос. архит.-строит. ун-та, 2011. – 104 с. ISBN 978-5-93057-440-1 Учебное пособие содержит теоретический материал по теме «Углеводороды», примеры решения задач и задачи для самостоятельного решения. Учебное пособие предназначено для изучения и выполнения контрольных заданий студентами заочной и очной формы обучения по следующим направлениям: 270800 «Строительство» профиль 27080004 «Производство строительных материалов, изделий и конструкций»; 280700 «Техносферная безопасность» и 250400 «Технология лесозаготовительных и деревоперерабатывающих производств». УДК 547(075.8) ББК 24.2я7 Рецензенты: к.б.н., доцент Т.М. Южакова, ТГАСУ; д.х.н., проф. В.Я. Денисов, КемГУ. ISBN 978-5-93057-440-1 2 © Томский государственный архитектурно-строительный университет, 2011 © Н.В. Субботина, О.А. Зубкова, Д.А. Коноплянский, 2011 ВВЕДЕНИЕ Основным элементом, входящим в состав органических соединений, является углерод, который может соединяться почти со всеми химическими элементами с образованием молекул цепной и циклической структуры самых различных размеров. Многие считают органическую химию химией соединений углерода. Однако не все соединения углерода относятся к органическим, например, оксиды углерода (СО, СО2), угольная кислота Н2СО3, ее соли – карбонаты и гидрокарбонаты, карбиды металлов и некоторые другие соединения являются неорганическими веществами. Качественной особенностью предмета органической химии является изучение не самого углерода, а углеводородов и их производных. Поэтому более точным является следующее определение: органическая химия – это химия углеводородов и их производных. Выделение органической химии в самостоятельный раздел химической науки вызвано многими причинами. Основная причина связана с многочисленностью и многообразием органических соединений. В настоящее время неорганических веществ насчитывается порядка 600 тыс., органических веществ известно около 10 млн, многие из них не существуют в природе, а получены в лаборатории (синтетическим путем). Причинами многообразия органических веществ являются: 1. Способность атомов углерода соединяться друг с другом и другими элементами периодической системы Д.И. Менделеева. При этом образуются цепи и замкнутые циклы. 2. Атом углерода может находиться в трех разных гибридных состояниях: sp, sp2, sp3. 3. Существование веществ с близкими свойствами, где каждый член гомологического ряда отличается от предыдущего на группу – СН2 – , которые являются гомологами. 3 4. Имеются существенные отличия в свойствах и реакционной способности органических соединений, что связано с таким явлением, как изомерия (см. подразд. 1.1.1). Законы химии управляют поведением как неорганических, так и органических веществ. Однако органические соединения имеют ряд отличительных особенностей. Так, например, большинство неорганических соединений – тугоплавкие вещества, а для органических соединений характерно состояние газов, жидкостей и низкоплавких твердых тел. Большинство химических реакций с участием органических соединений протекает гораздо медленнее, чем ионные реакции, характерные для неорганических веществ. Все эти отличительные особенности можно объяснить различием в характере химической связи. В наши дни органическая химия незаменима во многих отраслях, в том числе и в строительстве. В строительной индустрии необходимы пластмассы, полимерцементы и полимербетоны, клеи и герметики, кремнийорганические соединения, поверхностно-активные вещества и др. Многие органические вещества находят разностороннее практическое применение (полимерные материалы, лекарственные препараты, многочисленные органические красители и т. д.). Современная органическая химия, стремительно развиваясь и накапливая огромный фактический материал, тесно соприкасается с биологией, физикой, математикой и т. д. Со временем произошло выделение в самостоятельные области многих разделов органической химии. Так появилась химия полимеров, гетероциклических соединений, углеводов, угля и нефти. 4 1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ 1.1. Теория химического строения А.М. Бутлерова Теоретическим фундаментом органической химии является теория химического строения, разработанная выдающимся русским химиком А.М. Бутлеровым в 60-х годах ХIХ века. Основные положения теории строения органических соединений: 1. Атомы, входящие в состав молекул органического вещества, не находятся в беспорядочном состоянии, а соединены между собой в определенной последовательности химическими связями (согласно валентности этих атомов). Последовательность соединения атомов в молекуле А.М. Бутлеров назвал химическим строением. 2. Строение молекулы можно выразить при помощи структурной формулы, которая для данного вещества является единственной. 3. От строения молекул, т. е. от того, в каком порядке соединены между собой атомы в молекуле, зависят свойства вещества. 4. Зная свойства вещества, можно установить его строение, и наоборот, зная химическое строение органического соединения, можно много сказать о его свойствах. 5. Химические свойства атомов и атомных группировок не являются постоянными, а зависят от других атомов (атомных группировок), находящихся в молекуле. При этом наиболее сильное влияние атомов наблюдается в случае, если они связаны друг с другом непосредственно. Значение теории химического строения А.М. Бутлерова исключительно велико. Благодаря этой теории стало возможным предсказать основные свойства органических соединений, предвидеть пути их целенаправленного синтеза. 5 Главная идея этой теории заключается в том, что физические и химические свойства органических соединений определяются порядком соединения атомов в молекулах и их взаимным влиянием друг на друга, а также химическим, пространственным и электронным строением. Порядок соединения атомов в молекуле называется геометрическим строением, или структурой молекулы. Для выражения строения молекул используются структурные формулы. Обозначив связь между углеродом и водородом «–», структурная формула пропана будет выглядеть следующим образом: H H H H C C C CH3 H CH2 CH3 H H H развернутая структурная формула компактная структурная формула При изображении циклических соединений начертания символов углерода и водорода часто вообще опускают, а их присутствие при этом подразумевается, например, циклобутан можно изобразить следующим образом: H2C CH2 H2C CH2 или Нельзя забывать, что любая, даже очень удачная структурная формула, – всего лишь абстрактный образ молекулы. Она не является точным отображением реальной структуры и выражением свойств органической молекулы. Соединяясь друг с другом, атомы углерода образуют углерод-углеродные цепи, или углеродный скелет молекулы. В образующихся цепях атом углерода может быть связан либо с одним соседним атомом углерода, либо с двумя, тремя или четырьмя. 6 Соответственно различают первичные, вторичные, третичные и четвертичные атомы углерода. 1 CH3 CH3 CH3 2 3 CH C 4 CH2 1, 5 – первичные 4 – вторичный 2 – третичный 3 – четвертичный 5 CH3 CH3 Огромной заслугой А.М. Бутлерова является также то, что он первым объяснил явление изомерии. 1.1.1. Изомерия. Виды изомерии Изомерия – это явление существования веществ, имеющих одинаковый качественный и количественный состав, но различное строение. Эти вещества называются изомерами. Например, существуют два вещества, состав которых выражается одной и той же молекулярной формулой С4Н10. В одном из этих веществ атомы углерода образуют прямую (неразветвленную) цепь и называют их нормальными (сокращенно обозначая буквой н-): CH3 CH2 CH2 CH3 н-бутан Во втором веществе существует разветвленная цепь атомов углерода и называют такие соединения – изосоединения (обозначая приставкой изо-) : CH3 CH CH3 CH3 изобутан И н-бутан, и изобутан при обычных условиях являются газами; однако если н-бутан сжижается около 0 °С, то изобутан – при температуре –12 °С, т. е. изомеры имеют разные свойства, 7 что является подтверждением главного положения теории химического строения: свойства вещества зависят от его строения. Когда изомеры относятся к одному классу органических веществ, как в данном случае, то различия в их химических свойствах не очень существенны. Однако существуют изомеры, относящиеся к разным классам веществ, где уже различия в свойствах будут существенными. Примером таких изомеров являются этанол СН3 – СН2 – ОН, относящийся к классу спиртов, и диметиловый эфир СН3 – О – СН3, относящийся к классу простых эфиров. Эти два изомера имеют состав С2Н6О и молекулярную массу 46,07 у. е. Этанол – при обычных условиях жидкость (Ткип = +78 °С), смешивается с водой в любых соотношениях. Диметиловый эфир – газ (Ткип = –25 °С), практически нерастворимый в воде и сильно отличающийся от этанола по химическим свойствам. Существует достаточно много видов изомерии, но все их можно отнести к двум типам: структурная изомерия – явление существования изомеров, отличающихся химическим строением, т. е. порядком соединения атомов в молекулах; пространственная изомерия – явление существования изомеров, имеющих одинаковое химическое строение, но различную пространственную конфигурацию молекул, т. е. различающихся расположением атомов и атомных групп в пространстве. Структурная изомерия К структурной изомерии относятся: 1) Изомерия углерод-углеродной цепи (углеродного скелета), обусловленная различным порядком связи атомов углерода. С ростом числа атомов углерода в молекуле число изомеров цепи увеличивается. Если у бутана (С4Н10) два изомера, то у гексана (С6Н14) уже пять изомеров: CH3 8 CH2 CH2 CH2 CH2 CH3 н-гексан CH3 CH CH2 CH2 CH3 2-метилпентан CH CH2 CH3 3-метилпентан CH3 CH3 CH2 CH3 CH3 2,3-диметилбутан CH CH CH3 CH3 CH3 CH3 CH3 C CH2 CH3 2,2-диметилбутан CH3 Изомерия цепи возможна и для циклических соединений. Например, изомерами являются: H2C CH2 H2C CH2 H2C и H2C циклобутан CH CH3 метилциклопропан 2) Изомерия положения обусловлена различным положением: а) функциональных групп; б) кратных связей; в) заместителей в кольце. Например: а) CH3 CH2 CH2 Br и CH3 CH CH3 Br 1-бромпропан 2-бромпропан 9 б) CH2 CH CH2 CH3 CH3 и бутен-1 CH CH CH3 бутен-2 в) CH3 CH3 CH3 CH3 CH3 CH3 орто-диметилбензол мета-диметилбензол пара-диметилбензол 3) Межклассовая изомерия – изомерия веществ, принадлежащих к разным классам органических веществ (пример этилового спирта и изомерного ему диэтилового эфира приведен выше). 4) Метамерия – это вид структурной изомерии, обусловленной различным положением гетероатома в углеродной цепи. Например, метамерами являются: CH3CH2 O CH2CH3; диэтиловый эфир CH3 O CH2 CH2CH3 метилпропиловый эфир Пространственная изомерия Одним из видов пространственной изометрии является геометрическая изомерия, или цис-, транс-изомерия. Цис, транс – изомерия возможна для соединений, содержащих двойную связь между двумя атомами углерода (– С = С –). Если атомы или группы атомов, связанные с этими атомами углерода, неодинаковы, то из-за отсутствия свободного вращения вокруг двойной связи возможно их различное расположение относительно плоскости π-связи. Например, в молекуле бутена-2 (СН3 – СН = СН – СН3) с каждым sp2-гибридизованным атомом углерода связан один 10 атом водорода и одна группа СН3. Их пространственное расположение может быть следующим: H3C H C C CH3 H цис-изомер (цис-бутен-2) и H3C H C C H CH3 транс-изомер (транс-бутен-2) Как и структурные изомеры, геометрические изомеры различаются по своим свойствам. Например, температура кипения цис-бутена-2 равна +3,7 °С, а транс-бутена-2 – +0,9 °С. Переход цис- и транс-изомеров друг в друга возможен только при условии поворота вокруг двойной связи, для чего необходимо разорвать π-связь и затратить 263 кДж/моль. Поэтому цис- и транс-изомеры самопроизвольно друг в друга не превращаются. Другим видом пространственной изомерии является оптическая (зеркальная) или стереоизомерия. Стереоизомерия связана с различным расположением в пространстве атомов и атомных групп вокруг асимметрического углеродного атома. Асимметрический атом углерода – это углерод, все четыре валентности которого замещены различными заместителями и который является энантиомером. Энантиомеры – это стереоизомеры, относящиеся к друг другу как предмет и его зеркальное отражение, различные по абсолютной и относительной конфигурации, биологическим свойствам, но обладающие одинаковыми физическими и химическими свойствами. Например: COOH COOH * H C OH CH3 D- (–) -молочная кислота * OH C H CH3 L- (+) -молочная кислота 11 Если в органической молекуле содержится не один асимметрический атом углерода, а несколько, то, наряду с существованием энантиомеров, появляются уже и диастереомеры. Диастереомеры – это стереоизомеры, не являющиеся зеркальным отражением один другого и имеющие различные физические, химические и биологические свойства. Так, диастереомерами являются D-глюкоза и D-манноза. 1.1.2. Состояние валентных электронов в атоме углерода. Гибридизация При изучении органической химии особый интерес представляет электронное строение атома углерода, т. к. с ним связаны его свойства, определяющие во многом различия между органическими и неорганическими веществами. Углерод – первый элемент IV группы периодической системы элементов. Из курса общей химии известно, что электронная структура невозбужденного атома углерода может быть выражена формулой 1s22s22p2, т. е. во втором (внешнем) электронном слое у него два спаренных (с противоположными спинами) s-электрона и только два неспаренных p-электрона, которые могут участвовать в образовании ковалентных связей. Следовательно, углерод должен был бы проявлять валентность, равную двум, однако надо учитывать, что атом углерода в момент химической реакции «возбуждается», т. е. переходит из основного состояния в возбужденное (С∗ ). При этом происходит распаривание 2s-электронов и переход одного их них на 2p-орбиталь. В результате такого перехода образуются четыре неспаренных электрона (один 2s и три 2p). Это возможно потому, что состояние 2s и 2p очень близки в энергетическом отношении. Затраченная при этом энергия (676,2 кДж/моль) затем с избытком компенсируется при образовании четырех связей. 12 С ∗ С 2s ↑ 2p ↑ ↑ 2s ↑↓ ↑ 2p ↑ ↑ При образовании химических связей у атома углерода происходит гибридизация. Гибридизация – это смешение валентных электронных орбиталей, приводящее к образованию качественно новых, равноценных гибридных орбиталей с одинаковой формой и энергией, отличающихся только ориентацией в пространстве. В зависимости от вида гибридизации атомы углерода могут находиться в трех валентных состояниях: sp3-гибридизация. При этом виде гибридизации происходит смешение одной 2s- и трех 2p-орбиталей. В результате образуются четыре одинаковые гибридные орбитали, расположенные в пространстве относительно друг друга под углом 109°28′ в виде тетраэдра (рис. 1). Рис. 1. Схема образования четырех sp3-гибридных атомных орбиталей Состояние углеродного атома с sp3-гибридными орбиталями называют первым валентным состоянием, которое характерно для предельных углеводородов. 13 sp2-гибридизация. Эта гибридизация – результат смешения одной 2s- и двух 2p-орбиталей. При этом образуются три гибридные орбитали, расположенные в одной плоскости под углом 120 °С друг к другу (плоскость равностороннего треугольника). Третья 2p-орбиталь, не принимающая участия в гибридизации, сохраняет свою прежнюю форму и располагается в плоскости, перпендикулярной плоскости гибридных связей (рис. 2). Рис. 2. Схема образования π-связи за счет перекрывания двух 2p-негибридизованных орбиталей Такое состояние атома углерода называется вторым валентным состоянием. Этот тип гибридизации характерен для углерода, когда при комбинации одной гибридной и одной негибридизованной орбитали образуется двойная связь (непредельные углеводороды ряда этилена). sp-гибридизация. При смешении одной 2s- и одной 2pорбитали образуются две гибридные орбитали, расположенные на одной прямой линии. Остальные 2p-орбитали, не участвующие в гибридизации, расположены во взаимно перпендикулярных плоскостях (рис. 3). В результате чего при формировании тройной кратной связи – С ≡ С – участвует одна гибридная и две негибридизованные орбитали каждого атома углерода. Этот тип 14 гибридизации характерен для ацетиленовых углеводородов с тройными связями. Рис. 3. Схема образования тройной связи в молекуле ацетилена Следует отметить, что атомы углерода способны образовывать двойные и тройные связи не только друг с другом, но и с атомами других элементов, например, кислородом и азотом (С = О, С ≡ N). 1.1.3. Характер химических связей в органических соединениях В состав большинства органических соединений входит всего лишь несколько основных элементов: углерод, водород, кислород, азот, сера и значительно реже другие элементы. Таким образом, все многообразие органических соединений определяется, с одной стороны, их качественным и количественным составом, а с другой – порядком и характером связей между атомами. Основные химические особенности атома определяются свойствами электронов и их распределением вокруг ядра, следо15 вательно, теория химической связи должна быть, прежде всего, электронной теорией. Обобщенную характеристику элемента, связанную не с электронами на отдельных орбиталях, а с внешними электронами вообще, представляет собой электроотрицательность. Электроотрицательность – это способность атома притягивать к себе электроны. Значения электроотрицательности не имеют значимости констант, а показывают лишь относительную способность атомов притягивать электроны сильнее или слабее при образовании связи с другими атомами. В органических соединениях встречается 4 вида химической связи: ионная связь, ковалентная связь, водородная связь и донорно-акцепторная связь. Ионная связь возникает между атомами, которые сильно отличаются по электроотрицательности. Процесс образования связи состоит в передаче электрона от одного атома к другому. Образовавшаяся при этом электронная пара затем смещается к одному из соединяющихся атомов, в результате чего образуются два противоположно заряженных иона, которые связываются силами электростатического взаимодействия. Схематично этот процесс можно представить следующим образом: ii Na i+ iCl :→ Na + + Cl− ii Ковалентная связь. При взаимодействии атомов равных (атомы одного и того же элемента) или близких по электроотрицательности элементов переноса электронов не происходит. В этом случае связь между такими атомами образуется за счет обобществления неспаренных электронов (двух, четырех или шести), принадлежащих обоим атомам до образования химической связи. Каждая из обобщенных пар электронов образует одну ковалентную связь: ii ii ii ii ii ii ii ii : Cli+ iCl :→: Cl : Cl Cl – Cl (одна общая пара) 16 Молекула с ковалентной связью может быть неполярной, если связанные этой связью атомы имеют одинаковые электроотрицательности, например, в случае образования молекулы хлора, представленной выше. И может быть полярной, когда электронная пара вследствие большего сродства к электрону одного из атомов оттянута в его сторону, например: δ− CH 3 → Cl или СH δ+ 3 − Cl . При таком способе обозначения символы δ+ и δ– (частичные заряды) означают, что на атоме со значком δ– избыточная электронная плотность, а на атоме со значком δ+ она несколько понижена. Ковалентная связь может быть простой (одинарной) и кратной (двойной или тройной). Если связь между атомами осуществляется одной парой электронов, максимальная плотность которых расположена на линии, соединяющей центры этих атомов, то такая связь называется простой (одинарной) или σ-связью. Если в образовании ковалентной углерод-углеродной связи принимают участие две или более электронных пар, то такую химическую связь называют кратной. Она может быть двойной (в случае участия двух пар электронов) и тройной (с участием трех пар электронов). Образование связи возможно и способом, при котором атомы поставляют неодинаковое число электронов или когда в образовании связи участвуют электроны только одного из атомов, а другой, наоборот, готов их принять (имеет свободную орбиталь). В этом случае происходит также обобществление электронов, но не в равных частях, а путем передачи пары электронов одним из атомов в общее пользование, другой атом предоставляет свою свободную орбиталь, способную принять эти электроны, например, как при получении иона аммония: Н3N: + H+ → [NH4]+. 17 Атом, который обладает неподеленной парой электронов и предоставляет их для образования новой химической связи (в примере – атом азота в молекуле аммиака), называют донором, а атом, который принимает их (в примере ион водорода), называют акцептором. Поэтому такую связь часто называют донорно-акцепторной связью. Водородная связь образуется между молекулами, содержащими электроотрицательные атомы (O, N, F, реже Cl, Br, S), которые имеют неподеленную электронную пару, и молекулами с активными атомами водорода. Активными являются атомы водорода, связанные с другим атомом сильно полярной ковалентной связью (Н → О – ; Н → S – и т. д.). В этом случае водород обладает высокой протонной подвижностью, в результате чего возникает связь особого типа (Н-связь). Водородная связь объясняет особое поведение некоторых гидроксилсодержащих соединений (спиртов, кислот и т. д.), для которых характерны более высокие температуры кипения и плавления и наблюдается изменение растворимости и электрической проводимости и т. д. 1.1.4. Взаимное влияние атомов в молекулах органических соединений Еще одним важным положением теории химического строения является утверждение о том, что атомы и группы атомов, входящие в молекулу, оказывают взаимное влияние на химическое поведение друг друга. Смещение электронной плотности по цепи σ-связей называется индуктивным эффектом и обозначается буквой I. Атомы или группы атомов, электроотрицательность которых больше электроотрицательности атома углерода, в связях с ним оттягивают на себя электронную плотность и обладают отрицательным индуктивным эффектом –I (электроноакцепторы). К ним относятся: –F, –Cl, –Br, –I, –OH, –NH2, –CN, –NO2, –O– и др. 18 Атомы и группы атомов с меньшей электроотрицательностью отталкивают от себя электронную плотность в связях с углеродом и обладают положительным индуктивным эффектом +I (электронодоноры). К ним относятся: –СН3; –СН2–СН3; –СН(СН3)2; –С(СН3)3 и др. Рассматривая индуктивный эффект, необходимо отметить, что атомы углерода, находящиеся в различных гибридных состояниях, имеют разную электроотрицательность: Тип гибридизации Электроотрицательность С (sp) 3,2 С (sp2) 2,8 С (sp3) 2,5 При существовании кратной связи в молекуле индуктивный эффект увеличивается. Поэтому, например, в молекуле пропена СН3 – СН = СН2 группа СН3 проявляет положительный индуктивный эффект (+I). При передаче индуктивного эффекта этой группы на двойную связь, в первую очередь, ее влияние испытывают электроны подвижной π-связи (смещение ее электронной плотности обозначают изогнутой стрелкой): δ+ δ′+ δ′′– Н3С → СН = СН2 (sp3) (sp2) В молекулах с сопряженными двойными связями, содержащих электронодонорные или электроноакцепторные заместители, под влиянием последних происходит смещение π-электронного облака вдоль системы. В результате этого на противоположных концах такой системы появляются противоположные по знаку, но равные по величине частичные заряды. Такой тип электронного влияния называется эффектом сопряжения или мезомерным эффектом и обозначается буквой М. Примером влияния эффекта сопряжения на направление реакции может служить реакция ненасыщенного альдегида (акролеина) с бромистым водородом. Так как этот альдегид имеет систему двух 19 сопряженных двойных связей (этиленовая и карбонильная), потому к их концам и происходит присоединение бромоводорода (за счет перераспределения электронной плотности): СН2 = СН − С = О + Н – Br → [СН2Br – СН = СН –ОН] → Н неустойчивое соединение Н → СН2Br – СН2 – С = О Как и в случае индуктивного эффекта, мезомерный эффект бывает положительный (+М), который проявляют группы, смещающие π-электронную плотность в сторону системы, и отрицательный (–М), который проявляют группы, смещающие πэлектронную плотность в свою сторону. 1.2. Классификация реакций в органической химии Химические реакции можно охарактеризовать как процессы, при которых происходит перераспределение электронов внешних оболочек. Направление реакции существенно зависит от распределения электронов в реагирующих молекулах. Совокупность факторов, управляющих распределением электронной плотности и возможностью образования новой, более стабильной системы, в конечном счете обусловливает протекание химической реакции. Органические реакции подчиняются в принципе тем же законам, что и реакции неорганических веществ, но имеют специфические особенности. Например, в отличие от большинства неорганических реакций, в органических чаще всего принимают участие молекулы, а не ионы. Органические реакции можно разделить на четыре основных типа: 20 1. Реакции замещения – реакции, в результате которых осуществляется замена одного атома или группы атомов в исходной молекуле на другие атомы или группы атомов. 2. Реакции присоединения – реакции, в результате которых две или более молекул реагирующих веществ соединяются в одну. 3. Реакции отщепления – реакции, в результате которых из молекулы исходного соединения образуются молекулы нескольких новых веществ. 4. Реакции изомеризации – реакции, в результате которых из молекул одного вещества образуются молекулы других веществ того же качественного и количественного состава, т. е. с той же молекулярной формулой. В органической реакции различают: субстрат, реагент и продукты реакции. Из двух реагирующих веществ реагентом считают более простое вещество; основное органическое соединение, участвующее в реакции, называют субстратом. Механизм органической реакции зависит от характера реагента (а не субстрата), т. к. распределение электронной плотности в реагирующей молекуле часто определяет тип реагента, с которым основное органическое вещество (субстрат) будет реагировать. Так, в бромистом этиле углеродный атом, связанный с атомом брома и имеющий низкую электронную плотность, будет легко подвергаться атаке частицами, несущими отрицательный заряд ( CN − , OH − ), или молекулами, в которых имеются центры с высокой электронной плотностью (например, :NR3): δ+ δ− CH 3 − CH 2 → Br + OH − → CH 3 − CH 2 − OH + Br − . субстрат нуклеофил В этом случае реагент называют нуклеофильным реагентом или нуклеофилом, а реакция называется нуклеофильной реакцией. Напротив, реагент с электронным дефицитом (чистый катион – H + , NO 2− или молекула, имеющая центр с низкой электрон21 ной плотностью – SO3 и BF3) будет реагировать с субстратом, в котором имеются центры с высокой электронной плотностью. Реагент такого типа называется электрофильным реагентом, или электрофилом, а реакция называется электрофильной. Наиболее часто используются нуклеофилы: OH − , OR − , RS− , RCOO− , Hal− , CN − – N:, О:, RMgX, LiAlH4. Электрофилы: Н+, Н3О+, HNO3 (фактически NO2), H2SO4 (SO3), HNO2 (NO), R3C, RC = O, AlCl3, ZnCl2. И электрофильные, и нуклеофильные реакции называются гетеролитическими реакциями. Гетеролитические процессы еще называют ионными, т. к. в ходе реакции молекула субстрата под действием реагента способна разрываться с образованием ионов. Также существуют реакции, в которых реагент является радикальной частицей, несущей неспаренный электрон. Такие реакции называются радикальными или гомолитическими реакциями. Реакции этого типа из-за очень высокой реакционной способности радикалов мало чувствительны к распределению электронной плотности в субстрате. По радикальному механизму могут протекать реакции замещения (SR), присоединения (AdR) или отщепления (ЕR). Например, по механизму радикального замещения протекает реакция хлорирования алканов. 1.3. Классификация органических соединений Большинство органических соединений можно рассматривать как производные углеводородов, полученные замещением атомов водорода на функциональные группы. Функциональная группа – это группа атомов, которая определяет наиболее характерные химические свойства вещества и его принадлежность к соответствующему классу. 22 В зависимости от строения углеродной цепи выделяют следующие органические соединения: 1. Алифатические (ациклические) – соединения с открытой углеродной цепью прямой или разветвленной: а) предельные – атомы углерода связаны только одинарными связями; б) непредельные – содержат кратные углерод-углеродные связи. 2. Циклические – соединения, в которых атомы углерода образуют циклы: а) карбоциклические – циклы состоят только из атомов углерода; б) гетероциклические – циклы содержат не только атомы углерода, но и другие атомы (N,O,S). Например: Ациклические предельные соединения O CH3 (CH2)2 CH3 CH3 бутан OH CH3 (CH2)2 бутиловый спирт CH2 C CH3 бутанон-2 Ациклические непредельные соединения CH3 CH CH CH3 HC C бутен-2 CH2 CH3 бутин-1 Карбоциклические органические соединения CH H2C CH2 HC CH H2C CH2 HC CH CH циклобутан бензол 23 Гетероциклические органические соединения HC CH HC CH HC HC HC HC NH S пиррол тиофен В зависимости от природы функциональных групп производные углеводородов делят на классы, общие формулы и названия которых приведены в табл. 1. Таблица 1 Классификация органических соединений по функциональным группам Функциональная группа Формула – F, – Cl, – Br – OH –О–R O C H Название Название класса Галогенпроизводные УВ Спирты Гидроксильная группа Фенолы Эфирная группа Простые (алкоксильная) эфиры Галогены Карбонильная группа (оксогруппа) Примеры веществ СH3Cl, CH2 = CHI СН3–СН2 – ОН С6Н5ОН СН3 – О – СН3 CH3 Альдегиды Кетоны CH3 C C O H CH3 O C C O OH Сложноэфирная группа (алкоксикарбоOR нальная) O – NH2 24 Карбоксильная группа (карбоксил) Аминогруппа Карбоновые кислоты Сложные эфиры Амины CH3 CH3 C C O OH O O C2H5 СН3 – СН2 – NH2 Окончание табл. 1 Функциональная группа Формула Название – NO2 Нитрогруппа – SO3H Сульфогруппа Примеры веществ Название класса Нитросоединения Сульфокислоты СН3 – СН2 – NO2 СН3 – SO3H 1.4. Общее понятие о номенклатуре органических соединений В течение длительного времени названия органическим веществам давали по случайным признакам. Чаще всего эти названия отражали происхождение веществ (муравьиная, яблочная кислоты, винный спирт, молочный сахар и т. д.), иногда способ получения (пировиноградная кислота), а порой – имя исследователя (например, кетон Михлера). Эти случайные названия, не отражающие строения молекул органических веществ, обозначаются как тривиальные. С увеличением числа органических соединений, полученных синтетическим путем, все больше стала ощущаться острая потребность в новой номенклатуре, которая учитывала бы структуру соединения. Так возникла рациональная номенклатура. В ней все изомеры и гомологи рассматриваются как производные родоначальника конкретного класса углеводородов (например, в случае предельных углеводородов это метан, а непредельных – этилен и ацетилен). При этом учитываются названия функциональной группы и радикалов, связанных с ней. Например: H3C CH2 CH2 CH CH3 CH3 диметилпропилметан 25 Для несложных соединений эта номенклатура используется и в настоящее время. При переходе к более сложным органическим соединениям рациональная номенклатура становится не пригодной. В 1965 г. Международный союз чистой и прикладной химии (International Union Pure Applied Chemie – IUPAC) разработал и предложил систематическую номенклатуру, так называемую номенклатуру ИЮПАК. По этой номенклатуре названия органических веществ строятся следующим образом: 1. Находят самую длинную неразветвленную цепь. 2. Нумеруют ее с того конца, ближе к которому стоят: а) функциональная группа; б) кратная связь; в) заместитель. 3. Место заместителя обозначают цифрой, затем словами указывают число заместителей (ди-, три-, тетра- и т. д.) и далее называют сам заместитель. 4. Все соединение рассматривают как производное нормального углеводорода. 5. В конце добавляют окончание, которое складывается за счет наличия кратных связей или функциональных групп. Например: 7 6 CH3 CH 5 2 5 4 3 2 1 CH CH2 C CH CH CH3 CH3 CH3 4,6-диметил-5-этилгептен-2 1.5. Примеры решения задач Пример № 1. Даны вещества: циклобутан, ацетилен, гептан, бутен-1, бутин-1, циклогексан, 2,2,3-триметилбутан, бутадиен-1,3. Выберите среди них: 1) три пары изомеров; 2) две пары гомологов. Решение. 1) Из предложенных веществ изомерами являются: а) циклобутан и бутен-1 – формула С4Н8: 26 CH2 CH CH2 H2C CH2 CH3 H2C CH2 бутен-1 циклобутан б) бутин-1 и бутадиен-1,3 – формула С4Н6: CH3 CH2 C CH CH2 бутин-1 CH CH CH2 бутадиен-1,3 в) гептан и 2,2,3-триметилбутан – формула С7Н16: CH3 CH3 (CH2)5 CH3 CH3 C CH CH3 H3C CH3 гептан 2,2,3-триметилбутан 2) Циклобутан и циклогексан принадлежат к гомологическому ряду циклоалканов: CH2 H2C CH2 H2C CH2 H2C CH2 H2C CH2 CH2 циклогексан циклобутан Ацетилен и бутин-1 принадлежат к гомологическому ряду алкинов: HC CH ацетилен CH3 CH2 C CH бутин-1 Пример № 2. Напишите структурную формулу 2,2,5,5тетраметилгексана и формулу его изомера, имеющего в качестве заместителей при основной цепи только этильные радикалы. 27 Решение. Структурная формула 2,2,5,5-тетраметилгексана: CH3 6 5 CH3 4 C CH2 3 CH2 CH3 CH3 2 1 C CH3 CH3 В качестве изомера с этильными радикалами можно взять углеводород, имеющий 6 атомов углерода в главной цепи и два этильных заместителя в положениях 3 и 4, т. е. 3,4-диэтилгексан: 6 5 4 3 CH3 CH2 CH CH CH2 C2H5 C2H5 28 2 1 CH3 2. УГЛЕВОДОРОДЫ 2.1. Алифатические углеводороды Углеводороды (УВ) – это простейшие органические вещества, молекулы которых состоят из атомов только двух элементов: С и Н. Например: СН4, С2Н6, С6Н6 и т. д. Производные УВ – это продукты замещения атомов водорода в молекулах УВ на другие атомы или группы атомов. Например: H H C NH2 H Аминометан H H H C H H C Cl H H Хлорметан Производные УВ метана H H C OH H Метанол 2.1.1. Предельные или насыщенные углеводороды (парафины, алканы) Предельными углеводородами (алканами) называются соединения, в молекулах которых атомы углерода связаны между собой простой (одинарной) σ-связью и состав которых выражается общей формулой CnH2n+2, где n – число атомов углерода. 29 Алканы могут иметь неразветвленную цепь углеродных атомов (нормальные алканы, н-алканы) и разветвленную (изоалканы). Для алканов характерна только изомерия цепи, причем первые три члена гомологического ряда изомеров не имеют. Если расположить н-алканы в порядке удлинения каждой последующей молекулы на одну группу – CH2, то получится последовательность, называемая гомологическим рядом: первые члены ряда (С1 – С4) имеют тривиальные названия. Названия остальных гомологов образованы от греческих и латинских числительных. При отрыве атома водорода от молекулы алкана образуются частицы, называемые углеводородными радикалами (R). Названия одновалентных радикалов производят от названий соответствующих углеводородов с заменой окончания -ан на -ил (табл. 2). Таблица 2 Гомологический ряд алканов Углеводороды Метан Этан Пропан Бутан Пентан Гексан Гептан Октан Нонан Декан CH4 C2H6 C3H8 C4H10 C5H12 C6H14 C7H16 C8H18 C9H20 C10H22 Одновалентные радикалы Метил CH3Этил C2H5Пропил C3H7Бутил C4H9Пентил C5H11Гексил C6H13Гептил C7H15Октил C8H17Нонил C9H19Децил C10H21- Радикалы образуются не только органическими, но и неорганическими соединениями. Так, если от азотной кислоты отнять гидроксильную группу – OH, то получится одновалентный радикал – NO2, называемый нитрогруппой, и т. д. 30 Для названия изомеров широко применяют две номенклатуры: рациональную и заместительную. По рациональной номенклатуре углеводороды рассматриваются как производные метана, у которого один или несколько атомов водорода замещены на радикал. Если в формуле одинаковые радикалы повторяются несколько раз, то их обозначают греческими числительными: ди – два, три – три, тетра – четыре, пента – пять, гекса – шесть и т. д. Например: Рациональная номенклатура удобна для не очень сложных соединений: CH2 CH4 CH3 CH2 CH3 CH3 CH2 C CH3 CH2 CH2 CH3 CH3 метан диметилметан (пропан) метилдиэтилпропилметан По заместительной номенклатуре основой для названия служит одна углеродная цепь, а все другие фрагменты молекулы рассматриваются как заместители. В этом случае выбирают наиболее длинную цепь углеродных атомов и атомы цепи нумеруют с того конца, к которому ближе стоит углеводородный радикал. Затем называют: 1) номер углеродного атома, с которым связан радикал (начиная с простейшего радикала); 2) углеводород, которому соответствует длинная цепь. Если в формуле содержится несколько одинаковых радикалов, то перед их названием указывают число прописью (ди, три, тетра и т. д.), а номера радикалов разделяют запятыми. Например: 1 CH3 2 CH2 3 CH2 4 CH2 5 CH2 6 CH3 1 CH3 2 CH 3 CH2 4 CH2 5 CH3 CH3 гексан 2-метилпентан 31 1 CH3 2 CH2 3 4 CH 5 CH2 1 CH3 CH3 CH3 3-метилпектан CH3 CH 3 4 CH 2 CH3 CH 3 4 CH3 5 CH3 1 2 CH3 CH3 CH3 CH3 2,3-диметилбутан CH3 1 2 6 CH CH CH2 C CH2 CH3 CH2 C 3 CH2 4 CH3 CH3 2,2-диметилбутан 7 CH3 CH3 2,5-диметил-5-этил-3-изопропилгептан Как заместительная, так и рациональная номенклатура применяются не только для углеводородов, но и для других классов органических соединений. Способы получения алканов Источниками предельных углеводородов являются нефть и природный газ. Основной компонент природного газа – простейший углеводород метан, который используется непосредственно или подвергается переработке. Большинство углеводородов получают при переработке нефти и других природных источников. Но значительное количество ценных углеводородов получают искусственно, синтетическими или лабораторными способами. Лабораторные способы получения: 1. Гидрирование угля: nC + 2nH2 t, Fe CnH2n+2 2. Гидрирование непредельных углеводородов (этиленовых или ацетиленовых) в присутствии катализаторов (Pt, Pd, Ni): 32 kat C 2 H 4 + H 2 ⎯⎯ → C2 H6 этилен этан 3. Синтез Вюрца. При действии металлического натрия на моногалогенопроизводные углеводороды образуются алканы: H3C I + 2Na + I CH3 йодистый метил CH3 CH3 + 2NaI этан 4. Сплавление солей карбоновых кислот со щелочами: CH3 COONa + NaOH ацетат натрия CH4 + Na2CO 3 метан Химические свойства алканов Предельные углеводороды – малореакционноспособные соединения, что определяется высокой прочностью σ-связей С – С и С – Н. К реакциям присоединения они вообще не способны вследствие насыщенности всех связей атомов углерода. С большинством химических реагентов алканы или вовсе не реагируют, или реагируют чрезвычайно медленно. Обычно разрыв связей в молекулах алканов происходит по гомолитическому типу, т. е. реакции, в которые они вступают, радикальные. Таким образом, для предельных углеводородов различают два основных типа химических реакций: 1. Реакции замещения водорода с разрывом связи С – Н. 2. Реакции расщепления молекулы, происходящие с разрывом как С – Н, так и С – С связей. 1. Реакции замещения. В этих реакциях легче всего происходит замещение атома водорода, связанного с третичным углеродным атомом, труднее – со вторичным и совсем трудно – с первичным углеродным атомом. Это связано с энергией С – Н связи: у первичного около 420 кДж/моль; у вторичного – 390 кДж/моль; у третичного – 370 кДж/моль. 33 Рассмотрим основные реакции замещения предельных углеводородов. Нитрование. При нагревании (140 °С) и под давлением разбавленная азотная кислота действует как нитрующий агент, т. е. один из атомов Н2 замещается на нитрогруппу (-NO2) (реакция Коновалова): CH3 CH3 H3C CH2 C H + HO NO2 CH3 – H2O изопентан H3C CH2 C NO2 CH3 2-нитро-2-метилбутан Галогенирование. Это одна из важнейших реакций предельных углеводородов. Она протекает с замещением атома водорода в алканах на галогены. Идет она только на свету или при высоких температурах (300 ºС) и носит радикально-цепной характер. На первой стадии происходит распад молекулы хлора на два свободных радикала, этот процесс называется инициирование цепи: hν Сl2 ⎯⎯→ 2Сl• Образовавшийся атом хлора уже может оторвать атом водорода от метана, таким образом начинается развитие цепи: СН4 + Сl•→СН3• + HCl Свободный метильный радикал отрывает затем атом хлора от молекулы хлора, образуя хлористый метил и новый атом хлора: СН3• + Сl2→СН3Сl + Сl• В этой экзотермической реакции вместо атома хлора, расходуемого во 2 стадии, появляется другой атом хлора: Сl• + СН3Сl→ СН2Сl• + HCl 34 В результате последовательных реакций в цепи могут образовываться: СН3Сl – хлористый метил, СН2Сl2 – хлористый метилен, СНСl3 – хлороформ, ССl4 – четыреххлористый углерод. 2. Реакции расщепления. Из этих реакций следует отметить процессы, протекающие при окислении и дегидрировании алканов и крекинге нефти. Окисление. Окислители, такие как перманганаты или хромовая смесь, при обычных температурах не действуют на УВ с нормальной углеродной цепью. Легче окисляются УВ, в молекулах которых имеется третичный атом углерода. При температуре выше 300 °С предельные УВ сгорают с образованием углекислого газа и воды: С5Н12 + 8О2→5СО2 + 6Н2О пентан Дегидрирование (отщепление водорода происходит в результате разрыва связей С – Н, в присутствии катализатора при повышенных температурах). При дегидрировании метана образуется этин (ацетилен): 1500 °С С2Н2 + 3Н2 2СН4 ⎯⎯⎯→ метан ацетилен При дегидрировании других алканов образуются алкены: Cr O 460 °С 2 3, С3Н8 ⎯⎯⎯⎯⎯ → С2Н4 + Н2 пропан пропилен Крекинг – это высокотемпературная переработка нефти и ее фракций, в результате которой получаются, как правило, продукты с меньшей молекулярной массой. Различают два основных типа крекинга – термический и каталитический. Термический: при нагревании алканов до температуры около 500 ºС происходит разрыв связей С – С, причем в радика35 лах водород перераспределяется так, что получается смесь алкана и алкена, например: 500 °С → СН3 – СН3 + СН2 = СН2 Н3С – СН2 – СН2 – СН3 ⎯⎯⎯ бутан этан этилен 400 °С Н3С – СН2 – СН2 – СН3 ⎯⎯⎯ → СН4 + СН2= СН – СН3 бутан метан пропилен Каталитический: протекает в присутствии катализаторов (алюмосиликатов или хлорида алюминия) при 480–540 ºС и давлении 0,2–0,3 МПа. При каталитическом крекинге помимо превращения длинных углеводородов в алканы и алкены с короткими цепями происходит изомеризация углеродного скелета. Реакции изомеризации. При нагревании алканов в присутствии катализатора AlCl3 (хлорид алюминия) происходит превращение неразветвленной углеродной цепи в разветвленную: H3C CH2 CH2 CH3 + AlCl3 CH3 бутан CH CH3 CH3 изобутан Примеры решения задач Пример № 1. Напишите уравнения реакций, при помощи которых из метана и неорганических реагентов можно получить бутан. Решение. а) Бромированием метана можно получить бромметан: СН4 + Br2 → CH3Br + HBr метан бромметан б) При нагревании бромметана с натрием образуется этан (реакция Вюрца): 2CH3Br + 2Na → C2H6 + 2NaBr бромметан 36 этан в) При взаимодействии этана с бромом можно получить бромэтан: C2H6 + Br2 → C2H5Br + HBr этан бромэтан г) Бутан получается из бромэтана по реакции Вюрца: 2C2H5Br + 2Na → C4H10 + 2NaBr бромэтан бутан Пример № 2. Изобразите структурные формулы изомеров алкана С6Н14 и назовите их. Решение. Один изомер состава С6Н14 имеет углеродную цепь без разветвлений: CH3 CH2 CH2 CH2 CH2 CH3 н-гексан Два изомера – с пятью атомами углерода в главной цепи: CH3 CH CH2 CH2 CH3 CH2 CH3 CH3 2-метилпентан CH3 CH2 CH CH3 3-метилпентан Еще два изомера имеют главную углеродную цепь, состоящую из четырех атомов: CH3 CH3 CH CH CH3 CH3 CH3 2,3-диметилбутан CH3 C CH2 CH3 CH3 2,2-диметилбутан Ответ. Следовательно, эмпирической формуле С6Н14 соответствует пять изомеров. 37 Пример № 3. Органическое вещество содержит углерод с массовой долей 84,21 % и водород с массовой долей 15,79 %. Плотность паров вещества по воздуху составляет 3,93. Определите формулу этого вещества. Решение. Представляем формулу вещества в виде СхНу. Так как массовая доля показывает, сколько граммов вещества содержится в 100 г смеси, для расчетов берем массу образца 100 г. Определяем массу углерода и водорода в этом образце: m(C) = m ⋅ ω(С), где m – масса всего образца; ω – массовая доля, безразмерная величина. Если она дана в %, то ω (%) . 100 % m(C) = 100 ⋅ 0,8421 = 84,21 г. m(Н) = 100 ⋅ 0,1579 = 15,79 г. Определяем количества вещества (в молях) углерода и водорода в этом образце: n= m , M где n – количество вещества, моль; m – масса вещества, г; М – молекулярная масса вещества, г/моль. 84, 21 = 7, 02 моль; 12 15, 79 т(Н) = = 15,79 моль. 1 n(C) = Находим отношение количеств веществ водорода и углерода, входящих в состав соединения: n(H) 15,79 = = 2, 25 . n(C) 7, 02 38 Это отношение равно отношению коэффициентов у и х: n(H) y = ; n(C) x y = 2, 25 . x или (а) Исходя из формулы определения относительной плотности газа: M D= 1, M2 где D – относительная плотность газа, безразмерная величина; М1 – молекулярная масса одного газа, г/моль; М2 – молекулярная масса второго газа, г/моль. Зная плотность паров углеводорода по воздуху и молекулярную массу воздуха (М = 29 г/моль), рассчитываем молекулярную массу образца: М1(СхНу) = М2 ⋅ D; М1 (СхНу) =29 ⋅ 3,93 = 114 г/моль. Молекулярная масса может быть представлена в виде: М(СхНу) = М(С)х + М(Н)у; М(СхНу) = 12х +у. Получаем: 12х + у = 114. (б) Решая систему уравнений (а) и (б), находим: х = 8; у = 18. Таким образом, формула углеводорода – С8Н18, это октан. 2.1.2. Непредельные (ненасыщенные) углеводороды ряда этилена (алкены, олефины) Непредельные углеводороды (алкены, этиленовые углеводороды, олефины) представляют собой ненасыщенные алифати39 ческие углеводороды с общей формулой СnH2n, содержащие одну двойную связь. Двойная связь короче одинарной, а ее энергия больше, т. к. она является более прочной. Тем не менее, наличие подвижной, легко поляризуемой π-связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения. Для алкенов возможны 4 типа изомерии: 1. Изомерия цепи: характерна для алкенов, начиная с бутена. 2. Изомерия положения двойной связи. 3. Геометрическая изомерия, или цис-транс-изомерия. 4. Межклассовая изомерия – изомерны циклоалканам CH2 CH CH2 CH2 CH2 CH3; гексен-1 CH2 H2C H2C CH2 CH2 CH2 циклогексан Алкены простого строения часто называют по названиям соответствующих предельных углеводородов путем замены окончания -ан на -илен. Например: этан С2Н6 – этилен С2Н4, пропан С3Н8 – пропилен С3Н6. Иногда употребляют и рациональные названия. В этом случае алкены рассматривают как замещенные этилена: H3C CH CH CH2 CH3 симм-метилэтилэтилен По заместительной номенклатуре названия этиленовых углеводородов производят от названий алканов, заменяя окончание -ан на -ен (ен – двойная связь) с указанием номера атома углерода при двойной связи (главную цепь нумеруют с того конца, к которому ближе расположена двойная связь). Например: CH2 этен 40 CH2 CH2 CH CH3 пропен 1 CH2 2 3 CH CH2 бутен-1 4 CH3 1 2 CH3 3 4 CH CH CH3 1 2 CH2 C CH3 3 CH3 бутен-2 2-метилпропен-1 Непредельные углеводородные радикалы по систематической номенклатуре называют, добавляя к корню суффикс -енил-, но гораздо чаще для этих радикалов используют эмпирические названия: например, радикал этилена СН2 = СН – этенил – эмпирически называется винилом. Способы получения непредельных углеводородов 1. Получение из природных источников: в процессе термического крекинга предельных УВ вместе с алканами образуются алкены: t °С С16Н34 ⎯⎯→ С8Н18 + С8Н16 гексадекан октан октен 2. Лабораторные способы: а) дегидрирование предельных УВ. При пропускании алканов над катализатором (Pt, Ni, Al2O3, Cr2O3) при температуре 400–600 °С происходит отщепление молекулы водорода: kat , t °С СН3 – СН2 – СН2 – СН3 ⎯⎯⎯ ⎯ → СН3 – СН2 – СН = СН2 + Н2 бутан бутен-1 б) дегидратация спиртов. При воздействии водоотнимающих средств H2SO4 или Al2O3 на одноатомные спирты при температуре 170–180 °С: СН3 – СН2 – ОН → СН2 = СН2 + Н2О в) дегидрогалогенирование. При взаимодействии галогеналканов со щелочью в спиртовом растворе образуется двойная связь в результате отщепления молекулы галогеноводорода по правилу А.М. Зайцева: 41 при отщеплении галогеноводорода от вторичных и третичных галогеналканов атом водорода отщепляется от наименее гидрированного атома углерода. CH3 CH CH2 + NaOH CH3 + CH3 Br + H2O CH CH CH3 ++ NaBr + бутен-2 бромбутан г) гидрирование алкинов: происходит в присутствии катализаторов (Pt, Pd, Ni): СН ≡ СН + Н2 → Н2С = СН2 ацетилен этилен д) дегалогенирование. При действии Zn на дибромпроизводные алканов происходит отщепление атомов галогена и образование двойной связи: CH3 CH CH Br + Zn CH3 + CH3 Br CH CH CH3 ++ ZnBr2 бутен-2 2,3-дибромбутан Химические свойства алкенов Отличительной чертой алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения. Реакции присоединения 1) Гидрирование (присоединение водорода) происходит в присутствии катализаторов. Катализатором служит никель (П. Сабатье, Ж. Сандеран, 1899) или платина (PtO2 – катализатор Адамса): СН3 – СН = СН – СН3 + Н2 ⎯⎯→ СН3 – СН2 – СН2 – СН3 kat бутен-2 бутан 2) Галогенирование (присоединение галогенов): 42 СН3 – СН = СН2 + Cl2 → СН3 – СНCl – СН2Cl пропен-1 1,2-дихлорпропан 3) Гидрогалогенирование (присоединение галогеноводородов): CH2 CH2 + HBr CH3 этен CH2Br бромэтан В случае несимметричных алкенов присоединение галогеноводорода может идти по-разному: CH3 CHBr CH3 (1) CH3 2-бромпропан CH CH2 + HBr CH3 CH2 1-бромпропан CH2Br (2) Согласно правилу В.В. Марковникова: при присоединении галогеноводородов к несимметричным олефинам (при обычных условиях) водород присоединяется по месту двойной связи к наиболее гидрогенизированному (связанному с наибольшим числом водородных атомов) атому углерода, а галоген – к менее гидрогенизированному. Поэтому в реакции пропилена с бромоводородом образуется 2-бромпропан (1). По легкости присоединения галогеноводороды можно расположить в ряд: HF > HCl > HBr > HI. 4) Гидратация (присоединение воды). В присутствии катализаторов (Н4SO4конц, ZnCl2) к алкенам присоединяется вода с образованием спиртов. Реакция идет согласно правилу В.В. Марковникова: CH3 CH CH2 + H2O пропен-1 H2SO4 CH3 CH CH3 OH пропанол-2 Реакции окисления алкенов 1) Горение (процесс энергичного и полного окисления алкенов на воздухе), например, горение этилена: 43 CH2 CH2 + 3O 2 2CO2 + 2H2O 2) Реакция Е.Е. Вагнера. Если разбавленным раствором перманганата калия действовать на этилен при обычной температуре, то он превращается в двухатомный спирт – этиленгликоль: 3CH2 CH2 + 2KMnO4 + 4H2O 3H2C CH2 + 2MnO2 + 2KON OH OH этилен этиленгликоль 3) Реакция Н.А. Прилежаева. При окислении этилена кислородом воздуха в присутствии металлического серебра образуется оксид этилена: 2CH2 CH2 + O2 350 °C 2CH2 Ag CH2 O оксид этилена Изомеризация алкенов Изомеризация алкенов может представлять собой перемещение π-связи: CH2 CH CH2 CH3 kat, t CH3 бутен-1 CH CH CH3 бутен-2 или перестройку углеродного скелета: CH2 CH CH2 CH3 kat, t CH2 C CH3 CH3 бутен-1 2-метилпропен Реакции полимеризации Особым случаем реакции присоединения являются реакция полимеризации алкенов и их производных. При помощи реакции свободнорадикальной полимеризации веществ, содержащих двойную связь, получают большое 44 количество высокомолекулярных соединений, например, из этилена получают полиэтилен: УФ-свет,R nCH 2 = CH 2 ⎯⎯⎯⎯→ [ −CH2 − CH 2 −]n • Примеры решения задач Пример № 1. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: H SO 170 °С HBr Na , t 2 4 конц , ⎯ → Y ⎯⎯⎯ →Z С2Н5ОН ⎯⎯⎯⎯⎯⎯ → Х ⎯⎯ Решение. 1. При нагревании этилового спирта (С2Н5ОН) до 170 ºС с концентрированной серной кислотой (H2SO4) должен образоваться продукт (Х), реагирующий с бромоводородом. Это этилен: H SO 170 °С 2 4 конц , СН3 – СН2 – ОН ⎯⎯⎯⎯⎯⎯ → СН2 = СН2 + Н2О 2. В результате присоединения бромоводорода к этилену образуется бромэтан (Y): СН2 = СН2 + HBr → СН3 – СН2Br 3. При нагревании двух молекул бромэтана в присутствии металлического натрия (реакция Вюрца) образуется бутан (Z): 2СН3 – СН2Br + 2Na → СН3 – СН2 – СН2 – СН3 + 2NaBr Пример № 2. Смесь метана и этилена объемом 400 мл (нормальные условия) обесцветила бромную воду с массовой долей брома 3,2 % массой 40 г. Определите объемную долю этилена в смеси. Решение. С бромной водой, из веществ, входящих в состав смеси, легко взаимодействует только этилен с образованием 1,2-дибромэтана: С2Н4 + Br2 → C2H4Br2 45 Определяем массу и количество вещества молекулярного брома, содержащегося в бромной воде: m(Br2) = mω(Br2); m(Br2) = 40 ⋅ 0,032 = 1,28 г; n(Br2) = m ( Br2 ) 1, 28 ; n(Br2) = = 0, 008 моль; M ( Br2 ) 160 из уравнения реакции следует: n(С2Н4) = n(Br2), тогда n(С2Н4) = 0,008 моль. Находим объем этилена при нормальных условиях: V(С2Н4) = n(С2Н4)Vн.у; V(С2Н4) = 0,008 ⋅ 22,4 = 0,1792 л. Определяем объемную долю этилена в смеси: ω(C 2 H 4 ) = V ( C 2 H 4 ) 179, 2 = 100 = 44,8 % . V ( смеси ) 400 Ответ. Объемная доля этилена в смеси составляет 44,8 %. 2.1.3. Диеновые углеводороды (алкадиены) Диеновые УВ – это УВ, в молекулах которых между атомами углерода имеются две двойных связи. Общая формула: СnH2n–2, где n ≥ 3. Свойства диеновых углеводородов определяются, в основном, расположением двух двойных связей. Поэтому по их расположению диены классифицируют: 1. Алкадиены с кумулированным расположением двойных связей – это когда связи расположены рядом: СН2 = С = СН2 пропадиен-1,2 2. Алкадиены с сопряженными двойными связями – когда двойные связи разделены одной простой связью: 46 СН2 = СН – СН = СН2 бутадиен-1,3 3. Алкадиены с изолированными двойными связями – двойные связи разделены двумя или несколькими простыми связями: СН2 = СН – СН2 – СН = СН2 пентадиен-1,4 Для алкадиенов характерны 4 вида изомерии: – изомерия углеродного скелета; – изомерия положения двойных связей: СН2 = СН – СН2 – СН = СН2 и СН2 – СН = СН2 – СН = СН2 пентадиен-1,4 пентадиен-1,3 – цис-транс-изомерия; CH2 CH CH3 C C H H CH2 CH H цис-пентадиен-1,3 C C H CH3 транс-пентадиен-1,3 – межклассовая изомерия. Изомерны соединениям алкинов и циклоалканов. По систематической номенклатуре диеновые углеводороды называют так же, как и этиленовые. При формировании названия алкадиена указывают номера двойных связей. Главная цепь должна обязательно содержать обе кратные связи, окончание -диен добавляют к УВ главной цепи. 1 CH2 2 C 3 CH2 CH2 4 5 6 CH CH CH3 CH3 2-этилгексадиен-1,4 Способы получения алкадиенов в лабораторных условиях 1. Дегидрирование алканов и алкенов. Дегидрирование производится при высоких температурах в присутствии меднохромовых катализаторов: у алканов, алкенов отщепляется водород с образованием алкадиенов. 47 kat С4Н10 ⎯⎯→ СН2 = СН – СН = СН2 + 2Н2 бутан бутадиен-1,3 2. Дегидрогалогенирование дигалогеналканов и тетрагалогеналканов. В первом случае процесс происходит в присутствии спиртового раствора щелочи, во втором – Zn. CH2 CH2 CH2 CH2 + NaOH(спирт. р-р) Br CH2 Br CH CH CH2 + HBr бутадиен-1,3 1,4-дибромбутан CH2 CH CH CH2 + NaOH(спирт. р-р) Br Br Br Br CH2 CH CH CH2 + 2ZnBr2 бутадиен-1,3 1,2,3,4-тетрабромбутан Химические свойства Для алкадиенов, как и для алкенов, характерны реакции молекулярного, электрофильного и радикального присоединения, окисления, полимеризации. Во всех этих реакциях могут участвовать как одна, так и две связи – С =С – . Химические свойства алкадиенов с изолированными двойными связями аналогичны свойствам алкенов. Кумулированные алкадиены – наиболее реакционноспособные соединения. Это объясняется значительными напряжениями, возникающими в молекуле при появлении двух двойных связей у одного атома углерода. Реакции присоединения Диены, содержащие несопряженные двойные связи, ведут себя как обычные алкены. Присоединение идет независимо к каждой из этих связей. При этом могут затрачиваться две молекулы реагента (галогена, галогеноводорода и т. д.). Диеновые углеводороды с сопряженными связями отличаются высокой реакционной способностью и значительной ус48 тойчивостью по сравнению с диенами, имеющими кумулированные или изолированные двойные связи. Эти соединения присоединяют реагент не только по одной или двум отдельным двойным связям (1,2-присоединение), но и к противоположным концам молекулы (1,4-присоединение). Например, при галогенировании 1,3-бутадиена образуется 3,4-дибромбутен-1 (1,2-присоединение) и 1,4-дибромбутен-2 (1,4-присоединение). CH2 CH2 CH CH CH2 Br Br CH CH CH2 + Br2 1,3-бутадиен 3,4-дибромбутен-1 CH2 Br CH CH CH2 Br 1,4-дибромбутен-2 Соотношение продуктов зависит от условий и способа проведения соответствующих реакций. Важнейшим свойством диенов является их способность к полимеризации. Для диеновых углеводородов с сопряженными двойными связями особенно характерна способность под действием различных катализаторов или света, особенно ультрафиолетовых лучей, а иногда и самопроизвольно полимеризоваться с образованием высокомолекулярных углеводородов. Число мономерных звеньев, входящих в молекулу полимера, может изменяться от двух (димер) до десятков тысяч. Порядок соединения отдельных полимерных звеньев может быть различным. Полимеризация 1,3-диено идет за счет раскрытия двойных связей в положениях 1,4 или 1,2; и в том и в другом случае в полимерной цепи или в ее боковом ответвлении остается по одной двойной связи на каждое звено мономера. Поэтому, например, при полимеризации бутадиена получаются полимеры (полибутадиены) следующего строения: 49 ...– CH2 CH CH CH2 CH CH2 CH CH CH2 –... CH CH2 Примеры решения задач Пример № 1. При гидрировании бутадиена-1,3 массой 8,1 г получили смесь бутана и бутена-1. При пропускании этой смеси через раствор брома образовался 1,2-бромбутан массой 10,8 г. Определите массовые доли углеводородов в полученной смеси. Решение. Гидрирование бутадиена-1,3 протекает в соответствии с уравнениями СН2 = СН – СН = СН2 + Н2 → СН2 = СН – СН2 – СН3 (1) СН2 = СН – СН = СН2 + 2Н2 → СН3 – СН2 – СН2 –СН3 (2) 1,3-бутадиен бутен-1 1,3-бутадиен бутан Из компонентов полученной смеси с бромом взаимодействует только бутен-1: СН2 = СН – СН2 – СН3 +Br2 → CH2Br – CHBr – CH2 – CH3 (3) 1,2-дибромбутан Определяем количество вещества полученного 1,2-дибромбутана: n ( C 4 H8 Br2 ) = m ( C 4 H 8 Br2 ) 10,8 = = 0, 05 моль. M ( C 4 H8 Br2 ) 216 Из уравнения реакции (3) следует: n(C4H8) = n(C4H8Br2); т. е. n(C4H8) = 0,05 моль. Определяем массу полученного бутена-1: m(C4H8) = n(C4H8)M(C4H8) = 0,05 ⋅ 56 = 2,8 г. 50 На основании уравнения реакции (1): n1(C4H6) = n(C4H8); n1(C4H6) = 0,05 моль, т. е. это количество бутадиена-1,3, которое вступило в реакцию (1). Исходное количество вещества бутадиена-1,3 составляет: n ( C4 H6 ) = m ( C 4 H 6 ) 8,1 = = 0,15 моль. M ( C 4 H 6 ) 54 Рассчитываем количество вещества бутадиена-1,3, вступившего в реакцию (2): n2(C4H6) = n(C4H6) – n1(C4H6) = 0,15 – 0,05 = 0,1 моль. Как следует из уравнения реакции (2): n(C4H10) = n2(C4H6); тогда n(C4H10) = 0,1 моль. Определяем массу полученного бутана: m(C4H10) = n(C4H10)M(C4H10) = 0,1 ⋅ 58 = 5,8 г. Находим массу полученной смеси углеводородов в смеси: m = m(C4H8) + m(C4H10) = 2,8 + 5,8 = 8,6 г. Рассчитываем массовые доли углеводородов в смеси: m ( C 4 H8 ) 2,8 = 100 = 32, 6 % ; mсмеси 8, 6 m ( C 4 H10 ) 5,8 ω ( C 4 H10 ) = = 100 = 67, 4 % . mсмеси 8, 6 ω ( C 4 H8 ) = Ответ. Массовые доли бутана и бутена-1 в смеси составляют 67,4 и 32,6 % соответственно. 51 2.1.4. Непредельные углеводороды ряда ацетилена (алкины) Алкины (ацетиленовые углеводороды) – ненасыщенные углеводороды, содержащие в молекуле одну тройную связь. Общая формула таких соединений СnH2n–2. Согласно международной номенклатуры ИЮПАК углеродную цепь нумеруют таким образом, чтобы тройная связь получила наименьшую цифру, которая указывает в конце названия место нахождения краткой связи, при этом в названии основной цепи (алкана) суффикс -ан заменяют на -ин (табл. 3). Например: 6 5 H3C 4 CH CH2 3 C 2 1 C CH3 CH3 5-метилгексин-2 Таблица 3 Простейшие алкины Структурная формула H C C H CH3 C C H CH3CH2C C H CH3 C C H CH3CH2CH2 C C H CH3CH2 C C CH3 Номенклатура ИЮПАК Рациональная Этин Ацетилен Пропин Метилацетилен Бутин-1 Этилацетилен Бутин-2 Диметилацетилен Пентин-1 Пропилацетилен Пентин-2 Метилэтилацетилен Для первого представителя ряда алкинов С2Н2 сохраняется тривиальное называние ацетилен, поэтому иногда гомологи ацетилена называют как замещенные ацетилены (рациональная номенклатура) и тройную связь называют ацетиленовой связью (см. пример в табл. 3). Названия остатков алкинов образуют, присоединяя суффикс -ил (см. табл. 3), следовательно, алкинил: 52 H C C этинил CH3 пропинил-1 C C H C C CH2 пропинил-1 (пропаргил) Способы получения алкинов 1. Из карбида кальция при разложении водой. Карбид кальция СаС2, в свою очередь, получают прокаливанием смеси угля и негашеной извести в электропечах: 2500 °C 3C + CaO CaC2 + 2H2O CaC2 + CO CH CH + Ca(OH)2 2. Термический крекинг метана: 1500 °C 2CH4 CH CH + 3H2 3. Дигидрогалогенирование дигалогеналканов спиртовым раствором щелочи (щелочь и спирт берут в избытке): СН3 – СНBr – CHBr – CH3+2KOH(спирт)→ СН3 – С ≡ C – CH3+2KBr 2,3-дибромбутан бутин-2 4. Алкилирование металлических производных ацетилена (происходит удлинение цепи): CH3 C CNa + Br C2H5 CH3 C C C2H5 + NaBr Химические свойства алкинов Реакции присоединения. Ацетиленовые углеводороды обладают большей ненасыщенностью, чем алкены, поэтому все реакции присоединения у них протекают ступенчато. 1. Гидрирование. При присоединении одной молекулы водорода к тройной связи, в присутствии катализаторов (Ni, Pt, Pd), происходит процесс восстановления алкинов в алкены с дальнейшим восстановлением до алкана: 53 R C C R' H2 R CH CH R' H2 R CH2 CH2 R' 2. Галогенирование. Галогены также присоединяются к тройной связи с образованием или двузамещенного галогенопроизводного этиленового углеводорода (присоединение одной молекулы галогена), или четырехзамещенного галогенопроизводных алкана (присоединение двух молекул галогена). Алкины обесцвечивают бромную воду (качественная реакция): R C C R' Br2 R CBr CBr R' Br2 R CBr2 CBr2 R' 3. Гидрогалогенирование. Продукты присоединения к несимметричным алкинам определяются правилом Марковникова. В результате получается соединение, содержащее оба атома галогена при одном атоме углерода: CH3 C CH HCl CH3 C CH2 HCl CH3 Cl C CH3 Cl2 4. Гидратация (реакция М.Г. Кучерова, 1881). Вода присоединяется к ацетиленовым углеводородам под действием разных катализаторов, но особенно легко в присутствии сульфата ртути (II). При этом из ацетилена получается уксусный альдегид, а из гомологов ацетилена – кетоны: HgSO4 H C C H + H2O [H C C H] CH3 H OH виниловый спирт CH3 C HgSO4 CH + H2O [CH3 C CH2] OH C H O уксусный альдегид CH3 C CH3 O ацетон (кетон) Реакции полимеризации. Ацетиленовые углеводороды в зависимости от условий реакции способны образовывать разнообразные продукты полимеризации – линейные или циклические. 54 а) Димеризация. Очень важное техническое значение имеет реакция димеризации ацетилена, происходящая под действием водно-аммиачного раствора Cu2Cl2: CH CH + CH CH CH2 CH C CH винилацетилен б) Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Н.Д. Зелинского): 3CH CH C, 600 °C C6H6 бензол Реакции замещения. Водородные атомы в ацетилене или у алкинов с кратной связью на конце молекулы способны замещаться на металл – реакция металлирования. В результате образуются металлические производные ацетилена – ацетилениды. CH CH + 2[Ag(NH3)2]OH AgC CAg + 4NH3 + 2H2O Реакции окисления. Ацетилены легко окисляются с частичным или полным разрывом молекулы по тройной связи, например, при окислении перманганатом калия происходит обесцвечивание раствора перманганата калия: HC CH + 2KMnO4 [O] 2HCOOK + 2MnO2 формиат калия На воздухе ацетилен горит коптящим пламенем: 4CO2 + 2H2O 2CH CH + 5O2 Примеры решения задач Пример № 1. Состав соединения выражается формулой С4Н6. Известно, что это вещество легко взаимодействует с бромной водой, не реагирует с аммиачным раствором оксида серебра, но присоединяет воду в присутствии солей ртути (II). Напишите структурную формулу соединения и назовите его. Решение. Из формулы углеводорода следует, что вещество может относиться к алкинам, алкадиенам или циклическим алкенам, состав которых выражается общей формулой СnH2n–2. 55 Реакция присоединения воды в присутствии солей ртути (II) характерна для алкинов (реакция Кучерова). Так как углеводород не взаимодействует с аммиачным раствором оксида серебра, он не содержит тройную связь при первом углеродном атоме. Ответ. Структурная формула алкина: СН3 – С ≡ С – СН3 – это бутин-2. Пример № 2. Напишите структурные формулы изомерных ацетиленовых углеводородов состава С7Н12, главная цепь которых состоит из пяти углеродных атомов, и назовите их. Решение. Тройная связь в главной цепи может находиться в положениях 1 и 2: C C C C C C C C C C В первом случае возможны четыре структурных изомера (две группы –СН3 в положениях 3,3; 3,4; 4,4 или одна группа – С2Н5 в положении 3): CH3 CH3 CH2 C CH3 C CH CH3 CH3 CH2 C CH CH3 3,3-диметилпентин-1 CH3 C CH CH C 4,4-диметилпентин-1 CH CH3 CH2 CH3 CH3 CH C CH C2H5 3,4-диметилпентин-1 3-этилпентин-1 Во втором случае возможен единственный изомер, когда две метильные группы находятся в положении 4: CH3 CH3 C C C CH3 CH3 4,4-диметилпентин-2 56 2.2. Алициклические углеводороды (циклоалканы) Алициклические углеводороды – это вещества, молекулы которых содержат циклы, состоящие из углеродов в sp3гибридизации. Общая формула: СnH2n, где n ≥ 3. Классификация алициклических углеводородов: – циклоалканы; – терпены. Для циклоалканов характерно 5 видов изомерии: 1. Размер цикла. Например: CH2 CH2 CH2 CH2 CH2 циклопентан CH2 CH CH3 CH2 CH2 метилциклобутан 2. Взаимное расположение заместителей. 3. Строение заместителя. 4. Межклассовая изомерия. Циклоалканы изомерны алкенам. Циклоалканы называют, добавляя приставку цикло- к названию соответствующего нормального алкана: CH2 CH2 CH2 CH2 CH2 циклопентан CH2 CH2 CH2 циклопропан Одновалентные радикалы, образованные от циклоалканов, называют, заменяя суффикс -ан на -ил. Ненасыщенные циклические углеводороды называют, заменяя суффикс -ан на -ен, -диен и т. д. Положение кратных связей обозначают наименьшими цифрами. Например: 57 6 1 2 5 CH3 4 3 CH3 4,5-диметилциклогексадиен-1,3 Способы получения циклоалканов 1. Гидрирование бензола: + 3H2 CH2 t°, p, Ni CH2 CH2 бензол CH2 CH2 CH2 циклогексан CH3 + 3H2 метилбензол (толуол) CH3 t°, p, Ni метилциклогексан 2. Дегалогенирование дигалогенпроизводных: CH2 CH2 CH2 CH2 Br + Zn Br 1,3-дибромпропан CH2 + ZnBr2 CH2 циклопропан Химические свойства За исключением циклопропана и в меньшей степени циклобутана, все остальные циклоалканы по реакционной способности не отличаются от инертных алканов. 58 Неустойчивостью малых циклов объясняется способность циклопропана и циклобутана к реакциям присоединения, которые сопровождаются открытием цикла. Реакции присоединения в малых циклах 1. Гидрирование: CH2 CH2 + H2 Pt CH3 CH2 CH3 CH2 циклопропан н-пропан 2. Галогенирование: CH2 CH2 + Br2 Pt BrCH2 CH2 CH2Br CH2 циклопропан 1,3-дибромпропан 3. Гидрогалогенирование: CH2 CH2 + HBr2 Pt BrCH2 CH2 CH3 CH2 циклопропан 1-бромпропан Примеры решения задач Пример № 1. Существует два геометрических изомера 1,2диметилциклопропана. Изобразите их структуры. Решение. Для 1,2-диметилциклопропана существует цисизомер и транс-изомер: 59 H CH2 H C CH3 H CH2 CH3 C C C CH3 CH3 H цис-изомер транс-изомер Пример № 2. Циклогексен массой 12,3 г подвергли гидрированию. Продукт гидрирования сожгли, получив оксид углерода (IV) объемом 13,44 л (нормальные условия). Определите выход продукта гидрирования, если выход продуктов горения – количественный. Решение. При гидрировании циклогексена образуется циклогексан: + H2 или С6Н10 + Н2 → С6Н12 (1) Уравнение горения циклогексана: С6Н12 + 9О2 → 6СО2 + 6Н2О (2) Вычисляем количество вещества оксида углерода (IV), полученного при горении циклогексана: n(CO 2 ) = V (CO2 ) 13, 44 = 0, 6 моль. Vm 22, 4 Из уравнения реакции (2) следует, что количество реально полученного циклогексана равно: n(С6 Н12 ) = 1 1 n ( CO2 ) ; n ( C6 H12 ) = 0, 6 = 0,1 моль. 6 6 Находим массу реально полученного циклогексана: m p ( C6 H12 ) = n ( C6 H12 ) M ( C6 H12 ) = 0,1 ⋅ 84 = 8, 4 г. 60 Определяем количество вещества исходного циклогексена: n ( C6 H10 ) = m ( C6 H10 ) 12,3 = = 0,15 моль. M ( C6 H10 ) 82 На основании уравнения (1) записываем: n ( C6 H12 ) = n ( C6 H10 ) ; n ( C6 H12 ) = 0,15 моль. 0,15 моль – количество вещества циклогексана, который образовался бы при количественном выходе. Находим массу этого циклогексана: m ( C6 H12 ) = n ( C6 H12 ) M ( C6 H12 ) = 0,15 ⋅ 84 = 12, 6 г. Определяем выход циклогексана: η ( С 6 H12 ) = mp m 100 = 8, 4 100 = 66, 7 % . 12, 6 2.3. Ароматические углеводороды (арены) Ароматическими углеводородами (аренами) называются углеводороды с замкнутой π-сопряженной системой. Классические представители одноядерных аренов – бензол (C6H6) и толуол (C6H5СН3). CH CH HC CH HC CH или CH CH3 HC C HC CH CH3 или CH Бензол С6Н6 Толуол С6Н5СН3 61 Многоядерные арены могут включать в себя конденсированные кольца (нафталин С10Н8, антрацен С14Н10 и др.) и неконденсированные кольца (дифенил, дифенилметан и т. д.) Нафталин Антрацен CH2 Дифенил Дифенилметан Следуя номенклатурным правилам ИЮПАК, названия аренов должны иметь суффикс -ен. Предлагается писать не бензол, а бензен, не толуол, а толуен. Такие названия употребляются в английском языке, но в других языках пока еще сохраняется суффикс -ол, несмотря на то, что получается некоторая путаница с названиями спиртов и фенолов, которые по правилам ИЮПАК имеют суффикс -ол. Двузамещенные бензолы образуют три изомера в зависимости от положения заместителей: орто-, мета- и парапроизводные (сокращенно о-, м- и п-) или, соответственно, 1,2-, 1,3и 1,4-замещенные бензола. Названия остатков аренов образуют с помощью суффикса -ил (арил-). Для некоторых остатков сохранились тривиальные названия, например: CH2 фенил- 62 бензил- C2H5 2-этилфенил CH3 CH3 о-толил м-толил CH3 CH3 2,3-ксилил- CH2CH2 фенэтил- м-фенилен- п-фенилен- Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R). Общая формула гомологического ряда бензола СnH2n–6 (n ≥ 6). Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерацию кольца проводят так, чтобы номера радикалов были наименьшими. Например: CH3 CH3 1 6 2 5 3 4 CH3 CH3 1 6 2 5 3 4 1,2-диметилбензол 2 6 1 5 4 CH3 1,3-диметилбензол 3 CH3 1,4-диметилбензол Способы получения аренов 1. Ароматизация парафинов: 63 CH2 CH2 CH2 CH2 CH3 Cr2O3, t°, p + 4H2 CH3 2. Реакция Вюрца-Фиттига: C2H5 Br + 2Na + Br C2H5–2NaBr 3. Дегидрирование циклоалканов: CH2 CH CH2 CH2 CH Ni CH2 CH2 CH2 CH CH CH + 3H2 CH циклогексан бензол 4. Восстановление по Клемменсену: C6H5 CO CH3 [H] C6H5 CH2 CH3 5. Алкилирование бензола галогеналканами или алкенами в присутствии безводного хлорида алюминия: CH2CH3 H + CH3CH2Cl AlCl3 + HCl этилбензол 6. Тримеризация алкинов над активированным углем (реакция Зелинского): 64 3CH CH t°, Сактив. уголь Химические свойства аренов Реакции замещения. В основном это реакции электрофильного замещения. а) Галогенирование: Cl + Cl2 t, FeCl3 + HCl хлорбензол б) Нитрование: NO2 + HNO3 H2SO4 + H2O нитробензол Роль серной кислоты – образование электрофила NO2+. HNO3 + 2H2SO4 + + NO2 + H3O + 2HSO4 - катион нитрония в) Алкилирование (реакция Фриделя – Крафтса): CH3 CH + CH3 CH CH2 AlCl3 CH3 изопропилбензол (кумол) 65 CH3 CH CH3 Алкилирование бензола алкенами CH + CH3CH CH2 AlCl3⋅HCl Пропилен Изопропилбензол (кумол) Реакции присоединения. Ароматические соединения с большим трудом вступают в реакции присоединения. а) Гидрирование. Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении в присутствии металлических катализаторов: + 3H2 t°, p, Ni CH2 CH2 бензол CH2 CH2 CH2 CH2 циклогексан CH3 + 3H2 метилбензол (толуол) CH3 t°, p, Ni метилциклогексан б) Радикальное хлорирование. В случае гомологов бензола более легко происходит реакция радикального замещения атомов водорода в боковой цепи: CH2Cl CH3 + Cl2 + HCl бензилхлорид 66 H H H Cl C C C C C C H + 3Cl2 H H Cl Cl H H Cl Cl H H H H Cl гексахлорциклогексан (гексахлоран) Реакции окисления аренов а) Горение: 2C6H6 + 15O2 12CO2 + 6H2O; б) Окисление КМnO4. Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т. п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений. В отличие от бензола его гомологи окисляются довольно легко. H C H H толуол 3[O] OH C OH OH -H2O C O OH бензойная кислота 67 Классификация заместителей. Понятие об ориентирующем влиянии заместителей В незамещенной молекуле бензола π-электронная плотность равномерно распределена между всеми углеродными атомами, но если в бензольном кольце уже находится хотя бы один заместитель, то неизбежно нарушение распределения π-электронной плотности. В результате кольцо становится поляризованным. Таким образом, реакционная способность углеродных атомов зависит не только от характера атакующего реагента, но и от природы и положения находящегося в ядре заместителя, который ориентирует вхождение нового заместителя в определенное место бензольного кольца. Были выведены специальные правила ориентации, в основу которых положены теоретические соображения о перераспределении π-электронной плотности в бензольном кольце. По влиянию на реакционную способность бензольного кольца все заместители делят на две группы. Заместители I рода: ОН, OR, OCOR, SH, NH2, NHR, Alk, Hal. Эти заместители не имеют кратных связей. Они способны смещать электронную плотность в сторону кольца, т. е. обладают электродонорными свойствами. Облегчая вхождение электрофильных реагентов в бензольное кольцо, эти заместители ориентируют новый заместитель в орто- и пара-положения. При действии нуклеофильных реагентов реакция замещения идет с трудом, а реагент становится в мета-положение. Заместители II рода: NO2, SO3H, C≡N, COR, COOH, COOR, CCl3. Эти заместители содержат двойные и тройные связи. Они смещают электронную плотность от бензольного кольца, т. е. обладают электроноакцепторными свойствами. Эти заместители затрудняют вхождение электрофильных реагентов, ориентируя вновь входящий заместитель в мета-положение. В то же время заместители II рода облегчают реакции с нуклеофильными реагентами, способствуя в этом случае орто- и пара-ориентации. 68 Таким образом, замещение атомов водорода в бензоле происходит по определенным правилам с учетом природы заместителя и атакующего реагента, например: OH OH OH NO2 + HNO3 + NO2 заместитель I рода о-нитрофенол n-нитрофенол Так как заместитель – первого рода, а реагент – нуклеофильный, должен образовываться продукт с мета-ориентацией второго заместителя. Однако такие реакции (затрудняющие действие заместителя) протекают с трудом. NO2 NO2 + HNO3 NO2 заместитель II рода мета-динитробензол Примеры решения задач Пример № 1. Из ацетилена необходимо получить этилбензол. Решение. 1) Реакция тримеризации. При пропускании ацетилена над активированным углем (при 400 °С) образуется смесь продуктов, одним из которых является бензол: 3СН≡СН → С6Н6 69 2) Галогенирование бензола. В присутствии катализаторов – FeCl3 или AlCl3 – хлор или бром не присоединяются к бензолу, но замещают атомы водорода в его молекуле: Br + Br2 + HBr 3) Реакция Вюрца – Фиттига C2H5 Br + 2Na + Br C2H5 – 2NaBr Пример № 2. При сжигании гомолога бензола массой 0,92 г в кислороде получили оксид углерода (IV), который пропустили через избыток раствора гидроксида кальция. При этом образовался осадок массой 7 г. Определите формулу углеводорода и назовите его. Решение. Записываем уравнение реакции между оксидом углерода (IV) и гидроксидом кальция, который взят в избытке: Са(ОН)2 + СО2 → СаСО3 + Н2О. Определяем количество вещества карбоната кальция, полученного в результате реакции: n ( CaCO3 ) = m ( CaCO3 ) 7 = = 0, 07 моль. M ( CaCO3 ) 100 Из уравнения реакции следует: n ( CO2 ) = n ( CaCO3 ) ; n ( CO 2 ) = 0, 07 моль. 70 Вычисляем количество вещества атомарного углерода в оксиде углерода (IV): n ( C ) = n ( CO 2 ) ; n ( C ) = 0,07 моль. Такое же количество вещества атомарного углерода содержалось в исходном углеводороде. Определяем массу углерода: m ( C ) = n ( C ) M ( C ) ; m ( C ) = 0, 07 ⋅12 = 0,84 г. Находим массу водорода, который содержался в углеводороде: m ( H ) = m ( гомолога ) − m ( C ) = 0, 92 − 0,84 = 0, 08 г. Количество вещества атомарного водорода составляет: n(H) = m ( H ) 0, 08 = = 0, 08 моль. 1 M (H) Вычисляем отношение количеств веществ углерода и водорода в соединении: n ( C ) 0, 07 = = 0,875 . n ( H ) 0, 08 Представляем формулу гомолога бензола в виде СхН2х–6. Отношение количеств веществ углерода и водорода в этом веществе равно х: (2х – 6). Следовательно: x = 0,875 . 2x − 6 Отсюда получаем: х = 7, т. е. формула углеводорода С7Н8 CH3 метилбензол (толуол) 71 2.4. Галогенопроизводные углеводородов Галогенопроизводные УВ – это органические молекулы, полученные путем замещения в углеводородах одного или нескольких атомов водорода атомами галогенов. Классификация 1. По радикалу: а) предельные галогенопроизводные, например, CH3Cl хлорметан; б) непредельные, например – СН2 = СНСl хлорэтен. 2. По числу атомов галогенов: а) моногалогенопроизводные: – первичные, например СН3 – СН2 – Сl хлорэтен; – вторичные, например СН3 – СНСl – СН3. 2-хлорпропан Третичные, например СН3 – ССl – СН3 | СН3 2-хлор-2метилпропан б) полигалогенопроизводные СНCl3 трихлорметан. Изомерия и номенклатура Моногалогенопроизводные предельных УВ называются алкилгалогенидами, состав которых можно выразить общей формулой СnH2n+1 X, где Х – это галоген (Hal). В молекулах метана и этана все атомы водорода по положению равноценны, поэтому его замещение галогеном дает только одно галогенопроизводное: H H H C C I H H этилйодид (йодистый этил) Начиная с пропана, можно получить два изомерных галогенопроизводных: 72 СН3 – СН2 – СН2 – I йодистый пропил CH3 – CHI – CH3 вторичный йодистый пропил От бутана еще больше можно произвести изомеров: от бутана – первичный бутилйодид, вторичный бутилйодид; от изобутана – первичный йодистый изобутил и третичный йодистый изобутил: CH3 CH CHI CH3 CI CH3 CH3 1-йод-2-метилпропан CH3 2-йод-2-метилпропан Названия простейших моногалогенопроизводных строят от названий соответствующих одновалентных радикалов (алкилов), прибавляя к названию радикала слова: бромистый, хлористый и т. д. Названия простых двухвалентных радикалов производят от названий соответствующих алкилов, присоединяя к ним суффикс -ен: СН2Сl – CH2Cl этиленхлорид CH3 – CHCl – CH2Cl пропиленхлорид Названия радикалов, получающихся отнятием двух атомов водорода от одного крайнего атома углерода, имеют суффикс -иден: Н3С – СНCl2 хлористый этилиден H3C – CH2 – CHI2 йодистый пропилиден УВ радикалы дигалогенопроизводных, в которых атомы галогена находятся при двух крайних атомах углерода, состоят из ряда остатков СН2, или метиленов, соответственно строятся и их названия: СН2Cl – CH2 – CH2Cl хлористый триметилен CH2Br – CH2 – CH2 – CH2 – CH2Br бромистый пентаметилен 73 Галогенопроизводные, у которых все имевшиеся в молекуле атомы водорода замещены на галоген, называются пергалогенопроизводными: CF2 = CF2 CF3CF3 перфторэтан перфторэтилен Номенклатура ИЮПАК производит названия ГУВ от названий УВ, впереди ставится название галогена и цифра, обозначающая, при каком атоме углерода находится галоген. CH3 – CHCl – CH3 СН3Cl хлорметан 2-хлорпропан Если в УВ присутствует кратная связь, то она определяет начало нумерации: Н2С = СН – СН2 СН2Br 4-бромбутен-1 Способы получения 1. Галогенопроизводные алканов получают в реакциях свободнорадикального замещения (см. пп. 2.1.1). 2. Галогенопроизводные из алкинов получают в реакциях электрофильного присоединения (см. пп. 2.1.4). 3. Из этилового спирта образуется йодоформ: С2Н5ОН + NaОН + I2 → CHI3 + H – COONa + H2O йодоформ Также галогенопроизводные УВ из спиртов получают при взаимодействии с галогеноводородной кислотой в высокой концентрации. С2Н5ОН + HBr + ZnCl2 → C2H5Cl + ZnBr2 + H2O 4. Получение из альдегидов и кетонов O Cl CH3 C + PCl5 → CH3 C Cl + POCl3 H H ацетальдегид 74 1,1-дихлорэтан Химические свойства 1. Образование алканов (см. реакция Вюрца). 2. Образование циклопарафинов: CH2 CH2 CH2 CH2 CH2 CH2 + 2NaCl + 2Na → CH2 CH2 Cl Cl 1,4-дихлорбутан циклобутан 3. Образование эфиров азотной и азотистой кислот под действием высоких температур: C2H5I + AgNO2 → C2H5NO2 или C2H5 – O – NO + AgI йодэтан нитроэтан этилнитрит 4. Взаимодействие со щелочами. В зависимости от условий протекания при взаимодействии со щелочами возможно образование спиртов (SN2) или алкенов (Е2): C2H5Cl + NaOHводный → C2H5ОН + NaCl; (SN2) C2H5Cl + NaOHспиртовый р-р → Н2С = СН2 + Н2О + NaCl; (Е2) 5. При действии на алкилгалогениды магния в среде абсолютного эфира образуются магнийорганические соединения, называемые реактивом Гриньяра: СН3 – СН2 – I + Mg → СН3 – СН2 – MgI этилмагнийиодид Примеры решения задач Пример № 1. Сколько существует индивидуальных веществ состава С3Н5Cl, обесцвечивающих бромную воду? Приведите структурные формулы молекул этих веществ. Решение. С3Н5Cl – это монохлорпроизводное от углеводорода С3Н6. Это вещество обесцвечивает бромную воду, следовательно, имеет в своем составе двойную связь. Три атома углерода могут образовать только неразветвленный углеродный скелет с концевой двойной связью: 75 С – С = С. Структурная изомерия возможна только за счет положения атома хлора относительно двойной связи: СН3 – СН = СНCl; СН3 – СCl = СН2; Cl – СН2 – СН = СН2 1-хлорпропен 2-хлорпропен 3-хлорпропен 1-хлорпропен может существовать в виде цис-трансизомеров: H3C H H H3C Cl H C C транс-1-хлорпропен Cl C C H цис-1-хлорпропен Пример № 2. Синтезируйте из этана фторэтан. Решение. Прямое фторирование приводит к деструкции молекул углеводорода, лучше воспользоваться трифторидом кобальта: 2С2Н6 + CoF3 → 2C2H5F + CoF2 + HF. 76 3. ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ Каждый студент выполняет вариант контрольных заданий, обозначенный двумя последними цифрами номера зачетной книжки. Например, номер зачетной книжки 82520, две последние цифры 20, им соответствует 20 вариант контрольного задания, если номер зачетной книжки 82521, определяем по последней цифре, которой соответствует 1 вариант. Перечень задач для выполнения контрольных работ № варианта 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Номера задач, относящихся к данному варианту 1;21;41;61;81;101;121;141;161;181 2;22;42;62;82;102;122;142;162;182 3;23;43;63;83;103;123;143;163;183 4;24;44;64;84;104;124;144;164;184 5;25;45;65;85;105;125;145;165;185 6;26;46;66;86;106;126;146;166;186 7;27;47;67;87;107;127;147;167;187 8;28;48;68;88;108;128;148;168;188 9;29;49;69;89;109;129;149;169;189 10;30;50;70;90;110;130;150;170;190 11;31;51;71;91;111;131;151;171;191 12;32;52;72;92;112;132;152;172;192 13;33;53;73;93;113;133;153;173;193 14;34;54;74;94;114;134;154;174;194 15;35;55;75;95;115;135;155;175;195 16;36;56;76;96;116;136;156;176;196 17;37;57;77;97;117;137;157;177;197 18;38;58;78;98;118;138;158;178;198 19;39;59;79;99;119;139;159;179;199 20;40;60;80;100;120;140;160;180;200 77 1. Напишите структурные формулы изомерных углеводородов состава С6Н14. Назовите их. Укажите изомеры, содержащие третичные атомы углерода. 2. Напишите структурные формулы изомерных углеводородов состава С8Н18 с шестью углеродными атомами в главной цепи. Назовите их по номенклатуре ИЮПАК. 3. Какой углеводород получается при действии йодистого этила и йодистого изопропила? Напишите уравнение реакции. 4. Какой углеводород получается при действии бромистого пропила и бромистого втор-бутила? Напишите уравнение реакции. 5. Какой углеводород получается при действии бромистого пропила и бромистого изоамила? Напишите уравнение реакции. 6. Назовите по рациональной и систематической номенклатуре следующие углеводороды: CH3 а) CH3 CH3 C CH2 CH2 CH3 CH CH3 б) CH3 C CH CH3 CH3 CH3CH3 CH3CH3 в) CH3 C C CH2 CH3CH3 CH2 CH2 CH CH3 CH3 7. Напишите структурную формулу органического вещества состава С5Н12, если известно, что при его хлорировании получается преимущественно третичное хлорпроизводное, а при нитровании – третичное нитросоединение. Объясните, почему замещение наиболее легко происходит у третичного атома углерода. 8. Получите 3-этилпентан: а) гидрированием непредельного углеводорода; б) восстановлением галогенопроизводного. Сколько изомерных соединений можно использовать для этого в каждом случае? 78 9. Назовите по рациональной и систематической номенклатуре следующие углеводороды: CH3 а) CH CH2 CH2 CH CH3 CH CH3 CH3 CH3 б) CH3 CH3 CH CH2 CH2 CH CH CH3 CH3 C CH3 CH3 C2H5 в) CH3 CH CH2 CH3 CH C2H5 CH2 CH2 CH CH CH3 C2H5 10. Напишите схемы получения изобутана (любым способом) и его нитрование. 11. Какие из углеводородов состава С4Н10, С5Н12, С7Н14, С2Н2, С6Н6, С8Н8, С11Н24 являются предельными, назовите их согласно систематической номенклатуре. 12. Напишите структурные формулы и назовите согласно систематической номенклатуре следующие соединения: тетраметилметан; метилэтилпропилметан; метилдиизопропилметан; ди-трет-бутилметан; метилэтилди-втор-бутилметан; метилтриизобутилметан. 13. Напишите структурные формулы и назовите согласно рациональной номенклатуре следующие соединения: 3-метилгексан; 2,2,4-триметилпентан; 3-метил-3-этилгексан; 2,2,3,4,4пентаметилпентан; 4-метил-4-изопропилгептан; 2,3-диметил-3изопропилнонан. 14. Превратите изобутилбромид в предельный углеводород: а) с тем же строением углеродного скелета; б) с удвоенным числом углеродных атомов. 79 15. Какой объем раствора гидроксида натрия (ρ = 1,1 г/см3) потребуется для поглощения газа, выделяющегося при полном сгорании 2,12 г предельного углеводорода, содержащего 32 водородных атома в молекуле, если в результате образуется кислая соль? Объем измерен при нормальных условиях (н. у.). 16. Напишите структурные формулы всех алканов с пятью атомами углерода в главной цепи, плотность паров которых по водороду равна 50. Назовите их по систематической номенклатуре. 17. Углеводород имеет элементный состав: 82,76 % углерода и 17,24 % водорода (по массе). При хлорировании углеводород образует два изомерных монохлорида – первичный и третичный. Определите строение исходного углеводорода. 18. Газ, образующийся при полном сгорании 0,1 моль предельного углеводорода, пропустили через избыток известковой воды, при этом выпало 60 г осадка. Определите молекулярную формулу и строение предельного углеводорода, если известно, что он содержит один четвертичный атом углерода. 19. При прокаливании смеси массой 49 г, состоящей из ацетата калия и избытка гидроксида калия, выделился газ, прореагировавший при освещении с парами брома. В результате последней реакции образовалось 25,3 г трибромметана. Выход трибромметана составил 50 % от теоретического. Найдите массовые доли веществ в исходной смеси. 20. При взрыве 1 объема газообразного углеводорода прореагировало 2 объема кислорода; при этом образовалась смесь, состоящая из 1 объема СО2 и 2 объемов паров воды (условия измерения одинаковы). Определите формулу алкана. 21. Напишите механизм каталитического окисления (160 °С) тетрадекана. Какие вещества образуются при распаде гидроперекиси? 22. Укажите условия и приведите механизм термического крекинга тетрадекана. Какие пути превращения образующихся радикалов (диспропорционирования, β-распад, соединение) возможны? 80 23. Напишите формулы всех изомеров гептана, в состав которых входят третичные атомы углерода. Назовите их согласно систематической и рациональной номенклатурам. 24. Какие свободные радикалы могут образовываться при бромировании н-бутана, 2-метилбутана? 25. Напишите реакцию мононитрования по Коновалову для н-пентана и 2-метилбутана. Какой углеводород легче вступает в реакцию? 26. Установите строение карбоновой кислоты, натриевая соль которой при сплавлении с гидроксидом натрия образует пропан, а при электролизе – 2,3-диметилбутан. 27. В каком состоянии гибридизации находится атом углерода в следующих частицах: а) + CH 3 ; • СH 3 ; − CH 3 ? 28. Какие из веществ, с которыми вы сталкиваетесь в быту, содержат предельные углеводороды? 29. При синтезе метана по схеме С4Н10 → Х → Y → СН4 укажите промежуточные вещества Х и Y и напишите уравнения реакций. 30. С каким из веществ алканы не реагируют ни при каких условиях: бром; азотная кислота; бромоводород; озон? Напишите возможные реакции. 31. Плотность предельного углеводорода по водороду равна 21. Сколько молей воды образуется при полном сгорании одного моля этого углеводорода? 32. При сгорании предельного углеводорода образовались равные объемы углекислого газа и водяного пара. Установите простейшую формулу алкана. 33. При крекинге предельного углеводорода образовалась смесь двух углеводородов, содержащих одинаковое число атомов углерода. Плотность смеси по водороду равна 28,5. Напишите уравнение крекинга. 34. Какие соединения образуются при действии металлического натрия на 2-хлорпропан, 1-йод-2-метилпропан? Рассмотрите механизм реакции. 81 35. Расположите предельные углеводороды: н-пентан; 2метилбутан; 2,2-диметилпропан в порядке возрастания температуры кипения. Ответ объясните. 36. Какую частицу называют свободным радикалом? Каковы особенности свободного радикала? Сохраняется ли в метилрадикале • CH 3 направление валентных связей? 37. Как физические и химические свойства предельных углеводородов зависят от строения и характера химических связей? 38. Как относятся алканы к воздействию окислителей при низких температурах? Какие продукты реакции образуются при высоких температурах в избытке кислорода? 39. Напишите уравнения реакций с водой следующих магнийорганических веществ: а) СН3 – СН2 – MgBr; б) СН3 – СН – MgBr | СН3 40. Какие углеводороды образуются при полном и частичном гидрировании следующих соединений: а) (СН3)2С = СН2; б) СН3 – С≡С – СН3. 41. Какой объем водорода (н. у.) может присоединить смесь газов массой 15,4 г, которая содержит этилен (массовая доля 54,5 %), пропилен (27,3 %) и бутилен (18,2 %)? Ответ: 10,08 л. 42. Напишите структурные формулы следующих углеводородов: симметричного этилизопропилэтилена; изопропилэтилен; пропилэтилен; 2-метилгептатриен-1,3,5; пентадиен-1,3. 43. Назовите алкены, образующиеся при дегидратации следующего спирта: СН3 – СН2 – СН2 – СН2 – ОН. 44. Напишите уравнения реакции получения этиленового углеводорода из следующего соединения: 2-бром-3-метилгексана. 45. Какие соединения образуются в результате следующих превращений: КОН спирт.р-р Br2 (свет) → А ⎯⎯⎯⎯→ В Пентен ⎯⎯⎯⎯ 82 Объясните механизм реакции получения вещества А. Почему галогены – фтор, хлор, бром, йод – присоединяются к двойной связи с разной скоростью? 46. Какую массу бромной воды с массовой долей брома 1,6 % может обесцветить пропилен объемом 1,12 л (н. у.)? 47. Напишите структурные формулы соединений по их названиям: 3-метил-1-пентен; гексадиен-2,4; 2-метилбутадиен-1,3; пентен-2; 3-метил-4-изопропилгексен-1. 48. Назовите алкен, образующийся при дегидратации спирта: CH3 CH2 CH CH2 OH CH3 49. Написать уравнение реакции получения этиленового углеводорода из соединения 3-йод-2,5-диметилгексана. 50. При гидрировании смеси этана с этиленом массой 5,38 г получили газ массой 6,0 г. Определите массовую долю этилена в исходной смеси. 51. Написать уравнение реакции присоединения йодоводорода к изобутилену, учитывая правило Марковникова. 52. Назовите спирт, который может быть использован для получения алкена следующего состава: 5,5-диметилгексена-1. 53. Назвать алкен, образующийся при дегидратации спирта: CH3 CH3 CH CH2 CHOH CH3 54. Напишите структурные формулы соединений по их названиям: 2,2,5-триметилгексен-3; бутадиен-1,3; 3-метил-2-этилпентен-1; 5-метилгептадиен-1,2; 2,3-диметилпентен-1. 55. Напишите структурные формулы соединений по их названиям: 2,3-диметил-1-бутена; триметилен; этилиден; винил; бутадиен-1,3. 83 56. Напишите структурные формулы изомерных углеводородов этилового ряда следующего состава: С5Н10. Назовите их по рациональной и систематической номенклатуре. 57. Напишите структурные формулы соединений по их названиям: 4,6-диметилгептена-3; изопропилэтилен; метилэтилпропилэтилен; аллен; дивинил. 58. Для 2-этилпентена-1 напишите все возможные: а) гомологи; б) изомеры. Назовите эти соединения. 59. Напишите структурные формулы следующих углеводородов: изобутилэтилен; изопрен; этилизопропилэтилен; триметилэтилен; пропилен. Дайте им названия по другой номенклатуре. 60. Назовите следующие соединения: C2H5 C2H5 а) CH3 CH C CH CH CH2CH3 б) CH3 CH3 CH C C CH CH3 CH3 C2H5 CH3 в) CH3 CH3 C CH CH CH3 CH3 C2H5 CH2 CH3 CH3 г) CH CH3 C CH3 CH3 CH CH3 д) CH3CH CH CH CH3 C2H5 CH2 61. Напишите структурные формулы следующих соединений и назовите по систематической номенклатуре: 3-этилпентен-1; симм-метилизопропилэтилен; 2,2,5-триметилгексен-3; 3,6-диметилгептен-3; несимм-метилизопропилэтилен. 62. При гидрировании ацетилена объемом 672 мл (н. у.) получили смесь этана и этилена, которая обесцвечивает раствор брома в тетрахлориде углерода массой 40 г, массовая доля бро84 ма в котором составляет 4 %. Определите массовые доли углеводородов в полученной смеси. 63. Найдите молекулярную формулу газообразного углеводорода, если при сжигании 5,6 л его (н. у.) было получено 16,8 л оксида углерода (IV) и 13,5 л воды. 64. Определите химическую формулу углеводорода, содержание углерода в котором составляет 85,7 %; плотность вещества по водороду – 28. 65. Продукт взаимодействия непредельного углеводорода с хлором имеет молекулярную массу 113. Найдите формулу этого углеводорода. 66. Сколько граммов дихлорэтана может быть получено из смеси 1 моль этилена и 11,2 г хлора (н. у.)? 67. При пропускании этилена через бромную воду масса склянки с бромом увеличилась на 14 г. Какой объем этилена (при н. у.) поглотился при этом? 68. Какой объем этилена можно окислить кислородом объемом 10 л для получения ацетальдегида? Объемы газов измерены при одинаковых условиях. 69. Для полного сгорания 0,1 моля неизвестного алкена потребовалось 22,4 л кислорода (н. у.). Определите неизвестный алкен, если установлено, что продуктом реакции окисления этого вещества кислым раствором перманганата калия при нагревании является кетон. 70. Каковы причины геометрической изомерии некоторых этиленовых углеводородов? Существуют ли в виде циси транс-изомеров следующие углеводороды: а) бутен-1; б) бутен-2; в) 2-этилпентен-1; г) 2,4-диметилгексен-3? Составьте проекционные формулы цис- и транс-изомеров. В чем состоит отличие понятий «конформация» и «конфигурация»? 71. Какие виды структурной изомерии характерны для алкенов? Напишите структурные формулы изомерных углеводородов этиленового ряда состава С6Н12. Назовите их согласно рациональной и систематической номенклатурам. 85 72. Напишите структурные формулы всех изомеров, которые отвечают формуле С4Н8. 73. Сколько изомерных алкенов соответствует формуле С6Н12? Напишите их структурные формулы и назовите по рациональной и систематической номенклатурам. 74. Рассмотрите механизм реакций взаимодействия пропилена с хлором: а) на свету; б) при нагревании до 450–500 °С. Дайте названия продуктам. 75. Какое из соединений будет легче присоединять бром: этилен или тетраметилэтилен? Дайте объяснение. 76. Назовите следующие соединения: CH3 а) CH3CH2 C CH CH2 C2H5 C2H5 CH3 б) CH3 в) CH3 CH CH3 CH3 C CH2 C CH CH CH3 CH3 CH3 CH3 C CH C CH3 CH3 CH3 CH3 C2H5 г) CH3CH2CH2CH CH C CH2CH3 CH3 д) CH3 CH CH3 CH3 CH C CH2 C2H5 CH CH2 C2H5 CH3 77. Назовите алкены, образующиеся при каталитическом дегидрировании следующих соединений: а) гексан; б) 2-метил86 пентан. Напишите уравнения реакций и укажите условия их протекания. 78. Какие соединения образуются при нагревании с концентрированной серной кислотой следующих спиртов: а) этанол; б) 2-метилпропанол. Объясните механизм сернокислотной дегидратации на примере этанола. 79. Какие спирты необходимо взять для получения: а) несимм-диэтилэтилена; б) 3,4-диметилгексена-2? Напишите уравнения реакций. 80. Какие углеводороды образуются при нагревании со спиртовым раствором щелочи: а) 2-йод-2-метилпентана; б) 1бром пропана? Напишите уравнения реакций и объясните механизм реакций дегидрогалогенирования. 81. Напишите структурные формулы следующих углеводородов: изопропилацетилен; метилэтилацетилен; изобутилацетилен; гексин-1; 2,2-диметилгексин-3. Назовите эти УВ по другой номенклатуре. 82. Назовите по рациональной и систематической номенклатурам следующие соединения: CH3 а) CH C CH CH3 б) CH3 C C CH3 C CH3 CH3 CH3 в) CH3 C C CH3 CH3CH3 д) CH3 C CH CH2 CH3 г) CH3 C C C CH2 CH3 CH3 C C CH CH3 CH3 83. Напишите структурные формулы следующих углеводородов: метил-втор-бутилацетилен, ди-трет-бутилацетилен; 2,787 диметилоктин-5; метилацетилен; диметилацетилен. Назовите их по другой номенклатуре. 84. Напишите структурные формулы следующих углеводородов: 2,6,6-триметилгептин-3; трет-бутилацетилен; метилэтилацетилен; этилидин; гептен-1-диин-4,6. Назовите их по другой номенклатуре. 85. Назовите по рациональной и систематической номенклатурам следующие соединения: а) CH3 CH2 C CH б) CH3 CH C C CH2 CH CH2 CH3 CH3 в) CH3 CH2 CH C C C CH3 C2H5 C2H5 CH3 г) CH3 C C CH CH2 CH3 д) CH3 C CH2 CH2 CH2 CH3 C C CH CH3 CH3 CH3 86. Назовите следующие соединения: а) CH3 CH2 C CH б) CH3 CH C C CH2 C CH CH3 CH3 в) CH C CH2 CH3 CH CH C CH3 CH3 CH3 C2H5 г) CH3 88 C C CH CH2 CH2 CH3 CH3 д) CH3 C C C CH2 CH CH2CH3 CH3 CH3 87. Напишите структурные формулы следующих углеводородов: 4-метил-3-этилпентин-1; аллилен; винилацетилен; пентин-2; 4-метилгексин-2. Назовите их по другой номенклатуре. 88. Напишите структурные формулы следующих углеводородов: 4-метилгексин-2; 2,6-диметилгептин-3; бутин-2; винилацетилен; 3-метилбутин-1. Назовите по другой номенклатуре. 89. Написать структурные формулы следующих углеводородов: метилизобутилацетилен; метилизопропилацетилен; диметилацетилен; 3,3-диметилбутин-1; 4,4-диметилпентин-1. Назовите их по другой номенклатуре. 90. Назовите следующие соединения: а) CH3 CH C C CH2CH3 CH3 CH3 б) CH3 C C C CH CH3 CH3 CH3 CH3 в) C2H5 CH C C C C2H5 г) CH3 CH3 C2H5 C C C C CH2CH3 CH2 д) CH C C CH2 CH C2H5 CH3 CH3 91. Назовите следующие соединения: 89 CH3 CH3 а) CH3 C C CH3 б) CH C CH2 в) CH3CH2CH2 C CH CH3 C2H5 C CH2CH2CH3 CH3 C C CH3 CH3 CH3 г) CH3 C C C CH2 CH2 д) CH C CH CH2CH3 CH CH3 C2H5 C CH2 CH2 C2H5 CH3 92. Какой углеводород получится, если на 3,3-диметилбутин-1 подействовать бромом, а затем избытком спиртового раствора щелочи? 93. Получите любым способом 3-метилпентин-1 и напишите для него уравнения реакций: с водой; с аммиачным раствором серебра. 94. С помощью каких химических превращений можно отличить бутин-1 от бутина-2. 95. Напишите уравнение реакций ацетилена со следующими соединениями в присутствии соответствующих катализаторов: этиловым спиртом, синильной кислотой, уксусным альдегидом. 96. Напишите уравнение реакции этилацетилена со следующими веществами: бромистым водородом; аммиачным раствором окиси серебра; бромом. 90 97. Какие соединения получаются при действии избытка спиртового раствора гидроксида калия на следующие вещества: 1,1-дибромпропан; 2,3-дибромбутан. 98. Какой спирт может быть использован для получения пентина-2. Написать уравнение. 99. Напишите уравнение реакции Кучерова для следующих соединений: пентин-1; изопропилацителен. 100. Написать уравнение реакции взаимодействия с аммиачным раствором хлорида серебра: а) ацетилена; б) метилацетилена. 101. Написать уравнения реакций между: а) бутином-1 и хлороводородом; б) диметилацетиленом и бромом. 102. Какие соединения получаются при действии избытка спиртового раствора гидроксида калия на следующие вещества: 1,1-дибромпропан; 2,3-дибромбутан. 103. Охарактеризуйте третье валентное состояние атома углерода. С помощью атомных орбиталей изобразите строение молекулы ацетилена и этилацетилена. Какова природа тройной связи в ацетиленовых углеводородах с точки зрения современных представлений? 104. Сравните параметры (длину, энергию, поляризуемость) химических связей в молекулах ацетилена и этилена. Объясните имеющиеся отличия. Сравните реакционную способность этих соединений в реакциях присоединения. 105. Объясните причину усиления кислотных свойств молекулы ацетилена по сравнению с молекулами этилена и этана. Приведите примеры уравнений реакций, характеризующих кислотные свойства молекулы ацетилена. 106. Какие из следующих алкинов будут взаимодействовать с аммиачным раствором оксида серебра: метилацетилен; метилизопропилацетилен; пропилизопропилацетилен? Приведите уравнения реакций. 107. Расположите следующие ацетиленовые углеводороды в порядке ослабления их кислотных свойств: пропин, этин, 3хлорпропин, 3-метилбутин-1. Дайте объяснение. 91 108. С помощью каких качественных реакций можно различить: а) бутин-2 и бутан; б) бутин-1, бутин-2 и бутен-1? 109. Какие изменения (валентное состояние атома углерода и его электроотрицательность, валентные углы, прочность и длина углерод-углеродной связи) претерпевает молекула ацетилена при последовательном гидрировании до этилена и далее – до этана? На каком этапе гидрирование протекает легче и почему? 110. Какие соединения образуются при частичном и полном гидрировании: метилацетилена; бутина-1? Напишите уравнения реакций и укажите условия протекания. 111. Какие соединения образуются при частичном и полном гидрировании: диизопропилацетилена; пентина-2? Напишите уравнения реакций и укажите условия протекания. 112. Напишите реакции избытка спиртового раствора гидроксида калия со следующими соединениями: а) 1,1-дибромбутан; б) 1,1-дихлор-3,3-диметилбутан. Назовите продукты реакции. 113. Какова структурная формула углеводорода С6Н10, присоединяющего две молекулы брома и не реагирующего с аммиачным раствором гидроксида серебра? При его гидратации в условиях реакции Кучерова образуется смесь метилизобутилкетона и этилизопропилкетона. 114. Напишите реакции избытка спиртового раствора гидроксида калия со следующими соединениями: а) 2,2-дибромбутан; б) 3,4-дибром-2-метилгептан. Назовите продукты реакции. 115. Напишите уравнения реакций получения: метилэтилацетилена; этилацетилена, пентина-1. 116. Напишите уравнения реакций получения: диизопропилацетилена; 4-метил-4-этилгексина-2; винилацетилена. 117. Установите строение углеводорода н-С5Н8, если это вещество присоединяет две молекулы брома, а при взаимодействии с аммиачным раствором гидроксида серебра дает осадок, взрывающийся при нагревании. 92 118. Определите строение вещества состава С4Н6, которое при энергичном окислении хромовой смесью образует только уксусную кислоту. 119. Какой ацетиленовый углеводород можно получить из 3-хлорпентана? Напишите уравнения реакций. 120. Определите массовую долю примесей в техническом карбиде кальция массой 80 г, если из него получено 26,88 л (при н. у.) ацетилена. 121. Напишите структурные формулы изомерных диеновых углеводородов С5Н8. Назовите их. Обратите внимание на цис-транс-изомерию. 122. Напишите структурные формулы следующих углеводородов: 2-метилбутадиен-1,3; 3,4-диэтилгексадиен-2,4; 2,5-диметилгексадиен-1,5; 3,3-диметилпентадиен-1,4; 2,7-диметил-3этилоктадиен-3,5. 123. Назовите следующие соединения: а) CH2 CH C CH2 б) CH3 CH CH CH CH CH3 в) CH3 д) CH2 CH2 CH C C CH3 г) CH3 CH CH2 C CH3 CH CH2 CH CH2 CH3 124. Назовите углеводороды: а) СН2 = С = СН – СН3 б) СН2 = СН – СН = СН2 в) СН2 = СН – СН = СН – СН3 г) CH2 C CH CH CH3 CH3 д) СН2 = СН – СН2 – СН = СН2 125. Напишите структурные формулы и назовите согласно номенклатуре IUPAC следующие углеводороды: изопрен; дивинил; диаллил; аллен. 126. Напишите уравнения реакций с 1 молем брома: а) дивинила; б) гексадиена-1,5. 93 127. Какие продукты образуются при взаимодействии с 1 молем бромоводорода (в отсутствие перекисей и кислорода при комнатной температуре): а) 2,3-диметилбутадиена; б) 4метилпентадиена-1,4? 128. Сколько миллилитров водорода (н. у.) максимально может присоединиться к 16,4 г гексадиена-2,4? В каких условиях следует проводить реакцию? 129. Напишите уравнения реакций озонирования с последующим гидролизом озонида следующих веществ: а) бутидиен1,3; б) 3,3-диметилпентадиен-1,4. 130. Напишите уравнения реакций озонирования с последующим гидролизом озонида следующих веществ: а) 2,5-диметилгексадиен-2,4; б) гексадиен-2,5. 131. Получите диеновые углеводороды из следующих галогенпроизводных алкенов: а) винилхлорида; б) 3-хлорпентена-1. 132. Сколько литров бутадиена-1,3 можно получить из 100 л 96%-го этилового спирта (ρ = 0,8 г/мл)? 133. Составьте структурные формулы изомерных диенов состава С5Н8. 134. Сколько миллилитров водорода (н. у.) максимально может присоединиться к 16,4 г гексадиена? В каких условиях следует проводить реакцию? Какое вещество в результате образуется? 135. Установите структурную формулу углеводорода состава С6Н10, если при его восстановлении металлическим натрием в спирте образуется углеводород, при озонолизе которого получается смесь уксусного и изомасляного альдегидов. 136. Дайте определения понятия «энергия сопряжения». Каковы значения энергии сопряжения бутадиена-1,3? 137. Осуществите следующие превращения: СН2 = СН – СН = СН2 → СН2Cl – CHBr – CHBr – CH3 СН2 = СН – СН = СН2 → СН2Br – CH2 – CHCl – CH2Br 138. Составьте уравнение реакции полимеризации пентадиена-1,3. 94 139. Напишите структурные формулы диеновых углеводородов состава С6Н10. Для каких из них возможна геометрическая изомерия? 140. Предложите схему синтеза хлоропрена из неорганических соединений. 141. Какие виды структурной изомерии встречаются у галогеналканов? Напишите и назовите все изомерные соединения состава С5Н11Br. 142. Используя реакцию нуклеофильного замещения, получите из бромметана: а) этанол; б) метилэтиловый эфир. 143. На примере реакции 2-бром-2-метилбутана с водным раствором щелочи рассмотрите механизм реакции нуклеофильного замещения S N1 . ( ) 144. На примере реакции бромэтана с водным раствором щелочи рассмотрите механизм реакции нуклеофильного замещения S N 2 . ( ) 145. Используя реакцию нуклеофильного замещения, получите из бромметана: а) метиламин; б) нитрометан. 146. Напишите уравнения реакций постепенного замещения атомов водорода хромом в молекулу этана. В каких условиях протекает реакция? Каков ее механизм? 147. Напишите уравнения реакций при комнатной температуре соляной кислоты со следующими алкенами: пропен, бутен-2, бутен-1, 2-метилпропен. На примере 2-метилпропена рассмотрите механизм реакции. 148. Из каких ненасыщенных соединений можно получить: а) 2-бром-2-метилбутан; б) 2,2-дихлорпропан; в) 2,3-дибромбутан? Напишите уравнения реакций. 149. Из ацетилена получите: а) хлористый винил; б) трихлорэтилен. 150. Напишите уравнения реакций получения всеми возможными способами 2-бромпропана. 95 151. Напишите структурные формулы соединений: а) 3-метил-2-хлорпентана; б) 2,2-диметил-3-хлоргексана; в) хлористого тетраметилена; г) 3-хлорбутена-1; д) 4-бром-4-метилгексена-2. Какие из них имеют цис-транс-изомеры? 152. Напишите структурные формулы галогенпроизводных С6Н12Br, содержащих бром у третичного атома углерода. Назовите их. 153. Напишите структурные формулы соединений: а) 2-метил-3-хлорбутан; б) втор-бутилхлорид; в) 3-бром-2,4-диметилгексан; г) трет-бутилхлорид; д) 1-бром-4-метил-3-этилгептан; е) изопропилхлорид; ж) 1,2,2-трифторпропан. 154. Составьте формулы монохлорпроизводных пропана, бутана и изобутана. Назовите их и отметьте среди них первичные, вторичные и третичные хлоралканы. 155. Напишите структурные формулы и назовите все соединения состава С4Н8Br2. Укажите вицинальные и геминальные дибромбутаны. 156. Напишите структурные формулы соединений: а) 5бром-3-метилпентен-1; б) цис-2,3-дибромбутен-2; в) винилхлорид; г) 5-фторпентин-1; д) 3-бром-1-пентен-4-ин; е) 3-бром-4метилпентен-1. 157. Напишите структурные формулы соединений: а) аллилхлорид; б) транс-2,3-дибромбетен-2; в) 1,1,2,2-тетрафторэтен; г) 2-бром-3-метил-1-хлорпентен-2; д) 2-хлор-1,3-бутадиен; е) 3-метил-3-хлор-1,5-гексадиен. 158. Дайте названия согласно систематической номенклатуре следующим соединениям: а) СН2 = СН – СН2 – Br б) C3H7 CH CHBr CH CH CH2 в) СHF2 – CH2 – CH = CH – C – (CH3)2 – CH2 – F г) CH2 = C(CH3) – CH2 – CH2 – Br д) CH3 – CHCl – CH(CH3) – C ≡ CH 96 CH2 159. Дайте названия согласно систематической номенклатуре следующим соединениям: а) CH3 CH2 CH CH2 Cl б) I – CH2 – CH2 – Br в) CH3 CH3 CH CH2 CHBr CH3 г) CCl3 – CCl3; CH3 д) CH3 – CHCl – CH2 – CHBr – CH2 – CHBr – CH2 – CH3. 160. Сколько дифторпроизводных можно получить из пропана, пропилена, пентина-2? Напишите структурные формулы соединений и назовите их. 161. Изобразите структурные формулы следующих веществ: а) 1,1,2-триметилциклопентан; б) 1,3-циклопетадиен; в) изопропилциклогексан; г) 3,5-диметил-1,3-циклогексадиен; д) 1,3,5,7циклооктатетраен. 162. Назовите вещества, формулы которых приведены: 1) 2) CH3 3) 4) Br 5) Br 163. В чем причина устойчивости циклоалканов с большими размерами циклов? Объясните это явление на примере циклопентана и циклогексана. 164. Какие вещества образуются при взаимодействии с натрием: а) 1,3-дихлорпропана; б) 3,6-дихлоргептана? Напишите уравнения реакций. 165. Какие вещества образуются при взаимодействии с натрием: а) 2,5-дибромгептана; б) 1,4-дибромпентана? Напишите уравнения реакций. 166. Составьте формулы изомерных циклоалканов состава: а) С4Н8; б) С5Н10. Назовите эти вещества. Укажите число структурных изомеров для гомологов каждого из циклоалканов. 97 167. Напишите структурные формулы цис-1,2-дибромциклопропана и транс-1,3-диметилциклобутана. 168. Изобразите проекционные формулы всех возможных цис- и транс-изомеров следующих соединений: а) 1,2-диметилциклопропан; б) 1,2-циклобутан. 169. Изобразите проекционные формулы всех возможных цис- и транс-изомеров следующих соединений: а) 1,2,3-триметилциклопропан; 1,3-дихлорциклопентан. 170. Напишите структурные формулы изомерных циклоалканов состава С6Н12 с шестичленным, пятичленным и четырехчленным кольцом. Назовите их. 171. Напишите структурные формулы всех стереоизомерных циклобутандикарбоновых кислот. 172. Получите из соответствующих ациклических дигалогенопроизводных: а) метилциклопропан; б) 1,2-диметилциклобутан. 173. Напишите уравнения реакций гидрирования циклопропана и циклопентана. Сравните условия протекания данных реакций, объясните причину различий. 174. Напишите и назовите все изомеры в ряду циклобутана с брутто-формулой С8Н16. Обратите внимание на цис-трансизомерию. 175. Напишите уравнение реакции окисления циклогексана кислородом воздуха, укажите условия реакции. Назовите продукты реакции. Какое вещество образуется при дальнейшем окислении продуктов реакции азотной кислотой? 176. Какие вещества образуются при взаимодействии метилциклопентана и циклогексана с азотной кислотой? Напишите уравнения реакций и назовите полученные продукты. 177. Какие дигалогенопроизводные надо ввести в реакцию с цинковой пылью для получения: а) 1,1-диметилциклопропана; б) метилциклобутана. 178. Какие дигалогенопроизводные надо ввести в реакцию с цинковой пылью для получения: а) 1,2-диметилциклопропана; б) этилциклопропана. 98 179. Каким образом с помощью химических реакций различить пентен-1, метилциклобутан и циклопентан? 180. Напишите уравнения реакций циклопентана с водным раствором KMnO4: а) при комнатной температуре; б) при нагревании. 181. Смесь бензола и стирола некоторой массы обесцвечивает бромную воду массой 500 г с массовой долей брома 3,2 %. При сжигании смеси той же массы выделился оксид углерода (IV) объемом 44,8 л (н. у.). Определите массовые доли бензола и стирола в смеси. 182. Смесь бензола с циклогексеном массой 4,39 г обесцвечивает бромную воду массой 125 г с массовой долей брома 3,2 %. Какая масса воды образуется при сжигании в кислороде той же смеси массой 10 г? 183. Бензол, полученный дегидрированием циклогексана объемом 151 мл и плотностью 0,779 г/мл, подвергли хлорированию при освещении. Образовалось хлорпроизводное массой 300 г. Определите выход продукта реакции. 184. При бромировании бензола в присутствии бромида железа (III) получили бромоводород, который пропустили через избыток раствора нитрата серебра. При этом образовался осадок массой 7,52 г. Вычислите массу полученного продукта бромирования бензола и назовите этот продукт. 185. Из ацетилена объемом 3,36 л (н. у.) получили бензол объемом 2,5 мл. Определите выход продукта (ρбензола = 0,88 г/мл). 186. Ароматический углеводород, являющийся гомологом бензола, массой 5,3 г сожгли, получив оксид углерода (IV) объемом 8,96 л (н. у.). Определите формулу углеводорода. 187. Какой объем воздуха, измеренный при нормальных условиях, потребуется для полного сгорания 1,4-диметилбензола массой 5,3 г? Объемная доля кислорода в воздухе составляет 21 %. 188. Какой объем водорода, измеренный при нормальных условиях, образуется при циклизации и дегидрировании н99 гексана объемом 200 мл и плотностью 0,66 г/мл? Реакция протекает с выходом 65 %. 189. При дегидрировании этилбензола массой 4,24 г получили стирол. Выход продукта реакции составил 75 %. Какую массу раствора брома в тетрахлориде углерода может обесцветить полученный стирол, если массовая доля брома в растворе составляет 4 %? 190. При пропускании 30,24 л ацетилена над углем в качестве катализатора (при 65 °С) образовалось вещество, горящее коптящим пламенем. Сколько граммов вещества образовалось, если выход реакции составляет 80 %? 191. При взаимодействии смеси этилового спирта и фенола с избытком бромной воды выделилось 33,1 г осадка. Такая же масса смеси может прореагировать с 13,8 г металлического натрия. Каков состав исходной смеси в граммах? 192. Объясните, почему реакция Фриделя – Крафтса 1-хлор2-метилпропана с бензолом дает только трет-бутилбензол? 193. Почему 1,3,5-трибромбензол нельзя получить прямым бромированием бензола? 194. Газ, выделившийся при взаимодействии 3,2 кг технического карбида кальция, содержащего 30 % примесей, с избытком воды, пропустили под давлением над активированным углем при температуре 600 °С. Сколько граммов бензола было получено, если его выход составил 70 %? 195. Сколько изомерных гомологов бензола может отвечать формуле С9Н12? Напишите структурные формулы и назовите их. 196. При бромировании 78 г бензола получено 80 г бромбензола. Рассчитайте выход продукта в процентах от теоретически возможного. 197. Напишите структурные формулы всех изомерных монобромпроизводных пропилбензола и назовите их. 198. Напишите структурные формулы всех изомерных галогенопроизводных ароматического ряда состава С6Н4Cl2. Назовите их согласно систематической номенклатуре. 100 199. Сколько литров хлора необходимо для получения 3 т хлорбензола из бензола? 200. Напишите структурные формулы всех изомерных галогенопроизводных ароматического ряда состава С7Н7Br. Назовите их согласно систематической номенклатуре. 101 БИБЛИОГРАФИЧЕСКИЙ СПИСОК Основная литература 1. Артеменко, А.И. Органическая химия / А.И. Артеменко. – М. : Высшая шк., 2007. – 559 с. 2. Грандберг, И.И. Органическая химия / И.И. Грандберг. – М. : Дрофа, 2004. – 672 с. 3. Смит, В.А. Основы современного органического синтеза / В.А. Смит, А.Д. Дильман. – М. : Бином. Лаборатория знаний, 2011. – 750 с. 4. Хаханина, Т.И. Органическая химия / Т.И. Хаханина, Н.Г. Осипенкова. – М. : Высшее образование, 2010. – 396 с. 5. Курц, А.Л. Задачи по органической химии / А.Л. Курц. – М. : Бином. Лаборатория знаний, 2009. – 264 с. 6. Денисов, В.Я. Органическая химия / В.Я. Денисов, Д.Л. Мурышкин, Т.В. Чуйкова. – М. : Высшая школа, 2009. – 544 с. 7. Артеменко, А.И. Практикум по органической химии / А.И. Артеменко, И.В. Тикунова, Е.К. Ануфриев. – М. : – Высшая школа, 2001. – 187 с. 8. Иванов, В.Г. Сборник задач и упражнений по органической химии : учеб. пособие / В.Г. Иванов, О.Н. Гева, Ю.Г. Гаверова. – М. : Академия, 2007. – 320 с. Дополнительная литература 1. Артеменко, А.И. Справочное руководство по органической химии / А.И. Артеменко, И.В. Тикунова, В.А. Малеванный. – М. : – Высшая школа, 2001. – 145 с. 2. Сидоров, В.И. Химия в строительстве / В.И. Сидоров. – М. : НПИКЦ, 2007. – 312 с. 102 ОГЛАВЛЕНИЕ Введение ....................................................................................... 3 1. Теоретические основы органической химии ....................... 5 1.1. Теория химического строения А.М. Бутлерова ................ 5 1.1.1. Изомерия. Виды изомерии........................................ 7 1.1.2. Состояние валентных электронов в атоме углерода. Гибридизация ....................................................12 1.1.3. Характер химических связей в органических соединениях .......................................................................15 1.1.4. Взаимное влияние атомов в молекулах органических соединений .................................................18 1.2. Классификация реакций в органической химии ..............20 1.3. Классификация органических соединений ......................22 1.4. Общее понятие о номенклатуре органических соединений ...............................................................................25 1.5. Примеры решения задач ...................................................26 2. Углеводороды (УВ) .................................................................29 2.1. Алифатические углеводороды ..........................................29 2.1.1. Предельные или насыщенные УВ (парафины, алканы) ...............................................................................29 2.1.2. Непредельные (ненасыщенные) УВ ряда этилена (алкены, олефины) ...............................................39 2.1.3. Диеновые УВ (алкадиены).......................................46 2.1.4. Непредельные УВ ряда ацетилена (алкины)...........52 2.2. Алициклические углеводороды (циклоалканы)...............57 2.3. Ароматические углеводороды (арены).............................61 2.4. Галогенопроизводные углеводородов ..............................72 3. Задачи для самостоятельного решения ...............................77 Библиографический список ....................................................102 103 Учебное издание Наталья Валерьевна Субботина Ольга Александровна Зубкова Дмитрий Алексеевич Коноплянский ОРГАНИЧЕСКАЯ ХИМИЯ. ЗАДАЧИ И УПРАЖНЕНИЯ ЧАСТЬ I. УГЛЕВОДОРОДЫ Учебное пособие Под редакцией Н.В. Субботиной Редактор Е.А. Кулешова Технический редактор Н.В. Удлер Подписано в печать 31.10.2011. Формат 60×84/16. Бумага офсет. Гарнитура Таймс. Усл. печ. л. 6,05. Уч.-изд. л. 5,47. Тираж 150 экз. Зак. № 367. Изд-во ТГАСУ, 634003, г. Томск, пл. Соляная, 2. Отпечатано с оригинал-макета в ООП ТГАСУ. 634003, г. Томск, ул. Партизанская, 15. 104