Лекция 5 Полярография и анодная вольтамперометрия
advertisement
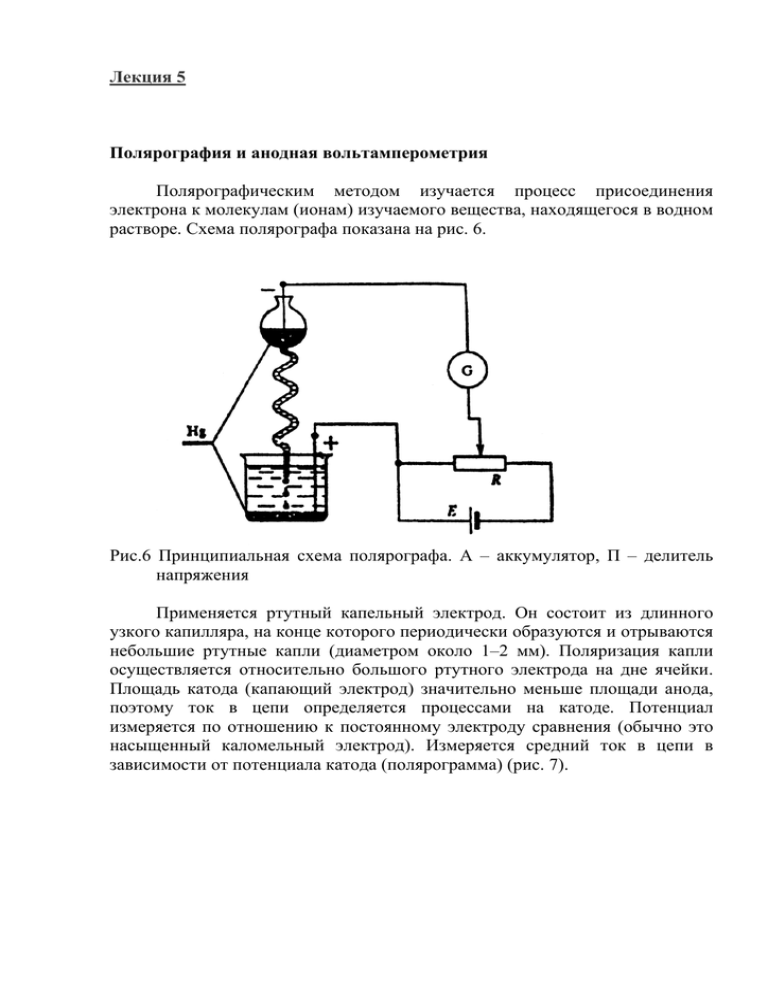
Лекция 5 Полярография и анодная вольтамперометрия Полярографическим методом изучается процесс присоединения электрона к молекулам (ионам) изучаемого вещества, находящегося в водном растворе. Схема полярографа показана на рис. 6. Рис.6 Принципиальная схема полярографа. А – аккумулятор, П – делитель напряжения Применяется ртутный капельный электрод. Он состоит из длинного узкого капилляра, на конце которого периодически образуются и отрываются небольшие ртутные капли (диаметром около 1–2 мм). Поляризация капли осуществляется относительно большого ртутного электрода на дне ячейки. Площадь катода (капающий электрод) значительно меньше площади анода, поэтому ток в цепи определяется процессами на катоде. Потенциал измеряется по отношению к постоянному электроду сравнения (обычно это насыщенный каломельный электрод). Измеряется средний ток в цепи в зависимости от потенциала катода (полярограмма) (рис. 7). Рис.7 Полярограмма При определенном потенциале ЕB (потенциал выделения) начинается восстановление молекул исследуемого вещества. С увеличением потенциала сила тока резко возрастает. При дальнейшем увеличении потенциала устанавливается стационарный предельный ток, в результате полная зависимость тока от потенциала имеет форму волны, которая характеризуется предельным током Iпр и потенциалом полуволны восстановления Е1/2вос, при котором ток I = 0,5Iпр. Ток Iпр определяется концентрацией реагирующего вещества, а Е1/2 зависит только от его природы. Потенциал полуволны позволяет важнейший молекулярный параметр – сродство к электрону Еэс (в единицах эВ), которое представляет энергию, выделяющуюся (положительное сродство) или поглощающуюся (отрицательное сродство) при присоединении к молекуле (или иону) электрона в вакууме: Еэс = Е1/2вос + Еэл,. Здесь Еэл – энергия электрода сравнения относительно вакуума, для насыщенного каломельного электрода Еэл = 4,64 эВ. Процесс окисления молекул (ионов) изучается методом анодной вольтамперометрии. Этот метод аналогичен методу полярографии с той разницей, что в этом случае снимается вольт-амперная характеристика процесса на аноде, в качестве которого используется платина или графит. Из потенциала полуволны окисления Е1/2ок получают величину потенциала ионизации Iпи – энергии, которая затрачивается для удаления электрона из молекулы: Iпи = Е1/2ок + Еэл. Потенциал ионизации и сродство к электрону являются важнейшими характеристиками молекул, определяющими их донорно-акцепторные, оптические, электрические и многие другие свойства. Спектральные методы Спектральные методы основаны на взаимодействии электромагнитного излучения с веществом, что приводит к поглощению излучения или его эмиссии. Электромагнитное излучение характеризуется длиной волны (частотой), энергией кванта, поляризацией. В зависимости от частоты (энергии кванта) электромагнитное излучение возбуждает различные атомные и молекулярные моды. В таблице даны характеристики электромагнитного излучения различных частотных диапазонов, характер взаимодействия с веществом и методы регистрации. Общим для всех видов электромагнитного излучения является закон поглощения: I = I0exp(-kd), где I – интенсивность излучения прошедшего через вещество, толщиной d, I0 – интенсивность падающего излучения, k – коэффициент поглощения. Электронные спектры поглощения и люминесценции Различные области электронного поглощения: ВУФ, УФ, видимый свет, ближнее ИК излучение. Измерительные приборы спектрофотометры и спектрофлуориметры. Чувствительные элементы в этих приборах – электронные фотоумножители и полупроводниковые детекторы. Спектр поглощения состоит из полос, характеристиками которых являются положение максимума на шкале длин волн (строгое соответствие данному соединению), интенсивность максимума (вероятность электронного перехода), произведение коэффициента экстинкции на полуширину спектра (сила осциллятора, момент перехода). f о→в = 4,32 × 10 −9 ν2 ∫ ε ν dν ≈ ∆ν1/2εмакс ν1 fо→в – сила осциллятора перехода из основного состояния в возбужденное, ∆ν1/2 – полуширина полосы поглощения в см-1, εмакс – молярный коэффициент поглощения в максимуме полосы, л×моль-1×см-1. Изосбестические точки в спектрах. Синглетные и триплетные состояния молекул, основное и возбужденные состояния (рис. 8). Рис.8 Основное и возбужденные состояния молекул. Синглет-синглетное поглощение. Принцип Франка–Кондона. Типы переходов в органических соединениях: σ →σ *, π →π *, n→σ *, n→π *. Интекомбинационный синглет-триплетный переход (рис. 9). Рис.9 Схема электронных переходов в молекуле Триплет-триплетное поглощение. Связь между строением молекул и электронными спектрами поглощения. Время жизни возбужденных Излучение Длина волны М γ-лучи 10-13-10-11 Энергия кванта ЭВ 107-105 Рентгеновские лучи 10-11-10-8 105-102 Характер взаимодействия с веществом и методы регистрации Взаимодействие с электронами внутренних орбиталей атомов и молекул (регистрация ионизации и возбуждения атомов и молекул) Взаимодействие с электронами внутренних орбиталей атомов и молекул Ультрафиолетовое 10-8-7×10-6 и видимое (λ = 10-700 нм) излучение 102-1,7 Инфракрасное излучение 7×10-6-10-4 (ν = 14000-100 см-1) 1,7-0,012 Микроволновое и радиоволновое излучение > 10-3 (ν < 3×1011 Гц) < 10-3 (регистрация ионизации и возбуждения атомов и молекул) Взаимодействие с электронами внешних орбиталей атомов и молекул (поглощение излучения и люминесценция) Взаимодействие с колебательными модами атомов и молекул (ИКспектроскопия) Взаимодействие с вращательными модами молекул, спиновыми состояниями электронов и ядер (ЭПР и ЯМР спектроскопия) состояний. Различные механизмы дезактивации возбужденных состояний – переходы внутримолекулярные безызлучательные, излучательные, с разрывом химической связи и межмолекулярный перенос энергии. Влияние заместителей, батохромный и гипсохромный сдвиг в спектрах. Флуоресценция и фосфоресценция. Образование возбужденных состояний в ходе химических реакций и при рекомбинации зарядов. Хемилюминесценция и электролюминесценция. Инфракрасные спектры поглощения Поглощение в ИК–области спектра связано с возбуждением колебательных уровней молекулы. Квантование колебательной энергии. Принцип Франка–Кондона. Связь ширины полосы колебательного спектра с геометрией молекулы в возбужденном состоянии. Характеристические частоты, соответствующие определенным связям и атомным группировкам в молекулах. Характерные интервалы частот: для валентных колебаний связей X–H (X = Si, P, S, C, N, O) 2000–4000 cм-1, для валентных колебаний двойных связей C=C, C=N, N=N, C=O 1500–1950 см-1, для валентных и деформационных колебаний простых связей X–Y 600-1500 см-1. Последний интервал содержит большое число хорошо определенных максимумов поглощения и используется для идентификации молекул разнообразных веществ. ИК–спектры снимаются на ИК спектрофотометрах. Чувствительными элементами в них являются тепловые детекторы – болометры. ИК–спектры используются для определения химической структуры соединений, так как каждая группа атомов имеет характерное поглощение, а также для количественной оценки соединений в различных смесях, тогда как электронные спектры поглощения и люминесценции дают сведения об электронной структуре, энергетических энергетических параметрах молекул и веществ. уровнях и Спектры комбинационного рассеяния Колебательные спектры, также как ИК–спектры. Они возникают при неупругом рассеянии света молекулами. Неупругими называются процессы, в которых происходит передача энергии от одной из сталкивающихся систем к другой. В случае комбинационного рассеяния (КР) свет может передать энергию молекуле, возбудив один или несколько типов ее вращательного или колебательного движения, или, наоборот, может приобрести энергию от молекулы, если эти внутренние движения уже возбуждены. Поскольку внутренние движения квантованы, передача энергии может происходить определенными порциями, поэтому в рассеянном спектре содержатся частоты, сдвинутые на дискретные величины по отношению к частоте падающего света. Спектры комбинационного рассеяния (КР) являются эмиссионными спектрами, их получают, облучая образец интенсивным монохроматическим светом (предпочтительнее использование лазеров) и разлагая отраженный свет в спектрометре. В отраженном свете наблюдается линия монохроматического света ν0 и, кроме того, ряд слабых спектральных линий ν1, ν2, ν3, , νк ν0, расположенных симметрично относительно ν0. Разности νк – ν0 соответствуют характеристическим колебательным частотам молекулы. Следует подчеркнуть, что ИК-полосы регистрируются в видимой области спектра (длина волны монохроматического света), поэтому регистрация колебательных частот КР методом более быстрая и точная, чем ИК-спектроскопией.


