наноструктуры на основе частиц взрывного синтеза и белковых
advertisement
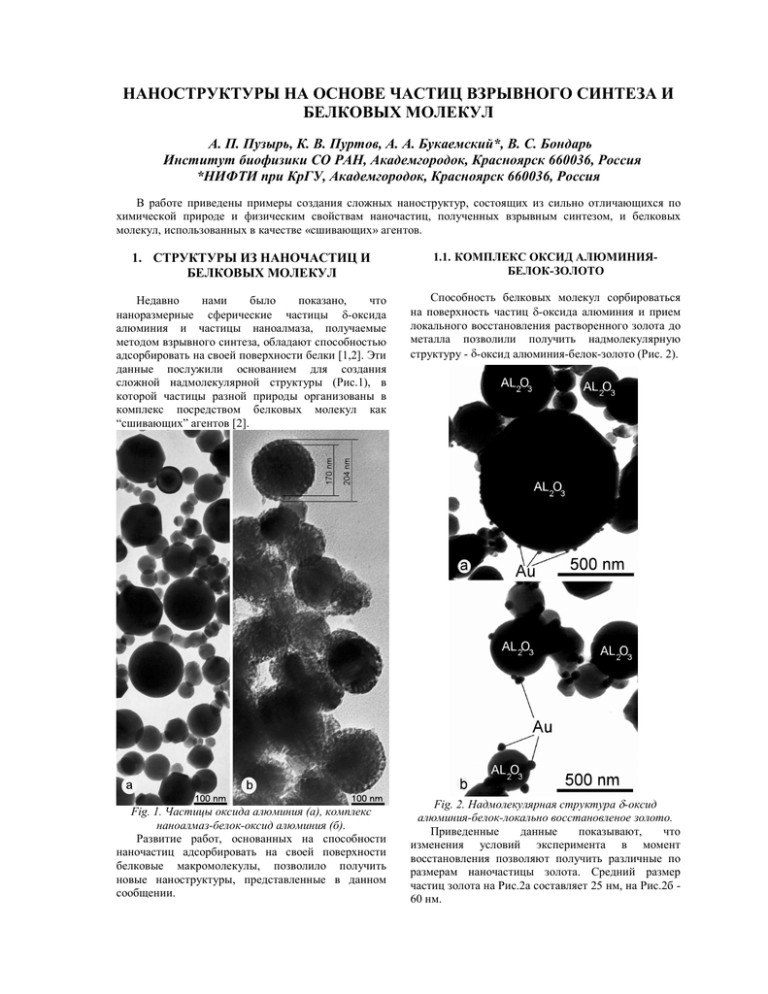
НАНОСТРУКТУРЫ НА ОСНОВЕ ЧАСТИЦ ВЗРЫВНОГО СИНТЕЗА И БЕЛКОВЫХ МОЛЕКУЛ А. П. Пузырь, К. В. Пуртов, А. А. Букаемский*, В. С. Бондарь Институт биофизики СО РАН, Академгородок, Красноярск 660036, Россия *НИФТИ при КрГУ, Академгородок, Красноярск 660036, Россия В работе приведены примеры создания сложных наноструктур, состоящих из сильно отличающихся по химической природе и физическим свойствам наночастиц, полученных взрывным синтезом, и белковых молекул, использованных в качестве «сшивающих» агентов. 1. СТРУКТУРЫ ИЗ НАНОЧАСТИЦ И БЕЛКОВЫХ МОЛЕКУЛ 1.1. КОМПЛЕКС ОКСИД АЛЮМИНИЯБЕЛОК-ЗОЛОТО Недавно нами было показано, что наноразмерные сферические частицы δ-оксида алюминия и частицы наноалмаза, получаемые методом взрывного синтеза, обладают способностью адсорбировать на своей поверхности белки [1,2]. Эти данные послужили основанием для создания сложной надмолекулярной структуры (Рис.1), в которой частицы разной природы организованы в комплекс посредством белковых молекул как “сшивающих” агентов [2]. Способность белковых молекул сорбироваться на поверхность частиц δ-оксида алюминия и прием локального восстановления растворенного золота до металла позволили получить надмолекулярную структуру - δ-оксид алюминия-белок-золото (Рис. 2). Fig. 1. Частицы оксида алюминия (а), комплекс наноалмаз-белок-оксид алюминия (б). Развитие работ, основанных на способности наночастиц адсорбировать на своей поверхности белковые макромолекулы, позволило получить новые наноструктуры, представленные в данном сообщении. Fig. 2. Надмолекулярная структура δ-оксид алюминия-белок-локально восстановленое золото. Приведенные данные показывают, что изменения условий эксперимента в момент восстановления позволяют получить различные по размерам наночастицы золота. Средний размер частиц золота на Рис.2а составляет 25 нм, на Рис.2б 60 нм. Увеличение количества восстанавливающих центров на единицу поверхности частицы оксида алюминия и исследование прочности сцепления наночастиц золота, образующихся на структуре δоксид алюминия-белок, составляют предмет отдельного исследования. 1.2. КОМПЛЕКС ОКСИД АЛЮМИНИЯНАНОАЛМАЗ-ОБЕЛИН Была показана возможность сорбции на частицы наноалмаза не только апообелина, но и его активного фермент-субстратного комплекса (обелина). При этом, сорбированный на частицы обелин сохраняет ферментативную активность. Было показано также, что белки могут адсорбироваться не только на поверхность частиц оксида алюминия, но и на окисную пленку, образующуюся после нанесения алюминия на подложку. Эти данные явились предпосылкой для создания двумерной (плоской) структуры. Fig. 3. Принципиальная схема монослойного расположения частиц наноалмаза с адсорбированным белком (обелином) на плоской подложке. Кинетика биолюминесцентной реакции может свидетельствовать о распределении частиц, адсорбированных на поверхности подложки. В случае, если частицы наноалмаза с сорбированным белком расположены на поверхности подложки в виде монослоя (Рис.3), то кинетика световой эмиссии обелина не должна отличаться от таковой в суспензии частиц с сорбированным белком (Рис.4а). Однако, кинетика биолюминесцентной реакции, регистрируемая при обработке подложки ионами кальция, имеет более медленную динамику (Рис.4б). Исходя из кинетики световой эмиссии и результатов, приведенных на рисунке 1б, следует, что частицы наноалмаза на поверности твердой подложки находятся в агрегированном состоянии (Рис. 5). Fig. 5. Принципиальная схема расположения агрегатов частиц наноалмаза с адсорбированным белком (обелином) на плоской подложке. Продолжение работ в направлении создания плоских структур будет направлено на подбор условий для получения монослойного распределения на подложке частиц наноалмаза, связанных с белком. 2. ХАРАКТЕРИСТИКИ НАНОЧАСТИЦ И БЕЛКА Получение сложных надмолекулярных структур, состоящих из сильно отличающихся по своей природе органических и неорганических компонентов, стало возможным благодаря ряду их физико-химических свойств. 2.1. НЕКОТОРЫЕ “ПОЛЕЗНЫЕ” СВОЙСТВА НАНОАЛМАЗА Fig. 4. Кинетика биолюминесценции обелина, сорбированного на частицы наноалмаза: (а) - в растворе, (б) - на подложке. Способность обелина генерировать кванты света при взаимодействии с ионами кальция была использована для регистрации наличия частиц наноалмаза на плоской двумерной поверхности и оценки их распределения на подложке. Это позволило выявить наличие фермента, а следовательно и связанных с ним частиц алмаза. Наноалмаз (средний размер частиц 4 нм) обладает высокими ионообменными и адсорбционными свойствами, связанными с наличием высокоразвитой поверхности частиц (270280 м2/г), большим количеством поверхностных функциональных ионогенных групп, характерных для ионитов с карбоксильными группами [3], а также присутствием карбонильных, гидроксильных, эфирных групп и углеводородных фрагментов [4]. Важным может являться и наличие на поверхности частиц микропримесей металлов [4]. Физикохимические свойства поверхности наноалмаза во многом определяются примесными атомами, 2 вошедшими в состав частиц в процессе синтеза, поверхностными функциональными группами, образованными в процессе очистки частиц от сопутствующих продуктов взрыва [3,5], привнесенным загрязнением, зависящим от метода очистки [4]. Учитывая это, в работе были использованы 4 образца наноалмазов, полученные от разных фирм и отличающиеся методами очистки частиц. Образец №1 произведен в Отделе физики высокодисперсных материалов Красноярского научного центра и очищен газофазовым методом. Образцы №2-4 синтезированы во Всероссийском федеральном ядерном центре. Образец №2 - очищен газофазовым методом, образец №3 – прошел специальную обработку, а образец №4 - получен по ТУ 2-037-67794. Эксперименты выполнялись с использованием водных суспензий частиц наноалмаза (1г порошка в 100 мл воды). Было показано, что образцы № 1, 2, 3 дают устойчивые суспензии (в течение 7-14 суток не наблюдается появления осадка частиц). При более длительном хранении суспензий происходит постепенное просветление верхней части раствора и появление осадка. Нельзя исключить, что одной из возможных причин наблюдаемого эффекта является агрегирование частиц, приводящее к их седиментации. Из образца № 4 не удалось получить устойчивую суспензию, поскольку через 2-5 мин после ультразвуковой обработки образуется резкая граница между осадком и прозрачной надосадочной жидкостью. Вполне вероятно, что частицы в данном образце присутствуют в виде достаточно больших и стабильных агрегатов и диспергирование ультразвуком не позволяет разделить их и получить устойчивую водную суспензию. рентгенограмм с привлечением литературных данных [7] показала, что синтезированный материал состоит из δ- и θ- модификаций оксида алюминия [8]. Причем содержание последней фазы составляет 14,3%. В недавней работе [2] на примере цитохрома С было показано, что сферические наноразмерные частицы δ-оксида алюминия, как и обычный оксид алюминия, обладают способностью адсорбировать на своей поверхности белок. 2.2. СВОЙСТВА ОКСИДА АЛЮМИНИЯ Fig. 6. Частицы оксида алюминия, полученные в результате фракционирования. Оксид алюминия является хорошо известным веществом и выпускается многими фирмами для колоночной и тонкослойной хроматографии. Данные о применении в хроматографических целях и описание сорбционных свойств ультрадисперсного порошка оксида алюминия, получаемого взрывным методом [6], отсутствуют. Синтезированный продукт (Рис.1а, 6) представляет собой порошок белого цвета с насыпной плотностью порядка 0.6-0.7 г/см3, удельная площадь поверхности 20 м2/г. Частицы имеют правильную сферическую форму, присутствует некоторое количество ограненных частиц, спеков практически не наблюдается. Распределение частиц по размерам логарифмически нормальное с параметрами d0.5 = 70 нм, дисперсия σ=1.9. Порошок по каталогу ASTM расшифровывается как δ-фаза оксида алюминия. Однако, для некоторых линий рентгеновской дифракции наблюдается несогласованность со справочными данными по их положениям и интенсивностям. Более корректная идентификация 2.3. ХАРАКТЕРИСТИКА ОБЕЛИНА Обелин, выделенный из гидроидного полипа Obelia longissima [9], относится к семейству светоизлучающих Са2+-связывающих EF-белков фотопротеинов, способных генерировать кванты видимого света при взаимодействии с ионами Ca2+ [10]. Фотопротеины представляют собой стабильный фермент-субстратный комплекс, состоящий из молекулы апобелка (около 20 kDa), представленного одной полипептидной цепью, субстрата (целентеразин) и кислорода. Координация ионов кальция в EF-центрах фотопротеина приводит к конформационным изменениям белковой молекулы, что сопровождается развитием биолюминесцентной реакции, протекающей по диоксетановому механизму. В результате реакции субстрат окисляется до целентерамида, образуется молекула СО2 и генерируется квант света. После удаления продуктов реакции, прореагировавший белок (апообелин) может быть регенерирован в 3 присутствие синтетического целентеразина, хелатора (ЭДТА, ЭГТА), SH-восстанавливающего реагента β-меркаптоэтанол) (дитиотреитол (ДТТ), и молекулярного кислорода [10]. Ген апообелина был выделен и экспрессирован в клетках Escherichia coli, в результате чего был получен штамм-продуцент этого белка [11]. 3. ВЗАИМОДЕЙСТВИЕ МОЛЕКУЛ БЕЛКА С ЧАСТИЦАМИ НАНОАЛМАЗА Информация о применении наночастиц алмаза в области биологии крайне мала. Известно, однако, его использование в решении биологической задачи, когда на поверхность частиц, предварительно обработанную целлобиозой, был адсорбирован белок и полученный комплекс успешно применен для наработки антител [12]. Выше было сказано, что частицы наноалмаза, получаемые взрывным синтезом, могут иметь значительные различия в физико-химических свойствах поверхности. Поэтому представлялось целесообразным проведение исследований на частицах с «различающейся» поверхностью. 3.1. ВЗАИМОДЕЙСТВИЕ АПООБЕЛИНА С НАНОАЛМАЗОМ Для образцов наноалмаза, использованных в работе (См. раздел 2.1), была проверена способность частиц сорбировать рекомбинантный апообелин из сложной белковой смеси. Исследования показали, что в условиях эксперимента образцы № 1 - 3 сорбируют около 90% этого белка из грубого клеточного экстракта E. coli. Последующая элюция ДТТ позволяет десорбировать с частиц № 1 - 3 до 40% достаточно чистого апобелка (Рис. 7). Fig. 7. Электрофореграмма белковых препаратов: (1) - экстракт клеток E.coli, (2) – апообелин выделенный с применением частиц. Эффективная десорбция белка под действием ДТТ позволила предложить два возможных механизма сорбции апообелина на частицы наноалмаза. 1. - Известно [13], что молекула апообелина содержит 5 цистеиновых остатков. Если допустить наличие атомов серы (или SH групп) на поверхности частиц, вполне вероятно образование SS связи между белком и наноалмазом. В этом случае ДТТ будет восстанавливать S-S связь апобелок – наноалмаз и вызывать десорбцию белка. 2. Известно [14,15], что ионы двухвалентных металлов, включая ионы первой переходной серии, способны координироваться аминокислотными остатками белков (прежде всего остатками гистидина и цистеина) с образованием хелатных комплексов. Помимо цистеиновых остатков молекула апообелина содержит также 5 аминокислотных остатков гистидина [13]. Поверхность частиц наноалмаза может содержать в виде примесей атомы двухвалентных металлов [4]. Если допустить наличие у этих атомов свободных валентностей, вполне вероятно образование координационных связей белок – металл. В данном случае ДТТ можно рассматривать как свободный лиганд, разрушающий эти координационные связи, что также будет приводить к десорбции белка. Однако, следует подчеркнуть, что такой механизм связывания апообелина с частицами может быть предложен только для образцов №1 - 3. Это объясняется тем, что для образца №4 были обнаружены существенные отличия в способности сорбировать апообелин. Во-первых, частицы образца №4 сорбируют рекомбинантный апообелин из экстракта практически полностью (до 99,7-99,9%). Во-вторых, последующее добавление ДТТ не позволяет десорбировать белок (в элюате обнаруживается не более 2% апобелка). Пока непонятно, чем определяются такие различия в сорбционных свойствах частиц. Можно предположить, что это связано как со способом очистки синтезированных частиц наноалмаза (ТУ 2037-677-94), так и со степенью их агрегированности (невозможность получения устойчивых суспензий). В связи с этим, нельзя исключить, что механизм связывания апообелина частицами образца №4 может отличаться от механизма, предложенного для образцов №1 - 3. Поскольку у образцов № 1, 2 и 3 не было обнаружено принципиальной разницы в способности сорбировать рекомбинантный апообелин из экстрактов E. coli, дальнейшие эксперименты были выполнены на образце № 1. Была проверена зависимость сорбционной емкости наноалмаза по отношению к апообелину от количества и степени агрегированности частиц в реакционной смеси. Выше было показано, что водные суспензии наноалмазов являются неустойчивыми системами и при их длительном хранении наблюдается образование осадка, вероятно, за счет агрегирования частиц. Скорость 4 агрегирования и образования осадка значительно возрастает после ресуспендирования частиц в белковом экстракте. В результате агрегирования количество свободных частиц и, возможно, суммарная сорбирующая поверхность, доступная для взаимодействия с белком, должны уменьшиться. Это может привести к снижению сорбционной емкости. Поэтому для предупреждения образования агрегатов частиц была применена ультразвуковая обработка суспензии в процессе ресуспендирования частиц в белковом экстракте. Таблица 1. Сорбционная емкость наноалмазов образца №1 по отношению к апообелину без и с применением ультразвуковой обработке суспензии. УльтраНесорбированный Элюированный звук белок (%) белок (%) + 10 42 9 44 Однако, как видно из полученных результатов (Таблица 1), такая манипуляция не позволила увеличить ни количество сорбированного обелина ни процент элюированного белка. В тоже время, процент адсорбированного наноалмазом апообелина возрастал при увеличении количества частиц в суспензии (Таблица 2). Таблица 2. Сорбционно - десорбционные свойства образца наноалмаза №1 от объема белкового экстракта. Соотноше Несорбированный Элюированный ние белок (%) белок (%) 1:1 10 47 1:2 2 52 1:3 0.2 44 Например, при увеличении количества наноалмаза в 3 раза белок из исходного экстракта сорбировался частицами практически полностью. Однако при этом выход апобелка при элюции повысить не удалось. Представленные в таблицах 1 и 2 результаты свидетельствуют в пользу того, что сорбционная емкость частиц наноалмаза в образце №1 по отношению к рекомбинантному апообелину вероятнее всего определяется не степенью агрегированности частиц, а скорее всего их количеством в реакционной среде. Тем не менее, степень агрегированности наночастиц может влиять на качество препарата апобелка, получаемого в процессе очистки. Была исследована сорбционная способность частиц наноалмаза, которые не образовали осадка при хранении их водной суспензии, и частиц, которые образовали осадок. В обоих случаях количество сорбированного частицами апообелина было практически одинаковым. Процент выхода апобелка при последующей элюции также не различался. Однако, электрофорез полученных элюатов обнаружил существенные различия в их белковом спектре. Элюат, который был получен при работе с частицами, находившимися во взвешенном состоянии, содержал обелин высокой степени чистоты. В элюате, полученном при работе с частицами из осадка, были обнаружены добавочные белки (Рис.7). Вероятно, эти результаты свидетельствуют в пользу того, что неагрегированные частицы наноалмаза могут обладать большей избирательностью по отношению к апообелину. Необходимо отметить возможность многократного использования одних и тех же частиц наноалмаза для выделения рекомбинантного апообелина из сложной белковой смеси. В эксперименте было показано, что, по крайне мере, последовательное пятикратное использование одних и тех же частиц после элюции белка ДТТ не приводило к существенному ухудшению их сорбционных свойств по отношению к апобелку. 3.2. ВЗАИМОДЕЙСТВИЕ ОБЕЛИНА С НАНОАЛМАЗОМ Fig. 8. Совпадение кинетических характеристик биолюминесцентной реакции обелина в растворе до и после сорбции на частицы наноалмаза. Частицы наноалмаза способны сорбировать не только апообелин, но и активный обелин, представляющий собой фермент-субстратный комплекс. Сорбированный на частицы обелин сохраняет свою биолюминесцентную активность при взаимодействии с ионами кальция. Причем, важным является тот факт, что различий в кинетике люминесцентной реакции между обелином, находящимся в растворе, и обелином, адсорбированным на частицы, обнаружено не было (Рис.8). 5 После сорбции на частицы обелин в первые сутки хранения при температуре 4oС теряет до 15% своей активности. В течение последующих двух недель (время эксперимента) дальнейшего падения активности обелина не наблюдалось. Это позволяет использовать частицы с сорбированным обелином в течение длительного времени. применен для создания структур, выполняющих роль эмиттеров электронов. Работа выполнена при частичной финансовой поддержке гранта INTAS 1754. ЛИТЕРАТУРА 4. ЗАКЛЮЧЕНИЕ 1. Таким образом, в данной работе показана принципиальная возможность создания сложных структур (комплексов), включающих органические и неорганические компоненты, которые значительно различаются своей природой и физико-химическими свойствами. Создание комплексов из наночастиц алмаза и оксида алюминия, получаемых взрывным синтезом, стало возможным благодаря их способности адсорбировать на своей поверхности белки, которые были использованы как «сшивающие» частицы агенты. На наш взгляд, полученные результаты могут представлять не только научный интерес для специалистов, работающих в области физики, химии и биологии, но и имеют несомненную прикладную значимость. Благодаря выраженным сорбционным свойствам, наночастицы могут составить новый класс сорбентов и применяться для разделения белковых молекул. По крайней мере, частицы наноалмаза уже сейчас успешно применяются для получения высокоочищенного рекомбинантного апообелина из экстрактов клеток E. coli. Показанная в работе возможность получения плоских подложек с частицами, несущими на своей поверхности светоизлучающие белки, может являться предпосылкой для создания люминесцентных биочипов. Подход, благодаря которому был получен комплекс, содержащий локальные кластеры металлического золота, вероятно, может быть 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. Бондарь В.С., Пузырь А.П. // Доклады РАН, 2000, т.373, с.251 Пузырь А.П., Бондарь В.С., Белобров П.И., Букаемский А.А. // Доклады РАН, 2000, т.373, с.408. Чиганова Г.А. // Коллоидный журнал, 1994, т.56, с.266. Чиганова Г.А., Чиганов С.А. // Неорганические материалы, 1999. т.35, с.581. Чиганова Г.А. // Журнал аналитической химии, 1995, т.50, с.1304. Белошапко А.Г., Букаемский А.А., Ставер А.М. // Физика горения и взрыва, 1990, т.26, с.93. Rooksby H. P. // J.Appl.Chem., 1958, №8, p. 44. Букаемский A. A., Тарасова Л.С., Федорова Е.Н. // Известия ВУЗов. Цветная металлургия, 2000, №5, с.60. Бондарь В.С., Трофимов К.П., Высоцкий Е.С. // Биохимия, 1992, т.57, с.1481. Blinks J.R., Prendergast F.G., Allen D.G. // Phapmacol. Revs., 1976, v.28, p.1. Илларионов Б.А., Маркова С.В., Бондарь В.С. и др. // ДАН, 1992, т.326, с.911. Kossovsky N., Gelman A., Hnatyszyn H.J. et al. // Bioconjugate Chem., 1995, v.6, p.507. Illarionov B.A., Bondar V.S., Illarionova V.A., Vysotski E.S. // Gene, 1995, v.153, p.273. Даванков В.А., Навратил Дж., Уолтон Х. Лигандообменная хроматография. М.: Мир, 1989, 294с. Малер Г., Кордес Ю. Основы биологической химии. М.: Мир, 1970, 567с. . 6


