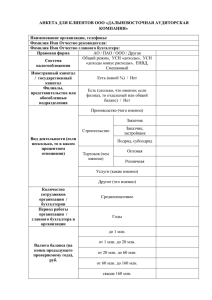
008038 По настоящей заявке испрашивается приоритет на основании следующих совместно рассматривае-
advertisement

008038 По настоящей заявке испрашивается приоритет на основании следующих совместно рассматриваемых предварительных заявок: регистрационный номер 60/438519, поданной 8 января 2003 г., регистрационный номер 60/494577, поданной 13 августа 2003 г., регистрационный номер 60/509260, поданной 8 октября 2003 г., и регистрационный номер 60/512090, поданной 20 октября 2003 г, и перечисленные заявки включены в данное описание посредством ссылок. Область техники, к которой относится изобретение Настоящее изобретение относится к стабилизированным композициям, содержащим белок ингибитора пути метаболизма тканевого фактора (TFPI). Более конкретно, оно относится к композициям, включающим TFPI или вариант TFPI, солюбилизирующий агент и антиоксидант. Уровень техники Ингибитор пути метаболизма тканевого фактора (TFPI) составляет в длину 276 аминокислот и функционирует как ингибитор свертывания крови, опосредованного тканевым фактором. Его аминокислотная последовательность приведена в SEQ ID NO:1. Амино-концевая область TFPI отрицательно заряжена, а карбокси-концевая область положительно заряжена. Белок TFPI содержит три домена ингибитора фермента Kunitz-типа. TFPI содержит 18 остатков цистеина и, если он правильно свернут, образует 9 дисульфидных связей. Первичная последовательность содержит три консенсусных сайта N-сцепленного гликозилирования (Asn-X-Ser/Thr). Остатки аспарагина сайтов гликозилирования находятся в положениях 145, 195 и 256. TFPI также известен как липопротеин-ассоциированный ингибитор коагуляции (LACI), ингибитор тканевого фактора (TFI) и ингибитор внешнего пути метаболизма (ЕМ). Предложено применение TFPI для лечения по различным показаниям, включая сепсис (US 6063764 и WO 93/24143), тромбоз глубоких вен (US 5563123, US 5589359 и WO 96/04378), ишемия (US 5885781, US 6242414, и WO 96/40224), рестеноз (US 5824644 и WO 96/01649) и рак (US 5902582 и WO 97/09063). Было показано, что вариант TFPI, который отличается от TFPI добавлением остатка аланина на аминоконце ("ala-TFPI"), является эффективным в лечении сепсиса на моделях животных. Carr и др., Circ Shock, 1994, Nov; 44 (3):126-37. После приготовления композиции, содержащие TFPI или вариант TFPI, можно упаковать для хранения в водной форме или в замороженном состоянии. TFPI или варианты TFPI, однако, могут агрегировать во время хранения в водных композициях. Агрегация вызвана взаимодействиями между молекулами TFPI или варианта TFPI, которые приводят к формированию олигомеров. Эти олигомеры могут оставаться растворимыми или могут образовывать большие, видимые скопления (агрегаты), которые осаждаются из раствора во время хранения. Образование агрегатов TFPI или варианта TFPI во время хранения водной композиции может неблагоприятно сказаться на его биологической активности, приводя к потере терапевтической эффективности в качестве противосвертывающего средства, эффективного для лечения различных состояний, включая сепсис. Кроме того, образование агрегатов может стать причиной других проблем, таких как закупорки трубок, мембран или насосов, когда композиция, содержащая TFPI или вариант TFPI, вводится с применением системы вливания. С тем, чтобы свести к минимуму эти проблемы, в данной области техники существует потребность для улучшенной стабилизации композиций, содержащих TFPI и варианты TFPI. Сущность изобретения Настоящее изобретение основано на существенных улучшениях стабильности водных композиций, содержащих TFPI или варианты TFPI, которые имеют место в случаях, когда такие композиции содержат солюбилизирующий агент и антиоксидант. Антиоксидант может присутствовать в виде газа, замещающего кислород, поглотителя кислорода или свободных радикалов, или хелатирующего агента. Изобретение включает, по меньшей мере, следующие варианты выполнения. Один вариант выполнения настоящего изобретения представляет собой водную композицию, содержащую от приблизительно 0,05 до приблизительно 15 мг/мл TFPI или варианта TFPI; от приблизительно 50 до приблизительно 600 мМ солюбилизирующего агента, выбранного из группы, состоящей из (i) аргинина или его аналога, (ii) лизина или его аналога и (iii) смесей (i) и (ii); и антиоксидант, выбранный из группы, состоящей из (i) газа, замещающего кислород, (ii) поглотителя кислорода или свободных радикалов, (iii) хелатирующего агента и (iv) их смесей; в котором водная композиция обладает (а) процентной устойчивостью к агрегации приблизительно 45% или больше; (b) процентной устойчивостью к окислению приблизительно 45% или больше; и (с) рН от приблизительно 4 до приблизительно 8. Другой вариант выполнения настоящего изобретения представляет собой способ получения водной композиции, содержащей TFPI или вариант TFPI, включающий этап добавления к водной композиции, содержащей от приблизительно 0,05 до приблизительно 15 мг/мл TFPI или варианта TFPI, от приблизительно 50 до приблизительно 600 мМ солюбилизирующего агента, выбранного из группы, состоящей из (i) аргинина или его производного, (ii) лизина или его производного и (iii) смесей (i) и (ii); и b) антиоксидант, выбранный из группы, состоящей из (i) газа, замещающего кислород, (ii) поглотителя кислорода или свободных радикалов, (iii) хелатирующего агента и (iv) смесей (i), (ii) и (iii), где водная композиция обладает (а) процентной устойчивостью к агрегации приблизительно 45% или больше; (b) процентной устойчивостью к окислению приблизительно 45% или больше; и (с) рН от приблизительно 4 до приблизительно 8. -1- 008038 Еще один вариант выполнения настоящего изобретения представляет собой фармацевтическую композицию, содержащую а) водную композицию и фармацевтически приемлемый наполнитель. Водная композиция содержит от приблизительно 0,05 до приблизительно 15 мг/мл TFPI или варианта TFPI; от приблизительно 50 до приблизительно 600 мМ солюбилизирующего агента, выбранного из группы, состоящей из (i) аргинина или его аналога, (ii) лизина или его аналога, и (iii) смесей (i) и (ii); и антиоксидант, выбранный из группы, состоящей из (i) газа, замещающего кислород, (ii) поглотителя кислорода или свободных радикалов, (iii) хелатирующего агента, и (iv) их смеси; в которой водная композиция обладает (а) процентной устойчивостью к агрегации приблизительно 45% или больше; (b) процентной устойчивостью к окислению приблизительно 45% или больше; и (с) рН от приблизительно 4 до приблизительно 8. Краткое описание чертежей На фиг. 1 показан период полураспада во время хранения (t1/2, в днях) четырех стандартных alaTFPI композиций, исследованных с помощью ионообменной жидкостной хроматографии высокого давления (IEX-HPLC) как функция концентрации аргинина при 50°С. Все композиции содержали 0,15 мг/мл ala-TFPI, доведенный до рН 5,5 в буфере либо с помощью основания L-аргинина и лимонной кислоты, либо с помощью L-аргинина НСl и 10 мМ лимонной кислоты/цитрата натрия. Специфические композиции ala-TFPI содержали: (а) 20-150 мМ L-аргинин НСl, 10 мМ лимонной кислоты/цитрата натрия в качестве буфера; (b) 20-150 мМ основания L-аргинина, титрованного лимонной кислотой; (с) 100-300 мМ Lаргинина НСl, 10 мМ лимонной кислоты/цитрата натрия в качестве буфера; (d) 100-300 мМ основания Lаргинина, титрованного лимонной кислотой. На фиг. 2 показана стабильность стандартной композиции ala-TFPI как функция концентрации растворенного кислорода, выраженной как процентная доля от полного насыщения воздухом. Процент растворимого ala-TFPI, остающийся в образцах устойчивости, хранившихся при 30°С, исследовали посредством обратно-фазной (RP) HPLC. Стандартная композиция ala-TFPI содержала 0,15 мг/мл ala-TFPI, 20 мМ лимонной кислоты/цитрата натрия и 300 мМ L-аргинина. Уровень рН составлял 5,5. На фиг. 3 показан период полураспада во время хранения (t1/2, в неделях) стандартной композиции ala-TFPI как функция концентрации растворенного кислорода, выраженной как процентная доля от полного насыщения воздухом. Процентная доля растворимого ala-TFPI, остающегося в образцах устойчивости, хранившихся при 30°С, была определена посредством RP-HPLC. Стандартная композиция ala-TFPI содержала 0,15 мг/мл TFPI, 20 мМ лимонной кислоты/цитрата натрия и 300 мМ L-аргинина. Уровень рН составлял 5,5. На фиг. 4 показана стабильность стандартной композиции ala-TFPI, содержащей хелатирующие агенты EDTA и DTPA, добавленные в количестве 0, 1, или 4 мМ. Процентная доля растворимого alaTFPI, остающегося в образцах устойчивости, хранившихся при 30°С, была определена посредством RPHPLC. Стандартная композиция ala-TFPI содержала 0,15 мг/мл ala-TFPI, 20 мМ лимонной кислоты/цитрата натрия и 300 мМ L-аргинина. Уровень рН составлял 5,5. На фиг. 5 показана стабильность стандартной композиции ala-TFPI, содержащей поглотитель кислорода метонин, добавленный в количестве 0, 2, 5, или 10 мМ. Процентная доля растворимого ala-TFPI, остающегося в образцах устойчивости, хранившихся при 30°С, была определена посредством RP-HPLC. Стандартная композиция TFPI содержала 0,15 мг/мл ala-TFPI, 20 мМ лимонной кислоты/цитрата натрия и 300 мМ L-аргинина. Уровень рН составлял 5,5. Фиг. 6 представляет собой хроматограмму RP-HPLC образца ala-TFPI. Пики A-F описаны в примере 1. Фиг. 7 - графики выживания Каплана-Мейера. Ось X, выживание; ось Y, время (часы). Сведения, подтверждающие возможность осуществления изобретения Водные композиции в соответствии с настоящим изобретением основаны на открытии, что прибавление к водной композиции, содержащей TFPI или вариант TFPI, i) аминокислотного солюбилизирующего агента (например, аргинина, лизина или их аналогов) и ii) антиоксиданта, где уровень рН данной водной композиции составляет от приблизительно 4 до приблизительно 8, приводит к образованию композиции, содержащей TFPI или вариант TFPI, обладающей в значительной мере увеличенной стабильностью во время хранения относительно композиций, содержащих TFPI или вариант TFPI, приготовленных без сочетания этих двух дополнительных компонентов. Данная в полной мере увеличенная стабильность композиции достигается посредством воздействия солюбилизирующего агента в сочетании с тем из антиоксидантов, который обеспечивает получение композиции, противостоящей не только агрегации во время хранения, но также и нежелательному окислению, особенно на остатках метионина TFPI. Водные композиции в соответствии с настоящим изобретением также противостоят другим нежелательным воздействиям (например, разворачивание, повторное сворачивание и денатурация), которые приводят к потере биологической активности или другим нежелательным характеристикам. Поскольку солюбилизирующий агент и антиоксидант, прежде всего, препятствуют независимым механизмам разложения TFPI или варианта TFPI (агрегация и окисление метионина, соответственно), сочетание солюбилизирующего агента и антиоксиданта обеспечивает более устойчивую композицию TFPI или варианта TFPI, чем возможно без этого сочетания, или даже без одного из этих двух компонен-2- 008038 тов. Например, окисление остатков метионина TFPI или варианта TFPI может быть нежелательным, даже когда TFPI или вариант TFPI являются биологически активными. Стабильность (устойчивость) водных композиций Водные композиции, содержащие TFPI или вариант TFPI в соответствии с настоящим изобретением, как правило, повышали устойчивость во время хранения в отношении одного или более эффектов разложения TFPI (например, агрегации и окисления метионина) относительно композиций, приготовленных в отсутствие сочетания солюбилизирующего агента и антиоксиданта, как описано в настоящем изобретении. Таким образом, поскольку композиции, содержащие TFPI и вариант TFPI, в соответствии с настоящим изобретением, обладают повышенной процентной устойчивостью к агрегации и повышенной процентной устойчивостью к окислению, период полураспада неагрегированного неокисленного TFPI или варианта TFPI повышается. Процентная устойчивость к агрегации и процентная устойчивость к окислению образца TFPI или вариантной TFPI могут меняться независимо. Предпочтительно TFPI или вариант TFPI в водных композициях в соответствии с настоящим изобретением являются биологически активными, как определяют, например, с помощью анализа времени протромбина, как описано ниже. Водные композиции по изобретению обладают по меньшей мере 45% устойчивостью к агрегации. "Процентной устойчивостью к агрегации" называется пропорция образца TFPI или варианта TFPI, который является растворимым в соответствии с измерением в 40°С ускоренной пробе устойчивости. В 40°С ускоренной пробе устойчивости образец TFPI или варианта TFPI выдерживают в течение восьми недель при 40°С. После выдерживания образец TFPI или варианта TFPI фильтруют через 0,2 мкм фильтр и подвергают анализу высокоэффективной жидкостной ионообменной хроматографии (IEX-HPLC) с тем, чтобы определить количество растворимого TFPI или варианта TFPI, оставшегося в растворе. Анализ IEXHPLC показал содержание ниже 45%. Таким образом, например, композиция TFPI или варианта TFPI, которая обладает 60% устойчивостью к агрегации, представляет собой композицию, в которой 60% TFPI или варианта TFPI являются растворимыми в соответствии с измерением в 40°С ускоренной пробе устойчивости. Композиция TFPI или варианта TFPI, которая обладает 80% устойчивостью к агрегации, представляет собой композицию, в которой 80% TFPI или варианта TFPI являются растворимыми в соответствии с измерением в 40°С ускоренной пробе устойчивости. Процентная устойчивость к агрегации TFPI или различных композиций TFPI по изобретению предпочтительно составляет приблизительно 45, 50, 60, 70 или 75%, или больше, более предпочтительно приблизительно 80, 82, 84, 85, 90, 92, 94, 95, 96, 97, 98 или 99%, или больше в соответствии с измерением в 40°С ускоренной пробе устойчивости и может, например, быть в диапазоне от приблизительно 45% или больше до приблизительно 99% или больше, от приблизительно 45% или больше до приблизительно 70% или больше, от приблизительно 60% или больше, до приблизительно 80% или больше, от приблизительно 70% или больше, до приблизительно 90% или больше, от приблизительно 80% или больше, до приблизительно 90% или больше, или от приблизительно 45% или больше, до приблизительно 70% или больше в соответствии с измерением в 40°С ускоренной пробе устойчивости. Водные композиции в соответствии с настоящим изобретением также обладают приблизительно 45% или большей устойчивостью к окислению. "Процентной устойчивостью к окислению" называется пропорция образца TFPI или варианта TFPI, который не содержит окисленный метионин в соответствии с измерением в 30°С ускоренной пробе устойчивости. В 30°С ускоренной пробе образец TFPI или варианта TFPI выдерживают в течение восьми недель при 30°С. После выдерживания образец TFPI или варианта TFPI подвергают анализу высокоэффективной жидкостной хроматографии с обращенной фазой (RP-HPLC) с тем, чтобы определить количество TFPI или варианта TFPI с окисленным метионином, присутствующего в растворе. Анализ RP-HPLC описан ниже. Таким образом, например, TFPI или композиция варианта TFPI, которая имеет 60%-ную устойчивость к окислению, представляет собой композицию, в которой 60% TFPI или варианта TFPI не содержат окисленный метионин в соответствии с измерением в 30°С ускоренной пробе устойчивости. Композиция TFPI или варианта TFPI, которая обладает 80% устойчивостью к окислению, представляет собой композицию, в которой 80% TFPI или варианта TFPI не содержат окисленный метионин в соответствии с измерением в 30°С ускоренной пробе устойчивости. Процентная устойчивость к окислению композиций TFPI или варианта TFPI в соответствии с настоящим изобретением предпочтительно составляет приблизительно 45, 50, 60, 70 или 75% или больше, более предпочтительно - приблизительно 80, 82, 84, 85, 89, 90, 91, 92, 94, 95, 96, 91, 98 или 99% или больше в соответствии с измерением в 30°С ускоренной пробе устойчивости и может, например, быть в диапазоне от приблизительно 45% или больше до приблизительно 99% или больше, от приблизительно 45% или больше, до приблизительно 70% или больше, от приблизительно 60% или больше, до приблизительно 80% или больше, от приблизительно 70% или больше, до приблизительно 90% или больше, или от приблизительно 80% или больше до приблизительно 90% или больше в соответствии с измерением в 30°С ускоренной пробе устойчивости. Период полураспада во время хранения TFPI или варианта TFPI в композициях в соответствии с настоящим изобретением находится обычно в диапазоне от приблизительно 1 до приблизительно 36 месяцев (например до приблизительно 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35 или 36 месяцев) в зависимости от температуры хранения. Водные композиции, содержащие TFPI или вариант TFPI, солюбилизирующий агент -3- 008038 и антиоксидант с уровнем рН от приблизительно 4 до приблизительно 8 в соответствии с настоящим изобретением, как правило, обладают периодом полураспада во время хранения в отношении агрегации и/или устойчивости к окислению, больше, чем приблизительно 8 недель при температуре приблизительно 15°С. Например, период полураспада во время хранения TFPI или варианта TFPI составляет от приблизительно 1 месяца до приблизительно 24 месяцев (например, приблизительно 1, 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22 или 24 месяца) при температуре приблизительно 15°С или приблизительно 30°С. Температура хранения Повышенная устойчивость при хранении достигается в зависимости от того, хранили водные композиции в соответствии с настоящим изобретением в виде жидкости для более позднего использования или замораживали и размораживали до использования. Температуры хранения могут располагаться в диапазоне от приблизительно -70°С до приблизительно 25°С (например, приблизительно -70, -60, -50, -40, -30, -20, -10, 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 15, 18, 20, 21, 22, 23, 24 или 25°С). Предпочтительно, водные композиции по изобретению хранят в жидкой форме для получения полного преимущества той возможности, что повышенная устойчивость при хранении в этой форме облегчает введение без восстановления, и возможности поставлять композицию в предварительно заполненных, готовых к использованию шприцах или в виде препаратов для многократного использования, если композиция совместима с бактериостатическими агентами. Предпочтительная температура хранения для жидких композиций составляет от приблизительно 2 до приблизительно 8°С (например, приблизительно 2, 3, 4, 5, 6, 7 или 8°С). TFPI и варианты TFPI TFPI представляет собой полипептид с аминокислотной последовательностью, показанной в SEQ ID NO:1. Предпочтительно, TFPI представляет собой рекомбинантный человеческий белок, получаемый в микробном организме. TFPI охарактеризован и описан с учетом его биологической активности в WO 01/24814. Варианты TFPI включают аналоги и производные TFPI, в том числе фрагменты TFPI, аналоги TFPI и производные TFPI. Варианты TFPI могут быть взяты у человека или из других источников млекопитающих, синтезированы или получены с помощью рекомбинантных методик. Аналоги представляют собой молекулы TFPI с одной или более заменами аминокислот, вставками, делениями и/или присоединениями. Предпочтительны консервативные замены, в которых аминокислоту заменяют на другую, имеющую схожие свойства. Примеры консервативных замен включают, без ограничений, Gly ⇔ Ala, Val ⇔ Ile ⇔ Leu, Asp ⇔ Glu, Lys ⇔ Arg, Asn ⇔ Gln, и Phe ⇔ Trp ⇔ Тyr. Они обычно попадают в диапазон приблизительно 1-5 аминокислот (например, 1, 2, 3, 4 или 5 аминокислот). Дополнительные аминокислоты могут быть присоединены в любом положении в молекуле, особенно на амино- или карбоксиконце. Например, один аналог TFPI, N-L-аланил-TFPI ("ala-TFPI"), содержит дополнительный остаток аланина в амино-концевой области. Присоединения аминокислот могут составлять 1, 2, 5, 10, 25, 100 или больше дополнительных аминокислот. Настоящее определение охватывает белки слияния. Фрагменты представляют собой части TFPI, аналогов TFPI или производных TFPI. Примеры фрагментов включают домены Kunitz 1, 2 или 3, домены Kunitz 1 и 2 или 2 и 3, или делеции N-конца, С-конца или обоих. Содержательное руководство для получения вариантов найдено в US 5106833. Фрагменты TFPI содержат по меньшей мере 20 последовательных аминокислот SEQ ID NO:1. Например, фрагмент может составлять в длину 20, 25, 30, 50, 100 150, 200, 250 или 275 последовательных аминокислот. Фрагменты TFPI, не обладающие биологической активностью, описаны в US 5106833. Использование таких фрагментов в настоящем изобретении также рассмотрено. Производные определены как аналоги TFPI, TFPI, или фрагменты TFPI, имеющие дополнительные компоненты. Примеры таких присоединений включают гликозилирование, фосфорилирование, ацетилирование или амидирование. Процентную гомологию между вариантом TFPI и SEQ ID NO:1 определяли с применением программы выравнивания Blast2 (Blosum62, Expect 10, standard genetic codes (стандартные генетические коды), open gap 11 (открытый промежуток 11), (extension gap 1) промежуток продления 1, gap x_dropoff 50, и low complexity filter off (фильтр малой сложности выключен)). Варианты TFPI обычно обладают приблизительно 70% или больше, предпочтительно, приблизительно 80% или больше, более предпочтительно приблизительно от 90 до 95% (например, 90, 91, 92, 93, 94 или 95%) или больше, и наиболее предпочтительно приблизительно 98 или 99% идентичностью аминокислотной последовательности по отношению к SEQ ID NO:1. Варианты аминокислотной последовательности TFPI могут быть приготовлены путем изменения последовательности ДНК, кодирующей TFPI. Способы для изменения нуклеотидной последовательности известны в данной области техники. См., например, Walker and Gaastra, eds. (1983) Techniques in Molecular Biology (MacMillan Publishing Company, New York), Runkel (1985) Proc. Natl. Acad. Sci. USA 82:488492, Kunkel et al. (1987) Methods Enzymol. 154:367-382, Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual (Cold Spring Harbor, New York), US 4873192, a также процитированные в них ссылки. Варианты TFPI предпочтительно обладают значительной величиной биологической активности, например 10, 30, 50, 60, 80, 90% или больше биологической активности TFPI в соответствии с измерени-4- 008038 ем, например, в протромбиновом (РТ) анализе, описанном ниже. Очевидно, любые изменения, сделанные в ДНК, кодирующей вариант TFPI, не должны вывести последовательность из рамки считывания и предпочтительно не должны создавать дополнительные области, которые могли бы произвести вторичную структуру мРНК. Руководство в определении, какие аминокислотные остатки можно замещать, вставлять или удалять без нарушения биологической или иммунологической активности TFPI, или варианта TFPI, можно найти, используя компьютерные программы, известные в данной области техники, такие как программное обеспечение DNASTAR, или у Dayhoff и др. (1978) в Atlas of Protein Sequence and Structure (Natl. Biomed. Res. Found., Washington, D.C.). Также рассмотрена стабилизация вариантов TFPI, которые не являются биологически активными. TFPI или варианты TFPI могут быть произведены рекомбинантным способом, как показано в US 4966852. Например, кДНК для требуемого белка можно включить в плазмиду для экспрессии в прокариотах или эукариотах. Существует множество ссылок, известных специалистам в данной области техники, которые предоставляют подробности относительно экспрессии белков с применением микроорганизмов. Смотри US 4847201 и Maniatas и др., 1982, MOLECULAR CLONING: A LABORATORY MANUAL (Cold Spring Harbor, New York). Доступно множество различных методик для трансформации микроорганизмов и применения трансформированного микроорганизма для экспрессии TFPI или варианта TFPI. Приведенное ниже представляет собой просто примеры возможных подходов. Последовательности ДНК TFPI или варианта TFPI могут быть связаны с подходящими управляющими последовательностями. Последовательности ДНК TFPI или варианта TFPI могут быть включены в плазмиду, такую как pUC13 или pBR322, которые коммерчески доступны от компаний, таких как Boehringer-Mannheim. Как только ДНК TFPI или варианта TFPI вставляется в вектор, ее можно клонировать в соответствующем хозяине. ДНК можно амплифицировать с помощью методик, таких как показанные в US 4683202 и US 4683195. кДНК можно получить путем индуцирования клеток, таких как клетки гепатомы HepG2 или SKHep, с тем, чтобы выработать мРНК, затем идентифицировать и выделить мРНК и обратно транскрибировать ее, чтобы получить кДНК. После того, как вектор экспрессии трансфомировали в хозяина, такого как Е. coli, бактерии можно культивировать и экспрессировать белок. Бактерии являются предпочтительными прокариотическими микроорганизмами, и особенно предпочтительной является Е. coli. Предпочтительный микроорганизм, применимый в настоящем изобретении, представляет собой Е. coli K-12, штамм ММ294, депонированный согласно условиям Будапештского Договора 14 февраля 1984 г. в Американской коллекции типовых культур, в настоящее время расположенной в 10801 University Blvd., Manassas, Virginia (номер доступа 39607). TFPI или варианты TFPI можно вырабатывать в бактериях или дрожжах и впоследствии очищать. В целом, можно использовать процедуры, показанные в US 5212091, US 6063764 и US 6103500 или WO 96/40784. TFPI или варианты TFPI можно очищать, делать растворимыми и повторно сворачивать в соответствии с WO 96/40784 и Gustafson и др., Prot. Express. Pur. 5:233 (1994). Например, при приготовлении согласно примеру 9 из WO 96/40784 получаются препараты ala-TFPI, которые содержат приблизительно от 85 до 90 мас.% полного белка по массе в виде биологически активного ala-TFPI. TFPI или вариант TFPI обычно добавляют к водным композициям в соответствии с настоящим изобретением в количестве от приблизительно 0,05 до приблизительно 15 мг/мл, (например, 0,05, 0,15, 0,5, 1, 2,5, 5, 7,5, 10, 12,5 или 15 мг/мл). Аминокислотный солюбилизирующий агент Аминокислотный солюбилизирующий агент, включенный в композиции, содержащие TFPI или вариант TFPI в соответствии с настоящим изобретением, прежде всего, предохраняет TFPI или вариант TFPI от агрегации, таким образом увеличивая его устойчивость во время хранения. Сниженное образование скоплений при добавлении аминокислотного солюбилизирующего агента встречается в зависимом от концентрации виде. Таким образом, повышающаяся концентрация аминокислотного солюбилизирующего агента приводит к увеличению устойчивости композиции TFPI или варианта TFPI вследствие соответствующего понижения образования скоплений во время хранения. Предпочтительные аминокислотные солюбилизирующие агенты представлены аргинином, лизином или аналогами аргинина или лизина. Аргинин или лизин могут присутствовать либо в свободной форме основания, либо в форме соли, например в форме соли соляной кислоты. Аналоги аргинина или лизина могут также быть в виде свободного основания или в форме соли. Аналоги аргинина включают, например, этиловый эфир аминогуанидин аргинина, гидроксамат аргинина и р-нитроанилид аргинина. Аналоги лизина включают, например, лизинамид, этиловый эфир лизина, гидроксамат лизина, и р-нитроанилид лизин. Предпочтительно, солюбилизирующий агент представляет собой аргинин, присутствующий либо в форме свободного основания, либо как форма соли соляной кислоты. Также предпочтительно использование в качестве солюбилизирующих агентов естественно встречающихся L-стереоизомеров аргинина или лизина, хотя стабилизированные композиции настоящего изобретения могут включать Dстереоизомеры или смеси L- и D-стереоизомеров. Аргининовый или лизиновый солюбилизирующие агенты или их аналоги включают в водную композицию в количестве, которое вызывает требуемый эффект стабилизации композиций TFPI или вариан-5- 008038 та TFPI во время хранения, такой, что, относительно подобной композиции, но без добавления солюбилизирующего агента, данная композиция демонстрирует улучшенную устойчивость к разложению. Предпочтительно, общее количество солюбилизирующего агента в композиции составляет от приблизительно 50 до приблизительно 600 мМ (например, 50, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550 или 600 мМ), более предпочтительно от приблизительно 100 до приблизительно 400 мМ, и наиболее предпочтительно - приблизительно 300 мМ. Определение количества отдельного аминокислотного основания, которое будет добавлено к водной композиции, содержащей TFPI или вариант TFPI, чтобы уменьшить образование агрегатов, увеличить устойчивость полипептида и увеличить устойчивость композиции при хранении, можно легко определить с применением способов, общеизвестных для специалистов в данной области техники и описанных, например, в примере 6, ниже. Например, действие либо аргининового, либо лизинового солюбилизирующего агента на стабильность TFPI или варианта TFPI во время хранения в водной композиции можно легко определить путем измерения изменения одного или более из множества возможных свойств композиции TFPI или варианта TFPI с течением времени, как, например, концентрация растворимого полипептида. Количество растворимого полипептида в растворе может быть определено с помощью ионо-эксклюзионной (IEC)-HPLC. В тех случаях, когда основной путь разложения TFPI или варианта TFPI представлен агрегацией, эффективное количество солюбилизирующего агента для смешения с композицией, содержащей TFPI или вариант TFPI, с тем, чтобы получить повышенную устойчивость, является количеством, которое привело к пониженному образованию скоплений с течением времени и, следовательно, к большей сохранности растворимого полипептида в растворе в неагрегированной (то есть, мономерной) молекулярной форме. Антиоксиданты Водные композиции TFPI или варианта TFPI в соответствии с настоящим изобретением также содержат антиоксидант. "Антиоксидант" представляет собой компонент, который уменьшает окисление TFPI или варианта TFPI, особенно аминокислотных остатков метионина в молекуле. Окисление остатков метионина, присутствующих в молекуле TFPI или варианта TFPI, является одним из основных путей разложения во время хранения композиций TFPI или варианта TFPI. Окисление связано с наличием примесей в композиции, которые либо реагируют с остатками метионина напрямую, либо катализируют реакции окисления. Поэтому использование определенных добавочных антиоксидантов для борьбы с эффектами таких примесей приводит к существенно большей стабильности композиций TFPI или варианта TFPI, даже композиций, которые уже содержат солюбилизирующий агент в соответствии с настоящим изобретением. Предпочтительно, антиоксидант является фармацевтически приемлемым и присутствует в концентрации от приблизительно 0,01 до приблизительно 50 мМ (например, приблизительно 0,01, 0,1, 1, 2, 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 мМ), более предпочтительно от приблизительно 1 до приблизительно 10 мМ (например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 мМ). Термин "фармацевтически приемлемый" означает, что при введении композиции пациенту нет существенных неблагоприятных биологических действий. Термин "пациент" охватывает как людей, так и ветеринарных пациентов. Три общих типа антиоксидантов эффективны в композициях TFPI или варианта TFPI в соответствии с настоящим изобретением: газы, замещающие кислород, поглотители кислорода или свободных радикалов и хелатирующие агенты. Газы, замещающие кислород Растворенный кислород, присутствующий в водной композиции TFPI или варианта TFPI, может, в конечном счете, привести к окислению метионина и, следовательно, либо к потере эффективности TFPI для его подразумеваемой терапевтической функции, либо к включению окисленных частиц (например, сульфоксида метионина) в полипептиде TFPI или варианта TFPI, которые могут обладать неизвестными или нежелательными физиологическими действиями. Газы, замещающие кислород, представляют собой газы, эффективные для удаления или вытеснения растворенного кислорода. Предпочтительно газ, замещающий кислород, значительно уменьшает концентрацию растворимого кислорода по отношению к концентрации растворенного кислорода в случае, если композиция уравновешена в воздухе при условиях окружающей среды. Предпочтительно газ, замещающий кислород, уменьшает концентрацию растворенного кислорода до менее чем приблизительно 10% по отношению к концентрации растворенного кислорода водной композиции TFPI или варианта TFPI, которая не содержит газ, замещающий кислород. Это условие резко усиливает устойчивость. Предпочтительные газы, замещающие кислород, в основном, инертны по отношению к композиции TFPI или варианта TFPI, то есть, значительная величина химической реакционной способности не встречается при подвергании композиции TFPI воздействию газа, замещающего кислород, такого, что поддерживается биологическая активность TFPI. Подходящие газы, замещающие кислород, включают азот, обогащенный азотом воздух, обогащенный азотом кислород, инертные газы (например, гелий или аргон), метан, этан, пропан, углекислый газ и смеси этих газов. "Обогащенный азотом воздух" и "обогащенный азотом кислород" представляют собой смеси азота и воздуха или кислорода, соответственно, содержащие азот в концентрации, большей, чем обнаружено в атмосфере (то есть, больше чем приблизительно 79 об.%). Азот является предпочтительным газом, замещающим кислород. -6- 008038 Газ, замещающий кислород, может присутствовать в любой концентрации в композиции, вплоть до предела его растворимости включительно. Растворимость газа, замещающего кислород, в композиции TFPI или варианта TFPI можно увеличить путем поддержания композиции в атмосфере с повышенным давлением, такой как закрытая емкость, содержащая замещающий газ выше уровня жидкости композиции. В качестве альтернативы, в свободном объеме можно поддерживать давление ниже атмосферного с тем, чтобы уменьшить растворимость газа, замещающего кислород. Газы, замещающие кислород, можно вводить в композицию TFPI или варианта TFPI любым традиционным способом, таким как очистка свободного объема выше уровня жидкости в ампуле или другой емкости, содержащей композицию TFPI или варианта TFPI, замещающим газом, распыление или барботирование вытеснительного газа через композицию TFPI или варианта TFPI, применение циклов сжатия/сброса давления замещающего газа, создание вакуума, сопровождаемое созданием давления замещающего газа, и т.п. После того, как замещение кислорода производят, как описано выше, повторное растворение кислорода в композиции TFPI или варианта TFPI предотвращают путем его изоляции от воздуха с помощью газа, замещающего кислород. Поглотители кислорода или свободных радикалов Другим типом антиоксиданта, применимого в настоящем изобретении, является поглотитель кислорода или поглотитель свободных радикалов. В целом, такие поглотители реагируют с кислородом и/или свободными радикалами активнее, чем TFPI или вариант TFPI. Они служат "расходуемыми" молекулами, которые реагируют с доступным кислородом, таким образом предотвращая нежелательные взаимодействия кислород - TFPI или кислород - вариант TFPI, в особенности, окисление остатков метионина. В предпочтительном варианте выполнения концентрация поглотителя кислорода или свободных радикалов составляет от приблизительно 0,1 до приблизительно 10 мМ. Подходящие поглотители кислорода или свободных радикалов являются устойчивыми в композициях TFPI или варианта TFPI в соответствии с настоящим изобретением. Предпочтительные фармацевтически приемлемые поглотители кислорода или свободных радикалов включают метионин, аскорбиновую кислоту или аскорбат натрия, L-, DL- или D-альфа-токоферол и ацетат L-, DL- или D-альфатокоферола, бетакаротин, селен, пиритинол, пропилгаллат, бутилированный гидроксианизол (ВНА) и бутилированный гидрокситолуол (ВНТ). Подходящая фаза для поглотителя кислорода или свободных радикалов закономерно зависит от его совместимости с композицией TFPI или варианта TFPI. Обычно в композиции, в соответствии с настоящим изобретением, подходящим образом можно включить гидрофильные антиоксиданты, такие как аскорбиновая кислота или ацетатная соль альфа-токоферола (то есть, ацетат альфа-токоферола). Можно использовать любой стереоизомер метионина (L-, D-, или DL-изомер) или комбинацию изомеров. Особенно предпочтительным антиоксидантом является метионин, особенно L-метионин. Обычно наилучшие результаты получают, когда добавленный метионин представляет, по меньшей мере, количество, эквивалентное, на молярной основе, количеству, присутствующему в TFPI или варианте TFPI. В нативной форме TFPI содержит 5 остатков метионина на каждую молекулу белка. Метионин, который является частью белка TFPI или варианта TFPI, называют "метионином TFPI или варианта TFPI", чтобы отличить его от метионина, добавленного в композицию в качестве антиоксиданта и который не является частью белка TFPI или варианта TFPI. Конечно, метионин в полипептиде, который не является метионином TFPI или варианта TFPI, может также выступать в качестве поглотителя кислорода для целей настоящего изобретения. Например, полипептид, содержащий поли(метионин) мог бы уменьшить коэффициент окисления метионина TFPI или варианта TFPI способом, подобным свободному метионину, добавленному в композицию. Поэтому важно отличать "метионин TFPI или варианта TFPI" в соответствии с определением выше от "метионина, не принадлежащего TFPI или варианту TFPI", который включает любые остатки метионина, добавленные в композицию либо в свободной форме, либо связанные в полипептиде, который не является TFPI или вариантом TFPI. Предпочтительно метионин присутствует в таком количестве, что молярное отношение метионина, не принадлежащего TFPI или варианту TFPI, и метионина TFPI или варианта TFPI составляет от приблизительно 1:1 до приблизительно 10000:1, более предпочтительно от приблизительно 1:1 до приблизительно 5000:1, еще более предпочтительно от приблизительно 100:1 до приблизительно 1000:1 и еще более предпочтительно от приблизительно 300:1 до приблизительно 1000:1, и еще более предпочтительно от приблизительно 500:1 до приблизительно 1000:1. В пересчете на абсолютную концентрацию метионин предпочтительно присутствует в композиции в концентрации от приблизительно 1 до приблизительно 10 мМ (например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 мМ). Однако концентрация используемого метионина может изменяться в зависимости от концентрации TFPI или варианта TFPI в композициях в соответствии с настоящим изобретением. Важное действие метионина или других поглотителей кислорода заключается в предотвращении формирования остатков сульфоксида метионина TFPI или варианта TFPI, которые могут вызвать нежелательные или неизвестные эффекты при физиологических условиях, даже в тех случаях, в которых TFPI или вариант TFPI могут быть биологически активными. Таким образом, количество добавляемого антиоксиданта, должно составлять достаточное количество -7- 008038 для такого ингибирования окисления остатков метионина, что количество сульфоксида метионина, получающегося при окислении добавленного метионина, является допустимым для регуляторных воздействий. Как правило, это означает, что композиция содержит не больше чем от приблизительно 10 до приблизительно 30% остатков метионина в виде сульфоксида метионина. Хелатирующие агенты Другим типом антиоксиданта, применимого в настоящем изобретении, является хелатирующий агент, также известный как секвестрант, который эффективно связывает ионы переходных металлов (например, Fe+3). Ионы переходного металла могут присутствовать в композиции и могут катализировать нежелательные реакции окисления, которые приводят к разложению белка и агрегации. Хелатирующие агенты выбирают таким образом, чтобы они обладали небольшой или не обладали химической реакционной способностью по отношению к другим компонентам композиции и в целом были совместимы с поддержанием требуемых физиологических свойств композиции (например, рН и осмолярность). Поэтому предпочтительно, чтобы в композициях использовались хелатирующие агенты, при введении которых в композицию преднамеренно не добавлялись катионы переходных металлов для таких целей, как поддержание рН или осмолярности. Хелатирующие агенты предпочтительно являются фармацевтически приемлемыми. Предпочтительные фармацевтически приемлемые допустимые хелатирующие агенты включают различные аминокарбоксилатные соединения, которые обладают емкостью для образования комплексов с лигандомметаллом с одним или более ионами переходного металла в растворе. Такие амино-карбоксилаты включают этилендиаминтетрауксусную кислоту (EDTA) и диэтилтриаминпентауксусную (DTPA), 1,2-бис(2аминофенокси)этан-N,N,N',N'-тетрауксусную кислоту (ВАРТА), этиленгликоль-бис(2-аминоэтил)N,N,N',N'-тетрауксусную кислоту (EGTA) и другие амино-карбоксилатные соединения, имеющие одну или множество карбоксилатных групп. Можно также использовать любую производную соль этих амино-карбоксилатных хелатирующих агентов, например форму двунатриевой соли, при условии, что остается емкость хелатирующего агента для образования комплекса со свободными ионами переходного металла, присутствующего в композиции варианта TFPI или варианта TFPI. Также эффективны формы этих хелатирующих агентов, отличные от форм соли, включают различные сложные эфиры, ангидриды и галогенированные формы этих соединений. Буфер Уровень рН композиций TFPI или варианта TFPI влияет на растворимость белка и, следовательно, на его стабильность. См. Chen и др. (1999) J. Pharm. Sciences 88(9):881-888. Предпочтительный диапазон рН для композиции в соответствии с настоящим изобретением составляет от приблизительно 4 до приблизительно 8 (например, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5 или 8), более предпочтительно от приблизительно 5 до приблизительно 6,5. Поскольку рН является существенным фактором для растворимости TFPI, использование буфера с тем, чтобы поддерживать подходящий уровень рН, может дополнительно увеличить устойчивость композиций. Таким образом, водные композиции в соответствии с настоящим изобретением могут дополнительно содержать буфер с тем, чтобы поддерживать уровень рН раствора. Предпочтительно, буфер представляет собой кислоту, в основном, не содержащую солевую форму, кислоту в форме соли или смесь кислоты и солевой формы. Предпочтительно, рН композиции поддерживают с использованием аргининового или лизинового аминокислотного солюбилизирующего агента в форме основания в сочетании с кислотой, в основном не содержащей солевую форму. Такое сочетание обеспечивает более низкую осмолярность раствора, чем если бы в качестве буфера использовали кислоту и ее солевую форму в сочетании с аминокислотным основанием. Преимущество такого сочетания состоит в том, что в водную композицию можно включить более высокую концентрацию аргининового или лизинового аминокислотного солюбилизирующего агента и/или антиоксиданта (например, метионина), не выходя за пределы изотоничности раствора. "Кислота, в основном, не содержащая солевую форму," означает, что кислота, служащая буферным агентом в водной композиции, обычно содержит меньше чем приблизительно 2% ее солевых форм. Как правило, когда в водной композиции используют буфер, содержащий кислоту, он приготовлен с применением солевой формы кислоты или сочетания кислоты и солевой формы сопряженного с кислотой основания. Таким образом, например, буфер можно приготовить с применением кислоты с натриевой, калиевой, аммонийной, кальциевой и/или магниевой солью сопряженного с ней основания. В случае, если выбирают буфер, содержащий форму основания аргининового или лизинового солюбилизирующего агента в сочетании с кислотой, в основном, не содержащей солевую форму, предпочтительные буферы выбирают из лимонной кислоты, янтарной кислоты, фосфорной кислоты, глутаминовой кислоты, малеиновой кислоты, яблочной кислоты, уксусной кислоты, винной кислоты и аспарагиновой кислоты. Лимонная кислота и янтарная кислота особенно предпочтительны для использования в качестве буфера в сочетании с аргинином в форме свободного основания. В противном случае, как упомянуто выше, аргинин можно использовать в форме соли, такой как форма соли НСl аргинина. В этом случае буфер обычно содержит сочетание кислоты, как описано выше, и солевой формы сопряженного с ней основания. Другие буферы, которые можно использовать, включают гистидин и имидазол. В целом, предпочтительные концентрации буфера составляют от приблизительно 0 до приблизительно 50 мМ (например, 0, 1, 2, 5, -8- 008038 10, 15, 20, 25, 30, 35, 40, 45 или 50 мМ), более предпочтительные концентрации составляют от приблизительно 5 до приблизительно 30 мМ. Если используемый буфер представляет собой аминокислотное основание и кислоту, в основном, не содержащую солевую форму, можно приготовить композиции, содержащие TFPI или вариант TFPI, которые являются, в основном, изотоническими, без необходимости включать дополнительные изотонизирующие агенты, такие как хлорид натрия. Композиция, которая является, в основном, изотонической вызывает лишь минимальный поток воды или не вызывает потока воды через мембраны окружающих клеток после введения in vivo. В целом, требуется изотоничность водных композиций, поскольку это уменьшает болезненность при введении и сводит к минимуму потенциальные гемолитические эффекты, связанные с гипертоническими или гипотоническими композициями. Изотоническое состояние соответствует осмолярности раствора от приблизительно 240 до приблизительно 340 мосмоль/л (например, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330 или 340 мосмоль/л), которое является предпочтительным в настоящем изобретении. Более предпочтительно, если изотоническое состояние в значительной степени достигается при осмолярности приблизительно 290 мосмоль/л. В некоторых случаях, однако, в зависимости от требуемых свойств композиции TFPI или варианта TFPI (например, рН и осмолярность), которые необходимо поддерживать, кислота, используемая в качестве буферного агента, может представлять собой солевую форму кислоты или смесь кислоты и ее солевой формы. В этом случае предпочтительный буфер представляет собой смесь кислоты и ее солевой формы. Кислота может быть представлена, например, лимонной кислотой, янтарной кислотой, фосфорной кислотой, глутаминовой кислотой, малеиновой кислотой, яблочной кислотой, уксусной кислотой, винной кислотой и аспарагиновой кислотой. Солевая форма кислоты может быть представлена натриевой, калиевой, кальциевой или магниевой солью сопряженного с ней основания. Особенно предпочтительными являются те буферы, в которых соль сопряженного основания находится в натриевой форме. Такие буферы включают лимонную кислоту/цитрат натрия, янтарную кислоту/сукцинат натрия, ортофосфорную кислоту/фосфат натрия, глутаминовую кислоту/глутамат натрия, малеиновую кислоту/малеат натрия, яблочную кислоту/малат натрия, уксусную кислоту/ацетат натрия, винную кислоту/тартрат натрия и аспарагиновую кислоту/аспартат натрия. Когда в качестве солюбилизирующего агента используют аргинин, даже в форме свободного основания, предпочтительным буфером является лимонная кислота/цитрат натрия или янтарная кислота/сукцинат натрия. В этом случае концентрация буфера предпочтительно составляет от приблизительно 5 до приблизительно 30 мМ (например, 5, 10, 15, 20, 25 или 30 мМ), более предпочтительно приблизительно 20 мМ. При использовании сочетания аминокислотного основания в буфере с кислотой, в основном, не содержащем солевой формы, возможны композиции, близкие к изотоническим, содержащие более высокие концентрации стабилизирующей аминокислоты, чем можно достичь с использованием буферной системы, которая представляет собой смесь кислоты и ее солевой формы. Более высокие концентрации солюбилизирующего агента, связанного в значительной степени с изотоническими композициями, в таких случаях также приводят к увеличению устойчивости TFPI или варианта TFPI и, таким образом, увеличению продолжительности хранения. Например, при использовании лимонной кислоты, для получения буфера с основанием аргинина, добавленным в водную композицию, содержащую TFPI или вариант TFPI с уровнем рН 5,5, концентрацию аргинина можно увеличить до 300 мМ, в то время как изотоничность композиции еще поддерживается. Это приводит к почти 35% увеличению продолжительности хранения TFPI или варианта TFPI при 50°С. Несмотря на то, что близкую продолжительность хранения TFPI или варианта TFPI можно достичь с применением той же концентрации аргинина и лимонной кислоты/ацетата натрия в качестве буферного агента, аргинин следует добавить в кислотной форме с тем, чтобы достичь того же уровня рН, и конечная композиция является гипертонической. Возможность использовать более высокие концентрации аминокислоты в качестве первичного стабилизирующего агента устраняет потребность в более традиционных стабилизирующих агентах TFPI или варианта TFPI, таких как бычий сывороточный альбумин или сывороточный альбумин человека, которые являются менее предпочтительными стабилизаторами из-за потенциального вирусного заражения. Дополнительные стабилизирующие агенты Композиции TFPI или варианта TFPI в соответствии с настоящим изобретением могут содержать другие соединения, которые увеличивают эффективность или способствуют требуемым качествам TFPI или варианта TFPI до тех пор, пока на первичный эффект стабилизации, достигнутый с помощью аминокислотного солюбилизирующего агента в сочетании с антиоксидантом не будет оказано неблагоприятное влияние. Например, разложение полипептида TFPI или варианта TFPI вследствие размораживания или механического раскалывания в ходе обработки композиций TFPI или варианта TFPI в соответствии с настоящим изобретением можно ингибировать путем включения в них поверхностно-активных веществ с тем, чтобы понизить поверхностное натяжение на границе раздела раствор-воздух. Подходящие поверхностно-активные вещества представляют собой неионогенные поверхностно-активные вещества, включая сложные эфиры сорбита и полиэтиленоксида, такие как полисорбат 80 (Tween 80) и полисорбат 20 (Tween 20); сложные эфиры полиоксипропилена-полиэтиленоксида, такие как Pluronic F68; спирты -9- 008038 полиэтиленоксида, такие как Brij 35; симетикон; полиэтиленгликоль, такой как PEG400; лизофосфатидилхолин; и полиоксиэтилен-р-1-октилфенол, такой как Тритон Х-100. Классическая стабилизация фармацевтических препаратов поверхностно-активными веществами или эмульгаторами описана, например, у Levine и др. (1991) J. Parenteral Sci. Technol. 45(3):160-165. Предпочтительным поверхностно-активным веществом, используемым в практике настоящего изобретения, является полисорбат 80. Другие стабилизирующие агенты, такие как альбумин, можно добавить в качестве опции с тем, чтобы дополнительно увеличить устойчивость композиций TFPI или варианта TFPI. Известное количество альбумина можно добавить при концентрациях приблизительно 1% мас./об. или меньше. Сахар или сахарные спирты можно также включить в композиции, содержащие TFPI или вариант TFPI в соответствии с настоящим изобретением. Можно использовать любой сахар, такой как моно-, ди- или полисахарид или водорастворимый глюкан (например, фруктоза, глюкоза, манноза, сорбоза, ксилоза, мальтоза, лактоза, сахароза, декстран, пуллулан, декстрин, циклодекстрин, растворимый крахмал, гидроксиэтиловый крахмал и карбоксиметилцеллюлоза-Na). Сахароза является самой предпочтительной сахарной добавкой. Можно использовать сахарные спирты (то есть, углеводороды С4-С8, с группой -ОН), например маннит, сорбит, инозит, галацитит, дульцит, ксилит или арабит. Маннит является самой предпочтительной добавкой сахарного спирта. Упомянутые выше сахара или сахарные спирты можно использовать по отдельности или в сочетании. Не существует фиксированного предела для используемого количества до тех пор, пока сахар или сахарный спирт растворим в жидком препарате и не оказывает неблагоприятного действия на эффекты стабилизации, достигнутые с применением способов в соответствии с настоящим изобретением. Предпочтительно, концентрация сахара или сахарного спирта лежит в диапазоне между приблизительно 1% вес./об. и приблизительно 15% вес./об., более предпочтительно между приблизительно 2% вес./об. и приблизительно 10% вес./об. Приготовление стабильных композиций Композиции в соответствии с настоящим изобретением предпочтительно готовят путем предварительного смешивания солюбилизирующего агента, антиоксиданта, в качестве опции, буфера и любых других наполнителей до включения TFPI или варианта TFPI. Последующее добавление предпочтительного количества солюбилизирующего агента и антиоксиданта с тем, чтобы достичь повышенной устойчивости TFPI или варианта TFPI, рН композиции можно установить предпочтительно в пределах диапазона, раскрытого здесь, который является оптимальным для TFPI или варианта TFPI. Несмотря на то, что рН можно установить после добавления TFPI или варианта TFPI, предпочтительно установить его до добавления, поскольку это уменьшает риск денатурации. Затем можно использовать подходящие механические устройства для достижения правильного смешения компонентов. Фармацевтические композиции Предпочтительно, водные композиции в соответствии с настоящим изобретением либо находятся в форме, которую можно ввести субъекту, либо находятся в форме, которую можно использовать для приготовления композиции, которую можно ввести субъекту. Водные композиции, включающие TFPI или варианты TFPI, можно разработать в виде унифицированной дозы, и они могут быть в форме инъекции или вливания, такой как раствор, суспензия или эмульсия. Предпочтительно водная композиция в соответствии с настоящим изобретением хранится в виде водной композиции с тем, чтобы воспользоваться преимуществом увеличенной устойчивости при хранении, достигаемым в соответствии с настоящим изобретением и как очерчено ниже. Фармацевтическую композицию TFPI или варианта TFPI предпочтительно стерилизуют посредством мембранной фильтрации и хранят в емкостях унифицированной дозы или мультидозы, таких как герметично закрытые флаконы или ампулы. Такие композиции также могут быть замороженными. Дополнительные способы для разработки композиций являются общеизвестными в данной области техники и могут использоваться для дальнейшего увеличения устойчивости при хранении водных фармацевтических композиций TFPI или варианта TFPI, если предусмотрено отсутствие нежелательного воздействия на положительные эффекты раскрытых здесь солюбилизирующих агентов, антиоксидантов и буферов. Полное обсуждение композиции и отбор фармацевтически приемлемых носителей, солюбилизирующих агентов, и т.д. может быть найдено в Remington's Pharmaceutical Sciences (1990) (18th ed., Mack Pub. Co., Eaton, Pennsylvania). Представленные ниже примеры приведены для иллюстрации, а не для ограничения. Все патенты, заявки на патенты и ссылки, процитированные в этом раскрытии, включены полностью в качестве ссылочного материала. Экспериментальная часть Следующие протоколы использовали в примерах 1-6, приведенных ниже с тем, чтобы определить действие отдельного солюбилизирующего агента и/или антиоксиданта на разложение TFPI или варианта TFPI и устойчивость во время хранения в водных композициях. HPLC с обращенной фазой RP-HPLC выполняли на системе Waters 626 LC, оборудованной 717 автоматическими пипетками (Waters Corporation, Milford, Maine), с применением колонки Vydac 214BTP54 C4 и предварительной колонки Vydac 214GCC54 (Separations Group, Hesparia, California). Колонки предварительно уравновесили - 10 - 008038 подвижной фазой А (10% ацетонитрил, 0,1% TFA). Этот способ RP-HPLC детектирует мономерные частицы TFPI или варианта TFPI в виде главного пика. Можно выявить другие пики, содержащие отдельные и множественные окисленные остатки метионина этого белка, а также пики, представляющие ацетилированные и карбамилированные формы TFPI или варианта TFPI. Ионообменная HPLC (IEX-HPLC) Ионнообменную (IEX)-HPLC выполняли на стеклянной колонке Pharmacia Mono-S HR 5/5 с применением системы Waters 626 LC с 717 автоматическими пипетками разогрева/охлаждения, как описано у Chen и др., выше. Колонку уравновесили 80% подвижной фазой А (70:30 об/об, 20 мМ ацетат натрия:ацетонитрил при рН 5,4) и 20% подвижной фазой В (70:30 об/об, 20 мМ ацетат натрия и 1М хлорид аммония:ацетонитрил при рН 5,4). После инжекции TFPI или вариант TFPI элюировали путем увеличения подвижной фазы В до 85% в течение 21 мин при скорости потока 0,7 мл/мин. TFPI или вариант TFPI элюировали приблизительно за 16,5 мин в виде отдельного пика и детектировали посредством поглощения UV при 280 нм с помощью детектора поглощения света Waters 486. Сбор и обработку информации выполняли на системе Perkin-Elmer Turbochrom. Концентрацию белка оценивали путем интегрирования области пика и сравнения ее с калибровочной кривой, получаемой от образцов известных концентраций. Измерение рH и осмолярности Уровень рН раствора различных композиций измеряли с помощью рН-метра от Orion (Model 611, Orion Research Incorporated Laboratory Products Group, Boston, Massachusetts). рН-метр калибровали в соответствии с калибровочной процедурой с двумя буферами, предложенной изготовителем, используя стандарт рН 4 (Fisher Scientific, Cat. No. SB 101-500) и стандарт рН 7 (Fisher Scientific, Cat. No. SB107500). Осмолярность раствора этих композиций измеряли с помощью Осмометра Давления Пара от Wescor (Model 5500, Wescor Inc., Logan, Utah). Осмометр калибровали по двум стандартам, поставляемым изготовителем: стандарт 290 ммоль/кг (Wescor, Reorder No. OA-010) и стандарт 1000 ммоль/кг (Wescor, Reorder No. OA-029). Другие материалы и способы Буферный раствор композиции приготовили с помощью Chiron Tech Service. Для использования в следующих исследованиях были получены стеклянные 10 см3 флаконы типа I и ламинированные пробки без силикона Daikyo Gummi. Уровни растворенного кислорода в флаконах TFPI или варианта TFPI определяли с помощью Nova BioProfile 200. Наблюдаемую оценку постоянной скорости первого порядка для окисления TFPI выполняли с применением программы KaleidaGraph® (Synergy Software, Reading Pennsylvania). Пример 1. Анализ протромбинового времени Подходящие анализы протромбинового времени описаны в US Patent 5888968 и в WO 96/40784. Вкратце, протромбиновое время можно определить с применением коагулометра (например, Coag-АMate MTX II от Organon Teknika). Подходящим буфером для анализа является 100 мМ NaCl, 50 мМ Tris, доведенный до рН 7,5, содержащий 1 мг/мл бычий сывороточный альбумин. Дополнительными требуемыми реагентами являются нормальная плазма человека (например, "Verify 1" от Organon Teknika), реагент тромбопластина (например, "Simplastin Excel" от Organon Teknika) и стандартный раствор TFPI (например, 20 мкг 100% чистого ala-TFPI (или его эквивалента) на каждый мл буфера для анализа). Стандартную кривую получали путем анализа времени коагуляции ряда разбавлении стандартного раствора TFPI, например, до конечных концентраций в пределах от 1 до 5 мкг/мл. Для определения времени свертывания образец или стандарт TFPI сначала разбавляли в буфере для анализа. Затем добавляли нормальную плазму человека. Реакцию свертывания запускали путем добавления реагента тромбопластина. Затем инструмент записывает время свертывания. Линейную стандартную кривую TFPI получили из графика логарифма времени свертывания против логарифма концентрации TFPI. Стандартную кривую выверили на основании чистоты стандарта TFPI для соответствия эквивалентной концентрации TFPI 100% чистого стандарта. Например, если стандарт представляет собой препарат ala-TFPI, который является биохимически чистым на 97% (то есть, он содержит 3% по весу молекулярных частиц без биологической активности TFPI), тогда концентрацию каждого разбавления стандарта умножают на 0,97, чтобы получить фактическую концентрацию TFPI. Таким образом, стандарт TFPI, в котором присутствует 1,0 мкг/мл, основанный на фактическом весе на мл препарата, который является чистым на 97%, будет эквивалентен и расцениваться как концентрация 1,0х0,97, или 0,97 мкг/мл. Также возможны другие меры эффективности TFPI в лечении сепсиса так же, как множества других показаний, включая такие измерения, как баллы 28-дневного снижения смертности от всех причин и улучшения состояния некоторой множественной дисфункции органов (MOD) относительно плацебо. Пример 2. Влияние концентрации L-аргинина на устойчивость ala-TFPI в различных композициях Композиции Ala-TFPI, содержащие ala-TFPI с конечной концентрацией 0,15 мг/мл при рН 5,5, приготовили из 0,6 мг/мл растворов запаса, которые подвергли обмену с буфером посредством диализа, проанализировали на конечные концентрации ala-TFPI, с применением спектроскопии UV/Vis, и разбавили до стартовой целевой концентрации 0,15 мг/мл, используя буфер лимонной кислоты, с добавлением цитрата натрия или без него. Добавление цитрата натрия использовали только для тех образцов, в которых - 11 - 008038 L-аргининовый солюбилизирующий агент присутствовал в виде L-аргинина HCL, в то время как лимонную кислоту саму по себе использовали для получения буферов в композициях, содержащих основание L-аргинина. Эти растворы затем разделяли на аликвоты (1 мл в каждой) во 3 см3 флаконы для хранения в устойчивом состоянии. Достаточное количество флаконов оставили для начальной во времени точки при измерениях концентрации. Остальную часть флаконов поместили в термостат при 50°С для ускоренного исследования устойчивости. Концентрации солюбилизирующего агента и буфера в композициях четырех образцов, содержащих 0,15 мг/мл ala-TFPI при рН 5,5, приведены ниже: 1) 20-150 мМ НСl L-аргининовый солюбилизирующий агент и 10 мМ буфер лимонная кислота/цитрат натрия; 2) 20-150 мМ солюбилизирующий агент L-аргининового основания, титрованный до рН 5,5 лимонной кислотой; 3) 100-300 мМ НСl L-аргининовый солюбилизирующий агент и 10 мМ буфер лимонная кислота/цитрат натрия; и 4) 100-300 мМ солюбилизирующий агент L-аргининового основания, титрованный до рН 5,5 лимонной кислотой. В дни 3, 7, 14 и 30 содержимое каждого флакона переносили в 1,7 мл пробирку микроцентрифуги и затем центрифугировали при 10000 об./мин в течение приблизительно 2 мин. После центрифугирования растворимый белок в образцах отделяли от агрегированного/осажденного белка. Количество растворимого белка определяли способом IEX-HPLC (Chen и др. (1999) J. Pharm. Sci. 88(9):881-888). Данные концентраций как функцию времени хранения затем наложили на модель экспоненциального затухания первого порядка (Y=Y0e-kt) для вычисления периода полураспада во время хранения для остающегося растворимого белка с применением графического программного обеспечения KaleidaGraph®. Значения периода полураспада во время хранения (t1/2) для композиций ala-TFPI построены как функция концентрации L-аргинина на фиг. 1. Эти данные показывают увеличение периода полураспада ala-TFPI во время хранения с увеличением концентрации L-аргинина. При применении только Lаргининового солюбилизирующего агента композиции показывают значительное увеличение периода полураспада во время хранения по сравнению с композициями с небольшой добавкой солюбилизирующего агента или без него. Пример 3. Кинетика разложения композиций ala-TFPI Одним из главных путей разложения для ala-TFPI во время хранения при 2-8°С является окисление остатков метионина. Окислительные частицы метионина можно рассматривать как частицы от ранней элюции до частиц главного пика способа обратно-фазной HPLC (RP-HPLC). На фиг. 6 представлена хроматограмма RPHPLC образца ala-TFPI, который демонстрирует анализ окисленных частиц. Пик А содержит множество частиц MetSO, пик С содержит отдельные частицы MetSO, пик D представляет собой материал, содержащий ala-TFPI, замещенный норвалином, пики Е и F представляют собой ацетилированный и/или карбамилированный ala-TFPI. Частицы пиков А и С интегрировали по отдельности. Все остальные частицы, включая главный пик и пики D, Е и F, группировали как частицы главного пика. Для понимания кинетики разложения при 30°С 2 мл образцы ala-TFPI приготовили, как описано в примере 2, каждый из которых содержал 0,15 мг/мл TFPI, 20 мМ буфер лимонная кислота/цитрат натрия и 300 мМ L-аргинин. Этими образцами заполнили 10 см3 стеклянные флаконы (2 мл образцов на каждый) и выдерживали при 30°С. Потерю растворимого белка из-за агрегации/осаждения исследовали в первую очередь, поскольку этот феномен приводит к уменьшению общей площади под пиками, основанной на HPLC. После 8 недель хранения при 30°С образцы устойчивости показали уменьшение от 2 до 5% общей площади под пиками из IEX-HPLC и RP-HPLC, указывая относительно малое количество агрегации/осаждения ala-TFPI с применением вышеуказанной композиции. Затем оценили разложение за счет окисления метионина путем отображения на графике содержания частиц главного пика, частиц пика А и частиц пика С из RP-HPLC как функцию времени хранения при 30°С. Спаду частиц главного пика сопутствовало возрастание частиц пика С и частиц пика А. Приблизительно 11 и 9% окисленных частиц после 8 недель хранения сформировались в виде отдельных частиц MetSO и множественных частиц MetSO, соответственно. Это говорит о том, что окисление метионина является важным путем разложения при стандартных условиях хранения, на основании доступных способов детекции. Результаты, приведенные в табл. 1, также показывают, что формирование частиц MetSO растет с температурой. Таблица 1. Влияние температуры на окисление Ala-TFPI - 12 - 008038 Пример 4. Влияние растворенного кислорода на устойчивость ala-TFPI Образцы готовили при наличии композиции, описанной в примере 3. Затем варьировали уровень растворенного кислорода путем освобождения свободного объема флакона с помощью смеси замещающих газов азот/воздух с помощью подготовленного ферментера. В каждом образце установили уровень рН 5,5 в буфере. С тем, чтобы способствовать уравновешиванию замещающего газа между свободным объемом и жидкостью, флаконы встряхивали при 200 об./мин в течение одного часа, в ходе освобождения. Флаконы затем содержали при 30°С, и образцы ala-TFPI извлекали в намеченные моменты времени для анализов стабильности. Уровень растворенного кислорода в каждом флаконе повторно измеряли в моменты времени для анализа устойчивости. В начальном пилотном исследовании флаконы ala-TFPI готовили при наличии уровней растворенного кислорода, представляющих 0, 20, 100 и 200% насыщения воздухом (если принимать 21% содержание кислорода за 100% условие насыщения). Результаты оценки устойчивости при 30°С показаны на фиг. 2. Результаты указывают на то, что окисление ala-TFPI было в значительной степени ингибировано при уменьшении уровня кислорода почти до 0% насыщения воздухом, это означает, что атмосфера над жидкостью являлась, по существу, атмосферой чистого азотного замещающего газа. Улучшение устойчивости, следующее из уменьшения растворенного кислорода от 200 до 20% насыщения воздухом, напротив, было относительно незначительным. Затем проводили второе исследование для более конкретной оценки рабочих характеристик устойчивости образцов ala-TFPI, содержащих растворенный кислород в пределах от 0 на 12% насыщения воздухом. В этом диапазоне обнаружили значительное влияние на устойчивость. Зависимость между периодом полураспада ala-TFPI во время хранения при 30°С и содержанием растворенного кислорода показана на фиг. 3. Исключительно сильного улучшения устойчивости ala-TFPI достигли, когда уровень кислорода в образце уменьшили до менее чем 5% насыщения воздухом (приблизительно 1% содержание кислорода). Уровень растворенного кислорода в отдельных флаконах образцов также измеряли в моменты времени, соответствующие анализам концентрации ala-TFPI, и значительное изменение в содержании растворенного кислорода в пузырьках не наблюдали. Эти результаты показывают, что использование замещающего газа, такого как азот, с тем, чтобы заместить достаточное количество кислорода, может значительно улучшить устойчивость ala-TFPI при хранении, если уменьшить концентрацию растворенного кислорода до достаточно низкого уровня. В связи с этим, замещающие газы, такие как азот, считаются антиоксидантами, поскольку они ингибируют окисление ala-TFPI. Пример 5. Влияние хелаторов металлов на окисление ala-TFPI Основной раствор ala-TFPI при 10 мг/мл разбавили до 0,15 мг/мл буфером, содержащим хелаторы металлов EDTA или DTPA при концентрации либо 1, либо 4 мМ. Эти композиции также содержали 20 мМ лимонную кислоту/цитрат натрия и 300 мМ L-аргинин в качестве солюбилизирующего агента. Разбавленными растворами ala-TFPI заполняли 10 см3 стеклянные флаконы (2 мл образца в каждом) и хранили при температурах либо 2-8°С, либо 30°С для анализа устойчивости. Кривые устойчивости главной пиковой области, оставшейся при температуре хранения 30°С, полученные с применением анализа RP-HPLC, показаны на фиг. 4. Данные периода полураспада во время хранения, полученные из этого исследования, при условиях 2-8°С и 30°С, представлены в табл. 2, ниже. Присутствие хелаторов металлов стабилизировало ala-TFPI в зависимости от концентрации, что говорит о том, что окисление остатка метионина ala-TFPI катализируется металлическими ионами в растворе. Независимо от фактического механизма, хелаторы металлов служат для предотвращения окисления alaTFPI и поэтому эффективны в качестве антиоксидантов. Пример 6. Действие свободной аминокислоты метионина на окисление ala-TFPI Основной 10 мг/мл раствор ala-TFPI разбавили до 0,15 мг/мл буфером, содержащим метионин. Эти композиции также содержали 20 мМ лимонную кислоту/цитрат натрия и 300 мМ L-аргинин в качестве солюбилизирующего агента. Разбавленными растворами ala-TFPI заполняли 10 см3 стеклянные флаконы (2 мл образца в каждом) и хранили при температурах либо 2-8°С, либо 30°С для анализов устойчивости. Кривые устойчивости главной пиковой области, оставшейся при температуре хранения 30°С, полученные с применением анализа RP-HPLC, показаны на фиг. 5. Данные периода полураспада во время хранения, полученные из этого исследования, при условиях 2-8°С и 30°С предоставлены в табл. 2, ниже. Эти данные показывают, что окисление остатка метионина ala-TFPI эффективно ингибируется включением в композицию от 2 до 10 мМ метионина. Фактически при температуре хранения 2-8°С окислительное разрушение ala-TFPI не было обнаружено в присутствии от 2 до 10 мМ метионина после 6 месяцев хранения. Кроме того, устойчивость композиций ala-TFPI, содержащих L-аргининовый солюбилизирующий агент, была дополнительно увеличена при помощи антиоксиданта, в этом случае, метионинового поглотителя кислорода. Без ограничений какой-либо частной теорией, полагается, что свободный метионин ингибирует окисление ala-TFPI путем обеспечения "расходуемого" метионина таким образом, что вероятность повреждения остатков метионина, связанных с белком, снижается. Окисление метионина может быть вызвано множеством факторов, включая наличие ионов металлов, растворенного кислорода и перекиси. Для предотвращения окисления метионина в белках было идентифицировано несколько антиоксидантов, таких как хелатирующие агенты, поглотители кислорода, - 13 - 008038 восстанавливающие агенты и замещающие газы. Хелатирующие агенты связываются с ионами металлов, которые катализируют окислительные реакции. Поглотители кислорода реагируют с кислородом, имея преимущества в окислении, и, таким образом, защищают белки за счет удаления источника окисления. Восстанавливающие агенты смягчают действие окислителей при окислении белков. Замещающие газы уменьшают парциальное давление кислорода над жидкостью и, следовательно, концентрацию растворенного кислорода. Эффективность хелатирующих агентов металлов, таких какие тестировали в примере 4, и метионина - поглотителя кислорода в уменьшении окисления ala-TFPI сравнили в табл. 2. По сравнению с контрольным образцом (композиция, приведенная в примере 3), содержащим 0,15 мг/мл ala-TFPI, 20 мМ буфер лимонной кислоты/цитрата натрия и 300 мМ L-аргинин, все антиоксиданты увеличили период полураспада ala-TFPI во время хранения. Среди всех условий, подвергнутых оценке, включение в композицию ala-TFPI 10 мМ метионина проявило особенную эффективность в стабилизации белка ala-TFPI против окисления. Таблица 2. Сравнение действия антиоксидантов на устойчивость Ala-TFPI Пример 7. Влияние концентрации белка ala-TFPI на окисление ala-TFPI Влияние концентрации ala-TFPI на окисление ala-TFPI исследовали для концентраций ala-TFPI в пределах от 0,15 до 10 мг/мл. Образцы стабильности готовили, разбавляя основную композицию 10 мг/мл ala-TFPI до 3, 1, 0,6, 0,3 и 0,15 мг/мл 20 мМ буфером лимонной кислоты/цитрата натрия, используемым в примере 3. Образцы также содержали 300 мМ L-аргинин. Неразбавленными и разбавленными основными пробами впоследствии заполнили 10 см3 стеклянные флаконы (2 мл образца в каждом), закрыли и хранили либо при 2-8°С, либо при 30°С для оценки устойчивости. Кривые устойчивости для главного пика, оставляемого RP-HPLC как при ускоренном температурном условии 30°С, так и при фактическом условии хранения 2-8°С, показывают, что период полураспада во время хранения ala-TFPI имеет, по существу, обратную зависимость от концентрации белка. Периоды полураспада этих кривых устойчивости приведены в табл. 3. Скорость окисления увеличивается при более низких концентрациях белка. Без ограничений какой-либо частной теорией, полагается возможным, что любое увеличение данной скорости может быть вызвано увеличением соотношения окислителей к молекулам белка в растворе. Таблица 3. Период полураспада во время хранения главного пика, оставляемого RP-HPLC для TFPI фазы 3 при различных концентрациях после хранения либо при 30°С, либо при 2-8°С Пример 8. Исследование выживания Исследование перевязки и пункции слепой кишки мышей проводили для сравнения свежеприготовленного материала клинической марки рекомбинантного ala-TFPI (rTFPI) (TFPI92) с материалом клинической марки, который был частично дезамидирован и окислен (TFPI 78). Эта модель вызывает многомикробное внутрибрюшинное и общее заражение путем прямой фекальной инфекции и некроза слепой кишки, что в близкой степени имитирует внутрибрюшной сепсис человека. Opal и др., Clinical Care Medicine 29, 13-18, 2001. - 14 - 008038 Оба препарата TFPI приготовили в соответствии с описанием в заявках: регистрационный номер 60/494546, поданной 13 августа 2003 г., регистрационный номер 60/509277, поданной 8 октября 2003 г. и регистрационный номер 60/512199, поданной 20 октября 2003 г. Эти заявки включены полностью в качестве ссылочного материала. Либо rTFPI 78, rTFPI 92, либо контроль разбавителя давали в слепой форме более 48 ч (SQ. q12 ч х четыре дозы). До и спустя 48 ч после хирургической процедуры брали кровь для определения уровня количественной бактериемии, эндотоксина и цитокинов (фактор некроза опухолиальфа и интерлейкин-6). За животными наблюдали ежедневно и регистрировали смертельные случаи, как только они происходили. Все животные проходили оценку вскрытия на гистологическое свидетельство повреждения органов и количественную бактериологию в конце экспериментального периода. Графики выживания Каплана-Мейера изображены на фиг. 7. Значительное преимущество в выживании наблюдалось у мышей, которые получали свежеприготовленный rTFPI по сравнению с частично окисленной, дезамидированной формой rTFPI. Обе группы rTFPI были в лучшем состоянии, чем мыши, которые получали разбавитель в контрольной группе. Как и ожидалось, ложно прооперированные мыши (хирургическое вмешательство с идентификацией слепой кишки, но без перевязки и пункции) пережили семидневный период исследования. Между двумя группами, обработанными rTFPI, не было значительных различий во вторичных результатах бактериемии, наличии в крови эндотоксинов или выработке цитокина. Это исследование демонстрирует, что TFPI, как представляется, предоставляет преимущество в выживании посредством механизма, который не объясняется уровнями в крови бактерий, эндотоксина или цитокинов. Дезамидированный, окисленный TFPI обеспечивает меньшую защиту, чем свежеприготовленный TFPI. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Водная композиция содержащая от приблизительно 0,05 до приблизительно 15 мг/мл TFPI или варианта TFPI; от приблизительно 50 до приблизительно 600 мМ солюбилизирующего агента, выбранного из группы, состоящей из (i) аргинина или его аналога, (ii) лизина или его аналога и (iii) смесей (i) и (ii); и антиоксидант, выбранный из группы, состоящей из (i) газа, замещающего кислород, (ii) поглотителя кислорода или свободных радикалов, (iii) хелатирующего агента и (iv) их смесей, где водная композиция обладает процентной устойчивостью к агрегации, составляющей приблизительно 45% или более; процентной устойчивостью к окислению, составляющей приблизительно 45% или более; и рН от приблизительно 4 до приблизительно 8. 2. Композиция по п.1, содержащая вариант TFPI, который является приблизительно на 70% или более гомологичным по отношению к TFPI (SEQ ID NO:1). 3. Композиция по п.2, в которой вариант TFPI представляет собой ala-TFPI. 4. Композиция по п.1, в которой солюбилизирующий агент представляет собой аргинин и аргинин находится в форме, выбранной из группы, состоящей из соли соляной кислоты, L-аргинина и свободного основания. 5. Композиция по п.1, содержащая приблизительно 300 мМ солюбилизирующего агента. 6. Композиция по п.1, в которой антиоксидант представляет собой газ, замещающий кислород. 7. Композиция по п.6, содержащая растворенный кислород в концентрации, меньшей чем приблизительно 10% по отношению к концентрации растворенного кислорода в водной композиции, включающей TFPI или вариант TFPI, которая не содержит газ, замещающий кислород. 8. Композиция по п.6, в которой газ, замещающий кислород, выбран из группы, состоящей из воздуха, обогащенного азотом, кислорода, обогащенного азотом, азота, инертного газа, метана, этана, пропана, углекислого газа и их смесей. 9. Композиция по п.8, в которой замещающий газ представляет собой азот. 10. Композиция по п.1, в которой антиоксидант представляет собой поглотитель кислорода или свободных радикалов или хелатирующий агент, причем антиоксидант присутствует в концентрации от приблизительно 0,01 до приблизительно 20 мМ. 11. Композиция по п.10, в которой антиоксидант присутствует в концентрации от приблизительно 1 до приблизительно 10 мМ. 12. Композиция по п.1, в которой антиоксидант представляет собой поглотитель кислорода или свободных радикалов и присутствует в концентрации от приблизительно 0,1 до приблизительно 10 мМ. 13. Композиция по п.1, в которой антиоксидант представляет собой поглотитель кислорода или свободных радикалов, выбранный из группы, состоящей из метионина, аскорбиновой кислоты, аскорбата натрия, L-альфа токоферола, DL-альфа токоферола, D-альфа токоферола, ацетата L-альфа токоферола, ацетата DL-альфа токоферола, ацетата D-альфа токоферола, бета-каротина, селена, пиритинола, пропилгаллата, бутилированного гидроксианизола, бутилированного гидрокситолуола, бутилированного гидрокситолуолметионина и их смесей. - 15 - 008038 14. Композиция по п.13, в которой антиоксидант представляет собой метионин и метионин является L-метионином. 15. Композиция по п.13, в которой антиоксидант представляет собой метионин, где метионин присутствует в таком количестве, что композиция содержит мольное отношение метионина, не принадлежащего TFPI, к метионину TFPI от приблизительно 1:1 до приблизительно 1000:1. 16. Композиция по п.1, в которой антиоксидант представляет собой хелатирующий агент, выбранный из группы, состоящей из: (i) амино-карбоксилатного соединения или его производного; (ii) EDTA или его производного; (iii) DTPA или его производного; (iv) BAPTA или его производного; (v) EGTA или его производного и (vi) смесей (ii), (iii), (iv) и (v). 17. Композиция по п.1, рН которой составляет от приблизительно 5 до приблизительно 6,5. 18. Композиция по п.1, осмолярность которой составляет от приблизительно 240 до приблизительно 600 мосмоль/л. 19. Композиция по п.18, осмолярность которой составляет приблизительно 290 мосмоль/л. 20. Композиция по п.1, период полураспада которой во время хранения составляет от приблизительно 1 до приблизительно 24 месяцев при температуре приблизительно 30°С. 21. Композиция по п.1, дополнительно содержащая буфер, выбранный из группы, состоящей из: (i) кислоты, в основном не содержащей солевой формы; (ii) кислоты в форме соли и (iii) смеси кислоты и солевой формы. 22. Композиция по п.21, в которой буфер представляет собой кислоту, в основном не содержащую солевую форму, при этом кислота выбрана из группы, состоящей из лимонной кислоты, янтарной кислоты, фосфорной кислоты, глутаминовой кислоты, малеиновой кислоты, яблочной кислоты, уксусной кислоты, винной кислоты и аспарагиновой кислоты. 23. Композиция по п.21, в которой буфер содержит смесь кислоты и солевой формы, где кислота выбрана из группы, состоящей из лимонной кислоты, янтарной кислоты, фосфорной кислоты, глутаминовой кислоты, малеиновой кислоты, яблочной кислоты, уксусной кислоты, винной кислоты и аспарагиновой кислоты, и солевая форма кислоты выбрана из группы, состоящей из натриевой, калиевой, кальциевой и магниевой соли основания, сопряженного с кислотой. 24. Композиция по п.23, в которой буфер выбран из группы, состоящей из лимонной кислоты/цитрата натрия, янтарной кислоты/сукцината натрия, фосфорной кислоты/фосфата натрия, глутаминовой кислоты/глутамата натрия, малеиновой кислоты/малеата натрия, яблочной кислоты/малеата натрия, уксусной кислоты/ацетата натрия, винной кислоты/тартарата натрия и аспарагиновой кислоты/аспартата натрия. 25. Композиция по п.21, в которой буфер присутствует в концентрации от приблизительно 5 до приблизительно 30 мМ. 26. Композиция по п.1, где ее процентная устойчивость к агрегации составляет от приблизительно 45% или более до приблизительно 50% или более. 27. Композиция по п.1, где ее процентная устойчивость к агрегации составляет от приблизительно 45% или более до приблизительно 99% или более. 28. Композиция по п.1, где ее процентная устойчивость к окислению составляет приблизительно 89% или более. 29. Композиция по п.1, где ее процентная устойчивость к окислению составляет от приблизительно 45% или более до приблизительно 99% или более. 30. Фармацевтическая композиция, содержащая водную композицию по п.1 и фармацевтически приемлемый наполнитель. 31. Фармацевтическая композиция по п.30, где ее процентная устойчивость к агрегации составляет от приблизительно 45% или более до приблизительно 99% или более. 32. Фармацевтическая композиция по п.30, где ее процентная устойчивость к окислению составляет от приблизительно 45% или более до приблизительно 99% или более. - 16 - 008038 Фиг. 1 Фиг. 2 Фиг. 3 - 17 - 008038 Фиг. 4 Фиг. 5 Фиг. 6 - 18 - 008038 Фиг. 7 Список последовательностей - 19 - 008038 Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 20 -