α1-глобулины
advertisement
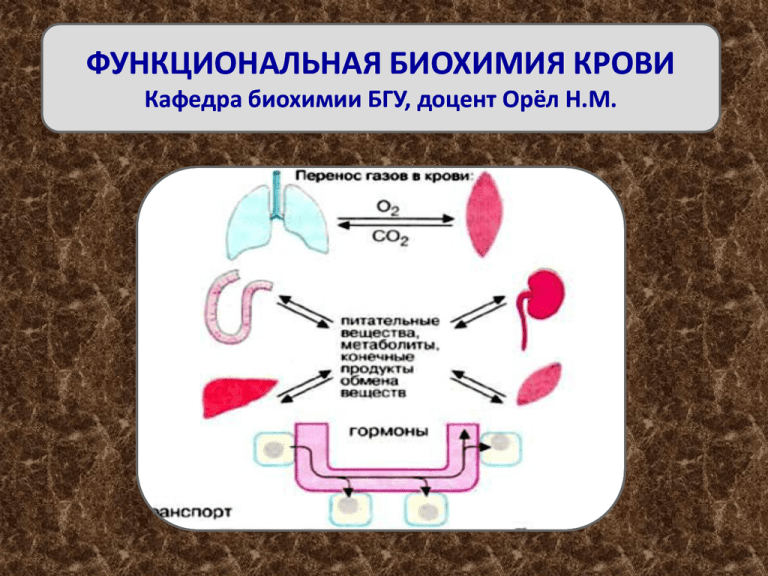
ФУНКЦИОНАЛЬНАЯ БИОХИМИЯ КРОВИ Кафедра биохимии БГУ, доцент Орёл Н.М. КРОВЬ – жидкая ткань, состоящая из клеток и плазмы Состав крови: плазма – 55 %, эритроциты – 44 %, остальные клетки – 1 %. Химический состав крови в норме относительно постоянен. Все случайные колебания в составе крови в здоровом организме быстро выравниваются. Биохимические функции крови - транспортная (транспорт газов, питательных веществ, метаболитов, продуктов обмена веществ, гормонов); - обезвреживающая; - защитная (иммунная защита); - гемостатическая; - регуляторная; - поддержание постоянства внутренней среды организма (гомеостазис): - поддержание химического состава; - поддержание постоянства рН (изогидрия) – (рН 7,36-7,40); - поддержание ионного состава (изоиония); - поддержание осмотического и онкотического давления (изоосмия) – (7,8 – 8,1 атм); - поддержание температуры – косвенно биохимическая (изотермия) (37,0-37,5). Биохимические функции клеток крови ЭРИТРОЦИТЫ Энергию (АТФ) получают путём окисления глюкозы до молочной кислоты (гликолиз), (90 %). Глюкоза поступает из плазмы, потребность 0,7 г в ч. Энергия необходима для поддержания трансмембранного градиента ионов Na+ и K+ , работу Na+, K+-АТФазы. Особенность гликолиза – образуется и 1,3 дифосфоглицерат, и 2,3 дифосфоглицерат – регулятор присоединения О2 к гемоглобину. В эритроцитах активно протекает пентозофосфатный цикл окисления глюкозы (10 %), в котором вырабатывается НАДФН+Н+, необходимый поддержания целостности мембран, инактивации пероксидов, проведения др. восстановительных реакций. Основная функция эритроцитов – связывать и переносить О2 от лёгких к тканям, а СО2 от тканей в лёгкие. • Содержат 34 % гемоглобина. Общее содержание его в крови 130-160 г/л или 750 г, в одном эритроците – около миллиона молекул. • За время своего существования (120 дней), эритроцит переносит от лёгких к тканям до 1 миллиарда молекул О2. Гемоглобин – состоит из протеина глобина и группы гема. Глобин содержит 4 полипептидных цепи (субъединицы) с м.м ~ 16 кДа. С каждой цепью связан 1 гем. 80 % аминокислотных остатков образуют α-спирали (обозначены A,B,C…H). АЛЛОСТЕРИЧЕСКИЕ ЭФФЕКТЫ В ГЕМОГЛОБИНЕ (Hb А) (BPG – 2,3-дифосфоглицерат) Типы гемоглобина (Hb): У взрослых – HbА1 (α2β2 -цепи) и небольшое количество HbА2 (иначе HbF) (α2δ2 -цепи) с более высоким сродством к О2. Эмбриональные (образуются в первые 3 месяца) – ξ2ε2 и α2γ2, затем вплоть до рождения доминирует HbF (фетальный α2δ2) – 80 % при рождении ребенка. В крови людей открыто более 300 вариантов гемоглобинов, вследствие мутации генов. Существуют ещё Hb : С, Д, Е, Ф, Н, 1, М, О. АНОМАЛЬНЫЕ Hb: 1. Hb S – в 6 положении β-цепи глобина глутаминовая кислота заменяется валином. У носителей гена HbS развивается серповидно клеточная анемия. Hb S после отдачи кислорода превращается в плохо растворимую форму, выпадает в осадок в виде веретенообразных кристаллоидов (тактоидов). Они деформируют клетку и приводят к гемолизу. Образование и обезвреживание активных форм кислорода в эритроците. НЕЙТРОФИЛЫ • Основной источник энергии глюкоза 90 % окисляется в гликолизе, менее интенсивно идет окислительное фосфорилирование. Небольшое количество глюкозы поступает в пентозофосфатный цикл. • Осуществляют биосинтез белков (малоактивно). Биохимические функции нейтрофилов: • Содержат большое количество лизосом (гидролазы разлагают фрагменты поврежденных тканей, мёртвые микроорганизмы). • Вырабатывают лизоцим. Содержат: миелопероксидазу, вырабатывающую Н2О2. НАДФ·Н-оксидазу – способствует образованию ·О2-. Н2О2 и О2 – сильные окислители, уничтожают микроорганизмы в момент фагоцитоза. Активация перекисного окисления липидов под действием Н2О2 и О2 может разрушать мембраны. Функционирует ферментативная (супероксиддисмутаза, каталаза, глутатионпероксидаза, церулоплазмин) и неферментативная (витамины Е,С, К, А и др.) системы защиты от активных форм кислорода. БАЗОФИЛЫ • Обладают мощным окислительным аппаратом. Глюкоза окисляется в гликолизе и ЦТК, интенсивно идет окислительное фосфорилирование. • Синтезируют белки (малоактивно). • Участвуют в аллергических реакциях – синтезируют медиаторы – гистамин, серотонин. Активно образуются в красном костном мозге при аллергии. • Продуцируют гепарин. Гепарин препятствует свертываемости крови, участвует в распаде ацилглицеролов, активируя липопротеинлипазу. Гистамин синтезируется путем декарбоксилирования гистидина: Серотонин синтезируется из триптофана путем его гидроксилирования с последующим декарбоксилированием Гепарин – включает повторяющийся тетрасахаридный компонент, состоящий из двух связанных α(1→4) дисахаридов. Дисахариды содержат βD-глюкуроновую кислоту и сульфатированный N–ацетилглюкозамин; сульфатированные L-идуроновую кислоту и N-ацетилглюкозамин. ЭОЗИНОФИЛЫ • Образование энергии путём гликолиза, окислительное фосфорилирование малоактивно. • Содержат набор лизосомальных ферментов, но отсутствует лизоцим. • Участвуют в аллергических реакциях (при сенсибилизации возрастает количество). • Накапливают и инактивируют гистамин. • Содержат пероксидазу. • Содержат профибринолизин, участвующий в растворении тромба. МОНОЦИТЫ (макрофаги) • Энергию получают путём гликолиза и окислительного фосфорилирования. • Имеют набор лизосомальных ферментов, интенсивно фагоцитируют микроорганизмы, вирусы, пыль и др. • По выполняемым функциям сходны с нейтрофилами. ЛИМФОЦИТЫ (сборная группа, различающаяся функционально) • Играют важную роль в формировании гуморального и клеточного иммунитета. • Энергию получают путём гликолиза, аэробный механизм малопродуктивен. • Имеют мощный аппарат синтеза белков (иммуноглобулинов), по активности превосходящий другие клетки крови и многие ткани. ТРОМБОЦИТЫ • Энергию получают в ходе гликолиза. • Участвуют во всех фазах свертывания крови (содержат тромбоцитарные факторы свертывания). • Содержат РНК и необходимые компоненты для биосинтеза белка. • Осуществляют разнообразные реакции обмена, накапливают серотонин. Почти все функции крови (за исключением специфических, выполняемых клетками крови) осуществляются плазмой. СОСТАВ ПЛАЗМЫ КРОВИ: 90 % ВОДЫ 10 % СУХОГО ОСТАТКА Минеральные вещества Безазотистые соединения глюкоза Белки 65-85 г/л Плазма Азотистые небелковые соединения Мочевина Билирубин фосфолипиды Креатин Кинины холестерин Аммиак Мочевая кислота Креатинин Полипептиды Биохимические показатели плазмы Большинство химических компонентов плазмы поступает из органов и тканей. Низкомолекулярные компоненты разнообразны, характеризуют различные стороны метаболизма органов и тканей, имеют важное значение для клинической биохимии. Макромолекулы секретируются печенью, эндокринными железами, слизистой кишечника, клетками крови и поступают активно путем экзоцитоза. Другие ткани и органы незначительно участвуют в формировании белкового состава плазмы. Биохимические функции крови определяются совместным участием химических компонентов клеток крови и плазмы. Содержание белков в плазме крови зависит от возраста • • • • • • у новорожденных – 48 - 73 г/л у детей до года – 47 - 72 г/л от 1 до 4 лет – 61 - 75 г/л от 5 до 7 лет – 52 - 78 г/л от 8 до 15 лет – 58 - 76 г/л у взрослых – 65 - 85 г/л Характеристика белков плазмы 1. Относительно стабильные белки: альбумины. 2. Нестабильные белки: иммуноглобулины (особенно Е, D) Концентрация нестабильных белков может возрастать в миллион раз. Биосинтез белков плазмы крови 1. Альбумины, фибриноген, 80 % глобулинов (все α-глобулины и частично β-глобулины) синтезируются в печени. 2. Иммуноглобулины синтезируют В-лимфоциты. 3. α2-Макроглобулины, белки системы комплемента синтезируют макрофаги. 4. Эритропоэтин синтезируется в почках. Катаболизм белков плазмы крови осуществляется: • в клетках эндотелия капилляров, • в мононуклеарах, • в клетках почечных канальцев. Белки сыворотки крови при электрофорезе на бумаге разделяются на 5 фракций: Одна фракция альбуминов; четыре фракции глобулинов: • α1-глобулины, • α2-глобулины, • β-глобулины, • γ-глобулины. Вместе с α- и β-глобулинами мигрируют липопротеины, с фракциями α1- и α2-глобулинов – гликопротеины При электрофорезе в блоке полиакриламидного геля на 16-17 фракций. При диск-электрофорезе в полиакриламидном геле на 29 фракций. При иммуноэлектрофорезе – более, чем на 30 фракций. Электрофореграмма белков в ПААГ Иммуноэлектрофорез – это комбинирование электрофореза и реакции преципитации непосредственно на гелевом блоке Содержание белков в плазме крови человека – 65-85 г/л альбумины 37-55 г/л, глобулины 20-30 г/л, фибриноген 2-4 г/л. АЛЬБУМИНЫ Преальбумин м.м. – 21 кД (0,18 -0,37 г/л) – первый пик на диск-электрофореграмме; транспортирует тироксин, витамин А. Индикатор нарушения белоксинтезирующей функции печени. Альбумины м.м. – 70 кД (37-55 г/л) 50-60% белков плазмы крови; растворимы в дистиллированной воде, в солях; не гликозилированы; синтезируются в печени, важнейшие молекулы-транспортеры. Выполняют функции: связывания воды; поддержания онкотического давления плазмы; транспортера магния, кальция, билирубина, жирных кислот, лизолецитина, прогестерона, лекарственных веществ (антибиотиков, сердечных гликозидов и др.). Являются формой депонирования белка в организме. ГЛОБУЛИНЫ Грубодисперсные белки; плохо растворимы в воде; синтезируются в печени, лимфоидной ткани; связаны с небелковым компонентом (гликозилированы); представлены рядом фракций: • • • • α1-глобулины, α2-глобулины, β-глобулины, γ-глобулины α1-ГЛОБУЛИНЫ составляют 2-5%. Эта группа включает: α1 – антитрипсин, α1 – серомукоид, α1 – орозомукоид, α1 – фетопротеин, протромбин, транскортин, ретинолсвязывающий белок, ЛПВП и др. α1-Антитрипсин (2-5 г/л) гликопротеин, мощный ингибитор протеиназ (трипсина, химотрипсина, плазмина, калликреина, эластазы); синтезируется клетками печени, выделяется в плазму, слюну, слезу, бронхиальные и назальные секреты, спинномозговую жидкость, дуоденальное содержимое. Функциональная роль: защита организма от действия протеолитических ферментов эндогенного и экзогенного происхождения (протеиназ крови, тканей, бактерий, грибов). 1мл сыворотки ингибирует 1 мг трипсина. α1-Гликопротеин (орозомукоид) (0,5-1,4 г/л) кислый белок, содержит до 40 % углеводов, участвует в транспорте стероидов, иммуномодулятор, подавляет активность Тлимфоцитов-киллеров. α1-Серомукоиды – плазменные гликопротеины (1 % белков плазмы и 12 % всех углеводов пазмы), кислые белки, основыне компоненты соединительной ткани, в плазму попадают при разрушении клеток. α1-фетопротеин у здоровых доношенных детей не выявляется, повышается при карциномах печени, тератокарциномах, после удаления карцином исчезает, при метастазах появляется вновь. Имеет значение для клинической диагностики. α₂-ГЛОБУЛИНЫ (7-13 %): гаптоглобин, церулоплазмин, α₂ –макроглобулин. Гаптоглобин (0,0-0,35 г/л) – молекула состоит из двух субъединиц, каждая содержит 4 полипептидные цепи. Связывает и транспортирует свободный гемоглобин в клетки ретикулоэндотелия. Связывает гемоглобин, препятствуя гемосидерозу тканей, почек. Комплекс Нb-гаптоглобулин повышает пероксидазную активность, бактерицидные свойства крови. В кровотоке гемоглобин комплексуется с гаптоглобином и гемопексином. Эти комплексы удаляются из крови печенью. Церулоплазмин - голубой белок, (0,25-0,45 г/л), молекула содержит 8 атомов меди. Функции: • является переносчиком ионов меди; • обладает антиоксидантными свойствами; • ферментативно окисляет 2-х валентное железо, увеличивает его всасывание, способствует включению в трансферрин; • детоксицирует путем окисления полифенолов, диаминов и др. • участвует в обмене эндогенных аминов; • усиливает пероксидазную активность плазмы; • является активатором гемопоэза; • относится к белкам острой фазы. ЦЕРУЛОПЛАЗМИН α₂ –Макроглобулин – цинксодержащий белок, включающий углеводный компонент (до 11 %), синтезируется вне печени, обладает 10 % всей протеиназной активности. Осуществляет: • ингибирование трипсина, тромбина, химотрипсина, плазмина, калликреина, • регуляцию свертывающей, фибринолитической, калликреиновой систем. В сыворотке крови содержится 4 ингибитора трипсина: • α₁–антитрипсин, • α₂ –макроглобулин, • интер-α-ингибитор трипсина, • термокислотостабильный ингибитор трипсина. β-ГЛОБУЛИНЫ (8-14%) • • • • • • трансферрин, гемопексин, ЛПНП, стероид-связывающий глобулин, β₂-микроглобулин, С3 и С4 – компоненты комплемента. Трансферрин (2-4 г/л) – транспортирует Fe3+ в крови. Комплекс окрашен в оранжевый цвет. Связаны с железом 1/3 молекул. Индивидуально специфичен – выявлено 19 типов трансферринов, различающихся по составу аминокислот и углеводному компоненту. Гемопексин – связывает Fe3+- гем, порфирин гемсодержащие хромопротеины и доставляет их в печень. В печени комплексы гемопексина распадаются, железо повторно используется. Уменьшает потери железа с мочой. Стероид-связывающий белок (гликопротеин)– синтезируется в печени и клетками иммунной системы. Биохимические функции: • белок острой фазы, (при острой фазе количество увеличивается в 1000 раз), • связывает и переносит половые гормоны (тестостерон, эстроген), • ингибитор агрегации тромбоцитов, • связывает фосфатидилхолин, поликатионы, полианионы, липиды, углеводы, • участвует в формировании гемопротеинов и каталазы, • неспецифический опсонин, • активирует комплемент, • способен связывать токсины, компоненты микроорганизмов, частиц поврежденных тканей. γ-Глобулины – составляют 12-22 % Включают в себя антитела, вырабатываемые организмом в ответ на введение чужеродных белков или других веществ с антигенной активностью. Выделяют 5 классов иммуноглобулинов: • • • • • Ig G, Ig A, Ig D, Ig M, Ig E. Основу молекулярной структуры Ig составляют 4 полипептидные цепи: 2 тяжёлые и 2 лёгкие, соединённые дисульфидными мостиками. Классы иммуноглобулинов
