генерация активных форм кислорода, перекисное окисление
advertisement

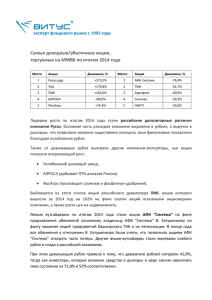
Биология УДК 58.02 + 577.352.4 Е.А. СПИВАК ГЕНЕРАЦИЯ АКТИВНЫХ ФОРМ КИСЛОРОДА, ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ И ПРОНИЦАЕМОСТЬ КЛЕТОЧНЫХ МЕМБРАН В ЛИСТЬЯХ ПРОРОСТКОВ ЯЧМЕНЯ (HORDEUM VULGARE L.) ПРИ ЗАСУХЕ Changes in ROS generation, lipid peroxidation product supply and cell membrane permeability under soil drought was studied in green barley (Hordeum vulgare L.) seedling leaves. ROS overproduction has been reported in barley seedlings, cultivated under drought since germination, which paralleled increases in lipid peroxidation. ROS production and lipid peroxidation intensified as the duration of drought raised. The increase in electrolyte output under prolonged drought was observed, suggesting the disturbance of membrane barrier properties. No changes in membrane permeability to free nucleotides occurred, indicating the absence of strong structure damage to barley seedlings cell membrane under experimental conditions in question. Засуха является одним из факторов, лимитирующих продуктивность сельскохозяйственных культур. Дефицит влаги вызывает значительные и постепенно усиливающиеся изменения большинства физиологических процессов у растения: задержку роста и развития, снижение скорости фотосинтеза, нарушение минерального питания и др. [1]. Первичной реакцией растения на заcуху на клеточном уровне является изменение окислительного потенциала, связанное с избыточной генерацией активных форм кислорода (АФК) [2]. Основные причины образования АФК в этом случае – перегрузка электрон-транспортной цепи хлоропластов, 51 Вестник БГУ. Сер. 2. 2010. № 1 связанная со снижением интенсивности фиксации CO2 в условиях стресса, и активация дыхательного процесса в митохондриях [3–5]. АФК играют двойную роль в ответе клетки на стрессовое воздействие. С одной стороны, они являются эндогенными сигнальными молекулами, участвующими в развитии устойчивости растения к стрессору [6–9], с другой – высокая реакционная способность АФК обусловливает их токсичность для клеток. В частности, действие АФК на клеточные мембраны проявляется в индукции процессов перекисного окисления липидов и деэтерификации жирных кислот, что приводит к увеличению проницаемости мембран для некоторых метаболитов и ионов [10, 11]. Целью настоящего исследования стало изучение генерации АФК, изменение содержания продуктов перекисного окисления липидов (ПОЛ) и барьерных свойств мембран в условиях почвенной засухи разной продолжительности. Материал и методика В качестве объекта исследования использовали 1-й настоящий лист зеленых проростков ячменя (Hordeum vulgare L.) сорта Гонар. Почвенную засуху моделировали в лабораторных условиях. Проростки выращивали в почве при следующем режиме: 14 ч света (освещенность 175 мкмоль квантов·м–2·с–1) и 10 ч темноты и температуре 23±2 ºС в течение 19 сут. Опытные растения не поливали с момента посадки. Сосуды с контрольными растениями взвешивали ежедневно и вес почвы в сосудах при необходимости доводили дистиллированной водой до первоначального значения. Пробы для анализа брали через 7, 10, 13, 16 и 19 сут после посадки. Долю влаги в почве определяли по формуле W = 100(mвл – mсух) / mвл, где W – доля влаги в почве; mвл – масса влажной; mсух – масса сухой (выдержанной в сушильном шкафу 6 ч при 105 °С) почвы соответственно [12]. Содержание АФК анализировали по методике, описанной в [13]. Для определения продуктов ПОЛ 1 г растительного материала гомогенизировали с 3 мл 50 % этанола. Гомогенат центрифугировали 5 мин при 7000 g. К 0,5 мл супернатанта последовательно добавляли 0,5 мл 1 % раствора тритона Х-100, 0,2 мл 0,6 М HCl и 0,8 мл 0,06 М раствора 2-тиобарбитуровой кислоты (ТБК). Реакционную смесь нагревали на кипящей водяной бане в течение 30 мин. Реакцию останавливали путем охлаждения проб проточной водой. Для стабилизации окраски добавляли 0,2 мл 5 мМ трилона Б и 1 мл 96 % этанола. Пробы спектрофотометрировали при 532 нм. Для сравнения использовали пробу, в которую добавляли указанные реактивы, кроме супернатанта и ТБК [14]. Проницаемость клеточных мембран оценивали по выходу электролитов и свободных нуклеотидов из листовой ткани ячменя. Выход электролитов определяли по методу [15], выход свободных нуклеотидов регистрировали согласно методу [16]. Для определения выхода электролитов брали навески листьев ячменя массой 0,5 г. Листья тщательно промывали дистиллированной водой, помещали в стеклянные пробирки, заливали 15 мл дистиллированной воды и инкубировали в течение 2 ч при температуре 20 ºС. Затем листья удаляли стеклянной палочкой и определяли электропроводность инкубационной среды с помощью кондуктометра HI9932 (HANNA Instruments, Германия). Из полученных значений электропроводности вычитали электропроводность используемой дистиллированной воды. Проницаемость клеточных мембран для свободных нуклеотидов оценивали по поглощению инкубационной среды при 260 нм на спектрофотометре Uvikon-931 (Германия). В статье представлены данные опытов в 3-кратной биологической повторности. Статистическую обработку данных проводили в программе «SigmaPlot 10.0». Результаты и их обсуждение При выращивании растений в течение 19 сут в условиях засухи доля влаги в почве снижалась с 51,9±0,4 до 22,0±1,7 %. Дефицит влаги в почве вызывал задержку роста и развития проростков ячменя. На 19 сут длина проростков, выращиваемых в условиях засухи, составляла 60 % от длины контрольных растений. Кроме того, у них наблюдалась задержка формирования третьего листа, в то время как у всех растений, выращиваемых при постоянном поливе, на 19 сут появлялся третий лист. Почвенная засуха сопровождалась снижением надземной массы опытных растений по сравнению с контролем: уже на 10 сут масса надземной части в опыте была на 20 % ниже, чем в контроле. Количество АФК увеличивалось с возрастом проростков как в условиях нормального водоснабжения, так и под действием засухи (рис. 1 а). Однако под действием почвенной засухи процесс генерации АФК проходил более интенсивно. Уже на 10 сут действия стрессового фактора содержание 52 Биология АФК в опыте на 28 % превышало их уровень в контрольных проростках. С ростом продолжительности стрессового воздействия разница в количестве АФК между контролем и опытом увеличивалась и к 16 сут достигла 60 %. На 19 сут содержание АФК резко снижалось в обоих случаях, оставаясь выше в опыте. Это можно объяснить снижением интенсивности обменных процессов в стареющем 1-м листе проростков ячменя. Клеточные мембраны являются одной из основных мишеней токсического действия АФК, которые способны запускать цепные реакции перекисного окисления мембранных липидов. Разрушение ненасыщенных жирных кислот и снижение количества полярных липидов в клетке приводит к изменению проницаемости мембран для некоторых веществ [17]. Таким образом, степень повреждения клеточных мембран у проростков ячменя в условиях засухи можно оценить по изменению уровня малонового диальдегида – одного из продуктов ПОЛ – и нарушению проницаемости клеточных мембран для электролитов и свободных нуклеотидов. В нашем исследовании увеличение уровня АФК привело к индукции процессов перекисного окисления липидов в листьях проростков ячменя, о чем свидетельствует увеличение содержания в них продуктов ПОЛ. Однако если разницу в уровнях АФК между контролем и опытом регистрировали уже на ранних этапах стрессового воздействия, то индукция процессов ПОЛ происходила на более поздних этапах. Так, на 7÷10 сут действия стрессового фактора содержание продуктов ПОЛ в Рис. 1. Накопление АФК (а) и продуктов ПОЛ (б) в 1-м листе опыте и контроле было одинаковым, на зеленых проростков ячменя, выращиваемых в течение 19 сут при 13 сут в опыте оно было на 16 % выше, постоянном поливе (1) и в условиях дефицита влаги в почве (2) чем в контроле, а на 16÷19 сут уже в 2 раза превышало значение, зарегистрированное в контроле (рис. 1 б). Несмотря на достаточно высокое содержание АФК и продуктов ПОЛ у проростков ячменя, подвергавшихся действию почвенной засухи в течение 7÷16 сут с момента прорастания, выход электролитов из ткани оставался на уровне контроля и только через 19 сут превысил его в 7 раз (рис. 2). Проницаемость клеточных мембран для свободных нуклеотидов в листьях ячменя в течение 19 сут не изменялась в обоих вариантах. Об этом свидетельствуют практически одинаковые значения поглощения инкубационной среды при 260 нм в контроле и опыРис. 2. Выход электролитов из 1-го листа проростков ячменя, те, которые составили 0,033±0,004 и выращиваемых в течение 19 сут при постоянном поливе (1) и в условиях дефицита влаги в почве (2) 0,037±0,005 соответственно. 53 Вестник БГУ. Сер. 2. 2010. № 1 Таким образом, у проростков ячменя, выращиваемых в условиях почвенной засухи с момента прорастания, происходит избыточная генерация АФК, которая сопровождается интенсификацией процессов ПОЛ. Выявлена тенденция к усилению процессов образования АФК и реакции ПОЛ у проростков при возрастании продолжительности стрессового воздействия. При длительной засухе отмечено увеличение выхода электролитов из ткани растений, что указывает на нарушение барьерных свойств клеточных мембран, но проницаемость мембран для свободных нуклеотидов не изменяется. Это является свидетельством отсутствия значительного структурного повреждения клеточных мембран у проростков ячменя в данных экспериментальных условиях. 1. L . X i o n g , J . - K . Z h u // Plant, Cell and Environment. 2002. Vol. 25. P. 131. 2. М е р з л я к М . Н . // Итоги науки и техники ВИНИТИ. Сер. физиол. растений. 1989. Т. 6. С. 1. 3. S m i r n o f f N . // New Phytol. 1993. Vol. 125. P. 27. 4. Ш а л ы г о Н . В . // Биосинтез хлорофилла и фотодинамические процессы в растениях. Мн., 2004. С. 77. 5. M i t t l e r R . // Trends Plant Sci. 2002. Vol. 7. P. 405. 6. A h m a d P . , S a r w a t M . , S h a r m a S . // J. of Plant Biology. 2008. Vol. 51. № 3. P. 167. 7. L o w P . S . , M e r i d a J . R . // Physiologia Plantarum. 1996. Vol. 96. P. 533. 8. N e i l l S . // New Phytologist. 2007. Vol. 175. P. 4. 9. H u n g S . - N . , Y u C h . - W . , L i n C . H . // Bot. Bull. Acad. Sin. 2005. Vol. 46. P. 1. 10. B l o k h i n a O . , V i r o l a i n e n E . , F a g e r s t e d t K . V . // Ann. Bot. 2003. Vol. 91. P. 179. 11. V a l e n t o v i č P . , L u x o v á M . , K o l a r o v i č L . , G a š p a r í k o v á O . // Plant Soil Environ. 2006. Vol. 52. № 4. P. 186. 12. К о в д а В . А . // Основы учения о почвах: в 2 ч. М., 1973. Ч. 2. С. 20. 13. К о з е л Н . В . , Ш а л ы г о Н . В . // Физиология растений. 2009. Т. 56. № 3. С. 351. 14. Р о г о ж и н В . В . , К у р и л ю к Т . Т . // Биохимия. 1996. № 8. С. 1432. 15. К о ж у ш к о Н . Н . // Методы оценки устойчивости растений к неблагоприятным условиям среды / Под ред. Г.В. Удовенко. Л., 1976. С. 33. 16. К о н е в С . В . , М а ж у л ь В . М . // Межклеточные контакты. Мн., 1977. С. 63. 17. К о з е л Н . В . , Ш а л ы г о Н . В . // Изв. НАН Беларуси. Серия биологических наук. 2008. № 3. С. 63. Поступила в редакцию 05.10.09. Елена Александровна Спивак – аспирант Института биофизики и клеточной инженерии НАН Беларуси. Научный руководитель – доктор биологических наук, заведующий лабораторией Института биофизики и клеточной инженерии НАН Беларуси Н.В. Шалыго. 54