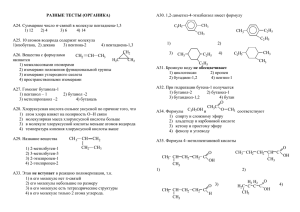
МИНИСТЕРСТВО КУЛЬТУРЫ РОССИЙСКОЙ ФЕДЕРАЦИИ «САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ КИНО И ТЕЛЕВИДЕНИЯ»
advertisement

МИНИСТЕРСТВО КУЛЬТУРЫ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ КИНО И ТЕЛЕВИДЕНИЯ» Кафедра общей, органической и физической химии ОРГАНИЧЕСКАЯ ХИМИЯ АЛИФАТИЧЕСКИЕ УГЛЕВОДОРОДЫ Учебное пособие для подготовки бакалавров направления 240100 «Химическая технология» и 241000 «Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии» САНКТ-ПЕТЕРБУРГ 2012 Составители: к.т.н., доцент Рясинская Н.К., к.т.н., доцент Велинзон П.3. инженер Гукасян В.Л. Под редакцией профессора, д.х.н. Чезлова И.Г. Рецензенты: д.х.н., профессор Ершов А.Ю. к.т.н., доцент Леликова Г.Ф. В учебном пособии рассматриваются классы алифатических углеводородов: насыщенные углеводороды - алканы, ненасыщенные алкены, алкадиены, алкины. Учебное пособие ставит своей целью помочь студентам в освоении теоретического курса органической химии и решении задач различного типа. Пособие состоит из разделов, включающих основы теории и примеры решения задач. Пособие рекомендовано студентам очного и заочного отделений, обучающимся по направлениям 240100 «Химическая технология» и 241000 «Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии» Рекомендовано к изданию в качестве общей, органической и физической химии. учебного пособия кафедрой Протокол № 3 от 28 октября 2011г. Одобрено Методическим Советом ФФиТРМ. Протокол № 4 от 11 декабря 2011г. © СПбГУКиТ 2 ВВЕДЕНИЕ Углеводороды – соединения, молекулы которых состоят только из атомов углерода и водорода. Они подразделяются на алифатические (ациклические) и циклические. В зависимости от наличия или отсутствия кратных связей (двойных и тройных) алифатические углеводороды делятся на алканы (предельные, насыщенные) и алкены, алкадиены и алкины (непредельные, ненасыщенные). В алифатических углеводородах атом углерода может находиться в трёх валентных состояниях. 1. ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМА УГЛЕРОДА И ЕГО ТРИ ВАЛЕНТНЫХ СОСТОЯНИЯ Рассмотрим электронный паспорт атома углерода в невозбуждённом (С) и в возбуждённом состоянии (С*): +6 С 1s2 2s2 2p2 +6 С* 1s2 2s1 2p3 Покажем его с помощью энергетических ячеек: C 2s в возбужденном состонии 2s 2p 1s C* 2p 1s В невозбужденном состоянии атом углерода имеет два неспаренных электрона. Для того чтобы вступить во взаимодействие с другими атомами и образовать с ними химические связи углерод должен перейти в возбужденное состояние (C*). У атома углерода в возбужденном состоянии имеет место энергетически выгодная промотация (перескок) электрона с s-уровня на рподуровень и углерод в возбуждённом состоянии (С*) имеет четыре неспаренных электрона, следовательно проявляет валентность, равную четырём. Эти четыре атомные орбитали (АО) имеют разную пространственную конфигурацию и такое состояние для атома углерода энергетически невыгодно. s - AO p - AO 3 Более низкой энергии атома углерода соответствуют четыре одинаковые АО, симметрично расположенные в пространстве. Американский ученый Л. Полинг (1931г.) ввел понятие гибридизации, согласно которому углерод участвует в образовании простых σ-связей не s- и р-АО, а гибридными (усреднёнными) АО. Следует помнить, что гибридизация – это не физическое явление, а чисто математическое. В зависимости от комбинации гибридных и негибридизованных орбиталей атом углерода может находиться в состоянии sp3-, sp2- или sp- гибридизации. sp3-Гибридизация. I-ое валентное состояние атома углерода. Этот тип гибридизации характерен для алканов и циклоалканов. В этих соединениях углерод образует простые σ-связи (сигма-связи) не s- и тремя рАО, а гибридными sр3-АО. s + 3p = sp3 - АО 4 В пространстве 4sр3-АО удалены друг от друга на угол 109°28´ (валентный угол). Электроотрицательность (Е) Сsр3 =2,5 (по шкале Полинга). 109 о 28/ Углерод-углеродная σ-связь образуется в результате перекрывания двух sр3–атомных орбиталей (АО) соседних атомов углерода, углеродводородная σ-связь в результате перекрывания sр3-АО атома углерода и s-АО водорода. С С С H σ-Связь имеет цилиндрическую симметрию относительно прямой линии, связывающей ядра атомов. Максимум перекрывания лежит на этой оси. 4 σ-Связь допускает свободное вращение атомов вокруг нее. Молекула метана с четырьмя идентичными заместителями у атома углерода представляет собой идеальный тетраэдр, геометрия которого обеспечивает минимальное отталкивание между четырьмя σ-связями. Молекула метана sp2-Гибридизация. II-ое валентное состояние углерода. Этот тип гибридизации характерен для алкенов, алкадиенов, аренов и соединений, содержащих двойную связь. C* p s s + 2p = sp2 - АО 3 Одна s- и две р-АО атома углерода гибридизуются и образуют три гибридные sр2-АО, расположенные в одной плоскости под углом 120°. Гибридные sр2-АО могут образовывать три σ-связи. р-АО, незатронутая гибридизацией, располагается перпендикулярно (под прямым углом) к плоскости, в которой лежат три sр2-АО и участвует в образовании π-связи. π-Связь образуется при боковом перекрывании р-АО соседних атомов углерода и имеет максимальное перекрывание над и под плоскостью. Электроотрицательность Е Сsр2 = 2.69 (по шкале Полинга) C π-Связь 5 C Так, в молекуле этилена три sр2-АО лежат в одной плоскости и участвуют в образовании трёх σ-связей, а р-АО двух атомов углерода образуют π-связь, располагающуюся перпендикулярно к плоскости молекулы. Молекула этилена sp- Гибридизация. III-е валентное состояние углерода. Этот тип гибридизации характерен для алкинов содержащих тройную связь. и соединений, C* 2n s+p 2 p s = sp - АО У атома углерода в sр-гибридизованном состоянии имеются две гтбридные sр-АО, расположенные на одной прямой в противоположных направлениях и образующие угол 180°. С их участием образуются две σсвязи. Две взаимно перпендикулярные негибридизованные р-АО участвуют в образовании двух π-связей. Так в молекуле ацетилена две sр-АО образуют две простые σ-связи, а две р-АО каждого из атомов углерода попарно перекрываются с образованием двух π-связей, расположенных во взаимно перпендикулярных плоскостях. Электроотрицательность Е Сsр = 2.74 (по шкале Полинга). Молекула ацетилена Ковалентные простые σ-связи гибридизованными sр3-, sр2- и sр-АО. 6 могут быть образованы только 2. АЛКАНЫ Алканами называются насыщенные (предельные) углеводороды, образующие гомологический ряд общей формулы С nH2n+2. Атомы углерода в предельных углеводородах находятся в sр3-гибридном состоянии и связаны с соседними атомами четырьмя простыми σ-связями. H CH4 H С CH3-CH3 H CH3-CH2-CH3 H метан этан пропан В таблице 1 приведены названия ряда алканов. Таблица 1 Формулы и названия ряда алканов Формула СH4 C2H6 C3H8 C4H10 C5H12 C6H14 C7H16 C8H18 Название метан этан пропан бутан пентан гексан гептан октан Формула C9H20 C10H22 C11H24 C12H26 C13H28 C14H30 C18H38 C20H42 Название нонан декан ундекан додекан тридекан тетрадекан октадекан эйкозан Номенклатура алканов По мере развития органической химии было предложено несколько различных систем и здесь мы остановимся на тех, которые используются в настоящее время. Первые четыре углеводорода имеют тривиальные названия (эмпирическая номенклатура). По систематической номенклатуре (научной, ИЮПАК, IUPAC) предельные углеводороды нормального строения называют исходя из греческого или латинского числительного (по числу атомов углерода) с добавлением суффикса – ан. 7 CH3-CH2- CH2- CH2-CH3 CH3-CH2-CH2-CH2- CH2-CH3 пентан гексан При отщеплении от молекулы алкана атома водорода образуется алкильный радикал (R·) – группа атомов, имеющих неспаренный электрон. Название радикала образуется от названия соответствующего алкана с заменой суффикса –ан на –ил. В таблице 2 приведены некоторые алканы и соответствующие им радикалы. Таблица 2 Названия, структурные формулы алканов и соответствующие им радикалы. Структура и название углеводорода СH4 метан CH3-CH3 этан Структура радикала CH3-CH2-CH3 пропан СH3CH3-CH2CH3-CH2–CH2CH3-CH -CH3 Название радикала метил этил н-пропил изопропил CH3-(CH2) 2-CH3 бутан CH3-CH2-CH2-CH2CH3-CH2-CH-CH3 н-бутил вторбутил CH3-CH-CH2- изобутил CH3 CH3CH(CH3)CH3 изобутан третбутил CH3-C-CH3 CH3 CH3-(CH2)3-CH3 пентан CH3-(CH2)3-CH2- пентил (амил) Разветвленные алканы получают названия на основе наиболее длинной углеродной цепи с добавлением приставок, обозначающих радикалы боковых цепей (группы, не вошедшие в основную цепь) с цифрами, указывающими, к какому атому углерода цепи они относятся. Нумерацию цепи производят так, чтобы сумма цифр при радикалах была бы наименьшей. CH3-CH-CH2-CH2-CH3 CH3-CH2-CH2-CH- CH2-CH3 CH3 CH2-CH3 2-метилпентан 3-этилгексан 8 Если одна и та же алкильная группа встречается более одного раза, то перед ней ставят приставку ди-, три- и т.д. CH3 CH3-CH-CH2-C-CH3 CH3 CH3 2,2,4-триметилпентан При наличии нескольких различных групп их перечисляют в порядке возрастания величины или в алфавитном порядке. CH3-CH-CH2-CН- CH2CH2-CH3 CH3 CH2-CH3 2-метил-4-этилгептан Если в алкане можно составить несколько цепей одинаковой длины, то главной выбирается та, в которой содержится наибольшее число алкильных заместителей. 7 6 4 5 3 CH3-CH-CH2-CН2- CH-CH2-CH3 2 1 CH3 Н3С-CH-CH3 2,6-диметил-3-этилгептан 5-изопропил-2-метилгептан (неверно - 2 заместителя) 3-изопропил-6-метилгептан (неверно - 2 заместителя) 2,6-диметил-5-этилгептан (неверно, так как сумма цифр больше) Иногда удобно использовать рациональную номенклатуру, в соответствии с которой в основу построения названия углеводорода ставится основоположник данного класса (для алканов - метан), а все группы (радикалы) записывают приставками, перечисляя их по старшинству. Количество одинаковых заместителей обозначают буквами (ди-, три-, тетраи т.д.). CH3-CH2--CH3 диметилметан CH3-CH2-CH2-CH3 метилэтилметан 9 Изомерия алканов 1. Структурная изомерия, связанная со строением углеродного скелета. CH3-CH2--CH2-CH3 CH3-CH-CH3 CH3 бутан изобутан Структурная изомерия обусловливает многообразие алканов; количество изомеров быстро растёт с увеличением числа атомов углерода в молекуле: бутан имеет 2 изомера, гексан - 5, октан - 18, декан - 75. 2. Пространственная, конформационная изомерия Свободное вращение атомов или групп атомов вокруг σ-связи создает возможность свободно менять расположение атомов в молекуле. Молекула представляет множественный набор возможных конформаций. Конформациями или поворотными изомерами являются наиболее устойчивые по энергии изомеры. Конформации изображают обычно в виде проекционных формул Ньюмена, которые ниже сопоставлены с козельными структурами. H CH3-CH3 H этан С H H С H H H H С H H H H HH H Формулы Ньюмена H С H H H H H H H H заторможенная конформация (более устойчивая) Промежуточные конформации называют скошенными. заслоненная конформация 10 H CH3 С H CH3-CH2--CH3 H пропан С H H H H H H H С H H H Типы углеродных и водородных атомов Каждый атом углерода в алкане удобно классифицировать по числу связанных с ним других углеродных атомов. Первичный атом углерода связан только с одним углеродным атомом, вторичный соединен с двумя, третичный – с тремя атомами углерода. Атомы водорода обозначают аналогично атомам углерода, с которыми они связаны. То же можно сказать и о углерод-водородных связях. Третичный атом углерода Вторичные атомы углерода H H H H H H C C C C C H H H H C H H H H Первичные атомы углерода 2.1. Способы получения алканов 1. Основными источниками предельных углеводородов являются нефть, которую подвергают фракционной перегонке, уголь, который гидрогенизируют при высоких температурах, и природный газ. 470°C, Fe nC + (n +1)H2 → CnH2n+2 250атм 11 2. Каталитическое гидрирование оксида углерода (II) – синтез ФишераТропша (1923г.) Ni, Co n CO + (2n +1)H2 → CnH2n+2 + n H2O 250-300ºС 400°C CO2 + 4H2 → CH4 + 2H2O Ni 3. Гидрирование непредельных углеводородов Pd, Pt, Ni СH3СН2СН2СH=CH2 + H2 1- пентен → t, p СH3СН2СН2СH2CH3 пентан 4. Восстановление галогенопроизводных углеводородов Ni СH3СН2СН2-Cl + H2 → СH3СН2CH3 + HCl СH3СН2СН2-J + HJ → СH3СН2CH3 + J2 5. Магнийорганический синтез абс. эфир СH3СН2-Cl + Mg ---------------→ СH3СН2-MgCl этилмагнийхлорид (реактив Гриньяра) Далее магнийорганическое соединение подвергают гидролизу или взаимодействию с алкилгалогенидом: СH3СН2-MgCl + H2O → СH3CH3 + Mg(OH)Cl СH3СН2-MgCl + СH3-Cl → CH3СН2CH3 + MgCl2 6. Реакция Вюрца (1855г.) 2СH3СН2-Br + 2Na → СH3СН2 СН2CH3 + 2NaBr Процесс образования углеводорода в этой реакции по П.П.Шорыгину включает на первой стадии образование натрийорганического соединения: СH3СН2-Br + 2Na → СH3СН2:‾‾ Na+ + NaBr 12 На второй стадии происходит замещение брома в бромэтане в результате атаки карбаниона: +δ ─δ ‾‾ + СH3СН2: Na + СH3СН2→Br → СH3СН2 СН2CH3 + NaBr При использовании в реакции Вюрца двух различных галогеналкилов получается смесь углеводородов: CH3CH2Br + 2Na + CH3Br → CH3CH2CH3 + CH3CH2CH2CH3 + CH3CH3 – 2NaBr пропан бутан Этан 7. Сухая перегонка солей карбоновых кислот с твёрдой щёлочью (метод Дюма). t CH3COONa + NaOH ТВ. → CH4 + Na2CO3 ацетат натрия метан В ряде случаев удобно проводить декарбоксилирование карбоновых кислот. t RCOOH → R-H + CO2 8. Электролиз солей карбоновых кислот (реакция Кольбе, 1849г.) электролиз + 2R-COO‾ Na + 2H2O → R-R + 2CO2 + 2NaOH + H2 электролиз + 2CH3COO‾ Na + 2H2O ацетат натрия → CH3-CH3 + 2CO2 + 2NaOH + H2 этан На аноде ацетат-ион CH3COO‾ превращается в свободный радикал ∙ CH3COO , который распадается на диоксид углерода и метильный радикал ∙ CH3 , который димеризуется с аналогичным радикалом. На катоде образуются водород и гидроксид натрия. Механизм электролиза подробно рассмотрен в задаче №7 (в теме «Алканы»). 2.2. Химические свойства алканов Алканы – малополярные и малореакционноспособные соединения. Для них характерны реакции замещения и крекинг, протекающие с разрывом связей С-Н и С-С, идущие по радикальному механизму, предполагающему гомолитический тип разрыва связи. 13 C C C C + Н + C H C H Эти процессы требуют больших энергетических затрат (высоких температур и облучения светом). Выход и состав продуктов во многом определяются относительной устойчивостью образующихся во время реакции радикалов. Устойчивость радикалов зависит от способности (возможности) свободного (неспаренного) электрона рассредоточиться по соседним связям С-С. Во время реакции в первую очередь образуются более устойчивые радикалы, для которых требуется затратить меньшее количество энергии. Устойчивость радикалов увеличивается от первичного к вторичному и далее к третичному. СН3 СН3 СН3-СН2 СН3-СН СН3-С СН3 СН3 Реакции радикального замещения Большой вклад в изучение радикальных цепных реакций внёс русский учёный Н.Н.Семенов. Наиболее значимыми являются реакции галогенирования, нитрования, сульфохлорирования и сульфоокисления. Галогенирование Галогенирование алканов протекает по радикальному механизму под действием квантов света или при высокой температуре. Реакционная способность галогенов убывает в ряду: F2 Cl2 Br2 J2 Наибольшее практическое значение имеет реакция хлорирования: CH3-CH2-CH3 + Cl2 h CH3-CH-CH3 + CH3-CH2-CH2Cl 25оС 45% Cl 55% 2-хлорпропан 1-хлорпропан 14 Механизм а) инициирование цепи h 2 Cl Cl 2 б) рост цепи CH3-CH2-CH3 + Cl CH3-CH-CH3 CH3-CH-CH3 Cl2 -HCl CH3-CH2-CH2 Cl + Cl CH3-CH2-CH2Cl в) обрыв цепи 2 Cl CH3-CH-CH3 + Cl Cl2 CH3-CH-CH3 Cl CH3-CH2-CH 2 + Cl CH3-CH2-CH 2Cl При низких температурах реакция хлорирования протекает региоселективно. Региоселективная реакция – реакция, в ходе которой химическим изменениям подвергается преимущественно одно из двух или нескольких положений молекулы, то есть избирательно по отношению к атомам водорода. Относительная реакционная способность первичных, вторичных и третичных атомов водорода по отношению к хлору составляет 1:4:5. Выход продукта галогенирования зависит также от фактора вероятности замещения первичных, вторичных и третичных атомов водорода в углеводороде (их количества). Подробный расчет относительного выхода изомерных моногалогенопроизводных углеводородов (при галогенировании алканов) приведен в задаче №.8 (в теме «Алканы»). Если реакция хлорирования проводится при высокой температуре, то получается иное соотношение изомерных галогенопроизводных. 450оC CH3-CH2-CH3 + Cl2 CH3-CH-CH3 + CH3-CH2-CH2Cl 75% Cl 25% 2-хлорпропан 1-хлорпропан При 450°С реакционная способность первичных и вторичных связей С-Н одинакова (1:1). Региоселективность реакции при повышении температуры резко уменьшается, то есть радикал хлора реагирует неизбирательно по отношению к атомам водорода. Кроме этого происходит расщепление молекулы углеводорода. 15 Бромирование алканов происходит значительно более региоселективно (более избирательно) из-за меньшей активности бромирующего агента. Относительная реакционная способность первичных, вторичных и третичных атомов водорода составляет 1:100:200, поэтому, если требуется получить третичный или вторичный галогеналкил, целесообразно проводить реакцию бромирования. 300оC CH3-CH2-CH3 + Br2 h CH3-CH-CH3 + CH3-CH2-CH2Br 8% Br 92% 2-бромпропан 1-бромпропан Имеются данные и о большем различии в относительной реакционной способности связей С-Н в реакции бромирования при других температурах. Нитрование Нитрование алканов проводят 10-20% HNO3 при 120-150оС (реакция Коновалова, 1888г.). СH3-CH 3 + HNO3 → СH3-CH2 NO2 + H2O Реакция протекает по свободнорадикальному нецепному механизму: HO-NO2 HO + NO2 СH3-CH3 + HO СH3-CH2 + H2O СH3-CH2 + NO2 СH3-CH2-NO2 или СH3-CH2 + HO-NO2 СH3-CH2-NO2 + OH Возможно проведение парофазного нитрования алканов (в газовой фазе при 350-500оС и 40-70% азотной кислотой HNO3). В этом случае реакция также протекает по механизму радикального замещения, однако сопровождается крекингом углеводорода (разрывом связей С-С). В результате образуются нитроалканы с меньшей молекулярной массой. CH3-CH2-CH3 HNO3 CH3-CH-CH3 + CH3-CH2-CH2 + CH3-CH2 + CH3 450о NO2 NO2 NO2 NO2 32% 34% 26% 8% Сульфохлорирование Сульфохлорирование алканов осуществляют при УФ-облучении при комнатной температуре (реакция Рида, 1936г.) по радикально-цепному механизму с получением сульфохлоридов. 16 R-H + SO2 + Cl2 h R-SO2-Cl + HCl хлорангидрид алкансульфокислоты Механизм: h 2 Cl Cl 2 R-H + Cl R + SO2 R-SO2 + Cl2 R + HCl R-SO2 R-SO2Cl + Cl В этой реакции замещение водорода у третичного углеродного атома не происходит вследствие пространственных факторов. CH3-CH- CH2-CH3 CH3 SO2, Cl2 CH3-CH- CH2-CH3 + CH3-CH- CH2-CH3 + h CH2SO2Cl CH3 SO2Cl 3- метил-2-сульфохлоридбутан (основной продукт) CH3-CH- CH2-CH2SO2Cl + HCl CH3 Сульфоокисление Сульфоокисление алканов при радикально-цепному механизму и алкансульфоновых кислот. УФ-облучении протекает по приводит к образованию R-H + SO2 + O2 h R-SO3H + H2O Окисление Предельные углеводороды устойчивы при низких температурах к большинству сильных окислителей (KMnO4, K2Cr2O7 и др.). Окисление происходит только в достаточно жестких условиях. В избытке кислорода наблюдается полное сгорание алканов до диоксида углерода и воды, при недостатке кислорода возможно частичное (до СО или С). СН4 + 2О2 → СО2 + 2Н2О 2СН4 + 3О2 → 2СО + 4Н2О СН4 + О2 → С + 2Н2О Окисление алканов в жидкой фазе происходит с расщеплением связей С-С и образованием смеси карбоновых кислот. 17 O2, 200oC, 30-90 атм. CH3-CH2- CH2-CH3 CH3-CООН Реакция окисления протекает по радикально-цепному механизму. Инициирование процесса проводится с помощью органических пероксидов, ∙ легко распадающихся на радикалы (R ). R + CH3-CH2- CH2-CH3 CH-CH2-CH3 -RH O-O O-O-CН-CH2-CH3 CH3 CH3 CH3-CH2- CH2-CH3 CH-CH2-CH3 + HO-O-CH-CH2CH3 CH3 CH3 o CH3-CH2- CH-O-OH 200 C CH3-CH2- CH-O - OH CH3 CH3 CH3-CH=О [O] CH3-CH2 + OH (С-С) разрыв CH3-CH2 + CH3-CH=О CH3-CООН [O] CH 3-CH2OH CH3-CH=О [O] CH3-CООН Изомеризация Изомеризация алканов – реакция, связанная с перестройкой углеродного скелета молекулы, происходит при нагревании с кислотами Льюиса (AlCl3, AlBr3). AlBr3, 50-200oC CH3-CH- CH3 CH3-CH2- CH2-СН3 CH3 При изомеризации углеводородов с большой молекулярной массой образуются смеси изомеров сложного состава. Дегидрирование Дегидрирование или отщепление водорода от алканов – реакция, обратная гидрированию ненасыщенных углеводородов. Для отщепления водорода в качестве катализаторов применяют оксиды металлов (Сr2O3, Fe2O3, ZnO) при температуре 450-650°С, металлы (Pt, Pd, Ni, Fe) при ~ 300°С. 1200oC, 0,01c 2CH4 CH CH + 3 H2 CH3-CH3 800oC CH2 18 CH2 + H2 CH3-CH2- CH2-СН3 Cr2O3/Al2O3 CH2=CH- CH2-СН3 +CH3-CH=CH-СН3 + H2 1- бутен 2-бутен 450oC CH2=CH- CH=СН2 + 2H2 1,3- бутадиен Если в цепи алкана содержится шесть и больше атомов углерода, то дегидрирование (риформинг) может завершиться образованием энергетически выгодным ароматическим углеводородом. CH3-(CH2)5-СН3 Cr2O3 400oC CH3 -3H2 -H2 гептан CH3 метилциклогексан толуол Крекинг Крекинг – высокотемпературный процесс (450-700оС) разложения алканов с большой молекулярной массой в присутствии катализаторов, в результате которого образуется смесь насыщенных и ненасыщенных низкомолекулярных углеводородов (за счет разрыва связей С-С и С-Н). t CH3-CH2-CH2-CH3 → CH3-CH3 + CH2=CH2 В процессе крекинга образуются углеводородные (алкильные) радикалы, превращения которых и определяют состав образующихся продуктов. Рассмотрим возможные превращения алкильных радикалов на примере н-пентильного радикала, образование которого может явиться результатом термической диссоциации связи С-Н в н-пентане: CH3-CH2- CH2-СН2-CH2-Н CH3-CH2- CH2-СН2-CH2 или связи С-С, например, н-декана: CH3-(CH2)3- CH2-CH2-(СН2)3-CH3 2 CH3-(CH2)3- CH2 Стабилизация свободного радикала, несущего неспаренный электрон, возможна за счет распада связей β(С-С) или β(С-Н). Так, при распаде связи β(С-С) образуется пропильный радикал и этилен: 19 CH3-CH2- CH2-СН2-CH2 CH3-CH2- CH2 + CH2-CH2 CH2=CH2 Распад связи β(С-С) пропильного радикала приводит к образованию этилена и метильного радикала, димеризация которого дает этан: CH3-CH2- CH2 CH3 + СН2=СН2 CH3 + CH3 СН3-СН3 При распаде связи β(С-Н) имеет место диспропорционирование радикалов по схеме: CH3-CH2- CH2-СН-CH2 Н + CH3-CH2- CH2-СН=CH2 1 пентен Н Н + CH3-CH2- CH2-СН2-CH2 CH3-CH2- CH2-СН2-CH2 пентан Возможна (но мало вероятна) димеризация радикалов: 2 CH3-(CH2)3- CH2 CH3-(CH2)3- CH2-CH2-(СН2)3-CH3 2.3. ЗАДАЧИ ПО ТЕМЕ «АЛКАНЫ» Задача № 1. Назовите по научной (ИЮПАК) и рациональной номенклатурам следующие углеводороды: а) CH3–СН – СН – СН-СН3 | | | СН3-СН2 СН3 СН3 б) CH3–СН–СН–СН2-СН3 | | Н3С СН(СН3)2 в) CH3–СН(СН3)–С(СН3)2–С(СН3)2-СН3 г) CH3–СH–СН2–СН-СН3 | | Н3С CH3-СН-СН2-СН3 Решение 4 3 2 1 а) CH3 – СН – СН – СН - СН3 6 5| | | СН3-СН2 СН3 СН3 20 Для наименования углеводорода по научной номенклатуре (ИЮПАК) выбираем самую длинную неразветвлённую цепь углеродных атомов и нумеруем её с одного из концов таким образом, чтобы сумма цифр при заместителях была наименьшей. Затем называем главную цепь (гексан) и добавляем в виде приставок названия и положения боковых заместителей. Приведенное вещество называется 2,3,4-триметилгексан. Для названия соединения по рациональной номенклатуре выбираем центральный третий атом углерода (выделен жирным шрифтом), называем радикалы, связанные с этим атомом углерода по старшинству, и добавляем слово метан, получаем метилизопропилвторбутилметан. 1 2 3 б) CH3 – СН – СН – СН2 - СН3 | |4 5 CH3 – СН(СН3)2 2,4-диметил-3-этилпентан, этилдиизопропилметан в) CH3–СН(СН3)–С(СН3)2–С(СН3)2-СН3 2,2,3,3,4,-пентаметилпентан, диметилизопропилтретбутилметан 1 2 3 4 г) CH3 – СН – СН2 – СН - СН3 | |5 6 7 Н3С CH3 – СН - СН2 - СН3 2,4,5-триметилгептан, метилизобутилвторбутилметан. Задача № 2. Напишите структурные формулы следующих углеводородов: а) диметилэтилизопропилметана, б) метилэтилвторбутилметана, в) диэтил диизопропилметана, г) метилбутилтретбутилметана. Решение СН3 | а) CH3–H2C-С–СН–СН3 | | H3C СН3 в) б) СH3-СН-СН3 | CH3–СН2–С–СН2-СН3 | CH3–СН-СН3 CH3–СН2–СH–СН-СН2-СН3 | | Н3С СН3 Н3С СН3 | | г) CH3–СН2–СН2–СН2-С–С-СН3 | | Н СН3 21 Задача № 3. Напишите структурные формулы и назовите соединения по научной и рациональной номенклатурам: Решение В задаче соединения представлены формулами Ньюмена. Для изображения структурной формулы записываем два углеродных атома, относительно которых в формуле Ньюмена происходит вращение, а затем соответствующие заместители у этих атомов. 1) Н3С Н | ↔| CH3 – Н2С – С – С – Н 2-метилбутан, диметилэтилметан | | Н Н 2) H Н СН3 | ↔ | | CH3 –С – С – СH – СН3 2-метилпентан, этилизопропилметан | | H Н Задача № 4. Изобразите, пользуясь формулами Ньюмена, конформацию бутана по связи C2-C3. Какая конформация более устойчива? Решение 1 2 ↔3 4 СН3–СН2 – СН2–СН3 σ – Симметрия простой связи допускает вращение атомов или групп атомов относительно этой связи. Изобразим конформации и энергетический профиль вращения вокруг связи С2-С3 в бутане. 22 CH3 H3C CH3 H H H H H H3C H CH3 H H H H CH3 H H 0 3 2 1 ° 60 CH3 H H 120 CH3 CH3 H H H 180 H H 6 5 ° H H CH3 4 ° CH3 H3C H H H ° 240 ° 300 ° Конформации с высокой энергией называются заслонёнными, а конформации с низкой энергией – заторможенными. Заслоненные конформации бутана не совсем одинаковы. Две из них (3ас и 5-ас) содержат в заслоненном положении метильную группу и атом водорода, а в конформации (1-sp) заслонены две метильные группы. Заторможенные конформации бутана (2-sc, 6-sc, 4-ар) также неодинаковы. В бутане наиболее устойчива конформация антиперипланарная (4-ар). 23 Задача № 5. Изобразите, используя формулы Ньюмена, конформации этаноламина (НО-СН2-СН2-NН2) по связи С–С. Какой из конформеров наиболее устойчив? Решение ↔ HО-СН2 – СН2-NН2 Изобразим возможные конформации этаноламина при вращении вокруг связи С–С. HO HO NH2 H H H H H HO H NH2 H H H H NH2 H H HO HO HO H H H H H 3 2 1 H2N H H H H H H H2N H NH2 6 4 5 Следовало ожидать, что наиболее энергетически выгодным является 4 конформация, так как достигается наименьшее отталкивание функциональных групп -ОН и -NН2. Однако в конформациях 2 и 6 образуются внутримолекулярные водородные связи и они оказываются более энергетически выгодными по сравнению с 4 конформацией. OH NH2 H H H H 24 Задача № 6. Получите 2,3-диметилбутан и 3-метилпентан по реакции Вюрца. Какие галогенопроизводные углеводородов нужно использовать? Решение Для проведения реакции Вюрца необходимо использовать алкилгалогениды и металлический натрий. Следует помнить, что в этой реакции происходит удлинение углеродной цепи, а если берется один галогеналкил (симметричный синтез), то цепь удваивается. Для получения 2,3-диметилбутана целесообразно использовать 2-хлорпропан, так как единственным продуктом реакции будет 2,3-диметилбутан. СH3–CH-Cl + 2Na + Cl–CH–CH3 → CH3–CH–CH–CH3 + 2NaCl | СH3 | | СH3 | СH3 СH3 Для синтеза 2-метилпентана можно взять два алкилгалогенида, например, хлорэтан и 2-хлорпропан. СH3–CH-Cl + 2Na + Cl–CH2–CH3 → CH3–CH–CH2–CH3 + 2NaCl | | СH3 СH3 2-метилбутан Наряду с 2-метилбутаном в этой реакции образуется еще два продукта: СH3–CH-Cl + 2Na + СН3–CH–Сl → CH3–CH–CH–CH3 + 2NaCl | | | | СH3 СH3 СH3 СH3 2,3-диметилбутан СH3–CH2-Cl + 2Na + Cl–CH2–CH3 → CH3–CH2–CH2–CH3 + 2NaCl бутан Задача № 7. Какие углеводороды получаются из изовалериановой кислоты ((СН3)2СН-СН2СООН): 1) при электролизе ее натриевой соли, 2) при нагревании с твердой щелочью? Решение Натриевую соль кислоты получают реакцией кислоты с водным раствором щелочи: (СН3)2СН-СН2СООН + NaOHводн. → (СН3)2СН-СН2СОО‾ Na+ + H2O 25 1) Na-соль кислоты в водном растворе диссоциирует на ионы: (СН3)2СН-СН2СОО‾ Na+ → (СН3)2СН-СН2СОО‾ + Na+ При электролизе (реакция Кольбе) на аноде происходят следующие процессы: ∙ (СН3)2СН-СН2СОО‾ ― ē → (СН3)2СН-СН2СОО Образующийся радикал неустойчив и стабилизируется за счёт β(С-С)-распада: ∙ (СН3)2СН-СН2СОО → (СН3)2СН-СН2∙ Далее радикалы димеризуются: 2 СH3–CH-CH2∙ → CO2 CH3–CH–CH2–CH2–CH–CH3 | | СH3 + | СH3 СH3 2,5-диметилгексан реакция Кольбе приводит Таким образом, к синтезу 2,5диметилгексана. 2) При щелочном сплавлении Na-соли изовалериановой кислоты (реакция Дюма) происходит потеря карбоксильной группы: t + СН3)2СН-СН2СОО‾ Na + NaOHтв → (СН3)2СН-СН3 + Na2СО3 изобутан Задача № 8. Определите изомерный состав и выход монохлоропроизводных 2,2,4триметилпентана, полученных при его хлорировании при 25°С. Относительная реакционная способность третичных, вторичных и первичных атомов водорода по отношению к хлору составляет 5:4:1. Решение hυ Cl―Cl СН3 ∙ СН3 CH3-C-CH2-CH-CH3 СН3 ∙ → Cl + Cl Cl -HCl СН3 СН3 CH3-C-CH2-CH-CH3 СН2 СН3 Cl2 h -Cl СН3 Cl -HCl CH3-C-CH-CH2-CH3 СН3 СН3 26 Cl2 h -Cl CH3-C-CH2-CH-CH3 СН2Cl СН3 1-хлор-2,2,4-триметилпентан СН3 CH3-C-CH-CH-CH3 Н3С Cl СН3 3-хлор-2,2,4-триметилпентан СН3 Cl -HCl СН3 CH3-C-CH2-C-CH3 СН3 СН3 Cl2 h -Cl Cl CH3-C-CH2-C-CH3 Н3С СН3 2-хлор-2,4,4-триметилпентан СН3 Cl -HCl СН3 CH3-C-CH2-CH-CH2 СН3 СН3 Cl2 h -Cl CH3-C-CH2-CH-CH2Cl СН3 СН3 1-хлор-2,4,4-триметилпентан При хлорировании 2,2,4-триметилпентана возможно получение четырёх изомерных монохлорпроизводных. Процентное содержание этих продуктов зависит от двух факторов: реакционной способности первичного, вторичного и третичного атомов водорода, которая составляет, по условию задачи, 1:4:5 и фактора вероятности замещения этих атомов водорода в молекуле для получения каждого соединения. Фактор вероятности составляет для: 1-хлор-2,2,4-триметилпентан - 9, 3-хлор-2,2,4-триметилпентан - 2, 2-хлор-2,4,4-триметилпентан - 1, 1-хлор-2,4,4-триметилпентан - 6. Общее количество возможных замещений атомов водорода с учётом их реакционной способности составляет: 9*1 + 2*4 + 1*5 + 6*1 = 28 (100%) Доля каждого продукта составляет: 1 вещество – 1-хлор-2,2,4-диметилпентан (9*100)/28 = 32% 2 вещество – 3-хлор-2,2,4-триметилпентан (8*100)/28 = 28,6% 3 вещество – 2-хлор-2,4,4-триметилпентан (5*100)/28 = 18% 4 вещество – 1-хлор-2,4,4-триметилпентан (6*100)/28 = 21,4% Задача № 9. Какие продукты могут образоваться при хлорировании бутана до монохлорпроизводных углеводородов? Решение hν Cl2 → 2Cl ∙ 27 Cl -HCl CH3-CH-CH2-CH3 Cl2 CH -CH-CH -CH 3 2 3 Cl 2-хлорбутан CH3-CH2-CH2-CH3 Cl -HCl CH3-CH2-CH2-CH2 Cl2 CH -CH -CH -CH 3 2 2 2 Cl 1-хлорбутан В результате реакции хлорирования получаются два основных продукта: 2-хлорбутан и 1-хлорбутан. На промежуточных стадиях образуются радикалы, которые могут димеризоваться и давать побочные продукты: CH3-CH2-CH-СH-CH2-CH3 2CH3-CH-CH2-CH3 H3C CH 3, 4-диметилгексан 2CH3-CH2-CH2-CH2 CH3-(CH2)6-CH3 CH3-CH-CH2-CH3 + СН3-CH2-CH2-CH2 октан CH3-CH2-CH-(СH2)3-CH3 CH 3-метилгептан Задача № 10. Осуществите следующую схему превращений: Br2 Na СН3-СН2-СН3 → А → В HNO3, разб → hυ D t Назовите все промежуточные и конечные продукты. Решение При бромировании пропана получится преимущественно вторичное бромопроизводное, так как реакционная способность вторичных атомов по отношению к брому в 100 раз выше, чем первичных: Br2 СН3-СН2-СН3 → СН3-СН–СН3 + НBr hυ | Br 2-бромпропан 28 С металлическим натрием протекает реакция Вюрца: Na 2 СН3- СН–СН3 → СН3- СН – СН–СН3 | | Br | Н3С СН3 2,3-диметилбутан При действии разбавленной азотной кислоты протекает реакция Коновалова: NO2 HNO3, разб СН3- СН – СН–СН3 | Н3С → | СН3-СН–С–СН3 + СН3-СН–СН–СН2NO2 | | СН3 | Н3С СН3 2-нитро-2,3диметилбутан | Н3С | СН3 1-нитро-2,3диметилбутан Задача № 11. Какие продукты могут образовываться при парофазном нитровании пропана азотной кислотой при 450°С? Решение Нитрование пропана при 450°С протекает по радикально-цепному механизму. Замещению будут подвергаться первичные и вторичные атомы водорода. Основные продукты нитрования пропана: HO-NO 2 OH + NO2 СН3- СН2-СН3 + OH СН3- СН-СН3 + HO-NO2 СН3-СН-СН3 + H2O СН3- СН-СН3 + OH NO2 2-нитропропан СН3-СН2–СН3 + ∙OH → СН3–СН2–СН2∙ + H2O СН3–СН2–СН2∙ + HO-NO2 → СН3–СН2–СН2 NO2 + ∙OH 1-нитропропан При 450°С также может иметь место термическая диссоциация связи С-С, поэтому необходимо учитывать возможность образования нитрометана СН3NO2 и нитроэтана СН3СН2NO2. 29 t СН3-CH2СН3 → СН3∙ + СН3-СН2∙ СН3∙ + HNO3 → CH3-NO2 + ∙OH СН3–СН2∙ + HNO3 → СН3-СН2-NO2 + ∙OH 3. АЛКЕНЫ Алкенами называются углеводороды, содержащие одну двойную связь С=С и образующие гомологический ряд общей формулы СnH2n. CH2=CH2 этен этилен CH2=CH-CH3 пропен пропилен CH2=CH-CH2-CH3 1-бутен бутилен Атомы углерода, образующие двойную связь, находятся в sp2-гибридном состоянии. Номенклатура Названия этиленовых углеводородов (алкенов) по научной номенклатуре (ИЮПАК) производят от названий соответствующих им предельных углеводородов (алканов) с заменой суффикса –ан на –ен. В названии алкена цифрой указывается положение двойной связи. При этом нумерацию углеродных атомов главной цепи ведут таким образом, чтобы атом углерода при двойной связи получил минимальное числовое значение. CH3-CH2-CH=CH-CH3 CH3-CH2-C=CH-CH3 | CH2-CH2-CH3 2-пентен 3-этил-2-гексен По рациональной номенклатуре этиленовые углеводороды рассматриваются как замещённые этилена. CH3-CH=CH2 метилэтилен CH3-CH2-CH=CH-CH3 сим.-метилэтилэтилен CH3-CH2-C=CH-CH-CH3 | | CH3 CH3 α-метил-α-этил-β-изопропилэтилен Алкильные радикалы, содержащие двойные связи, имеют тривиальные названия: 30 CH2=CHвинил CH2=CH-CH2аллил Изомерия Для этиленовых углеводородов характерны три вида изомерии. 1. Изомерия углеродного скелета CH2=CH-CH2-CH2-CH3 CH2=CH-CH-CH3 | CH3 3-метил-1-бутен 1-пентен 2. Изомерия положения двойной связи CH2=CH-CH2-CH3 1-бутен CH3-CH=CH-CH3 2-бутен 3. Пространственная (геометрическая) изомерия Геометрическая изомерия определяется расположением заместителей относительно двойной связи. Заместители, расположенные по одну сторону от плоскости двойной связи, находятся в Ζ-(цис)-положении относительно друг друга, если они расположены по разные стороны двойной связи- то в Ε(транс)-положении. CH3 CH3 H С=С H CH2-CH3 С=С H CH2-CH3 Е-2-пентен H Z-2-пентен (транс) (цис) CH3 CH3 H CH3 С=С H CH-CH3 С=С CH-CH3 CH3 H Е-4-метил-2-пентен 31 H Z-4-метил-2-пентен 3.1. Способы получения алкенов 1. Дегидратация спиртов Кислотная дегидратация спиртов протекает при нагревании в присутствии кислых катализаторов (H2SO4, H3PO4). Направление отщепления воды определяется правилом Зайцева: наряду с гидроксильной группой наиболее легко отщепляется водород от соседнего наименее гидрогенизированного атома углерода. H2SO4 CH3-CH2-CH-CH3 → CH3-CH=CH-CH3 | t транс-2-бутен OH основной продукт Механизм H+ → CH3-CH2-CH-CH3 CH3-CH2-CH-CH3 → | | –H2O + OH OH2 + –H → CH3-CH=CH-CH3 СН3 СН3-С-ОН + CH3-CH2-CH-CH3 → СН3 H2SO4 t СН3 СН3_С= СН2 + Н2О изобутилен H2SO4 СН3СН2 СН2СН2OH СН3СН= СНСН3 + СН3СН2- СН=СН2 + Н2О о 2-бутен 1-бутен н-бутиловый спирт t140 C основной продукт Дегидратацию спиртов также проводят пропусканием их паров над катализатором (Al2O3) при температуре 300-400°C. СН3СН2СН2OH Al2O3 350о СН3 СН=СН2 + Н2О пропен Реакционная способность спиртов в реакции дегидратации определяется образованием более устойчивого карбкатиона и изменяется в следующем порядке: первичные < вторичные < третичные. 2.Дегалогенирование вицинальных дигалогенопроизводных алканов 32 СН3-СН- СН-СН2-СН3 Zn -ZnBr2 СН3-СН=СН-СН2-СН3 Br Br 2,3-дибромпентан 2-пентен 3. Дегидрогалогенирование галогенопроизводных алканов Реакция осуществляется под действием сильных оснований в спиртовом растворе. Дегидрогалогенирование происходит преимущественно по правилу Зайцева. СН3-СН- СН-СН2 H Cl H KOH сп. р-р -КCl, -H2O СН3-СН=СН-СН3 + СН3-СН2-СН=СН2 2-бутен (80%) 1-бутен (20%) 4. Восстановление алкинов При использовании соответствующих реагентов реакция может протекать стереоселективно с получением раздельно цис- и транс-изомеров. H3C 2Na, NH3 (ж) СН3-С H С=С CH3 + 2NaNH2 H транc-2-бутен С-СН3 H2, Pd H3C С=С CH3 H H цис-2-бутен 5. Каталитическое дегидрирование предельных углеводородов Дегидрирование алканов проводят с катализатором триоксидом хрома при температуре до 450°С. CH3-CH2-CH2-CH3 Cr2O3 CH3-CH=CH-CH3 + CH3-CH2-CH=CH2 + H2 300oC Cr2O3 (CH3)2CH-CH3 (CH3)2C=CH2 изобутан изобутилен Крекинг алканов осуществляют при более высоких температурах и протекает он менее однозначно. 33 o CH3-CH2-CH2-CH3 700-800 C CH3-CH=CH2 + CH2=CH2 + СH4 + СН3-СН3 + бутан пропен этен метан этан + CH2=CH-CH2-CH3 + CH3-CH=CH-CH3 + Н2 1-бутен 2- бутен 3.2. Химические свойства алкенов В этиленовых углеводородах π-связь менее прочная, чем σ-связь, поэтому атака реагентов направлена в первую очередь на π-систему. Поскольку электронная плотность π-связи сосредоточена на периферии, она легко подвергается атаке реагентов, обеднённых электронами, таких как электрофильные частицы или радикалы. Реакции электрофильного присоединения Галогенирование Этиленовые углеводороды присоединяют галогены с высокой скоростью в мягких условиях, образуя вицинальные дигалогенопроизводные предельных углеводородов. Хлорирование и бромирование- наиболее распространённые реакции, чего нельзя сказать о фторировании и иодировании. Фтор - чрезвычайно активный реагент и реакция приводит к получению смеси продуктов. Иод, наоборот, присоединяется очень медленно. Бромирование алкенов служит качественной реакцией на двойную связь, поскольку сопровождается изменением окраски, вызванной обесцвечиванием брома (в растворе CCl4 бром имеет красный цвет) по мере его присоединения по двойной связи. CH3-CH=CH2 + Br2 CCl4 25oC CH3-CH-CH2 Br Br 1,2- дибромпропан Механизм CH3-CH=CH2 + Br2 CCl4 25oC CH3-CH-CH2Br - комплекс - Br-Br - комплекс Br + CH3-CH=CH2 CH3-CH-CH2Br Br 34 Реакция электрофильного присоединения протекает в направлении образования энергетически выгодного σ-комплекса (третичный > вторичный > первичный). Присоединение галогеноводородов К двойной связи могут присоединяться все галогеноводороды. Реакционная способность увеличивается с повышением кислотности (электрофильности) в ряду HF < HCl< HBr < HI. CH3-СН2-CH=CH2 + HBr CH3-СН2-CH-CH3 Br 2-бромбутан Механизм CH3-СН2-CH=CH2 Н+ CH3-СН2-CH=CH2 Н+ -комплекс Br CH3-СН2-CH-CH3 -комплекс CH3-СН2-CH-CH3 Br Водород кислоты присоединяется к атому углерода при двойной связи, имеющему наибольшее число атомов водорода, то есть наиболее гидрогенизированному (правило Марковникова). Реакция протекает через образование наиболее устойчивого карбкатиона (третичные > вторичные > первичные). Однако, направление присоединения галогеноводородов к производным алкенов во многом определяется поляризацией двойной связи. Так, при взаимодействии 1,1,1-трифторпропена с HBr образуется 1,1,1трифтор-3-бромпропан в соответствии с поляризацией двойной связи в исходном продукте. F F H Br F C CH2-CH2Br F C CH= CH2 F F Присоединение хлорноватистой и бромноватистой кислот При взаимодействии алкенов с хлорноватистой или бромноватистой кислотами или с водными растворами галогенов образуются галогеноспирты (галогенгидрины), у которых гидроксильная группа и галоген находятся у соседних атомов углерода. 35 Br2 + H2O СH3-CH-CH2Br (HOBr) СH3-CH=CH2 OH 1-бром-2-пропанол Механизм - СH3-CH = CH2 + Br-Br СH3-CH-CH2 -Br +H2O -Br + СH3-CH-CH2 -Br -Н СH3-CH-CH2 -Br OH OH2 Эта реакция протекает по элекрофильному механизму в направлении образования более устойчивого карбкатиона и в соответствии с правилом Марковникова. Присоединение серной кислоты При взаимодействии алкенов с конценрированной серной кислотой образуются моноалкилсульфаты ( гидросульфаты). 20°C CH3-CH=CH2 + H2SO4 → CH3-CH-CH3 | OSO3H изопропилгидросульфат Механизм СН3_СH= СН2 HSO4 H+ CH3-CH=CH2 CH3-CH-CH2 Н+ -комплекс Н -комплекс СН3_СH_СН3 OSO3H Гидратация алкенов В присутствии кислотных катализаторов алкены присоединяют воду с образованием спиртов. СН3 СН3 Н2 О СН3_С_СН3 СН3_С=СН2 + H ОН 2-метил-2-пропанол 36 Эта реакция протекает также по электрофильному механизму через стадию образования карбкатиона, что предопределяет порядок присоединения элементов воды в соответствии с правилом Марковникова (присоединение водорода к наиболее гидрогенизированному атому углерода при двойной связи). СН3 СН3 СН3_С= СН2 + H+ СН3_С_ СН3 + О_ Н Н СН3 СН3 СН3_С_ СН3 СН3_С_ СН3 + -Н ОН _ О Н Н К карбкатиону может присоединиться как вода, так и анион серной кислоты с образованием алкилсерной кислоты, гидролиз которой также приводит к спирту. СН3 СН3 СН3_С_ СН3 + ОSO3H СН3_С_ СН3 Н2O ОSO3H СН3 СН3_С_ СН3 + H2SO4 ОН Реакции радикального присоединения Гидрирование В присутствии платины или палладия алкены в мягких условиях гидрируются (восстанавливаются) до алканов. При этом имеет место гетерогенный катализ. Pt CH3-CH=CH2 + H2 → CH3-CH2-CH3 Ni CH2=CH2 + H2 → CH3-CH3 300°C При применении менее активных катализаторов (никеля) гидрирование проводят при более высоких температурах (200-300°С) и под давлением. 37 Галогенирование В условиях, способствующих гомолитическому разрыву связей (газовая фаза, свет, температура, присутствие пероксидов), присоединение галогенов протекает по радикальному механизму. CH3-CH2-CH=CH2 + Br2 → CH3CH2-CH-CH2 | | Br Br 1,2-дибромбутан Механизм Br h 2 Br 2 CH3-CH2-CH=CH2 + Br CH3-CH2-CH-CH2Br + Br2 CH3-CH2-CH-CH2Br CH3-CH2-CH-CH2 + Br Br Br Гидробромирование Присоединение бромоводорода к алкенам может проходить в присутствии пероксидов (перекиси водорода, перекиси ацетила, перекиси бензоила) по радикальному механизму. CH -CH -CH=CH + HBr H2O2 CH -CH -CH -CH Br 3 2 2 3 2 2 2 Механизм H2O2 + HBr Br + H3O2 CH3-CH2-CH=CH2 + Br CH3-CH2-CH-CH2Br + HBr CH3-CH2-CH-CH2Br CH3-CH2-CH2-CH2Br + Br В этой реакции присоединение водорода кислоты происходит к менее гидрогенизированному атому углерода, то есть против правила Марковникова (перекисный эффект Караша). Это объясняется тем, что радикал Br∙ реагирует с π-системой с образованием в первую очередь наиболее стабильного радикала (Устойчивость радикалов увеличивается: первичные < вторичные < третичные). Реакции радикального замещения При галогенировании этиленовых углеводородов при температурах выше 400°С происходит замещение атома водорода у соседнего с двойной связью атома углерода (аллильное замещение). Двойная связь при этом сохраняется. 38 Cl2, 500oC СH2=CH-CH3 СH2=CH-CH2Cl + HCl аллилхлорид Реакция протекает по механизму радикального замещения (SR): 1 стадия – инициирование цепи t 2 Cl Cl-Cl 2 стадия – развитие цепи (образование аллильного радикала) СH2=CH-CH2 + Cl -HCl СH2=CH-CH2 СH2-CH=CH2 Н 3 стадия – продолжение цепи СH2=CH-CH2 + Cl2 СH2=CH-CH2Cl + Cl Предпочтительность аллильного положения в реакциях SR определяется повышенной устойчивостью образующегося стабилизированного резонансом промежуточного аллильного радикала. Реакции окисления Окисление алкенов в зависимости от природы выбранного окислителя может приводить к разнообразным продуктам Получение эпоксидов При окислении этиленовых углеводородов кислородом в присутствии серебряного катализатора образуются органические окиси, называемые эпоксисоединениями. По научной номенклатуре этот трёхчленный цикл называется оксирановым. Ag 2СH2=CH-CH3 + O2 2СH2-CH-CH3 O эпоксипропан Эти соединения можно также получить при взаимодействии алкенов с надкислотами (надуксусной CH3COOOH, надбензойной С6H5COOOH) (реакция Прилежаева, 1909г.). O CH2-CH-CH2-CH3 + CH3COOH O CH2=CH-CH2-CH3 + CH3-COOH 1,2-эпоксибутан Образование вицинальных диолов ( реакция Вагнера, 1898г.) Алкены легко окисляются раствором перманганата калия на холоде в нейтральной или слабощелочной среде. Реакцию используют как 39 качественную пробу на наличие двойных и тройных связей С-С, так как в ходе процесса розово-фиолетовая окраска перманганат-иона исчезает и выпадает коричневый осадок оксида марганца (IV). 3СH3-CH2-СH=CH2 2KMnO4, 4H2O 3СH3-CH2-СH-CH2 + 2MnO2 + 2KOH OH OH 1,2-бутандиол В качестве окислителя можно также использовать перекись водорода. СH3-CH=СH-CH3 + H2O2 СH3-CH-СH-CH3 OH OH 2,3-бутандиол Образование карбонильных соединений При озонолизе алкенов (реакция озонирования по Гарриесу) и последующем расщеплении озонидов водой образуются альдегиды и кетоны. Реакция также может быть использована для установления структуры алкена. O-O-O СH3-CH2-C=СH-CH3 + O3 СH3-CH2-C СH3 мольозонид СH3 O СH-CH3 O СH3-CH2-C O СH-CH3 Н2O СH3 озонид СH3-CH2-C=О + СH3-C O + Н2О2 Н СH3 метилэтилкетон уксусный альдегид Образование кетонов и кислот Окисление этиленовых углеводородов сильными окислителями (концентрированные растворы окислителей KMnO4, CrO3, HNO3) приводит к разрыву углеродной цепи по месту двойной связи и образованию в зависимости от строения исходного углеводорода карбоновых кислот или кетонов. Реакцию применяют для установления структуры алкена. О О KMnO4, H+ СH3-CH2-СH=CH-CH3 СH3-CH2-С + CH3-С OH OH 40 СH3-С=CH-CH3 KMnO4, H+ О СH3-С=О + CH3-С OH СH3 СH3 Реакции полимеризации Полимеризацией называют химический процесс, в котором молекулы ненасыщенного углеводорода присоединяются одна к другой за счёт разрыва π-связей и образования новых σ-связей. n CH2=CH2 СН2-СН2 n мономер полимер Полимер, полученный из одинаковых мономеров, называют гомополимером, из различных мономеров – гетерополимером или сополимером. Цепная полимеризация приводит к образованию высокомолекулярных соединений с n > 1000. В зависимости от условий проведения процесса различают радикальную и ионную полимеризацию. Радикальная полимеризация может быть вызвана действием высоких температур, облучением или введением веществ, способных легко образовывать радикалы. Реакция представляет собой радикально-цепной процесс: CH2=CH2 R + CH2=CH2 R-СН2-СН2 R-СН2-СН2-CH2-CH2 и т.д. Обрыв цепи может проходить путём стабилизации радикалов – их соединением (димеризацией), диспропорционированием. Упрощённо процесс можно выразить суммарным уравнением: R + n CH2=CH2 R СН2-СН2 n полиэтилен Ионная полимеризация сопровождается гетеролитическим расщеплением π-связи под действием катионов (H2SO4, H3PO4, BF3, AlCl3, HF) или анионов (сильные нуклеофилы (CH3)3CLi). K+ + CH2=CH-CH3 K-СН2-СН+ CH2=CH-CH3 CH3 41 K-СН2-СН-CH2-CH+ CH3 CH3 K-СН2-СН-CH2-CH-СН2-CH+ CH3 n-2 CH3 СН2=CH-CH3 -H CH3 K-СН2-СН-CH2-CH-СН=CH CH3 CH3 n-2 CH3 полипропилен 3.3. ЗАДАЧИ ПО ТЕМЕ «АЛКЕНЫ» Задача № 1. Правильно ли названы по научной номенклатуре (IUPAC) следующие алкены: а) 2-метил-3-бутен, б) 3,4,4-триметил-2-пентен, в) 3-метил-2-бутен, г) 3,5-диметил-3-гексен, д) 3,3-диметил-1-бутен, е) 3- метил-4 изобутил-3гексен? Исправьте ошибочные названия. Решение Для правильного названия углеводорода следует изобразить его структурную форму. 4 3 2 1 а) H3C-CH-CH=CH2 2-метил-3-бутен (неверно) | 3-метил-1-бутен (правильно) CH3 При названии этиленовых углеводородов по научной номенклатуре атом углерода при двойной связи должен получить наименьший номер, поэтому соединение названо неверно. Правильное название 3- метил-1-бутен. CH3 1 2 3 4| 5 б) H3C-CH=С–С–CH3 | | H3C CH3 Соединение названо правильно. 4 3 2 3,3,4-триметил-2-пентен 1 в) H3C-CH=С-CH3 3-метил-2-бутен (неверно) | 2-метил-2-бутен (правильно) CH3 В данном соединении при нумерации углеродных атомов как слева направо, так и справа налево атом углерода при двойной связи оказывается вторым, однако при нумерации справа налево метильный заместитель 42 получит меньший номер, поэтому правильное название соединения 2-метил2-бутен. 6 5 4 3 2 1 г) H3C-CH2-С=СН–CH-СН3 3,5-диметил-3-гексен (неверно) | | 2,4-диметил-3-бутен (правильно) H3C CH3 Как и в предыдущем примере, при нумерации углеродных атомов справа налево или слева направо атом углерода при двойной связи оказывается третьим. Однако справа налево сумма цифр при заместителях будет наименьшей, поэтому правильное название 2,4-диметил-3-бутен. CH3 1 2 3| 4 д) H2C=СН–С–CH3 | CH3 Углеводород назван правильно. 1 2 3 3,3-диметил-1-бутен 4 е) CH3-CH2–С=С–CH2-СН3 3,3,4-триметил-2-пентен (неверно) | | 5 6 7 3,6-диметил-4-этил-3-гептен (правильно) H3C CH2–СН–СН3 | СН3 Углеводород назван неверно, так как выбрана не самая длинная углеродная цепь, содержащая двойную связь. Нумерация должна быть проведена, как показано в формуле. Правильное название 3,6-диметил-4этил-3-гептен. Задача № 2. Какие соединения образуются при нагревании с концентрированной серной кислотой следующих спиртов: а) 2-бутанола, б) 1-бутанола, в) 3,3-диметил-1-бутанола? Покажите механизм дегидратации на примерах Б и В. Решение а) СН3-СН-СН2СН3 | ОН При дегидратации спиртов водород отщепляется от наименее гидрогенизированного атома углерода (по правилу Зайцева), поэтому основным продуктом реакции дегидратации 2-бутанола является 2-бутен. В качестве побочного продукта образуется незначительное количество 1бутена. 43 Н2SO4 СН3-СН-СН2СН3 → СН3-СН=СН-СН3 + | -H2O ОН 90% СН2=СН-СН2-СН3 10% б) СН3-СН2-СН2-СН2ОН При дегидратации 1-бутанола казалось бы, что единственным продуктом реакции должен быть 1-бутен, однако практически основным продуктом реакции является 2-бутен. Это можно объяснить при рассмотрении механизма реакции: H+ + + СН3-СН2-СН2-СН2ОН → СН3-СН2-СН2-СН2ОН → СН3-СН2-СН2-СН2 | -H2O H Стабилизация первичного карбкатиона может происходить за счет отщепления протона от соседнего углеродного атома или за счёт перегруппировки в более устойчивый, в данном случае вторичный, карбкатион (1,2-гидридный сдвиг). Второе направление оказывается энергетически выгодным и, следовательно, основным продуктом реакции является 2-бутен: + СН3-СН2-СН2-СН2 в) -Н+ → СН3-СН2-СН=СН2 (10%) | | -н: + -Н+ → СН3-СН2-СН-СН3 → СН3-СН=СН-СН3 (90%) СН3 | СН3-С-СН2-СН2ОН | СН3 Рассмотрим механизм реакции кислотной дегидратации 3,3-диметил-1бутанола. СН3 СН3 СН3 + | H | | + + СН3-С-СН2-СН2ОН → СН3-С-СН2-СН2-ОН → СН3-С-СН2-СН2 | (Н2SO4) | | -H2O | СН3 СН3 Н СН3 44 CH3 CH3 + CH3-C-CH2-CH2 (2%) CH3-C-CH=CH2 CH3 CH3 CH3 + CH3-C-CH-CH3 CH3 CH3 + CH3 - C - CH-CH3 H3C -H + CH3 CH3 - C = C-CH3 (98%) H3C CH3 Задача № 3. Какие углеводороды можно использовать для получения 2-хлор-2метилбутана? Приведите уравнения реакций и механизм электрофильного присоединения (АЕ). Решение Cl h (SR) CH3-CH2-CH-CH3 + Сl2 CH3-CH2-C-CH3 -HСl СH3 СH3 2-метилбутан Cl (AE) CH3-CH2-C=CH2 + НСl CH3-CH2-C-CH3 СH3 СH3 2-метил-1-бутен (AE) CH3-CH=C-CH3 + НСl Cl CH3-CH2-C-CH3 СH3 СH3 2-метил-2-бутен Механизм АЕ: CH3-CH=C-CH3 + НСl CH3-CH=C-CH3 H+ СH СH3 2-метил-2-бутен 3 комплекс 45 -Cl Cl CH3-CH2-C-CH3 Cl CH3-CH2-C-CH3 СH3 СH3 комплекс Задача № 4. Из пропана получите 2,3-диметил-2-бутен и назовите все промежуточные продукты. Решение Пропан содержит три углеродных атома, а 2,3-диметил-2-бутен – 6, следовательно, в процессе синтеза необходимо удвоить число углеродных атомов. Это можно достичь, применяя реакцию Вюрца. На первой стадии синтеза необходимо получить 2-галогенпропан. Br2 1) СН3-СН2-СН3 → СН3-СН-СН3 + HBr hυ | Br 2-бромпропан 2) 2СН3-СН-СН3 + 2Na → СН3-СН-СН-СН3 + 2NaBr | | | Br СН3 СН3 2,3-диметилбутан Сl Сl2 | 3) СН3-СН-СН-СН3 → СН3-СН-С-СН3 | | hυ | | СН3 СН3 СН3 СН3 2-хлор-2,3-диметилбутан Галогенирование легче протекает по третичному атому углерода и основным продуктом реакции оказывается 2-хлор-2,3-диметилбутан. Сl | КОН 4) СН3-СН-С-СН3 → СН3-С = С-СН3 | | спирт | | СН3 СН3 СН3 СН3 2,3-диметил-2-бутен Реакция дегидрогалогенирования или отщепления (элиминирования) проходит в соответствии с правилом Зайцева. Задача № 5. Предложите схему получения 2-метил-2-бутена из 2-метил-1-бутена. Решение 46 CH2=C(CH3)-CH2-CH3 → CH3-C(CH3)=CH-CH3 2-метил-2-бутен можно синтезировать реакцией дегидрогалогенирования 2-бром-2-метилбутана или 2-бром-3-метилбутана. Из 2-метил-1-бутана легко образуется 2-бром-3-метилбутан гидрогалогенированием по электрофильному механизму. Поэтому схема превращения 2-метил-1-бутана в 2-метил-1-бутена следующая: Br HBr | КОН СН2=С-СН2-СН3 → СН3-С-СН2-СН3 → СН3-С=СH-СН3 | | спирт | СН3 СН3 СН3 Таким образом, для переноса двойной связи из положения 1 в положение 2 необходимо сначала провести гидрогалогенирование по электрофильному механизму, а затем дегидрогалогенирование. Задача № 6. Заполните следующую схему превращений: Br2 3-метилпентан NaOH → Б → hυ спирт O3 В → С Н2О Назовите все промежуточные и конечный продукты. Решение При бромировании 3-метилпентана легче будет замещаться водород у третичного атома углерода: Br Br2 | СН3-СН2-СН-СН2-СН3 → СН3-СН2-С-СН2-СН3 + HBr | hυ | СН3 СН3 3-бром-3-метилпентан Под действием спиртового раствора щелочи отщепляется HBr (по правилу Зайцева водород отщепляется от менее гидрогенизированного атома углерода) и образуется этиленовый углеводород. Br | NaOH СН3-СН2-С-СН2-СН3 → СН3-СН=С-СН2-СН3 +NaBr + H2O | спирт | СН3 СН3 3-метил-2-пентен 47 При озонировании этиленового углеводорода в начале образуется мольозонид, который превращается в озонид, гидролиз последнего даёт карбонильные соединения. О-О-О О – О О3 | | | | Н2О СН3-СН=С-СН2-СН3 → СН3-СН – С-СН2-СН3 → СН3-СН-О-С-СН2-СН3 → | | | СН3 СН3 СН3 мольозонид → СН3-С=О | Н ацетальдегид + озонид СН3-С-СН2-СН3 || О метилэтилкетон Задача № 7. Следующие алкены расположите в ряд по возрастанию легкости их вступления в реакцию гидробромирования: а) 1-бутен, б) 2-бутен, в) этен, г) 2,3-диметил-2-бутен. Решение При электрофильном присоединении HBr стадией, определяющей скорость реакции, является присоединение электрофильной частицы (Н+). Это присоединение идет тем легче, чем больше электронодонорных заместителей находится при двойной связи. В этилене нет алкильных заместителей (электронодонорных заместителей), поэтому он наиболее медленно будет вступать в реакцию гидробромирования. В 1-бутене – один алкильный заместитель, в 2-бутене – два алкильных заместителя, а в 2,3диметил-2-бутане – четыре. Следовательно, скорость реакции гидробромирования возрастает в ряду: СН2=СН2 < СН2=СН-СН2-СН3 < СН3-СН=СН-СН3 < СН3-С = С-СН3 | | СН3 СН3 Задача № 8. Определите строение этиленового углеводорода, если известно, что его подвергли окислению KMnO4 в кислой среде, а в результате последующих превращений продуктов окисления был получен этилен. KMnO4 А → + H NaOH Б → Н2О NaOH тв. В → t Cl2 Г → hυ 48 NaOH Д → спирт этилен Решение Такие задачи удобнее решать с выполнения последних стадий и последовательно переходить к первой реакции. Этилен в результате реакции дегидрогалогенирования может быть получен из хлорэтана: NaOH CH3-CH2Cl → CH2=CH2 спирт Хлорэтан может получить реакцией радикального хлорирования этана: Cl2 CH3-CH3 → CH3-CH2Cl hυ При обработке натриевой соли пропионовой кислоты твёрдой щелочью можно получить этан (реакция Дюма): CH3-CH2-C=O + NaOH тв. → Na2CO3 + CH3-CH3 | O‾ Na+ Соли карбоновых кислот получают при действии разбавленного раствора щелочи на кислоты: NaOH CH3-CH2-COOH → CH3-CH2-COO‾ Na+ Н2О И, наконец, пропионовая кислота может быть получена при окислении этиленового углеводорода: KMnO4 CH3-CH2-CН=СН-СН2-СН3 → 2 CH3-CH2-COOH + H Так как по условию задачи получается единственный продукт реакции, то этиленовый углеводород имеет симметричное строение, т.е. окислению подвергался 3-гексен. Поэтому схема последовательных превращений выглядит следующим образом: KMnO4 3-гексен → + H NaOH NaOHтв. CH3-CH2-C=O → CH3-CH2-C=O → | Н2О |_ t + ОН O Na NaOH → CH3-CH2Cl → CH2=CH2 спирт 49 Cl2 CH3-CH3 → hυ Задача № 9. Установите структуру углеводорода состава С7Н14, если известно, что при его окислении К2Сr2O7 в кислой среде получаются два продукта: первый - метилэтилкетон, второй - карбоновая кислота, при электролизе которой образуется бутан. Решение Бутан может быть получен при электролизе из Na-соли пропионовой кислоты: электролиз СН3-СН2-СOO‾ Na + → СН3-СН2-СН2СН3 + СО2 + NaOH + H2 Следовательно, вторым продуктом окисления этиленового углеводорода является пропановая (пропионовая) кислота, поэтому исходный этиленовый углеводород - 3-метил-3-гексен. К2Сr2O7 СН3-СН2-С=СН-СН2-СН3 → + | Н СН3 СН3-СН2-С=О + СН3-СН2-СOOH | СН3 Задача № 10. Соединение состава С5Н10 при каталитическом гидрировании образует 2-метилбутан. Если исходное соединение обработать бромистоводородной кислотой в присутствии перекиси водорода, а затем полученный раствор нагреть с металлическим натрием, то образуется 2,7-диметилоктан. Определите строение соединения и напишите реакции. Решение Запишем условие задачи в виде структурных формул: Н2 С5Н10 → СН3-СН-СН2-СН3 кат. | СН3 HBr Na С5Н10 → ? → СН3-СН-СН2-СН2-СН2-СН2-СН-СН3 H2O2 | | | СН3 СН3 Из строения полученного реакцией гидрирования 2-метилбутана, видно, что соединение С5Н10 имеет изоструктуру. Анализируя строение 2,7диметилоктана и реакции, приводящие к его получению (реакция перекисного эффекта Караша и реакция Вюрца), можно сделать вывод, что соединение С5Н10 имеет не только изоструктуру, но и двойную связь, находящуюся у первого атома углерода. Это соединение 3-метил-1-бутен. 50 Реакции: HBr Na СН3-СН-СН=СН2 → СН3-СН-СН2-СН2Br → СН3-СН-(-СН2-)4-СН-CH3 | | | | СН3 СН3 CH3 CH3 4. АЛКАДИЕНЫ Алкадиенами называются ненасыщенные углеводороды общей формулы CnH2n-2, содержащие две двойные связи. Различают три типа диенов: ― кумулированные, в молекулах которых двойные связи непосредственно примыкают к одному атому углерода (C=C=C), ― сопряжённые, в молекулах которых двойные связи разделены одной простой одинарной связью (C=C-C=C), ― изолированные, в молекулах которых двойные связи разделены более чем одной одинарной связью (C=C-(C)n>1-C=C). CH2=C=CH2 CH2=CH-CH=CH2 1,2-пропадиен 1,3-бутадиен аллен CH2=CH-CH2-CH2-CH=CH2 1,5-гексадиен Номенклатура Названия диеновых углеводородов по научной номенклатуре (ИЮПАК) производят от названий соответствующих им предельных углеводородов (алканов) с заменой суффикса –ан на –диен. В названии алкадиена цифрами указываются положения двойных связей, при этом нумерацию углеродных атомов главной цепи ведут таким образом, чтобы двойные связи принимали минимальные числовые значения. CH3-CH=C-CH=CH2 | CH3 3-метил-1,3-пентадиен CH3-CH=CH-CH-CH-CH=CH-CH3 | | H3C CH3 4,5-диметил-2,6-октадиен Правилами номенклатуры ИЮПАК сохранены тривиальные названия – изопрен, хлоропрен. 51 CH2=C-CH=CH2 | CH3 2-метил-1,3-бутадиен изопрен CH2=C-CH=CH2 | Cl 2-хлор-1,3-бутадиен хлоропрен 4.1. Способы получения алкадиенов 1. Дегидрирование предельных углеводородов Cr2O3 CH3-CH2-CH2-CH3 → CH2=CH-CH=CH2 400°C 2. Дегидратация двухатомных спиртов (диолов) CH3 CH3 | Al2O3 | CH3-C-CH2-CH2 → CH2=C–CH=CH2 | | 400°C OH OH 3-метилпропан-1,3-диол 2-метил-1,3-бутадиен Реакция протекает в сторону получения более устойчивого сопряжённого алкадиена. H+ CH3-CH-CH2-CH2-CH2 → CH3-CH=CH-CH=CH2 | | – 2H2O OH OH пентан-1,4-диол 1,3-пентадиен 3. Получение 1,3-бутадиена (по методу С.В. Лебедева) из этанола над дегидрирующим и дегидратирующим катализатором при 400-500°С. MgO, ZnO, 400-500°C 2C2H5OH ―― ――――――→ CH2=CH-CH=CH2 – 2H2O, – H2 Реакция включает следующие стадии: дегидрирование спирта до альдегида, альдольную конденсацию альдегида, восстановление альдола до 1,3- бутандиола и, наконец, дегидратацию последнего. H2 2C2H5OH → 2CH3CHO → CH3-CH(OH)-CH2-CHO → -2H2 → CH3-CH(OH)-CH2-CH2-OH → CH2=CH-CH=CH2 – 2H2O 4. Дегидрогалогенирование дигалогенопроизводных 52 KOH CH2-CH2-CH2-CH2-CH2-Cl → CH2=CH-CH2-CH=CH2 | сп. р-р Cl 1,5 дихлорпентан 1,4-пентадиен Алкадиены с изолированными двойными связями получают обычными способами, разработанными для алкенов. 4.2. Химические свойства алкадиенов Химические свойства диеновых углеводородов зависят от расположения двойных связей. В кумулированных диенах две π-связи ориентированы во взаимно перпендикулярных плоскостях. Центральный атом углерода находится в spгибридном состоянии. Кумулированные диены менее стабильны, чем диены с изолированными и сопряжёнными двойными связями. При нагревании в щелочной среде они перегруппировываются в алкины. R-CH=C=CH2 OH R-CH2-C CH t В изолированных алкадиенах двойные связи мало влияют друг на друга, т.е. каждая реагирует так, как если бы она была единственной двойной связью в молекуле (одна π-связь не оказывает влияния на другую). Они ведут себя, как обычные алкены, вступая в реакции, характерные для этого класса. Различие с алкенами состоит в том, что требуется удвоенное количество реагента. CH2=CH-CH2-CH2-CH=CH2 + 2H2 1,5-гексадиен CH3-CH-CH2-CH2-CH2-CH3 гексан Наибольший теоретический и практический интерес представляют сопряжённые алкадиены. Сопряжённые диены отличаются от других диенов тем, что они более устойчивы, более ракционноспособны и вступают в реакции 1,4-присоединения. В 1,3-бутадиене атомы углерода находятся в sp2-гибридном состоянии, все атомы углерода и водорода лежат в одной плоскости (все σ-связи также лежат в этой плоскости). Негибридизованные р-АО (атомные орбитали) каждого атома углерода располагаются перпендикулярно плоскости и параллельно друг другу, что создаёт условия для их перекрывания. 53 Так, в 1,3-бутадиене две двойные связи разделены одной ординарной, и 1 2 3 4 CH2=CH-CH=CH2 это создаёт предпосылки для заметного воздействия между собой не только р-АО первого и второго, третьего и четвёртого атомов углерода, но частично второго и третьего. Происходит образование обобщённого четырёх р-πэлектронного облака молекулы. Делокализация 4р-π-электронного облака выражается в усреднении длин связей, которые для С1-С2 и С3-С4 составляет 0,134 нм, а С2-С3 0,147нм, т.е. двойные связи становятся длиннее, а простая короче. О делокализации р-АО свидетельствует ограничение свободного вращения вокруг связи С2-С3, что приводит к получению двух геометрических изомеров типа S- цис и S- транс 1,3-алкадиенов. H2C H H C H C =C CH 2 CH2 H C= CH 2 S -транс S -цис Для сопряжённых диенов характерны реакции присоединения, протекающие по электрофильному (AdE) и радикальному (AdR) механизмам. В зависимости от соотношения реагирующих веществ реакции присоединения могут проходить в молекуле диена с разрывом одной или двух кратных связей. Реакции электрофильного присоединения В реакциях электрофильного присоединения, как правило, образуется смесь продуктов 1,2- и 1,4-присоединения. Однако, при низких температурах (-40 ~-80°С) преимущественно образуется продукт 1,2-присоединения, а при более высоких (40-80°С) – 1,4. Галогенирование Галогены могут присоединяться как по радикальному, так и по ионному механизмам. Если реакция протекает по схеме электрофильного 54 механизма, то она идёт через стадии образования π- и σ-комплексов. При этом также реализуются направления 1,2 - и 1,4-присоединения. CH2-CH-CH=CH2 2 1, Br Br CH2=CH-CH=CH2 + Br2 1,4 CH -CH=CH-CH 2 Br Механизм CH2=CH-CH=CH2 + Br2 2 Br CH2=CH-CH=CH2 Br-Br -комплекс + CH2-CH-CH=CH2 Br -комплекс 1,2 Br + CH2-CH=CH-CH2 Br 1,4 -комплекс Br CH2-CH-CH=CH2 CH2-CH=CH-CH2 Br Br Br Br Строение σ-комплекса может быть представлено двумя резонансными структурами (аллильного типа). Вследствие делокализации положительного заряда происходит атака нуклеофила по двум электрофильным центрам. Гидрогалогенирование СН3 -СН = СН-СН2Вг 1,4-присоединение СН2 = СН -СН = СН2+Н Вг СН3 - СНBr -СН = СН2 1,2-присоединение Механизм + CH2=CH-CH=CH2 H CH2=CH-CH=CH2 H+ -комплекс 55 + + CH3-CH-CH=CH2 CН3-CH=CH-CH2 -комплекс -комплекс Br Br CH3-CH=CH-CH2 CH3-CH-CH=CH2 Br Гипогалогенирование Br ОН CH2=CH-CH=CH2 + HOCl (Cl+, OH-) 1,2 1,4 CH2=CH-CH-CH2Сl 1-хлор-3-бутен-2-ол CH2-CH=CH-CH2 OH Cl 4-хлор-2-бутен-1-ол Реакции радикального присоединения Гидрирование При восстановлении 1,3-бутадиена атомарным или каталитически возбуждённым в момент выделения водородом образуются продукты как 1,2-, так и 1,4-присоединения. ат CH3-CH2-CH=CH2 (1,2) к H 2, CH2=CH-CH=CH2 H 2, к ат CH3-CH=CH-CH3 (1,4) Присоединение водорода по типу 1,4 является следствием условий делокализации электронной плотности, как это показано на схеме: CH2=CH-CH=CH2 + H CH2=CH-CH-CH3 Образовавшийся радикал аллильного типа вследствие делокализации неспаренного (холостого) электрона за счет его сопряжения с двойной связью обладает двойственной реакционной способностью, как это иллюстрируется резонансными структурами, отражающими крайние возможные смещения в молекуле, и приведённой мезо(средней) структурой. 56 ....... CH2=CH-CH-CH3 CH2-CH=CH-CH3 H CH2-CH-CH-CH3 H CH2=CH-CH2-CH3 CH3-CH=CH-CH3 Гидрирование сопряжённых диенов в условиях гетерогенного катализа, как правило, приводит к алканам. 2H2 CH2=CH-CH=CH2 → CH3-CH2-CH2-CH3 Pt Восстановить сопряжённый алкадиен избирательно по типу 1,4присоединения удаётся при действии амальгамы натрия в водно-спиртовой среде. Na(Hg) CH2=CH-CH=CH2 → CH3-CH=CH-CH3 H2O, C2H5OH Галогенирование В отличие от электрофильного присоединения при свободнорадикальном процессе преимущественно образуется продукт 1,4присоединения при любых температурах. CH2=CH-CH=CH2 + Br2 R CH2-CH=CH-CH2 CH2-CH-CH=CH2 Br Br Br 1,4-дибром-2-бутен Br 3,4-дибром-1-бутен Механизм реакции: Br2 t CH3-CH2-CH=CH2 + Br 2 Br CH2-CH-CH=CH2 CH2-CH=CH-CH2 Br Br Br2 Br2 CH2-CH-CH=CH2 CH2-CH=CH-CH2 Br Br Br Br Реакция диенового синтеза (реакция Дильса – Альдера, 1929г.) Диеновые углеводороды вступают в реакцию с непредельными соединениями (диенофилами), содержащими активированную кратную связь. Реакции диенового синтеза стали одним из универсальных методов синтеза соединений, содержащих шестичленные циклы. 57 CH2 C N CH2 HС HC HС HС H2C CH2 HС C N C N HC HC CH2 В реакции Дильса-Альдера происходит круговой перенос электронов с образованием двух новых σ-связей и замыканием цикла. Диенофил атакует диен одновременно с двух концов (согласованный процесс), поэтому диен должен быть в s-цис-конформации. Электронодонорные заместители в диене облегчают реакцию циклоприсоединения. Напротив, диенофил должен содержать электроноакцепторные заместители при кратной связи. В качестве диенофилов часто используются акролеин, акриловая кислота и её производные - эфиры и нитрил, малеиновый ангидрид и др. O CH2=CH-CH=CH2 + HС HС C бензол 5 O 2OоС C O малеиновый ангидрид CH2=CH-CH=CH2 + HС CН=СН2 4 O 6 Н C С1 O 2 С 3 C O Н цис-1, 2,3,4-тетрагидрофталевый ангидрид CН=СН2 HС Окисление сопряжённых диенов Окисление сопряжённых диенов в зависимости от типа окислителя и условий проведения реакции может протекать с образованием различных кислородсодержащих соединений. KMnO4 CH2=CH-CH=CH2 → HOOC-COOH + 2H2O H2O 1,3-бутадиен щавелевая кислота Озонолиз 1,3-диенов протекает по обычной для алкенов схеме: 2O3 CH2=C-CH=CH2 → 2H-C=O + CH3-C-CH=O | H2O | || CH3 H O метаналь 2-оксопропаналь 58 При озонолизе диеновых углеводородов образуются альдегиды и кетоны, при этом один из продуктов содержит две концевые карбонильные группы. Реакция может быть использована для установления структуры исходного диена. O-O O- O CH3-CH=CH-CH=CH2 + 2O3 CH3-CH - O- CH-CH- O -CH2 H2 O O O O O + C C + HC H H H H уксусный глиоксаль муравьиный альдегид аьдегид CH3-C Полимеризация сопряжённых диенов Сопряжённые диены, подобно этиленовым, легко вступают в реакции полимеризации, которые могут идти как по ионному, так и по радикальному механизмам. Полимеризация может протекать в 1,2- и 1,4-положения, причём в случае 1,4-присоединения возможно образование либо цис-, либо трансструктур. Двойные связи в полимерах имеют исключительную важность, так как обусловливают возможность осуществления сшивки (вулканизации) линейных макромолекул. 1-2 CH2 CH H2C=CH H nCH2=CH-CH=CH2 цис 1-4 n H С=С H2С СH2 H С=С транс H2С 1-4 n СH2 H n Полимеризация сопряжённых диенов приводит к высокомолекулярным соединениям – каучукам. Эти соединения отличаются высокой эластичностью и устойчивостью и имеют огромное практическое значение. 59 4.3. ЗАДАЧИ ПО ТЕМЕ «АЛКАДИЕНЫ» Задача № 1. Назовите по научной номенклатуре следующие углеводороды: СН3 | а) СН3-СН2-СН-СН-СН2-СН=СН2 | СН=СН2 б) СН3-СН2 – С – С – СН3 || || Н2С СН2 в) СН3-СН2-СН=СН-СН=С-СН3 | СН2-СН3 г) СН2=С-СН– С – СН3 | || СН3-СН2 СН2 Решение Для наименования диеновых углеводородов по научной номенклатуре выбираем самую длинную неразветвленную цепь углеродных атомов, содержащую обе двойные связи, и нумеруем её таким образом, чтобы атомы углерода при двойных связях получили наименьшее числовое значение. Затем называем главную цепь с указанием мест положения двойных связей и добавляем cуффикс -диен. Названия и положения заместителей указываем перед названием главной цепи. СН3 | 3 4 5 6 а) СН3-СН2-СН-СН-СН2-СН=СН2 3-вторбутил-1,5-гексадиен |2 1 СН=СН2 3 2 б) СН3-СН2 – С – С – СН3 2-метил-3-этил-1,3-бутадиен 4 || 1|| Н2С СН2 8 7 6 5 4 3 в) СН3-СН2-СН=СН-СН=С-СН3 3-метил-3,5-октадиен |2 1 СН2-СН3 60 5 4 3 2 г) СН2=С-СН– С – СН3 | 1|| СН3-СН2 СН2 2-метил-4-этил-1,4-пентадиен Задача № 2. Напишите уравнения реакций получения хлоропрена из метана и необходимых органических веществ. Решение CH2=C–CH=CH2 хлоропрен | Cl Окисление метана при высоких температурах приводит к ацетилену. 1500°C 2CH4 → CH≡CH + 3H2 0,1сек Ацетилен в присутствии катализатора димеризуется в винилацетилен. Cu2Cl2 2CH≡CH → CH2=CH–C≡CH При гидрохлорировании винилацетилена в присутствии катализатора получается хлоропрен. Cu2Cl2 CH2=CH–C≡CH + HCl → CH2=CH–C=CH2 | Cl 2- хлор-1,3-бутадиен Задача № 3. Какие соединения могут получиться при действии брома на изопрен (2-метил-1,3-бутадиен)? Отметьте соединения, имеющие цис- и трансизомеры. Приведите механизм 1,2 и 1,4 электрофильного присоединения. Решение Br 1,2 CH2-C-CН=CН2 нет изомеров Br СH3 Br CH2=C-CН=CН2 + Br2 3,4 CH2=C-CН-CН2 СH3 СH3 1,4 нет изомеров Br CH2-C=CН-CН2 Br СH3 Br 1,4-дибром-2-метил-2-бутен 61 H3 С H H3 С С=С BrH2C CH2Br С=С BrH2C CH2Br цис (Z) H транс (Е) Механизм АdЕ СH3 CH2=C-CH=CH2 СH3 Br2 CH2=C-CH=CH2 Br-Br комплекс СH3 СH3 CH2-C-CH=CH2 CH2-C=CH-CH2 Br Br комплекс комплекс Br Br СH3 СH3 CH2-C-CH=CH2 CH2-C=CH-CH2 Br Br Br Br Задача № 4. Получите 2,4-гексадиен из ацетилена, используя реакцию А.Е.Фаворского. Решение По реакции Фаворского ацетилен вступает в реакцию конденсации с карбонильными соединениями (в присутствии щелочей). По условию задачи требуется получить диен, содержащий в главной цепи шесть углеродных атомов, поэтому целесообразно провести реакцию ацетилена с двумя молекулами уксусного альдегида: СН3СНО CH ≡CH → KOHтв НС≡С-С(OH)-СН3 СН3СНО → КОНтв. 62 СН3-СН(OH)-С≡С-СН(OH)-СН3 Полученный 3-гексин-2,5-диол содержит тройную связь и две гидроксильные группы, поэтому далее можно восстановить тройную связь (гидрировать до предельного диола), а затем последний подвергнуть процессу дегидратации, которая протекает в соответствии с правилом Зайцева. Н2, Pd СН3-СН-С≡С-СН-СН3 | | ОН ОН → H2SO4 СН3-СН-СН2-СН2-СН-СН3 → | | ОН ОН → СН3-СН=СН-СН=СН-СН3 2,4- гексадиен Задача № 5. Осуществите следующие превращения: Cl2 KOH СН3СН2СН3 → ? hυ → Cl2 ? → сп.р-р Na ? → ? 2H2O → Al2O3 ? + 500°С Н полимеризация → ? → ? 300°С по типу 1,4 Cl2 Na Решение Cl2 KOH СН3-СН2-СН3 → СН3-СН-СН3 → СН3-СН=СН2 → СН2-СН=СН2 → hυ | сп.р-р 5000С | Cl Cl 2H2O Al2O3 → СН2=СН-СН2-СН2-СН=СН2 → СН3-СН-СН2-СН2-СН-СН3 → Н+ | | 300°С ОН ОН полимеризация → СН3-СН=СН-СН=СН-СН3 → по типу 1,4 -(-СН-СН=СН-СН-)| | n СН3 СН3 Задача № 6. Осуществите ряд последовательных превращений. Назовите конечный продукт. О || 2C2H5MgBr HC ≡ CH → СН3-С-СН3 A → Н2О B → Решение 63 2Н2, Pd C → t H2SO4 Д → Е При взаимодействии ацетилена с магнийорганическими соединениями протекает реакция Иоцича. НС≡СН + С2H5MgBr → HC≡CMgBr + C2H6 НС≡CMgBr + C2H5MgBr → BrMgC≡CMgBr + C2H6 Полученный реактив Иоцича конденсируется с карбонильными соединениями. CH3 | BrMg-C≡CMgBr + CH3-C-CH3 → BrMg-C≡C-C-OMgBr + → || | O CH3 CH3 CH3 | + CH3-C-CH3 → | BrMgO-C-C ≡ C-C-OMgBr || | O | CH3 CH3 При гидролизе полученного соединения образуется 2,5- диметил-3гексин-2,5-диол. CH3 | CH3 CH3 | H2O BrMgO-C-C ≡ C-C-OMgBr | → | | HO-C-C ≡ C-C-OH | CH3 CH3 | CH3 | CH3 CH3 Полученный диол подвергают восстановлению, и далее кислотной дегидратации. CH3 CH3 CH3 CH3 | 2Н2, Pd | HO-C-C ≡ C-C-OH → | | CH3 CH3 → t | | HO-C-CH2-CH2-C-OH | CH3 H2SO4 → | CH3 CH3-C=CH-CH=C-CH3 + H2O | CH3 2,5-диметил-2,4-гексадиен | CH3 Задача № 7. Предложите схему получения 1,5-гексадиена, используя в качестве исходного продукта 2-пропанол. 64 Решение Запишем задание в виде структурных формул: CH3-CH(OH)-CH3 → CH2=CH-CH2-CH2-CH=CH2 Из формул исходного и конечного соединений видно, что имеет место удвоения числа атомов углерода и, следовательно, 1,5-гексадиен можно получить применяя реакцию Вюрца, а именно, при действии металлического натрия на галогенопроизводные углеводородов. Наиболее подходящим галогенопроизводным является аллилхлорид, синтезировать который можно следующим образом: 2-пропанол подвергнуть кислотной дегидратации, получить пропен и затем прохлорировать его при 500°С (реакция радикального замещения). H2SO4 CH3–CH-CH3 | OH → CH3-CH=CH2 пропен - H2O 500°C CH2=CH–CH3 + Cl2 → CH2=CH–CH2Cl + HCl 3-хлорпропен 2 CH2=CH–CH2Cl + 2Na → CH2=CH–CH2-CH2–CH=CH2 + 2NaCl 1,5-гексадиен Задача № 8. Установите строение углеводорода состава С6Н10, если известно, что он не реагирует с аммиачным раствором окиси серебра, вступает в реакцию с акролеином, при озонировании и последующем гидролизе озонида дает два альдегида, один из которых уксусный. Приведите уравнения всех реакций. Решение Углеводород состава С6Н10 может быть алкином или диеном. Так как он не реагирует с аммиачным раствором окиси серебра, то он не может быть алкином с концевой тройной связью. Далее по условию углеводород вступает в реакцию с акролеином (непредельным альдегидом с поляризованной двойной связью) - это реакция Дильса-Альдера и она характерна для диеновых углеводородов. Учитывая структуру продуктов реакции, полученных при озонировании и последующем гидролизе, можно предположить, что строение исходного углеводорода следующее: СН3-СН=СН-СН=СН-СН3 2,4-гексадиен Реакция озонолиза: O—— O O ——O | | | | CH3-CH=CH-CH=CH-CH3 + 2O3 → CH3-CH–O–CH-CH–O–CH-CH3 → 65 O ∕∕ H2O → 2 CH3-C + HC - CH \ || H ацетальдегид || O O глиоксаль Реакция Дильса-Альдера: H3C C H CH3 O C C H-C + CH O H H H-C CH2 C H3C CH3 H Задача № 9. В результате озонолиза синтетического каучука был получен 4-оксопентаналь. Определите строение каучука и диенового углеводорода, из которого он был получен. Решение Каучук представляет собой полимер, состоящий из повторяющихся одинаковых звеньев сопряжённого диена, соединённых по типу 1,4 присоединения. Поэтому каждое звено полимера содержит одну двойную связь между углеродными атомами С2-С3. При озонолизе происходит разрыв двойной связи в макромолекуле полимера. В результате озонолиза был получен 4-оксопентаналь. Запишем это соединение в более удобном для решения задачи виде: O O ∕∕ CH3-C-CH2-CH2-C || O ∕∕ ≡ \ H O=C-CH2-CH2-C | CH3 \ H Напишем несколько фрагментов цепи полимера, который при озонолизе образует 4-оксопентаналь, и выделим элементарное звено (выделено жирным шрифтом): 1 2 3 4 =С-СН2-СН2-СН=С-СН2-[-СН2-СН=С-СН2-]-СН2-СН=С-СН2-СН2-СН= | | | | CH3 CH3 CH3 CH3 66 По строению среднего звена можно сказать, что полимеризации по типу 1,4-присоединения подвергался изопрен: СН2=СH-С=СН2 → | CH3 2-метил-1,3бутадиен [―СН2-СH=С-СН2―]n | CH3 изопреновый каучук 5. АЛКИНЫ Алкинами называются ненасыщенные углеводороды, имеющие в своём составе тройную углерод-углеродную связь и имеющие общую формулу CnH2n-2. CH≡CH CH3-C≡CH CH3-C≡C-CH3 этин пропин 2-бутин ацетилен метилацетилен диметилацетилен В ацетиленовых углеводородах атомы углерода при тройной связи находятся в sp-гибридном состоянии. Изомерия Для ацетиленовых углеводородов характерна: 1) структурная изомерия, обусловленная строением углеродного скелета HC≡C-CH2-CH2-CH3 HC≡C-CH-CH3 | 1-пентин CH3 3-метил-1-бутин 2) изомерия по положению тройной связи HC≡C-CH2-CH2-CH3 CH3-C≡C-CH2-CH3 2-пентин Номенклатура Правила построения названий ацетиленовых углеводородов по научной номенклатуре (ИЮПАК) такие же, как и для этиленовых, с той лишь разницей, что суффикс -ен заменяют суффиксом –ин. Если в углеводороде имеются двойные и тройные связи, то при нумерации цепи они должны получить наименьшие значения. 67 По рациональной замещённые ацетилена. номеклатуре CH3-C≡C-CH2-CH-CH3 | CH3 5-метил-2-гексин метилизобутилацетилен алкины рассматриваются как CH3-CH=CH-C≡CH 3-пентен-1-ин CH2=CH-C≡C-CH3 1-пентен-3-ин CH2=CH-C≡CH 3-бутен-1-ин винилацетилен CH3-C≡C-CH2-CH2-CH3 2-гексин метилпропилацетилен 5.1. Способы получения алкинов 1. Карбидный метод (Вёлер,1862г.) t CaCO3 → CaO + CO2 2000°C CaO + 3C → CaC2 + CO CaC2 + 2H2O → CH≡CH + Ca(OH)2 карбид ацетилен кальция 2. Пиролиз этилена и метана Пиролиз этилена и метана проводят при очень высоких температурах в очень короткие интервалы времени (сотые доли секунды), так как ацетилен термодинамически нестабилен (хранят в баллонах в сжиженном состоянии в растворе ацетона). 1200oC CH2=CH2 HC CH + H2 этилен ацетилен 1500oC 2 CH4 HC CH + 3H2 метан 0,1 сек 3.Дегидрогалогенирование дигалогенопроизводных углеводородов 68 Дегидрогалогенирование как вицинальных, так и геминальных дигалогеналканов применяют в лабораторной практике для получения алкинов. 2KOH СH3-CH-CH2 СH3-C CH сп. р-р, t Cl Cl 1,2-дихлорпропан пропин СH3-CH2-CHCl KOH СH3-C CH + 2 KCl + 2H2O сп. р-р, t Cl 1,1-дихлорпропан 4. Метод алкилирования ацетилена Реакции алкилирования ацетилена возможны благодаря поляризации связи ≡С-Н и связанной с ней кислотности таких соединений. Метод состоит из двух стадий: ацетилен превращают в металлоорганическое соединение, которое затем реагирует с галогеналканами. HC HC CH + NaNH2 амид натрия NH3 жидк C: Na+ + Br -CH2-CH2-CH3 HC C: Na+ + NH3 ацетиленид натрия HC C-CH2-CH2-CH3 + NaBr 1-пентин Алкилирование ацетиленидов натрия успешно проходит только с первичными галогеналканами. 5. Магнийорганический синтез (реакция Иоцича, 1902г.) абс. эфир H3C-Br + Mg H3C-MgBr HC HC CH + H3C-MgBr C-MgBr HC C-MgBr + CH4 реактив Иoцича (броммагнийацетилен) HC C-CH-CH3 + MgBr2 + Br-CH-CH3 CH3 2-бромпропан 69 CH3 3-метил-1-бутин 5.2. Химические свойства алкинов Химические свойства алкинов во многом определяются наличием тройной связи. Типичными реакциями алкинов, как и алкенов, являются реакции присоединения. Алкины вступают в реакции электрофильного присоединения менее активно, чем алкены. Это объясняется образованием, на первой стадии винил-катиона, богатого энергией, для которого требуется большая энергия активации, чем для алкил-катиона и процесс присоединения к алкинам в целом замедляется. Алкины вступают также в реакции нуклеофильного присоединения, так как атомы углерода при тройной связи дезэкранированы. Ацетиленовая группировка, находящаяся на конце молекулы, обладает повышенной С-Н кислотностью, благодаря большой поляризации связи ≡С-Н, и, как следствие этого, атом водорода легко отщепляется. Реакции электрофильного присоединения Галогенирование H3C-C CH + Br2 Механизм H3C-C CH + H3C-CBr = CHBr Br-Br CH3-CBr=CHBr Br2 H3C-CBr2-CHBr2 + H3C-C CH - CH2-C=CH -Br Br Br-Br π- комплекс σ- комплекс Br2 CH3-CBr2-CHBr2 Гидрогалогенирование CH3-CH2-C=CH HBr CH3-CH2-C=CH2 Br 2-бром-1-бутен CH3-CH2-CBr=CH2 + HBr → CH3-CH2-CBr2-CH3 2,2-дибромбутан 70 Br Электрофильное присоединение к несимметричным алкинам в условиях гетеролитического процесса проходит по правилу Марковникова (водород кислоты присоединяется к атому углерода, несущему наибольшее число атомов водорода). Гипогалогенирование CH3-CH2-C CH HOBr CH3-CH2-C = CH ( Br+, OH-) OH Br CH3-CH2-C -CH2Br O Рекции нуклеофильного присоединения Реакция гидратации по Кучерову (1991г.) При гидратации ацетилена получается альдегид, при гидратации гомологов ацетилена - кетоны. HC CH + H2O HgSO4 H2SO4 CH2=CH O CH3-C H OH енол ацетальдегид CH HOH + HC=CH Механизм HC CH + Hg+2 HC Hg+2 + H-O-H HC=CH OH -Hg+2 HC=CH2 Hg+1 CH3-C CH + H2O Hg+1 HgSO4 H2SO4 CH3-C=CH2 OH 71 CH3-C O H CH3-C- CH3 O 2-пропанон Присоединение спиртов CH3-C CH + C2H5OH C2H5ONa CH3-C=CH2 OC2H5 метилвинилэтиловый эфир Механизм - + CH3-C CH + C2H5O CH3-C=CH C2H5OH OC2H5 C2H5O CH3-CH=CH2 OC2H5 Присоединение карбоновых кислот CH3-C CH + CH3COOH CH3-C=CH2 O-C-CH3 O метилвинилацетат Механизм O CH3-C OH + CH3-C H2O - CH3-C O + H3O+ CH3COOH O CH + CH3-C O CH3-C=CH O O-C-CH3 O H CH3-C=CH + CH3-C O O O-C-CH3 O 72 Реакции радикального присоединения Гидрирование H2 CH≡CH → H2 CH2=CH2 Pd → Pd H2 CH3-C≡CH → H2 CH3-CH=CH2 Ni пропин CH3-CH3 → CH3-CH2-CH3 Ni пропен пропан Реакция каталитического гидрирования алкинов протекает в две стадии: сначала образуются алкены, а затем алканы. Подобрав соответствующие условия, можно остановить реакцию на первой стадии. Присоединение водорода происходит нестереоселективно и сопровождается образованием промежуточных цис- и транс-алкенов. При использовании селективных реагентов и специальных условий можно осуществить стереоселективное восстановление алкинов. При восстановлении алкинов литием или натрием в жидком аммиаке при низкой температуре образуются транс-алкены. При гидрировании алкинов над специально приготовленным палладием (катализатор Линдлара) образуются цис-алкены. H3C H 2Na, NH3 (ж) С=С + 2NaNH2 CH 3 H транс-2-бутен СН3-С С-СН3 H2, Pd H3C С=С CH3 H H цис-2-бутен Галогенирование Присоединение галогенов к алкинам может проходить и по механизму радикального (гомолитического) присоединения под действием света. h СН3С СН + Cl2 СН3-СCl2-СНCl2 t Гидрогалогенирование Присоединение к алкинам бромистоводородной кислоты в присутствии перекисей (перекисный эффект Караша) происходит против правила Марковникова. 73 С2Н5-С СH + HBr Механизм H2O2 + HBr С2Н5-С СH H2O2 HBr С2Н5-СH=СHBr Br + Br С2Н5-СH2-СHBr2 + OH + H2O С2Н5-С=СHBr образуется более устойчивый радикал С2Н5-С=СHBr + HBr С2Н5-СH=СHBr + Br С2Н5-СH=СHBr + Br С2Н5-СH-СHBr2 С2Н5-СH-СHBr2 + HBr С2Н5-СH2-СHBr2 + Br 1, 1-дибромбутан Реакции конденсации Реакция А.Е.Фаворского В присутствии твёрдого едкого кали ацетилен конденсируется с ацетоном с образованием непредельных спиртов. OH CH 3 KOH тв. СН3-С С- C CH3 СН3-С С-Н + O C OH CH3 CH3 Реакция В.Реппе (1949г.) В присутствии формальдегидом. HС С-Н + HC=O H ацетиленида Cu2C2 HС меди ацетилен H HC=O С- C-OH H конденсируется с H HOH2C-C C-CH2OH Cu2C2 Реакция изомеризации (А.Е.Фаворский, 1887г.) Изомеризация алкинов под действием сильных оснований подробно была изучена А.Е.Фаворским (1887г.). При действии щелочных металлов тройная связь перемещается на конец молекулы. Действие спиртовых растворов щелочей наоборот способствует переходу концевой тройной связи в цепь молекулы. Na, t H3С-C C- СН3 H3С-CH2-C СН NaOC2H5 74 Кислотные свойства (Реакции с участием подвижного атома водорода) Алкины с концевой тройной связью проявляют слабые СН-кислотные свойства и способны отщеплять протон под действием сильных оснований. Повышенная подвижность атома водорода обусловлена большей электроотрицательностью атома углерода в sp-гибридном состоянии и, следовательно, большей стабильностью образующегося аниона. Этим алкины отличаются от алканов и алкенов, которые не реагируют со щелочными металлами и их гидроксидами. Ацетилен - более сильная кислота, чем аммиак, но более слабая, чем вода и спирты. При пропускании ацетилена в раствор амида натрия в жидком аммиаке выделяется аммиак и соль – ацетиленид натрия. NH3ж CH≡CH + NaNH2 → CH≡CNa + NH3 Ацетиленид натрия (как соль слабой кислоты и сильного основания) легко гидролизуется водой. CH≡CNa + H2O → CH≡CH + NaOH Гомологи ацетилена могут образовать только моноалкилацетилениды. NH3ж CH3-C≡CH + NaNH2 метилацетилен → CH3-C≡CNa + NH3 метилацетиленид натрия При действии на ацетилен аммиачных растворов солей меди и серебра образуются ацетилениды меди и серебра. CH≡CH + 2[Ag(NH3)2]OH → Ag―C≡C―Ag↓ + 4NH3 + 2H2O ацетиленид серебра CH≡CH + 2[Cu(NH3)2]OH → Cu―C≡C―Cu↓ + 2NH3 + 2NH4Cl ацетиленид меди Реакции образования ацетиленидов серебра и меди используют для идентификации алкинов с концевой тройной связью. С магнийорганическими соединениями алкины образуют производные по СН- кислотному центру (реактивы Иоцича). CH3-C≡CH + CH3-MgBr → CH3-C≡C-MgBr + CH4 реактив метилацетиленГриньяра магнийбромид реактив Иоцича 75 Реактивы Иоцича широко применяются в органических синтезах для получения гомологов ацетилена и разнообразных функциональных производных ацетиленовых углеводородов. CH3-C≡C-MgBr + CH3-CH2-Br → CH3-C≡C-CH2-CH3 + MgBr2 -δ +δ H2O CH3-C≡C-MgBr + CH3-C=O → CH3-C≡C-CH-O- MgBr → CH3-C≡C-CH-OH | | | H CH3 CH3 3-пентин-2-ол Реакции полимеризации Реакции полимеризации ацетиленовых углеводородов проходят сложнее, чем у этиленовых углеводородов. В присутсвии катализатора хлорида меди (1) ацетилен димеризуется с образованием винилацетилена. CuCl CH≡CH + CH≡CH → CH2=CH-C≡CH 1-бутен-3-ин При действии на этот продукт хлористого водорода получается хлоропрен, являющийся мономером для получения синтетического каучука. CH2=CH-C≡CH + HCl → CH2=CH-C=CH2 | Cl 2-хлор-1,3-бутадиен Винилацетилен при взаимодействии с ацетиленом может образовывать дивинилацетилен. CuCl CH2=CH-C≡CH + CH≡CH → CH2=CH-C≡C-CH=CH2 Ацетилен и его гомологи также вступают в реакции циклоолигомеризации. При нагревании ацетилена в присутствии активированного угля (реакция Бертло-Зелинского, 1922г.) получается бензол. C 400oC 3HС CН акт, бензол Гомологи ацетилена в присутствии металлокомплексных катализаторов (соединений Cr, Ni, Co) превращаются в соответствующие производные бензола. 76 R 3R-С CН кат R R Тримеризацией диизопропилацетилена в присутствии солей кобальта (Co2(CO)8 или Hg[Co2(CO4)]2) был получен гексаизопропилбензол. R R R кат 3R-С C-R R R где R: -СH(СH3)2 R При действии на ацетилен соединений никеля может образоваться циклооктатетраен (реакции Реппе). 4HС CH Ni(CN)2 циклооктатетраен Реакции окисления Все известные методы, приводящие к окислительному расщеплению двойной связи, пригодны для расщепления тройной связи. В качестве окислителей применяют перманганат калия в кислой или щелочной средах, озон, дихромат калия в кислой среде. При окислении происходит разрыв углеродной цепи по месту тройной связи и продуктами окисления являются соответствующие карбоновые кислоты. O3 CH3-С C-CH3 KMnO4, H+ 2CH3COOH K2Cr2O7 H2SO4 Первичный атом углерода в алкинах с концевой тройной связью окисляется до диоксида углерода. Реакции окисления алкинов используют преимущественно для определения их строения. При окислении алкинов 77 раствор пермаганата калия обесцвечивается, поэтому реакция служит качественной пробой на ненасыщенность. KMnO4, H+ CH3-CH2CH2C ≡ CH → CH3-CH2CH2COOH + CO2 5.3. ЗАДАЧИ К ТЕМЕ « АЛКИНЫ» Задача № 1. Назовите по научной и рациональной номенклатуре следующие углеводороды: а) CH3-CH2-CH(CH3)-C≡C-CH3 CH3 | б) CH3-CH-C≡C-C-CH3 | | CH3 CH3 в) CH3-C≡C-СН2-СН(СH3)-CH3 г) CH3-CН2-C≡С-СН2-СН=CH2 д) Н2С=СН-С≡С-CH3 Решение 6 5 4 3 2 1 а) CH3-CH2-CH(CH3)-C≡C-CH3 Для наименования углеводорода по научной номенклатуре выбираем длинную цепь углеродных атомов, содержащую тройную связь и нумеруем её таким образом, чтобы атом углерода при тройной связи получил наименьший номер. Затем называем главную цепь с указанием места положения тройной связи (2-гексин) и добавляем в виде приставок названия и положения боковых заместителей. Приведенное вещество называется 4метил-2-гексин. Наименование соединений по рациональной номенклатуре строим от ацетилена с добавлением названий радикалов: метилвторбутилацетилен. б) 2,2,5-триметил-3-гексин, изопропилтретбутилацетилен в) 5-метил-2-гексин, метилизобутилацетилен 78 г) 7 6 5 4 3 2 1 CH3-CН2-C≡С-СН2-СН=CH2 В этом соединении двойная и тройная связи должны получить меньшие номера, поэтому соединение следует назвать 1-гептен-4-ин, по рациональной номенклатуре – этилаллилацетилен. д) 1-пентен-3-ин, метилвинилацетилен. Задача № 2. Из уксусной кислоты и неорганических веществ получите ацетилен. Решение Одним из методов получения ацетилена является окисление метана при высокой температуре. Метан может быть получен из натриевой соли уксусной кислоты по реакции Дюма. Схема получения ацетилена из уксусной кислоты следующая: NaOH CH3-COOH CH3-COO‾ Na+ → разб CH3-COONa + NaOHтв. t → Na2CO3 + CH4 1500°C CH4 → HC≡CH 0,! cек Задача № 3. Получите 2-пентин из 2-бутина. Решение В задаче требуется получить ацетиленовый углеводород, в котором длина углеродной цепи увеличивается на один атом углерода. Это можно осуществить реакцией алкилирования. В реакцию алкилирования вступают ацетиленовые углеводороды только с концевой тройной связью, поэтому необходимо переместить тройную связь на конец молекулы, т.е.2-бутин превратить в 1-бутин. Для этого следует провести реакцию изомеризации по Фаворскому: Na CH3-С≡С-СН3 → НС≡С-СН2-СН3 t В ацетиленовых углеводородах с концевой тройной связью атом водорода обладает кислым характером и легко замещается на металлы: NaNH2 НС≡С-СН2-СН3 → CH3-CH2-C≡C‾ Na+ NH3 79 Ацетилениды металлов алкилируются галогеналканами. СН3-Br + CH3-CH2-C≡C‾ Na+ → CH3-C≡C-CH2-CH3 + NaBr 2-пентин Задача № 4. Какие из приведенных ниже углеводородов могут существовать в виде Z- и E-изомеров (цис-, транс-изомеров)? Напишите их проекционные формулы и дайте названия по научной номенклатуре. а) СН3-СН2-С≡С-СН-СН3 | СН3 б) СН3-СН2-СН=СН-СН-СН3 | СН3 в) СН3-СН-СН2-СН2-СН3 | СН3 г) СН3-С≡С-СН=СН-СН3 Решение Геометрическая изомерия может наблюдаться у соединений, имеющих двойную связь. Поэтому соединения (а) и (в) не обладают Z- и E-изомерией. б) СН3-СН2-СН=СН-СН-СН3 | СН3 Соединение (б) имеет два различных заместителя у атомов углерода при двойной связи, поэтому соединение может быть в двух геометрических изомерах: СН3 | СН3-СН2 СН-СН3 \ / С=С / \ Н Н Z-2-метил-3-гексен СН3-СН2 Н \ / С=С / \ Н СН-СН3 Е-2-метил-3-гексен | СН3 80 г) СН3-С≡С-СН=СН-СН3 Соединение имеет двойную и тройную связи, но геометрическая изомерия наблюдается только относительно двойной связи: СН3-С≡С СН3 \ / С=С Z-2-гексен-4-ин / \ Н Н СН3-С≡С Н \ / С=С / \ СН3 Н Е-2-гексен-4-ин Задача № 5. Из бутанола получите 1-бутин и 2-бутин. Решение Одним из методов получения алкинов является реакция дегидрогалогенирования вицинальных дигалогенопроизводных углеводородов, поэтому 1-бутин можно получить из 1,2-дибромбутана. 1,2-Дибромбутан легко можно синтезировать из 1-бутена присоединением молекулы брома. 1-Бутен можно получить из бутанола реакцией дегидратации. Схема получения 1-бутина следующая: H2SO4 СН3-СН2-СН2-СН2-ОН → СН2=СН-СН2-СН3 → t, –Н2О Br2 2NaOH → СН2-СН-СН2-СН3 → НС≡С-СН2-СН3 | | спирт Br Br 2-Бутин можно Фаворскому: получить из 1-бутина реакцией изомеризации t, C2H5ONa НС≡С-СН2-СН3 → СН3-С≡С-СН3 Задача № 6. Получите из ацетилена метилизобутилацетилен, используя реакцию Иоцича. Решение 81 по НС≡СН → СН3-С≡С-СН2-СН-СН3 | СН3 Из формул исходного и конечного соединений видно, что в молекулу ацетилена требуется ввести два заместителя – метил и изобутил. Заместители следует вводить последовательно, поэтому вначале синтезируем метилацетилен. абс. эфир СН3Br + Mg → СН3-MgBr реактив Гриньяра (метилмагнийбромид) -δ +δ -δ +δ СН3-MgBr + НС≡СН → НС≡С-MgBr + СН4 , реактив Иоцича НС≡С-MgBr + СН3Br → НС≡С-СН3 + MgBr2 метилацетилен Второй заместитель – изобутил вводим аналогично: СН3-СН-СН2Br + Mg → СН3-СН-СН2-MgBr | | СН3 СН3 СН3-С≡СН + СН3-СН-СН2-MgBr → СН3-С≡С-MgBr + СН3-СН-СН3 | | СН3 СН3 СН3-С≡С-MgBr + СН3-СН-СН2Br → СН3-С≡С-СН2-СН-СН3 + MgBr2 | | СН3 СН3 Задача № 7. В трех пробирках без этикеток содержатся следующие жидкости: пентан, 1-пентен, 1-пентин. Какими реакциями можно идентифицировать эти вещества? Решение Ацетиленовые углеводороды с концевой тройной связью реагируют с аммиачным раствором окиси серебра с образованием осадка, поэтому добавим в три пробирки Ag(NH3)2OH. В пробирке, где находится 1-пентин, выпадет осадок (пропилацетиленид серебра). Ag(NH3)2OH НС≡С-СН2-СН2-СН3 → AgС≡С-СН2-СН2-СН3 ↓ Этиленовые углеводороды реагируют с бромом при комнатной температуре, поэтому к двум оставшимся веществам прибавляем раствор 82 брома в четырёххлористом углероде. В одной из пробирок красный цвет брома исчезнет: 1-пентен реагирует с бромом. Br2 СН2=СН-СН2-СН2-СН3 → СН2-СН-СН2-СН2-СН3 СCl4 | | Br Br Пентан определяем по отрицательным реакциям с перечисленными реагентами. Задача №8. Расположите приведенные углеводороды в ряд по уменьшению реакционной способности в реакции электрофильного присоединения с HBr: пропин, 2-бутин, пропен, 2-бутен. Приведите уравнения реакций. Решение Тройная связь труднее чем двойная, подвергается действию электрофильных агентов (E+). Это объясняется образованием на первой стадии винил-катиона (–СE=С+–), богатого энергией, следовательно энергия активации для его образования требуется выше, чем для алкил-катиона (>СE-С+<), поэтому винил-катион образуется медленнее и процесс присоединения к алкинам в целом замедляется. Следовательно, из приведенных в задаче соединений наиболее реакционноспособными являются пропен и 2-бутен. Последний имеет два электронодонорных заместителя при двойной связи, а пропен один. Присоединение электрофильных частиц идет тем быстрее, чем больше электронодонорных заместителей находится при кратной связи. На основании вышесказанного следует, что реакционная способность приведенных соединений уменьшается в следующем ряду: СН3-СН=СН-СН3 > СН3-СН=СН2 > СН3-С≡С-СН3 > СН3-С≡СН 2-бутен пропен 2-бутин пропин СН3-СН=СН-СН3 + НBr → СН3-СН2-СНBr-СН3 СН3-СН=СН2 + НBr → СН3-СНBr-СН3 Br HBr | СН3-С≡С-СН3 + НBr → СН3-СH=С-СН3 → СН3-СH2-С-СН3 | | Br Br Br HBr | СН3-С≡СН + НBr → СН3-С=СН2 → СH3-С-СН3 | | Br Br 83 Электрофильное присоединение протекает по правилу Марковникова. Задача № 9. Какие продукты образуются в следующей цепи превращений: Na метилацетилен → CH3J А → H2O Б NH3ж → метилацетилен В → Г HgSO4 Назовите промежуточные продукты. Решение Метилацетилен при взаимодействии с натрием в жидком аммиаке образует ацетиленид натрия, который вступает в обменную реакцию с иодистым метилом с образованием диметилацетилена. + СН3-С≡СН + Na → СН3-С≡С‾ Na метилацетиленид натрия СН3-С≡С‾ Na + + CH3J → СН3-С ≡С-СН3 + NaBr диметилацетилен При взаимодействии с водой протекает реакция Кучерова. Н2О СН3-С≡С-СН3 → СН3-С=СН-СН3 ↔ СН3-С-СН2-СН3 Нg2+ | || ОН О енол метилэтилкетон Кетоны реагируют с ацетиленовыми углеводородами, содержащими концевую тройную связь (реакция Фаворского). СН3 +δ –δ +δ | СН3-С-СН2-СН3 + СН3-С≡С-Н → СН3-С≡С-С-СН2-СН3 || КОН тв. | О –δ ОН 3-метил-4-гексин-3-ол Задача № 10. Осуществите следующие превращения: электролиз СН3СН2СООNa → ? Br2 KOH → ? → hv сп.р-р 84 KMnO4 ? → ? + Н NaOH → водн.р-р ? → NaOHтв → t 1500°С ? NaNH2 → ? → CH3-CHBr-CH3 ? → Н2О ? 0,1сек → ? HgSO4 Решение электролиз СН3СН2СООNa → Br2 СН3-СН2-СН2-СН3 KMnO4 → СН3-СН=СН-СН3 → СН3СООН + → 0,1сек. NaNH2 CH≡CH → – NH3 CH≡CNa → СН3-СН2-СН-СН3 → hυ, -HBr | сп.р-р Br NaOH H 500°С KOH → NaOHтв СН3СООNa водн. р-р CH3CHBrCH3 → – NaBr → CH4 → -Na2CO3 Н2О CH≡C-CHCH3 → CH3-C- CHCH3 | HgSO4 || | СН3 O CH3 Задача №11. Как можно отличить следующие два изомерных углеводорода: 4-метил-2-пентин и 3-гексин? Решение Изомерные ацетиленовые углеводороды можно отличить реакцией озонирования или окисления в жестких условиях KMnO4 или K2Cr2O7. При этом происходит разрыв углеродной цепи по месту тройной связи и образование карбоновых кислот. О-О-О О3 / \ Н2О СН3-С≡С-СН-СН3 → СН3-С---------С-СН-СН3 → СН3-С=О + СН3-СН-С=О | \ / | | | | СН3 О-О-О СН3 ОН СН3 ОН 4-метил-2-пентин уксусная изомасляная кислота кислота О-О-О О3 / \ Н2О СН3-СН2-С≡С-СН2-СН3 → СН3-СН2-С---------С-СН2-СН3 → 2СН3-СН2-С=О \ / | О-О-О ОН пропионовая кислота Продукты окисления получаются разные, поэтому, проведя их анализ, можно определить и различить исходные изомеры. 85 Задача №12. Определите, какой ацетиленовый углеводород (А) был подвергнут окислению K2Cr2O7 в кислой среде, если в результате ряда последующих превращений в качестве единственного продукта получен 2,3-диметил-2бутен. K2Cr2O7 А → Б + Н NaOH электролиз → В → разб. Br2 Г NaOH → Д hv → Е (2,3-диметил-2-бутен) сп. р-р Решение Задачи такого типа удобно решать с последней реакции, последовательно переходя к начальным. 2,3-Диметил-2-бутен получен из вещества (Д) действием спиртового раствора щелочи, следовательно, проводилась реакция дегидрогалогенирования монобромалкана. Таким бромалканом мог быть только 2-бром-2,3-диметилбутан. Br | СН3-С-СН-СН3 | | Н3С СН3 NaOH → спирт СН3-С=С-СН3 | | Н3С СН3 2-Бром-2,3-диметилбутан получают из 2,3-диметилбутана реакцией радикального бромирования. Br Br2 | СН3-СН-СН-СН3 → СН3-С-СН-СН3 | | hυ | | Н3С СН3 Н3С СН3 Замещение в этой реакции идет исключительно третичного атома водорода. Предельные углеводороды получаются электролизом солей карбоновых кислот по реакции Кольбе: электролиз СН3-СН-СOO‾ Na+ | СН3 → . СО2 + СН3-СН-СН-СН3 + NaOH + H2 | | Н3С СН3 Соли карбоновых кислот образуются при взаимодействии кислот водным раствором щелочи: NaOH СН3-СН-СOOH | СН3 → водн. р-р СН3-СН-СOO‾ Na+ | СН3 86 Ацетиленовый углеводород, при окислении которого получается только изомасляная кислота, должен иметь симметричную структуру: K2Cr2O7 СН3-СН-С≡С-СН-СН3 | | СН3 СН3 → 2СН3-СН-СОOH | СН3 + Н Таким образом, исходный ацетиленовый углеводород (А) – 2,5-диметил-3-гексин. Задача №13. Установите строение углеводорода состава С5Н8, если известно, что он: а) не реагирует с аммиачным раствором окиси серебра, б) взаимодействует с водой с образованием кетона. Решение Углеводород имеет общую формулу СnH2n-2, следовательно, относится к ацетиленовым или диеновым углеводородам. При реакции с водой образуется кетон, значит, данный углеводород является алкином. Не образует осадка с аммиачным раствором окиси серебра, следовательно, алкин не имеет концевой тройной связи. Вывод: углеводород C5H8 — 2-пентин. Структурная формула: CH3-C≡C-CH2-CH3 Реакции: Hg2+ CH3-C≡C-CH2-CH3 +H2О → CH3-C-CH2-CH2-CH3 + CH3-CН2-C-CH2-CH3 || || О О Ag(NH3)2OH CH3-C≡C-CH2-CH3 2-пентин → реакция не идёт. 87 6. Л И Т Е Р А Т У Р А 1. Травень В.Ф. Органическая химия. В 2-х т. – М.: Академкнига, 2005. – 727с. и 582с. 2. Органическая химия. Основной курс. Под ред. Н.А. Тюкавкиной. -М.: Дрофа, 2004.– 635с. 3. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – СПб.: «Иван Фёдоров», 2003. – 624с. 4. Нейланд О.Я. Органическая химия. – М.: Высшая школа, 1990. – 751с. 5. Вопросы и задачи по органической химии. Под ред. проф. Суворова Н.Н. – М.: Высшая школа, 1988. – 255с. 6 Янковский С.Я., Данилова Н.С. Задачи по органической химии. − М.: «КОЛОС», 2000. − 327с. 7.Иванов В.Г., Горденко В.А., Гева О.Н. Органическая химия. –М.: AСADEMA, 2005. – 605с. СОДЕРЖАНИЕ Введение 1. Электронное строение атома углерода и его три валентных состояния 2. Алканы 2.1. Способы получения алканов 2.2. Химические свойства алканов 2.3. Задачи по теме «Алканы» 3. Алкены 3.1. Способы получения алкенов 3.2. Химические свойства алкенов 3.3. Задачи по теме «Алкены» 4. Алкадиены 4.1. Способы получения алкадиенов 4.2. Химические свойства алкадиенов 4.3. Задачи по теме «Алкадиены» 5. Алкины 5.1. Способы получения алкинов 5.2. Химические свойства алкинов 5.3. Задачи по теме «Алкины» 6. Список литературы 88 3 3 7 11 13 20 30 32 34 42 51 52 53 60 67 68 70 78 88