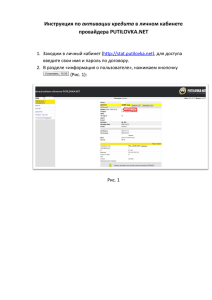
Синтез углеродных адсорбентов методом термохимической
advertisement

Северный (Арктический) федеральный университет имени М.В.Ломоносова На правах рукописи Белецкая Марина Геннадьевна Синтез углеродных адсорбентов методом термохимической активации гидролизного лигнина с использованием гидроксида натрия 05.21.03 – технология и оборудование химической переработки биомассы дерева, химия древесины Диссертация на соискание ученой степени кандидата технических наук Научный руководитель: доктор технических наук, профессор Н.И. Богданович; Архангельск 2014 ОГЛАВЛЕНИЕ СПИСОК ПРИНЯТЫХ СОКРАЩЕНИЙ 5 ВВЕДЕНИЕ 6 1 АНАЛИТИЧЕСКИЙ ОБЗОР 7 1.1 Назначение и направления практического использования активных углей 1.1.1 Практическое применение активных углей для адсорбции из жидкой фазы 1.1.1.1 Использование активного угля для очистки воды 7 8 10 1.1.1.2 Использование активированного угля для производства конденсаторов 11 1.1.2 Использование активных углей в газообразных среда 16 1.1.2.1 Рекуперационные АУ 1.1.2.2 Использование активных углей для очистки воздуха 17 18 1.2 Основные сырьевые источники получения активных углей 1.2.1 Синтез углеродных адсорбентов из нетрадиционного сырья 1.2.2 Синтез углеродных адсорбентов из отходов растительного происхождения 1.2.3 Синтез адсорбентов из технических лигнинов 1.3 Методы парогазовой активации в синтезе активных углей 1.4 Методы химической активации в синтезе активных углей 21 22 25 29 31 34 1.4.1 Применение ZnCl2 для химической активации 1.4.2 Применение карбонатов щелочных металлов для химической активации 34 36 1.4.3 Применение KOH и NaOH для химической активации 1.5 Методы исследования пористой структуры активных углей 39 45 1.5.1 Изотерма БЭТ 1.5.2 Теория объемного заполнения микропор (ТОЗМ) 1.5.3 Другие методы исследования пористой структуры АУ 1.6 Требования, предъявляемые к АУ для суперконденсаторов и других 48 50 52 53 электротехнических устройств 1.7 Выводы по аналитическому обзору 2 МЕТОДИЧЕСКАЯ ЧАСТЬ 2.1 Характеристика объекта исследования 2.2 Подготовка образцов 2.3 Получение активных углей 2.4 Методика выщелачивания угольных остатков пиролиза 2.5Методика определения выхода АУ 55 57 57 57 57 58 59 2.6 Методы анализа активных углей 59 2.6.1 Определение насыпной плотности 59 2 2.6.2 Определение содержания золы 59 2.6.3 Определение содержания воды в угле 59 2.6.4 Определение адсорбционной активности по йоду 59 2.6.5 Определение площади удельной поверхности по йоду 59 2.6.6 Определение осветляющей способности по метиленовому голубому 60 2.6.7 Определение адсорбционных свойств по гексану 61 2.6.8 Определение адсорбционных свойств по бензолу 61 2.6.9 Определение адсорбционных свойств по методу низкотемпературной адсорбции азота 61 2.7 Методики обработки изотерм адсорбции 63 2.7.1 Обработка изотерм адсорбции азота 63 2.7.1.1 Анализ изотерм адсорбции по уравнению Брунауэра - Эмметта - Теллера 64 2.7.1.2 Анализ изотерм адсорбции по уравнению Дубинина-Радушкевича 65 2.7.1.3 Анализ изотерм адсорбции по уравнению Дубинина-Астахова 66 2.7.1.4 Анализ изотерм адсорбции по t-методу 68 2.7.1.5 Метод анализа изотерм Horvath-Kawazoe 69 2.7.2 Анализ изотерм адсорбции из растворов по уравнению Лэнгмюра 70 2.7.3 Анализ изотерм адсорбции из растворов по уравнению Фрейндлиха 72 3 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 3.1 Термохимическая активация исходного гидролизного лигнина 3.1.1 Термохимическая активация лигнина вибропомола 74 74 74 3.1.2 Термохимическая активация лигнина нефракционированного 3.2 Термохимическая активация предварительно термообработанного лигнина 76 78 3.2.1 Влияние температуры предварительной термообработки ГЛ и расхода NaOH на выход и свойства АУ 78 3.2.2 Влияние температуры термохимической активации на выход и свойства АУ 3.2.3 Влияние условий синтеза на формирование пористой структуры АУ 3.3 Исследование термохимической активации с использованием методов планированного эксперимента. 3.3.1 Исследование в области низких дозировок NaOH 3.3.1.1 Влияние режимных параметров на выход и адсорбционные свойства АУ 3.3.2 Исследование в области высоких дозировок NaOH 3.3.2.1 Влияние режимных параметров на выход и адсорбционные свойства АУ 3.3.2.2 Изотермы адсорбции МГ и их анализ по уравнениям Фрейндлиха и Лэнгмюра 81 83 85 86 86 90 91 94 3 3.3.2.3 Изотермы адсорбции йода и их анализ по уравнениям Фрейндлиха и Лэнгмюра 3.3.3 Сравнительный анализ результатов планированного эксперимента 3.4. Анализ пористой структуры АУ по данным низкотемпературной адсорбции 97 100 азота 102 3.5 Исследование потребительских свойств АУ 108 3.5.1 Испытание по использованию в суперконденсаторах 3.5.2 Испытание ПАУ «Карболин» в ВНИИ крахмалопродуктов 3.5.3 Испытание ПАУ «Карболин» в производстве водки 110 111 112 3.6 Выводы по экспериментальной части 114 4 ТЕХНОЛОГИЧЕСКАЯ ЧАСТЬ 116 4.1 Технология синтеза активного угля методом термохимической активации в присутствии NaOH 116 ВЫВОДЫ СПИСОК ЛИТЕРАТУРЫ ПРИЛОЖЕНИЯ 128 129 145 4 СПИСОК ПРИНЯТЫХ СОКРАЩЕНИЙ АУ – активных углей; СВ – сточные воды; БХО – биохимическая очистка; ПФГ – поверхностные функциональные группы; ДЭС – двойной электрический слой; РАУ – рекуперационные активные угли; ПОСВ - пиролизованных осадков сточных вод; НСО – нефтесодержащие отходы; ИАИ – избыточный активный ил; ОМК – органоминеральная композиция; Теория БЭТ – теория Брунауэра-Эммета-Теллера; ТХА – термохимическая активация; ГАУ – гранулированный активный уголь; ЛСТ – лигносульфонаты; ГЛ – гидролизный лигнин; ТОЗМ – теория объемного заполнения микропор; ИЮПАК – Международный союз теоретической и прикладной химии; BJH – Метод Barrett–Joyner–Halenda; ОИВТ РАН - Объединенный Институт Высоких температур РАН; 5 ВВЕДЕНИЕ Промышленность химической переработки древесины приводит к образованию большого количества отходов, значительную часть которых составляют так называемые технические лигнины, в том числе гидролизный и целлолигнин. В частности, гидролизного лигнина в отвалах накопилось десятки миллионов тонн, которые возможно рационально переработать различными термическими методами, что в определенных условиях позволит получать высококачественные адсорбенты – активные угли. Несмотря на предложения по переработке гидролизного лигнина в продукты, нужные в различных отраслях промышленности, все они не нашли широкого применения, в основном, из-за высоких требований к качеству получаемых продуктов и, значит, к качеству исходного сырья. А в тех отраслях, где непостоянство состава и неупорядоченная структура не играют важной роли, например в сельском хозяйстве, строительной индустрии, буровой технике и др., масштабы использования лигнина достаточно малы. Практикующееся сжигание лигнина в топках котельных нельзя считать рациональным с точки зрения потенциальной ценности этого сырья. Альтернативным сжиганию решением проблемы утилизации лигнина, в частности гидролизного, является пиролиз. Из методов активации углеродсодержащего сырья находят применение парогазовые и химические. Последние в настоящее время приобретают все большую популярность. В зарубежной практике оба метода активации с использованием в качестве активирующего агента хлорида цинка, серной кислоты, сульфидов щелочи развиваются равноценно. Это объясняется тем, что химические методы позволяют получать адсорбенты со строго заданными параметрами пористой структуры и высокими показателям адсорбционных свойств. Из реагентов для химической активации в последнее время получают распространение гидроксиды щелочных металлов (NaOH и KOH). О промышленных реализациях подобных процессов синтеза АУ в литературных источниках сведений практически не имеется, но приводятся результаты широких экспериментальных исследований, проводимых в данной области в различных странах. Целью данной работы является изучить влияние условий синтеза углеродных адсорбентов из гидролизного лигнина с использованием в качестве активирующего агента гидроксида натрия. Так как гидролизный лигнин в настоящее время вырабатывается на промышленных предприятиях в ограниченных количествах, в качестве сырьевого материала мы использовали лигнин из отвалов АГЗ. 6 1 АНАЛИТИЧЕСКИЙ ОБЗОР Адсорбционные и другие свойства наноструктурированных углеродных материалов (активных углей) во многом определяются методами активации и характеристиками используемых углеродсодержащих сырьевых материалов. В последнее время для синтеза подобных материалов все чаще используются каменные угли и другие твердые горючие ископаемые. Вместе с тем, сохраняется интерес к углеродным материалам растительного происхождения, в особенности к отходам, которые образуются при их переработке. В некоторых случаях углеродные адсорбенты, получаемые из этих отходов обладают уникальными свойствами. Причем, они являются наиболее пригодными при реализации методов термохимической активации. 1.1 Назначение и направления практического использования активных углей В настоящее время потребители испытывают дефицит высококачественных АУ с высокой адсорбционной емкостью. В обзоре [1] рассмотрена структура потребления активированных углей. Согласно ей, основными потребителями углеродных адсорбентов является производство пищевых продуктов (42%), технологическое использование (38%), охрана окружающей среды (10%). В обзоре [2] также рассмотрены области использования активированных углей, при этом особое внимание уделяется процессам депирогенизации растворов и водоподготовки, химическом синтезе, процессах извлечения золота и ряда других драгоценных металлов и др. Опубликованы работы, касающихся получения и применения древесных активированных углей в экологических целях [3]. Кроме традиционных потребителей активных углей в последнее время они широко применяются для изготовления суперконденсаторов и аккумуляторных батарей. Технические характеристики суперконденсаторов и батарей в большей мере определяются показателями качества АУ, используемых для этих целей. Традиционные назначения АУ – очистка газовых и жидких сред в различных технологических процессах. Например, очень большое значение активные угли имеют в процессах синтеза медицинских препаратов, в частности антибиотиков. Жидкие среды, в которых протекают процессы получения указанных препаратов, обычно подвергаются глубокой адсорбционной очистке перед заключительной стадией их выделения из растворов и последующим изготовлением таблетированных и других форм. Во всех развитых странах мира процессы приготовления питьевой воды требуют огромных количеств АУ различного качества. Это и порошкообразный АУ, используемый в процессе углевания при приготовлении питьевой воды, и гранулированные и зерненные угли, применяемые на финишной стадии тонкой завершающей очистки воды от различных примесей. 7 В связи с ужесточением требований к сбросу очищенных сточных вод в водоемы возникает проблема глубокой доочистки СВ физико-химичсекими методами. Для доочистки СВ часто применяются адсорбционные методы с использованием АУ. Под термином «доочистка» подразумеваются методы и процессы, дополняющие традиционные технологические схемы очистки сточных вод данного состава. Вследствие широкого распространения биохимической очистки (БХО) общих потоков сточных вод обычно первичной очисткой считается механическая, вторичной – биологическая, а третичной – доочистка. При этом в процессе доочистки возможна любая необходимая и достижимая степень удаления или деструкции загрязнений. Применение сорбции на АУ позволяет дополнительно после БХО извлечь из воды более 80% оставшихся загрязняющих веществ. Доочистка биохимически очищенных сточных вод на АУ, т е сочетаний стадий БХО и сорбции, получила значительно большее распространение, чем очистка сырых (исходных) стоков на АУ. 1.1.1 Практическое применение активных углей для адсорбции из жидкой фазы Для очистки жидкостей применимы как зерненные, так и порошкообразные активные угли. На зерненых АУ ведутся преимущественно непрерывные процессы, и порошкообразные больше пригодны для работы с периодическими процессами. С целью лучшего обеспечения контакта обрабатываемой среды с углем процесс чаще всего ведут при интенсивном перемешивании. Простейшим способом отделения адсорбента от жидкой фазы является отстаивание, но применяется оно редко ввиду длительности осаждения. Чаще всего такой методом используется при очистке вин и другой алкогольной продукции [4]. Ввиду этих трудностей чаще всего используют фильтрование. Технологи применения порошковых активных углей весьма разнообразна и позволяет решать специфические задачи. Так, например, при очистке вин используется исключительно порошкообразные АУ, так как в данном случае необходимо избегать даже кратковременного контакта продукта с большим количеством угля. Во многих процессах химической промышленности вещества подвергаются перекристаллизации с обработкой активированным углем, чтобы после фильтрования получить чистый кристаллический конечный продукт. При водоподготовке все большее применение находят зерненные активные угли. Так, с 1925 г. на водопроводной станции в Хамме применяются зерненные активные угли при получении питьевой воды, равно как и в большинстве европейских стран. Сахарная промышленность так же использует костяные или древесные угли в зерненной форме для осветления сиропов и в производстве сахара. Наибольшее распространение эти технологии получили в США [5]. Активные угли находят широкое применение в процессах дезодорирования пищевых масел и жиров, которые являются важнейшими при рафинировании. Для этих 8 целей используют тонкопористый порошковый АУ парогазовой активации. Зерненные АУ используются только в исключительных случаях, например при дезодорировании таллового масла [4]. Многие важные химические вещества содержат большие количества окрашивающих примесей, которые попадают в продукт из сырья или образуются в процессе производства. Часто такие примеси возможно удалить при помощи обработки активированным углем. Также к таким нежелательным примесям относятся не только дурнопахнущие вещества, но и те, которые мешают процессу в результате образования пены или эмульсии. Активные угли используются для очистки природных органических соединений значительно чаще, чем неорганических. Образующийся в процессе разложения жиров при производстве мыла глицерин, несмотря на все усовершенствования техники перегонки, все равно приходится обрабатывать активированным углем в сыром состоянии, особенно на конечном этапе. С этой целью применяют порошкообразный АУ так как часто требуется очень высокая степень очистки: в производстве пищевых продуктов, фармацевтических и медицинских препаратов, а так же косметических средств [2]. Для получения нитроглицерина используется очень чистое сырье. Именно поэтому к применяемому в его производстве активированному углю предъявляются высокие требования. Это относится, например, к содержанию минеральных компонентов, так как глицерин может растворять неорганические соли, а так же используемый адсорбент не должен оказывать окисляющего действия на глицерин, а значит быть свободным от поверхностных кислородных соединений [6]. Порошковые АУ нашли широкое применение при очистке желатина и пектина [7]. Однако процесс очистки может быть затруднен ввиду высокой вязкости очищаемых продуктов. Кроме того процессы очистки могут быть многократными из-за высоких требований к продуктам пищевой промышленности и низкого расхода как угля, так и желатина и пектина [5]. Кофеин, получаемый экстрагированием кофейных зерен или чая с помощью хлористого метила, необходимо очищать от примесей перед использованием в фармацевтической промышленности или производстве безалкогольных напитков [8]. Для используемых с этой целью адсорбентов важным показателем является содержание ионов железа, поскольку кофеин может образовывать окрашенные комплексы с Fe3+. Ряд других органических веществ, получаемых методами биосинтеза, например антибиотики типа пенициллина, стрептомицина, неомицина и других, необходимо после завершения процесса синтеза также очищать с помощью активированного угля. 9 1.1.1.1 Использование активного угля для очистки воды Пористые углеродные материалы (сорбенты) человечество использует на протяжении многих столетий. Как уже отмечалось, еще в XVIII веке была открыта способность древесного угля очищать различные жидкости и поглощать некоторые газы. До начала XX века углеродные сорбенты (главным образом древесный и костный активные угли) применяли преимущественно в пищевой промышленности и виноделии для очистки жидкостей. В настоящее время основные направления использования углеродных сорбентов связаны с технологическими процессами адсорбционной очистки, разделения, выделения и концентрирования в газовых и жидких средах. Постоянно возрастает роль углеродных сорбентов в решении экологических проблем: очистки питьевой воды, стоков[9-12]. При очистке питьевой воды перед коагуляцией иногда используется порошкообразный активированный уголь для так называемого углевания [13]. Этот уголь не подлежит регенерации и в результате образуется большое количество шлама. На заключительной стадии питьевую воду также подвергают дополнительной сорбционной очистке. В данном случае используется гранулированные и зерненные формы АУ. Наряду с высокими требованиями к адсорбционным свойствам к ним предъявляются дополнительные требования к механической прочности. Углеродные сорбенты используют в различной форме: в виде порошка с размером частиц до 0,8 мм, гранул более крупного размера, блоков различной формы и величины, пленок, волокон тканей. В России для очистки воды наиболее распространены гранулированные сорбенты. Эффективную очистку природных вод от наиболее токсичных веществ обеспечивает гранулированный уголь типа АГ, имеющий товарную марку СКД-515, а также порошковый активный уголь типа ОУ марки СПДК-27Д [14]. Для очистки сточных вод используют разнообразные материалы естественного и искусственного происхождения, но чаше всего применяют активный уголь. Из древесных отходов образуются малозольные угли с хорошо развитой пористой структурой, определяемой структурой исходной древесины. Угли из опилок, лесосечных и других отходов древесины имеют сеть развитых транспортных каналов, делающих их перспективными для обесцвечивания жидких сред. Целесообразность их применения для очистки сточных вод промышленных предприятий будет определяться лишь экономическими соображениями. Известно, что сорбционная очистка сточных вод является наиболее эффектной из всех известных методов очистки, но не получает широкого распространения по причине отсутствия достаточно дешевых и унифицированных сорбентов. Кроме того, сорбционная очистка, также как и любая другая, как уже отмечалось, приводит к образованию большого количества шламов, 10 требующих специальной и обычно весьма сложной технологии переработки. [4, 5, 13, 15] Многочисленные публикации с начала 80-х гг. прошлого века [13, 16] и более современные 2000-х гг. [17] свидетельствуют о высокой эффективности очистки сточных вод, в том числе коммунально-бытовых, совмещающих процессы сорбции и биохимического окисления за счет одновременного использования активных углей и активного ила. Данный комбинированный метод получил широкое распространение и в настоящее время выделяется в самостоятельный технологический процесс, который носит название биосорбции. В этих процессах происходит окисление соединений, трудно – или неокисляемых в условиях обычной БХО. Очевидные преимущества данного процесса заключаются в отсутствии дорогостоящей термической регенерации поглотителей, что сокращает затраты на очистку до 50%, а также количество загрязняющих веществ, поглощенных активными углями, в 2-10 раз выше максимальной сорбционной емкости последних в статических условиях вне биологического процесса. Механизм биосорбции в настоящее время полностью не установлен. Наиболее вероятным полагают быстрое поглощение субстрата из раствора непосредственно клетками биопленки на поверхности фрагментов активного угля и последующее биохимическое окисление фиксированного субстрата. Вследствие этого биохимическое окисление любого органического сорбата увеличивает количество извлекаемых загрязняющих веществ из воды в 1,5-7 раз по сравнению с их же адсорбцией в отсутствие микроорганизмов [4, 5]. 1.1.1.2 Использование активированного угля для производства конденсаторов Электрохимические двойнослойные суперконденсаторы занимают промежуточную нишу между аккумуляторами, способными запасать высокую электрическую энергию, и диэлектрическими конденсаторами, способными отдавать высокую мощность в течение нескольких миллисекунд. Суперконденсаторы получили широкое применение в автомобилестроении (рекуперация торможения, облегченный запуск двигателя, электрическая стабилизация системы), промышленности (автопогрузчики, лифты), а также в бытовой электронике. Современные суперконденсаторы должны обладать высоким ресурсом службы – порядка 700 000 циклов, что соответствует от 5 до 20 лет работы в зависимости от степени нагрузки; малой себестоимостью при расчете на один цикл использования как энергии, так и мощности; возможностью работать в критических условиях (высокая амплитуда токов, перепады напряжения, экстремальные температурные условия); экологичностью. Наиболее полно этим требованиям удовлетворяют суперконденсаторы, которые в качестве основного электродного материала используют активированный уголь, а электролита – водный раствор. При этом для водных электролитов характерны низкие 11 удельные энергетические характеристики, приводящие к существенному увеличению массы устройств, в котором он применяется. Суперконденсаторы на неводных органических электролитах имеют более высокую удельную энергию, однако эти электролиты пожаро- и взрывоопасны, а также токсичны, что практически исключает их применение в системах общественного транспорта. [18] Первый конденсатор с двойным слоем на пористых угольных электродах был запатентован в 1957 году фирмой General Electric [19]. Так как точный механизм к тому моменту времени был не ясен, было предположено, что энергия запасается в порах на электродах, что и приводит к образованию «исключительно высокой способности накопления заряда». Чуть позже, в 1966 фирма Standard Oil of Ohio, Cleveland (SOHXO), USA запатентовала элемент, который сохранял энергию в двойном слое [20]. Первые ионисторы с малым внутренним сопротивлением для применения в мощных схемах были разработаны фирмой PRI в 1982 году. На рынке эти ионисторы появились под именем «PRI Ultracapacitor». В России производством электрохимических силовых конденсаторов занимаются компания ЭСМА, Елецкий завод «Энергия», ЗАО "Научно Производственное Объединение "ТехноКор", ИНКАР-М. Их продукция в основном идет на экспорт. Обычный конденсатор представляет собой обкладки из фольги, разделенные диэлектриком, а ионистор - это комбинация конденсатора с электрохимической батареей — электрохимический конденсатор. В нем применяются специальные материалы для обкладок и электролит. В качестве обкладок используются материалы одного из трех типов: обкладки большой площади на основе активированного угля, оксиды металлов и проводящие полимеры [21]. Использование высокопористых угольных материалов позволяет достичь плотности емкости порядка 10 Ф/см2 и больше. Ионисторы на базе активированного угля наиболее экономичны в изготовлении. Их еще называют двухслойными или DLC конденсаторами, потому что заряд сохраняется в двойном слое, образующемся на поверхности обкладки. [22] Принято считать, что в состав пористых углеродных материалов входят гетероатомы, как правило, кислорода и водорода, реже серы, азота и галогенов, которые происходят из исходного сырья и становятся частью структуры вследствие неполной карбонизации. Возникновение гетероатомов на поверхности углерода в виде поверхностных функциональных групп (ПФГ) может проявляться при выдерживании углеродных материалов на воздухе даже при комнатной температуре. Адсорбция кислорода (необратимая хемосорбция), начинающаяся уже при комнатной температуре, становится более заметной с повышением температуры. В зависимости от природы углеродного материала, условий и температуры его обработки на поверхности углерода 12 могут образовываться кислородсодержащие группы трех типов – кислотные, основные и нейтральные. Кислотные ПФГ формируются при нагревании углерода в атмосфере кислорода в интервале температур 200-700 оС или в реакциях окисления в жидкой среде. [20] К этому, наименее стабильному, типу ПФГ относятся карбоксильные, сложноэфирные и фенольные группы. Основные и нейтральные поверхностные группы являются более устойчивыми и образуются при комнатной температуре после того, как поверхность углерода очищена от ПФГ путем термической обработки. Функциональные группы электрохимически инертны в рабочем диапазоне напряжений и повышают смачиваемость углеродных электродов, повышая их удельную емкость, обеспечивая доступ электролита в поры, тем самым, развивая поверхность формирования ДЭС. Избыточный адсорбированный кислород или поверхностные комплексы в значительной степени влияют на скорость и механизм саморазрядки конденсатора. В частности, углеродные материалы с высокой концентрацией кислотных поверхностных групп склонны демонстрировать высокие скорости саморазрядки. Рост тока утечки предполагает, что кислородные группы выступают в роли активных центров, катализирующих электрохимическое окисление или восстановление углерода, или разложение компонентов электролита. Напротив, удаление кислородсодержащих групп высокотемпературной обработкой в инертной атмосфере приводит к снижению значений тока утечки. Наличие кислородных ПФГ также способствует нестабильной работе конденсатора, обусловленной ростом эквивалентного последовательного сопротивления и ухудшению емкости. Как правило, удаление ПФГ способствует повышению стабильности работы конденсаторов [23]. Как правило, емкость пористого углерода, выражаемая в Ф/г, пропорциональна его доступной удельной поверхности (м2/г). Время от времени это соотношение выполняется на практике и обычно приводится для упрощения. Основными факторами, приводящими к невыполнению этого соотношения, являются: допущения, принимаемые при измерении удельной поверхности электрода; колебания значений удельной поверхности углерода в зависимости от морфологии; вариации химии поверхности; изменение условий измерения емкости [21]. Удельная поверхность углеродных материалов и электродов на их основе обычно измеряется методом газовой адсорбции (как правило, азота при 77 К) и рассчитывается с использованием теории БЭТ для преобразования адсорбционных измерений в значения удельной поверхности. Несмотря на широкое распространение, это приближение имеет ряд ограничений по отношению к высокопористым и гетерогенным материалам, для которых лучше использовать полуколичественные подходы. Газовая адсорбция предполагает проникновение газа в большинство открытых пор, подходящих по размеру адсорбату, доступ электролита к поверхности во многом определяется структурой 13 углеродного материала и свойствами его поверхности. Проникновение электролита в поры малого диаметра, особенно в случае органических молекул, очень ограничено (ввиду эффекта ионных сит) и определяется природой используемого электролита. Разнообразие взаимодействий на границе раздела фаз электрод-электролит, обусловленное различными свойствами электролитов (вязкостью, диэлектрической проницаемостью, дипольным моментом), также оказывает влияние на смачиваемость, а, следовательно, и на способность электролита проникать в поры электрода. [24] Абсолютное большинство открытых пор вносит вклад в значение удельной поверхности, однако не все они доступны в электрохимических процессах. Поэтому размер пор оказывает влияние на толщину и протяженность ДЭС, и определяет подвижность электролита и его способность образовывать ДЭС. Поэтому удельная поверхность, образованная такими порами, не будет влиять на емкость ДЭС. [21] Исследования показали, что в водных растворителях микропоры с диаметром >0,5нм доступны для процессов электроадсорбции простых гидратированных ионов, а оптимальный размер пор для возникновения ДЭС на углеродном аэрогеле составляет 0,8-2,0 нм. Емкость электродных материалов в органических электролитах, как правило, ниже, чем в водных, что обусловлено большим средним диаметром сольватированных органических ионов. В то время, как ведутся дискуссии относительно оптимального размера доступных пор, бесспорным остается факт наиболее высоких значений емкости для микропористых углеродов, что говорит о том, что большая часть микропор все же доступна и органическим молекулам. Возможно, это объясняется десольватацией органического электролита, приводящей к уменьшению ионного размера электролита и форсирует его электросорбцию в поры меньшего диаметра. [25] Узкие микропоры доступны только при подходящем «сопротивлении раствора», возникающем ввиду затруднений или ограничений диффузии в узкие поры. Этот факт вносит существенный вклад в значение константы времени, а, следовательно, ведет к низким значениям емкостной скорости из-за задержки движения ионов в поры в процессах зарядки/разрядки. Поэтому узкие микропоры будут вносить лишь незначительный вклад в емкость накопления зарядов при высокоскоростном или непродолжительном силовом импульсе зарядки или разрядки. В электрохимических конденсаторах с электродами, выполненными из пористого углерода, неизбежно распределение сопротивления электролита за счет распространения глубоко в поры. Это сопротивление (R) связано с распределенной межфазной емкостью (C) элементов и приводит к неравномерному распределению эффективного сопротивления и емкости в электроде. В этом случае возникает цепь распределенных сопротивления и емкости, что ограничивает скорость зарядки и разрядки. Силовая емкость таких систем ограничена «эффектом проникновения». При низких скоростях зарядки или росте частоты, проникновение 14 электролита затруднено и доступна меньшая часть удельной поверхности. Увеличение размера пор приводит к снижению распределенного сопротивления электролита и его более глубокому проникновению в электрод, и, следовательно, увеличению емкости (рисунок 1.1). [23] Рисунок 1.1 - Влияние размера пор в зависимость емкости от частоты для углеродного электрода с заданным размером пор Очевидно, что распределение пор по размерам лежит в основе большинства фундаментальных критериев отбора углеродных материалов для электродов, а именно взаимосвязи между плотностями мощности и энергии, зависимости эксплутационных характеристик от частоты и т.д. Поэтому современные исследователи ориентированы на создание углеродных материалов с заданным размером пор, что из которых получатся электроды с высокими значениями емкости и низким сопротивлением. [2125] Научно-производственным предприятием "Эксин" было запатентован конденсатор [26] с двойным электрическим слоем, у которого один из электродов выполнен из углеродного материала, а другой - из материала, включающего в себя диоксид свинца. Описываемый конденсатор имеет улучшенные удельные характеристики и меньшую стоимость. Предложенный конденсатор с двойным электрическим слоем (ДЭС) обладает высокими удельно-энергетическими характеристиками, способен запасать и отдавать электрическую энергию с большой скоростью. Известны конденсаторы с двойным электрическим слоем, с жидким электролитом и электродами, выполненными из разнообразных материалов с большой удельной поверхностью [27-29]. Наилучшие результаты достигнуты при использовании в качестве материалов электродов различных активированных углей. Удельная емкость таких конденсаторов превышает 2Ф/см3, а использование апротонных электролитов позволяет увеличить рабочее напряжение до 2-3 В [30-31]. Наиболее близким по технической сущности и достигаемому эффекту является конденсатор с ДЭС, содержащий два электрода и жидкий электролит (водный раствор 15 гидроксида щелочного металла с концентрацией 3 - 7 моль/л), у которого поляризуемый (отрицательный) электрод выполнен из углеродного волокнистого материала, а неполяризуемый - оксидно-никелевый. Максимальное напряжение этого конденсатора составляет 1,4 В, удельные емкость и энергия соответственно 46 Ф/см3 и 45 Дж/см3 [32]. 1.1.2 Использование активных углей в газообразных средах Особую область применения АУ в газоочистке, имеющую лишь экологический аспект при затратной экономике представляет санитарная очистка газов (обычно в виде различных вентиляционных потоков). Эта область углеадсорбционных технологий включает процессы обессеривания газов (удаление SO2, SO3, H2S и других соединений серы), адсорбцию вредных и дурнопахнущих веществ, в том числе органических паров низкой концентрации, а также удаление радиоактивных газов. [4] Классический пример применения активированного угля в газовой среде связан с использованием его в противогазе. Разработанный Н. Д. Зелинским противогаз к 1916 году был принят на вооружение почти во всех европейских армиях. Довольно часто необходимо обеспечивать приток свежего воздуха в помещениях, в которых находятся люди или работают очень чувствительные технические приборы. Так. при наличии источников сильного загрязнения (аэропорты, рафинирующие и крупномасштабные предприятия химической промышленности) наряду с механическим удалением пыли или других грубодисперсных взвесей необходимо устанавливать адсорбционный фильтр для удаления паро- и газообразных примесей.[33] Во всех случаях применения, когда необходимо удалить незначительные концентрации сильнолетучих соединений, предпочитают активные угли с высокой удерживающей способностью, которая основана на возможно высокой доле микро- и субмикропор. Для адсорбционной очистки воздуха и отходящих газов используются преимущественно тонкопористые формованные угли с большой насыпной плотностью или зерненные активные угли из скорлупы кокосового ореха. Такое применение активированные угли нашли не только в рекуперации растворителей, но и обессеривании газов, очистке паров бензина, выделяемых автотранспортными средствами. Кроме органических примесей часто приходится удалять из воздуха агрессивные или токсичные вещества: диоксид серы, сероводород, хлористый водород, аммиак, меркаптаны, ртуть. Для этих целей в большинстве случаев применяют пропитанные (импрегнированные) АУ, так как эти газы не всегда можно удалить простой адсорбцией. Например, следы соляной кислоты или диоксида серы поглощаются щелочным импрегнированным углем, а амины, особенно алкиламин, аммиак – активированным углем, пропитанным серной кислотой [34]. 16 1.1.2.1 Рекуперационные АУ Активные угли находят широкое использование с различными целями в многочисленных химических производствах, одним из которых является производство искусственных волокон с использованием растворителей. Ежегодный дефицит активных углей для рекуперации растворителей составляет в России в настоящее время около 4000 т, в том числе 2000 т в производстве искусственных волокон и 2000 т в различных производствах химической, фармацевтической, пищевой и других отраслей промышленности. [5] Наиболее остро стоит проблема очистки отходящих газов от фтор- и хлорорганических соединений растворителей, а так же высококипящих соединений. Ввиду нерациональности использования каталитических приемов углеадсорбционная очистка является наиболее приемлемой. В целом активные угли, используемые для рекуперации растворителей должны обладать определенными характеристиками: высокая реализуемая активность (> 10 % масс.), зерна или крупные гранулы (2,5 – 5,0 мм) и достаточную прочность при истирании [33]. Известная номенклатура активных углей, выпускаемых промышленностью в нашей стране, не соответствует требуемым показателям адсорбционных и прочностных характеристик, которые необходимы для рекуперации широкого спектра органических соединений. Учитывая специфику поведения органических растворителей и их хлорпроизводных в пористой структуре активных углей на различных стадиях процесса рекуперации необходимо использовать уголь, который при развитой системе микропор должен обладать достаточным объемом мезопор. Рекуперационные процессы основаны на циклическом использовании активных углей. [5] Среди отечественных марок рекуперационного активного угля (РАУ), производимого в промышленных масштабах, требуемым параметрам удовлетворяет только РАУ марки АР-А, основой которого является каменноугольное сырье. Однако, из-за низкой прочности и незначительно развитой пористости, обусловленных реакционной способностью сырья, уголь данной марки не эффективен в отношении паров низкомолекулярных растворителей, концентрация которых высока в газовой фазе. Активные угли другого типа – АРТ – 1 (2) и СКТ – 3, которые получают на основе торфа, имеют большой объем микропор, но характеризуются их незначительными размерами и узким распределением пор по размерам. По этой причине они неэффективны для рекуперации средне – и высококипящих органических растворителей. В связи с этим использование их практикуется только в отношении паров сероуглерода и низкокипящих органических соединений, таких как этанол, метанол, ацетон. 17 Более эффективная рекуперация средне- и высококипящих органических растворителей и их хлорпроизводных обуславливает необходимость разработки технологии гранулированных активных углей на основе каменноугольного сырья, которое, в отличие от сырья растительного происхождения, за исключением кокосового угля, характеризуются развитым объемом микропор (до 0,4 – 0,5 см3/г). [36] Однако, реакционная способность каменных углей низка. В случае использования высокореакционного каменноугольного сырья развитие пористости в активном угле идет в направлении преимущественного образования мезо- и макропор при сравнительно слабом (до 0,2 см3/г) развитии микропор. [35] В связи с этим, более перспективным для технологии синтеза гранулированных рекуперационных активных углей является метод шихтования. Использование шихты из различных по свойствам углеродсодержащих материалов позволяет управлять скоростью процесса активации и пористой структурой активных углей. Впервые этот метод был использован В.М.Мухиным для разработки технологии рекуперационных активных углей. В настоящее время данный метод используется в производстве гранулированных активных углей, служащих основой катализаторов средств защиты органов дыхания. [5] Рекуперация летучих органических растворителей имеет как экономическое, так и экологическое значение, так как их потери с отходящими в атмосферу газами весьма значительны. 1.1.2.2 Использование активных углей для очистки воздуха В то время как обычно используемые для рекуперации растворителей аппараты являются типовыми конструкциями, обеспечивающими примерно одинаковые показатели эффективности газоочистки, устройства, используемые для очистки воздуха и газов без рекуперации поглощенных веществ весьма различны. В зависимости от объема воздуха и вида примеси обычно применяют цилиндрические фильтры со сплошной или развернутой шихтой, а также фильтры различных форм кассетного исполнения [4]. Диоксид серы по масштабу выброса превосходит все другие токсичные газообразные вещества, загрязняющие атмосферу. Он образуется при сгорании серы, сульфида водорода, а также при нагревании различных сульфиов в токе воздуха или кислорода. Сера, содержащаяся в топливе и рудах, при их сжигании или окислительном обжиге превращается в агрессивный газ. Предварительная сероочистка топлива (например, многосерннстого угля) и руд не может в полной мере обеспечить ликвидацию выбросов диоксида серы в атмосферу. Основным источником загрязнения атмосферы диоксидом серы являются теплоэлектростанции. Концентрация SO2 в дымовых газах теплоэлектростанций зависит в основном от содержания серы в топливе. 18 Так, при сжигании мазута с массовым содержанием серы 3-3,5 % концентрация диоксида серы в дымовых газах составляет 0,4-0,45 об. % [35]. Загрязняя атмосферу, диоксид серы наносит вред окружающей среде (человеку, животному и растительному миру). Улавливание диоксида серы необходимо не только с санитарно-гигиенической точки зрения, но и по технико-экономическим соображениям. Именно с диоксидом серы связана проблема «кислых» дождей, когда, поднимаясь в верхние слои атмосферы, он соединяется с влагой, образуя сернистую кислоту. Содержащие ей «кислые» осадки уничтожают леса и растительный покров. Такие явления имеют место, например, в Канаде и Скандинавии в результате работы американских ТЭЦ в Чикаго и британских угольных ТЭЦ. Отечественная химическая промышленность, хотя и занимает среди других отраслей по общему выбросу сернистого ангидрида лишь шестое место (после теплоэнергетики, автотранспорта, цветной и черной металлургии, нефтеперерабатывающей индустрии), в районе местоположения сернокислотных заводов интенсивно загрязняет атмосферу. В отходящих газах сернокислотных производств содержится 0,2-0,3 % SO2, а также SO3и аэрозоли H2SO4. [36] Для обезвреживания газов, содержащих диоксид серы, предложено большое число методов, но ни один из них не может быть признан идеальным. Углеродные материалы являются достаточно эффективными средствами выделения из газов диоксида серы как с рекуперационной так и с санитарной целями, причем их потенциальные возможности в этом направлении выявлены далеко не полностью. Для улавливания диоксида серы в основном применяют углеродные пористые вещества. Емкость активных утлей по SO2 обычно составляет 4-7 г/100 г угля. [4] Если улавливание производить из потока газа, не содержащего кислорода, поглощение диоксида серы активным углем происходит по законам физической адсорбции, и при десорбции активность адсорбента полностью восстанавливается. Вне зависимости от концентрации диоксида серы в обрабатываемом газе, в адсорбированной фазе содержится около 50 мас. % серной кислоты, образующейся в результате окисления диоксида серы до триоксида и взаимодействии его с водой. Остальная часть приходится на продукты окисления и гидролиза кислоты. Это соотношение изменяется только в зависимости от температуры и влажности среды [2]. Скорость экстракции серной кислоты зависит от структуры активных углей. Чрезмерное развитие микропористости угля вызывает необходимость увеличения периода экстракции и расхода промывной воды. Поэтому иногда понижают микропористость углей, применяемых для извлечении диоксида серы, путем их дополнительной активации при температурах свыше 700 оС. Для промышленных установок адсорбционного извлечения диоксида серы в неподвижном слое адсорбента 19 рационально использовать механически прочные активные угли в виде крупных гранул, слой которых имеет небольшое гидравлическое сопротивление. [37] Также часто для поглощения сернистых соединений используют импрегнированные активные угли, пропитанные щелочью, а амины и аммиак адсорбируют активным углем, импрегнированным серной кислотой. В условиях очень низких температур и парциальных давлений сероводорода для его удаления применяют активные угли, пропитанные йодом. при адсорбции свободных от кислорода газов для импрегнирования используют перманганат калия, который при нанесении восстанавливается до диоксида марганца. Во всех случаях очистки газов с помощью импрегнированных активных углей необходимо учитывать, что химические реакции с помощью импрегнирования требуют значительно большего времени контакта по сравнению с другими реализуемыми на практике чисто адсорбционными процессами. Очистка больших объемов отходящих газов, содержащих органические примеси в значительных (но недостаточно высоких для реализации процессов термического или каталитического дожигания) концентрациях, обычно сопряжена с укороченным сроком службы угольных фильтров и обычно обуславливает необходимость достаточно частой регенерации находящихся в них адсорбентов. Решение таких задач реализовано в технологии «Адокс» (ФРГ), когда отходящий воздух пропускают через слой активного угля длиной 50 см в вертикальных или кольцевых адсорберах. Когда за фильтром достигается проскоковая концентрация, проводят регенерацию шихты нагретым до 250600 оС инертным газом [5]. Существующие на данный момент представления о возможности извлечения оксидов азота (NOx) из газов активными углами различны. Монооксид азота (NO), образующийся в основном при высоких температурах (например, в топках паровых котлов и двигателях внутреннего сгорания) очень плохо адсорбируется даже при его высоких парциальных давлениях [4]. Повышенное содержание водяного пара и температура более 55 оС еще более снижают эту адсорбируемость. При высоких температурах (выше 150 °С) наблюдается повышение теплоты адсорбции, что свидетельствует о реакции восстановление азота. В присутствии воздуха при температурах меньше 650 °С монооксид азота превращается в диоксид NO2 и/или в его димер N2О4.[5] Из-за большого периода полупревращения этих реакций NO ещё длительное время существует вместе с термодинамически устойчивым NO2 (особенно в следовых концентрациях при низких температурах. На активном угле диоксид азота адсорбируется лучше, чем монооксил, хотя полного разделения этой смеси достичь невозможно. В свободных от кислорода газах, содержащих NO2, в потоке за слоем активною угля можно обнаружить NO, образующийся вследствие восстановления NO 2 20 углеродом. Повторное окисление NO до NO2 возможно только в кислородсодержащих газах. [37] Особым классом широко распространенных химических поглотителей являются купрамиты - активные угли различных марок, пропитанные CuSO4 и поглощающие широкий спектр дурнопахнущих веществ, включающий таковые, выделяемые человеком, и сильно действующие ядовитые вещества. Такие поглотители применяют для защиты атмосферы в бомбоубежищах, подводных лодках, кораблях и других замкнутых пространствах. Одним из наиболее важных и окончательно не решенных вопросов защиты окружающей среды от загрязнений является обезвреживание быстро увеличивающеюся выброса в атмосферу с отходящими газами различных соединений ртути. Данная проблема наряду с экологическим имеет экономический аспект, обусловленный безвозвратными потерями ртути. [35] Для содержания ртути в отходящих промышленных газах характерны самые широкие пределы. Изменение ей концентрации фиксировано не только на разных однотипных предприятиях, по и на одном и том же агрегате (например, металлургическом). Это связано с условиями реализации обжига, пылеулавливания и других процессов. Общие потери ртути с технологическими и вентиляционными газами составляют примерно 40 г на каждую тонну добытой руды. [5] Обезвреживание и очистка технологических и вентиляционных газов, содержащих ртуть, уже давно являются предметом многочисленных исследований. Именно поэтому с помощью активных углей успешно решают задачи улавливания ртутьсодержащих органических соединений. Адсорбционный метод с успехом используют для очистки отходящих дымовых газов производств винилхлорида, хлора и каустической соды. [2] Например, в производстве винилхлорида ртутьсодержащие отходящие газы образуются на стадии приготовления катализатора гидрохлорирования ацетилена. Их основу составляют загрязненные смеси воздуха и азота. Концентрация ртути в поступающем на адсорбцию газе в течение девятимесячной эксплуатации установки колебалась в пределах 0,5-9,8 мг/м3, составляя в среднем 1,8 мг/м3. На выходе из адсорбера она составляла 0,001-0,003 мг/м3, что находится в пределах санитарных требований. Степень очистки при этом составляла 99,8 %. [5] Также для улавливания паров ртути также находят широкое применение активные угли, импрегнированные водными растворами минеральных кислот. 1.2 Основные сырьевые источники получения активных углей Известно, что первичным сырьем для синтеза активированного угля служил древесный уголь, затем каменный. В настоящее время активные угли получают из различного углеродсодержащего сырья: древесина и целлюлоза [38, 39], торф [40], бурый и каменный уголь [41], жидкие и газообразные углеводороды [42], синтетические 21 полимеры [43], растительные отходы [44], прочее сырье (сажа, асфальт, битум, автомобильные покрышки, отходы производства синтетических полимеров, осадки сточных вод). поливинилхлорида и других 1.2.1 Синтез углеродных адсорбентов из нетрадиционного сырья В настоящее время использование новейших научно-технических достижений в целях реализации малоотходных и безотходных технологий относится к основным принципам государственной политики в области обращения с отходами. Объем сброса загрязненных сточных вод составил по отрасли ЖКХ более 13 млрд. т в год [45]. Кроме того, весомое значение имеют стоки промышленных предприятий. Например, на предприятиях целлюлозно-бумажной промышленности ежегодно образуется значительное количество органических, минеральных и органо-минеральных отходов, среди которых осадки сточных вод являются наиболее трудно утилизируемыми [46]. В связи с этим в большую проблему в настоящее время вылились вопросы утилизации осадков сточных вод, так как с повышением требований к охране водоемов количество задерживаемых осадков на очистных станциях значительно увеличилось. Из образующихся ежегодно около 80 млн. м3 осадков утилизируется не более 3%, остальные осадки складируются на иловых площадках. Причиной такого положения является несоответствие между существующими мощностями по очистке городских сточных вод и обработке осадков [45]. Проблема утилизации осадков, образующихся при очистке производственных и бытовых сточных вод, приобретает особое значение, так как она связана не только с решением природоохранных задач, но и способствует экономическому развитию регионов вследствие восполнения сырьевых и материальных ресурсов [46]. Обсемененность патогенными микроорганизмами, содержание вредных, сорбированных в процессе биологической очистки сточных вод, хлор- серо- и других органических веществ не позволяет использовать осадки, содержащие активный ил, без специальной обработки. Основное направление утилизации осадков в отрасли в настоящее время - сжигание, приводящее к полной их стерилизации и возможности складирования без опасения нанести вред окружающей среде [47]. В результате пиролиза в температурном интервале 900...920°С осадков сточных вод целлюлозно-бумажных предприятий, кондиционированных на стадии механического обезвоживания хлорным железом и известью, получаются эффективные адсорбенты для очистки сточных вод от органических загрязнений. Дополнительная парогазовая активация при этом не требуется. Гидроксиды железа, образующиеся при кондиционировании осадков хлорным железом и известью, определяют формирование пористой структуры пиролизованных осадков сточных вод (ПОСВ). Известь, не вступившая в реакцию с FeCl3, не влияет на формирование ПОСВ как сорбента, но участвует в процессе очистки воды вследствие коагуляции лигноподобных соединений 22 и осаждения образовавшихся гелей на внешней поверхности и в макропорах ПОСВ. Использование хлорированного купороса вместо хлорида железа (III) при кондиционировании осадков приводит к значительному увеличению адсорбционных свойств ПОСВ как в отношении общепризнанных сорбатов, так и при очистке сточных вод по показателям XПK и БПК. Так же синтезированные в присутствии гидроксидов железа адсорбенты из осадков обладают ферромагнитными свойствами. Это позволяет осуществлять их отделение от обрабатываемых сред при очистке сточных вод методами магнитной сепарации [46, 48]. Несмотря на все достоинства данных адсорбентов от предложенной технологии в настоящее время отказываются ввиду высокой токсичности веществ для кондиционирования. Ввиду развития нефтеперерабатывающей промышленности так же актуальна разработка ресурсосберегающих и экологически безопасных технологий утилизации нефтесодержащих отходов (НСО) [49, 50], которые образуются при добыче и транспортировке нефти, а также в процессе их переработки. В настоящее время основным способом утилизации НСО является их складирование в шламонакопителях, амбарах и прудах - отстойниках, что приводит к длительному и чаще безвозвратному отчуждению значительных земельных ресурсов, сопровождается экологическими рисками загрязнения атмосферы, поверхностных водоемов и подземных вод. На предприятии формируются следующие виды твердых НСО: − кек, образующийся в системе фазоразделения жидких нефтеотходов; − осадок после центрифугирования флото- и нефтешламов; − донные отложения резервуаров хранения нефти; − избыточный активный ил (ИАИ) биохимических очистных сооружений. Установлено, что образцы НСО и ИАИ подвергаются деструкции в одном температурном диапазоне 500–550°С, что позволяет утилизировать их совместно. В связи с высокой влажностью образцов ИАИ для снижения энергоемкости термической обработки доля ИАИ в перерабатываемых отходах не должна превышать 10 %. Основными продуктами пиролиза являются пиролизат – органоминеральная композиция – крупнодисперсный материал черного цвета (основная фракция – 20 мм), содержащий пироуглерод и пиролизные газы, часть которых способна конденсироваться. В результате пиролиза образца была получена органоминеральная композиция (ОМК), составляющая 8–9 % от массы перерабатываемого образца. Полученный ОМК обладает значительным содержанием пироуглерода, а также наличие пор позволяет предложить использование их в качестве адсорбентов. Высокая гидрофобность материала позволяет использовать его для извлечения нефти и нефтепродуктов из воды и поглощения нефти, разлитой на твердых поверхностях. [49] Кроме того, одной из 23 областей применения сорбентов на основе природных газов и газов нефтепереработки, а также нефтяных и каменноугольных смол, является гемосорбция и энтеросорбция [51]. Рост количества и интенсивности эксплуатации транспорта на пневмоколесном ходу, как в быту, так и в промышленности, привел к появлению большого количества отработанных шин. Указанные отходы специфичны, так как не поддаются гниению, саморазрушению, аккумулируются, занимая земельные площади, загрязняя населенные пункты, водоемы, лесонасаждения. В то же время изношенные шины сохраняют достаточный уровень технологических свойств для повторной переработки и могут рассматриваться как вторичное сырье для получения ценных продуктов. Один из способов получения сорбента включает пиролиз изношенных шин с получением углеродного остатка, активацию углеродного остатка водяным паром, подаваемым в пиролизную камеру снизу, охлаждение углеродного остатка от температуры 450-500°С до 150-200°С, дополнительную активацию за счет периодической подачи сверху в пиролизную камеру воды в несколько ступеней при суммарном количестве охлаждающей воды на всех ступенях охлаждения, не превышающем 0,5 л на 1 кг углеродного остатка [52, 54]. Была предложена технологии переработки изношенных автомобильных шин методом «сухого» бескислородного пиролиза предварительно измельченного резинового отхода до фракции 1 – 3 мм с образованием многокомпонентной парогазовой смеси и твердого остатка [53]. Выход продуктов пиролиза в среднем составлял: - газ – 7,6 – 8,0%; смола + вода – 60,0 – 61,0 %; твердый остаток – 31,0 – 32,6%. Для полученного твердого остатка определены следующие параметры: - удельная поверхность – 49,0 м2/г; - адсорбционная способность по метиленовом голубому – 58,9 мг/г; - содержание серы – 2,1 %. Твердый остаток может быть использован в качестве исходного материала для получения активированного угля, пироуглерода [54]. Использование твердого остатка пиролиза автомобильных шин для синтеза сорбентов целесообразно с экономической точки зрения, поскольку в настоящее время активные угли стоят очень дорого, а данное сырьё может заменить уже известные сорбенты и сделать сорбционную очистку более доступной [53]. В последние годы широкое распространение получили активные угли на основе полимерных материалов, например со сферическими частицами, углеродные волокна и ткани [55]. Помимо большого объема древесных отходов деревообрабатывающие и мебельные предприятия являются источником поступления различных органических соединений (формальдегид, фенол, бутилацетат, ацетон, уксусная кислота и др.) в 24 промышленные стоки. При производстве ДВП, ДСП и фанеры образуются сточные воды, тяжелая эмульсионная фракции которых содержит до 40% карбамидоформальдегидной смолы, которая не утилизируется и служит источником загрязнения окружающей среды [56]. Углеродные адсорбенты на ее основе были получены Л.А. Новиковой и сотрудниками [57]. Также О.Н. Новиковым были получены и исследованы адсорбенты на основе дивинилбензола [58]; на основе винилпиридиновой смолы – В.В. Стрелко и Николаевым В.Г. [59]; на основе фенолформальдегидной смолы – в ЛТИ им. Ленсовета [60]. 1.2.2 Синтез углеродных адсорбентов из отходов растительного происхождения При заготовке древесины только в лесу остается до 25% биомассы. При дальнейшей переработке круглого леса также неизбежно образуются отходы в виде опилок, стружки, срезок, горбылей. Следовательно, при переработке такого ценнейшего природного сырья как древесина, половина от ее объема используется неквалифицированно. Одним из самых распространенных направлений переработки древесных отходов является их использование в качестве топлива (сжигание) с целью получения тепловой энергии. Однако, как правило, древесные отходы в виде опилок, мелкой щепы, стружки и коры неудобны для транспортировки, складирования и хранения. Высокая влажность древесных отходов не позволяет эффективно использовать их в качестве топлива без дополнительной подготовки. Таким образом, осуществление пиролиза является более рациональным способом их переработки. Теоретические основы пиролиза растительной биомассы предполагают, что любые материалы, содержащие в качестве основных компонентов полимерные углеводы и лигнин, могут быть подвергнуты пирогенетической переработке с получением древесного угля и ценных низкомолекулярных веществ [61]. Таким образом, для пиролиза может использоваться различное недревесное сырье (солома различных злаков, бамбук, багасса сахарного тростника, кукурузная кочерыжка, стебли хлопчатника, риса и гречихи, хлопковая, рисовая и гречишная шелуха, подсолнечная лузга и т.п.), т.е. все то, что не находит пока применения в промышленности и составляет основную массу отходов, ежегодно направляемых в отвал [61]. Образующиеся в процессе механической и химической переработки древесины такие малоценные продукты, как технические лигнины, осадки сточных вод, кора и опилки также могут быть переработаны методами пиролиза с получением углеродных адсорбентов [62]. В соответствии с принятой технологией одностадийного получения активных углей из различных видов углеродсодержащего сырья: смешанной лиственной древесины, отходов лесопереработки (щепа, кора) и лесопиления (древесный опил) без разделения по видам древесины возможно осуществления пиролиза и активации в 25 аппаратах кипящего слоя [63-65]. Также предложено осуществление процесса в режиме фонтанирования слоя. Из некондиционной древесины и древесных отходов были получены активные угли, не уступающие по основным нормируемым показателям древесным углям типа БАУ и БАУ-МФ. В связи с лесозаготовками актуальна пирогенетическая переработка вершинной части деревьев, крупных сучьев, ветвей, коры, корневищ сосны, ели, лиственницы, пихты, березы [66, 67]. В работе [68] изучено влияние условий и характера сырья на характеристики получаемых углей. Для получения активного угля описан способ, включающий пиролиз частиц древесины в неподвижном слое в бескилородной среде и активацию в движущемся слое водяным паром [69]. Пиролиз ведут при одновременном воздействии электропотенциала напряжением 15-53В, а активацию – при одновременном воздействии электропотенциала напряжением 12-50 В. С целью получения активного угля при пиролизе древесины эффективно используется фосфорная кислота [70], которая также входит в состав активирующего агента при получении гранулированного плотного угля из лигноцеллюлозных материалов [71, 72, 3]. Щепу, образующуюся в процессе эксплуатации рубильных машин, и отход канифольно-экстракционных производств – пневый осмол исследовали в качестве сырья сначала в лабораторных условиях, затем на опытно-промышленной установке [73]. На основании этих испытаний и отработки технологии было показано, что полученные древесные угли по своим физико-химическим показателям и адсорбционным свойствам превосходят промышленные марки углей, производимых по традиционной технологии. Характеристики активных углей позволяют их использовать в медицинской и фармацевтической промышленностях, для очистки медицинских препаратов, технологических растворов и в других областях [68]. Нетрадиционным сырьем, не нашедшим пока широкого применения в промышленности, для получения дешевых карбонизованных образцов могут быть косточки различных плодовых деревьев, скорлупа грецких орехов, которые являются вторичными отходами пищевого производства [74, 75]. В работе [76] предложен синтез активных углей из скорлупы грецкого ореха при доступе воздуха. Отмечается, что полученный адсорбент сохранил плотную, трубчатую структуру исходного материала, и вместе с тем обладает высокоразвитой поверхностью, что делает его перспективным для использования в различных областях промышленности, биологии и медицины. Индийскими исследователями в лабораторных условиях был получен активный уголь из скорлупы кокосового ореха при температурах 300, 350 и 400 оС методом парогазовой активации и в среде азота [77]. Полученные адсорбенты проявили высокую сорбционную активность для малеиновой и щавелевой кислот. 26 В Республике Казахстан из шрота косточек винограда, который образуется после выделения масла и экстракта сухого был получен сорбент, который является продуктом третьего этапа комплексной переработки косточек винограда местного сорта «Кабарне», произрастающего в Южно-Казахстанской области. Сорбент получали методом активации. Активизирующими агентами в большинстве случаев служат углекислый газ или водяной пар. Активацию проводили при температуре 573, 673, 773, 873, 973, 1073 К с выдержкой при каждой температуре в течении 1 часа [78]. Наибольший объем пор Vc отмечается для образца, полученного при температуре 573 К – 11·10-4 м3/кг, а начиная с 773 К начинает снижаться, что делает дальнейшее повышение температуры синтеза не целесообразным. При переработки кедрового ореха на ядра или высококачественное кедровое масло в качестве отхода образуется скорлупа кедрового ореха, составляющая в среднем 51–59% от веса самого ореха [79], которую необходимо утилизировать желательно с получением ценных и полезных продуктов. Одним из таких продуктов может быть активированный уголь из скорлупы кедровых орехов, который с успехом можно применять для очистки сточных вод, воздушного бассейна и питьевой воды [80-82]. Следует отметить, что основным компонентом скорлупы кедровых орехов является лигнин, содержание которого составляет 52,8%, что более чем в 2 раза превышает его содержание в древесине кедра. Вместе с тем содержание гемицеллюлоз в скорлупе примерно в два раза меньше, чем в древесине кедра, а содержание целлюлозы отличается незначительно. Эти различия могут сказываться на закономерностях образования древесного угля из древесины и из скорлупы кедровых орехов. Был изучен процесс пиролиза скорлупы кедровых орехов в атмосфере инертного газа в интервале температур 200-500 °С с образованием древесного угля. [83]. Установлено, что выход древесного угля из скорлупы кедровых орехов заметно выше, чем из древесины хвойных пород и составляет при 500 °С 34,6 вес. %. Эта величина заметно превышает выход угля из древесины березы и сосны – 24,.9 и 27,8% соответственно [84], что может быть обусловлено более высоким содержанием термостабильного компонента скорлупы – лигнина. Исследование физико-химических характеристик получаемого древесного угля, такие как плотность (истинная и кажущаяся), пористость и объем пор при различных температурах пиролиза показало, что при этой же температуре наблюдается максимальная пористость и был получен адсорбент с наибольшим объемом пор, но с самой высокой зольностью. В результате получили активный уголь с осветляющей способностью по метиленовому голубому около 200 мг/г, что ниже требования ГОСТ 4453-74 и свидетельствует о слабо развитой мезопористой структуре углей; сорбционная активность по йоду превысила показатели ГОСТ 6217-74 и составила 8799%, что свидетельствует о хорошо развитой микропористой структуре [82]. При 27 пиролизе скорлупы кедровых орехов получаются зернёные активные угли, отличающиеся отсутствием вредных примесей (при парогазовой активации), высокой механической прочностью и очень тонкими порами, что делает их идеальными для медицинских, пищевых и других целей. [85] Осуществлена оптимизация процесса производства гранулированного активированного угля (ГАУ) из скорлупы орехов [86]. Для опытов использованы скорлупа орехов: миндаля, пекана, макадамии. Общее количество скорлупы, образующейся при использовании орехов в США 270 тыс. т/г. Состав скорлупы, %: целлюлоза 25,8-51,9; лигнин 16,8-47,6; гемицеллюлоза 8,7-17,9; влага 3,8-10,4; зольность 0,2-3,1. Активация скорлупы проведена H3PO4 за 0,5-1 час при температуре 170°С в атмосфере N2 и воздуха. Окисление ГАУ выполнено за 4 часа при температуре 300°С. Выход ГАУ 36-40%. ГАУ обладает развитой уд. ПВ 852-1070 м2/г. Поглощение ионов Cu 0,26-0,29 ммоль/г. Один из перспективных углеродсодержащих материалов для производства активных углей – целлолигнин, образующийся в качестве отхода при получении фурфурола по бескислотному способу гидролиза древесины. Целлолигнин – полидисперсная рыхлая масса коричневого цвета с характерным запахом фурфурола, состоящая из смеси целлюлозы (40 – 45 %), органических кислот (до 4 %), смолистых веществ (5 – 10 %) и зольных элементов (0,5 – 2 %) [87]. Из-за рыхлости структуры целлолигнина при грануляции влажной массы не получаются плотные и прочные сырые гранулы, поэтому для формования целлолигнина применяется брикетирование [35]. Предложен способ получения активного угля, включающий модифицирование целлолигнина или лигнина ортофосфорной кислотой в количестве 0,8-2% мас., брикетирование, карбонизацию в две стадии при температуре 400-450°С и 750-800°С со скоростью нагревания на первой стадии 10-15°С/мин и на второй стадии 1-5°С/мин, активирование при температуре 850-900°С смесью водяного пара и углекислого газа. Предложенный способ позволяет получить активные угли с высокими адсорбционными свойствами по плохо сорбирующимся органическим веществам с низкой молекулярной массой, например хлористый этил, ацетон, сероуглерод [88]. Процессы модифицирования и брикетирования целлолигнина освоены на Шумерлинском химическом заводе. Ввиду того, что вращающиеся печи карбонизации, используемые в производстве активных углей типа АГ, не приспособлены для карбонизации брикетов, процесс карбонизации осуществлялся на Сявском лесохимическом заводе в горизонтальной тоннельной печи. Активные угли типа АЦБ, полученные на основе модифицированного целлолигнина, благодаря высокоразвитому объему микропор имеют лучше адсорбционные свойства по сравнению с аналогами – углями АГ-3, АР и УАФ [89]. 28 Создание промышленных технологий получения высококачественных активных углей на основе гидролизного целлолигнина одновременно обуславливает возможность эффективного использования многотоннажных отходов гидролизных производств, следовательно, позволяет решить экологические проблемы в районах размещения предприятий [35]. 1.2.3 Синтез адсорбентов из технических лигнинов В связи с тем, что лигнин является многотоннажным отходом предприятий химической переработки древесины (20 – 30 % от веса древесины), большое внимание уделяется переработке его в древесный уголь. В обзоре [90] дан анализ процессов пиролиза технических лигнинов с целью получения адсорбентов с регенерацией химикатов. Установлено, что обработка различных лигнинов сульфатом железа в определенных условиях позволяет получать адсорбенты с разноплановыми свойствами [91]. Наряду с пористой структурой адсорбенты могут обладать магнитной восприимчивостью, что делает их подобными магнетиту. Полученные ферромагнитные адсорбенты могут быть использованы для очистки сточных вод от фенолов, ПАВ и других загрязнений. Рассматриваемые адсорбенты легко отделяются от обрабатываемой среды методами магнитной сепарации. Ферромагнитные адсорбенты были также получены пиролизом отходов переработки древесины в присутствии гидроксида железа (III) [92]. Полученные образцы ферромагнитных адсорбентов снижают загрязненность сточных вод по ХПК и БПК5 на уровне промышленно выпускаемых сорбентов ОУ-А и имеют следующие показатели: сорбция метиленового голубого – до 360 мг/г, йода – до 120%; магнитная восприимчивость при напряженности магнитного поля 4000 Гс - до 38 – А⋅м2/кг; объем адсорбирующих пор по данным низкотемпературной адсорбции азота – 0,58 см3/г. Первый цех по получению активных углей из гидролизного лигнина был создан на Бирюсинском гидролизном заводе [93]. Принятая на заводе технология основана на получении активных углей из гранул, получаемых влажным формованием. Процесс не лишен недостатков, среди которых следует отметить низкую прочность и большую истираемость лигниновых гранул и др. [68]. Поэтому реализованная технология с парогазовой активацией полученного угля-сырца не может удовлетворять требованиям оптимальности как по качеству получаемого АУ, так и по принятым технологическим решениям переработки с высоким содержанием летучих веществ [90]. Позднее Симкиным и Петровым был предложен улучшенный вариант этой технологии [94]. Для переработки формованного лигнина (гранулы и брикеты) предложены щелевые аппараты, позволяющие проводить пиролиз и активацию материалов древесного происхождения с размерами кусков 10-100 мм в вертикальном слое. Конденсация 29 реторты обеспечивает совместное проведение процессов пиролиза кускового углеродсодержащего сырья и активации образующегося из него угля. При использовании в качестве сырья гидролизных лигнинов хвойных пород деревьев совмещенным способом можно получать активные угли высокого качества: адсорбционная активность по йоду – 61 %, по метиленовому голубому – 289,2 %, по мелассе – 121,4 %, суммарная пористость – 1,35 см3/г (для гранул лигнина ОГМ–1,5) [68], которые удовлетворяют требованиям действующих стандартов. В работе Петрова показан синтез и применение окисленных активных углей из технических лигнинов [95]. Влияние условий получения данных адсорбентов было оценено путем сравнения величины удельной поверхности. Показано, что адсорбция паров органических веществ на окисленных активных лигнинных углях сопровождается хемосорбционным эффектом. Ранее было описано получение активированного угля из лигнина карбонизацией крафт-лигнина при 352 oC в среде азота в течение 2 ч, затем графитизацией при 1100 oC в атмосфере аргона при скорости нагрева 50 oC/мин и при выдержке при 1100 oC в течение 1часа [96]. Запатентован способ получения из гидролизного лигнина углей различного назначения, который позволяет увеличить выход угля на стадии пиролиза и уменьшить его зольность [97]. Способ включает мокрый помол лигнина, отжим лигниновой пульпы с последующим пиролизом подсушенного лигнина, причем мокрый помол лигнина ведут в фурфуролсодержащем водном растворе пентозных и гексозных сахаров, который образуется одновременно с используемым для производства угля лигнином при перколяционном гидролизе растительного сырья разбавленной 0,3 - 1,0 %-ной серной кислотой. Данный способ позволяет повысить выход угля на 8 - 12,5%, а также снизить зольность угля на 5 - 9% [97] Следует отметить, что при изучении продуктов пиролиза гидролизного лигнина при 400-500 оC [98] методами термографии и хромато-масспектрометрии было обнаружено, что в отходящих жидких продуктах отсутствуют высокотоксичные канцерогенные вещества. Весьма специфическим отходом предприятий ЦБП является шлам-лигнин, выделенный из сточных вод в процессе коагуляции высокомолекулярных соединений (ВМС) и коллоидов сернокислым алюминием (Байкальский ЦБК и Селенгинский ЦКК). Несмотря на ограниченные ресурсы данного технического лигнина в настоящее время, можно прогнозировать, что повышение требований к качеству очищенных стоков приведет к накоплнению подобных техногенных отходов и на других предприятиях ЦБП. Основным направление утилизации шлам-лигнина является термическое сжигание, альтернатива ему – пиролиз с получение сорбентов-коагулянтов для чистки жидких выбросов [90]. 30 Одним из направлений совершенствования технологии получения активированных углей является совмещение термохимического процесса пиролиза и активирования водяным паром. В работе [99] приведены результаты экспериментального исследования, характеризующие влияние условий совмещенного термохимического процесса пиролиза и активирования водяным паром технических лигносульфонатов (ЛСТ) на формирование пористой и тонкой структуры активных углей на натриевом основании. Установлены основные закономерности процесса, которые заключаются в том, что первичная пористая структура активных углей формируется на стадии карбонизации лигносульфоната, тогда как парогазовая обработка необходима для раскрытия сформировавшихся пор, что обеспечивает доступ к ним молекул – адсорбтивов. В процессе пиролиза-активации лигносульфонатов формируется развитая щелевидная пористая структура угля, включающая микропоры полушириной 0,50-0,64 нм. Соединения натрия, образующиеся при восстановлении сульфита натрия, могут участвовать в термохимических процессах образования микропор. 1.3 Методы парогазовой активации в синтезе активных углей При производстве активного угля вначале исходный материал подвергают термической обработке без доступа воздуха, в результате которой из него удаляются летучие (влага и частично смолы). Карбонизованные материалы отличаются пониженным содержанием кислорода и водорода [3]. Структура образовавшегося угля – сырца – крупнопористая; и он не может непосредственно быть использован как промышленный адсорбент. Задача получения ажурной микропористой структуры решается в процессе активации. Активация производится двумя основными методами: окислением газом либо паром или обработкой химическими реагентами [15]. Реализуемые в производственной практике технологии активных углей базируются в основном на использовании методов парогазовой и химической активации разнообразных углеродсодержащих материалов [5]. Уникальное преимущество физической активации является сохранение оригинальной микроструктуры сырья в конечном активированном угле, что не возможно в химическом процессе активации. Еще одна важная отличительная черта между физическими и химическими методами активации в том, что процесс физической активации состоит из активации поверхности, где эрозия поверхности преобладает над реакцией формирования пор [41]. Основным методом получения активных углей в настоящее время является парогазовая активация перерабатываемого сырья. Этот метод технологически наиболее прост, экологически безопасен и позволяет использовать весьма широкую гамму углеродсодержащего сырья – от древесных опилок до антрацитов (и даже алмазов) [5]. 31 Существующая технология производства углеродных адсорбентов с использованием методов парогазовой активации природного или специально синтезируемого сырья включает две последовательные стадии: пиролиз и карбонизацию сырья с образованием пористого науглероженного материала и последующее его активирование высокотемпературным окислителем, в качестве которого в большинстве случаев используется водяной пар [15]. В процессе активации происходит газификация (выгорание аморфного углерода), блокирующего доступ к порам внутри материала, с образованием развитой и взаимно сообщающейся внутренней сети пор и каналов, обладающей способностью избирательно сорбировать на своей поверхности вещества из газовой и жидкой сред [99]. В качестве окисляющих агентов используются преимущественно водяной пар, диоксид углерода и кислород или воздух. При использовании кислорода следует соблюдать осторожность, поскольку он реагирует с углеродом в 100 раз быстрее диоксида углерода. По результатам исследований на графите водяной пар обладает реакционной способностью, в 8 раз превышающей реактивность диоксида углерода. Долю угля, выгоревшего при активации, называют степенью обгара. Наиболее микропористые угли образуются при степени обгара около 50 %. В пределах степени обгара 50-70 % получаются разнородно пористые активные угли с достаточно развитой микро- и мезопористостью, а выше 75 % - макропористые угли. При использовании водяного пара для обеспечения эффективной скорости реакции необходима температура около 8000С, а при использовании диоксида углерода 900 0С. Если теплота подводится в основном активирующими газами, его температура должна быть еще выше [4]. При этом следует избегать избытка кислорода, поскольку в противном случае последует внешний обгар. С одной стороны, при удалении оксида углерода и водорода из газовой атмосферы процесс активирования значительно ускоряется, так как эти продукты замедляют скорость реакции пара с углеродом, блокируя активные центры на поверхности угля. Кроме того, сгорание реакционных газов приводит к восстановлению необходимых для активирования реагентов – диоксида углерода и водяного пара [4]. Возможно комбинирование различных газов для активирования. Часто используется активирование водяным паром и диоксидом углерода, который является продуктом побочной реакции при активировании паром. Активирование водяным паром и кислородом позволяет получить активные угли с высокой обесцвечивающей способностью ввиду того, что добавление незначительных количеств кислорода приводит к увеличению скорости реакции в несколько раз. Каталитическое ускорение процесса газового активирования играет немаловажную роль. Наиболее эффективными катализаторами процессов газификации и 32 активации являются кислородосодержащие соединения щелочных и щелочноземельных металлов. В работе [99] приведены результаты экспериментального исследования, характеризующего влияние условий совмещенного термохимического процесса пиролиза и активирования водяным паром технических лигносульфонатов (ЛСТ) на формирование пористой и тонкой структуры получаемых активных углей. Двухстадийная термохимическая обработка исходного сырья усложняет технологию синтеза углеродных адсорбентов, выход готового продукта при этом обычно невысок. В совмещенном процессе пиролиза и активации упрощается технология синтеза углей за счет исключения стадий карбонизации. Выход активных углей притом возрастает на 20…25% [100]. Соединения натрия, присутствующие в исходном сырье, естественным образом катализируют газификацию углерода, что позволяет совершить активацию за несколько минут по сравнению с многочасовой выдержкой в печи активации традиционного или специально синтезируемого сырья. Было установлено, что первичная пористая структура активных углей формируется на стадии карбонизации лигносульфонатов, тогда как парогазовая обработка необходима для раскрытия сформировавшихся пор, что обеспечивает доступ к ним молекул — адсорбтивов. В процессе пиролиза-активации лигносульфонатов формируется развитая щелевидная пористая структура угля, включающая микропоры полушириной 0,50-0,64 нм. Н.Ф. Федоров и М.А. Андреев совместно с Г.К. Ивахнюком и А.О. Шевченко показали возможность ускорения процесса парогазовой активации за счет использования слабых электрических полей, налагаемых на перерабатываемую шихту, т.е. нереагентного воздействия на нее. Позднее Н.Ф. Федоровым и М.А. Андреевым была оценена возможность реагентного воздействия на рассматриваемый процесс за счет использования водяного пара модифицированного различными солями. В качестве солевых добавок вводимых в воду использовались соли ряда веществ, эффективность применения которых в технологии активного угля было выявлено другими исследователями при осуществлении химической активации или же при использовании их в качестве каталитических добавок. Были взяты хлорид цинка и фосфаты щелочных металлов. [101] Механизм каталитического действия щелочных соединений на реакции между углеродом и газообразным окислителем в процессе термической трансформации органического сырья до настоящего времени не ясен. Большинство исследователей отдает предпочтение окислительно-восстановительному циклу, при котором катализатор попеременно восстанавливается углеродом и окисляется газообразным реагентом. Имеются и другие гипотезы, согласно которым щелочные металлы внедряются в углеродные слои и действуют как доноры электронов, промотирующие хемосорбцию в процессы распада. Реальными являются также процессы взаимодействия 33 щелочным металлов с неспаренными валентными электронами углерода, подтверждаемые данными ЭПР-спектроскопии. Обсуждается механизм катализа, по которому происходит образование карбидных соединений или гидридов щелочных металлов. [102]. Реализация любого из предлагаемых механизмов действия щелочных катализаторов приводит к увеличению пористости карбонизованных продуктов. 1.4 Методы химической активации в синтезе активных углей При химическом активировании используют главным образом некарбонизованные исходные материалы, к которым относятся торф и древесные опилки. Можно также использовать шламовые отходы осветляющих производств. Превращение такого сырья в активный уголь происходит под воздействием дегидратирующих агентов при высоких температурах. В этом случае кислород и водород избирательно и полностью удаляются из углеродсодержащего материала, при этом происходит одновременно карбонизация и активация (обычно при температурах ниже 650 0С). В качестве активирующих агентов в технике в основном используются фосфорная кислота, хлорид цинка и сульфид калия. Кроме того, можно использовать химические вещества, оказывающее дегидратирующее действие – роданид калия, серную кислоту и другие вещества, частично оказывающие также и каталитическое действие [103]. При использовании их возможно образование угля при весьма низкой температуре, причём образующийся углерод характеризуется наибольшей активностью. К таким веществам следует отнести и гидроксид натрия, использование которого ограничивается, в первую очередь, по причине высоких расходов на активацию и сложности регенерации из отработанных промывных растворов. В таких исследованиях, реагент растворяется в воде, смешивается с сырьем, и смесь выдерживается при 85 °C, без испарения. Таким образом, гидратация сырья облегчается, и улучшается его пропитка за счет обеспечения доступа раствора вглубь сырья. После окончания пропитки, осуществляется карбонизация в потоке азота и полученный уголь промывают, чтобы удалить оставшийся активирующий агент. Аналогичный метод был использован для получения крупнокускового угля, который включал карбонизацию под давлением в 130 МПа. На практике в промышленных масштабах в настоящее время реализованы два метода химической активации – сернистокалиевая и хлорцинковая. Первую применяют в основном в России, вторую – за рубежом [5]. 1.4.1 Применение ZnCl2 для химической активации Наличие различных толкований существа процесса образования активного угля в присутствии неорганических добавок, в том числе и хлорида цинка, связано с тем, что 34 несмотря на большое количество использованных с этой целью неорганических веществ, такие процессы до последнего времени были изучены недостаточно. Одной из первых работ в этой области в нашей стране является обзор Т.Г. Плаченова [104]. Хлорцинковая активация основывается на пропитке некарбонизованного материала раствором хлорида цинка при нагревании до 90-100 оС. Способность ZnCl2 к активации углеродсодержащего сырья основывается на его способности к обезвоживанию. В процессе активации, ZnCl2 удаляет атомы водорода и кислорода из воды в составе углеродных материалов, а не кислород органических соединений, что приводит к образованию пор, а также к повышению содержания углерода [105]. Множество исследований было проведено зарубежными учеными. Пример использования ZnCl2 для активации был описан в работе Катурла и соавт.[106], который синтезировал гранулированный активированный уголь с размером частиц около 2 мм химической активацией косточек персика с ZnCl2. Степень активации оценивали по количеству Zn (XZn), импрегнируемого в сырье, которое изменялось в пределах от 0,20 до 1.2 г Zn/г сырья. Термическая обработка была проведена в токе азота при температуре 500 ° C. Сочетание химической активации хлоридом цинка с физической активацией диоксидом углерода позволило получить углеродные адсорбенты с удельная площадью поверхности 3000 м2/г при степень обгара 60 - 70%. После пропитки с ZnCl2 происходит деструкция целлюлозный компонента, что следует из реакции дегидратации во время стадии карбонизации. В результате карбонизации, последующего обугливания, следует ароматизация углеродного скелета, а также происходит развитие пористости. Были проведены исследования карбонизации сырья хлоридом цинка в интервале температур 500 – 800 0С. Как и ожидалось, в результате карбонизации наблюдалась незначительная убыль массы, уменьшение размера частиц, снижение пористости с ростом температуры процесса, что наиболее выражено при низких значениях соотношения раствора активирующего агента к сырью.[106] Лопес-Гонсалес и соавт. [107] синтезировали активированный уголь из оливковых косточек с использованием ZnCl2, и сравнили его с углем, полученным физической активацией с CO2. По сравнению с CO2, хлорид цинка проявил себя лучше с точки зрения значения площади поверхности (2084 м2/г), общего объема пор (0,5 см3/г) и адсорбции метиленового голубого. Таким образом синтезировали активированный углеродный материал с лучшей структурными и адсорбционными характеристиками по сравнению с активными углями, полученными активацией с диоксидом азота. Иными словами, ZnCl2, или любой химический активатор в целом, выступает в качестве шаблона для формирования пористой структуры в дополнение к химически реагирующим с углеродом веществам [108]. Когда соотношение активирующего агента 35 и угля-сырца (углеродсодержащего сырья) высоко, значительное количество ZnCl 2 осаждается на внешней поверхности углеродной матрицы. В результате происходит локализованные разрешения органических вещества, что приводит к образованию более широких и более крупных поры (мезо-и макропористости). Последние несколько исследовательских групп использовали метод хлорцинковой активации такого углеродсодержащего сырья, как рисовая шелуха [109], кукурузный початок [110], кофейная гуща [111], опилки тикового дерева [112], косточки абрикоса [113] и вишни [114], багассы сахарной свеклы [115], скорлупы кокоса [116] и древесины тамаринда [117]. 1.4.2 Применение карбонатов щелочных металлов для химической активации Kiyoshi Okada и соавт. [118] оценивали влияние природы активирующего агента (Li2CO3, Na2CO3, K2CO3, Rb2CO3, Cs2CO3) на процесс активации углеродного материала, полученного из макулатуры. Было установлено, что изменение физических свойств катиона щелочного металла активирующего агента оказывает существенное влияние на структурные свойства активированного угля. Лучшими в качестве активирующих агентов были признаны соли K, в связи с образованием атомарного K в процессе активации, как показано в реакции, который впоследствии встраивается внутри соседних слоев гексагональной плоскости сети атомов углерода. 2 C + K2CO3→2 K + 3 CO Из-за интеркаляции K были разделены соседние плоскости графена. Даже после удаления K водной или кислотной промывкой, перестроенные или неупорядоченные графеновые листы углеродного кристаллита не возвращаются в исходное положение, в результате чего остаются поры и пустоты. Полученный активированный углеродный материал имеет высокую пористость и высокое значение удельной площади поверхности. Значения удельной поверхности, а также значения объема пор активированных углеродных материалов, полученные с использованием различных активирующих агентов, а именно, Li2CO3, Na2CO3, K2CO3, Rb2CO3 и Cs2CO3 были 790, 610, 880, 1230, 1370 м2/г и 0,64 , 0,65, 0,58, 0,75 и 0,85 см3/г соответственно, когда процесс активации осуществляется при 1073 К в течение 2 ч и при соотношении активирующего агента и сырья (мас. / мас.%) равном 1. Когда процесс активации проводили при 1173 К при прочих равных условиях, подобно тому, как и в предыдущем случае, значения удельной площади поверхности и объем пор были 680, 790, 1740, 1200, 1310 м2/г и 0,53, 0,78, 1,15, 0,77 и 0,80см3/г. Таким образом, размер катиона активирующего агента оказывает существенное влияние на структурный объем пор и удельную площадь поверхности (SBET) углеродных материалов. Чем больше размер катиона (Rb, Cs) активирующего агента, тем больше 36 значение удельной площади поверхности, а значит, размер катиона щелочного металла является важным параметром для определения эффективности активирующего агента в процессе химической активации. Чтобы понять природу взаимодействия между K2CO3 (активирующего агента) и углеродсодержащего сырья (лигнин) Junichi Hayashi и соавт. [119], использовали термический анализ. Углеродсодержащее сырье (лигнин), полученное из крафтцеллюлозы подвергли карбонизации в атмосфере N2 в диапазоне температур 323 - 1273 K при скорости нагрева 10 К / мин. Из лигнина, который активировали в присутствии K2CO3 при температуре активации 1073 К с отношением пропитки 1 (K2CO3: лигнина (масс / масс)), получили активированный углеродный материал со значением площади поверхности ~ 2000 м2/г. Было установлено, что температура активации оказывает существенное влияние на характеристики активированного угля. Быстрый рост SBET, а также значения Vp активированных углей наблюдается при температуре активации в диапазоне 773 - 1073 K. Дальнейшее увеличение температуры активации ведет к снижению значений SBET и Vp, что указывает на эффективность K2CO3 в качестве активирующего агента при температуре активации около 873 К. Hayashi и соавт. [120] получили активированный уголь с высокой удельной площадью поверхности (2772 м2 / г) с узким распределением пор по размерам из отходов полиуретановой пены с использованием K2CO3. В результате удаления углерода карботермическим восстановлением K2CO3 (1) полиуретановый уголь обладал высоким значением удельной площади поверхности, а также отчетливым распределением пор. В дополнение к снижению температуры разложения полиуретановых компонентов, наличие K2CO3 в карбонизационной смеси вызвало структурные изменения в полиуретане во время активации. Было обнаружено, что K2CO3 эффективен в качестве активирующего агента в двух диапазонах температур [120]: один ниже 773 K, где термическое разложение карбонатов щелочных металлов происходит в результате изменения в поведении карбонизации угля-сырца, и другой диапазон температур - выше 873 K, где процесс карботермического восстановления K2CO3 приводит к превращению углерода в уголь. Быстрый рост SBET и Vp наблюдались при температуре активации около 873К. Wei Li и соавт., [121] получили активированный уголь с высокой удельной площадью поверхности (SBET = 2557 м2 / г, Vp = 1,647 мл / г), используя стебли табака в качестве углеродсодержащего сырья, K2CO3 в качестве активирующего агента, и микроволновую энергию, как источник излучения вместо обычного нагрева в электрической печи. Активация смеси науглероженных остатков от табачного стебля и K2CO3 проходила в токе азота в кварцевой реакционной камере под воздействием микроволнового облучения 2,45 ГГц в промышленной микроволновой печи. Было 37 установлено, что оптимальные условия активации следующие – время облучения микроволнами 30 мин., мощностью микроволновой печи 700 Вт и соотношение K2CO3 к углю (масс./масс.) 1,5. После процесса активации полученный материал промывали 50% HCl в течение 2 ч для удаления металлических примесей. Развитие пористости (1,647 см3/г) и формирование высокой площади удельной поверхности (2557 м2/г) стало результатом термической диссоциации K2CO3, и карботермического восстановления K2CO3 и K2O с получением металлического К. Образованный таким образом металлический K встраивается в слои углеродного материала, который при последующей отмывки от HCl создает пустоты в этом материале. Индра Нееля и соавт., [122] получили микропористый активированный уголь с высокой площадью поверхности, с узким распределением пор по размерам из высушенных стеблей калотрописа гигантского. Калотропис гигантский является сорняком, произрастающим на пустырях Индии. Для оценки влияния катиона активирующего агента на структурные свойства активированного угля, уголь, полученный из калотрописа гигантского подвергается активации с Li2CO3, Na2CO3 и K2CO3 при температуре 1073 К в течение 8 ч в среде азота. Соотношение угля к активирующему агенту было 1:1 (масс./масс.). Уголь-сырец, а также активированные угли подвергали порометрическому анализу с использованием газа N2 в качестве адсорбата при 77 К. Было выяснено, что существует устойчивое повышение объема адсорбата, адсорбированного на активированного угле, при использовании в качестве активирующего агента в ряду от Li2CO3 к K2CO3 через Na2CO3. Было установлено, что удельная поверхность активированного угля, находится в зависимости от радиуса катиона активирующего агента: для Li2CO3 – 480 м2/г, Na2CO3 – 811 м2/г, К2CO3 - 892 м2/г. Проводились исследования влияния солей натрия на процесс получения активных углей на базе основных промышленных лигносодержащих отходов химической переработки древесины: лигносульфонатов (ЛС), лигносодержащих отходов производства ванилина, сульфатного и гидролизного лигнинов. Изучение свойств углей, полученных при пиролизе окисленных ЛС – отхода синтеза ванилина – без активирования водяным паром с последующей водной экстракцией минеральных веществ из карбонизованного продукта показывает, что для формирования пористой структуры необходима температура пиролиза 800 0С и продолжительность процесса не более 30 минут. По видимому, повышенная щелочность окисленных лигносульфонатов (pH 10,5) и высокое содержание солей (около 60 %), представленных, главным образом, сульфатом и карбонатом натрия, приводит к тому, что для окислительновосстановительных процессов, протекающих в системе при пиролизе и необходимых для формировании пористой структуры угля, не нужно вводить дополнительный 38 окислитель – водяной пар. Угли, полученные в оптимальных режимах имеют следующие показатели: общая удельная поверхность 1470 м2/г, объем пор 0,5 и мезопор 0,2 см3/г, характеристическая энергия адсорбции в микропорах 15,7 кДж/моль, сорбция метиленового голубого 520 мг/г, йода 110 %. Выход активных углей 14 – 16 % по отношению к органическим веществам ЛС. [123]. 1.4.3 Применение KOH и NaOH для химической активации Наиболее часто используемые щелочи для активации углеродных материалов KOH и NaOH. Исследования Harry Marsh и Dennis S Yan [124] были посвящены механизмам реакций между углеродистым материалом и КОН. Исследователи смогли предложить убедительное описание процесса активации угля-сырца KOH. На основании законов термодинамики был сделан вывод, что реакция между КОН и углеродсодержащим материалом может привести к образованию функциональных групп, таких как – OK, образующихся с использованием кислорода солей. K2O + C → C-O-K + K Наличие калия и кислорода в угле приводит к окислению поперечных связей атомов углерода в соседних слоях в процессе активации. На краях пластинки создаются поверхностные функциональные группы. В результате удаления связей между соседними слоями, а также формирования новых функциональных групп на отдельных слоях, слои кристаллита от своих нормальных (совершенно плоских) форм переходят в слегка морщинистый (или сложенный) или сморщенный вид. Кроме того, металлический калий, полученный в процессе активации, встраивается в систему между слоями кристаллита. После процесса активации, когда углеродный материал промывают водой, соли калия, присутствующие в угле, удаляются путем выщелачивания. В то же время, слои не могут вернуться в исходное состояние (непористое состояние) из-за созданной прослойки пустоты. Таким образом, оставшийся слой способствует развитию пористости и высокому значению поверхности угля [124]. Данные исследования были реализованы в экспериментальном процессе активации KOH на основании результатов Seong – Ho Yoon и др. [125]. Исследования Seong – Ho Yoon и др., были направлены на изучение структурных изменений, происходящих в углеродных нановолокнах при активации, а также влияния активации на структурные свойства полученного активированного угля. Адсорбенты на основе смеси C2H4 и H2 были синтезированы при 873 К с использованием Cu-Ni катализатора. Уголь-сырец был активирован КОН (КОН:уголь-сырец = 4:1, масс/масс) при трех различных температурах активации, а именно 1073, 1123 и 1273 К. Удельная площадь поверхности угля при активации увеличилась с 174 до 439, 587 и 1212 м2/г соответственно при температурах активации 1073, 1123 и 1273 К. Наиболее ярким аспектом исследования является понимание структурных преобразований сырья, 39 происходящих при увеличении температуры активации с КОН (увеличение температуры активации от 1073 до 1273 K). В результате исследователи предложили модель процесса активации с KOH. Важными особенностями модели являются: избирательная газификация графенов частицами C-OK, K2O, и K2CO3, образующихся во время процесса активации KOH; местное удаление или расширение графеновых слоев (слоев из углеродных кристаллитов) и, наконец, разрушение волокнистой структуры слоев графена. Byung-Joo Kim и соавт., [126] изучили процесс активации с KOH графитовых нановолокон на основании рентгеновского излучения и наблюдений с использованием электронной микроскопии, и предложили механизм для объяснения развития пористости при активации KOH. Графитовые нановолокна, как известно, имеют слоистую структуру. В процессе активации выделяют три стадии, а именно, разрушение длинных волокон в сторону более коротких волокон, расширению слоев графена путем внедрения K (расширение поры) и пилинг (с участием совокупного эффекта разделения слоев графена, а также разрушение волокон), которые участвуют в развитии пористости. Значение площади поверхности полученных графитовых нановолокон составляет 320 м2/г. Но при активации с КОН при трех различных температурах, а именно: 1172,1273 и 1373 K значения площади поверхности увеличились до 500, 580 и 790 м2/г соответственно. В дополнение к развитию пористости и повышению удельной площади поверхности, еще одним явным преимуществом активации с KOH является образование поверхностных функциональных - OH групп на углеродной поверхности. (- ОК) группы, образовавшиеся на углеродной поверхности при активации KOH преобразуется в (- ОН) группы при водной отмывке по реакции ионного обмена. Таким образом, в дополнение к созданию пор путем удаления K, после промывки водой, полярные функциональные группы – ОН, создающиеся в больших количествах делают поверхность угля гидрофильной. Molina-Sabio и Родригес-Рейносо [80] описывают исследование образца гранулированного активированного угля с использованием КОН для активации без разрушения гранул угля до порошка. Они описывают активацию угля KOH, полученного из оливковых косточек (размер частиц около 3 мм), карбонизованных в атмосфере азота при 300, 500 и 800 ° C, а впоследствии пропитанных водными растворами KOH в соотношении 0.005-3 г (КОН ) / г сырья, прежде чем нагревали в атмосфере азота. Когда соотношение пропитки превышало 0,1 / 1, пропитанные оливковые косточки иногда распадались в порошок. Кроме того, было установлено что температура термической обработки играет важную роль для развития пористости. Пористость в углях, активированных при 500 и 700 ° C низкая, независимо 40 от используемого углеродсодержащего сырья (сырье или уголь-сырец), в то время как активирование при температуре 850 и 900 °C приводит к увеличению пористости, что свидетельствует о критическом диапазоне температур активации KOH атомов углерода. Аналогичное поведение сообщают Hayashi и соавт. (2000) [119] при исследовании активации различных лигноцеллюлозных материалов карбонатом калия. Кроме того, выход около 20-25%, соответствующий выходу в результате карбонизации углеродсодержащего сырья, был связаны с низким уровнем развития пористости, в то время, как в более активированных углях выход ниже, около 10-15% масс (которые в свою очередь, соответствует общему выходу в результате тепловой активации лигноцеллюлозных материалов). Это говорит о том, что развитие пористости путем активации KOH может быть связано с реакциями газификации. В качестве сырья для получения активных углей японские ученые предложили использовать остаток от пиролиза скорлупы кокосового ореха. При продувке азотом смесь угля и KOH (1:4) нагревают до 500оС, выдерживают 1 час, а затем нагревают до 800оС и выдерживают 1,5 часа [127]. Этот способ был запатентован в США [128]. Выход угля с удельной поверхностью 2680 м2/г и общим объемом пор 1,68 мл/г составлял 60%. Множество исследований было посвящено установлению механизма активации с использованием гидроксида калия для различных углеродных материалов: Zengmin Shen и соавт. [129], Joanna Gorka и соавт. (флороглюциновые смолы) [130], Qi Jiang и соавт. (метан), [131] Yungang Liu и соавт. (бензол) [1132], Kierzek и соавт. (древесный уголь, смолы или каменный уголь с высоким содержанием летучего углерода) [133], Yong bin Ji и соавт., [134]. Основная стоимость производства активированного угля заключается в потреблении активирующего агента. Задачей его является формирование высокой удельной площади поверхности углеродного материала на единицу веса, что является наиболее экономичным. Активация NaOH дешевле и экологически безопаснее. Процесс химической активации имеет преимущество над физической активации. С помощью химического процесса активации были получены адсорбенты с относительно большими значениями удельной площади поверхности с повышенной микропористостью, а также узким распределением пор по размерам. Формирование металлических K или Na неизбежно при активации углеродного материала либо с КОН или NaOH. Общий вид стехиометрический реакции между активирующим агентом и углеродсодержащим сырьем следующий [135]: 6 MOH + 2 C → 2 M + 3 H2 + 2 M2CO3 где M=K, Na Поразительное различие между процессами активации с KOH и с NaOH является следствием особенностей их атомов. Калий, образующийся непосредственно в процессе 41 активации с KOH, внедряется между графеновыми слоями углеродного кристаллита. Такое внедрение сильнее выражено в случае с углеродными материалами высокой упорядоченности. Напротив, NaOH – эффективный активирующий агент для углеродных материалов с неупорядоченной структурой. Едва ли найдутся доказательства внедрения натрия в углеродный кристаллит. Процесс активации с гидроксидом натрия протекает там, где есть дефектные участки, путём химической реакции на поверхности. Образование карбонатов щелочных металлов и их последующее разложение при высоких температурах (> 800 °C) с выделением CO и CO2 является общей чертой активации с KOH и с NaOH. Образование газов, таких как CO и CO2, также происходит в процессе удаления летучих из углеродного сырья (лигноцеллюлозных материалов и углей с высоким содержанием летучих). Основываясь на результатах исследований о влиянии соотношения NaOH/сырье в процессе активации на структурные свойства (на удельную площадь поверхности и объём пор) и на морфологию поверхности (изучение растровым электронным микроскопом), Ru-Ling Tseng предложил двухступенчатый механизм активации, определяющий образование углеродных материалов при активации с гидроксидом натрия. Было обнаружено, что когда значения отношения NaOH:сырьё лежали в интервале 0…1, удельная площадь поверхности образцов уменьшалась с 290 до 113 м2/г. Этот процесс считается I этапом процесса активации, и он связан с пиролизом поверхности. Когда отношение NaOH: сырье находилось в интервале от 2 до 4, была обнаружена тенденция к возрастанию значений удельной площади поверхности (с 1478 до 1887 м2/г). Необходимо отметить, что когда отношение изменялось от 1 до 2, наблюдалось приращение величины значений удельной площади поверхности (от 113 до 1478 м2/г). Это II этап активации, он связан с процессами травления и разбухания. Jair C.C. Freitas с сотр. [136], используя ЯМР-спектроскопию натрия-23 (MAS NMR, или вращение под магическим углом), подтвердили присутствие ионов Na+, связанных с кислородсодержащими поверхностными функциональными группами, находящимися преимущественно на краях графеновых плоскостей в развитой сети пор угля. Таким образом, подтвердили образование поверхностных групп -O-Na и предложены в работе [137]. Чтобы добиться понимания природы связывания между натрием, образованным в углеродном материале при активации c NaOH, и поверхностью угля, Jair Freitas [138] провёл ЯМР-исследование в образце активного угля. Был синтезирован активный уголь из рисовой шелухи, который активировали с NaOH при 800 °C и при соотношении NaOH к углю 3:1. Полученную после активации смесь углеродного сырья с продуктами разложения активирующего агента (карбонатами и силикатами) подвергали водной 42 отмывке. Несмотря на это, ионы Na+ оставались связанными с поверхностью угля. Было обнаружено уменьшение содержания золы при активации угля и последующей отмывке активированного материала водой. Это указывает на вовлеченность неорганического вещества (в особенности кремния) в процесс активации с гидроксидом натрия и на последующее образование водорастворимых силикатов натрия, что и приводит к уменьшению содержания золы после активации и отмывки. В рисовой шелухе кремний присутствует в виде аморфной кремниевой кислоты. Обнаружено, что некоторые соединения кремния являются химически связанными с функциональными группами угля. Такой кремний играет значительную роль в процессе активации. При температуре 700 °C в активном угле был обнаружен Na2SiO3·6H2O; когда температура активации возросла до 800 °C, в активном угле были обнаружены такие соединения как Na2SiO3 и Na4SiO4 (до отмывки водой). Когда процесс активации проводили с углём, предварительно обработанным плавиковой кислотой HF (для удаления присутствующего в угле кремния), не было обнаружено следов силиката натрия, а был обнаружен только карбонат натрия. Таким образом, обработка плавиковой кислотой является эффективным способом полного удаления кремния и предотвращения образования силикатов натрия в процессе гидроксиднатриевой активации. Значения удельной площади поверхности по БЭТ для активных углей, полученных из угля с кремнием и без кремния (обработанного HF) – 450 и 1400 м2/г соответственно. Таким образом, присутствие кремния в угле снизило эффективность процесса активации из-за конкуренции кремния с углеродом за активирующий агент (NaOH) с последующим образованием силикатов натрия. Эффективность процесса активации зависит не только от природы углеродного сырья, но и от применяемого активирующего агента. Чем сильнее реагирование между сырьём и активирующим агентом, тем ниже температура начала реакции (то есть, выделение водорода происходит при более низкой температуре). Если в качестве активирующего агента применяют KOH, реакция между углеродом и активирующим агентом начинается при относительно более низких температурах по сравнению с NaOH; это свидетельствует о том, что KOH более реакционноспособен в сравнении с NaOH. Hye-Ryun Hwang с сотр. [139] обнаружили, что KOH является лучшим активирующим агентом по сравнению с NaOH. Повышенная эффективность KOH связана с большим ионным радиусом калия (0,267 нм) по сравнению с таковым у натрия (0,190 нм). Исследователи систематически анализировали изменение в эффективности KOH и NaOH как активирующих агентов, используя в качестве сырья для получения углеродных материалов осадки сточных вод и каменноугольный пек. Среда активации (продуваемый газ: N2, CO2 или H2O) также оказывает влияние на структурные свойства активного угля. Влияние реакционной атмосферы на процесс 43 активации с NaOH оценивали для трёх различных атмосфер, а именно, для CO2, H2O и N2. Использование азота при активации с NaOH дало положительные результаты. Скорость тока азота является важным фактором, влияющим на структурные свойства углеродных материалов. При увеличении скорости тока азота было обнаружено увеличение пористости. Процесс активации с NaOH тормозился в атмосфере CO2. В присутствии CO2 замедлялся процесс развития пор, так как основная реакция между CO2 и NaOH протекает быстрее, чем реакции СO2 и NaOH c углеродом. Процесс активации с NaOH в присутствии водяного пара приводил к образованию углеродных материалов с хорошей пористостью. Увеличение эффективности процесса активации обусловлено совместным влиянием реакций углерод – гидроксид и углерод – водяной пар. Было обнаружено, что в сравнении с CO2 и водяным паром азот является хорошей альтернативой в качестве среды активации. В России исследования, связанные с переработкой отходов древесного происхождения с целью получения углеродных сорбентов, проводятся преимущественно в С(А)ФУ на кафедре химических технологий [123, 140-161]. Отмечается [162-164], что добавление к пиролизуемому лигнинсодержащему материалу (древесина, однолетние растения, целлолигнин, лигнин) соединений щелочного характера, до 10–20% от сырья, приводит к увеличению выхода смолы и увеличению выхода угля. Однако в области более высоких дозировок (>100%) наблюдается противоположный эффект. Общий характер влияния щелочи выражается в снижении температуры начала деструкции материала, увеличении степени его распада в области низких температур [39, 163, 165, 166] и образовании термостабильной вторичной структуры, т.е. структуры угля, при температурах выше 300oС. Исходя из проведенного анализа следует, что натриевые основания являются эффективными реагентами термохимической активации, не требующие применения водяного пара, углекислого газа или другого газообразного окислителя. Методом термохимической активации с использованием соединений щелочных металлов можно получать высококачественные активные угли из любых отходов растительного происхождения, а также углеродсодержащего сырья. Существует также смешанная активация, которая заключается во введении в углеродсодержащее сырье неорганических (химических) реагентов, карбонизации результирующего импрегната при 450 – 750 0С и парогазовой активации карбонизованного материала. Этот метод применяют дл развития пористой структуры (особенно объема мезо- и микропор) активных углей химической активации (например для получения активного угля марки СКТ – 6А), а также для повышения реакционной способности карбонизованных гранул с целью повышения производительности 44 процесса на стадии активации (например, при производстве углей марок АГ – 3 и АГ 5) [5]. 1.5 Методы исследования пористой структуры активных углей В первые десятилетия прошлого века активный уголь обычно принимали за аморфную разновидность углерода. Хотя электронные фотографии позволяют различать рыхлую структуру, состоящую из мельчайших углеродных частиц размером около 3 нм, только рентгеноструктурный анализ Гофманна впервые показал, что эти частицы представляют собой кристаллиты размерами 1-3 нм. Поэтому в настоящее время активный уголь относят к группе микрокристаллических разновидностей углерода. [4] Хотя графитоподобные кристаллиты в активных углях состоят из (так же как у графита) из плоскостей протяженностью 2-3 нм, образованных шестичленными кольцами, типичная для графита ориентация отдельных плоскостей решетки друг относительно друга нарушена. Это означает, что в активных углях слои беспорядочно сдвинуты относительно друг друга и не совпадают в направлении, перпендикулярном плоскости слоев. Расстояние между слоями больше чем у графита (0,3354 нм) и составляет от 0,344 до 0,365 нм. Диаметр заключенного в одной плоскости строительного элемента составляет 2,0 – 2,5 нм, а иногда и больше. Высота пачки слоев равна 1,0 – 1,3 нм. Таким образом, графитовые кристаллиты в активных углях содержат 3 – 4 параллельных углеродных слоя. [5] Средний диаметр каждого кристаллита составляет около 10 нм. Размер его может увеличиться под действием графитизации, что обычно происходит при очень высокой температуре (> 1000 ° С) и в инертной атмосфере [167]. Химическим подтверждением графитной структуры активных углей является возможность образования соединений внедрения. Кроме графитовых кристаллитов активные угли содержат, по данным рентгеновского анализа Райли [168], от одной до двух третей аморфного углерода; наряду с этим присутствуют гетероатомы, в частности, кислород. Неоднородная масса, состоящая из кристаллитов графита и аморфного углерода, обусловливает необычную структуру активных углей. Между отдельными частицами появляются щели и трещины (поры) шириной порядка 10-10 – 10-8 м [4]. Принятое вначале деление пор на микро- и макропоры оказалось слишком грубым для описания адсорбционных процессов. М.М. Дубинин, основываясь на различие механизмов адсорбционных и капиллярных явлений, протекающих в адсорбентах, предложил универсальную классификацию пор [169]. Наиболее крупная их разновидность – макропоры. Их эффективные радиусы превышают 100-200 нм. В активных углях удельная поверхность составляет от 0,5 до 2 м2/ г. В процессах адсорбции макропоры играют роль крупных транспортных каналов 45 для адсорбируемых молекул. Адсорбция в макропорах крайне мала и обычно ее не учитывают при оценке адсорбционных свойств активных углей. Более мелкая разновидность пор – мезопоры – характеризуется существенно меньшими размерами. Эффективные радиусы мезопор находятся в интервале от 1,5 – 1,6 до 100 – 200 нм. Удельные поверхности мезопор активных углей обычно составляют 50 – 90 м2/г, достигая у отдельных образцов 300 – 400 м2/г. Адсорбция на активных углях с сильно развитой мезопористой структурой может быть значительной за счет последовательного образования на поверхности мезопор адсорбционных слоев. Поглощение в мезопорах завершается их объемным заполнением по механизму капиллярной конденсации [167]. Мезопоры, так же как и макропоры, служат транспортными путями для адсорбируемых молекул; в них так же осаждаются каталитические и хемосорбционные добавки при введении их в активные угли. Наиболее мелкая разновидность пор углеродных адсорбентов – микропоры – соизмерима по размерам с адсорбируемыми молекулами. Полуширина таких пор составляет меньше чем 0,6 – 0,7 нм. Также выделяют и более крупные поры (супермикропоры), полуширина которых больше чем у микропор, но меньше 1,5 – 1,6 нм. Пользуясь представлениями и диаметрах и радиусах пор, которые следует рассматривать как эффективные параметры, можно допустить, что поры имеют только цилиндрическую форму. Однако, в активных углях преобладают V – образные и щелевидные поры наряду с порами неправильной формы. Кроме того, во многих исследованиях доказывается существование так называемых бутылкообразных пор с узкими входами, которые образуются, в частности, в классическом процессе хлорцинкового активирования [4]. Для активных углей типично наличие всех перечисленных разновидностей пор, хотя отдельные из них могут преобладать. Таким образом, активные угли принадлежат к адсорбентам смешанного типа: их пористая структура имеет полимодальный характер. Особенностью адсорбции в микро- и супермикропорах является повышение энергии адсорбции по сравнению с таковой при поглощении в непористом адсорбенте той же химической природы. Этот эффект является следствием наложения полей поверхностных сил, обусловленных дисперсионными взаимодействиями сил противоположных стенок пор. В результате происходит заполнение адсорбируемыми молекулами объема адсорбирующих пор (микро- и супермикропор) в соответствии с полями адсорбционных сил в них и взаимодействиями между адсорбированными молекулами. Адсорбционное уравнение Гиббса является основой термодинамического описания адсорбционных систем в рамках метода избытков. Оно весьма полезно и 46 широко используется при изучении процессов адсорбции на жидких поверхностях, т.к. в этом случае поверхностное натяжение - экспериментально измеряемая величина и ее зависимость от адсорбции различных веществ (в том числе поверхностно - активных) является важной характеристикой таких систем. [4] Уравнение Фрейндлиха является одним из самых ранних эмпирических уравнений, используемых для описания данных о равновесии, и имеет следующий вид: где a - количество адсорбированного веществ, С – концентрация поглощаемого вещества в растворе, а К и n - коэффициенты, которые, как правило, зависят от температуры. [15] Уравнение Фрейндлиха очень широко используется в описании адсорбции органических веществ из водных растворов на активированном угле. Он также применим в газовой фазе гетерогенных систем с поверхностями, при условии, что диапазон давления не слишком широк, так как при низком давлении это уравнение не подчиняется закону Генри, а когда давление достаточно высоко, оно не имеет конечного предела. Поэтому, как правило, действует в узком диапазоне данных адсорбции. [15] Лэнгмюр (1918) был первым, кто предложил теорию адсорбции на плоской поверхности с точки зрения кинетики, что это есть непрерывный процесс бомбардировки молекул на поверхности и соответствующая десорбция молекул с поверхности к поддержанию нулевой скорости накопления на поверхности в равновесии. Предположение, что молекулы адсорбируются с одинаковой вероятностью на любых участках поверхности, в том числе и уже занятых ранее — слишком грубое допущение, пригодное лишь для очень малых степеней покрытия. Можно сделать другое предположение, состоящее в том, что адсорбция происходит лишь на свободных участках поверхности и что любое попадание молекул на уже занятые места не приводит к акту адсорбции. Это предположение равносильно постулату монослойной адсорбции и оно действительно выполняется, в случае химической адсорбции. Другое используемое допущение об однородности поверхности - равноценность всех ее участков. И, наконец, третье допущение состоит в отсутствии взаимодействия адсорбированных молекул, т.е. считается, что время пребывания молекулы на поверхности не зависит то того, в какое место она ударилась — в непосредственной близости от другой молекулы или на большом от нее расстоянии. Все эти допущения были приняты Лэнгмюром [15] при выводе изотермы адсорбции, сделанном им в 1918 г. Уравнение Лэнгмюра сыграло большую роль в развитии теории адсорбции как первое уравнение, основанное на простой, физически обоснованной модели процесса адсорбции. Оно и до сих пор часто применяется, особенно для описания закономерностей химической адсорбции. 47 1.5.1 Изотерма БЭТ При адсорбции докритическими адсорбатами, их молекулы адсорбируются на твердой поверхности, как процесс наслоения, и, когда давление достаточно велико (около 0,1 относительного давления) формируется несколько слоев. Браунер, Эммет и Теллер разработали теорию для объяснения этой многослойной адсорбции. Область применимости этой теории находится примерно в диапазоне 0,05 и 0,35. Уравнение БЭТ по-прежнему остается самым важным уравнением для характеристики мезопористых твердых веществ, в основном из-за его простоты. Теория БЭТ была впервые разработана Браунером и соавт. (1938) для горизонтальной поверхности (без кривизны) и без ограничений в количестве слоев, которые могут быть размещены на поверхности. Теория БЭТ основана на кинетической модели адсорбционного процесса, выдвинутой Лэнгмюром, то есть поверхность энергетически однородна (энергия адсорбции не меняется в процессе адсорбции в том же слое) и нет никакого взаимодействия между адсорбированными молекулами. Пусть s0, s1, s2 и sn. области поверхности, неохваченные ни одним слоем, охваченные одним слоем, двумя слоями и N слоями молекул адсорбата, соответственно (рисунок 1.4). [5] Рисунок 1.2 – Многослойность в теории БЭТ Целью метода БЭТ является расчет площади поверхности. Для этого необходимо знать площадь поперечного сечения посадочной площадки Acs молекулы адсорбата, и исходя из этого рассчитать площадь поверхности пробы. Азот является наиболее широко распространенным газом, который используют для определения площади поверхности, т.к. он показывает промежуточные значения для конcтанты С (50 – 250) для большинства твердых поверхностей, предотвращая как локальную адсорбцию, так и поведение газа как двумерного. Поскольку было показано, что константа С влияет на величину Acs для адсорбата, доступный диапазон значений константы С для азота позволяет произвести расчет площади поперечного сечения исходя из свойств жидкого азота. Для плотно упаковонного монослоя азота при 77 К площадь поперечного сечения Acs составляет 16,2 Å2 [15]. Исходя из этого, возможно рассчитать удельную площадь поверхности из общей площади поверхности St и массы адсорбента. 48 Экспериментальная изотерма адсорбции стандартного пара на исследуемом образце, выраженная в линейной форме уравнения БЭТ: Брунауэр считает, что уравнение БЭТ выполняется в интервале относительных давлений 0,05—0,35. При меньших, чем 0,05 давлениях сказывается влияние химической и энергетической неоднородности поверхности, при давлениях Р/Ро > 0,35 уравнение не выполняется из-за пренебрежения продольными взаимодействиями адсорбированных молекул и из-за приближенности принятого при его выводе допущений К2 = К3 = … = КL и Q2 = Q3…= QL. Даже небольшая разница в энергии адсорбции во втором и последующих слоях существенно влияет на величины адсорбции из-за экспоненциальной зависимости. Интервал применимости уравнения БЭТ P/P0 = 0,05…0,35, определенный его авторами, не является универсальным для всех систем. Возможно, что эти пределы наиболее часто изучались для систем, для которых константа С не слишком варьировалась, например, для систем, изученных Эмметом и Брунауэром: азот, аргон и другие газы на силикагелях, алюмо- и хромогелях, промотированных железных катализаторах и некоторых других адсорбентах. Однако бывают случаи, когда уравнение полимолекулярной адсорбции выполняется до значительно меньших давлений — до Р/Ро= 0,1 и меньше. Как правило, в этих случаях константа С велика. Это свидетельствует о том, что при большой энергии адсорбции преимущественное заполнение монослоя наступает при меньших Р/Ро. И, следовательно, отклонения от этого уравнения начинаются раньше, а интервал применимости сдвигается в сторону меньших давлений. По этим причинам интервал применимости уравнения БЭТ правильнее оценивать не в единицах относительного давления, а степенью покрытия поверхности. Следует отметить, что удельная поверхность и по БЭТ и по Лэнгмюру имеет завышенные значения более чем на одну треть, поскольку формально учтена поверхность микропор, что по теории объемного заполнения считается неприемлемым. Если учесть, что суммарный объем пор составляет 2300 мм3/г, а объем микропор 900 мм3/г, то это означает, что доля реальной поверхности адсорбента равна 0,61. Следовательно, по БЭТ удельная поверхность адсорбента приблизительно будет равна 2500, а по Лэнгмюру 3600, что уже, само по себе, выделяет этот класс адсорбентов на фоне известных адсорбентов в особый класс с повышенной адсорбционной емкостью. [170] 49 1.5.2 Теория объемного заполнения микропор (ТОЗМ) Основное назначение активных углей, как адсорбентов, состоит в концентрировании примесей, находящихся в обрабатываемой среде, в объеме сорбирующих пор. По существующим теоретическим представлениям динамическая активность слоя активных углей прямо пропорциональна его статической (равновесной) активности. Определяющий показатель качества активных углей – равновесные величины адсорбции в заданных условиях. Дубинин М.М. развил теорию адсорбции, предложенную Поляни, и разработал теорию объемного заполнения микропор (ТОЗМ) [171], которая описывает равновесную адсорбцию на активных углях различной пористой структуры. Основное допущение потенциальной теории состоит в том, что на поверхности твёрдого тела действуют силы притяжения, так называемые дисперсионные силы, которые создают силовое поле. Область действия сил притяжения характеризуется так называемым адсорбционным потенциалом, который представляет собой работу, выполняемую силами адсорбции при переносе частицы из окружающего пространства на поверхность твёрдого тела [4]. Введя представление о функции распределения объемов пор по значениям химического потенциала адсорбата в них, М.М. Дубинин и Л. В. Радушкевич получили уравнение изотермы адсорбции ТОЗМ. Каждый микропористый адсорбент характеризуется по ТОЗМ двумя параметрами: объемом микропор и характеристической энергией. Так как в адсорбционной технике наибольшее распространение получили именно микропористые адсорбенты (активные угли, цеолиты, тонкопористые ксерогели), ТОЗМ применяется не только в физико-химических исследованиях, но и в инженерных расчетах. Адсорбция газовых и жидких смесей. На практике всегда имеют дело не с индивидуальным адсорбтивом, а со смесью газов или с жидкими растворами. Поэтому требуется обобщение теории адсорбции на случай многокомпонентного адсорбтива. В принципе можно исходить из любой модели адсорбции и распространить ее на этот случай. При адсорбции газовой смеси это достигается не только большим усложнением уравнений, но и введением в них дополнительных эмпирических параметров, связанных или с взаимодействием разнородных молекул, или, в более общем виде, с влиянием одних веществ на коэффициент активности других. В случае адсорбции жидких растворов независимо от их концентрации вся поверхность адсорбента заполнена. Вследствие этого адсорбция молекулы каждого компонента сопровождается вытеснением некоторого числа молекул остальных компонентов, т.е. адсорбция носит конкурентный характер. 50 Для практического применения адсорбционного процесса способность адсорбента поглощать определенный адсорбтив, так называемая адсорбционная способность, имеет решающее значение. Поэтому экспериментально определяется равновесная адсорбционная емкость при постоянной температуре как функция равновесной концентрации и соответственно парциального давления. Графическое изображение этой зависимости называется изотермой адсорбции. Для отдельных случаев представляет интерес также изобара адсорбции, т.е. температурная зависимость адсорбции при постоянном парциальном давлении (концентрации). Изостерой адсорбции называется температурная зависимость парциального давления адсорбтива при постоянной адсорбции; в отдельных случаях она также представляет интерес для практики применения активного угля [4]. В соответствии с эмпирической классификацией, впервые предложенной Брунауэром и в последующем принятой ИЮПАК, различают несколько основных типов изотерм адсорбции в зависимости от их вида (рисунок 1.3). Классическая систематизация Брунауэра вначале содержала только типы Ι-V; кроме них в настоящее время принято включать в качестве самостоятельного типа VΙ форму изотермы, предложенную Пиэрсом [172]. Рисунок 1.3 – Изотермы адсорбции Для практического использования в адсорбционной технике представляют интерес преимущественно типы Ι, ΙΙ и ΙV, поскольку при подобных видах изотерм достигаются высокие сорбционные емкости при низких концентрациях. Изотермы III и V типов характерны для систем с очень слабым взаимодействием адсорбент - адсорбат и встречаются реже. Изотермы типа I характерны для микропористых адсорбентов, практически не содержащих мезопор. Для изотерм этого типа характерно наличие почти горизонтального плато, которое может подходить к оси p/p0 = 1 почти под прямым углом или иметь вблизи неё резкий подъём. Если адсорбция газа описывается изотермой II типа, то это указывает на то, что тело является непористым. Изотерма IV типа характеризует тело как мезопористое. Характерный признак изотермы IV - наличие петли гистерезиса. 51 1.5.3 Другие методы исследования пористой структуры АУ Метод Липпенса и де Бура предполагает использование толщины слоя адсорбента, определенной по методике БЭТ, для расчета удельной поверхности. Теория основана на представлениях о существовании адсорбционного равновесия между паром и поверхностью твердого тела. Если допустить, что покрытие, образующееся при определенном парциальном давлении, равномерно распределяется по поверхности твердого тела, тогда можно по объему адсорбата и поверхности БЭТ адсорбента рассчитать среднюю толщину покрытия. t-распределение получают из графика зависимости толщины адсорбционной пленки, возрастающей с повышением парциального давления, от парциального давления (или количества адсорбированного пара). [4] Определение площади поверхности и капиллярной конденсации необходимо для определения распределения пор по размерам. Механизм адсорбции, применимый для микропористых твердых веществ, называемых микропоры заполнения. В этом классе твердых тел стенки микропор находятся в непосредственной близости друг к другу, обеспечивая более высокий адсорбционный потенциал в микропорах. Этот мощный потенциал связан с дисперсионными силами. Теории, основанные на этих силах, включают как теорию Поляни, так и, в частности, Дубинина, который ввел термин объемного заполнения микропор. Эта теория является основой для многих уравнений, которая в настоящее время используется для описания равновесия в микропористых твердых тел. Для более детального анализа пористой структуры адсорбентов (вычисление доли пор различного диаметра в общей пористой структуре) по изотермам адсорбции используют дополнительные расчетные модели, например, метод BJH. Метод Barrett–Joyner–Halenda (BJH), предложенный в 1951 г., изначально был разработан для относительно широкопористых адсорбентов, обладающих широким распределением пор по размерам. Однако было многократно показано, что он может быть успешно применим практически ко всем типам пористых материалов. В основу модели положено допущение о цилиндрической форме пор и то, что радиус поры равен сумме радиуса Кельвина и толщины адсорбированной на стенке поры пленки [173]. Распределение пор по объему с учетом их размера (диаметра) называется распределением пор по размерам. Для определения такого распределения изотерма десорбции адсорбента предпочтительнее изотермы адсорбции. Десорбционная ветвь изотермы для того же объема газа представляет меньшее относительное давление, т.е. используются меньшие энергии. Таким образом, изотерма десорбции ближе к истинному термодинамическому равновесию. Тем не менее, в некоторых случаях рекомендуется использование изотермы адсорбции. Во всех случаях анализа 52 распределения пор по размерам в качестве адсорбата используется азот как наиболее подходящий и хорошо изученный. Поскольку для каждого шага процесса десорбции известно значение Ар, площадь пор можно накопительно суммировать. Метод BJH рассчитывает ∑Асj для каждого шага изменения давления следующим образом: Предполагается, что все поры, освободившиеся от конденсата при снижении относительного давления имеют средний радиус r , рассчитанный из полученных по уравнению Кельвина наибольшего и наименьшего значений радиусов на шаг снижения Р/Р0. Средний радиус капилляров рассчитывается как: где - это адсорбированного слоя для пор среднего радиуса для данного шага снижения относительного давления и рассчитывается из уравнения . Значение “c” в уравнении вычисляется из: 1.6 Требования, предъявляемые к АУ для суперконденсаторов и других электротехнических устройств В настоящее время в суперконденсаторах используются высокопористые углеродные материалы с активными порами размером от 0,7 до 30 нм, разделенные на следующие диапазоны: супермикропоры – меньше 0,7нм, микропоры – 0,7 – 2нм, мезопоры 2 – 50 нм, макропоры больше 50 нм [15]. Такие материалы с электролитами на основе водных растворов щелочи и органических растворов ацетонитрила образуют двойной электрический слой с удельной запасенной энергией до 6 кДж/кг и удельной мощностью до 10 кВт/кг. Для существенного повышения удельных энергетических характеристик систем накопления энергии до 40 кДж/кг и удельной мощностью до 20 кВт/кг необходимо использование новых высокоэнергетических электролитов на основе ионных жидкостей с напряжением декомпозиции до 6 вольт. [175] Однако, использование этих электролитов с существующими наноструктурными пористыми материалами не обеспечивает необходимых энергетических характеристик двойного электрического слоя из-за электрохимической несовместимости молекул ионной жидкости и пористой структуры и химии поверхности углеродного материала. Поэтому ставится задача создания нового поколения наноструктурных углеродных материалов с заданными пористой структурой и химией поверхности путем их целенаправленного синтеза по алгоритмам, разработанным на основе молекулярнодинамического моделирования двойного электрического слоя. Такие материалы будут оптимизированы для использования с высокоэнергетическими электролитами на основе 53 ионных жидкостей с целью получения максимальной величины поверхности двойного электрического слоя для достижения необходимых значений удельных энергетических характеристик систем накопления энергии. Характеристики производимых промышленностью активированных углей зависят от исходного материала для их производства и метода их активации. Для основных типов производимых в России активированных углей, были определены характеристики пористой структуры (таблица 1.1), на основании которых был выбран тип С – активированный уголь на основе фурфурола, наиболее соответствующий типу выбранной ионной жидкости. Таблица 1.1 – Характеристики активированных углей Тип А B C D E Объем микропор, см3/г 0,12 0,17 0,38 0,38 0,33 Объем мезопор, см3/г Общий объем, см3/г 0,25 0,16 0,71 0,65 0,51 0,41 0,38 1,15 1,13 0,87 Удельная поверхность мезопор, м2/г 52 56 183 190 183 Удельная поверхность, м2/г 190 310 1040 1030 1090 Приведенные в этой таблице характеристики необходимы для геометрического подбора активированного угля для работы с ионной жидкостью. Кроме этого, требуется учет влияния химии поверхности на процесс формирования двойного электрического слоя. Поскольку электрохимическое окно ионной жидкости сильно зависит от материала рабочего электрода были исследованы вольтамперограммы [175], полученные на электродах из разных типов активированного угля, а также циклические вольтамперограммы, полученные на элементарных суперконденсаторах с электродами из различных типов активированного угля. 150 1 125 2 100 75 C, Ф/г 50 3 25 4 0 -25 -50 -75 -100 -125 0 250 500 750 1000 1250 1500 1750 2000 2250 2500 U, мВ Рисунок 1.4 - Циклические вольтамперограммы. Материал электрода- активированный Скорость развертки 5 мВ/с Материал электрода – активированный уголь: типА D(1), типСкорость E(2), тип C(3), развертки тип уголь: тип D(1), тип Е(2),тип С(3), тип В(4), тип (5). 5мВ/с. B(4), тип A(5). Электролит 1Ме-3BuImBF4 Электролит BuMeImBF4. 54 Результаты обработки экспериментальных характеристик, из которой следует, что активированный уголь типов С и D обладает максимальным значением электрохимического окна (3,5 вольт) и таким образом подходит для использования в суперконденсаторе с электролитом основе ионной жидкости 1-Ме3ВuImBF4 Применение нового высокоэнергетического электролита потребовало использования наноструктурированного углеродного материала с определенной химией поверхности и структурой пористости – соотношением микро – и мезопор (0,7 – 2 нм и 2 – 8 нм), соответствующим геометрическим размерам катионов и анионов электролита. Такой высокодисперсный углеродный материал оказалось возможным синтезировать на основе активированного угля ФАС, технологический процесс изготовления которого допускает варьирование структуры пористости в соответствии с наперед заданными условиями [176]. Эти условия определяются согласно разработанной в ОИВТ РАН феноменологической теории оптимизации пористой структуры высокодисперсного пористого материала и размеров ионов электролита по критерию формирования максимальной поверхности двойного электрического слоя [177]. Использование упомянутой теории оптимизации позволяет использовать в активной массе суперконденсатора любой высокодисперсный углеродный материал, технология изготовления которого допускает тонкую настройку параметров технологического процесса с целью получения заданной структуры пористости. 1.7 Выводы по аналитическому обзору 1. Углеродные адсорбенты находят применение в самых разнообразных отраслях промышленности. Традиционными потребителями являются: очистка воды и воздуха, медицина и фармацевтика, рекуперация растворителей и т.д. 2. В последнее время появились новые потребители активных углей. А именно, в производстве молекулярных накопителей электрической энергии (аккумуляторы, конденсаторы, суперконденсаторы, ионисторы). Требования к активных углям для изготовления указанных накопителей энергии четко не определены. имеются лишь самые общие рекомендации к их характеристикам. 3. В качестве сырьевых материалов для синтеза активных углей в последнее время наиболее широко используются каменные угли и другие горючие ископаемые. Однако, сохраняется интерес к использованию для данных целей сырьевых материалов растительного происхождения, в особенности отходов их переработки. 4. Из методов активации все шире применяются термохимические, с использованием различных реагентных систем, вступающих, как правило, в окислительно-восстановительное взаимодействие с углеродсодержащим материалом, 55 приводящим в итоге к формированию развитой пористой структуры получаемых адсорбентов. 5. Наиболее высоким активирующим действием из всех реагентных систем обладают гидроксиды щелочных металлов, а именно NaOH и KOH. 6. В качестве сырьевых материалов для термохимической активации в присутствии щелочных реагентов наиболее пригодны технические лигнины, коксы и различные высококонденсированные отходы растительного происхождения. 7. Для оценки внутренней поверхности и пористой структуры получаемых адсорбентов, определяющих их технические характеристики, наиболее широко используются методы, основанные на анализе изотерм с использованием уравнений БЭТ, Дубинина-Радушкевича, Дубинина-Астахова, Ховарда-Ковазое для адсорбции из газовой фазы, и уравнение Фрейндлиха для адсорбции из жидкой фазы. Целью настоящей работы являлось оценить возможность синтеза углеродных адсорбентов на основе гидролизного лигнина с использованием активирующего агента гидроксида натрия. На основе сформулированной цели поставлены следующие задачи: в качестве 1. Определить принципиальную возможность использования гидролизного лигнина, отобранного из отвалов, в качестве сырьевого материала для ТХА с NaOH. 2. Оценить влияние степени измельчения гидролизного лигнина на выход и свойства получаемых углеродных адсорбентов. 3. Экспериментально определить необходимость и условия предварительной карбонизации лигнина и ее влияние на выход и свойства адсорбентов. 4. Используя методы планированного эксперимента, изучить влияние режимных параметров предпиролиза и термохимической активации на формирование адсорбционных свойств и пористой структуры активированных углей. 5. Оценить возможность использования синтезируемых адсорбентов при изготовлении суперконденсаторов и в пищевой промышленности. 56 2 МЕТОДИЧЕСКАЯ ЧАСТЬ 2.1 Характеристика объекта исследования Сырьём для наработки активных углей в данной работе являлся гидролизный лигнин – отход гидролизного производства. Гидролизный лигнин отбирался из отвалов Архангельского гидролизного завода. Характеристика объекта исследования: исходная влажность лигнина 70 %. лигнин Класона - 79,4%, трудногидролизуемых полисахаридов – 12,1 % экстрактивные вещества (экстракция спирто-бензольной смесью) - 14,8%, минеральные вещества 3,9%. Элементарный состав ГЛ в % от сухой массы: - углерода 60%; - кислорода 33%; - водорода 7%. 2.2 Подготовка образцов При проведении термохимической активации лигнина в режиме химической активации в качестве активирующего агента применяли насыщенный раствор гидроксида натрия (61 – 65%). Заранее зная влажность исходного сырья и концентрацию раствора NaOH, их смешивали в определенных соотношениях. Полученную вязкую массу заливали в металлическую реторту и помещали в заранее разогретую до температуры активации печь. Сушка реакционной смеси происходила в реторте перед началом термического разложения. 2.3 Получение активных углей Подготовленные образцы подвергали ТХА в режиме химической активации на лабораторной установке кафедры химических технологий САФУ, изображенной на рисунке 2.1. Основными элементами установки является реторта (реактор), которая помещается в печь с регулируемым электрообогревом, и конденсационная система, включающая прямой и обратный холодильники, а также приемник жидких продуктов. Металлическая вертикальная реторта имеет форму цилиндра высотой 300 мм, внутренним диаметром 100 мм и толщиной стенки 3 мм. Сверху реторта закрывается металлической крышкой, к которой приварен штуцер для вывода парогазов. Крышка крепится к корпусу реторты с помощью 8 болтов. Уплотнение достигается за счет прокладки из асбеста. 57 Рисунок 2.1– Схема установки с металлической ретортой: 1 – электропечь; 2 – реторта; 3 – конденсационная система; 4 – приемник конденсата Воздушно-сухой ГЛ или продукт его предварительной карбонизациии смешивается с концентрированным раствором гидроксида натрия. Полученную вязкую массу заливают в металлический стакан, помещаемый затем в реторту, которую закрывают металлической крышкой с трубкой для отвода парогазов, и зажимают болтами. Реторту устанавливают в печь, заранее разогретую до заданной температуры. Шланг для отвода парогазов соединяют с системой их охлаждения. Сушка реакционной смеси происходит в реторте перед началом термохимического разложения. Продолжительность ТХА составляет 90 минут. По окончании процесса пиролиза реторту вынимали из печи, охлаждали и производили выгрузку угольного остатка, которая осуществляется в водной фазе. Достигается это путём заливания остывшего металлического стакана 300 мл дистиллированной воды и количественного переноса угля в стаканы для его дальнейшей обработки и анализа. 2.4 Методика выщелачивания угольных остатков пиролиза Выщелачивание - это процесс отмывки угля от содопродуктов, образующихся при пиролизе. При предварительных исследованиях было установлено, что наиболее полное извлечение содопродуктов достигается при трехкратном получасовом кипячении угля (каждый раз со свежей порцией дистиллированной воды). Гидромодуль отмывок составлял 10. Фильтраты отмывок объединяли и анализировали. По окончании отмывок уголь обрабатывали 0.5 н раствором соляной кислоты для снижения его зольности. После кислотной отмывки остаток на фильтре промывали дистиллированной водой. Окончание отмывки угля от кислоты контролировали по универсальной индикаторной бумаге. 2.5 Методика определения выхода АУ 58 Отмытый активный уголь высушивали при температуре 105С до абсолютно сухого состояния, измельчали и просеивали через сито с размерами ячеек 0,25 мм и взвешивали. Рассчитывали выход активного угля в расчёте на сухую массу исходного сырья по следующей формуле: где Мау – выход активного угля, г; Мс – навеска исходного материала, г; Wс – влажность исходного сырья, %. 2.6 Методы анализа активных углей 2.6.1 Определение насыпной плотности Определение насыпной (или гравиметрической) плотности осуществляли по методике, изложенной в ГОСТ 7657-84 178. 2.6.2 Определение содержания золы Определение содержания золы в угле проводили по методике, рекомендованной ASTM D 2866-11 179. 2.6.3 Определение содержания воды в угле Определение содержания воды в угле (влажности) проводили методом высушивания по методике ASTM D 2867 [180]. 2.6.4 Определение адсорбционной активности по йоду Определение адсорбционной активности по йоду проводили по методике МРТУ №6-16-1003-67 181, но со следующими изменениями: объем раствора йода составил 50 мл, навеска угля 0,1000г ±0,0002. 2.6.5 Определение площади удельной поверхности по йоду Согласно ASTM D1510 [182] под йодным числом активного угля понимают количество йода (в мг), которое может адсорбировать 1 г этого угля в порошкообразной форме из разбавленного водного раствора йода; остаточная равновесная концентрация йодного раствора должна быть 0,02н. При получении остаточных концентраций в пределах 0,007-0,03 н. пользуются поправочными коэффициентами. Предполагается, что при равновесной концентрации 0,02н йод адсорбируется в виде монослоя. Поэтому существует зависимость между йодным числом АУ и его удельной поверхностью, которую можно определить, например по БЭТ [4]. 59 Удельная поверхность , м2/г 2000 1600 1200 800 400 0 0 400 800 1200 Удельная адсорбция по йоду, мг/г 1600 Рисунок 2.2 – Зависимость удельной поверхности от удельной адсорбции активных углей Значения удельной поверхности с очень большой удельной поверхностью, определяемые по йодному числу, оказываются заниженными. Это объясняется тем, что йод адсорбируется в основном на поверхности пор с диаметрами значительно более 1 нм, а при большой удельной поверхности возрастает доля тонких пор, которые недоступны молекулам йода. 2.6.6 Определение осветляющей способности по метиленовому голубому Для определения осветляющей способности по метиленовому голубому пользовались стандартной методикой по ГОСТ 4453-74 183, основанной на фотоколориметрическом определении светопропускания раствора метиленового голубого до и после обработки углем. Для проведения анализа необходимо построить градуированный график (рисунок 2.3) зависимости оптической плотности водного раствора от содержания метиленового голубого. С этой целью готовят растворы, содержащие 15, 30, 45, 60, 90…мг/л метиленового голубого. В виду высоких осветляющих свойств полученных нами углей объем добавляемого раствора метиленового голубого составлял 50 мл, что в 2 раза превышает количество, рекомендованное в методике 183. 60 0,8 0,7 Оптическая плотность 0,6 0,5 0,4 0,3 0,2 0,1 0 0 30 60 90 120 150 180 210 240 Содержание метиленового голубого, мг/л Рисунок 2.3 – Калибровочный график 2.6.7 Определение адсорбционных свойств по гексану Адсорбцию паров гексана определяют эксикаторным методом. В предварительно высушенный и взвешенный бюкс помещают навеску угля около 0,6 г, взвешенную с точностью до 0,0002 г. Бюкс с открытой крышкой ставят в эксикатор, заполненный на четверть объема гексаном. Взвешивание бюксов проводят через 24 часа от начала эксперимента. Равновесную величину сорбции паров гексана рассчитывают, как отношение привеса к его исходной навеске. 2.6.8 Определение адсорбционных свойств по бензолу Изотермы адсорбции паров бензола снимали при температуре 17-20 оС на адсорбционно-вакуумной установке с пружинными весами типа Мак-Бена-Барка [184]. 2.6.9 Определение адсорбционных свойств по методу низкотемпературной адсорбции азота Удельная поверхность является одной из мер силы взаимодействия твердого тела с окружающей средой, будь то газ, жидкость или другое твердое тело. Такие характеристики материалов, как каталитическая активность, электростатические свойства порошков, светорассеяние, способность к агломерации, свойства обжига и глазурования, способность удерживать влагу, срок хранения и множество других свойств сильно связаны со значением удельной поверхности. Поэтому определение удельной поверхности является одним из самых распространенных методов исследования показателей дисперсности наноматериалов. Для практической реализации данной методики наиболее широко используются сорбционные волюметрические (измерение объёма) анализаторы, основанные на методе низкотемпературной адсорбции азота. Суть метода состоит в анализе сорбции газа твердым телом при постоянной криогенной температуре и постепенном повышении давления. Образец исследуемого вещества предварительно очищается путем нагрева в 61 условиях вакуума либо путем продувки в динамической газовой атмосфере. После очистки в ячейку с образцом подается небольшое количество газа - адсорбата, молекулы которого конденсируются на поверхности образца, постепенно образуя монослой. По количеству газа, ушедшего на образование монослоя, зная поперечное сечение его молекул и массу образца, можно судить о величине удельной поверхности этого материала. Общий вид анализатора удельной поверхности по методу низкотемпературной адсорбции азота ASAP 2020, представлен на рисунке: Рисунок 2.4 - Внешний вид установки анализатора площади поверхности и пористости ASAP 2020 Анализатор ASAP 2020 включает в себя две независимые вакуумные системы: одна для подготовки образцов, а вторая – для их анализа. Наличие двух отдельных систем, а также отдельных портов для подготовки образцов позволяет параллельно осуществлять подготовку и анализ образцов, т. е. реализовать непрерывную работу прибора. Между вакуумным насосом и коллектором в системах анализа и дегазации встроены охлаждаемые ловушки. Рядом с портом анализа образцов находится пробирка для измерения давления насыщения образца (Psat). На боковой панели анализатора удобно расположены патрубки напуска газа и электрические разъемы. Анализатор ASAP 2020 оснащен подъемным механизмом для автоматического подъема и опускания сосуда Дьюара с рабочей жидкостью для анализа. В целях безопасности сосуд Дьюара закрывается съемным щитком. В анализаторе ASAP 2020 предусмотрены запатентованные компанией Micromeritics изотермические кожухи для пробирок с образцами. Эти изотермические кожухи обеспечивают равномерное распределение температуры по всей длине образца и пробирок для измерения Psat. 62 Для каждого образца, подвергаемого анализу, необходимо создать файл со сведениями о нем. При создании файла образца необходимо ввести собственные значения на панели Sample Defaults (Стандартные параметры образцов) в зависимости от характера образца. Файл сведений об образце можно создать в расширенном, базовом или ограниченном формате. Перед началом эксперимента должен быть определен вес образца с точностью до 0,001 грамма с использованием аналитических весов. Для получения точных результатов важно использовать чистые и сухие пробирки для образцов. Оптимальное количество материала образца определяется экспериментально. Меньшее количество материала образца может привести к изменчивости результатов, большее – неоправданно увеличивает продолжительность анализа. Образцы с высокими площадями поверхности требуются в меньших количествах. Но такие образцы необходимо тщательно взвешивать после дегазации, поскольку даже небольшая абсолютная погрешность может составлять значительную долю от общей массы. В этом случае необходимо точно соблюдать инструкции по взвешиванию. Для снижения влияния погрешности взвешивания следует использовать навеску образца около 0,0100 мг. Большинство твердых материалов абсорбируют влагу и прочие загрязнители из атмосферы. Во время анализа образец должен быть чистым. Поэтому для удавления влаги и прочих загрязнителей образец нагревается и помещается в вакуум. Эту операцию называют дегазацией образца. Дегазация образца производится легко и практически полностью в автоматическом режиме в 2 стадии: 1. Нагрев образца до заданной температуры и создание вакуума в пробирке. 2. Выдерживание образца в условиях дегазации в течение заданного времени. В программу анализа ASAP 2020 включено несколько готовых файлов параметров (находятся в папке params). Хотя эти файлы могут достаточно точно подходить к требованиям лаборатории, возможно, что понадобится создать дополнительные файлы. После дегазации образца и его перемещения в порт для анализа можно начать анализ. 2.7 Методики обработки изотерм адсорбции 2.7.1 Обработка изотерм адсорбции азота Математические методы, используемые для описания и системного анализа изотерм адсорбции из газовой фазы, приведены в аналитическом обзоре (раздел 1.5). 63 При анализе изотерм расчет поверхности и объем мезопор осуществляли методами: BET Surface Area, Langmuir Surface Area, t – Plot; для микропор: HorvathKawazoe, Dubinin. В программе производится расчет площади и параметров пористости с привлечением распространенных моделей: метод Лэнгмюра, BET, BJH, t-метод Хэлси, метод Дубинина-Радушкевича (DR), Дубинина-Астахова(DA). 2.7.1.1 Анализ изотерм адсорбции по уравнению Брунауэра - Эмметта - Теллера Теория БЭТ основана на кинетической модели адсорбционного процесса, выдвинутой Лэнгмюром. В этой модели поверхность твердого тела рассматривается как совокупность адсорбционных мест. В состоянии динамического равновесия скорость конденсирующихся на свободных местах молекул газовой фазы равна скорости испарения молекул с занятых мест. Наиболее удобной формой уравнения БЭТ для его приложения к экспериментальным данным является [15]: где P – давление газа, Ps – давление его насыщенных паров, a – масса газа, адсорбированного при относительном давлении Р/Рs, am – вес адсорбированного вещества, образующего покрывающий всю поверхность монослой, С – константа ВЕТ, относящаяся к энергии адсорбции в первом адсорбированном слое и, следовательно, ее значение характеризует взаимодействие адсорбент/адсорбат. Уравнение БЭТ носит линейный характер и может быть использовано, если зависимость 1 / [W(Ps/P)-1] от P/Ps, который для большинства твердых веществ ограничен небольшим участком изотермы адсорбции, обычно для отношения Р/Р s в пределах от 0,05 до 0,35. Этот линейный участок для микропористых материалов соответствует относительно низким давлениям. Стандартная процедура метода ВЕТ требует не менее трех точек в соответствующем диапазоне давлений. Вес монослоя адсорбата Wm можно получить из наклона s и отрезка i, отсекаемого прямой на оси ординат. Из уравнения БЭТ получаем Из этой системы можно рассчитать Wm: 64 Следующим шагом в применении метода БЭТ является расчет площади поверхности. Для этого необходимо знать площадь поперечного сечения посадочной площадки Acs молекулы адсорбата. Тогда общую площадь поверхности пробы St можно представить как: Удельную поверхность S твердого вещества можно рассчитать из общей площади поверхности St и массы навески w по уравнению: Общий объем пор получается из количества газа, адсорбированного при относительном давлении близким к единице, в предположении, что поры затем будут заполнены жидким адсорбатом. Если твердое вещество не содержит макропор, изотерма остается почти горизонтальной в диапазоне Р/Рs, приближающемся к 1 и объем пор в этом случае определяется хорошо. Однако, при наличии макропор изотерма круто поднимается вблизи Р/Рs = 1 и может даже получить почти вертикальное направление. В этом случае истинного объема пор определить не удается. С помощью уравнения объем адсорбированного азота (Vads) можно преобразовать в объем содержащегося в порах жидкого азота (Vliq): где Ра и Т – давление и температура окружающей среды, Vm – молярный объем жидкого адсорбата (для азота Vm = 34,7 см3/моль) [188]. 2.7.1.2 Анализ изотерм адсорбции по уравнению Дубинина-Радушкевича М.М. Дубининым и его школой в результате многолетних и всесторонних исследований были разработаны основы теории физической адсорбции, учитывающей структуру сорбента. Дубинин и Радушкевич [4, 191] при анализе характеристических кривых для активных углей обнаружили сходство в их форме при переходе от одного образца к другому и пришли к заключению, что для их описания наиболее пригодно уравнение гауссовской функции W = W0 exp(-kε2) (2.8) где W0 – объём ожиженного вещества при ε = 0; k – константа. 65 В последующих работах Дубиным с соавторами для углеродных адсорбентов с однородными микропорами было получено фундаментальное уравнение теории объёмного заполнения микропор (ТОЗМ) [15]. W = W0 exp(-(А/Е0)2) (2.9) Е0 – характеристическая энергия адсорбции стандартного пара. Уравнение хорошо описывает адсорбцию паров на многих пористых телах. Параметры уравнения зависят от структуры пористых тел. Для описания пористой структуры содержащей микро- и супермикропоры, используется уравнение: W = W01 exp[-(А/Е01)2] + W02 exp[-(А/Е02)2] (2.10) W01 – предельный объём адсорбционного пространства микропор; Е01 – характеристическая энергия адсорбции в микропорах стандартного пара; W02 и Е02 – объём супермикропор и характеристическая энергия соответственно 2.7.1.3 Анализ изотерм адсорбции по уравнению Дубинина-Астахова В основе теории объемного заполнения пор лежат термодинамические закономерности, и поэтому при описании адсорбционного равновесия используются такие термодинамические функции как энтальпия, энтропия и энергия Гиббса. Для расчета изменений этих функций в качестве стандартного состояния при рассматриваемой температуре принимается объемная жидкая фаза, находящаяся в равновесии с ее насыщенным паром при давлении Ps или летучести fs. Основной термодинамической функцией является дифференциальная максимальная мольная работа адсорбции A, равная со знаком минус изменению энергии адсорбции Гиббса ∆G: где P – равновесное давление, а f – летучесть пара при температуре Т. Введение в формулу летучести вместо давления позволяет учесть неидеальность газовой фазы. Принимая температурную инвариантность уравнения и используя известное в математической статистике распределение Вейбула, Дубинин и Астахов получили термическое уравнение адсорбции в аналитической форме: или в линейной форме: 66 причем отрезок, отсекаемый прямой на оси ординат, равен lnа0, а угловой коэффициент прямой равен (RT/E0)n. Если показатель степени известен (2 для активных углей), то из графика легко определяются предельная величина адсорбции а0 и характеристическая энергия адсорбции Е0 на основании одной экспериментальной изотермы адсорбции. Отклонения от линейной зависимости в области малых величин адсорбции связано с тем, что уравнение Дубинина-Астахова не выполняется при a/a0< 0,1, а отклонения в области больших величин адсорбции проявляются в случае активных микропористых углей с заметно развитой поверхностью мезопор за счет дополнительной адсорбции на этой поверхности при относительных давлениях близких к единице. Уравнение Дубинина-Астахова является эмпирическим, поскольку основано на допущении о возможности использования распределения Вейбула для описания распределения заполнения микропор θ по дифференциальной мольной работе адсорбции А. Более того оно термодинамически некорректно, так как при Р, стремящемся к нулю, не дает уравнения Генри. Однако, в отличие от уравнения БЭТ, основное уравнение ТОЗМ количественно описывает изотермы адсорбции паров на микропористых углях (в интервале 0,15< θ<1). В случае микропористых активных углей можно рассчитывать изотермы адсорбции большого числа адсорбтивов на данном адсорбенте по изотерме адсорбции одного адсорбтива, поскольку а коэффициенты подобия lij с хорошей точностью могут быть рассчитаны по соотношению где Пi, Пj – парахоры соответствующих адсорбтивов. При этом значения a0 c хорошей точностью находятся по соотношению: Поскольку отношения плотностей адсорбатов и адсорбтивов для больших групп веществ практически одинаковы и можно использовать табличные значения мольных объемов жидких адсорбтивов (V0). При этом значения объема микропор (W0) находятся с ошибкой, зависящей от соотношения мольных объемов адсорбата и адсорбтива, но для 67 последующих расчетов в рамках метода полного содержания эта ошибка не имеет значения, поскольку важен лишь факт постоянства W0. Важно отметить, что экстраполяция линейной зависимости lnPs = A−B/T в закритическую область температур (Т>Ткр на 100-150 градусов) позволяет использовать уравнения Дубинина-Астахова для описания адсорбции газов на микропористых адсорбентах, используя вместо Ps значения Р(Т) [189]. В случае невыполнения постулата о температурной инвариантности характеристических кривых температурная зависимость адсорбции на микропористых углях и цеолитах может быть рассчитана на основании установленной экспериментально в работах А.А. Фомкина и сотр.[189-190] «линейности изостер адсорбции», выполняющейся в широких интервалах температур и, в том числе, при переходе через критические температуры адсорбтивов. Соответствующие линейные зависимости для любой постоянной величины адсорбции могут быть представлены в виде: где и – константы, для определения которых необходимы экспериментальные данные как минимум при двух температурах. 2.7.1.4 Анализ изотерм адсорбции по t-методу В t-методе де Бура и Липпенса [176] при построении V-t графиков на оси абсцисс откладывались среднестатистические величины толщин адсорбционной пленки на стандартном образце, на оси ординат — адсорбированные объемы для исследуемого образца. Для определения распределения пор можно использовать метод сравнения tраспределений для пористых тел с непористыми аналогами, для которых оно будет иметь вид прямой, наклон которой соответствует удельной поверхности. Если метод используется для микропористых адсорбентов, то в начальной области относительных давлений зависимость количества адсорбированного вещества удельной поверхности пор и толщины адсорбированного слоя tможет быть представлена соотношениями: и t – распределение остается линейным. С повышением парциального давления заполняются субмикропоры. Построение соответствующих графиков зависимости адсорбированного объема от толщины слоя дает возможность определить объем заполненных пор с диаметром 2t на соответствующем участке на оси объема. При постоянном парциальном давлении 68 величина t связана с так называемым диаметром Кельвина d и истинным диаметром пор D следующим образом: Толщины адсорбционной пленки получены делением объема жидкого адсорбата (при допущении, что он имеет плотность нормальной жидкости) на удельную поверхность исследуемого образца. Для азота после преобразований получено где Vα — адсорбированный объем, см3 НТД/г при данном давлении, А — удельная поверхность, м2/г. Коэффициент 1,547 получен и результате перевода объема адсорбированною газа в объем жидкости и после соответствующею пересчета использованных единиц физических величин. В качестве стандартных образцов авторы использовали гидроксиды и оксиды алюминия и построили единую для них кривую зависимости величин t от Р/P0 [174]. В другой работе [175] эти авторы экспериментальные данные по адсорбции азота на оксидах титана, циркония и магния, сернокислого бария и кремнезема сгруппировали в три универсальные t-кривые. Информация, которая может быть получена из этого (также как и из других) сравнительного метода значительно богаче. Во-первых, область прямолинейности позволяет убедиться, что изотерма (или ее участок) является действительно аффинной. Во-вторых, определение удельной поверхности производится не по одной точке, а по всему интервалу аффинности. В-третьих, удается отметить наличие дополнительного процесса — капиллярной конденсации. В-четвертых, появляется возможность выявить различные участки образца, последовательно заполняемые в ходе сорбционного процесса, и определить их удельную поверхность. 2.7.1.5 Метод анализа изотерм Horvath-Kawazoe Метод Horvath-Kawazoe [191] позволяет рассчитать распределение микропор по размерам по области низких давлений на изотерме. Этот метод выражает зависимость потенциала адсорбции щелевидных пор от ширины пор по уравнению: где NA – число Авогадро, Ns – число атомов на единице поверхности адсорбента, As и Аа задаются формулами: 69 где Na – число молекул на единице поверхности адсорбата, m – масса электрона, с – скорость света; αs – поляризационная способность адсорбента; αа – поляризационная способность адсорбата; χs – магнитная восприимчивость адсорбента; χа – магнитная восприимчивость адсорбата; (l-ds) – эффективная ширина поры; d = ds + da, ds – диаметр молекулы адсорбента; da – диаметр молекулы адсорбата; l – расстояние между двумя слоями адсорбента; σ = 0,858d/2. Метод ХК применяют следующим образом: выбирают эффективную ширину микропор и по уравнению Дубинина - Радушкевича рассчитывают соответствующие P/P0. Из изотермы адсорбции определяют величину адсорбции, соответствующую каждому значению P/P0. Затем берут производную отношения объёма адсорбированного газа к общему объёму (W/W0) по эффективной ширине поры и получают распределение микропор по размерам. 2.7.2 Анализ изотерм адсорбции из растворов по уравнению Лэнгмюра Уравнение Лэнгмюра, а, следовательно, и метод определения поверхности, может быть применено к системам, в которых процесс не осложняется полимолекулярной адсорбцией, адсорбцией в микропорах и капиллярной конденсацией. Данное уравнение основано на допущении: адсорбция локализована и происходит на активных центрах, равноценных в энергетическом отношении и расположенных относительно редко на поверхности адсорбента. Однако данное уравнение в технической адсорбции часто применяется в качестве интерполяционного при расчёте кинетики и динамики процессов поглощения примесей из газовой и жидких сред, а также для сравнительной оценки удельной поверхности внутри определенного класса адсорбентов. Выяснилось, что уравнение Лэнгмюра не целесообразно применять в области малых концентраций. Уравнение Лэнгмюра в общем виде имеет вид [15]: где A – величина адсорбции, мг/г; am – величина ёмкости монослоя, моль/г; b – коэффициент, характеризующий теплоту адсорбции; 70 с – равновесная концентрация, мг/л; P – давление, Па. После несложных преобразований можно получить линейную форму уравнения (2.2). Ее обычно используют для определения коэффициентов уравнения Лэнгмюра am и b. где α0 – коэффициент конденсации; K0 – энтропийный коэффициент; К – постоянная Больцмана; m – масса молекулы, г; Т – абсолютная температура, К; qм – величина теплоты адсорбции одной молекулы. Отсюда можно сделать вывод о том, что при прочих равных условиях переменной величиной в этом уравнении является qм. Определив значение qм и с, можно рассчитать удельную адсорбцию. По значению удельной адсорбции, зная величину посадочной площадки (справочные данные) можно рассчитать удельную поверхность и некоторые фрактальные характеристики данного адсорбата. На рисунке 4.8. приведена изотерма адсорбции метиленового голубого поверхностью активных углей в координатах уравнения Лэнгмюра. 1/C 1,6 1,5 1,4 1,3 1,2 1,1 1 0,9 0,8 0,7 0,6 y = 0,005x + 0,7008 0 20 40 60 80 100 120 140 160 1/A Рисунок 2.6 – Изотерма адсорбции МГ в координатах уравнения Лэнгмюра Линейность изотермы в координатах уравнения Лэнгмюра является обязательным условием при доказательстве правомерности теории мономолекулярной адсорбции в рассматриваемой системе. Для нахождения коэффициентов уравнения Лэнгмюра пользовались методом графической обработки соответствующей изотермы, при этом отрезок, отсекаемый 71 прямой на оси ординат равен величине 1/am, а наклон прямой позволяет вычислить коэффициент b. Обработка данных с использованием ЭВМ заключается в построении изотермы в координатах уравнения Лэнгмюра и автоматическим выводом уравнения полученной прямой. Представим полученное уравнение в линейной форме: Величина b0 = 1/am. Отсюда находим величину am: Дальнейший расчёт с использованием величин емкости монослоя am позволяет определить удельную поверхность пор, доступных для выбранных адсорбтивов, что является одним из качественных показателей вырабатываемых углеродных адсорбентов. где am – ёмкость монослоя, моль/г; NA – число Авогадро; wm – площадь, занимаемая молекулой адсорбата в плотном слое на поверхности адсорбента (элементарная площадка). 2.7.3 Анализ изотерм адсорбции из растворов по уравнению Фрейндлиха Достоинство формулы Фрейндлиха [15] в простоте и удовлетворительном соответствии опыту в широком интервале концентраций растворенных веществ, вследствие чего ее часто применяют в настоящее время, особенно для практических расчетов. Обычно в расчетах используют линейную форму уравнения: Эмпирическое уравнение Фрейндлиха является частным случаем более общего, но также эмпирического уравнения изотермы адсорбции теории объёмного заполнения микропор. Данное уравнение совпадает с уравнением (2.30), если принять, что: На рисунке 2.7 представлена изотерма адсорбции МГ на угле в линейной форме уравнения Фрейндлиха. Тангенс угла наклона прямой позволяет определить значения коэффициента n, а отрезок, отсекаемый ею на оси ординат – lgk. 72 Обработка данных с использованием ЭВМ заключается в построении изотермы в координатах уравнения Фрейндлиха и автоматическим выводом уравнения полученной прямой. Представим полученное уравнение в линейной форме: Рисунок 2.7 – Изотерма адсорбции МГ в координатах уравнения Фрейндлиха Значение константы n будет численно равно: n = kх. Константа k в уравнении Фрейндлиха является качественной характеристикой величины предельной сорбции для данного класса адсорбентов, а константа n характеризует значение характеристической энергии адсорбции Е, по которой судят о пористой структуре АУ. В частности, о строении микропор синтезируемых активных углей. 73 3 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Цель экспериментальных исследований заключалась в разработке технологических основ пиролиза с получением активных углей (АУ) в режиме термохимической активации гидроксидом натрия. Ранее было показано, что при получении АУ путём термохимической активации используются главным образом некарбонизованные исходные материалы. В настоящем экспериментальном исследовании в качестве исходного сырьевого материала использовали гидролизный лигнин (ГЛ) из отвалов АГЗ. Изначально исследования проводили с использованием в качестве сырья исходного ГЛ и лигнина вибропомола. На втором этапе для синтеза адсорбентов использовали предварительно термообработанный ГЛ. 3.1 Термохимическая активация исходного гидролизного лигнина Существующая технология производства углеродных адсорбентов с использованием методов термохимической активации позволила выяснить, что на формирование адсорбционных свойств определенное влияние наряду с сульфатом и карбонатом оказывает также гидроксид натрия. Его положительное влияние на получение АУ из различных углеродных материалов можно считать доказанным. Ниже приведены экспериментальные данные, характеризующие активирующие свойства гидроксида натрия применительно к термической переработке ГЛ, а также возможности использования полученных адсорбентов для производства суперконденсаторов высокой мощности. 3.1.1 Термохимическая активация лигнина вибропомола Лигнин подвергался вибропомолу из соображений обеспечения хорошего контакта частиц углеродного материала с активирующим агентом. Для этого его измельчали на вибромельнице и готовили суспензию лигнина в 42% - ном растворе гидроксида натрия. Полученную массу упаривали и сушили в сушильном шкафу при 103 оС, после чего подвергали термообработке при 500, 550 и 600 оС. Экспериментальные данные, характеризующие выход и адсорбционные свойства угля, отмытого от соединений натрия горячей водой, приведены в таблице 3.1. Как следует из экспериментальных данных таблицы 3.1. лишь при дозировках щелочи 300% по отношению к а.с. лигнину формируется пористая структура, позволяющая адсорбировать йод, МГ и гептан в количествах, значительно превышающих таковую для промышленно выпускаемых порошкообразных АУ. Обращает внимание высокий выход угля, превышающий в 3 раза для варианта парогазовой активации. Положительное влияние температуры в области 500 – 600 оС прослеживается слабо. 74 Вместе с тем, для практической реализации подобного процесса исходный лигнин необходимо высушивать до влажности 18-20% и подвергать измельчению на вибромельнице. Таблица 3.1 – Выход и адсорбционные свойства активного угля из лигнина вибропомола № D, г/г 1 2 3 4 5 6 7 8 9 1,82 1,82 1,82 2,50 2,50 2,50 3,00 3,00 3,00 Температура ТХА, оС 500 550 600 500 550 600 500 550 600 Выход угля к а.с. ГЛ, % 55,33 53,38 53,94 52,71 46,59 47,60 39,80 37,32 36,28 Адсорбция МГ, мг/г 74,7 74,5 72,1 77,3 69,7 69,8 540,7 538,8 559,0 Йода, мг/г 321 360 300 410 416 420 967 1071 1114 Гептана, мг/г 302,4 327,2 304,9 220,7 248,5 238,3 528,7 553,3 572,7 Учитывая несовершенство процесса виброизмельчения и присущие ему недостатки, был проведен сравнительный эксперимент химической активации с гидроксидом натрия лигнина вибропомола и лигнина исходного без измельчения. В последнем случае лигнин был расфракционирован по размеру частиц на 5 фракций: 0-1 мм, 1-2 мм, 2-3 мм, 3-5 мм и выше 5 мм. Все фракции позволили получить адсорбент с одинаковым выходом и одинаковыми свойствами. Поэтому в таблице 3.2 представлены сравнительные данные, полученные с лигнином вибропомола и ГЛ исходным нефракционироанным. Дозировка щелочи составляла при этом 300%, температура термообработки 600оС. Таблица 3.2 – Влияние измельчения лигнина на выход и свойства активного угля № опыта 1 2 Лигнин Выход отмытого угля, % Вибропомола Исходный 38,4 26,2 йода 1266 1239 Адсорбция, мг/г МГ 584,0 594,2 Как следует из таблицы 3.2, влияние измельчения сказывается на выходе угля, но не влияет на сорбционные свойства. Причем выход снижается весьма ощутимо при отсутствии измельчения: с 38,4 до 26,2%. Вместе с тем, исключение необходимости использовать стадию вибропомола ГЛ при практической реализации процесса делает его более предпочтительным. В заключение предварительных исследований с ГЛ вибропомола и исходного нефракционированного были реализованы четыре опыта, отличающиеся способом удаления влаги из реакционной массы после обработки лигнина водным раствором щелочи. В одном случае тот и другой лигнин, обработанный щелочью, предварительно высушивали в сушильном шкафу, во втором случае сырой ГЛ с NaOH сразу помещали в печь, предварительно нагретую до температуры 600 оС. Полученные экспериментальные 75 данные свидетельствуют, что способ удаления влаги из реакционной массы не влияет на выход и сорбционные свойства АУ. И в том и в другом случае они остаются на уровне, приведенном в таблице 3.2 для лигнина вибропомола и исходного. 3.1.2 Термохимическая активация лигнина нефракционированного Экспериментальное исследование по химической активации исходного ГЛ АГЗ в присутствии гидроксида натрия проводили в режиме термообработки без предварительного удаления влаги. То есть лигнин, обработанный водным раствором щелочи, сразу помещали в зону высоких температур. Подобный вариант активации является наиболее технологичным, т.к. позволяет исключить из технологической схемы не только стадию виброизмельчения, но и стадии сушки как исходного ГЛ, так и полученной реакционной массы. Экспериментально изучали влияние температуры и продолжительности термообработки реакционной массы, а также влияние дозировок NaOH на выход и свойства АУ в новых условиях. Полученные экспериментальные данные обработаны графически и представлены на рисунках 3.1-3.4. 0 0,5 Выход угля, % 30 1 Продолжительность, час 1,5 2 30 25 25 20 20 15 15 10 10 400 500 600 700 ТТХА, оС 800 900 Рисунок 3.1 – Влияние температуры и продолжительности ТХА на выход отмытого угля при D =3,00 г/г Как следует из графических данных, представленных на рисунках 3.1-3.4., условия термообработки исходного ГЛ в присутствии NaOH должны быть следующими: 1. Дозировка NaOH к а.с. ГЛ – 2,4 г/г; 2. Температура ТХА реакционной массы – 600 оС; 3. Продолжительность термообработки после отгонки влаги – 1 час. 76 650 600 550 500 450 400 350 300 250 200 1150 1100 1050 1000 950 900 850 0,5 1 1,5 Продолжительность, час Адсорбционная активность по МГ, мг/г Адсорбционная активность по йоду, мг/г 1200 2 Рисунок 3.2 – Влияние продолжительности ТХА (температура 600оС) на адсорбционные свойства отмытого угля 1300 700 600 500 1100 400 1000 300 АМГ, мг/г Aйода, мг/г 1200 200 900 100 800 0 1,8 2 2,2 2,4 2,6 2,8 3 D, г/г Рисунок 3.3 – Влияние дозировок гидроксида NaOH на адсорбционные свойства отмытого угля. Повышение температуры термообработки до 700 оС приводит к дальнейшему росту адсорбционных свойств АУ (рисунок 3.4), однако при этом снижается его выход и существенно осложняется подбор материала для изготовления реактора по причине химической коррозии. Снижение дозировки щелочи до 2,20 г/г приводит к некоторому ухудшению сорбционных свойств по йоду, а значит и соответствующему развитию микропористой структуры, а также сдвигает процесс в область неустойчивого регулирования: небольшое дальнейшее снижение дозы гидроксида натрия резко ухудшает сорбционные свойства угля. 77 1350 600 500 1100 400 300 850 200 100 0 Адсорбционная активность по йоду, мг/г Адсорбционная активность по МГ, мг/г 700 600 400 500 600 700 ТТХА, оС 800 900 Рисунок 3.4 – Влияние температуры термообработки на сорбционные свойства отмытого угля (τ=60 мин) 3.2 Термохимическая активация предварительно термообработанного лигнина Мы предположили, что большой расход NaOH на термохимическую активацию объясняется, в первую очередь, карбонизацией NaOH выделяющимся при пиролизе CO2 и карбоновыми кислотами, что приводит к его инактивации. С целью уменьшения образования указанных кислородсодержащих газообразных продуктов было предложено проводить предварительную термообработку исходного сырья. Известно, что при термообработке в температурном интервале 300 … 400 оС основная часть кислорода компонентов сырья улетучивается, а значит, карбонизация NaOH с образованием неактивного для ТХА Na2CO3 будет снижена. 3.2.1 Влияние температуры предварительной термообработки ГЛ и расхода NaOH на выход и свойства АУ Проведенные исследования определили возможность получения АУ методом ТХА из ГЛ. Как следует из графика на рисунке 3.5, повышение температуры предобработки ГЛ с 250 до 400 оС приводит к уменьшению выхода науглероженного материала с 87 до 56 %. В основном это происходит за счет улетучивания органических веществ, содержащих кислород. 78 Выход угля -сырца, % 90 80 70 60 50 250 300 350 400 Температура предобработки, 0C Рисунок 3.5- Влияние температуры предпиролиза на выход угля-сырца Выход, % 40 2 35 30 3 25 1 20 0,8 1 1,2 1,4 1,6 D, г/г 1,8 2 Рисунок 3.6 - Влияние дозировок NaOH на выход активного угля при различных температурах предпиролиза: 1 – 300 оС, 2 –350 оС, 3 – 400 оС. Из расположения опытных точек на рисунке 3.6 видно, что предварительная термообработка благоприятного влияет на выход АУ. Кривые 3 и 4 располагаются наиболее высоко. Выход АУ достигал в отдельных опытах 35-37%, что значительно Насыпная плотность, г/л выше, чем в случае лигнина нетермообработанного (24-26%) и термообработанного при температурах 300-325оС (кривые 1 и 2 на рисунке 3.6). Отсюда можно заключить, что при одной и той же дозировке гидроксида натрия в расчете на ГЛ расход активирующего агента в пересчете на получаемый уголь с повышением температуры предпиролиза будет снижаться. Увеличение дозировок щелочи оказывает слабое отрицательное влияние на выход АУ. 400 3 300 200 2 1 100 0 0,8 1 1,2 1,4 D, г/г 1,6 1,8 2 Рисунок 3.7 - Влияние дозировок NaOH на насыпную плотность АУ при различных температурах предпиролиза: 1 – 300 оС, 2 – 350 оС, 3 – 400 оС. 79 Предварительная термообработка приводит к существенному росту насыпной плотности угля (рисунок 3.7). Влияние NaOH на насыпную плотность менее значительно. В основном, с увеличением дозировок гидроксида натрия насыпная плотность снижается. Сорбция йода полученными адсорбентами возрастает как с ростом температуры предпиролиза, так и с увеличением дозировок гидроксида натрия (рисунок 3.8). 1900 1600 Айода, мг/г 2 3 1 1300 1000 0,8 1 1,2 1,4 1,6 D, г/г 1,8 2 2,2 Рисунок 3.8 - Влияние дозировок NaOH на адсорбцию йода АУ при различных температурах предпиролиза: 1 – 300 оС, 2 –350 оС, 3 – 400 оС. 700 АМГ, мг/г 550 400 1 2 3 250 100 0,8 1 1,2 1,4 D, г/г 1,6 1,8 2 Рисунок 3.9 - Влияние дозировок NaOH на адсорбцию МГ АУ при различных температурах предпиролиза: 1 – 300 оС, 2 –350 оС, 3 – 400 оС. Существенное отличие влияния предпиролиза и активирующего агента (щелочи) проявляется в формировании высоких осветляющих свойств АУ по МГ (рисунок 3.9). Из рисунка видно, что повышение температуры термообработки приводит к формированию высоких осветляющих свойств угля при более низких дозировках гидроксида натрия. Однако абсолютное значение сорбции МГ при этом несколько снижается. Поэтому в случае необходимости производства именно мезопористых осветляющих углей предпиролиз следует проводить при температуре 300 оС (кривая 1), а дозировку щелочи нужно увеличить до 2,0 г/г в расчете на ГЛ. 80 Адсорбционная активность по парам гептана, мг\г 600 500 3 400 1 2 300 200 0,8 1 1,2 1,4 D, г/г 1,6 1,8 2 Рисунок 3.10 - Влияние дозировок NaOH на адсорбцию паров гептана АУ при различных температурах предпиролиза: 1 – 300 оС, 2 – 350 оС, 3 – 400 оС. Сорбция гептана синтезированными адсорбентами возрастает с ростом дозировок активирующего агента (рисунок 3.10). Однако и в этом случае наиболее целесообразной дозировкой щелочи в расчете на исходный гидролизный лигнин следует считать 170%. Несколько сложнее интерпретируется влияние температуры предпиролиза на значение данного параметра. Можно лишь констатировать, что с повышением температуры предварительной термообработки способность активного угля сорбировать гептан формируется при меньших дозировках NaOH. Из экспериментальных данных, представленных на рисунках 3.6 - 3.10, видно, что варьируя температуру предпиролиза и дозировку активирующего агента можно в широких пределах изменять физические и адсорбционные свойства активных углей и получать активные угли с заранее заданными адсорбционными свойствами. АУ универсального типа, пригодные для использовании в самых различных областях, формируются из ГЛ, предварительно термообработанного при температуре 400 оС и активированного гидроксидом натрия с дозировкой около 170% по отношению к ГЛ. Предварительная термообработка лигнина в температурном интервале 300-400 оС позволяет увеличить выход АУ с 25 до 35%, почти в 2 раза снизить удельный расход щелочи и является фактором, регулирующим насыпную плотность получаемого адсорбента. 3.2.2 Влияние температуры термохимической активации на выход и свойства АУ На следующем этапе работы исследовали влияние температуры ТХА на выход, насыпную плотность и адсорбционные свойства синтезированного АУ из лигнина, предварительно термообработанного при температурах 300 и 400 оС. Из рисунков 3.11 и 3.12 видно, что выход углей и их насыпная плотность с ростом температуры активации снижаются. АУ, полученные из лигнина, предварительно термообработанного при 81 температуре 400 оС, имеют больший выход и оказываются более плотными (кривая 2), чем из ГЛ, термообработанного при 300 оС (кривая 1), что еще раз подтверждает ранее сделанные выводы. Выход АУ, % 41,5 35,5 2 29,5 1 23,5 17,5 550 600 650 ТТХА, оC 700 750 Рисунок 3.11 - Влияние температуры активации на выход АУ Как следует из расположения кривых 2 на рисунках 3.11 - 3.15*, адсорбционные свойства образцов, полученных из ГЛ с температурой предпиролиза 400 оС, с повышением температуры активации во всем исследуемом интервале (550-750 оС) в основном имеют тенденцию к возрастанию. Насыпная плотность, г/л 400 2 300 200 1 100 0 550 600 650 ТТХА, оС 700 750 Рисунок 3.12 - Влияние температуры активации на насыпную плотность АУ Для образцов, синтезированных из лигнина, термообработанного при 300 оС, при дозировке гидроксида натрия в пересчете на ГЛ 1,7 г/г осветляющая способность по МГ проходит через слабовыраженный максимум в области температур около 600 оС (кривые 1). 2200 Айода, мг/г 2000 2 1800 1600 1 1400 1200 550 600 650 ТТХА, оС 700 750 Рисунок 3.13 - Влияние температуры активации на адсорбционную активность по йоду 82 670 АМГ, мг/г 590 2 510 430 1 350 550 600 650 ТТХА, оС 700 750 Рисунок 3.14 - Влияние температуры активации на осветляющую способность по МГ Агептана, мг/г 1000 850 2 700 550 1 400 550 600 650 ТТХА, оС 700 750 Рисунок 3.15 - Влияние температуры активации на адсорбцию паров гептана *Примечание: для рисунков 3.11 - 3.15 обозначение кривых будет следующим: D=1,7 г/г; 1 – Tп/п=300 оС; 2 – Tп/п=400 оС. 3.2.3 Влияние условий синтеза на формирование пористой структуры АУ Для некоторых образцов синтезированных нами углеродных адсорбентов были сняты изотермы адсорбции-десорбции бензола, исходя из которых, оценивались параметры их пористой структуры. Некоторые изотермы для иллюстрации представлены на рисунке 3.16. В таблице 3.3 приведены результаты расчетов характеристической энергии адсорбции (Ео), объема микропор (Vми), мезопор (Vме) и общего объема сорбирующих пор (Vсум). При наличии мезопор рассчитывалась их внутренняя поверхность (Sме). Все расчеты проводились с использованием уравнения Дубинина – Радушкевича (см. раздел 2.7.2). Полученные изотермы (рисунок 3.16) по классификации ИЮПАК относятся к типу Н4 [15], что указывает на то, что в структуре адсорбентов преобладают щелевидные поры. Отличительной чертой всех изотерм, за исключением образцов 4 и 5, является смещение петли гистерезиса в область очень низких относительных давлений. Поэтому ее нельзя связывать с наличием капиллярной конденсации, протекающей в мезопорах. 83 16 TП/П=400 оС, ТТХА=750 оС 14 А, ммоль/г 12 TП/П=300 оС, ТТХА=600 оС 10 8 TП/П=400 оС, ТТХА=600 оС 6 4 2 0 0 0,1 0,2 0,3 0,4 0,5 0,6 P/Ps 0,7 0,8 0,9 Рисунок 3.16 – Изотермы адсорбции-десорбции паров бензола при D=1,7 г/г По Грегу и Сингу [15] причина такого явления состоит либо в «активированном проникновении» молекул адсорбтива в поры, либо в изменении структуры самого адсорбента вследствие, например, его набухания из-за нежесткой структуры. Таблица 3.3 – Условия получения и результаты анализа пористой структуры адсорбентов Условия синтеза Параметры пористой структуры № образца ТТХА, оС ТП/П, оС D, г/г Vсум, см3/г Vми, см3/г Sме, м2/г 1 2 3 4 5 6 7 600 600 700 750 600 650 750 300 300 300 300 400 400 400 1,7 2,0 2,0 2,0 1,7 1,7 1,7 0,96 0,98 1,21 1,16 0,86 1,04 1,16 0,91 0,97 0,93 0,83 0,84 1,02 1,12 278 87 - Ео, кДж/моль 15,3 14,2 14,3 14,0 14,4 18,5 14,7 Анализируя характер изотерм и рассчитанные по ним параметры пористой структуры, можно сделать некоторые обобщающие выводы. Во-первых, обращает на себя внимание достаточно низкая энергия адсорбции бензола в микропорах. Известно, что если энергия адсорбции не превышает значение 15 кДж/моль, можно утверждать, что микропоры представлены в основном супермикропорами, т.е. порами, размер которых находится на границе собственно мезопор и микропор (0,8-1,6 нм). Именно такие адсорбенты являются оптимальными при ориентации использования их для обработки жидких сред и при изготовлении суперконденсаторов. К чисто супермикропористым можно отнести образцы АУ 1,3,5,6 (таблица 3.3). Наличие мезопор характерно для угля синтезированного из лигнина, предварительно термообработанного при 300 оС и активированного при 700 оС (образец 5). Их поверхность достигает 260 м2/г, но для большинства синтезированных углей мезопоры отсутствуют. Практически все исследуемые образцы углей содержат высокий объем супермикропор. Для промышленно выпускаемых АУ общий объем микропор, включая супермикропоры, редко превышает 0,4 см3/г. В данном случае объемы этих пор 84 находятся в пределах 0,8-1,2 см3/г и зависят от условий получения АУ. Именно этим фактором можно объяснить высокую адсорбционную способность углей по йоду и МГ. Увеличению объема адсорбирующих пор способствует повышение температуры активации (образцы 1-3), увеличение дозировки NaOH (образцы 6 и 7), снижение температуры предпиролиза (образцы 3 и 7). Следует отметить, что предварительная термообработка гидролизного лигнина перед термохимической активацией позволяет снизить удельный расход гидроксида натрия на единицу получаемого угля, повысить его адсорбционные свойства. Как уже отмечалось, в процессе термообработки при термохимической активации происходит карбонизация NaOH, в результате чего до 90% от первоначального его количества превращается в карбонат натрия. Предварительная термообработка лигнинов снижает степень карбонизации, а значит и инактивации, активирующего агента. 3.3 Исследование термохимической активации с использованием методов планированного эксперимента Процессы многоуровневой переработки древесных организацией, которая отходов обладает характеризуются сложной следующими признаками: многофакторностью воздействия и откликов, сложностью алгоритмов планирования, проведения и обработки результатов технологического эксперимента, необходимостью проведения имитационных экспериментов. Внешний потенциал информации в химикотехнологических процессах очень велик. Чтобы пропустить информацию по весьма тесным каналам восприятия, мы вынуждены уменьшить этот потенциал и ограничить число возможностей, между которыми делается выбор. Это достигается изучением процесса с помощью его модели - упрощенной системы, отражающей отдельные, ограниченные в нужном направлении характеристики рассматриваемого процесса. Проблема планирования исследований чрезвычайно обширна. Это связано, прежде всего, с большим разнообразием задач, возникающих в практике эксперимента. Обычно при планировании выделяют два основных направления: планирование экстремальных экспериментов и планирование экспериментов по выяснению механизма явлений. С проблемами первого типа исследователю приходится встречаться в процессе поиска условий, при которых изучаемое явление отвечает некоторому критерию оптимальности наблюдений. Эксперименты второго типа ставятся для выяснения закономерностей, характеризующих явление в целом, чаще всего это исследования различных моделей, описывающих изучаемое явление. Планирование эксперимента относится к одной из самых актуальных проблем научного исследования. Многогранность изучаемых явлений, сложность и высокая стоимость оборудования, острая нехватка времени - всё это вынуждает исследователя тщательно продумывать план проведения предстоящих экспериментов. 85 Поиск оптимальных условий проведения процесса активации для получения АУ с заданными структурно - сорбционными характеристиками является важной физикохимической задачей. Поэтому применение методов математического моделирования с целью выяснения взаимосвязи формирования пористой структуры угля с условиями их синтеза в стадии термохимической активации представляет несомненный интерес для прогнозирования структурно - адсорбционных свойств получаемых сорбентов. Разработка оптимального режима получения активных углей из данного вида сырья одно из направлений данного исследования. Задача оптимизации сводилась к определению параметров, обеспечивающих наибольший выход активных углей, имеющих удовлетворительные адсорбционные и другие свойства. При разработке технологии получения АУ из ГЛ необходимо решение вопросов об условиях процесса активирования. На процесс пиролиза при получении АУ влияют крупность сырья, температура, продолжительность активирования, расход активирующего агента, природа сырья, из которого получают АУ, т.е. его физикохимические характеристики и другие факторы. Возникает необходимость проводить исследования процесса активирования с целью отыскания оптимальных условий в каждом конкретном случае при изменении технологических факторов с учетом общих и частных условий процесса. При изучении процесса активирования, задача оптимизации становится многофакторной, решать ее приходится при неполном знании механизмов рассматриваемых явлений, не поддающихся описанию аналитическими методами. Таким образом, наработка углей и оценка их сорбционных свойств проводилась методом планированного эксперимента. Для оценки влияния каждого из выбранных факторов на выход и свойства активного угля был реализован центральный композиционный ротатабельный униформ-план второго порядка. Среди технологических параметров, влияющих на выход активных углей и его характеристики, важнейшими являются температура предварительной термообработки, температура термохимической активации и дозировка активирующего агента. 3.3.1 Исследование в области низких дозировок NaOH 3.3.1.1 Влияние режимных параметров на выход и адсорбционные свойства АУ Как известно, гидроксид натрия является основным источником эксплуатационных затрат при подобном синтезе адсорбентов, определяющим их себестоимость. Поэтому с целью снижения его расхода, дозировку активирующего агента в центре плана зафиксировали на уровне 1,2 г/г к абсолютно сухому сырью. Температуру предпиролиза и ТХА при указанной дозировке активирующего агента следует несколько повысить. Поэтому в центре плана следует принять температуру 86 предпиролиза 450 °С и температуру активации 725 °С. Значения и интервалы варьирования факторов представлены в таблице 3.4. Таблица 3.4 – Уровни и интервалы варьирования факторов Переменные факторы ТП/П, Х1, ºС ТТХА, Х2, ºС D, Х3, г/г Шаг варьирования, λ 30 45 0,24 -α 400 650 0,8 Характеристики плана Уровни факторов -1 0 1 420 450 480 680 725 770 0,96 1,2 1,44 +α 500 800 1,6 Полученные экспериментальные данные, представленные в приложении А, были использованы для расчета коэффициентов уравнений регрессии 2 порядка. Уравнения со значимыми коэффициентами являются математическими моделями, описывающими процесс. В общем виде искомая по плану второго порядка математическая (статистическая) модель достаточно надежно аппроксимируется уравнением y= b0+b1·x1+ b2 ·x2 + b3 ·x3 + b12 ·x1 ·x2 + b13·x1·x3 + b23 ·x2 ·x3 +b11 ·x12 + b22 ·x22 + +b33 ·x33 По уравнениям 3.1 – 3.5, описывающим математические модели, были построены поверхности отклика, которые наглядно демонстрируют влияние режимных параметров на выходные характеристики. Выход, % (3.1) Fрасч=0,58; Fтабл=4,74 Адсорбционная активность по МГ, мг/г (3.2) МГ Fрасч=0,48; Fтабл=4,74 Адсорбционная активность по йоду, мг/г (3.3) йода Fрасч=0,56; Fтабл=4,82 Удельная поверхность по данным адсорбции йода, м2/г по йоду (3.4) Fрасч=0,63; Fтабл=4,77 Адсорбционная способность по гексану, мг/г (3.5) Fрасч=0,50; Fтабл=4,74 Во всех случаях Fрасч < Fтабл. Таким образом, полученные математические модели адекватны изучаемым процессам при доверительной вероятности 95 %. Полученные уравнения регрессии позволили установить влияние факторов на процесс синтеза угля. 87 На рисунке 3.17 а, б представлены поверхности отклика выхода АУ. Их анализ показывает, что поверхности отклика относительно температуры предпиролиза проходят через максимум в температурном интервале около 450 оС, а относительно дозировки щелочи наоборот – через минимум. Выход, % Выход, % 40 40 35 35 30 25 20 30 25 TТХА, oС D, г/г Т П/П, оС а D, г/г б Рисунок 3.17 - Поверхности отклика выхода АУ: а – температура предпиролиза 450 оС; б – Температура ТХА 725 оС Имеет место взаимодействие таких факторов, как температура ТХА и дозировка щелочи, т. е. усиление положительного влияния температуры активации на значение выхода АУ при увеличении дозировки щелочи и, наоборот, при повышении температуры ТХА усиливается положительное влияние дозировки на выход АУ. Для оценки сорбционных свойств сорбентов, как и ранее, использовали общепризнанные адсорбтивы: МГ и йод, растворенные в воде. Указанные вещества широко применяются при тестировании АУ, используемых в технологии очистки жидких сред. Поскольку размер пор синтезируемых нами адсорбентов из ГЛ вполне может быть соизмерим с размерами молекул МГ, йода, их можно использовать в качестве своеобразных молекулярных сит и, оценивая селективность адсорбции, установить особенности пористой структуры. АМГ, мг/г 700 АМГ, мг/г 800 550 600 400 200 0 TТХА,оС 400 250 D, г/г D, г/г ТП/П, оС а б Рисунок 3.18 - Поверхности отклика адсорбционной активности по МГ: а – температура предпиролиза 450 оС; б – температура ТХА 725 оС. 88 Как видно из рисунка 3.18, повышение температуры термохимической активации и дозировки щелочи улучшают сорбционные свойства АУ по МГ. Температура предпиролиза влияния не оказывает. Максимальные сорбционные свойства наблюдаются при температуре ТХА примерно 800 оС и предпиролиза 500оС, а также при дозировке щелочи примерно 1,3 г/г. Взаимные влияния на данной модели отсутствуют. Значительно более сложная зависимость получается при исследовании сорбционных свойств АУ по йоду, поверхности отклика для которой представлены на рисунке 3.19 (а, б). Айода, мг/г Айода, мг/г 3000 3000 2500 2000 1500 1000 500 0 2500 2000 1500 D, г/г ТТХА, оС TТХА, оС D, г/г б а Рисунок 3.19 - Поверхности отклика адсорбционной активности по йоду АУ: а – температура ТХА 725 оС; б – температура предпиролиза 450 оС. Как видно, положительное влияние на адсорбцию йода оказывает температура ТХА. Наблюдается взаимное отрицательное влияние дозировки щелочи и температуры активации, а значит, при увеличении дозировки щелочи ослабевает влияние температуры химической активации на сорбционные свойства по йоду. Следует отметить, что наибольшие значения адсорбции по йоду достигаются в тех же условиях температурной обработки что и по МГ, а значит, эти условия следует признать близкими к оптимальным при синтезе АУ. Потребляемый расход щелочи при этих условиях для достижения наилучшей адсорбции составляет примерно 1,3 г/г. На основании данных о зависимости адсорбции йода активированными углями и удельной площади поверхности по БЭТ [4], были получены данные, которые возможно представить в виде поверхностей отклика значения удельной поверхности от режимных параметров (рисунок 3.20). Как видно, характер поверхностей отклика для удельной поверхности синтезированных АУ аналогичен характеру поверхностей отклика для адсорбционной активности по йоду, что вполне естественно и хорошо объясняется существующим представлением о расчете удельной поверхности по данным адсорбции из растворов. 89 Sпо йоду м2/г Sпо йоду м2/г 2500 2300 2100 1900 1700 1500 2400 1900 1400 900 400 D, г/г D, г/г TТХА,оС ТП/П, оС а б Рисунок 3.20 - Поверхности отклика удельной поверхности образцов активированного угля (по йоду): а – температура предпиролиза 450 оС; б – температура ТХА 725 оС. Aгексан, мг/г Aгексан, мг/г 800 700 600 500 400 300 200 100 TТХА, оС 750 650 550 450 350 250 150 D, г/г D, г/г а ТП/П, оС б Рисунок 3.21 - Поверхности отклика адсорбционной активности по парам гексана АУ: а – температура предпиролиза 450 оС; б – температура ТХА 725 оС. На адсорбцию из газовой фазы на примере гексана (уравнение 3.5 и рисунок 3.21) влияет как температура активации, так и дозировка щелочи, с увеличением которых адсорбция повышается. Оптимальные условия наблюдаются те же что и по МГ и йоду. Поверхности относительно дозировки щелочи и температуры ТХА имеют выпуклый характер (коэффициент b33 и b22 отрицательный), а относительно температуры предпиролиза – зависимость линейна. 3.3.2 Исследование в области высоких дозировок NaOH В результате выше приведенных результатов исследований был сделан вывод, что с увеличением дозировки активирующего агента адсорбционные свойства активированного угля возрастают, а температура предпиролиза практически не оказывает влияния на адсорбционные свойства и выход активных углей. Поэтому с целью улучшения адсорбционно-технических характеристик синтезируемых адсорбентов дозировка активирующего агента, в качестве которого выступал гидроксид натрия, была увеличена, а температура предпиролиза и активации снижены. Таким 90 образом, дозировку NaOH зафиксировали на уровне 1,7 г/г к а.с. лигнину в центре плана и приняли температуру предпиролиза 400°С, а температуру термохимической активации 675 °С. Так как выходные параметры в условиях опытов должны изменяться по простым математическим зависимостям не выше второго порядка, в качестве плана был выбран опять же центральный композиционный ротатабельный униформ-план Уровни независимых переменных и интервал варьирования приведены в таблице 3.5. Таблица 3.5 - Значения и интервалы варьирования факторов Х1, Т П/П, оС Х2, ТТХА, оС Х3, D, г/г Шаг варьирования, λ 30 45 0,24 Характеристики плана Уровни факторов -1,682 (α) -1 0 1 350 370 400 430 600 630 675 720 1,3 1,46 1,7 1,94 +1,682 (α) 450 750 2,1 В соответствии с матрицей планирования определяющейся выбранным планом было получено 20 образцов активированных углей. 3.3.2.1 Влияние режимных параметров на выход и адсорбционные свойства АУ Полученные экспериментальные данные (Приложение Б) были использованы для расчета коэффициентов уравнений регрессии и разработки статистических моделей, связывающих значения выходных параметров с условиями их получения. Расчёт коэффициентов, проверка их значимости и оценка полученных моделей на адекватность экспериментальным данным проводились обычными методами математической статистики, принятыми в планировании эксперимента [128, 129]. Обработав экспериментальные данные мы получили уравнение регрессии, описывающее зависимость выхода АУ от режимных параметров синтеза, в следующем виде: Выход, % х Fрасч=0,637; Fтабл=4,74 Адсорбционная активность по МГ, мг/г Fрасч=0,95; Fтабл=4,82 Адсорбционная активность по йоду, мг/г Айода (3.8) Fрасч=4,38; Fтабл=4,77 Адсорбционная активность по парам гексана, мг/г Агексана (3.9) 91 Fрасч=4,38; Fтабл=4,77 Так как расчетное значение критерия Фишера меньше табличного, значит, полученная модель может быть использована для построения поверхности отклика и прогнозирования значений выходного параметра в области варьирования переменных (рисунок 3.22). Выход, % 32,5 30 27,5 25 22,5 Выход, % 32 29 26 23 20 ТП/П, оС TТХА, оC D, г/г ТП/П, оС а б Рисунок 3.22 - Поверхности отклика выхода АУ: а – D=1,7 г/г; б – температура ТХА 675 оС Из рисунка 3.32 видно, что, как и в разделе 3.3.1, наибольшее влияние на выход АУ оказывает температура предпиролиза в данном интервале варьирования этого фактора. Поверхность отклика проходит через максимум в области температур предпиролиза около 400 оС, о чем так же свидетельствует и отрицательное значение коэффициента b11 (уравнение 3.6). Температура активации и дозировка гидроксида натрия в заданных интервалах значительного влияния на выход не оказывают. На адсорбционную активность по МГ, как видно из уравнения регрессии (3.7) и представленных графических зависимостей (рисунок 3.23), положительно влияют все режимные параметры процесса. АМГ, мг/г АМГ, мг/г 1120 970 820 670 520 Т П/П, оС TТХА, оС 1150 1000 850 700 550 400 D, г/г ТП/П, оС а Рисунок 3.23 - Поверхности отклика адсорбционной активности по МГ активированного угля: а – D = 1,7 г/г; б – температура ТХА 675 оС б Осветляющая способность по МГ возрастает при повышении температуры предпиролиза и термохимической активации. Дозировка гидроксида натрия и температурные факторы закоррелированны между собой, что видно из рисунков 3.23 (а 92 и б). С повышением дозировки активирующего агента осветляющая способность по МГ также возрастает. Для всех синтезированных образцов активного угля была также исследована адсорбционная активность по йоду. Полученные экспериментальные данные были обработаны с применением статистических методов и получением уравнения регрессии (3.8). Полученные результаты оказались адекватными экспериментальными данными, на основании которых были построены графические зависимости – поверхности отклика адсорбционной активности по йоду от режимных параметров (рисунок 3.24). Как следует из рисунка 3.24, наибольшее влияние на адсорбционную активность по йоду оказывает температура предпиролиза: с ее повышением в данном интервале варьирования адсорбционная активность по йоду возрастает. Aйода, мг/г Aйода, мг/г 1460 1420 1380 1340 1300 1500 1450 1400 1350 1300 ТП/П, оС D, г/г TТХА, оС б а Рисунок 3.24 - Поверхности отклика адсорбционной активности по йоду АУ: а – D=1,7 г/г; б – температура ТХА 725 оС Для определения способности полученных образцов к поглощению газов, аналогичным образом была исследована адсорбция паров гексана. Поверхности отклика (по уравнению 3.9) представлены ниже. Агексана, мг/г Агексана, мг/г 750 650 550 450 350 250 770 620 470 320 ТП/П, оС TТХА, оС ТП/П, оС D, г/г а б Рисунок 3.25 - Поверхности отклика адсорбции гексана АУ: а – D = 1,7 г/г; б – температура ТХА 675 оС Анализ поверхностей отклика и уравнения регрессии показывает, что на адсорбцию паров гексана влияние оказывают все факторы. С повышением температуры предпиролиза и активации адсорбция возрастает. Вместе с тем, дозировка щелочи не 93 оказывает аналогичного эффекта. Наибольшая адсорбция гексана наблюдается при минимальных дозировках NaOH и максимальных температурах предпиролиза. 3.3.2.2 Изотермы адсорбции МГ и их анализ по уравнениям Фрейндлиха и Лэнгмюра Полученные изотермы адсорбции МГ как обычно были использованы для расчета коэффициентов уравнений Фрейндлиха и Лэнгмюра, значения которых представлены в приложении Б. Зависимость коэффициентов этих уравнений от режимных параметров получения образцов АУ была статистически обработана с получением уравнений регрессии. Для всех образцов были получены изотермы адсорбции МГ (рисунок 3.36). 1000 2 1 3 6 600 7 400 5 200 0 0 150 300 450 600 750 900 Ср, мг/л D=1,46 г/г 0 150 300 450 600 750 900 Ср, мг/л D=1,94 г/г 1000 1200 1000 10 13 Айода, мг/г 600 400 9 200 0 200 600 400 16 200 11 0 14 800 12 800 АМГ, мг/г 8 800 АМГ, мг/г АМГ, мг/г 4 900 800 700 600 500 400 300 200 100 0 400 600 Ср, мг/л D=1,7 г/г 800 0 0 150 300 450 600 Ср, мг/л 750 900 Рисунок 3.26 - Изотермы адсорбции МГ. Обозначение соответствует обозначению в таблице Приложение Б (3.10) Fрасч=1,17; Fтабл=4,82. (3.11) Fрасч=3,24; Fтабл=4,74 (3.12) Fрасч=0,73; Fтабл=4,77 94 (3.13) Fрасч=1,44; Fтабл=4,74. На коэффициент k в уравнении Фрейндлиха (рисунок 3.27), характеризующий величину предельной адсорбции, оказывают влияние все факторы процесса, о чем свидетельствуют коэффициенты b1, b2, b3 уравнения регрессии (3.10). К К 550 450 350 250 150 50 ТП/П, оС 420 320 220 120 D, г/г TТХА, оС а ТТХА, оС б Рисунок 3.27 - Поверхности отклика коэффициента k в уравнении Фрейндлиха для адсорбционной активности по МГ: а – D=1,7 г/г; б – температура предпиролиза 400оС При повышении температуры предпиролиза и термохимической активации коэффициент k будет расти. Из уравнения 3.11 видно, что наибольшее влияние на коэффициент n будут оказывать опять же температура предпиролиза и термохимической активации. Поверхности отклика (рисунок 3.28) показывают, что наиболее низкие значения коэффициента n характерны для образцов с более высокими температурами предпиролиза и активации. С изменением дозировки активирующего агента значение коэффициента n проходит через четко выраженный минимум в области дозировок около 1,7 г/г. Таким образом, максимальное значение характеристической энергии адсорбции будет наблюдаться при указанном расходе щелочи, и максимальных температурах процесса. n 0,3 n 0,36 0,3 0,24 0,18 0,12 0,06 0,26 0,22 0,18 0,14 0,1 ТП/П, оС TТХА, оС ТТХА, оС D, г/г а б Рисунок 3.28 - Поверхности отклика коэффициента n в уравнении Фрейндлиха для адсорбционной активности по МГ: а – D = 1,7 г/г; б – температура предпиролиза 400 оС 95 Поверхности отклика для коэффициента am, определяющего емкость монослоя МГ, представлены на рисунке 3.29. am 1100 1000 900 800 700 600 am 1200 1000 800 600 ТП/П, оС TТХА, оС а D, г/г TТХА, оС б Рисунок 3.29 - Поверхности отклика коэффициента am в уравнении Лэнгмюра для адсорбционной активности по МГ: а – D = 1,7 г/г; б – температура предпиролиза 400 оС Из рисунка 3.29 (б) следует, что значение коэффициента am находится в линейной зависимости от температуры предпиролиза и дозировки гидроксида натрия. При увеличении дозировки NaOH и повышении температуры предпиролиза значение коэффициента am будет линейно расти. Аналогичная зависимость наблюдается при взаимном влиянии температуры термохимической активации и дозировки активирующего агента. Следовательно, при наибольших значениях переменных факторов эксперимента емкость монослоя МГ будет максимальной. Зависимость коэффициента b в уравнении Лэнгмюра от режимных параметров процесса будет описываться уравнением 3.13 и поверхностями отклика, представленными на рисунке 3.30. Из полученных данных видно, что повышение температуры предпиролиза оказывает исключительно положительное влияние на значение коэффициента b, характеризующего величину теплоты адсорбции. Дозировка гидроксида натрия и температура ТХА в данном интервале варьирования закоррелированны между собой следующим образом: при повышении температуры термохимической активации максимальное значение коэффициента b будет наблюдаться при минимальной дозировке NaOH, и наоборот, при повышении дозировки активирующего агента наибольшее значение теплоты адсорбции будет иметь место при минимальной температуре ТХА. 96 b 0,12 0,1 0,08 0,06 0,04 0,02 0 b 0,12 0,09 0,06 0,03 0 TТХА, TТХА, оС Т П/П, оС oС D, г/г а б Рисунок 3.30 - Поверхности отклика коэффициента b в уравнении Лэнгмюра для адсорбционной активности по МГ: а – D = 1,7 г/г; б – температура предпиролиза 400 оС 3.3.2.3 Изотермы адсорбции йода и их анализ по уравнениям Фрейндлиха и Лэнгмюра Как и прежде, для всех образцов угля были получены изотермы адсорбции йода, которые представлены на рисунке 3.31. 4 200 8 150 3 100 50 0 0 25 50 Cр, мг экв/л 6 100 50 0 7 150 Айода, % Айода, % 200 2 1 75 4 0 100 25 10 250 50 Cр, мг экв/л 12 15 150 11 13 Айода, % Айода, % 200 150 100 14 200 9 75 100 100 50 50 0 0 0 25 50 75 Cр, мг экв/л 100 0 25 50 Cр, мг экв/л 75 100 Рисунок 3.31 -Изотермы адсорбции йода активированным углем: а – D=1,46 г/г; б – D=1,94 г/г; в – D=1,7 г/г; г – ТП/П=400 оС, ТТХА=675 оС. Полученные изотермы были обработаны в координатах уравнений Фрейндлиха и Лэнгмюра. Коэффициенты этих уравнений приведены в приложении Б. На основании полученных данных были рассчитаны уравнения регрессии и построены поверхности отклика, связывающие значения указанных коэффициентов с условиями синтеза АУ. 97 Уравнения регрессий для констант уравнений Фрейндлиха и Лэнгмюра будут иметь вид (3.14 – 3.17): (3.14) Fрасч=2,20; Fтабл=4,77 (3.15) Fрасч=1,85; Fтабл=4,88. (3.16) Fрасч=1,11; Fтабл=4,77 (3.17) Fрасч=0,10; Fтабл=2,65 Полученные модели использовали для построения поверхностей отклика констант от режимных параметров (рисунок 3.32). К К 105 90 75 60 45 30 90 80 70 60 50 40 D, г/г D, г/г ТП/П, оС ТТХА, оС а б Рисунок 3.32 - Поверхности отклика константы k уравнения Фрейндлиха для адсорбционной активности по йоду активированного угля: а – температура предпиролиза 400 оС; б – температура ТХА 675 оС Из поверхностей отклика видно, что температурные факторы синтеза активированного угля оказывают положительное влияние на значение константы k уравнения Фрейндлиха. То есть чем выше температура предпиролиза и ТХА, тем выше будет значение коэффициента K, а значит, тем выше будет величина предельной адсорбции. Дозировка гидроксида натрия и температура предпиролиза аналогичным образом влияет на данный выходной параметр. Положительное влияние повышения дозировки NaOH прослеживается только при высоких температурах активации. Уравнение регрессии 3.15 описывает математическую модель для коэффициента n в уравнении Фрейндлиха, и использовалось для построения поверхностей отклика (рисунок 3.33). 98 n n 0,32 0,4 0,35 0,3 0,25 0,2 0,15 ТП/П, оС TТХА, оС 0,29 0,26 0,23 TТХА, оС D, г/г а б Рисунок 3.33 - Поверхности отклика константы n уравнения Фрейндлиха для адсорбционной активности по йоду АУ: а – дозировка NaOH 1,7 г/г; б – температура предпиролиза 400 оС Анализ поверхностей отклика и уравнения регрессии показывает, что на величину характеристической энергии адсорбции влияют все переменные факторы. Так, повышение температуры предпиролиза отрицательно влияет на значение коэффициента n, особенно в области высоких температур ТХА. Но, следует отметить, что при максимальных и минимальных значениях температурных режимов данного интервала варьирования величина энергии адсорбции будет наименьшей. Повышение дозировки активирующего агента целесообразно лишь при низких температурах термохимической активации. Используя полученное уравнение регрессии для емкости монослоя раствора йода (3.16), были построены поверхности отклика, представленные на рисунке 3.34. Представленные зависимости значения коэффициента am, характеризующего емкость монослоя, показывают, что все переменные факторы оказывают положительное влияние на данный выходной параметр. am am 260 230 200 170 140 110 80 TТХА, оС ТП/П, оС 250 220 190 160 130 D, г/г TТХА, оС а б Рисунок 3.34 - Поверхности отклика коэффициента am уравнения Лэнгмюра для адсорбционной активности по йоду: а – температура предпиролиза 400 оС; б – температура ТХА 675 оС 99 Таким образом, значение коэффициента am возрастает с повышением дозировки гидроксида натрия в области высоких температур ТХА, а также с ростом как температуры предпиролиза, так и термохимической активации. b b 0,8 0,6 0,4 0,2 0 ТП/П, оС TТХА, оС 0,8 0,7 0,6 0,5 0,4 0,3 0,2 1,30 1,54 D, г/г 1,78 2,02 ТП/П, оС б а Рисунок 3.35 - Поверхности отклика коэффициента b уравнения Лэнгмюра для адсорбционной активности по йоду АУ: а – D = 1,7 г/г; б – температура ТХА 675 оС Для коэффициента b зависимость влияния температуры предпиролиза и ТХА в какой-то мере аналогична емкости монослоя: с повышением этих факторов теплота адсорбции в основном будет возрастать. Но повышение дозировки NaOH оптимальным образом сказывается на данном параметре. То есть наиболее высокое значение коэффициента b будет наблюдаться при дозировках щелочи около 1,5 г/г. 3.3.3 Сравнительный анализ результатов планированного эксперимента Выше было указано (раздел 3.3.1), что в области низких дозировок NaOH (0,8-1,6 г/г) основное положительное влияние на выход и адсорбционные свойства синтезируемых АУ оказывает именно расход реагента на активацию. Температура предпиролиза практически не оказывает самостоятельного влияния на выход АУ и их адсорбционные свойства. Именно поэтому было принято решение реализовать аналогичный план, в котором дозировку NaOH повысили до 1,3-2,1 г/г, а температуры предпиролиза и ТХА снизили на 50 оС. Полученные экспериментальные данные подтвердили правильность подобного решения. Их сравнительный анализ показывает, что в области высоких дозировок гидроксида натрия и пониженных температур предпиролиза и термохимической активации выход АУ вырос на 2 абсолютных %, существенно увеличилась сорбционная способность в отношении МГ в среднем с 570 до 860 мг/г, отвечающего за адсорбцию в супермикро- и мезопорах. Именно подобные АУ наилучшим образом подходят для адсорбции из жидких сред и изготовления суперконденсаторов. Однако, развитие данной пористой структуры по указанным косвенным данным (адсорбция МГ) 100 осуществляется за счет снижения адсорбционных свойств по йоду, а значит, за счет снижения содержания более мелких пор. Об этом же свидетельствуют данные по адсорбции гексана из газовой фазы, который адсорбируется преимущественно в микропорах. Адсорбционные свойства в отношении данного адсорбата снижаются в среднем с 565 до 396 %. Полученные математические модели, связывающие значения констант в уравнениях Фрейндлиха и Лэнгмюра по данным анализа изотерм адсорбции МГ и йода представляют самостоятельные значения. Таблица 3.6 – Коэффициенты уравнений регрессии b3 b12 b13 b23 b11 b22 b33 1,6 0 0 1,6 -2,1 0 1,9 -1,0 0 -0,7 0 -2,2 -0,2 0 80 0 0 0 0 -28 -66 61 30 0 0 0 -28 -20 18,2 4,8 0 -9,6 8,5 0 -18,4 0 5,2 0 4,3 10,8 0 0 99 0 0 0 14 0 -40 20 0 -37 0 40 17 -16 Адсорбция МГ kв 290 72 45 22 0 0 0 20 -23 -32 в n 0,17 -0,03 -0,02 0 0 0 0 0 0,02 0,02 в am 827 53 34 23 39 0 0 0 -11 0 bв 0,05 0,03 0,01 0 0 0,01 -0,01 0 0 0 Адсорбция йода kв 65,2 8,5 9,2 0 0 0 3,9 -1,4 0 -2,1 в n 0,20 0,02 -0.01 0,01 0.02 0 0 0,02 0,01 0,01 в am 143,8 25,7 11,8 6,8 0 0 7,6 7,2 0 0 bв 0,47 0,07 0,13 -0,03 0 0 0 -0,04 0 -0,02 Примечание: индекс «н» обозначает выходные параметры для АУ, полученного при низких дозировках NaOH, индекс «в» обозначает выходные параметры для АУ, полученного при высоких дозировках NaOH. yн yв АМГн АМГв Айодан Айодав Агексанан Агексанав bo 28,9 30,6 570 806 200,0 135,1 565 396 b1 0 0 0 83 0 25,2 0 86 b2 0 0 89 48 34,6 12,1 68 55 Рассчитав по моделям значения этих констант (таблица 3.6) для АУ, синтезированных в различных условиях и представляющих их соответственно в уравнении Лэнгмюра и/или Фрейндлиха, мы можем определить их адсорбционные свойства без проведения эксперимента. То есть таким образом можно прогнозировать адсорбцию как йода, так и МГ в области варьирования переменных при синтезе АУ, не осуществляя длительный и дорогостоящий эксперимент. Как видно из рассчитанных по уравнениям регрессии (моделям) значениям констант Фрейндлиха и Лэнгмюра на них также оказывают большое влияние условия реализации опытов, в том числе как температура предпиролиза, так и ТХА, а также расход реагента. Вместе с тем, изменение уровня варьирования переменных существенно повлияло на коэффициенты в уравнениях регрессий и на их абсолютные значения. Поэтому для каждой конкретной 101 области синтеза АУ необходимо ориентироваться на несколько отличающихся по своему характеру статистических моделей. 3.4. Анализ пористой структуры АУ по данным низкотемпературной адсорбции азота Для анализа влияния режимных параметров синтеза АУ, на формирование их пористой структуры использовали образцы планированного эксперимента с высокой дозировкой NaOH. Изучение характеристик пористой структуры проводилось методом низкотемпературной адсорбции азота (77 К) по методике, описанной в разделе 2.6.8. Изотермы адсорбции-десорбции азота, полученные для образцов АУ в различных условиях термохимической активации, представлены на рисунке 3.36 (нумерация кривых соответствует номерам опытов в таблице приложения Б). Из них следует, что пористая структура представлена в основном микропорами (относительное давление до 0,16). Мезопоры присутствуют в небольшом количестве. Для выяснения вопросов о формировании пористой структуры эти изотермы были обработаны по уравнению БЭТ в интервале относительных давлений 0,05-0,35, уравнению Лэнгмюра, уравнению Дубинина-Радушкевича и Дубинина-Астахова, а также по уравнению t-plot (удельная поверхность микропор), объемы и распределение микропор по размерам в исследованных материалах оценивались методом Horvath-Kawazoe, БЭТ и ДубининаIsotherm Linear Plot 000-001 : UGL раздел 1 izot +++ 000-021 : UGL 1 micro +++ 000-002 : UGL 2 izot +++ 000-022 : UGL 2 micro +++ Астахова (см. 2.7.1). 000-003 : UGL 3 izot +++ 000-023 : UGL 3 micro +++ 000-004 : UGL 4 izot +++ 000-024 : UGL 4 micro +++ 600 4 Quantity Adsorbed (cm³/g STP) 500 2 1 400 300 3 200 100 0 0.00 0.05 0.10 0.15 0.20 0.25 0.30 0.35 0.40 0.45 0.50 0.55 0.60 0.65 0.70 0.75 0.80 0.85 0.90 0.95 Relative Pressure (P/Po) D=1,46 г/г 102 Isotherm Linear Plot 000-005 : UGL 5 izot +++ 000-025 : UGL 5 micro +++ 000-006 : UGL 6 izot +++ 000-026 : UGL 6 micro +++ Quantity Adsorbed (cm³/g STP) 400 000-007 : UGL 7 izot +++ 000-027 : UGL 7 micro +++ 8 000-008 : UGL 8 izot +++ 000-028 : UGL 8 micro +++ 6 300 7 200 5 100 0 0.00 0.05 0.10 0.15 0.20 0.25 0.30 0.35 0.40 0.45 0.50 0.55 0.60 0.65 0.70 0.75 0.80 0.85 0.90 0.95 Relative Pressure (P/Po) D=1,94 г/г Isotherm Linear Plot 000-009 : UGL 9 izot +++ 000-029 : UGL 9 micro +++ 000-010 : UGL 10 izot +++ 000-030 : UGL 10 micro +++ 000-011 : UGL 11 izot +++ 000-031 : UGL 11 micro +++ 000-012 : UGL 12 izot +++ 000-032 : UGL 12 micro +++ Quantity Adsorbed (cm³/g STP) 600 10 500 12 400 9 300 11 200 100 0 0.00 0.05 0.10 0.15 0.20 0.25 0.30 0.35 0.40 0.45 0.50 0.55 0.60 0.65 0.70 0.75 0.80 0.85 0.90 0.95 Relative Pressure (P/Po) D=1,7 г/г Isotherm Linear Plot 000-013 : UGL 13 izot +++ 000-015 : UGL 15 izot +++ 000-033 : UGL 13 micro +++ 000-035 : UGL 15 micro +++ 000-014 : UGL 14 izot +++ 000-016 : UGL 16 izot +++ 000-034 : UGL 14 micro +++ 000-036 : UGL 16 micro +++ 500 Quantity Adsorbed (cm³/g STP) 14 400 16 15 300 13 200 100 0 0.00 0.05 0.10 0.15 0.20 0.25 0.30 0.35 0.40 0.45 0.50 0.55 0.60 0.65 0.70 0.75 0.80 0.85 0.90 0.95 1.00 Relative Pressure (P/Po) ТП/П=400 оС; ТТХА=675 оС Рисунок 3.36 - Изотермы адсорбции – десорбции азота Все изотермы адсорбции, полученные для образцов серии, имеют I тип по классификации ИЮПАК, характерный для микропористых твердых тел, у которых 103 преобладают щелевидные поры, развитая микропористая система, и относительно невысокий объем пор других размеров. Сводная таблица, характеризующая значения выходных параметров по данным методам расчета, приведена в Приложении В. Их использовали для расчетов коэффициентов уравнений регрессии, связывающих полученные экспериментальные данные с условиями реализации опытов. Уравнения регрессии (3.18 – 3.23) и поверхности отклика, характеризующие влияние переменных факторов эксперимента на параметры пористой структуры представлены на рисунке 3.47. (3.18) БЭТ Fрасч=1,44; Fрасч=4,74 (3.19) Fрасч=2,30; Fрасч=4,74 (3.20) Fрасч=2,99; Fрасч=4,74 (3.21) Fрасч=1,40; Fрасч=4,77 (3.22) Fрасч=2,15; Fрасч=4,74 (3.23) Fрасч=2,95; Fрасч=4,60 SЛэнгм, м2/г SБЭТ, м2/г 2500 4250 2000 3250 1500 2250 1000 1250 500 0 TТХА, 0C 250 TТХА, 0C ТП/П, оС ТП/П, оС а а б 104 б SДР, м2/г SДА, м2/г 3250 2750 2250 1750 1250 750 250 2750 2250 1750 1250 750 250 ТП/П, оС ТТХА, 0C TТХА, 0C ТП/П, оС в в г г е е Sме t-plot, м2/г 600 500 400 300 200 100 0 Sми t-plot, м2/г 2250 1750 1250 750 250 TТХА, оC TТХА, оС ТП/П, оС ТП/П, оС д д Рисунок 3.37 – Влияние режимных параметров на формирование удельной поверхности АУ по показателю: а) удельная поверхность по БЭТ, м2/г; б) удельная поверхность по Лэнгмюру, м2/г; в) удельная поверхность по Дубинину-Радушкевичу, м2/г; г) удельная поверхность по Дубинину-Астахову, м2/г д) удельная поверхность по методу t-plot (микропоры), м2/г; е) удельная поверхность мезопор, м2/г Анализируя представленные зависимости видно, что их характер для всех показателей пористости, за исключением площади поверхности по методу t-plot аналогичен. Однако, расчет по уравнению Лэнгмюра показывает заведомо завышенные результаты, так как при использовании данного метода предполагается, что адсорбция протекает по мономолекулярному механизму. А значит, адсорбированный азот, в том числе и при объемном заполнении микропор раскладывается на однородную поверхность в виде монослоя. Результаты расчета по уравнениям Дубинина – Радушкевича и Дубинина – Астахова оказались весьма близки полученным по методу БЭТ. Однако, учитывая, что в мировой практике при характеристике удельной поверхности по результатам 105 низкотемпературной адсорбции азота используется исключительно уравнение БЭТ, в последующем для анализа мы использовали именно данный метод. Для анализа удельной поверхности, определяемой микро- и мезопорами, мы использовали метод t-plot, позволяющий, по нашему мнению, наиболее точно оценить поверхность указанных пор по отдельности, если принимать общую удельную поверхность, определенную по БЭТ. Сумма показателей Sми и Sме по t-plot количественно определяет именно удельную поверхность по БЭТ. Как следует из рисунка 3.37 общая удельная поверхность микропор наилучшим образом формируется в условиях наиболее высоких температур предпиролиза и термохимической активации. Причем положительное влияние температур предпиролиза и ТХА проявляется в основном при высоких температурах того и другого фактора. Влияние дозировки щелочи на удельную поверхность образцов не прослеживается, а значит, ее можно уменьшить без ущерба для параметров пористой структуры. Как видно из рисунка 3.37 (е) общая удельная поверхность возрастает в указанных выше условиях за счет мезопор. При повышении температур предпиролиза с 350 оС до 450 оС при максимальной температуре ТХА площадь мезопор возрастает с 50 до 550 м2/г. Аналогичным образом при повышении температуры ТХА от 600 до 735 оС поверхность мезопор возрастает более чем в 10 раз. Как следует из уравнения регрессии, являющегося по существу математической моделью процесса, в условиях реализации опыта на формирование удельной поверхности мезопор весьма существенное влияние оказывает расход щелочи. Анализ коэффициентов при двойных взаимодействиях (b13 и b23) показывает, что наиболее сильное и опять же положительное влияние щелочи на значение поверхности мезопор проявляется опять же при высоких температурах предпиролиза и химической активации. Об этом свидетельствует как знак при этих коэффициентах, так и их абсолютное значение. Естественно предположить, что удельная поверхность АУ будет зависеть от объема сорбирующих пор, в особенности от объема микропор. Приведенный анализ и полученные уравнения регрессии на основании которых были построены поверхности отклика по формированию объема и размера сорбирующих пор (рисунок 3.38) косвенно подтверждает высказанное предположение. (3.24) общ Fрасч=4,36; Fтабл=4,70 (3.25) Fрасч=3,09; Fтабл=4,70 (3.26) ми по Fрасч=2,63; Fтабл=4,70 (3.27) 106 Fрасч=2,63; Fтабл=4,70 Vобщ, см3/г 1,45 1,25 1,05 0,85 0,65 0,45 TТХА, 0С VДА, 1,1 1 0,9 0,8 0,7 0,6 0,5 0,4 Т П/П, оС TТХА, 0С а Т П/П, оС б Median pore width, nm Vми по HK, 1,2 1,2 1,1 1 0,9 0,8 1 0,8 0,6 0,4 0,2 TТХА, оС ТП/П, оС в Т П/П, оС TТХА, оС г Рисунок 3.38 – Влияние режимных параметров на формирование пористой структуры активированных углей по показателю: а) общий объем пор по БЭТ, см3/г; б) объем микропор по Дубинину-Астахову, см3/г; в) объем микропор по Horvath-Kawazoe, см3/г; г) средняя ширина пор по Horvath-Kawazoe , нм Наблюдается общая тенденция в расположении поверхностей отклика, характеризующих удельную поверхность (рисунок 3.37а) и общий объем сорбирующих пор (3.38а), а так же удельную поверхность и объем микропор по Дубинину-Астахову (рисунок 3.37г и 3.38б). Как и следовало ожидать, наиболее высокие значения общего объема сорбирующих пор и объема микропор получены при максимальных значениях в условиях экспериментальных температур предпиролиза и активации. Из уравнений регрессии видно, что дозировка гидроксида натрия в области варьирования данной переменной (1,3 – 2,1 г/г) никакого влияния на объем пор не оказывает. Рисунки 3.38 (б и в) показывают, что зависимости влияния температурных факторов на объемы микропор, определенные по методу Дубинина-Астахова и по методу Horvath-Kawazoe, имеют аналогичный характер. Увеличению объема микропор способствует повышение температуры предпиролиза и термохимической активации. Следует отметить, что объем микропор в полученных образцах составляет 85-90% от общего объема пор. Как видно из представленных данных, микропоры в наших образцах представлены в основном супермикропорами (рисунок 3.38 (г)), которые, как известно, имеют полуширину от 0,8 до 1,6 нм. Практически все образцы имеют размер пор 0,9- 107 1,1нм. Как известно, подобные АУ наиболее пригодны для работы в жидких средах, в частности для их очистки и облагораживания, и в некоторых случаях для извлечения полезных веществ. Кроме того, именно подобные угли оптимальным образом подходят для изготовления суперконденсаторов. 3.5 Исследование потребительских свойств АУ Дл определения потребительских свойств в лабораторных условиях кафедры ХТ САФУ были наработаны 2 образца АУ, которые были переданы для исследований в ведущую научную лабораторию по углеродным адсорбентам ЭНПО «Неорганика» (г. Электросталь). Исследование физико-химических и адсорбционных свойств нового порошкового активного угля, условно названного «Карболин» проводили в соответствии с ГОСТами и методическими инструкциями, принятыми в настоящее время в Российской Федерации для оценки качества активных углей (углеродных сорбентов). Опытный образец «Карболин» был получен при температуре предпиролиза 400 С, температуре активации 750 оС и дозировке гидроксида натрия 1,3 г/г. Результаты исследования приведены в таблице 3.7, там же представлены о результаты исследования порошкового активного угля РНО М200 (производства компании «Еврокарб», Великобритания), полученного на основе скорлупы кокосового ореха, и являющегося в этом плане мировым эталоном. Также в таблице 3.7 приведены технические требования к углю ОУ-А на основе березового угля-сырца (производства ОАО «Сорбент», г. Пермь, Россия) и технические требования к углю УАФ на основе каменноугольного сырья (производство ОАО «Заря», г. Дзержинск, Россия). Заниженные значения адсорбционной активности по йоду и МГ, приведенные в таблице 3.7 по данным НПО «Неорганика» и ОАО «НИИ ВОДГЕО, объясняются тем, что в соответствии с требованиями ГОСТа концентрации указанных адсорбатов недостаточно для полного насыщения испытуемого угля. Таким образом, как йод, так и МГ в условиях анализа были полностью извлечены из раствора. При этом адсорбционная способность его использовалась не полностью. Не смотря на это, как следует их данных, приведенных в таблице 3.7 опытный образец ПАУ «Карболин» в 1,5-2,0 раза превосходит как отечественные так и зарубежные аналоги по своим адсорбционным свойствам при работе в жидких средах. Следует также обратить особое внимание на то, что «Карболин» содержит 2,3 % масс золы, что в 4-5 раз меньше, чем у отечественных ПАУ и на уровне зарубежного аналога. То же самое можно сказать и о содержании особо вредного для работы в жидких средах и при производстве суперконденсаторов Fe3+. 108 Таблица 3.7 - Характеристика порошкового активного угля, полученного методом химической активации. Показатель 1. Активность по йоду, % 2. Активность по МГ, мг/г 3. Содержание золы, % 4.Содержание золы водорастворимой, % 5.Содержание золы кислоторастворимой, % 6. Содержание соединений Fe3+ 7.Содержание водорастворимых соединений Fe, % 8. Содержание влаги, % 9. Выход летучих, % 10. Насыпная плотность, г/дм3 11. Тонина помола (остаток на сите 0,1 мм), % 12. рН 13. Суммарный объем пор по воде, см3/г Опытный ОУ-А по УАФ по Мировой уровень образец ПАУ ГОСТ ГОСТ PHOM200 «Карболин» (Великобритания) 118/126,6*/235** 70 70 103 363/386*/704** 225 190 246 2,3/2,35* 10 11,5 2,6 0,5/0,2* 2 - 1,3 1,5 - - - 0,09 0,2 - 0,04 отс. отс. - отс. 0,3/3,9* 12,1 212 10 - 5 - 5,6 320 18 5 5 1 3 4-6 8-9 9-11 1,24 0,75 0,80 0,71 * Данные ОАО «НИИ ВОДГЕО» **Данные кафедры ХТ САФУ Дисперсность (мм): >0,16-2,0 %; 0,1-15,6 %; 0,063-21,6 %; 0,05-12 %; <0,05-48,8 %. Адсорбционные свойства высокопористых углеродных материалов зависят как от характера их поверхности, так и от текстурных характеристик: удельной поверхности, размеров пор и распределения пор по размерам. Одним из эффективных методов исследования последних является классическая низкотемпературная адсорбция азота, использующаяся уже почти столетие без принципиальных изменений методики. Развитие метода шло по пути совершенствования аппаратурного оформления и в настоящее время типичными стали автоматические адсорбционные установки, например ASAP 2020 Micromeritics и «Сорби-MS». Для исследования пористой структуры ПАУ «Карболин» была измерена изотерма адсорбции азота при температуре жидкого азота (-196 ºС) на установке ASAP-2020. Этот же образец был исследован методом сорбции азота на приборе «Сорби-MS» в МГУ им. М.В. Ломоносова. Характеристики пористой структуры ПАУ «Карболин», рассчитанные из изотермы адсорбции, приведена в таблице 3.8. Более полные сведения по анализу данного угля приведены в приложении Б. 109 Таблица 3.8 - Сравнительная характеристика пористой структуры образца «Карболин» Прибор ASAP-2020 Сорби-MS Объем пор, см3/г микро мезо 0,868 0,327 0,2 0,7 Объем сорбирующих пор, см3/г 1,24 2,09 Sэкв, м2/г Еа, кДж/моль 2445 2525 18,06 - Результаты наших исследований пористой структуры опытного анализируемого АУ «Карболин» несколько отличаются от результатов, полученных на приборе «СорбиMS» в МГУ им. М.В. Ломоносова. Это связано с тем, что «Сорби-MS» характеризуется более низкой чувствительностью микропор, в результате чего образуется ошибка при анализе сорбентов, содержащих как микро- так и мезопоры. Однако, относительное значение при использовании этих сорбентов может быть учтено при последующем поиске возможных потребителей. Такие параметры представляются весьма значимыми с точки зрения применения ПАУ «Карболин» в качестве электродного материала молекулярных накопителей энергии. 3.5.1 Испытание по использованию в суперконденсаторах В настоящее время изготовление и применение суперконденсаторов, основным материалом которых является активный уголь, имеет стратегическое значение для любой страны. Суперконденсаторы позволяют решать многие задачи развития современной техники: от стабильной работы мобильных телефонов до быстрого запуска двигателей тяжелой техники. Порошковые активные угли для суперконденсаторов должны удовлетворять следующим требованиям: - большая величина удельной поверхности (> 1500 м2/г); - развитый объем супермикропор (> 0,4 см3/г); - развитый объем мезопор (> 0,2 см3/г); - низкое содержание золы (< 1,0 % масс); - низкое содержание Fe3+ (< 0,02 % масс). Поэтому основной сферой где может быть с успехом применен «Карболин», естественно является производство суперконденсаторов. Различных типов этих изделий около 50, причем в каждом виде суперконденсаторов к активному углю предъявляются свои особые требования. Основные исследования использования ПАУ «Карболин» в составе суперконденсаторов емкостью 100Ф с неводным электролитом были выполнены в ОАО ВСКБ «Рикон» (г. Воронеж). Акт испытаний приведен в приложении В. На основе образцов активных углей были сделаны электроды для намотки секций суперконденсаторов емкостью 100Ф. 110 Значения параметров, полученные в результате испытаний суперконденсаторов с различными активными углями приведены в таблице 3.9. Таблица 3.9- Результаты испытаний суперконденсаторов № п/п Наименование параметров Ед. изм. № образца 1 Емкость, С Ф 2 Внутреннее сопротивление, Rвн мОм 1 2 3 1 2 3 Значение параметров с/конд на основе ПАУ Norit DLC РНО М200 «Карболин» Supra 30 105,0 97,0 89,6 103,0 95,0 88,9 98,0 94,0 71,1 10,0 9,0 13 8,0 9,0 12 8,0 7,5 11 По данным таблицы 3.9 номинальную емкость суперконденсатора в пределах допуска и номинальное значение внутреннего сопротивления обеспечивает углеродный материал на основе углей марки РНО М200 и «Карболин». Причем следует отметить, что суперконденсатор на основе ПАУ «Карболин» превосходит мировой эталон Norit DLC Supra 30 в 1,2 раза по емкости и в 1,4 раза по внутреннему сопротивлению. Исследования использования ПАУ «Карболин» в составе образца суперконденсатора на органическом электролите BMimBF4 были выполнены в ГНЦ ФГУП «Центр Келдыша» (г. Москва). Они показали, что суперконденсатор на основе ПАУ «Карболин» имеет довольно высокие значения удельной емкости электрода − в расчете на массу углеродного материала Суд =65,8 Ф/г при напряжении 2,5-3,0 В. При этом конденсаторная сборка с электродами на основе «Карболина» имела относительно высокое внутреннее сопротивление − 8 Ом. Однако представленный активный уголь «Карболин» имеет достаточно высокие характеристики и может с успехом использоваться в качестве электродного материала молекулярных накопителей энергии и Li-батарей. И наконец, оценка применения ПАУ «Карболин» в более мощных суперконденсаторах, проведенная в ЗАО «ЭЛТОН» (г. Троицк, Московская обл.), показала его более высокую эффективность (на 50 %) при более коротких (порядка 10 минут) циклах заряд/разряд по сравнению с лучшими образцами углей, протестированных ранее (приложение Г). Из этого следует, что применение данного угля весьма перспективно в более мощных суперконденсаторах системы PbO 2(H2SO4)C. К сожалению, в настоящее время такие конденсаторы в данный момент не производятся. 3.5.2 Испытание ПАУ «Карболин» в ВНИИ крахмалопродуктов Пищевая промышленность России остро нуждается в высокоэффективных ПАУ для очистки и осветления растворов. Общий объем применения ПАУ в пищевой 111 промышленности может быть оценен в настоящее время в 5 тыс. тонн в год, при этом основная его доля приходится на производство крахмала и патоки (около 1000 тонн в год). В таблице 3.10 приведены результаты испытаний ПАУ «Карболин» по ГОСТ 4453-91 «Уголь активный осветляющий древесный порошкообразный». Акт испытаний приведен в приложении Д. Таблица 3.10 - Результаты испытания опытного образца ПАУ «Карболин» Наименование показателя 1. Внешний вид 2. Адсорбционная активность по метиленовому голубому, мг/г 3. Адсорбционная активность по мелассе, % 4. Массовая доля золы, % 5. Массовая доля влаги, % 6. Массовая доля водорастворимой золы, % 7. рН водной вытяжки 8. Содержание водорастворимых соединений железа ПАУ «Карболин» Норма по ГОСТ 4453-91 Тонкодисперсный порошок черного цвета, не содержащий посторонних включений 281,25 Не менее 210 113 Не менее 100 2,55 5,0 Не более 6 Не более 58 0,7 Не более 1,0 3,9 4-6 отсутствие отсутствие Анализ полученных результатов показывает, что образец имеет высокую адсорбционную активность по мелассе и метиленовому голубому. Порошкообразный активный уголь марки «Карболин» может быть использован в крахмалопаточной промышленности на стадии адсорбционной очистки паточных и глюкозных сиропов. 3.5.3 Испытание ПАУ «Карболин» в производстве водки Одной из современных технологий производства водки является обработка водноспиртовой смеси порошковым активным углем, так называемая технология «Полтовчанка». Характеристика представленных для исследования в этом процессе ПАУ «Карболин» приведена в таблице 3.11 и акте испытаний, приведенном в приложении Е. Наибольшая активность по йоду и МГ отмечена для ПАУ «Карболин» из ГЛ, но в нем содержится наибольшее количество влаги. Активный уголь РНОМ 200 из скорлупы кокоса имел несколько меньшую активность по адсорбции йода и МГ, содержание водорастворимой золы и влаги в нем меньше. Адсорбционная активность по йоду и метиленовому голубому АУ МеКС 0 из косточек абрикоса ниже, а содержание кислоторастворимой золы выше, чем в двух других адсорбентах. 112 Таблица 3.11 - Сравнительные результаты исследования АУ Наименование показателя 103; 105* Марка угля МеКС 0 Косточка абрикоса 90; 95* 246 2,3 0,5 1,5 0,3 18 206 5,0 0,8 6,0 5 РНОМ 200 Исходное сырье Скорлупа кокоса Адсорбционная активность по йоду, % Адсорбционная активность по метиленовому голубому, мг/г Содержание золы, % Зола водорастворимая, % Зола кислоторастворимая, % Массовая доля воды, % Остаток на сите 0,1 мм, % Карболин ГЛ 118; 118* 363 2,6 1,3 1,2 5,6 1 *Данные ГНУ ВНИИПБТ В образцах водно-спиртовой жидкости проводили газохроматографический анализ и органолептический анализ. Определяли жесткость, щелочность, величину рН и содержание микроэлементов. Результаты анализов представлены в таблице 3.12. Таблица 3.12- Результаты анализа водно-спиртовой жидкости Определяемый показатель Исходная сортировка После обработки активным углем РНОМ 200 МеКС 0 Карболин Физико-химический анализ Жесткость, ºЖ 0,02 0,02 0,02 Щелочность, объем соляной 0,05 0,1 0,1 кислоты с концентрацией (НСl) = 0,1 н моль/дм3, израсходованный на титрование 100 см3 водки, см3 Окисляемость по Лангу, мин. 9,5 10,0 12,3 Разность в окисляемости, мин. 0,5 2,8 Водородный показатель рН 6,7 7,0 7,2 Массовая концентрация, мг/дм3: - железа (общего) следы следы следы - сульфатов следы 2,2 2,0 - хлоридов 3,0 3,5 3,6 - силикатов 0,4 0,4 0,45 Газохроматографический анализ Массовая концентрация, мг/дм3 в 1 дм3 безводного спирта: уксусного альдегида 1,0 1,8 1,9 2-пропанола 0,62 0,62 0,62 Объемная доля метилового спирта в пересчете на безводный спирт, % 0,0020 0,0020 0,0020 Органолептический анализ Дегустационная оценка, балл 9,2 9,35 9,45 Разность в дегустационной оценке, балл 0,15 0,25 0,02 0,05 11,2 1,7 7,1 следы 2,0 3,7 0,4 1,9 0,62 0,0020 9,42 0,12 Исходная сортировка имела жесткость 0,02 ºЖ; щелочность 0,1 см3 0,1 н раствора HCl на 100 см3; окисляемость по Лангу 9,5 мин.; величину рН 6,7. Содержание 113 микроэлементов в ней составляло (мг/дм3): железа и сульфатов − следы; хлоридов − 3,0; силикатов − 0,4. После обработки во всех образцах увеличивалась щелочность от 0,05 до 0,1 см3 0,1 н раствора HCl на 100 см3 и величина рН от 6,2 до 7,0-7,2, что свидетельствует о «щелочных» свойствах активных углей. Для углей отмечено незначительное увеличение содержания сульфатов и хлоридов. Разность в окисляемости между сортировкой после обработки увеличилась на 0,52,8 минут, лучшая − 2,8 минут отмечена для активного угля МеКС 0, но и для ПАУ «Карболин» она достаточно высока − 1,7 минут. По результатам газохроматографического анализа: содержание 2-пропанола и метилового спирта после обработки не изменилось, концентрация уксусного альдегида увеличилась на 0,8-0,9 мг/дм3 в пересчете на безводный спирт. Обработка наноструктурными углеродными материалами позволила улучшить органолептические показатели, дегустационные баллы увеличились на 0,12-0,25 балла. Таким образом, ПАУ «Карболин» может быть рекомендован для обработки водно-спиртовых растворов при производстве водки по технологии «Полтовчанка». 3.6 Выводы по экспериментальной части 1. Углеродные адсорбенты, получаемые термохимической активацией гидролизного лигнина с NaOH, в 2-4 раза превосходят по своим адсорбционным свойствам промышленно выпускаемые активные угли на предприятиях России. 2. Экспериментально доказано, что при синтезе активированного угля возможно использовать ГЛ из отвалов, причем его предварительное измельчение перед смешением с активирующим агентом и сушка реакционной смеси не оказывают влиянии на адсорбционные свойства. 3. Предварительная карбонизация (предпиролиз), приводящая к уменьшению содержания элементного кислорода в гидролизном лигнине, позволяет увеличить выход углеродных адсорбентов почти на 40 % и снизить расход гидроксида натрия, и является одним из факторов регулировании пористой структуры и адсорбционных свойств. 4. С использованием методов планированного эксперимента определено влияние режимных параметров на значение коэффициентов в уравнениях Фрейндлиха и Лэнгмюра при адсорбции из растворов метиленового голубого и йода, что позволяет прогнозировать их адсорбционные свойства. 5. На основании данных низкотемпературной адсорбции азота экспериментально определено, что удельная поверхность углеродных адсорбентов, полученных из гидролизного лигнина в оптимальных условиях синтеза, достигает 1600 м2 по БЭТ, а пористая структура представлена на 90% супермикропорами. 114 6. Результаты независимой экспертизы одного из образцов полученного активного угля показали, что он соответствует мировым аналогам, используемых при изготовлении суперконденсаторов и в некоторых областях пищевой промышленности. 115 4 ТЕХНОЛОГИЧЕСКАЯ ЧАСТЬ 4.1 Технология синтеза активного угля методом термохимической активации в присутствии NaOH Результаты проведённых лабораторных исследований позволили разработать технологическую схему производства порошкообразного активированного угля из гидролизного лигнина методом термохимической активации в присутствии NaOH. Процесс получения активных углей является непрерывным. Основные стадии процесса представлены на блок-схеме (рисунок 4.1): Теплоноситель Теплоноситель Сырьё Предпиролиз Угольсырец HCl Термохимическая активация Блок смешения Вода Отработанные ДГ Отмывка Сушка Уголь Теплоноситель Зелёный щелок на регенерацию Формирование теплоносителя Парогазы NaOH Парогазы Воздух Мазут Рисунок 4.1 – Блок-схема процесса производства активного угля из ГЛ методом ТХА в присутствии NaOH Аппаратурное оформление приведённой блок-схемы представлено на рисунке 4.2. Разработанная технологическая схема действует следующим образом. Исходное сырьё из бункера сырья (БС) ленточным питателем (ЛП1) подаётся на сушку в сушильную установку со встречными струями (СВС). Сушка сырья осуществляется в течение 3 часов при температуре 105°С. Подсушенное до влажности 10 % сырьё ленточным питателем (ЛП2) подается на предварительную термическую обработку при температуре 4500С в барабанную печь (БП) с внешним нагревом. Полученный на стадии предпиролиза уголь-сырец загружается в бункер углясырца (БУС), откуда секторным дозатором Д1 направляется в смеситель С1, туда же насосом-дозатором (НД2) из отделения регенерации ОР подается концентрированный водный раствор NaOH при расходе 1,3 г/г. Реакционная масса насосом-дозатором НД1 перекачивается в реактор непрерывного действия Р для термообработки. Реактор представляет собой две стандартные колосниковые решетки для топки котельной установки, оборудованные специальным коробчатым покрытием. Первоначально происходит интенсивная сушка реакционной массы, а затем пиролиз и активация. Парогазовые продукты, 116 выделяющиеся при термообработке, сжигаются в верхней части реактора Р, для чего подается необходимое количество воздуха. Активный уголь с чешуйчатых решеток поступает в приемник угля ПУ, туда же подается вода для отмывки и охлаждения угля. Приемник угля оборудован мешалкой, необходимой для гомогенизации угольной суспензии. Из приемника угля угольная суспензия насосом Н1 направляется на ленточный вакуум-фильтр ВФ, где активный уголь проходит пять ступеней отмывки от минеральной части. Промывка угля осуществляется противотоком. На третью ступень отмывки подается вода, а промывные воды отбираются в бак и насосом перекачиваются на вторую ступень, откуда промывные воды снова отбираются в бак и насосом направляются на первую ступень отмывки. Таким образом, щелок укрепляется и поступает в отдел регенерации ОР. На четвертую ступень отмывки насосом Н4 подается раствор 0,5н соляной кислоты с гидромодулем 10. Кислота необходимой концентрации готовится в смесителе С2, куда поступает концентрированная кислота и вода. На пятую ступень подается вода для отмывки угля от кислоты. Кислые промывные воды с четвертой и пятой ступени объединяют и направляют на нейтрализацию. Промытый активный уголь поступает на сушку в барабанную сушилку БС с внешним нагревом. Высушенный уголь с влажностью 10% поступает на упаковку и складируется. На этом заканчивается технологическая цепочка движения сырья и продукта. Технологическая цепочка по газо-воздушному тракту начинается с отбора дымовых газов процесса активации, которые направляются на сушку исходного лигнина и на его предварительную термообработку. Расход дымовых газов регулируется задвижками З3 и З6. Необходимая скорость теплоносителя в разгонных трубах СВС достигается за счет инжектированиярециркулирующих отработанных дымовых газов. Отработанные дымовые газы процесса предварительной термообработки сырья направляются на поддержание теплового режима сушки активного угля. Тепловой режим активации осуществляется за счет сжигания в верхней части реактора парогазов активации и парогазов предварительной термообработки сырья. Парогазы предпиролиза подаются в реактор газодувкой. Отработанные дымовые газы дымососом В5 выводятся через дымовую трубу. В соответствии со схемой (рисунок 4.1) составлены материальные и тепловые балансы процесса синтеза углеродных сорбентов, результаты которого приведены ниже. Параметры процесса синтеза на начальной стадии были получены на основании проведённых оценок, в итоге приняты следующие значения: расход исходного сырья – 3280 кг/ч; температура сырья – 20оС; расход раствора щёлочи – 5664 кг/ч. 117 Д4 З5 ВР2 В2 Д2 Д1 БК Д5 З2 ВР1 В5 В3 З1 ЛП 1 ЛП 2 З4 ВР4 В4 БУС Д1 Ц ВР6 ВР7 ВР8 ВР9 ВР10 З3 ВЗ8 ВФ Щ2 ВР3 УС1 НД 1 С1 БП СВС В6 В Р Н3 ПУ ВЗ4 БС ВЗ7 ВЗ3 Д2 Н1 ВР5 К2 З1 Н2 ОР Щ1 ВЗ5 ВЗ 1 С2 ВР11 Н4 ВР12 Активный уголь на склад ВР13 НД 2 В1 К1 К1 К2 К2 В В Рисунок 4.2 – Технологическая схема производства угля из гидролизного лигнина методом ТХА в присутствии щёлочи В – вода; ПГ – парогазы; РМ – реакционная масса; УС1 – угольная суспензия; УС – уголь-сырец; Щ1 – щёлок 60%-ный; Щ2 – слабый щёлок; Щ3 – щёлок; К1 – кислота концентрированная; К2 – кислота слабая; К3 – кислота промывная; ВД – воздух; ДГ1 – дымовые газы 12200С; ДГ2 – дымовые газы 7380С; ДГ3 – дымовые газы 5180С; ДГ4 – дымовые газы 700С; ДГ5 – дымовые газы в атмосферу. 118 Характеристики гидролизного лигнина: зольность сырья в расчете на сухую массу Aс = 3,9 %; влажность W = 70 %; выход летучих веществ в расчете на органическую массу Vdaf = 63,4 %. Элементный состав по основным компонентам был следующий (масс. % на абсолютно сухое беззольное вещество): углерод – 60; водород – 7; кислород – 33 %. Перед стадией предпиролиза происходит высушивание сырья до влажности W = 10 %. На стадии предпиролиза осуществляется испарение остаточной влаги и частичное выгорание органической части сырья, которые переходят в парогазы и подаются на формирование теплоносителя перед стадией пиролиза в количестве 637,5 кг/ч. Выход угля-сырца после стадии предпиролиза 548кг/ч. Его состав следующий: углерод – 76,1; водород – 4,9; кислород – 19,0 %. Для поддержания температуры предпиролиза на уровне 450 оС в зону нагрева необходимо подводить около7516 МДж тепла (таблица 4.1). Тепло с теплоносителем на предпиролиз приходит после стадии активации, при этом температура теплоносителя 738оС. Таблица 4.1 – Тепловой баланс процесса предпиролиза Приход 1. Тепло с сырьём, в т.ч. 2. С ТН Итого МДж 21939,0 7515,5 % Расход 74,5 1. С углём-сырцом, в т.ч. 25,5 2. С отработанным ТН 3. На испарение влаги 4. С парогазами 5. Теплопотери 29454,5 100,00 Итого МДж 15749,6 741,2 7471,3 5116,3 376,2 29454,6 % 53,5 17,4 2,5 25,4 1,2 100,00 Отработанный теплоноситель после предпиролиза с температурой 518оС поступает на сушку синтезируемого угля. Далее по технологической цепочке к полученному после предпиролиза углюсырцу добавляют раствор NaOH и полученную смесь с температурой 98,40С направляют на стадию термохимической активации, при этом расход смеси уголь-сырец и NaOH оставит 2664,4 кг/ч (таблица 4.2). Таблица 4.2 – Материальный баланс процесса пиролиза Приход 1.Реакционная смесь, в т.ч.: а.с.вещества NaOH вода Итого кг/ч 2664,4 548,3 1222,7 846,4 Расход 1. Угольный остаток в т.ч.: органическая часть NaOH Na2CO3 зола 2. Парогазы, в т.ч. сухие парогазы испарённая влага 2664,4 100,0 Итого % 100 21,6 46,4 32,0 кг/ч 1705,1 258,6 567,4 272,5 606,6 959,3 112,9 846,4 2664,4 % 63,6 9,8 29,7 13,0 11,1 36,4 4,3 32,1 ,77 100,00 119 Теплота для поддержания температуры термохимической активации на уровне о 750 С вводится непосредственно в реакционную зону нагретым теплоносителем (смесью парогазов после предпиролиза и ТХА с добавлением воздуха). Часть тепла поступает в реакционную зону со смесью (таблица 4.3). Таблица 4.3 – Тепловой баланс процесса пиролиза Приход 1. Тепло с РМ 2. С ТН МДж 15870,9 13964,5 Итого 29835,4 % Расход 53,20 1. Тепло с угольным остатком 46,80 2. С отработанным ТН 3. На испарение влаги 4. С парогазами 5. Тепло химическихреакций 6. Теплопотери 100,0 Итого МДж 11584,115,5 7515,5 2856,3 7088,5 -1,4 793,8 29836,8 % 38,7 25,2 9,6 23,8 0,00 2,7 100,0 Теплоноситель для пиролиза формируется в соответствии с материальным балансом приведённым в таблице 4.4: Таблица 4.4 – Материальный баланс стадии формирования теплоносителя Приход 1.ПГ предпиролиза 2.ПГ с пиролиза 3.Воздух Итого кг/ч 392,2 112,9 5106,0 5611,1 % 6,99 2,01 91,00 100,00 Расход 1.ДГ от сжигания ПГ кг/ч 5611,1 % 100,00 Итого 5611,1 100,00 Парогазы приходят на сжигание после пиролиза и предпиролиза следующего элементного состава (таблица 4.5): Таблица 4.5 – Элементный состав парогазов Компонент С Н О Итого кг/ч 301,9 57,9 293,8 653,6 % 46,19 8,86 44,95 100,0 Для сжигания парогазов требуется кислород: кислород на реакцию с углеродом С + О2 = СО2: кг/ч кислород на реакцию с водородом ½ Н + О2 = Н2О: кг/ч Следовательно, для сжигания парогазов требуется 1268,3 кг/ч кислорода. Согласно таблице 4.4, содержащегося кислорода в парогазах недостаточно для сжигания, поэтому необходимо дополнительно подавать 974,5 кг/ч кислорода. Для этого на сжигание парогазов подают 5106,0 кг/ч воздуха, который содержит 1072,3 кг/ч дополнительного кислорода. 120 Состав и количество компонентов теплоносителя определяется из уравнений соответствующих реакций и приведёно в таблице 4.6. Таблица 4.6 – Состав, образующегося теплоносителя Состав СО2 Н2О О2 N2 Итого Количество Плотность кг/ч м3/ч % об. 1107,0 563,6 8,42 1790,7 2227,3 33,25 974,7 682,6 10,19 4033,6 3224,3 48,14 7906,0 6697,8 100,00 Теплоемкость смеси кг/м3 1,964 0,804 1,428 1,251 Теплоёмкость, кДж/м3∙К при температуре 450 700 900 1000 1,898 2,090 2,171 2,205 1,556 1,642 1,697 1,724 1,386 1,435 1,466 1,479 1,313 1,355 1,381 1,393 1,496 1,540 1,583 1,603 Таким образом, для поддержания теплового режима в реактор подаётся 6697,8 м /ч теплоносителя. 3 Таблица 4.7 – Тепловой баланс стадии формирования теплоносителя Приход 1. С ПГ предпиролиза 2. С ПГ пиролиза 3. С воздухом Итого МДж 7471,3 7088,5 102,5 14662,3 % 51,8 47,5 0,7 100,0 Расход 1. ДГ 2. Теплопотери МДж 13964,5 697,9 % 95,24 4,76 Итого 14662,4 100,00 Тепло, уходящее с дымовыми газами: Q= G ТН (1 % ттеплопот рь от т - ла ДГ) Теплопотери при формировании теплоносителя составляют 5 % от тепла дымовых газов. Температура, образующихся дымовых газов: Q = VДГ * сДГ * tДГ tТН = 12210С. Полученный в результате пиролиза уголь в количестве 1705 кг/ч подаётся на отмывку, где он промывается 9441 кг/ч воды. На стадии отмывки из угля вымываются натриевые соли и часть минеральных веществ угля, при этом образуется 9840,5кг/ч щёлока. Выход отмытого угля составляет 1306,4 кг/ч. Таблица 4.8 – Тепловой баланс стадии отмывки угольного остатка Приход 1.С неотмытым углем 2.От растворения солей 3.С водой 4. С кислотой Итого МДж 7192,0 3108,4 2139,6 968,7 13409,0 % 53,63 23,18 15,96 7,23 100,0 Расход 1.С отмытым углем 2.Со щелоком 3. С кислой водой 4. Теплопотери Итого МДж 1601,7 10650,2 889,7 268,0 13409,6 % 11,94 79,43 6,63 2,00 100,0 121 Завершает процесс синтеза углеродных сорбентов стадия сушки отмытого угля. При этом из угля испаряется 828 кг/ч влаги. Выход высушенного угля составляет 246 кг/ч, из которого 10 % –влажность угля и 0,9 % – его зольность. На основании сделанных расчетов был осуществлен подбор оборудования для технологического процесса. В таблице 4.9 представлены параметры рекомендуемой газодувки ТВ-125-2,0-В2. Таблица 4.9 – Параметры газодувки Характеристики газодувки производительность 120 м3/ч напор 2,0 кгс/см2 число оборотов 48,3 с-1 Характеристики электродвигателя тип BAO2-450LA2У2 мощность 315 кВт КПД 0,92 Для фильтрования угля используем вакуумный ленточный фильтр с ножевым съемом осадка. Принимаем, что удельная производительность фильтра равна 40 кг/м3 в час. Расход угля 1035 кг/час. Типоразмер фильтра ЛОП10-7К-0,1 со следующими характеристиками: Площадь поверхности фильтрования 40 м2 Ширина ленты 950 мм Масса фильтра с приводами 16750 кг Рабочее давление 0,05МПа Установленная мощность 6,3 кВт Скорость движения ленты 0,066-0,156 м/с Исполнение Ст3сп5, 12Х18Н10Т Характер процесса разделение с промывкой Габаритные размеры 15535×1950×2330 мм Затем отмытый уголь высушивается в барабанной сушилке с внешним нагревом дымовыми газами. В соответствии с расчетом вместимости барабана (13 м3) и его диаметра (1,4 м), типовую сушильную камеру выбираем по каталогу: Диаметр 1400 мм. Толщина стенки барабана 8 мм. Нагрузка на бандаж 25 тс. Скорость вращения барабана 1,6/2/3,15 Мощность электродвигателя 9кВт Тип редуктора ГТС Электродвигатель серии АО2. Очистка газов, участвующих в технологическом процессе осуществляется в циклоне. Всего газов через циклон проходит 6697,8 м3/ч. Подбираем циклон типа ЦН – 15 – 800*1УП [192]. Его характеристики будут следующими: Производительность 5800-6740 м3/ч Скорость газов в циклоне 3,5 м/с Рабочий объем бункера 0,205 м3 122 В соответствии с предложенной технологической схемой и сделанными расчетами был произведен расчет технико-экономических показателей производства предложенных углеродных адсорбентов, полученных методом термохимической активации. Затраты, образующие себестоимость продукции, группируются по элементам: - материальные затраты; - затраты на оплату труда и отчисления на социальные нужды; - амортизация основных фондов и прочие затраты. В планируемом производстве активного угля эффективное время работы основного технологического оборудования составляет 340 дней или 8160 часов. Производство работает круглосуточно в две смены. Расчет численности и тарифного фонда заработной платы рабочих представлен в таблице 6.1. Таблица 6.1. – Расчет численности и тарифного фонда заработной платы рабочих. Профессия Основные рабочие 1.Аппаратчик реактора (печи) 2.Аппаратчик узла промывки АУ 3.Аппаратчик промывки дымовых газов 4.Аппаратчик узла сушки АУ 5.Аппаратчик по обслуживанию насосов 6. Упаковщик Итого Вспомогательные рабочие 1.Дежурный персонал 1.1 Электромонтер 1.2.Слесарь 1.3.Дежурный по КИПиА Итого 2. Ремонтный персонал 2.1 Электромонтер 2.2 Слесарь Итого Всего Количество, чел В списочн смену ое Разряд, условия труда Тарифная ставка за час, руб Отрабо тано чел/ч Тарифный фонд зар.платы. тыс.руб. 1 5 VI –ТВ 51,7 8480 438,4 1 5 V– ТВ 47,1 8480 399,4 1 5 V– ТВ 47,1 8480 399,4 1 5 V –ТВ 47,1 8480 399,4 1 5 V –ТВ 47,1 8480 399,4 2 7 10 35 IV –ТВ 44,7 8480 59360 758,1 2794,1 1 1 1 5 5 5 VI –ТВ V –ТВ VI –ТВ 51,7 47,1 51,7 8480 8480 8480 438,4 399,4 438,4 3 15 25440 1276,2 2 2 4 14 3 3 6 56 4824 4824 9648 94448 227,1 227,1 454,2 4524,5 V – ТВ V – ТВ 47,07 47,07 123 Таблица 6.2. – Расчет годового фонда заработной платы рабочих, тыс. руб. Основные рабочие Показатели 1. Тарифный фонд зар.платы 2. Доплаты к тарифному фонду зар.платы 2.1 Премии для основных рабочих 2.2 Премии для вспомогательных рабочих 2.3. За ночное и вечернее время 2.4. За работу в праздничные дни 3. Доплата по районному коэффициенту 4. Северная надбавка 5. Основная заработная плата 6. Дополнительная зар.плата 7. Годовой фонд зар.платы. 2794,1 1271,3 Вспомогательные рабочие Дежурный Ремонтный персонал персонал 1276,2 454,2 516,8 90,8 255,2 90,8 494,6 78,2 225,9 35,7 0 0 813,1 358,6 109,0 2032,7 6911,2 1333,9 8245,1 896,5 3048,1 588,3 3636,4 272,5 926,5 189,0 1115,5 698,5 Время работы в ночную и вечернюю смены принимаются в размере 59% от планируемого рабочего времени. Таблица 6.3. – Расчет заработной платы служащих Должность 1. Руководители Начальник участка Мастер смены ИТОГО 2.Специалисты Механик Электрик Экономист ИТОГО 3. Служащие Лаборант Учетчик Уборщица ИТОГО ВСЕГО Заработная плата за месяц, руб Сев. Усл. Район НадИтого Труда коэф. бавка Годовой фонд, тыс.руб 35000 23000 58000 4600 4600 7000 5520 12520 17500 13800 31300 59500 46920 106420 714,00 2252,16 2966,16 1 1 1 3 14500 14000 15000 43500 2900 2800 – 5700 3480 3360 3000 9840 8700 8400 7500 24600 29580 28560 22550 83640 355,0 342,7 306,0 1003,7 4 2 2 8 16 9000 15000 5000 29000 130500 1800 1000 2800 7400 2160 3000 1200 6360 28720 5400 7500 3000 15900 71800 18360 25500 10200 54060 244120 881,3 612,0 244,8 1738,1 5708,0 Количество, чел. Оклад 1 4 5 В себестоимость продукции входят амортизационные отчисления и затраты на текущий ремонт. Распределение стоимости основных фондам по видам отчислений на амортизацию и текущий ремонт приводится в таблице 6.4 124 Таблица 6.4 – Расчет стоимости оборудования Виды оборудования Смесители, 2 шт. Реактор Вакуум–фильтр Сушилка Сушилка со встречными струями Барабанная печь Циклон, 2 шт Мультициклон Вспомогательное оборудование ИТОГО Масса, кг 700 15960 9950 14000 10980 12850 1600 1940 21080 89060 Цена, тыс. руб. 1250,0 12820,0 1550,0 7485,0 10750,0 9540,0 650,0 1250,0 2760,0 48055,0 При вычислении калькуляционных затрат на себестоимость учитываются расходы на содержание и эксплуатацию оборудования, а также цеховые расходы. Группировка затрат по статьям расхода применяется в промышленности для конкретного определения путей снижения себестоимости. Таблица 6.5 – Расчет капитальных вложений Виды капитальных вложений 1. Покупная стоимость оборудования 2. Транспортные расходы 3. Стоимость КИПиА 4. Стоимость технологических трубопроводов 5. Прочее неучтенное оборудование 6. Монтажные работы 7. Аренда зданий ИТОГО % – 7 8 10 20 15 – тыс. руб. 48055,0 3360,9 3844,4 4805,5 9611,0 7208,3 5000 81885,1 Таблица 6.6 – Смета расходов на содержание и эксплуатацию оборудования Статьи затрат 1. Амортизация оборудования 2. Эксплуатация и текущий ремонт оборудования – зарплата (основная и дополнительная) дежурного и ремонтного персонала – услуги ремонтных и строительных цехов 3. Прочие расходы ИТОГО Сумма, тыс. руб. 14416,5 3287,3 4751,9 5259,6 768,9 28484,2 Таблица 6.7 – Смета цеховых расходов Статьи затрат 1.Содержание цехового персонала 2.Расходы на опыты, научные исследования* 3.Расходы по охране труда** 4.Прочие расходы ИТОГО Сумма, тыс. руб. 7192,1 82,5 654,7 39,6 7968,9 * Расходы на опыты и научные исследования рассчитываются как 1% от фонда заработной платы основных рабочих. 125 ** Расходы по охране труда рассчитываются как 3,5% от фонда заработной платы всех работников цеха. Таблица 6.8 – Расчёт материальных затрат Наименование Активированный уголь 1. Гидролизный лигнин 2. Гидроксид натрия 3. Соляная кислота 3. Электроэнергия, кВт 4. Вода техническая, м3 5. Вода чистая, м3 6. Упаковка Итого Колво прод., т 2000 Норма расхода, т Кол–во на год,т Цена тыс. руб/т Стоимость за год, тыс. руб. 3,98 5,174 0,134 10 45 5 0,1 7960,0 10348,0 268,0 20000 90000 10000 100 1,0 32 7,5 4,0 0,016 0,04 0,7 7960,0 331136,0 2010 80000 1440 400 70 423016,0 Отработанный гидроксид натрия после отмывки направляется в цех каустизации и регенерации и используется для приготовления дополнительного продукта – белого щёлока. Следовательно, затраты на свежий гидроксид натрия сократятся на 80 %, но при этом увеличатся затраты на регенерацию щелочи и будут составлять 8000 тыс. руб/год. Соляная кислота, используемая для отмывки АУ, на 50 % будет использоваться повторно. Таблица 6.9 – Калькуляция себестоимости Статьи затрат Гидролизный лигнин Гидроксид натрия Соляная кислота Электроэнергия Вода техническая Вода чистая Упаковочный материал Основная и дополнительная заработная плата производственных рабочих Расходы по содержанию и эксплуатации оборудования Расходы по очистке сточных вод Цеховые расходы Цеховая себестоимость Полная себестоимость на весь объем продукции Полная себестоимость на 1т. активного угля Сумма, тыс. руб. 7960,0 82784,0 1005,0 80000 1440 400 70 8245,1 28484,2 1648,2 7968,9 219935,4 220005,4 110,0 Прибыль на весь объем продукции (активного угля) рассчитывается как разность между ценой и себестоимостью продукции: 265000–110,0 ∙ 2000 =45000тыс. руб. 126 Таблица 6.10 – Основные технико–экономические показатели Показатели 1. Объем реализуемой продукции, тыс.руб. 2. Годовой объем производства, т. 3. Объем капитальных вложений, тыс. руб. 4. Себестоимость продукции, тыс.руб. 5. Валовая прибыль, тыс. руб. Фондоотдача, руб./руб. Налоги, тыс. руб. -налоги на прибыль -налоги на имущество - страховые взносы 6. Чистая прибыль, тыс. руб. 7. Срок окупаемости, лет Величина 265000 2000,0 81885,1 220005,4 45000 0,56 13530,8 10800 573,2 2157,6 31469,2 2,6 Срок окупаемости будет 2,6 года или 2 года 8 месяцев. На основании проведенных расчетов можно сделать вывод, что внедрение данного производства экономически оправдано. 127 ОСНОВНЫЕ ВЫВОДЫ 1. Углеродные адсорбенты, получаемые термохимической активацией гидролизного лигнина с NaOH, в 2-4 раза превосходят по своим адсорбционным свойствам промышленно выпускаемые активные угли на предприятиях России. 2.Экспериментально доказано, что при синтезе активированного угля возможно использовать ГЛ из отвалов, причем его предварительное измельчение перед смешением с активирующим агентом и сушка реакционной смеси не оказывают влиянии на адсорбционные свойства. 3.Предварительная карбонизация (предпиролиз), приводящая к уменьшению содержания элементного кислорода в гидролизном лигнине, позволяет увеличить выход углеродных адсорбентов почти на 40 % и снизить расход гидроксида натрия, и является одним из факторов регулировании пористой структуры и адсорбционных свойств. 4.С использованием методов планированного эксперимента определено влияние режимных параметров на значение коэффициентов в уравнениях Фрейндлиха и Лэнгмюра при адсорбции из растворов метиленового голубого и йода, что позволяет прогнозировать их адсорбционные свойства. 5.На основании данных низкотемпературной адсорбции азота экспериментально определено, что удельная поверхность углеродных адсорбентов, полученных из гидролизного лигнина в оптимальных условиях синтеза, достигает 1600 м2 по БЭТ, а пористая структура представлена на 90% супермикропорами. 6.Результаты независимой экспертизы одного из образцов полученного активного угля показали, что он соответствует мировым аналогам, используемых при изготовлении суперконденсаторов и в некоторых областях пищевой промышленности. 7.Разработана технологическая схема производства активных углей методом термохимической активации с гидроксидом натрия с использованием парогазов предпиролиза и активации для обеспечения теплового режима синтеза адсорбентов. Техноэкономические расчеты подтверждают экономическую целесообразность организации синтеза активных углей по предлагаемой технологии в расчете на 2000 т угля /год. 128 СПИСОК ЛИТЕРАТУРЫ 1 Будницкий Г.А. Углеродные волокна и материалы на основе вискозных волокон / Г.А.Будницкий, B.C.Матвеев, М.Е.Казаков // Химические волокна. -1993. - №5. - С. 1922. 2 Bansal R.C. Activated carbon adsorption / R.C.Bansal, M.Goyal. – USA: Taylor & Francis Group. - 2005. – 520 p. 3 Беляев Е.Ю. Получение и применение древесных активированных углей в экологических целях // Химия растительного сырья. – 2000. - №2. - С. 5–15. 4 Кинле Х. Активные угли и их промышленное применение / X.Кинле, Э.Бадер; Пер. с нем. Т. Б. Сергеевой – Л.: Химия. Ленинградское отделение, 1984. – 215 с. 5 Мухин В.М. Производство и применение углеродных адсорбентов: учеб. пособие / В.М.Мухин, В.Н. Клушин // М.: Российский химико-технологический университет им. М.В.Менделеева, 2012. – 308 с. 6 А.С. № 179294 СССР М. Кл. С 07 С 31/22 Способ очистки синтетического глицерина / Маркина Н.Г., Иванова Л.А., Малныкина М.И., Полковникова А.Г. (СССР). - 925769/23-04; заявлено 16.10.64; опубл. 23.02.78, Бюл. 11. – С. 2 7 Халецкий А.В. Сорбция красящих веществ из растворов пектина активированным углем / А.В.Халецкий, В.В.Котов, А.Л.Лукин // Воронежский государственный аграрный университет имени К.Д.Глинки, Воронеж. - 2009. Т. 9. Вып. 2 8 Dabrowski A. Adsorption-from theory to practice // Advances in Colloid and Interface Science. - 2001. - №93. – p.135–224. 9 Кузнецов Б.Н. Синтез и применение углеродных сорбентов // Соросовский образовательный журнал. –1999. – №12. – С. 29-34. 10 Яцевская М.И. Активные угли на службе у человека // Минск: о-во "Знание" БССР, 1983. – 21 с. 11 Олонцев В.Ф. Активные угли (получение и применение) / В.Ф.Олонцев, В.В.Олонцев. // Пермь: ГУ Перм. центр науч.-техн. информ., 2005. – 88 с. 12 Moreno-Castilla C. Adsorption of organic molecules from aqueous solutions on carbon materials // Carbon. – 2004. - №42. – p.83–94. 13 Смирнов А.Д. Сорбционная очистка воды. - Л: Химия, 1982. – 168 с. 14 Алексеев Л.П. Выбор эффективной марки активных углей / Л.П.Алексеев, В.Л. Драгинский, С.Я. Михеева и др. // Водоснабжение и санитарная техника. – 1995. – № 5. – С. 8-10. 15 Кельцев Н.В. Основы адсорбционной техники. - М.: Химия, 1984. – 592 с. 129 16 Когановский А.М. Очистка и использование сточных вод в промышленном водоснабжении / А.М.Когановский, Н.А.Клименко, Т.М.Левченко, Р.М.Марутовский, И.Г.Рода. – М.: Химия, 1983. – 288 с. 17 Родионов А.И. Технологические процессы экологической безопасности. Основы энвайронменталистики / А.И.Родионов, В.Н.Клушин, В.Г.Систер. - Калуга: Изд-во Н. Бочкаревой, 2000. – 800 с. 18 Измайлова М.Ю. Разработка суперконденсаторов с использованием ионной жидкости 1-метил – 3 – бутилимидазолий тетрафторбората: автореф. дис. на соиск. уч. степ. канд. техн. наук (05.17.03) // Рос. химико-технологич. унив-т. им. Д.И. Менделеева. – Москва, 2010. – 16 с. 19 Patent №2800616 A US, 2,8 OOt616. Low voltage electrolytic capacitor / Howard I Becker (US); filed April 14, 1954; issued Jul 23, 1957. 20 Patent 3288641 A US, Ser. No. 200,723 4 Claims (Cl. 136-6) Electrical energy storage apparatus / Robert A Rightmire (US); filed Jun 7, 1962; issued Nov 29, 1966. 21 Шорникова О.Н. Связующее для полимерных композиционных материалов: уч. пособие для студ. по спец. «Композиц. материалы» / О.Н.Шорникова, Н.В.Максимова, В.В.Авдеев. - Москва. - 2010. – 52 с. 22 Zhang Y. Progress of electrochemical capacitor electrode materials: a review / Y.Zhang, H.Feng, X.Wu, L.Wang, A. Zhang, T.Xia, H.Dong, X.Li, L.Zhang // Hydrogen Energy. 2009. - V.34. - p. 4889-4899. 23 Beguin F. Carbons for electrochemical energy storage and conversional systems / F.Beguin, E.Frakowiak // CRS Press. - 2010. - p. 518. 24 Pandolfo A.G. Carbon Properties and their role in supercapacitors / A.G.Pandolfo, A.F.Hollenkamp // The Journal of Power Sources. - 2006. - V.157 - p.11-27. 25 Frakowiak E. Carbon materials for the electrochemical storage of energy in capacitors / E.Frakowiak, F.Beguin // Carbon. - 2001. - V.39. - p. 937-950. 26 Патент №2160940 (RU) H01G9/155 Конденсатор с двойным электрическим слоем / А.И.Беляков, О.Г.Дашко, В.А.Казаров, С.А.Казарян и др. (РФ). - 99117170/09; заявлено 11.11.1997; опубл. 20.12.2000. 27 Patent № 4313084 (US) H01G9/08 Laminated structure of double-layer capacitor / M.Hosokawa, T.Kawamura, K.Sanada (JP). - 06/022982, filed Mar 03, 1979; issued Jan 26, 1982. 28 Патент №2185675 (RU) H01G009/04 Конденсатор с двойным электрическим слоем / В.И.Васечкин, Ю.М.Вольфкович, П.А.Шматко, Е.А.Ашмарин, О.Г.Дашко (РФ). 2000119106/09; заявлено 18.12.1997; опубл. 20.07.2002. 29 Patent №3210420 A1 (DE) H01G9/00 Electrochemical double-layer capacitor / Konrad Dr Mund, Helmut Freller (DE). – P 32 10 420.0; filed 22.03.1982; issued 22.09.1983. 130 30 Patent № 4697224 A (US) H01G9/155 Electric double layer capacitor / M.Maesaka, K.Watanabe (JP). – 60 – 245347; filed 23.10.1986; issued 29.09.1987. 31 Sekido S. Liquid Electrolyte Double-Layer Capacitor Gold Capacitor / S.Sekido, et al. // National Technical Report. - Apr. 1980. - vol. 26, iss. 2. - PP. 220-230. 32 Patent № WO1997007518 A1 (RU) H01G11/30 Capacitor with a double electrical layer / I.N.Varakin, A.B.Stepanov, V.V.Menukhov (RU) - PCT/RU1995/000171; filed 19.08.1995, issued 27.02.1997. 33 Ван Дриль И. Применение активных углей для очистки и рекуперации растворителей // Проспект фирмы «Norit Reseach». — Аммерефот, 1997. -14 с. 34 Патент №2463107 (RU) C01B031/16 Активированный уголь, импрегнированный кислотой, способы его получения и применения. / Кузуб Р. Юджин (CA), Так Дзин Квон (CA), Джонсон Ричард Л. (CA) - 2009110159/05; заявлено 23.08.2006, опубл. 23.09.2010. 35 Мухин В.М. Активные угли России / В.М.Мухин, А.В.Тарасов, В.Н.Клушин. – М.:Металлургия, 2000. - 352 с. 36 Кельцев Н.В. Исследование процесса очистки отходящих газов от паров ароматических углеводородов при повышенных температурах / Н.В.Кельцев, В.М.Мухин, В.Н.Глупанов // Сб. научн. тр. МХТИ им. Д.И. Менделеева. М. - 1979. вып. 9. - с. 12-22. 37 Yang R.T. Adsorbents: fundamentals and applications / R.T.Yang - Hoboken, New Jersey: John Wiley & Sons, Inc. – 2003. - 410 с. 38 Саврасова Ю.А. Углеродные адсорбенты на основе лигноцеллюлозных материалов / Ю.А.Саврасова, Н.И.Богданович, Н.А.Макаревич, М.Г.Белецкая // Лесной журнал. - 2012. - №1. - с. 107-112. 39 Masakatsu M. Rapid microwave pyrolysis of wood / M.Masakatsu, K.Harumi, T.Shikenobu, T.Kenji, A.Koji // J.Chem. Eng. Jap. – 2000. – vol. 33, iss. 2. – РP. 299-302. 40 Uraki Y. Preparation of activated carbon from peat / Y.Uraki, Y.Tomai, M.Ogawa, S.Gaman, S.Tokura // BioResources. – 2009. - №4 (1) – PP. 205-213. 41 Viswanathan, B. Methods of activation and specific applications of carbon materials / B.Viswanathan, P.Indra Neel, T.K.Varadarajan // Indian Institute of Technology Madras. 2009. - p. 160. 42 Mingbo Wu. Preparation of porous carbons from petroleum coke by different activation methods / Wu Mingbo, Qingfang Zha, Jieshan Qiu, Xia Han, Yansheng Guo, Zhaofeng Li, Aijun Yuan, Xin Sun // Fuel. – 2005. – 84, 14-15. – p. 1992 – 1997. 43 Juma M. Pyrolisis and combustion of scrap tire / M.Juma, Z.Koreňová, J.Markoš, J.Annus, Ľ.Jelemenský // Petroleum & Coal. – 2006. - 48(1). – p. 15-26. 44 Чесноков Н.В. Углеродные адсорбенты из гидролизного лигнина для очистки сточных вод от органических примесей / А.О.Еремина, В.В.Головина, Н.В.Чесноков, 131 Б.Н.Кузнецов // Journal of Siberian Federal University; Chemistry. – 2011. – № 1 (4) – с. 100-107. 45 Медведев А.В. Разработка метода электродуговой пиролизной утилизации осадков сточных вод городских очистных учреждений: автореф. диссерт. на соискание уч. ст. канд. техн. наук (25.00.36) // Тюменский государственный нефтегазовый университет. - Тюмень, 2003. – 24 с. 46 Кузнецова Л.Н. Пиролиз осадков сточных вод ЦБП с получением органоминеральных адсорбентов для очистки промышленных стоков: автореф. диссерт. на соискание уч. ст. канд. техн. наук (05.21.03) // Архангельский государственный технический университет. - Архангельск, 2000. – 20 с. 47 Богданович Н. И. Пиролиз осадков, содержащих активный ил, с получением органоминеральных адсорбентов для очистки жидких и газовых выбросов / Н.И.Богданович, Л.Н.Кузнецова // Менеджмент экологии. Мат-лы конф. «Экология-99». – Вологда, Вологодский ГТУ. - 1999. – С. 50-53. 48 Bogdanovich N. Pyrolysis of Biomass Waste to Produce Sorbents with Specific Properties / N. Bogdanovich, Т. Osadchaya, G. Dobele et. al. // Power Production from biomass with Special Emphasis on Gasification and Pyrolysis. - Finland ESPOO. – 1996. – P. 295-299. 49 Вайсман Я.И. Исследования физико-химических свойств и термической деструкции отходов нефтеперерабатывающих предприятий / Я.И.Вайсман, И.С.Глушанкова, Л.В.Рудакова, М.С.Дьяков // Научные исследования и инновации. 2010. - T. 4, № 3 – С.21-24. 50 Патент № 2225754 (РФ) B01J20/00 Сорбент для очистки нефтесодержащих промышленных стоков и способ его получения / Биктимиров А.Ф., Сармин И.А. (РФ) 2001112085/15; заявлено 03.05.2001; опубл. 20.03.2004. 51 Суровикин В.Ф. Новые гемо- и энтеросорбенты на основе нанодисперсных углерод-углеродных материалов / Л.Г.Пьянова, Л.С.Лузянина // Рос. хим. ж. (Ж. Рос. хим. об-ва им. Д.И.Менделеева). – 2007 - т. LI, №5. – С. 159-165. 52 Патент № 2456236 (РФ) C01B 31/08 Способ получения сорбента органических соединений / Жежера Н.И., Самойлов Н.Г. (РФ) - 2011104769/05; заявлено 09.02.2011; опубл. 20.07.2012. 53 Трошина Е.А. Изучение сорбционных характеристик твёрдого остатка пиролиза шин / Е.А.Трошина, О.Ю.Пичахчи // Экологические проблемы индустриальных мегаполисов: Труды II международной научно-практической конференции. – М.: МГУИЭ, 2005. – С. 129 – 130. 132 54 Новичков Ю.А. Исследование процесса бескислородного пиролиза изношенных автомобильных шин / Ю.А.Новичков, Т.В.Петренко, В.И.Братчун // Вестник Харьковского Национального Автомобильно-дорожного Университета. – 2005. - №29. 55 Рощина Т.М. Адсорбционные явления и поверхность / Т.М.Рощина // Соросовский Образовательный Журнал. - 1998. - №2. - С. 89-94. 56 Бельчинская Л.И. Природозащитные технологии обезвреживания и утилизации отходов мебельных производств / Л.И. Бельчинская. - Воронеж: Воронеж. гос. лесотехн. акад., - 2002. - 209 с. 57 Новикова Л.А. Поверхностные характеристики нового углеродного сорбента на основе карбамидоформальдегидной смолы / Л.А.Новикова, Л.И.Бельчинская, Н.Т.Картель и др. // Материалы IV международной конференции «Сорбенты как фактор качества жизни и здоровья», Белгород. – 2012. – С. 117-122. 58 Новиков О.Н. Сорбенты на основе сополимеров дивинилбензола с производными фумаровой и малеиновой кислот: автореф. диссерт. на соискание уч. степ. канд. химич. наук (02.00.06) // Иркутский Государственный Университет. – Иркутск, 2000. – 17 с. 59 Николаев В.Г. Гемосорбция на активированных углях / В.Г.Николаев, В.В.Стрелко.– К.: Наукова думка, 1979. – 406 с. 60 Ивахнюк Т.Г. Зависимость пористой структуры углеродных адсорбентов от условий пластификации исходной резольной фенолформальдегидной смолы / Т.Г.Ивахнюк, Л.Б.Севрюгов, Т.Г.Плаченов // Получение, структура и свойства сорбентов: Межвуз. сб. науч. тр. – Л.: ЛТИ им. Ленсовета, 1977. – С. 19-25. 61 Гордон Л.В. Технология и оборудование лесохимических производств Учебник для техникумов. 5-е изд., перераб. / Л.В. Гордон, С.О.Скворцов, В.И Лисов. — М.: Лесн. пром-сть. - 1988— 360 с. - М., 1988, 357с. 62 Кузьмина Р.И. Пирогенетическая переработка некоторых древесных отходов и отходов лущения семян / Р.И.Кузьмина, С.Н.Штыков, К.Е.Панкин, Ю.В.Иванова, Т.Г.Панина // Химия растительного сырья. – 2010. - №3. – С. 61-65. 63 Кузнецов Б.Н. Актуальные направления химической переработки возобновляемой растительной биомассы / Б.Н.Кузнецов // Химия в интересах устойчивого развития. – 2011. - №19. - С 77-85. 64 Патент №2352349 (РФ) A61K 36/185 Способ переработки коры березы / Левданский В.А., Левданский А.В., Кузнецов Б.Н. - 2008102252/15; заявлено 21.02.2008, опубл. 20.04.2009. 65 Патент 1663009 А1 (SU) C10B53/02 Способ получения угля из гидролизного лигнина / Давыдова Л.Н., Киселев В.П., Воропаев Ю.М., Щипко М.Л., Симкин Ю.Я., Кузнецов Б.Н., Иванченко А.В. – 4470134/26; заявлено 05.08.1988; опубл. 15.07.1991. 133 66 Патент №:2051096 C01B031/08 Способ получения активированного угля / Щипко М.Л., Янголов О.В., Кузнецов Б.Н. - 93034069/26; опубл. 27.12.1995 Б.И. №36 67 Кононов Г.Н. Термолиз лигносодержащего сырья / Г.Н.Кононов, Л.А.Мазитов, В.О.Климов // Научные труды Московского государственного университета леса. - 1994. - № 273. - С. 61-65. 68 Петров В.С. Технология сорбентов и других угольных материалов из отходов растительного происхождения / В.С.Петров, Ю.Я.Симкин, О.К.Крылова // Химия в интересах устойчивого развития, 1996. Т. 4. № 4-5. С. 389-394. 69 Покровская Е.Н., Никифорова Т.П., Маковский Ю.А. // 1-я Всерос. конф. по полимерным материалам пониженной горючести: Тез. докл. Волгоград. 1995. С. 105107. 70 Богданович Н.И. Синтез углеродных адсорбентов из лигноцеллюлозных материалов термохимической активации с NaOH / Н.И.Богданович, Г.В.Добеле, Ю.А.Саврасова // Акт. проблемы теории адс-ции, пор-ти и адс. селект-ти: материалы XIV Всерос. симпозиума с участием иностранных ученых. 26 – 30 апреля 2010 г. – Москва – Клязьма. - 2010. - С. 68. 71 Hu S. Study on course of pyrolysis with phosphoric acid method by thermal analysis / S.Hu, B.Huang, Q.Lin // Chemistry and industry of forest products. 1998. V. 18, №2. P. 53-58. 72 Patent №5538932 (US) B01D53/02 Preparation of high activity, high density activated carbon with activatable binder / Zhiquan Q. Yan, John C. McCue (US). - US 08/449,811; filed 24.05.1995; issued 27.07.96. 73 Бубнова А.И. Получение микропористых углеродных адсорбентов из хвойных опилок с предобработкой ортофосфорной кислотой на стадии предпиролиза / А.И.Бубнова, Н.И.Богданович, Н.А.Макаревич // Материалы IV международной конференции «Сорбенты как фактор качества жизни и здоровья», Белгород. – 2012. – C. 31-36. 74 Олонцев В.Ф. Современные технологии высококачественных углеродных адсорбентов. Сообщ. 2. Технологии на основе растительного сырья // Химическая промышленность. - 1998. - № 1. - С. 8 - 12. 75 Патент №2111923 (РФ) B01J20/20 Способ получения активного угля из косточек плодов и скорлупы орехов / В.П.Голубев, В.М.Мухин, А.М.Тамамьян, И.Д.Зубова и др (РФ). - 97110295/25; заявлено 24.06.1997; опубл. 27.05.98 г1998 бюлл. №15 76 Габрук Н.Г. Сорбенты на основе природного сырья / Н.Г.Габрук, О.Н.Чуркина // Материалы II Всерос. науч. конф. «Сорбенты как фактор качества жизни и здоровья», Белгород. - 2006 г. – с.52-55 134 77 Rahman M.A. Preparation and characterization of activated charcoal as an adsorbent / M.A.Rahman, M.Assadullah, M.M.Haque, M.A.Motin, M.B.Sultan // J.Surface Sci. Technol. – 2006. - Vol 22, No. 3-4. - pp. 133-140. 78 Анарбаева Р.М. Влияние температуры активации на размер пор сорбента из виноградных косточек / Publishing house Education and Science s.r.o.Южно-Казахстанская государственная медицинская академия, г. Шымкент, РК. - 2009 79 Судачкова Н.Е. Семена кедра сибирского: научное издание / Отв. ред. Н.Е. Судачкова; Институт леса и древесины им. В.Н. Сукачева СО РАН. - Новосибирск: Наука, 1979. - 129 с. 80 Rodriguez-Reiniso F. Activated carbons from lignоcellulosic materials by chemical and/or physical activation: an overview / F. Rodriguez-Reiniso, M. Molina Sabio // Carbon. 1992. – vol. 30, № 7. – P. 1111-1118. 81 Петров B.C. Оптимизация процесса получения активных углей из скорлупы кедрового ореха / Т.Н.Поборончук, B.C.Петров, Г.И.Сорокина // Химия растительного сырья. – 2000. – № 4. – С. 55-63. 82 Петров B.C. Разработка оптимального режима получения активных углей из скорлупы ореха сосны сибирской / B.C.Петров, Т.Н.Поборончук // 3-й Междунар. симп. "Каталитические превращения угля". Сборник трудов. – Новосибирск, 1997. – ч. 2. – С. 325-326. 83 Оффан К.Б. Закономерности пиролиза скорлупы кедровых орехов с образованием древесного угля в интервале температур 200-500 оС / К.Б.Оффан, В.С.Петров, А.А.Ефремов // Химия растительного сырья. - 1999. - № 2. - С. 61 – 64. 84 Петров B.C. Технология сорбентов и других угольных материалов из отходов растительного происхождения / B.C.Петров, Ю.Я.Симкин, O.K.Крылова // Химия в интересах устойчивого развития. – 1996. – Т. 4. – № 4-5. – С. 389-394. 85 Савельева Ю.Р. Получение активного угля из скорлупы кедрового ореха / Ю.Р.Савельева, А.Н.Кряжов, М.С.Богомолов, В.Л.Ивасенко, В.Т.Новиков // Химия растительного сырья. – 2003. – № 4. – С. 61 – 64. 86 Toles C.A. Steam- or carbon dioxide-activated carbons from almond shells: physical, chemical and adsorptive properties and estimated cost of production / C.A. Toles et al. // Bioresource Technology. – 2000. - 75(3). - PP. 197-203 87 Евилевич А. З. Безотходное производство в гидролизной промышленности / А.З.Евилевич, Е.И.Ахмина, М.Н.Раскин. – М.: Лесная пром-сть, 1982. – 184 с. 88 Патент №:2362734 (РФ) C01B31/08 Способ получения активного / В.М.Мухин, В.С.Гостев, В.В.Чебыкин, С.Н.Соловьев, В.А.Карев, Г.А.Нагорная (РФ). 2008120177/15; заявлено 22.05.2008; опубл. 27.07.2009. 135 89 Мухин В.М. Активные угли. Эластичные сорбенты, катализаторы, осушители и химические поглотители на их основе / Под общей ред. д.т.н. В.М. Мухина. – М.: Издательский дом «Руда и металлы». - 2003. – 278 с. 90 Богданович Н.И. Пиролиз технических лигнинов / Н.И.Богданович // Лесной журнал 1998. - № 2-3. - C. 120-132. 91 Dobele G. Biomass for Energy, Environment, Agriculture and Industry / G.Dobele, N.Bogdanovich, T.Dizhbite et al // Pergamon Oxford. – 1994. - Vol. 3. – PP.1848-1852. 92 Шевченко Р.С. Формирование сорбционных и магнитных свойств ферромагнитных адсорбентов при пиролизе отходов переработки древесины в присутствии гидроксида железа (III) / Р.С.Шевченко, Н.И.Богданович, Л.Н.Кузнецова, Г.В.Добеле // Изв. высших учеб. завед. Лесной журнал. – 1999. – №2-3. - С. 142-150. 93 Цыганов Е.А. Термическая переработка древесины и ее компонентов / Е.А.Цыганов, В.А.Рык, С.Л.Глушанков и др. // Тез. докл. конф. 1-3 июня 1988. Красноярск. - 1988. - С. 65-66. 94 Симкин Ю.Я. Альтернативные технологии получения активных углей из формованного гидролизного лигнина / Ю.Я.Симкин, В.С.Петров // Изв. высших учеб. завед. Лесной журнал. - 1997. - № 4. - С. 63-69. 95 Петров Е.В. Получение и применение окисленных активных углей на основе технических лигнинов / Е.В.Петров, Л.Н.Григорьев, А.Г.Черкашин, Т.И.Буренина // Изв. высших учеб. завед. Лесной журнал. - 1996. - № 1-2. - С. 86-93. 96 Rodriguez-Mirasd J., Rodriguez-Mirasd J., Cordero T. // Carbon 94, Granada, 3-8, July, 1994: Extend. Abstr. and Programne. Cranada, 1994. P. 444-445. 97 Патент 1663009 (РФ) С 10 В 53/02 Способ получения угля из гидролизного лигнина / А.В.Иванченко, Б.Н.Кузнецов, М.Л.Щипко. - 4470134/26; заявлено 05.08.1988; опубл. 15.07.91. БИ№ 26. 98 Сталюгин В.В. Некоторые вопросы карбонизации гидролизного лигнина и получения активных углей на его основе / В.В.Сталюгин, Б.М.Кондратенок, Б.Н.Дудкин, С.Г.Любитова, С.А.Мордованюк // Тр. Коми науч. центра УрО РАН. – 1993. - № 129. - С. 113-119. 99 Богданович Н.И. Формирование пористой и надмолекулярной структуры активных углей в совмещенном процессе пиролиза-активации технических лигносульфонатов на натриевом основании. / Богданович Н.И., Добеле Г.В., Кузнецова Л.Н., Цаплина С.А. // Изв. высших учеб. завед. Лесной журнал. - 1998. - № 2-3. С. 153166. 100 Богданович Н.И. Влияние водяного пара на выход и свойства угля, получаемого при пиролизе гидролизного лигнина / Н.И.Богданович, Е.Д.Гельфанд, Г.П.Рудаметова // Лесохимия и подсочка: Реф.инф. – 1977. - №7. – С. 4-6. 136 101 Федоров Н.Ф. Реагентная интенсификация процесса парогазовой активации в технологии активных углей / Н.Ф.Федоров, М.А.Андреев, И.В.Андреева // Акт. проблемы теории адс-ции, пор-ти и адс. селект-ти: материалы XIV Всерос. симпозиума с участием иностранных ученых. 26 – 30 апреля 2010 г. – Москва – Клязьма. - 2010. - С. 29. 102 Богданович, Н.И. Новые реагенты термохимической активации углеродных материалов в синтезе адсорбентов / Н.И.Богданович, Л.Н.Кузнецова, Г.В.Добеле // Углеродные адсорбенты: материалы Второго международного семинара. – Кемерово: ИУУ СО РАН, 2000. – С.16–18. 103 Филоненко Ю.Я. Адсорбция: теоретические основы, адсорбенты, адсорбционные технологии / Ю.Я.Филоненко, И.В.Глазунова, А.В.Бондаренко ; под общ. ред. Ю.Я.Филоненко. – Липецк: ЛЭГИ. - 2004. – 103 с. 104 Плаченов Т.Г. Хлорцинковая активация угля / Т.Г.Плаченов - Л.: Химтеорет. 1937.-96 с. 105 Zhonghua H. A new composite adsorbent produced by chemical activation of elutrilithe with zinc chloride / H.Zhonghua, E.F.Vansant // Journal of Colloid and Interface Science. – 1995. - №176. – PP.422-431. 106 Marsh H. Activated carbon / M.Harry, F.Rodriguez-Reinoso / GB.: Elsevier Science. 2006. – 554 p. 107 Lopez-Gonzalez J.D. Preparation and characterization of active carbons from olive stones // J.D.Lopez-Gonzalez, F.Martinez-Vilchez, F.Rodriguez-Reinoso // Carbon. – 1980. – 18. – PP. 413-418. 108 Krishnan K.A. Adsorption of nitrilotriacetic acid onto activated carbon prepared by steam pyrolysis of sawdust: Kinetic and isotherm studies // Colloids and Surfaces A: Physicochemical and Engineering Aspects. – 2008. - 317 (1-3). - 344-351 109 Tanzil H.U. Preparation and characterization of activated carbon from a low rank coal / H.U.Tanzil, W.A.Tamoor, S.Z.Ahmed, A.H.K.Yousufzai // Carbon. – 1996. – Vol. 34 (1). – PP. 77 – 82. 110 Tsai W.T. A low cost adsorbent from agricultural waste corn cob by zinc chloride activation / W.T.Tsai, C.Y.Chang, S.L.Lee // Bioresource Technology. – 1998. – 64. – PP. 211 – 217. 111 Boonamnuayvitaya V. Preparation of activated carbons from coffee residue for the adsorption of formaldehyde / V.Boonamnuayvitaya, S.Sae-ung, W.Tanthapanichokoon // Separation and Purification Technology. – 2005. – 42. – PP. 159 – 168. 112 Mohanty K. Adsorption of phenol from aqueous solutions using activated carbons prepared from Tectona grandis sawdust by ZnCl2 activation / K.Mohanty, D.Das, M.N.Biswas // Chemical Engineering Journal. – 2005. – Vol.115, iss.1-2. – PP. 121-131. 137 113 Basar C.A. Applicability of the various adsorption models of three dyes adsorption onto activated carbon prepared waste apricot / C.A.Basar // Journal of Hazardous Materials. – 2006. - vol. 135, no. 1. - PP. 232-241. 114 Olivares – Marin M. Preparation of activated carbon from cherry stones by chemical activation with ZnCl2 / M. Olivares – Marin, C. Fernandez – Gonzalez, A. Macias – Garcia, V. Gomez – Serrano // Applied Surface Science. – 2006. - vol. 252, iss.17. – PP. 5967–5971 115 Önal, Y. Textural development of sugar beet bagasse activated with ZnCl2 / Journal of Hazardous Materials // Y.Onal, C.Akmil-Basar, C.Sarici-Ozdemir, S.Erdogan. – 2007. – 142. - PP. 138-143. 116 Namasivayam C. Application of coconut coir pith for the removal of sulfate and other anions from water / C.Namasivayam, D.Sangeetha // Desalination. – 2008. - vol.219, iss. 1–3. – PP. 1-13. 117 Acharya J. Removal of chromium (VI) from wastewater by activated carbon developed from Tamarind wood activated with zinc chloride / Jyotikusum Acharya, J.N. Sahu, B.K. Sahoo, C.R. Mohanty, B.C. Meikap // Chemical Engineering Journal. – vol.150, iss. 1. – 2009. – PP. 25-39. 118 Okada K. Porous properties of activated carbons from waste newspaper prepared by chemical and physical activation / K.Okada, N.Yamamoto, Y.Kameshima, A.Yasumori // Journal of Colloid and Interface Science. – 2003. - vol.262, iss.1. – PP. 179 – 193. 119 Hayashi J. Preparation of activated carbon from lignin by chemical activation / J.Hayashi, A.Kazehaya, K.Muroyama, A.P.Watkinson // Carbon. – 2000. – vol.38, iss.13. – PP. 1873-1878. 120 Hayashi J. Preparation and characterization of high-specific-surface-area activated carbons from K2CO3-treated waste polyurethane / J.Hayashi, N.Yamamoto, T.Horikawa, K.Muroyama, V.G.Gomes // Journal of Colloid and Interface Science. – 2005. – vol.281, iss.2. – PP. 437 – 443. 121 Li W. Preparation of high surface area activated carbons from tobacco stems with K2CO3 activation using microwave radiation / Wei Li, Li-bo Zhang, Jin – hui Peng, Ning Li, Xue – yun Zhu // Industrial Crops and Products. – 2008. – vol.27, iss.3. – PP. 341 - 347 122 Patent 2007CH00376 (IN) A 20081128 A process for the preparation of activated carbon from botanical sources / B.Viswanathan, T.K.Varadarajan, P.Indra Neel. - 2008 123 Богданович Н.И. Термохимический синтез новых углеродных материалов на основе технических лигнинов / Н.И.Богданович, Г.В.Добеле, Л.Н.Кузнецова, Н.В.Орлова // Физикохимия лигнинов. Мат-лы междунар. Конференции. – 2005. – С.105. 124 Marsh H. Formation of active carbons from cokes using potassium hydroxide / H.Marsh, D.S.Yan, T.M.O'Grady, A.Wennerberg // Carbon. – 1984. - vol.22, iss.6. – PP. 603611. 138 125 Yoon S.-H. KOH activation of carbon nanofibers / S.-H.Yoon, S.Lim, Y.Song, Y.Ota, W.Qiao, A.Tanaka, I.Mochida // Carbon. – 2004. – vol.42, iss.8 – 9. – PP. 1723 – 1729. 126 Kim B.-J. A study on pore-opening behaviors of graphite nanofibers by a chemical activation process / Byung – Joo Kim, Young – Seak Lee, Soo – Jin Park // Journal of Colloid and Interface Science. – 2007. – vol.306, iss.2. – PP. 454 – 458. 127 Abe I. Получение активных углей с активацией под действием гидроксида калия из различных сырьевых материалов / I.Abe, S.Iwasaki // Science and Industries (Osaka). 2001. - vol.75, iss.9. - PP. 437 - 440. 128 Patent №5064805 (US) COI B31/12 Production of high quality activated carbon / T.Otowa. - US 07/414,788; filed 29.09.1989, issued 12.11.91. 129 Shen Z. Preparation of activated mesocarbon microbeads with high mesopore content / Z. Shen, X.Ruisheng // Fuel Processing Technology. – 2003. – vol.84, iss.1 – 3. – PP. 95 – 103. 130 Gorka J. KOH activation of mesoporous carbons obtained by soft-templating / J.Gorka, A.Zawislak, J.Choma, M.Jaroniec // Carbon. – 2008. – vol.46, iss.8. – PP. 1159 – 1161. 131 Jiang Qi. Preparation of activated carbon nanotubes / Qi Jiang, Mei-Zhen Qu, Bo-Lan Zhang, Zuo-Long Yu. – Carbon. – 2002. – vol.40, iss.14. – PP. 2743 – 2745. 132 Liu.Y. / Investigation of preparation and structures of activated carbon nanotubes / Y.Liu, Z.Shen, K.Yokogawa // Materials Research Bulletin. – 2006. – vol.41, iss.8. – PP. 1503 – 1512. 133 Kierzek K. Electrochemical capacitors based on highly porous carbons prepared by KOH activation / K.Kierzek, E.Frackowiak, G.Lota, G.Gryglewicz, J.Machnikowski // Electrochimica Acta. – 2004. – vol.49, iss.4. – PP. 515 – 523. 134 Ji Y. Preparation of activated carbons by microwave heating KOH activation / Y.Ji, T.Li, L.Zhu, X.Wang, Q.Lin // Applied Surface Science. – 2007. – vol.254, iss.2, PP. 506 – 512. 135 Lillo-Rodenas M.A. Understanding chemical reactions between carbons and NaOH and KOH: An insight into the chemical activation mechanism / M.A.Lillo-Rodenas, D.CazorlaAmoros, A.Linares – Solano // Carbon. – 2003. – vol.41, iss.2. – PP. 267 – 275. 136 Freitas J.C.C. A multiple-field 23Na NMR study of sodium species in porous carbons / J.C.C.Freitas, M.A.Schettino, F.G.Emmerich, A.Wong, M.E.Smith // Solid State Nuclear Magnetic Resonance. – 2007. – vol.32, iss.4. – PP. 109 – 117. 137 Yamashita Y. Influence of alkali on the carbonization process—II: Carbonization of various coals and asphalt with NaOH / Y.Yamashita, K.Ouchi // Carbon. – 1982. – vol.42, iss.1. - PP. 47 – 53. 139 138 Freitas J.C.C. NMR investigation on the occurrence of Na species in porous carbons prepared by NaOH activation / J.C.C.Freitas, M.A.Schettino Jr., A.G.Cunha et al. // Carbon. – 2007. – vol.45, iss.5. – PP. 1097 – 1104. 139 Hwang H. – R. The preparation of an adsorbent from mixtures of sewage sludge and coal-tar pitch using an alkaline hydroxide activation agent / H.-R.Hwang, W.-J.Choi, T.– J.Kim, J.-S.Kim, K.- J.Oh // Journal of Analytical and Applied Pyrolysis. – 2008. – vol.83, iss. 2. – PP. 220 – 226. 140 Богданович Н.И. Термохимическая активация древесины гидроксидом натрия / Н.В.Труфанова, Н.И.Богданович, С.М.Фадеев, Л.Н.Кузнецова // Химия технология растительных веществ: сб. мат-лов 2 Всерос. конф., Казань. - 2002. – С. 153. 141 Богданович Н.И. Формирование адсорбционных свойств угля при пиролизе черного щелока в присутствии NaOH / Л.В.Попова, Н.И.Богданович, Л.Н.Кузнецова // Охрана окр. среды и рац. исп-е природн. ресурсов: сб. науч. тр., Архангельск. - 2001. – Вып. 7. – С. 157-161. 142 Богданович Н.И. Теоретические основы термохимической активации технических лигнинов / Н.И.Богданович, Г.В.Добеле, Л.Н.Кузнецова, С.М.Фадеев // Современное состояние и перспективы развития теории адсорбции. Тез. докл. IX Междунар. конф. по теоретическим вопросам адсорбции и адсорбционной хроматографии. - М.: ИФХ РАН. - 2001. – С. 25. 143 Богданович Н.И. Термохимическая активация технических лигнинов сульфатом и карбонатом натрия / Н. И.Богданович, Г.В.Добеле, С.А.Цаплина, С.М.Фадеев, Л.Н.Кузнецова // Современные теоретические модели адсорбции в пористых средах. Мат-лы V Всерос. симп. с участ. иностр. ученых. – М.: ИФХ РАН. - 1999. – С. 65. 144 Богданович Н.И. Термохимическая активация технических лигнинов с получением порошкообразных активных углей и регенерацией химикатов / Н.И.Богданович, Г.В.Добеле, Л.Н.Кузнецова, С.А.Цаплина // Синтез, исследование и использование адсорбентов. Тез. докл. II Национального симпозиума. – М.: РАН. - 1995. – С. 36-37. 145 Богданович Н.И. Синтез углеродных супермикропористых адсорбентов на основе технических лигнинов / Н.И.Богданович, С.А.Цаплина, Л.Н.Кузнецова, Г.В.Добеле, А.А.Фомкин // Теория и практика адсорбционных процессов. Сб. тр. РАН. – М.: ИФХ РАН. - 1997. – С. 247 - 249. 146 Богданович Н.И. Восстановление сульфата натрия при пиролизе черного щелока / Н.И.Богданович, С.А.Цаплина, С.М.Фадеев // Наука – северному региону. Сборник научных трудов. – Архангельск. - 2005. – Вып. 62. – С. 173. 147 Богданович Н.И. Активные угли термохимической активации технических лигнинов / Н.И.Богданович, Л.Н.Кузнецова, Г.В.Добеле, С.А.Цаплина // Актуальные 140 проблемы теории адсорбции и синтеза сорбентов. Мат-лы VI Всерос. симп. с участ. иностр. ученых. – М.: ИФХ РАН. - 2000. – С. 54-55. 148 Богданович Н.И. Пиролиз технических лигнинов с получением углеродных адсорбентов и регенерацией химикатов / Н.И.Богданович, С.А.Цаплина, Л.Н.Кузнецова // Лесохимия и органический синтез. Тез. докл. II Российского совещания. – Сыктывкар. - 1996. – С. 115. 149 Богданович Н.И. Синтез активных углей (АУ) термохимической активацией технических лигнинов / Н.И.Богданович, С.М.Фадеев, Л.Н.Кузнецова, С.А.Цаплина // Поморье в Баренц-регионе на рубеже веков: экология, экономика, культура. Материалы международной конф. – Архангельск, ИЭПС УрО РАН. - 2000. – С. 32 - 33. 150 Богданович Н.И. Термохимическая активация древесных отходов гидроксидом натрия / Н.И.Богданович, Н.В.Труфанова, С.М.Фадеев // Мат-лы междунар. экологич. форума стран Баренц-региона. – Архангельск. - 2001. – С. 192 - 193. 151 Богданович Н.И.Термохимическая активация ЛСТ на натриевом основании гидроксидом натрия / Н.И.Богданович, Н.В.Орлова, Л.Н.Кузнецова // Охрана окружающей среды и рациональное использование природных ресурсов. Сб.науч.тр., вып.VIII. – Архангельск. - 2002. – С.112 - 119. 152 Богданович Н.И. Каталитический пиролиз технических лигносульфонатов на Naосновании с температурной предобработкой / Н.И.Богданович, Л.Н.Кузнецова, Н.В.Орлова // Химия и технология растительных веществ. Мат-лы III Всерос. конф. – Саратов: Изд-во Сарат. губ. торг.-пром. палаты. - 2004. – С. 268 - 271. 153 Bogdanovich N. Lignin Activated Carbons / N.Bogdanovich, G.Dobele, G.Telysheva, T.Osadshaya // Biomass for Energy and Industry. 7th E. C. Conference, Ponte Press. – Brussels-Luxembourg. - 1994. – РP. 1040 - 1043. 154 Богданович Н.И. Термохимическая активация измельченных древесных материалов гидроксидом натрия / Н.И.Богданович, Н.В.Труфанова, С.М.Фадеев, Л.Н.Кузнецова, Г.В.Добеле // Актуальные проблемы адсорбции, модифицирования поверхности и разделения веществ. Материалы VII Всерос. Симп. – М: ИФХ РАН. 2002. – С.158. 155 Bogdanovich N. Sorption Methods of PPI Waste Water Cleaning in the Systems with Active Silt / N.Bogdanovich, L.Kuznetsova, G.Dobele // Biomass for Energy and Industry: 7th European Conf. – Brussels; Luxembourg: Ponte Press, 1994. – PP. 1216-1219. 156 Bogdanovich N. Application of Sorbent Obtained by Pyrolysis of Sewage Sludge for Biological Treatment of Waste Water / N.Bogdanovich, G.Dobele, G.Telysheva // Applied Biochemistry and Biotechnology: Humana Press. - 1996. – Vol. 57/58. – РP. 857 - 876. 157 Bogdanovich N. Sorption methods of PPI Waste Water Cleaning in the Systems with Active Silt / N.Bogdanovich, L.Kuznetsova, G.Dobele // 7th European Conference on Biomass 141 for Energy and Environment, Agriculture and Industry. Abstracts. – Florence. - 1992. – P. 1602. 158 Bogdanovich N. Pyrolysis of Sewage Studge with Obtaining of Sorbents / G.Dobele, N.Bogdanovich, G.Telysheva // Seventeenth Symposium on Biotechnology for Fuels and Chemicals. Abstracts. – Colorado. - 1995. – P. 154. 159 Богданович Н.И. Применение пиролизованного активного ила для очистки стоков ЦБП / Н.И.Богданович, Е.Д.Гельфанд, Л.Н.Кузнецова // Безотходные технологические процессы и охрана окружающей среды: Тез. докл. науч.-техн. конф. – Рига. - 1981. – С. 103 - 109. 160 Богданович Н. И. Термохимическая активация ЛСТ гидроксидом натрия / Н.И.Богданович, Л.Н.Кузнецова, Н.В.Труфанова, Г.В.Добеле, С.А.Цаплина // Экология северных территорий России. Проблемы, прогноз ситуации, пути развития, решения. т.2. Материалы междунар. конф. – Архангельск: ИЭПС РАН. - 2002. – С. 281 - 285. 161 Богданович Н.И. Углеродные адсорбенты из технических лигнинов / Н.И.Богданович, Г.В.Добеле, Л.Н.Кузнецова, С.А.Цаплина // Углеродные адсорбенты: Тез. докл. Междунар. семинара. – Кемерово. - 1997. – С. 20 - 21. 162 Srivastava S.K. Influence of alkali on pyrolysis of coals / S.K.Srivastava, S.K.Rao // Fuel. - 1988. - vol. 67, iss.12 - PP. 1683 - 1684. 163 Matsukata M. Migration of alkali and alkaline earth elements into carbon black / M.Matsukata, E.Kikuohi, Y.Morita // Fuel. - 1992. - vol.71, iss.6 - PP. 705 - 707. 164 Srivastava S.K. Hydrogen production from coal-alkali interaction / S.K.Srivastava, J.Saran, J.Sinha, L.V.Ramachandran, S.K.Rao // Fuel. - 1988. -vol. 67, iss.12. - PP. 1680 1682. 165 Кузнецов Б.Н. Каталитическая химия растительной биомассы / Б.Н.Кузнецов // Соросовский образовательный журнал. - 1996. - № 12. - С. 47 – 55. 166 Панасюк Л.В. О реакциях, происходящих при термическом разложении гидролизных лигнинов в щелочной среде / Л.В.Панасюк, Л.Г.Панасюк // Изв. высших учеб, завед. Лесная промышленность. - 1968. - № 3. - С. 116 - 118. 167 Duong D.Do. Adsorption analysis: Equilibria and kinetics / D.Do Duong - Imperial College Press: Series of Chemical Engineering, vol.2.: Australia. – 1998. – 913 p. 168 Riley H.L. Amorphous carbon and graphite / H.L. Riley // Quart. Rev Chemical Society. - №1. – 1947. – PP. 59 – 72. 169 Дубинин M.M. Исследование пористой структуры активных углей комплексными методами / M.M.Дубинин // Успехи химии. – 1955. - № 24, вып.1, с. 3 - 18. 170 Богданович Н.И. Адсорбционные свойства сорбента на основе термохимической активации древесины / Н.И.Богданович, Г.В.Добеле, Н.А.Макаревич // Мат-лы междунар. конференции. Физикохимия лигнинов. – Архангельскю - 2005. – С. 217 - 220. 142 171 Дубинин М.М. Современное состояние теории объемного заполнения микропор / М.М.Дубинин // Изв. АН СССР. Серия химическая. - 1991. - №1. - С. 9 – 30. 172 Pierce C. The heats of adsorbtion. III. Methanol on carbon / Conway Pierce, R. Nelson. Smith // J. Phys. Chem. – 1950 – vol. 54, iss. 3. – PP. 354-364. 173 Barrett E.P. The determination of pore volume and area distributions in porous substances. I. Computations from nitrogen isotherms / E.P.Barrett et al. // Journal of American Chemical Society. - 1951. - vol.73. - PP. 373 – 380. 174 Aligizaki K.K. Pore Structure of Cement-Based Materials: Testing Interpretation and Requirements (Modern Concrete Technology) / K.K.Aligizaki - Taylor & Francis: USA. 2005. - 432 p. 175 Новиков Д.В. Факторы, влияющие на электрохимическое окно стабильности электролита суперконденсатора 1-Me-3-BuImBF4 / Д.В.Новиков, М.Ю.Измайлова, К.К.Деньщиков // Тезисы II Международной научно-технической конференции «Современные методы в теоретической и экспериментальной электрохимии», Плес. – 2010. - С. 26. 176 Гурьянов В.В. Прогнозирование параметров микропористой структуры и адсорбционных свойств активных углей / В.В.Гурьянов, Г.А.Петухова, Н.С.Поляков // Известия академии наук. Серия химическая. - 2001. - №6. - С. 933 - 937. 177 Деньщиков К.К. Оптимизация взаимодействия наноструктурированных углеродных материалов и электролитов на основе ионных жидкостей для повышения электроэнергетических характеристик суперконденсаторов / К.К.Деньщиков // Международный форум по нанотехнологиям, Тезисы докладов. – 2008. - Т.2. - с. 472 – 473. 178 ГОСТ 7657-84. Уголь древесный. Технические условия. – Введ. 86.01.01. – М.: ИПК Издательство стандартов, 2002. – 8 с. 179 ASTM D 2866 – 11. Standard Test Method for Total Ash Content of Activated Carbon. – Intr. 1983. – PA, USA.: ASTM Intern., 2011. – 35 p. 180 ASTM D 2867-09. Standard Test Methods for Moisture in Activated Carbon. - Intr. 1998. - PA, USA.: ASTM Intern., 2009. – 32 p. 181 МРТУ № 6-16-1003-67. Активные угли. Методы испытаний. Метод определения сорбционной активности по йоду. 182 ASTM D 1510-13. Standard Test Method for Carbon Black—Iodine Adsorption Number. - Intr. 1998. - PA, USA.: ASTM Intern., 2013. – 28 p. 183 ГОСТ 4453-74 Уголь активный осветляющий древесный порошкообразный. Технические условия. – Введ. 76.01.01. – М.: Издательство стандартов, 1992. – 23 с. 143 184 Пуляревич М.Я. Измерение изотермы адсорбции на адсорбционно-вакуумной установке с пружинными микровесами: Метод. Указ. // ЛТИ. - 1971. – 43 с. 185 Lippens B.S. Studies on pore systems in catalysts I. The adsorption of nitrogen; apparatus and calculation / B.S.Lippens, B.J.Linsen, J.H. de Boer // Journal of Catalysis. – 1964. – vol. 3, iss.1. – P. 32 - 37. 186 De Boer J.H. Thet-curve of multimolecular N2-adsorption / Journal of Colloid and Interface // Science J.H. de Boer, B.S. Lippens et al. – 1966. – vol. 21, iss. 4 – PP. 405 - 414. 187 Lippens B.C. Studies on pore systems in catalysts: V. The t method / B.C.Lippens, J.H. de Boer // Journal of Catalysis. - 1965 -vol.4, iss.3 - PP. 319 - 323. 188 Вячеславов А.С. Измерение площади поверхности и пористости методом капиллярной конденсации азота / А.С.Вячеславов, Е.А.Померанцева // Московский Государственный университет им.М.В.Ломоносова. метод. разраб. Москва. – 2006. – 55 с. 189 Толмачев А.М. Описание адсорбции газов, паров и растворов / Сорбционные и хроматографические процессы. // А.М.Толмачев. Т.9. Вып.1. С.147-153. — 2009. — Т. 59, № 1. — С. 5–32. 190 Фомкин А.А. Физическая адсорбция газов, паров и жидкостей при высоких давлениях на микропористых адсорбентах: // Диссерт. докт. физ-мат наук. М.: ИФХ РАН. 1993. – 398 с. 191 Вячеславов А.С. Определение площади поверхности и пористости материалов методом сорбции газов / А.С.Вячеславов, М.Ефремова // Московский Государственный университет им.М.В.Ломоносова. метод. разраб. Москва. – 2011. – 65 с. 192 Попов Ю.А. Газоочистные аппараты сухого и мокрого типов. Каталог / Сост-ли Ю.А.Попов, С.С.Янковский и др. // ЦИНТИХИМНЕФТЕМАШ. – Москва. – 1984. – 91 с. 144 Приложение А Адсорбция ТП/П, oС 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 + + + + -α α 0 0 0 0 0 0 0 0 0 0 TТХА, oС + + + + 0 0 -α α 0 0 0 0 0 0 0 0 D, г/г + + + + 0 0 0 0 -α α 0 0 0 0 0 0 Выход, % 27,7 29,4 24,8 24,4 24,8 28,4 29,0 29,3 24,7 25,7 29,1 32,8 31,5 41,5 29,1 29,6 25,8 27,1 35,6 25,7 МГ, мг/г Йода, мг/г Гексана, мг/г 259,3 346,1 578,5 528,7 488,6 397,4 576,4 672,3 666,7 587,5 399,5 610,2 200,0 597,2 469,2 565,9 687,2 682,5 558,5 456,6 1204 1266 2420 2166 1965 1393 2288 2413 2223 2343 1716 2469 1080 1963 1901 2093 2354 2281 1783 1586 308,3 392,8 544,8 528,0 602,4 522,4 683,5 722,5 658,4 554,1 481,8 644,6 275,8 633,4 564,5 602,4 612,3 614,0 620,2 590,5 Удельная поверхность по йоду, м2/г 1180 1220 2180 2000 1840 1710 2100 2210 2040 2150 1620 2260 1080 1820 1780 1920 2020 2040 1770 1700 145 Приложение Б 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 ТП/П, 0 С TТХА, 0 С D, г/г + + + + -α α 0 0 0 0 0 0 0 0 0 0 + + + + 0 0 -α α 0 0 0 0 0 0 0 0 + + + + 0 0 0 0 -α α 0 0 0 0 0 0 Выход, % на а.с.с, % МГ, мг/г Йода, мг/г Гексана, мг/г 27,7 29,9 25,7 30,1 26,4 25,5 28,6 26,9 24,6 24,7 32,5 21,4 33,4 28,6 30,0 26,4 31,2 32,5 31,4 30,7 657 746 593 851 694 823 716 917 717 987 605 1018 618 931 808 871 863 839 761 696 1209 1529 1073 1820 1019 1462 1271 1786 1274 2166 1143 1845 1145 1527 1400 1653 1398 1338 1336 1271 367,6 448,4 298,4 601,2 328,2 458,2 349,0 477,8 417,3 615,0 305,0 583,64 275,7 402,5 406,8 411,5 411,9 406,7 407,1 407,2 Адсорбция Осветляющая способность по МГ Константы Константы уравнения уравнения Фрейндлиха Лэнгмюра k n am b 185,8 0,197 716 0,017 282,6 0,153 738 0,059 127,7 0,240 724 0,008 407,2 0,124 869 0,115 92,1 0,306 806 0,007 370,2 0,132 802 0,164 222,0 0,185 748 0,027 390,6 0,141 934 0,086 290,9 0,143 741 0,043 389,0 0,146 963 0,087 99,5 0,277 756 0,006 338,8 0,169 908 0,101 125,8 0,250 854 0,006 261,5 0,205 894 0,053 366,7 0,128 854 0,055 373,5 0,143 877 0,106 241,1 0,203 854 0,044 296,7 0,163 843 0,044 238,5 0,181 789 0,027 227,8 0,173 738 0,023 Адсорбционная активность по йоду Константы Константы уравнения уравнения Фрейндлиха Лэнгмюра k n am b 47,3 0,248 134,3 0,200 66,7 0,239 166,3 0,347 55,9 0,161 106,1 0,518 75,8 0,249 189,4 0,523 37,2 0,257 106,8 0,234 49,2 0,285 154,7 0,234 60,4 0,191 133,3 0,295 74,9 0,242 183,8 0,561 49,0 0,242 131,2 0,268 79,0 0,277 213,0 0,552 46,3 0,225 120,2 0,221 81,4 0,222 186,2 0,716 53,4 0,200 121,3 0,485 70,6 0,253 186,8 0,405 61,6 0,196 132,6 0,452 71,5 0,226 179,3 0,317 67,0 0,190 143,4 0,401 63,4 0,201 144,8 0,307 59,7 0,195 132,3 0,329 67,3 0,173 128,7 0,984 146 Приложение В 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Удельная поверхность, м2/г ТП/П, оС TТХА, оС D, г/г + + + + -α α 0 0 0 0 0 0 0 0 0 0 + + + + 0 0 -α α 0 0 0 0 0 0 0 0 + + + + 0 0 0 0 -α α 0 0 0 0 0 0 Объем пор, см3/г SBET SLang St-Plotми St-Plotме SDR SDA Vобщий VDA Vmax HK 1162 1117 803 1643 589 960 860 1272 891 1668 747 1670 698 1360 846 1215 1023 989 863 843 2439 1721 1301 2678 980 1505 1453 1995 1526 2780 1461 2808 1227 2288 1385 2076 1742 1620 1461 1463 672 1075 749 1480 534 897 770 1161 668 1526 562 1374 623 1230 776 868 912 929 775 756 490 42 53 164 55 63 90 111 223 142 185 296 75 130 70 347 110 59 88 87 1296 1579 1089 2099 853 1307 1180 1681 1077 2275 1038 2029 991 1947 1161 1375 1411 1401 1202 1210 1244 1476 1069 1799 825 1202 1129 1595 977 2016 1055 1765 1044 1713 1139 1253 1350 1478 1182 1168 0,83 0,62 0,48 0,96 0,36 0,54 0,52 0,71 0,54 0,98 0,52 0,99 0,45 0,82 0,50 0,73 0,63 0,59 0,53 0,54 0,54 0,62 0,46 0,78 0,38 0,52 0,49 0,69 0,42 0,88 0,45 0,75 0,44 0,75 0,50 0,55 0,57 0,64 0,50 0,50 0,54 0,59 0,44 0,89 0,32 0,49 0,46 0,66 0,46 0,92 0,40 0,86 0,38 0,75 0,47 0,61 0,56 0,56 0,48 0,47 Ширина пор по HK, нм 1,0184 0,9134 0,9698 1,0912 0,9958 0,9651 0,9513 0,9705 1,0550 1,0408 0,9116 1,0498 0,8918 1,0187 0,9836 1,1123 0,9342 0,9293 0,9300 0,9385 147 Приложение Г стр.1 148 Приложение Г стр.2 149 Приложение Д 150 Приложение Е 151 Приложение Ж стр.1 152 Приложение Ж стр.2 153