Твердофазный синтез пептидов с применением микроволнового
advertisement
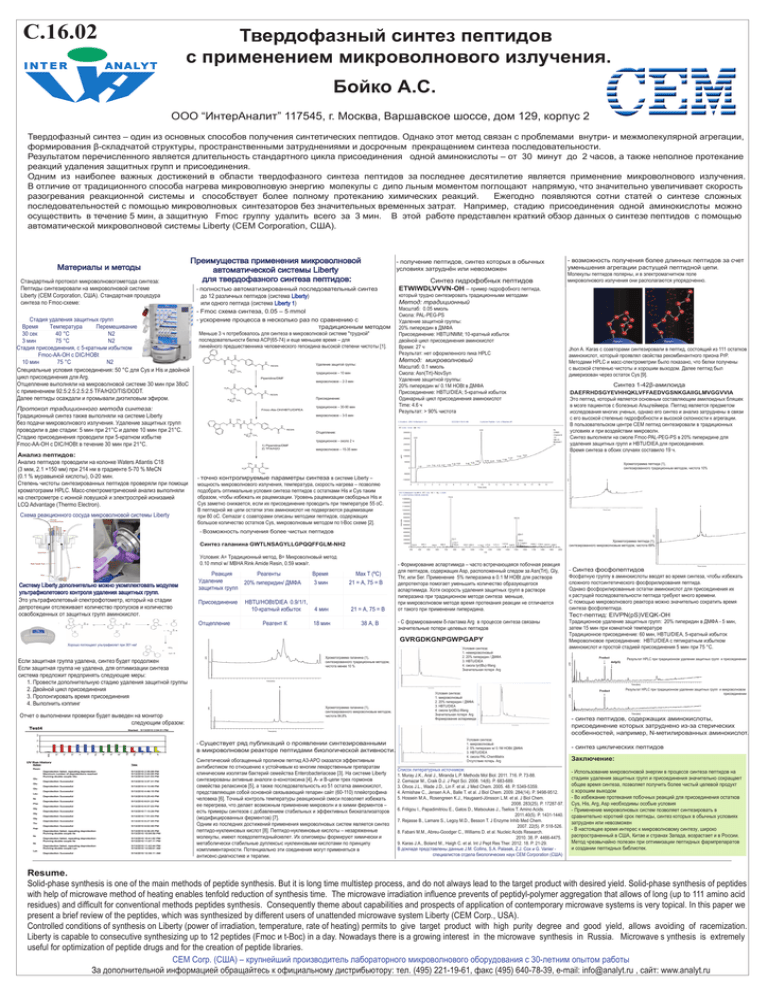
С.16.02 Твердофазный синтез пептидов с применением микроволнового излучения. Бойко А.С. ООО “ИнтерАналит” 117545, г. Москва, Варшавское шоссе, дом 129, корпус 2 Твердофазный синтез – один из основных способов получения синтетических пептидов. Однако этот метод связан с проблемами внутри- и межмолекулярной агрегации, формирования β-складчатой структуры, пространственными затруднениями и досрочным прекращением синтеза последовательности. Результатом перечисленного является длительность стандартного цикла присоединения одной аминокислоты – от 30 минут до 2 часов, а также неполное протекание реакций удаления защитных групп и присоединения. Одним из наиболее важных достижений в области твердофазного синтеза пептидов за последнее десятилетие является применение микроволнового излучения. В отличие от традиционного способа нагрева микроволновую энергию молекулы с дипо льным моментом поглощают напрямую, что значительно увеличивает скорость разогревания реакционной системы и способствует более полному протеканию химических реакций. Ежегодно появляются сотни статей о синтезе сложных последовательностей с помощью микроволновых синтезаторов без значительных временных затрат. Например, стадию присоединения одной аминокислоты можно осуществить в течение 5 мин, а защитную Fmoc группу удалить всего за 3 мин. В этой работе представлен краткий обзор данных о синтезе пептидов с помощью автоматической микроволновой системы Liberty (CEM Corporation, США). Материалы и методы Стандартный протокол микроволновогометода синтеза: Пептиды синтезировали на микроволновой системе Liberty (CEM Corporation, США). Стандартная процедура синтеза по Fmoc-схеме: Стадия удаления защитных групп Время Температура Перемешивание 30 сек 40 °С N2 3 мин 75 °С N2 Стадия присоединения, с 5-кратным избытком Fmoc-AA-OH с DIC/HOBt 10 мин 75 °С N2 Специальные условия присоединения: 50 °C для Cys и His и двойной цикл присоединения для Arg. Отщепление выполняли на микроволновой системе 30 мин при 38оС с применением 92.5:2.5:2.5:2.5 TFA/H2O/TIS/DODT. Далее пептиды осаждали и промывали диэтиловым эфиром. Протокол традиционного метода синтеза: Традиционный синтез также выполняли на системе Liberty без подачи микроволнового излучения. Удаление защитных групп проводили в две стадии: 5 мин при 21°С и далее 10 мин при 21°С. Стадию присоединения проводили при 5-кратном избытке Fmoc-AA-OH с DIC/HOBt в течение 30 мин при 21°C. Анализ пептидов: Анализ пептидов проводили на колонке Waters Atlantis C18 (3 мкм, 2.1 ×150 мм) при 214 нм в градиенте 5-70 % MeCN (0.1 % муравьиной кислоты), 0-20 мин. Степень чистоты синтезированных пептидов проверяли при помощи хроматограмм HPLC. Масс-спектрометрический анализ выполняли на спектрометре с ионной ловушкой и электроспрей ионизаией LCQ Advantage (Thermo Electron). Схема реакционного сосуда микроволновой системы Liberty Преимущества применения микроволновой автоматической системы Liberty для твердофазного синтеза пептидов: - получение пептидов, синтез которых в обычных условиях затруднён или невозможен - полностью автоматизированный последовательный синтез до 12 различных пептидов (система Liberty) или одного пептида (система Liberty 1) - Fmoc схема синтеза, 0.05 – 5 mmol - ускорение процесса в несколько раз по сравнению с традиционным методом Меньше 3 ч потребовалось для синтеза в микроволновой системе "трудной" последовательности белка ACP(65-74) и еще меньшее время – для линейного предшественника человеческого гепсидина высокой степени чистоты [1]. O H N O O O H N O O RESIN H 3C H3C CH3 Piperidine/DMF микроволновое – 2-3 мин O H 2N O H N O O RESIN Присоединение: O H3C H3C CH3 Fmoc-Ala-OH/HBTU/DIPEA традиционное – 30-90 мин микроволновое – 3-5 мин O O CH3 N H H N O Метод: традиционный Масштаб: 0.05 ммоль Смола: PAL-PEG-PS Удаление защитной группы: 20% пипередин в ДМФА Присоединение: HBTU/NMM; 10-кратный избыток двойной цикл присоединения аминокислот Время: 27 ч Результат: нет оформленного пика HPLC Масштаб: 0.1 ммоль Смола: Asn(Trt)-NovSyn Удаление защитной группы: 20% пипередин w/ 0.1M HOBt в ДМФА Присоединение: HBTU/DIEA; 5-кратный избыток Одинарный цикл присоединения аминокислот Time: 4.6 ч Результат: > 90% чистота традиционное – 10 мин O O H N O O RESIN O H 3C H3C CH3 Отщепление: традиционное – около 2 ч 1) Piperidine/DMF 2) TFA/H2O CH3 H 2N O H N Молекулы пептидов полярны, и в электромагнитном поле микроволнового излучения они располагаются упорядоченно. который трудно синтезировать традиционными методами Метод: микроволновый Удаление защитой группы: O Синтез гидрофобных пептидов ETWIWDLVVVN-OH – пример гидрофобного пептида, - возможность получения более длинных пептидов за счет уменьшения агрегации растущей пептидной цепи. микроволновое – 15-35 мин Jhon A. Karas с соавторами синтезировали в пептид, состоящий из 111 остатков аминокислот, который проявлял свойства рекомбинантного приона PrP. Методами HPLC и масс-спектрометрии было показано, что белки получены с высокой степенью чистоты и хорошим выходом. Далее пептид был димеризован через остаток Cys [9]. Синтез 1-42β-амилоида DAEFRHDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVVIA Это пептид, который является основным составляющим амилоидных бляшек в мозге пациентов с болезнью Альцгеймера. Пептид является предметом исследования многих ученых, однако его синтез и анализ затруднены в связи с его высокой степенью гидрофобности и высокой склонности к агрегации. В пользовательском центре СЕМ пептид синтезировали в традиционных условиях и при воздействии микроволн. Синтез выполняли на смоле Fmoc-PAL-PEG-PS в 20% пиперидине для удаления защитных групп и HBTU/DIEA для присоединения. Время синтеза в обоих случаях составило 19 ч. Хроматограмма пептида (1), синтезированного традиционным методом, чистота 10% O OH OH - точно контролируемые параметры синтеза в системе Liberty – мощность микроволнового излучения, температура, скорость нагрева – позволяю подобрать оптимальные условия синтеза пептидов с остатками His и Cys таким образом, чтобы избежать их рацемизации. Уровень рацемизации свободных His и Cys заметно снижается, если их присоединение проводить при температуре 55 оС. В пептидной же цепи остатки этих аминокислот не подвергаются рацемизации при 80 оС. Cemazar с соавторами описаны методики пептидов, содержащих большое количество остатков Cys, микроволновым методом по t-Boc схеме [2]. - Возможность получения более чистых пептидов Хроматограмма пептида (1), синтезированного микроволновым методом, чистота 69% Синтез галанина GWTLNSAGYLLGPQQFFGLM-NH2 Условия: A= Традиционный метод, B= Микроволновый метод 0.10 mmol w/ MBHA Rink Amide Resin, 0.59 мэкв/г. Систему Liberty дополнительно можно укомплектовать модулем ультрафиолетового контроля удаления защитных групп. Это ультрафиолетовый спектрофотометр, который на стадии депротекции отслеживает количество пропусков и количество освобожденных от защитных групп аминокислот. Реакция Реагенты Удаление 20% пиперидин/ ДМФА защитных групп Присоединение Отщепление Время 3 мин HBTU/HOBt/DIEA 0.9/1/1, 10-кратный избыток 4 мин Реагент К 18 мин Max T (ºC) 21 = А, 75 = В 21 = А, 75 = В 38 А, В Отчет о выполнении проверки будет выведен на монитор следующим образом: - С формированием δ-лактама Arg в процессе синтеза связаны значительные потери целевых пептидов GVRGDKGNPGWPGAPY Хорошо поглощают ультрафиолет при 301 нм! Если защитная группа удалена, синтез будет продолжен Если защитная группа не удалена, для оптимизации синтеза система предложит предпринять следующие меры: 1. Провести дополнительную стадию удаления защитной группы 2. Двойной цикл присоединения 3. Пролонгировать время присоединения 4. Выполнить кэппинг - Формирование аспартимида – часто встречающаяся побочная реакция для пептидов, содержащих Asp, расположенный следом за Asn(Trt), Gly, Thr, или Ser. Применение 5% пиперазина в 0.1 M HOBt для раствора депротектора помогает уменьшить количество образующегося аспартимида. Хотя скорость удаления защитных групп в растворе пиперазина при традиционном методе синтеза меньше, при микроволновом методе время протекания реакции не отличается от такого при применении пиперидина. Хроматограмма галанина (1), синтезированного традиционным методом, чистота менее 10 % Хроматограмма галанина (1), синтезированного микроволновым методом, чистота 84,8% - Существует ряд публикаций о проявлении синтезированными в микроволновом реакторе пептидами биологической активности. Синтетический обогащенный пролином пептид A3-APO оказался эффективным антибиотиком по отношению к устойчивым ко многим лекарственным препаратам клиническим изолятам бактерий семейства Enterobacteriaceae [3]. На системе Liberty синтезированы активные аналоги α-конотоксина [4], A- и B-цепи трех гормонов семейства релаксинов [5], а также последовательность из 51 остатка аминокислот, представляющая собой основной связывающий гепарин сайт (60-110) плейотрофина человека [6]. Точный контроль температуры реакционной смеси позволяет избежать ее перегрева, что делает возможным применение микроволн и в химии ферментов – есть примеры синтезов с добавлением стабильных и эффективных биокатализаторов (модифицированных ферментов) [7]. Одним из последних достижений применения микроволновых систем является синтез пептидо-нуклеиновых кислот [8]. Пептидо-нуклеиновые кислоты – незаряженные молекулы, имеют псевдопептидныйскелет. Их олигомеры формируют химически и метаболически стабильные дуплексыс нуклеиновыми кислотами по принципу комплиментарности. Потенциально эти соединения могут применяться в антисенс-диагностике и терапии. Условия синтеза: 1. немикроволновый 2. 20% пиперидин / ДМФА 3. HBTU/DIEA 4. смола tyr(tBu)-Wang Значительная потеря Arg Условия синтеза: 1. микроволновый 2. 20% пиперидин / ДМФА 3. HBTU/DIEA 4. смола tyr(tBu)-Wang Значительная потеря Arg Формирование аспаримида Условия синтеза: 1. микроволновый 2. 5% пиперазин w/ 0.1М HOBt/ ДМФА 3. HBTU/DIEA 4. смола PAL-ChemMatrix Отсутствие потерь Arg Список литературных источников: 1. Muray J.K., Aral J., Miranda L.P. Methods Mol Biol. 2011. 716. P. 73-88. 2. Cemazar M., Craik D.J. J Pept Sci. 2008. 14(6). P. 683-689. 3. Otvos J.L., Wade J.D., Lin F. et al. J Med Chem. 2005. 48. P. 5349-5359. 4. Armishaw C., Jensen A.A., Balle T. et al. J Biol Chem. 2009. 284(14). P. 9498-9512. 5. Hossein M.A., Rosengreen K.J., Haugaard-Jönsson L.M. et al. J Biol Chem. 2008. 283(25). P. 17287-97. 6. Friligou I., Papadimitriou E., Gatos D., Matsoukas J., Tselios T. Amino Acids. 2011.40(5). P. 1431-1440. 7. Rejasse B., Lamare S., Legoy M.D., Besson T. J Enzyme Inhib Med Chem. 2007. 22(5). P. 518-526. 8. Fabani M.M., Abreu-Goodger C., Williams D. et al. Nucleic Acids Research. 2010. 38. Р. 4466-4475. 9. Karas J.A., Boland M., Haigh C. et al. Int J Pept Res Ther. 2012. 18. P. 21-29. В докладе представлены данные J.M. Collins, S.A. Palasek, Z.J. Cox и G. Vanier специалистов отдела биологических наук СЕМ Corporation (США) - Синтез фосфопептидов Фосфатную группу в аминокислоты вводят во время синтеза, чтобы избежать сложного постсинтетического фосфорилирования пептида. Однако фосфорилированные остатки аминокислот для присоединения их к растущей последовательности пептида требуют много времени. С помощью микроволнового реактора можно значительно сократить время синтеза фосфопептида. Тест-пептид: EIVPN(pS)VEQK-OH Традиционное удаление защитных групп: 20% пиперидин в ДМФА - 5 мин, затем 15 мин при комнатной температуре Традиционное присоединение: 60 мин, HBTU/DIEA, 5-кратный избыток Микроволновое присоединение: HBTU/DIEA с пятикратным избытком аминокислот и простой стадией присоединения 5 мин при 75 °C. Результат HPLC при традиционном удалении защитных групп и присоединении Результат HPLC при традиционном удалении защитных групп и микроволновом присоединении - синтез пептидов, содержащих аминокислоты, присоединение которых затруднено из-за стерических особенностей, например, N-метилированных аминокислот. - синтез циклических пептидов Заключение: - Использование микроволновой энергии в процессе синтеза пептидов на стадиях удаления защитных групп и присоединения значительно сокращает общее время синтеза, позволяет получить более чистый целевой продукт с хорошим выходом - Во избежание протекания побочных реакций для присоединения остатков Cys, His, Arg, Asp необходимы особые условия - Применение микроволновых систем позволяет синтезировать в сравнительно короткий срок пептиды, синтез которых в обычных условиях затруднен или невозможен - В настоящее время интерес к микроволновому синтезу, широко распространенный в США, Китае и странах Запада, возрастает и в России. Метод чрезвычайно полезен при оптимизации пептидных фармпрепаратов и создании пептидных библиотек. Resume. Solid-phase synthesis is one of the main methods of peptide synthesis. But it is long time multistep process, and do not always lead to the target product with desired yield. Solid-phase synthesis of peptides with help of microwave method of heating enables tenfold reduction of synthesis time. The microwave irradiation influence prevents of peptidyl-polymer aggregation that allows of long (up to 111 amino acid residues) and difficult for conventional methods peptides synthesis. Consequently theme about capabilities and prospects of application of contemporary microwave systems is very topical. In this paper we present a brief review of the peptides, which was synthesized by different users of unattended microwave system Liberty (CEM Corp., USA). Controlled conditions of synthesis on Liberty (power of irradiation, temperature, rate of heating) permits to give target product with high purity degree and good yield, allows avoiding of racemization. Liberty is capable to consecutive synthesizing up to 12 peptides (Fmoc и t-Boc) in a day. Nowadays there is a growing interest in the microwave synthesis in Russia. Microwave s ynthesis is extremely useful for optimization of peptide drugs and for the creation of peptide libraries. CEM Corp. (США) – крупнейший производитель лабораторного микроволнового оборудования с 30-летним опытом работы За дополнительной информацией обращайтесь к официальному дистрибьютору: тeл. (495) 221-19-61, факс (495) 640-78-39, e-mail: info@analyt.ru , сайт: www.analyt.ru


