П. стр. 156-165, стр.172-176. а
advertisement

Лекция 14
Адсорбция.
П. стр. 156-165, стр.172-176.
Определение.
Адсорбция (явление) - это изменение концентрации вещества в поверхностном слое по
сравнению с концентрацией в объемной фазе.
Адсорбцией (величиной), а или , называют количество адсорбированного вещества,
пв
i ,отнесенное к единице поверхности
n
niпв
, a
.
Избыточной адсорбцией (адсорбцией по Гиббсу, ИЮПАК) вещества i называют разность
между количеством вещества i в реальной системе и системе сравнения. Эту разность
ni пв
- это избыточная
ni относят к площади поверхности раздела фаз Ω. Величина i
адсорбция по Гиббсу.
При послойной адсорбции можно говорить о степени заполнения слоя
am
a
am
(1)
- адсорбция при полном заполнении слоя.
Адсорбция происходит на границе раздела двух фаз. Граница поверхностного слоя размыта,
определить её положение, т.е. объём поверхностного слоя, практически трудно. Это можно
понять, если представить себе слой на границе раздела двух жидкостей, жидкости и газа.
Возникает вопрос о способе измерения адсорбции. Как определить, какая доля вещества
находится в поверхностном слое, а какая в объемной фазе?
Два взгляда на поверхностный слой и адсорбцию:
а) поверхностный слой - это объем толщиной d; количество вещества в этом слое,
отнесенное к единице поверхности – полная адсорбция.
б) точно определить границу поверхностного слоя трудно, адсорбция - это избыточная
величина, определяемая, как разность между системой, обладающей поверхностным слоем и
системой без поверхностного слоя.( см. рис.1, 2)
Лекция 14
1
1
n1
V
Фазовая граница
Фаза II
Фаза I
1 ( II )
1 ( I )
Z”
Z’
Z
Границы поверхностный слой
Рис.1. Полная адсорбция ( зеленая+синия области ) и избыточная адсорбция (синяя область)
по Гиббсу компонента 1 на границе фаз I и II. 1 ( I ); 1 ( II ) - плотности компонента 1 в
фазах I и II . Показаны границы адсорбционного слоя
Z ' и Z ".
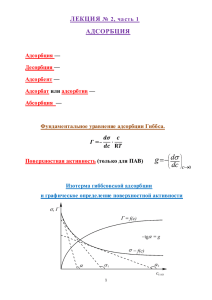
Термодинамическое определение избыточной адсорбции по Гиббсу
Получим термодинамическое уравнение для определения избыточной адсорбции.
Построим систему сравнения и сопоставим её свойства со свойствами реальной системы (см.
рис.2).
Система сравнения ( гипотетическая система) состоит из двух фаз. У нее нет поверхностного
слоя. Граница раздела фаз в системе сравнения - математическая линия, поверхностное
натяжение отсутствует. Плотность вещества в каждой из фаз I и II постоянна до границы
раздела (см. рисунок 1).
Реальная система содержит поверхностный слой, границы которого не определены точно, и
поверхность раздела, площадью . Она обладает поверхностной энергией (натяжением) .
В выражение (2а) для полного дифференциала внутренней энергии реальной системы
добавляется слагаемое, связанное с работой по увеличению поверхности, σ
(I)
(II)
dΩ . Объем
реальной системы равен объёму системы сравнения, V = V + V . Температура,
давление, химические потенциалы компонентов в реальной системе и системе сравнения
одинаковы.
Запишем фундаментальные уравнения для реальной системы и системы сравнения:
Лекция 14
2
dU р TdS р pdV р d i dni р
(2а)
i
dU
cр
dU ( I ) dU ( II ) TdS pdV i dni
I
I
I
i
TdS
II
pdV
II
(2б)
i dni
II
i
dU пв TdS пв d i dni пв
(2в)
i
U(Рл)=f(V(Рл), S(Рл), ni(Рл
(II)
T, p, δ, μi
U(Пв)=f(,S(Пв),
n1
U(II)=f(V(II), S(II), ni(II))
T, p, μi
(Пв))
T, δ, μ1
(I)
Реальная система
U(I)=f(V(I), S(I), ni(I))
Система сравнения
Рис.2 Избыточная адсорбция по Гиббсу. Реальная система
сравнения
(I+II)
(справа). Показан поверхностный слой
(Рл)
(Пв)
(слева), и система
(синий цвет).
.
Объем, энтропия, числа молей в реальной системе равны
V ( р ) V ( I ) V ( II ) ; S ( р ) S I S II S ( пв ) ; ni( р ) ni( I ) ni( II ) ni( пв )
Выражение (2в) получается вычитанием (2б) из (2а):
Лекция 14
3
Это фундаментальное уравнение для поверхностного слоя.
Внутренняя энергия является однородной функцией своих переменных в уравнении (2в),
поэтому, по теореме Эйлера
U ( пв ) TS ( пв ) i ni( пв )
(3)
i
Применить теорему Эйлера к (2а) нельзя, поскольку площадь и объем не могут быть
переменными для одной однородной функции.
Величины
ni( пв ) ni( р ) ni( I ) ni( II ) - это избыточное
количество компонента i (см.
рисунок 1).
Из (3) и (2в) получим аналог уравнения Гиббса-Дюгема для поверхностного слоя:
S ( пв ) dT d ni( пв ) d i 0
(4)
i
При постоянной температуре, разделив на
левую часть (4) получим
ni( пв )
d
d i d i d i 0
i
i
или
ai i
i T , j
(5)
Выражение (5) дает термодинамическое определение адсорбции. Химические потенциалы
при равновесии одинаковы в граничащих фазах и поверхностном слое. Производная в правой
части (5) измерима.
Уравнение (5) дает возможность определять адсорбцию на границе раздела жидкой фазы и
газа или двух жидких фаз. Рассмотрим простейший случай. В двухкомпонентной системе газ
(А) – жидкий раствор (А-В) происходит существенная адсорбция одного из компонентов
(А), второй же компонент практический не адсорбируется.
В этом случае уравнение (5)
можно переписать в виде:
Лекция 14
4
aA
A T ,B
RT ln p A T ,B
RT ln x A T ,B
(6)
В правой части мы используем выражения для химического потенциала компонента в
идеальном газе и разбавленном растворе, подчиняющемся закону Генри. Производные в
уравнении (6) измеримы.
Рассмотрим адсорбцию на границе твердое вещество – газ. В этом случае величина
быть определена весовым методом.
a может
Термодинамический вывод уравнения Ленгмюра.
Уравнение Ленгмюра связывает адсорбцию вещества на поверхности, a , с давлением пара
того же вещества над поверхностью, p . В уравнении Ленгмюра речь идет о монослойной
адсорбции, т.е. вещество может покрывать поверхность только одним слоем.
Адсорбция происходит на однородной поверхности, покрытой адсорбционными центрами.
Адсорбция рассматривается, как “химическое” равновесие между свободным адсорбционным
центром, молекулой в газе и адсорбировавшейся молекулой (молекула + центр, адсорбат).
На поверхности свободные центры и адсорбат образуют идеальный раствор.
Химический потенциал адсорбата на поверхности:
ад (пв ) ад0 (пв ) RT ln
Химический потенциал cвободных адсорбционных центров:
ц (пв ) ц0 (пв ) RT ln(1 )
Стандартные потенциалы определяются при θ
= 1 и θ = 0, соответственно.
Условие равновесия при монослойной адсорбции:
ц0 (пв ) RT ln(1 ) + 0 ( газ ) RT ln
p
=
p0
ад (пв ) ад0 (пв ) RT ln
0
GT0 ад
(пв ) 0 ( газ ) ц0 (пв ) RT ln K
(7)
Отсюда, термодинамическая константа равновесия адсорбции равна
Лекция 14
5
K
p
1 0
p
;
Практическая константа адсорбции равна
Kp
.
1 p
(8)
Далее,
K p p K p p ,
Kp p
1 K
p
(9)
p
a am am
Kp p
1 K
p
p
(10)
Последняя строчка представляет собой уравнение Ленгмюра для монослойной адсорбции.
При
p , 1, a am .
При малых p справедливо уравнение Генри для адсорбции
a am K p p
(11)
Изотерма монослойной адсорбции Ленгмюра приводится на рисунке 3.
Лекция 14
6
a
a am am
Kp p
1 K p p
am
1
Область Генри,θ 0
p
Рис. 3. Изотерма Ленгмюра.
Основные постулаты модели Ленгмюра:
1) На поверхности каждый адсорбционный центр взаимодействует только с одной
молекулой;
2) Адсорбционные центры и адсорбированные молекулы образуют на поверхности
идеальный раствор.
В уравнении (10) можно перейти к обратным координатам:
1
1
1
a am * K p * p am
(12)
Обработка экспериментальной линейной зависимости 1/
предельное заполнение
a
от 1/p даст константу
Kp и
am .
Изобара адсорбции - это зависимость а от температуры Т при постоянном давлении.
Зависимость константы адсорбции от температуры имеет вид:
0
ln K p
H ad
2
T
R
T
p
(13)
Лекция 14
7
Энтальпия адсорбции всегда меньше нуля, поэтому с ростом температуры
K p стремится к
нулю и адсорбция стремится к нулю:
a am am
Kp p
1 K
p
p
0; T ;
(14)
Наоборот, при Т0 степень заполнения стремиться к единице.
Изостера адсорбции - это зависимость давления от температуры при фиксированной степени
заполнения. Изостерическая теплота десорбции
ln K p
H
H ad
ln p
2
RT 2
T RT
T
(15)
Формула (15) следует из (9) и (13).
Для того, чтобы с ростом температуры степень заполнения сохранялась, нужно, чтобы
равновесное давление росло с той же скоростью, с какой падает константа равновесия
адсорбции.
Конкурентная адсорбция по Ленгмюру.
Допустим, что на одной поверхности адсорбируются одновременно
i
компонентов.
Постулаты Ленгмюра сохраняются. Тогда условие равновесия для компонента i имеет вид
K p( i )
i
(16)
0 pi
где i ; 0 - доля адсорбционных центров, занятых молекулами компонента i и свободных
центров на поверхности, соответственно.
Выразим из этого уравнения i :
i K p( i ) 0 pi
(17)
Доля свободных центров 0 равна
Лекция 14
8
0 1 i 1 K p( i ) 0 pi ; 0
i
i
1
1 K p( i ) pi
(18)
i
Для степени заполнения любого компонента получаем:
i 0 K pi
(i )
p
K p( i ) pi
(19)
1 K p( i ) pi
i
Адсорбция любого компонента
ai ami am
i выражается формулой
K p( i ) pi
(20)
1 K p( i ) pi
i
Предельная адсорбция
am одинакова для всех компонентов.
Неленгмюровские изотермы.
Экспериментальные изотермы не всегда описываются уравнением Ленгмюра. Возможные
причины отклонений :
1) Неоднородность поверхности.
2) Зависимость К р от степени заполнения, часто - уменьшение константы адсорбции по мере
увеличения степени заполнения.
3) Ассоциация адсорбированных молекул на поверхности.
Эмпирические изотермы описывают адсорбцию при определенных степенях заполнения
(редко – изотермы целиком!):
a const p
1
n
, где n
= 1-5, (изотерма Френдлиха)
am = С 1 + С 2 ln p (логарифмические изотермы)
Изотерма БЭТ.
Лекция 14
9
Уравнение БЭТ связывает адсорбцию вещества на поверхности, a , с давлением пара того
же вещества над поверхностью, p . Уравнение описывает полимолекулярную адсорбцию. На
каждом адсорбционном центре может находиться к молекул адсорбата (от к = 0 до
бесконечности).
C
K1
K1 ps
K2
1
K2
ps
am
K1
1 7
0
3
Рис. 4. Основные параметры модели БЭТ. В результате обработки экспериментальных
данных определяются параметры С и а m .
0 до давления насыщенного пара
ps . Когда давление достигает ps , начинается конденсация
Модель описывает адсорбцию в интервале давлений от
адсорбируемого вещества
вещества на поверхности. Образуется объемная фаза.
Лекция 14
10
p
0<p<ps
ps
T
Рис. 5. Интервал давлении на диаграмме состояния адсорбируемого вещества, в котором
происходит адсорбция.
На каждом адсорбционном центре может находиться от
(θ 0 + θ 1 +.... θ к …) = 1
0 до k
молекул адсорбата, поэтому
(21)
0 ;i доля свободных центров и центров, на которых адсорбировано i молекул,
соответственно.
Первый слой адсорбированного вещества взаимодействует с поверхностью. Равновесие
описывается константой
K1 :
К 1 = θ 1 /(θ 0 )p; θ 1 = К 1 (θ 0 )p
(22)
Для равновесия во втором слое, где молекулы адсорбата взаимодействуют с молекулами
адсорбата из первого слоя, справедливо соотношение:
К 2 = θ 2 /{(θ 1 )*p}
Значение константы
K2
(23)
K 2 в модели задается
1
ps
(24)
Лекция 14
11
Следовательно,
2 K 2 p 1 1
p
ps
(25)
Введем параметр С:
С = К 1 /К 2 = К 1 p s
(26)
В результате, из (24), (25) и (21) получаем:
p
θ 2 = (θ 1 )*(p/p s ) = К 1 θ 0 р* (p/ p s ) = C 0
p
s
2
Равновесие в любом слое, начиная со второго, описывается с помощью константы
(27)
K 2 . Она
характеризует взаимодействие адсорбат-адсорбат. Для слоя с номером к получим
K2
k
k 1 p
; k K 2 k 1 p
p
k 1 K 2 k 2 p; k k 2
ps
p
ps
k 1
k 1
p
K1 0 p
ps
k
В результате, для любого
p
k C 0
ps
2
и т.д.;
k 1
(28)
получаем:
k
(29)
Подставляем (29) в (21)
(θ 0 + С*( θ 0 )* (p/ p s ) + С*(θ 0 )* (p/ p s ) 2 +.... С*(θ 0 )* (p/ p s ) к...) = 1
Лекция 14
12
θ 0 *( 1 +C*{ (p/ p s ) + (p/ p s ) 2 +.... (p/ p s ) к...)} = 1
(30)
В фигурных скобках - бесконечная геометрическая прогрессия без первого слагаемого
(единицы!), причем (p/ p s )<1. Сумма в фигурных скобках равна
p / p
k
s
к
1 ( p / ps ) k
1
1
1
1 ( p / ps )
1 ( p / ps )
(31)
следовательно, получаем из (30) и (31)
1 p / p s C C C * ( p / ps )
C
C *
1 p / ps
1 p / ps
1 (C 1) * ( p / ps )
*
1
p
p
1
/
s
* 1
(32)
В результате:
1 p / ps
1 (C 1) * ( p / ps )
(33)
Теперь запишем выражение для адсорбции. Нужно учесть, сколько именно молекул
находится на каждом адсорбционном центре. Посмотрим на формулу (30). Первое
слагаемое в скобках, единица, пропадает, поскольку это доля свободных центров. Выносим за
скобки (p/ p s ):
a = a m *C* (p/ p s )* θ 0 {1 + 2* (p/ p s ) +.... k* (p/ p s ) к-1...}
(34)
a m - это предельная адсорбция в слое. В модели БЭТ она одинакова во всех слоях, т.е. в
заполненном слое с любым номером находится одинаковое количество адсорбированных
молекул. Остается провести суммирование.
Заметим, что выражение в фигурных скобках в уравнении (34) - это производная от
выражения в скобках (30).
Лекция 14
13
Поэтому, продифферециировав по (p/
1
1 ( p / ps )
2
p s ) сумму
1
1 , получим
1 ( p / ps )
.
Выражение для адсорбции (34) преобразуется к виду
p
am 0C
ps
a
2
p
1
ps
(35)
Подставляем выражение для θ 0 из (33) в
a
(35), получаем:
am * C * ( p / ps ) * (1 ( p / ps ))
am * C * ( p / ps )
{1 (C 1) * ( p / ps )}*{1 ( p / ps )}2 {1 (C 1) * ( p / ps )}*{1 ( p / ps )}
(36)
am и C . Первая из них особенно
интересна. Это предельное количество молекул в слое. С помощью am определяют площади
Уравнение содержит две неизвестных константы -
поверхностей, на которых идет адсорбция (чаще всего по азоту!).
Перегруппировываем сомножители, берем обратные величины от обеих частей
1
1
1
1
C 1
a
p a m C p am C
1
ps
ps
(37)
a и отношение давлений
p
1
.
Правая
часть
–
это
линейная
функция
от
аргумента
.
p
ps
ps
В уравнении (37) слева – измеримые величины: адсорбция
Лекция 14
14
Уравнение БЭТ представляют в виде
y
1
C 1
x
amC
amC
1
p
1
a
ps
1
1
am C
am
Sпв
NA SN2
MN2
C 1
am C
p
ps
1
Рис. 5. График экспериментальной линейной зависимости, с помощью которого в методе БЭТ
определяют параметр a m .
По экспериментальным значениям
x
и
y
определяют
C и am . Константа am позволяет
определить эффективную площадь поверхности образца (метод БЭТ):
g
s
a
m
NA
m2
g
S
M
g
s - эффективная площадь, занимаемая одной молекулой адсорбата. Чаще всего для
определения эффективной площади используют адсорбат азот.
s ( N 2 ) 15*10-20 m2.
Обсуждение модели БЭТ.
Лекция 14
15