1 Лекция: «КАРБОНОВЫЕ КИСЛОТЫ» Ст. преподаватель
advertisement
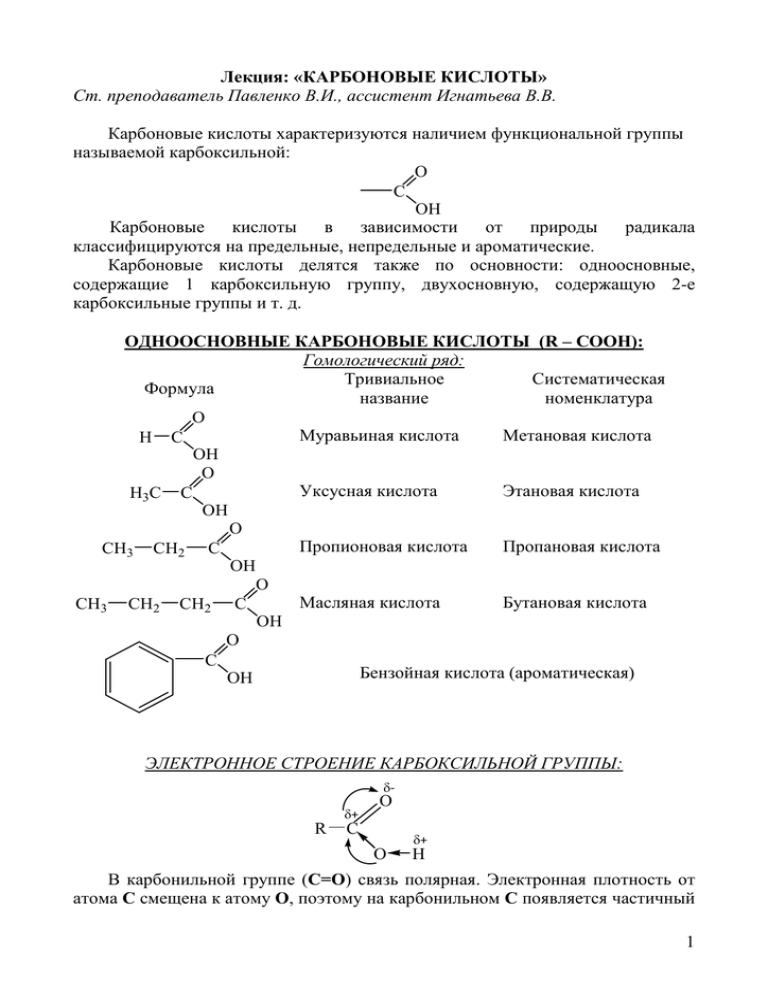
Лекция: «КАРБОНОВЫЕ КИСЛОТЫ» Ст. преподаватель Павленко В.И., ассистент Игнатьева В.В. Карбоновые кислоты характеризуются наличием функциональной группы называемой карбоксильной: O C OH Карбоновые кислоты в зависимости от природы радикала классифицируются на предельные, непредельные и ароматические. Карбоновые кислоты делятся также по основности: одноосновные, содержащие 1 карбоксильную группу, двухосновную, содержащую 2-е карбоксильные группы и т. д. ОДНООСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ (R – COOH): Гомологический ряд: Тривиальное Систематическая Формула название номенклатура O Муравьиная кислота Метановая кислота H C OH O Уксусная кислота Этановая кислота H3C C OH O Пропионовая кислота Пропановая кислота CH3 CH2 C OH O Масляная кислота Бутановая кислота CH3 CH2 CH2 C OH O C Бензойная кислота (ароматическая) OH ЭЛЕКТРОННОЕ СТРОЕНИЕ КАРБОКСИЛЬНОЙ ГРУППЫ: δ- δ+ R O C δ+ O H В карбонильной группе (С=О) связь полярная. Электронная плотность от атома С смещена к атому О, поэтому на карбонильном С появляется частичный 1 положительный заряд. Стремясь компенсировать свой заряд, атом С притягивает к себе неподеленную пару е− атома О гидроксильной группы (ОН). В свою очередь атом О оттягивает электронную плотность связи О – Н , в результате атом Н становится подвижным и его отрыв в виде протона облегчается. ХИМИЧЕСКИЕ СВОЙСТВА: 1. ДИССОЦИАЦИЯ КИСЛОТ: O R C OH O R C + H+ Oкарбоксилатанион протон Карбоксилат-анион является гибридной формой 2-х равноценных по энергии резонансных структур: OO O R C R C R C O O O Делокализация (распределение) отрицательного заряда приводит к стабилизации аниона. Таким образом, карбоксилат-анион стабилизирован резонансом, благодаря которому отрицательный заряд распределяется по всем трем атомам группы. Анион, в котором отрицательный заряд распределен между двумя атомами кислорода, устойчивее, чем анион, в котором отрицательный заряд локализован на одном кислороде (в спиртах), поэтому карбоксилат-анион имеет меньшую тенденцию присоединять протон обратно, чем алкоголят-ион. Карбоновые кислоты проявляют выраженные кислотные свойства. Самой сильной кислотой является муравьиная: с увеличением углеводородного радикала сила кислоты снижается. Электроноакцепторные заместители увеличивают кислотные свойства, а электронодонорные – уменьшают. 2. ОБРАЗОВАНИЕ СОЛЕЙ С МЕТАЛЛАМИ И ЩЕЛОЧАМИ: O O + Na H3C C H3C C + H2 OH ONa ацетат натрия O H C O + NaOH OH H C + H2O ONa формиат натрия 2 3. РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ (SN). А) Реакция этерификации (получение сложных эфиров): Карбоновые кислоты при нагревании в присутствии катализатора реагируют со спиртами, образуя сложные эфиры: O O H3C C + H2O H3C C + C2H5OH O C2H5 OH этилацетат (этиловый эфир уксусной кислоты) O H C O + CH3OH OH кислотного H C + H2O O CH3 метилформиат (метиловый эфир муравьиной кислоты) Эфиры имеют приятные запахи, например, персика, апельсина, фруктового сока: O CH3 CH2 CH2 C O CH2 CH3 этилбутират – имеет запах яблока Б) Образование амидов: O O + NH3 + H2O H3C C H3 C C NH2 OH аммиак амид уксусной кислоты O O CH3 CH2 C CH3 CH2 C + NH3 + HCl Cl NH2 амид пропионовой кислоты В) Образование ангидридов кислот: O O + P2O5 H3C C 2 H3C C O OH - H3PO4 H3C C O уксусный ангидрид Г) Образование галогенангидридов: O O + PCl5 + POCl3 + HCl H 3C C H 3C C OH Cl ацетилхлорид хлороангидрид уксусной кислоты 3 4. ЗАМЕЩЕНИЕ ВОДОРОДА У α–УГЛЕРОДНОГО АТОМА O O H H t + Br2 CH3 C C + HBr CH3 C C OH OH Br H пропионовая кислота α - бромпропионовая кислота ДИКАРБОНОВЫЕ КИСЛОТЫ. НАСЫЩЕННЫЕ И НЕНАСЫЩЕННЫЕ (С ДВОЙНЫМИ СВЯЗЯМИ) НОМЕНКЛАТУРА: Тривиальное название Формула Систематическая номенклатура COOH Щавелевая кислота Этандиовая кислота Малоновая кислота Пропандиовая кислота Янтарная кислота Бутандиовая кислота Глутаровая кислота Пентандиовая кислота Фумаровая кислота транс-бутендиовая кислота Малеиновая кислота цис-бутендиовая кислота COOH COOH H2C COOH COOH H2C 2 COOH COOH H2C H 3 COOH COOH C C HOOC HOOC H COOH C H C H 4 ХИМИЧЕСКИЕ СВОЙСТВА: Все дикарбоновые кислоты более сильные кислоты, чем одноосновные с тем же числом атомов углерода. Кислотность 2-х основных кислот тем выше, чем короче цепь атомов углерода, связывающих карбоксильные группы. Щавелевая кислота – самая сильная. Двухосновные кислоты вступают в те же реакции, что и одноосновные. 1. ПОЛУЧЕНИЕ СОЛЕЙ: COOH COONa + NaOH COOH щавелевая к-та -H2O + NaOH -H O 2 COOH кислая соль COONa COONa средняя соль (оксалат натрия) 2. ПОЛУЧЕНИЕ ЭФИРОВ: C O OH C O O C + CH3OH C OCH3 OCH3 + CH3OH -H2O OH щавелевая кислота O C -H2O C OH неполный эфир 3. ПОЛУЧЕНИЕ АМИДОВ. O O C C C OH NH2 + NH3 + NH3 -H2O -H2O O O C C C OH OH щавелевая кислота неполный амид O O OCH3 полный эфир (диметилоксолат) O NH2 O NH2 полный амид ОТЛИЧИТЕЛЬНЫЕ РЕАКЦИИ, ХАРАКТЕРНЫЕ ТОЛЬКО ДЛЯ ДВУХОСНОВНЫХ КИСЛОТ: ОТНОШЕНИЕ К НАГРЕВАНИЮ: Декарбоксилирование (отщепление СО2): COOH t - CO2 t HCOOH CO + H2O COOH щавелевая кислота 5 COOH t H2C CH3COOH - CO2 COOH малоновая кислота Дегидратация (отщепление воды): O O H2 C C H2C C OH t O O -H O 2 H2 C C H2C C OH O янтарная кислота ангидрид янтарной кислоты O O HC C HC C OH t O O -H O 2 HC C HC C OH O малеиновая кислота ангидрид малеиновой к-ты (цис-изомер) Фумаровая кислота (транс-изомер) этой реакции при нагревании не дает вследствие удаления карбоксильных групп в пространстве. БИОЛОГИЧЕСКАЯ РОЛЬ ДИКАРБОНОВЫХ КИСЛОТ. Щавелевая кислота образует труднорастворимые соли (оксалаты), которые образуют камни в почках и мочевом пузыре (оксалатные камни). К таким солям относится оксалат кальция. Янтарная кислота содержится в янтаре и в недозрелых фруктах. Фумаровая кислота участвует в обменных процессах пртекающих в организме. В частности, она является промежуточным соединением в цикле Кребса (трикарбоновых кислот). НЕНАСЫЩЕННЫЕ КАРБОНОВЫЕ КИСЛОТЫ (ОДНООСНОВНЫЕ). Тривиальное название Формула Систематическая номенклатура O CH3 C H CH C Кротоновая кислота Бутеновая кислота Акриловая кислота Пропеновая кислота OH O H2 C CH C OH 6 За счет карбоксильной группы ненасыщенные кислоты вступают в реакции, характерные для насыщенных кислот, в часности они образуют соли, галогенангидриды, ангидриды, сложные эфиры, амиды. По кратной связи в углеводородном радикале ненасыщенные кислоты проявляют свойства алкенов. Так, для них характерны реакции присоединения, окисления и полимеризации. Однако присоединение галогеноводородов к ненасыщенным кислотам протекает против правила Марковникова вследствие электроноакцепторного влияния карбоксильной группы δ- δ+ H2C CH O + HCl C CH3 H C O C OH OH Cl Характерной особенностью акриловой кислоты является ее способность к полимеризации. Она является основой для волокна нитрон, используемого для производства лечебного белья. Эти кислоты являются промежуточными продуктами в цикле Кребса. АРОМАТИЧЕСКИЕ МОНОКАРБОНОВЫЕ КИСЛОТЫ Простейшим представителем является бензойная кислота. Реакционная способность бензойной кислоты обусловлена наличием в ее структуре карбоксильной группы и бензольного кольца. По карбоксильной группе для нее характерны реакции, свойственные насыщенным монокарбоновым кислотам, а именно, образование солей, галогенангидридов, ангидридов, сложных эфиров. При нагревании бензойной кислоты в присутствии медного порошка происходит ее декарбоксилирование с образованием бензола и углекислого газа. За счет бензольного кольца бензойная кислота вступает в реакции электрофильного замещения (нитрование, сульфирование, галогенирование), свойственные ароматическим углеводородам. Являясь ориентантом ІІ рода, карбоксильная группа направляет замещение в мета-положение. O O C C H2SO4 OH + HNO OH 3 -H2O бензойная кислота NO2 мета-нитробензойная кислота. 7