Аминокислоты: Строение и свойства боковых радикалов
advertisement
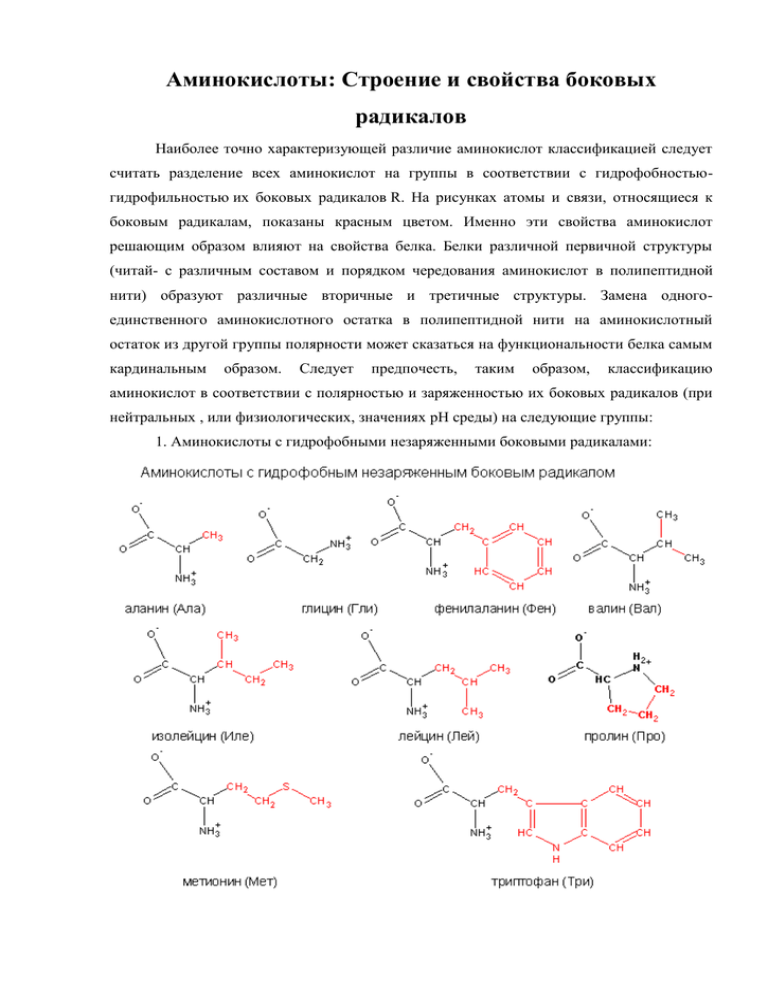
Аминокислоты: Строение и свойства боковых радикалов Наиболее точно характеризующей различие аминокислот классификацией следует считать разделение всех аминокислот на группы в соответствии с гидрофобностьюгидрофильностью их боковых радикалов R. На рисунках атомы и связи, относящиеся к боковым радикалам, показаны красным цветом. Именно эти свойства аминокислот решающим образом влияют на свойства белка. Белки различной первичной структуры (читай- с различным составом и порядком чередования аминокислот в полипептидной нити) образуют различные вторичные и третичные структуры. Замена одногоединственного аминокислотного остатка в полипептидной нити на аминокислотный остаток из другой группы полярности может сказаться на функциональности белка самым кардинальным образом. Следует предпочесть, таким образом, классификацию аминокислот в соответствии с полярностью и заряженностью их боковых радикалов (при нейтральных , или физиологических, значениях рН среды) на следующие группы: 1. Аминокислоты с гидрофобными незаряженными боковыми радикалами: 2. Аминокислоты с гидрофильными незаряженными радикалами. Участки белка, содержащие такие аминокислотные остатки способны гидратироваться и взаимодействовать водородными связями с другими аналогичными остатками. 3. Аминокислоты с боковыми радикалами, заряженными положительно при нахождении в водных растворах с нейтральными или близкими к нейтральным значениямрН. Изоэлектрическая точка этих аминокислот значительно больше 7,0 и они имеют избыточный положительный заряд при нейтральных рН. Белки, содержащие превалирующие количества таких аминокислотных остатков называют щелочными, поскольку их изоэлектрическая точка также больше 7,0. 4. Аминокислоты с отрицательным зарядом в боковой цепи радикала. Изоэлектрическая точка этих аминокислот меньше 7,0. Следует, однако, иметь в виду, что такое разделение аминокислот в значительной степени условно, поскольку такие аминокислоты, как глицин практически не имеют бокового радикала, тирозин, например, может проявлять как гидрофильные, так и гидрофобные свойства. Это же касается и аминокислоты метионин. Тем не менее, подобного рода классификация в наибольшей степени отражает функциональные различия аминокислот. Кислотно-основные свойства аминокислот и pI 20 протеиногенных аминокислот млекопитающих Название АЛАНИН ВАЛИН ЛЕЙЦИН ИЗОЛЕЙЦИН МЕТИОНИН ТРИПТОФАН pKa pKa pKa pI aбоковой Структура (R-CH(NH2)-COOH) aCOOH NH3+ цепи неполярные гидрофобные CH3-CH(NH2)-COOH 2,34 9,69 6,01 (CH3)2CH-CH(NH2)-COOH 2,32 9,62 5,96 CH3-CH(CH3)-CH2-CH(NH2)-COOH 2,36 9,60 5,98 CH3-CH2-CH(CH3)-CH(NH2)-COOH 2,36 9,68 6,02 CH3-S-(CH2)2-CH(NH2)-COOH 2,28 9,21 5,74 2,38 9,39 5,89 ФЕНИЛАЛАНИН ТИРОЗИН ПРОЛИН Ph-CH2-CH(NH2)-COOH HO-Ph-CH2-CH(NH2)-COOH 1,83 2,20 1,99 9,13 9,11 10,07 10,6 - 5,48 5,66 6,30 ГЛИЦИН CH2(NH2)-COOH полярные незаряженные HO-CH2-CH(NH2)-COOH CH3-CH(OH)-CH(NH2)-COOH HS-CH2-CH(NH2)-COOH NH2-C(=O)-(CH2)2-CH(NH2)-COOH NH2-C(=O)-CH2-CH(NH2)-COOH положительно заряженные NH2-(CH2)4-CH(NH2)-COOH NH2-C(=NH)-NH-(CH2)3-CH(NH2)COOH 2,34 9,60 - 5,97 2,21 2,71 1,71 2,17 2,02 9,15 9,62 8,18 9,13 8,60 5,68 6,16 5,02 5,65 5,41 2,18 2,17 9,12 10,53 9,04 12,84 9,82 10,76 1,82 9,17 6,00 7,59 1,88 9,60 3,65 2,77 2,16 9,67 4,32 3,24 СЕРИН ТРЕОНИН ЦИСТЕИН ГЛУТАМИН АСПАРАГИН ЛИЗИН АРГИНИН ГИСТИДИН отрицательно заряженные COOH-CH2-CH(NH2)-COOH АСПАРАГИНОВАЯ КТА ГЛУТАМИНОВАЯ К-ТА HOOC-(CH2)2-CH(NH2)-COOH 10,28 -


