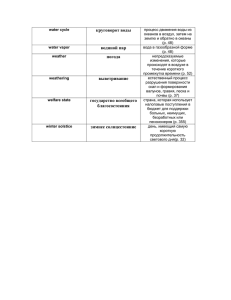
МИКРООРГАНИЗМЫ И ВИРУСЫ В ВОДНЫХ ЭКОСИСТЕМАХ
advertisement

УЧРЕЖДЕНИЕ РОССИЙСКОЙ АКАДЕМИИ НАУК ЛИМНОЛОГИЧЕСКИЙ ИНСТИТУТ СИБИРСКОЕ ОТДЕЛЕНИЕ РОССИЙСКОЙ АКАДЕМИИ НАУК МОО «МИКРОБИОЛОГИЧЕСКОЕ ОБЩЕСТВО» РОССИЙСКАЯ ЭКОЛОГИЧЕСКАЯ АКАДЕМИЯ LIMNOLOGICAL INSTITUTE OF THE SIBERIAN BRANCH OF THE RUSSIAN ACADEMY OF SCIENCES IOP «MICROBIOLOGICAL SOCIETY» RUSSIAN ACADEMY OF ECOLOGY МИКРООРГАНИЗМЫ И ВИРУСЫ В ВОДНЫХ ЭКОСИСТЕМАХ MICROORGANISMS AND VIRUSES IN AQUATIC ECOSYSTEMS Материалы 3-го Байкальского Микробиологического Симпозиума с международным участием Иркутск, 3–8 октября 2011 г. Abstracts of the 3-rd Baikal Symposium on Microbiology (BSM-2011) Irkutsk, October 3–8, 2011 Иркутск Издательство Института географии им. В.Б. Сочавы СО РАН 2011 УДК 579.8 М 59 Симпозиум проводился при финансовой поддержке Российского фонда фундаментальных исследований МИКРООРГАНИЗМЫ И ВИРУСЫ В ВОДНЫХ ЭКОСИСТЕМАХ / Материалы 3-го Байкальского Микробиологического Симпозиума с международным участием (Иркутск, 3–8 октября 2011 г.). – Иркутск: Издательство Института географии им. В.Б. Сочавы СО РАН, 2011. – 166 с. ISBN 978-5-94797-171-2 В сборнике тезисов представлены материалы 3-го Байкальского Микробиологического Симпозиума с международным участием по различным фундаментальным и прикладным аспектам водной микробиологии, а также вирусологии, исследования по которой стали активно проводиться лишь в последнее время: микробиальное разнообразие и процессы круговорота веществ, вирусы водоемов и их взаимодействие с микроорганизмами, симбиотические ассоциации и биопленки, микробиальная деградация поллютантов, микробиологический и вирусологический мониторинг водоемов. Также на Симпозиуме проведен «Круглый стол» и обсуждены методические вопросы по получению достоверной микробиологической и вирусологической информации на водоемах и водотоках. Специально проведены сессии молодых ученых для оценки результатов и актуальности выполняемых ими исследований. Организационный комитет: Дрюккер В.В. – председатель, проф., чл.-корр. РЭА, Лимнологический институт СО РАН, Россия Ан Т.С., проф., Кангвонский Университет, Корея Бузолева Л.С., проф., Дальневосточный государственный Университет, Россия Ватанабе Я., проф., Риссо Университет, Япония Гальченко В.Ф., чл.-корр. РАН, Институт микробиологии им. С.Н. Виноградского РАН, Россия Ганбаров Х.Г., проф., Бакинский Государственный Университет, Азербайджан Грачев М.А., академик РАН, Лимнологический институт СО РАН, Россия Дегерменджи А.Г., чл.-корр. РАН, Институт биофизики СО РАН, Россия Драбкова В.Г., проф., Институт озероведения РАН, Россия Земская Т.И., д.б.н., Лимнологический институт СО РАН, Россия Коломиец Э.И., чл.-корр. НАН Б, Институт микробиологии НАН Б, Беларусь Кондратьева Л.М., проф., Институт водных и экологических проблем ДВО РАН, Россия Копылов А.И., проф., Институт биологии внутренних вод им. И.Д. Папанина РАН, Россия Крылов В.Н., проф., НИИ вакцин и сывороток им. И.И. Мечникова РАМН, Россия Кутлиев Д., проф., Институт микробиологии АН РУз, Узбекистан Намсараев Б.Б., проф., Институт общей и экспериментальной биологии СО РАН, Россия Олейник Г.Н., проф., Институт гидробиологии НАН У, Украина Парфенова В.В., к.б.н., Лимнологический институт СО РАН, Россия Подгорский В.С., академик НАН У, Институт микробиологии и вирусологии им. Д.К. Заболотного НАН У, Украина Цэцэг Б., д.б.н., Институт биологии МАН, Монголия Белькова Н.Л., к.б.н. – ученый секретарь Симпозиума, Лимнологический институт СО РАН, Россия Подготовка материалов к печати – Н.Л. Белькова ISBN 978-5-94797-171-2 © Лимнологический институт СО РАН, 2011 2 Спонсоры Российский Фонд Фундаментальных Исследований ОАО «Иркутскэнерго» ЗАО «Научное оборудование» Байкальский музей ИНЦ СО РАН ООО «Аква» 3 4 К ВОПРОСУ БИОДЕСТРУКЦИИ ПОЛЛЮТАНТОВ В ВОДЕ АПШЕРОНСКОГО ПОБЕРЕЖЬЯ КАСПИЙСКОГО МОРЯ Алиев С.Н. Институт Микробиологии НАНА, г. Баку, Патамдарское шоссе, 40, Азербайджан e-mail: saribala-aliyev@rambler.ru Загрязнение окружающей среды является серьёзнейшей проблемой глобального значения. Это касается как наземных, так и водных экосистем. Одним из приоритетных загрязнителей во всем мире являются углеводороды нефти. В морской воде Каспийского моря источником углеводородов являются разрабатываемые в акватории Западного и ЮгоЗападного Каспия нефтяные месторождения, промышленные и бытовые стоки, сбрасываемые в море и впадающие в море реки. Одной из задач данной работы было выяснение роли микроорганизмов в процессах минерализации органических веществ углеводородного характера. С этой целью в воде определялось количество нефтеокисляющих и фенолокисляющих микроорганизмов. Результаты наблюдения на 6-ти станциях (о. Пираллахы, о. Жилой, Говсаны, Бак. Бухты, м. Шихово, Приморск) в зоне Апшеронского побережья Каспия показали, что максимальное количество нефтеокисляющих и фенолокисляющих бактерий отмечается летом и составляет 105 кл/мл. Сравнительно заметное увеличение углеводородокисляющих микроорганизмов наблюдается весной лишь в акваториях окружения островов Пираллахы, Жилого и в Бакинской бухте. Увеличение численности углеводородокисляющих бактерий в прибрежной зоне связано с влиянием береговой полосы, обеспечивающей микроорганизмов необходимым количеством аллохтонного органического субстрата различного происхождения. Изменение численности бактерий в течение года проявляется в каждом биотопе по-разному. В частности, по сравнению с остальными районами, в акваториях Бакинской бухты и м. Шихово численность нефтеокисляющих микроорганизмов за весь год оказывается на один-два порядка выше и это объясняется наличием в воде большого количества органического субстрата. Данные по концентрации нефти в водных образцах показали ее прямую корреляцию с максимальными значениями численности микроорганизмов. Несмотря на достаточно высокую скорость деструкционных процессов в водах исследованных акваторий Апшеронского побережья Каспийского моря (до 1,2 мгС/л) процессы самоочищения осложняются большим количеством аллохтонной органики со сложной структурой и сравнительно невысоким количеством углеводородокисляющей микрофлоры. Сравнительный анализ интенсивности биодеградации органических соединений в прибрежных водах Апшеронского побережья с аналогичными данными 2002 года свидетельствуют об ухудшении экологической обстановки, обусловленной техногенным и антропогенным воздействием на акваторию Бакинской бухты. TO THE BIO-DESTRUCTION OF POLLUTANTS IN THE COAST OF CASPIAN SEA ABSHERON PENINSULA S.N.Aliyev Microbiology Institute of Azerbaijan National Academy of Sciences AZ 1073 Patamdart ave.40, Baku, Azerbaijan e-mail: saribala-aliyev@rambler.ru Environmental contamination is important problem with global value. It concerns both land, and water ecosystems. One of priority pollutants all over the world are oil hydrocarbons. In sea water of Caspian Sea a source of hydrocarbons are developed oil fields in the Western and Southwest Caspian Sea, the industrial and household wastes discharged in the sea and running into the sea rivers. Research of a role of microorganisms in the processes of mineralization of 5 hydrocarbonic character organic substances was one of the main goals of presented work. For this reason the quantity of oil-oxidizing and phenol-oxidizing microorganisms was defined. As a results of research at 6 stations (Pirallahy, Jiloy, Govsany, Baku Bay, Shikhovo, Primorsky) in a zone of Absheron Peninsula of Caspian sea it was revealed that the maximum quantity of oil-oxidizing and phenol-oxidizing bacteria were marked in summer period and totally amount was 105 km/ml. Comparative increasing of oil-oxidizing microorganisms was observed in the spring only in water areas near Pirallahy, Jiloy, Baku bay. Increasing of oil-oxidizing bacteria in a coastal areas is connected with influence of the shore, providing microorganisms with necessary quantity of allochthonic various origin organic substratum. Change of number of bacteria within a year appeared in each biotope differently. In particular, in comparison with other coastal areas, in water of the Baku bay and Shihov the number of oil-oxidizing microorganisms during a year appears on one-two order above and it explains availability of considerable quantity of organic substratum. The data on concentration of oil in water samples presented its direct correlation with the maximum values of number of microorganisms. Despite high speed of destructive processes in the investigated areas of Absheron Peninsula of Caspian sea (1,2 mgC/l) self-cleaning processes become complicated, because of considerable quantity of allochthonic organic compounds with difficult structure and rather low quantity of oil-oxidizing microbiota. The comparative analysis of intensity of biodegradation of organic compounds in coastal waters of Apsheron Peninsula with the similar data of 2002 testified deterioration of the ecological conditions caused by technogenic and anthropogenous influence on water area of the Baku bay. УТИЛИЗАЦИЯ ФТАЛЕВОЙ КИСЛОТЫ ТРАНСФОРМИРУЮЩИМИ ФТАЛАТЫ ШТАММАМИ БАКТЕРИЙ 1 Анохин Б.А.1, Максимов А.Ю.2, Ремезовская Н.Б.2, Овечкина Г.В.2 Пермский государственный университет, 614990, г. Пермь, ул. Букирева, 15; 2Институт экологии и генетики микроорганизмов УрО РАН, 614081, г. Пермь, ул. Голева, 13 e-mail: boris.anokhin@gmail.com Фталевая кислота и ее эфиры применяются в производстве красок, пластиков, парфюмерных и косметических изделий, фармацевтических препаратов и др. В результате повсеместного использования данных продуктов в окружающую среду поступают значительные количества содержащих фталаты отходов. Исходя из их чрезвычайной мобильности в почвенных и водных средах, стойкости в пищевых цепях, токсичности для животных и человека фталаты регулярно описываются как приоритетные загрязнители биосферы. Микробная деградация как принципиальный способ детоксикации фталатов, описана неоднократно. Однако важной проблемой применения биодеструкторов является накопление не менее токсичных продуктов частичной деградации. Так, фталевая кислота является ключевым интермедиатом в бактериальной деградации фталатов, и далеко не все фталат-трансформирующие микроорганизмы способны к дальнейшей ее утилизации. Целью настоящей работы явился отбор штаммов микроорганизмов, трансформирующих фталаты и способных утилизировать фталевую кислоту, а также изучение динамики ее деградации. В работе использовали 23 штамма микроорганизмов, активно трансформирующих фталевые эфиры. Для отбора штаммов-деструкторов культуры выращивали в течение 96 ч при 30°С на агаризованной минеральной среде N. В качестве единственного источника углерода и энергии добавляли фталевую кислоту в концентрации 5 мМ (0,83 г/л). Микробную деградацию проводили в колбах с жидкой средой N, содержащей фталевую кислоту в концентрации 10 и 20 мМ (1,66 и 3,32 г/л соответственно), на орбитальном шейкере при 120 об/мин, 30°С в течение 120 ч. Показатели роста в жидкой культуре определяли по оптической плотности среды при 600 нм (OD600) на спектрофотометре SmartSpec Plus (Bio-Rad, США). Остаточное содержание фталевой кислоты в культуральной среде определяли методом высокоэффективной жидкостной хроматографии на хроматографе LC-10ADVP (Shimadzu, Япония) при длине волны 238 нм с использованием колонки С18 6 (4.6×200 мм, Phenomenex, США). Мобильная фаза состояла из ацетонитрила, воды и уксусной кислоты (60:38:2), скорость потока – 1 мл/мин, при 25°С. При высеве на агаризованную среду из 23 штаммов отобраны 3 культуры, наиболее активно усваивающих фталевую кислоту: Arthrobacter sp. Х-13, Arthrobacter sp. 20-14 и Rhodococcus ruber П5-3М. При росте штаммов Х-13 и 20-14 в жидкой среде с начальной концентрацией фталевой кислоты 10 мМ в течение первых 48 ч наблюдалась практически полная деградация субстрата (до 0,11 мМ), что сопровождалось экспоненциальным увеличением OD600. В ходе дальнейших 72 ч культивирования количество биомассы и содержание фталевой кислоты практически не изменялись. В жидкой культуре П5-3М максимальная деградация (до 0,12 мМ) зафиксирована на 60 ч роста, причем показатель OD600 оставался низким, достигнув максимума только к 108 ч культивирования. В среде с начальной концентрацией фталевой кислоты 20 мМ штаммы Х-13 и 20-14 деградировали субстрат (до 0,15 и 0,09 мМ соответственно) и наращивали максимальную биомассу к 60 ч роста. В культуре R. ruber П5-3М деградация (до 0,19 мМ) наблюдалась уже к 48 ч роста. Однако плотность культуры родококка возрастала только к 72 ч и достигала максимума к 108 ч культивирования, при этом содержание фталевой кислоты не менялось. Таким образом, установлено, что штаммы Arthrobacter sp. Х-13 и 20-14, а также R. ruber П5-3М, трансформирующие фталаты, способны к дальнейшему метаболизму продукта трансформации – фталевой кислоты, в концентрации до 20 мМ. Данные культуры микроорганизмов могут быть использованы для биодеструкции фталевой кислоты и ее эфиров в водной среде. Работа поддержана АВЦП "Развитие научного потенциала высшей школы (2009–2011 годы)", проект № 2.1.1.6252 и ФЦП "Научные и научно-педагогические кадры инновационной России" на 2009-2013 годы, 2009-1.1-201-018. o-PHTHALATE UTILIZATION BY PHTHALATE ESTERSTRANSFORMING BACTERIA 1 B. Anokhin1, A. Maksimov2, N. Remezovskaya2, G. Ovechkina2 Perm State University, 15 Bukirev St., 614990 Perm, Russia; 2Institute of Ecology and Genetics of Microorganisms, Ural Branch, Russian Academy of Sciences, 13 Golev St., 614081 Perm, Russia e-mail: boris.anokhin@gmail.com o-Phthalic acid and phthalate esters are used to manufacture dyes, plastics, perfumes, cosmetics and pharmaceuticals. Wide use of these products results in release of vast phthalates amounts into environment. Due to their high soil and water mobility, food chain stability, and human and animal toxicity phthalates are accurately described as priority environmental pollutants. Microbial degradation of phthalates is reported to be a principal approach to their detoxification. However the accumulation of toxic products of incomplete biotransformation becomes a serious biotechnological problem. Thus, phthalate is a key metabolite during its esters degradative pathways and only few phthalate esters-degrading microorganisms are capable to utilize it. The aim of this study was to select phthalate and its esters-degrading microorganisms as well as to investigate the dynamics of microbial phthalate utilization. 23 bacterial strains used in the work are capable of phthalate esters degradation. To select ophthalate degraders the bacteria were cultivated on a solid N minimal medium supplemented with 5 mM (0.83 g L-1) o-phthalic acid at 30 °C for 96 h. In degradation studies the bacteria were inoculated in the N broth medium at two phthalate loadings of 10 and 20mM (1.66 and 3.32 g L-1, respectively). The degradation process was carried out at 30 °C on a rotary shaker at 120 rev min-1 for 120 h. Growth index was determined by optical density of broth medium at a wave length of 600 nm (OD600) on SmartSpec Plus spectrophotometer (Bio-Rad, USA). The residual phthalate was quantificated by HPLC on LC-10ADVP chromatograph (Shimadzu, Japan) using a C18 columne (4.6 · 200 mm; Phenomenex, USA). The mobile phase consisted of a mixture of acetonitrile, water, 7 and acetic acid (60:38:2, v/v/v) at a flow rate 1 ml min-1, at 25°C. o-Phthalate was detected by its UV absorbance at a wave length of 238 nm. When grown on a solid N medium Arthrobacter sp. X-13, Arthrobacter sp. 20-14, and Rhodococcus ruber P5-3M were selected as active phthalate-assimilating strains. In broth culture the cells of X-13 and 20-14 degraded 10 mM phthalate almost completely (to 0.11 mM) after 48 h of incubation, and this clashed with OD600 exponential increase. No OD600 and residual phthalate changes were observed at the time of the following 72 h incubation. In P5-3M culture phthalate degradation (to 0.12 mM) occurred after 60 h, whereas OD600 remained very low and reached its peak value at 108 h. Under identical conditions, the strains X-13 and 20-14 degraded substrate (to 0.15 and 0.09 mM, respectively) and got their maximal biomass only after 60 h of growth when initial phthalate concentration was increased to 20 mM. Contrary, P5-3M phthalate degradation (to 0.19 mM) was faster, during 48 h of incubation. The density of Rhohococcus culture started to increase only after 72 h and highest OD600 was reached to 108 h, with nothing changes in residual phthalate content. This results show that phthalate esters-utilizing Arthrobacter sp. X-13 and 20-14 as well as Rhodococcus ruber P5-3M are capable of degrading o-phthalic acid in a concentration up to 20 mM. Therefore, these bacteria are suitable for phthalate and its esters biodestruction in aquatic environments. The research is supported by ADTP “High School Scientific Potential Development 20092011”, #2.1.1.6252; FTP “Scientific and Educational Staff of Innovative Russia 2009-2013”, #2009-1.1-201-018. КСЕНОБИОТИКИ В ТРОФИЧЕСКИХ ЦЕПЯХ ВОДНЫХ ЭКОСИСТЕМ ПРИ ПРОИЗВОДСТВЕ АКВАКУЛЬТУРНЫХ ИСТОЧНИКОВ ПИЩИ Антипова Л.В.,1 Антипов С.С.,2 Алтаева А.,3 Аликулов З.3, Дворянинова О.П.4 ГОУ ВПО Воронежская государственная технологическая академия, Воронеж, Россия, , ГОУ ВПО Воронежский государственный университет, Воронеж, Россия, 3 Евразийский национальный университет им. Л.Н. Гумилева», Астана, Казахстан; 4ООО «Системы качества жизни», Нововоронеж, Россия e-mail: meatech@yandex.ru 1 Водная среда повергнута разнообразным формам загрязнения, особенно в индустриальных зонах. Вследствие человеческой деятельности содержание различных токсинов увеличивается в водных экосистемах. В результате действия органических и не органических веществ происходит разрушение тканей водных организмов, включая изменения, повреждение и отмирание, вызванные неспецифическими изменениями клеточной мембраны в результате действия липофильных ксенобиотиков. Механизм токсического действия не ограничен одним специфическим процессом, а включает в себя различные зоны и механизмы. Подобно млекопитающим, фагоциты рыб захватывают вторгающиеся инородные тела и обычно осуществляют их убийство путем выделения цитотоксических активных форм кислорода (АФК) для вирусов, бактерий и паразитов. Животные сформировали клеточные механизмы интенсивного производства АФК и молибденсодержащих ферментов (МО-ферментов), таких как ксантиноксидаза (КО) и альдегид оксидаза (АО), играющих важную роль во внутриклеточном производстве АФК. Гранулоциты, нейтрофилы и макрофаги специализируются на производстве большого количества пероксида и перекиси водорода, в основном, благодаря активности ксантиноксидазы, которая обладает онкопротекторной активностью вследствие способности ее генерировать цитотоксичные АФК, включая супероксиданионрадикал и перекись водорода. АФК, продуцируемые молибденовыми ферментами, так же нужны для борьбы против вторгающихся бактериальных клеток. 8 Не смотря на исключительную важность МО-ферментов в организмах животных, МОферменты рыб остаются малоизученными. Рассматривая молекулярные и регуляторные сходства МО-ферментов рыб и животных прототипов, мы представляем аргументы, поддерживающие потенциальные возможности КО рыб производить мочевую кислоту – потенциальный антиоксидант, а также КО и АО для трансформации ксенобиотиков. Повышение ксенобиотиктрасформационной активности МО-ферментов рыб в естественных условиях позволяют производить здоровые, высококачественные рыбные продукты в аквакультуре. МО-ферменты могут также использоваться как биоматериалы для ксенобиотиков, содержащихся в водной среде. Замечательной особенностью КО является достаточно простая активация in vivo под действием пуриновой и липидобогащенной диеты рыб, содержащей вольфрам (химический аналог МО). Вольфрам как химический аналог молибдена может заменить молибден в активных центрах, и в этом случае КО и АО становятся инактивированными. Ряд экспериментов продемонстрировал, что применение вольфрамобогащенной диеты для животных значительно снижают активность КО и снижают биосинтез внутриклеточных свободных радикалов. Пурины увеличивают образование мочевой кислоты; липолиновая (жирная) кислота преобразует оксидазную форму КО в дегидрогеназную, которая не образует АФК, но образует мочевую кислоту (карбомид). Одной из важных областей наших исследований является фокусировка на комбинации диет и эффекте этих комбинаций на развитие болезней. Изменение молибдена или вольфрама в диете в комбинации с антиоксидантами могут также иметь многообещающие перспективы в лечении болезней, увеличении резистентности животных к природным стрессам, и детоксикации ксенобиотиков тяжелыми металлами рыб. Исследования механизмов, лежащих в основе АФК – зависимой разобщения биологических систем, имеют перспективы для антиоксидативных манипуляций для животных и человека. Цели и задачи исследования: - изучение активности МО - ферментов, их содержание и распространение в различных органах рыб; - исследования мочевой кислоты в различных органах рыб, т.к. это может быть индикатором (маркером) уровня окисления. В следствии действия ксенобиотиков, тяжелых металлов и неблагоприятной водной среды получены новые сведения в области: - изучения in vivo регуляции КО и АО активности под действием молибдена и вольфрама; - показано, что пурин – обогащенная диета имеет эффект активации КО и АО рыб, а также образование мочевой кислоты; - получены предварительные данные по ксенобиотиктрансформирующей активности двух форм КО и АО с использованием пестицидов; - установлены изменения активности и содержания КО и АО в чистой и загрязненной воде с различными ксенобиотиками. - показано, что нитрат и нитрит обусловливают снижение активности КО; - предполагается, что ATP – основной источник энергии в живых организмах. После гибели, АТР быстро разлагается до гипоксантина, который далее разлагается до ксантина и мочевой кислоты. Таким образом, количество ксантина и мочевой кислоты могут служить показателями свежести рыбы. Полученные результаты доказывают реальную возможность регулирования уровня контаминации путем коррекции диеты рыб и создания сбалансированных и обогащенных кормов для рыб. В рамках взаимных исследований и разносторонней квалификации специалистов, созданы базовые рецептуры кормопродуктов, содержащих защитные факторы и 9 позволяющие получать объекты аквакультуры, прежде всего рыб, с высокой степенью безопасности для обеспечения здорового питания населения. KSENOBIOTICS IN TROPHIC CHAINS OF WATER ECOSYSTEMS BY MANUFACTURE AQUACULTURES OF SOURCES OF FOOD Antipova L.V.,1 Antipov S.S.,2 Altaeva А.,3 Alikulov Z.3, Dvorjaninova O.P.,4 1 The Voronezh state technological academy, Voronezh, Russia, 2 The Voronezh state university, Voronezh, Russia, 3 Euroasian national university of L.N. Gumilev, Astana, Kazakhstan; 4ООО «Systems of quality of life», a Novovoronezh, Russia e-mail: meatech@yandex.ru The water environment is plunged to various forms of pollution, especially in industrial zones. Owing to human activity the maintenance of various toxins increases in water ecosystems. As a result of action organic and not organic substances there is a destruction of fabrics of water organisms, including changes, damage and the dying off caused by nonspecific changes of a cellular membrane as a result of action lipofilnyh ksenobiotics. The mechanism of toxic action is not limited by one specific process, and includes various zones and mechanisms. Like mammals, phagocytes of fishes grasp interfering foreign matters and usually carry out their murder by allocation of cytotoxic active forms of oxygen (MIM) for viruses, bacteria and parasites. Animals have generated cellular mechanisms of intensive manufacture MIM and Moenzymes, such as ksantinoksidaza (KO) and aldehyde oxidize (joint-stock company), playing an important role in endocellular manufacture MIM. Granulocytes, neitrofili and macrophages specializes on considerable quantity manufacture peroxides and hydrogen peroxides, basically, thanks to activity ksantinoksidazs, which possesses onkoprotektornses activity owing to ability it to generate cytotoxic MIM, including superoxidanionradical and hydrogen peroxide. MIM, produced Mo-enzymes as are necessary for struggle against interfering bacterial cages. Despite exclusive importance of Mo-enzymes in organisms of animals, Mo-enzymes of fishes remain a little studied. Considering molecular and regulators similarities of Mo-enzymes of fishes and animal prototypes, we represent the arguments supporting potential possibilities TO fishes to make uric acid - a potential antioxidant, and also TO and joint-stock company for transformation ksenobiotics. Increase ksenobioticstransformations activity of Mo-enzymes of fishes healthy, high-quality fish products in aquacultures under natural conditions allow to make. Moenzymes can be used also as biomaterials for ksenobiotics, containing in the water environment. Remarkable feature TO is simple enough activation in vivo under action puréeing and lipid containing the diet of fishes containing tungsten (chemical analogue МО). Tungsten as chemical analogue of molybdenum can replace molybdenum in the active centers, and in this case TO and joint-stock companies become removal. A number of experiments has shown that application volframcontaining diets for animals considerably reduce activity TO and reduce biosynthesis of endocellular free radicals. Pureness increase formation of uric acid; lipolinovs (fat) acid will transform oxidizes the form TO in degidrogenazes which does not form АФК, but forms uric acid (carbomid). One of important areas of our researches is focusing on a combination of diets and effect of these combinations on development of illnesses. Change of molybdenum or tungsten in a diet in a combination with antioxidants can have also promising prospects in treatment of illnesses, increase in resistance of animals to natural stresses, and detoksicas ksenobiotics heavy metals of fishes. Researches of the mechanisms underlying MIM - dependent dissociation of biological systems, have prospects for antioxidants’ manipulations for animals and the person. The purposes and research problems: - Studying of activity МО - enzymes, their maintenance and distribution in various bodies of fishes; 10 - Researches of uric acid in various bodies of fishes since it can be the indicator (marker) of level of oxidation. In an action consequence ksenobiotics, heavy metals and the adverse water environment new data in area are received: - Studying in vivo regulation TO and joint-stock company of activity under the influence of molybdenum and tungsten; - It is shown that пурин - the enriched diet has effect of activation TO and joint-stock company of fishes, and also formation of uric acid; - The preliminary data on ksenobioticstransformations activity of two forms TO and jointstock company with use of pesticides is obtained; - Activity and maintenance changes TO and joint-stock company in the pure and polluted water with various ksenobiotics are established. - It is shown that nitrate and nitrite cause activity decrease TO; - It is supposed that ATP - the basic energy source in live organisms. After destruction, АТР quickly decays to gipoxantins which decays further to xantins and uric acid. Thus, quantity xantins and uric acid can serve as indicators of freshness of fish. The received results prove real possibility of regulation of level pollutions by correction of a diet of fishes and creation of the balanced and enriched forages for fishes. Within the limits of mutual researches and versatile qualification of experts, base compounding fodder-productizes created, containing protective factors and allowing to receive objects aquaculture, first of all fishes, with high degree of safety for maintenance of a healthy food of the population. ТОКСИКОЛОГИЧЕСКИЕ ЭФФЕКТЫ НАНОЧАСТИЦ НА МЕМБРАНЫ КЛЕТОК ВЫСШИХ ВОДНЫХ РАСТЕНИЙ Ахмедов И.С., Агаева Н.Дж., Абдуллаева А.Р., Халилов Р.И. Бакинский Государственный Университет, AZ1148,ул.З.Халилова 23, Баку, Азербайджан e-mail:ismet522002@yahoo.com Интенсивное развитие нанотехнологии требует изучение токсикологическиx характеристик наноматериалов и наночастиц, синтезирующихcя различными физикохимическими методами. Исследование молекулярногo и клеточногo механизма токсикологического влияния исскуственно полученных наночастиц в жидкой среде однo из интересных областей в нанотоксикологии. Есть данные о том, что продукты нанотехнологии попадая в воднyю средy, могут включаться в пищeвyю цепь водной экосиcтемы. Накопление наночастиц в растительных и животных организмax водоемов может привecти к дальнейшему распрострaнению их в надземных экосистемах, в том числе и в организме человека. В последнeе время использование наноматериалов входит в обычную практику и мы будем все чаще сталкиваться с вопросом: как влияют синтетические наноматериалы на биологические организмы? Учеными было доказано, что токсический эффект наночастиц зависит от их концентрации, площади их поверхности, а также среды, в которой они находятся. Hа начальной стадии своегo развития в нанотоксикологии сделаны интересные эксперименты, доказывающие токсичность некоторых наночастиц. Показано, что наночастицы кадмия, хрома, меди, никеля и цинка токсичны для водной культуы дафний и их токсичность усиливается при низких pH среды.Фитотоксические исследования свойств наночастиц цинка и его оксида на кукурузе, редисе, рапсе, огурце показали, что их концентрация 2000 мг/л отрицательно действует на проростание семян кукурузы и подавляет удлинение корней. Токсичность наночастиц прежде всего связaнa их взаимодействием с плазматической мембранoй и мембранной системой внутриклеточной органоидов клетки. Показано, что токсичность фуллерена влияет на клеточные мембраны из-за присутствия свободных радикалов. 11 Учитывая актуальность нанотоксикологии в данной работе мы изучали влияние некоторых наночастиц металлов (железа, алюминия, никеля) на электрические характеристики мембран клеток листьев высших водных растений. В качествe объекта исследования были использованы клетки листьев Elodea canadensis, мембранный потенциал (МП) которых на свету достигает 250-300 мВ. Изменение МП при действии наночастиц регистрировались методом микроэлектродной техники. В плазматических мембранах клеток растений, паралельнo с Н+-АТФазной протонной помпой, функционирует также редокс цепь, Н+ выводящего активного насоса. Эксперименты показывают, что редокс цепь плазматических мембран клеток растений более чувствительна к факторам внешнeй среды и она выполняет защитную функцию посредством трансдукции внешних сигналов. Показателем активности редокс цепи плазматических мембран является значение амплитуды изменения МП при действии феррицианида и УФ света с длиной волны 300-320 нм, так как при действии этих факторов наблюдается сильная деполяризация. Деполяризация МП охватывает активную часть МП и является результатом ингибирования редокс системы плазматической мембраны. По амплитудe и характеру изменения активности редокс помпы мы обсудили токсичность данных наночастиц. Листья элодеи инкубировали в разных концентрациях наночастиц. Наночастицы железа представляли 10-2М водную суспензию магнетита. Наночастицы алюминия и никеля имели размер 40 нм в суспензиях. Редокс активности плазматических мембран изучали в листьяx, которые долгое время выдерживали в темноте и на свету. Результаты этих экспериментов показали, что долгое время (около 10 дней) значение МП не изменяется при инкубирование листьев элодеи в растворах наночастиц железа и алюминия, однако в растворах никеля наблюдается сильное деполяризация МП и через 3 дня происходит некроз листьев и клетки погибают. Активность редокс помпы плазматической мембраны клеток листьев, находящихся в растворе магнетита на свету увеличивается по сравнению c контролeм. Однако активность редокс помпы в темноте резко снижается, несмотря на высокий уровень мембранного потенциала. Наночастицы алюминия не влияет на активность редокс помпы. Таким образом, результаты наших экспериментов показaли, что наночастицы железа в течение короткого времени не проходят мембраны, однако сильно влияют на транспортные функции плазматической мембраны, изменяя активность редокс системы и приводят к более уязвимым состояниям клетки на факторы внешней среды. TOXICOLOGICAL EFFECTS OF NANOPARTICLES ON MEMBRANES OF THE HIGHER WATER PLANTS Ahmadov I.S., Аgaeva N.J., Abdullaeva А.Р., Khalilov R.I. Baku State University, AZ1148, Z.Khalilov str. 23, Baku, Azerbaijan e-mail: ismet522002@yahoo.com Intensive development of nanotechnology demands the study of toxicological characteristics of nanomaterials and nanoparticles, synthesized by various physical and chemical methods. The research of the molecular and cell mechanism of toxicological influence artificial manufacturing nanoparticles in liquid environment is one of interesting areas in nanophytotoxicology. There are data that products of nanotechnology getting in water environment, can enter the food chain. Accumulation nanoparticles in plants and animal organisms of water ecosystem will be able to spread later on ground-based ecosystems, including in a human body. Lately using nanopartcles is included into usual practice and we will face even more often a question: how the synthetic nanomaterials influences on biological organisms? Scientists proved that the toxic effect of nanoparticles depends on their concentration, their surface area, as well as the environment in which they reside. Despite the initial stage of its development in nanotoxicology have been made interesting experiments demonstrating the toxicity of some nanoparticles. It is shown that nanoparticles of cadmium, chromium, copper, nickel and zinc are toxic to aquatic faiths Daphnia and their toxicity is enhanced at low pH of environment. Phytotoxic studies of the properties of 12 nanoparticles of zinc and its oxide on corn, radish, rapeseed, cucumber showed that their concentration of 2000 mg/l adversely affects prorostanie corn seeds and inhibits root elongation. Toxicity of nanoparticles primarily connected their interaction with the plasma membrane and membrane system of intracellular organelles cells. It is shown that the toxicity of fullerenes affects the cell membranes due to the presence of free radicals. Given the relevance of nanotoxicology in this paper, we studied the effect of some metal nanoparticles of iron, aluminum, nickel on the electrical characteristics of cell membranes of leaves of higher aquatic plants. As the object of investigation were used leaves of Elodea canadensis cell membrane potential (MP) where on the light reaches 250-300 mV. The changing the MP under the action of nanoparticles were recorded by the microelectrode technique. In the plasma membranes of plant cells, along with H +-ATPase proton pump is functioning redox- chain, as H + pump that outputs protons actively. Experiments show that redox - chain of plasma membranes of plant cells are more sensitive to environmental factors, and it serves a protective function in the transduction of external signals. Indicator of activity of the redox chain of plasma membrane is the amplitude of the change of the MP under the action of ferricyanide and UV light with a wavelength of 300-320 nm, since the effect of these factors, there is a strong depolarization. Depolarization of the MP includes an active part of MP and is the result of inhibition of the redox system of plasma membrane. On the amplitude and character change in the activity of the redox pump, we discussed the toxicity of these nanoparticles. Leaves of elodea were incubated in different concentrations of nanoparticles. Nanoparticles of iron represented 10 M of water suspension of magnetite. Nanoparticles of aluminum and nickel were the size of 40 nm in suspensions. Redox activity of plasma membranes was studied in the leaves of which has incubated to in the dark and on the light. The results of these experiments showed that for a long time (10 days) the value of the MP does not change with incubation of leaves in the solutions nanoparticles of iron and aluminum, but in solutions of nickel there is a strong depolarization of the MP and 3 days later is necrosis of leaves and cells die. The activity of the redox pump plasma membrane of leaves in solution of magnetite in the light increases as compared controls. However, the activity of the redox pump in the dark, sharply reduced despite a high level of membrane potential. Nanoparticles of aluminum did not affect the activity of the redox pump. Thus, the results of our experiments show that nanoparticles of iron for a short time does not pass the membrane, but strongly affect the transport function of plasma membrane, altering the activity of the redox system leads to a more vulnerable state of the cell to environmental factors. РЕАЛИЗАЦИЯ БИОМАТЕМАТИЧЕСКОГО ПОДХОДА ДЛЯ ЭКСПРЕСС-ОЦЕНКИ СОСТОЯНИЯ БИОЦЕНОЗА АКТИВНОГО ИЛА В ПРОЦЕССАХ ПРОДЛЕННОЙ АЭРАЦИИ СТОЧНЫХ ВОД НЕФТЕХИМИЧЕСКОГО КОМПЛЕКСА Балымова Е.С., Ахмадуллина Ф.Ю. ГОУ ВПО Казанский государственный технологический университет e-mail: elena-balymova@rambler.ru В практике эксплуатации очистных сооружений насущной проблемой является необходимость поддержания высокой активности биоагента, от состояния которого зависит эффективность процесса биологической очистки особенно сложных по составу промышленных стоков. Содержание в последних ксенобиотиков и экотоксикантов приводит к инактивации ферментативных систем смешанной популяции микроорганизмов, вследствие чего значительно ухудшается качество очищенных стоков. В настоящее время контроль за качеством очищаемых стоков и, как следствие, эффективностью очистки осуществляется на основе методов химического анализа. Однако данный метод контроля имеет ограниченную информативность, так как представляет 13 результаты прошедшего процесса биологической очистки, а также не учитывает последствий воздействия токсичных сточных вод на активную биомассу. Поэтому сегодня в условиях ужесточения требований к водам, сбрасываемым в природный водоем, назрела необходимость создания эффективного и экспрессного метода контроля за состоянием активного ила с целью обеспечения требуемого качества очистки сложных и нестабильных по своему составу сточных вод, содержащих токсиканты и ксенобиотики. В данном случае метод биодиагностики биоценоза активного ила решает эту проблему, так как он более чувствителен и дает информацию о состоянии биоагента в любой момент времени. Однако ежедневное микроскопирование иловых суспензий лимитируется как временным фактором, так и необходимостью увеличения штата микробиологов, повышая затраты вспомогательного производства. В связи с этим целесообразно и перспективно внедрение в практику биоматематического подхода при оценке состояния ценоза активных илов, что позволит не только прогнозировать состояние микроорганизмов смешанной популяции в течение всего процесса биологической очистки сточных вод, но и оценить его восстановительный потенциал при залповых сбросах экотоксикантов и ксенобиотиков, что и является целью работы. Необходимым и достаточным условием реализации такого подхода является, на наш взгляд, проведение систематического микробиологического контроля биоценоза активного ила в стабильных и нестабильных условиях функционирования очистных сооружений (с учетом критических) с последующей математической обработкой экспериментальных данных. Для подтверждения последнего в работе проведено целенаправленное исследование взаимного влияния основных экотоксикантов (фенол, СПАВы и гликоли) и химического потребления кислорода на активный ил. Объектом исследований являлся активный ил, формирующийся на сточных водах производств органического синтеза возраста 40 – 45 суток. Многоплановая задача, решаемая в работе, диктует необходимость проведения экспериментальных исследований в условиях максимально возможно приближенных к производственным. Основной метод, используемый в работе биоиндикация. Биодиагностику осуществляли на основании биоиндикаторов, выявленных в результате детального изучения исследуемого активного ила. В работе предусматривалась как качественная, так и количественная оценка состояния активного ила по следующим критериям: гидробиологические индексы Шеннона и Куба и пятибалльная шкала. Результаты исследований обобщались в виде таблиц, с последующим их анализом. На следующем этапе были проанализированы количественные оценки состояния активного ила. В результате анализа было показано соответствие балльной системы и индекса Шеннона. Однако оценка состояния по индексу Шеннона дает несколько завышенные результаты, т.к. индекс Шеннона учитывает только родовое разнообразие, а при балльной системе оценивается состояние надиловой жидкости, флокул и индикаторных микроорганизмов. Что касается индекса Куба, полученные в работе разрозненные результаты не коррелируют ни с индексами Шеннона, ни с оценкой балльной системы. В связи с этим математическая обработка экспериментальных данных проводилась по балльной системе. Учитывая сложность системы взаимного влияния токсикантов на биоценоз активного ила, использовали уравнение регрессии в виде полиномиальной зависимости второго порядка функции 5 переменных. Высокий коэффициент детерминации подтверждает адекватность полученного уравнения. Анализ полученного материала свидетельствует о том, что пик ингибирующего воздействия экополлютантов приходится на 8 часов аэрирования, исследуемый активный ил обладает достаточно высоким восстановительным потенциалом. При минимальных 14 концентрациях фенола и СПАВов активный ил практически полностью восстанавливается, а при залповых сбросах - восстанавливается лишь частично. Предлагаемая экспресс-биодиагностика прогнозирования состояния активного ила, оценки его восстановительного потенциала в вариабельных условиях формирования отличается высокой чувствительностью, оперативностью и возможностью прогнозирования поведения биоагента с необходимой точностью, а также высокой технологичностью, возможностью осуществления в производственных условиях и минимизацией затрат при внедрении данного метода. BIOMATHEMATICAL APPROACH FOR RAPID ASSESSMENT OF ACTIVATED SLUDGE IN EXTENDED AERATION SEWAGE OF PETROCHEMICAL COMPLEX Balymova E.S., Akhmadullina F.Yu. Kazan State Technological University e-mail: elena-balymova@rambler.ru Pressing problem in practice of treatment facilities operation is required maintenance of biological agents in high activity, which affects on efficiency of biological treatment particularly of complex composition of industrial effluents. Content in wastewater of xenobiotics and toxicants leads to inactivation of the enzyme systems of a mixed population of microorganisms, resulting in significantly worse quality of treated effluent. At the present time, control over the quality of treated effluent and as a consequence, the effectiveness of treatment is based on the methods of chemical analysis. However, this control method has limited information content, as it represents the results of past biological treatment process, and ignores the effects of toxic waste water on the active biomass. So today, in conditions more stringent requirements for water discharged into natural water body, there is a need for an effective and rapid method of monitoring the activated sludge condition in order to ensure the required quality of treatment of complex and unstable in their composition waste water containing toxicants and xenobiotics. In this case, the method of activated sludge biodiagnostics solves this problem because it is more sensitive and provides information on the status of biological agents at any time. However, the daily sludge microscopy is limited by the suspension as a temporary factor and the need to increase staff microbiologists, increasing the cost of secondary production. In this regard, appropriate and promising implementation in practice biomathematical approach in assessing the active sludge state, which will not only predict the state of a mixed population of microorganisms during the process of biological wastewater treatment, but also to assess its potential for reducing salvo discharges toxicants and xenobiotics, that is the purpose of work. Necessary and sufficient condition for such an approach is, in our opinion, the systematic microbiological monitoring ecological community of activated sludge in stable and unstable conditions of the functioning sewage treatment plants (with critical), followed by mathematical processing of experimental data. To confirm it in the work carried out purposeful investigation of mutual influence of the major toxicants (phenol, surfactants and glycols) and chemical oxygen demand in the activated sludge. Object of study is the activated sludge, which is formed at the organic synthesis wastewater plants aged 40 - 45 days. Multi-dimensional problem solved in the work dictates the need for experimental studies in conditions close as possible to production. The main method used in this work bioindication. Biodiagnostics performed on the basis bio-indicators identified in the detailed study of the investigated activated sludge. 15 In the work involved both qualitative and quantitative assessment of the sludge on the following criteria: Hydrobiological indices of Shannon and Cuba and the five-point scale. The research results summarized in tabular form with its subsequent analysis. In the next stage we analyzed the quantitative assessment of activated sludge. The analysis showed compliance scoring system and the Shannon index. However, the estimation of the Shannon index gives several overestimated results, because Shannon index takes into account only the generic variety, while scoring system evaluates the state of supernatant, floccules and indicator microorganisms. With regard to Cuba index obtained in disparate results do not correlate with any indices of Shannon, nor with the evaluation scoring system. In this regard, the mathematical analysis of experimental data was carried out on a point system. Given the complexity of the mutual influence of toxicants on activated sludge used the regression equation in the form of a polynomial dependence of the second order function 5 variables. The high coefficient of determination confirms the adequacy of this equation. Analysis of the resulting material shows that the peak inhibitory effect pollutants have at 8 hours of aeration, activated sludge investigated has a fairly high reduction potential. With minimal concentrations of phenol and detergents activated sludge is almost completely recovered, while volley discharges - is restored only partially. The proposed rapid biodiagnostics forecasting sludge, evaluating its reduction potential in the variable conditions of the formation is characterized by high sensitivity, speed and ability to predict the behavior of biological agents with the required accuracy, as well as high technology, the ability to implement in a production environment and cost minimization in the implementation of this method. ГЕОХИМИЧЕСКАЯ ДЕЯТЕЛЬНОСТЬ МИКРООРГАНИЗМОВ В АЗОТНЫХ И УГЛЕКИСЛЫХ ТЕРМАХ БАЙКАЛЬСКОЙ РИФТОВОЙ ЗОНЫ Бархутова Д.Д., Данилова Э.В., Дамбаев В.Б. Институт общей и экспериментальной биологии СО РАН, 670047 г. Улан-Удэ, ул. Сахьяновой, 6, Россия e-mail: darima_bar@mail.ru С целью изучения геохимической роли микробного сообщества были исследованы 2 группы гидротерм Байкальской рифтовой зоны. Первая группа – это азотные термальные источники - Алла, Гарга, Сея, Уро (Баргузинская впадина), вторая – углекислые термальные источники - Хойто-Гол и Жойгон (Восточный Саян). Воды источников Алла, Гарга, Сея, Уро с Т= 49.7-74 °С относятся к щелочным сульфатным или сульфатно-гидрокарбонатным натриевым с низкой минерализацией (1401000 мг/л). Вода источника Алла содержит сероводород и сульфиды, концентрация которых варьирует от 2 до 42 мг/л в различных выходах. Гидрокарбонатные натриевые воды источников Хойто-Гол и Жойгон характеризуются минерализацией 480-1976 мг/л, нейтральными и слабощелочными значениями рН. Температура выходов воды не превышает 38,5оС. В воде источников Хойто-Гол содержание сероводорода и сульфидов достигает 23,8 мг/л. Вода источников Жойгон содержит железо, концентрация которого составляет 1,4-3,7 мг/л. В районе излива и теплых ручьях гидротерм развиваются микробные маты различных типов – циано-бактериальные, пурпурные, зеленые и серные. Изменение физико-химических условий среды (температуры, окислительно-восстановительного потенциала, концентрации химических элементов, освещенности и т.д.) определяет зональное распределение и смену микробных сообществ. Структурообразующим компонентом микробных матов являются фототрофы оксигенные цианобактерии и аноксигенные эубактерии. Они служат первичными 16 продуцентами органического вещества. В некоторых случаях первичными продуцентами являются хемолитоавтотрофные серобактерии. Изучение интенсивности продукционных процессов в гидротермах показало, что наибольшей продуктивностью обладают микробные маты, развивающиеся при температуре менее 50оС. Высокое содержание сульфатов в воде исследованных источников обуславливает доминирование процесса сульфатредукции на терминальном этапе деструкции органического вещества. Высокая скорость этого процесса создает условия для активного функционирования микроорганизмов цикла серы. Исследование изотопного состава углерода микробных матов показало, что происходит его фракционирование между органическим веществом и карбонатов. Органическое вещество цианобактериальных матов обогащено лёгким изотопом углерода. Выявлена важная роль микробного сообщества гидротерм в карбонатном минералообразовании. Наибольшая активность травертинообразования в гидротерме Гарга обнаружена в зонах микробного мата с превышением скорости продукции над деструкцией с постоянным доступом воды источника. В щелочных и окислительных условиях гидротермы Хойто-Гол происходит интенсивный процесс литификации микробных матов, который подавляет продукцию органического вещества и формирование толстых бактериальных матов. Тонкие и рыхлые маты цементируются карбонатами, преобразуясь в сплошные травертиновые корки. Эти корки надстраиваются над более древними травертиновыми структурами, образующими многометровые купола в районе выходов термальных вод. Таким образом, в современных азотных и углекислых гидротермах Байкальской рифтовой зоны микробное сообщество участвует в продукции и деструкция органического вещества, разрушении и синтезе минералов, образовании и потреблении газов, изменении физико-химических условий среды обитания. Работа выполнена при финансовой поддержке грантов РФФИ 10-04-93169 Монг_а и МО РФ РНП № 2.1.1/12153. GEOCHEMIKAL ACTIVITY OF MICROORGANIZMS IN NITROGEN FND CARBONATED HYDROTHERMS OF BAIKAL RIFT ZONE D.D. Barkhutova, E.V. Danilova, V.B. Dambaev Institute of General and Experimental Biology SB RAS, 670047, Ulan-Ude, Sakhyanovoy st.,6, Russia e-mail: darima_bar@mail.ru The geochemical role of the microbial community was studied in 2 groups of hydrothermal vents of the Baikal rift zone. The first group is nitrogen thermal springs - Alla, Garga, Saya, Uro (Barguzin depression), and the second - carbonated hot springs - Hojto Gol and Zhoygon (East Sayan). Water of Alla, Garga, Saya, Uro springs (with T = 49.7-74°C) are the alkali sodium sulfate or sulfate hydrocarbonate sodium and low salinity (140-1000 mg/l). Alla water contains hydrogen sulfide and sulfide, whose concentration varies from 2 to 42 mg/l in different outputs. Sodium bicarbonate water Hojto Gol and Zhoygon springs characterized by mineralization of 480-1976 mg / l, neutral and weakly alkaline pH values. Temperature of water does not exceed 38.5 °C. In water of Hojto-Gol springs hydrogen sulfide and sulfide reaches 23.8 mg/l. Water sources Zhoygon contains iron, its concentration is 1.4-3.7 mg / liter. Microbial mats of various types - cyano-bacterial, purple, green, and sulfur developed in the area of output and warm streams of hydrotherms. Changing the physical and chemical environmental conditions (temperature, redox potential, concentration of chemical elements, lighting, etc.) determines the zonal distribution and change of microbial communities. Structure-forming component of the microbial mats are phototrophs - oxygenic cyanobacteria and anoxygenic eubacteria. They are the primary producers of organic matter. In some cases, the primary producers are hemolitoavtotrofic sulfur bacteria. 17 Study of the intensity of production processes in hydrotherms showed that the highest productivity have microbial mats developing at a temperature less than 50°C. The high content of sulfates in water of studied springs determines the dominance of sulfate reduction in the terminal stage of decomposition of organic matter. High speed this process creates the conditions for the active functioning of microbial sulfur cycle. Study of carbon isotope composition of microbial mats showed that it is the fractionation between organic matters and carbonates. Organic matter enriched cyanobacterial mats light isotope of carbon. In hydrothermal carbonate mineral formation the important role of the microbial community revealed. In Garga hydrotherm most active of travertine forming found in zones of microbial mats in excess of the speed of production over destruction with sustainable access the water source. In alkaline and oxidative conditions of Hojto Gol hydrotherm is an intensive process of lithification of microbial mats, which suppresses the production of organic matter and the formation of thick microbial mats. Thin and loose mats cemented with carbonates and converted into solid travertine crust. These crusts are built on more ancient travertine structures, forming a dome in the multimeter outputs of thermal waters. Thus, in modern nitrogen and carbon hydrotherms of Baikal rift zone microbial community involved in the production and destruction of organic matter destruction and synthesis of mineral formation and consumption of gas, change the physicochemical conditions of the habitat. The work supported by RFBR grant №10-04-93169 Mong_а and grant of Russian Ministry of Education DSP № 2.1.1/12153. ПОИСК ФАКТОРОВ, ОПРЕДЕЛЯЮЩИХ РАЗНООБРАЗИЕ ПРЕСНОВОДНЫХ МИКРОБНЫХ СООБЩЕСТВ 1 Белькова Н.Л.1, Матюгина Е.Б.2 УРАН Лимнологический институт СО РАН, Иркутск; 2 УРАН Институт природных ресурсов, экологии и криологии СО РАН, Чита e-mail: belkova@lin.irk.ru Изучение функционирования пресноводных экосистем в современных условиях является одной из приоритетных научных проблем. Микробные сообщества – одни из наиболее существенных компонентов живого населения водоемов, которые играют важную роль в процессах круговорота веществ и энергии и в трофической цепи организмов пелагиали. Изучение влияния различных физико-химических факторов на разнообразие и состав микроорганизмов в микробных сообществах разных пресноводных экосистем является одной из актуальный научных задач, практическое значение которой заключается в возможности разработки эффективного подхода для мониторинга природных микробных популяций. В работе был использован комплекс молекулярных методов для изучения разнообразия и полуколичественной оценки состава микробных сообществ таких пресноводных объектов как озеро Байкал, пресноводные озера Забайкальского края и высокогорные озера Восточных Саян, республика Бурятия. В лабораторных экспериментах адаптированы методы для изоляции микроорганизмов, находящиеся в природных условиях в некультивируемом состоянии. Разработаны подходы для учета представленности основных филогенетических групп в микробных сообществах с помощью групп-специфичной ПЦР и детекции генотипов активных и жизнеспособных клеток. Впервые показано, что в глубинных байкальских водах доминируют представители архей. Сравнительный молекулярно-генетический анализ природных образцов из десяти проанализированных пресных водоемов (оз. Байкал; высокогорные озера Восточных Саян: Перевальное, Первое, Черное, Бирюзовое, Вулканное, Исток, Малое Черное; палеовулкан Алханай: три выхода холодных вод в долине р. Убжогое) 18 показал, что во всех водах детектируются представители основных таксономических групп: эубактерии, археи, цианобактерии, планктомицеты, альфа- и бетапротеобактерии, а представленность фил цитофаги-флавобактерии, вирмикуты и актинобактерии зависит от физико-химических характеристик и микроэлементного состава вод. Подобраны оптимальные составы питательных сред для культивирования гетеротрофных микроорганизмов из ультраолиготрофных пресных водоемов. Максимальное разнообразие колоний получено на средах, содержащих дрожжевой экстракт, соевый пептон, или гидролизат сои. Показано, что добавление декстрозы, пирувата натрия и микроэлементов приводило к увеличению численности колоний на средах с низкими концентрациями мясного пептона и гидролизата казеина, а внесение витаминных добавок существенно не влияло на культивируемость микроорганизмов. Работа поддерживается грантом РФФИ №09-04-00977 и интеграционным проектом №122. SEARCHING FOR FACTORS DETERMINING THE DIVERSITY OF FRESHWATER MICROBIAL COMMUNITIES Belkova N.L.1, Matyugina E.B.2 1 Limnological Institute SB RAS, Irkutsk; 2 Institute of Natural Resources, Ecology and Kryology SB RAS , Chita e-mail: belkova@lin.irk.ru Investigation of freshwater ecosystem functioning in modern time is one of the tasks of first priority. Microbial communities are one of the most important component in the population of water reservoirs those play key role either in element and energy cycling or in trophic loops. Studyng of effect variety of physoco-chemical parameters on diversity and composition of microorganisms in freshwater ecosystem is very important scientific problem which has practical usage in developing morden approach for monitoring of natural microbial communities. Complex molecular methods was used for diversity study and semiquantitative analysis of microorganisms composition in microbial communities such freshwater ecosystems as Lake Baikal, freshwater lakes of Transbaikalia and high mountain lakes of Sayan, Buryatia. In laboratory experiments methods for heterotrophic bacteria cultivation were adapted for isolation of microorganisms in viable but unculturable stage. Approaches for enumeration of main phylogenetic bacterial groups by real-time PCR were developed. At the first time was shown that in deepwater layers of Lake Baikal archae was dominated genotype. Comparison of ten natural samples revealed that eubacteria, archae, cyanobacteria, planctomycetes, Alphaproteobacteria and Betaproteobacteria are widespread bacterial groups, wereas distribution of Cytophaga, Firmicutes, and Actinobacteria depended on physicochemical parameters of waters investigated. Optimal contents of media for heterotrophic bacteria cultivation from ultraoligotrophic freshwaters were found. This work was supported by grant RFBR №09-04-00977 and Integrated project of SB RAS №122. ХАРАКТЕРИСТИКА БИОХИМИЧЕСКОЙ АКТИВНОСТИ СИМБИОНТНОЙ МИКРОФЛОРЫ ПИЩЕВАРИТЕЛЬНОГО ТРАКТА ДАЛЬНЕВОСТОЧНОГО ТРЕПАНГА APOSTYCHOPUS JAPONICUS Богатыренко Е.А., Бузолева Л.С. Дальневосточный федеральный университет, 690600 г. Владивосток, ул. Октябрьская, 27 e-mail: jokonda@mail.ru 19 Дальневосточный трепанг Apostychopus japonicus относится к важным объектам промысла в морях Дальнего Востока. В настоящее время в связи с интенсификацией промысла отмечается значительное сокращение численности популяций этого животного во всех районах его обитания. Поэтому вполне очевидна необходимость создания марикультурных хозяйств по его выращиванию. При этом наиболее перспективным решением проблемы контроля заболеваемости гидробионтов при их искусственном культивировании является применение пробиотиков, которые представляют собой живые организмы и (или) вещества микробного или иного происхождения, оказывающие благоприятные эффекты на физиологические функции, биохимические и поведенческие реакции организма хозяина через оптимизацию его микробного статуса. Целью работы стал поиск среди симбионтной микрофлоры трепанга пробиотических штаммов микроорганизмов, способных к синтезу амилазы, хитиназы, хондроитинсульфатазы и альгинатлиазы, то есть ферментов участвующих в переваривании трудноусваиваемых природных полимеров, которые в большом количестве поступают в пищеварительный тракт трепангов вместе с грунтом и останками различных морских животных и водорослей. Для проведения исследований по изучению свойств микрофлоры дальневосточного трепанга были отобраны взрослые особи голотурии из прибрежной зоны о-ва Попова и из бухты Киевка Японского моря (Приморский край России). В условиях стерильности кишечники трепангов были извлечены с помощью скальпеля и помещены в отдельные пенициллиновые флаконы с жидкой питательной средой СММ (среда для морских микроорганизмов). Накопительную культуру получали в течение суток в термостате при температуре 30°C, после чего делали посев на агаризованную среду СММ методом Дригальского и инкубировали бактерии в тех же условиях в течение двух суток. После этого различные по морфологии одиночные колонии откалывали с помощью микробиологической петли и пересевали в пробирки на скошенную агаризованную СММ. С полученными 67 чистыми культурами проводилась дальнейшая работа по изучению их ферментативной активности путем посева бактерий на плотные и жидкие среды с хитином, альгинатом натрия, крахмалом и хондроитинсульфатом. Штаммы, проявившие активность на указанных средах, были идентифицированы с помощью готовых биохимических API тестов производства компании bioMerieux (Франция). Определение амилазной и хондроитинсульфатазной активности проводилось по методу Шомодьи, хитиназную активность измеряли, используя модифицированный колориметрический метод оценки количества N-ацетиламиносахаров, оценку альгинатлиазной активности осуществляли визкозиметрическим методом. В ходе работы выяснилось, что амилазная активность микрофлоры трепанга варьирует в пределах 0,046-0,593 ед. (мкмоль/мл мин). Более высокая активность отмечена у штаммов, выделенных из трепангов бухты Киевка. Это может объясняться тем, что в песчано-илистом грунте, с которого были собраны особи голотурий бухты Киевка, содержание углеводов выше, чем в каменисто-песчаных грунтах прибрежных вод о-ва Попова. Эта особенность среды обусловливает интенсивное развитие специфической микрофлоры, способной активно разлагать крахмал, на поверхности песчано-илистых грунтов, а, следовательно, и в кишечнике детритофагов. Хондроитинсульфатазная активность исследованных штаммов составила 0,124-0,412 ед. (мкмоль/мл мин). Следует отметить, что ни один из штаммов, выделенных из кишечников голотурий бухты Киевка, не проявил активности в расщеплении хондроитинсульфата, что, возможно, объясняется наличием у гидробионтов эндогенных ферментов. Хитиназная активность изучаемых микроорганизмов варьировала в пределах 0,29 – 2,09 ед. (мг/мл час). Из всей коллекции штаммов только 4 (около 6%), входящие в состав микрофлоры трепангов о-ва Попова, в различной степени гидролизовали хитин. Отсутствие хитиназ у бактерий голотурий бухты Киевка, также как и в случае с хондроитинсульфатазной активностью, возможно, объясняется наличием у трепангов этого района ферментов эндогенной природы. Альгинатлиазная активность полученных бактерий составила 29,7-78,1% (степень падения вязкости тест-раствора). Наибольшую альгинатлиазную активность проявили бактерии видов 20 Ps. stutzeri, B. coagulans и B. megaterium К13 со значениями 75.4, 78.1 и 73.6% соответственно. Сравнив полученные результаты с опубликованными данными, мы пришли к выводу, что выделенные нами штаммы играют важную роль в переработке и усвоении поступающей в организм трепанга растительной пищи. Стоит отметить, что из 67-ми штаммов только один Pseudomonas stutzeri проявил высокую активность в отношении всех четырех изученных ферментов. Также следует отметить высокую активность штамма Bacillus pumilus в расщеплении хондроитинсульфата и хитина, а штаммов Bacillus coagulans и Bacillus megaterium K13 - в отношении гидролиза крахмала и альгината натрия. CHARACTERISTICS OF BIOCHEMICAL ACTIVITY OF SYMBIOTIC MICROFLORA OF DIGESTIVE TRACT OF FAR EASTERN TREPANG APOSTYCHOPUS JAPONICUS Bogatyrenko E.A, Buzoleva L.S. Far Eastern Federal University, 690600 Vladivostok, Oktyabrskaya st., 27 e-mail: jokonda@mail.ru Far Eastern trepang Apostychopus japonicus is important object of a craft in the seas of the Far East. Due to intense fishing the numbers of this species have decreased significantly throughout its range, so maricultural cultivation is evidently necessary. The application of preparations based on probiotics, i.e., living microorganisms and/or compounds of microbial or other origin that exhibit a favorable effect on the physiological functions, biochemical, and behavioral reactions of the host organisms by optimization of its microbial status is the most perspective solution of disease control problem. The goal of the work was the search of probiotic strains among symbiotic trepang’s microflora capable to synthesize amylase, chitinase, chondroitin sulfatase, and alginate lyase, i.e. enzymes participating in digestion of natural polymers which huge amount comes with ground and remains of marine animals and seaweeds to digestive tract of trepang. For investigation of the microflora of the Far Eastern trepang adult specimen were collected from the coastal zone of the Popov Island and the Kievka Bay in the Sea of Japan, (Primorskii krai, Russia). The intestines of the trepangs were aseptically removed and placed into individual penicillin vials with liquid CMM medium (medium for marine microorganisms). Enrichment cultures were obtained by 24h incubation at 30°C; the material was then spread-inoculated on CMM agar and incubated for two days under the same conditions. Material from morphologically different isolated colonies was then transferred to slanted CMM agar with a microbiological loop. The enzymatic activity of pure 67 cultures was determined by inoculation on solid and liquid media with chitin, sodium alginate, starch, and chondroitin sulfate. The strains exhibiting activities on these media were identified using the API biochemical tests (bioMerieux, France). The amylase and chondroitin sulfatase activities were determined by the Somogyi method, chitinolytic activity was measured by the modified colorimetric method of N-acetylaminosugar determination, alginate lyase activity was determinated by viscosimetric method. During our work it was found out the amylase activity of trepang’s microflora is within the range 0,046-0,593 U (μmol/(ml min)). Higher activity were registered among the strains from the intestines of the Kievka Bay trepangs. These higher levels of enzyme activity are probably not accidental and result rather from the higher carbohydrate content in the silt–sandy sediments of Kievka Bay compared to the stone–sandy sediments of Popov Island. These characteristics of the environment result in intense development of specific microflora capable of active starch decomposition on the surface of silt–sandy sediments and, therefore, in the intestines of detritus consumers. Chondroitin sulfatase of investigated strains were 0,124-0,412 U (μmol/(ml min)). None of the strains isolated from the Kievka Bay holothurians possessed chondroitin sulfatase activity. This may be explained by the presence of endogenous enzymes in the animals. Chitinase activity of 21 studied microorganisms was within the range 0,29 – 2,09 U (mg/(ml h)). Only four strains (about 6% of the collection) from the Popov Island trepangs exhibited some degree of chitin hydrolysis. Similarly to chondroitin sulfatase activity, the absence of chitinases in bacteria from the Kievka Bay holothurians may result from the presence of endogenous enzymes in the trepangs from this site. Alginate lyase activity of isolated bacteria were 29,7-78,1% (level of viscosity decrease). P. stutzeri, B. coagulans, and B. megaterium K13 exhibited the highest levels of alginate lyase activity (75.4, 78.1, and 73.6%, respectively). Comparison of our results with the published data suggested that the isolated strains play an important part in processing and assimilation of vegetable food in the trepang organism. Of 67 strains, only P. stutzeri exhibited activity of all the four investigated enzymes. High activity of B. pumilus in hydrolysis of chondroitin sulfate and chitin should be mentioned, as well as of B. coagulans and B. megaterium K13 in respect to starch and sodium alginate. СООБЩЕСТВА СУЛЬФАТРЕДУЦИРУЮЩИХ БАКТЕРИЙ В АЭРОБНЫХ ВОДАХ ЧЕРНОГО МОРЯ Брюханов А.Л.,1,2 Корнеева В.А.,2 Часовников В.К.,3 Пименов Н.В.1 Учреждение Российской академии наук Институт микробиологии им. С.Н. Виноградского РАН, проспект 60-летия Октября, дом. 7, корп. 2, 117312 Москва, Россия, 2Биологический факультет Московского государственного университета им. М.В. Ломоносова, Ленинские горы, дом. 1, корп. 12, 119991 Москва, Россия, 3Южное отделение Учреждения Российской академии наук Института океанологии им. П.П. Ширшова РАН, ул. Просторная 1-г, 353470 Геленджик, Краснодарский край, Россия. e-mail: brjuchanov@mail.ru, npimenov@mail.ru 1 Черное море является самым большим в мире меромиктическим водоемом. В центральной части моря кислородсодержащие воды доходят от поверхности до глубин 90100 м, а на континентальном склоне – до 145-160 м. Глубже аэробной зоны водная толща содержит сероводород, концентрация которого достигает 370 мкМ на глубинах 1500-2000 м. В 1980-х годах было доказано, что сульфатредуцирующие бактерии (СРБ) играют важнейшую роль в образовании и накоплении сероводорода в анаэробной водной толще. Тем не менее, гидрохимические исследования показали наличие восстановленных соединений серы и в поверхностных водах Черного моря. Целью работы являлось изучение биогеохимической активности и филогенетического состава сообществ черноморских СРБ в поверхностной аэробной водной толще и сопоставление этих данных с зоной хемоклина (граница аэробных/анаэробных вод), где ранее были выявлены повышенные активности микроорганизмов различных физиологических групп, в том числе и СРБ. Для доказательства присутствия СРБ в аэробных водах Черного моря использовали комплексный подход, основанный на сочетании гидрохимических, радиоизотопных и молекулярно-биологических методов. Пробы воды с глубин от 30 до 600 м отбирали в летний период 2007-2010 гг. на станции с глубиной 1300 м (44°.458 N, 37°.882 Е), расположенной на свале глубин российского сектора Черного моря в 10-12 милях от Голубой бухты. Радиоизотопные эксперименты с использованием 35S-SO42- показали, что не только в анаэробной зоне и хемоклине, но также и в окисленных поверхностных водах происходят микробиологические процессы восстановления сульфатов. Установлено, что внесение ацетата и бутирата приводит к увеличению интенсивности процесса сульфатредукции как в анаэробных, так и в аэробных водах. Результаты радиоизотопных измерений активности СРБ подтверждаются данными распределения восстановленных форм серы в окисленных поверхностных водах Черного моря. Нами выявлено присутствие восстановленных форм серы в аэробных водах (тиосульфата – 1,2-1,8 мг/л, сульфита – 0,1-0,6 мг/л). Распространение и филогенетический состав анаэробных микробных сообществ СРБ в поверхностной водной толще Черного моря исследовали с помощью молекулярно22 биологических методов. Количественный подсчет и идентификацию микроорганизмов осуществляли с использованием 16S рРНК-специфичных олигонуклеотидных зондов, меченных карбоцианином 3, в ходе флуоресцентной in situ гибридизации (FISH). ПЦР с праймерами, специфичными к гену 16S рРНК основных шести филогенетических групп СРБ, проводили с использованием двух типов ДНК-матриц – с тотальной ДНК, которую выделяли из зафиксированных и отфильтрованных водных проб, и с продуктом амплификации гена 16S рРНК бактерий («вложенная» ПЦР). Многочисленные сульфатредукторы, относящиеся к родам Desulfotomaculum (~30,5% от детектированных клеток бактерий), Desulfovibrio (до 29,6%) и Desulfobacter (~6,7%), были обнаружены методом FISH в аэробных водах на глубинах 30-70 м, тогда как представители рода Desulfomicrobium (~33,5%) преобладали в зоне хемоклина на глубине 150 м. Однако реальная численность клеток СРБ может быть ниже из-за возможной неабсолютной специфичности известных FISH-зондов для вышеупомянутых родов. ПЦР с использованием праймеров к гену dsrB, кодирующему диссимиляционную сульфитредуктазу, выявила присутствие СРБ во всех поверхностных (30-200 м) водных горизонтах. Помимо Desulfotomaculum, Desulfovibrio и Desulfobacter методом «вложенной» ПЦР в аэробных и в верхних анаэробных водах были обнаружены СРБ, относящиеся к группе 5 (DesulfococcusDesulfonema-Desulfosarcina). Специфических фрагментов ДНК сульфатредукторов, принадлежащих к группе 2 (Desulfobulbus) и 3 (Desulfobacterium), не обнаружено. Присутствие метаболически активных СРБ в поверхностных водах Черного моря, выявляемых методом FISH, хорошо коррелирует с гидрохимическими данными по обнаружению восстановленных соединений серы на соответствующих глубинах. Существование СРБ в аэробных морских водах может быть обусловлено наличием в их клетках разнообразных высокоэффективных ферментативных и поведенческих механизмов антиокислительной защиты (в особенности, у представителей рода Desulfovibrio), а также присутствием в морской воде взвешенных частичек (например, фрагментов диатомовых водорослей) и пеллетного материала, внутри которого могут формироваться анаэробные микрозоны. Таким образом, результаты наших исследований доказывают присутствие в кислородсодержащих поверхностных водах Черного моря физиологически активных анаэробных СРБ. Установлено также, что в состав микробных сообществ СРБ поверхностных вод и зоны хемоклина Черного моря, с одной стороны, входят разные филогенетические группы сульфатредукторов, а с другой – численность представителей отдельных групп СРБ существенно меняется при изменении гидрохимических параметров водной толщи. Работа финансировалась за счет средств из грантов РФФИ 10-04-00220-а и Carl Zeiss. COMMUNITIES OF SULFATE-REDUCING BACTERIA IN THE BLACK SEA OXIC WATERS Brioukhanov A.L.,1, 2 Korneeva V.A.,2 Chasovnikov V.K.,3 Pimenov N.V.1 Winogradsky Institute of Microbiology, Russian Academy of Sciences, pr. 60-letiya Oktyabrya 7/2, 117312 Moscow, Russia, 2Faculty of Biology, Lomonosov Moscow State University, Leninskie Gory 1/12, 119991 Moscow, Russia, 3Southern Branch of Shirshov Institute of Oceanology, Russian Academy of Sciences, ul. Prostornaya 1-g, 353470 Gelendzhik, Krasnodar Territory, Russia e-mail: brjuchanov@mail.ru, npimenov@mail.ru 1 The Black Sea is the world’s largest meromictic basin. In the central part of the sea, oxygenated waters lie from a surface to a depth of 90-100 m, while above the continental slope their lower border is somewhat deeper, at 140-160 m. Below the oxic zone, the water column contains hydrogen sulfide (up to 370 μM at 1500-2000 m). In 1980s, a series of publications confirmed the major role of sulfate-reducing bacteria (SRB) in production and accumulation of sulfide in the anoxic water column. However, hydrochemical investigations also revealed the presence of reduced 23 sulfur compounds in the Black Sea upper waters. The goal of the present work is to study the biogeochemical activity and phylogenetic composition of SRB communities in the Black Sea upper oxic water column and to compare these results with the chemocline zone (the border between oxidized and reduced water layers) where high activities of microorganisms from different physiological groups (including sulfate reducers) have been detected earlier. To prove the presence of SRB in the Black Sea oxic surface waters we used the complex approach based on a combination of hydrochemical, radioisotope and molecular biological methods. Water samples from the depths of 30 to 600 m were collected in summer 2007-2010 at the 1300-m station (44°.458 N, 37°.882 Е) located on the continental slope in the Russian sector of the Black Sea, 10-12 miles from the Golubaya Bay. Radioisotope experiments with 35S-SO42- indicated microbial processes of sulfate reduction not only in the anoxic water column and chemocline zone but also in the oxic surface waters. It was found that addition of acetate and butyrate led to an increase in the sulfate reduction intensity both in anoxic and oxic waters. The results of radioisotope measurements of SRB activity were confirmed by the data of distribution of reduced sulfur compounds in the Black Sea oxygenated surface waters. We found the presence of such reduced sulfur compounds in oxic waters as thiosulfates (1.2-1.8 mg/L) and sulfites (0.1-0.6 mg/L). The abundance and phylogenetic structure of anaerobic SRB microbial communities in the Black Sea upper water column were analyzed by molecular techniques. The enumeration and identification of microorganisms were performed using fluorescent in situ hybridization (FISH) with carbocyanine 3-labeled 16S rRNA-specific oligonucleotide probes. PCR with primers, specific to 16S rRNA gene of six main SRB phylogenetic groups, were attempted on two types of DNA as templates – on the total DNA extracted from corresponding fixed and filtered water samples, and on the amplification products of bacterial 16S rRNA gene (“nested” PCR). Numerous sulfate reducers belonging to Desulfotomaculum (~30.5% of the cells detected by universal probes for Bacteria), Desulfovibrio (up to 29.6%) and Desulfobacter (~6.7%) were revealed by FISH in oxic waters at a depth 30-70 m, whereas Desulfomicrobium-related SRB (~33.5%) were prevalent in the chemocline zone at 150-m depth. However, the real numbers of SRB may be lower because of possible non-absolute specificity of the known FISH probes for these genera. PCR with primers, specific to the dissimilatory sulfite reductase (dsrB) gene, detected the presence of SRB in all surface water layers (from 30 to 200 m). Besides Desulfotomaculum, Desulfovibrio and Desulfobacter, “nested” PCR revealed the presence of SRB from group 5 (Desulfococcus-Desulfonema-Desulfosarcina) in the oxic and upper anoxic waters. Specific DNA fragments of sulfate reducers belonging to group 2 (Desulfobulbus) and 3 (Desulfobacterium) were not found. The presence of physiologically active SRB in the Black Sea surface waters, detected by FISH, correlates well with the hydrochemical data on the presence of reduced sulfur compounds at the corresponding depths. The presence of SRB in the Black Sea oxic waters is likely to depend on their highly effective enzymatic and behavioral antioxidative defense mechanisms (in particular, in representatives of Desulfovibrio), and on surrounding suspended particles (for instance, diatom frustules) or pellets material within which anoxic microzones may exist. Thus, our results prove the presence of physiologically active anaerobic SRB in the Black Sea oxygenated upper water column. It was also found that phylogenetic structure of SRB communities in the oxic waters and the chemocline zone is different, and the total microbial numbers of corresponding SRB groups vary significantly under change of hydrochemical parameters of the water column. The work was supported by the Russian Foundation for Basic Research (project no. 10-0400220-a) and Carl Zeiss grant. 24 ОСОБЕННОСТИ СОСТАВА И СТРУКТУРЫ МИКРОБНЫХ СООБЩЕСТВ НЕКОТОРЫХ СОЛЕНЫХ ОЗЕР НОВОСИБИРСКОЙ ОБЛАСТИ Брянская А.В.1, Малуп Т.К.1, Розанов А.С.1, Лазарева Е.В.2, Таран О.П.3, Демидов Е.А.1, Пельтек С.Е.1 1 Институт цитологии и генетики СО РАН, Пр. Ак. Лаврентьева, 10, Новосибирск, Россия; 2 Институт геологии и минералогии СО РАН, Пр. Ак. Коптюга, 3, Новосибирск, Россия; 3 Институт катализа им. Г.К. Борескова СО РАН, Пр. Ак. Лаврентьева, 5, Новосибирск, Россия e-mail: bal412003@mail.ru В Новосибирской области расположено огромное количество мелких бессточных соленых и горько-соленых озер. Находясь на незначительном расстоянии друг от друга, эти озера имеют собственную территорию водосбора и, не смотря на достаточно схожие условия образования, сильно отличаются по геохимическим показателям. Соленые озера Новосибирской области представляют собой пример практически не изученного ареала, исследование которого позволит получить новые данные о микробном разнообразии гипергалинных водоемов и оценить эффекты воздействия окружающей среды на микробиоту. Целью настоящей работы было изучение состава и структуры микробных сообществ некоторых соленых озер Новосибирской области. В результате экспедиционных работ 2008-2010 гг. были изучены 11 озер Купинского и Баганского районов Новосибирской области. Химический состав воды и содержание микроэлементов были определены методами атомно-эмиссионной спектрометрии, капиллярного электрофореза, ИСП-МС и атомной абсорбции. Изучение состава и структуры микробных сообществ проводилось методом FISH и методом безлигазного клонирования (SLIC). Филогенетическое положение выделенных микроорганизмов было определено с помощью анализа последовательности гена 16S рРНК. Проведенное геохимическое исследование природных растворов показало, что по соотношению концентрации анионов в водах озера подразделяются на 2 класса – хлоридный и хлоридно-сульфатный. Значения pH водоемов варьируют от 7 до 9. Значительные различия наблюдаются в минерализации раствора. Большинство озер хлоридно-сульфатного класса представлены крепкими рассолами и имеют минерализацию от 200 до 250 г/л. Редко встречаются озера с минерализацией воды ниже 100 г/л. За период исследований в прибрежной зоне озер были отмечены микробные сообщества разного типа. В трех из исследованных озер развивались бентосные микробные сообщества с доминированием галофильных цианобактерий и эукариотных водорослей. Представители архей визуализировались в планктоне ряда озер, обуславливая розовомалиновую окраску воды. Многие озера характеризовались обильным развитием галофильного рачка Artemia salina. В прибрежной полосе ряда озер были отмечены песчаные маты, сформированные нитчатыми цианобактериями. Микроскопический анализ планктонных микробных сообществ показал, что в пробах исследованных озер широко представлены археи, бактерии, цианобактерии и водоросли. Из проб воды и донных осадков было выделено более 200 бактериальных и архейных штаммов, принадлежащих разным филогенетическим группам. Были обнаружены представители родов: Nesterekonia, Kocuria, Bacillus, Dietzia, Micrococcus, Microbacterium, Arthrobacter, Halomonas, Halorubrum, Haloarcula и др. В результате проведенного пилотного клонирования микробного сообщества одного из озер были выявлены и идентифицированы одноклеточные и колониальные цианобактерии, принадлежащие к родам Synechococcus и Cyanothece; и представители Deltaproteobacteria (Desulfatibacillum sp., Pelobacter sp., 25 Desulfotalea sp.), Alphaproteobacteria (Erythrobacter sp.), Bacteroidetes (Gramella sp.) и Firmicutes (Bacillus sp.). Методом FISH была определена численность архей, бактерий и водорослей и общая численность микроорганизмов в пробах воды. Полученные результаты показали, что распределение разных групп организмов в исследуемых озерах крайне неравномерно. В большинстве случаев наблюдалось численное преобладание архей. Самой немногочисленной и наиболее постоянной в количественном отношении группой являются водоросли и цианобактерии. В целом же общая численность микроорганизмов в пробах воды исследованных озер, определенная методом FISH, была на несколько порядков выше, чем значения численности, полученные методом посева. Проведенные исследования показали, что основными доминантами, ответственными за особенности структуры микробных сообществ соленых озер Новосибирской области, непосредственно в планктоне являются археи и устойчивые к высоким значениям минерализации бактерии, реже – водоросли или цианобактерии. Доминантами в микробных сообществах, развивающихся в прибрежной зоне озер, являются нитчатые и колониальные цианобактерии. В целом же состав микробных сообществ соленых озер Новосибирской области крайне разнообразен, интересен и перспективен для дальнейших работ в области экологии, микробиологии, геохимии и биотехнологии. Работа поддержана Интеграционными проектами СО РАН №10 и 73. SOME PECULIARITIES OF THE CONTENT AND STRUCTURE OF MICROBIAL COMMUNITIES OF SEVERAL SALINE LAKES FROM NOVOSIBIRSK OBLAST A.V. Bryanskaya1, T.K. Malup1, A.S. Rozanov1, E.A. Demidov1, E.V. Lazareva2, O.P. Taran3, S.E. Peltek1 1 Institute of Cytology and Genetics SB RAS , Pr. Lavrentyeva, 10, Novosibirsk, 630090, Russia; 2 Institute of Geology and Mineralogy SB RAS, Pr. Koptug, 3, Novosibirsk, 630090, Russia; 3 Boreskov Institute of Catalysis SB RAS, Pr. Lavrentyeva, 5, Novosibirsk, 630090, Russia e-mail: bal412003@mail.ru There are numerous small endorheic saline and bitter-saline lakes in Novosibirsk oblast. These lakes are located close to each other, but have their own sources and, despite being of similar origin, differ significantly in their geochemical properties. Saline lakes of Novosibirsk oblast present an example of an almost unstudied habitat, which may give new data on microbial diversity of hypersaline lakes and estimate the effect of the environment on microbiota. The aim of the present work was to study the contents and structure of microbial communities of several saline lakes from Novosibirsk oblast. Eleven lakes from Kupino and Bagan regions of Novosibirsk oblast were studied in 20082010. Chemical composition and microelement content of water were studied using emission spectroscopy, capillary electrophoresis, ICP MS, and atomic absorption. The structure of microbial communities was studied in water and sediment samples by the FISH and SLIC techniques. Phylogenetic position of isolated strains was detected by molecular biological methods (16S rRNA gene sequences). Geochemical study of the natural solutions revealed the presence of two classes of anion content: chloride and chloride-sulfate ones. pH values range from 7 to 9. Considerable differences have been observed in solution mineralization. The majority of the chloride-sulfate lakes is hypersaline and has mineralization value from 200 to 250 g/l. Lakes with the mineralization value below 100 g/l are rare. Different types of microbial communities were detected in coastal areas of the lakes. In three of the studied lakes, benthos microbial communities were detected that were dominated by halophilic cyanobacteria and eukaryotic algae. Archaea were found in the plankton of some lakes, 26 causing pinkish-crimson coloring of the water. Many lakes were characterized by abundance of the halophilic crustacean Artemia salina. Sandy mats with the prevalence of filamentous cyanobacteria were found in coastal areas of some lakes. Microscopic analysis demonstrated that archaea, bacteria, cyanobacteria, and algae are abundant in the samples taken from the studied lakes. More than 200 bacterial and archaeal strains belonging to various phylogenetic groups were isolated from water and sediment samples. The representative of the genera Nesterekonia, Kocuria, Bacillus, Dietzia, Micrococcus, Microbacterium, Arthrobacter, Halomonas, Halorubrum, Haloarcula, etc. were found. Cloning of the DNA sequences of microbial communities allowed to identify single-cell and colonial cyanobacteria belonging to the genera Synechococcus and Cyanothece; and the representatives of Deltaproteobacteria (Desulfatibacillum sp., Pelobacter sp., Desulfotalea sp.), Alphaproteobacteria (Erythrobacter sp.), Bacteroidetes (Gramella sp.) and Firmicutes (Bacillus sp.). The quantity of archea, bacteria and algae and total quantity of microorganisms in water samples were determined using the FISH technique. The obtained results demonstrated that the distribution of various groups of organisms in the studied lakes is very uneven. Since all the lakes were hypersaline, archaea prevailed in seven of them. Algae and cyanobacteria were the most small and constant groups. On the whole, total quantity of microorganisms in water samples of the studied lakes estimated by the FISH technique was several magnitudes of order higher than that obtained using cultivation. Therefore, our studies demonstrated that archaea and mineralization-tolerant bacteria, and rarer, algae or cyanobacteria, are the major dominants of plankton microbial communities of saline lakes of Novosibirsk oblast. Filamentous and colonial cyanobacteria are dominant in microbial communities of the coastal areas. On the whole, microbial communities of the saline lakes of Novosibirsk oblast are very diverse, interesting, and promising for further studies in ecology, microbiology, geochemistry, and biotechnology. This study has been supported by SB RAS Integration projects №10 and 73. ВЛИЯНИЕ АНТРОПОГЕННОГО ЗАГРЯЗНЕНИЯ НА ПРОЯВЛЕНИЕ ПАТОГЕННЫХ СВОЙСТВ У МОРСКИХ ПСЕВДОМОНАД Бузолева Л.С., Компанец Г.Г. НИИ эпидемиологии и микробиологии СО РАМН 690002 г. Владивосток, ул.Сельская, 1; Дальневосточный федеральный университет, 690000 г. Владивосток, ул. Октябрьская, 25 e-mail: buzoleva@mail.ru Род Pseudomonas широко распространен в природе. Это распространение связано со способностью этих микроорганизмов приспосабливаться к различным экологическим условиям среды и усваивать различные по природе соединения. Псевдомонады обладают высокими темпами размножения, значительной скоростью роста и обширным спектром активности, обуславливающими их возможность трансформировать и утилизировать практически все существующие в природе органические вещества. Эти микроорганизмы приспосабливаются и к новым химическим соединениям, загрязняющим морскую среду. Приспособления эти могут выражаться в изменении как морфологии, так и генотипа бактерий (Смирнов и др., 1990). Подобные приспособления могут сопровождаться приобретением микроорганизмами признаков, представляющих опасность для гидробионтов, наземных организмов и человека. В данном случае можно говорить об усилении патогенных свойств условно – патогенных и патогенных микроорганизмов, о цитопатическом эффекте (Анисимова, 1994). Сравнительных исследований биологических свойств, особенно патогенных морских псевдомонад, по данным литературы нет. Поэтому целью данной работы является: изучение плазмидного спектра, биологических свойств бактерий рода Pseudomonas, в том числе факторов патогенности, выделенных из морской среды с разной степенью загрязнения. 27 Объектом исследования явились бактерии рода Pseudomonas, выделенные из районов залива Петра Великого с разной антропогенной нагрузкой: высоко загрязненные органическими веществами (б. Золотой Рог, б. Находка и Амурский залив), чистый район (б. Киевка). Определение липолитической, лецитиназной, протеолитической и гемолитической активности проводили согласно общепринятым в микробиологической практике методикам ( Лабинская, 2004). Антибиотикочувствительность определяли на среде Мюллера-Хинтона дискодиффузионным методом в агар. Адгезивные свойства исследовали по методике В.И. Бриллис (1996). Цитотоксические и инвазионные свойства оценивали по инфицированию культуры клеток бактериями, изменению морфологии отдельных клеток и деструкции монослоя клеток Hella. Вирулентность культур определяли на неинбредных мышах путем 9 внутрибрюшинного заражения возрастающими дозами (от 10 до 10 КОЕ/мл), с вычислением LD50 и ее доверительного интервала при помощи метода Кербера, а также по кератоконъюнктивальной пробе на морских свинках. Признаки, констатирующие принадлежность исследуемых штаммов к роду Pseudomonas, определяли согласно общепринятым методам (Берджи, 1997). Определение минимально ингибирующих концентраций тяжелых металлов (Cu, Pb, Cd, Zn, Co, Fe, Ni) проводили согласно известной методике для морских бактерий (Безвербная, 2005). В результате проведенных исследований установлено, что доминирующей группой в микробных ценозах прибрежных вод зал. Петра Великого являются бактерии рода Pseudomonas. Сравнительная характеристика биохимических свойств псевдомонад не показала различий у штаммов, выделенных из районов с разной степенью антропогенной нагрузки. Все исследуемые штаммы обладали слабыми биохимическими свойствами в отношении разложения простых органических веществ. Тем не менее, устойчивость к антибиотикам у штаммов из бухты Золотой Рог оказалась на 30 % выше по сравнению со штаммами, выделенными из бухты Киевка, что является следствием влияния хозяйственно бытовых стоков, поступающих в бухту Золотой Рог. Штаммы бактерий рода Pseudomonas, выделенные из б. Золотой Рог, б. Находка и Амурского залива, характеризующихся высокой антропогенной нагрузкой, обладали выраженными факторами патогенности, по сравнению со штаммами, выделенными из контрольных (чистых в отношении загрязнения поллютантами районов). Сравнительные исследования патогенных свойств псевдомонад, выделенных из районов с разной степенью антропогенной нагрузки, показали, что штаммы, выделенные из бухты Золотой Рог, в 93% случаев разрушали живые клетки, в сравнении – штаммы из бухты Киевка лишь в 17% были активны в этом отношении. Штаммы из бухты Золотой Рог обладали высокой способностью адгезировать на живых клетках, а штаммы из бухты Киевка являлись слабоадгезируемыми. Наиболее устойчивыми к тяжёлым металлам оказались штаммы, выделенные из б. Золотой Рог, подверженной наиболее мощному антропогенному воздействию. В модельных экспериментах было установлено, что тяжелые металлы способны активировать факторы патогенности морских микроорганизмов, в частности, свинец, вызывая усиление адгезивных и инвазивных свойств псевдомонад, увеличивал количество микроорганизмов, проникающих в клетки эпителия, способствуя ускорению развития инфекции. У этих штаммов были выражены цитопатогенные свойства на фоне низкой антибиотикочувствительности. Таким образом, органическое загрязнение и техногенное (взаимодействие тяжелых металлов с морскими микроорганизмами, при их обитании в загрязненных акваториях) способствуют появлению эпидемически опасных штаммов, представляющих угрозу для здоровья человека. 28 INFLUENCE OF ANTHROPOGENOUS POLLUTION ON EXPRESSION OF PATHOGENIC PROPERTIES IN MARINE PSEUDOMONADES Buzoleva L.S. Research Institute of Epidemiology and Microbiology SD RAMS 690002 Vladivostok, Selskaya st., 1; Far Eastern Federal University, 690000 Vladivostok, Oktyabrskaya st., 27 e-mail: buzoleva@mail.ru Pseudomonas genus is widespread in the nature. This distribution is connected with ability of these microorganisms to adapt to various ecological environmental conditions and to assimilate various compounds. Pseudomonads possess high rates of reproduction, considerable growth rate and an extensive spectrum of the activity, causing their possibility to transform and utilize practically all organic substances existing in the nature. These microorganisms adapt and to the new chemical compounds polluting marine environment. These adaptations can be expressed in change of both morphology and genotype of bacteria (Smirnov, etc., 1990). Similar adaptations can be accompanied by acquisition of the signs representing danger to hydrobionts, land organisms and human by microorganisms. In this case it is possible to speak about strengthening of pathogenic properties opportunistic and pathogenic microorganisms, about cytopathic effect (Anisimov, 1994). Comparative researches of biological properties, especially pathogenic marine pseudomonades, according to the literature aren't present. Therefore the purpose of this work is studying of plasmid spectrum, biological properties of bacteria of Pseudomonas genus, including the factors of pathogenicity isolated from marine environment with different degree of pollution. Object of research were the bacteria of Pseudomonas genus isolated from areas of Peter the Great gulf with different anthropogenous press: high polluted by organic substances (Gold Horn bay, Nakhodka bay and Amursky bay), pure area (Kievka bay). Definition of lypolytic, lecithinase, proteolytic and haemolytic activity were conducted according to standard techniques in microbiological practice (Labinskaya, 2004). Antibioticsensitivity were defined on Muller-Hinton medium by disk diffusive method in agar. Adhesive properties were investigated by V.I.Brillis's technique (1996). Cytotoxic and invasive properties were estimated by infection of cells culture by bacteria, change of morphology of cells and destruction of Hella cells' monolayer. Virulence of cultures were defined on noninbred mice by intraperitoneal infection with increasing doses (from 10 to 109 cell/ml), with calculation of LD50 and its confidential interval by means of Kerber's method, and also by keratoconjunctive test on porpoises. The signs ascertaining belonging of investigated strains to Pseudomonas genus were defined according to standard methods (Bergey, 1997). Definition of minimum inhibiting concentration of heavy metals (Cu, Pb, Cd, Zn, Co, Fe, Ni) were conducted according to a known technique for marine bacteria (Bezverbnaya, 2005). As a result of researches it is established that dominating group in microbic cenosis of coastal waters of Peter the Great gulf is bacteria of Pseudomonas genus. The comparative characteristic of biochemical properties of pseudomonades hasn't shown distinctions in strains isolated from areas with different degree of anthropogenous press. All investigated strains possessed weak biochemical properties in decomposition of simple organic substances. Nevertheless, stability to antibiotics of strains from the Gold Horn bay was on 30 % higher in comparison with strains isolated from Kievka bay that is a consequence of influence of household sewage arriving into the Gold Horn bay. Bacteria strains of Pseudomonas genus isolated from the Gold Horn bay, Nakhodka bay and Amursky bay characterized by high anthropogenous press possessed the expressed factors of pathogenicity in comparison with strains isolated from control (pure areas). Comparative researches of pathogenic properties of pseudomonades isolated from areas with different degree of anthropogenous press have shown that strains isolated from the Gold Horn bay in 93 % of cases destroyed live cells, in comparison – strains from Kievka bay only in 17 % were active in this 29 respect. Strains from the Gold Horn bay possessed high ability to adhere on live cells, and strains from Kievka bay were weak adhesive. The most steady against heavy metals were strains isolated from the Gold Horn bay exposed to the most powerful anthropogenous influence. In modeling experiments it has been established that heavy metals are capable to activate factors of pathogenicity of marine microorganisms, in particular, lead, causing strengthening adhesive and invasive properties of pseudomonades, increased quantity of the microorganisms getting into cells of epithelium promoting acceleration of infection development. In these strains cytopathogenic properties against low antibiotic-sensitivity have been expressed. Thus, organic and technogenic pollution (interaction of heavy metals with marine microorganisms, with their habitation in the polluted water areas) promote occurrence of epidemically dangerous strains posing threat for human health. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЕ РАЗНООБРАЗИЕ ЦИАНОФАГОВ В ОЗЕРЕ БАЙКАЛ Бутина Т.В., Потапов С.А., Белых О.И. Учреждение Российской академии наук Лимнологический институт Сибирского отделения РАН, г. Иркутск, 33, а/я 278, Россия e-mail: tvbutina@mail.ru В последнее время все большее внимание исследователей уделяется изучению вирусов водных экосистем. Несмотря на возрастающий интерес к водной вирусологии многие пресноводные экосистемы остаются малоизученными. Целью данной работы стало изучение разнообразия цианофагов в озере Байкал с помощью генетической идентификации. Молекулярно-генетические методы стали ценным инструментом в изучении распространения вирусов в природе, в том числе в природных водоемах. Благодаря разработанным генетическим маркерам удается идентифицировать широкий спектр «некультивированных» вирусов известной классификации. Как известно, цианобактерии принимают активное участие в функционировании водных экосистем, и цианофаги являются одним из природных факторов, регулирующих численность и разнообразие цианобактерий. Озеро Байкал – один из самых крупных пресноводных водоемов – уникальный по своим свойствам и видовому разнообразию. Недавние исследования вириопланктона озера Байкал (Дрюккер, Дутова, 2006; 2009) выявили высокую численность, разнообразие и сезонную динамику вириопланктона озера Байкал и показали, что, как и в других водных экосистемах, наибольшее количество вирусов в озере составляют хвостатые бактериофаги трёх семейств: Siphoviridae, Podoviridae и Myoviridae. Нами были получены первые данные о наличии и разнообразии Т4-бактериофагов, в том числе Т4-цианофагов, в озере Байкал (Бутина и др., 2010; Butina et al., 2010). Пробы воды из озера Байкал были отобраны в апреле и августе 2010 г. в пелагиали Южного Байкала на разрезе Листвянка-Танхой на глубине 5-10 метров. Пробы воды объемом до 0,5 л последовательно фильтровали через поликарбонатные фильтры (Millipore) с диаметром пор 1.2; 0.8; и 0.2 мкм, концентрировали ПЭГ 8000, затем из полученных концентратов выделяли ДНК с помощью набора ДНК-сорб (ИнтерЛабСервис). В качестве матрицы для ПЦР использовали выделенную ДНК, а также непосредственно образцы воды, полученные после фильтрации через 0.2 мкм фильтры. Отобранные пробы воды оказались положительными в ПЦР-реакции с выбранными наборами праймеров к генам фотосинтеза psbD и капсидного белка g20. Амплифицированные фрагменты клонировали и определяли нуклеотидные последовательности на автоматическом секвенаторе Beckman Coulter CEQ8800. BLAST-анализ показал, что полученные последовательности генов psbD и g20 отличаются от всех известных, представленных в базе данных GeneBank. Из полученных 30 данных следует, что цианофаги озера Байкал характеризуются значительным разнообразием и сильно отличаются от всех известных к настоящему времени вирусов цианобактерий. Наибольшее сходство выявленных последовательностей было обнаружено с генами цианофагов, принадлежащих семейству Myoviridae, поражающих пикопланктонные цианобактерии рода Synechococcus. Как известно, пикопланктонные фототрофные организмы являются одними из основных производителей первичной продукции в водных экосистемах, и от их жизнедеятельности зависит функционирование других трофических уровней. Таким образом, цианофаги могут значительно влиять на продуктивность и общее функционирование озера Байкал. Работа выполнена при поддержке гранта РФФИ № 10-04-01613-a. MOLECULAR-AND-GENETIC DIVERSITY OF CYANOPHAGES IN LAKE BAIKAL Butina T.V., Potapov S.A., Belykh O.I. Limnological Institute SB RAS, P.O. Box 278, 664033 Irkutsk, Russia e-mail: tvbutina@mail.ru Recently the increasing attention of researchers is given to study of viruses of water ecosystems. Despite of intensive interest to aquatic virology, many freshwater ecosystems remain poorly studied. This study was aimed at elucidating diversity of cyanophages in Lake Baikal by using the genetic identification. Molecular-and-genetic methods became the valuable tool in study of distribution of viruses in nature, including the natural reservoirs. Due to developed genetic markers it is possible to identify a wide range of "uncultivated" viruses of known taxonomy. As is known that cyanobacteria take active part in functioning of water ecosystems and cyanophages are one of the natural factors controlling a number and a diversity of cyanobacteria. Lake Baikal – one of the largest freshwater lakes – unique on the properties and species diversity. Recent studies of Lake Baikal virioplankton (Дрюккер, Дутова, 2006; 2009) have revealed a huge number, diversity and seasonal abundance of virioplankton of Lake Baikal and have shown, that the greatest number of viruses in lake, as well as in others water ecosystem was the tailed bacteriophages of three families: Siphoviridae, Podoviridae and Myoviridae. We obtained the first data about presence and diversity Т4-бактериофагов, including Т4-cyanophages, in Lake Baikal (Butina et al., 2010a,b). Water samples were collected in April and August, 2010 from Southern Baikal in station Listvjanka-Tanhoj on the depths of 5-10 m. Water samples (0.5 l) were sequentially filtered through polycarbonate filters (Millipore) with pore size of 1.2, 0.8 and 0.2 µm, concentrated by PEG 8000, and then DNA was extracted from obtained concentrates using a DNA-sorb kit (InterLabService). Extracted DNA, as well as directly water samples after a filtration through 0.2 µm filters were used for PCR. Water samples were positive in PCR-analysis with chosen sets of primers to genes of photosynthesis psbD and of capsid protein g20. Amplified fragments were cloned and analyzed by sequencing on a Beckman Coulter CEQ8800. The BLAST-analysis has shown that received sequences of genes psbD and g20 differed from all available in database GeneBank. It followed from data obtained that cyanophages from Lake Baikal are considerably diverse and strongly differ from all known viruses of cyanobacteria by present. The greatest similarity of obtained sequences was revealed with genes of cyanophages, belonging to the family Myoviridae, infected the picoplankton cyanobacteria of genus Synechococcus. As known, picoplankton phototrophic organisms are one of the basic producers of primary production in water ecosystems and functioning of other trophic levels depends on their vital functions. Thus, cyanophages might significantly influence productivity and the general functioning of Lake Baikal. This research was supported by the Russian Foundation for Basic Research, project 10-0401613-a. 31 ХАРАКТЕРИСТИКА ЛАГУНЫ БУССЕ (ЮЖНАЯ ЧАСТЬ О. САХАЛИН) ПО МИКРОБИОЛОГИЧЕСКИМ ПОКАЗАТЕЛЯМ Галанина Е.В., Полтева А.В. Сахалинский НИИ рыбного хозяйства и океанографии, 693023, г. Южно-Сахалинск, ул. Комсомольская, 196 e-mail: galanina@sakhniro.ru Микробиологический мониторинг лагуны Буссе проводился с 2005 г. как часть комплексных исследований, цель которых – оценка акватории залива с точки зрения пригодности для воспроизводства ценных промысловых гидробионтов (трепанга, приморского гребешка и др.). При выборе районов для разведения беспозвоночных, в частности моллюсков–фильтраторов, предпочтение отдается участкам с низким уровнем органического загрязнения и не подверженным хроническому антропогенному влиянию. Для характеристики качества воды в лагуне определяли показатели численности микроорганизмов различных эколого-трофических групп, в том числе, осуществляющих различные стадии деструкции органического вещества, а также микроорганизмовиндикаторов антропогенного влияния – фенолрезистентных и санитарно-показательных. Пробы воды для микробиологических исследований отбирали в приповерхностном и придонном слоях с весны по осень. Учет численности микроорганизмов вели на агаровых средах, приготовленных на морской воде: эвтрофной группы на рыбопептонном агаре (РПА), олигокарбофильной – на РПА, разбавленном в 10 раз, фенолрезистентных бактерий – на «голодном» агаре, содержащем 1% фенола. Индекс лактозоположительных кишечных палочек определяли согласно МУ 2260-80. Микроорганизмов, участвующих в минерализации полимерных субстратов углеводной природы и процессах нитрификации, учитывали на крахмало-аммиачном агаре. Коэффициент минерализации (КМ) рассчитывали по формуле: КМ = NКАА/NРПА, где N – число микроорганизмов, выросших на соответствующих питательных средах (Никитин, Никитина, 1978). Как показали проведенные исследования, численность эвтрофной группы гетеротрофного микробного сообщества лагуны за период исследований варьировала в поверхностных водах в пределах 30–475, в придонных – 60–2070 кл./мл, что по трофосапробиологическим показателям соответствует «олигосапробной» характеристике вод (ГОСТ 17.1.2.04-77). Регистрируемое для олиготрофных водоемов численное превышение олигокарбофильной группы микроорганизмов над эвтрофной, было характерным и для микробных комплексов лагуны. Диапазон численности олигокарбофильных микроорганизмов для приповерхностных вод находился в пределах 230–900, для придонных – 325–7200 кл./мл. Показатели численности и соотношение гетеротрофных групп планктонного сообщества микроорганизмов в лагуне свидетельствовали о протекании процессов аммонификации органических веществ и его дальнейшей минерализации, которая на участках акватории проходила с различной интенсивностью (КМ – 1,6–8,5). Разложение полимерных углеводных веществ, источниками которых в лагуне являются активно вегетирующие водоросли анфельция, ламинария, осуществляла группа амилолитических бактерий, по численности не превосходившая эвтрофную и олигокарбофильную группы. Перечисленные процессы способствовали очищению лагуны от легкоокисляемых органических веществ, накопление которых в значительных количествах приводит к эвтрофированию водных объектов. Полученные данные по численности фенолрезистентных микроорганизмов (10–102 кл./мл) отражали фоновое содержание фенольных соединений в воде. Подобные соединения, за счет которых могут развиваться фенолрезистентные микроорганизмы, образуются в водоемах в процессе жизнедеятельности гидробионтов, а также в результате накопления растительного материала, и его трансформации. Потенциальными источниками таких соединений в лагуне были заросли зостеры. 32 Поскольку лагуна Буссе находится в зоне достаточно активной хозяйственной деятельности человека, было проведено исследование проб воды на наличие санитарнопоказательных микроорганизмов, присутствие которых является индикатором хронического антропогенного загрязнения, либо кратковременного антропогенного влияния. В результате проведенных исследований санитарные индикаторные микроорганизмы выделены не были. Отсутствие в пробах воды санитарно-показательных микроорганизмов характеризовало лагуну как водоем свободный от значимого антропогенного влияния. Таким образом, полученные в результаты исследований, проведенных в лагуне Буссе в 2005-2010 гг., микробиологические характеристики, позволяют отнести залив к водоемам, пригодным для разведения гидробионтов. CHARACTERISTIC OF BUSSE LAGOON (SOUTHERN SAKHALIN) BY MICROBIOLOGICAL INDICES Galanina E.V., Polteva A.V. Sakhalin Research Institute of Fisheries and Oceanography, 196, Komsomolskaya St., YuzhnoSakhalinsk, 693023 e-mail: galanina@sakhniro.ru The microbiological monitoring of Busse Lagoon has been conducted since 2005 as part of the complex studies for the purpose to estimate the bay area in respect to its fitness for reproduction of valuable commercial hydrobionts (sea cucumber, Japanese scallop, and others). When choosing areas to cultivate invertebrates, particularly mollusks-filtrators, the sites with low level of organic pollution and not subjected by the persistent anthropogenic impact are preferable. To characterize water quality in the lagoon, we determined quantitative indices of microorganisms from different ecologic-trophic groups, including those accomplishing different stages of destruction of organic substances, and also microorganisms-indicators of anthropogenic impact – phenol-resistant and sanitary-indicative. Water samples for microbiological analysis were taken in the near-surface and near-bottom layers during the spring–autumn period. The abundance of microorganisms was assessed on the agar medium prepared using a sea water: eutrophic group on fish-peptone agar (FPA), oligocarbophilic – on FPA diluted as much as 10 times, phenolresistant bacteria – on “hungry” agar containing 1% of phenol. Index of lactose-positive coli bacilla was determined according to MD 2260-80. The microorganisms participating in mineralization of carbohydrate-nature polymer substrates and nitrification processes were counted on starch-ammonia agar. The coefficient of mineralization (CM) was calculated using the formula: CМ = NSАА/NFPA, where N – number of microorganisms grown on the corresponding nutrient mediums (Nikitin, Nikitina, 1978). The analyses showed that during the study period the abundance of eutrophic group of heterotrophic microbe community of Busse Lagoon varied within 30–475 cell/ml in the surface waters and within 60–2070 cell/ml in the near-bottom waters that corresponds to “oligosaprobic” characteristic of waters (GOST 17.1.2.04-77). The abundance excess of oligocarbophilic group of microorganisms over the eutrophic one, which is usually recorded for oligotrophic water bodies, was common for microbe lagoon complexes as well. The abundance of oligocarbophilic microorganisms in the near-surface waters ranged within 230–900 cell/ml, and in the near-bottom waters within 325–7200 cell/ml. The abundance characteristics and ratio of heterotrophic groups of planktonic communities of microorganisms in Busse Lagoon indicated a behavior of ammonification processes of organic substances and its further mineralization, which appeared to be differently intensive on the study area (CМ – 1.6–8.5). Decomposition of polymer carbohydrate substances, the sources of which are the actively vegetating algae (ahnfeltia, laminaria), was made by the group of amylolytic bacteria, which did not exceed the eutrophic and oligocarbophilic groups by abundance. The listed processes promoted lagoon purification from the light-oxidized organic substances, which accumulation in great numbers results in eutrophication of water objects. 33 The obtained data on abundance of phenol-resistant microorganisms (10–102 cell/ml) reflected the background content of phenol compounds in water. Such compounds, due to which phenol-resistant microorganisms can develop, are formed in water bodies during the vital activity of hydrobionts, and also because of accumulation of plant material and its transformation. The potential sources of such compounds in the lagoon were zostera thickets. As far as Busse Lagoon is located in a zone of rather developed human economic activity, the water samples were analyzed for occurrence of sanitary-indicative microorganisms, which are the indicator of persistent anthropogenic pollution or a short-term anthropogenic impact. No sanitary-indicative microorganisms were revealed during studies. Their absence in water samples has characterized Busse Lagoon as a water body free from significant anthropogenic impact. Thus, the microbiological characteristics obtained during studies conducted in Busse Lagoon in 2005-2010 allow referring the bay to water bodies fit for hydrobionts cultivation. ФЕРМЕНТАТИВНАЯ АКТИВНОСТЬ БАКТЕРИЙ, ВЫДЕЛЕННЫХ ИЗ МОРСКОЙ ВОДЫ, ЗАГРЯЗНЕННОЙ НЕФТЕПРОДУКТАМИ 1 Ганбаров Х.Г.1, Абдурахманов Ф.Ю.2 Бакинский Государственный Университет, 2 Институт микробиологии НАН Азербайджанской Республики, г. Баку, Азербайджанская Республика e-mail:khuda1949@mail.ru Каспийское море в настоящее время интенсивно загрязняется, что приводит к изменению химического состава его воды. Подсчитано, что ежегодно в море сбрасывается несколько десятков тыс.тонн нефти. Особую тревогу вызывает состояние Бакинской бухты, в которую сбрасывается, кроме того, огромное количество неочищенных хозяйственнобытовых и промышленных сточных вод. Ферменты и ферментативная активность микроорганизмов, имеющихся в водоемах, являются показателями интенсивности биологической очистки. Целью нашей работы явилось изучение ферментативной активности некоторых бактерий, выделенных из Каспийского моря на территории Бакинской бухты. Показано, что в морской воде на территории Бакинской бухты содержатся такие трудноразлагаемые ароматические углеводороды, такие как монометил-, диметил- и триметилбензолы, нафталин и др. Из морской воды были выделены чистые культуры бактерий рода Pseudomonas, Bacillus и Actinomyces, изучена их ферментативная активность. Бактерии выращивались на среде следующего состава (г/л): (NH4)2SO4-2; KH2PO4 ·2H2O-2; Na2HPO4·12H2O-3; MgSO4·7H2O-0,2; FeSO4·7H2O-0,05; CaCl2-0.01; MnSO4·7H2O0.002; дрожжевой экстракт-0.3. В качестве источника углерода использовали глюкозу, ароматические углеводороды (толуол, п-ксилол, псевдокумол, нафталин), п-крезол, бензойную, п- толуиловую, п- оксибензойную и протокатеховую кислоты. При росте на среде с ароматическими углеводородами и окисленными их продуктами бактерии рода Pseudomonas aeruginosa штамм 37, Ps. putida штамм 23, Ps. fluorescens штамм 14, Ps. ellipsoideus штамм 24 обладали активностью метилгидроксилазы п-ксилола и метилгидроксилазы п-крезола. Однако активность метилгидроксилазы п-крезола значительно варьировала в зависимости, как от штамма бактерий, так и от вида источника углерода. Что касается ферментов расщепления ароматического кольца, то Pseudomonas putida штамм 23 обладает активностью всех трех ферментов (пирокатехин-1,2-диоксигеназа, пирокатехин-2,3-диоксигеназа и протокатехоат-3,4-диоксигеназа), осуществляющих разрыв кольца. У культур Pseudomonas aeruginosa штамм 37 и Ps. fluorescens штамм 14 отсутствовала активность фермента пирокатехин-1,2-диоксигеназы, а у Pseudomonas ellipsoideus штамм 24 – активность фермента пирокатехин-2,3-диоксигеназы. У бактерий Bacillus cereus штамм 7 и B. idosus штамм 44 наблюдалась активность только двух ферментов: пирокатехин-1,2-диоксигеназы и протокатехоат-3,4-диоксигеназы. 34 У бактерий Actinomyces flavus штамм 61 и Act. violaceus штамм 17 наблюдалась слабая активность метилгидроксилазы п-ксилола и высокая активность как пирокатехин-1,2диоксигеназы, так и протокатехоат-3,4-диоксигеназы. Таким образом, показано, что все исследованные виды бактерий рода Pseudomonas обладают активностью как ключевых ферментов окисления ароматических углеводородов, так и ферментов расщепления ароматического кольца. Бактерии рода Bacillus не проявляли активность ключевых ферментов действия на ароматические углеводороды и обладали активностью фермента расщепления ароматического кольца только по орто-пути. Бактерии рода Actinomyces имели очень слабую активность ключевых ферментов окисления ароматических углеводородов, но обладали высокой активностью ферментов расщепления ароматического кольца по орто-пути. Следовательно, бактерии рода Pseudomonas являются активными деструкторами ароматических углеводородов нефти, а бактерии родов Bacillus и Actinomyces способны разлагать более окисленные ароматические соединения. ENZYME ACTIVITY OF BACTERIA, ISOLATED FROM OIL POLLUTED SEA WATER 1 Ganbarov Kh.G.1, Abdurachmanov F.Y.2 Baku State University, Institut of Microbiology of Azerbaijan National Academy of Scinces, Baku, Azerbaijan e-mail: khuda1949@mail.ru 2 Kaspian Sea is intensively being polluted now and it brings up to change of chemical composition of its water. It is known that tens of thousands ton of oil yearly is dropped into the sea. Especially alarm cause condition of Baku bay, where also dropped, in addition, a large amount of consumer and industrial sewage waters. Enzymes and enzyme activity of microorganisms available in reservoirs are indices of biological purification intensity. The aim of the present work was to study the enzyme activity of some bacteria, isolated from Kaspian Sea in territory of Baku bay. It was shown that in the territory of Baku bay are containd such kind of aromatic hydrocarbons, as monomethylbenzene, dimethylbensene, trimethylbenzen, naphthalin and etc., which are highly resistant to biodegradation. Out of the sea water were isolated pure cultures of bacteria genus Pseudomonas, Bacillus and Actinomyces and studied their enzymatic (oxygenases) activity. The bacteria were cultivated on the medium of following composition (g/l): (NH4)2SO4-2; KH2PO4·2H2O-2; Na2HPO4·12H2O-3; MgSO4·7H2O-0,2; FeSO4·7H2O-0,05; CaCl2-0,01; MnSO4· 7H2O-0,002; yeast extract-0,3. As a source of carbon were used glucose, aromatic hydrocarbons (benzene, toluene, o-, mand p-xylene, pseudocumene and naphthalin), p-cresol, benzoic acid, o-, m- and p-toluic acids and p-hydroxybenzoic acid. During the growth on aromatic hydrocarbons and their oxidized derivatives bacteria Pseudomonas aeruginosa strain 37, Ps. putida strain 24 displayed the activity of p-xylene-methylhydroxilase and p-cresol-methyl-hydroxilase. p-Cresol-methyl-hydoxilase activity significantly varied depending on both strains of bacteria and a kind of carbon sources. As to enzymes splitting the aromatic ring, it was shown that Ps. putida strain 23 has catechol-1,2-dioxygenase, catechol-2,3dioxygenase and protocatechoat-3,4-dioxygenase. Catechol-1,2-dioxygenase was not detected in Ps. aeruginosa strain 37 and Ps. fluorescens strain 14 and catechol-2,3-dioxygenase was absent in Ps. ellipsoideus strain 24. The activity of two enzymes: catechol-1,2-dioxygenase and protocatechoat-3,4-dioxygenase were observed in bacteria Bacillus cereus strain 7 and B. idosus strain 44. 35 The low activity of p-xylene-methyl-hydroxilase and highest activity of both catechol-1,2dioxygenase and protocatechoate-3,4-dioxygenase were observed in bacteria Actinomyces flavus strain 61 and Act. violaceus strain 17. Thus, it has been established that all the studied species of genus Pseudomonas possess the activity of both key enzymes of aromatic hydrocarbons oxidation and enzymes of aromatic ring cleavage. The bacteria genus Bacillus are not possessed activity of key enzymes of aromatic hydrocarbons oxidation, but are capable for cleavage of aromatic ring only by orto-way. The bacteria genus Actinomyces had very low activity of key enzymes of aromatic hydrocarbons oxidation and high activity of aromatic ring cleavage enzymes by orto-way. Therefore, the bacteria genus Pseudomonas are active destructors of oil aromatic hydrocarbons, while the bacteria genus Bacillus and Actinomyces are capable decompose of more oxidized aromatic compounds. РАСПРОСТРАНЕНИЕ МИКРООРГАНИЗМОВ В МЕЛКОВОДНЫХ ЗАЛИВАХ ОЗЕРА БАЙКАЛ Гаранкина В.П., Дагурова О.П., Намсараев Б.Б. Институт общей и экспериментальной биологии СО РАН, Сахьяновой, 6, Улан-Удэ, Россия e-mail: G_val_82@mail.ru С водами реки Селенга в мелководные заливы озера Байкал поступает значительное количество взвесей, органического и неорганического вещества. Заливы придельтового пространства реки Селенга отличаются хорошей прогреваемостью в летний период и высокой продуктивностью (Кулагин, Помазкина, 1977). Цель работы – изучить распространение микроорганизмов в воде и грунтах мелководных заливов (сорах) озера Байкал и сравнить с прибрежными участками открытого Байкала. Были изучены характеристики мелководных заливов Провал, Посольский Сор, Сор Черкалов и двух фоновых участков открытого Байкала – Боярск и Энхалук. Пробы были отобраны в различные сезоны. Общая численность бактерий в воде заливов и фоновых участках была сопоставима – 1,6-2,9 млн кл/мл. Заливы характеризовались чуть более высокой численностью. Такая же закономерность наблюдалась для значений численности сапрофитных и целлюлозоразлагающих бактерий. Численность сапрофитов в заливах достигала 1,2 млн кл/мл, целлюлозоразлагающих – до 0,1 млн кл/мл. Максимальные значения были определены для залива Сор Черкалов. Сезонные колебания численности бактерий происходили в пределах одного порядка. Максимальные значения были приурочены к летним месяцам. При этом отмечалось увеличение доли сапрофитных бактерий от общей численности. Пики деструкции, в целом, совпадали с июльскими пиками численности гетеротрофов. Деструкция в воде изученных участков превышала продукцию. Продукция в воде мелководных заливов составляла в среднем 0,062 мг О2/л ч, деструкция – 0,093 мг О2/л ч. В контрольных участках эти показатели были ниже и составляли 0,055 и 0,085 мг О2/л ч соответственно. Вклад оксигенного фотосинтеза в продукцию был наибольшим (72%), темновая ассимиляция СО2 составляла 5%, доля хемосинтеза была довольно значительной – 20%. Фотосинтез в заливе Провал отличался большей интенсивностью по сравнению с другими изученными мелководными заливами. Содержание органического углерода в грунтах заливов было выше, чем в фоновых участках: среднее значение для заливов – 0,54%, для фоновых участков – 0,20%. Количество бактерий в осадках заливов также было выше. Самые высокая численность была обнаружена в заливе Сор Черкалов (среднее значение 3,34 млн кл/мл). В заливе Провал в ряду осадков «песок - заиленный песок – ил» содержание органического углерода, общая численность бактерий и численность сапрофитных бактерий увеличивались. Произведено молекулярное клонирование суммарной ДНК, выделенной из поверхностных осадков. Обнаружены некультивируемые представители четырех филогенетических линий – протеобактерии 36 (классы альфа-, бета-, гамма- и дельтапротеобактерии), бактероиды, актинобактерии и веррукомикробии (Гаранкина и др., 2010). Таким образом, как в воде, так и в осадках мелководных заливов озера Байкал численность микроорганизмов была несколько выше, чем в фоновых участках, находясь в пределах одного порядка. Продукция и деструкция в воде заливов также характеризовались более высокими значениями. В осадках присутствовали некультивируемые представители различных филумов эубактерий, широко распространенные в других пресных экосистемах. DISTRIBUTION OF MICROORGANISMS IN SHALLOW BAYS OF LAKE BAIKAL Garankina V.P., Dagurova O.P., Namsaraev B.B. Institute of General and Experimental biology SB RAS Sachyanovoy St., 6, Ulan-Ude, Russia e-mail: G_val_82@mail.ru A significant quantity of suspensions, organic and inorganic matter comes in the shallow bays of Lake Baikal with the waters of the Selenga River. Bays near area of Selenga delta are characterized by high heating of the summer period and high productivity (Kulagin, Pomazkina, 1977). The purpose of the work is to study of microorganisms’ distribution in water and sediments in shallow bays (sors) of Lake Baikal and to compare with the sites of the open Baikal. The characteristics of shallow bays Proval, Posolsky Sor, Scherkalov Sor and two coastal sites of open Baikal - Boyarsk and Enkhaluk were studied. Samples were taken in different seasons. The total number of bacteria in the water bays was from 1.6 to 2.9 million cells/ml. It was comparable with control sites. Bays were characterized by slightly higher numbers. The same pattern was observed for the values of the number of saprophytic and cellulolytic bacteria. The number of saprophytic bacteria reached 1.2 million cells/ml, the number of cellulolylitic bacteria reached 0.1 million cells/ml. Maximal values were determined in Scherkalov Sor. Seasonal fluctuations of numbers of bacteria occurred within the same order. Maximal values were measured in summer months. The part of saprophytic bacteria in total number increase. The peaks of destruction, in general, coincided with the July peaks of abundance of heterotrophs. Destruction of the water of studied sites exceeded production. Production and destruction in water shallow bays reached 0.062 mg O2/ l h and 0.093 mg O2 / l h, respectively. In the control sites these values were lower and reached 0.055 and 0.085 mg O2 / l h, respectively. Contribution of oxygenic photosynthesis in the production was the highest (72%), dark assimilation of CO2 was 5%, the chemosynthesis was 20%. Photosynthesis in Proval has greater intensity in comparison with other studied shallow bays. The organic matter concentration of in bays’ sediments was higher: the average value for the bays control sites was 0.54% and for the control sites was 0.20%. The number of bacteria in the sediments of the bays was also higher. The highest number in the bay Scherkalov Sor (average of 3.34 million cells / ml) was found. Organic matter content, total number of bacteria and number of saprophytic bacteria increased a sediment range "sand - silted sand - silt" in the bay Proval. Molecular cloning of total DNA extracted from surface sediments was produced. Uncultivated representatives of the four phylogenetic lines was found. These belong to Proteobacteria (α,β,γ,δ), Bacteroidetes, Actinobacteria and Verrukomicrobia (Garankina et al, 2010). Thus, both in water and in sediments of shallow bays of Lake Baikal the number of microorganisms was slightly higher than in control sites, being within one order. Production and destruction in the water bays were also characterized by higher values. In the sediments uncultivated representatives of the various eubacteria phyla were found, which are widespread in other freshwater ecosystems. 37 МИКРОБИОЛОГИЧЕСКАЯ ТРАНСФОРМАЦИЯ ОРГАНИЧЕСКИХ ВЕЩЕСТВ В МАЛЫХ ЭСТУАРНЫХ СИСТЕМАХ Гаретова Л.А., Каретникова Е.А. Институт водных и экологических проблем ДВО РАН, 680000, Ким Ю Чена, 65, Хабаровск, Россия e-mail: micro@ivep.as.khb.ru В зонах взаимодействия морских и речных вод возникает биогеохимический барьер, в районе которого происходит резкое изменение концентрации растворенных и взвешенных веществ, физико-химических свойств воды и интенсификация биохимических процессов в воде и донных отложениях. Целью работы являлось исследование состава бактериопланктонных и бактериобентосных сообществ, содержания органического вещества (ОВ), качественного и количественного состава углеводородов (УВ) в воде и донных отложениях (ДО), а также физико-химических параметров водной среды (температура, соленость, рН, цветность, УЭП) малой эстуарной системы река-озеро-бухта Токи (Татарский пролив) в летне-осенний период 2009-2010 гг. Установлено, что в течение приливоотливных циклов гидролого-гидрохимические параметры воды системы имеют переменный, флуктуирующий характер и претерпевают выраженные изменения в том же диапазоне, что и сезонные колебания. За один суточный цикл соленость воды варьирует: в устье реки от 0 до 0,97‰, по станциям озера от 0 до 31,24‰, в бухте от 10,46 до 31,04‰. По станциям эстуария содержание ОВ в воде изменяется от 0,7 до 17,0 мг/л, количество УВ составляет от 0,8 до 10% от общего содержания ОВ в воде. Максимумы концентраций ОВ и УВ в воде не зависимо от сезона выявлялись на стадии отлива. По данным хроматографического анализа фракция насыщенных алканов воды представлена смесью гомологов с длиной цепи от С11 до С25. В течение приливоотливных циклов качественный и количественный состав алканов претерпевает существенные изменения, что отражается на величине CPI (индекс нечетности), который колеблется в интервале 0,16-2,45. Содержание фенолов в воде составляло 0-8,1 мкг/л при максимальных концентрациях в озерной части эстуария в фазу отлива. В донных отложениях озерной части эстуария содержание ОВ составляло от 0,1 до 65,2 г/ дм3, УВ от 0,23 до 155 мг/ дм3. В составе фракции n-алканов донных отложений доминируют углеводороды с длиной цепи С12-С14, составляющие в сумме от 43,9% в грунтах середины озера до 72,8% в ДО устья реки. Значения СPI по станциям озерной части эстуария составляют 0,9-1,67. Величины содержания ароматических углеводородов и спиртов коррелируют с содержанием ОВ в донных отложениях озера (r = 0,890 и r = 0,819 соответственно). Среди продуктов брожения в донных отложениях обнаружены, мг/дм3: метанол – 0,108-3,347; бутанол – 0,004-0,042; изопропанол – 0,007-0,263; этилацетат – 0,0050,916; ацетальдегид – 0,015-0,091. Показано, что при широком диапазоне варьирования численности (0,1-85,0 тыс. КОЕ/мл), общей закономерностью пространственно-временного распределения гетеротрофных бактерий в воде исследуемой акватории является увеличение численности в озерной части эстуария по сравнению с водами реки и бухты. Значимые корреляционные связи между численностью углеводородокисляющих бактерий (УОБ) и содержанием УВ в воде отсутствовали. Загрязнение донных отложений УВ оказывает влияние на численность УВБ на фоне действия таких гидролого-гидрохимических факторов среды как температура воды, соленость, общее содержание ОВ. Положительная корреляция между численностью УВБ и общим содержанием УВ в ДО (r = 0,700) указывает на активно протекающие процессы трансформации природных и антропогенных УВ в ДО озерной части эстуария и подтверждает индикационные возможности данной группы бактерий в пределах обнаруженных концентраций УВ. 38 MICROBIOLOGICAL TRANSFORMATION OF ORGANIC MATTER IN SMALL ESTUARINT SYSTEM Garetova LA, Karetnikova EA Institute of Water and Ecology Problems FEB RAS, 680000, Kim Yu Chen 65, Khabarovsk, Russia e-mail: micro@ivep.as.khb.ru The interaction of sea and river water creates a biogeochemical barrier in coastal areas. In the small estuarine zones the concentration of dissolved and suspended substances, physical and chemical properties of water changes very rapidly and the intensity of biochemical processes in water and sediment is rather high. The aim of this work was to study the composition of bacterioplankton and bacteriobenthos communities, organic matter (OM), qualitative and quantitative composition of hydrocarbons (HC) in water and bottom sediments (BS), as well as physical and chemical parameters of water (temperature, salinity, pH, color , conductivity) in a small estuarine system of the river-lake-bay Toki (Tatarsky Strait) in summer-autumn of 20092010. It was shown that during a daily tidal cycle hydrological and hydrochemical parameters of water systems changed significantly and fluctuated in the same range as the seasonal variations. During one daily cycle salinity varied: in the mouth of the river from 0 to 0.97 ‰, in the middle of the lake from 0 to 31.24‰, in the bay from 10.46 to 31.04‰. Concentration of OM in estuarine water varied from 0.7 to 17.0 mg/l and content of hydrocarbon was from 0.8 to 10% of the total amount of OM. Maximal concentrations of OM and hydrocarbons were detected at the low tide irrespective of the seasons. The chromatographic analysis of saturated alkane fraction of water showed that it was a mixture of hydrocarbons from C11 to C25. Qualitative and quantitative composition of alkanes changed significantly during the tidal cycles and the CPI value consequently changed too. This coefficient varied in the range of 0.16-2.45. The content of phenols in water was 0-8.1 mg/l with the highest concentrations in the lake part of the system during the low tide phase. In the sediments of the lake part of the estuary concentration of OM ranged from 0.1 to 65.2 g/dm3 and that of hydrocarbons from 0.23 to 155 mg/dm 3. The n-alkanes C12-C14 dominated and reached 43.9% of total hydrocarbons in the bottom sediments in middle of the lake and 72.8% the river estuary accordingly. CPI values were 0.9-1.67 at the stations of the lake part of the estuary. Concentrations of aromatic hydrocarbons and alcohols correlated with OM in the sediments of the lake part (r = 0.890 and r = 0.819 respectively). The following compounds were found in sediment fermentation products (mg/dm 3): methanol – 0.108-3.347; butanol – 0.004-0.042; i-propanol – 0.007-0.263; ethylacetate – 0.005-0.916; acetaldehyde 0.015-0.091. The number of heterotrophic bacteria in water also varied in a wide range of 0.1-85.0 thousand CFU/ml. The general trend of spatial and temporal distribution of heterotrophic bacteria in water was increasing this value in the lake part compared to waters of the river and bay. Correlation between oil-oxidizing bacteria (OB) and the concentration of hydrocarbons in water was not revealed. Sediment contamination of HC affected OB under hydrological and hydrochemical factors such as water temperature, salinity, total OM concentration. Correlation between OB and concentration of hydrocarbons in sediments was positive (r = 0.700). This correlation coefficient confirms the role of OB as an indicator of oil contamination of sediments in the range of detected concentrations of hydrocarbons. ТОКСИЧНЫЕ ЦИАНОБАКТЕРИИ ОЗ. БАЙКАЛ И ВОДОЕМОВ БАЙКАЛЬСКОГО РЕГИОНА Гладких А.С., Белых О.И., Тихонова И.В., Сороковикова Е.Г., Потапов С.А. Лимнологический институт СО РАН, Улан-Баторская, 3, г. Иркутск, Россия, 664033 e-mail: gladkikh@lin.irk.ru 39 Цианобактерии являются неотъемлемым компонентом водных экосистем. Они продуцируют широкий круг вторичных метаболитов, среди которых ряд являются сильнодействующими токсинами для человека и животных. Наиболее опасными цианотоксинами являются микроцистины, вызывающие поражения печени и сакситоксины, обладающие нейропаралитическим действием. В последние годы, в связи с многочисленными случаями отравлении людей по всему миру, работы по выявлению токсичных и токсиногенных цианобактерий стали необходимой частью мониторинга водоемов. В первую очередь это касается хозяйственно важных водных объектов. Целью нашего исследования было изучение видового состава цианобактерий, поиск генов синтеза токсинов и иммуноферментный анализ проб из оз. Байкал, оз. Котокель и водохранилищах р. Ангара. Работа по выявлению токсичных цианобактерий в водоемах байкальского региона ведется с 2005 года. Ранее нами были определены токсичные виды в оз. Котокель, Братском и Усть-Илимском водохранилищах. В 2010 году пробы воды были отобраны по всей акватории оз. Байкал, а также в оз. Котокель и водохранилищах ангарского каскада. В пробах фитопланктона из оз. Байкал было выявлено 10 видов цианобактерий, 6 из которых являются потенциально токсичными. Пленки цветения, образованные в основном Anabaena lemmermannii, отмечались на поверхности воды в Чивыркуйском заливе, в прибрежных районах с. Турка и г. Северобайкальска. В оз. Котокель наблюдалось массовое цветение цианобактерий по всей акватории. Был получен положительный результат ПЦР анализа на наличия генов синтеза микроцистинов в пробах из Среднего Байкала: залив Куркут (Малое море), м. Тонкий, с. Турка, Баргузинский залив, а также Усть-Илимского водохранилище и оз. Котокель. В Южном Байкале крупные цианобактерии встречались единично, в Северном Байкале, несмотря на цветение, токсичные виды обнаружены не были. Большинство определенных в ходе работы нуклеотидных последовательностей гена микроцистин синтазы из оз. Байкал принадлежали представителям рода Anabaena. В оз. Котокель были определены последовательности цианобактерий родов Anabaena и Microcystis, содержащих гены синтеза микроцистинов. Одновременно был проведен поиск генов синтеза сакситоксинов, анализ давал положительный результат в пробах из Баргузинского залива, с. Турка, залива Куркут и УстьИлимском водохранилища. Полученные нуклеотидные последовательности имели высокую степень сходства (98-99%) с последовательностям родом Aphanizomenon и Anabaena, выделенными из токсичных цветений в Германии и Австралии. Методом иммуноферментного анализа были определены цианотоксины: микроцистины в оз. Котокель, Усть-Илимском водохранилище и в прибрежной зоне около с. Турка (озеро Байкал) и сакситоксины – в Усть-Илимском водохранилище, Баргузинском заливе, с. Турка и заливе Куркут (Малое Море). В оз. Байкал и Усть-Илимском водохранилище концентрации токсинов были низкими и не превышали ПДК, в то время как в оз. Котокель содержание токсинов в десятки раз превысило установленные нормы. Следует отметить, что за весь период мониторинга оз. Байкал на наличие генов синтеза микроцистина (2005-2010 гг.) положительный результат получен нами впервые. Работа выполнена при финансовой поддержке Гранта Президента РФ МК1239.2010.4. TOXIC CYANOBACTERIA OF LAKE BAIKAL AND WATER BODIES OF BAIKAL REGION 1 Gladkikh A.S.1, Belykh O.I.1, Tikhonova I.V.1, Sorokovikova E.G.1, Potapov S.A.1 Limnological Institute SB RAS, 3, Ulan-Batorskaya St., Irkutsk 664033, Russia, P.O. Box 278 e-mail: gladkikh@lin.irk.ru Cyanobacteria produce a wide range of secondary metabolites, among them several are potent toxins to human beings and animals. The most dangerous cyanotoxins are hepatotoxic 40 microcystins and neurotoxic saxitoxins. For the recent years, due to the numerous cases of poisoning of people throughout the world, identification of toxic and toxigenic cyanobacteria became an essential part of monitoring of water bodies. In particular this applies to economically important water bodies. The aim of our study was to investigate species composition of cyanobacteria, to search for genes of toxins synthesis and ELISA of samples from Lake Baikal, Lake Kotokel and reservoirs of the Angara River. Since 2005 toxic cyanobacteria have been identified in water bodies of the Baikal region. We have already identified toxic species in Lake Kotokel and in Bratsk and Ust-Ilimsk reservoirs. In 2010 water samples were collected across the water area of Lake Baikal, Lake Kotokel and reservoirs of Angara cascade. In the phytoplankton samples from Lake Baikal we found 10 species of cyanobacteria, 6 of which were potentially toxic. Films of bloom primarily with Anabaena lemmermannii were observed on the water surface in Chivyrkui Bay and in the coastal areas of Turka village and Severobaikalsk town. Massive blooms of cyanobacteria were observed over the entire area of Lake Kotokel. PCR analysis for the presence of microcystin synthase gene gave positive results in samples from the Central Baikal: Kurkut Bay (Maloye More), Cape Tonky, Turka, Barguzin Bay; Ust-Ilimsk reservoir and Lake Kotokel. In Southern Baikal, large cyanobacteria occurred sporadically. In Northrn Baikal, in spite of the bloom, toxic species were not found. Most of the identified nucleotide sequences of microcystin synthase gene from Lake Baikal belonged to the genus Anabaena, from Lake Kotokel – to genera Anabaena and Microcystis. Simultaneously, saxitoxin synthesis genes were identified in the samples from Lake Baikal (Barguzin Bay, Turka, Kurkut Bay) and Ust-Ilimsk reservoir. Nucleotide sequence had a high homology (98-99%) with sequences of genera Aphanizomenon and Anabaena, isolated from toxic blooms in Germany and Australia. Cyanotoxins were defined by ELISA: microcystins in Lake Kotokel, Ust-Ilimsk reservoir and in the coastal area of Turka village (Lake Baikal) and saxitoxins – in Ust-Ilimsk reservoir, Barguzin Bay, Turka and Kurkut Bay. In Lake Baikal and Ust-Ilimsk reservoir concentrations of toxins were low and did not exceed the WHO threshold, while in Lake Kotokel the content of toxins was tens of times higher than the standard norms. It should be noted that during the whole period of monitoring (2005-2010) microcystin synthase genes were identified in Lake Baikal for the first time. The work was supported by grant of the President of Russian Federation MK-1239.2010.4. РАЗНООБРАЗИЕ МИКРООРГАНИЗМОВ ЭПИБИОНТНЫХ СООБЩЕСТВ, АССОЦИИРОВАННЫХ С ГИДРОИДАМИ БЕЛОГО МОРЯ Горелова О.А., Баулина О.И., Косевич И.А., Лобакова Е.С. Биологический факультет Московского государственного университета имени М.В.Ломоносова, Москва, Ленинские горы, д.1, стр. 12, Россия e-mail: ogo439@mail.ru Колониальные гидроиды составляют значительную часть сообществ донных организмов в морях умеренных и высоких широт. Разветвленные побеги колоний, покрытые хитиноидным скелетом (перисарком), представляют собой биологический субстрат для сидячих организмов, в том числе, различных микроорганизмов, включая фототрофные. Сообщества эпибионтных микроорганизмов, ассоциированных с гидроидами морей высоких широт, в частности Белого моря, являются практически не изученными. В настоящем сообщении представлены данные морфологического исследования сообществ микроорганизмов, обитающих на поверхности гидроидов, различающихся по анатомо-морфологической организации (относимые к разным подклассам), собранных в сублиторали Кандалакшского залива в районе беломорской биостанции имени Н.А. Перцова (МГУ имени М.В. Ломоносова). Образцы исследовали методами сканирующей и просвечивающей электронной микроскопии. 41 Атекатные (Tubularia larynx, Coryne lovenii, Eudendrium ssp.) содержат эпибионтов, в основном, на побегах. Виды из разных семейств существенно отличаются по «насыщенности» эпибионтного оброста микроорганизмами. Выявляются: диатомеи рода Cocconeis и другие одноклеточные микроводоросли; нити клеток без чехла или с чехлом, идентифицируемые нами как трихомные цианобактерии; нитевидные ветвящиеся и неветвящиеся формы, предположительно, актиномицеты и/или трихомные бактерии; кокки, короткие и длинные палочки – морфотипы, характерные для прокариот. У T. larynx и Eudendrium ssp.дополнительно выявляются простекобактерии или стебельковые бактерии. C. lovenii принципиально выделяется среди всех гидроидов тем, что побеги заселяются лишь одиночными микроорганизмами, а на щупальцах гидрантов они формируют скопления. Наиболее сложная организация эпибионтного сообщества среди атекатных в виде биопленки, сформированной, преимущественно, палочковидными и коккоидными прокариотами присуща видам рода Eudendrium. Большинство из изученных нами 16-ти видов текатных гидроидов, часть из которых представлена в настоящем сообщении, характеризуются наличием плотного микробного оброста, который при его максимальном развитии покрывает в виде гетерогенной биопленки большую часть поверхности колоний. Наибольшее разнообразие структурной организации эпибионтного сообщества и составляющих его микробных морфотипов свойственно Dynamena pumila. Они включают все описанные выше у атекатных, а также нитчатки красных водорослей, палочки неправильной формы, образующие V- и Y- образные фигуры, часто в виде плоских розетковидных агрегатов (возможно коринебактерии) и извитые формы. Особенностью данного сообщества является формирование внедряющейся в перисарк биопленки, изобилие диатомей, главным образом, Cоссoneis scutellum и нитчатых форм цианобактерий. В отличие от D. pumila близкородственные виды Symplectoscyphus tricuspidatus, Sertularella gigantea и Sertularia mirabilis имеют менее плотное и обширное микробное покрытие побегов. По составу микроорганизмов в сообществах они различаются между собой. Так, простекобактерии выявляются только у двух последних видов, причем у S. gigantea простекобактерии c полярно расположенным нитеобразным выростом, длина которого может в десятки раз превышать длину клетки, выявляются в массовых количествах. У последнего вида и у S. mirabilis найдены палочковидные бактерии с множеством шишкообразных выступов. Нитчатки красных водорослей найдены только у S. mirabilis, а коринеформные бактерии - у S. mirabilis и у S. tricuspidatus. Obelia longissima является вторым видом, которому наряду с D. pumila, свойственно максимальное разнообразие микробных морфотипов, однако, без видимого доминированиями цианобактерий и диатомовых водорослей. У Gonothyraea loveni обрастание эпибионтами внешнего скелета ствола и боковых ветвей также подобно таковому у D. pumila. Однако в этом случае доминирующим среди фототрофных микроорганизмов является только диатомея C. scutellum, но не трихомные цианобактерии. Таким образом, использование морфологических критериев с привлечением данных ультраструктурной организации клеток и биопленок позволило обнаружить высокую степень разнообразия в составе сообщества про- и эукариотных микроорганизмов, включая фототрофов, живущих в тесных ассоциациях с гидроидами. В целом выявлено 10 видов диатомей, 3 морфотипа других микроводорослей, 6 морфотипов цианобактерий, 12 различных морфотипов других прокариот и 3 морфотипа простейших. Вместе с тем, различия по набору эпибионтных микроорганизмов, их обилию и характеру заселения поверхности животных свидетельствует о специфике формирования ассоциативных систем микроорганизмов с гидроидами разных видов в сходных условиях местообитания. Работа выполнена при поддержке РФФИ (09-04-00675). 42 DIVERSITY OF EPIBIOTIC MICROORGANISMS COMMUNITY ASSOCIATED WITH WHITE SEA HYDROIDS Gorelova O.A., Baulina O.I., Kosevich I.A., Lobakova E.S. Faculty of Biology, M.V. Lomonosov Moscow State University, Leninskie Gory, Bld. 1/12, Russia e-mail: ogo439@mail.ru Colonial hydroids constitute considerable part of benthic community in temperate and high latitude seas. Branched shoots of the colony covered with chitinous skeleton (perisarc) represent biological substrate for sessile organisms. Among them there are diverse microorganisms including phototrophic ones. Communities of epibiotic microorganisms associated with hydroids from high latitude seas remains obscure. The present study presents the results on morphological investigation of microorganism communities inhabiting the surface of colonial hydroids (from different subclasses) differing in anatomical and morphological organization, collected in the subtidal zone of Kandalaksha Bay in the vicinity of the N.A. Pertzov White Sea Biological Station MSU. The samples were studies with the help of scanning and transmission electron microscopy. Athecates (Tubularia larynx, Coryne lovenii, Eudendrium ssp.) have epibionts mostly upon their shoots. “Richness” of the microorganism epibiotic community distinguishes the hydroid species from different families. We discovered the diatoms belonging to g. Cocconeis and other unicellular microalgae; filaments of cells with and without the sheath identified as trichome cyanobacteria; filamentous branching and non-branching forms presumably the actinomycetes and /or trichome bacteria; coccus, short and long rods – morphotypes characteristic for prokaryotes. Prosthecobacteria and stalk bacteria found additionally on T. larynx and Eudendrium ssp. C. lovenii differs fundamentally among other hydroids in shoots inhabited only by solitary microorganisms forming in addition accumulations upon the hydranth tentacles. The most complex organisation of epibiotic community in the form of biofilm formed predominantly by stick-form and coccoid prokaryotes resides among athecates in the species of g. Eudendrium. The development of the dense microbial fouling community characterises most of the hydroid species of 16 examined thecates presented in part in the present essay. In the case of the advanced development, the microbial community covers most of the hydroid colony surface as heterogeneous biofilm. The greatest diversity of epibiotic community structural organization and included microbial morphotypes is peculiar to Dynamena pumila. They include all mentioned already for athecates plus filamentous red algae, rods of irregular shape forming V- and Y-shaped figures often in flat rosette-like aggregates (possibly the corynebacteria) and twisted forms. Distinctive features of that community are the development of the biofilm penetrating the perisarc, plenty of diatoms mostly Cоссoneis scutellum, and filamentous cyanobacteria. In contrast to D. pumila its relative species Symplectoscyphus tricuspidatus, Sertularella gigantea and Sertularia mirabilis have less dense and extensive microbial covering of the shoots. These hydroid species differ in the microorganism composition of the communities. Thus, the prosthecobacteria observed only in the latter two species. Moreover, prosthecobacteria discovered in mass upon S. gigantea, have polar filament in length ten times more than the cell dimensions. Stick-form bacteria with numerous cone-shaped protrusions observed upon S. gigantea and S. mirabilis. Studies revealed filamentous red algae only upon S. mirabilis and coryneform bacteria only upon S. mirabilis and S. tricuspidatus. Besides D. pumila, Obelia longissima is another species characterised by the highest diversity of microbial morphotypes but without obvious dominating of cyanobacteria and diatom algae. In Gonothyraea loveni the epibiotic fouling over the outer skeleton of the stem and branches is similar to D. pumila. In this case the diatom C. scutellum but not trichome cyanobacteria dominates among phototrophic microorganisms. Thus, usage of morphological criteria together with data on cells and biofilm ultrastructure allowed revealing the high level of diversity in pro- and eukaryotic microorganisms’ community composition including phototrophs tightly associates with hydroids. Overall, we distinguished 10 species of diatoms, 3 other microalgae morphotypes, 6 cyanobacteria morphotypes, 12 different 43 morphotypes of other prokaryotes and 3 protista morphotypes. At the same time differences in epibiotic microorganism composition, their abundance and the mode of the surface colonisation testify upon the specificity of the associated with hydroid species microorganism systems development in similar environments. The work was supported by RFBR, Grant # 09-04-00675. МИКРОБНЫЕ ПРОЦЕССЫ В РАЙОНЕ ЕСТЕСТВЕННЫХ НЕФТЕПРОЯВЛЕНИЙ ОЗЕРА БАЙКАЛ Дагурова О.П., Бурюхаев С.П., Намсараев Б.Б., Земская Т.И. Институт общей и экспериментальной биологии СО РАН, Сахьяновой, 6, Улан-Удэ, Россия e-mail: dagur-ol@mail.ru Цель исследования – выявить особенности протекания микробных процессов в донных осадках районов естественной разгрузки нефти. В колонках осадков, отобранных из районов, где отмечены естественные нефтепроявления (мыс Горевой Утес и мыс Толстый) определены интенсивности микробных процессов темновой ассимиляции углекислоты, сульфатредукции, метаногенеза и метанокисления. В донных осадках в районе м. Горевой утес темновая ассимиляция составляет 0,171,80 мкг С дм-3 сут-1, в районе м. Толстый этот показатель был выше и достигал 3,51 мкг С дм-3 сут-1. Микробное сообщество проявляло активность по всей длине изученных колонок осадка. Распределение процесса по глубине в осадках мыса Толстый характеризовалось более значительными колебаниями значений, чем в осадках Горевого утеса. Значения темновой ассимиляции углекислоты в районах нефтепроявлений были сопоставимы с величинами процесса в осадках из районов с дополнительной разгрузкой газов – грязевого вулкана Маленький и Кукуйского каньона. Сульфатредукция в местах нефтепроявлений характеризовалась величинами на уровне значений в фоновых районах, что обусловлено незначительным содержанием сульфатов в осадках. Локальные пики сульфатредукции наблюдались в глубинных слоях, обогащенных сульфатами. В Толстом процесс был немного активнее. Интенсивность автотрофного образования метана в исследуемых районах озера варьирует от 0,23 до 26,88 мкл СН4 дм-3 сут-1. Величины ацетокластического метаногенеза были ниже на 2-3 порядка и составляли 0,001-0,16 мкл СН4 дм-3 сут-1. В отдельных пробах зарегистрировано преобладание ацетокластического метаногенеза, что является нехарактерным для озера. Там же обнаружено и высокое содержание ацетата. Во всех слоях всех изученных колонок выявлена высокая потенциальная способность сообщества к осуществлению процесса окисления метана. Интенсивность окисления метана составляет 71,3-1757,3 мкл СН4 дм-3 сут-1. Максимальные значения наблюдаются в поверхностных слоях осадков. Следует отметить, что потребление метана в исследованных осадках было стабильно высоким по всей длине колонок, в отличие от осадков фоновых районов, где ниже 10 см метанокисление практически не регистрировалось. В районах нефтепроявлений максимальные значения метанокисления наибольшие для байкальских осадков (тысячи микролитров), что больше, чем в районах газопроявлений (сотни) и в фоновых районах (десятки). В изученных донных осадках до СО2 окислялось 27-88% потребленного метана, в биомассу клеток и внеклеточные метаболиты переходило 12-73% углерода метана. Доля углерода метана в клеточном материале и экзометаболитах в районах нефтепроявлений (среднее значение 43%) и газопроявлений (51%) больше, чем в фоновых районах (25%), что может свидетельствовать о благоприятных условиях для функционирования метанотрофного сообщества в районах нефте- и газопроявлений. Наибольшие значения содержания меченого углерода метана в биомассе и экзометаболитах приурочены к поверхностным горизонтам осадков. Таким образом, осадки из районов нефтепроявлений озера Байкал характеризуются фоновыми значениями интенсивности терминальных процессов анаэробной деструкции 44 органического вещества – сульфатредукции и метаногенеза, а также темновой ассимиляции углекислоты. При этом в осадках зафиксированы значительные величины окисления метана, намного превышающие метанокисление в других районах. Подобная картина может указывать на то, что в районах нефтепроявлений развивается своеобразное микробное сообщество, отличающееся от микробных сообществ фоновых районов, которое в основном использует метан, просачивающийся из глубинных слоев осадков вместе с углеводородами нефти. Данное метанотрофное сообщество характеризуется высокой активностью, как в поверхностных, так и в глубинных слоях осадков. Работа выполнена при поддержке Интеграционного проекта СО РАН 20.9. MICROBIAL PROCESSES IN THE REGION OF NATURAL OIL SEEPS OF BAYKAL LAKE Dagurova O.P., Buryukhaev S.P., Namsaraev B.B., Zemskaya T.I. Institute of General and Experimental Biology SB RAS, Sakhyanovoy St., 6, Ulan-Ude, Russia e-mail: dagur-ol@mail.ru Purpose of study is to reveal the special features of microbial processes in the bottom sediments of the regions of the natural unloading of oil. The intensity of microbial processes of the dark assimilation of carbonic acid dioxide, sulfate reduction, methane formation and methane oxidation are measured in the sediment columns selected from natural oil venting area (cape Gorevoy Utes and cape Tolstiy). The intensity of dark assimilation of CO2 in sediments of Gorevoy Utes was 0.17-1.80 mkg C dm -3 day -1. In the region of Tolstiy it was higher and reached to 3.51 mkg C dm -3 day -1. Microbial community was active throughout the entire length of the studied sediment columns. The depth distribution of process in the sediments of cape Tolstiy was characterized by the more significant fluctuations of values, than in the sediments of Gorevoy Utes. The values of the dark assimilation of carbonic acid dioxide in the regions of natural oil seeps were compared with the values of process in the sediments from the regions with the additional unloading of gases of mud volcano Malenki and Kukuyski canyon. Sulfate reduction in the sites of natural oil seeps was characterized by values at the level of values in the control sites, which is caused by the insignificant concentration of sulfates. The local peaks of sulfate reduction were observed in the deep, enriched by sulfates layers. The process was more active in Tolstiy. The intensity of the autotrophic methane formation in the regions varies from 0.23 to 26.88 mkl CH4 dm -3 day -1. The values of acetoclastic methane formation were 0.001-0.16 mkl CH4 dm -3 day -1 and were lower by 2-3 orders. In the some samples the uncharacteristic predominance of acetoclastic methane formation was registered. The high concentrations of acetate were measured in these samples. The high potential capability of microbial community for the methane oxidation was revealed in all layers of all studied columns. The intensity of the oxidation of methane is 71.31757.3 mkl CH4 dm-3 day -1. Maximal values in the surface layers of sediments are measured. It should be noted that the methane consumption in the investigated sediments was stable high throughout the entire length of columns, in contrast to the sediments of the control sites, where below 10 cm methane oxidation practically was not recorded. In the regions of natural oil seeps the maximal values of methane oxidation are greatest for the Baikal sediments (thousands of microliters), which is greater than in the regions of gas vents region (hundred microliters) and in control sites (ten microliters). 27-88% methane was oxidized to CO2, 12-73% methane was oxidized to biomass of cells and the extracellular metabolites. The part of methane carbon in the cellular material and extracellular metabolites was greater in the regions of natural oil seeps (average value 43%) and gas vents (51%). It is more than this part in control sites (25%). It may be testifying about the favorable conditions for the functioning of methanotrophic community in the regions of oil and gas vents. The greatest values of the concentration of the carbon tracer of methane in the biomass and extracellular metabolites were measured in the surface horizons of sediments. 45 Thus, sediments from the regions of natural oil seeps of Baikal Lake are characterized by the control values of the intensity of the terminal processes of the organic matter anaerobic destruction (sulfate reduction and methane formation) and also the dark assimilation of carbonic acid dioxide. In this case in the sediments are measured the significant magnitudes of the methane oxidation, which considerably exceed methane oxidation by other regions. A similar picture can indicate that in the regions of natural oil seeps the unique microbial community is developed, which is differed from the microbial communities of control sites. This community in essence uses methane, which is venting from the deep layers of sediments with the hydrocarbons of oil. This methanotrophic community is characterized by high activity both in the surface and in the deep layers of sediments. The work is supported by Integrated Project SB RAS 20.9. БАКТЕРИОФАГИ И БАКТЕРИОПЛАНКТОН УЛЬТРАОЛИГОТРОФНОГО ВЫСОКОГОРНОГО ОЗЕРА ХУБСУГУЛ Дрюккер В.В., Дутова Н.В., Ковадло А.С. Лимнологический институт СО РАН, 664033, г. Иркутск, ул. Улан-Баторская, 3, Россия e-mail: drucker@lin.irk.ru Озеро Хубсугул – высокогорное, ультраолиготрофное озеро тектонического происхождения, расположенное на севере Монголии на высоте 1645 м над уровнем моря. Оно является самым крупным озером в Монголии по запасам пресных вод – 383,3 км3, площадь его составляет 2760 км2, длина – 136 км, максимальная глубина – 262 м. Вода озера мало минерализована, сумма главных ионов составляет 210-230 мг/л, имеет слабощелочную реакцию – рН = 8,1–8,5, насыщена кислородом по всей толще – 8,10-11,43 мг/л. В настоящее время выраженного антропогенного влияния на озеро не оказывается, однако идет интенсивное рекреационное освоение его. Целью работы было изучение пространственного и вертикального распределения численности бактериопланктона, морфологического разнообразия, размерного спектра и численности бактериофагов на различных участках и глубинах озера Хубсугул методом трансмиссионной микроскопии (ТЭМ). Пробы воды были отобраны в период с 10 по 15 августа 2009 г. на 16-ти станциях, расположенных по всей акватории озера, от поверхности до глубины 203 м с катера «Ярославец». Определялась общая численность бактерий методом эпифлуоресцентной микроскопии (микроскоп “Olympus” TO41, Япония) с использованием красителя ДАФИ, количество гетеротрофных бактерий методом посева на рыбо-пептонный агар, разведенный 1:10. Для изучения бактериофагов методом ТЭМ пробы фиксировали формальдегидом, фильтровали через мембранный фильтр “Сынпор” №2 для удаления фитои зоопланктона, взвесей. Бактериофаги осаждали ультрацентрифугированием – бакет-ротор “Discovery-96 SE”, 100 000g (время 1,5 час.). Осадок ресуспендировали в объеме 1,5 мл, 20 мкл суспензии наносили на медные сетки, покрытые формвар-углеродной подложкой, высушивали и контрастировали 1% -ым раствором фосфовольфрамовой кислоты. Сетки просматривали на ТЭМ LEO-906E (Германия), напряжение 80 кВ, увеличение 35 000-70 000 раз. Из каждой пробы воды было приготовлено по две сетки, на которых учитывали бактериофаги в 200 полях зрения. Температура и прозрачность воды определялись общепринятыми методами. В период исследований температура поверхностного слоя воды на различных участках пелагиали озера составляла 10,9-12,7 С, в литорали – 13,9-14,0 С. С глубиной температура воды заметно снижалась: на 10 м она была 8,7 С, на 35 м – 4,3 С, а в слое 50203 м – 3,9-3,6 С. Прозрачность воды составляла на глубинных станциях 19,0-19,8 м, а в прибрежье – 12,5 м. Общая численность бактерий в воде озера Хубсугул варьировала от (1,7±0,78)·105 кл/мл до (1,2±0,24) ·106 кл/мл. Минимальные значения были отмечены в поверхностном слое воды, что не характерно для большинства водоемов, в то время как максимальные 46 наблюдались на глубине50-60 м. Количество гетеротрофных микроорганизмов в воде было повсеместно низким, что является также отличительной особенностью для Хубсугула (даже по сравнению с озером Байкал), и составляло в поверхностном слое 2-90 кл/мл, на глубинах 5-150 м – в пределах 5-20 кл/мл, несколько увеличиваясь в придонных слоях воды – 25-30 кл/мл. По степени развития летнего бактериопланктона оз. Хубсугул в настоящее время классифицируется как ультраолиготрофный водоем. Исследования бактериофагов Хубсугула впервые были начаты нами в 2004 г. в северной части озера. В 2009 г. общая численность фаговых частиц составила в поверхностном слое воды (0,09-0,11) ·106 мл-1 по всей акватории озера. Заметные различия в концентрации бактериофагов наблюдались в вертикальном распределении – максимальная численность отмечена на глубине 35 м – 0,26 · 106 мл-1. На других глубинах их количество было меньше в 1,5-3 раза, что сопоставимо с их концентрацией в озере Байкал. В размерной структуре бактериофагов преобладали частицы с диаметром капсида 3080 нм – 46-64%. Проведенное изучение морфологии автохтонных бактериофагов оз. Хубсугул показало их значительное разнообразие. Самыми распространенными фагами во всей толще воды, как и в Байкале, являются бактериофаги семейств Siphoviridae (В1, В2), Myoviridae (A1, A2), Podoviriade (C1) с различными формами и размерами хвостовых выростов, относящиеся к порядку Caudovirales. Численность самых распространенных хвостатых фагов в оз. Хубсугул достигает 70%, что согласуется с результатами исследований их в различных водных экосистемах мира. BACTERIOPHAGES AND BACTERIOPLANKTON FROM THE ULTRAOLIGOTROPHIC HIGH-MOUNTAIN KHOVSGOL LAKE Drucker V.V., Dutova N.V., Kovadlo A.S. Limnological Institute SB RAS, 3, Ulan-Batorskaya St., Irkutsk 664033, Russia e-mail: drucker@lin.irk.ru Lake Khovsgol is a high-mountain ultraoligotrophic lake of tectonic origin located in the north of Mongolia at 1645 m asl. It is the largest lake in Mongolia having large reserves of fresh waters – 383.3 km3. Its area is 2760 km2 with maximal depth 262 m and length 136 km. The lake water is low-mineralized – total amount of ions 210-230 mg/l and weak alkaline reaction – pH = 8.1-8.5. The lake is saturated with oxygen within the entire water column – 8.10-11.43 mg/g. At present, no significant anthropogenic effect on the lake has been recorded. However, intensive recreational exploration of the lake takes place. This work was aimed at studying spatial and vertical distribution of bacterioplankton abundance, morphological diversity, size spectrum and abundance of bacteriophages at different sites and depths of Lake Khovsgol using transmission electron microscopy (TEM). Water samples were collected from 16 sites located from the surface to 203 m around the water area from board the ship “Yaroslavets” on 10-15 August 2009. Total abundance of bacteria was estimated with epifluorescence microscopy (a microscope “Olympus” TO41, Japan) with DAPI staining, and abundance of heterotrophic bacteria were calculated from plating onto fish-peptone agar with 1:10 dilution. Samples for bacteriophage TEM analysis were fixed in formaldehyde, filtered through a membrane filter “Synpor” no. 2 for removal of phyto- and zooplankton and admixtures. Bacteriophages were settled by ultracentrifugation (a bucket-rotor “Discovery-96 SE”, 100000 g) for 1.5 h. The residue (1.5 ml) was resuspended, and 20 µl of the suspension was placed onto copper formvar coating grids, dried and contrasted with a 1% phosphotungstic acid. The grids were examined under a TEM LEO-906E (Germany) at 35,000-30,000x magnification. Two grids were prepared from each water sample and bacteriophages were counted on 200 fields. Temperature and transparency of water were determined with generally accepted methods. Temperature of surface water layer at different sites of the pelagic area varied between 10.9 and 12.7 ºC, in the littoral zone – 13.9 and 14.0 ºC. Water temperature decreased significantly with 47 depths: at 10 m it was 8.7 ºC, at 35 m – 4.3 ºC, whereas in the 50-203 m layer it was 3.9-3.6 ºC. Water transparency was 19.0-19.8 m at deep sites and 12.5 m in the coastal area. Total abundance of bacteria in the Lake Khovsgol water varied from (1.7±0.78) ·105 cell/ml to (1.2±0.24) ·106 cell/ml. Minimal values were recorded in the surface water layer which is not typical of the majority of water bodies, whereas maximal values were recorded at 50-60 m. Abundance of heterotrophic microorganisms in the water were ubiquitously low which is also a peculiar feature of Lake Khovsgol (even compared to Lake Baikal) making up 2-90 cell/ml in the surface layers and 5-20 cell/ml at 5-150 m increasing insignificantly in the near-bottom water layers – 25-30 cell/ml. At present, judging by the level of summer bacterioplankton development, Lake Khovsgol is classified as an ultraoligotrophic water body. Studies on bacteriophages from Lake Khovsgol were started by us in 2004 in the northern area of the lake. In 2009, total abundance of phage particles was (0.09-0.11) ·106 ml-1 in the surface layer around the entire water area of the lake. Significant differences in bacteriophage concentration were recorded in vertical distribution: maximal abundance was registered at 35 m – 0.26 · 106 ml-1, whereas at other depths their abundance was 1.5-3 times lower, which is consistent with their concentrations in Lake Baikal. Particles with capsid diameter of 30-80 nm dominated in the size structure of bacteriophages – 46-64%. Morphology of autochthonous bacteriophages was very diverse in Lake Khovsgol. Like in Lake Baikal, the most common phages within the entire water column were bacteriophages of the families Siphoviridae (В1, В2), Myoviridae (A1, A2), Podoviriade (C1) with different shapes and sizes of tails belonging to the order Caudovirales. Abundance of the most common tailed phages in Lake Khovsgol amounted to 70% which is consistent with the results of studies performed in different aquatic ecosystems of the world. ВЕРТИКАЛЬНОЕ РАСПРЕДЕЛЕНИЕ КАРОТИНОИДОВ В ДОННЫХ ОТЛОЖЕНИЯХ ОЗЕРА ШИРА КАК ИНДИКАТОР РЕЖИМА СТРАТИФИКАЦИИ ОЗЕРА В ПРОШЛОМ 1 Зыков В.В.,1 Рогозин Д.Ю.,1 Калугин И.А.,2 Дарьин А.В.2 Институт биофизики СО РАН, 2Институт геологии и минералогии им. Соболева СО РАН e-mail: zykovvv@yandex.ru Фототрофные сообщества озер оказывают большое влияние на состав их седиментационных отложений. Если на иловые отложения не влияют внешние условия, что и происходит в меромиктических водоемах, то они практически без искажений накапливаются из года в год, таким образом, по вертикальному распределению каротиноидов, как биомаркеров фототрофных микроорганизмов можно судить об эволюции, как водоема, так и фототрофных сообществ внутри озера. В июле 2009 года совместной экспедицией Института биофизики и Института геологии и минералогии им. Соболева СО РАН со дна в наиболее глубокой части озера Шира был взят керн донных отложений длиной около 1,4 метров. По длине керна чередовались характерные черные и светлые слои, химический анализ которых показал, что белые слои вызваны выпадением в осадок карбонатов, что наблюдается при понижении уровня озера. Что бы оценить влияние подобных изменений на фототрофные сообщества, из проб, взятых из белых и черных участков керна, были экстрагированы ископаемые каротиноиды. Их состав и концентрации определялись методом обратно-фазной высокоэффективной жидкостной хроматографии (ВЭЖХ) со спектрофотометрическим и масс-спектрометрическим детектированием (Agilent, США) в соответствии с базой данных on-line www.lipidbank.jp. В керне были обнаружены и количественно оценены аллоксантин (пигмент криптофитовых водорослей), лороксантин (зеленые водоросли), лютеин (зеленые водоросли и высшие растения), зеаксантин (цианобактерии, гетеротрофы), cis- и trans-окенон (пурпурные серные бактерии) и изоренирантин в следовых количествах (пигмент зеленых 48 серных бактерий на рисунках он не показан). Количество каротиноидов оценивалась по методике для измерения концентрации окенона, созданной на основе эталона полученного из чистой культуры штамма пурпурных серных бактерий Thiocapsa sp. Shira_1 (AJ633676 в EMBL/GenBank), выделенного из хемоклина озера Шира. С помощью полученных данных были построены профили вертикального распределения пигментов в донных отложениях. Наличие каротиноидов пурпурных серных бактерий в донных отложениях за последние более чем 2000 лет указывает на стратификацию озера в этот период, его неравномерное присутствие, в свою очередь, указывает на возможное изменение гидрологического режима озера и/или изменения характера освещенности хемоклина в прошлом. Так как эти факторы отражают влияние климатических изменений и уровня озера, то с используя их возможно будет произвести реконструкцию изменений климата в данной местности. Аналогичные вариации происходят и с другими каротиноидами. Для их объяснения требуется провести более тонкий анализ кернов, включающий в себя как изучение пигментного состава, так и прочих палеолимнологических факторов (панцири диатомовых водорослей, пыльца растений, хим. состав и пр.). С помощью этих данных можно будет реконструировать условия формирования экосистемы озера на протяжении сотен лет. Автор выражает благодарность Е.Г. Струковой за помощь при хроматографических анализах. Работа выполнена при поддержке РФФИ (проект № 09-04-01114), Междисциплинарного интеграционного проекта СО РАН № 95, Программы фундаментальных исследований Президиума РАН «Биологическое разнообразие» (проект № 15), ФЦП «Научные и научно-педагогические кадры инновационной России» (государственный контракт №14.740.11.0638 на 2009-2013 гг.) и совместного проекта СО РАН и Академии наук Тайваня (проект № 149). ANALYSIS OF THE VERTICAL DISTRIBUTION OF FOSSIL CAROTENOIDS IN BOTTOM SEDIMENTS OF SHIRA LAKE AS PROXY OF STRATIFICATION Zykov V.V.1, Rogozin D.Y.1, Kalugin I.A.2, Darin A.V.2 1 Institute of biophysics of SB of RAS, 2Institute of geology and mineralogy of SB of RAS e-mail: zykovvv@yandex.ru The communities of phototrophic organisms of Lakes give influence on content of their bottom sediments. If bottom sediments have not been affected by external conditions, as in meromictic lakes, sediments accumulate without distortion, so the vertical distribution of carotenoids, as indicator of phototropic activity, shows the evolution of lake conditions and photothrophic communities within lake. The 1.4 m –long sediment core from deepest part of Lake Shira was obtained in July 2009 by the joint team of Institute of Biophysics and Institute of Geology and Mineralogy of Siberian Branch of Russian Academy of Science. There are specific layers of different colors along the core, the chemical analysis of these layers reveal that “white” layers contain carbonates that settling-out during the decrease of the lake level. To evaluate the influence of such changes, white and black layers of the core were sub-sampled and analysed for carotenoids. The composition and concentrations of carotenoids were estimated by reversed-phase high-performance liquid chromatography with spectrophotometer and mass-spectrometry detection. The carotenoids were identified by spectral characteristics and molecular weights obtained from online database www.lipidbank.jp. In the core were found and evaluated several carotenoids: alloxanthin (marker of cryptophytes algae), loroxanthin (marker of green algae), lutein (marker of green algae and high plants), zeaxanthin (marker of cyanobacteriae), cis- and trans- okenone (marker of purple sulfur bacteria) and trace amount of Isorenieratene (marker of green sulfur bacteria). For quantitative 49 analyses we used the pure standard of okenone extracted from pure culture of Purple sulfur bacteria Thiocapsa sp. Shira_1 (AJ633676 в EMBL/GenBank) (isolated from Shira Lake) and purified by thin-layer chromatography. Presence of okenone indicates the meromixis of the lake Shira during past 2000 years. From the other hand, the variations of concentration probably indicate the variations of habitat conditions of purple sulphur bacteria, i.g. light availability and/or stability of meromixis. Both factors are affected by water level which is driven by climate. Therefore, the local climate variations can be reconstructed from bottom sediments of Lake Shira by pigment analyses in combination with other proxies (diatom, pollen, chemical analyses etc.). ПРОСТРАНСТВЕННАЯ СУКЦЕССИЯ МИКРООРГАНИЗМОВ БИОПЛЕНОК В ТЕХНИЧЕСКИХ СИСТЕМАХ ВОДООТВЕДЕНИЯ Кирилина Т.В., Сироткин А.С., Семенова Е.Н., Чан Т.Х. Казанский государственный технологический университет, 420015, г. Казань, ул. К. Маркса, 68, Российская Федерация e-mail: asirotkin@mail333.com В настоящее время перед сооружениями биологической очистки ставится задача глубокого удаления всех форм азотсодержащих веществ, что осуществляется в сложных многостадийных процессах, реализуемых в различных условиях. Вследствие неоднородности распределения концентраций кислорода и органического углерода в объеме биофильтра и в толще биопленки имеет место пространственное распределение (сукцессия) микроорганизмов. Микробный консорциум биопленки способен к изменению своей структуры в ответ на изменение условий культивирования. Изучение феномена пространственной сукцессии микроорганизмов и их активности является существенным для оптимизации процессов удаления соединений азота в процессе биофильтрации [1, 2]. Цель данных исследований состояла в выявлении зависимости эффективности комбинированного удаления соединений азота и углерода в процессе биофильтрации сточной воды, а также в выявлении пространственной сукцессии углеродокисляющих и азоттрансформирующих микроорганизмов и их активности в исследованном процессе очистки сточных вод. Материалы и методы исследований. Экспериментальные исследования проводились на базе лабораторного биофильтра, разделенного на несколько последовательных секций, оснащенных индивидуальными системами аэрации. В качестве загрузочного материала использовался керамзит, средний диаметр частиц которого составлял 10 мм. В ходе эксперимента значение гидравлического времени пребывания сточной воды в биофильтре составляло от 6 до 8 часов. Значения ХПК поступающей воды изменялись от 100 до 350 мг/дм3, БПК5 – от 70 до 250 мг/дм3. Инокулятом для процесса биофильтрации являлась сточная вода городских очистных сооружений. Пусковой период работы биофильтра составил около 20 суток, по завершении которого в биофильтр подавался модельный раствор сточной воды. Модельный раствор сточной воды для экспериментов подготавливался в соответствии с данными литературы [3]. Длительность процесса непрерывной биофильтрации сточных вод в ходе экспериментальных исследований составляла более 120 суток. Периодически отбирались пробы воды для анализа содержания органических веществ по показателям ХПК и БПК5, а также концентраций аммонийного азота, азота нитритов, нитратов. В экспериментах использовались стандартные методы определения вышеуказанных показателей. В ходе экспериментов проводился анализ респираторной активности микроорганизмов, накопления биомассы по сухому веществу, а также анализировался микробный состав консорциума по результатам флуоресцентной in-situ гибридизации (FISH/DAPI). 50 На основании экспериментальных данных показано, что в процессе очистки сточных вод в биофильтре наблюдается пространственное распределение автотрофных нитрифицирующих и гетеротрофных микроорганизмов. На входе в биофильтр биоценоз представлен главным образом гетеротрофными микроорганизмами, в средней части биофильтра – гетеротрофными и нитрифицирующими бактериями, на выходе – нитрифицирующими микроорганизмами. Оценка экспериментальных данных процесса очистки коммунально-бытового стока в секционированном биофильтре свидетельствует о высокой эффективности удаления соединений углерода, азота и фосфора. Эффективность очистки по ХПК (БПК) достигала 98 %, по аммонийному азоту до 99,9 %, по фосфатам - в среднем 50-55 %. По результатам анализа экспериментальных данных следует сделать вывод о перспективности процесса аэробной биофильтрации сточных вод; при этом в объеме загрузки аэрируемого биофильтра граничат аэробные, аноксические и анаэробные зоны, в которых является возможным протекание разнообразных процессов, в том числе нитрификации, денитрификации, а также анаэробного окисления аммония (ANAMMOXпроцесс). Данные, полученные в ходе FISH/DAPI – анализа микробных групп азоттрансформирующих микроорганизмов, свидетельствуют о развитии автотрофных нитрификаторов в аэробных зонах, гетеротрофных денитрификаторов, являющихся факультативными анаэробами, а также о присутствии в сообществе анаэробных ANAMMOX-бактерий. SPATIAL DISTRIBUTION OF BIOFILM MICROORGANISMS IN TECHNICAL SYSTEMS OF WASTEWATER TREATMENT Kirilina T.V., Sirotkin A.S., Semenova E.N, Chan T.H. Kazan state technological university 420015, Kazan, K. Marx st, 68, Russian Federation e-mail: asirotkin@mail333.com The research aims consisted in assessment of the carbon and nitrogen compounds removal in the process of biofiltration, detection of carbon oxidizing and nitrogen transformating bacteria’s spatial distribution and their activity in the studied process of waste water treatment. An estimation of domestic wastewater biofiltration in section biofilter showed an effective carbon, nitrogen and phosphor removal: COD (BOD) removal efficiency was 98 %, nitrogen of ammonium - up to 99,9 %, phosphate – on the average 50-55 %. Results of the experimental investigations confirmed a success of an aerobic wastewater biofiltration. In the volume of biofilter substrate there are aerobic, anoxic and anaerobic zones, providing opportunity of the different processes, including nitrification, denitrification and anaerobic ammonium oxidation (ANAMMOX process). Specific bacteria carring out these processes were identified by microscopic investigations (FISH/DAPI). ДЕНИТРИФИКАТОРЫ В РЕКЕ СЕЛЕНГЕ И ОЗЕРЕ БАЙКАЛ Ковадло А.С.,1 Дрюккер В.В., 1 Калмычков Г.В.2 1 Лимнологический институт СО РАН, Иркутск, Россия 2 Институт геохимии СО РАН, Иркутск, Россия e-mail: kovadlo@yandex.ru Нитратный азот является фактором эвтрофикации, а также делает воду непригодной для питьевых целей. Одним из способов удаления нитрата является денитрификация. Целью исследования было выявление денитрификаторов в природной системе река Селенга - озеро Байкал и изучение отдельных штаммов денитрифицирующих бактерий. Изучение этих микроорганизмов дает важную информацию о их распространении и позволяет оценить их потенциал для биоремедиации. Пробы для анализа отбирали в реке Селенге и зоне 51 смешивания вод реки Селенги в озере Байкал. Для выявления денитрификаторов был применен метод накопительных культур - использована среда с добавлением метанола в одном варианте и цитрата натрия – в другом. В результате проведенных исследований было выявлено, что в почти половине проб, отобранных с поверхности реки Селенги имеются микроорганизмы денитрификаторы, а в зоне смешивания– в 80 % проб. Из проб, взятых в зоне смешивания вод реки Селенги и озера Байкал, выделены метилотрофные бактерии рода Hyphomicrobium. Филогенетический анализ 16S рРНК выявил 97 % гомологию с типовым штаммом Hyphomicrobium denitrificans DSM 1869T. Газовой хроматографией выявлено, что на 94 % выделяемый Hyphomicrobium sp. газ состоит из N2. DENITRIFICATION IN THE FRESHWATER SELENGA RIVER – LAKE BAIKAL ECOSYSTEM Kovadlo A.S. 1, Drucker V.V. 1, Kalmychkov G.V. 2 Limnological Institute, Siberian Branch of the Russian Academy of Sciences, Irkutsk 2 Institute of Geochemistry, Siberian Branch of the Russian Academy of Sciences, Irkutsk e-mail: kovadlo@yandex.ru 1 Excess of nitrogen in surface waters causes eutrophication and health problems in humans. One of the ways to reduce nitrate load is to remove nitrate through denitrification. The aim of the present study was to reveal bacterial denitrification in the Selenga River-Lake Baikal system and to investigate strains of these bacteria. The study of denitrifying bacteria gives important information on distribution of these microorganisms and allows evaluating potential of isolated strains for remediation of nitrate contamination. Surface water samples were collected from the Selenga River and from the mixing zone of river and Lake Baikal waters in the Selenga River estuary. Approximately half of the chemical flow that enters the oligotrophic Lake Baikal comes from the Selenga River. Methods of enrichment and subsequent isolation of denitrifying bacteria were used. Methanol or sodium citrate was selected as a carbon source for denitrification. According to the method mentioned above, the nitrate reducing bacteria were found in half of the surface river samples. Methylotrophic bacteria of the genus Hyphomicrobium were isolated from the mixing zone of river and Lake Baikal waters. According to the analysis of 16Sr RNA gene, sequences of strain Hyphomicrobium had 97% similarity to the Hyphomicrobium denitrificans DSM 1869T. Gas chromatography revealed that 94% of the gas produced by this bacterium consisted of nitrogen. ВЛИЯНИЕ БАКТЕРИОФАГА НА БИОПЛЕНКУ УСЛОВНОПАТОГЕННОЙ БАКТЕРИИ PSEUDOMONAS AERUGINOSA Ковадло А.С., Дрюккер В.В., Огнева Н.В. Лимнологический институт СО РАН, Иркутск, Россия e-mail: kovadlo@yandex.ru Биопленки, образуемые бактериями, имеют повышенную устойчивость к антимикробным агентам благодаря ряду адаптационных механизмов, в частности, образованию непроницаемого матрикса. Pseudomonas aeruginosa широко распространена в природе и является опасным микроорганизмом для людей с ослабленным иммунитетом, являясь источником хронической инфекции с широким диапазоном устойчивости к антибиотикам. Целью работы было сравнительное наблюдение взаимодействия бактериофагов и биопленки Pseudomonas aeruginosa при различных условиях. Было выявлено, что важным фактором в подавлении развития биопленки является концентрация антимикробного агента: использование большего титра фаговых частиц 9х109 частиц (1 вариант) по сравнению с 8х105 частиц (2 вариант) сокращает концентрацию клеток в биопленке на 60% в первые сутки воздействия, тогда как более низкая концентрация неэффективна в данных условиях эксперимента. Клетки штамма Pseudomonas aeruginosa 52 PAO1, подверженные воздействию антимикробных агентов, вырабатывают к ним устойчивость: через сутки воздействия бактериофага на биопленку появляются бактериальные клетки, необратимо устойчивые к воздействию используемого вируса. Также появляются и антибиотикоустойчивые клетки после воздействия антибиотика, даже при концентрации в 100 раз превышающую концентрацию, рекомендуемую производителем препарата. Непродолжительное воздействие антимикробных агентов (фага, антибиотика) в течение суток в концентрации, не уничтожающей биопленку, значительно активизирует рост биопленки по сравнению с контролем. Наибольший бактерицидный эффект на биопленку Pseudomonas aeruginosa PAO1 в условиях эксперимента был получен при комбинированном воздействии бактериофага и антибиотика. Работа поддержана грантом РФФИ № 09-05-00725. EFFECT OF BACTERIOPHAGES ON THE BIOFILM OF AN OPPORTUNISTIC PATHOGENIC BACTERIA PSEUDOMONAS AERUGINOSA Kovadlo A.S., Drucker V.V., Ogneva N.V. Limnological Institute SB RAS, Irkutsk, Russia e-mail: kovadlo@yandex.ru Biofilms formed by bacteria possess elevated resistance to antimicrobial agents due a number of adaptive mechanisms, in particular, to the formation of impermeable matrix. Pseudomonas aeruginosa is widely spread in nature and is a dangerous microorganism for humans with weakened immunity being a source of chronic infection with a wide range of resistance to antibiotics. The aim of this work was to compare interaction of bacteriophages and biofilms of Pseudomonas aeruginosa under different conditions. It was revealed that the concentration of antimicrobial agent was a main factor in inhibition of biofilm development: the use of large titre of phage particles 9x109 (1 variant) compared to 8x105 particles (2 variant) reduces cell concentration in the biofilms by 60% during the first day of exposure, whereas lower concentration is ineffective under these conditions of the experiment. Strain cells of Pseudomonas aeruginosa PAO1 subjected to the effect of antimicrobial agents generate resistance to them: in a day after the effect of bacteriophages on the biofilms, bacterial cells appear which are irreversibly resistant to the impact of the virus used. Antibiotic resistant cells also appear after the influence of an antibiotic even if the concentration is 100 times higher than that recommended by the drug manufacturer. Short-term impact of antimicrobial agents (a phage, an antibiotic) during a day with the concentration which does not destroy the biofilms activates significantly the growth of biofilms compared to the control. The strongest bactericidal effect on the biofilms of Pseudomonas aeruginosa PAO1 under the experiment was recorded at the combination of the effect of bacteriophage and antibiotic. The work was supported by RFBR grant No. 09-05-00725. ОЦЕНКА МИКРОБНОГО РАЗНООБРАЗИЯ СУЛЬФАТРЕДУЦИРУЮЩЕГО СООБЩЕСТВА ДОННЫХ ОТЛОЖЕНИЙ СОДОВЫХ ОЗЕР ЗАБАЙКАЛЬЯ Козырева Л.П.1, Ананьина Л.Н.2, Захарюк А. Г.1, Плотникова Е.Г.2, Намсараев Б.Б.1 1 УРАН Институт общей и экспериментальной биологии Сибирского отделения РАН, 670047, г. Улан-Удэ, ул. Сахъяновой, 6, Россия; 2 УРАН Институт экологии и генетики микроорганизмов УрО РАН, 614081, г. Пермь, ул. Голева, 13, Россия e-mail: kozyreva@biol.bscnet.ru Сульфатредуцирующие бактерии играют ключевую роль на терминальных этапах анаэробной деструкции органического вещества (ОВ) в содовых и содово-соленых озерах, 53 расходуя в процессе сульфатредукции до 87 мг С/ кг в сут. В сообществе донных отложений они находятся в тесной кооперации с другими микроорганизмами, участвующими в деструкции ОВ. Таким образом, их можно рассматривать как сульфатредуцирующее сообщество. Целью данной работы являлась оценка разнообразия микробного сообщества накопительных культур, полученных с использованием проб донных осадков содовосоленых озер Забайкалья и поддерживаемых в восстановленных условиях в присутствии сульфата. Генeтическое разнообразие изучали методом денатурирующего градиентного гельэлекторофореза (ДГГЭ). Выделение геномной ДНК согласно Wilson K (1995) проводили из биомассы, полученной путем центрифугирования 16 мл накопительной культуры при 10000 об/мин в течение 15 мин. Амплификацию фрагмента гена 16S рРНК осуществляли с использованием прямого праймера 27F, включающего 40 п.н. GC-хвост на 5`-конце, и обратного праймера 518R в термоциклере My Cycler («Bio-Rad Laboratories», США) согласно Tiirola et al. (2002). Разделение ампликонов выполняли в 6% (в/об) полиакриламидном геле с линейным денатурирующим химическим градиентом от 40 до 60%, где 100% составляет 7М мочевина и 40% формамид, согласно протоколу (Muyzer et al., 1993). Электрофорез проводили в течение 16 часов при 45 V и температуре 60оС на приборе DcodeTM Universal Mutation System («Bio-Rad Laboratories», США). Полученные гели документировали с использованием системы Gel Doc XR («Bio-Rad Laboratories», США). Последующий нумерический анализ ДГГЭ-профилей осуществляли с помощью пакета программ TreeconW версия 1.3 (van der Peer, De Wachter, 1994). Филогенетическое разнообразие изучали секвенированием элюированых из полиакриламидного геля фрагментов гена 16S рРНК и последующим сравнением полученных нуклеотидных последовательностей с использованием пакета программ EzTaxon server 2.1 (Chun et al., 2007) c таковыми из публичных баз данных. Были проанализированы накопительные культуры (НК) из содовых озер, характеризующихся разной минерализацией (М), объединяемых в 2 группы – Алгинское, Хилганта (М до 50 г/л), Сульфатное, Соленое, Белое (М до 10 г/л). НК поддерживали на минеральной среде с сульфатом натрия и лактатом в качестве источника углерода и донора электронов (рН 8.5-10, М 15 г/л) в течение 3-4-х лет, за исключением НК оз. Белое (6 мес.). Все накопительные культуры перед анализом были перенесены на свежую среду и инкубировались в течение 2-х месяцев при температуре 30оС. Качественная оценка образования сероводорода показала наибольшую активность НК оз. Соленое. При микроскопировании во всех НК выявлены вибрионы и палочки разных размеров. Для изучения разнообразия микробного сообщества НК, полученных с использованием проб донных осадков содово-соленых озер Забайкалья и поддерживаемых в сульфатредуцирующих условиях, впервые был применен ПЦР-ДГГЭ метод, позволяющий оценить таксономическое разнообразие сообщества при условии, что количество полос на фореграмме соответствует числу таксонов бактерий (Muyzer et al., 1993). Анализ полученных данных выявил, что НК отличаются по количеству присутствующих в них таксонов. Так, в НК из оз. Алгинское и оз. Белое присутствуют представители двух таксонов, оз. Сульфатное - трех, оз. Соленое — четырех. Наибольшим разнообразием характеризовалась НК оз. Хилганта, в ней выявлены представители семи таксономических групп. Исследуемые НК отличались не только по количеству представленных в них таксонов, но и по составу. Так, в НК озер Алгинское, Белое и Сульфатное было выявлено по одному уникальному фрагменту 16S рДНК, которые не были обнаружены в других образцах, а в пробах озер Соленое и Хилганта таковых было выявлено два и пять, соответственно. Последующий сравнительный анализ элюированных из геля и секвенированных фрагментов 16S рДНК показал присутствие в сульфатредуцирующем сообществе исследуемых НК представителей классов Clostridia, Actinobacteria, Synergistia, Spirochaetes, Mollicutes, Epsilonproteobacteria. Кроме того, в исследуемых НК были выявлены бактерии 54 близкородственные факультативному сероредуктору Sulfurospirillum deleyianum DSM6946T (90%), а также строгому анаэробу, обладающему сахаралитической активностью, Anoxynatronum sibiricum Z-7981T (100%), выделенному ранее из оз. Нижнее Белое (Бурятия) (Schumache et al., 1992; Garnova et al., 2003). Необходимо отметить распространенность в сульфатредуцирующем сообществе озер Забайкалья бактерий близкородственных строго анаэробному протеолитику Proteiniclasticum ruminis D3RC-2T (96%), которые были выявлены в НК озер Сульфатное, Хилганта, Соленое и Белое. В то же время, в НК методом ПЦР-ДГГЭ не были выявлены сульфатредукторы, выделенные нами в культуру из проб озер Алгинское и Белое, показывающие 99% гомологии с известным алкалофильным сульфатредуктором Desulfonatronum lacustre Z-7951Т. Чистые культуры этих сульфатредукторов (штаммы B918-01 и Al915-01) были охарактеризованы и проведено их сравнение с типовым штаммом вида. Оба организма являются облигатно алкалофильными (рНопт 9.3), умеренно галофильными (NaClопт 4%) и мезофильными (Топт 36оС) вибрионами. В отличие от типового вида D. lacustre Z-7951Т используют более широкий ряд соединений в качестве доноров электронов: лактат, пируват, формиат, оксалат, фруктозу, метанол, но не используют этанол. Штамм Al915-01 способен также окислять ацетат. На водороде рост слабый. Установлено, что в качестве акцепторов электронов организмы используют сульфат, тиосульфат и сульфит, а Al915-01 также и нитрат. Рост без акцептора электронов не обнаружен. Содержание Г+Ц пар в ДНК составляет 58,2-58,3 мол. %. По результатам ДНК-ДНК гибридизации уровень гомологии между штаммами В918-01 и Al915-01 составляет 52%. Уровень гомологии культур с D. lacustre составляет 71% (В918-01) и 40% (Al915-01). Таким образом, мы предполагаем, что штамм B918-01 является новым представителем вида D. lacustre, а штамм Al915-01 - новым видом рода Desulfonatronum. Полученные нами результаты указывают на отличие таксономического состава сульфатредуцирующих бактерий исследуемых озер Забайкалья. Кроме того, выявлено таксономическое разнообразие членов сульфатредуцирующего сообщества, а низкий уровень сходства генов 16S рРНК с известными последовательностями свидетельствует о слабой изученности анаэробного бактериального сообщества донных осадков содово-соленых озер Забайкалья. Работа выполнена при поддержке гранта Российского фонда фундаментальных исследований № 10-04-01185-а. ASSESSMENT OF MICROBIAL DIVERSITY OF SULFATE-REDUCING COMMUNITY IN BOTTOM SEDIMENTS OF SODA LAKES OF TRANSBAIKAL REGION Kozyreva L.P.1, Anan’yna L.N.2, Zakharyuk A.G.1, Plotnikova E.G.2 1 Institute of General and Experimental Biology, Siberian Branch, RAS 670047, Ulan-Ude, 6, Sakhyanovoi str., Russia; 2 Institute of Ecology and Genetics of Microorganisms, UB, RAS 614081, Perm, 13, Golev str., Russia e-mail: kozyreva@biol.bscnet.ru Sulfate-reducing bacteria play a key role at the terminal stages of anaerobic destruction of organic matter (OM) in soda and soda-saline lakes, while spending up to 87 mg of C/kg a day in the process of sulfate reduction. In bottom sediment community these are found in close cooperation with other microorganisms being involved in OM destruction. Therefore, one could consider these as sulfate-reducing community. The aim of our work was the assessment of the diversity of microbial community in enrichment cultures that were obtained using bottom sediment samples from soda-saline lakes of Trans-Baikal region and that were maintained under reduced conditions in sulfate presence. Genetic diversity was investigated using the denaturing gradient gel electrophoresis 55 (DGGE). Isolation of genomic DNA from biomass obtained by centrifugation of 16 ml batch culture at 10000 rpm for 15 min was performed according to Wilson K (1995). The 16S rRNA fragment was amplified using the primer pair 27F(GC)/518R in termocycler My Cycler («Bio-Rad Laboratories», USA) according to Tiirola et al. (2002). Separation of amplicons was performed in 6% (w/v) polyacrylamide gel with a linear gradient of denaturants ranging from 40 to 60%, where 100% contained 7M urea and 40% formamide, according to the protocol (Muyzer et al., 1993). Electrophoresis was carried out at 45 V for 16 h at a constant temperature of 60ºC using the DcodeTM Universal Mutation System («Bio-Rad Laboratories», USA). Gel was documented using Gel Doc XR system («Bio-Rad Laboratories», USA). Subsequent numerical analysis of DGGE profiles was performed using the software package TreeconW version 1.3 (van der Peer, De Wachter, 1994). Phylogenetic diversity was studied by sequencing the eluted from polyacrylamide gel fragments of 16S rRNA gene and comparing the nucleotide sequences using the software package EzTaxon server 2.1 (Chun et al., 2007) with those from public databases. Enrichment cultures (ECs) from soda lakes have been analyzed that were characterized by differing mineralization (M) and combined in 2 groups – Alginskoye, Khilganta (M up to 50 g/l), Sulfatnoye, Solenoye, Beloye (M up to 10 g/l). ECs were maintained on a mineral medium with sodium sulfate and lactate as a source of carbon and electron donor (pH 8.5-10; M 15 g/l) for 3-4 years, except for Beloye Lake (6 mos.). Prior to analysis all of ECs were transferred to the fresh medium and incubated for 2 months at 30°C. Qualitative evaluation of H2S formation demonstrated the highest EC activity in Solenoye Lake. Morphological analysis of all ECs indicated the presence of vibrions and differently-sized rods. To study the diversity of microbial community in ECs derived from sediment samples of soda-saline lakes in Trans-Baikal region and supported by sulfate-reducing conditions, PCR-DGGE method was used for the first time to assess the taxonomic diversity of the community, provided that the number of bands corresponded to the number of bacterial taxa (Muyzer et al., 1993). Analysis of the data revealed that ECs differed in the number of presenting taxa. Thus, representatives of two taxa were observed in the ECs from the Lakes Alginskoye and Beloye, in the Lake Sulfatnoye - of three ones, and of four ones in the Lake Solenoye. The ECs from Lake Khilganta were characterized by the greatest diversity, and seven taxonomic groups were found therein. ECs under study differed not only in the number of taxa, but also in their composition. For example, one unique fragment of 16S rDNA being found in ECs from Lakes Alginskoye, Beloye and Sulfatnoye was not detected in other ECs, and there were two and five unique fragments in the samples of the Lakes Solenoye and Khilganta, respectively. Subsequent comparative analysis of the eluted from gel and sequenced fragments of 16S rDNA showed the presence of the representatives of classes Clostridia, Actinobacteria, Synergistia, Spirochaetes, Mollicutes, Epsilonproteobacteria in the sulfate-reducing community of ECs under study. Bacteria closely related to facultative sulfur-reducer Sulfurospirillum deleyianum DSM6946T (90%), as well as to strict anaerobe possessing saccharolytic activity, Anoxynatronum sibiricum Z7981T (100%), which was selected previously from the Lake Nizhnee Beloye (Buryatia) have been detected in ECs under study (Schumache et al., 1992; Garnova et al., 2003). It should be mentioned the prevalence in sulfate-reducing bacterial community of Trans-Baikalia Lakes of bacteria closely related to strictly proteolytic anaerobe Proteiniclasticum ruminis D3RC-2T (96%) that was identified in ECs from Lakes Sulfatnoye, Khilganta, Solenoye and Beloye. At the same time, sulfate reducers that we have isolated in culture from samples of Lakes Alginskoye and Beloye, showing 99% homology with the known alkalophilic sulfate-reducer Desulfonatronum lacustre Z-7951T were not revealed by PCR-DGGE in the ECs. Pure cultures of these sulfate reducers (strains B918-01 and Al915-01) were characterized and compared with the specific type strain. Both microorganisms were found to be obligately alkaliphilic (pHopt 9.3), moderately halophilic (NaClopt 4%) and mesophilic (Topt 36°C) vibrions. Unlike type species D. lacustre Z-7951T these use wider range of compounds as electron donors, such as lactate, pyruvate, formate, oxalate, fructose, methanol, and do not use ethanol. Strain A1915-01 is also capable of acetate oxidating. Growth on a hydrogen is weak. It was detected that 56 microorganisms used sulfate, thiosulfate and sulfite as electron acceptors; A1915-01 also used nitrate in this process. Growth without electron acceptors was not observed. G+C pairs in DNA comprise 58,2-58,3 mol.%. According to DNA-DNA hybridization the homology level between strains B918-01 and A1915-01 reached 52%. The homology level of cultures to D. lacustre amounted 71% (B918-01) and 40% (A1915-01). Therefore, we suggest that strain B918-01 is a novel representative of a species D. lacustre, and strain A1915-01 is a novel species of genus Desulfonatronum. Results obtained indicate the defference in taxonomic composition of sulfate-reducing bacteria of Trans-Baikal lakes under study. In addition, the taxonomic diversity of members of sulfate-reducing community is revealed, and the low level of 16S rRNA gene homology to known sequences evidences for poor investigation of anaerobic bacterial comminity of bottom sediments from soda-saline lakes of Trans-Baikal region. This work was conducted under the support of grant No. 10-04-01185-a from the Russian Foundation for Basic Research. МИКРООРГАНИЗМЫ-ДЕСТРУКТОРЫ ОРГАНИЧЕСКИХ ПОЛЛЮТАНТОВ РЕКИ ДНЕПР Коломиец Э.И., Алещенкова З.М. Институт микробиологии НАН Беларуси, 220141, г. Минск, ул. акад. Купревиыа,2, Беларусь e-mail: kolomiets@mbio.bas-net.by Среди городов Республики Беларусь наиболее широкий спектр загрязняющих веществ, по которым превышаются максимальные разовые ПДК их содержания в воздухе, отмечается в г. Могилеве. Он включает оксид углерода, диоксид азота, сероводород, фенол, аммиак, формальдегид. В воде реки Днепр, протекающей через Могилев, имеют место превышения ПДК различных веществ, обусловленные как антропогенными, так и природными причинами. Основные факторы, определяющие химический состав воды Днепра, - высокая плотность населения и густая сеть промышленных предприятий, среди которых крупнейшее - ОАО «Могилёвхимволокно». Производственные стоки предприятия смешиваются с коммунальными водами г. Могилева и проходят последовательную механическую обработку, биологическую очистку и доочистку в естественных условиях, после чего сбрасываются в реку Днепр. Вопрос о недопустимости сброса неочищенных сточных вод в Днепр стоит очень остро, так как река протекает по территории нескольких государств, и загрязнители могут мигрировать далеко от места поступления стока. Вместе с тем, в поверхностных водах имеют место превышения ПДК различных веществ, при этом основную долю составляют тяжелые металлы (цинк, медь, марганец, общее железо), соединения аммонийного и нитритного азота, фосфора, а также органические вещества. Методы интенсификации биологической очистки, основанные на совершенствовании структуры потоков, улучшении массообмена в сооружениях или закреплении биомассы ила в них, уже исчерпали себя и не приносят требуемого эффекта. Использование чистых культур микроорганизмов-деструкторов в технологии очистки воды является приоритетным направлением, а способ интродукции микроорганизмов-дестркторов в активный ил с целью адаптации его к высоким концентрациям токсических ингредиентов стоков оценивается как наиболее перспективный и эффективный. Среди 27 исследованных активных микроорганизмов-деструкторов п-ксилола, этиленгликоля, метанола, диметилтерефталата, содержащихся в сточных водах ОАО «Могилёвхимволокно» в качестве интродуцентов были использованы 2 культуры родококков видов erythropolis и opacus: Rhodococcus erythropolis 5Д и Rhodococcus opacus ДСС-31, проявившие деструктивную активность к более широкому спектру токсических органических веществ, таких как фенолы, моно и дихлорфенолы, нефть и продукты ее 57 переработки. Интродукция микроорганизмов-деструкторов в активный ил была осуществлена в аэротенках 2-ой и 3-ей очереди очистных сооружений г. Могилева. Изучение состава бактерий, выделенных из активного ила аэротенков, свидетельствует о том, что среди них доминируют представители родов Bacillus (37,5%), Rhodococcus (28,1%), Pseudomonas (18,7%), в среднем по 3% приходится на бактерии родов Arthrobacter, Micrococcus, Enterobacter. Результаты исследований показали способность интродуцированных штаммов микроорганизмов-деструкторов приживаться и стабилизировать свою численность в составе биоценоза активного ила, очищающего сточные воды химических производств г. Могилева, что дает возможность снизить токсическую нагрузку на микрофлору активного ила и интенсифицировать процесс очистки сточных вод. Анализ образцов воды реки Днепр, отобранных вниз по течению от рассеивающего спуска очищенных сточных вод, свидетельствует о присутствии микроорганизмов, способных использовать загрязняющие органические вещества в качестве источника углерода. В воде обнаружены бактерии родов Bacillus, Arthrobacter, Pseudomonas, Enterobacterium, Micrococcus и др. Среди выделенных бацилл были отобраны штаммы, мобилизующие фосфаты и штаммы антагонистов, которые были использованы в дальнейших исследованиях по повышению продуктивности и защите растений. MICROBIAL STRAINS-DEGRADERS OF ORGANIC POLLUTANTS FROM RIVER DNIEPER Kolomiets E. I., Aleschenkova Z.M. Institute of Microbiology Belarus National Academy of Sciences, Kuprevich str.2, 220141 Minsk, Belarus e-mail: kolomiets@mbio.bas-net.by Among cities of Belarus republic the widest range of pollutants exceeding maximal permissible concentrations (MRC) in air is recorded in Mogilev. The list includs carbon oxide, nitrogen dioxide, hydrogen sulphide, phenol, ammonia, formaldehyde. Water of river Dnieper flowing across Mogilev is saturated with various substances exceding MPC levels. This contamination is caused by both anthropogenic and natural reasons. Major factors defining chemical composition of Dnieper water are high density of population and branched network of industrial enterprises, with chemical fiber plant holding a dominant position. Production effluents mixed with municipal sewage are subjected to sequential mechanical treatment, biorecovery and natural remediation followed by discharge into river Dnieper. The problem of blocking access of polluted wastewaters into the Dnieper is extremely important since the river crosses the borders of several countries and the pollutants may migrate downward far from the source of contamination. Extra MPC levels of various substances are recorded in surface waters, where main contribution is made by heavy metals (zinc, copper, manganese, iron), compounds of ammonium and nitrite nitrogen, phosphorus, organic substances. Methods of intensifying biological decontamination based on perfection of flow structure, optimization of mass exchange in purification units or immobilization of activated sludge biomass were exhausted and now do not yield required effect. Application of pure cultures of microbial degraders in technologies of water purification is a priority trend and method of introducing microbial strains into activated sludge to adapt it to elevated concentrations of toxic sewage ingredients is estimated as most promising and efficient. Among 27 examined active microbial degraders of p-xylene, ethylenglycol, methanol, dimethylterephthalate inhabiting effluents of Mogilev chemical fiber plant 2 cultures were introduced into activated sludge- Rhodococcus erythropolis 5D and Rhodococcus opacus DCC31 displaying decomposing activity towards a broad spectrum of toxic organic pollutants, like phenols, mono- and dichlorphenols, oil and derived products. Introduction was carried out in aerated tanks of 2d and 3d lines of Mogilev municipal decontamination station. Studies on taxonomic affiliation of bacteria isolated from activated sludge of aerated tanks indicated the prevalence of genera Bacillus 58 (37.5%), Rhodococcus (28.1%), Pseudomonas (18.1%) with minor 3% shares contributed by bacteria Arthrobacter, Micrococcus, Enterobacter. Investigation results demonstrated ability of introduced microbial strains-degraders to adapt and stabilize population in biocenoses of activated sludge detoxifying wastewaters of Mogilev chemical industry, allowing to reduce toxic pressure on activated sludge microbiota and accelerate decontamination of effluents. Analysis of Dnieper water samples taken downstream from sewers dispersing decontaminated effluents detected microorganisms capable to utilize organic pollutants as a carbon source. Bacteria of genera Bacillus, Arthrobacter, Pseudomonas, Enterobacter, Micrococcus, etc. were identified. Isolated bacilli were screened for strains mobilizing phosphates and antagonistic strains used in further research to promote productivity and control diseases of cultivars. ВЛИЯНИЕ СОЛЕНОСТИ НА МИКРОБИОЛОГИЧЕСКУЮ ТРАНСФОРМАЦИЮ НАФТАЛИНА И ФЕНАНТРЕНА Кондратьева Л.М., Морозова О.Ю., Жукова О.В., Рапопорт В.Л. Институт водных и экологических проблем ДВО РАН, ул. Ким-Ю-Чена,65, Хабаровск 680000 Россия e-mail: kondrlm@rambler.ru В природных условиях трансформация и деструкция ароматических органических веществ различного строения и генезиса происходит при участии микроорганизмовдеструкторов. Роль микроорганизмов в самоочищении водных экосистем заключается в детоксикации моно- и полициклических ароматических углеводородов (ПАУ) и продуктов их трансформации. Чаще всего исследуется поэтапная биодеградация ароматических веществ отдельными видами микроорганизмов. Однако в природных условиях в трансформации и деструкции стойких углеводородов принимают участие микробные комплексы (консорциумы). Эффективность функционирования таких микробных ассоциаций зависит от их адаптационной способности к изменяющимся физико-химическим параметрам экологической ниши, гидрофобности субстрата и его молекулярной структуры. Наглядным примером изменения характера метаболизма в зависимости от параметров среды обитания могут служить микробные комплексы, способные к адгезии на взвешенных веществах, которые мигрируют вниз по течению реки и оседают на биогеохимическом барьере при смешении речных и морских вод. При выносе взвешенного материала в морские воды коренным образом изменяется весь набор абиотических факторов (температура, насыщенность кислородом, рН, соленость и др.), который способен вызвать структурные перестройки в микробоценозе и изменения его ферментативной активности. Для оценки влияния режима солености на качественный состав продуктов трансформации ПАУ нами были использованы быстро метаболизируемый бициклический нафталин и более стойкий к биодеградации из-за меньшей растворимости трехциклический фенантрен. В качестве деструкторов использовали планктонные и бентосные микробные комплексы (МК) с разных участков р. Амур. Идентификацию продуктов трансформации ПАУ проводили методами хроматомасс-спектрометрии на GCMS-QP 2010 «Shimadzu» и газовой хроматографии («Кристалл-5000.1» с пламенно ионизационным детектором). При моделировании процессов разложения ПАУ было отмечено, что изменение режима солености (с 1 % до 3 % NaCl) может оказывать разнообразное влияние на метаболизм микробных комплексов в зависимости от их местообитания. При повышении солености и в присутствии косубстрата пептона происходило образование биопленок, слизистого матрикса на частицах нафталина и интенсивное окрашивание водной среды цветными интермедиатами. Такими свойствами обладали бентосные микробоценозы, сформировавшиеся в условиях повышенного евтрофирования в зоне влияния крупных притоков. Адгезивная способность у планктонных микробных комплексов из 59 незагрязненных местообитаний не выявлена. Высокую активность на нафталине в присутствии пептона и 3% NaCl проявляли бентосные микробные комплексы с Нижнего Амура, где происходит седиментация взвешенных веществ. Максимальное количество летучих компонентов (47) было обнаружено в культуральной жидкости (КЖ) при соокислении нафталина и пептона бактериобентосом с Нижнего Амура, среди них доминировали бензол, толуол и о-ксилол. Минимальное количество летучих веществ (25) было идентифицировано в результате культивирования микробных комплексов на одном нафталине, независимо от их местообитания. В присутствии 3 % NaCl увеличивалось содержание метилированных производных бензола. Образование димителбензолов было характерно для бентосных сообществ независимо от их местообитания. При температуре 23оС и увеличении солености среди продуктов трансформации нафталина при участии бактериобентоса с Нижнего Амура были обнаружены бутанол (0,011 мг/дм3) и ацетальдегид (0, 034 мг/дм3). Изменение абиотических факторов среды обитания (солености и температуры), коренным образом влияло на механизмы трансформации фенантрена, не только используемого микроорганизмами в качестве единственного источника углерода, но и при соокислении с легко доступными органическими веществами. Показано, что фенантрен, находящийся в евтрофированных природных водах очень медленно разлагается даже при оптимальном температурном режиме (23оС). Среди продуктов трансформации в зависимости от условий культивирования присутствовал нафталин. Изменение режима солености, присутствие косубстрата приводило к накоплению в КЖ ацетальдегида в достаточно высоких концентрациях (0,027-0,032 мг/дм3), в ней также присутствовали разнообразные метилированные производные бензола. При участии в трансформации фенантрена бентосных МК был обнаружен бутилацетат. При повышенной солености трансформация фенантрена сопровождалась образованием довольно сложных соединений, в том числе нафто[1,2-с]фуран-1,3-дион и 3 бензилгексагидропиролло[1,2-а]пиразин-1,4-диона, токсичность которых для гидробионтов недостаточно изучена. При трансформации нафталина и фенантрена природными МК евтрофирование и повышение солености водной среды выступают ключевыми факторами, влияющими на образование метилированных и этилированных производных бензола. Учитывая субстратную специфичность ферментов принимающих участие в деструкции ПАУ, независимо от их происхождения можно наблюдать вторичное загрязнение прибрежных акваторий в зоне влияния речного стока. Работа выполнена при поддержке РАН, Программа 14, проект № 09-I-ОНЗ-04. SOLINITY EFFECT ON MICROBIOLOGICAL TRANSFORMATION OF NAPHTHALENE AND PHENANTHRENE Kondratyeva L.М., Morozova О.Yu., Zhukova О.V., Rapoport V.L. Institute of Water and Ecology Problems FEB RAS, 65, Kim Yu Chen st. Khabarovsk 680000 Russia e-mail: kondrlm@rambler.ru In natural environment microorganism-destructors take part in the transformation and destruction of aromatic organic matter of different structure and genesis. The role of microorganisms in water ecosystem self-purification is the detoxification of mono- and polycyclic aromatic hydrocarbons (PAH) and their transformation products. Most studies focus on the stage-by-stage biodegradation of aromatic compounds by different microorganisms. However, in natural environment microbial complexes (consortiums) take part in the transformation and destruction of stable compounds. Efficient functioning of such microbial associations depends on their capacity to adapt to changing physical and chemical parameters of the ecological niche, hydrophobic properties of the substrate and its molecular structure. 60 Microbial complexes, able to adhere to suspended matter that migrates down the river and sediments at the biogeochemical barrier due to river and sea water mixing, may serve a clear example that metabolism nature changes with environment parameters. The whole range of abiotic factors (temperature, oxygen saturation, pH, salinity, etc.), which can cause structural rearrangements in the microbiocenoses and its fermentation activity, change with suspended matter discharge into sea waters. Quick-metabolizing bicyclic naphthalene and less-soluble and thus more biodegradationresistant tricyclic phenanthrene were used to assess the impact of salinity fluctuations on quantitative composition of PAH transformation products. Plankton and benthos microbial complexes from different parts of the Amur River were applied as destructors. PAH transformation products were identified with chromato-mass-spectrometry (Shimadzu GCMSQP 2010) and gas-chromatography (Crystal-5000.1 gas chromatograph with a flame-ionization detector). PAH decomposition modeling revealed that salinity fluctuations (from 1% to 3% NaCl) may produce various effects on the metabolism of microbial complexes depending on their habitat. In case of increased salinity and peptone as a co-substrate biofilms (slime matrix) were formed on the naphthalene particles and intermediates intensively colored the water media. These qualities were common to benthos microbiocenoses from the impact zones of big tributaries, where eutrophication was increased. Plankton microbial complexes, which habitats were not contaminated, revealed no adhesive capacity. Benthos microbial complexes from the Lower Amur, where suspended matter sediments, were highly active on naphthalene with peptone and 3% NaCl. Maximal content of volatile components (47) was found in the culture liquid (CL), when naphthalene and peptone were co-oxidized with bacteriobenthos from the Lower Amur. The prevailing components were benzene, toluene and о-xylene. Minimal content of volatile components (25) was found when microbial complexes, irrespective of their habitat, grew on naphthalene only. In presence of 3% NaCl the amount of methylated benzene derivatives increased. Irrespective of their habitat all benthos communities produced dimethyl benzene. Butanol (0,011 mg/dm3) and acetaldehyde (0,034 mg/dm3) as naphthalene transformations products were registered in the experiment with bacteriobenthos from the Lower Amur, when the temperature was 23оС and salinity was increased. Changes of abiotic factors of bacteria living environment (salinity and temperature) significantly affected transformation mechanisms of phenanthrene, not only in case when phenanthrene was the only source of carbon for microorganisms, but also in case of cooxidation with easy accessible organic matter. Phenanthrene was proved to decompose in eutrophicated natural waters very slowly even at optimal temperature (23о С). Depending on cultivation conditions naphthalene could be found among transformation products. Salinity changes and co-substrate addition caused significant accumulation in the CL of acetaldehyde (0,027-0,032 mg/dm3) and formation of various methylated benzene derivatives. Butyl acetate was found in case of phenanthrene transformation with benthos microbial complexes. Phenanthrene transformation at increased salinity produced rather complex compounds, including naphtho[1,2-с]furane-1,3-dion and 3 benzene-hexa-hydro-pyrollo[1,2-а]pyrazine-1,4-dion, which toxicity has not been fully studied yet. Eutrophication and increased water salinity are key factors for naphthalene and phenanthrene transformations with microbial complexes that effect the formation of methylated and ethylated benzene derivatives. Allowing substrate specificity of enzymes that assist in PAH destruction irrespective of their origin, secondary pollution of coastal waters in the zones of river discharge impact may be observed. The studies were supported by the Program 14 of RAS, project № 09-I-ОНЗ-04. 61 МИКРОБИОЛОГИЧЕСКАЯ ТРАНСФОРМАЦИЯ ОРГАНИЧЕСКИХ ВЕЩЕСТВ НА БИОГЕОХИМИЧЕСКОМ БАРЬЕРЕ «ВОДА-ДНО» Кондратьева Л.М. Институт водных и экологических проблем ДВО РАН, ул. Ким-Ю-Чена,65, Хабаровск 680000 Россия e-mail: kondrlm@rambler.ru Донные отложения являются одной из важнейших депонирующих сред гидросферы. Наиболее активные биогеохимические процессы происходят в контактной зоне «вода–дно», в которых принимают участие структурированные бентосные микронные комплексы. Традиционный анализ численности и структуры бактериобентоса не дает полной информации о характере преобразования веществ в донных отложениях. Только в сочетании с экспериментальным исследованием физиолого-биохимической активности бентосных микроорганизмов по отношению к различным источникам углерода и азота можно выявить факторы и механизмы формирования качества воды и прогнозировать ее сезонные изменения. Исследования активности бентосных микробных комплексов в устьевых зонах крупных притоков р. Амур (реки Зея, Бурея и Сунгари) показали возможность их использования для оценки разнообразных природных и антропогенных воздействий на водные объекты. Масштабы воздействия можно зарегистрировать на локальном уровне на отдельных участках реки в результате сброса неочищенных сточных вод, аварийных ситуаций и региональном уровне вследствие преобразования ландшафтов в бассейнах главных притоков, например при строительстве гидротехнических сооружений. Активность микробиологической трансформации органических веществ на биогеохимическом барьере «вода–дно» отражает динамику разнонаправленных процессов самоочищения и вторичного загрязнения водных объектов. Она связана с сезонным евтрофированием, поступлением трудноминерализуемых соединений с территории водосбора во время паводков, их седиментацией в составе взвешенных веществ и дальнейшим перераспределением по руслу реки с влекомыми наносами. Особое место занимают исследования активности микробиологической трансформации стойких ароматических углеводородов природного и антропогенного происхождения. В результате экспериментальных микробиологических исследований с привлечением хроматографических медов было показано, что в контактной зоне «вода–дно» из нерастворимых полициклических ароматических углеводородов, в зависимости от температурного режима и адаптационного потенциала могут образовываться разнообразные производные бензола. При имитации зимнего режима качественный состав продуктов трансформации фенантрена бентосными микробоценозами с разных участков р. Амур существенно отличался. Так бактериобентос из местообитаний, расположенных выше устья р. Сунгари, оказался способным к образованию ацетона, метанола, толуола, м-ксилола. Ниже устья р. Сунгари на фоне хронического загрязнения р. Амур ароматическими углеводородами бентосные микробоценозы оказались более активными и осуществляли трансформацию фенантрена с интенсивным накоплением цветных интермедиатов. Среди продуктов метаболизма идентифицированы вторичный бутанол, изопропилбензол, толуол и о-ксилол, которые часто относят к категории веществ, содержащихся в промышленных сточных водах. Проведенные исследования показали, что в зимний период в водную среду из донных отложений загрязненных стойкими ароматическими углеводородами могут поступать водорастворимые токсичные вещества (метанол, бензол и его метилированные производные). процессы, происходящие в донных отложениях, Микробиологические сопровождаются не только всем известным метилированием токсичных элементов. Благодаря трансформации органических веществ, входящих в состав взвешенных веществ в зонах их аккумуляции изменяется миграционная способность и потенциальная токсичность 62 ионов тяжелых металлов. Так поступающие со стоками и высвобождающиеся в результате деструкции органических веществ ионы тяжелых металлов (ртуть, свинец, кадмий) могут оказывать негативное влияние на последующие процессы восстановления низкомолекулярных соединений. На первом этапе самоочищения водных экосистем при трансформации сложных комплексных соединений происходит высвобождение подвижных форм металлов, которые оказывают влияние на дальнейшие этапы деградации органических веществ. Конечные результаты этого процесса зависят от окислительно-восстановительных условий, адаптационной способности и устойчивости бактериобентоса к ионам тяжелых металлов. Исследование микробиологической активности в донных отложениях, формирующихся в зонах аккумуляции взвешенных веществ, позволяет прогнозировать локальные участки с повышенным содержанием восстановленных продуктов деструкции органических веществ. Так на основании изучения бактериобентоса в пробах донных отложений, отобранных по поперечному профилю р. Амур ниже промышленных центров Приамурья были выявлены зоны с высокой активностью сульфатредуцирующих и денитрифицирующих бактерий. В результате евтрофирования при низкой водности на этих участках реки можно прогнозировать формирование сероводородных зон и изменение рН. Исследование микробиологической трансформации органических веществ на биогеохимическом барьере «вода–дно» позволяет прогнозировать образование токсичных продуктов метаболизма микроорганизмов при нарушении процессов аммонификации, нитрификации, денитрификации и сульфатредукции. Работа выполнена при поддержке РАН, Программа 14, проект № 09-I-ОНЗ-04. MICROBIOLOGICAL TRANSFORMATION OF ORGANIC MATTER AT THE WATER – BOTTOM BIOGEOCHEMICAL BARRIER Kondratyeva L.M. Institute of Water and Ecology Problems FEB RAS, 65 Kim Yu Chen st., Khabarovsk 680000 Russia e-mail: kondrlm@rambler.ru Bottom sediments make one of the most important depositing areas of hydrosphere. Most active biogeochemical processes take place in the water – bottom contact zone, where structured complexes of benthos microorganisms play a significant role. Traditional analyses of bacteriobenthos number and structure do not provide full information on transformations of bottom sediment substances. Only additional experimental studies of physiological and biochemical activity of benthos microorganisms against various sources of carbon and nitrogen allow revealing factors and mechanisms of water quality formation and predicting water quality seasonal fluctuations. Studies of activities of benthos microbial complexes in the estuary zones of big Amur tributaries (the Zeya, Bureya and Sungari rivers) showed that these complexes may be used as indicators of various natural and anthropogenic effects on water objects. The scales of effects can be identified both at the local level as caused by untreated sewage leakage or other emergency situations and at the regional level as caused by landscape transformations due to hydrotechnical constructions. The degree of microbiological transformation of organic substances at the water – bottom biogeochemical barrier reflects the dynamics of differently directed processes: selfpurification and secondary pollution of water objects. Much depends on seasonal eutrophication, hard-mineralized compounds brought with flood waters from the drainage area, their sedimentation as components of suspended matter and further redistribution with the river flow. Special attention is given to the degree of microbiological transformation of stable aromatic hydrocarbons of natural and anthropogenic origin. Experimental microbiological studies with chromatographic methods showed that various benzene derivatives are formed from insoluble polycyclic aromatic hydrocarbons in the water – bottom contact zone depending on temperature and 63 bacteriobenthos adaptation potential. Winter regime modeling revealed that the qualitative compositions of products of phenanthrene transformation by microbial cenoses taken from various parts of the Amur River differed significantly. Bacteriobenthos, collected upper the Sungari River juncture, was capable to form acetone, methanol, toluol, м-xylol. Bacteriobenthos, collected in the Amur stretches lower the Sungari River juncture, chronically polluted with aromatic hydrocarbons, was more active and transformed phenanthrene with intensive accumulation of colored intermediates. Secondary butanol, isopropyl benzene, toluol, o-xylol were found among metabolism products. These substances are known to belong to the industrial waste water component group. Our studies showed that in winter water-soluble toxic substances (methanol, benzene and its methylated derivatives) can get into water from bottom sediments, polluted with stable aromatic hydrocarbons. Microbial processes in bottom sediments are not only coupled with well-known methylation of toxic elements. Due to transformation of organic substances contained in suspended matter in the zones of its accumulation the migration capacity and potential toxicity of heavy metal ions also change. Thus, ions of heavy metals (mercury, lead, cadmium), which are discharged with industrial wastes and are released during organic matter destruction, can negatively effect further processes of low-molecular compound restoration. At the first stage of water ecosystem self-purification the transformation of complex compounds causes the release of metal mobile forms, which effect further stages of organic matter degradation. Final results of this process depend on redox conditions, bacteriobenthos adaptation capacity and resistance to heavy metal ions. Studies of microbiological activities in bottom sediments, formed in the suspended matter accumulation zones, allow predicting localization of high concentrations of restored products of organic matter destruction. Studies of bacteriobenthos in bottom sediments, sampled across the Amur River lower the industrial cities identified zones, characterized with high activity of sulphatereducing and denitrifying bacteria. Under low water conditions eutrophication may cause the formation of hydrogen-sulphide zones and pH changes in these river stretches. Studies of microbiological transformations of organic matter at the water – bottom biogeochemical barrier allow predicting the formation of toxic products of microorganism metabolism, if processes of ammonification, nitrification, denitrification and sulfate-reduction are disturbed. The studies were supported by the Program 14 of RAS, project № 09-I-ОНЗ-04. ПРОСТРАНСТВЕННОЕ И ВРЕМЕННОЕ РАСПРЕДЕЛЕНИЕ ВИРИОПЛАНКТОНА В ВОДОХРАНИЛИЩАХ ВОЛГИ: РОЛЬ ВИРУСОВ В СМЕРТНОСТИ ГЕТЕРОТРОФНОГО БАКТЕРИОПЛАНКТОНА И ПИКОЦИАНОБАКТЕРИЙ Копылов А.И., Косолапов Д.Б., Заботкина Е.А., Стройнов Я.В. Институт биологии внутренних вод им. И.Д. Папанина РАН, 152742 Ярославская обл., пос. Борок, Россия e-mail: kopylov@ibiw.yaroslavl.ru Вирусы в водных экосистемах выполняют важные функции контроля численности, продукции и разнообразия бактерио- и фитопланктона, оказывают существенное влияние на биогеохимические циклы углерода и других элементов (Weinbauer, 2004). Цель работы состояла в оценке количества вириопланктона, роли бактериофагов и цианофагов в смертности прокариотных микроорганизмов в водохранилищах разного трофического статуса. Планктонные бактерии и вирусы учитывали методом эпифлуоресцентной микроскопии с использованием флуорохромов DAPI и SYBR Green (Porter, Feig, 1980; Noble, Fuhrman, 1998).Численность пикоцианобактерий определяли методом эпифлуоресцентной микроскопии по автофлуоресценции их клеток (Maclsaac, Stockner, 1993). Для расчета частоты инфицированных клеток и вирус-индуцированной смертности микроорганизмов использовали общепринятые методы (Binder, 1999; Suttle,2000). 64 В семи мезотрофных и эвтрофных водохранилищах Волго-Балтийского бассейна количество планктонных вирусных частиц находилось в пределах (9.4-120) × 106 частиц/мл и превышало количество гетеротрофных бактерий в 2.5-9 раз. На долю вирусов приходилось 0.2-1.0% (в среднем для всех водохранилищ 0.6%) общей биомассы планктона, время оборота его численности – 0.3-11.6 сут. Максимальные величины количества и продукции вирио- и бактериопланктона зарегистрированы в наиболее продуктивном Иваньковском водохранилище. Инфицированные клетки составляли 5.5-33.5% общей численности бактерий. В одной инфицированной клетке находилось до 403 фаговых частиц. В июлеавгусте вирус-индуцированная смертность гетеротрофных бактерий изменялась от 6.1 до 40.6% (в среднем 20.2%) суточной продукции бактериопланктона водохранилищ. Изучение сезонной динамики планктонных вирусов в Рыбинском водохранилище показало, что их численность была максимальной в июле-августе, а фаг-индуцированная смертность бактерий – а августе-сентябре. Пикоцианобактерии являются существенным компонентом летнего фитопланктона волжских водохранилищ. В Рыбинском, Шекснинском, Горьковском и Чебоксарском водохранилищах доля инфицированных клеток в их общей численности изменялась от 3 до 32%, а вирус-индуцированная смертность – от 5 до 67% суточной продукции пикоцианобактерий. Количество зрелых фаговых частиц в инфицированной клетке пикоцианобактерий достигало 305. Наиболее высокие величины обнаружены в наиболее продуктивных районах водохранилищ и участках, испытывающих загрязняющее влияние населенных пунктов. В процессе вирусного лизиса клеток гетеротрофных бактерий и пикоцианобактерий в водную толщу исследованных водохранилищ выделялось 43-213 (в среднем 108) мг С/(м2 × сут) органических веществ, что составляло 5-73% (в среднем 18.8%) интегральной первичной продукции планктона. Проведенное исследование показало, что планктонные вирусы являются постоянным и наиболее многочисленным компонентом планктонных сообществ водохранилищ, играющим важную роль в регулировании численности и продукции как гетеротрофного, так и автотрофного пикопланктона. SPATIAL AND TEMPORAL DISTRIBUTION OF VIRIOPLANKTON IN THE VOLGA RESERVOIRS: THE ROLE OF VIRUSES IN THE MORTALITY OF HETEROTROPHIC BACTERIOPLANKTON AND PICOCYANOBACTERIA Kopylov A.I., Kosolapov D.B., Zabotkina E.A., Stroinov Ya.V. Papanin Institute for Biology of Inland Waters RAS, 152742 Yaroslavl, Borok, Russia e-mail: Kopylov@ibiw.yaroslavl.ru In aquatic ecosystems viruses perform important functions of control over the number, productivity and biodiversity of bacterio- and phytoplankton, have a significant effect on biogeochemical cycles of carbon and other elements (Weinbauer, 2004). The purpose of this study is to assess the number of virioplankton, the role of bacteriophages and cyanophages in the mortality of prokaryotic microorganisms in reservoirs of different trophic status. Planktonic bacteria and viruses were counted by the epifluorescence microscopy method using DAPI and SYBR Green (Porter, Feig, 1980; Noble, Fuhrman, 1998) fluorochroms. The number of picocyanobacteria was determined using the method of epifluorescence microscopy by autofluorescence of their cells (Maclsaac, Stocker, 1993). Generally accepted methods (Binder, 1999; Suttle, 2000) were utilized to calculate the frequency of infected cells and virus-induced mortality of microorganisms. In seven mesotrophic and eutrophic reservoirs of the Volga-Baltic basin the number of planktonic viral particles ranged from 9.4 to 120 x 106 particles/ml and exceeded the number of heterotrophic bacteria 2.5-9 times. Viruses accounted for 0.2-1.0% (0.6% on average for all the 65 reservoirs) of the total plankton biomass and the turnover time of its number varied from 0.3 to 11.6 days. The maximum values of vireo- and bacterioplankton abundance and production were recorded in the most productive Ivan’kovo Reservoir. Infected cells amounted to 5.5-33.5% of the total number of bacteria. There were up to 403 phage particles per infected cell. In July-August virusinduced mortality of heterotrophic bacteria varied from 6.1 to 40.6% (29.2% on average) of the bacterioplankton daily production in the reservoirs. The study of seasonal dynamics of planktonic viruses in Rybinsk Reservoir showed that their number was maximal in July-August, and phageinduced mortality of bacteria – in August-September. Picocyanobacteria are an essential component of summer phytoplankton of Volga reservoirs. In Rybinsk, Sheksna, Gorky and Cheboksar Reservoirs the percentage of infected cells relative to their total number varied from 3 to 32% and virus-induced mortality – from 5 to 67% of the picocyanobacterial daily production. The number of mature phage particles per picocyanobacterium infected cell reached 305. The highest values were recorded in the most productive areas of the reservoirs and sites subject to pollution from human settlements. During the process of viral lysis of heterotrophic bacterial and picocyanobacterial cells, from 43 to 213 (108 on average) mg C/m2 day of organic matter was released in water masses of the investigated reservoirs that accounted for 5-73% (18.8% on average) of the integral primary production of phytoplankton. This study has shown that planktonic viruses are a permanent and most numerous component of the reservoirs’ planktonic communities that plays an important role in the regulation of both the heterotrophic and autotrophic picoplankton number and productivity. ПОЛУЧЕНИЕ И ИДЕНТИФИКАЦИЯ НАКОПИТЕЛЬНЫХ КУЛЬТУР СУЛЬФАТРЕДУЦИРУЮЩИХ БАКТЕРИЙ ИЗ ПОВЕРХНОСТНЫХ ВОД ЧЕРНОГО МОРЯ Корнеева В.А.1, Брюханов А.Л.1,2, Захарова Е.Е.2, Пименов Н.В.2 Биологический факультет Московского государственного университета им. М.В. Ломоносова, Ленинские горы, дом. 1, корп. 12, 119991 Москва, Россия, 2Учреждение Российской академии наук Институт микробиологии им. С.Н. Виноградского РАН, проспект 60-летия Октября, дом. 7, корп. 2, 117312 Москва, Россия. e-mail: busenica@yandex.ru, brjuchanov@mail.ru, npimenov@mail.ru 1 Черное море является крупнейшим меромиктическим водоемом на Земле, в анаэробных водах которого происходит накопление сероводорода, образующегося преимущественно в ходе жизнедеятельности сульфатредуцирующих бактерий (СРБ). Однако в серии биогеохимических работ было показано, что в поверхностных водах (аэробной зоне и зоне хемоклина) происходят процессы микробной трансформации окисленных и восстановленных соединений серы. Нами было выявлено присутствие в данных зонах СРБ родов Desulfotomaculum, Desulfovibrio, Desulfomicrobium и др. Несмотря на то, что в последние годы Черное море активно изучается, к настоящему времени в литературе пока нет данных о выделении чистых культур сульфатредукторов даже из анаэробных черноморских вод. Целью данной работы было получение активных накопительных и чистых культур СРБ из аэробных вод и зоны хемоклина Черного моря, а также идентификация микроорганизмов в полученных культурах с помощью молекулярно-биологических методов. Накопительные культуры получали на среде Видделя для морских форм сульфатредукторов из проб, отобранных в глубоководной зоне Черного моря в марте 2009 г. из аэробных вод (с глубин 30 и 70 м), зоны хемоклина (120 м) и анаэробных вод (165 м). Идентификацию микроорганизмов проводили с помощью флуоресцентной in situ гибридизации (FISH) с олигонуклеотидными зондами, специфичными к 16S рРНК основных 66 филогенетических групп СРБ, и молекулярного клонирования участка гена 16S рРНК с последующим рестрикционным анализом. Количество активных бактериальных клеток, идентифицируемых зондами EUB338 + EUB338 II, в накопительных культурах с глубин 30 и 70 м (аэробная зона), не превышало 39% от общей численности микроорганизмов, составлявшей 1,03 × 107 и 2,20 × 107 кл./мл, соответственно. С глубин 120 м (нижняя граница хемоклина) и 165 м (анаэробная H2Sсодержащая водная толща) получены более активные накопительные культуры СРБ, численность бактериальных клеток в которых составляла 63 и 67% от общего микробного числа, составлявшего 2,33 × 108 и 4,41 × 108 кл./мл, соответственно. В анаэробных накопительных культурах СРБ, выделенных из аэробной зоны (30 и 70 м) Черного моря, преобладали представители родов Desulfomicrobium (6,2% и 20% от общей численности активных бактериальных клеток, соответственно). Накопительные культуры СРБ, полученные из водных проб нижней границы хемоклина глубоководной части Черного моря, содержали СРБ родов Desulfovibrio (23%), Desulfotomaculum (7,6%) и Desulfomicrobium (до 4%). Представители рода Desulfobacter обнаружены не были. Полученные накопительные культуры СРБ из аэробной зоны Черного моря оказались менее активными, чем накопительные культуры из зоны хемоклина и анаэробных вод Черного моря. В связи с этим был проведен ряд экспериментов по подбору оптимального состава среды для получения активных накопительных культур из аэробной зоны. Активность оценивали визуально по количеству образуемого культурой сероводорода. В результате активные накопительные культуры были получены при добавлении в основную среду Видделя для морских форм сульфатредукторов тиосульфата, KI, солей Mn (II), Cr (VI) и Mo (VII), а также при замене стандартных органических компонентов среды (лактата и бутирата) на бензоат или ацетат. Необходимо отметить, что во всех случаях активное образование H2S отмечалось при культивировании накопительных культур с глубины 70 м, кроме эксперимента с добавлением тиосульфата, где сульфатредукция наблюдалась в накопительных культурах с глубины 30 м, и ацетата, где активными были обе культуры. Для выяснения точной филогенетической принадлежности микроорганизмов были выбраны (как наиболее активные) накопительные культуры, полученные при добавлении в основную среду солей Cr (VI) и Mn (II). В результате в накопительной культуре из аэробной зоны (70 м), полученной при добавлении Cr (VI), было выявлено наличие доминирующих сульфатредуцирующих микроорганизмов, наиболее близких к бактериям рода Desulfosporosinus (97% гомологии нуклеотидных последовательностей по методу BLAST), и гетеротрофных микроорганизмов наиболее близких к роду Vibrio (99% гомологии). В накопительной культуре с той же глубины, полученной на среде Видделя с добавлением Mn (II), было выявлено присутствие только одного сульфатредуктора, наиболее близкого по нуклеотидной последовательности гена 16S рРНК к представителям рода Desulfofrigus (98% гомологии). В дальнейшем планируется провести точное определение видовой принадлежности данной СРБ, а также изучение механизмов ее устойчивости к окислительным стрессам. Работа финансировалась за счет средств из гранта РФФИ 10-04-00220-а. OBTAINING AND IDENTIFICATION OF ENRICHMENT CULTURES OF SULFATE-REDUCING BACTERIA FROM THE BLACK SEA UPPER WATER COLUMN 1 Korneeva V.A.,1 Brioukhanov A.L.,1,2 Zakharova E.E.,2 Pimenov N.V.2 Faculty of Biology, Lomonosov Moscow State University, Leninskie Gory 1/12, 119991 Moscow, Russia, 2Winogradsky Institute of Microbiology, Russian Academy of Sciences, pr. 60-letiya Oktyabrya 7/2, 117312 Moscow, Russia. e-mail: busenica@yandex.ru, brjuchanov@mail.ru, npimenov@mail.ru 67 The Black Sea is the world’s largest meromictic basin. Its anaerobic waters contain fair quantity of hydrogen sulfide. It is known that sulfate-reducing bacteria (SRB) play a major role in sulfide production in the Black Sea. Later biogeochemical data indicated that sulfate reduction takes place not only in the anaerobic water column but also in the surface waters (aerobic zone and oxicanoxic interface). We have found the presence of SRB belonging to Desulfotomaculum, Desulfovibrio, Desulfomicrobium etc. in the upper water column of the Black Sea. However, none of the Black Sea sulfate-reducing microorganism species is identified and isolated in pure culture up to date. The goal of the present work was to obtain enrichment and pure cultures of SRB from the Black Sea upper water column, and to identify them using molecular biological approach. Widdel’s medium was used for cultivation of marine SRB enrichment cultures. The inoculums were obtained from water samples (30, 70, 120 and 165 m depths) collected in March 2009 in the central part of the Black Sea. The identification of microorganisms was performed using fluorescent in situ hybridization (FISH) with 16S rRNA specific oligonucleotide probes, molecular cloning with subsequent restriction analysis and sequencing. In enrichment cultures from the depths of 30 and 70 m, aerobic zone (1.03 × 107 and 2.20 × 7 10 cells ml-1, respectively), the number of active bacterial cells revealed with EUB338 + EUB338 II FISH-probes did not exceed 39% of the total microbial number (DAPI-stained cells). Enrichment cultures of SRB from 120 m (lower chemocline border) and 165 m (anoxic sulfide-containing waters) were more active and contained 2.33 × 108 and 4.41 × 108 cells ml-1 (63 and 67% of the total microbial number, respectively). The representatives of Desulfomicrobium predominated in enrichment cultures from 30 and 70 m (6.2% and 20% of bacterial cells detected by FISH, respectively). Enrichment cultures of SRB from 120 m depth contained Desulfovibrio (23% of bacterial cells detected by FISH), Desulfotomaculum (7.6%) and Desulfomicrobium (up to 4%). No Desulfobacter sp. cells were detected. Because enrichment cultures from the Black Sea aerobic waters were less active than cultures obtained from the oxic-anoxic interface (chemocline zone) and anaerobic waters, the selection of optimal medium composition was performed. It was shown that addition of thiosulfate, KI, Mn (II), Cr (VI), Mo (VII) salts as well as the replacement of lactate and butyrate to benzoate and acetate resulted in obtainment the active sulfate reducing enrichment cultures. Besides, the enrichment cultures from 70 m usually were more active than cultures from 30 m (apart from experiments with addition of thiosulfate and acetate). Enrichment cultures from 70 m depth obtained by addition of Cr (VI) and Mn (II) salts into Widdel’s medium were identified using molecular cloning, restriction analysis and sequencing. The predominated SRB belonging to Desulfosporosinus sp. (97% homology of the 16S rRNA nucleotide sequences) and the heterotrophic bacterium Vibrio sp. (99% homology) were found in the enrichment culture obtained by addition Cr (VI). Only Desulfofrigus sp. was found in the enrichment culture obtained by addition of Mn (II). We are going to focus on more exact identification of Desulfofrigus sp. and to study of its antioxidative defense mechanisms. The work was supported by the Russian Foundation for Basic Research (project no. 10-0400220-a). ЗНАЧЕНИЕ ГЕТЕРОТРОФНЫХ БАКТЕРИЙ В СТРУКТУРНОФУНКЦИОНАЛЬНОЙ ОРГАНИЗАЦИИ ПЛАНКТОННЫХ СООБЩЕСТВ ОЗЕР, РЕК И ВОДОХРАНИЛИЩ Косолапов Д.Б., Копылов А.И. Институт биологии внутренних вод им. И.Д. Папанина РАН 152742, пос. Борок Ярославской обл., Россия e-mail: dkos@ibiw.yaroslavl.ru 68 Гетеротрофные бактерии являются основным компонентом микробных пищевых сетей (микробной «петли»), выполняющим важнейшие функции в трофических взаимодействиях планктонных организмов и круговоротах биогенных элементов в водных экосистемах. Бактерии усваивают растворимые органические вещества, образуемые фитопланктоном и недоступные большинству других гидробионтов, и выедаются протистами, которые, в свою очередь, являются важными пищевыми объектами для многоклеточного зоопланктона. В процессе питания протозойного и метазойного планктона в водную толщу попадают соединения биогенных элементов, которые, тем самым, остаются в фотической зоне и усваиваются фитопланктоном. Согласно современным представлениям о функционировании водных экосистем, микробная «петля» является основным направлением, по которому осуществляются потоки вещества и энергии в планктонных пищевых сетях морей и озер (Azam et al., 1983; 1990). Цель работы – количественная оценка роли гетеротрофных бактерий в структурно-функциональной организации планктонных сообществ озер, рек и водохранилищ. В результате исследований озер европейской части России и центральной Азии, различающихся по уровню трофии и типу перемешивания, морфометрии и минерализации, было установлено, что доля гетеротрофных бактерий и простейших в суммарной биомассе планктона в летний период составляла от 12 до 65% (в среднем 32%). Вклад гетеротрофных микроорганизмов в формирование биомассы озерного планктона в большей степени зависел от уровня развития кладоцер (контроль «сверху»), чем от обеспеченности ресурсами (контроль «снизу»). Доминирующим компонентом микробных пищевых сетей был бактериопланктон, занимавший 69-96% (в среднем 81%) микробной биомассы. Установлена положительная корреляционная зависимость между биомассой бактерий и первичной продукцией фитопланктона. Гетеротрофные жгутиконосцы потребляли от 3 до 81% суточной бактериальной продукции и являлись в ряде исследованных озер основной причиной смертности бактерий. Кроме них важную роль в регулировании развития бактериопланктона играли инфузории и ветвистоусые ракообразные, а также бактериофаги. В реках структурно-функциональная организация планктонных микробных трофических сетей, главным компонентом являлись гетеротрофные бактерии, в значительной степени зависела от уровня развития ветвистоусых ракообразных и коловраток, что, в первую очередь, определялось скоростью течения воды, интенсивностью и характером загрязнений. В горных реках, а также на участках равнинных рек, находящихся в зоне влияния городов, микробная биомасса превышала биомассу фито- и зоопланктона. На относительно чистых участках равнинных рек, характеризующихся низкими скоростями течения воды и обильным развитием зоопланктона, вклад гетеротрофных бактерий в суммарную биомассу планктона составлял 11-56%. В этих экосистемах бактерии и питающиеся им простейшие активно участвовали в переносе углерода органических веществ, образуемых фитопланктоном и попадающих с водосбора, к метазойному планктону. В реках с высокими скоростями течения воды, а также испытывающих влияние городов, количество зоопланктона было низким, и доля бактерий в общей биомассе планктона возрастала до 60-82%. В воде этих рек основная часть углерода циркулировала в пределах микробной «петли»: РОВ – бактерии – простейшие. В реофильном протозоопланктоне доминировали гетеротрофные жгутиконосцы, которые потребляли в среднем в равнинных реках 30%, в загрязненных реках – 61%, а в горных реках – 28% суточной продукции бактериопланктона. В водохранилищах Верхней Волги доля гетеротрофных бактерий в биомассе планктонных сообществ в среднем за вегетационный период составляла 20-40%, и колебалась по сезонам в пределах 5-55%. В этих крупных равнинных водоемах бактерии выполняли важную функцию переноса вещества и энергии от автотрофных организмов к метазойному планктону. На разных участках водохранилищ в линейную трофическую цепь прямо или через промежуточное звено, каковым являются протисты, поступало от 22 до 46% бактериальной продукции. В зависимости от сезона главная роль в потреблении 69 бактериопланктона принадлежала гетеротрофным жгутиконосцам, инфузориям, кладоцерам или вирусам. Результаты исследования водных экосистем разного типа свидетельствуют об огромной роли гетеротрофного бактериопланктона в структурной организации и потоках углерода в планктонных трофических сетях. Относительное значение бактерий возрастает в олиготрофных экосистемах, а также в реках с быстрым течением воды и на участках водоемов и водотоков, загрязняемых промышленно-бытовыми сточными водами городов. Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований, грант № 10-04-01009-а. IMPORTANCE OF HETEROTROPHIC BACTERIA IN THE STRUCTURE AND FUNCTIONS OF PLANKTONIC COMMUNITIES IN LAKES, RIVERS AND RESERVOIRS Kosolapov D.B., Kopylov A.I. Institute for Biology of Inland Waters of RAS Borok, Yaroslavl, Russia e-mail: dkos@ibiw.yaroslavl.ru Heterotrophic bacteria are the main component of microbial food webs (microbial "loop"), carrying out the major functions in trophic interactions of planktonic organisms and cycles of carbon and other elements in aquatic ecosystems. Bacteria metabolize dissolved organic substances, produced by a phytoplankton and are inaccessible to the majority of other aquatic organisms, and are consumed by protists, which, in turn, are the important food objects for a metazoans. Nutrients produce during the protozoan and metazoan feeding and exude into the water column and, thus, remain in euphotic zone and can be assimilated by a phytoplankton. According to the modern view of the aquatic ecosystems functioning, microbial "loop" is the major direction on which matter and energy flow in marine and freshwater planktonic food webs (Azam et al., 1983; 1990). This work was aimed a quantitative estimation of a role of heterotrophic bacteria in the structural and functional organization of planktonic communities of lakes, rivers and reservoirs. As a result of researches of lakes of the European part of Russia and the Central Asia, differing on trophic status and mixing type, morphometric characteristics and salinity, it has been shown, that a portion of heterotrophic bacteria and protists in the total planktonic biomass during the summer ranged from 12 to 65% (average, 32%). The contribution of heterotrophic microorganisms into the lake plankton biomass in rather depended on the level of development of cladocerans (top-down control), than on the availability of resources (bottom-up control). Bacterioplankton was the dominant component of microbial food webs, occupied 69-96% (average, 81%) of microbial biomass. Positive correlation was established between the bacterial biomass and the primary phytoplankton production. Heterotrophic nanoflagellates consumed from 3 to 81% of daily bacterial production and were the main cause of bacterial mortality in a number of lakes. In addition, ciliates and cladocerans, as well as bacteriophages, control bacterioplankton. In the rivers the structural and functional organization of planktonic microbial food webs, the main component of which were heterotrophic bacteria, substantially depended on the level of cladocerans and rotifers development, that, in the first place, was defined by current velocity, intensity and pattern of pollution. The microbial biomass exceeded the biomass of phyto-and a zooplankton in the mountain rivers and also in the zones of the lowland rivers, which were impacted of the cities. The contribution of heterotrophic bacteria into the total plankton biomass ranged from 11 to 56% on the relatively pristine sites of the lowland rivers characterized by current velocity and abundant zooplankton. In these ecosystems bacteria and protists feeding them were active in the transfer of phytoplankton and terigenic organic carbon to metazoans. In the rivers with high current velocity and the zones of anthropogenic influences the zooplankton abundance was low, and the percentage of bacteria in the total plankton biomass increased up to 60-82%. In water column of these rivers the main part of carbon flows within microbial "loop": DOC – bacteria – 70 protists. Heterotrophic flagellates dominated among riverine protists and consumed on the average 30%, 61% and 28% of daily bacterial production in the lowland, polluted and mountain rivers correspondingly. In the Upper Volga reservoirs the average for the vegetation period portion of heterotrophic bacteria in the total planktonic biomass was between 20 and 40% and fluctuated from 5 to 55% during the period. In these large lowland reservoirs bacteria had an important function in the carbon flows from autotrophic organisms to metazoans. On different parts of the reservoirs from 22 to 46% of bacterial production entered to the linear food chain directly or through an intermediate link what were protists. Depending on the season the major role in the bacterioplankton consumption were belonged to heterotrophic flagellates, ciliates, cladocerans or phages. Results of researches of different aquatic ecosystems testify to a huge role of heterotrophic bacterioplankton in structure and carbon flows in planktonic food webs. Relative importance of bacteria increases in the oligotrophic environments, and in the rivers with a fast current velocity, as well as in the parts of bodies of water polluted by industrial and municipal sewage of the cities. This work was supported by the Russian Fund of Basic Researches under grant No. 10-0401009-а. ИСПОЛЬЗОВАНИЕ БАКТЕРИЙ РОДА ENTEROCOCCUS ДЛЯ КОНТРОЛЯ КАЧЕСТВА И ДЕЗИНФЕКЦИИ ВОДЫ Кравченко О.С., Парфенова В.В., Павлова О.Н., Суслова М.Ю. УРАН Лимнологический институт СО РАН, а/я 278, 664033, Иркутск, Россия e-mail: ok.c@mail.ru В соответствии с Директивой Совета Европейского Союза 80/778/ЕЕС от 15 июля 1980 г., при оценке качества воды, предназначенной для потребления человеком, в качестве индикаторных микроорганизмов следует определять не только E. coli, но и фекальные энтерококки (Фомин, 2002). Самым главным достоинством бактерий рода Enterococcus является их устойчивость к неблагоприятным внешним воздействиям. Эта устойчивость делает их особенно ценными санитарно-показательными микроорганизмами в случаях опасности загрязнения объектов энтеровирусами, возбудителями туберкулеза, устойчивых к нормативным обеззараживающим дозам активного хлора. При обнаружении в воде атипичных E. coli энтерококкометрия воды становится главным методом выявления фекального характера загрязнения. Нормативные документы РФ рекомендуют проведение энтерококкометрии при исследовании воды открытых водоемах, плавательных бассейнах с морской и пресной водой, но, к сожалению, проведение энтерококкометрии не является обязательной при исследовании питьевой воды (Мед. микробиология.., 1999). Цель данной работы – в лабораторных условиях на примере бактерий рода Enterococcus проверить традиционный способ дезинфекции воды методом хлорирования. Эксперименты были проведены в байкальской воде со штаммом Enterococcus faecium в присутствии и без питательного вещества. В колбы с байкальской водой объемом 100 мл вносили посевной материал (1,2х107) и различное количество гипохлорита кальция. Для определения количественного содержания и характера развития бактерий в колбах отбирали аликвоты воды по 1 мл, которые высевали на эскулиновый агар с азидом и канамицином и культивировали в течение суток при 37ºС. Проведенные нами эксперименты показали, что бактерии рода Enterococcus устойчивы к действию хлора, используемого для дезинфекции питьевой воды. На практике с целью уничтожения микроорганизмов хлор вводят с избытком из того расчета, чтобы через 30 минут после хлорирования воды содержание остаточного хлора было не менее 0,3 мг/л. В результате эксперимента установлено, что при концентрациях хлора равных 0,6 мг/л и 0,3 мг/л, клетки остаются жизнеспособными даже после 30 минутной обработки. В присутствии питательных веществ энтерококки показывают высокий уровень устойчивости не только при действии минимальных, но и максимальных концентраций дезинфицирующего вещества 71 даже через сутки. Дальнейшие исследования при помощи сканирующей и трансмиссионной микроскопии показали, что при наличии питания клетки бактерий рода Enterococcus не изменяют свою морфологию при воздействии на них ни минимальных, ни максимальных концентраций хлора. Таким образом, впервые выявлена на клеточном уровне и подтвержденная с помощью сканирующей и трансмиссионной микроскопии устойчивость бактерий рода Enterococcus в присутствии органических веществ к действию хлора. Эта устойчивость особенно нежелательна в аспекте загрязнения и самих водоемов, используемых для получения питьевой воды, и состояния водопроводных сетей. Результаты проведенных собственных исследований показали, что традиционные способы очистки и дезинфекции воды методом хлорирования неэффективны, и в использовании их нет никакого смысла, кроме того, отказ от метода обеззараживания воды путем двухступенчатого хлорирования позволит уменьшить отрицательное техногенное воздействие на окружающую среду и здоровье человека. Кроме того, на практике при проведении санитарно-микробиологической оценки качества воды, а также эффективности процессов ее очистки и обеззараживания просто необходимо проводить исследование на наличие бактерий рода Enterococcus. THE USE OF ENTEROCOCCUS BACTERIA FOR QUALITY CONTROL AND DISINFECTION OF WATER Kravchenko O.S., Parfenova .V., Pavlova O.N., Suslova M.Yu. Limnological Institute SB RAS, Irkutsk, Russia ok.c@mail.ru According to the Regulations of the EU Council 80/778EEC of July 15 1980, both E. coli and fecal Enterococci should be determined as indicator microorganisms (Fomin, 2002) to assess water quality consumed by humans. The main advantage of bacteria of the genus Enterococcus is their resistance to unfavourable stresses. This stability makes them especially valuable sanitaryrepresentative microorganisms in case of danger of pollution by enteroviruses, tuberculosis agents, resistant to regulatory aseptic doses of available chlorine. When atypical E. coli is detected in the water, enterococcometry of water is the main method for revealing fecal character of pollution. According to normative standards of the Russian Federation, it is recommended to perform enterococcometry of the water in open water bodies and swimming-pools with marine and fresh water. Unfortunately, enterococcometry is not an obligatory measure for analysis of drinking water (Med. Microbiology, 1999). This work was aimed at checking a conventional method of water disinfection under laboratory conditions on the example of Enterococcus bacteria using chlorination method. Experiments were performed with a strain Enterococcus faecium in the Baikal water with and without nutrients. Inoculation material (1.2x107) and different amounts of calcium hypochlorite were added to the vials with Baikal water (100 ml). An aliquot of 1 ml was collected for quantitative content of bacteria in vials and their growth, plated onto esculin agar with azide and kanamycin and cultivated at 37 °C for 24 h. These experiments showed that bacteria of the genus Enterococcus are resistant to chlorine used for disinfection of drinking water. In practice, chlorine is added in large amounts and in 30 min after chlorination the content of remaining chlorine is not less than 0.3 mg/l. As a result of the experiment, cells remain viable at chlorine concentration of 0.6 and 0.3 mg/l after the 30-min treatment. Enterococci demonstrate high level of resistance even in a day under the impact of both minimal and maximal concentrations of disinfectant. Further SEM and TEM investigations showed that cells of Enterococcus bacteria with nutrients do not change their morphology under the effect of minimal and maximal chlorine concentrations. Thus, resistance of the genus Enterococcus bacteria to chlorine at the presence of nutrients was for the first time revealed at the cell level and confirmed by means of scanning and transmission microscopy. This resistance is undesirable for water bodies the water of which is used 72 for drinking and for water-supply pipeline network. The results of the investigations showed that traditional methods of treatment and disinfection of water are ineffective, and there is no need to apply them. Moreover, the refusal to apply a two-stage chlorination method for water disinfection will allow the decrease of negative anthropogenic impact on the environment and human health. In addition, it is necessary to perform studies on the presence of the genus Enterococcus of bacteria to assess water quality and effectiveness of the processes of its treatment and disinfection. СРАВНЕНИЕ РЕГИОНАЛЬНОЙ СПЕЦИФИЧНОСТИ И ЛИТИЧЕСКОЙ АКТИВНОСТИ УМЕРЕННЫХ ФАГОВ PSEUDOMONAS AERUGINOSA Крылов В.Н., Кропински А., Плетенева Е.А., Буркальцева М.В., Шабурова О.В., Крылов С.В. 1 Научно-исследовательский институт вакцин и свороток им.И.И.Мечникова, РАМН 105064, Москва, Малый Казенный пер. 5а; 2 Department of Cellular & Molecular Biology, University of Guelph, Guelph, Ontario N1G 2W1, Canada e-mail: krylov.mech.inst@mail.ru Оценка доступного видового разнообразия природных вирулентных фагов, активных на бактериях вида Pseudomonas aeruginosa, одного из основных источников внутрибольничной инфекции, позволяет сделать вывод, что широкое применение фаготерапии с использованием известных в настоящему времени и достаточно изученных вирулентных фагов приведет к быстрому накоплению фагоустойчивых вариантов. Одним из возможных путей преодоления этого является вовлечение в фаготерапию новых, в том числе умеренных видов фагов. Это требует, во-первых, расширения районов поиска новых фагов, и во-вторых существенной модификации их генетической структуры. Прежде всего, умеренным фагам надо придать необратимую вирулентность, и, кроме того, устойчивость к развитию в присутствии часто встречающихся в клинических изолятах P.aeruginosa плазмид, обладающих способностью подавлять развитие фагов с использованием разных механизмов. В работе проведено сравнительное исследование группы умеренных фагов, как из коллекции лаборатории генетики бактериофагов, так и фагов, выделенных в озере Байкал и предоставленных для изучения сотрудником лаборатории молекулярной биоинженерии ГУ ИБХ РАН Сыкилинда Н.Н. COMPARISON OF REGIONAL SPECIFICITY AND LYTIC ACTIVITY OF TEMPERATE PHAGES OF PSEUDOMONAS AERUGINOSA 1 Krylov V.N., 2Kropinski A., 1Pleteneva E.A., 1Burkaltseva M.V., 1Shaburova O.V., 1 Krylov S.V. 1 II Mechnikov Research Institute of Vaccines & Sera, RAMS 105064, Moscow, Maly Kazenyi sidestreetl, 5a2; 2 Department of Cellular & Molecular Biology, University of Guelph, Guelph, Ontario N1G 2W1, Canada e-mail: krylov.mech.inst@mail.ru Evaluation of available species diversity of natural virulent phages, active on the bacterium Pseudomonas aeruginosa, a major source of nosocomial infection, suggests that the widespread use of phage therapy using known and studied so far virulent phages will lead to a rapid accumulation of phage-resistant variants. One possible way to overcome this is to include into phage treatment new species of temperate phages. This requires, firstly, the expansion of areas of search for new phages, and secondly a significant modification of their genetic structure of such temperate phages to introduce irreversible virulence, and in addition, the resistance to grow in the presence of commonly 73 encountered in clinical isolates of P.aeruginosa plasmids capable to suppress the development of phages with use of different mechanisms. We will report results of a comparative study of temperate phages, both from the collection of the Laboratory of Bacteriophage Genetics in I. I. Mechnikov Research Institute of vaccines and Sera and phages isolated in the Lake Baikal and provided for the study from the laboratory of Molecular Bioengineering Research Institute of Bioorganic Chemistry Sykilinda N.N. ОБЛИГАТНЫЙ ДЕСТРУКТОР ЭТИЛЕНДИАМИНТЕТРААЦЕТАТА БАКТЕРИАЛЬНЫЙ ШТАММ Chelativorans oligotrophicus LPM- 4 КАК ОСНОВА БИОСЕНСОРА ДЛЯ ОПРЕДЕЛЕНИЯ ПОЛЛЮТАНТА Кувичкина Т.Н., Капаруллина Е.Н., Доронина Н.В., Решетилов А.Н. Учреждение Российской академии наук Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН Пр. Науки 5. Пущино, Московская область, 142290 e-mail:kuv@ibpm.pushchino.ru Этилендиаминтетраацетат (ЭДТА) – хелатирующий агент группы аминополикарбоновых кислот. Благодаря способности образовывать стабильные водорастворимые комплексы (хелаты) с ионами двух- и трехвалентных металлов широко применяется в промышленных процессах для удаления ионов металлов. В 2000 г. суммарное производство ЭДТА достигло 200 000 тонн, при этом до 80% потребленного ЭДТА поступает в окружающую среду. В настоящее время ЭДТА считается одним из наиболее распространенных антропогенных загрязнителей в мире. Поэтому закономерен интерес исследователей к мониторингу ЭДТА в водной среде. Традиционными методами определения ЭДТА в стационарных лабораториях являются титриметрия и высокоэффективная жидкостная хроматография (ВЭЖХ), хотя они достаточно эффективны, но дороги. Поэтому имеет значение разработка альтернативных методов определения этого загрязнителя. Из городских очистных сооружений г. Пущино был выделен бактериальный штамм LPM-4 облигатный деструктор ЭДТА, обладающий специфической потребностью в ЭДТА как единственном источнике углерода, азота и энергии. Недавно он был отнесен к новому роду и виду Chelativorans oligotrophicus LPM-4 sp. nov. (типовой штамм LPM4T=BKMB2395T=ВКМВ2445=DSM19276T). Целью работы являлось создание модели биосенсора для определения ЭДТА и металл-ЭДТА комплексов на основе иммобилизованных клеток штамма Chelativorans oligotrophicus LPM-4 в качестве рецептора и электрода Кларка в качестве преобразователя. Бактериальный штамм выращивали в жидкой среде в колбах Эрленмейера на качалке. Биомассу (конец экспоненциальной фазы роста) отделяли, отмывали HEPES- буфером. Клетки бактерий иммобилизовали на стеклобумагу методом физической адсорбции. Подготовленный биорецепторный элемент фиксировали на поверхности кислородного электрода. Измерение проводили в HEPES-буфере, насыщенном кислородом, при 30-32°С с помощью потенциостата IPC-Micro ООО «Кронас» (Россия). Скорость потребленного кислорода определяли как скорость изменения тока электрода во времени в нА/мин, которая является удобной единицей измерения в биосенсорной практике. Показано, что биосенсор давал отклики при введении Mg-ЭДТА, N,N´этилендиаминдиацетата, иминодиацетата, глиоксилата, а также пировиноградной кислоты. Показано, что наиболее благоприятными условиями функционирования биосенсора являются HEPES-буфер со значением рН 7,4 и низкой ионной силой (30мМ). Были получены градуировочные зависимости отклика биосенсора от концентрации следующих десяти аналитов: ЭДТА, Ba ЭДТА, Mg-ЭДТА,Ca-ЭДТА, Mn-ЭДТА , Co ЭДТА, Cd-ЭДТА,Zn-ЭДТА, Ni-ЭДТА, Cu-ЭДТА. Длительность одного измерения не превышало 10 мин. Долговременная стабильность, определяемая как периодически измеряемый отклик сенсора при его непрерывном использовании и постоянном контакте с определяемым веществом, составила 4 недели. 74 OBLIGATE ETHYLENEDIAMINETETRAACETATE-DEGRADER BACTERIAL STRAIN Chelativorans oligotrophicus LPM–4 AS THE BASIS OF THE BIOSENSOR FOR POLLUTANT DETERMINATION T.N. Kuvichkina, E.N. Kaparullina, N.V. Doronina, A.N. Reshetilov Skryabin Institute of Biochemistry and Physiology of Microorganisms Russian Academy of Sciences pr. Nauki 5,Pushchino, Moscow oblast, 142290 e-mail:kuv@ibpm.pushchino.ru Ethylenediaminetetraacetate (EDTA) - the chelating agent of group aminopolycarboxylic acids. Due to ability to form stable water-soluble complexes (chelates) with di-and trivalent metal ions it is widely applied in industrial processes to removal of metal ions. In 2000 year total manufacture EDTA has reached 200 000 tons, thus to 80 % consumed EDTA arrives in environment. Now EDTA it is considered one of the most widespread anthropogenous pollutant in the world. Therefore interest of researchers to monitoring EDTA in the water environment is natural. Traditional methods of EDTA determination in stationary laboratories are titration analysis and high-performance liquid chromatography (HPLC), though they are effective enough, but roads. Working out of alternative methods of determination of it pollutant therefore matters. From city treatment facilities of Pushchino has been allocated bacterial strain LPM-4 EDTA obligate destructor, possessing specific requirement in EDTA as a unique source of carbon, nitrogen and energy. Recently it has been carried to a new genus and species Chelativorans oligotrophicus LPM4 sp. nov. (Typical strain LPM-4T=BKMB2395T=ВКМВ2445=DSM19276T). The purpose of the work was creation of a biosensor model for EDTA and metal- EDTA determination on a basis of strain Chelativorans oligotrophicus LPM-4 immobilized cells as a receptor with pO2 electrode as the transducer. Bacterial strain was cultivated in Erlenmeyer flasks with mineral medium containing EDTA as sole source of carbon nitrogen and energy on a shaker at 28°C. Cells grown to the exponential growth phase were harvested, washed with HEPES-buffer. Bacterial cells immobilized on chromatographic paper by physical adsorption method. Prepared receptor element was fixed at Clark-type electrode surface. Measurements were conducted in HEPES-buffer saturated with air at 30-32°С with potentiostate IPC-Micro "Cronas" (Russia). Oxygen consumption rate was determined as the rate of a change in electrode current in time, nanoamperes per minute, which is the usual conditional unit in biosensor practice. It is shown, that a biosensor gave responses at introduction Mg-EDTA, N, N ' ethylenediaminediacetate, iminodiacetate, glyoxylate, and also pyruvic acid. It is shown, that optimum conditions of biosensor functioning are the HEPES-buffer with value рН 7.4 and low ionic force (30 мМ). Dependences of the biosensor response on concentration following ten substances : EDTA, Ba-EDTA, Mg-EDTA, Ca-EDTA, Mn-EDTA, Co-EDTA, Cd-EDTA , ZnEDTA, Ni-EDTA, Cu EDTA have been received. Duration of one measurement was not exceeded by 10 minutes. The long-term stability defined as periodically measured response of sensor at its continuous use and constant contact to determined substance has made 4 weeks. МОЛЕКУЛЯРНЫЙ МЕХАНИЗМ СОКРАЩЕНИЯ ХВОСТОВЫХ ЧЕХЛОВ БАКТЕРИОФАГОВ СЕМЕЙСТВА MYOVIRIDAE Курочкина Л.П.1, Аксюк А.А.2, Россманн М.Г.2, Месянжинов В.В.1 Институт биоорганической химии им. академиков М.М.Шемякина и Ю.А.Овчинникова РАН, 117997 Москва, ул. Миклухо-Маклая, 16/10; 2 Университет Пурдью, Вест Лафайет, США e-mail: lpk@ibch.ru 1 75 Характерной особенностью бактериофагов семейства Myoviridae является наличие хвостового отростка, прикрепленного к одной из вершин капсида и обеспечивающего высокую инфекционность вирионов. Хвост фага – метастабильная структура, которая в процессе инфицирования подвергается структурной реорганизации, ведущей к необратимому сокращению чехла. Энергия сокращения чехла позволяет жесткому внутреннему стержню проникать через клеточную стенку и обеспечивает введение геномной ДНК в клетку хозяина. Сократимые чехлы фагов, своего рода молекулярные «мышцы» вирусов, представляют собой простейшие двигательные системы, состоящие из молекул одного типа. Цель настоящей работы – изучение структуры и свойств чехольных белков различных представителей семейства Myoviridae, а также выяснение молекулярного механизма сокращения хвостовых чехлов в процессе инфицирования. В качестве объектов исследования выбраны негомологичные чехольные белки бактериофагов: Т4 (172 kbp) E. coli, phiKZ (280 kbp) и SN (66 kbp) P. aeruginosa, имеющих общую морфологию хвостов, но существенно различающихся по длине хвостов и количеству субъединиц белка в чехле. Чехольные белки фагов phiKZ и SN были идентифицированы и охарактеризованы нами, их локализация на частицах вирионов была подтверждена с помощью иммуноэлектронной микроскопии. Характерной особенностью чехольных белков является их способность к самосборке в полимерные структуры как in vivo, так и in vitro. Рекомбинантные белки, продуцируемые клетками E. coli, формируют поличехлы нерегулярной длины, что затрудняет их кристаллизацию. Поэтому методами генной инженерии были получены укороченные с Сконца молекулы мутанты чехольных белков, которые утратили способность к полимеризации. С помощью ограниченного трипсинолиза этих мутантов были получены стабильные протеазоустойчивые фрагменты чехольных белков, которые удалось закристаллизовать. Впервые для вирусов семейства Myoviridae определены с атомным разрешением структуры фрагментов двух чехольных белков. Методом множественной аномальной дисперсии с разрешением 1.8 Å определена структура полученного нами ранее трипсинустойчивого фрагмента чехольного белка – продукта гена (пг) 18 – фага Т4, а затем на ее основе методом молекулярного замещения решена структура другого мутанта (примерно 3/4 молекулы) с разрешением 3.5 Å. Кристаллическая структура пг18 была встроена в ранее реконструированные на основе криоэлектронных изображений модели растянутого и сокращенного чехлов. Предложен механизм сокращения чехла фага Т4. Показано, что при сокращении чехла субъединицы пг18 перемещаются относительно друг друга без заметных изменений в их структуре. С разрешением 2.2 Å определена структура протеазоустойчивого фрагмента чехольного белка (пг29) фага phiKZ. Впервые проведен сравнительный анализ пространственных структур двух чехольных белков. Хотя эти белки не имеют гомологии на уровне аминокислотной последовательности, а элементы вторичной структуры у пг29 связаны между собой в порядке, отличном от пг18, выявлено сходство в топологии чехольных белков фагов phiKZ и Т4, что, по-видимому, обусловлено подобием выполняемых ими функций и указывает на общее эволюционное происхождение. MOLECULAR MECHANISM OF TAIL SHEATH CONTRACTION OF THE MYOVIRIDAE FAMILY BACTERIOPHAGES 1 Kurochkina L.P. 1, Aksyuk A.A. 2, Rossmann M.G. 2, Mesyanzhinov V.V. 1 Shemyakin-Ovchinnikov Institute of Bioorganic Chemistry RAS, ul. Miklukho-Maklaya 16/10, 117997 Moscow, Russia; 2 Purdue University, 915 West State Street, West Lafayette, IN 47907-2054, USA e-mail: lpk@ibch.ru Bacteriophages of Myoviridae family are characterized by specialized organelle attached to capsid vertex and called a contracted tail that facilitates high viral infection efficiency. During 76 infection the phage tail is subjected to the conformational rearrangement resulting in irreversible sheath contraction. The rigid internal tube penetrates through a cellular wall and provides DNA injection into the host cell. Phage contracted sheath, molecular "muscle" of virus, is simple biological mechanical device consisting of one type molecules. In the present investigation, the structure and properties of tail sheath proteins and molecular mechanism of tail sheath contraction during infection of Myoviridae bacteriophages have been studied. Nonhomologous tail sheath proteins of phages T4 (172 kbp) E. coli, phiKZ (280 kbp) and SN (66 kbp) Ps. aeruginosa with general tail morphology, but different genome size, tail length and number of protein subunits in the sheath, were studied. Tail sheath proteins of bacteriophages phiKZ and SN were identified and characterized by us for the first time. Localization of sheath proteins on virion particles was confirmed by immunoelectron microscopy. Tail sheath proteins self-assemble into polymeric structures both in vivo and in vitro. Recombinant proteins produced by E. coli cells form polysheaths of variable lengths, which makes crystallization difficult. Therefore, C-terminal deletion mutants that lack polymerization properties were constructed by genetic engineering. Using limited trypsinolysis of these mutants, the stable protease-resistant fragments of sheath proteins were obtained and crystallized. Crystal structures of two sheath protein fragments for Myoviridae viruses were solved for the first time. The structure of gp18 trypsin-resistant fragment of phage T4, earlier obtained, was determined with the multiple anomalous dispersion method, refined to 1.8 Å resolution, and subsequently used as a molecular replacement model to solve the structure of the bigger mutant (about 3/4 of molecule) to 3.5 Å resolution. The crystal structure was fitted into cryo-EM reconstructions of the tail sheath before and after contraction. Mechanism of T4 tail sheath contraction was suggested. It was shown that during contraction, gp18 subunits slide over each other with no apparent change in their structure. The crystal structure of protease-resistant fragment of phiKZ sheath protein, gp29, was solved to 2.2 Å resolution. Comparative analysis of spatial structures of two tail sheath proteins was carried out. The protease-resistant fragments have similar topology, although these proteins have no homology at the level of amino acid sequence, and second structure elements in gp29 molecule have different arrangement in comparison with those of gp18. Probably, genes encoded proteins performing similar functions formed as a result of divergence homologous genes during evolution. РОЛЬ МИКРООРГАНИЗМОВ В ОЧИСТКЕ ПРОМЫШЛЕННЫХ И СЕЛЬСКОХОЗЯЙСТВЕННЫХ СТОКОВ Кутлиев Дж., Мавлянова М.И, Уринова А.А. Институт микробиологии АН РУз, 100128, ул. А. Кадыри 7б, г. Ташкент, Узбекистан e-mail: kutliyev@rambler.ru Охрана окружающей среды становится важнейшей государственной задачей. Очистка почвы, водоемов от вредных и токсичных соединений возможна при интенсивном внедрении в практику достижений экологической биотехнологии-области науки и практики, основанной на использовании активной микробной биомассы в целях защиты окружающей среды. Прогресс экологической биотехнологии в решающей степени зависит от формирования и постоянного пополнения фонда культур микроорганизмов, обладающих способностью разлагать и утилизировать вредные и токсические соединения, ксенобиотики, отходы промышленности и сельского хозяйства. Цель работы – изучение роли микроорганизмов и разработка биотехнологии удаления из сточных вод загрязнителей с помощью микроорганизмов-деструкторов, гидробионтов, высших водных растений. В работе использовали классические методы, используемые в микробиологии. Культуры углеводородокисляющие бактерий выращивали на среде Раймонда. Сапрофиты на РПА. 77 Промышленные стоки содержат две группы загрязнителей: чужеродные органические соединения ксенобиотики и ионы тяжелых металлов. В основе микробиологической очистки от ксенобиотиков лежит отбор и селекция микроорганизмов-деструкторов с иммобилизацией их на инертном носителе. Тяжелые металлы удаляются из растворов путем адсорбции на микробной биомассе. Освобождение воды от нефтегазовых загрязнений осуществляется с использованием микроорганизмов деструкторов. Нами разработана биотехнология удаления из сточных вод загрязнителей с помощью иммобилизованных селекционированных микроорганизмов деструкторов, гидробионтов, высших водных растений. Суть технологии в создании в очистном сооружении пространственной сукцессии, состоящей из микроорганизмов-деструкторов, утилизирующих углеводороды нефти и газа до CO2 и H2O, а также формировании трофической цепи и гидробионтов, дочищающих воду от остатков органических соединений и бактерий. Использование микроорганизмов в процессах очистки и доочистки сточных вод различного типа способствует разрушению многих токсичных продуктов (сероводород, аммиак, фенол и др.). В Институте микробиологии АН РУз разработана система ступенчатых биопрудов (45) для очистки промышленных и сельскохозяйственных стоков. В климатических условиях Узбекистана (до 300 солнечных дней) использование биопрудов для очистки промышленных стоков высоко актуальна. Наряду с использованием активных местных штаммов бактерийдеструкторов углеводородов и фенола используются высшие водные растения (Pistia stratiotes и Eihornia crassipes). Оказалось, что мощная корневая система растений является естественным иммобилизатором бактерий и гидробионтов, что приводит к увеличению численности бактерий и ускорению процесса очистки. Преимуществом указанного метода является деструкция органических загрязнителей до CO2 и H2O, отсутствие использования дорогостоящих и дефицитных реагентов. Кроме того в процессе биологической очистки не происходит увеличения солесодержания воды и количества образующихся осадков. Известно, что после предварительной физико-химической очистки до 95% общего объема нефтесодержащих вод подвергается биологической очистке совместно с бытовыми стоками предприятия. Растения, активно поглощая биогенные элементы и выделяя биологически активные соединения, стимулирует развитие и вызывает аккумуляцию бактерий в зоне корневой системы. И именно бактерии затем осуществимой деструкцию органических и неорганических веществ. Происходит снижение БПК, ХПК, окисляемости, концентрации нефтепродуктов и других соединений сточных вод до предельно допустимых норм для технического использования. Огромная биомасса растений при выращивании на очищенных сточных водах достигающая до 3500 тонн сырой или 180-200 тонн сухой биомассы практически не используется. Нами предлагается использовать сухую биомассу растений в качестве альтернативного источника для получения биотоплива. Указанная биотехнология в течение 12 лет применяется на ряде предприятий нефтегазовой промышленность, открывает перспективу создания замкнутой системы водоснабжения, а при выпуске воды в природные водоемы предотвращает их эвтрофикацию. THE ROLE OF MICROORGANISMS IN INDUSTRIAL AND AGRICULTURAL WATER TREATMENT Kutliev J., Mavlyanova M.I., Urinova A.A. Microbiology institute ASc RUz, 100128, A.Kadiri, 7bTashkent, Uzbekistan e-mail: kutliev@rambler.ru 78 Environmental protection is one of the most important governmental problems. Biotechnological ecology is an area of science and experience based on using active microbial mass in order to preserve environment. Intensive introduction of biotechnological ecology’s advantages into practical experience of ground clearance and water treatment is a good solution. These advantages in large extend depend on forming and regular stocking of fund collection by microorganisms enable to decompose and utilize harmful and toxic compounds, xenobiotics, industrial and agricultural waste products. The goals of the work are: the role of microorganisms and biotechnological deletion of waste products from sewage using microorganisms-decomposer, hydrobionts, higher water plants. We used classical microbiological approach in our work. Hydrocarbon-oxidizing bacteria were grown on Raymond medium, saprophytes – on RPA. Industrial sewage contains two types of contaminants: xenobiotics (substance that is foreign to the body or to an ecological system) and heavy metal ions. Sampling and selection of microorganisms-destructors with their further immobilization on inert support are the basis of microbiological treatment against xenobiotics. Heavy metal ions are removed by their adsorption on germ culture. Microorganisms-destructors are used to dispose oil-and-gas contamination. We developed biotechnological approach of immobilized microorganisms-destructors, hydrobionts, higher water plants to remove pollutants from sewage. The main idea is to create spatial succession in treating facility, trophic chains and hydrobionts. The succession contains microorganisms-destructors that utilize oil and gas to CO2 and H2O, hydrobionts perform final treatment water from organic compounds and bacteria. Microorganisms in purification and afterpurification of sewage water help in degradation of a deal of toxic products (hydrogen sulfide, ammonia, phenol, etc.). In the Microbiology institute of ASc RUz step-like bioponds (4-5) have been developed for industrial and agricultural water treatment. In climatological conditions (300 sunny days) of Uzbekistan water treatment bioponds are of a great importance. Alongside with active local strain of microorganisms, destructing hydrocarbon and phenol) higher water plants (Pistia stratiotes and Eihornia crassipes) are also used. It turned out that massive root system of plants is a natural immobilizator of bacteria and hydrobionts that leads to growth of bacteria population and speeds up the process of water treatment. The advantages of this approach are destruction of organic contaminant to CO2 and H2O and no necessity to use expensive and deficient reagents. Moreover, during the biological purification the amount of salt and sediment does not increase. It is known that after preliminary physical and chemical treatment 95% of the whole volume of oil-and-gas containing water goes through biological purification alongside with household sewage. Plants absorb biogenic elements and produce biologically active compounds thereby stimulating the accumulating and growth of bacteria near the root system. Bacteria then destruct organic and nonorganic compounds. Decrease in biological and chemical oxygen demand, oxidability, oil and other wastewater products concentration till maximum permissible value takes place. The huge amount of plants (about 3500 tonnes of raw or 180-200 tonnes of dry solid matter) that grow on treated water are almost not being used. Here we suggest using dry solid matter of plants as alternative source of biofuel. During 12 years the following biotechnology put into practice in a number of oil and gas industrial factories as well as offers the challenge of making closed loop system of water supply, water discharge to natural pools preserves their eutrophication. МИКРОФЛОРА ВНУТРЕННИХ ОРГАНОВ ДВУСТВОРЧАТОГО МОЛЛЮСКА UNIO PICTORUM Логинова Е.Г., Алёхина Г.П., Мисетов И.А. Оренбургский государственный университет, г. Оренбург, пр. Победы 13, Россия e-mail:leg87@list.ru 79 В связи с малоподвижным образом жизни и фильтрационным способом питания моллюски способны аккумулировать в своих тканях и органах микроорганизмы содержащиеся в окружающей среде, а следовательно, отражать экологическое состояние водоема. Цель работы - изучение количественных характеристик и видового состава микрофлоры внутренних органов двустворчатого моллюска Unio pictorum среднего течения реки Урал и его притоков. Для достижения этой цели были поставлены и решены следующие задачи: − изучить видовой состав микрофлоры внутренних органов моллюска Unio pictorum; − сопоставить количественные характеристики микрофлоры моллюска и водоемов в точках отбора. Объектом исследования послужили пресноводные двустворчатые моллюски, класс Bivalvia, семейство Unionidae, вид Unio pictorum. Видовая принадлежность моллюсков определялась с помощью стандартных определителей. Отбор перловицы обыкновенной проводился с июля по август 2006 – 2010 годов на реках Урал, Сакмара, Илек. На исследуемых реках было выбрано шесть точек согласно данным Федеральной службы по гидрометеорологии и мониторингу окружающей среды. Они ранжировались по индексу суммарного загрязнения (Ксум.) и относились ко II – III классам вод Моллюсков вскрывали в стерильных условиях, выделяя следующие органы: мантия, сифон, жабры, печень, оставшиеся органы, подвергая их взвешиванию, растиранию до гомогенной массы. Посев суспензии каждого органа моллюска осуществляли на среды Эндо, мясо-пептонный агар и висмут–сульфит агар по методу Дригальского. Идентификацию выделенных микроорганизмов проводили на основании морфологических, тинкториальных, культуральных и биохимических свойств. При анализе биохимического профиля выросших микроорганизмов использовали коммерческие тест-системы ID32E rapide фирмы BioMerieux (Франция) в соответствии с «Определителем бактерий Берджи» (1997), а также использовали оригинальную компьютерную программу для определения бактерий. В ходе исследований была выделена и идентифицирована микрофлора внутренних органов моллюсков, отобранных из биоценозов, отличающихся по интенсивности антропогенного воздействия. Было определено 15 видов микроорганизмов, относящихся к 9 родам факультативно анаэробных грамотрицательных палочек сем. Enterobacteriaceae. Анализируя состав микроорганизмов в исследуемых органах моллюска было отмечено, что некоторые из них стабильно и обильно выделялись из различных органов на всех этапах исследования, это дало основание причислить их к естественной, автохтонной микрофлоре моллюска, таковыми оказались: Pantoea dispersa, Pantoea agglomerans, Erwinia uredovora, Erwinia cаrotovora, Serratia plymuthica. Кроме собственной микрофлоры моллюски содержат и аллохтонные микроорганизмы, которые попадают внутрь моллюска в процессе фильтрации. В жабрах и мантии были идентифицированы микроорганизмы, которые мы отнесли к аллохтонным - Enterobacter amnigenеs, Enterobacter cloacae, Leminorella grimontii, Salmonella spp, другие три вида представлены автохтонной микрофлорой - Pantoea dispersa, Erwinia uredovora и Erwinia cаrotovora. Наибольшим видовым разнообразием обладает смесь внутренних органов 9 видов, некоторые из них встречались только здесь, более однообразной была микрофлора печени и сифона 3-4 вида. Количество микроорганизмов, заселяющих моллюск, во многом зависит от экологического состояния водоема. В соответствии с данными Федеральной службы по гидрометеорологии и мониторингу окружающей среды, наибольшее антропогенное загрязнение испытывает река Урал ниже слияния с рекой Сакмара, река Илек в районе поселка Веселый и река Илек в районе райцентра Илек, это нашло свое подтверждение в наших исследованиях. Проведенные исследования позволили сделать следующие выводы: 80 1 При изучении видового состава были выделены 15 видов микроорганизмов, относящихся к 9 родам факультативно анаэробных грамотрицательных палочек сем. Enterobacteriaceae. 2 Оценивая количественное и видовое соотношение встречаемости микроорганизмов в исследуемых органах моллюсков, было отмечено, что наибольшей бактериальной обсемененностью отличается смесь внутренних органов, жабры и мантия. 3. С увеличением антропогенной нагрузки на водоем повышается количество микроорганизмов в органах моллюска, что неизбежно сказывается на процессах самоочищения водоемов. MICROFLORA OF AN INTERNAL OF BICUSPID MOLLUSCUM UNIO PICTORUM Loginova E.G., Alechina G. P, Misetov I.A. The Orenburg state university, Orenburg, avenue of the Victory 13, Russia e-mail:leg87@list.ru In connection with an inactive way of life and filtration way of a food molluscums are capable to accumulate in the tissues and organs microorganisms containing in environment and consequently, to reflect an ecological condition of a reservoir. The work purpose - studying of quantitative characteristics and specific structure of a microflora of an internal of bicuspid mollusk Unio pictorum an average watercourse Ural Mountains and its inflows. For achievement of this purpose following problems have been put and solved: 1 To study specific structure of a microflora of an internal of mollusk Unio pictorum; 2 To compare quantitative characteristics of a microflora of a mollusk and reservoirs in selection points. As object of research fresh-water bicuspid molluscums, class Bivalvia, family Unionidae, kind Unio pictorum have served. The specific accessory of molluscums was defined by means of standard determinants. Selection перловицы was spent by the ordinary from July till August 2006 – 2010 on the rivers Ural Mountains, Sakmara, Ilek. On the investigated rivers it has been chosen six points it agree to the data of Federal Agency of hydrometeorology and environment monitoring. They were ranged on an index of total pollution (Ksum.) also concerned to II – to III classes of waters Molluscums opened in sterile conditions, allocating following organs: a mantle, a siphon, gills, a liver, the remained organs, subjecting to their weighing, grinding to homogeneous mass. Crops of suspension of each organ of a molluscum the agar and bismuth-sulfite an agar on a method Drigalsky carried out on mediums Endo, meat-peptonic. Identification of the allocated microorganisms spent on the basis of morphological and biochemical properties. At the analysis of a biochemical profile of evolved microorganisms used commercial test systems ID32E rapide firms BioMerieux (France) according to «the Determinant of bacteria of Berdzhi» (1997), and also used the original computer program for definition of bacteria. During researches the microflora of an internal of the molluscums which have been selected from biocenoses, different on intensity of anthropogenous influence has been allocated and identified. It has been defined 15 species of microorganisms concerning 9 sorts of facultatively anaerobic Gram-negative rods of family Enterobacteriaceae. Analyzing structure of microorganisms in investigated organs of a molluscum it has been noticed that some of them were stably and plentifully allocated from various organs at all investigation phases, it has given the grounds to rank them to a natural, autochthonic microflora of a molluscum, that had appeared: Pantoea dispersa, Pantoea agglomerans, Erwinia uredovora, Erwinia cаrotovora, Serratia plymuthica. Except own microflora molluscums contain and аллохтонные microorganisms which get in a molluscum in the course of a filtration. 81 In gills and a mantle microorganisms which we have carried - Enterobacter amnigenеs, Enterobacter cloacae, Leminorella grimontii, Salmonella spp. have been identified, other three kinds are presented by an autochthonic microflora - Pantoea dispersa, Erwinia uredovora and Erwinia cаrotovora. The greatest specific variety the admixture of an internal 9 kinds some of them possesses met only here, the microflora of a liver and a siphon 3-4 kinds was more monotonous. The quantity of the microorganisms occupying a molluscum, in many respects depends on an ecological condition of a reservoir. According to the data of Federal Agency of hydrometeorology and environment monitoring, the greatest anthropogenous pollution is tested by the river Ural Mountains below merge to the river Sakmara, the river Ilek around settlement Cheerful and the river Ilek around district Ilek, it has found the acknowledgement in our researches. The conducted researches have allowed to draw following conclusions: 1. At studying of specific structure have been allocated 15 species of microorganisms concerning 9 sorts facultatively anaerobic gramnegative of sticks of family Enterobacteriaceae. 2 Estimating a quantitative and specific parity of occurrence of microorganisms in investigated organs of molluscums, it has been noticed that the greatest bacteriemic semination the admixture of an internal, gills and a mantle differs. 3. With augmentation of an anthropogenous load at a reservoir the quantity of microorganisms in molluscum organs raises that inevitably affects processes of self-cleaning of reservoirs. ИССЛЕДОВАНИЕ ALK ГЕНОВ У ЧИСТЫХ КУЛЬТУР УГЛЕВОДОРОДОКИСЛЯЮЩИХ МИКРООРГАНИЗМОВ, ВЫДЕЛЕННЫХ ИЗ РАЙОНОВ ЕСТЕСТВЕННЫХ НЕФТЕПРОЯВЛЕНИЙ НА ОЗЕРЕ БАЙКАЛ Ломакина А.В.,1 Павлова О.Н.,1 Морозов И.В.,2 Земская Т.И.1 1 Учреждение российской академии наук Лимнологический институт СО РАН (ЛИН СО РАН), Иркутск, ул. Улан-Баторская, 3; 2Учреждение российской академии наук институт химической биологии и фундаментальной медицины СО РАН, Новосибирск, Проспект Лаврентьева, 8 e-mail: lomakina@lin.irk.ru Известно, что решающую роль в трансформации нефти до простых соединений выполняют микроорганизмы (Барышникова и др., 2001; Назина и др., 2002; Head et al., 2006; Muyzer et al., 2008). Процесс окисления н-алканов и других углеводородов осуществляется с помощью ферментативных систем. Установлено, что в реакции окисления алканов участвует трехкомпонентная ферментативная система, основным ферментом является алканмонооксигеназа (Smits et al., 2002; Whyte et al., 2002; van Beilen et al., 2003, 2007). Озеро Байкал является крупнейшим в мире пресноводным водоемом. В число уникальных характеристик оз. Байкал входят природные выходы нефти, известные с XVIII столетия. Исследования показали, что в этих районах отмечено повышенное содержание микроорганизмов, способных окислять нефть и ее производные. У чистых культур углеводородокисляющих микроорганизмов (УВОМ), выделенных из водной толщи и донных осадков, был осуществлен поиск alk генов, используя три группы праймеров, предложенных К. Sei с соавторами (2003). Данные праймеры позволяют амплифицировать alk гены у микроорганизмов, способных окислять алканы с различной длиной цепи. Наибольшее количество штаммов (76%) показали положительную ПЦР-реакцию с праймерами на III группу alk генов. Преобладание этой группы генов отмечено у штаммов, выделенных из двух исследованных районов. ДНК 10% штаммов показали положительный результат с праймерами на alk гены I группы. Alk гены II группы были детектированы у представителей р. Acinetobacter sp. Лишь ДНК 14% исследованных штаммов не давала продуктов с праймерами ни на одну группу alk генов. Это представители рр. Micromonospora, 82 Mycobacterium, Pseudomonas, Brevibacillus, Acinetobacter. Alk гены исследованы у 15 штаммов, принадлежащих к различным филумам: Actinobacteria, Firmicutes, классам α-, γProteobacteria. Среди них четыре штамма содержали alk гены II группы, способные окислять алканы с длиной цепи от С12 до С20. У 11 штаммов УВОМ были детектированы в геноме alk гены III группы, ответственные за окисление широкого спектра н-алканов. Установлено, что наиболее гетерогенной по структуре нуклеотидных последовательностей alk генов группой, как по результатам исследования, так и по литературным данным, является III группа, которая содержит в геноме alk гены р. Rhodococcus. Кроме того, эта группа включает alk гены представителей рр. Pseudomonas (Pseudomonas fluorescens) и Burkholderia sp. (Sei et al., 2003). Филогенетический анализ исследованных нами штаммов нуклеотидных последовательностей фрагментов alk генов III группы показал наибольший процент сходства с последовательностями alk генов вида Rhodococcus fascians (AJ301873). Тогда как по структуре нуклеотидных последовательностей гена 16S рРНК данные штаммы имели наибольший процент сходства (98-99%) с последовательностями Rhodococcus sp., Mycobacterium sp., Micromonospora sp., Arthobacter sp., Paenibacillus sp., Sphingomonas sp. Установлено, что штаммы, различающихся по нуклеотидным последовательностям гена 16S рРНК, по alk генам были одинаковы и наиболее сходны с alk генами представителей р. Rhodococcus. Это может свидетельствовать о том, что эти гены могли появиться в геноме различных родов бактерий в результате горизонтального межвидового переноса. Известно, что alk гены являются адаптивными, то есть связанными с приспособлением к меняющимся условиям среды. Адаптивные гены не являются обязательными для всех представителей бактериальной популяции, они располагаются на плазмидах, что значительно повышает возможность их переноса между членами популяции, даже если эти члены не являются близкородственными (Турова, 2009). Таким образом, чистые культуры УВОМ районов естественных нефтепроявлений на озере Байкал содержат в геноме alk гены, ответственные за окисление н-алканов с различной длиной цепи. Работа выполнена при поддержке программы Президиума РАН (проект 21.9), Интеграционного проекта №27, гранта РФФИ 10-05-00681, гранта Президента РФ МК1901.2010.5. ALK GENES IN PURE CULTURES OF HYDROCARBON OXIDIZING MICROORGANISMS ISOLATED FROM NATURAL OIL SEEPAGES IN LAKE BAIKAL Lomakina A.V.,1 Pavlova O.N.,1 Morozov I.V.,2 Zemskaya T.I.1 1 Limnological Institute SB RAS, 3, Ulan-Batorskaya St., Irkutsk, Russia 2 Institute of Chemical Biology and Fundamental Medicine SB RAS, 8, Acad. Lavrentyev Avenue, Novosibirsk, Russia e-mail: lomakina@lin.irk.ru It is known that microorganisms play a decisive role in transformation of oil to simple compounds (Baryshnikov et al., 2001; Nazina et al., 2002; Head et al., 2006; Muyzer et al., 2008). Oxidation of n-alkanes and other hydrocarbons is carried out with the help of enzymatic system. Three-component enzymatic system with the major enzyme alkane-monooxygenase takes part in oxidation reaction (Smits et al., 2002; Whyte et al., 2002; van Beilen et al., 2003, 2007). Lake Baikal is the largest freshwater body in the world. One of the unique features of the lake is its natural oil seepage known from the XVIII century. High concentrations of microorganisms able to oxidize oil and its derivatives were recorded in these areas. Three groups of primers offered by K. Sei and coauthors (2003) were used for search of alk genes in pure cultures of hydrocarbon oxidizing microorganisms (HCOM) isolated from water column and bottom sediments. These primers allowed the amplification of alk genes in microorganisms able to oxidize 83 alkanes of different chain length. The greatest number of strains (76%) had positive PCR with primers to group III of alk genes. This group of genes dominated in the strains isolated from the two sites under study. DNA of 10% strains had positive result with primers to alk genes of group I. Alk genes of group II were detected in representatives of the genus Acinetobacter sp. DNA in 14% of studied strains did not generate products with primers to none of the groups of alk genes: Micromonospora, Mycobacterium, Pseudomonas, Brevibacillus, and Acinetobacter. Alk genes were examined in 15 strains belonging to different phyla (Actinobacteria and Firmicutes) and classes (αand γ-Proteobacteria). Four strains among them contained alk genes of group II able to oxidize alkanes with long chain – from C12 to C20. Alk genes of group III responsible for oxidation of a wide spectrum of n-alkanes were detected in 11 strains of HCOM. It was established that group III which had alk genes of the genus Rhodococcus in the genome was the most heterogeneous group in the structure of nucleotide sequences. Moreover, this group contained alk genes of the genera Pseudomonas (Pseudomonas fluorescens) and Burkholderia sp. (Sei et al., 2003). Phylogenetic analysis of the strains of nucleotide sequences of group III alk gene fragments revealed the highest percentage of similarity with the sequences of alk genes in Rhodococcus fascians (AJ301873), whereas these strains had the highest percentage of homology (98-99%) in the structure of nucleotide sequences of 16S rRNA gene with the sequences of Rhodococcus sp., Mycobacterium sp., Micromonospora sp., Arthobacter sp., Paenibacillus sp., and Sphingomonas sp. Strains differing in nucleotide sequences of 16S rRNA gene were more similar to alk genes of the genus Rhodococcus. These genes are likely to have emerged in the genome of different bacterial genera as a result of horizontal interspecific transfer. Alk genes are adaptive, i.e. they adapt to changing conditions of the environment. Adaptive genes are not obligatory for all representatives of the bacterial population. They are located on plasmids which increases the possibility of their transfer among the population members, even if these members are not closely related (Turova, 2009). Thus, pure HCOM cultures from the areas of oil seepages in Lake Baikal contain alk genes in the genome responsible for oxidation of n-alkanes with different chain length. The work was supported by RAS Presidium programmes (Project 21.9), Integrated Project No. 27, RFBR Grant 10-05-00681, and RF President Grant MK-1901.2010.5. МИКРОБНАЯ ОЧИСТКА СТОЧНЫХ ВОД В БИОПРУДАХ Мавлянова М., Кутлиев Дж., Уринова А.А. Институт микробиологии АН РУз, 100128, ул. А. Кадыри 7б, г. Ташкент, Узбекистан e-mail: kutliyev@rambler.ru Проблема очистки сточных вод остается одной из сложных и актуальных. Сточные воды, попадая в открытые водоемы, приводят к эвтрофикации, не пригодности использования воды для хозяйственных нужд. Наиболее существенным способом борьбы с загрязнениями промышленного типа является разработка так называемых «систем интенсивной очистки». Основную роль в этих системах играют ассоциации микроорганизмов, способные утилизировать широкий спектр загрязнителей. При этом степень очистки промышленных стоков возрастает, если используются специально отселекционированные биоценозы. Цель работы – скрининг углеводородокисляющих микроорганизмов, выделенных из промышленных стоков и отбор культур, способных эффективно утилизировать нефть и нефтепродукты. В работе использовали классические методы, используемые в микробиологии. Культуры углеводородокисляющих бактерий выращивали на среде Раймонда с добавлением нефти или другого углеводорода. На протяжении ряда лет проводятся исследования в области выделения и изучения состава и роли специфичных аборигенных форм бактерий, обладающих в очистных сооружениях нефтегазоперерабатывающих предприятий использующих различные углеводороды как единственный источник углерода. Из наиболее активных штаммов создана ассоциация бактерий деструкторов углеводородов, относящихся к родам Pseudomonas, 84 Bacillus, Rhodococcus. Введение ассоциации бактерий, полученной методом накопительных культур, длительный период культивировавшихся на нефти, дизельном топливе, бензине и др., позволяет интенсифицировать работу биопрудов первой ступени очистки от загрязнителей и стабилизировать процессы в последующих. Основным агентом очистки являлись гетеротрофные микроорганизмы, участвующие в процессах денитрификации, окислении углеводородов, восстановлений сульфатов, метановом брожении, численность которых колебалась от 102 кл/мл до 106 кл/мл. В первом пруду окисление загрязнителей происходит в присутствии избытка органических веществ и недостатка кислорода. Загрязненная вода токсична для простейших и других гидробионтов. В результате деятельности бактерий происходит снижение токсичности стоков, появляется возможность культивировать высшие водные растения (ВВР), такие как пистия телорезовидная, эйхорния отличная, обладающие хорошо развитой корневой системой, на которой адсорбируются загрязнители, являющейся естественным иммобилизатором микрофлоры и микрофауны. Микроскопирование ризосферы макрофитов выявило, что она обильно заселена разнообразными формами простейших, активно питающимися бактериальными клетками. Из простейших в пленке обрастания подводной части ВВР доминировали Chilodonella incunata, Unonema nigricans, Litonotus lamella, Aspidisca costata, в виде преобладали Halteria grandinella, Actinophrus sol. Микроорганизмы перифитона ВВР обладали преимущественно дегидрогеназной, каталазной, протеазной и целлюлазной активностью. По мере очистки в конечных биопрудах отмечалось снижение бактериального состава перифитона, а в сточной воде. Простейшие были представлены кругоресничными инфузориями являющиеся седиментанорами и фильтраторами (Vоrticella convallaria, V. campanula), а также наблюдались виды, характерные для более высокой степени очистки-коловратки роды Rotaria, Notommata. Иммобилизация микроорганизмов на естественном носителе позволяет повысить их концентрацию, создает условия для формирования пространственной сукцессии состоящей из микроорганизмов деструкторов, утилизирующих загрязнители, а также формируется трофическая цель из гидробионтов, дочищающих воду от остатков органических соединений и бактерий до ПДК естественных водоемов. MICROBIAL WASTEWATER PURIFICATION IN BIOPONDS Mavlyanova M., Kutliev J., Urinova A.A. Microbiology institute ASc RUz, 100128, A.Kadiri, 7bTashkent, Uzbekistan e-mail: kutliev@rambler.ru Sewage water purification is still on o the complicated and urgent issue. When wastewaters percolate into open spillway it causes eutrophication. Elaboration of so called “intensive purification system” is the most essential way to cope with agricultural contamination. Microorganisms associations that utilize the wide range of contaminants play an important role in this type of systems. When certain selected biocenoses are used purification efficiency increases. The goal of the project was to carry out screening of industrial sewage isolated hydrocarbon oxidizing microorganisms as well as selection of germs enable to utilize effectively oil-and-gas products. We used classical microbiological approaches. Hydrocarbon oxidizing microorganisms were grown in Ryamond medium with addition of oil or another hydrocarbon. During several years a number of researches focus on isolation of specific local forms of microorganisms that prevail in oil-and-gas processing factories and consume various forms of hydrocarbons as the only source of carbon. The most active strains are combined into association of carbon destructing bacteria. They refer to Pseudomonas, Bacillus, Phodococcus. Association of bacteria grown over a long period of time in oil, diesel oil, petroleum and etc. allows intensifying the functioning of first step purification bioponds and stabilizing the processes in the next ponds. The basic water treatment agents were heterotrophic microorganisms that participate in 85 denitrification, hydrocarvon oxidizing, sulphate reduction, methane fermentation. Their population was about 102 cell/ml – 106 cell/ml. In the first pond contaminants’ oxidizing occurs in abundance of organic matter and oxygen. Contaminated water is toxic against protozoa and other hydrobionts. As a consequence of bacteria activity sewage water toxicity decreases, such higher water plants as Pistia stratiotes and Eichornia crassipes may be grown. These plants with massive root system where contaminants get adsorbed are natural immobilizator of microflora and microfauna. Microscopial investigation of macrophytes’ rhizosphera showed that it is inhabited with various protozoa forms that feed actively on bacteria. In BBP underwater zone the following protozoa dominated - Chilodonella incunata, Unonema nigricans, Litonotus lamella, Aspidisca costata, Halteria grandinella, Actinophrus sol. Peripheton BBP microorganisms showed mostly dehydrogenase, catalase, protease and cellulose activity. In the process of water purification in final bioponds the level of bacterial content in periphetone decreased. Protozoa were found to be sedimentation and filtration possessed circular ciliary infusoria (Vorticella convallaria, V.campanula) as well as kolovratkas Rotaria, Notommata that are typical at high level of purification. Immobilization of microorganisms on natural carrier allows to increase their concentration, makes conditions to form spare microorganisms-destructing successions, to utilize the contaminants, to form trophic chain of hydrobionts that finish water cleaning from organic matter and bacteris to maximum permissible concentration of natural bioponds. РАЗНООБРАЗИЕ КУЛЬТИВИРУЕМОГО И ПРИРОДНОГО МИКРОБНОГО СООБЩЕСТВА ДОННЫХ ОСАДКОВ ШЕЛЬФА КАРСКОГО МОРЯ, ЕНИСЕЙСКОГО ЗАЛИВА И ГЫДАНСКОЙ ГУБЫ Мамаева Е.В., Суслова М.Ю., Павлова О.Н., Парфенова В.В., Земская Т.И. Лимнологический институт СО РАН, 664033, Иркутск, ул. Улан-Баторская, 3 e-mail: elena_m@lin.irk.ru Объектом данного исследования является шельф Карского моря и близ расположенные заливы - Енисейский и Гыданский. Эти районы представляют интерес в связи с их отличающимися геохимическими характеристиками, что обусловлено влиянием речного стока и морских приливов. В настоящее время в обско-енисейском устьевом регионе и шельфе открыты крупные нефтегазовые месторождения, эксплуатация которых может привести к изменениям гидрологического и гидрохимического режимов Карского моря. Материалом для анализа послужили образцы воды и донных осадков, отобранные в ходе экспедиции в 2009. Установлено, что максимальные значения общей численности микроорганизмов (ОЧМ) выявлены в поверхностных слоях воды в шельфе Карского моря (до 515 тыс. кл/мл). С глубиной отмечено снижение ОЧМ до 23 тыс. кл/мл. Минимальное количество микроорганизмов детектировано в пробах воды, отобранных на разрезе от Енисейского залива до п. Диксон, где численность органотрофных, психрофильных микроорганизмов и бактерий р. Bacillus, не превышала 45, 190 и 35 КОЕ/мл, соответственно. Максимальные значения этих групп микроорганизмов выявлены на разрезе о. Олений – о. Сибирякова. Максимум численности углеводородокисляющих микроорганизмов отмечен в пробах воды Карского моря на станциях разреза п. Диксон – о. Сибирякова – до 1200 КОЕ/100мл. В результате проведенного исследования установлено, что в культивируемом микробном сообществе доминируют бактерии р. Bacillus. Так, в донных осадках и водной толще р. Енисей их количество составляет 46 и 54%, соответственно, в шельфе Карского моря- 41 %. В донных осадках залива Гыданская губа процент представителей р. Bacillus равен 81. Структура нуклеотидных последовательностей фрагментов гена 16S рРНК исследована у чистых культур бактерий, изолированных из донных осадков шельфа 86 Карского моря, Енисейского залива и Гыданской губы. По результатам анализа исследуемые штаммы были отнесены к филумам - Firmicutes, Actinobacteria , -Proteobacteria, родам – Brevibacillus, Bacillus, Aeromonas, Plantibacter. Природное микробное сообщество донных осадков в районах разрезов о. Олений- о. Сибирякова, п. Диксон- о. Сибирякова, Сопочная Карга – м. Нарзой, м. Отвесный- м .Пака Сала по данным филогенетического анализа представлено филумами α-, β-, δ-, Proteobacteria, Actinobacteria, Acidobacteria, Bacteroidetes, Chloroflexi, Crenarchaeota, Thaumarchaeota. Ближайшие гомологи полученных нуклеотидных последовательностей имеют высокий процент сходства с микроорганизмами из различные экологических ниш, как морских так и пресноводных. Также среди ближайших родственников обнаружены последовательности, выделенные из донных осадков Арктики и Антарктики. Работа выполнена в рамках программы Президиума РАН, проекта 20.7. DIVERSITY OF CULTURABLE AND NATURAL MICROBIAL COMMUNITIES OF BOTTOM SEDIMENTS FROM THE KARA SEA SHELF, YENISEI BAY AND GYDANSKAYA GULF Mamaeva E.V., Suslova M.Yu., Pavlova O.N., Parfenova V.V., Zemskaya T.I. Limnological Institute SB RAS, 3, Ulan-Batorskaya St., Irkutsk, Russia 664033 e-mail: elena_m@lin.irk.ru The Kara Sea shelf and neighbouring areas of Yenisei Bay and Gydanskaya Gulf were objects of this research. These areas are of interest for investigators due to the distinct geochemical characteristics because of the impact of the river flow and sea tides. At present, new oil and gas deposits have been discovered in the Ob-Yenisei mouth area and shelf, the exploitation of which may cause changes in hydrological and hydrochemical regimes of the Kara Sea. Samples of water and bottom sediments collected during the 2009 expedition were analyzed. Maximal values of total abundance of microorganisms (TAM) were detected in the surface water layers in the Kara Sea shelf (up to 515x104 cell/ml). Decrease of TAM up to 23x104 cell/ml was observed with depth. Minimal content of microorganisms was detected in the water samples collected at the cross-section from Yenisei Bay to Dickson where the abundance of organotrophic and psychrophilic microorganisms and bacteria of the genus Bacillus made up 45, 190 and 35 CFU/ml, respectively. Maximal values of these groups of microorganisms were recorded at the transect Oleny Island – Sibiryakov Island. Maximal abundance of carbon oxidizing microorganisms (up to 1200 CFU/100ml) was detected in the water samples from the Kara Sea at the transect Dickson – Sibiryakov Island. It was established that bacteria of the genus Bacillus dominated in the culturable microbial community. Their abundance in the sediments and water column of the Yenisei River was 46 and 54%, respectively, 41% in the Kara Sea shelf, and 81% in the bottom sediments of Gydanskaya Gulf. The structure of nucleotide sequences of 16S rRNA gene fragments was analyzed in pure cultures of bacteria isolated from the bottom sediments of the Kara Sea shelf, Yenisei Bay and Gydanskaya Gulf. Strains were referred to phyla Firmicutes, Actinobacteria, ɣ-Proteobacteria, and genera – Brevibacillus, Bacillus, Aeromonas, Plantibacter. Natural microbial community in the bottom sediments at the transects Oleny Island – Sibiryakov Island, Dickson – Sibiryakov Island, Sopochnaya Karga – Cape Narzoy, Cape Otvesny – Cape Paka Sala was represented by phyla α-, β-, δ-, ɣ-Proteobacteria, Actinobacteria, Acidobacteria, Bacteroidetes, Chloroflexi, Crenarchaeota, and Thaumarchaeota. The closest homologues of nucleotide sequences had a high percentage of homology with microorganisms from different ecological marine and freshwater niches. Among the closest homologues there were also detected sequences isolated from the bottom sediments of the Arctic and Antarctic. The work was supported by the RAS Presidium Programme, Project 20.7. 87 ИММОБИЛИЗАЦИЯ ЛИЗОЦИМА НА НАНОАЛМАЗАХ, БИОЛОГИЧЕСКИЕ ПРИЛОЖЕНИЯ Могильная О.А., Бондарь В.С. Институт биофизики СО РАН, Красноярск, Россия e-mail: ol_mog@mail.ru Системы с иммобилизованными на гетерогенной поверхности ферментами широко используются в биомедицинских исследованиях. Основная направленность таких исследований связана с разработкой и конструированием новых тест-систем для биологического мониторинга и медицинской диагностики (включая многокомпонентные тест-системы многоразового действия), а также новых средств терапии пролонгированного действия. В качестве матрицы для иммобилизации протеинов (в частности, ферментов) перспективным материалом являются модифицированные наноалмазы (МНА) взрывного синтеза, обладающие высокой коллоидной устойчивостью в дисперсионных средах (вода, растворы глюкозы) и пригодные для биологических и медицинских исследований. Благодаря выраженному химическому полиморфизму поверхности, МНА проявляют высокие адсорбционные свойства к различным соединениям пептидной природы (белки, ферменты, гормоны). Одним из вариантов модельной системы пролонгированного действия на основе МНА для медицинских целей (например, средства для лечения открытых ожоговых и посттравматических ран) может являться система, конструируемая с использованием лизоцима из куриного яйца. Небольшие размеры и хорошо изученный механизм действия этого фермента дают определенные преимущества в исследованиях его конформационных и функциональных изменений при иммобилизации на носителе. В настоящей работе приводятся данные сравнительного анализа каталитической активности лизоцима после его неспецифической адсорбции и ковалентной иммобилизации на поверхности частиц МНА. Исследования выполнены с использованием МНА марки RUDDM 0-200 (d50 = 100 нм), производимые ООО «Реал-Дзержинск» (Дзержинск, Россия) по технологии, разработанной в ИБФ СО РАН (Красноярск, Россия), и обладающие высокой коллоидной стабильностью в гидрозолях. В экспериментах использовали лизоцим из белка куриных яиц, производимый фирмой «Serva» (Germany). Тестовыми объектами для оценки активности свободного лизоцима и адсорбированного (или ковалентно иммобилизованного) на частицы МНА, являлись светящиеся грамотрицательные бактерии Photobacterium phosphoreum шт. 2015 и Escherichia coli шт. Z905 из коллекции IBSO RAS (http://www.ibp.ru/collection/), а также грамположительные бактерии Bacillus subtilis шт. 2335. Установлено, что кратковременная инкубация водного раствора лизоцима с гидрозолем МНА при весовых соотношениях белка и наночастиц 1:2 приводит к полной адсорбции фермента на наночастицы. Показано, что при ковалентной пришивке фермента на МНА, предварительно активированные бензохиноном, можно иммобилизовать 0.20 - 0.25 мг лизоцима на 1 мг наночастиц. Как показали эксперименты, в обоих вариантах связывание белка с МНА сопровождается образованием крупных агрегатов наночастиц и снижением их коллоидной устойчивости в гидрозоле. Показано, что активность фермента после его адсорбции и ковалентной иммобилизации на частицы МНА снижена по сравнению со свободным ферментом в растворе. Наблюдаемый эффект, вероятно, может объясняться конформационными изменениями части молекул фермента при его адсорбции или ковалентной иммобилизации на МНА и утрате каталитической функции. Нельзя исключить также, что снижение активности объясняется стерическими затруднениями при взаимодействии фермента с поверхностью бактериальной клетки из-за большого размера агрегатов (комплексов) МНА-лизоцим и, как следствие, невозможностью выполнения ферментом каталитической функции. Причем, при разной ориентации комплекса МНАлизоцим на поверхности клетки, кластер МНА может экранировать либо субстрат от взаимодействия с ферментом, либо сайт связывания фермента с субстратом. В пользу высказанного предположения свидетельствуют более медленные скорости лизиса 88 бактериальных клеток при воздействии комплекса МНА-лизоцим, по сравнению со скоростями их лизиса в присутствие растворенного (свободного) фермента. Дальнейшие исследования будут направлены на оптимизацию условий иммобилизации лизоцима на наночастицы с целью получения более активного комплекса МНА-фермент. Работа поддержана Президиумом РАН (программа № 21, проект 64 (3.6.3)). IMMOBILIZATION OF LYSOZYME ON THE NANODIAMONDS, BIOLOGICAL APPLICATIONS Mogilnaya O.A., Bondar V.S. Institute of Biophysics, SB RAS, Krasnoyarsk, Russia e-mail: ol_mog@mail.ru Systems with immobilized enzymes on a heterogeneous surface are widely used in biomedical research. The main thrust of such research is related to the design and constructing of new test systems for biological monitoring and medical diagnostics (including multi-test system reusable), as well as new means of therapy with prolonged action. The modified nanodiamonds (MND) synthesized by detonation are a promising material as the matrix for the immobilization of proteins (particularly enzymes). MND have high colloidal stability in the dispersion medium (water, glucose solution) and are suitable nanomaterial for bio- and medical applications. Thanks to the chemical polymorphism of the surface, MND particles exhibit high adsorption properties for the various peptide compounds (proteins, enzymes, hormones). One example in developing of MND model systems with prolonged action for medical purposes (eg, treatment of open wounds) may be a system with hen egg white lysozyme. Small size and well-studied mechanism of action of this enzyme provide certain advantages in studies of its conformational and functional changes when immobilization on the nanocarrier. This work presents data of a comparative analysis of the catalytic activity of lysozyme after the nonspecific adsorption and covalent immobilization on the surface of MND. Studies were performed using MND (Brand RUDDM 0-200, d50 = 100 nm) produced LTD Real-Dzerzhinsk "(Dzerzhinsk, Russia) on technology developed in the IBP SB RAS (Krasnoyarsk, Russia). Hen egg white lysozyme (Serva, Germany) was used. Test objects to assess the activity of adsorbed or covalently immobilized lysozyme on the MND nanoparticles were gram-negative bacteria Photobacterium phosphoreum strain 2015 and Escherichia coli strain Z905 from the collection IBSO RAS (http://www.ibp.ru/collection/), as well as gram-positive bacterium Bacillus subtilis strain 2335. It is established that a short-term incubation of an aqueous solution of lysozyme with hydrosol MND leads to a complete adsorption of the enzyme on nanoparticle at weight ratios of protein and nanoparticle 1:2. We can immobilize 0.20 - 0.25 mg of lysozyme to 1 mg of nanoparticles by covalent conjugation of the enzyme with MND. The experiments showed that in both cases protein binding with MND accompanied by the formation of large aggregates of nanoparticles and the reduction of their colloidal stability in hydrosols. It was shown that the enzyme activity after the adsorption and covalent immobilization on the MND was reduced compared with free enzyme activity in solution. The observed effect can probably be explained by conformational changes of the enzyme molecules during its adsorption or covalent immobilization on the MND and loss of their catalytic function. Reduced enzymatic activity may also explain the steric difficulties in interaction of the enzyme with the surface of bacterial cell from the formation of large aggregates of MND-lysozyme and, consequently, the inability to perform the catalytic function. And, depending on the orientations of the complex MND-lysozyme on the cell surface, the clusters of nanoparticles can close substrate on the interaction with the enzyme or the bindingsite of the enzyme with substrate. In favor of this assumption is supported by the slower rate of lysis of bacterial cells when exposed to a complex MND-lysozyme compared with rates of lysis in the presence of free enzyme. Further studies will be aimed at optimizing the conditions for immobilization of lysozyme on nanoparticles in order to get more active MND-lysozyme complex. This work was supported by the Presidium of RAS (program no. 21, project no. 64 (3.6.3)). 89 ФОРМИРОВАНИЕ БИОПЛЕНОК ПРИ ТРАНСФОРМАЦИИ ФЕНАНТРЕНА БАКТЕРИОБЕНТОСОМ РЕКИ АМУР Морозова О.Ю.,1 Литвиненко З.Н.2 1 Институт водных и экологических проблем ДВО РАН, 2 Дальневосточный государственный университет путей сообщения, г. Хабаровск, ул. Ким-Ю-Чена, 65 e-mail: helga1986@inbox.ru Проблема загрязнения водных экосистем стойкими органическими соединениями различного характера занимает центральное место в ряду актуальных задач современной экологии. Среди поллютантов, обладающих канцерогенными и мутагенными свойствами, а также имеющих тенденцию к биоаккумуляции, выделяют полициклические ароматические углеводороды (ПАУ). Донные отложения способны накапливать из речной воды весь комплекс химических веществ, присутствующих в ней, поэтому их следует рассматривать как интегральный индикатор загрязнения водных объектов. Целью исследования было определить взаимосвязь между образованием биопленок и активностью фенантренметаболизирующих консорциумов бактерий – представителей бентосных микробоценозов р. Амур, культивируемых в разных температурных условиях и при различном наборе субстратов. Для исследования микробиологической трансформации стойких органических соединений использовали бентосные микробные комплексы (БМК), отобранные на участках р. Амур выше и ниже устья р. Сунгари и на Нижнем Амуре (с. Савинское). Культивирование бактериобентоса проводили на минеральной среде, основным источником углерода выступал фенантрен (100 мг/л), дополнительным – 1% раствор пептона, для оценки влияния режима солености вносили 3% раствор NaCl. Бактерии выращивали при 2 температурных режимах: 23°С и 2°С в течение нескольких месяцев. Активность БМК определяли на фотометре КФК3-01 при длине волны 490 нм. Известно, что все микроорганизмы обладают способностью, выраженной в различной степени, прикрепляться к органическим и неорганическим поверхностям. Результатом успешного осуществления адгезии и колонизации во внешней среде является формирование биоплёнки на поверхности субстрата. Очевидно, что биопленка не является бесструктурным гомогенным скоплением клеток и слизи, а представляют собой сообщество поверхностноассоциированных клеток, заключенных в полимерный матрикс, покрытый поверхностной оболочкой, имеющей в своем составе полисахариды, белки и билипидный компонент. Образующиеся биопленки значительно повышают устойчивость бактерий к токсикантам и другим негативным факторам окружающей среды. Первым этапом формирования вновь образующейся биоплёнки на незаселённой поверхности является адгезия на ней отдельных бактериальных клеток. В модельном эксперименте с использованием донных отложений р. Амур, адгезия на стекле впервые была отмечена на 15 сутки в вариантах с бактериобентосом выше и ниже устья р. Сунгари, культивируемым при температуре 23°С, и на 60 сутки – в остальных вариантах. В результате длительной адаптации микробоценозов к фенантрену в течение 75 суток при высокой температуре, произошло селекционирование отдельных культур микроорганизмов в вариантах с БМК ниже устья р. Сунгари, что подтверждает образование крупных слизистых биопленок на дне колб и на частицах фенантрена. Наиболее плотные биопленки образовывал бактериобентос из зоны влияния р. Сунгари в присутствии пептона и 3% NaCl при температуре 23°С. Следовательно, микробоценозы, отобранные ниже устья р. Сунгари имеют адаптационный потенциал развития в условиях поступления большого количества азотсодержащих органических соединений и повышенной минерализацией водной среды, используя при этом принцип иммобилизации к твердым поверхностям. Представители 90 консорциума бактерий с Нижнего Амура слизистые биопленки не образовывали при любой температуре, предпочитая развиваться в прикрепленном состоянии на частицах фенантрена. Показано, что максимальную активность по отношению к фенантрену показали БМК ниже устья р. Сунгари, культивируемые при 23°С. Биодеградация фенантрена сопровождалась изменением цветности модельных систем в результате образования промежуточных продуктов трансформации. Образование цветных интермедиатов фенантрена отмечено уже на 3 сутки в вариантах с бактериобентосом, отобранных ниже устья р. Сунгари, при культивировании в условиях высокой температуры. Низкая температура ингибирует процесс трансформации фенантрена, а также снижает способность БМК образовывать биопленки. Таким образом, экспериментально установлена зависимость формирования биопленок представителями бактериобентоса р. Амур от условий культивирования микробоценозов. Наиболее активно образование биопленок происходит с участием БМК, выделенных из наиболее загрязненных участков реки (в зоне влияния р. Сунгари). На скорость и характер образования биопленок влияет температура: при более высокой температуре быстрее образуются плотные слизистые биопленки, прикрепленные к твердой поверхности. Высокое содержание легкодоступных органических соединений и повышенная минерализация среды способствует формированию биопленок бактериобентосом р. Амур. THE FORMATION OF BIOFILMS IN THE PROCESS OF TRANSFORMATION OF PHENANTHRENE BY BACTERIOBENTHOS FROM AMUR RIVER 1 Morozova O.Y.,1 Litvinenko Z.N.2 Institute of Water and Ecological Problems, FEB RAS, 2 Far Eastern state Transport University, Khabarovsk, Kim Yu-Chen street, 65. e-mail: helga1986@inbox.ru The problem of aquatic ecosystems pollution by different persistent organic compounds is the most actual problem of the modern ecology. Among the pollutants, which have carcinogenic and mutagenic properties, as well as having a tendency to be bioaccumulated, polycyclic aromatic hydrocarbons (PAHs) are considered. Bottom sediments can accumulate the whole complex of chemical substances from the river water, so its should be considered as an integral indicator of water pollution. The aim of our investigation was to determine the relationship between the formation of biofilms and bacterial activity of phenantrene-metabolizing consortium – the representatives of the benthic microbial complexes (BMCs) from Amur River, which we cultured under different temperature conditions and various set of substrates. To study the microbial transformation of persistent organic substances we used benthic microbial complexes, which were selected above and below the estuary of the Songhua River at sites of Amur River and the Lower Amur (near the village of Savinskoe). Bacteriobenthos cultivation was performed on a mineral medium, where phenanthrene was the main source of carbon (100 mg/L), 1% solute of peptone was extra source of carbon. 3% NaCl solution was added to assess the influence of salinity regime. Bacteria were grown at different temperature regimes: 23°C and 2°C during several months. The activity of BMCs was measured on a photoelectric photometer (wavelength 490 nm). It is known, that all microorganisms have the ability to attach to organic and inorganic surfaces in varying degrees. The formation of biofilm on the surface of the substrate is the successful implementation of the adhesion and colonization in the external environment. Obviously, the biofilm is not a structureless homogeneous clumps of cells and slime, but it is a community of surface-associated cells enclosed in the polymer matrix. It consists of polysaccharides, proteins and lipids components. The forming biofilms significantly increase the tolerance of bacteria to toxicants and other negative environmental factors. 91 The first step of the formation of the biofilm on the uninhabited surface is adhesion of the individual bacterial cells on it. In a model experiment with the BMCs from Amur River, adhesion cells was firstly noted in the variants with bacteriobenthos (above and below the estuary of the Songhua River) cultivated at 23°C after 15 days and in other variants after 60 days. Some microbial cultures in variants with BMCs (lower the estuary of Songhua River) been breeding as a result of prolonged adaptation to phenanthrene during 75 days at high temperature. It confirms by the formation of large mucosal biofilms in the bottom of the flask and the particles of phenanthrene. The most dense biofilms were formed by bacteriobenthos from the zone of Songhua River influence in the presence of peptone and 3% NaCl at 23°C. Consequently, the microbial complexes from the site below the estuary Songhua River have adaptive capacity to develop in a conditions with a large amount of incoming nitrogen-containing organic compounds and increased mineralization of the water. The microbial cenoses using the principle of immobilization to a solid surface. Representatives of the Lower Amur bacterial consortium not formed the slimy biofilms at either temperatures, preferring to grow in the attached state on the particles of phenanthrene. The maximum activity was showed by BMCs from the site below the estuary of the Songhua River cultured at 23°C. Biodegradation of phenanthrene was accompanied by a change of the model systems color due to the formation of colored intermediates. Products of the phenanthrene transformation we observed already on third day in versions with bacteriobenthos (selected from the site lower estuary Songhua River) when it cultured at high temperature condition. Low temperature conditions inhibits the transformation of phenanthrene as well as reduces the ability of BMCs to form biofilms. Thus, the experiments have shown that the biofilm formation by representatives bacteriobenthos from Amur River depend of different conditions microbial cenoses culture. The most active formation of biofilms occurs with the participation of BMCs isolated from the most polluted river sites (zone of Songhua River influence). The temperature influence on formation speed and nature of the biofilms: the higher the temperature the faster the formation of dense slimy biofilms attached to a solid surface. The high content of readily available organic compounds and increased mineralization of the water promotes the formation of biofilms by bacteriobenthos from the Amur River. ФУНКЦИОНИРОВАНИЕ БАКТЕРИОПЛАНКТОНА И БАКТЕРИОБЕНТОСА В ВОДОЕМАХ, ЗАГРЯЗНЕННЫХ НЕОРГАНИЧЕСКИМ АЗОТОМ Олейник Г.Н., Старосила Е.В. Институт гидробиологии НАН Украины, пр. Героев Сталинграда, 12, Киев, Украина, 04210 e-mail: jenya_star@ukr.net Увеличение концентрации биогенных веществ (фосфора, неорганического азота) в водных объектах приводит к ускорению их евтрофирования. Трансформация органических и минеральных веществ автохтонного и аллохтонного происхождения протекает в гидроэкосистемах за счет жизнедеятельности организмов планктона и бентоса. Определение закономерностей формирования и функционирования микроорганизмов в условиях антропопрессии необходимо для общей характеристики гидробиоценозов, расшифровки их реакции на изменения абиотических и биотических факторов. Целью проводимых исследований было установить закономерности функционирования бактериопланктона и бактериобентоса в условиях экстремального загрязнения водных объектов неорганическим азотом (Nнеорг). Обработку препаратов для характеристики структурных параметров бактериопланктона и бактериобентоса выполняли, окрашивая препараты соответствующими флуорохромами, используя систему автоматического анализа изображения и программирования MultiScan. Метаболическую активность бактерий определяли in situ цитохимическими методами; анализ структуры бактериопланктона на основании 16S рРНК выполнен методом PCR−DGGE. Деструкцию органического вещества в воде и донных отложениях, а также активность каталазы 92 в донных отложениях определяли общепринятыми методами. Объектом исследования был каскад искусственных водоемов (прудов). В воде пруда, в который поступают подпочвенные воды, загрязненные Nнеорг его концентрация была 97,7−1349,0, в следующем в каскаде пруду ― 54,0–74,4 мг N/дм3. Экстремальная концентрация Nнеорг в водоемах отразилась на функционировании микробоценоза как непосредственно, так и косвенно вследствие общих изменений в экосистеме: слабого развития фотоавтотрофных организмов, связанным с этим недонасыщением воды О2 и преобладания в составе органического вещества биохимически стойких соединений, малочисленного зоопланктона и отсутствия рыбы. Непосредственное действие Nнеорг проявилось в повреждении цитоплазматической мембраны клеток бактериопланктона (доля клеток с неповрежденной мембраной составляла 7%). Изменения в экосистеме исследованных водоемов обусловили снижение содержания в бактериопланктоне клеток с нуклеоидом и реплицированным нуклеоидом, угнетение процессов деструкции органического вещества в воде и донных отложениях, уменьшение активности каталазы и преобладание в илах химического разложения Н2О2. Снижение содержания аммонийного азота в воде экстремально загрязненного пруда со слабым развитием автотрофного звена было связано с активной его ассимиляцией бактериопланктоном, о чем свидетельствует обратная зависимость между концентрацией N−NН4, размерами клеток и биомассой бактерий. Значительную роль бактериопланктона в процессах трансформации Nнеорг и органического вещества в исследованных водоемах подтверждает высокая гетерогенность генетического профиля групп бактерий, в состав которых входят микроорганизмы, принимающие участие в цикле азота и способные разлагать трудно усвояемые органические соединения. Известно, что стратегия метаболизма микроорганизмов определяется генетической стратегией. В бактериопланктоне прудов метаболически активные Rстратеги, относящиеся к группе Cytophaga-Flavobacterium, составляли 60%, а α-Proteobacteria, обладающие низкой активностью характерной для К-стратегов, ― 30% всех идентифицированных секвенций рРНК. Эластичность метаболизма бактериопланктона, его способность адаптироваться к различным условиям существования, проявилось в присутствии высокой доли секвенций рРНК (8−24%), общих для исследованных водоемов, с различной концентрацией Nнеорг. THE FUNCTIONING OF BACTERIOPLANKTON AND BACTERIOBENTHOS IN PONDS, POLLUTED BY INORGANIC NITROGEN Olejnik G.N., Starosyla Iev. V. Institute Hydrobiology, pr. Geroev Stalingrada, 12, Kiev, Ukraine, 04210 e-mail: jenya_star@ukr.net The increasing of biogenic elements (phosphorus, inorganic nitrogen) concentrations in water bodies resulted in acceleration of its eutrophication. The transformation of autochthonous and allochthonous organic and mineral substances is occurred in hydroecosystems through vital activity of planktonic and benthic organisms. The determination of regularities in the formation and functioning of microorganisms in conditions of anthropogenic influence is necessary for the creation of the general characteristic of hydrobiocenosis, decryptions of its reactions on changes in abiotic and biotic factor. The aim of the executed studies was to determine the regularities of the functioning of bacterioplankton and bacteriobenthos in conditions of the extreme contamination of the water bodies by inorganic nitrogen (Ninorg). The processing of preparations for description of structural parameters of bacterioplankton and bacteriobenthos was carried out with application of appropriate fluorescent stains, using system of the automatic analysis of the image and programming MultiScan. The metabolic activity of bacteria was determined by in situ methods; the analysis of the bacterioplankton structure on the basis of 16S rRNA was executed by PCR−DGGE method. The decomposition of organic matter in water and bottom sediments, as well as activity of catalaza in bottom sediments were defined by traditional methods. The object of the investigation was a cascade of artificial water bodies (ponds). 93 In water of the one of these ponds (most polluted), to which entering subsoil water, polluted by Ninorg, its concentration was 97.7−1349.0, in the next in cascade pond ― 54.0−74.4 mg N/l. The extreme concentration of Ninorg in ponds was reflected in functioning of microbiocenosis as directly, so indirectly, as a consequence of the general changes in ecosystem: weak development of photoautotrophic organisms, connected with oxygen deficiency and predominance in composition of organic matter of the biochemically stable substances, non-numerous zooplanktons and absences of fishes. The direct effect of Ninorg was expressed in cell membranes damages of the bacterioplankton (the part of the cells with intact membrane constituted 7%). The changes in ecosystem of investigated ponds caused to the reduction of the contents in bacterioplankton cells with visible nucleoid and replicated nucleoid, oppression of the processes of decomposition of organic matter in water and bottom sediments, reduction to catalaza activity and prevalence in bottom sediments of the chemical decomposition of H2O2. The reduction of the nitrogen ammonium contents in water of extremely polluted pond with weak development of autotrophic biotic elements was connected with active assimilation of this substance by bacterioplankton. That is suggested by negative correlation between concentration of N−NН4, size of the cells and biomass of bacteria. The significant role of bacterioplankton in process of the transformations of Ninorg and organic matter in studied water bodies is confirmed by high heterogeneity of a genetic profile of the bacteria groups, including the microorganisms participated in the nitrogen cycle and capable to degrade hard assimilable organic substances. It is known that strategy of the microorganisms’ metabolism is defined by genetic strategy. In ponds bacterioplankton metabolic active R-strategists, related to Cytophaga-Flavobacterium group, formed 60%, but α-Proteobacteria, possessing low activity typical to К-strategists, ― 30% of all identified sequences of rRNA. The variability of the bacterioplankton’s metabolism, its ability to adapt to different conditions of existence, was reflected in presence of high part of common for investigated water bodies with different concentration Ninorg sequences of rRNA (8−24%). СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА МИКРООРГАНИЗМОВ Р. RHODOCOCCUS И Р. PSEUDOMONAS, ОБРАЗУЮЩИХ БИОСУРФАКТАНТЫ Павлова О.Н., Лихошвай А.В., Федорова Г.А., Шишлянникова Т.А., Букин С.В., Ломакина А.В., Земская Т.И. Учреждение Российской академии наук Лимнологический институт СО РАН e-mail: pavlova@lin.irk.ru Проведен поиск микроорганизмов – потенциальных продуцентов биосурфактантов, изолированных из воды, донных осадков, битумных построек районов естественных нефтепроявлений оз. Байкал. Отработана методика культивирования микроорганизмов для определения способности продуцировать биоПАВ: бактерии, отнесенные к роду Rhodococcus и Pseudomonas, выращивали на средах [Куюкина, 2006] и [Карпенко и др., 2006], соответственно. Для бактерий родов Paenibacillus, Brevibacillus, Micrococcus, Arthrobacter, Novospingobium, Microbacterium, Micromonospora использовали минеральную среду BushnellHaas [1941]. В качестве единственного источника углерода во всех средах использовали 3,0% н-гексадекана (о/о). Образование сурфактантов, способных значительно снижать поверхностное натяжение, выявлено у двух штаммов микроорганизмов, относящихся к р. Rhodococcus и р. Pseudomonas. В лабораторных условиях было установлено, что за 36 суток эксперимента в присутствии штамма Pseudomonas fluorescens (№ 5-05), показавшего положительную ПЦРреакцию на III группу alk генов, окислилось 35% н-алканов нефти с длиной цепи С10-С24. При этом в среде не происходило накопления короткоцепочечных алканов, что дает основание считать, что данный штамм окисляет их до более простых соединений. В то время как штамм Rhodococcus erythropolus (№ 4-08), имеющий также alk гены III группы, по истечению 94 4 суток эксперимента полностью утилизировали н-алканы с длиной цепи C26-C30, накапливая при этом в среде алканы C12-C17, C20 и C22 (увеличение концентрации на 17-129%). По данным различных авторов, микроорганизмы, снижающие поверхностное натяжение культуральных сред более чем на 10мН/м, уже считаются перспективными в качестве продуцентов [Cooper,1986; Willumsen, Karlson, 1997; Самсонова, Макаревич, 2009]. При росте на среде с н-гексадеканом, показатель σ водной эмульсии экстракта биомассы Rhodococcus erythropolus (№ 4-08) достигал значения 35,93 мН/м, таким образом, значение Δσ для этого штамма составляет 27,13 мН/м. Для штамма Pseudomonas fluorescens (5-05) была выявлена способность образовывать не только поверхностно-активные вещества, но и эмульгирующие. Также перспективным для дальнейших исследований является штамм № 208 Rhodococcus globerulus, который обладает слабой поверхностной активностью (снижает поверхностное натяжение на 7,26 мН/м) и выраженной эмульгирующей активностью. Сравнение величин поверхностного натяжения и индексов эмульгирования водных эмульсий экстрактов биомассы бактерий и их супернатантов свидетельствует о том, что у всех исследуемых изолятов как поверхностно-активные, так и эмульгирующие свойства в основном ассоциированы с биомассой бактерий, а не с супернатантом культуральной жидкости. Тем ни менее, показано, что 58% исследованных штаммов обладают эмульгирующей активностью. С помощью световой и эпифлуоресцентной микроскопии изучен характер взаимодействия микроорганизмов с н-гексадеканом. У микроорганизмов, принадлежащих к разным родам и имеющих отличное друг от друга строение клеточной стенки установлено два типа взаимодействия, существенно отличающиеся друг от друга. После четырех суток культивирования грамотрицательных Pseudomonas fluorescens на среде с н-гексадеканом выявлена адгезия микроорганизмов на поверхности углеводородных капель. В то время как грамположительные бактерии Rhodococcus erythropolus обладающие гидрофобной клеточной стенкой, локализуются внутри углеводородных капель. Таким образом, в результате проведенных исследований выявлены активные штаммы микроорганизмов, способные синтезировать биосурфактанты и имеющие в своем геноме alkгены, ответственные за деградацию углеводородов нефти. Работа выполнена при поддержке междисциплинарного интеграционного проекта СО РАН № 27; гранта Президента РФ МК-1901.2010.5; фонда РФФИ, грант № 10-05-00681. COMPARATIVE CHARACTERISTICS OF MICROORGANISMS Р. RHODOCOCCUS AND Р. PSEUDOMONAS FORMING BIOSURFACTANTS Pavlova O.N., Likhoshvay A.V., Fedorova G.A., Shishlyannikov T.A., Bukin S.V., Lomakina A.V., Zemskaya T.I. Limnological Institute SB RAS, Irkutsk Russia e-mail: pavlova@lin.irk.ru Microorganisms, potential producers of biosurfactants, were isolated from the water, bottom sediments, and bitumen mounds in the areas of natural oil seepages of Lake Baikal. Methods of microorganism cultivation were worked out for determining abilities to produce biosurfactants: bacteria referred to Rhodococcus and Pseudomonas were cultivated on media of (Kuyukina, 2006) and (Karpenko et al., 2006), respectively; mineral media Bushnell-Haas was used for bacteria of the genera Paenibacillus, Brevibacillus, Micrococcus, Arthrobacter, Novospingobium, Microbacterium, and Micromonospora. The 3.0% n-hexadecane (о/о) was used in all media as the only source of carbon. Formation of surfactants able to decrease surface tension significantly was revealed in two strains of microorganisms belonging to Rhodococcus and Pseudomonas. It was established that 35% of oil n-alkanes with the chain length C10-C24 was oxidized for 36 days of the experiment in the presence of the strain Pseudomonas fluorescens (No. 5-05) with positive PCR to group III of alk genes. Accumulation of short-chain alkanes did not occur in the medium. There is every reason to 95 think that this strain oxidizes them to simpler compounds. Strain Rhodococcus erythropolus (No. 408) having also alk genes of group III utilized completely n-alkanes with the chain length C26-C30 after 4 days of the experiment accumulating alkanes C12-C17, C20 and C22 in the medium (concentration increased by 17-129%). According to data of different authors, microorganisms decreasing surface tension of culture medium by over 10mH/m are considered as prospective producers (Cooper, 1986; Willumsen, Karlson, 1997; Samsonova, Makarevich, 2009). The value σ of aqueous emulsion of biomass extract Rhodococcus erythropolus (No. 4-08) while growing on the medium with n-hexadecane was 35.93 mH/m. Thus, Δσ for this strain was 27.13 mH/m. Strain Pseudomonas fluorescens (No. 5-05) was able to form not only surfactants but also emulsifying substances. Strain Rhodococcus globerulus (No. 2-08) that possess weak surface activity (reduces surface tension by 7.26 mH/m) and expressed emulsifying activity is also prospective for further studies. Comparison of surface tension values and indices of emulsification of aqueous emulsions of bacterial biomass extracts and their supernatants demonstrates that both surface-active and emulsifying properties in all isolates are associated rather with bacterial biomass than with supernatant of culture liquid. Nevertheless, 58% of strains possess emulsifying activity. Interaction of microorganisms with n-hexadecane was examined with light and epifluorescence microscopy. Microorganisms belonging to different genera and having different structure of the cell wall had two types of interaction differing from each other. Adhesion of microorganisms was detected on the surface of hydrocarbon drops after 4 days of cultivation of gram-negative Pseudomonas fluorescens on the medium with n-hexadecane, whereas gram-positive Rhodococcus erythropolus having hydrophobic cell wall were localized inside hydrocarbon drops. Thus, active strains of microorganisms were revealed being able to synthesize biosurfactants and having alk genes responsible for degradation of hydrocarbons of oil. The work was supported by Interdisciplinary Integration Project SB RAS No. 27, RF President Grant MK 1901.2010.5, ad RFBR Grant No. 10-05-00681. МИКРОБНАЯ ДЕГРАДАЦИЯ СЕРОСОДЕРЖАЩИХ ПОЛЛЮТАНТОВ В СОСТАВЕ ХИМИЧЕСКИ ЗАГРЯЗНЕННЫХ СТОЧНЫХ ВОД Перушкина Е.В., Сироткин А.С., Садыкова З.О., Мубаракшина Л.Ф. ГОУ ВПО «Казанский государственный технологический университет», 420015, РФ, г. Казань, ул. К. Маркса, 68 e-mail: perushkina_elena@mail.ru Основными серосодержащими загрязнениями производственных и хозяйственнобытовых сточных вод являются сульфаты, синтетические поверхностно-активные вещества, а также сульфиды, тиосульфаты, сульфиты и общая сера. Среди указанных соединений наиболее токсичными являются сульфид-ионы: согласно требованиям СанПиН 2.1.4.559-96 предельно допустимая концентрация сероводорода в воде водоемов не должна превышать 0,003 мг/л, а сульфидов – 0,3 мг/л. Содержание сульфидов в сточных водах производств различных отраслей промышленности может варьировать от 5 до 14 мг/л для сточных вод нефтедобывающей промышленности и от 100 до 50000 мг/л для высококонцентрированных сточных вод нефтеперерабатывающих и химических предприятий (Терентьев В.И., 2003). В настоящее время в составе отходов ряда химических производств отмечено накопление органических полисульфидов, которые представляют собой технологические потери и значительно затрудняют процесс традиционной биологической очистки. Поэтому исследование процессов биологической деструкции синтетических полисульфидных поллютантов и токсичных восстановленных соединений серы является одной из первоочередных экологических задач. Необходимо отметить, что в аэробных процессах биологического окисления компонентов производственных сточных вод происходят процессы усвоения, аммонификации и окисления восстановленных соединений серы, в том числе H2S. При этом 96 специфические процессы окисления восстановленных соединений серы осуществляют бесцветные серобактерии, тионовые бактерии, некоторые сероокисляющие бактериигетеротрофы, а также некоторые фототрофные бактерии, переходящие на хемотрофный метаболизм (Терентьев В.И., 2003). Цель научной работы состояла в исследовании процессов биоокисления компонентов сточных вод сероокисляющими микроорганизмами и анализе промежуточных и конечных продуктов окисления соединений серы. Материалы и методы исследований. Объектами исследования служили почвенная ассоциация сероокисляющих микроорганизмов (SA) (Ягафарова Г.Г., 2005) и ассоциации сероокисляющих микроорганизмов EA1, ЕА2 и ЕА3, выделенные авторами из активного ила биологических очистных сооружений ОАО «Казанский завод синтетического каучука». Экспериментальные исследования процессов биологического окисления серусодержащих компонентов сточных вод при развитии ассоциаций сероокисляющих микроорганизмов проводили в условиях периодического культивирования (n=80 об/мин, температура 28 °С), в ходе которого контролировали изменение концентрации субстратов - тиосульфатов и сульфидов, а также продуктов биоокисления - сульфатов и политионатов. Прирост биомассы сероокисляющих микроорганизмов оценивали по изменению содержания белка в культуральной жидкости методом Бредфорд и подсчетом количества клеток методом Коха. В качестве контроля химического окисления восстановленных соединений серы параллельно анализировали их концентрации в среде без внесения микроорганизмов. Полученные результаты. Установлено, что процессы биообезвреживания сточной воды для всех исследуемых ассоциаций идут по пути окисления восстановленных соединений серы до сульфата через промежуточные продукты – политионаты. Известно, что образование политионатов может происходить при окислении тиосульфата, сероводорода и молекулярной серы (Гусев М.В.,1992). Увеличение концентрации продуктов неполного окисления серы в завершающей фазе эксперимента свидетельствует о том, что путь окисления сульфидов сточных вод проходит через образование тиосульфатов и дальнейшего биоокисления тиосульфатов до политионатов. Представители микроорганизмов активного ила (ЕА1 и ЕА2) адаптированы для развития на сточной воде, что сопровождается глубоким окислением восстановленных соединений серы: сульфидов – на 88-90%, тиосульфатов – более чем на 99,9%. Высокое значение экономического коэффициента (Yp/s=1,08) позволило охарактеризовать ЕА2, как ассоциацию, обладающую высокой биоокислительной активностью по утилизации субстратов сточной воды в сульфат. Необходимо отметить, что протекание процессов биоокисления сопровождалось значительным закислением среды культивирования до рН 3,5, что инициировало снижение концентрации микроорганизмов в суспензии. Развитие сероокисляющих микроорганизмов в присутствии нерастворимых компонентов полисульфидного каучука сопровождается биодеградацией полимера на 60 %. Известно, что начальной стадией биотрансформации сераорганических полимеров является микробное окисление серусодержащей части молекулы (Леонтьева С.В.,2006; Szeto S.Y., 1984). В процессе биодеградации полисульфидного каучука происходит высвобождение сульфид-ионов в раствор и их дальнейшее биоокисление (на 96 %). Преобразование молекулы полимера сопровождается окислением групп, содержащих восстановленную серу (–S-S-, -S-H, -C-S-), до сульфоновой группы, затем до политионатов, сульфитов и сульфатов. Результаты настоящего исследования позволяют сделать вывод о высоком биоокислительном потенциале сероокисляющих микроорганизмов в составе смешанных популяций для деградации растворенных серосодержащих соединений, а также нерастворимых полимерных компонентов в составе сточных вод. 97 MICROBIAL DEGRADATION OF CHEMICAL WASTE WATER SULFUR-CONTAINING POLLUTIONS Perushkina E.V., Sirotkin A.S., Sadikova Z.O., Mubarakshina L.F. Kazan state technological university, K. Marx st, 68, Kazan 420015 Russian Federation e-mail: perushkina_elena@mail.ru The biological oxidation process of waste water by sulfur-oxidizing microorganisms with intermediate and final products analysis were investigated in that article. It was shown that in the biological waste water neutralization processes the microbial associations have oxidized the reduced sulfur compounds to sulfate across intermediate products – polythionates. The polythionates formation can take place in oxidizing processes of thiosulfate, hydrogen sulfide and molecular sulfur (Gusev M.V., 1992). In the last experimental phase the intermediate products concentration increase has indicated that the sulfides oxidation goes through thiosulfate formation and its biooxidation to polythionates. The activated sludge microorganisms (EA1 and EA2 associatons) were adapted to growing in the waste water. The sulfide removal efficiency was 88-90%, the thiosulfate – up to 99,9 %. High value of economic coefficient (Yp/s=1,08) allowed to characterize the EA2, as an association with high biooxidizing activity on waste water substrate utilization to sulfate. The biological oxidizing process was followed by high decreasing of cultivation medium up to pH 3,5. It has allowed to microorganisms concentration decrease. The insoluble polysulfide rubber components degradation by sulfur-oxidizing microorganisms was 60%. The first stage of sulfur-organic polymers biotransformation was the microbial oxidation of the sulfur-containing molecule’s part (Leontieva S.V., 2006; Szeto S.Y., 1984). In the polysulfide rubber biodegradation process the sulfide ions have transited into the solution and its removal efficiency was 96%. The reduced sulfur-containing clusters (-S-S-, -S-H, C-S-) of the polymer molecules were oxidized into sulfonic acid clusters, later into polythionates, sulfites and sulfates. The present investigations results have allowed to deduce a high biooxidizing potential of sulfur-oxidizing microorganisms in mixed populations for soluble sulfur-containing pollutions and insoluble polymeric components degradation in waste water treatment. ОЦЕНКА СОСТОЯНИЯ ЭКОСИСТЕМЫ ПО ФУНКЦИОНАЛЬНЫМ ПОКАЗАТЕЛЯМ БАКТЕРИОПЛАНКТОНА КРАСНОЯРСКОГО ВОДОХРАНИЛИЩА Попельницкая И.М. 1, Мучкина Е.Я. 2, Попельницкий В.А. 3 1 ГОУ ВПО «Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого» Министерства здравоохранения и социального развития Р.Ф. 660022, г. Красноярск, ул. Партизана Железняка, дом 1; 2 ФГОУ ВПО «Красноярский государственный аграрный университет», 660049, г. Красноярск, ул. Мира 90; 3 ФГАОУ ВПО «Сибирский федеральный университет» 660041, г. Красноярск, пр. Свободный 79 e-mail: popelnickayairina@mail.ru, emuchkina@yandex.ru Объектом наблюдения являлось крупное глубоководное водохранилище бассейна Верхнего Енисея – (Красноярское), где на протяжении длительного периода изучали структурные и функциональные показатели бактериального сообщества как части планктонной биоты. Проводили многолетние исследования продукционных характеристик и деструкции органического вещества планктона. Специфика водохранилища определяется гидрофизическими параметрами и степенью антропогенной нагрузки. Максимальная глубина 105 м возле плотины, средняя 37- м, максимальная ширина 1,5 км, средняя – 0,5 км. Объем водных масс 73,3 км3. Протяженность 396 км. В ходе становления водохранилища и формирования сообществ экосистемы выделено 3 этапа: I - этап заполнения с периодами 98 наполнения и вспышки развития (1967-1970 гг.); II - этап формирования (1971–1976 гг.) и III - этап стабилизации (1996-2002 гг.) с периодами стабильности (1976-1979); активизации (1990-1995) и устойчивой стабильности.(1996-2002). Cредние значения дыхания III (1) – 16 R R гО2/м2 ( = 2.5 ), на этапе III (2)- 32 гО2/м2 ( = 3.6 ) и в фазе активизации III (3) – 25 гО2/м2 B B R ( = 3.0 ). В стадии активизации наблюдалась наиболее высокая активность дыхания B бактериопланктона. Результаты, проведенных исследований показали, что в связи с увеличением деструкции органического вещества в экосистеме, наблюдается увеличение численности и активации бактериопланктона. Как видно, бактериопланктон адекватно отражает изменения среды и может использоваться как показатель изменения условий среды. ESTIMATION STATE VALUE OF KRASNOYARSK DEEP-RESERVOIR ECOSYSTEM WITH FUNCTIONAL BACTERIOPLANKTON INDEXES I.M. Popelnitskaya1, E.Ya. Muchkina 2, V.A. Popelnitskii 3. Krasnoyarsk State medical university1 ; Krasnoyarsk State Agrarian University2 ; Sibirian Federal University3 e-mail: popelnickayairina@mail.ru, emuchkina@yandex.ru On the base of many-years dynamics of a deep-water reservoir bacterial community the stages of the ecosystem development were revealed. The reservoir and current ecosystem state of reservoir were determined. Analyses of state and evolution of bacterial community during multiyear period of time (1978-2002 years) allowed to expose the stages of the succession process in the water body and to identify current ecosystem state. The specificity of the reservoir is determined by the hydrophysical parameters and the intensity of the anthropogenic influence. The maximum depth of 105 m is localized near the dam, average 73 m. The maximum width is 1.5 km, average – 0.5 km. the whole volume of the water is 73.3 km3. The length is 396 km. Multi-year researches revealed changes in bacterial community as apart of plankton during establishment of the Krasnoyarsk reservoir ecosystem. During general succession throughout thirty two years period of reservoir functioning the bacterial community passed a set of stages. I – stage of reservoir filling (19671970); II – stage of hydrobiological regime establishment (1971-1975); III – stage of stabilization of previously formed hydrobiological regime (1976-2002), where stage of stability (1976-1989); stage of activization (1990-1995); stage of settled stability (1996-2002) are singled out. In the stage III (1) overage bacterial respination was 16 g O2/m2 (R/B = 2,5) in stage III (2) – 32 g O2/m2 (R/B = 3,6) in stage III (3) – 25 O2/m2 (R/B = 3,0) The reaction of bacterial community during this period was expressed in increasing of total number of bacteria or in increasing of number of bacteria forming colonies on fish-peptone agar or in increasing of destraction. Thus, the results of studies show that with an increase in the destruction of the organic matter intensity in the ecosystem the activity of bacterioplankton increase as will. So, bacterial community reflect environmental changes adequately and can be used as indexes of changing environmental conditions. РАЗНООБРАЗИЕ САЛИЦИЛАТГИДРОКСИЛАЗ И ИХ РОЛЬ В БИОДЕГРАДАЦИИ ПАУ Пунтус И.Ф.1, Власова Е.П.2 1 УРАН Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН, 142290 г. Пущино, Московская область, Проспект Науки 5, Россия; 2 ГОУ ВПО Тульский государственный университет, 300600 г. Тула, пр. Ленина, д.92, Россия e-mail: puntus@ibpm.pushchino.ru, simcem@list.ru 99 Добыча нефти является одной из важнейших отраслей промышленности в России. При ежегодной добыче нефти 400 млн тонн, 15 млн тонн в год попадает в окружающую среду в результате потерь при ее транспортировки. Более 75% состава нефти приходится на углеводороды, в которых полициклические ароматические углеводороды являются одними из токсичных. Основную роль в деградации подобных загрязнений играют микроорганизмы. Салицилатгидроксилаза (СГ) является одним из ключевых ферментов деградации полициклических ароматических углеводородов, катализирует декарбоксилирование и одновременное гидроксилирование салицилата в присутствии НАДН, приводящее к образованию катехола. Биохимические исследования салицилатгидроксилаз в последнее десятилетие были дополнены активными генетическими исследованиями. Использование современных молекулярно-генетических методов для изучения генов салицилатгидроксилаз показало большое их разнообразие. В процессе изучения генов салицилатгидроксилаз с использованием ПЦР и ПДРФ-анализа в лаборатории биологии плазмид ИБФМ им. Г.К. Скрябина были выявлены новые типы генов nahG и nahU. Последние исследования показали, что наиболее распространенным геном в штаммах флюоресцирующих псевдомонад является ген СГ гомологичный гену nahG плазмиды pDTG1 штамма Pseudomonas putida 9816-4. Гены салицилатгидроксилаз часто располагаются в составе конъюгативных плазмид. Плазмидная локализация показана для генов nahG и nahU. Для многих салицилатгидроксилаз показана широкая субстратная специфичность. Целью данной работы было выявление различий в каталитических свойствах негомологичных салицилатгидроксилаз NahG и NahU и исследовании их роли в биодеградации ПАУ. Разработанная нами процедура очистки салицилатгидроксилаз включает обработку бесклеточного экстракта стрептомицин-сульфатом, ионообменную хроматографию, гидрофобную хроматографию и гель-фильтрацию. Получены гомогенные препараты негомологичных салицилатгидроксилаз NahG и NahU. Изучены их кинетические и каталитические свойства. Зависимость начальной скорости реакции от концентрации субстрата обрабатывали по уравнению Михаэлиса-Ментен. Показано различие в кинетических свойствах негомологичных салицилатгидроксилаз, что свидетельствует о специфичности взаимодействия «субстрат-фермент». Различия в Км и Vмах исследуемых нами салицилатгидроксилаз свидетельствуют, что ферменты ведут себя по-разному в условиях загрязнения. СГ типа NahG работает при более низких уровнях загрязнения, а при более высоких уровнях включается СГ типа NahU. Исследуемые салицилатгидроксилазы состоят из одной субъединицы, молекулярная масса одинакова и равна 46 и 45 кДа для NahG и NahU. Изучена субстратная специфичность негомологичных салицилатгидроксилаз. Показано, что активность ферментов отличается в зависимости от положения группы заместителя в молекуле субстрата. Активность обоих ферментов по отношению к замещенным салицилатам с пара- положением группы заместителя выше, чем в метаположении. Для фермента NahU выше активность в отношении амино- и хлорзамещенных салицилатов. Активность СГ NahU выше по отношению к салицилатам, имеющим группу заместителя в положении 3, а NahG – выше по отношению к салицилатам, имеющим группу заместителя в положении в положении 5, что свидетельствует о существовании различий в пространственной конфигурации активного центра изучаемых салицилатгидроксилаз. Кроме того, оба фермента выполняют роль 1-гидрокси-2-нафтоатгидроксилаз, однако активность NahU выше в 3 раза. Поскольку показано большее разнообразие гена nahG по сравнению с nahU, можно предположить, что фермент NahU эволюционно возник позднее в результате адаптации бактерий к более высоким уровням загрязнения ПАУ. Наличие генов негомологичных салицилатгидроксилаз на конъюгативных плазмидах приводит к горизонтальному переносу генетического материала внутри микробной популяции, тем самым, расширяя спектр 100 потребляемых субстратов (в том числе хлорированных), что способствует адаптации бактерий к новым условиям загрязнения. Работа выполнена при финансовой поддержке грантов РФФИ № 11-04-90759-моб_ст, № 11-04-97562-р_центр_а. SALYCILATE HYDROXYLASE DIVERSITY AND ITS ROLE IN PAHS BIODEGRADATION Puntus I.F.1, Vlasova E.P.2 G.K. Skryabin Institute of Biochemistry and Physiology of Microorganisms, Russian Academy of Sciences, Prospekt Nauki 5, Pushchino, Moscow Region, 142290 Russia; 2 Tula State University, Prospekt Lenina 92, Tula, 300600 Russia e-mail: puntus@ibpm.pushchino.ru, simcem@list.ru 1 Oil production is among the most important industries in Russia. With annual crude oil production of 400 billion tons 15 billion tons is released into environment as a result of oil transportation. Hydrocarbons are more than 75% of oil composition, with polycyclic aromatic hydrocarbons being toxic. Microorganisms have the basic role in degradation of such pollutions. Salycilate hydroxylase (SH) is a key enzyme of degradation of polycyclic aromatic hydrocarbons, catalyzing decarboxylation and simultaneous hydroxylation of salycilate hydroxylase in the presence of NADH resulting in catechol formation. Last decade biochemical studies of salycilate hydroxylase have been extended by active genetic research. The use of novel molecular-genetic methods for study of salycilate hydroxylase genes has revealed their great diversity. New types of nahG and nahU genes have been discovered in Laboratory of Plasmid Biology of IBPM RAS, using PCR and RFLP-analysis. Recent studies have shown the most distributed gene in fluorescent pseudomonas to be SH one homologous to nahG gene of pDTG1 plasmid of a strain Pseudomonas putida 9816-4. Salycilate hydroxylase genes are often located in conjugative plasmids. Plasmid localization is shown for nahG and nahU genes. A wide substrate specificity for many salycilate hydroxylases is shown. The objective of this work was to reveal differences in catalytic properties of nonhomologous salycilate hydroxylases NahG and NahU and study their role in PAH biodegradation. The clean-up procedure for salycilate hydroxylase developed by the authors includes treatment of cell-free extract with streptomycin sulfate, ion-exchange chromatography, hydrophobic chromatography and gel-filtration. Homogenous preparations of non-homologous salycilate hydroxylases NahG and NahU have been obtained. Their kinetic and catalytic properties have been studied. The dependence of initial reaction rate on the substrate concentration was calculated, using Michaelis-Menten equation. The difference of kinetic properties of hon-homologous salycilate hydroxylases is shown that testifies to the specificity of “substrate-enzyme” interaction. Differences in Km and Vмах of salycilate hydroxylases studied are the evidence of different behavior of enzymes under the pollution conditions. SH of NahG-type works at lower pollution level. At higher levels SH of NahU-type is initiated. Salycilate hydroxylases studied contain one subunit; molecular mass is the similar, 46 and 45 kDa for NahG and NahU, respectively. Substrate specificity of nonhomologous salycilate hydroxylases has been studied. Enzymes activity has been shown to differ, depending on the position of the substituent group in a substrate molecule. The activity of both the enzymes with the respect to substituted salycilate in para-position of the substitute group is higher than for its meta-position. The activity of the enzyme NahU is higher with the respect to amino- and chlorine-substituted salycilate. The activity of SH NahU is higher with the respect to salycilate bearing the substitute group in position 3, the one of NahG – to salycilate bearing the substitute group in position 5 that testifies to the existence of differences in spatial configuration of the active centre of the salycilate hydroxylases studied. Moreover, both the enzymes have a role of 1-hydroxy2-naphthoate hydroxylase, however, NahU activity is significantly higher. 101 Since the higher diversity of nahG in comparison with nahU is shown, we may suggest that the enzyme NahU appeared evolutionary later as a result of bacterial adaptation to higher PAH pollution levels. The presence of non-homologous salycilate hydroxylases into conjugative plasmids results in horizontal transfer of genetic material inside microbial population, widening the spectrum of substrates consumed (including chlorinated ones) and stimulating bacterial adaptation. The work was supported by grants of RFBR № 11-04-90759-mob_st and 11-04-97562r_center_a. ЭКОЛОГИЯ ФОТОТРОФНЫХ СЕРНЫХ БАКТЕРИЙ И ЕЕ СВЯЗЬ С ЛИМНОЛОГИЧЕСКИМИ ХАРАКТЕРИСТИКАМИ В МЕРОМИКТИЧЕСКИХ ОЗЕРАХ ХАКАСИИ (РОССИЯ) Рогозин Д.Ю.,1,2 Зыков В.В.,1,2 Генова С.Н.,3 Дегерменджи А.Г.1 Институт биофизики СО РАН, г. Красноярск, Академгородок 50 стр.50, 2Сибирский Федеральный Университет, г. Красноярск, пр. Свободный 79, 3Институт вычислительного моделирования СО РАН, г. Красноярск, Академгородок 50 стр.50 e-mail: rogozin@ibp.ru 1 Фототрофные серные бактерии являются важным компонентом экосистем меромиктических озер, своего рода «визитной карточкой» этих водоемов. В некоторых стратифицированных водоемах продукция этих организмов составляет существенную долю в круговороте углерода, однако их роль в экосистемах таких озер остается не до конца понятой. Фототрофные серные бактерии осуществляют аноксигенный фотосинтез с использованием восстановленных соединений серы в качестве донора электронов, поэтому развиваются в тех местах, где одновременно присутствуют свет и сульфид. В стратифицированных водоемах такой зоной является хемоклин – граница между аэробными и анаэробными слоями воды. На территории Южной Сибири расположены два солоноватых меромиктических озера – Шира и Шунет (Республика Хакасия). В этих озерах нами изучены видовой состав и вертикальные профили распределения биомасс пурпурных серных бактерий (ПСБ) (Chromatiaceae) и зеленых серных бактерий (ЗСБ) (Chlorobiaceae) во все сезоны года в течение пяти лет. В зоне хемоклина отбор проб осуществлялся с помощью многошприцевого пробоотборника с разрешением 5 см по глубине, что позволило выявить микростратификацию микробного сообщества. А именно, в озере Шунет, характеризующемся резкими градиентами физико-химических условий и относительно неглубоким расположением хемоклина, выявлена аномально плотная популяция ПСБ в виде взвешенного «пурпурного слоя», формирующегося в интервале глубин порядка 5-10 см, и достигающего рекордных значений численностей свыше 108 кл мл-1. Под «пурпурным слоем» формируется плотная популяция ЗСБ. В озере Шира, характеризующемся мене устойчивыми градиентами и более глубоким расположением хемоклина, популяция ПСБ достигает значительно меньшей плотности, а ЗСБ почти отсутствуют. Нами исследована сезонная динамика вышеописанных бактерий, и показано, что зима не является «мертвым сезоном» для данной группы бактерий в обоих озерах. Исследована межгодовая подледная динамика пространственных распределений аноксигенных фототрофных бактерий в обоих озерах, и выявлена ее связь с физико-химическими и метеорологическими факторами. Показано, что биомасса ПСБ в подледный период зависит от освещенности и при благоприятных условиях в озере Шира может превышать летние значения. Освещенность же в водной толще в подледный период зависит от характера снегового покрова на поверхности льда, и сильно варьирует в данной местности для разных зим. Показано, что характер снегового покрова на поверхности льда может быть оценен дистанционно с помощью спутниковых данных, следовательно – возможен непрерывный мониторинг подледной освещенности в исследуемых водоемах. Показано, что в озере Шира зона хемоклина располагается в разные зимы на различных глубинах. Межгодовые вариации расположения 102 зоны хемоклина были адекватно смоделированы с помощью математической модели, и показано, что вышеуказанные вариации определяются метеоусловиями в осенний и зимний период. Освещенность в зоне хемоклина сильно зависит от глубины его расположения. Благодаря снижению биомассы фитопланктона в зимнее время водная толща оз. Шира становится более прозрачной, и при сочетании «высокого» расположения хемоклина (11 м) и малоснежной зимы, количество света, достигающего зоны хемоклина в 2007 г., и как следствие – биомасса ПСБ, превышали все известные летние значения для оз. Шира. В исследуемом нами районе Хакасии озера испытывали значительные изменения уровня на протяжении последнего столетия. В 1900-1920-е годы наблюдалось резкое уменьшение объема оз. Шира, его уровень снижался на 7 метров ниже современного. Затем, в период примерно с 1926 по 1937 произошел подъем озера Шира на 4 м, который совпал с периодом увеличения атмосферных осадков. Аналогичные колебания уровня в этот период испытывали все озера данного региона. При снижении уровня воды увеличивается освещенность в зоне обитания фототрофных серных бактерий, т.е. в хемоклине, что может привести к увеличению продукции фототрофных серных бактерий. С другой стороны, расчеты, сделанные с помощью математической модели, показывают, что при глубине 17-19 м осеннее перемешивание могло захватывать всю водную толщу, т.е. при минимальном уровне, наблюдавшемся около 1930 г., оз. Шира могло переходить в голомиктический режим. Биомасса фототрофных серных бактерий при этом предположительно должна была снижаться или вовсе исчезать, т.к. при перемешивании исчезает сероводород, необходимый этим бактериям в качестве донора электронов при фотосинтезе. Таким образом, остатки фототрофных серных бактерий (ДНК и пигменты), захороненные в донных отложениях оз. Шира, могут служить индикаторами изменений режимов стратификации озера, а следовательно – индикаторами колебаний его уровня при изменениях климата. ECOLOGY OF PHOTOTROPHIC SULFUR BACTERIA RELATED WITH LIMNOLOGICAL CONDITIONS IN MEROMICTIC LAKES OF KHAKASSIA (RUSSIA) Rogozin DY1,2, Zykov VV1,2, Genova SN3, Degermendzhy AG1 1 Institute of Biophysics SD RAS, Krasnoyarsk, Akademgorodok 50, 2Siberian Federal University, Krasnoyarsk, Svobodny 79, 3Institute of Computational Modelling, Krasnoyarsk, Akademgorodok 50 e-mail: rogozin@ibp.ru Meromixis is a condition of persistent chemical stratification in lakes with incomplete mixing over the course of a year. It usually results in anoxia and the accumulation of sulphide in the monimolimnion (deeper water layers up to lake bottom) and reduced vertical mixing. Phototrophic anoxic bacteria may contribute substantially to total primary production in meromictic lakes. These bacteria use sulphide as electron-donors for anoxygenic photosynthesis. Dense accumulations of these bacteria can develop, if light reaches the deep sulphide-containing layers. Although blooms of anoxic photosynthetic bacteria are observed in the pelagial of many lakes and reservoirs, their ecological significance in these systems remains unclear. In vast Asian part of Russia there are only three meromictic lakes described in literature as meromictic. Two of them are Lake Shira and Lake Shunet (Khakassia, South Siberia). The year-to-year variations of vertical distribution and biomass of purple sufur bacteria (PSB) and green sulfur bacteria (GSB) together with profiles of temperature, salinity, oxygen, sulphide and light were studied during 2002-2009 for all seasons including under-ice periods (Rogozin et al., 2005; Rogozin et al., 2009, 2010). 103 In Lake Shunet the pronounced gradient of salinity, relatively “shallow” chemocline position (5 meters depth) and high concentration of sulphide (up to 14 mM) were registered. The anomalously dense population of PSB was registered in chemocline of this lake. The PSB abundance reached 4 ×108 cells ml-1 which is a second value of the world (Rogozin et al., 2005). Only in Lake Mahoney (Canada) the PSB density was a higher (Overmann, 1997). Under the “purple layer” the GSB developed in high abundance. In Lake Shira the salinity gradient is weaker than in Lake Shunet and chemocline position is deeper. Therefore, biomass of PSB is relatively low and GSB are almost absent from this lake. We showed that thickness of mixolimnion in Lake Shira varied from 11 to 16.7 m depending on a year. These variations were simulated by mathematical 1D model of temperature and salinity conditions taking into account ice formation. The simulated profiles generally coincided with the measured ones. We showed that year-to-year variations of air temperatures and winds determine the mixing processes in Lake Shira and year-to-year variations of mixolimnion thickness (Rogozin et al., 2010). Winter biomass of purple sulphur bacteria in the studied meromictic lakes may vary depending on amount of light penetrating into the chemocline through the snow cover and ice on a lake surface. The amount of light reaching deeper layers depends on snow-cover characteristics. The nature of snow cover can be remotely sensed by reflectance of the lake surface. Therefore, the under-ice light conditions can be roughly derived by monitoring of snow cover dynamics in studied lakes (Rogozin et al., 2009). In relatively less strongly stratified Shira Lake the vertical position of chemocline in winter can vary resulting in considerable changes in light conditions of chemocline. Hence, the under-ice light conditions of anoxic phototrophic bacteria depend on chemocline position. Due to increase in transparency of mixolimnion in winter, the combination of shallower chemocline with absence of snow results in higher light intensity in the chemocline of Shira Lake. Therefore, the biomass of purple sulphur bacteria in chemocline of Lake Shira may exceed the summer values under these conditions. Generally, meteorological conditions determine the mixing behavior in Lake Shira, therefore light conditions of phototrophic bacteria in chemocline during under-ice period can be simulated and predicted by model. In the part of Khakasia under study, the water levels of many lakes changed during last century. In 1900-1920s, the level of Lake Shira was 7 m lower than now. After this, during the period 1926 to 1937 the lake level increased by 4 m correspondently to increase of annual precipitation in the region. The levels of other lakes of the region changed in a similar pattern. The decrease of water level results in increase of the light availability resulting to higher PSB production in the lake. From the other hand, when the maximum depth was as low as 17-19 m, the lake Shira could be holomictic as it was demonstrated by mathematic model. During the periods of holomixis the PSB biomass should decrease or completely disappear from the lake because of absence of sulphide. Therefore, the molecular remains of phototrophic sulphur bacteria (DNA and pigments) in sediments of Shira Lake can be considered as a proxy of patterns of stratification, and consequently – as a proxy of water level oscillations imposed by climate oscillations. ПЛАНКТОННОЕ МИКРОБНОЕ СООБЩЕСТВО КРУПНОГО РАВНИННОГО ВОДОХРАНИЛИЩА В ПОДЛЁДНЫЙ ПЕРИОД Романенко А.В., Копылов А.И., Косолапов Д.Б., Заботкина Е.А. Институт биологии внутренних вод им. И.Д. Папанина РАН, 152742 Ярославская обл., пос. Борок, Россия e-mail: roma@ibiw.yaroslavl.ru Исследования проводились в 2008 г. в Рыбинском водохранилище (Верхняя Волга): объем 25.4 км3 , площадь 4550 км2, средняя глубина 5.6м. Продолжительность периода ледостава составляет 155-170 суток. Толщина льда достигает 70 см. Толщина снега на льду составляет 10-50 см. Ассимиляция 14СО2 в результате фотосинтеза подо льдом не зарегистрирована. В течение января-марта исследовали численность, биомассу, функциональные характеристики вирусов, пикоцианобактерий, гетеротрофных бактерий, 104 простейших и вирусов. Установлено неравномерное распределение гетеротрофных бактерий по вертикали подо льдом. Максимальная биомасса гетеротрофных бактерий была обнаружена на границе лед-вода (2-3 см подо льдом) – до 5.5 мг/л. Значительное развитие бактерий непосредственно подо льдом связано со скоплением в этом микрослое большого количества детрита и водорослей Melosira islandica. Зимой 2008 г., величины численности и биомассы бактерий, средние для столба воды, составили, соответственно, 2.2-3.9 млн. кл/мл и 635-904 мг/м3, что было значительно выше таковых величин зарегистрированных в 1988 г. – 1.9-2.2 млн. кл/мл и 269-298 мг/м3. В течение января-марта наблюдалось возрастание размеров клеток бактерий, численности активнодышащих клеток бактерий, удельной скорости роста бактериопланктона. Численность (6-70 кл/мл) и биомасса (0.8-9.5 мг/м3) пикоцианобактерий в зимний период были существенно ниже, чем летом. Однако, их вклад в общую биомассу фитопланктона в феврале-марте (25%) был выше, чем в мае-октябре (обычно ниже 10%). Зимой 2008 г. простейшие были представлены, в основном, гетеротрофными нанофлагеллятами (32-253 кл/мл и 1.2-16.6 мг/м3). Амебы и инфузории присутствовали в значительно меньших количествах. Скорость осветления воды бесцветными жгутиконосцами составила 1.2-1.5 нл/(экз × час). В разных участках водохранилища гетеротрофные нанофлагелляты потребляли от 0.7 до 14.0% (в среднем 5.0%) суточной бактериальной продукции. В подлёдный период обнаружена высокая численность планктонных вирусов (39-84 млн. частиц/мл). Доля инфицированных клеток гетеротрофных бактерий в общей численности бактериопланктона колебалась от 4 до 30%, а вирус-индуцированная смертность бактерий – от 5 до 55% (в среднем 17%) суточной продукции бактерий. Доля инфицированных клеток пикоцианобактерий изменялась в пределах 4-40% (в среднем 16%) от их общей численности. Структура планктонного сообщества водохранилища в подлёдный период и в вегетационный период значительно отличались. В мае-октябре основным компонентом планктона был фитопланктон, в январе-марте – гетеротрофный бактериопланктон. Доля микробного сообщества зимой составила 90%, летом – около 40% от суммарной биомассы планктона. Анализ потоков углерода в пелагической трофической сети водохранилища показал большое значение гетеротрофных микроорганизмов в функционировании планктонного сообщества в подледный период. PLANKTONIC MICROBIAL COMMUNITY OF A LARGE FLATLAND RESERVOIR DURING THE PERIOD OF ICE COVER. Romanenko A.V., Kopylov A.I., Kosolapov D.B., Zabotkina E.A. Papanin Institute for Biology of Inland Waters RAS, 152742 Yaroslavl, Borok, Russia e-mail: roma@ibiw.yaroslavl.ru This study was conducted in 2008 in Rybinsk Reservoir (the Upper Volga): capacity 25.4 km3, area 4550 km3, average depth 5.6 m. The duration of ice period is 155-170 days. Ice thickness makes up to 70 cm. The depth of snow over ice ranges from 10 to 50 cm. No assimilation of 14CO2 as a result of under ice photosynthesis is recorded. The number, biomass, functional characteristics of viruses, picocyanobacteria, heterotrophic bacteria, protozoa and viruses were being investigated from January through March. An uneven vertical distribution of heterotrophic bacteria under ice was recorded. The maximal biomass of heterotrophic bacteria was found at the ice-water boundary (2-3 cm under ice) – up to 5.5 mg/l. A significant development of bacteria under ice is associated with the accumulation of large amounts of detritus and Melosira islandica algae in this microlayer. In winter of 2008, the values of bacteria number and biomass, average for the water column, amounted to 2.2-3.9 million cells/ml and 635-904 mg/m3 correspondingly that was considerably higher the values recorded in 1988 – 1.9-2.2 million cells/ml and 269-298 mg/m3. In January105 March, increases in bacterial cells size, the number of actively respiring cells of bacteria and specific growth rate of bacterioplankton were observed. The number (6-70 cells/ml) and biomass (0.8-9.5 mg/m3) of picocyanobacteria in winter period was significantly lower than in summer time. However, their contribution to the total biomass of phytoplankton was greater in February-March (25%) than in May-October (usually below 10%). In winter, 2008, protozoa were mainly represented by heterotrophic nanoflagellates (32-253 cells/ml and 1.2-16.6 mg/m3). Amoebas and infusoria were present in much smaller quantities. The rate of water clarification by colorless flagellates ranged from 1.2 to 1.5 nl/(cells hr). In different parts of the reservoir, heterotrophic nanoflagellates consumed from 0.7 up to 14.0% (5.0% on average) of the daily bacterioplankton production. A high abundance of planktonic viruses (39-84 million particles/ml) was recorded during the ice period. The percentage of infected cells of heterotrophic bacteria ranged from 4 to 30% of the total bacterioplankton number, and virus induced mortality of bacteria – from 5 to 55% (17% on average) of the bacterial daily production. Infected picocyanobacteria cells accounted for 4-40% (16% on average) of their total number. The structure of the reservoir’s planktonic community in the ice and vegetation periods differed considerably. In May-October, phytoplankton was the main component of the community, in January-March – heterotrophic bacterioplankton. In winter, microbial community accounted for 90% of the total plankton biomass, in summer – about 40%. The analysis of carbon flows in pelagic trophic web of the reservoir has shown that heterotrophic microorganisms play an important role in the functioning of planktonic community during the ice period. ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА КЛЕТОК РОДОКОККОВ НА ГРАНИЦЕ РАЗДЕЛА ФАЗ УГЛЕВОДОРОД-ВОДА Рубцова Е.В.,1 Куюкина М.С.,1, 2 Ившина И.Б.,1, 2 Казаков А.С.,1 Макарихин И.Ю.1 1 Пермский государственный университет, г. Пермь, ул. Букирева, 15, Россия; 2 Институт экологии и генетики микроорганизмов УрО РАН, г. Пермь, ул. Голева, 13, Россия e-mail: Rev85@rambler.ru Актинобактерии рода Rhodococcus – одна из наиболее перспективных в биотехнологии групп микроорганизмов благодаря наличию полифункциональных оксигеназных ферментных комплексов и способности к окислительной трансформации широкого спектра природных и антропогенных углеводородов. Реализация биотехнологического потенциала родококков предусматривает всестороннее изучение механизмов их адгезии к гидрофобным соединениям, а также физико-химических факторов, регулирующих данный процесс. В связи с этим, цель настоящей работы – изучение термодинамических параметров процесса адгезии клеток родококков на границе раздела фаз углеводород-вода. В работе использовали чистую культуру Rhodococcus ruber ИЭГМ 231 из Региональной профилированной коллекции алканотрофных микроорганизмов (акроним ИЭГМ; номер во Всемирной Федерации коллекций культур 768, www.iegm.ru/iegmcol/strains/index.html). Термодинамические свойства клеток родококков в двухфазной системе изучали с помощью автоматического тензиометра Sigma 701 (KSV Instruments Inc, Финляндия) методом отрыва кольца (Дю Нуи). Определяли значения поверхностного и межфазного натяжения различных концентраций суспензии клеток (ОП600нм=0,25 0,5; 0,75; 1,0; 1,50; 2,0 и 2,25) в системе вода-воздух и вода-н-гексадекан в изотермических (25°С) условиях. В качестве контроля использовали систему вода-нгексадекан без добавления клеток. На основании полученных значений поверхностного и межфазного натяжения суспензии рассчитывали свободную энергию и работу адгезии, общую энергию межфазного взаимодействия. Установлено, что клетки R. ruber ИЭГМ 231 проявляют выраженную (96-98%) адгезивную активность в отношении н-гексадекана, что свидетельствует о высокой гидрофобности их клеточной стенки. При исследовании 106 термодинамических свойств клеток родококков на границе раздела фаз нами показана четкая зависимость их межфазной (r=-0,9872 при р=0,0002) активности от используемой клеточной концентрации. Так, при сравнительно невысоких (ОП600нм<1,0) концентрациях клеточной суспензии увеличение количества клеток сопровождается постепенным понижением показателя межфазного натяжения на 3-6 мН/м. При дальнейшем увеличении концентрации (ОП600нм≥1,5) бактериальных клеток происходит резкое (на 15 мН/м) снижение значений межфазного натяжения до постоянной (28-29 мН/м) величины, что объясняется насыщением межфазного слоя клетками родококков. При анализе динамики межфазного натяжения в зависимости от концентрации клеток, установлено, что в контрольной системе и при относительно невысоких (ОП600нм<1,0) концентрациях клеточной суспензии наблюдается значительное (на 1-4 мН/м) снижение показателей межфазного натяжения особенно интенсивно в течение первого часа взаимодействия фаз, что, предположительно, связано с участием диффузионных молекулярных переходов между водной и гидрофобной фазами. В то время как при использовании более концентрированных (ОП600нм>1,5) суспензий плотная упаковка клеток родококков в межфазном слое препятствует процессу диффузии молекул углеводорода в водную среду. По-видимому, при достижении пороговой (ОП600нм=1,5) концентрации клеток на границе раздела фаз происходит образование межклеточных контактов и инициация формирования бактериальной биопленки. Выявленный факт подтверждается расчетом термодинамических показателей адгезионного процесса родококков на границе раздела фаз, свидетельствующих о скачкообразном возрастании значений работы адгезии, резком снижении показателей свободной энергии адгезии и величины полной межфазной энергии, что характерно для предельной сорбции бактериальных клеток в межфазном слое. Полученные данные могут быть использованы для регуляции роста бактериальных биопленок в жидких гетерофазных системах. Исследование выполнено при поддержке гранта Президента РФ “Ведущие научные школы” НШ64403.2010.4 и Программы Президиума РАН “Молекулярная и клеточная биология”. THERMODYNAMIC PROPERTIES OF RHODOCOCCUS CELLS AT THE HYDROCARBON-WATER INTERFACE 1 Rubtsova E.V.,1 Kuyukina M.S.,1,2 Ivshina I.B.,1, 2 Kazakov A.S.,1 Makarikhin I.Yu.1 Perm State University, 15 Bukirev Str., Perm,, Russia; 2 Institute of Ecology and Genetics of Microorganisms UB RAS, 13 Golev Str., Perm, Russia e-mail: Rev85@rambler.ru Actinobacteria of the genus Rhodococcus are one of the most promising for biotechnology groups of microorganisms due to the presence of polyfunctional oxygenaze enzyme complexes and oxidative transformation of broad natural and anthropogenic hydrocarbon substrates. An application of the biotechnological potential of rhodococci requires the comprehensive study of their adhesion to hydrophobic compounds, as well as physical and chemical factors regulating this process. The present study is aimed to elucidate thermodynamic parameters of Rhodococcus cell adhesion at the interface of hydrocarbon-water system. We used a strain Rhodococcus ruber IEGM 231 from the Regional Specialized Collection of Alkanotrophic Microorganisms, acronym IEGM, Perm, Russia (WFCC # 768, www.iegm.ru/iegmcol/strains/index.html). Thermodynamic properties of Rhodococcus cells in two-phase system were studied using Du Nouy Ring automatic tensiometer Sigma 701 (KSV Instruments Inc. Finland). The surface and interfacial tensions at different cell suspension concentrations (OD600nm = 0.25, 0.5, 0.75, 1.0, 1.5, 2.0 and 2.25) in the air-water and water-hexadecane systems were measured under isothermal (25°C) conditions. The waterhexadecane system without bacterial cells was used as a control. Based on surface and interfacial tension values of cell suspensions, the adhesion free energy and work, as well as the total interfacial interaction energy were calculated. It was found that rhodococcal cells possess high (96-98%) adhesive activity towards hexadecane, indicating their cell wall hydrophobicity. Examination of the 107 thermodynamic properties of Rhodococcus cells at the interface revealed strong correlation (r =0.987. p=0.0002) between the interfacial activity and cell concentration. Thus, at relatively low (OD600nm<1.0) concentrations of the cell suspension, the increase in cell numbers is accompanied by a gradual decrease (by 3-6 mN/m) of the interfacial tension. A further increase of bacterial cell concentration (OD600nm≥1.5) leads to a sharp (15 mN/m) reduction in interfacial tension to a constant value (28-29 mN/m) due to saturation of the interfacial layer with Rhodococcus cells. Analyzing the dynamics of interfacial tension, it has been shown that in the control system and at relatively low (OD600nm<1.0) cell concentrations, there is a significant (up to 1-4 mN/m) decline in the interfacial tension curves, particularly during the first hour of the experiment, due to diffusion processes between the aqueous and hydrophobic phases. In more concentrated (OD600nm>1.5) suspensions, the dense “packing” of rhodococcal cells in the interfacial layer hinders the diffusion of hydrocarbon molecules to the water phase. Apparently, the threshold (OD600nm=1.5) cell concentration achieved at the interface leads to the formation of intercellular interactions and allows the bacterial biofilm formation. This phenomenon was confirmed by the calculations of the thermodynamic parameters, indicating a sharp increase in the work of adhesion, dramatic reductions of the adhesion free energy and total interfacial energy, which suggest the maximal sorption of bacterial cells in the interfacial layer. The data obtained can be used for regulation of bacterial biofilms in two-phase liquid systems. The study was supported by the Russian Federation President Program "Leading Scientific Schools, grant NS-64403.2010.4 and the RAS Presidium Program "Molecular and Cellular Biology”. ИССЛЕДОВАНИЕ РАСПРОСТРАНЕНИЯ НЕФТЕОКИСЛЯЮЩИХ МИКРООРГАНИЗМОВ ВДОЛЬ АЗЕРБАЙДЖАНСКОГО ПОБЕРЕЖЬЯ КАСПИЙСКОГО МОРЯ С ИСПОЛЬЗОВАНИЕМ ГИС-ТЕХНОЛОГИЙ Салманов М.А.1, Байрамов Р.В.2, Велиев М.Г.3, Алиева С.Р.1 Институт Микробиологии НАН Азербайджана, Баку, Патамдарское шоссе, 40, Азербайджан; 2Бакинский Государственный Университет, AZ-1148, 23, З. Халилов, Баку, Азербайджан; 3Институт Полимерных Материалов НАНА, 124 С.Вургун, AZ 5004, Сумгаит, Азербайджан e-mail: saida_bio@mail.ru 1 Картографирование биологических объектов, как метод, отображающий их пространственное размещение, сочетание и их взаимосвязь на Каспийском море, находится только на ранних этапах. Важное значение имеет картографирование в прибрежных районах на Каспийском море и в частности у побережья Абшерона. Выбор предполагаемых экспериментальных станций, для изучения микроорганизмов проводился с помощью ГИС технологий. До предварительного выезда на экспериментальные станции были определены координаты с геопривязанных космических снимков и существующих мелкомасштабных карт, что дало возможность оптимально ускорить процесс нахождения планируемых станций отбора проб. Для выбора станций на космических снимках с целью отбора проб, были измерены географические координаты выбранных экспериментальных прибрежных участков Абшерона. В качестве базового материала для ГИС–визуализации использовались космические снимки «Ландсат». Точки измерялись с помощью портативной Глобальной Системы Позиционирования (GPS) «Гармин». Определенные на месте координаты измерены в географической координатной системе и преобразованы в универсальную поперечную цилиндрическую проекцию системы Меркатора, а затем наложены на космические снимки для визуального отображения и анализа исследованных участков с использованием Arc GIS 9.1. Для определения нефтяного загрязнения у Абшеронского полуострова Каспийского моря использовались результаты, проведенного нами хроматографического анализа, а также свежие литературные данные. Материалом для микробиологических исследований 108 послужили пробы воды и грунта, а также погруженные в воду водоросли-макрофиты, скелетонизированные листья высших растений, отобранные с 7 участков. На основе проведенных исследований с целью анализа наличия связи между родовым составом микроорганизмов и степенью нефтяного загрязнения было составлено одно ортофотоизображение, на которое наносились условные обозначения, полученные на основе анализа наших данных о наличии и составе микроорганизмов. Совмещение точек отбора проб и данных о нефтяном загрязнении показало, что точки обилия состава грибов и бактерий совпадают с точками сравнительно чистых станций, и напротив, на загрязненных станциях состав грибов был скудным. Установлено, что выделенные микроорганизмы распределялись вдоль Абшеронского полуострова Каспийского моря неравномерно. Несомненно, что это связано с составом воды, наличием стоков и составом самих стоков. Отмечены роды грибов и бактерий, представители которых встречались на всех исследованных участках. Показано, что состав грибов и бактерий на участках со значительным нефтяным загрязнением был беден и включал в основном грибы четырех родов (Acremonium, Aspergillus, Mucor, Penicillium) и бактерии (Bacillus, Micrococcus, Acinetobacter, Aeromonas), при этом их процент был ниже сравнительно с участками, где содержание нефти и нефтепродуктов было минимальным. В результате проведенных исследований было показано, что такая группа деструкторов органического вещества, как грибы, так и бактерии широко распространены в прибрежной зоне Абшеронского полуострова Каспийского моря, участвуя в самоочищении морской воды. Таким образом, применение ГИС технологий является перспективной методикой, дающей возможность более точного определения станций отбора проб и обуславливающей получение конкретных данных о распределении микроорганизмов у морского побережья. STUDY OF OIL-OXIDIZING MICROORGANISMS’ DISTRIBUTION ALONG AZERBAIJAN COAST OF CASPIAN SEA BY USAGE OF GISTECHNOLOGIES Salmanov M.A.1, Bayramov R.V.2, Veliyev M.G.3, Aliyeva S.R.1 Microbiology Institute of ANAS, AZ 1073 Patamdart ave. 40, Baku, Azerbaijan; 2Baku State University, AZ-1148, 23, Z.Khalilov str., Baku, Azerbaijan; 3Institute of Polymer Materials of ANAS, 124 S.Vurgun St, AZ 5004 Sumgait, Azerbaijan e-mail: saida_bio@mail.ru 1 Mapping of biological objects as a method of displaying of their spatial placing, the combination and their interrelation on Caspian Sea nowadays is on the early stage. The great value has mapping of coastal areas of Caspian Sea and in particular at Absheron peninsula. The choice of prospective experimental stations, for studying of microorganisms was conducted by using of GIStechnologies. Before sampling on experimental stations coordinates from the geo-adhered space pictures and existing small-scale charts that providing the chance to increase the optimum process of a finding of planned stations of sampling have been defined. For a choice of stations in space pictures for the purpose of sampling, geographical coordinates of the chosen experimental coastal areas of Absheron was measured. As a base material for GIS-visualization space pictures of "Landsat" were used. Points were measured by usage of portable GPS-"Garmin". The coordinates defined on a place are measured in geographical coordinate system and transformed to the universal cross-section cylindrical projection of system Mercator, and then imposed on space pictures for visual display and the analysis of the investigated sites with using of Arc GIS 9.1. For definition of oil pollution level in the water of Caspian Sea Absheron Peninsula, the chromatographically analysis were implemented, and also the fresh literary data were used. As a material for microbiological researches water and samples, seaweed-macrophyte, leaves were selected from 7 coastal zones. Based on the conducted researches with the objectives to analyze availability of relation between consistency of microorganisms and oil pollution degree it was compiled two ortho109 photo images. The combination of these ortho-photo images showed that points of abundance of fungi and bacteria consistency completely coincides with the points of comparatively clean stations. It was established that the collected microorganisms were distributed along Absheron Peninsula of Caspian sea irregular. Apparent, that this is connected with water structure, presence of discharges and their consistency. It was defined genera of fungi and bacteria which collected from water of all investigated sites. It’s shown that the structure of fungi and bacteria on sites with considerable oil pollution was poor and included basically fungi from four genera: Acremonium, Aspergillus, Mucor, Penicillium and following bacteria genera: Bacillus, Micrococcus, Acinetobacter, Aeromonas, thus their percent was lower in compare with sites where the maintenance of oil and oil products was minimal. As a result of conducted researches it was shown that such group of oildestructor, both fungi, and bacteria widespread in a coastal zone of Absheron peninsula of Caspian Sea, participating in self-cleaning of sea water. Thus, application of GIS technologies is the perspective technique, giving the chance for more accurate definition of stations of sampling and helping with obtain of correct data about distribution of microorganisms at sea coast. ПРИЧИНЫ И ЭКОЛОГИЧЕСКИЕ ПОСЛЕДСТВИЯ ЭВТРОФИРОВАНИЯ В КАСПИЙСКОМ МОРЕ Салманов М.А., Гусейнов А.Т., Алиева С.Р. Институт Микробиологии НАНА, AZ 1073, Баку, Патамдарское шоссе, 40, Азербайджан e-mail: anarxezer@mail.ru Кызылагачский залив имеет исключительно важное значение для рыбного хозяйства Каспийского моря. Из-за прекращения гидромелиоративных работ и нарушения водного баланса с 80-х годов прошлого века зарастаемость залива интенсифицируется из года в год,и в настоящее время более 70% его зеркала занято растителъностъю, которая вегетатирует с марта по ноябръ-декабрь месяцы со средней биомассой до 27-30 кг/м2. Водоем в настоящее время стал мелководным, типично дистрофным с гумифицированной водой, соленость которой в летние месяцы приравнивается почти к морской, когда с одной стороны отсутствуют притоки речных вод, с другой – происходит нтенсивное испарение воды в нем. Планомерно изучены продукционно-деструкционные процессы в Кызылагачском заливе, играющий незаменимую роль в общей биологической продуктивности Каспийского моря в контексте влиянии комплексных антропогенных факторов на функционирование экосистемы водоема. В сезонном аспекте изучены микробиологический режим воды и донных отложений, первичная продукция фотосинтеза фитопланктона с помощью радиоуглеродного метода (С14), величины деструкции органического вещества и впервые рассчитан баланс органического вещества как в Малом (пресноводный), так и Большом (морской) Кызылагачском заливах. Установлено, что отсутствие гидромелиоративных работ и стока рек стало главной причиной минерализации вод Малого залива, его обмеления, отрастания высшей водной растительностью более 50% площади водоема. В нем идут процессы заболачивания, в грунтах и в придонных слоях воды из года в год интенсифицируются анаэробные процессы, летом возникают заморы и происходит массовая гибель бентоса, рыб. Общее число микроорганизмов в среднем за год изменяется по сезонам и составляет 5 (зима) - 15 (осень) млн/мл а сапрофитные бактерии - 2-4,8 тыс/мл. В период замора сильно сокращается количество вегетативных аэробных форм сапрофитов. Величина первичной продукции в нем за год изменяется составляет 1500 гС/м2. В Большом заливе эти показатели равны 2-6 млн/мл и 1000 гС/м2 соответственно. В большом заливе антропогенное эвтрофирование связано с влиянием аллохтонного вещества местных рек и стоком р. Куры. Кислородный режим здесь, в отличие от такового Малого залива не является критичный, чему способствуют волнение, циркуляция вод и связь с Каспием. Было показано, что интенсивность продукционно-деструкционных процессов тесно связано с гидрологическим, солевым и газовым режимами водоема. Антропогенное эвтрофирование стало главной причиной возникновения гипоксии – анаэробиоза в Малом заливе. 110 THE REASONS AND ECOLOGICAL CONSEQUENCES OF EUTROPHICATION IN CASPIAN SEA Salmanov M.A., Huseynov A.T., Aliyeva S.R. Microbiology Institute of ANAS, AZ 1073 Patamdart ave 40., Baku, Azerbaijan e-mail: anarxezer@mail.ru The Khizilagach gulf has all-important value for fish resources of Caspian Sea. Because of the termination of hydro-meliorative works and water imbalance since 80th years of the last century overgrowing of gulf is intensified from year to year, and now more than 70 % of its are occupied by plants, which growth from March till November - December with an average biomass up to 27-30 kg/m2. The reservoir became now shallow, is typical dystrophic with humified water which salinity in summer months is equated almost to sea when on the one hand there are no inflows of river waters, and another – occurs intensive water evaporation. Productive and destructive processes in Khizilagach gulf attaching an important role to the total biological productivity of Caspian in the context of influence to the complex anthropogenous factors in the functioning of reservoir ecosystem is systematically studied. Microbiological regime of water and bottom sediments, preliminary production of photosynthesis of phytoplankton by the help of radiocarbonous method, quantity of destruction of organic matter are studied and for the first time the balance of organic matter in the Little (freshwater), as well as in Big Khizilagach gulf has been calculated in the seasonal aspect. It became clear that the absence of irrigation work and rivers’ sewage waters have become the main reason of mineralization of the Little gulf waters, its shallowing, grow of water with 50% that consists more than the reservoir square. Pooling processes in it are going on, in the ground and bottom stratums of water anaerobic processes are intensified year by year, freezing processes and massive death of benthos and fish in summer takes place. The average amount of microorganisms in a year according to the seasons consists 5 (winter)-15 (autumn) mln/ml, but saprophytic bacteria-2 - 4,8 th/ml. In the freezing period the amount of vegetative aerobic saprophytic forms are seriously decreased. Quantity of preliminary production in it in a year is changed and consists 1500g C/m2. In the Big gulf these indexes are accordingly equal to 2-6 mln/ml and 1000g C/m2. In the Big gulf anthropogenous eutrophication is connected with the influence of allochthonic origin matter of local rivers and Khur river stream. Hydrogenous regime here differing from such a little gulf is not critical, the reason of which is waving and circulation of water and its relation with Caspian. It’s revealed that intensity of production-destruction processes is closely connected with hydrological, salt and gas regimes of water reservoirs. Anthropogenesis eutrophication has become the main reason of origin of hypoxia-anaerobiosis in small gulf. ОСОБЕННОСТИ РАЗРАБОТКИ И ИСПОЛЬЗОВАНИЯ ПЦР-АНАЛИЗА ДЛЯ ИНДИКАЦИИ ЛЕПТОСПИР В ОБЪЕКТАХ ОКРУЖАЮЩЕЙ СРЕДЫ Самсонова А.П., Петров Е.М. Федеральное государственное бюджетное учреждение "Научно-исследовательский институт эпидемиологии и микробиологии им. почетного академика Н.Ф. Гамалеи" Министерства здравоохранения и социального развития Российской Федерации, 123098, г. Москва, ул. Гамалеи, 18, Россия e-mail: lepto@gamaleya.org В современных условиях при решении проблемы обеспечения населения питьевой и хозяйственно-бытовой водой нормативного качества и в достаточном количестве доминирующий характер приобретает необходимость мероприятий, направленных на обеспечение биобезопасности. Одним из составляющих этого является разработка 111 современных методов микробиологического мониторинга водоемов с целью индикации возбудителей инфекционных болезней и прогноза эпидемиологической ситуации. Как известно, в объектах окружающей среды возбудители инфекционных болезней составляют ничтожную долю от всех живущих там микроорганизмов (в отличии от органов и тканей больных людей и животных), многие из которых используемыми в настоящее время методами не выявляются. Кроме того, многие возбудители содержатся в объектах окружающей среды в концентрациях, на несколько порядков меньших, чем в биологических и клинических материалах и в других формах (покоящиеся и некультивируемые). Поэтому важное значение имеет использование современных молекулярно-генетических методов, в том числе полимеразной цепной реакции (ПЦР), которые, благодаря своей высокой аналитической чувствительности и специфичности, позволяют повысить эффективность диагностики. При наличии в пробах смеси микроорганизмов, особенно близкородственных, может наблюдаться явление интерференции, которое в даннном случае заключается в сниженном выходе продуктов ПЦР (Самсонова А.П. с соавт., 1996, Rosner A., Maslenin L., 2005). В современных условиях необходимо учитывать ухудшение экологической ситуации во многих регионах России, так и в мире, так как наличие в объектах окружающей среды ряда химических веществ (соединения фенола, поверхностно-активные вещества) в высоких концентрациях может искажать результаты анализа (Gelfand, White, 1990, Greenfield L., White T.J., 1993). Тем не менее, судя по данным литературы, при разработке различных тестсистем, в том числе и ПЦР-тест-систем, эти моменты не учитываются. Одни и те же тестсистемы без проведения соответствующих испытаний предлагается использовать для индикации возбудителей как в клинических материалах, так и в объектах окружающей среды. Потенциально это может привести к диагностическим ошибкам. Возбудителями лептоспирозов являются спирохеты рода Leptospira номенклатурного вида L. interrogans sensu lato, а L. biflexa s.l. - сапрофиты. Основной путь распространения патогенных лептоспир - водный. Представители ряда сероваров, например grippotyphosa, могут длительно переживать в объектах внешней среды (вода, почва). Поэтому использование молекулярно-генетических методов, в частности ПЦР-индикации лептоспир в водоемах имеет важное эпидемиологическое и профилактическое значение. Целью нашей работы является исследование влияния интерференции патогенных и сапрофитических лептоспир и химических загрязнителей окружающей среды на результаты индикации лептоспир в водных объектах методом ПЦР. Для создания модельных систем использовали штаммы М20 (геномовид L. interrogans серогруппа Icterohaemorrhagiae серовар copenhageni), Moskva V (геномовид L. kirschneri серогруппа Grippotyphosa серовар grippotyphosa) и Patoc (геномовид L. biflexa серогруппа Semaranga серовар patoc), выращенные в жидкой среде. Полученные суспезии культур разводили деионизованной водой или раствором "загрязнителя" до концентрации 10^3 клеток в 1 мкл. Для исследования интерференции между патогенными и сапрофитическими лептоспирами проводили сравнение результатов ПЦР в моно- и смешанных культурах. Для моделирования загрязнения проб воды использовали фенол, насыщенный 0,1 М трис (рН 7,0), в разведениях от 1/100 до 1/100000 и водный раствор стирального порошка "Лотос" в концентрациях от 1% до 0,001%. Все пробы кипятили на водяной бане 15 минут и использовали для постановки ПЦР. Использовали 3 ПЦР-тест-системы, разработанные в нашей лаборатории, протокол постановки реакции и регистрации результатов описаны нами ранее (Самсонова А.П. с соавт., 1994, 1996, 2006, 2008). Показано, что результаты ПЦР не зависят от присутствия в пробах с патогенными лептоспирами М20 и Moskva V сапрофита Patoc (соотношение концентраций патоген/сапрофит от 1:1 до 1:100), т.е. интерференции между ними при проведении ПЦР не наблюдается. Показано, что положительные результаты ПЦР наблюдаются в присутствии в пробах загрязнителей в диапазонах соответственно: фенол - разведения 1/100- 1/1000, стиральный порошок "Лотос" - 0,1-1% во всех исследованных тест-системах. 112 Таким образом, на модельных системах подтверждено, что разработанные нами ПЦРтест-системы могут быть использованы для индикации патогенных лептоспир в пробах воды в условиях наличия родственных сапрофитических культур. Тем не менее, требуется проведение дальнейших исследований на более представительных выборках и реальных проб из объектов окружающей среды. Полезными являются разработки мультилокусных тест-систем индикации лептоспир и систем MLTS. PECULIARITIES OF DEVELOPMENT AND USE OF PCR- ANALYSIS FOR LEPTOSPIRES INDICATION IN ENVIRONMENTS Samsonova A.P., Petrov E.M. Федеральное государственное бюджетное учреждение "Научно-исследовательский институт эпидемиологии и микробиологии им. почетного академика Н.Ф. Гамалеи" Министерства здравоохранения и социального развития Российской Федерации, 123098, г. Москва, ул. Гамалеи, 18, Россия e-mail: lepto@gamaleya.org In modern conditions the problem of biosafety drinking and housekeeping water is one of important. One part of this is development of modern methods of microbiology monitoring of water objects to indication pathogens and epidemiological situation prognosis. It is known, in environments pathogens are insignificant part of all microorganisms (distinguishing from patients and animal tissues), most of them cannot indicate with help of known methods. Most of pathogens contain in environments in less concentration and in another forms than in human and animal tissues. Therefore it is important to use modern molecule genetics methods, in particular polymerase chain reaction (PCR), which may raise of diagnostic efficacy thanks to its high analytical sensitivity and specifity. If mixe of related microorganisms presents in samples, phenomenon of interference can be observed Samsonova A.P. et al., 1996, Rosner A., Maslenin L., 2005). It is necessary to take into account worse ecological situation in many regions of Russia and world. Some chemical substances in environment samples can influence on analyses results Gelfand, White, 1990, Greenfield L., White T.J., 1993). Nevertheless, on literature data, this moments does not take in attension during PCR-test-systems developments. Same test-systems often were used for pathogen indication both in clinical and enviromental samples without this testing. Potentially it can lead to diagnostic mistakes. Leptospires are spirohaetes of genus Leptospira, containing two nomen species: L. interrogans sensu lato - leptospiroses agents in humans and animals and L. biflexa s.l. saprophytes. Water way is base for Leptospira spread. Leptospires of some serovars (grippotyphosa) can survive in environments very long. Therefore use of PCR for indication of pathogen leptospires in water objects has important epidemiological and prophilactic significance. The aim of reseach is investigation of influence on PCR results by strain interferention and chemical pollution. For making of modele systems we have used strains M20 (genomespecies L. interrogans serogroup Icterohaemorrhagiae serovar copenhageni), Moskva V (L. kirschneri Grippotyphosa grippotyphosa) and Patoc (L. biflexa Semaranga patoc), grouthed in liquid medium. These cultures were diluted in deionizated water or in solvents of pollutions to 10^3 cells in 1 mkl. For investigation of interference we comparatived PCR results with monocultures pathogen strains M20 and Moskva V and mixed cultures them with saprophitic strain Patoc. For modelling of pollutions we have used phenol, saturated with 0,1 М Tris pH 7,0 (dilutions from 1/100 to 1/100000) and solution of soap-powder "Lotos" (concentrait ons from 1% to 0,001%). All samples were boiled in water bath 15 minutes and were used for PCR. We tested 3 PCR-test-systems these earlier were developted in our laboratory (Samsonova A.P. et al., 1994, 1996, 2003, 2008). All PCR procedures were described in these articals. It was shown that for these test-systems PCR results did not depend on presence of saprophytic strain Patoc in mixed cultures with pathogen leptospires (rate from 1:1 to 1:100). 113 Interference was not observed. Minimal inhibiting concentrations for PCR were: dilutions of phenol 1/100- 1/1000, soap- powder concentrations 1%- 0,1%. So on modele systems we have sonfered that our develored PCR-test-systems can used for indication of pathogenic leptospirres in environments. Nevertherless it is necessary to carry out investigations on more representative elections and with real samples from environments. Developments of multilocus test-systems for leptospires indication and MLST- systems will be useful. БИОПРЕПАРАТ ДЛЯ ОЧИСТКИ ВОДЫ ОТ НЕФТИ И НЕФТЕПРОДУКТОВ Сваровская Л.И., Алтунина Л.К., Писарева С.И. Учреждение Российской академии наук Институт химии нефти Сибирского отделения РАН, 634021, Академический 4, Томск, Россия e-mail: sli@ipc.tsc.ru Цель настоящей работы – разработка биопрепарата на основе иммобилизованных углеводородокисляющих микроорганизмов для ликвидации последствий аварийных разливов нефти, загрязняющих открытые водоемы. Для иммобилизации микроорганизмов, в качестве твердого субстрата-носителя использовали сферозолу (алюмо-силикатные микросферы) – отход в составе летучей золы при высокотемпературном сжигании углей на теплоэлектростанциях. Cферозола характеризуется совокупностью уникальных свойств: удельный вес меньше воды, низкая плотность – 0.4 г/см3, высокая температура плавления – 1200°С, размер частиц – 10-150 мкм, удельная поверхность – 150-250 м2/г, удельный объем пор – 0.67-0.7 см3/г, высокая сорбционная активность и химическая инертность, что позволяет на основе сферозолы получить экологически безопасный, эффективный, легкий сыпучий биопрепарат, который не тонет в воде и характеризуется высокой деструктивной углеводородокисляющей активностью. Для создания биопрепарата использовали ассоциацию из 8-ми углеводородокисляющих штаммов, выделенных из нефти Советского месторождения Западной Сибири и принадлежащих к родам Вacillus, Pseudomonis, Arthrobacter и Streptomyces. Определение их филогенетического положения и фенотипической характеристики проведено в Новосибирском ЦКП "Секвенирование". Отбор штаммов, проявляющих углеводородокисляющую активность, проводили по формированию вокруг колоний чистого, свободного от нефти пространства при посеве на нефтезагрязненный мясо-пептонный агар. Способность штаммов к утилизации индивидуальных углеводородов исследовали при их культивировании на минеральной селективной среде в парах жидких и твердых углеводородов при 25 °С. Отмечена их высокая активность по отношению к алифатическим (пентан, нонан, гексадекан) и ароматическим углеводородам (бензол, нафталин, фенантрен) с образованием донного и пристеночного осадков и мощных биопленок на границе средавоздух. В ассоциации они наиболее полно способны к деструкции нефтей и нефтепродуктов, загрязняющих воду. Полученный биопрепарат представляет сухой сыпучий порошок, содержащий в 1 грамме 2.5×109 микробных клеток. Углеводородокисляющую активность биопрепарата исследовали при внесении в воду, загрязненную нефтью в концентрации от 5 до 30 г/л. Для загрязнения применяли нефть Советского месторождения Западной Сибири, с плотностью – 0.852 г/см3 и вязкостью при 20 °С – 7.2 мПа⋅с. Биопрепарат вносили в концентрации 0.1 г/л жидкой фазы. В процессе биодеградации определяли динамику численности микроорганизмов и накопление альдегидов, как продуктов метаболизма, вес нефти до и 114 после биодеградации. Почти одновременное максимальное накопление альдегидов и численности микроорганизмов свидетельствует о деструктивной активности биопрепарата. Биодеградация нефти в разных вариантах опыта составила 91.7-97 %, остаточное содержание нефтепродуктов в воде – 0.15-2.5 г/л. Без внесения биопрепарата биодеградация углеводородов нефти за 30 суток не превышала 15 %. Пробы исходной и остаточной нефтей анализировали методом газо-жидкостной хроматографии (ГЖХ). Хроматографический анализ исходного загрязнения воды и после биодеструкции показал значительные изменения молекулярно-массового распределения н-алканов и изоалканов. Степень биодеструкции углеводородов для исходного загрязнения и после биодеградации, рассчитанная по формуле (Pr+Ph)/(nС17+nС18), составила 0.6 и 6.5 соответственно. Хромато-масс-спектрометрический анализ биодеградированной нефти показал, что максимальные изменения для ароматических углеводородов отмечены в области алкилбензолов, которые элиминировали полностью, деструкция алкилнафталинов составила 77 %, фенантренов – 48 %. На разработанный препарат получен патент № 2361686 РФ. Биопрепарат не имеет аналогов, обладает широким спектром деструкции углеводородов любой структуры (линейной, циклической), удельный вес в 1.5 раза меньше воды, что обеспечивает тесный контакт с нефтью, загрязняющей водную поверхность, и позволяет рекомендовать его для ликвидации аварийных разливов нефти и нефтепродуктов. BIOPREPARATION FOR WATER PURIFICATION FROM OIL AND OIL PRODUCTS Svarovskaya L.I., Altunina L.K., Pisareva S.I. Institute of Petroleum Chemistry, Siberian Branch of the Russian Academy of Science 4, Akademichesky Avenue, 634021, Tomsk, Russia e-mail: sli@ipc.tsc.ru The aim of the present work is to develop biopreparation based on immobilized hydrocarbon-oxidizing microorganisms to eliminate the consequences of oil spills contaminating open waters. To immobilize microorganisms we used sphero-ash (alumo-silicate microspheres) – waste in the composition of flue ash at high-temperature firing of coal at thermal power plants – as a solid substrate-carrier. Sphero-ash is characterized by a set of unique properties: specific weight is lower as compared with that of water, low density – 0.4 g/cm3, high melting point – 1200 °С, particle size – 10-150 μm, specific surface – 150-250 m2/g, specific pore volume – 0.67-0.7 cm3/g, as well as high sorption activity and chemical inertness. It enables one to obtain environmentally safe, effective, light and loose biopreparation based on sphero-ash which does not sink in water and is characterized by a high destructive hydrocarbon-oxidizing activity. To create biopreparation we used association of 8 hydrocarbon-oxidizing strains of the following genera: Вacillus, Pseudomonis, Arthrobacter and Streptomyces separated from oil of Sovetskoye oil field, West Siberia. Their phylogenetic position and phenotypic characteristics were determined at the Center of collective use “Sequence Analysis” in Novosibirsk. The strains exhibiting hydrocarbon-oxidizing activity were selected by the formation of pure and oil-free space around the colony at the inoculation on oil-polluted meat-peptone agar. The ability of strains to utilize individual hydrocarbons was investigated at their cultivation on selective mineral medium in the vapor of liquid and solid hydrocarbons at 25 °С. One determined their high activity with respect to aliphatic (pentane, nonane and hexadecane) and aromatic (benzene, naphthalene and phenanthrene) hydrocarbons to form bottom and wall sediments and thick biofilms on medium-air boundary. In association the strains are much more capable to destruct oil and oil products contaminating water. 115 A biopreparation obtained is a dry loose powder containing 2.5×109 microbial cells in 1 gram. Hydrocarbon-oxidizing activity of the biopreparation was investigated by placing it into water contaminated with oil at concentrations ranging from 5 to 30 g/L. Oil recovered from Sovetskoye oil field, West Siberia, was user as a contaminator, its density was 0.852 g/cm3 and viscosity at 20 °С – 7.2 mPa⋅s. The biopreparation was added at concentration of 0.1 g/L of liquid phase. In the process of biodegradation we determined dynamics of microorganism number and accumulation of aldehydes as metabolism products, oil weight before and after biodegradation. Almost simultaneous maximal accumulations of aldehydes and number of microorganisms evidence destructive activity of the biopreparation. In different variants of the test oil biodegradation amounted to 91.7-97 % and the content of oil products in water ranged from 0.15 to 2.5 g/L. Without the biopreparation biodegradation of oil hydrocarbons for 30 days did not exceed 15 %. The samples of the initial and residual oils were analyzed by gas-liquid chromatography. Chromatographic analyses of the initial contamination of water and after biodestruction proved considerable changes in molecular-mass distribution of n-alkanes and isoalkanes. A degree of hydrocarbon biodestruction was calculated by formula (Pr+Ph)/(nС17+nС18), for the initial contamination it was 0.6 and for contamination after biodegradation – 6.5, respectively. Chromatography-mass spectrometry analysis of biodegradated oil demonstrated that maximal changes for aromatic hydrocarbons were fixed in the region of alkylbenzenes which completely eliminated, whereas destruction of alkylnaphthalenes amounted to 77 % and that of phenanthrenes – 48 %. The biopreparation is covered by RF Patent № 2361686. There are no analogues of this preparation. It has a wide spectrum of destruction of hydrocarbons of any structure (linear and cyclic) and its specific weight is 1.5 less than that of water providing a close contact with oil which contaminates water surface. Therefore one can recommend the biopreparation to eliminate emergency spills of oil and oil products. ОЦЕНКА СПОСОБНОСТИ ЦИАНОБАКТЕРИЙ К СИНТЕЗУ И СЕКРЕЦИИ СОЕДИНЕНИЙ, УЧАСТВУЮЩИХ В АУТОРЕГУЛЯЦИИ ЧИСЛЕННОСТИ 1 Семенова Л.Р.,1 Загоскина Н.В.,2 Соловченко А.Е.1,2, Селях И.О.1 Московский Государственный университет им. М.В.Ломоносова, 2 Институт физиологии растений им. К.А.Тимирязева РАН, г. Москва, Россия e-mail: cyano@mail.ru Массовое размножение микроводорослей в соленых и пресных водоемах, искусственных и технологических водохранилищах и прудах, а также системах водоснабжения промышленных предприятий приводит к негативным последствиям: «цветению» воды, образованию структурированных биопленок - «матов» и формированию устойчивых биологических обрастаний. В то же время цианобактерии приобретают все большее значение как ценный объект биотехнологии. Способность расти на недорогих минеральных средах, высокая скорость прироста биомассы и значительный выход полезного продукта выделяют их среди других используемых микроорганизмов. В связи с этим остро встает проблема разработки методов контроля и управления численностью цианобактериальной популяции. В случае «цветения» необходимо подавлять избыточный рост, в случае направленного культивирования - увеличивать прирост биомассы. В настоящее время для борьбы с массовыми вспышками развития микроводорослей используются физические и химические методы неспецифического действия, имеющие серьезные ограничения. Поэтому все большее внимание уделяется поиску и разработкам биологических методов контроля численности микроводорослей. Одним из таких методов может стать использование веществ, синтезируемых самими цианобактериями для 116 регуляции их роста. Использование регуляторов роста цианобактерий для более эффективного культивирования и оптимизация физико-химических параметров биореакторов сулят значительные выгоды в биотехнологии этих организмов. У многих видов бактерий регуляция роста связана с функционированием Quorum Sensing (QS) – систем - особого типа регуляции экспрессии генов бактерий, зависящей от плотности их популяции. QS-регуляция осуществляется путем продукции и рецепции клетками небольших сигнальных молекул, называемых аутоиндукторами (АИ). У грамотрицательных бактерий в качестве АИ чаще всего выступают N-ацилгомосеринлактоны (АГЛ). Нами получены предварительные данные о способности цианобактерий к образованию АГЛ. На роль аутоиндукторов также претендуют индолы, фенольные, гормоноподобные и некоторые другие секретируемые цианобактериями соединения. Из перечисленных веществ сведения о фенольных соединениях (ФС) микроводорослей фрагментарны и противоречивы. Выделенные и идентифицированные ФС цианобактерий преимущественно относятся к простым галогенсодержащим формам, хотя имеются данные об обнаружении негалогенированных простых и сложных форм. Целью настоящей работы была оценка способности некоторых цианобактерий к синтезу и секреции ФС. Использованы альгологически чистые культуры цианобактерий Anabaena variabilis ATCC 29413 Synechocystis sp. PCC 6803, Chlorogloeopsis fritschii ATCC 27193, Oscillatoria sp. CALU 1414, Oscillatoria sp. CALU 1416, Nostoc sp. CALU 542 и Gloeocapsa sp. CALU 743, относящиеся к разным субсекциям. Исследовали лиофильно высушенные препараты культуральной жидкости (КЖ) и биомассы. Результаты тонкослойной хроматографии и колориметрического метода свидетельствуют о присутствии сходных ФС во всех исследованных экстрактах, причем в экстрактах биомассы ФС больше, чем в КЖ. Отмечена непригодность стандартных метчиков ФС растений для идентификации ФС цианобактерий. Методом ВЭЖХ обнаружено, что исследованные экстракты содержат 3 – 5 основных (мажорных) компонентов и несколько десятков минорных. У большинства обнаруженных соединений на спектрах преобладали максимумы, расположенные в УФ-С (190-280 нм) и УФ-B (280-315 нм) диапазонах. В отдельных случаях присутствовали компоненты с разрешенными максимумами в сине-зеленой области видимой части спектра. Полученные результаты свидетельствуют о наличии в КЖ исследованных цианобактерий ФС или веществ, cходных с ними по химической структуре. Несоответствие положений максимумов поглощения обнаруженных веществ и «классических» максимумов ФС растений может объясняться небольшими различиями в химической структуре (наличием у обнаруженных веществ заместителей – атомов галогенов, что часто встречается у ФС цианобактерий, или других радикалов). Обнаружено также соединение со временем удерживания Rt ≈ 6,2 мин., присутствующее в экстрактах Chlorogloeopsis, Oscillatoria, Gleocapsa и обладающее разрешенным спектром поглощения с выраженными максимумами в УФ и видимой областях спектра. По форме спектра это соединение имеет фенольно-индольную природу и близко к мономерной форме сцитонемина - особого пигмента, обнаруженного в чехлах некоторых морских и почвенных цианобактерий и играющего важную роль в экранировании УФ радиации. Сходство спектров поглощения этого вещества у трех исследованных культур со спектрами сцитонемина, представленными в литературе, позволяет полученные нами данные с большой долей вероятности считать достоверными. Для идентификации ФС требуются дополнительные исследования. 117 ESTIMATION OF THE ABILITY OF CYANOBACTERIA FOR SYNTHESIS AND SECRETION OF THE COMPOUNDS PARTICIPATING IN AUTOREGULATION OF THEIR NUMBERS Semenova L.R.1, Zagoskina N.V.2, Solovchenko A.E.1,2, Selyakh I.O.1 1 MV Lomonosov Moscow State University, 2 KA Timiryazev Institute of Plant Physiology RAS, Moscow, Russia e-mail: cyano@mail.ru Mass growth of algae in saline and fresh waters, artificial and technological reservoirs and ponds including water supply systems of industrial enterprises often causes water blooms, formation of structured biofilms ("mats") and the permanent fouling. At the same time, cyanobacteria are going importance as a valuable object of biotechnology. Cyannobacteria are distinguished among other biotechnologically important microorganisms for their ability to grow on inexpensive mineral media, high biomass accumulation rates and considerable yields of valueadded products. These circumstances make the developing of methods for monitoring and control the size of cyanobacterial populations an important problem. In the case of water blooms it is necessary to suppress the excessive growth. On the contrary, in case industrial cultivation in is desirable to stimulate the biomass accumulation. Currently, the control of microalgal blooms is carried out using nonspecific physical and chemical agents which have serious limitations. Therefore increasing attention is paid to search and development of the methods for biomonitoring of microalgae numbers. A promising candidate method is based on the use of substances synthesized by the cyanobacteria and participating in regulation of their growth. The use of natural growth regulators of cyanobacteria makes it possible to increase the efficiency of their cultivation and to optimize the physic-chemical parameters of bioreactors. As a result, significant benefits could be obtained for the biotechnology of these organisms. In many bacterial species, regulation of growth involves so called Quorum Sensing (QS), a special type of regulation of bacterial gene expression which depends on their population density. QS-regulation operates by means of the production and reception of small signaling molecules called auto inducers (AI). In Gram-negative bacteria AI are often represented by N-acylhomoserinlakton (AHL). We have obtained preliminary data on the ability of cyanobacteria to produce AHL. Potential AI also includes indolic, phenolic, hormone-like and other compound groups excreted by cyanobacteria. Among these substances phenolic compounds (PC) of microalgae are poorly studied, only scarce and contradictory reports have been in the field made so far. Isolated and identified PC of cyanobacteria are mainly represented by simple halogenated species, although there is evidence of the presence of simple and more compels non-halogenated PC in cyanobacteria. This study was aimed to estimate the ability of some cyanobacteria to synthesize and excrete PC. Algological pure cultures of the cyanobacteria Anabaena variabilis ATCC 29413, Synechocystis sp. PCC 6803, Chlorogloeopsis fritschii ATCC 27193, Oscillatoria sp. CALU 1414, Oscillatoria sp. CALU 1416, Nostoc sp. CALU 542 and Gloeocapsa sp. CALU 743, belonging to different subsections served as the objects for this study. Freeze-dried preparations of their culture medium (CM) and biomass samples were investigated. The results of thin layer chromatography and colorimetric assay indicate the presence of similar PC in all extracts, but in the extracts of biomass PC were more abundant than in the CM. It should be noted that the pure PC of plants are not suitable as standard compounds for the identification of cyanobacterial PC. HPLC-DAD analysis revealed that the studied extracts contain 3–5 major and a several dozens of minor component. In the absorption spectra of the most of detected components peaks were detected in the UV-C (190-280 nm) and UV-B (280-315 nm) spectral regions. There were also components possessing resolved maxima in the blue-green region of the visible part of the 118 spectrum. These results indicate the presence of PC or substances with similar chemical structure in the CM of the investigated cyanobacteria. The discrepancy between the positions of the maxima in the spectra of the detected in CM substances and these of the ‘classic’ PC of plants could stem from slight differences in their substitution pattern (e.g. halogenations common for the PC of cyanobacteria). A compound was also detected with Rt ≈ 6, 2 min. in the of extracts Chlorogloeopsis, Oscillatoria, Gloeocapsa possessing absorption maxima both in the UV and visible parts of the spectrum. According to the data in the literature, the shape of the spectrum of this compound is indicative of its phenol-indole nature and was similar to that of the monomer form of scytonemin – a UV-screening pigment which presents in the sheath of some marine and soil cyanobacteria. Further confirmation of the identify of the PC detected requires additional investigations. ОПТИМИЗАЦИЯ ПРОЦЕССА ОЧИСТКИ НЕФТЕЗАГРЯЗНЕННОЙ ВОДЫ В БИОРЕАКТОРЕ С ИСПОЛЬЗОВАНИЕМ ИММОБИЛИЗОВАННЫХ КЛЕТОК РОДОКОККОВ Серебренникова М.К., Куюкина М.С., Ившина И.Б. Институт экологии и генетики микроорганизмов УрО РАН, 614081, Пермь, ул. Голева, 13, Россия e-mail: m070887kc@mail.ru Нефть и нефтепродукты относятся к распространенным и опасным загрязнителям окружающей среды, которые приводят к негативным изменениям в биоценозах. Важным направлением экологической биотехнологии является разработка эффективных и безопасных способов очистки нефтезагрязненных сред, основанных на использовании углеводородокисляющих микроорганизмов. Актинобактерии рода Rhodococcus способны окислять труднодоступные и токсичные для многих микроорганизмов компоненты нефти (алифатические, ароматические, полициклические углеводороды и их производные) [1, 2]. Эффективным способом очистки загрязненных углеводородами промышленных сточных вод является использование биореактора с иммобилизованными на носителе бактериальными клетками. Иммобилизация позволяет концентрировать большие количества биомассы и избегать ее значительных потерь, длительное время сохранять окислительную способность бактериальных клеток после их многократного использования в биореакторе, что важно для эффективной деградации загрязнителей [3]. Ранее нами [4] подобраны оптимальные условия процесса иммобилизации клеток родококков на органическом носителе в условиях колоночного биореактора. Цель работы – оптимизация режима обработки нефтезагрязненной воды в биореакторе с иммобилизованными на органическом носителе клетками родококков. В работе использовали ассоциацию культур Rhodococcus ruber ИЭГМ 615 и Rhodococcus opacus ИЭГМ 249 из Региональной профилированной коллекции алканотрофных микроорганизмов (акроним ИЭГМ, WDCM # 768; www.iegm.ru/iegmcol), различающихся по спектру потребляемых субстратов, что позволяет наиболее полно деградировать нефтяные углеводороды. Иммобилизацию клеток проводили адсорбционным методом, который заключается в прокачивании суспензии родококков (2,0 x 107 кл/мл) со скорость 2,0 мл/мин через лабораторный колоночный биореактор (12,0 х 1,4 см), заполненный гидрофобизованными хвойными опилками (2 г, d=1–3 мм). Процесс иммобилизации осуществляли при комнатной температуре в течение 7 сут. Способность иммобилизованных клеток родококков деградировать нефтяные углеводороды изучали с использованием 2%-ной эмульсии модельной нефти (н-декан, н-ундекан, н-додекан, н-тетрадекан, н-гексадекан, нгептадекан, н-нонадекан – по 12%, пристан – 6%, нафталин, аценафтен, фенантрен, антрацен – по 2%), стабилизованной 0,1%-ным р-ом Твина 60. Эмульсию подвергали УЗ-обработке и пропускали через колонку со скоростью 0,6 и 1,2 мл/мин при 28°С в течение трех недель. 119 Количественное содержание углеводородов в образцах из биореактора определяли с помощью ГХ-МС после экстракции хлороформом. В результате проведенных исследований установлено, что степень деградации индивидуальных углеводородов, входящих в состав модельной нефти, в биореакторе составляет от 50 до 100%. Отмечено, что иммобилизованные клетки наиболее эффективно (80-100%) окисляют алифатические компоненты нефти с длиной углеродной цепи от 10 до 17 атомов и нафталин. Степень деградации н-нонадекана и пристана достигает 75%. Менее эффективно происходит окисление фенантрена и антрацена (51%), а также аценафтена (30%). Очевидно, вследствие низкой растворимости в воде и высокой сорбционной способности данные полиароматические углеводороды малодоступны для биологического окисления. В целом эффективность процесса биодеградации нефти в биореакторе составила 77%. Кроме того, установлено, что увеличение скорости подачи нефтяной эмульсии в биореактор от 0,6 до 1,2 мл/мин приводит к снижению продолжительности деградационного процесса от трех до двух недель при сохранении заданного уровня эффективности. Выявленный факт послужит сокращению временных и энергетических затрат на проведение мероприятий по очистке нефтезагрязненных сточных вод в биореакторе. OPTIMIZATION OF OIL-CONTAMINATED WATER PURIFICATION IN A BIOREACTOR WITH IMMOBILIZED RHODOCOCCUS CELLS Serebrennikova M.K., Kuyukina M.S., Ivshina I.B. Institute of Ecology and Genetics of Microorganisms, Ural Branch, Russian Academy of Sciences, 614059 Perm, Goleva Street, 13, Russia e-mail: m070887kc@mail.ru Crude oil and petroleum products are widespread and dangerous pollutants of the environment, which cause negative changes in ecosystems. Developing of effective and safe remediation methods for oil-contaminated environments is an important area of environmental biotechnology. These methods are based on the application of hydrocarbon-oxidizing bacteria. Bacteria of the genus Rhodococcus are capable to degrade many oil constituents, including aliphatic, aromatic and polycyclic hydrocarbons and their derivatives that cannot be transformed by other microorganisms [1, 2]. Bioreactors with immobilized bacterial cells are widely used to cleanup contaminated wastewaters. Immobilization enables to concentrate biomass, avoid its significant losses, and to maintain an oxidizing activity of bacterial cells after multiple applications, which is important for effective degradation of pollutants [3]. In our previous study [4] an optimal regime of the immobilization process for rhodococcal cells in a sawdust-packed column bioreactor was developed. The present study is aimed to optimize oil-contaminated water purification in a bioreactor containing sawdust-immobilized rhodococcal cells. The strains used were Rhodococcus ruber IEGM 615 and Rhodococcus opacus IEGM 249 from the Regional Specialized Alkanotrophic Microorganisms Collection (acronym IEGM, WDCM # 768; www.iegm.ru/iegmcol). These strains differed by the range of substrates utilized that provides complete degradation of oil hydrocarbons. Adsorptive immobilization was performed as follows: the Rhodococcus cell suspension (2.0 x 107 cells/ml) was pumped through the column bioreactor filled with 2 g hydrophobized sawdust (particle size 1–3 mm) at a flow rate of 2.0 ml/min and room temperature for 7 days. Oil-degrading activity of immobilized Rhodococcus cells was studied using 2% (v/v) aqueous emulsion of the modified model oil consisting of: n-С10, n-С11, n-С12, n-С14, n-С16, n-С17, n-С19 - 12 %; pristane - 6 %; naphthalene, phenanthrene, anthracene, acenaphthene - 2 %, and stabilized with 0.1 % Twin 60. The model oil emulsion was pumped into the column at flow rates 0.6 and 1.2 ml/min at room temperature for 3 weeks. Residual hydrocarbons concentrations in the samples from the bioreactor were determined by GC–MS after extraction with chloroform. It was found that degradation degree for individual hydrocarbons of model oil in the reactor ranged from 50 to 100%. Immobilized Rhodococcus cells effectively oxidized aliphatic oil 120 components with carbon numbers from C10 to C17, and naphthalene; the biodegradation extent reached 80-100%. The degradation of n-nonadecane and pristane did not exceed 75%. The oxidation of phenanthrene and anthracene was less effective (51%), and so was that of acenaphthene (30 %). Apparently, these PAHs are not readily biodegradable due to their low solubility in water and high sorption capacity. As a result, the efficiency of the biodegradation of oil hydrocarbons in the bioreactor was 77%. In addition, it was found that biodegradation process was almost completed after two weeks in the bioreactor at flow rate 1.2 ml/min, whereas it took 3 weeks at the flow rate 0.6 ml/min. It should be noted that the efficiency of degradation process at 1.2 ml/min was of the same level as at the flow rate 0.6 ml/min. Revealed fact could reduce the time and energy consumption during the clean up of oil-contaminated wastewater in a bioreactor. РЕЗУЛЬТАТЫ МОНИТОРИНГА ЧЕРНОМОРСКИХ АЛЬГОВИРУСОВ В КРЫМСКОМ РЕГИОНЕ (2002-2011гг.) Степанова О.А.1, Шоларь С.А.2 1 Институт биологии южных морей НАН Украины им. А.О. Ковалевского, проспект Нахимова 2, Севастополь, 90001,Украина; 2Севастопольский национальный технический университет, ул.Университетская 33, г.Севастополь, 99053, Украина e-mail: solar-ua@ya.ru, stas.narod@mail.ru Мониторинг вирусов гидросферы направлен на понимание роли вирусов в круговороте органического углерода, в процессах функционирования пищевых цепей и биоразнообразия в водоемах. Анализ получаемых при этом результатов является основой для оценки стабильности гидроэкосистем, увеличивая предсказуемость воздействий глобальных изменений на биогеохимические процессы во всем Мировом океане. Альговирусы представляют особый интерес для исследователей, т.к. они вызывают лизис первичных продуцентов кислорода и органической материи в гидросфере, занимают ключевую позицию в эволюции микроводорослей и поддержании их видового многообразия. Не исключена и роль альговирусов в патологии организмов, потребляющих фитопланктон. С этих позиций с 2002г проводится поиск альговирусов в различных пробах из черноморской среды в Крымском регионе. Целью исследований явилось изучение экологии и биологии новых для науки черноморских альговирусов и возможностей практического применения полученных результатов. Изоляцию альговирусов осуществляли по авторским методикам [Пат.65864A UA, №2003065499; А 2010 03881 UA], изучая пробы морской воды, черноморских мидий Mytilus galloprovincialis и жабр различных видов черноморских рыб. Материал отбирали из бухт Севастополя и открытого моря. В качестве индикаторных культур микроводорослей использовали жидкие коллекционные культуры Tetraselmis viridis и Phaeodactylum tricornutum (с 2002г), Dunaliella viridis (с 2008г) и Prorocentrum pusilla (с 2010г), полученные из отдела экологической физиологии водорослей Института биологии южных морей НАН Украины. Всего с мая 2002 по март 2011гг было изучено 383 пробы, из которых 220 проб морской воды, 48 проб из мидий и 115 проб из жабр рыб. Было выделено 146 вирусных изолятов к четырем видам микроводорослей, из них - 38 вариантов вируса Tetraselmis viridis (TvV), 63 варианта вируса Phaeodactylum tricornutum (PtV), 32 варианта вируса Dunaliella viridis (DvV) и 13 вариантов вируса Prorocentrum pusilla (PpV). Из проб воды были изолированы 22 TvV, 48 PtV, 17 DvV и 11 PpV, из проб от мидий (мантийная жидкость) - 8 TvV, 15 PtV, 15 DvV и 2 PpV, из проб от рыб (жабры) – 8 TvV. Мониторинг черноморских альговирусов в Крымском регионе в 2002-2011гг и изучение свойств выделенных вирусов позволили получить результаты, имеющие теоретическую и практическую новизну в новом направлении гидробиологии – в морской вирусологии: 121 Впервые из черноморской среды по авторской методике были изолированы и изучены новые для науки альговирусы микроводорослей Tetraselmis viridis, Phaeodactylum tricornutum, Dunaliella viridis и Prorocentrum pusilla. Сведения о геномах и метаданных некоторых из них помещены в National Center for Biotechnology Information (NCBI) и Community Cyberinfrastructure for Advanced Marine Microbial Research and Analysis (CAMERA). Полученная информация о нуклеотидных и аминокислотных последовательностях черноморских альговирусов используется для поиска сходства с представителями ДНК-содержащих вирусов суши и гидросферы. Впервые для альговируса микроводоросли Tetraselmis viridis был определен второй хозяин - микроводоросль Dunaliella viridis, что свидетельствует о его более широких возможностях для сохранения в природе по сравнению с вирусами, специфичными только по отношению к одному хозяину. Черноморские альговирусы изолируются из проб воды акваторий города Севастополя в соответствии с сезонностью их хозяев – микроводорослей, поэтому поиск альговирусов в воде предложено использовать для изучения динамики географического распространения и сезонности микроводорослей. Полученные результаты об изменении частоты выделения альговирусов микроводорослей Tetraselmis viridis и Phaeodactylum tricornutum свидетельствуют и об изменении численности этих водорослей в акваториях г. Севастополя, что в свою очередь указывает на возможные экологические сдвиги в изучаемых акваториях. Среди тест-объектов по изоляции черноморских альговирусов в качестве биоиндикатора предложено использовать материал от мидий (мантийную жидкость), что позволяет выделять вирусы чаще, чем из других тест-объектов, благодаря накопительноконцентрирующим свойствам этих моллюсков. Мидии, после предварительной очистки в проточной воде, предложено использовать для концентрации водных вирусов из исследуемых проб морской воды. Это методическое усовершенствование позволяет на 1-2 порядка сконцентрировать численность вирусов в мантийной жидкости по сравнению с исследуемой водой и повышает чувствительность используемых авторских методик по изоляции альговирусов из проб воды. Альговирусы, определяемые в жабрах рыб, предложено рассматривать в качестве биомаркеров при оценке физиологического состояния различных представителей ихтиофауны. С учетом высокой видовой специфичностью вирусов, набор известных альговирусов предложено использовать для тестирования (определения вида) неизвестных микроводорослей. Заключение: результаты проведенного мониторинга и изучения свойств черноморских альговирусов внесли новые теоретические и практические знания в развитие нового направления в гидробиологии – морской вирусологии. RESULTS OF MONITORING BLACK SEA ALGAE VIRUSES IN CRIMEA REGION (2002-2011) 1 Olga Stepanova1, Stanislav Sholar2 A.O. Kovalevsky Institute of biology of the Southern Seas of National Academy of Science of Ukraine,2 Nahimov Avenue, Sevastopol, 90001, Ukraine, 2Sevastopol National Technical University, 33 University street, Sevastopol, 99053, Ukraine e-mail: solar-ua@ya.ru, stas.narod@mail.ru The monitoring of viruses of hydrosphere is directed at understanding of a role of viruses in organic carbon cycle, in processes of functioning of food webs and biovariety in aquatic environment. The analysis of results of such monitoring is a basis for an estimation of stability hydroecosystems, increasing of predictability of influences of global changes on biogeochemical processes in World Ocean. Researchers have a special interest about algae viruses, because algae 122 viruses cause the lysis of primary producers of oxygen and organic material in hydrosphere and have a key position in evolution of algae and in maintenance of their variety. Is not excluded also the role of algae viruses in pathology of hydrobionts, eating phytoplankton. On basis of these positions from 2002 we carry out the search of algae viruses in different samples from Black Sea environment in the Crimea region. The purpose of our researches is the study of ecology and biology of new, unknown Black Sea algae viruses and opportunities of practical application of the received results. We carried out the isolation of algae viruses with using the author's methods [Pat.65864A UA, N2003065499; A 2010 03881 UA], studying the samples of marine water, of Black Sea mussels Mytilus galloprovincialis and gills of different species of the Black Sea fishes. A material was selected from bays of Sevastopol and open sea. For carrying out method of isolation of algae viruses we used liquid cultures Tetraselmis viridis and Phaeodactylum tricornutum (from 2002), Dunaliella viridis (from 2008) and Prorocentrum pusilla (from 2010), which we received from a department of ecological physiology of seaweed of Institute of Biology of the Southern Seas of NAS of Ukraine. Since May 2002 till March 2011 we studied 383 samples, from which - 220 samples of marine water, 48 samples from mussels and 115 samples from fishes gills. From this samples were isolated 146 variants of viruses to 4 algae species and among them were 38 variants of a virus Tetraselmis viridis (TvV), 63 variants of a virus Phaeodactylum tricornutum (PtV), 32 variants of a virus Dunaliella viridis (DvV) and 13 variants of a virus Prorocentrum pusilla (PpV). From samples of marine water were isolated 22 TvV, 48 PtV, 17 DvV and 11 PpV, from samples of mussels (liquid) - 8 TvV, 15 PtV, 15 DvV and 2 PpV, from samples of fishes gills - 8 TvV. Monitoring of Black Sea algae viruses in the Crimea region in 2002-2011 and study of properties of the isolated viruses have allowed us to receive results having theoretical and practical novelty in a new direction in hydrobiology - marine virology: For the first time from the samples of Black Sea environment by an author's method were isolated and investigated new algae viruses of Tetraselmis viridis, Phaeodactylum tricornutum, Dunaliella viridis and Prorocentrum pusilla. The information about viral genomes and metadata of some of them are in National Center for Biotechnology Information (NCBI) and Community Cyberinfrastructure for Advanced Marine Microbial Research and Analysis (CAMERA). The received information about nucleotide and amino acid sequences of Black Sea algae viruses is used for search of similarity with the representatives of DNA viruses from a land and hydrosphere. For the first time we determined for virus of Tetraselmis viridis availability of second host seaweed Dunaliella viridis. This fact testifies about more opportunities for preservation of this virus (with 2 hosts) in a nature in comparison with viruses specific only to one host. Black Sea algae viruses were isolated from samples of marine water near Sevastopol according to seasonal prevalence of their hosts, therefore the search of algae viruses in water is offered for using in study of dynamics of geographical distribution and seasonal prevalence of microseaweeds. The received results testify about change of frequency of prevalence of viruses of Tetraselmis viridis and Phaeodactylum tricornutum and consequently about change of number of their hosts (microseaweeds) in water areas near Sevastopol. Therefore this fact can show possible ecological shifts in investigated Black Sea regions. Among samples used for isolation of Black Sea algae viruses we offered to use a material from mussels (liquid - as bioindicator). This can allow us to isolate viruses more often, than from other samples, due to concentrating properties of mussels. We offered to use mussels after their preliminary clearing in flowing water for concentration of water viruses from researched samples of sea water. This methodical improvement allows us to concentrate number of viruses in liquid of mussels in comparison with researched water in 10-100 and raises the sensitivity of author's method used for isolation of algae viruses from samples of marine water. Detected algae viruses in the gills of fishes we offered to consider as biomarkers at an estimation of a physiological status of the various representatives of marine fishes. 123 We offered to use the set of known algae viruses for definition of a species of unknown microseaweeds. The conclusion: results of the carried out monitoring and the study of properties of Black Sea algae viruses have brought new theoretical and practical knowledge in development of a new direction in hydrobiology - marine virology. СТРУКТУРНО-ФУНКЦИОНАЛЬНЫЕ ХАРАКТЕРИСТИКИ БАКТЕРИОПЛАНКТОНА ВОДОХРАНИЛИЩ СРЕДНЕЙ ВОЛГИ В ПЕРИОД АНОМАЛЬНО ВЫСОКОЙ ТЕМПЕРАТУРЫ ВОДЫ 2010 ГОДА Стройнов Я.В., Копылов А.И. Институт биологии внутренних вод им. И.Д. Папанина РАН, 152742 Ярославская обл., пос. Борок, Россия e-mail: styarr@ibiw.yaroslavl.ru В июле-августе 2010 года температура поверхностной воды в водохранилищах Средней Волги достигала 29-33оС, что вызвало очень сильное «цветение» воды цианобактериями. Основными компонентами фитопланктона в этот период были цианобактерии Microcystis sp., Oscillatoria sp. В Горьковском и Чебоксарском водохранилищах первичная продукция фитопланктона, составляла, в среднем для водоема, соответственно, 1629±282 и 2653±563 мг С/(м2 × сут), что превышало таковые в годы с обычной температурой воды (1923оС) более чем в 2 раза. По данным Н.М. Минеевой содержание в воде хлорофилла в этот период было выше, по сравнению с предыдущими годами, в 3-5 раз. Цель работы состояла в оценке влияния сильного «цветения» воды цианобактериями на структурно-функциональные характеристики бактериопланктона. Исследования проводили на 12 станциях в Горьковском водохранилище и 20 станциях в Чебоксарском водохранилище. Первичную продукцию фитопланктона определяли радиоуглеродным методом (Романенко, Кузнецов, 1974). Планктонные бактерии и вирусы учитывали методом эпифлуоресцентной микроскопии с использованием флуорохромов DAPI и SYBR Green (Porter, Feig, 1980; Noble, Fuhrman, 1998). В Горьковском водохранилище, в среднем для водоема, численность (11.6±1.2 млн. кл/мл) и биомасса (886±96 мг/м3) бактериопланктона оказались, соответственно, в 3 и 2 раза выше, чем в предыдущие годы. На некоторых станциях значения этих параметров достигали 20.9 млн. кл/мл и 2.1 г/м3. Величины удельной скорости роста бактерий (0.035±0.006 час-1) и бактериальной продукции (189±35 мг С/(м3 × сут)) также превышали таковые в обычные годы, соответственно, в 1.3 и 2.5 раз. Отношение общего количества планктонных вирусов к общей численности бактериоланктона (NВ/ NБ) в период сильного «цветения» воды цианобактериями (NВ/ NБ = 4.0) было существенного ниже такового во время умеренного цветения (NВ/ NБ = 8.7). Вклад бактериопланктона в формирование общей биомассы планктонного сообщества (ВПС) в июле –августе 2010 г. (17% от ВПС) оказался существенно меньше, чем в этот же период 2005 г. (29% от ВПС). В Чебоксарском водохранилище, в среднем для водоема, численность (15.4±0.9 млн. кл/мл) и биомасса (1420±88 мг/м3) бактериопланктона оказались в 2 раза выше, чем в предыдущие годы. На некоторых станциях значения этих параметров достигали 18.5 млн. кл/мл и 1.5 г/м3. Величины удельной скорости роста бактерий (0.033±0.003 час-1) и бактериальной продукции (258±27 мг С/(м3 × сут)) также превышали таковые в обычные годы, соответственно, в 1.4 и 3 раза. Отношение общего количества планктонных вирусов к общей численности бактериоланктона (NВ/ NБ) в период сильного «цветения» воды цианобактериями (NВ/ NБ = 3.6) было существенного ниже такового во время умеренного «цветения» (NВ/ NБ = 6.0). Вклад бактериопланктона в формирование общей биомассы планктонного сообщества (ВПС) в июле –августе 2010 г (16% от ВПС) оказался существенно меньше, чем в этот же период 2005 г. (27% от ВПС). 124 Таким образом, в период мощного «цветения» воды цианобактериями значительно возрастает численность, биомасса и продукция бактериопланктона, но снижается его доля в общей биомассе планктонного сообщества. Полученные данные свидетельствуют, что в июле-августе 2010 г. водные массы на значительной акватории водохранилищ приблизились к уровню гипертрофных вод. STRUCTURAL AND FUNCTIONAL CHARACTERISTRICS OF BACTERIOPLANKTON IN RESERVOIRS OF THE MIDDLE VOLGA DURING THE PERIOD OF OBNORMALLY HIGH WATER TEMPERATURES OF 2010 Stroynov Ya.V., Kopylov A.I. Papanin Institute for Biology of Inland Waters RAS, 152742 Yaroslavl, Borok, Russia e-mail: styarr@ibiw.yaroslavl.ru In June-August of 2010 the temperature of surface water in reservoirs of the Middle Volga reached 29-33оC that resulted in very intense cyanobacterial water blooms. During this period, Mycrocystis sp. and Oscillatoria sp. cyanobacteria were the main components of phytoplankton. In Gorky and Cheboksar Reservoirs the phytoplankton primary production averaged to 1629±282 and 2653±563 mg C/m2 day correspondingly that exceeded these parameters for years with typical water temperature (19-23оC) more than twice. According to N.M. Mineeva, the chlorophyll content of water during this period was 3-5 times higher than in previous years. The purpose of this study is to assess the effect of heavy water blooms of cyanobacteria on structural and functional characteristics of bacterioplankton. The investigations were carried out at 12 stations in Gorky and 20 stations in Cheboksar Reservoirs. The radiocarbon method (Romanenko, Kuznetsov, 1974) was employed to determine the phytoplankton primary production. Planktonic bacterium and viruses were counted by an epifluorescence microscopy method using DAPI and SYBR Green fluorochroms (Porter, Feig, 1980; Noble, Fuhrman, 1998). In Gorky Reservoir, on average for the waterbody, the number (11.6±1.2 million cells/ml) and biomass (886±96 mg/m3) of bacterioplankton appeared correspondingly 3 and 2 times higher than in previous years. At some stations the values of these parameters reached 20.9 million cells/ml and 2.1 g/m3. The specific growth rate of bacterium (0.035±0.006 hr-1) and bacterial production (189±35 mg C/m3 day) also exceeded values of these parameters in normal years 1.3 and 2.5 times correspondingly. During the period of intense cyanobacterial water blooms, the ratio of the total number of planktonic viruses to the total number of bacterioplankton (NV/NB =4.0) was significantly lower than during a moderate water blooming (NV/NB =8.7). In July-August, 2010, the bacterioplankton contribution to the total biomass of the planktonic community (BPC) proved to be significantly less (17% of BPC) than during the same period of 2005 (29% of BPC). In Cheboksar Reservoir, on average for the waterbody, the number (15.4±0.9 million cells/ml) and biomass (1420±88 mg/m3) of bacterioplankton appeared two times higher than in previous years. At some stations the values of these parameters reached 18.5 million cells/ml and 1.5 g/m3. The specific growth rate of bacterium (0.033±0.003 hr-1) and bacterial production (258±27 mg C/m3 day) also exceeded values of these parameters in normal years 1.4 and 3 times correspondingly. The ratio of the total number of planktonic viruses to the total number of bacterioplankton (NV/NB ) during the period of intense water blooms of cyanobacteria was significantly lower (NV/NB =3.6) than during a moderate water blooming (NV/NB =6.0). The bacterioplankton contribution to the total biomass of the planktonic community (BPC) appeared significantly less (16% of BPC) in July-August of 2010 than during the safe period of 2005 (27% of BPC). Thus during the period of powerful water blooms of cyanobacteria the bacterioplankton number, biomass and productivity significantly increases but its portion in the total biomass of the 125 planktonic community decreases. The obtained data suggest that in July-August of 2010 water masses in considerable areas of the reservoirs approached the hypertrophic level. УТИЛИЗАЦИЯ АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ БАКТЕРИОБЕНТОСОМ Стукова О.Ю. 1, Шевкунова О.И.2 1 Институт водных и экологических проблем ДВО РАН, 2 Дальневосточный государственный университет путей сообщения, Хабаровск, Россия e-mail : olgastukova1@rambler.ru В настоящее время актуальность приобрела экологическая проблема загрязнения прибрежных морских акваторий ароматическими углеводородами (АУ) различного генезиса. В связи с тем, что АУ способны аккумулироваться в мягких тканях гидробионтов, они долгое время могут сохраняться в окружающей среде, оказывая при этом токсические свойства. Решающая роль в процессе самоочищения донных отложений отводится микроорганизмам и их адаптационным возможностям. Особая биохимическая организация микробной клетки связана с её полифункциональной ферментативной активностью. Микробные комплексы (МК) способны разрушать и обезвреживать многие органические вещества, имеющие токсические свойства. Высокая микробиологическая активность МК по отношению к ароматическим углеводородам является ярким примером формирования качества воды в Амурском лимане. Основная цель исследований состояла в изучении активности бентосных микробоценозов Амурского лимана, формирующиеся в донных осадках зоны смешения морских и пресных вод по отношению к ароматическим соединениям различного строения (нефть, водорастворимая фракция нефти, бензол, фенол, ксилол, толуол). В качестве объектов исследований были использованы МК из донных отложений, отобранных в марте 2008 г. Для определения активности самоочищения в Амурском лимане от ароматических соединений различного строения был использован метод биоиндикации с применением инициированных сообществ. Впервые получены результаты экспериментальных исследований экологического состояния донных отложений Амурского лимана в период ледостава. В качестве биоиндикаторов загрязнения водной среды нефтью и нефтепродуктами использовали бентосные сообщества, отобранные из разных местообитаний. В результате модельного исследования бентосные сообщества проявляли различные ответные реакции на загрязнения донных отложений ароматическими углеводородами и изменяли свою активность по отношению к различным ароматическим соединениям. По всей исследуемой водной акватории южной части Амурского лимана бентосные микробные сообщества (БМС) использовали в качестве источника углерода сырую нефть. В связи с тем, что нефть представляет собой смесь различных углеводородов, легкоокисляемых и трудноминерализируемых соединений утилизация её происходила поэтапно. Во время микробиологической деструкции ароматических соединений на первом этапе осуществляется её детоксикация. Однако для этого необходимы подходящие физикохимические условия среды для развития различных физиологических групп микроорганизмов. В начале модельного исследования был отмечен рост аэробных бактерий на нефтяной пленке. В связи с тем, что растворение гидрофобных фракций нефти и поступление в среду для культивирования происходит постепенно. Наиболее активный рост БМС наблюдался на растворимой фракции нефти (РФН) только на 45 сутки. Скорость расщепления таких субстратов зависела от наличия других токсичных веществ, которые в комплексе могут обладать аддитивным эффектом. Проведенные модельные исследования с использованием в качестве источников углерода приготовленной фракции нефти показали, что не все БМС, отобранные из 126 различных биотопов способны утилизировать водорастворимые ароматические соединения. Следует отметить, что максимальную активность проявляли только БМС на юге Амурского лимана. Установлено, что основу токсических компонентов составляет именно растворенные продукты – предельные углеводороды, нафтеновые кислоты. Возможно, что в водорастворимой фракции нефти присутствует эффект синергизма. Показано, что бензол и монофенол токсичный для микроорганизмов, обитающих в устьевой зоне, поэтому БМС не использовали их в качестве единственного источника углерода. Степень токсичности нефти определяется количественным и качественным составом, в частности содержанием углеводородов (толуол, ксилол, бензол и нафталин). Углеводороды подавляют бактериальный хемотаксис и тем самым препятствуют разложению органического вещества в водоемах, при этом АУ (фенол, толуол, сырая нефть) действуют даже при очень низкой концентрации. Максимальную активность проявляли микробоценозы из донных отложений, отобранных в районе мыса Лазарева и в проливе Невельского по отношению к метиллированным формам бензола (толуол и нефтяной ксилол), которые могут образоваться, в результате длительной микробиологической трансформации ароматических углеводородов. Можно предположить, что здесь происходит вторичное загрязнение донных осадков растворенными органическими веществами, продуктами микробиологической деструкции ароматических соединений. Поэтому эти вещества выступают в качестве фактора экологического риска для развития гидробионтов и могут влиять на воспроизводство биоресурсов в прибрежных морских акваториях. UTILIZATION OF AROMATIC HYDROCARBONS BACTERIOBENTHOS 1 Stukova O. Y, 2Shevkunova O. I 1 Institute of Water and Ecological Problems, FEB RAS, 2Far Eastern State Transport University, Khabarovsk, Russia e-mail: olgastukova1@rambler.ru Currently, the environmental problem of pollution of coastal waters aromatic hydrocarbons of different origin acquired relevance. Due to the fact that aromatic hydrocarbons (AU) can accumulate in soft tissues of aquatic organisms, they may persist for a long time in the environment, providing cancinogenic, mutagenic and toxic influence. Decisive role in the process of purification of sediments is given to the microorganisms and their adaptive capacity. Special biochemical organization of microbial cells is associated with its multifunctional enzyme activity. Microbial complexes are capable of damaging and disabling a number of different toxic organic substances. The main objective of the research was to examine the activity of benthic microbial of the Amur estuary, formed in the bottom sediments of the mixing zone of the marine and fresh water in relation to aromatic compounds with different structures (oil, water-soluble fractions of petroleum, benzene phenol, xylene, toluene). Microbial complexes of sediment collected in March 2008 were used as objects of the experiments to determine the activity of self-purification in the Amur estuary of the aromatic compounds of different structure the method with bioindication initiated by communities was used. The experimental results of the ecological state of sediments Amur estuary during the freezing period were obtained for the first time. Benthic communities, selected from different habitats were used as bioindicators of water pollution by oil and petroleum products. As a result of the model, study benthic communities showed different responses to sediment contamination by aromatic hydrocarbons and changes, its activity towards various aromatic compounds. In all investigated water area of the Amur estuary microbial complexes, selected to the south of the estuary used crude as a carbon source. Due to the fact that oil is a mixture of various hydrocarbons, easily oxidized and compounds mineralizired with difficulties took place gradually. 127 Its on the during the microbial degradation of aromatic compounds detoxification takes place requires appropriate physical and chemical condition of the environment for which development of various physical groups of microorganism. At the beginning of the model study the growth of aerobic bacteria on the oil film was marked. Due to the fact that the dissolution of the hydrofoil fraction and their arrival into the culture medium take place gradually, the most active growth of benthic microbial communities (BMS) was only observed in the soluble fraction of crude oil (NGF) 45 days later. The rate of cleavage of substrates depended on the presence of other toxic substances, which may have an additive effect together. The fulfilled model studies, using as carbon sources NGF, showed that not all of BMS, selected from a variety of habitats can utilize water-soluble aromatic compounds. It should be noted that the maximum activity showed only BMS in the south of the Amur estuary. It was ascertained that the basis of toxic components is exactly soluble products – saturated hydrocarbons, naphthenic acid. It is considered that there is an effect of synergy in the soluble fraction. It is ascertained that the microorganisms living in the estuarine zone did not use benzene, monophenols were also toxic for them, so their BMS was not used as the only carbon source. The toxicity of oil is determined by the quantitative and qualitative composition, in particular volatile hydrocarbons (toluene, xylene, benzene), and naphthalene. Hydrocarbons inhibit bacterial chemotaxis and thereby prevent the decomposition of organic matter in water bodies, and the AU (phenol, toluene, crude oil) are effective even at very low concentrations. The most active growth of benthic communities on benzene and phenol was observed from samples of sediment collected in the southern part of the Amur estuary. Microbial complexes of sediment collected in the vicinity of Cape Lazarev and Nevelsky Strait exhibited the maximum activity in relation to the methylated forms of benzene (toluene and xylene, petroleum), which may result from prolonged microbiological transformation. We can assume that there happens secondary contamination of bottom sediments by dissolved organic substances, products of microbial degradation of aromatic compounds. Therefore, these substances act as environmental risk factors for the development of aquatic organisms that may affect the reproduction of biological resources in coastal waters. КАЧЕСТВО ВОДЫ И СОВРЕМЕННОЕ СОСТОЯНИЕ ВОД ОЗЕРА БАЙКАЛ ПО САНИТАРНО-МИКРОБИОЛОГИЧЕСКИМ ПОКАЗАТЕЛЯМ Суслова М.Ю., Кравченко О.С., Косторнова Т. Я., Парфенова В.В. УРАН Лимнологический институт СО РАН, а/я 278, 664033, Иркутск, Россия e-mail: suslova@lin.irk.ru Пресные водоемы служат основными источниками питьевой воды, поэтому одной из сторон пристального исследования является изучение состава и функционирования микробных сообществ водных экосистем, определяющих или влияющих на качество воды. Широко известным примером олиготрофного, глубоководного озера, который служит источником для получения питьевой воды, является озеро Байкал. Общий объем содержащейся в Байкале воды составляет 20% от всей пресной воды планеты. Проведенные в 2010 г. исследования были направленны на изучение пространственного и количественного распределения органотрофных и санитарнопоказательных бактерий (СПБ) в воде озера. Пробы отбирались по всей акватории. Органотрофные бактерии учитывали на среде РПА, разбавленной в 10 раз (Горбенко А.Ю., 1992). Количественный анализ на содержание колиформных бактерий (ОКБ, ТКБ) проводили согласно МУК 4.2.1884-04 (2005), а определение общего микробного числа (ОМЧ) по МУК 2.1.4.1184-03 (2003). Микробиологические исследования в июне 2010 г. показали, что наибольшая численность СПБ в Южном Байкале выявлена у пос. Култук, в 15 км от берега. СПБ были 128 обнаружены во всех пробах, отобранных на этой станции. Численность ОКБ составила от 10 КОЕ/100 мл до 147 КОЕ/100 мл, ТКБ 25 КОЕ/100 мл было обнаружено на глубине 5 м, в то время как ОМЧ не превышало 7 КОЕ/мл. На Южном Байкале СПБ также были выявлены на трех станциях разреза Маритуй-Солзан, где численность ОКБ в среднем составила 16 КОЕ/100 мл, а ТКБ–6 КОЕ/100 мл. В начале июня в Среднем Байкале СПБ были обнаружены в пробах воды взятых на глубине 50 м станций 3 км от м. Ухана и центральной станции Ухан–Тонкий, где ОКБ–15 КОЕ/100 мл и 4 КОЕ/100 мл, соответственно. На станции 3 км от м. Тонкий на поверхности ОКБ и ТКБ составляло 5 и 2 КОЕ/100 мл, соответственно. В поверхностных пробах центральной станции Крестовый–Хобой ОКБ было 8 КОЕ/100мл, ТКБ–2 КОЕ/100 мл. Наибольшая численность ОМЧ определена на станциях Малого моря, где колебалась от 6 до 225 КОЕ/мл. В августе СПБ были детектированы на станциях 3 км от м. Тонкого и 7 км от м. Ижемей. В Северном Байкале в июне высокая численность СПБ наблюдалась на центральной станции Солнечный–Ушканьи в поверхностном слое воды, где ОКБ составило 96 КОЕ/100мл, ТКБ–26 КОЕ/100 мл и ОМЧ–13 КОЕ/мл. Максимальная численность СПБ зарегистрирована в точке 7 км от Нижнеангарска в поверхностной пробе (ОКБ - 410 КОЕ/100 мл, ОМЧ–30 КОЕ/мл) и на глубине 10 м (ОКБ–300 КОЕ/100 мл). На станции Тыя–Немнянка в толще воды от 0 до 50 м численность ОКБ колебалась от 1 до 170 КОЕ/100 мл, ОМЧ от 1 до 62 КОЕ/мл, ТКБ–1 КОЕ/100 мл - на поверхности. В августе ОКБ были обнаружены на станции 7 км от Нижнеангарска по всех глубине (от 0 до 200 м) и составляли от 1 до 4 КОЕ/100 мл. В июне 2010 г. численность органотрофнных микроорганизмов по всей акватории озера составляла от 0 до 345 КОЕ/мл, где четверть посевов не дали рост. Максимальные значения зарегистрированы на разрезе Тыя-Немнянка от 2 до 300 КОЕ/мл. В августе численность органотрофных бактерий колебалась от 14 КОЕ/мл на станции центр Ухан– Тонкий (придонный горизонт) до 1700 КОЕ/мл на поверхности станции Елохин–Давша. Особое внимание было уделено устьям и протокам наиболее крупных рек впадающих в Байкал. Здесь численность органотрофных бактерий составляет сотни и тысячи КОЕ/мл, а ОМЧ до 230 КОЕ/мл. Кроме того, здесь же обнаружены ОКБ до 416 КОЕ/100 мл и ТКБ до 11 КОЕ/100 мл. Таким образом, в результате проведенных исследований воды Байкала можно отнести к предельно чистым–в июне, и очень чистым–в августе. Поступление в Байкал достаточно большого количества загрязненных речных вод, а также недостаточно-очищенных хозяйственно-бытовых стоков, ведет к снижению качества воды озера. В связи с этим исследования качества вод самой акватории и основных притоков Байкала должны стать неотъемлемой частью мониторинга его экосистемы для сохранения водных ресурсов озера и его бассейна. WATER QUALITY AND PRESENT STATE OF LAKE BAIKAL WATER: SANITARYMICROBIOLOGICAL CHARACTERISTICS Suslova M.Yu., Kravchenko O.S., Kostornova T.Ya., Parfenova V.V. Limnological Institute SB RAS, 3, Ulan-Batorskaya St., Irkutsk 664033, Russia e-mail: suslova@lin.irk.ru Freshwater bodies serve as the main source of drinking water. Therefore, one of the aspects of thorough studies is the survey of composition and functioning of microbial communities in aqueous ecosystems determining or affecting water quality. Lake Baikal is a well-known example of an oligotrophic deep lake which is the source of drinking water. The lake contains 20% of all freshwaters of the world. Surveys performed in 2010 were aimed at studying spatial and quantitative distribution of organotrophic and sanitary-representative bacteria (SRB) in the lake water. Samples were collected 129 around the entire water area of the lake. Organotrophic bacteria were counted on the FPA medium diluted 10 times (Gorbenko, 1992). Quantitative analysis on the content of coliform bacteria (total amount of coliform bacteria (TACB) and thermotolerant coliform bacteria (TTCB)) according to Methodical Guidelines 4.2.1884-04 (2005), and total microbial amount (TMA) according to Methodical Guidelines 2.1.4.1184-03 (2003). Microbiological studies performed in June 2010 showed that the highest SRB abundance was detected in Southern Baikal at Kultuk settlement 15 km off the shore. SRB were recorded in all samples collected from this site. TACB ranged from 10 to 147 CFU/100 ml, TTCB (25 CFU/100 ml) were registered at a depth of 5 m, whereas TMA did not exceed 7 CFU/100 ml. In Southern Baikal, SRB and TTCB were on average 16 CFU/100 ml and 6 CFU/100 ml, respectively. In early June, SRB were detected in the water samples collected at 3 km from Cape Ukhan from 50 m and at the central site Ukhan-Tonky (Central Baikal) where TACB amounted to 15 CFU/100 ml and 4 CFU/100 ml, respectively. At the site 3 km off Cape Tonky, TACB and TTCB were 5 and 2 CFU/100 ml on the surface, respectively. In the surface samples from the central site Krestovy-Khoboy, TACB and TTCB made up 8 and 2 CFU/ 100 ml, respectively. The highest abundance of TMA was recorded at sites in Maloye More ranging from 6 to 22 CF/100 ml. In August, SRB were detected at 3 km off Cape Tonky and 7 km of Cape Izhemey. In Northern Baikal, high abundance of SRB was detected at the central site SolnechnyUshkany in the surface water layer in June where TACB made up 96 CFU/100 ml, TTCB – 26 CFU/100 ml and TMA – 13 CFU/100 ml. Maximal abundance of SRB was registered at 7 km off Nizhneangarsk in the surface water sample (TACB – 410 CFU/100 ml, TMA – 30 CFU/100 ml) and at a depth of 10 m (TACB – 300 CFU/100 ml). At the site Tyya-Nemnyanka in the 0-50 m layer, TACB ranged from 1 to 170 CFU/100 ml, TMA – from 1 to 62 CFU/100 ml, and TTCB – 1 CFU/100 ml on the surface. In August at 7 km off Nizhneangarsk, TACB were detected within the entire depth (0-200 m) – 1-4 CFU/100 ml. In June 2010, the abundance of organotrophic microorganisms around the entire water area ranged from 0 to 345 CFU/100 ml where ¼ of the plating did not sprout. Maximal values were recorded at Tyya-Nemnyanka – from 2 to 300 CFU/100 ml. In August, the abundance of organotrophic bacteria ranged from 14 CFU/100 ml at the site Ukhan-Tonky (near-bottom layer) to 1,700 CFU/100 ml on the surface at the site Elokhin-Davsha. Special attention was paid to mouths and flows of the largest tributaries of Lake Baikal. The abundance of organotrophic bacteria in these areas were hundreds and thousands CFU/100 ml, and TMA – up to 230 CFU/100 ml. Moreover, TACB and TTB were also detected here up to 416 and 11 CFU/100 ml, respectively. Thus, as a result of these studies, Lake Baikal may be considered as a maximum pure lake in June and very pure in August. Input of rather large amount of polluted river waters into Lake Baikal and poorly treated wastes lead to deterioration of water quality of the lake. Therefore, studies of water quality in the water area of the lake and of the main tributaries of Lake Baikal should become an integrated part of monitoring of its ecosystem for conservation of water resources of the lake and its basin. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ И БИОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ БАКТЕРИОФАГОВ Pseudomonas aeruginosa ОЗЕРА БАЙКАЛ Сыкилинда Н.Н.1, Ковадло А.С. 2 , Кадыков В.А.1, Шнейдер М.М.1 , Курочкина Л.П.1, Шишкова Н.А. 3, Месянжинов В.В.1 , Дрюккер В.В.2, Мирошников К.А.1 1 Учреждение Российской академии наук Институт биоорганической химии им. акад. М.М. Шемякина и Ю.А. Овчинникова РАН, 117997, ул. Миклухо-Маклая 16/10, г. Москва В-437, Россия, 2 Учреждение Российской академии наук Лимнологический институт СО РАН, 664033, а/я 278, г. Иркутск, 33, Россия, 3 Федеральное государственное учреждение науки 130 государственный научный центр прикладной микробиологии и биотехнологии, п. Оболенск Серпуховского района Московской области, Россия e-mail: sykilinda@mail.ru Бактериофаги (вирусы бактерий) – важное трофическое звено водных экосистем, которые контролируют численность и многообразие микроорганизмов в планктоне и бентосе. Ранее в Лимнологическом институте СО РАН методом трансмиссионной электронной микроскопии (ТЭМ) было изучено морфологическое разнообразие бактериофагов озера Байкал, их размерная структура, сезонная динамика численности и вертикальное распределение по глубине. Цель данной работы - выделение и изучение биологических свойств бактериофагов Ps. aeruginosa озера Байкал. Выбор объекта обусловлен экологической и медицинской значимостью хозяина. Псевдомонады принимают активное участие в процессах деградации самых различных органических веществ и широко представлены в микробном сообществе Байкала. Кроме того, Ps. aeruginosa - условный патоген с множественной устойчивостью к антибиотикам и наиболее частый возбудитель внутрибольничных инфекций, представляет серьезную проблему для медицины и ветеринарии. Использование бактериофагов или их компонентов в качестве альтернативы антибиотикам рассматривается как перспективное направление в терапии таких заболеваний. Для выделения бактериофагов из проб воды использовали общепринятый метод обогащения фагов в присутствии Ps. aeruginosa РАО1. Также был апробирован хроматографический метод сорбции вирусов из большого объема воды на аффинном носителе Hi-TrapQ (GE Healthcare). Наличие фагов в образцах выявляли стандартным методом агаровых слоев по пятнам лизиса на газоне тестируемых бактерий. Бактериофаги наращивали из отдельных бляшек и чистили в ступенчатом градиенте концентраций хлористого цезия. Для характеристики вирусных частиц использовали методы ТЭМ, электрофорез в ПААГ в денатурирующих условиях, электрофорез в агарозном геле фаговых ДНК после обработки рестриктазами. Для более точной классификации применяли метод полимеразной цепной реакции (ПЦР), используя в качестве матриц ДНК байкальских фагов и праймеры, сконструированные на основе анализа консервативных нуклеотидных последовательностей известных групп фагов (РВ1-, KMV-, phiKZ-, EL-, P2-, LUZ-, phiCD119- и D3- группы фагов), представленных в базе данных GenBank. С этой же целью проводили секвенирование отдельных фрагментов фаговых ДНК и сравнивали с известными последовательностями из GenBank. Биологическую активность бактериофагов проверяли на клинических изолятах Ps. аeruginosa. Выделены и охарактеризованы бактериофаги четырех морфотипов. Использование молекулярно-генетических и биологических методов исследования позволило установить принадлежность некоторых из них к фагам широко распространенных изученных групп. Выделены также бактериофаги, видовую принадлежность которых не удалось установить. Повсеместно на протяжении всего периода исследований (2005-2010 гг.) выделялись умеренные фаги семейства Siphoviridae. Бактериофаги, выделенные из девяти районов озера Байкал, имели сходные морфологию вирусных частиц и набор структурных белков. По результатам рестрикционного анализа фаговых ДНК и определения спектра хозяев фаги разделены на 3 группы. Методом ПЦР не удалось идентифицировать их видовую принадлежность. Один из выделенных вирусов семейства Siphoviridae с иным набором структурных белков является PMG1-подобным из D3-группы бактериофагов. Выделено два суперинфекционных фага семейства Inoviridae c характерным набором структурных белков и различающиеся между собой размером репликативных форм ДНК (FB1-12 kb и FB2-10 kb). Результаты секвенирования ~95% генома фага FB1 показали полную гомологию с геномом фага PF4 – профагом Ps. aeruginosa РАО1, играющим важную роль в жизненном цикле биопленок. Охарактеризованы две группы фагов семейства Myoviridae, выделенные в разное время и из разных районов Байкала. Три литических бактериофага первой группы лизируют 131 большинство патогенных штаммов Ps. аeruginosa. На основании проведенных исследований они являются представителями повсеместно распространенной консервативной группы PB1 фагов. Три других фага этого же семейства образуют едва заметные пятна лизиса на газоне клеток PAO1. Секвенирование отдельных фрагментов ДНК одного из этой группы фагов выявило наличие нуклеотидных последовательностей, не представленные в базе данных GenBank. Выделенный фаг семейства Podoviridae является представителем известной консервативной группы KMV –подобных фагов. Работа выполнена при поддержке гранта РФФИ № 09-05-00725а. MOLECULAR-GENETIC AND BIOLOGICAL CHARACTERISTICS OF BACTERIOPHAGES Pseudomonas aeruginosa FROM LAKE BAIKAL Sykilinda N.N.1, Kovadlo A.S.2, Kadykov V.A.1 , Schneider M. М.1, Kurochkina L.P.1, Shishkova N.A. 3, Mesyanzhinov V.V.1 , Drucker V.V.2, Miroshnikov К.А.1 1 Shemyakin-Ovchinnikov Institute of Bioorganic Chemistry of the Russian Academy of Sciences, 117997, street Miklukho-Maklaya 16/10, Moscow В-437, Russia, 2Limnological Institute of the Siberian Branch of the Russian Academy of Science, 664033, P.O. Box 278, Irkutsk, 33, Russia, 3 Federal official body of a science the state center of science of applied microbiology and biotechnology, Obolensk of the Serpukhov area of Moscow Region, Russia e-mail: sykilinda@mail.ru Bacteriophages (viruses of bacteria) are an important trophic link of water ecosystems, which control abundance and diversity of microorganisms in a plankton and a benthos. A morphological diversity of free bacteriophages of Lake Baikal, their dimensional size, seasonal and depth variation in abundance has been revealed with transmission electron microscopy (TEM) at Limnological Institute SB RAS earlier. The goal of this work is to isolate and investigate bacteriophages of Pseudomonas aeruginosa. The choice of the host is accounted for high abundance of Pseudomonads in the ecosystem of Lake Baikal and their ability to utilize various compounds as sources of carbon and energy. In addition Ps. aeruginosa is multidrug resistance facultative human pathogen, the most common and lethal hospital infectious agent and represents a serious problem for medicine and veterinary science. Use of phages or their products alternatively to antibiotics in therapy is considered as effective against such infections. Standard host enrichment protocol was used for phage isolation from fresh water with Ps. aeruginosa PAO1 as target host strains. The chromatographic method of sorption of viruses from great volume of water on affine carrier Hi-TrapQ (GE Heatheare) has been approved also. Presence of phages in samples revealed a standard method of double agar layers. Bacteriophages from single plaques grown and in a gradient of concentration of chloride cesium purified. Morphology of virus particles studied with ТEМ methods. SDS-PAGE of structural proteins of virus particles, genome restriction analysis, PCR amplification and sequencing of separate fragments genomes and homology search have been used for classification of bacteriophages. Bacteriophages of four morphotypes are isolated and characterized. The results of the molecular- biological researches have shown, that some of them belong to phages of the widespread studied groups. Other bacteriophages couldn't identified by these methods. Everywhere throughout all period of researches (2005-2010) were isolated the temperate bacteriophages of family Siphoviridae. The bacteriophages isolated from nine regions of Lake Baikal, had similar morphology of virus particles and a set of structural proteins. By results of the restriction of the virus DNA and definitions of a spectrum of the hosts the bacteriophages are divided into three groups. These bacteriophages couldn't identified by PCR method. One of the isolated viruses of family Siphoviridae with other set of structural proteins is PMG1-like bacteriophage of D3-group. Two superinfectious phages of family Inoviridae having a characteristic set of structural proteins and differing of the size of replicative DNA forms (FB1-12 kb and FB2-10 kb) are isolated. The results of sequences of 95% phage FB1 genome have shown a full homology with genome of 132 phage PF4 which is prophage Ps. aeruginosa РАО1, playing an important role in life cycle of biofilms. Two groups of phages families Myoviridae isolated at various times and from different regions of Baikal are characterized. Three lytic bacteriophages of the first group are strictly virulent for the many pathogenic Ps. аeruginosa strains. Based on the of the molecular- biological researches, these phages can be classified into everywhere widespread conservative group PB1 of phages. Other three phages of the same family form turbid plaques on Ps. aeruginosa РАО1. The presence nucleotide sequences not presented in databases has revealed by sequencing of separate DNA fragments of one from this group of phages. The isolated phage of family Podoviridae is identified as the representative of known conservative group of KMV -like phages. The work was supported by the grant RFBR № 09-05-00725a. СВОЙСТВА БАКТЕРИОФАГОВ, ВЫДЕЛЕННЫХ ИЗ ПРИРОДНЫХ ИСТОЧНИКОВ И ОБЛАДАЮЩИХ ЛИТИЧЕСКИМ ДЕЙСТВИЕМ В ОТНОШЕНИИ БАКТЕРИЙ ВИДА BACILLUS THURINGIENSIS Талалаева Г.Б. ГОУ ВПО «Иркутский государственный университет», Иркутск, 664003, ул. Сухэ-Батора, 5, Россия e-mail: nadin_buk@mail.ru Целью нашей работы являлось сравнительное изучение спектра литического действия фагов, выделенных из лизогенных штаммов бактерий вида B. thuringiensis, а также фагов, выделенных из природных источников (проб воды из естественных водоемов и почвы). Забор проб воды производили из Иркутского водохранилища, рек Ангара, Ушаковка и оз. Байкал (в районе г. Байкальск) в слое, не превышающем 15 см от поверхности, в 3-5 м от прибрежной части водоема. Забор проб почвы осуществлялся вблизи водоема в 20-50 м от берега, в горизонте 5-20 см. В качестве индикаторных культур использовали 20 штаммов B. thuringiensis, относящихся к разным биохимическим и серологическим вариантам. Сравнительный анализ полученных результатов показал, что фаги (3-и образцаштамма), выделенные из проб воды Иркутского водохранилища и р. Ангара (в других пробах фаги отсутствовали), лизировали 11-14 штаммов из 20-ти индикаторных культур. Фаги, выделенные из почвы (5 образцов – штаммов), лизировали 12-16 штаммов из 20-ти индикаторных культур. В то же время фаги, выделенные из 2-х лизогенных культур B. thuringiensis (biovar galleriae, serovar H5a5b и biovar dendrolimus, serovar H4a4b) лизировали 1-7 штаммов из 20-ти опытных культур. Таким образом, фаги, выделенные из природных источников, обладают широким спектром литического действия по отношению бактерий вида B.thuringiensis в сравнении с фагами, выделенными из лизогенных культур этого вида. PROPERTIES OF BACTERIOPHAGES ISOLATED FROM NATURAL SOURCES AND HAVING LYTIC ACTION IN RELATION TO BACTERIA OF BACILLUS THURINGIENSIS Talalaeva G.B. State Educational Institution of Higher Professional Education “Irkutsk State University”, Irkutsk, 664003, 5 Sukhe-Batora St., Russia e-mail: nadin_buk@mail.ru The purpose of our research was to perform a comparative study of the range of lytic action by bacteriophages isolated from lysogenic strains of B. thuringiensis, as well as by bacteriophages isolated from natural sources (water samples from natural bodies of water and soil). 133 Water samples were collected from Irkutsk Reservoir, the Angara, the Ushakovka Rivers and Lake Baikal (in the area of the town of Baikalsk). Samples were taken from the top layer not deeper than 15 cm from the surface, at the distance of 3-5 m from the shore. Soil samples were collected near the water body at the distance of 20-50 m from the shore, at the depth interval of 5-20 cm. 20 strains of B. thuringiensis belonging to various biochemical and serological type were used as indicator cultures of the study. Comparative analysis of water samples indicated that bacteriophages (3 sample strains) isolated from the water of the Irkutsk Reservoir and the Angara River (no bacteriophages were present in the remaining samples) performed lytic action in relation to 11-14 strains out of 20 indicator cultures. Bacteriophages isolated from soil (5 sample strains) performed lytic action in relation to 12-16 strains out of 20 indicator cultures. Alongside with that, bacteriophages isolated from 2 lysogenic cultures of B. thuringiensis (biovar galleriae, serovar H5a5b, and biovar dendrolimus, serovar H4a4b) performed lytic action in relation to 1-7 strains out of 20 experimental cultures. Thus, bacteriophages isolated from natural sources have broader range of lytic action in relation to B. thuringiensis bacteria versus bacteriophages isolated from lysogenic cultures of this type. ЭКОЛОГИЧЕСКИ ЧИСТАЯ БИОТЕХНОЛОГИЯ ПЕРЕРАБОТКИ ОТХОДОВ СЕЛЬСКОХОЗЯЙСТВЕННЫХ КОМПЛЕКСОВ Уринова А.А., Кутлиев Дж., Мавлянова М.И. Институт микробиологии АН РУз, 100128, ул. А. Кадыри 7б, г. Ташкент, Узбекистан e-mail: kutliyev@rambler.ru Сточные воды птицефабрик, расположенных на территории крупных городов, поступающие в водоемы, вызывают серьезные санитарно-эпидемиологические нарушения. В условиях республики Узбекистан широко используется метод очистки сточных вод промышленных и сельскохозяйственных предприятий с помощью микроорганизмов и высших водных растений (Pistia stratiotes и Eihornia crassipes), корневая система которых является естественным иммобилизатором различных групп микроорганизмов. Цель работы – поиск путей повышения интенсивности очистки сельскохозяйственных стоков с помощью микроорганизмов, активно разрушающих загрязнители. Материалы и методы: Микроорганизмы культивировали на элективных средах, характерных для каждой группы бактерий. Численность бактерий определяли методом десятикратных разведений. Изучались сточные воды птицефабрики «Майская», расположенной в городской черте г.Ташкента, имеющие резкий запах аммиака, сероводорода, содержащие избыток органических веществ, особенно различные формы азота (до 2000 мг/л), характеризующиеся практически отсутствием кислорода. В процессе утилизации этих веществ в сточной воде большую роль играют физиологические группы бактерий, такие как аммонификаторы, нитрификаторы, денитрификаторы, сульфатредуцирующие, целлюлозоразлагающие, численность которых в зависимости от степени очистки стоков колеблется от 103 до 5х106 кл/мл, а также микромицеты, активно участвующие в окислительно-восстановительных процессах. Органические вещества под их действием разлагаются с образованием аммиачного азота, который окисляется до нитритов, затем до нитратов и в последний стадии до свободного азота, количество растворенного кислорода достигает 11-12 мг 02/л, БПК5 снижается с 700 до 30 мг 02/л сточная вода становится прозрачной, запах отсутствует. Только в воде, очищенной от токсических веществ, могут развиваться макрофиты. Дальнейшая очистка происходит в сообществе бактерии-растения. В сточной воде 134 птицефабрики интенсивно развиваются простейшее, регулирующие численность бактерий, уничтожающие патогенные формы. В начальных прудах выявлены простейшие из полисапробной зоны, в конечных биопрудах, где интенсивно развивались макрофиты, доминируют представители мезосапробной зоны, а перед спуском в водоём - в незначительном количестве олигосапробы. В климатических условиях Узбекистана биологический метод очистки сточных вод в биопрудах можно применять 9 месяцев в году, доводя степень очистки до 90-95%. Прирост биомассы пистии и эйхорнии на сточных водах птицефабрики составил 1 кг/м2/сутки, за сезон-2700-3000 т/га сырой или 150 т абс. сухой массы. Очищенная в биологических прудах вода с использованием микроорганизмов и макрофитов является оптимальным способом решения проблемы деструкции различных загрязнителей. Данная технология характеризуется экономичностью, высокой эффективностью и экологической безопасностью. Очищенную воду можно использовать для повторного гидросмыва и орошения с/х культур. Использование бактерий и макрофитов для доочистки сточных вод птицефабрик позволяет существенно улучшить экологическую обстановку. ENVIRONMENTALLY APPROPRIATE BIOTECHNOLOGY OF FARM PRODUCTS PROCESSING Urinova A.A., Kutliev J., Mavlyanova M.I. Microbiology institute ASc RUz, 100128, A.Kadiri, 7b Tashkent, Uzbekistan e-mail: kutliev@rambler.ru Wastewaters from poultry factories in a territory of metropolises cause severe sanitary and hygienic breach. Microorganisms and higher water plants with massive root system (such as Pistia stratiotes and Eihornia crassipes) are widely used in industrial and agricultural water treatment in Uzbekistan. The goal of the project was searching for novel ways of agricultural waste water treatment. Materials and methods: Microorganisms were cultivated on a proper selective medium for each group of bacteria. Bacteria population was calculated by tenfold dilution. We studied sewage water with oxygen deficiency and poignant smell of ammonium, hydrogen sulfide, abundance of organic matter, various forms of nitrogen (about 2000mg/ml) from the territory of “Mayskaya” poultry factory within the precincts of Tashkent city. Physiological groups of bacteria such as ammonificators, nitrifiers, denitrifiers, sulfatereducing and cellulose-fermenting bacterium, with a population varying from 103 to 5×106 cells per ml, as well as micromycetes,that take part in redox reactions, play an important role in the process of waste water treatment. Under effect of above-mentioned bacteria organic compounds decompose to ammonia nitrogen which then oxidizes to nitrite, nitrate and free nitrogen. Oxygen level increases to 11-12 mg O2/l, biochemical oxygen demand decreases from 700 to 30 mg O2/l, sewage water becomes clear, smell vanishes. Macrophytes can only grow in toxins purified water. Further purification takes place in bacteria-plants cooperation. Protozoa that regulate bacteria population and destruct pathogens can intensively grow in factory sewage water. In the initial ponds there are polysaprobic protozoa, in last bioponds with intensive growing macrophytes mezosaprobic protozoa dominate, before water discharge there are also traces of oligosaprobic protozoa. 135 Biological approaches of bioponds wastewater treatment in Uzbekistan may be used 9 months a year, while purification efficiency may reach 90-95%. In poultry sewage water pistia and eihornia biomass increment is 1 kg/m2 per day, 2700-300 tonnes/hectare of raw and 150tonnes of absolute dry matter per season. Using microorganisms and macrophytes to purify water in biological ponds is an optimal way to destroy various contaminants. The technology is economical, high effective and ecologically safe. Purified water then approached for water rewash and agricultural irrigation. Bacterial and macrophytal afterpurification of sewage water from poultry factory enables to improve ecological situation in significant way. БИОРЕМЕДИАЦИЯ НЕФТЯНЫХ ЗАГРЯЗНЕНИЙ С ИСПОЛЬЗОВАНИЕМ БИОПРЕПАРАТА «МИКРОБАК», КОНСОРЦИУМА ПЛАЗМИДОСОДЕРЖАЩИХ ШТАММОВ «ВИО» И АССОЦИИРОВАННЫХ РАСТЕНИЙ Филонов А.Е.1, Овчинникова А.А.1, Ветрова А.А.1, Нечаева И.А.2, Петриков К.В.2, Власова Е.П.2, Ахметов Л.И.1, Пунтус И.Ф.1, Забелин В.А.3, Боронин А.М.1 1 УРАН Институт биохимии и физиологии микроорганизмов им. Г.К.Срябина РАН, пр. Науки, 5, г. Пущино, Московская обл., 142290, Россия; 2 ГОУ ВПО Тульский государственный университет, пр. Ленина, 92, г. Тула, 300600, Россия; 3 ОАО «Биоойл», Красный пр., 13, г. Новосибирск, 630007, Россия e-mail: filonov.andrey@rambler.ru Целью работы были скрининг углеводородокисляющих микроорганизмов и разработка эффективных микробных консорциумов и биопрепаратов для очистки окружающей среды от разливов нефти и нефтепродуктов в широком диапазоне температур. Необходимость рекультивации обширных территорий России, загрязненных нефтью и нефтепродуктами, очевидна. Известно, что нефтяные разливы достигают 15 млн. тонн в год при ежегодной добыче 400 млн. тонн. Наши подходы к разработке технологий очистки включают активацию эндогенной микрофлоры и интродукцию активных штаммов микроорганизмов и их консорциумов, способных к эффективной деградации нефтепродуктов в сочетании с устойчивыми к нефти растениями. Одним из основных методов очистки нефтезагрязненных территорий является применение биопрепаратов. По нашему мнению, в состав биопрепаратов целесообразно включать плазмидсодержащие микроорганизмы, способные утилизировать углеводороды нефти в широком диапазоне температур и рН, при повышенном содержании соли и продуцировать поверхностно-активных веществ. Результаты: На основании скрининга большая коллекция микроорганизмов лаборатории биологии плазмид (ИБФМ РАН им. Г.К.Скрябина), способных к деградации различных углеводородов, были отобраны и охарактеризованы наиболее активные плазмидсодержащие штаммыдеструкторы. Эти штаммы были затем использованы при разработке биопрепарата "МикроБак" и консорциума "ВиО". Помимо микроорганизмов, растения также играют значительную роль в ремедиации нефтезагрязнённых почв. Мы показали, при использовании совместном использовании ассоциации микроорганизмов и растений, эффективность деструкции нефти увеличивалась, поскольку растения вносили свой вклад в процесс снижения концентрации загрязнителя и обеспечивали благоприятные условия для роста и метаболизма штаммов-деструкторов. Газонная трава и ячмень оказались наиболее устойчивыми к нефти по результатам проведенного скрининга. Полевые испытания биопрепарата опытного образца биопрепарата "МикроБак", состоящего из штаммов Pseudomonas и Rhodococcus, проводили на почвах, загрязненных дизельным топливом, газовым конденсатом и мазутом, в г. Шатск Тульской области, Россия, 136 в течение сентября-ноября 2007 года. Степень деструкции углеводородов нефти составила более 90% через два месяца после обработки. Кроме того, совместно с ОАО "Биоойл" проводились полевые испытания консорциума «ВиО» на территории нефтяных месторождений в Ямало-Ненецком АО в течение июля-августа 2008 года. Уровень очистки достигал 70% через 2 месяца после интродукции микробного консорциума. Выводы: Лабораторные исследования и полевые испытания продемонстрировали высокую нефтеокисляющую активность ассоциации "ВиО" и биопрепарата "МикроБак". Они могут быть рекомендованы для очистки почвенных и водных экосистем от разливов нефти и нефтепродуктов в средней климатической полосе и северных географических регионах (температурный диапазон от 0 до 42°С). Работа выполнена при поддержке грантов МНТЦ # 2366, МНТЦ # 3624, РФФИ-08-0499019-офи, Федеральной целевой программы Государственный контракт 02.740.11.0296, Государственный контракт No3N-320-09. OIL-SPILL BIOREMEDIATION USING A BIOPREPARATION “MICROBAC”, A CONSORTIUM OF PLASMID-BEARING STRAINS “V&O” AND ASSOCIATED PLANTS Filonov A.E1, Ovchinnikova A.A.1, Vetrova A.A.1, Nechaeva I.A.2, Petrikov K.V.2, Vlasova E.P.2, Akhmetov L.I.1, Puntus I.F.1, Zabelin V.A.3, Boronin A.M.1 1 G.K. Skryabin Institute of Biochemistry and Physiology of Microorganisms, Russian Academy of Sciences, Prospekt Nauki 5, Pushchino, Moscow Region, 142290 Russia; 2 Tula State University, Prospekt Lenina 92, Tula, 300600 Russia; 3 JSC “Biooil”, Krasny Prospekt 13, Novosibirsk, 630007 Russia e-mail: filonov.andrey@rambler.ru Purpose of work was to screen hydrocarbons-degrading microorganisms and development of effective microbial consortia and biopreparations to clean-up environment from crude oil and oil products spills in a wide temperature range. The necessity of recultivation of spacious territories of Russia polluted with crude oil and oil products is of a great importance. It is known that the leakage reaches 15 million tons per year with annual oil extraction 400 million tons. Our approaches to develop the clean-up technologies include activation of indigenous microflora and the introduction of active microbial strains and consortia able to degrade oil products effectively in combination with oil-resistant plants. One of the main method of clean-up of oil-polluted territories is application of biopreparations. In our opinion there is a necessity of including plasmid-bearing microorganisms capable of utilizing oil hydrocarbons within a wide temperature and pH range, soil salinity and producing surface-active substances. Results: Based on screening of a large collection of microorganisms of Laboratory of Plasmid Biology (IBPM RAS by G.K. Skryabin) able to degrade different hydrocarbons active plasmidbearing strains were selected and characterized. The strains were then used to develop the biopreparation “MicroBac” and the consortium “V&O”. Besides microorganisms plants have a significant role in remediation of oil-spilled soils. We have shown, when using an association of microorganisms and plants jointly, the efficiency of oil degradation increased since plants make a contribution into the process of diminution of pollutant concentration and establish favorable conditions for growth and metabolism of degrader microorganisms. Lawn grass and barley proved to be the most oil-resistant by the results of the performed screening. Fields tests of biopreparation “MicroBac” pilot sample consisting of Pseudomonas and Rhodococcus strains were carried out on soils contaminated with diesel fuel, gas condensated fluid and mazut in Shatsk site of Tula region, Russia, during September-November 2007. Oil 137 hydrocarbons degradation level was more 90% by the third month after the treatment. Moreover together with JSC “Biooil” field tests of “V&O” consortium on the territory of oilfields of YamalNenetsky region were performed during July-August, 2008. Clean-up level reached 70% in 2 months after the consortium application. Conclusions: Laboratory research and field tests performed have demonstrated high oil-oxidizing activity of the association “V&O” and the biopreparation “MicroBac”. They could be recommended to clean-up soil and water biotopes from crude oil and oil products spills contamination in moderate and northern geographic regions (temperature range from 0 to 42°C). This research was supported by ISTC #2366, ISTC #3624, RFBR-08-04-99019-ofi, Russian Federal Program, State Contract 02.740.11.0296, State Contract No3N-320-09. АНАЛИЗ CRISPR-СИСТЕМ МЕТАГЕНОМНОГО СООБЩЕСТВА О. БАЙКАЛ Хабудаев К.В. Лимнологический Институт СО РАН, ул. Улан-Баторская 3, г. Иркутск, Россия. e-mail: khabudaev@lin.irk.ru Недавно открытые и описанные CRISPR-системы, представляющие собой кассеты с набором идентичных повторов, разделенных вариабельными последовательностями (спейсерами), имеют важное значение в противофаговом иммунитете прокариот. Согласно ранее выдвинутой теории, спейсеры представляют собой элементы геномов бактериофагов и плазмид, которые однажды заражали клетку. Анализ таких CRISPR-систем и связанных с ними функциональных компонентов, позволяет определить таксономию организмов, иммунитет к которым имеют исследуемые прокариоты. Однако ранее используемые методы определения таксономии спейсерных последовательностей давали возможность охарактеризовать не более 2% анализируемых последовательностей. Нами был предложен метод исследования спейсеров на основе данных чтений, составляющих сборку метагенома. Такой подход позволил таксономически классифицировать до 9% спейсеров в исследуемых метагеномах. Одним из важных компонентов CRISPR-систем являются C-белки, выполняющие регуляторную функцию работы данной системы. Нами был проведен поиск и анализ регуляторных С-белков в трех образцах метагенома бактериального сообщества, ассоциированного с диатомовой водорослью Synedra acus. Сравнительная характеристика набора трех метагеномов выявила характерные различия состава CRISPR-кассет и C-белков. Analysis of CRISPR-systems in metagenome of bacterial community of Lake Baikal Khabudaev K. V. Limnological Institute SB RAS, 3, Ulan-Batorskaya St, Irkutsk, Russia e-mail: khabudaev@lin.irk.ru The recently discovered and described CRISPR-systems which represent a set of tapes with identical repeats separated by variable sequences (spacers), seem to play an important role in protecting bacterial cell from archaeal virus or bacteriophage assaults. According to the previous theory, spacers are elements of the genomes of bacteriophages and plasmids that infected cells any time. The analysis of such systems and CRISPR-associated functional components allows to determine the taxonomy of viruses that infect bacterial cells. However, previously used methods for determining the taxonomy of spacer sequences allowed possible to characterize not more than 2% of the analyzed sequences. We proposed a new method for studying the spacers based on the reads that constitute the assembly of a metagenome. Such an approach is taxonomically classified to 9% of spacers in the samples of metagenome. The C-proteins are an important component of CRISPRsystems that perform a regulatory function of a system. We carried out a search and analysis of the 138 regulatory C-proteins in three samples of bacterial community metagenome associated with the diatom Synedra acus. Comparative analysis of three metagenomes revealed characteristic differences of the CRISPR-cassettes and C-proteins. АВТОХТОННАЯ И АЛЛОХТОННАЯ МИКРОБИОТА КАРСТОВЫХ ПЕЩЕР И ПОДЗЕМНЫХ ВОДОЁМОВ СРЕДНЕЙ СИБИРИ Хижняк С.В., Нестеренко Е.В., Ланкина Е.П., Илиенц И.Р., Воробьёва С.В., Кимм А.А., Воронов А.И. Красноярский государственный аграрный университет, Красноярск, Мира, 90, Россия e-mail: skhizhnyak@yandex.ru Исследование посвящено изучению бактерий и грибов в известняковых карстовых пещерах средней Сибири. Исследования проводили в девятнадцати пещерах, относящихся к девяти карстовым участкам. Длина пещер варьирует от 41 м (пещера Айдашинская) до 43470 м (пещера Большая Орешная); глубина пещер варьирует от 29 м (пещера Песчаная) до 274 м (пещера Кубинская); температура воздуха, воды и пещерных отложений варьирует от 0 до +5ºC в зависимости от типа пещеры и района внутри пещеры с преобладающей температурой +4ºC; относительная влажность воздуха около 90-100%. Автохтонные микроорганизмы пещерных отложений представлены бактериями и грибами, субстратом для которых служит экзогенное органическое вещество. И бактерии, и грибы адаптированы к низкой температуре с оптимум роста в диапазоне 14–20°C и максимальной температурой роста в диапазоне 26–29°C в зависимости от штамма. Численность грибов варьирует от менее чем 103 колониеобразующих единиц (КОЕ) на грамм отложений в малопосещаемых пещерах и участках пещер, до 3,6x106 КОЕ г-1 в районах с высокой антропогенной нагрузкой, таких, как подземные стоянки спелеотуристов, а также в других районах с источниками органики, таких, как районы обитания колоний летучих мышей или привходовые участки. Среди преобладающих изолятов обнаружены представители родов Penicillium (34,5%), Chrysosporium (21%) and Mucor (20%). Общая численность культивируемых бактерий варьирует от 104 до 107 КОЕ г-1 пещерных отложений и от 102 до 105 КОЕ мл-1 воды. Наиболее обильная и разнообразная бактериальная биота присутствует в участках с высокой антропогенной нагрузкой, где численность бактерий (до 5,75x107 КОЕ г-1) сопоставима с таковой в почвах региона. В отличие от грибов, высокие численности культивируемых бактерий (до 105-106 КОЕ г-1) обнаруживаются и в участках с низкой антропогенной нагрузкой, включая ранее не посещавшиеся человеком участки пещер. Бактерии в пещерах метаболически активны и имеют время генерации in situ 48-72 часа. В пещерных отложениях и подземных водоёмах обнаружены как олиготрофы, так и эвтрофы, относительная численность облигатных олиготрофов варьирует от 6,8 до 94,5% от общего числа культивируемых бактерий. Среди преобладающих пещерных бактерий с путём секвенирования гена 16S рРНК выявлены представители родов Arthrobacter, Bacillus, Sporosarcina, Paenibacillus и Pseudochrobactrum. Аллохтонные бактерии и грибы представлены мезофильными формами, способными к росту при температуре +4ºC. Подземные источники воды в посещаемых пещерах загрязнены Escherichia coli с численностью до 4,8x103 КОЕ мл-1. Относительная численность форм, адаптированных к низкой температуре и мезофилов в разных пещерах, а также в разных участках индивидуальных пещер статистически значимо различается. Максимальная численность форм, адаптированных к низкой температуре (до 91% от общей численности культивируемых бактерий и до 33% грибов) обнаруживаются в малопосещаемых пещерах и участках, характеризующихся длительным притоком органического вещества. Сравнение результатов исследований с результатом математического моделирования показывает. Что формирование микробных сообществ в изученных пещерах до сих пор продолжается. 139 Бактерии и грибы служат субстратом для беспозвоночных, таких как клещи и коллемболы. Результаты лабораторных и полевых экспериментов показали, что выделенные из сибирских пещер адаптированные к низким температурам микроорганизмы могут быть использованы в низкотемпературных биотехнологических процессах, включая защиту растений и биоремедиацию в холодных регионах. AUTOCHTHONOUS AND ALLOCHTONOUS MICROBIOTA OF KARST CAVES AND UNDERGROUND WATER BODIES OF THE MIDDLE SIBERIA Khizhnyak S.V., Nesterenko E.V., Lankina E.P., Ilients I.R., Vorobyeva S.V., Kimm A.A., Voronov A.I. Krasnoyarsk State Agrarian University, Krasnoyarsk, Mira, 90, Russia e-mail: skhizhnyak@yandex.ru The research has been devoted to the study of bacteria and fungi in the limestone karst caves of the Middle Siberia. The researches have been done in nineteen caves of nine karst areas. The length of the caves varies from 41 m (the Aidashinskaya cave) to 43470 m (Bolshaya Oreshnaya cave); the depth of the caves varies from 29 m (Peschanaya cave) to 274 m (Cubinskaya cave); the temperature of air, water and cave sediments varies from 0 to +5ºC depending on the cave type and cave site with prevail temperature +4ºC; relative humidity of air is about 90-100%. The autochthonous microorganisms of cave sediments are presented with bacteria and fungi feeding on the exogenous organic matter. Both bacteria and fungi are cold-adapted with the optimal growth temperature in the range of 14–20°C and the maximal growth temperature in the range of 26–29°C depending on strain. The total number of fungi varies from less then 103 colony forming units (CFU) per gram of cave sediments in low impact caves and cave sites to 3,6x106 CFU g-1 in high impact areas such as underground camp sites or other areas with organic income such as bat's colonies areas or near-entrance areas. Among predominant fungal isolates members of Penicillium (34,5%), Chrysosporium (21%) and Mucor (20%) genera were found. The total number of cultivated bacteria varies from 104 to 107 CFU g-1 of cave sediments and from 102 to 105 CFU ml-1 of water. The most abundant and diverse bacterial biota is present in high human impact areas where number of bacteria (up to 5,75x107 CFU g-1) is comparable with those in the soils of region. In contrast with the fungi, high numbers of cultivated bacteria (up to 105-106 CFU g-1) are found in low human impact areas including previously non-visited cave sites. Cave bacteria are metabolic active with minimal observed in situ generation time 48-72 hours. Both oligotrophs and eutrophs were found in the cave sediments and in the underground water bodies, with the percentage of obligate oligotrophs ranged from 6,8 to 94,5% to total number of cultivated bacteria. Among predominant cave bacteria the members of genera Arthrobacter, Bacillus, Sporosarcina, Paenibacillus and Pseudochrobactrum were found using 16S rRNA Gene sequence analysis. The allochtonous bacteria and fungi are presented with the mesophilic forms which are able to grow at temperature +4ºC. Underground water sources in the high-impact caves are contaminated with Escherichia coli in number up to 4,8x103 CFU ml-1. The relative numbers of the cold-adapted and the mesophilic forms varies significantly between individual caves and between sites within the cave. Maximal numbers of cold-adapted forms (up to 91% of total number of cultivated bacteria and up to 33% of fungi) are found in lowimpact caves and cave sites with long-term income of organic matter. Comparison of the results of study with the results of math modeling showed that microbial communities' formation in the researched caves is still in progress. Both bacteria and fungi serve as a food source for cave invertebrate such as ticks and collembola. The results of laboratory and field experiments demonstrated that cold-adapted 140 microorganisms isolated from Siberian caves can be used in low-temperature biotechnological processes including plant protection and bioremediation in the cold areas. РИЗОСФЕРА ВОДНОГО МАКРОФИТА КАК ЕСТЕСТВЕННЫЙ ИММОБИЛИЗАТОР МИКРООРГАНИЗМОВ Хушмуродова Г., Кутлиев Дж. Институт микробиологии АН РУз, 100128, ул. А. Кадыри 7б, г. Ташкент, Узбекистан e-mail: kutliyev@rambler.ru Эффективная очистка промышленно-бытовых и сельскохозяйственных сточных вод немыслима без поддержания значительной биомассы микроорганизмов в очистном сооружении. Цель работы – изучить взаимоотношение микроорганизмов и высших водных растений при совместном культивировании на сточных водах разных предприятий. В работе использовали классические методы, используемые в микробиологии. Высокую концентрацию микробов-биокатализаторов можно обеспечить путям их иммобилизации на нерастворимых в воде носителях. Для обеспечения иммобилизации повышенного количества биомассы микроорганизмов нами впервые использована гидрокультура (Pistia stratiotes и Eihornia crassipes), обладающая мощной корневой системой, вокруг и на которой концентрируются огромное количество микроорганизмов (500 млн.кл/мл). Среди них много видов, активно участвующих в деструкции загрязняющих веществ в стоках. В сточных водах птицефабрик, ПО «Навоиазот» эти макрофиты действительно проявили себя активными и удобными естественными «иммобилизаторам» биоценоза бактерий, грибов, простейших, которые участвуют в деструкции поступающих со стоками загрязнителей. Модельные лабораторные опыты, проведенные на водопроводной воде, подтвердили высокую аккумуляционную активность корней и корневых волосков пистии и эйхорни, поддерживая плотность клеток 3х105 в мл. В тоже время, в тех участках гидрофита, где нет корней, численность сапрофитных форм микроорганизмов составляла 102 кл/мл. При совместном культивировании микроорганизмов и высших водных растений образуется в зависимости от состава стока огромная биомасса достигающая до 3500 сырой или 180-200 тонн сухой биомассы на га, которую можно использовать в качестве альтернативного источника для получения биотоплива. WATER MACROPHYTE RHIZOSPHEREIS A NATURAL MICROORGANISMS IMMOBILIZATOR Khushmurodova G., Kutliev J. Microbiology institute ASc RUz, 100128, A.Kadiri, 7bTashkent, Uzbekistan e-mail: kutliev@rambler.ru Effective industrial and agricultural waste water treatment is impossible without significant biomass of microorganisms in treating facility to be maintained. The goal of the project is to study microorganisms-higher water plants relationship while cultivating together in factories sewage water. We used classical microbiological approach in our work. High concentration of catalytic bacteria was kept by immobilizing them on insoluble supporters. We introduced water crops (Pistia stratiotes and Eihornia crassipes) to immobilize higher amount of microorganisms’ biomass. These water crops have massive root system where a large number of microorganisms (500 mil.cell/ml) concentrate. There are a lot of strain that destruct contaminants in wastewater. The macrophyte proved to be active and practical natural “immolizator” for bacteria, fungi, and protozoa’s biocoenosis as it was shown in poultry factories and PO “Navoiazot”. Simulated laboratory tests on running water also supported the high accumulating activity of pistia’ and eihornia’s root and root fibril. Cells density reached 3×105 cell per ml. At the same time in the non-root zone of hydrophytes’ body saprophytes number was 102 141 cell per ml. Co-cultivation of microorganisms and higher water plants leads to formation of a great biomass from 3500 tonnes of raw or 180-200 tonnes of dry products per hectare that can be used as alternative source of biofuel. ТРОФИЧЕСКАЯ СТРУКТУРА ДОННОГО МИКРОБНОГО СООБЩЕСТВА В РАЗНЫХ БИОТОПАХ НИЖНЕГО БОТАНИЧЕСКОГО ПРУДА (г. САМАРА) Шерышева Н.Г.1, Осипов Г.А.2, Плетнева С.Ю.3 Институт экологии Волжского бассейна РАН, ул. Комзина, 10, г. Тольятти, Россия; 2 Академическая группа академика РАМН Ю.Ф. Исакова при НЦ ССХ им. А.Н. Бакулева, Рублевское шоссе, д. 135, г. Москва, Россия; 3Тольяттинский государственный университет, ул. Белорусская,16, г. Тольятти, Россия e-mail: sapfir-sherry@yandex.ru, osipovga@mail.ru, s.yu1@yandex.ru 1 В функционировании микробного сообщества пищевые отношения имеют первоочередное значение. Цель настоящей работы - выявить особенности трофической структуры бактериобентоса, обитающего в разных биотопах экосистемы пруда. Для определения родового (видового) и количественного состава сообществ мы применили метод биохимических микробных маркеров, в качестве которых используются жирные кислоты (Осипов, 1993; Верховцева, Осипов, 2008; Жукова, 2009). Нижний Ботанический пруд характеризуется большим видовым разнообразием водной растительности. Физико-химические условия и специфика состава растительных сообществ обуславливают особенности морфотипов донных отложений на разных участках пруда. Нами были исследованы четыре биотопа: (1) мелководье (глубина 1,5 м) с зарослями роголистника темно-зеленого (Ceratophyllum demersum), где формируется аэробный серый детритный ил; (2) сообщество рогоза узколистного (Typha angustifolia), в зарослях которого образуется микроаэробный темно-серый грубодетритный ил (глубина 2,3 м) и (3-4) два открытых участка с анаэробными черными сероводородными илами на глубинах 3 м и 5,5 м. В отобранных пробах илов измеряли активную реакцию среды (рН) и окислительновосстановительный потенциал (Eh) полевым рН-метром. Из химических компонентов, важных для жизнедеятельности бактерий, определяли содержание органического вещества, включая лабильную фракцию [Гигиняк, 1973; Паников, 1992], общего и двухвалентного железа [Lovley and Phillips, 1986]. Идентификацию типов илов проводили на основе гранулометрического состава [Кузяхметов и др., 2004]. Анализ жирнокислотного состава биомассы ила проведен на хромато-масс-спектрометре АТ 6850/5973 фирмы Agilent Technologies. В илах исследованных биотопов микроценозы характеризуются многообразием эколого-трофических групп бактерий и большим видовым сходством. В значительном количестве в сообществах присутствуют гидролитики рр. Cytophaga, Cellulomonas, Bacillus, Butyrivibrio. Минерализацию легкоутилизируемого органического вещества активно осуществляют хемоорганогетеротрофы рр. Aeromonas, Clostridium, Spirochaetа, Acetobacter, Pseudomonas. Из вторичных анаэробов обнаружены сульфатредуктор Desulfovibrio sp. и группа железовосстанавливающих бактерий. На основе полученных с помощью метода микробных маркеров количественных показателей выявлены некоторые особенности участия эколого-трофических групп бактерий в разложении органического вещества. Так, хемоорганотрофы рр. Streptomyces и Sphaerotilus обнаружены только в глубоководной зоне водоема, где аэробный хемолитотроф Nitrobacter sp., напротив, отсутствует. В зарослях рогоза доминируют целлюлозолитики рр. Cellulomonas, Butyrivibrio, бродильщик-диссипотроф р. Spirochaetа и водородная бактерия р. Xanthomonas. На этом биотопе ил формируется из разложившихся остатков макрофитов. В пелитово-алевритовом иле (глубина 3 м), состоящем из растительного и животного детрита, 142 преимущество получают целлюлозолитики-бродильщики р. Clostridium и углеводородокисляющие актиномицеты рр. Rhodococcus, Nocardia. В тонкодисперсном пелитовом иле (глубина 5,5 м) детрит образуется, в основном, из отмирающего зоопланктона. На этом биотопе максимально представлены р. Aeromonas и водородные бактерии рр. Pseudomonas, Hydrogenophaga. Для диссимиляционных Fe-редукторов определяющими является анаэробные условия - максимальное их развитие регистрировалось на глубине 5,5 м. В зарослях рогоза и в пелагиале (глубина 3 м), где сосредоточено наибольшее количество растворенного органического вещества, оптимально развиваются органотрофы рр. Butyrivibrio, Spirochaetа, Micrococcus, Acetobacterium, Nocardia, Pseudonocardia, Rhodococcus и представители сем. Enterobacteriaceae. Из полученных результатов следует, что на развитие отдельных эколого-трофических групп бактерий донного сообщества в различных биотопах пруда влияние оказывает генезис органического вещества, его биохимическая доступность, значения окислительновосстановительного потенциала и гранулометрический состав ила. TROPHIC STRUCTURE OF BENTHIC MICROBIAL COMMUNITIES IN THE LOWER BOTANIC POND (SAMARA) 1 Sherysheva N.G.1, Osipov G.A.2, Pletneva S.YU.3 Institute of Еcology of the Volga River basin of the RAS, 445003, Komzina st.10, Togliatti, Russia, 2 Group of Academician Y.F. Isakov, Bakoulev Center for Cardiovascular Surgery, Russian Academy of Medical Sciences, Roublyevskoe Shosse, 135, Moscow, Russia, 3 Togliatti State University, Belorusskaya st. 16, Togliatti, Russia e-mail: sapfir-sherry@yandex.ru, osipovga@mail.ru, s.yu1@yandex.ru The trophic relationships have a primary importance in the development of the microbial community. The aim of this work is to reveal the features of the benthic microbial communities trophic structure in different biotopes of the pond. We applied mass spectrometry microbial markers MSMM approach in order to determine the genera/species quantitative composition of the communities, (Osipov, 1993; Verkhovtseva, 2008; Zhukova, 2009). The Lower Botanic pond is characterized by a large diversity of aquatic vegetation. Physicochemical conditions and speciation of vegetation communities determine particular morphotypes of bottom sediments in different parts of the pond. We studied four biotopes: (1) shallow water (depth 1.5 m) with tangled Ceratophyllum demersum, where aerobic detrit gray silt is formed; (2) community of Typha angustifolia, where microaerobic dark gray coarse detrit silt is formed (depth 2.3 m); and (3-4) two open pelagic areas 3 m and 5.5 m deep with black anaerobic hydrogen sulfide sediments. We measured redox potential with a portable pH-Eh meter in the sediments. We also determined organic matter using dichromate oxidation, also mobile organic matter [Giginyak, 1973; Panikov, 1992], total and divalent iron [Lovley and Phillips, 1986] as well. Granulometric analyses of the silts were also done. Fatty acids determinations of microbial community were accomplished by using gas chromatograph - mass spectrometer АТ 6850/5973 (Agilent Technologies, USA). The species compositions of microcenoses were similar in all biotopes. The hydrolytics of the genera Cytophaga, Cellulomonas, Bacillus, Butyrivibrio are present in considerable amount in the communities. The chemoorganoheterotrophs of the genera Aeromonas, Clostridium, Spirochaetа, Acetobacter, Pseudomonas decompose digestible organic matter. The secondary anaerobes sulfate-reducing bacterium Desulfovibrio sp. and a group of Fe(III)-reducing bacteria are also present. On the basis of quantitative MSMM data one can depict some peculiarities of the participation of bacteria in various stages of decomposition of organic matter by their fatty acids markers. Thus, the primary chemoorganotrophs of the genera Streptomyces, Sphaerotilus were found only in a deep zone of the pond, where aerobic chemolithotroph Nitrobacter sp. is absent in 143 contrast. The cellulose fermentants of the genera Cellulomonas, Butyrivibrio, fermentantdissipotroph of the genus Spirochaeta and hydrogen-oxidizing bacterium of the genus Xanthomonas considerably dominate in tangles of Typha angustifolia. The silt was formed here from remains of the decomposed macrophytes. In the pelagic sediments (depth 3 m), which includes plant and animal detritus and fine mineral particles, the hydrolytic-fermentants of the genus Clostridium and hydrocarbon-oxidizing actinomycetes of the genera Rhodococcus, Nocardia have been prevalent. In pelitic silt (depth 5.5 m) detritus was formed from the dead zooplankton. In this biotope, the genus Aeromonas dominates, and hydrogen bacteria genera Pseudomonas and Hydrogenophaga are also present. Anaerobic conditions are crucial for dissimilatory Fe(III)-reducing bacteria, therefore their maximum quantity was detected at the depth 5.5 m. The tangles of Typha angustifolia and pelagic sediments (3 m depth) which is enriched in dissolved organics are optimal for organotrophs of the genera Butyrivibrio, Spirochaetа, Micrococcus, Acetobacterium, Nocardia, Pseudonocardia, Rhodococcus and Enterobacteriaceae family. From these results we can conclude that the development of some ecologo-trophic groups of bacteria of benthic community in the pond biotopes is determined by the origin and biochemical availability of organic matter, values of redox potential and granulometric composition of the silt. МИКРОБИОЛОГИЧЕСКИЕ ПОКАЗАТЕЛИ В КОМПЛЕКСНОМ МОНИТОРИНГЕ ЭКОЛОГИЧЕСКОГО СОСТОЯНИЯ РЫБОХОЗЯЙСТВЕННЫХ ОЗЕР СРЕДНЕГО ПРИОБЬЯ Шорникова Е.А., Абзалова Э.Г. ГОУ ВПО «Сургутский государственный университет ХМАО-Югры», пр. Ленина, 1, г. Сургут, 628400, Россия e-mail: capucin72@mail.ru В Ханты-Мансийском автономном округе основной отраслью производства являются предприятия нефтегазового комплекса, оказывающие значительное влияние на качество воды и донных отложений, видовой состав и численность гидробионтов водных объектов региона. На территории ХМАО насчитывается свыше 290 тыс. озер, общая площадь которых составляет более 30 тыс. км2. Большая часть озер приурочена к территории Среднего Приобья, где сформировался уникальный озерно-болотный комплекс – Сургутское Полесье. Большинство озер данной территории относятся к рыбохозяйственной категории. Целью данного исследования являлось оценка качества воды рыбохозяйственных озер по показателям химического состава и структуры микробного сообщества. Объектом исследования были выбраны озера на территории Сургутского и ХантыМансийского районов ХМАО. Всего было изучено 9 озер в 21 контрольном створе. По происхождению котловин исследованные озера являются органогенными, речными (соровые) и гидрокарьерными. Шесть озер расположено на территории Федоровского нефтегазового месторождения, три озера планируется использовать для разведения форели и муксуна. В период открытой воды 2009-2010 гг. осуществлялся комплексный мониторинг экологического состояния озер, в программу которого были включены 24 показателя химического состава, структура микробного сообщества, определяющая трофический статус водоемов, эффективность процессов самоочищения и зачастую являющаяся индикатором характера загрязнения водных объектов. В структуре микробного сообщества озер изучали численность бактерий пяти эколого-трофических групп: гетеротрофные бактерии с температурным оптимумом 20 и 37°С, олиготрофные, углеводородокисляющие и фенолусваивающие бактерии. По результатам гидрохимических и микробиологических исследований рассчитывали индекс качества воды, предложенный Башмаковой И.Х. и модифицированный на кафедре экологии СурГУ (Башмакова, 2004; Шорникова, 2007). 144 В воде исследованных озер выявлены бактерии всех эколого-трофических групп. Численность гетеротрофных бактерий с температурным оптимумом 20ºС варьировала в диапазоне 101-105 кл./см3. Численность гетеротрофных бактерий с температурным оптимумом 37°С достигала 106 кл./см3. В ряде проб выявлено превышение рекомендованных значений численности гетеротрофных бактерий в водных объектах, предназначенных для разведения рыбы. Численность олиготрофных бактерий составила 103-105 кл./см3. Количественное соотношение численности гетеротрофных бактерий, развивающихся на богатых и бедных органическим веществом питательных средах, позволило сделать вывод о замедленной скорости процессов самоочищения и накоплении органического вещества в оз. Качынлор, Голубых озерах, соровых озерах в районе о-ва Заячий. Численность фенолусваивающих бактерий составила 102-104 кл./см3, углеводородокисляющих бактерий – 101-104 кл./см3. В пробах воды, отобранных из соровых озер на территории г. Сургута, фенолусваивающие бактерии отсутствовали. Наличие в пробах воды фенолусваивающих и углеводородокисляющих бактерий свидетельствует об антропогенной нагрузке различной степени выраженности. По значениям Iwq, рассчитанным по микробиологическим показателям, исследованные озера были отнесены к категориям от чистых (соровые озера в г. Сургуте и пос. Шапша) до загрязненных (оз. Качнылор на территории Федоровского нефтегазового месторождения). Полученные значения численности бактерий различных эколого-трофических групп в структуре микробного сообщества слабо коррелируют с результатами, полученными методами химического анализа. Включение показателей структуры микробного сообщества в программу мониторинга экологического состояния озер позволило выявить приоритетные загрязнители водного объекта, оценить потенциал самоочищения озер. Таким образом, экосистемы исследованных озер испытывают достаточно высокую антропогенную нагрузку, регистрируемую по показателям химического состава и структуры микробного сообщества, и связанную с воздействием промышленного производства и рекреации, что может негативно сказаться на их рыбопродуктивности. На основании результатов двухлетнего мониторинга сделано заключение о несоответствии качества воды озер требованиям, предъявляемым к водным объектам, предназначенным для рыборазведения. MICROBIOLOGICAL INDICATORS IN COMPLEX MONITORING OF THE FISHERIES LAKES IN MIDDLE PRIOBIE Shornikova E.A., Abzalova E.G. Surgut State University, Lenina str., Surgut, 1, 628400, Russia e-mail: capucin72@mail.ru The basic branch of industry in Khanty-Mansi autonomous area is the oil and gas production complex, which makes considerable impact on water and sediments quality, species composition and number of hydrobionts of water waterbodies. It is over 290 thousand of lakes with total area more than 30 thousand км2 in Ugra. The most part of lakes is placed in Middle Priobie where the unique lacustrine-boggy landscape complex – the Surgut Polesye was generated. The majority of lakes are of commercial fishing importance. An objective of this research was to estimate the water quality of fisheries lake with the use of chemical and microbiological parameters. In total 9 lakes in 21 control station in Surgut and Khanty-Mansiysk regions have been studied. By the lake basin origin the investigated lakes were organogenous, floodplain or sand-wash opencast. Six lakes are located in territory of the Fedorovsky oil deposit, three lakes are planned to use for fish farming. The complex monitoring of lakes was established during 2009-2010. The research program consisted of 24 physical and chemical measures, parameters of the microbial community structure: number of heterotrophic bacteria with a temperature optimum 20 and 37°С, oligotrophic, oiloxidizing and phenol-oxidizing bacteria. The parameters of microbial community structure can be used to define the trophic status of lakes, the efficiency of water self-purification processes and to 145 indicate character and intensity of water pollution. Based on the results of hydrochemical and microbiological researches the Water Quality Index (Iwq) was counted. Number of heterotrophic bacteria with a temperature optimum 20ºС in lakes was varied in a range of 101-105 cells/ml. Number of heterotrophic bacteria with a temperature optimum 37°С reached 106 cells/ml. The number of heterotrophic bacteria exceeds the commercial fishing standards in several samples. Number of oligotrophic bacteria was 103-105 cells/ml. Quantitative ratio of number of heterotrophic bacteria cultured on concentrated and diluted nutrient mediums has allowed to determine the slowed down intensity of processes of water self-purification and accumulation of organic substance in Kachynlor lake, Blue Lakes and flooding lakes on the island Zayachi. The number of phenol-oxidizing bacteria was varied in range 102-104 cells/ml, oiloxidizing bacteria – 101-104 cells/ml. In the samples selected from floodplain lakes in territory of Surgut phenol-oxidizing bacteria were absent. The presence of phenol-oxidizing and oil-oxidizing bacteria in samples testifies to anthropogenic stress of various intensity. Based on values of Iwq which were calculated with the use of microbiological parameters, the investigated lakes have been classified to categories from «pure» (floodplain lakes in Surgut and Shapsha) to «polluted» (Kachynlor lake in territory of the Fedorovsky oil deposit). The received data on number of bacteria of various trophic groups in microbial community poorly correlate with the results received by methods of the chemical analysis. Inclusion of microbiological parameters to the research program has allowed to reveal priority pollutants of lakes, to estimate potential of water self-purification. Thus, ecosystems of the investigated lakes are exposed to high enough anthropogenic stress registered by indicators of a chemical parameters and structure of microbial community, and had been caused by industrial production and recreation that can negatively affect on their fish capacity. Based on the results of two-year monitoring we concluded that water quality in the most of investigated lakes falls short of commercial fishing standards. ISOLATION OF ACTINOMYCES FROM FRESHWATER SPONGES, BAIKALOSPONGIA AND LUBOMIRSKIA, IN LAKE BAIKAL Ahn T.-S., Joung Y., Jung D. Departement of Environmental Science, Kangwon National University, South Korea e-mail: Ahnsja@empal.com Objectives. Actinomyces has characteristics of both bacteria and fungi and exist various environmental conditions. Especially, those have been interested industrially and scientifically since they can produce antibiotics and several secondary metabolities. However, most studies about actinomyces have been performed for isolates from soil environment and only a few has been conducted for actinomyces from other environmental. Therefore, the aims of this study were to isolate actinomyces from freshwater sponges in Lake Baikal and understand its characteristic. Methods. Pyrosequencing was performed to observe bacterial community of two kind freshwater sponges, Baikalospongia and Lubomirskia. Isolated actinomyces from fresh water sponges were identified by sequencing a part of the 16S rRNA gene. Growth rate depends on temperature and pH, gram staining, API 20NE test, oxidase and catalse test, enzyme activities, analysis of cellular fatty acid compositions and antimicrobial activity were investigated to understand isolated characteristic of actinomyces. Results and conclusions. As the results of Pyrosequencing, we found that the microbial community of sponge in Lake Baikal consists of 6% and 8% of actionomyces group. Seven strains of actinomyces were isolated from Baikalospongia and Lubomirskia and classified as Streptomyces griseoplanus, Streptomyces halstedii, Streptomyces violascens, Streptomyces flavovirens and Streptomyces microflavus. The results of characterization test showed that each isolated actinomyces has varied unique habitat like that it produces different metaboilites according to medium or culture environment. One isolated actinomyces produce antibiotics of gram-positive bacteria, two isolated actinomyces produce antibiotics of gram-negative bacteria and another one isolated actinomyces produce antibiotics of yeast. 146 THE MICROBIOLOGICAL RESULTS OF SOME SURFACE WATER AND SOIL OF MONGOLIA Battsetseg Ch.1, Narantuya D.1, Dorjkhand B.2, Ouyn-Erdene D.1 1 National University of Mongolia, 2Institute of Public Health e-mail: battsetseg@num.edu.mn For the environmental control including microbiological evaluation, besides the indications of agro chemistry, general biology and chemical tolerant. Microbiological investigation is important for the evaluation of water and soil quality, protect from pollution, take steps purification, and prevent from infected disease, specially intestines infected disease. Microbial pollution of water and soil is influencing negatively for human health, soil biological activity and purification process of soil. In order to detect directly difficulties of the pathogenic bacteria from surroundings, that through the way to identify of indicator microorganisms, for determine of the level microbial pollution. Aim of this study was determined the level of some surface water and soil bacterial pollution of Mongolia. We were collected the samples from Tuul River, Damba spring, Selbe River of Ulaanbaatar, Delgerekh spring of Ovorkhangai province and soil samples altogether 8 sites of Tsogttsetsii sum, Omnogobi province. We took the soil samples by “envelope” method and determined the level of bacterial pollution by following indications. In that, total number of microorganisms per gram soil, coli forms titer, Proteus titer, anaerobes titer and thermopiles. However, the level of water pollution was determined total number of microorganisms per milliliter and E.coli titer. We were determined total number microorganisms of soil, which diluted the soil suspensions by 1:101-1:108 and inoculated on the Nutrient agar, Plate count agar, Schukovich method for determined Proteus, thermopiles determined that inoculated from each dilutions and incubated in 56-600C temperature by 24-48 hr, and colony description. Analysis for determine of coli form titer used redox method and enrichment from each dilution. After 24 hr, the isolates inoculated confirmation test on the Endo agar, Eosin Methylene Blue agar from with acid and gas. Determined of coli form titer by the Oxidation disc put the oxidase test from colonies with red glossy metal and dark colors and controlled by microscope, and Gram stain. Cl.perfringens titer was determined that from each dilution of samples transferred into the sterilized tubes and heated for 15 minute at the 800C. After heat shock to bacteria from the transient exposure of the sample to put in a drop sterilized Petri dish to 450C Clostridial agar and Perfringens Agar Base may occur. Further of the inoculation put into special box and absorbed of air in the box by product of the Mitsubishi Gas Chemical Co. After the incubation in the anaerobe condition for 24 hr, at the 370C temperature, and to prepared the preparation of dark colored colony by microscopic control. Total number of water bacteria was determined by the same method of soil, and used the standard method for E.coli titer. The investigation results, total number of bacteria per gram were of the new waste point of Tsogtsetsii sum, Omnogobi province 1,5х106 cell/g, ger district 2х106 cell/g, the well of sum 3х106 cell/g, MCS International LLC 2,6х106 cell/g, around the enrichment industry 3х106 cell/g, waste water treatment plant 5х106 cell/g, liquid waste centre of sum 12х106 cell/g, solid waste point 11х106 cell/g. Through these results, above sampling sites included for the category that new waste point and ger district were “slightly polluted”, waste water treatment plant and liquid and solid waste centre of sum were “very polluted”, other sampling sites were “moderately polluted”. The testify indication of the soil pollution through excretions that E.coli titer were 0.001 of the liquid and solid waste centre of sum, its included to the category “evidently polluted” and other sampling sites were not polluted through coliforms. 147 In soil were detected anaerobe bacteria (Cl.perfringens), it’s indicated that for a longer time contaminated through excretions. Proteus is not indication of soil pollution by oneself. E.coli, Cl.perfringens is detecting with them that to be property of pollution. The well of sum, liquid and solid waste points centre of sum were polluted higher by Proteus. In soil, which polluted through manure, is containing thermopiles. Besides the sites well of sum, MCS International LLC, ger district, and the enrichment industry, the above indication of other sampling sites were 1001-10000 cell/g and included for category “slightly polluted”. Total number of bacteria per milliliter and E.coli titer of the study hygienic microbiology of water were higher than standard and included for category “polluted”. Total numbers of bacteria were to Tuul river 5х103 cell/ml, Damba spring 1,5х103cell/ml, Selbe River 19х103 cell/ml, Delgerekh spring 6х103 cell/ml. E.coli titer to Tuul and Selbe rivers were higher than 2380, and Delgerekh and Damba springs were 2380. All of water samples were polluted by Protei and detected anaerobe bacteria from Tuul river. As seen the results of this study, microbial pollution were higher of soil and water of settlement in Mongolia. Therefore, comprehensive to take steps necessary for protected of public health, to detect of pathogens, prevent from them, and to decrease environmental pollution. This work has been done within the framework of the project “The genotoxicological study of water and soil of Tsogttsetsii sum, Umnugobi” supported by the Asia Research Center, Mongolia and Korea Foundation for Advanced Studies, Korea. MICROBIAL TRANSFORMATION OF ARSENIC IN GROUNDWATER LABORATORY AND FIELD EXPERIMENTS Freikowski D., Gallert C., Winter J. KIT, Karlsruhe Institute of Technology, Institute of Biology for Engineers and Biotechnology of wastewater treatment, Am Fasanengarten, Karlsruhe, 76131, Germany e-mail: Dominik.Freikowski@kit.edu, Claudia.Gallert@kit.edu, Josef.Winter@kit.edu Arsenic contaminated groundwater is a serious worldwide problem under reducing conditions as well as under high pH and oxidizing conditions, were the arsenic is soluble in the oxidized state. According to the WHO the arsenic concentration in the groundwater should be lower than 50 μg l-1. Arsenic concentrations much higher than this amount could be found in many Asian countries like in the West Bengal Delta plain, India. There the arsenic concentration in the groundwater reaches more than 400 μ l-1. The high arsenic concentration in the groundwater, which is used for irrigation, human and animal water supply influences the health of several million people. The role of microorganisms in the mobilisation of arsenate by reduction of As(V) to soluble and mobile As(III) and the role of Fe(III) reducing microorganisms in contaminated sediment samples were examined in soil column experiments. Contaminated sediment samples were brought into the lab from a drilling champagne. Beside sterile and natural conditions, the influence of different electron donors like lactate, ethanol or sucrose and the addition of sulphate were tested. The influence on arsenic mobilisation, the change of As species and the amount of mobilised arsenic in the different columns was monitored. Addition of an electron donor (lactate) and an electron acceptor (sulfate) enhance arsenic elution. Up to 30 % of soil-bound arsenic could be mobilized and arsenite could be detected as an arsenic species. To verify the results from the laboratory experiments, a field test in West Bengal in December 2009 was conducted. Sucrose, the cheapest carbon source was selected as the electron donor for heterotrophic, sulphate- or arsenateor iron(III)-reducing microorganisms. Sixty kg of the sugar was injected into a field piezometer. After flushing with water several neigbouring monitoring wells were sampled during the next 3 weeks. Beside the measurement of the geochemical parameters in the field such as pH, redox state, DO, temperature, samples were also taken into the lab for measurement of sucrose, fatty acids, DOC, major cations and anions, total arsenic and arsenic species. 148 MICROBIAL LIFE UNDER HALOPHILIC CONDITIONS Gallert C., Winter J. KIT, Karlsruhe Institute of Technology, Institute of Biology for Engineers and Biotechnology of wastewater treatment, Am Fasanengarten, Karlsruhe, 76131, Germany e-mail: Claudia.Gallert@kit.edu, Josef.Winter@kit.edu Halophilic or halotolerant microorganisms require or tolerate salt concentrations above 0.5 M. Extreme halophilic organisms can grow at salt concentrations of ≤30 %. This organisms are metabolically versatile and can use a variety of electron donors and acceptors. To live in an environment with a reduced water activity, an adaption to the osmotic pressure is necessary. Two different strategies were evolved in the different domains of life. Organisms which use the salt-instrategy pump K+-ions in huge amounts into the cytoplasm to overcome the osmotic pressure. Other organisms produce macromolecules, so called compatible solutes to resist the water loss. Halophilic microorganisms could be used for treating saline wastewaters from food processing industries, the tanning industry, oil production and processing, leachate from landfills and sewage created by the use of sea water for toilet flushing. All known wastewater treatment processes for carbon and nitrogen removal could be used for treatment of saltcontaining wastewater. Examples for aerobic, anaerobic, nitrification and denitrification processes by using different reactor design will be shown. A major point in saline wastewater treatment is the halophilic biomass. Depending on the salt concentration of the wastewater, two possible ways for biomass production and maintenance can be used. If the salt concentration is in the range of ~3%, non-saltadapted halotolerant biomass from a domestic or industrial plant could be used which must be adapted step-wise to higher salt concentrations. If the salt concentration is much higher than 5%, halophilic biomass must be used for inoculation of reactors. There are a lot of natural and manmade ecosystems like seawater/sediments or biofliters from aqua-culturing of fish or shrimps which can be used as a source of halophilic microorganisms for wastewater treatment. CHANGES OF BACTERIAL COMMUNITY STRUCTURE DEPENDING ON POLLUTANT IN NAK-DONG RIVER (KOREA) Jin S.-Y., Lee Y.-O. Dept. of Biological Science, Daegu University, Kyung-Buk, 712-714, South Korea e-mail: ecolomi@daegu.ac.kr For investigating the bacterial community structure (Proteobacteria, nitrifyer) depending on pollutant (effluent of domestic WWTP), this study was performed at 2 sites (site 1; without, site 2; with pollutant) of Nak-Dong River. For that, conventional chemical parameters and quantitative/qualitative bacterial community structure were analyzed using FISH and PCR-DGGE. NO3--N at site 2 (0.58mg/L) was higher than site 1 (0.21mg/L). The results of bacterial community structure plus total count (stained cells by DAPI) were as follows: No. of total count at site 2 (3.6·106 cell/mL) was higher than site 1 (2.8·106 cell/mL). The ratios of α·β-proteobacteria (known as dominantly occurred in unpolluted water) to total count (%), were higher at site 1(α-;46%, β;27%) while those ratio of γ- proteobacteria, dominated in water polluted by degradable organics was higher at site 2 (36%). Among nitrifying bacteria, the No. of NH4-oxidizer (AOB) and NO2oxidizer (NOB) was more at site 2 [AOB; 9.3·105 cell/mL, NOB: 1.6·106 cell/mL] than site 1 [AOB; 7.8·105 cell/mL, NOB: 0.8·106 cell/mL]. Also for the qualitative evaluation of nitrifying bacteria, amoA gene for ammonia monooxygenase was detected at both 2 sites and the similarity of GMAOB (site 1) and DG-AOB (site 2) to Nitrosomonas sp. known as ammonia oxidizing bacteria, was 96%, 96% respectively. And nitrite-oxidizing bacteria, Nitrobacter sp., proven with primer FGPS was detected with similarity of 98% (site 1; GM-NOB) and 99% (site 2; DG-NOB). Therefore, it could be concluded that the nitrification at site 2 was more activated due to input of effluent discharged by domestic wastewater plant, compared to site 1. 149 EFFECT OF NUTRIENT LIMITATION ON PICOCYANOBACTERIAL GROWTH IN LAKE BAIKAL Katano T.a,#, Murata T.b, Azumi H.c, Mitamura O.c, Satoh Y.d, Drucker V.V.e, Fialkov V.A.f, Mimura T.g, Watanabe Y.h, Sugiyama M.b a Institute of Lowland and Marine Research, Saga University, Honjo-machi 1, Saga 840-8502, Japan; b Faculty of Integrated Human Studies, Kyoto University, Yoshida-Nihonmatsu-cho, Sakyoku, Kyoto 606-8501, Japan; c School of Environmental Science, University of Shiga Prefecture, 3165 Hassaka-cho, Hikone, Shiga 522-0057, Japan; dFaculty of Science, Yamagata University, Yamagata 990-8560, Japan; eLimnological Institute, Siberian Branch of the Academy of Sciences, Ulan-Botorskaya, Irkutsk, Russia; f Baikal Museum, Siberian Branch of the Academy of Sciences, Ulan-Botorskaya, Listvyanka, Russia; gDepartment of Biology, Graduate School of Science, Kobe University; h Faculty of Geo-Environmental Science, Rissho University, 1700 Magechi, Kumagaya, Saitama 360-0194, Japan e-mail: f9130@cc.saga-u.ac.jp Picocyanboacteria numerically predominate among the phytoplankton and account for a significant portion of the total primary production during summer in Lake Baikal. To conserve the ecosystem of the lake, it is important to understand the growth limiting factor for picocyanobacteria. Among the environmental factors, nutrient concentration is of interest to evaluate the possibility to regulate picocyanobacterial growth in this oligotrophic lake. However, information on nutrient limitation on the growth has not yet been accumulated. To evaluate the possible effects of nutrient limitation on picocyanobacterial growth, nutrient enrichment experiments were carried out 2 times in the southern basin of Lake Baikal in July 2010. A field survey was also conducted to clarify the horizontal distribution of picocyanobacteria in relation to nutrient concentrations in the southern basin. Cell density at the surface in the southern basin ranged between 2.3 x 104 and 5.5 x 104 cells ml-1. Nitrate concentrations at the surface ranged between 4.05 and 6.76 µM, while phosphate concentrations ranged between 0.03 and 0.10 µM. Thus, it appears that among the two, phosphate is the limiting nutrient for the growth. Nutrient enrichment experiments were conducted in duplicate, and incubations were carried out on the lake’s shore for 48 h. Growth rates ranged from 0.00 and 0.21 day-1 in the first experiment, and from 0.02 and 0.11 day-1 in the second experiment. In both experiments, no significant difference was detected among the treatments. These results revealed that picocyanobacterial growth was not limited by nutrients in the summer, although ambient levels of phosphate were low. These results imply that the high affinity of picocyanobacteria for nutrients has a crucial role in outcompeting larger phytoplankton in the lake. FLUX AND CHEMICAL COMPOSITION OF SETTLING PARTICLE IN LAKE BAIKAL Sugiyama M.,1# Akagashi Y.,2 Nakamura T.,3 Katano T.,4 Tanaka Y.,5 Sato Y.,6 Watanabe Y.,7 Mitamura O.,8 Nakano S.,9 Mimura T.,10 Drucker V.V.11 1 Graduate School of Global Environmental Studies, Kyoto University, Kyoto 606-8501, Japan; 2 Graduate School of Human and Environmental Studies, Kyoto University, Kyoto 606-8501, Japan; 3 Nichiyu Giken Kogyo Co., Ltd., Kawagoe 350-1107, Japan; 4Institute of Lowland and Marine Research, Saga University, Saga 840-8502, Japan; 5Faculty of Marine Science, Tokyo University of Marine Science and Technology, Minato-Ku, Tokyo 108-8477, Japan; 6Faculty of Science, Yamagata University, Yamagata 990-8560, Japan; 7Faculty of Geo-Environmental Science, Rissho University, Kumagaya 360-0194, Japan; 8School of Environmental Science, University of Shiga Prefecture, Hikone 522-0057, Japan; 9Center for Ecological Research, Kyoto University, Otsu 5202113, Japan; 10Graduate School of Science, Kobe University, Kobe 657-8501, Japan; 11 Limnological Institute, Russian Academy of Sciences, 664033, Irkutsk, Russia e-mail: masahito.sugiyama@sojin0206.mbox.media.kyoto-u.ac.jp 150 Knowledge of settling particles is indispensable to discuss the mechanism of material circulation in the hydrospere, because these particles play a very significant role in the vertical material transport in lakes and the ocean. However, there are some reports about the flux and chemical composition of settling particles in Lake Baikal. We performed sediment trap experiments in Baruguzine Bay and the southern basin of Lake Baikal. We discuss their results in this presentation. Settling particles were collected at 50 m depth in Baruguzine Bay (August, 2002 and 2003; June-October, 2004, depth: 150 m) and the southern basin (off-Listvyanka, March and May, 2003, depth: 150 m) using a sediment trap (SMC7S-500, Nichiyu Giken Kogyo) that were deployed for 317 days without preservatives. The particles were filtered through Whatmann GF/F filters or 0.4 μm Nuclepore filters. Particulte organic carbon (POC) and nitrogen (PON) collected on a GF/F filter were determined with a CHN analyzer (2400, Perkin Elmer). Ignission Loss was measured after combustion of the particles at 600 oC for 3 h. Some metals and P, and Si were determined with an ICP atomic emission spectorometer (ICAP-96-953, Japan Jarrel Ash) after acid digestion and alkaline fusion of the sample collected on a Nuclreplore filter, respectively. Settling flux seasonally changed and its values were 26-279 mg/m2/day for total dry weight and 12-115 mg/m2/day for ignission loss. Major chemical componets in the settling particles were ignission loss (organic carbon), Si, Al and Fe. Ignission loss occupied 21-46 % of total settling flux and it was shown that organic matter is a major component of settling particles. Continuous sediment trap experiment was performed at 17-day interval during from June to October, 2004 and 7 samples were collected. Total and ignission loss fluxes showed extremely high values in middle July responding to rapid increase of water temperature. IN VITRO SELECTION OF AN RNA LIGAND FOR HUMAN TOLL-LIKE RECEPTOR 2 ECTODOMAIN Yoon J.-H., Byun J. Department of Molecular Biology, Dankook University, Yongin-si, Gyeonggi-do 448-701, The Republic of Korea e-mail: jonghoe@dankook.ac.kr Innate immunity is a kind of inborn trait and associated with toll-like receptors (TLRs). TLRs are known to recognize pathogen-associated molecular patterns and play a crucial role in innate immunity by mediating the activation of macrophages. They also recruit phagocytic cells and produce proinflammatory cytokine/chemokine. TLRs are concerned with maturation of antigenpresenting cells that carry out adaptive immune responses along with dendritic cell, macrophage and B cell. In human, 10 different TLRs have been identified so far. Among these TLRs, TLR2 heterodimerizes with TLR1 and TLR6 and helps to recognize various ligands including proteoglycan and bacterial lipoprotein. Given this importance of TLR2, we decided to develop an aptamer that can bind to TLR2 and thus can modulate its function(s). Aptamer is a nucleic acid molecule that binds to a specific target molecule and can act as a ligand, an antagonist or an agonist. Human TLR2 (hTLR2) has 23 leucine rich repeats (LRRs) including a C-terminal LRR and two Nterminal LRRs. LRR9-LRR12 domain binds to other ligands, whereas LRR11-LRR14 domain make contacts with hTLR1. To develop an RNA aptamer for hTLR2, LRR8-LRR15 domain has been chosen as target protein and its coding sequences were cloned into pQE-80L vector that can express membrane protein with accompanying 6 his-tag sequences. Origami strain of E.coli that can efficiently express membrane protein was used for overexpression of LRR 8-15 ectodomain. The purified protein was then used for in vitro selection of RNA aptamer(s) in the RNA library using SELEX (Systematic Evolution of Ligands by Exponential Enrichment) procedure. Characterization of the obtained aptamer is currently underway. Potential application of the TLR aptamer in aquatic animals and its implication with regard to immune-defense system will be discussed. 151 ИЗУЧЕНИЕ РАЗВИТИЯ АЛЬГО-БАКТЕРИАЛЬНЫХ ПОДЛЕДНЫХ СООБЩЕСТВ ЮЖНОГО БАЙКАЛА (ПАДЬ ВАРНАЧКА) МЕТОДАМИ СВЕТОВОЙ, ЭПИФЛУОРЕСЦЕНТНОЙ И СКАНИРУЮЩЕЙ ЭЛЕКТРОННОЙ МИКРОСКОПИИ В ВЕСЕННИЙ ПЕРИОД 2011 ГОДА Башенхаева М.В., Петрова Д.П., Захарова Ю.Р., Волокитина Н.А., Шишлянников М.С. Лимнологический институт СО РАН, г. Иркутск, ул. Улан-Баторская, 3, Россия e-mail: monya9090@mail.ru Явление подледного и ледового цветения диатомовых водорослей в полярных регионах Мирового океана [1, 2] и в пресноводных горных озерах [3] интенсивно изучается в последние десятилетия. Данный период является неотъемлемой частью развития водорослей, поскольку во время подледного цветения происходит синтез органических веществ, обеспечивающих жизнедеятельность бактерий и зоопланктона в летний период. Настоящая работа направлена на изучение альго-бактериальных сообществ во время их подледного развития в Южном Байкале. Отбор проб подледных сообществ проводила группа водолазов ЛИН СО РАН. Пробы были отобраны в трех точках в литоральной (до 40 м от берега) и пелагической зонах (от 1 км от берега) в период с 3 марта по 2 апреля 2011 г. Пробы фиксировали 1% р-ром глутарового альдегида и р-ром Люголя. Анализировали пробы методами световой, эпифлуоресцентной и сканирующей электронной микроскопии. В начале марта 2011 года и в литоральной, и в пелагической зонах преобладали динофитовые водоросли Gymnodinium baicalense. Кроме того, в состав проб входили диатомовые водоросли Aulacoseira islandica, A. baicalensis, Synedra acus и S. ulna. В начале апреля видовой состав пелагической зоны был пополнен диатомовыми водорослями Cyclotella minuta и Chrysosphaerella baicalensis Popovsk., однако количество клеток водорослей уменьшилось. В литоральной зоне стали преобладать динофитовые водоросли Peridinium baicalense. По сравнению с данными 2010 года по видовому составу сильных изменений не произошло, однако в 2011 году в составе проб подледных сообществ не были обнаружены золотистые водоросли Dinobryon cilindricum, которые в 2010 году доминировали. На протяжении всего периода отбора проб весной 2011 года численность свободноживущих бактерий превышала численность бактерий, колонизирующих диатомеи. Максимальная численность бактерий - 2,1×106 кл/мл была в пробе, отобранной 1.04.2011 в пелагической зоне. Таким образом, нами показано, что в 2011 году наблюдалось снижение ОЧМ в (2,1×106 кл/мл), по сравнению с 2010 годом (7,3×107 кл/мл). Показано, что бактерии колонизируют диатомовые водоросли в виде единичных клеток. Работа выполнена в рамках гранта РФФИ-№ 09-04-12231-офи-м. ВИРУСЫ – СОСТАВНАЯ ЧАСТЬ БИОПЛЕНОК НА ИСКУССТВЕННОМ СУБСТРАТЕ В УСЛОВИЯХ ПРИРОДНОГО ЭКСПЕРИМЕНТА НА БАЙКАЛЕ Дутова Н.В., Дрюккер В.В. Лимнологический институт СО РАН, 664033, г. Иркутск, ул. Улан-Баторская, 3, Россия e-mail: drucker@lin.irk.ru Впервые электронно-микроскопическим методом исследовано вирусное сообщество обрастаний, формирующихся на поверхности металлической пластины, закрепленной неподвижно в литоральной зоне Южного Байкала, и находившейся в естественных условиях с экспозицией более одного года. Установлено, что основная часть бактериофагов образовавшейся биопленки, исследованных на трансмиссионном электронном микроскопе LEO-906 E (Германия), 152 представлена хвостатыми формами с преобладанием семейства Podoviridae – 44%. Фаги данного семейства имеют короткий конусовидный отросток, размером 11-38 нм, диаметр капсида составляет 28-97 нм без выраженных структурных деталей. Следует отметить, что в биопленках на искусственном субстрате не обнаруживались те морфологические формы бактериофагов, которые присутствуют в придонной воде. Подобное различие наблюдается и в таксономическом составе микроорганизмов, изученных молекулярно-биологическими методами (Белькова, Долгих, 2010). Значительную часть обрастаний – 30% составляли однородные по своей морфологии фаговые частицы с диаметром капсида 28-100 нм. Менее значимы в составе бактериофагов оболочечные вирусные частицы без хвостового отростка. В размерной структуре фагов обрастаний отмечается высокая частота встречаемости частиц с размерным спектром 30-60 нм – 41% и > 60-80 нм – 39%. Крупные фаги, относящиеся к размерным классам > 80-100 нм и > 100 нм, составляют лишь 9% и 7% соответственно. Для частиц < 30 нм зарегистрирован самый низкий уровень развития – 4%. В придонной воде литоральной зоны озера Байкал определен широкий спектр фагов, включая различные морфотипы ряда семейств. Значительное большинство бактериофагов – 78% относятся к порядку Caudovirales (с хвостовыми отростками), включающий семейства Siphoviridae, Myoviridae, Podoviridae. Эти фаги с различной формой и размером капсида от 28 до 160 нм, длиной хвостового отростка 12-187 нм, которым присущи индивидуальные черты строения. В меньшей степени по сравнению с обрастаниями в придонной литоральной зоне озера представлены фаговые частицы без хвостового отростка икосаэдрической формы с диаметром капсида от 29 до 120 нм, а также бесхвостые частицы с двумя четко выраженными оболочками. Впервые в оз. Байкал найдены оболочечные фаги с хвостовым выростом, длина которого достигает 130-152 нм, диаметр капсида – 122-140 нм. В составе природного вирусного сообщества придонной воды одинаковую степень развития приобретают бактериофаги четырех размерных классов: 30-60 нм, > 60-80 нм, > 80100 нм, > 100 нм с частотой встречаемости 20-28%. Для мелких фаговых частиц - < 30 нм частота встречаемости составляет всего 2%. Таким образом, впервые проведенный анализ морфологического разнообразия и размерного спектра бактериофагов в биопленках, формирующихся на искусственном субстрате (металлическая пластина) продолжительное время, и в придонной воде литоральной зоны озера Байкал, выявил существенные различия в структуре вирусного сообщества, что позволяет утверждать о наличии различных биологических систем вирусхозяин и их механизмов взаимодействия в отличающихся экологических условиях. Работа поддержана грантом РФФИ № 09-05-00725а. РАСПРЕДЕЛЕНИЕ МИКРООРГАНИЗМОВ, АССОЦИИРОВАННЫХ С ДИАТОМОВЫМИ ВОДОРОСЛЯМИ, В ГЛУБОКОВОДНЫХ РАЙОНАХ ОЗ. БАЙКАЛ Захарова Ю.Р., Усольцева М.В., Михайлов И.С. Лимнологический институт СО РАН, ул. Улан-Баторская, 3, Иркутск, Россия e-mail: zakharova@lin.irk.ru Среди известных в природе симбиозов наиболее древними и экологически значимыми считаются симбиотические ассоциации водорослей с гетеротрофными микроорганизмами. Водоросли выполняют функции основных поставщиков органического вещества, а их бактериальные спутники стимулируют процессы развития водорослей, продуцируя СО2, факторы роста, витамины, микроэлементы, снижая концентрации свободного О2. Целью работы было определить доминирующие виды диатомовых водорослей и количественный состав их бактериальных ассоциантов в весеннем фитопланктоне оз. Байкал. 153 Отбор планктонных проб воды проводили в мае-июне 2010 г. на центральных глубоководных станциях разрезов Листвянка-Танхой (Южный Байкал), Ухан-Тонкий (Средний Байкал), Елохин-Давша (Северный Байкал) с поверхностного слоя, середины вертикального разреза и придонного слоя воды. Водоросли изучали в живом и фиксированном состоянии под световым микроскопом «Axiostar plus» и СЭМ «Quanta 200». Пробы бактериопланктона обрабатывали в соответствии со стандартными методиками. ОЧМ оценивали после окрашивания проб ДАФИ с помощью эпифлюоресцентного микроскопа «Axiovert 200». Культивируемые бактерии выделяли в аэробных условиях на чашках Петри с рыбо-пептонным агаром (РПА/10) и на оригинальной среде (ДА), в составе которой единственным источником углерода являлся гидролизат диатомовой водоросли Synedra acus subsp. radians. В весеннем фитопланктоне Южного и Среднего Байкала доминировали следующие виды диатомовых водорослей: Aulacoseira baicalensis (K. Meyer) Simonsen и Synedra acus subsp. radians. Постоянными субдоминантами были Stephanodiscus meyeri Genkal et Popovskaya, Aulacoseira islandica (O. Müller) Simonsen. В Северном Байкале доминировал вид A. baicalensis. Численность его была на порядок ниже по сравнению с Южным и Средним Байкалом. ОЧМ в поверхностном слое воды составляла 9.3×105 кл/мл в Южном Байкале, 7.9×105 кл/мл − в Среднем и 1.4×106 кл/мл − в Северном Байкале. При микроскопии проб из поверхностного слоя воды наблюдали, что бактерии активно колонизировали диатомовые водоросли A. baicalensis S. acus и находились на поверхности створок живых диатомей в виде единичных клеток или микроколоний. В толще воды и придонном слое бактерии были локализованы как на поверхности, так и внутри клеток погибших и разрушенных диатомей. Максимальное количество культивируемых бактерий, использующих для роста органическое вещество диатомей, обнаружено в поверхностных слоях воды на всех глубоководных станциях озера по вертикали каждого разреза. В поверхностном слое количество бактерий колебалось в пределах от 28 КОЕ/мл (Ухан-Тонкий) до 324 КОЕ/мл (Листвянка-Танхой) В толще воды сопутствующие диатомеям бактерии доминировали на ст. Ухан-Тонкий (130 КОЕ/мл), в придонном слое воды − на ст. Елохин-Давша на глубине 830 м (120 КОЕ /мл). Наименьшая численность была отмечена в толще воды на глубине 400 м на ст. ЛиствянкаТанхой и ст. Елохин-Давша (2-4 КОЕ/мл). Полученные результаты о колебаниях численности микроорганизмов объясняются характером взаимоотношений, которые существуют между эукариотами и прокариотами в водной среде. Показано, что ассоциированные с диатомовыми водорослями микроорганизмы доминируют в самом верхнем слое воды, возможно, что они так же участвуют в деструкции диатомей, осаждаясь в осадках. Работа выполнена в рамках гранта РФФИ-№ 09-04-12231-офи-м. ОЦЕНКА АНТРОПОГЕННОГО ВОЗДЕЙСТВИЯ НА РЕКУ ЛИСТВЯНКА НА ОСНОВЕ БИОХИМИЧЕСКИХ ОСОБЕННОСТЕЙ Escherichia coli Зацаринная Е.А., Сидорова Н.А. Петрозаводский государственный университет, Петрозаводск, ул. Ленина, д. 33а, Россия e-mail: microbiog@mail.ru В результате увеличения интенсивности антропогенного воздействия на природные экосистемы все более насущной становится проблема их сохранения и восстановления. Одним из важных этапов является разработка комплексных методов оценки состояния экосистем. Несмотря на разнообразие предлагаемых в настоящее время вариантов оценки антропогенного воздействия, полнота, уникальность и достоверность сведений, полученных с использованием микробиологического мониторинга, делают его одной из важнейших составляющих комплексного мониторинга (Иванов, Бойцов, 2000). В данном направлении одним из наиболее эффективных методов оценки является изучение природных популяций 154 микроорганизмов, включая изучение степени распространенности атипичных штаммов и штаммов мутантов. Впервые основы построения системы пространственно-временного мониторинга на основе природных популяций Escherichia coli были предложены Р.А. Пшеничновым и С.В. Колотвиновым (1986). Данная система основана на изучении 94 показателей, включая 44 показателя биохимических, физиологических и популяционных свойств. Подобный анализ несомненно дает наиболее полную и адекватную информацию о состояния пресноводной экосистемы, однако требует больших временных и материальных затрат. Авторами в предыдущих работах (Корнилова,2006; Корнилова, 2008; Корнилова, Сидорова, 2008; Сидорова, 2010) было показано, что эффективными маркерами антропогенного воздействия служат следующие показатели: устойчивость к антибиотикам, потребность в факторах роста, активность каталазы, наличие множественных форм ферментов (SOD, ADH, EST, GOT, ALP). В работе представлены результаты оценки состояния микробной составляющей экосистемы р. Листвянка (Рязанская область, Россия). Этот водоем служит коллектором коммунально-бытовых и промышленных сточных вод г. Рязани, прошедших очистные сооружения. Объектами исследования были выбраны изоляты E. coli, выделенные из р. Листвянка после впадения в нее сточных вод в весенне-осенний период 2010 г. Цель данной работы заключалась в оценке степени антропогенного воздействия на р. Листвянка на основе сложноорганизованных данных биохимических особенностей E. coli. Выделение бактерий из отобранных проб воды осуществлялось по общепринятой методике мембранной фильтрации на среде Эндо. Оценивали типичность культуральных и тинкториальных свойств, морфологию выделенных бактерий. Полученные культуры идентифицировали по системе ТИМАЦ с помощью наборов микрообъемного определения. После видотипирования сформирована репрезентативная выборка из 50 штаммов E. coli. Устойчивость к антибиотикам определяли дискодиффузным методом на агаризованной среде АГВ по отношению к 20 антибактериальным препаратам с различными механизмами действия и частотой применения. Выявление потребности в факторах роста с последующей расшифровкой природы трофической зависимости к 20 аминокислотам проводилась на ГМС с набором аминокислот. Активность каталазы устанавливалась по методу Баха и Опарина, основанного на титровании перманганатом калия в кислой среде избытка H2O2, неразрушенной каталазой . Выявление множественных форм ферментов осуществлялось методом гель-электрофореза в блоке полиакриламидного геля в трис-ЭДТАборатной буферной системе, рН 8,3, при напряжении 200 В в течение 2,5 часов. В изученном микробной сообществе встречаемость культур с множественной лекарственной устойчивостью (устойчивых к 5 и более антибиотика) составила 30,8%. Максимально отмечена резистентность 1 штамма к 14 препаратам. Доля изолятов чувствительных ко всем 20 анализируемым антибиотикам составила 34,6%. С одинаковой частотой (11,5%) встречались бактерий, устойчивые к 3, 4 и 5 антибиотикам. Культуры оказались наиболее устойчивыми к стрептомицину, канамицину и карбеницилину (57,7, 34,6 и 23,0% соответственно). Потребностями в факторах роста обладало 63,6% выделенных культур, причем все они относились к полиауксотрофным, среднее количество необходимых аминокислот 12. Активность каталазы значительно превышала данный показатель для лабораторной культуры E. coli К12. Множественные формы ферментов выделены только по SOD, GOT и ALP (21,7, 30,4 и 47,8% соответственно). Полученные данные позволяют сделать вывод об интенсивном загрязнении данной экосистемы именно фекальным, а не промышленными стоками. Следует отметить, что предложенное сочетание маркеров антропогенного воздействия позволило не только оценить экологическое состояние исследуемой экосистемы в рамках поставленной цели , но и может использоваться для оценки состояния других экосистем. 155 НОВЫЕ ПИТАТЕЛЬНЫЕ СУБСТРАТЫ ДЛЯ ДРОЖЖЕЙ– САХАРОМИЦЕТОВ Калюжин В.А. НИИ биологии и биофизики, г. Томск, пр. Ленина, 36, НИИ ББ, Россия e-mail: vladimirkalyuzhin@bk.ru Целью работы был поиск новых источников углеродов и энергии для выращивания биотехнологических культур микроорганизмов. Была сделана попытка получения пищевых продуктов исходя из таких техногенных веществ загрязнителей окружающей среды, как отработка смазочных масел, фенол, формальдегид, ксилол, ацетон, крезолы, находящиеся в водной среде. В роли опытного объекта были выбраны хлебопекарные дрожжи – сахаромицеты, раса 14. Данный вид характерен тем, что его аллергенность минимальна, производство распространено по всему миру и среди других пищевых биотехнологических культур их производство наиболее крупнотоннажно. Выход биомассы дрожжей определялся гравиметрическим методом после их высушивания до постоянного веса. Традиционно дрожжи выращивают на отходах сахарного производства или других растительных продуктов. В нашей работе применялся подход с использованием микроорганизмов медиаторов. Получение медиаторов – утилизаторов описано в патентах РФ (Калюжин 2008; Калюжин 2010). Микроорганизмы – утилизаторы перечисленных веществ подвергались дезинтеграции. Наиболее оптимальным способом был кислотный гидролиз совмещенный с обработкой абразивом. Выход сухой биомассы дрожжей составлял 5–8 г на 1МДж энергии в виде исходного вещества. Это в 3 – 6 раз меньше, чем на дрожжевых заводах. Однако поскольку в нашем случае процесс многостадийный, то потери неизбежны и выход биомассы понижен. Нами также проводились работы по превращению различных веществ загрязнителей в источники пищи для водных позвоночных и беспозвоночных видов. При этом у веществ меняется статус. Они из загрязнителей превращаются в пищевой субстрат, расширяя тем самым пищевую базу для многих видов. На основе наших разработок в ТГУ создано инновационное предприятие ООО «БиоРетокс», решающий экологические и биотехнологические задачи. ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ ИММОБИЛИЗОВАННОЙ НА ХИТОЗАНЕ ЛИПАЗЫ Ковалева Т.А., Беленова А.С. Воронежский государственный университет, г. Воронеж, Университетская пл. 1, Россия e-mail: tamara_kovaleva@inbox.ru В настоящее время разрабатываются новые прогрессивные технологии очистки водных объектов от загрязнений с использованием иммобилизованных ферментов, которые имеют ряд преимуществ перед растворимыми катализаторами в связи с более высокой стабильностью по отношению к денатурирующим факторам окружающей среды. В связи с увеличением использования липолитических ферментов в комунальном хозяйстве для очистки сточных вод, становится необходимым изучение условий иммобилизации липаз на носителях, которые могут применяться в данной отрасли. Цель настоящего исследования – подбор носителей и изучение способов иммобилизации липазы. В качестве носителей для иммобилизации использовались различные типы хитозанов. По химической структуре хитозан является сополимером D-глюкозамина и N-ацетил-Dглюкозамина. Большое количество свободных аминогрупп в молекуле хитозана определяет его свойство связывать ионы водорода и приобретать избыточный положительный заряд. За счет большого количество водородных связей, которые способен образовать хитозан, он 156 является универсальным сорбентом, который может связывать огромный спектр веществ органической и неорганической природы, в том числе и ферментов Определение каталитической активности липазы проводили спектрофотометрическим методом Андерсона - Маккарти. Содержание белка в свободном ферментном препарате определяли методом Лоури, для иммобилизованной на хитозане липазы использовали модифицированный метод Лоури. Достоверность отличий контрольных и экспериментальных результатов оценивали при помощи t-критерия Стьюдента. Осуществлена иммобилизация липазы на высокомолекулярном (10-12 кДа) и низкомолекулярном (1-1,5 кДа) хитозане адсорбционным методом. Обнаружено, что при иммобилизации липазы на хитозане с молекулярной массой 1-1,5 кДа каталитическая активность ферментного препарата снижалась на 59%. При иммобилизации липазы на высокомолекулярном хитозане каталитическая активность иммобилизованного ферментного препарата составляла 24% активности нативного фермента. Очевидно, фермент достаточно прочно связывается с матрицей данного носителя, существенно не изменяя при этом своей каталитически активной конформации, что позволяет считать хитозан перспективным сорбентом-матрицей для получения стабильных и высокоактивных гетерогенных биокатализаторов на основе иммобилизованной липазы. Показано, что связывание фермента с матрицей высокомолекурного хитозана приводит к сдвигу оптимальной температуры катализа в сторону более высоких значений, для низкомолекулярного носителя данного эффекта не наблюдается. Оптимальные значения pH при иммобилизации остаются неизменными. Анализ результатов экспериментов позволяет сделать заключение о том, что адсорбционная иммобилизация липазы на хитозане является перспективным для применения методом иммобилизации. КОРИЧНЕВООКРАШЕННЫЕ СЕРОБАКТЕРИИ ВОДНОЙ ТОЛЩИ ЧЕРНОГО МОРЯ Лунина О.Н., Пименов Н.В., Горленко В.М. Институт микробиологии РАН, Москва, 117312, Проспект 60-Летия Октября, д.7, корп.2, e-mail:onlun@yandex.ru Долгие годы считалось, что фотическая зона в глубоководной зоне Черного моря ограничивается верхними 70-80 м, поэтому аноксигенные фототрофные бактерии (АФБ), которые развиваются в большинстве меромиктических озер на границе кислородных и сероводородных вод, здесь из-за отсутствия света активно функционировать не могут. Однако в конце 80-тых годов в литературе появились первые сообщения об обнаружении в зоне хемоклина на глубинах 90-100 м следовых количеств бактериохлорофила e (БХле), который присутствует у зеленых серных бактерий Chlorobiaceae [1]. Позже в сериях работ было показано, что в некоторые сезоны года в центральной части моря минимальные количества света могут достигать хемоклина и обеспечивать развитие моноспецифической АФБ Chlorobiaceae филотип BS-1 [2]. Недавно появилось сообщение об обнаружении АФБ в хемоклине континентального склона на глубинах 140-150 м [3]. В сериях экспедиций 2005-2010 гг. нами было обнаружено присутствие в хемоклине континентального склона Черного моря коричневоокрашенных зеленых серобактерий, филогенетически близких к Clorobium BS-1. Хороший рост этих микроорганизмов наблюдался при посевах свежеотобранных проб морской воды на стандартную среду для зеленых серобактерий, а также просто при добавлении к морской воде дрожжевого экстракта. Обращает на себя тот факт, что накопительные культуры АФБ были получены из горизонтов водной толщи в интервале 150-180 м, в то время как появление сероводорода отмечалось на глубине 165-167 м. Стабильное присутствие жизнеспособных клеток АФБ на глубинах, куда проникновение света маловероятно даже в период наибольшей прозрачности вод, ставит вопрос о механизмах, способствующих выживанию этих микроорганизмов в 157 отсутствии света. Большинство исследователей сходится во мнении, что появление АФБ в хемоклине континентального склона определяется особенностью горизонтальных течений в Черном море, и микроорганизмы сюда попадают из хемоклина глубоководной зоны. Однако, на наш взгляд, постоянное присутствие активных форм АФБ на границе кислородных и сероводородных вод континентального склона может указывать на способность коричневоокрашенных серных бактерий переключаться на хемотрофный или органотрофный тип питания. ВЛИЯНИЕ ТЯЖЕЛЫХ МЕТАЛЛОВ НА ВИРУЛЕНТНОСТЬ ПАТОГЕННЫХ БАКТЕРИЙ, ОБИТАЮЩИХ В МОРСКОЙ СРЕДЕ Остапенко Е.А. НИИ эпидемиологии и микробиологии СО РАМН, г. Владивосток, Россия e-mail: angel.8807@bk.ru Возрастающая антропогенная нагрузка на морскую среду вызывает значительные экологические изменения в прибрежных акваториях, принимающих наибольшее количество загрязняющих веществ. В результате действия токсикантов, являющихся мощным фактором отбора, в морских прибрежных биоценозах доминируют организмы, развившие механизмы устойчивости к этим веществам или способные к их активной утилизации. К числу наиболее опасных групп поллютантов относятся тяжелые металлы. По токсикологическим оценкам «стресс – индексов» они занимают одно из первых мест среди загрязняющих веществ (Израэль, Цыбань, 1989). При этом ионы тяжелых металлов не могут быть существенно модифицированы или деградированы в среде подобно токсическим органическим соединениям. Для прибрежных вод Приморья металлы являются наиболее характерными загрязнителями, что обусловлено как природными геохимическими особенностями региона, так и значительным антропогенным воздействием. Параллельно с загрязнением прибрежной зоны тяжелыми металлами, имеет место и бактериальное загрязнение вод. В прибрежную зону моря со сточными водами поступает большое разнообразие условно-патогенных и патогенных микроорганизмов. В г. Владивостоке сточные воды (бытовые, инфекционных больниц) попадают практически без очистки в залив Золотой Рог, Амурский залив. Морские воды этих прибрежных акваторий, характеризующихся очень сильным загрязнением тяжелыми металлами, перемешиваются со сточными водами. В такой ситуации не исключена возможность формирования измененных штаммов условно-патогенных и патогенных бактерий под влиянием тяжелых металлов. В этом плане особого внимания заслуживает изучение влияния тяжелых металлов на вирулентность условно-патогенных бактерий, что явилось целью наших исследований. Для выполнения поставленной цели необходимо было оценить уровень металл – устойчивости условно-патогенных бактерий. Для этого в эксперимент были взяты по 8 штаммов бактерий Yersinia pseudotuberculosis, Salmonela enteritidis, Listeria monocytogenes, Pseudomonas aeruginosa, которые культивировали на средах с тяжелыми металлами такими как Co, Cd, Pb,Cu,Zn, взятыми в разных концентрациях (0,5-1%). Установлено, что устойчивость условно-патогенных бактерий к тяжелым металлам зависит от биологических особенностей штамма. Так наиболее устойчивыми оказались штаммы у сальмонелл, листерий, псевдомонад, иерсиний. Устойчивые к высоким концентрациям металлов штаммы были проверены на вирулентность на белых неинбредных мышах. Показано, что невирулентные штаммы сальмонелл, выращенные на свинце и на меди приобрели высоко вирулентные свойства, при этом вирулентность составила 102 микробных клеток. В отношении листерий и псевдомонад повышения вирулентности не наблюдали. Таким образом, тяжелые металлы способны влиять на вирулентные свойства условнопатогенных бактерий значительно усиливая их при этом. Следовательно такие прибрежные акватории, в которых присутствует смешанное загрязнение (техногенное загрязнение и бытовые стоки), являются очагами формирования высоко вирулентных штаммов, что является опасным в эпидемиологическом отношении. 158 КОМПЛЕКСНЫЕ ИССЛЕДОВАНИЯ БИОПЛЕНОК ЛИТОРАЛИ ОЗ. БАЙКАЛ Парфенова В.В. УРАН Лимнологический институт Сибирского отделения РАН, Иркутск e-mail: parf@lin.irk.ru Микробиологи, ориентированных на изучение чистых культур, считают суспензионные культуры как нормальное состояние жизнедеятельности этих организмов. Это верно и важно при исследовании физиологии и биохимии бактерий, так как гомогенные суспензии бактерий легко собираются и обрабатываются для экспериментальных целей. Действительность прокариотической жизни в природных местообитаниях заключается в том, что микроорганизмы проводят часть или все периоды жизни, прикрепляясь к поверхностям, создавая сложное сообщество. В последние годы произошел настоящий взрыв в исследовании, посвященном пониманию поведения бактерий на поверхностях - биопленках. Для исследования биопленок нами были отобраны пробы, как с натуральных субстратов, так и с искусственных: пластинки из нержавеющей стали, гранита, мрамора, амфиболита и неопределенных природных камней, выстилающих литоральную зону оз. Байкал. В работе был применен комплексный подход с использованием методов классической микробиологии (микроскопирование, культивирование, физиолого-биохимическое тестирование) и молекулярной биологии (пиросеквенирование по 16S рРНК). Микрокопирование показало большое разнообразие различных морфологических групп бактерий, которое отличалось в зависимости от субстрата, который мы использовали в работе. Культивирование выявило, что в формировании биопленок на природном камне участвовали все известные группы бактерий: сапрофиты, дрожжи, грибы, актиномицеты, бактерий, круговорота азота и фосфора. Общая численность бактерий была до 5 млн.кл./см, а число культивируемых олиготрофных, хемоорганотрофных, психрофильных бактерий варьировала в пределах 2-5 порядков на 1 см2. Таксономическое разнообразие по морфологическим и физиологобиохимическим показателям состояло из 5 родов микроорганизмов: Pseudomonas, Flavobacterium, Methylobacterium, Alcaligenes, Aureobacterium, и дополнительные исследования позволили выявить еще представителей рода Streptococcus, Bacillus. В биопленке по гену 16S pРНК выявлено 5047 последовательностей, которые относятся к домену Bacteria. Обнаружено 552 таксона, принадлежавших к 15 бактериальным филам. Наиболее многочисленны и разнообразны были филы Actinobacteria (1448 последовательностей, 31 род, 23,7%), Bacteroidetes (1635, 52, 32,9%) и Proteobacteria (1191, 196, 28,8). Филотип Flavobacterium доминировал в биопленке (925 последовательностей). Работа выполнена в рамках Бюджетного Проекта № VI.51.1.9 «Особенности формирования и жизненная стратегия микробного сообщества и вирусов в биопленках в оз. Байкал», при поддержке гранта РФФИ №10-05-01078-а. БАКТЕРИОПЕРИФИТОН ТРОСТНИКА ОБЫКНОВЕННОГО В ВОЛЖСКОМ ПЛЕСЕ РЫБИНСКОГО ВОДОХРАНИЛИЩА Рыбакова И.В.1, Белькова Н.Л.2, Суханова Е.В.2 Институт биологии внутренних вод им. И. Д. Папанина РАН, 152742, Ярославская обл., Некоузский р-н, пос. Борок, Россия 2 УРАН Лимнологический институт СО РАН, 664033 г. Иркутск, ул. Улан-Баторская, 3, а/я 278, Россия e-mail: ryba@ibiw.yaroslavl.ru, belkova@lin.irk.ru 1 В процессе отмирания и разложения фитомассы высших водных растений (ВВР) в воду поступают органические и минеральные вещества, в результате изменяется гидробиологический режим водоема. Цель работы – определить численность и активность 159 бактериального сообщества ассоциированного с тростником обыкновенным, как наиболее распространенным ВВР в прибрежной зоне Рыбинского водохранилища. Исследования проводили весной-осенью. За этот период общее число бактерий в обрастаниях тростника изменялось в пределах 127-6057 млн.кл./г растения, при средней 1713 млн.кл./г, их биомасса - 4,2-643,6 мкг/г, при средней 162,2 мкг/г. Наибольшие их значения наблюдали в период активного развития тростника – в июле-августе и осенью, при массовом разложении растений. В составе сообщества бактерий доминировали мелкие бактериальные клетки, кокки и эллипсоидные. Доля крупных клеток, палочек и нитей, в бактериальной биомассе перифитона тростника - возрастала от лета к осени, с 35,2 до 57,4% и с 8,8 до 10,1%, соответственно. Бактериальная продукция (БП) изменялась в пределах 13-117 мкгС/сут. на 1 грамм растительной массы, при средней 39 мкгС/(гхсут.), в то время как в воде зарослей соответствовала 53 мкгС/(лхсут.). В начале лета на молодых растениях БП была минимальна, в июле регистрировали максимум и, к осени постепенное снижение до 15 мкгС/(гхсут.). Весной на прошлогодних растениях бактериальная продукция ниже в 1,4 раза, чем на вегетирующих. Деструкция ОВ протекала со скоростью 34-301 мкгС/(гхсут.) (средняя 99 мкгС/(гхсут.)). В начале летнего сезона она была не велика, в июле-августе отмечали максимум и в октябре – снижалась до минимума. Весной на прошлогодних растениях деструкция ОВ протекала в среднем со скоростью 37 мкгС/(гхсут.), что меньше, чем на вегетирующих в этот же период. Была установлена корреляционная связь БП с деструкцией ОВ с Ккор.=1. Величины первичной продукции в обрастаниях составили 346 мкгС/(гхсут.) в начале летнего сезона и осенью снижались до 12 мкгС/гхсут., при средней 143 мкгС/(гхсут.). Весной, мертвый растительный субстрат активно заселялся водорослями и величины фотосинтеза здесь были в 1,7 раза выше, чем на вегетирующих растениях. Количество гетеротрофов, растущих на рыбопептонном агаре, изменялось от 2,8 до 44,9 млн.кл./г, при средней 20,2 млн.кл./г. Среднее значение численности углеводородокисляющих бактерий было 1892,2 тыс.кл./г, что составило 0,127 % от ОЧБ. В обрастаниях тростника, этих микроорганизмов больше, чем на погруженных и меньше, чем на растениях с плавающими листьями (Рыбакова, 2010). Численность бактерий, разрушающих клетчатку, колебалась в пределах 0,3-2887 тыс.кл./г, при максимуме летом и минимуме осенью. Весной на прошлогодних растениях клетчатку-разрушающих бактерий было в 10 раз больше, чем на вегетирующих. Вероятно это обусловлено большей усвояемостью растительного материала старых растений. Доля этой группы бактерий в ОЧБ перифитона тростника составила 0,001% весной и поздней осенью, а в период разложения тростника составила 0,105% . Амилолитические микроорганизмы варьировали в пределах 10-27 млн.кл./г, с максимумом в летнее время. Число денитрифицирующих бактерий варьировало в пределах 3-53 тыс.кл./г, при наибольших величинах в сентябре. В конце августа в обрастаниях тростника регистрировали нитрифицирующие бактерии 1 фазы, количество которых в среднем было 230 тыс.кл./г. При снижении температуры воды до 3-4°С, численность их уменьшалась до 0,08-0,20 тыс.кл./г. Молекулярно-генетическими методами было изучено разнообразие генотипов микроорганизмов, ассоциированных с тростником. Они были представлены филогенетическими линиями: протеобактерии (α, β, γ и δ-подгруппы), Bacteroidetes/Chlorobi Chlamydiae/Verrucomicrobia и цианобактерии. В накопительных культурах микроорганизмов, разрушающих клетчатку, определены доминирующие бактерии, с высоким процентом гомологии с бактериями рода Cellvibrio. 160 ИССЛЕДОВАНИЕ ЧИСЛЕННОСТИ И РАЗНООБРАЗИЯ БАКТЕРИАЛЬНОЙ МИКРОФЛОРЫ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА БАЙКАЛЬСКИХ БРЮХОНОГИХ МОЛЛЮСКОВ Тулупова Ю. Р., Парфенова В. В., Ситникова Т. Я., Сороковикова Е. Г., Кулакова Н. В. УРАН Лимнологический институт CO РАН, Иркутск, Улан-Баторская 3 e-mail: Tulupova@lin.irk.ru Впервые проведены исследования разнообразия и численности бактерий, присутствующих в желудке и кишечнике байкальских беспозвоночных животных, на примере эндемичных брюхоногих моллюсков вида Benedictia baicalensis. Моллюски и грунт, на котором они находились, собраны в течение двух лет в разные сезоны года с литорали песчано-каменистых грунтов залива Лиственничный, в Малом море и акватории п. Слюдянка. Для подсчета, выделения и идентификации бактерий различных групп из пищевого комка и фекалий моллюсков использовали классические бактериологические методы исследования. Для идентификации бактерий в кристаллическом стебельке применяли комплексные методы сканирующей и трансмиссионной микроскопии. Для молекулярно-генетической характеристики микрофлоры кишечного тракта моллюсков проводили скрининг 16S рДНК. В результате исследований обнаружена высокая численность колиформных бактерий в желудке и фекалиях моллюсков наряду с их отсутствием или незначительным количеством в придонной воде и грунте, откуда производился сбор моллюсков. Максимальное количество колиформных бактерий отмечено в феврале. К апрелю, с возрастанием численности гетеротрофных бактерий, количество колиформов в желудочном содержимом и фекалиях снизилось в 17 и 14 раз соответственно и в дальнейшем существенно не менялось. Максимум численности гетеротрофных бактерий, напротив, наблюдался в апреле. Сезонные колебания численности гетеротрофов в желудке и фекалиях соответствовали таковым в окружающей моллюсков среде. Также выявлено преобладание на 3-4 порядка численности амилолитических и протеолитических бактерий, выделенных из пищевого комка и фекалий моллюсков, над численностью бактерий этих же групп в среде обитания моллюсков. Во всех пробах отмечена преимущественная численность бактерий амилолитиков, так как моллюски потребляют пищу преимущественно растительного характера. Обнаружено, что среди множества родов культивируемых бактерий, обычных для донных осадков Байкала, наиболее многочисленны в желудке и кишечнике моллюсков представители родов Bacillus, Pseudomonas, Flavobacterium, Micrococcus, Acinetobacter, представители семейства Enterobacteriaceae, такие рода как Klebsiella, Enterobacter и E. coli. В желудке моллюсков находится кристаллический столбик (стебелек) – плотное цилиндрическое образование с концентрической структурой, содержащий амилолитические ферменты, способствующие перевариванию растительной пищи. В нем обнаружены бактерии, принадлежащие к семейству Spirochaetaceae. Семейство Spirochaetaceae включает в себя 8 родов, представители 5 из них являются симбионтами желудочно-кишечного тракта поедающих древесину тараканов и термитов (рода Clevelandina, Diplocalyx, Hollandina, Pillotina), многих двустворчатых и некоторых брюхоногих моллюсков (род Cristispira). Присутствие спирохет у моллюсков связано с наличием у них кристаллического стебелька и питанием их растительной пищей. Проведенное исследование найденных бактерий с помощью сканирующей и трансмиссионной микроскопии выявило ряд морфологических признаков, позволивших отнести обнаруженные спирохеты к роду Cristispira. В результате молекулярно-генетического анализа выявлены 5 филогенетических групп, соответствующие филумам Alpha-, Beta-, Gamma- Proteobacteria, Bacteroidetes и Tenericutes. Идентичность исследованных нуклеотидных последовательностей с 161 последовательностями, депонированными в международную базу GenBank составила 8599%. Наибольшая идентичность найдена с последовательностями, полученными из некультивируемой биоты пресной и морской воды, а также микрофлоры пищеварительного тракта моллюсков, ракообразных и насекомых. Работа выполнена при поддержке интеграционного проекта СО РАН № 96 и гранта РФФИ № 10-05-011078-А. ДИНАМИКА ПРОЦЕССОВ ЦИКЛА МЕТАНА В ОСАДКАХ ОЗЕРА БАЙКАЛ Шубенкова О.В.,1 Максименко С.Ю.,1 Погодаева Т.В.,1 Калмычков Г.В.,2 Земская Т.И.1 1 Лимнологический институт СО РАН, ул. Улан-Баторская, 3, г. Иркутск, Россия; 2 Институт геохимии СО РАН, ул. Фаворского 1А, г. Иркутск, Россия. e-mail: tzema@lin.irk.ru Цель работы: Провести лабораторный эксперимент с природным микробным сообществом осадков, вмещающих газовые гидраты, по выявлению в них процессов метангенерации и метанокисления. В качестве объектов исследования были взяты образцы донных осадков, отобранные на ст. Маленький, Большое Голоустное (Южный Байкал) и Посольская Банка (Средний Байкал). Поровые воды осадков исследуемых станций по химическому составу гидрокарбонатно-кальциевые. На всех станциях отбора проб были зафиксированы пики ацетат-ионов (от 15 до 50 мг/л), на ст. Маленький отмечено присутствие ионов железа (7 мг/л), в поверхностном слое осадка ст. Посольская Банка - повышенные концентрации сульфат-ионов (до 62 мг/л). Образцы осадка были помещены во флаконы со средой для накопления метаногенов, атмосфера полностью замещалась аргоном и дополнительно метаном в концентрациях, приближенных к таковым в исследуемых районах. Эксперимент экспонировали при комнатной температуре в течение 290 суток. Пробы надосадочного газа отбирали с периодичностью каждые 10 суток и анализировали на газовом хроматографе (“ЭХО-ПИД” с пламенно-ионизационным детектором). В течение первых 20 суток мы наблюдали одинаковую картину для всех станций: концентрация метана в среде резко падала, т.е. шло его активное потребление. Мы допускаем, что полностью избавиться от остаточного кислорода, который находится в среде и осадке нам не удается и потребление метана на этой стадии происходит с участием аэробных метанотрофных бактерий. Однако, после того как осадки становились полностью восстановленными, начиналась генерация метана - процесс, который осуществляется в строго анаэробных условиях. Метангенерация на исследуемых станциях наступала с разным интервалом: на ст. Б. Голоустное и Посольская Банка - на 60-69 сутки, а на ст. Маленький лишь на 150 сутки, в результате концентрации метана в пробах увеличились в 300 - 600 раз. Причем эти процессы были характерны для поверхностных слоев 0-5 см. Методом окраски по DAPI оценено морфологическое разнообразие микробного сообщества в исследуемых пробах. Отмечено преобладание крупных и мелких палочек, нитевидных форм микроорганизмов, а также мелких кокковидных форм. Дальнейший анализ содержания метана в пробах (100-110 сутки) выявил снижение данного параметра до исходных значений, уменьшение численности микроорганизмов, исчезновение нитевидных форм. В глубинных осадках явного процесса метангенерации не наблюдалось, лишь на ст. Б. Голоустное в слое 110 см, начиная со 190 суток, содержание метана в пробе увеличилось в 300 раз. Затем в течение 26 суток наблюдался период потребления метана, при котором его концентрация достигла исходных значений. Микроскопирование показало, что на данном этапе микробное сообщество было представлено крупными палочками с включениями. 162 Интересно отметить, что на момент окончания экспонирования эксперимента в пробах ст. Маленький вновь отмечается значительное увеличение содержания метана. Работы по выполнению эксперимента решено продолжить. Таким образом, в лабораторных условиях удалось зафиксировать процессы цикла метана, такие как метангенерация и анаэробное окисления метана. Известно, что анаэробное окисление в морских экосистемах осуществляется консорциумом архей, относящихся к группе ANME и сульфатредуцирующих бактерий. Очевидно, что данный процесс в Байкале идет по другому пути, поскольку сульфаты в осадках присутствуют в незначительных количествах и их концентраций не достаточно для осуществления этого процесса, также не были выявлены последовательности специфических групп архей. Вопрос о возможном окислителе, участвующем в анаэробном окислении метана, на сегодняшний день остается открытым. Работа выполнена при поддержке Интеграционного проекта № 27, Программы Президиума РАН 21.9. 163 Авторский указатель Абдуллаева А.Р. Абдурахманов Ф.Ю. Абзалова Э.Г. Агаева Н.Дж. Аксюк А.А. Алёхина Г.П. Алещенкова З.М. Алиев С.Н. Алиева С.Р. Аликулов З. Алтаева А. Алтунина Л.К. Ананьина Л.Н. Анохин Б.А. 11 34 144 11 75 79 57 5 108, 110 8 8 114 53 6 Генова С.Н. Гладких А.С. Горелова О.А. Горленко В.М. Гусейнов А.Т. Дагурова О.П. Дамбаев В.Б. Данилова Э.В. Дарьин А.В. Дворянинова О.П. Дегерменджи А.Г. Демидов Е.А. Доронина Н.В. Дрюккер В.В. Антипов С.С. Антипова Л.В. Ахмадуллина Ф.Ю. Ахмедов И.С. Ахметов Л.И. Байрамов Р.В. Балымова Е.С. Бархутова Д.Д. Баулина О.И. Башенхаева М.В. Беленова А.С. Белых О.И. Белькова Н.Л. Богатыренко Е.А. Бондарь В.С. Боронин А.М. Брюханов А.Л. Брянская А.В. Бузолева Л.С. Букин С.В. Буркальцева М.В. Бурюхаев С.П. Бутина Т.В. Велиев М.Г. Ветрова А.А. Власова Е.П. Волокитина Н.А. Воробьёва С.В. Воронов А.И. Галанина Е.В. Ганбаров Х.Г. Гаранкина В.П. Гаретова Л.А. 8 8 13 11 136 108 13 16 41 152 156 30, 39 18, 159 19 88 136 22, 66 25 19, 27 94 73 44 30 108 136 99, 136 152 139 139 32 34 36 38 Дутова Н.В. Жукова О.В. Забелин В.А. Заботкина Е.А. Загоскина Н.В. Захарова Е.Е. Захарова Ю.Р. Захарюк А.Г. Зацаринная Е.А. Земская Т.И. Зыков В.В. Ившина И.Б. Илиенц И.Р. Кадыков В.А. Казаков А.С. Калмычков Г.В. Калугин И.А. Калюжин В.А. Капаруллина Е.Н. Каретникова Е.А. Кимм А.А. Кирилина Т.В. Ковадло А.С. Ковалева Т.А. Козырева Л.П. Коломиец Э.И. Компанец Г.Г. Кондратьева Л.М. Копылов А.И. Корнеева В.А. Косевич И.А. Косолапов Д.Б. Косторнова Т.Я. 164 102 39 41 157 110 36, 44 16 16 48 8 102 25 74 46, 51, 52, 130, 150, 152 46, 152 59 136 64, 104 116 66 152, 153 53 154 44, 82, 86, 94, 162 48, 102 106, 119 139 130 106 51, 162 48 155 74 38 139 50 46, 51, 52, 130 156 53 57 27 59, 62 64, 69, 104, 124 22, 66 41 64, 69, 104 128 Кравченко О.С. Кропински А. Крылов В.Н. Крылов С.В. Кувичкина Т.Н. Кулакова Н. В. Курочкина Л.П. Кутлиев Дж. Куюкина М.С. Лазарева Е.В. Ланкина Е.П. Литвиненко З.Н. Лихошвай А.В. Лобакова Е.С. Логинова Е.Г. Ломакина А.В. Лунина О.Н. Мавлянова М.И. Макарихин И.Ю. Максименко С.Ю. Максимов А.Ю. Малуп Т.К. Мамаева Е.В. Матюгина Е.Б. Месянжинов В.В. Мирошников К.А. Мисетов И.А. Михайлов И.С. Могильная О.А. Морозов И.В. Морозова О.Ю. Мубаракшина Л.Ф. Мучкина Е.Я. Намсараев Б.Б. Нестеренко Е.В. Нечаева И.А. Овечкина Г.В. Овчинникова А.А. Огнева Н.В. Олейник Г.Н. Осипов Г.А. Остапенко Е.А. Павлова О.Н. Парфенова В.В. Пельтек С.Е. Перушкина Е.В. Петриков К.В. Петров Е.М. Петрова Д.П. 71, 128 73 73 73 74 161 75, 130 77, 84, 134, 141 106, 119 25 139 90 94 41 79 82, 94 157 77, 84, 134 106 162 6 25 86 18 75, 130 130 79 153 88 82 59, 90 96 98 36, 44, 53 139 136 6 136 52 92 142 158 71, 82, 86, 94 71, 86, 128, 159, 161 25 96 136 111 152 Пименов Н.В. Писарева С.И. Плетенева Е.А. Плетнева С.Ю. Плотникова Е.Г. Погодаева Т.В. Полтева А.В. Попельницкая И.М. Попельницкий В.А. Потапов С.А. Пунтус И.Ф. Рапопорт В.Л. Ремезовская Н.Б. Решетилов А.Н. Рогозин Д.Ю. Розанов А.С. Романенко А.В. Россманн М.Г. Рубцова Е.В. Рыбакова И.В. Садыкова З.О. Салманов М.А. Самсонова А.П. Сваровская Л.И. Селях И.О. Семенова Е.Н. Семенова Л.Р. Серебренникова М.К. Сидорова Н.А. Сироткин А.С. Ситникова Т.Я. Соловченко А.Е. Сороковикова Е.Г. Старосила Е.В. Степанова О.А. Стройнов Я.В. Стукова О.Ю. Суслова М.Ю. Суханова Е.В. Сыкилинда Н.Н. Талалаева Г.Б. Таран О.П. Тихонова И.В. Тулупова Ю.Р. 22, 66, 157 114 73 142 53 162 32 98 98 30, 39 99, 136 59 6 74 48, 102 25 104 75 106 159 96 108, 110 111 114 116 50 116 119 154 50, 96 161 116 39, 161 92 121 64, 124 126 71, 86, 128 159 130 133 25 39 161 Уринова А.А. Усольцева М.В. Федорова Г.А. Филонов А.Е. Хабудаев К.В. 77, 84, 134 153 94 136 138 165 Халилов Р.И. Хижняк С.В. Хушмуродова Г. Чан Т.Х. Часовников В.К. Шабурова О.В. Шевкунова О.И. Шерышева Н.Г. Шишкова Н.А. Шишлянников М.С. Шишлянникова Т.А. Шнейдер М.М. Шоларь С.А. Шорникова Е.А. Шубенкова О.В. Ahn T.-S., Akagashi Y. Azumi H. Battsetseg Ch. Byun J. Dorjkhand B. 11 139 141 50 22 73 126 142 130 152 94 130 121 144 162 146 150 150 147 151 147 Fialkov V.A. Freikowski D. Gallert C. Jin S.-Y. Joung Y. Jung D. Katano T. Lee Y.-O. Mimura T. Mitamura O. Murata T. Nakamura T. Nakano S. Narantuya D. Ouyn-Erdene D. Sato Y. Sugiyama M. Tanaka Y. Watanabe Y. Winter J. Yoon J.-H. 150 148 148, 149 149 146 146 150 149 150 150 150 150 150 147 147 150 150 150 150 148, 149 151 Научное издание МИКРООРГАНИЗМЫ И ВИРУСЫ В ВОДНЫХ ЭКОСИСТЕМАХ Материалы 3-го Байкальского Микробиологического Симпозиума с международным участием (Иркутск, 3–8 октября 2011 г.) Технический редактор А.И. Шеховцов Подписано в печать 26.09.2011 г. Формат 60х90/8. Гарнитура Times New Roman. Бумага Ballet. Уч.-изд. л. 14,2. Усл. печ. л. 19,2. Тираж 120 экз. Заказ 525. Издательство Института географии им. В.Б. Сочавы СО РАН 664033, Иркутск, ул. Улан-Баторская, 1 166