Современное применение металлов платиновой группы
advertisement
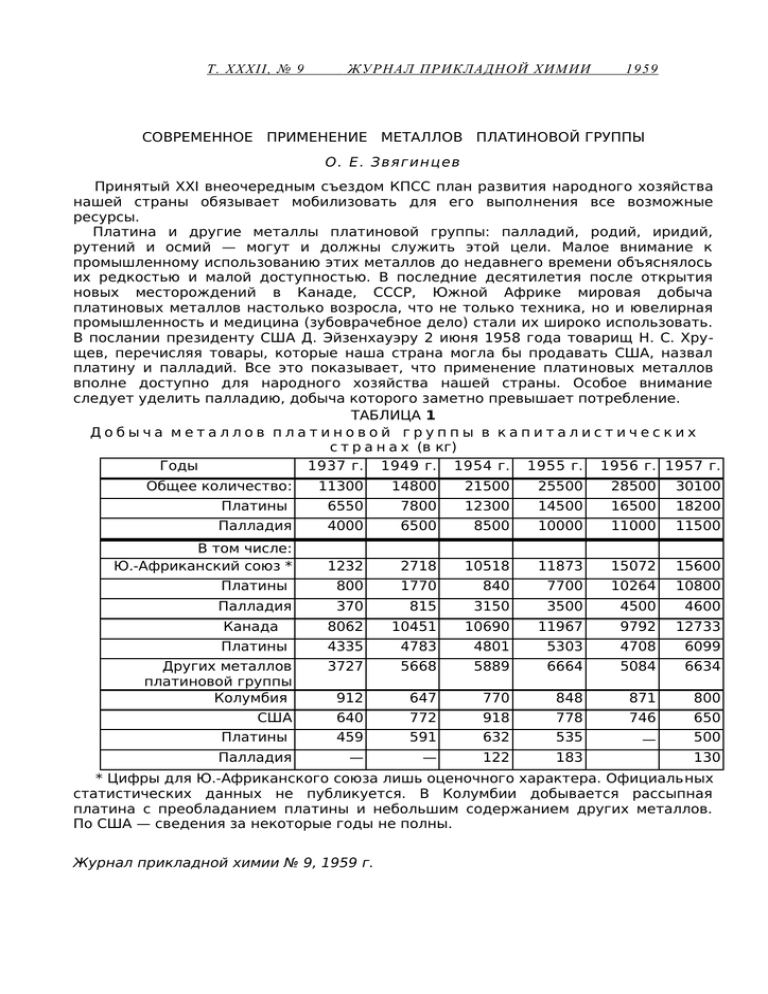
Т. XXXII, № 9 ЖУРНАЛ ПРИКЛАДНОЙ ХИМИИ 1959 СОВРЕМЕННОЕ ПРИМЕНЕНИЕ МЕТАЛЛОВ ПЛАТИНОВОЙ ГРУППЫ О. Е. Звягинцев Принятый XXI внеочередным съездом КПСС план развития народного хозяйства нашей страны обязывает мобилизовать для его выполнения все возможные ресурсы. Платина и другие металлы платиновой группы: палладий, родий, иридий, рутений и осмий — могут и должны служить этой цели. Малое внимание к промышленному использованию этих металлов до недавнего времени объяснялось их редкостью и малой доступностью. В последние десятилетия после открытия новых месторождений в Канаде, СССР, Южной Африке мировая добыча платиновых металлов настолько возросла, что не только техника, но и ювелирная промышленность и медицина (зубоврачебное дело) стали их широко использовать. В послании президенту США Д. Эйзенхауэру 2 июня 1958 года товарищ Н. С. Хрущев, перечисляя товары, которые наша страна могла бы продавать США, назвал платину и палладий. Все это показывает, что применение платиновых металлов вполне доступно для народного хозяйства нашей страны. Особое внимание следует уделить палладию, добыча которого заметно превышает потребление. ТАБЛИЦА 1 Добыча металлов платиновой группы в капиталистических с т р а н а х (в кг) Годы 1937 г. 1949 г. 1954 г. 1955 г. 1956 г. 1957 г. Общее количество: Платины 11300 6550 14800 7800 21500 12300 25500 14500 28500 16500 30100 18200 Палладия 4000 6500 8500 10000 11000 11500 В том числе: Ю.-Африканский союз * 1232 2718 10518 11873 15072 15600 Платины 800 1770 840 7700 10264 10800 Палладия 370 815 3150 3500 4500 4600 8062 4335 10451 4783 10690 4801 11967 5303 9792 4708 12733 6099 Других металлов платиновой группы Колумбия 3727 5668 5889 6664 5084 6634 912 647 770 848 871 800 США Платины 640 459 772 591 918 632 778 535 746 650 500 Палладия — — 122 183 Канада Платины — 130 * Цифры для Ю.-Африканского союза лишь оценочного характера. Официальных статистических данных не публикуется. В Колумбии добывается рассыпная платина с преобладанием платины и небольшим содержанием других металлов. По США — сведения за некоторые годы не полны. Журнал прикладной химии № 9, 1959 г. 1890 О. Е. Звягинцев В табл. 1 приведены данные о мировой добыче металлов платиновой группы за последние годы (без СССР) [1]. Статистика потребления платиновых металлов в различных отраслях промышленности, ювелирном деле и для медицинских целей в капиталистических странах не ведется. Исключение составляют США, где эти данные публикуются. Но так как США потребляют львиную долю всех металлов платиновой группы из мировой добычи, то цифры, приводимые в табл. 2, для США характеризуют распределение платины и палладия между потребителями [ 2]. ТАБЛИЦА 2 Потребление платины и палладия различными отраслями п р о м ы ш л е н н о с т и США (в кг) Общее количество Платина Палладий 2984 2164 Платина Палладий 4748 3615 Платина Палладий 9960 7295 Платина Палладий 14527 10938 Платина Палладий 13395 12441 Платина * Палладий * 10960 11400 Промышленность химическая и электроювели нефтеперера техническа рная батывающая я 1937г. 569 294 1550 5 649 257 1949 г. 1001 893 2501 298 1688 997 1954г. 5658 1614 1174 465 4788 853 1955г. 10827 1514 1639 1127 7798 892 1956г. 9628 1676 1205 978 9486 492 1957г. 7650 1550 950 900 8820 550 медиц прочие инская 346 1251 296 619 225 2 57 13 441 892 73 297 383 896 164 225 387 944 499 241 200 600 160 200 Как видно из табл. 2, потребление платины и палладия в США до 1957 г. росло, и только начавшийся экономический кризис приостановил этот рост. Особенно выросло потребление палладия в электротехнической промышленности, зубоврачебном деле и химических производствах. Не безынтересно подробнее рассмотреть, для каких целей и в какой форме применяются металлы платиновой группы в различных областях народного хозяйства и в каких направлениях может развиваться их применение. Применение металлов платиновой группы в химической и нефтеобрабатывающей промышленности Давно известно применение платины как химически стойкого материала для изготовления аппаратуры. Так, например, еще в начале XIX века изготавливались из платины аппараты для выпаривания сер* По неполным данным. 1891 Современное применение металлов платиновой группы ной кислоты. Однако вследствие дороговизны платины такие предметы изготавливались очень редко. В последние годы положение изменилось. Платина и ее сплавы начали широко внедряться в ряд химических производств в качестве материала для аппаратов. Это относится главным образом к производствам различных фторсодержащих веществ, особенно в тех случаях, когда нужно получить очень чистый продукт. Однако редко делают реакторы или их части целиком из платины; обычно применяют плакировку аппаратуры или ее частей платиновой фольгой. Тогда изготовление даже крупной аппаратуры обходится сравнительно дешево. Один квадратный метр платиновой фольги толщиной 0.025 мм весит всего 540 г. Кроме того, платина в течение срока работы аппарата почти не теряется и после замены его другим может быть реализована как лом. Таким образом, на стоимость продукта накладывается лишь стоимость изготовления плакировки и незначительная сумма стоимости потерь платины. По этим причинам плакированная платиной аппаратура нашла себе применение не только при изготовлении очень чистых химических препаратов, но и в сравнительно крупных химических производствах и в пищевой промышленности. В тех случаях, когда химической стойкости и тугоплавкости платины недостаточно, обращаются к сплавам платины с металлами, повышающими эти свойства. Так, например, при производстве стеклянного волокна лодочки для расплавления стеклянной массы и фильеры, через которые выливается тончайшая струйка массы, дающая при затвердевании волокно, делаются из сплава платины с родием (7% родия). Родий повышает температуру плавления платины и придает ей большую химическую стойкость. Платина применяется также в некоторых электрохимических производствах в качестве нерастворимых электродов. Так, в аппаратах для электролитического получения перекиси водорода, персульфатов и органических перекисей аноды изготовляют из платины. Применение платины в химических лабораториях хорошо известно, и здесь не имеет смысла перечислять платиновые предметы лабораторного обихода. Стоит лишь упомянуть, что для придания тиглям и чашкам большей механической прочности иностранные фирмы часто изготовляют эти предметы из сплава платины с 1—3% родия; срок службы этих предметов значительно повышается. Потребление платиновых металлов в качестве материалов для химической аппаратуры не занимает первостепенного места. Главная часть этих металлов потребляется в химической и нефтеперерабатывающей промышленности в качестве катализаторов. Применение платины и палладия для ускорения различных реакций ведет свою родословную с начала XIX века [ 8 ]. За последние годы появилось огромное количество работ, особенно американских, посвященных каталитическим реакциям при помощи платины и палладия. Огромное большинство их относится к процессам органического синтеза, окисления, гидрогенизации и дегидрогенизации. Особенно много работ и патентов заявлено за послед ние годы на применение платины в нефтеперерабатывающей промышленности для получения высокооктановых бензинов и других продуктов. Как платина, так и палладий могут применяться в каталитических реакциях в разнообразных формах. В гетерогенном катализе применяются катализаторы сле дующих типов. 1. К о м п а к т н ы е м е т а л л ы в виде жести, фольги, проволоки и, чаще, сетки. Благодаря малой удельной поверхности эти катализаторы наименее активны. Они применяются для реакций в газовой среде и при высокой температуре. 2. П л а т и н о в а я и п а л л а д и е в а я г у б к а , получаемые прокали ванием солей этих металлов до полного термического разложения и спекания. 3. П л а т и н о в а я и п а л л а д и е в а я ч е р н ь , т. е. металлы, получен ные восстан овлением солей металлов в форме высокодисперсных порошков. 1892 О. Е. Звягинцев Благодаря большой удельной поверхности они обладают высокой адсорбционн ой способностью и каталитической активностью. 4. Металлы в коллоидной форме, получаемые в условиях, обеспечивающих очень высокую дисперсность частиц (в присутств ии защитных кол лоидов). Эти катализаторы применяются главным образом для проведения реакций в жидкой среде. 5. Катализаторы с платиной и палладием на носител я х или трегерах. В качестве нейтральных веществ, на которые наносится мелко раздробленный металл, могут применяться керамические массы, пемза, уголь, серно кислый барий, окись алюминия. Трегер играет роль стабилизатор а, не дающего метал лам изменять свою дисперсность. Платиновая и палладиевая чернь и коллоидные по рошки чувствительны к температуре выше 400° и быстро теряют активность. Нанесен ные на твердую массу трегера металлы не изменяют свои каталитические свойства при нагревании. 6. Промотированные или активированные смешанные к а т а л и з а т о р ы с п л а т и н о й и п а л л а д и е м состоят из массы, где носитель не индифферентен по отношению к процессу, а также является активно действующим на скорость или избирательность химических реакций. 7. Скелетные катализаторы, получаемые из сплавов платины или палладия с медью путем растворения неблагородного компонента в кислотах. Такие катализаторы, будучи твердыми массами, обладают большей пористостью и развитой поверхностью. Кроме того, благодаря вытравлению из кристаллов атомов неблагород ных металлов, получаются дефектные кристалличе ские решетки, обладающие повы шенной каталитической активностью. В гомогенном катализе в жидкой фазе широко применяются соединения и соли платины и палладия, растворимые в реагирующих жидкостях, чаще всего платино- хлористоводородная и палладистохлор истоводородная кислоты, легко растворимые в спиртах и других органических веществах. Мы не будем здесь останавливаться на способах приготовления платиновых, палладиевых и смешанных катализаторов — вопросе чрезвычайной важности, но требующем специального рассмотрения. Остановимся лишь на требованиях к чистоте тех металлов, которые служат материалами для приготовления катализаторов. Многочисленные исследования показали, что многие примеси в платине и палладии изменяют их каталитические активности. Так, например, при реакции окисления аммиака родий, сплавленный с платиной, увеличивает активность, а золото даже при очень малом содержании в платине отравляет катализатор. Поэтому аффинаж (очистка) металлов платиновой группы, применяемых для изготовления катализаторов должна быть совершенной. Допускаемые в аффинированных металлах примеси в общей сложности не должны превышать сотых долей процента. В платине обычными примесями являются железо, иридий, палладий, никель, медь. Палладий содержит железо, платину, родий, никель, медь. Иногда в незначительных количествах присутствуют и иные элементы. Однако, когда сумма примесей не превышает названного предела нескольких сотых долей процента, металлы могут считаться вполне приемлемыми для изготовления катализаторов. Но в некоторых случаях приходится требовать от аффинажа металлов повышенной чистоты, как например в упомянутом сплаве — катализаторе для окисления аммиака — не должно быть и следов золота. Наши аффинажные заводы изготавливают очень чистые металлы, а если это необходимо, могут выдавать платину и палладий в спектральночистом состоянии. Методы получения спектральночистой платины разработаны Черняевым и Рубинштейном [4], спектральночистого палладия Рубинштейном и Сокол [ 5] в Институте общей и неорганической химии им. Н. С. Курнакова. Для некоторых производств применяют не чистую платину, а ее сплавы с родием, палладием, иридием и другими. По истечении некоторого срока, катализаторы теряют частично свою активность и их необходимо заменять новыми. Отработавшие свой срок катализаторы регенерируются. 1893 Современное применение металлов платиновой группы В краткой статье нет возможности дать обзор всех каталитических реакций, ускоряемых платиновыми металлами. Мы постараемся привести примеры различных химических процессов, иллюстрирующих значение этих металлов для современной химической и нефтеперерабатывающей промышленности. В курсах химической технологии часто описывается процесс контактн ого полу чения серной кислоты при помощи платиновог о катализатор а. В качество примеров приводятся контактный аппарат Тентелевского химического завода в Петербурге с платин ированным асбестом и метод Грилло- Шредера [ в ] с платиной на сернокислом магнии и другие. Но в настоящее время сернокислотные заводы почти не пользуются платиновыми катализаторам и, перейдя на более дешевые ванадиевые катализаторы, хотя они менее активны, чем платиновые. В технологии неорганических веществ наиболее значительным процессом по ко личеству потребляемых платиновых металлов в настоящее время является окисление аммиака в азотную кислоту. Теория каталитического окисления аммиака на платине была разработан а Оствальдом и Брауэром [ 7 ], а затем Нейманом и Розе [ 8 ]. Первым заводом контактной азотной кислоты был построенный в России И. И. Андреевым и его сотрудниками в 1916 г. [ 9 ]. В настоящее время производство азотной кислоты этим методом достиг ло огромных размеров. В СССР созданы и работают мощные за воды азотной кислоты. Сплавы — катализаторы на основе платины — в настоящее время считаются непревзойденными по активности и стойкости в условиях производ ства. Окисление аммиака может производиться либо при атмосферном давлении и тем пературе 700—750°, либо под давлением 7—8 атм. при температуре 850—900°. Если применяют окисление при низком давлении, то сетку контактного аппарата распо лагают в 3 слоя при применении повышенного давления — 15—20 слоев. Сетка делается из сплава платины с 5—7% родия. Добавка родия делает сетку более прочной и дол говечной, каталитическая активность ее при этом не меняется. Советскими учеными было предложено заменить часть родия более дешевым палладием. Это оказалось полезным не только в смысле удешевления сетки, но и позволило увеличить активность ее как катализатор а. При оптимальной температуре и скорости движения газов выход окислов азота составляет 97—98%. Размеры сеток в зависимости от конструкц ии ап паратов 1.1—2 метра. Их изготовляют из проволок диаметром 0.05—0.09 мм. Число плетений на 1 см 2 сетки составляет 1024 [ 9 ]. При работе сетки претерпевают изменения: они засариваются пылью (главным образом окислами железа) и благодаря длительному нахождению при высокой тем пературе делаются хрупкими, а поверхность их рыхлой. При этом каталитическая активность сетки падает, частицы разрыхленной поверхности проволоки отрываются и уносятся газами. По истечении определенного времени работы сетки сменяют и направляют на аффинажный завод для регенерации платиновых металлов. Срок службы сеток примерно 1 —1.5 года при работе под атмосферным давлением. Потери платинового сплава в производственных условиях при работе под давлением 7—8 атм. доходят до 0.3—0.4 г на тонну 100% азотной кислоты и 0.04—0.06 г при работе под атмосферным давлением. Попытки заменить платиновые металлы другими, более дешевыми материалами не увенчались успехом, так как по своей каталитической активности для процесса окисления аммиака платина остается наилучшей. Каталитическая дегидрогенизация органических с о е д и н е н и й в настоящее время имеет огромное значение в химии и химической технологии. Первые исследования в этой области произведены Бертло, Рейсетом и Милоном [10], Сабатье и Сен-дереном [11], Вилаыдом [12], и другими. Наиболее важные работы в этой области проделаны Зелинским и его школой, начиная с 1911 г. [13]. Зелинским с сотрудниками [13, 14] было установлено, что не все циклические углеводороды дегидрируются на платине и палладии: дегидрируются углеводороды, состоящие из шестичленных циклов или содержащие шестичленные гидроароматические циклы. Другие же углеводороды не способны отщеплять водород. На основе этих каталитических реакций были проведены исследования смесей углеводородов, позволившие различать компоненты этих смесей. Подробное изучение реакций каталитической дегидрогенизации углеводородов, проведенное Н. Д. Зелинским и его школой, позволило разработать важный и надежный метод исследования нефтей [15, 16]. 1894 0. E. Звягинцев Более того, был найден подход к обогащению нефтяных фракций ароматическими углеводородами путем гидрогенизации гексагидроароматических соединений, содержащихся в нефтях некоторых месторождений СССР [17]. Способ Зелинского сыграл большую роль в анализе бензинов и стал одним из основных технологических методов облагораживания (увеличения содержания ароматических углеводородов) бензинов. Особенно широко этот метод или его варианты применяются в американской нефтеперерабатывающей промышленности. Этим отчасти объясняется значительное увеличение потребления платины в этой отрасли промышленности за последнее десятилетие. 1 Все реакции дегидрогенизации ведутся в паровой фазе с применением платины, палладия или иных катализаторов на твердом носителе, на угле, керамике, окиси алюминия, силикагеле. Следует упомянуть недавно опубликованную Шуйкипым и его сотрудниками [19] работу по облагораживанию прямо генных бензинов методом низкотемпературной дегидрогенизации на платинированном угле. Реакция ведется при температуре 300° в паровой фазе над углем, содержащим 2—4% платины. В другой работе тех же авторов [19] приводятся опыты получения толуоловых концентратов методом низкотемпературной дегидрогенизации на платинированном угле. Опыты велись с фракцией бензинов 98—112° как от очищенной, так и неочищенной нефти (Ильской и Хадыженской). Катализатор состоял из древесного угля с 4% платины. Температура реакции около 300°. Полученные концентраты содержали 30—40 объемн. % толуола, последний выделялся методом азеотропной перегонки его с метанолом. Очищенный толуол полностью соответствовал требованиям ГОСТа. В противоположность упомянутым реакциям реакция гидрогенизации (присоединение водорода) может вестись как в паровой, так и в жидкой фазах. В случае жидкофазной гидрогенизации катализатор вносится в коллоидной форме. Глубокое изучение реакций каталитической гидрогенизации начато Сабатье и его сотрудниками и Зелинским и его учениками в 90-х годах прошлого века. 1 Под названиями «реформинг-процесс», «гудриформин-процесс» в различных капиталистических странах, особенно США, разумеются производственные каталитические процессы переработки нефтепродуктов для п ол у ч е н и я высокооктанового авиационного и автомобильного топлив. Мощность установок в С Ш А в 1 9 5 7 г . с о с т а в л ял а о к о л о 1 3 0 0 0 0 0 б а р е л е й в с у т к и . Э т о с о с т а в л я е т 1 4 % о т в с е х п р о д у к т о в н е ф т е п е р е г о н к и С ША [ 1 8 ]. В 1902 г. С. А. Фокин провел реакции гидрогенизации жиров в жидкой фазе. В 1904 г. был начат В. Н. Ипатьевым большой ряд работ по гидрогенизации под давлением водорода. Платина, палладий, осмий и рутений могут служить катализаторами для многих реакций гидрирования различных веществ: олефинов и полиолефинов, ацетилена и его производных, циклических и ароматических углеводородов, альдегидов и кетонов, органических кислот и их производных, нитросоединений и ряда других. В качестве примера можно привести реакцию, открытую в 1933 г. Н . Д. Зелинским, Б . А. Казанским и А. Ф. Плате. Она состоит в раскрытии циклопентана при действии водорода над платиной. Пятичленный цикл является очень устойчивым. Это наблюдение послужило началом целого ряда исследований. Его практическое значение в применении к моторному топливу состоит в том, что после такой гидрогенизации повышается октановое число последнего [ 20]. 1895 Современное применение металлов платиновой группы Зайцев еще в 1872 г. [ 2 1 ] провел парофазное восстанов ление нитро бензола в анилин с палладиевым катализатором. Эта реакция, изу чавшаяся потом многими исследователями, лежит в основе химии красок и имеет большое значение для других разделов органическог о синтеза. Гидрогенизация жиров играет большую роль в получении твердых жиров из жидкого растительног о масла. Обычно для этих целей поль зуются никелевым катализатор ом. Реакцию ведут в жидкой фазе и ката лизатор остается в продуктах реакции. Поэтому для целей получения высококачественных пищевых твердых жиров никелевый катализатор непригоден и его заменяют палладиевым, который отделяют после реак ции. Примером применения в качестве катализатора рутения можно при вести реакцию синтеза высокоплавких парафинов, изученную Кельбель и Баттахарйа в 1958 г. [ 2 2 J. Реакция ведется в .жидкой фазе при помощи суспензии рутения (1 г в 150 мл воды). Еще большее значение для практических целей имеет каталитическая реакция получения глицерина и других многоатомных спиртов из цел люлозы или полисахаридов при помощи рутения. Многоатомные спирты — гликоли, глицерин, эритрит, пентиты и гекситы — обладают большой реакционной способностью, обусловливаю щей возможность образования значительног о числа разнообразных орга нических соединений. Этим объясняется непрерывный рост производства многоатомных спиртов, приобретающих все большее значение для раз вития важных отраслей химической промышленности, а также увеличе ния выпуска товаров широкого потребления. Одним из реальных путей практического решения проблемы полу чения многоатомных спиртов из непищевого сырья, в частности глице рина и сорбита, является каталитическое превращение в многоатомные спирты полисахаридов растительных материалов. Для этого могут быть исполь зованы отходы лесозаготовок и переработки древесины, различные растительные отходы сельского хозяйства (кукурузная кочерыжка, хлопковая шелуха, подсолнечная лузга, солом а и другие) и камыш. Организация промышленного производства многоатомных спиртов из непищевого растительног о сырья позволит в короткие сроки решить задачу применения новых видов сырья для получения различных хими ческих продуктов, для чего в настоящее время расходуется продоволь ственное зерно, картофель и пищевые жиры. Одновременно такое произ водство многоатомных спиртов неограниченно расширит сырьевую базу для развития промышленности тяжелого органического синтеза. Наибольший интерес и практическое значение из многоатомных спиртов вследствие своих особых химических и физических свойств и связанног о с этим многостороннего применения представляет глице рин [ 2 3 ]. Гидрирован ие целлюлозы с превращением ее в многоатомные спирты до сих пор представляло большие затруднения из-за трудности подыска ния катализатора. Применявшийся никелевый катализатор ввиду его растворимости совершенно непригоден для гидрирования в кислой среде. Нахождение не растворимого в кислотах катализатора решает задачу гидрирования целлюлозы и рентабельного получения глицерина из непищевого сырья. Таким катализатором оказался рутений. А. А. Баландин, Н. А. Васюнин а, Г. С. Барышева и С. В. Чепиго (Институт органической химии им. Н. Д. Зелинского Академии наук СССР и Всесоюзный научно-иссле довательский институт гидролизной промышленности) [ 2 4 ] нашли, что 1896 О. Е. Звягинцев рутений позволяет получить из целлюлозы, гемицеллюлоз и крахмала в кислой среде (серная или фосфорная кислоты) 78—95% отвечающих им многоатомных спиртов или моносахар идов, причем в продукте реакции отсутствуют свободные редуцирующие вещества. Так, сульфитная цел люлоза в присутствии 2% H 2 S0 4 и 0.1% рутения на угле или силикагеле при температуре 156—160° и 70 атмосферах за 2 часа дает прозрач ный бесцветный раствор, из которого выделено 82% моноангидрида сорбита по отношению к исходной целлюлозе с учетом присоедин ившейся воды. Из неочищенной гемицеллюлозы (отход вискозного производств а) с 1 % H 2 S0 4 и 0.1 % рутения при температуре 155—160° и 70 атмосферах за 1 час получено 78% многоатомных спиртов. Теми же авторами найдено, что близкие результаты дает также пал ладий, но надо ожидать, что некоторая его часть будет теряться вслед ствие перехода в раствор, Применение платиновых металлов в радиотехнике, машиностроении и электротехнике, приборостроении В этих отраслях техники применяются по большей части сплавы, так как чистые металлы по физическим и химическим свойствам мало подходят для этих целей. Многостороннее и разнообразное применение сплавов стало возможным после получения результатов всестороннего изучения двойных и тройных систем сплавов платиновых металлов. За границей такими исследованиями занимались лаборатории Бюро стандартов США и промышленные лаборатории в США, Германии и Англии. Однако наиболее существенные результаты достигнуты в СССР. Эти работы были начаты в 1922 г. в Институте платины Академии наук под руководством Н. С. Курнакова, в 1934 г. они перешли в Институт общей и неорганической химии Академии наук СССР, где была организована специальная лаборатория, работавшая под руководством В. А. Немилова I 2 5 ]. В 1953 году эти работы были перенесены в Институт металлургии Академии наук СССР и одновременно проводятся в Московском государственном университете им. М. В. Ломоносова. Н. С. Курнаковым и его учениками и последователями изучено около сорока двойных систем сплавов благородных металлов и более 15 трой ных. Многие из изученных сплавов нашли применение в различных обла стях техники [ 2 6 ]. Тугоплавкие и не окисляющиеся при высоких температурах сплавы платины распространены для изготов ления нагревательных элементов печей сопротивления. Если печи с платинов ой обмоткой могут длительно работать при температуре 1200—1300°, то печи с нагревателями из сплава платины с 40% родия работают при 1500° и выше. Для высокотемператур ных печей применяются также сплавы платины с большим содержанием родия и с иридием, длительно и устойчиво работающие при температуре 1500-1700°. Особенно широкое применение в электротехнике нашли сплавы пла тиновых металлов для изготовления всевозможных контактов. Контакты из других металлов при проскакиван ии искр или при кратковременном образован ии вольтовой дуги во время замыкания или размыкан ия тока сильно корродируют или изменяют свою форму. Контакты из сплавов платины с 25% иридия обладают большой механической прочностью и весьма мало меняются под влиянием воздейств ия электрическог о тока. Поэтому платино- иридиевые контакты идут для авиационных моторов и ряда других ответственных механизмов в электротехнике сильных токов. В слаботочной технике в огромных количествах применяются кон такты и наконечники из платино- серебряных и особенно палладиево- 1897 Современное применение металлов платиновой группы серебряных сплавов различного состава. Из сплавов палладия с серебром изготовляются также проволока, трубки и кольца и другие детали для электротехники, авиационн ого приборостроения, тяжелого и транспортного машиностроения, судостроения (20, 40, 80% серебра). В радиотехнике и электронике платиновые металлы завоевывают себе все более значительные области применения. Они хорошо себя зарекомендовали в качестве антиэмиссионных покрытий в электровакуумных приборах. Подобные покрытия могут быть нанесены электролитически или путем совместной протяжки покрываемого металла с надетой на него трубкой из платиновог о металла. Платиновые металлы могут быть хорошими материалами подложек катодов, не реагирующих с активным покрытием, либо могут быть исполь зованы в виде сплавов с активными металлам и, как например сплавы платина- барий, в качестве активных кернов для катодов на основе окислов. Представляет большой интерес электронная эмиссия осмия как ближайшего соседа рения, дающего более стабильную эмиссию, чем вольфрам. Иридий применяется как нереагирующий керн для натриевооксидного катода, работающего в атмосфере кислорода при давлениях до 0.1—0.01 мм рт. ст. Из сплавов палладия с серебром и медью изготовляются электрические сопротивления для радиотехнических целей (36% серебра и 4 % меди, Э% серебра и 20% меди). Весьма интересен сплав палладия с 18% иридия, обладающий большой упругостью. В авиационном приборостроении он нашел себе применение для изготовления пружинящих электроконтактов. Известны платино- платинородиевые термопары Ле Шателье, нашед шие себе широкое потребление при измерении высоких температур (до 500°). Эти термопары состоят из платиновой проволоки и проволоки из сплава платины с 10% родия. Материалы для их изготовления должны быть очень высоког о качества, и состав сплава приготовлен весьма точно, такие термопары в определенных условиях очень устойчивы. Для измерения более высоких температур (до 1800°) некоторые иностранные фирмы выпускают иридиево- рутениевые термопары. Чисты й палладий в некоторых случаях применяется в вакуумной технике как поглотитель водорода и других газов и как фильтр, пропускающий только водород, но задерживающий другие газы. Наконец, надо еще указать на антикоррозионные и упрочняющие покрытия платиной, палладием и родием частей приборов и часовых механизмов . Родирование не только упрочняет поверхность покрываемых предметов, но и придает им нетускнеющий блеск. Отражательная способность полированной поверхности родия очень высока (85%) и уступает толь ко серебру. Но серебро быстро тускнеет. Поэтому родием покрывают поверхности оптических отражателей и прожекторов. Способы электролитиче ског о палладирован ия, платинир ования и родирован ия в достаточн ой мере разработаны [ 2 7 ]. Применение платины и палладия в медицине Из сплавов платины с иридием (10%) изготовляют некорродирующие иглы шприцев для впрыскиван ия и вливания. Платина применяется для изготов ления наконечников приборов для прижигания. За границей особенно много платины и палладия в форме сплавов упо требляется в зубоврачебном деле. В СССР платиновые металлы для этих целей идут сравнительно мало, так как платиновые диски выпущены в продажу лишь недавно, а палладий и сплавы пока не выпускаются 1898 О. Е. Звягинцев и советские дантисты недостаточно знакомы с их обработкой. А между тем по своему внешнему виду (матово- белый мягкий блеск), неокисляемости, прочности и дешевизне палладиевые сплавы могли бы с успехом заменить золото в коронках и искусственных зубах. Для изготовления крампонов (штифтов) искусственных фарфоровых зубов идет платина с 5% меди или серебра. Материалом для изготов ления коронок и литых зубов могут служить различные двойные, тройные и более сложные сплавы на основе платины или палладия. К этим метал лам прибавляют золото, серебро, медь и другие металлы (например, никель) для придания твердости и меньшей истир аемости. Припоями для зубоврачебных изделий служат сплавы более богатые легкоплавкими компонентами (золотом, палладием, серебром). Применение платиновых металлов в ювелирном деле Во время первой империалистической войны, когда цены на платину сильно возросли, в США, а затем и в европейских капиталистических странах платиновые ювелирные изделия сделались очень модными. Часы, цепочки, кулоны и другие изделия стали обязательными принадлежностями зажиточного человека. Впоследствии, к середине 20-х годов, мода прошла. Но любители украшений убедились, что многие ювелирные изделия из платины действительно красивый изящны. Так, например, бриллианты, оправленные в платину, имеют очень приятный мягкий блеск, гораздо более красивый, чем в золоте или серебре. Очень хороша комбинация золотых и платиновых звеньев в цепочках браслетов и тонких цепочках для подвески кулонов. Платиновые часы, отделанные должным образом, также имеют прекрасный вид. Палладиево- платиновые сплавы и палладий вначале имитир овали платину, но выпускались по более дешевой цене. Однако оказалось, что палладиевые изделия имеют прекрасный вид, не уступающий чисто платиновым. Поэтому палладий надо считать хорошим ювелирным материа лом. Он вдвое легче платины, а потому на изделия того же объема его идет вдвое меньше, и, кроме того, палладий несколь ко дешевле платины. Матовый теплый блеск палладия придает изделиям особую прелесть, не присущую серебру. Кроме того, палладий не темнеет при употреблении, как серебро. Палладий можно золотить гальваническим способом; позо лота на нем очень хорошо держится. В Англии учреждена медаль имени Волластона, открывшего палла дий, изготов ляемая из этого металла и выдаваемая за научные заслуги. После открытия платины в Ю. Америке испанское правительство в 1735 г., опасаясь как бы новым металлом не стали пользоваться для фальсификации золота, издало закон, предписывающий уничтожение запасов сырой платины. Правительственные чиновники на монетных дворах в городах Санта-Фэ и Папаяне обязывались сохранять всю пла тину, остававшуюся в качестве побочного продукта при очистке золотого песка, и по мере накопления периодически при свидетелях бросать ее в близлежащ ие реки Боготу и Кауку [ 2 8 ]. Никакого применения платина долгое время не находила, так как ее драгоценные свойства не были известны. В настоящее время научными исследованиями показаны многие ценные свойств а всех платиновых металлов и они нашли широкое применение в самых различных областях техники. Во многих случаях платиновые металлы и, особенно платина, не заменимы другими мате риалами. Если учитывать потребление платины в тоннах, то оно не значительно по сравнению с другими металлам и: медью, свинцом, оловом. Но ее значение очень велико. Можно сравнить его со значением соли при приготовлении пищи, ее прибавляют немного, но без нее нельзя приготовить обеда. 1899 Советский Союз обладает значительными природными ресурсами платиновых металлов. Необходимо, чтобы эти ресурсы использов ались полностью для развивающейся промышленности и для производств а предметов широкого потребления. ЛИТЕРАТУРА [1] Statistical sammery of mineral Jndustry 1938, 1957; Minerals, oct.-dec. 1956; Eng. min. J., feb.-iul. 1958. — [2] Metal statistics 1957; Mineral industry servis, 2693 (1958). — [3] A. M. Р у б и н ш т е й н , Изв. сектора платины АН СССР, 19, 61 (1943). — [4] И. И. Ч е р н я е в и А. М. Р у б и н ш т е й н , ДАН СССР, 48, 5, 353 (1945). — [5] А. М. Р у б и н ш т е й н и С. К. С о к о л , ЖПХ, XXXII, А, 930 (1959). - [6] F. M e y e r , J. Soc. Chem. Ind., 22, 348 (1903). — [7] W. О s t-w a 1 d, Англ. пат. 698 (1902); 8300 (1902). — [8] В. N e u m a n n u. H. R o s e , Z. ang. Ch, 33, 45 (1920). — [9] С. И. В о л ь ф к о в и ч , А. П. Е г о р о в и Д. А. Э п ш т e й н. Общая химическая технология, 1. Госхимиздат. М., 243 (1952); А. К. К о л о с о в . Материалы по истории отечественной химии. Сб. докладов на 2-м Всесоюзном совещании по истории химии в 1951 г. Изд. АН СССР, М., 196 (1953). — [10] I. R e i s e t u. Е. М i 11 о n, Ann. Chem., 3, 8, 280 (1843). — [11] P. S a b а-t i e r и. J. В. S e n d e r e n s , Ann. Chem., 8, 4, 473 (1905). — [12] H. W i 1 1 a n d, Ber., 45, 2606 (1912). — [13] N. D. S e 1 у n s k i y, Ber., 44, 3122 (1911). — [14] N. D. S e 1 у n s k i у и др., Ber., 63, 1485 (1930). — [15] N. D. S e 1 у n s k i у, Ber., 45, 3678 (1912). — [16] H. Д. З е л и н с к и й и 10. К. Ю p ь e в, Изв. АН СССР, 851 (1930). — [17] А. Ф. П л а т е . Каталитическая ароматизация парафиновых углеводородов. М.—Л. (1948). — [18] М. G. F о u w 1, Platinum Metals Re-viw, 1, 4 (1957); 2, 2, 3, 4 (1958). — [19] H. И. Ш у Й к и н, X. М. М и н а ч е в, С. С. Н о в и к о в , Н. Ф. К о н о н о в и И. Л. Г а г а р и н , ЖПХ, XXXI, 1732 (1958). — [20] Н. Д. З е л и н с к и й и А. А. Б а л а н д и н . Сб. «Советская химия за 25 лет.» Изд. АН СССР, М.—Л., 188 (1944). — [21] М. S a y t z e f f , J. pr. Chem., 6, 128 (1872). — [22] H. К б 1 b e 1 u. К. К. В h a 11 а с h а г у у a, Lieb. Ann., 618, 67 (1958). — [23] С. В Ч е п и го, А. А. Б а л а н д и н , Н. А. В а с ю н и н а, А. П. С е р г е е в , Хим. наука и пром., 2, 4, 416 (1957). — [24] А. А. Б а л а н д и н и др., Изв. АН СССР, ОХН, 3, 392 (1957). — [25] О. Е. З в я г и н ц е в . Материалы по истории отечественной химии. Сб. докладов на 2-м Всесоюзном совещании по истории химии в 1951 г. Изд. АН СССР, М., 146 (1953). — [26] В. А. Н е м и л о в, Изв. сектора платины, 19, 21 (1943). — [27] М. А. К л о ч к о и 3. С. М е д в е д е в а , Изв. сектора платины, 19, 103 (1943). — [28] Л. А. Ч у г а е в, Изв. инст. по изучению платины и других благородных металлов, 1, 1, 2 (1920). Поступило в Редакцию 22 мая 1959 г.
