Изучение газовых законов.
advertisement

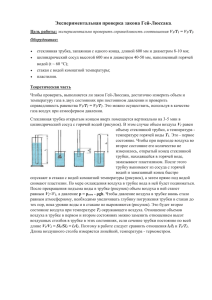
Работа 1. Изучение газовых законов. Повторить §18 (под редакцией А.А. Пинского «Физика 10»); §70, §71(Мякишев, Буховцев, Соцкий «Физика-10») Цель работы: 1)Проверка соотношения между изменениями объема и давления определенного количества газа при его изотермическом сжатии. 2) Исследование зависимости давления газа от температуры при его изохорном охлаждении. При исследовании газовых законов, рассматривается газ в двух состояниях, при одном из параметров постоянном. В работе предлагается исследовать справедливость законов Бойля-Мариотта и Шарля. Объектом изучения в работе является воздух, находящийся внутри прозрачной трубки. В исходном состоянии он имеет следующие параметры. Давления равно атмосферному. Объем равен объему внутренней полости трубки. Температура соответствует температуре воздуха в помещении класса. Второе состояние для экспериментальной проверки закона Бойля-Мариотта получают путем сжатия. Для этого кран на одном конце закрывают. Второй кран остается открытым. Конец трубки с открытым краном погружают в мерный цилиндр, который предварительно заполняют водой комнатной температуры, не долив до верхнего края 15 – 20 мм. Кран опускают до дна цилиндра. Через открытый кран в трубку заходит вода и сжимает воздух до тех пор, пока его давление не сравняется с внешним давлением. Таким образом, во втором состоянии параметры воздуха окажутся следующими: Объем будет равен объему внутренней полости за вычетом объема воды, вошедшей в трубку. Давление возрастет на величину гидростатического давления столбы воды в цилиндре. Температура не меняется. Объем внутренней полости определяется произведением площади поперечного сечения трубки на еѐ длину. Поскольку поперечное сечение трубки не меняется, объем воздуха удобно измерять в условных единицах. За условную единицу принимают единицу длины трубки. Итак, в исходном состоянии давление определяется по показаниям барометра-анероида, а объем – измерительной лентой по длине внутренней полости. Для измерения давления во втором состоянии измеряют разницу уровней воды в мерном цилиндре и в трубке – Н. По формуле для расчета гидростатического давления жидкости вычисляют давление столба воды: Р=ρgH, где ρ – плотность воды. Давление воздуха во втором состоянии будет равно сумме атмосферного и гидростатического давления. Для определения объема воздуха во втором состоянии измеряют длину столба воды, вошедшей в трубку. Из измеренной ранее длины трубки вычитают длину столба воды. Завершив измерения, находят произведения давления на объем воздуха в первом и втором состояниях. Сравнивая полученные числа, делают вывод о справедливости закона Бойля-Мариотта. Исследуемым газом во втором опыте является воздух, находящийся внутри прозрачной трубки. Чтобы его нагреть трубку укладывают плотно виток к витку в стакан калориметра. Перед этим один из кранов закрывают. Укладку начинают с того конца, на котором находится закрытый кран, и проводят так, чтобы конец с открытым краном оказался сверху. Затем в стакан наливают теплой воды. Уровень воды должен быть выше открытого крана не более чем на 5 – 10 мм. Воздух в шланге при нагревании станет расширяться, и из крана начнут выходить пузырьки. Когда температура воздуха и воды сравняются, расширение прекратится, и пузырьки перестанут образовываться. После отделения последнего пузырька кран закрывают. Состояние воздуха в шланге в этот момент принимают за исходное и приступают к определению его параметров – температуры и давления. Температуру определяют термометром по температуре воды, а давление по показанию классного барометра-анероида. Такой способ измерения давления возможен по следующим соображениям. Пузырьки образуются до тех пор, пока давление воздуха в трубке не станет равным сумме давления атмосферы и столба воды над краном. Но так как уровень воды над краном по условию проведения опыта составляет всего несколько миллиметров, давлением водяного столба можно пренебречь по сравнению с давлением атмосферы. Исходя из этого, можно считать, что в исходном состоянии давление воздуха в трубке равно атмосферному давлению. Измерив исходные параметры воздуха, его переводят в другое состояние путем охлаждения до комнатной температуры. Трубку извлекают из калориметра и в виде бухты вешают на лапку штатива. Лапка штатива предварительно закрепляется на стержне на высоте около 35 см от поверхности стола. Под лапку ставят мерный цилиндр, в который налито 15 – 20 мл воды. Термометр также вынимают из калориметра. Затем один из кранов соединяют с манометрической трубкой. Делается это в следующей последовательности. Свободный конец манометрической трубки погружают до дна в мерный цилиндр. Верхнюю часть манометрической трубки немного зажимают в лапке штатива, но так чтобы внутренний канал был бы погружен в воду. Только после этих операций манометрическую трубку с помощью соединительного патрубка соединяют с краном. При контакте с более холодным воздухом классного помещения воздух в большой трубке охлаждается, его давление падает, но объем остается постоянным. Если открыть кран, то на концах манометрической трубки возникает разность давлений и вода из сосуда начинает втягиваться вверх по трубке до тех пор, пока давление столба воды в ней не уравновесит атмосферное давление, то есть пока не наступит равенство: Рат = Р2 + Рв , где Р2 – давление в шланге, а Рв – давление столба воды в трубке. Отсюда: Р2 = Рат − Рв . По высоте водяного столба определяют его давление и, зная давление атмосферы, вычисляют давление в большой трубке после охлаждения – Р2. Температура в трубке в этот момент равна температуре воздуха в классе и определяется термометром. Получив значения начальных и конечных значений температур и давлений, находят отношения давления воздуха к его температуре в нагретом и охлажденном состоянии и, проверяют насколько выполняется равенство Шарля в условиях проведенного эксперимента. Выполнение работы. Оборудование: 1)Прозрачная трубка с кранами; 2) мерный цилиндр; 3) измерительная лента; 4) манометрическая трубка; 5) штатив с лапкой; 6) термометр лабораторный; 7)барометр-анероид; 8) стакан; 9) горячая вода. 1. Исследование изотермического процесса. 1) Приготовьте в тетради таблицу для записи результатов измерений и вычислений. мм L1, Р1, Па ΔL, мм мм L2, Н, мм Рв, мм Р2, мм L1P1 2) Измерьте длину воздушного столба в трубке – L1. 3) Закройте один кран и погрузите конец трубки с открытым краном в мерный цилиндр. L2P2 4) Измерьте длину столба воды, вошедшей в трубку – ΔL. 5) Измерьте разницу уровней воды в мерном цилиндре и трубке – Н. 6) Вычислите длину воздушного столба в трубке после сжатия 𝐿2 = 𝐿1 − 𝛥𝐿. 7) Вычислите гидростатическое давление воды Рв = 𝜌𝑔𝐻. 8) Вычислите давление воздуха в трубке после сжатия Р2 = Р1 + Рв . 9) Вычислите произведения L1P1 и L2P2. Сделайте вывод о том, насколько точно изменение параметров газа в проделанном опыте соответствует закону Бойля-Мариотта. 10) Укажите причины, повлиявшие на точность полученных результатов. 2. Исследование изохорного процесса. 1) Приготовьте в тетради таблицу для записи результатов измерений и вычислений: t 1,0 С Т1, К Р1, Па t 2, 0C Т2, К Н, мм Рв, Па Р2, Па Р1/T1 P2/T2 2) По показанию термометра определите температуру воздуха в классе – t2. 3) Уложите шланг во внешний стакан калориметра. 4) Заполните стакан теплой водой так, чтобы открытый кран оказался бы погруженным не более чем на 5 – 10 мм. 5) По выделению пузырьков определите момент выравнивания температур воды и воздуха в трубке. 6) По температуре воды определите температуру в трубке – t1. 7) С помощью барометра-анероида определите давление воздуха в трубке Р1=Рат. 8) Закройте кран, извлеките трубку из стакана и поместите еѐ на штатив как сказано выше. 9) Присоедините к крану манометрическую трубку, выполняя последовательность действий, изложенную в предыдущем разделе. 10) Плавно откройте кран и наблюдайте за поднятием уровня воды в манометрической трубке. В момент, когда температуры воздуха в большой трубке и в комнате станут одинаковыми, поднятие уровня воды прекратится. Измерьте после этого разность уровней воды в трубке и в мерном цилиндре – Н. 11) Вычислите величину давления водяного столба: Р = 𝜌𝑔𝐻, где ρ – плотность воды, g – ускорение свободного падения, Н – разность уровней. 12) Вычислите давление воздуха в трубке после охлаждения Р2 = Рат − Рв . 13) Переведите полученные значения температуры в градусы шкалы Кельвина. 14) Вычислите отношения P1/T1 и P2/T2. 15) Сделайте вывод о том, насколько полученный результат соответствует теории. Укажите возможные причины расхождения экспериментальных данных с теорией. Контрольные вопросы. 1. Почему процесс сжатия воздуха в данной работе можно считать изобарным? 2. Какие условия должны выполняться, чтобы, определяя параметры газа можно было воспользоваться законом Бойля-Мариотта? 3. Почему охлаждение воздуха в проведенном опыте можно считать изохорным? 4. На какую величину изменяется количество воздуха в шланге при подключении к нему манометрической трубки? Какой процент эта величина составляет от количества воздуха в исходном состоянии, если диаметр манометрической трубки 2 мм? Задачный минимум: О.Ф. Кабардин и др. «задачник 9-11 кл.» № 7.7, 7.8, 7.10