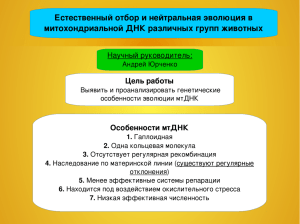
Общая характеристика работы:
advertisement

на правах рукописи
СОРОКИНА Светлана Юрьевна
Видоспецифичность полиморфизма митохондриальной ДНК у
близкородственных видов дрозофил
группы virilis (Diptera: Drosophilidae)
03.00.15 – генетика
03.00.26 – молекулярная генетика
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва 2009
Работа выполнена в лаборатории генетики Учреждения Российской академии наук
Института биологии развития им. Н.К. Кольцова РАН (ИБР РАН) и лаборатории
сравнительной генетики животных Учреждения Российской академии наук Института общей
генетики им. Н.И. Вавилова РАН (ИОГен РАН)
Научные руководители:
доктор биологических наук, профессор
МИТРОФАНОВ Владимир Григорьевич,
кандидат биологических наук
АНДРИАНОВ Борис Витальевич
Официальные оппоненты:
член-корр. РАН, доктор биологических наук, профессор,
ЗАХАРОВ-ГЕЗЕХУС Илья Артемьевич
доктор биологических наук
БАКЛУШИНСКАЯ Ирина Юрьевна
Ведущая организация:
Учреждение Российской академии наук Институт молекулярной биологии им. В.А.
Энгельгардта РАН
Защита состоится 9 декабря 2009 г. в 15 часов на заседании диссертационного совета
Д002.238.01 при Учреждении Российской академии наук Институте биологии развития им.
Н.К. Кольцова РАН по адресу: 119334, г. Москва, ул. Вавилова, 26.
Сайт: http://idbras.comcor.ru; е-mail: idbras@bk.ru
С диссертацией можно ознакомиться в библиотеке и на сайте Учреждения Российской
академии наук Института биологии развития им. Н.К. Кольцова РАН по адресу: 119334, г.
Москва, ул. Вавилова, 26.
Автореферат разослан ___________________ 2009 года
Ученый секретарь Диссертационного совета,
кандидат биологических наук,
Е.Б. Абрамова
ele0806@yandex. ru
2
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Задача исследования генофонда популяции
актуальна для любого биологического вида, так как все виды в разной степени
подвержены селекции и генетическому дрейфу и отвечают на эти воздействия
по-разному в зависимости от своей популяционной структуры. Природным
популяциям свойственна генетическая гетерогенность. Это свойство
определяет экологическую лабильность вида и его жизнеспособность в
непостоянных условиях среды. Популяции синантропных видов, напротив,
отличаются генетической мономорфностью, очень нестабильны и подвержены
резким колебаниям численности вплоть до полного локального вымирания.
Быстрое возрастание генетического груза, проявляющееся в потере
жизнеспособности популяции, как ответ на интенсивный отбор, хорошо
известно почти для всех видов сельскохозяйственных и домашних животных.
Вместе с тем, природные популяции, несмотря на отбор и большие флуктуации
численности, регулярно проводящие популяцию через “бутылочное
горлышко”, вырождаются лишь изредка. Следовательно, в природе должны
существовать механизмы, препятствующие росту генетического груза в
популяциях и способствующие поддержанию генетической гетерогенности.
Учет этих механизмов может быть полезным при проведении селекции, а также
при мониторинге промысловых и охраняемых видов. Одним из таких
механизмов может быть генетическая подразделенность природных популяций.
Известно, что сохраняются лишь популяции с достаточно сложной структурой,
которая позволяет стабильно поддерживать генное разнообразие во времени
(Алтухов, 2003). Особенно велико значение подразделенной структуры
популяции для поддержания полиморфизма митохондриальных генов, так как
из-за отсутствия рекомбинации в митохондриальном геноме популяции
необратимо накапливают слабо вредные мутации в результате случайной
потери лучших вариантов, т.е. подвержены эффекту “храповика Меллера”.
В настоящее время в связи с ростом технологического прогресса все
больше видов вовлекается во взаимодействие с человеком и все большее
влияние человек оказывает на их генетическую структуру и изменчивость. С
этой точки зрения, особый интерес в качестве объектов для популяционных
исследований представляют виды, образующие настоящие природные
популяции. Группа видов-двойников Drosophila virilis состоит из 11 видов,
слабо различимых морфологически и неполностью изолированных
репродуктивно. Филогения группы сводятся к разделению на две филады: virilis
(D.virilis, D.americana americana, D.americana texana, D.novamexicana,
D.lummei) и
montana (D.montana, D.lacicola, D.borealis, D.flavomontana,
D.kanekoi, D.ezoana и D.littoralis). Вместе с тем, последовательность событий
филиации еще окончательно не установлена.
В настоящее время данная группа интенсивно исследуется с точки зрения
эволюции и видообразования как в России, так и за рубежом. Внимание к этой
группе, в первую очередь, связано с тем, что виды группы virilis представляют
собой модель эволюции на ранних этапах дивергенции. Активно исследуются
полиморфные генетические признаки, такие как мобильные элементы,
3
микросателлиты. Большое внимание уделяется генетическому контролю
поведенческих и морфологических признаков, связанных с формированием
репродуктивной изоляции, а также признаков, связанных с адаптациями к
новым условиям среды, таких как стрессоустойчивость и диапауза.
Цель и задачи исследования. Целью данной работы является
исследовние генетической структуры и динамики митохондриальной
изменчивости природных популяций Drosophila группы virilis. Для достижения
данной цели были поставлены следующие задачи: 1) Оценить уровень
изменчивости митохондриальной ДНК (мтДНК) в группе видов-двойников
дрозофил virilis по трем признакам: полиморфизм длин рестрикционных
фрагментов (ПДРФ) тотальной мтДНК по рестрикционной эндонуклеазе HinfI;
изменчивость последовательности 3’-концевого фрагмента гена 16S рРНК;
изменчивость последовательности фрагмента гена COI; 2) Изучить особенности
внутривидового полиморфизма мтДНК синантропных и свободноживущих
видов группы на примере четырех видов: D.littoralis, D.americana, D.virilis и
D.montana; 3) Исследовать внутрипопуляционную структуру и динамику
митохондриальных маркеров в одной из природных популяций D.littoralis (пос.
Рыбинский, Ростовская обл.); 4) Провести анализ сопряженности
митохондриальных гаплотипов с полиморфным ядерным ДНК-маркером для
выявления расовой структуры популяции.
Научная новизна и практическая значимость работы. Впервые
проведен многолетний анализ динамики митохондриальных маркеров в одной
из природных популяций дрозофилы. Было обнаружено устойчивое
соотношение мт-гаплотипов. Дальнейшее исследование сопряженности
ядерных и митохондриальных маркеров позволило установить наличие в
популяции расовой подразделенности как фактора, способствующего
поддержанию генетической гетерогенности и стабильности популяционного
генофонда. Анализ изменчивости митохондриальной ДНК в группе virilis
проведен впервые. В работе получен ряд новых данных, позволяющих уточнить
филогенетическую структуру группы virilis. В частности, показано единство
митохондриального генофонда двух подвидов D.americana; а также получено
подтверждение разделения вида D.littoralis на два подвида: D.l.littoralis и
D.l.imeretensis. Исследуется эволюция митохондриального рибосомного гена в
связи с функциональной и структурной организацией его РНК-продукта.
Полученные результаты вносят вклад в фундаментальные исследования
по генетике популяций, разрабатываемые на дрозофиле как модельном объекте
и закладывают основы для дальнейшего изучения динамики митохондриальных
генофондов насекомых. Результаты работы могут также быть полезны для
исследований в области охраны и мониторинга популяций редких и
исчезающих видов, а также рационального использования эксплуатируемых
популяций, проводимых в учреждениях системы РАН и РАСХН, таких как
Институт комплексного освоения природных ресурсов РАН, Всероссийский
научно-исследовательский
институт
генетики
и
разведения
4
сельскохозяйственных
животных
РАСХН,
Всероссийский
научноисследовательский институт охотничьего хозяйства и звероводства РАСХН.
Апробация результатов. Материалы диссертации были представлены на
следующих конференциях, школах, семинарах: Вторая всероссийская школа
молодых ученных ВОГиС по экологической генетике: Симбиогенетика и
эволюция, Санкт- Петербург, 2001; 45th Annual Drosophila Research Conference,
Washington, USA, 2004; 46th Annual Drosophila Research Conference, San Diego,
USA, 2005; 19th European Drosophila Research Conference, Eger, Hungary, 2005;
Конкурс молодых ученых ИБР РАН, Москва, 2005; 47th Annual Drosophila
Research Conference, Houston, Texas, 2006; Конкурс молодых ученых ИБР РАН,
Москва, 2006; 48th Annual Drosophila Research Conference, Philadelphia,
Pennsylvania, USA, 2007; XX International Congress of Genetics Berlin, Germany,
2008; Пятый съезд Вавиловского общества генетиков и селекционеров, Москва,
2009; а также на заседании объединенного семинара генетических лабораторий
Института биологии развития им. Н.К. Кольцова РАН, 27 апреля 2009 г.
Публикации. По теме диссертации опубликовано 6 статей в журналах,
рекомендованных ВАК, и 8 тезисов в трудах российских и зарубежных
конференций.
Объем и структура диссертации. Диссертация изложена на ___
страницах машинописного текста. Состоит из следующих частей: введение,
обзор литературы, материалы и методы, результаты и обсуждение, выводы,
список литературы. Работа проиллюстрирована ___ таблицами и ___
рисунками. Список литературы включает___ наименований.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы
Объект исследования. В работе были использованы изосамочные линии
мух 11 видов дрозофил группы virilis из коллекции лаборатории генетики
Института биологии развития им Н.К. Кольцова РАН и UC San Diego
Drosophila Stock Center, USA. Линии D.americana любезно предоставлены
доктором Б. МакАллистером, Dept Biol Sci, University of Iowa, IA, USA. Линии
D.littoralis были собраны в природных популяциях Ростовской области (пос.
Рыбинский), Московской области (пос. Куликово), Краснодарского края (пос.
Дивноморское), Хакасии (Государственный этнографический музей-заповедник
пос. Казановка). Линии D.montana: 1021.0, 1021.19, 1021.21, 1021.23 (Северная
Америка); 1023.0, MO1 (Финляндия); 6 линий из природной популяции
Иркутской области (Государственный природный биосферный заповедник
"Баргузинский").
Сбор биологического материала. Сбор самок Drosophila группы virilis
производился по берегам пресных водоемов в местах с характерным биотопом,
включающим растения рода ива (Salix), в утреннее и предвечернее время суток,
5
соответствующее периодам максимальной активности дрозофил данной
группы. Сборы производились с использованием дрожжевой приманки.
Выделение ДНК. ДНК из мух выделялась по стандартой методике с
экстракцией фенол-хлороформом (Maniatis et al., 1982). Для выделения мтДНК
из мух применялась модификация метода Афонзо (Afonso et al., 1988)
Реконструкция вторичной структуры фрагмента 16S рРНК.
Вторичная структура РНК-продукта фрагмента гена 16S рРНК была построена
с использованием скелета известных структур рРНК большой субчастицы
рибосомы из базы данных структур рибосомных РНК (The European Large
Subunit Ribosomal RNA Database: http://bioinform.psb.ugent.be/webtools/rRNA)
(Wuyts et al., 2001) при помощи программы RnaViz 2.
ПЦР амплификация. ПЦР амплификацию проводили на матрице
тотальной ДНК, выделенной из одной мухи. Праймеры для 3’-концевого
фрагмента митохондриального гена 16S рРНК:
прямой - 16Sar 5'-CGCCTGTTTATCAAAAACAT-3’ (Simon et al., 1994),
обратный - 16Sb 5’-CTCCGGTTTGAACTCAGATCA-3’. Стандартные праймеры
для 5'-района гена субъединицы 1 цитохром с оксидазы (COI) насекомых
(Folmer et al., 1994): прямой – 5'- GGTCAACAAATCATAAAGATATTGG-3',
обратный – 5'- TAAACTTCAGGGTGACCAAAAAATCA-3'. Праймеры для
выявления аллельных форм ретротранспозона Tv1:
прямой - 5'-CTACCGCTGCGCCAATTAAG-3',
обратный – 5'-TGGTTGGGGGAGTGACATATCC-3'.
Филогенетические построения. Для каждой выборки, а также для их
комбинаций рассчитывались следующие популяционные показатели: доля
общих фрагментов (F), попарные генетические дистанции (P), внутри- и
межпопуляционные генетические дистанции (D), генетическое разнообразие индекс Шеннона (H). Филогенетическое древо мт-гаплотипов строили для
генов COI и 16S рРНК методом ближайшего соседа (Neighbor-Joining). В
качестве внешней группы привлекались D.melanogaster и D.yakuba (группа
melanogaster). Надежность ветвления оценивалась на основании расчетного
индекса бутстрепа (1000 псевдореплик).
Програмное обеспечение. Обработка нуклеотидных данных, сравнение
нуклеотидных последовательностей, вычисление генетических дистанций и
филогенетический анализ проводили при помощи пакета программ Lasergene
97 “DNASTAR” и MEGA 4.1 (Tamura et al., 2007). Реконструкция вторичной
структуры 3’-концевого фрагмента гена 16S рРНК сделана при помощи
программы RnaViz 2.0 (De Rijk, De Wachter, 1997). Построение статистической
парсимониальной сети митохондриальных гаплотипов проводили в программе
TCS ver. 1.18 (Clement et al., 2000).
Результаты и обсуждение
1. Межвидовая изменчивость мтДНК в группе virilis. Исследование
межвидовой изменчивости мтДНК в группе virilis проводилось по трем
признакам: полиморфизм длин рестрикционных фрагментов (ПДРФ) тотальной
мтДНК
по
рестрикционной
эндонуклеазе
HinfI;
изменчивость
6
последовательности 3’-концевого фрагмента гена 16S рРНК; изменчивость
последовательности фрагмента гена COI.
1.1. ПДРФ-анализ мтДНК в группе virilis. Исследование полиморфизма
длин рестрикционных фрагментов (ПДРФ) мтДНК одиннадцати видов
дрозофил группы virilis проводилось с использованием мелкощепящей
рестрикционной эндонуклеазы HinfI с пятинуклеотидным сайтом рестрикции
(GAnTC), которая разрезает мтДНК дрозофилы на 9 – 14 фрагментов длиной от
300 п.о. до 5000 п.о. На рис. 1 приведен результат фракционирования HinfI
рестрикционных фрагментов митохондриальной ДНК одиннадцати видов
дрозофил группы virilis. Каждый вид обладает уникальным набором полос,
отличающим его от любого другого по одному или нескольким признакам.
Суммирование размеров фрагментов для каждого вида дает минимальную
оценку размеров митохондриального генома. Эта величина оказалась
различной у разных видов и колебалась от 15.5 до 17.5 т.п.о., что близко к
ожидаемой величине 16 т.п.о. Исключением оказалась D.borealis, у которой
размер ДНК митохондрий оказался существенно выше, чем у остальных – 19.7
т.п.о.
Рис. 1.
Межвидовой
полиморфизм
длин
рестрикционных
фрагментов
HinfI
митохондриальной ДНК в группе virilis.
Сокращения видовых названий: D.virilis - Vi;
D.amеricana americana – Aa; D.americana
texana - At; D.novamexicana - No; D.lummei Lu; клеточная культура D.virilis - CVi;
D.kanekoi - Ka; D.ezoana - Ez; D.littoralis - Lt;
D.borealis - Bo; D.flavomontana – Fl; D.montana
- Mo; D.lacicola - Lc. Маркер молекулярной
массы – двойное расщепление ДНК фага λ
ЕсоRI и HindIII. Длины фрагментов (сверху
вниз): 21,226; 5,148; 4,973; 4,268; 3,530; 2,027;
1,904; 1,584; 1,375; 0,947; 0,831; 0,564 т.п.о.
Рассчитаный по числу общих
фрагментов
индекс
генетического
сходства между видами (F) (доля общих
фрагментов) показывает, что виды филады
virilis значительно ближе друг к другу, чем виды филады montana.
Усредненные значения F для внутри- и межфиладных сравнений приведены в
табл. 1. Максимальные значения F соответствуют американской ветви филады
virilis (D.a.americana, D.a.texana, D.novamexicana) и составляют в среднем
0,753. Минимальные значения F соответствуют D. kanekoi – 0,121. Данный вид
одинаково удален от обеих филад.
1.2. Изменчивость 3’-концевого фрагмента гена 16S рРНК. Нами было
проведено секвенирование 3’-концевого фрагмента гена 16S рРНК длиной 478
нуклеотидов у одиннадцати видов дрозофил группы virilis. Изучаемый
7
фрагмент соответствует позициям NN 12902-13380 мт-генома D.yakuba
(GenBank ID: NC_001322). Всего было выявлено 18 полиморфных сайтов, что
составляет 4% последовательности. Соотношение четырех нуклеотидов
смещено в сторону А и Т нуклеотидов. Содержание АТ-пар составляет 75%.
Наблюдается смещенное соотношение G и C нуклеотидов: на долю G
приходится 16%, тогда как С составляет только 9% последовательности.
Значения генетических дистанций (Р) при попарных сравнениях в группе
колеблются от 0 (между D.montana и D.ezoana) до 0,025 (D.kanekoi), со средним
значением в группе 0,009. Максимальные значения P характерны для вида
D.kanekoi, что указывает на его наибольшую удаленность от общего предка.
Филогения группы virilis по гену 16S рРНК представлена на рис. 2. Значения Р
при сравнении группы с удаленным видом D.yakuba (группа melanogaster) в
среднем составляет 0,069, причем отдельно для филады virilis оно составляет
0,064, а для филады montana – 0,072, что указывает на большую близость
филады virilis к общему предку по сравнению с филадой montana, которая за
время дивергенции накопила больше изменений. Максимальное значение - у
D.kanekoi - 0,087.
87
34
D.novamexicana.seq
D.a.americana.seq
D.a.texana.seq
D.virilis.seq
D.lummei.seq
50
55
D.lacicola.seq
D.borealis.seq
D.flavomontana.seq
15
31
41
D.ezoana.seq
D.montana.seq
D.littoralis.seq
D.kanekoi.seq
0.002
Рис 2.
Филогения группы virilis, построенная по данным изменчивости 3’-концевого
фрагмента гена 16S рРНК. Дендрограмма посторена по методу ближайшего соседа
(Neighbor-Joining) с bootstrap-поддержкой - 1000 псевдореплик.
1.2.1. Реконструкция вторичной структуры фрагмента 16S рРНК. С
использованием известных скелетов вторичных структур рРНК большой
субчастицы рибосомы других организмов была построена вторичная структура
фрагмента 16S рРНК дрозофил группы virilis и выделены функционально
значимые структурные элементы (рис. 3).
8
Рис. 3.
Вторичная структура
3’-коцевого фрагмента 16S
рРНК D.virilis. Вторичная
структура построена при
помощи программы RnaViz
2.0
с
использованием
гомологичной
последовательности
H.marismortui в качестве
скелета. Домен IV – область
взаимодействия большой и
малой субчастиц рибосомы;
Домен V – область пептидил
трансферазного центра; а –
универсальный
олигомер
GACAAUA,
часть
центральной
пептидилтрансферазной
петли большой субчастицы
рибосомы; б – Центральный
протуберанец; в – L1протуберанец; г – П-петля; д
– А-петля; Нуклеотиды,
заключенные в квадраты,
отмечают
сайты,
полиморфные внутри группы
virilis.
Нуклеотиды,
заключенные
в
круги,
отмечают сайты, полиморфные при сравнении группы virilis с внешней группой (D.yakuba).
Домен IV ответственен за взаимодействие большой и малой субчастиц
рибосомы и является высоко консервативным в исследованной группе
дрозофил. Домен V отсветственен за связывание субстратов и факторов
элонгации трансляции. В центральной части исследованного фрагмента (NN
103-109) локализован универсальный для всех организмов мотив GACAAUA,
являющийся частью центральной пептидилтрансферазной петли и
непосредственно участвующий в образовании пептидной связи (Nissen et al.,
2000). Участки последовательности, находящиеся между позициями A122–
U216 и A217-U272 соответствуют центральному и L1-протуберанцам домена V,
определяющим конформацию активного пептидилтрансферазного центра
большой субчастицы рибосомы. Идентифицированы последовательности,
соответствующие А- и П-петелям, которые вовлечены в непосредственное
взаимодействие с аминоацил- и пептидил-тРНК в активном центре рибосомы.
Полиморфные
сайты
распределены
неравномерно
по
длине
последовательности. Нуклеотидных замещений оказалось больше в стеблевых
структурах центрального и L1-протуберанцев, в то время как открытые
9
петельные области, участвующие в формировании третичной и четвертичной
структуры, оказались более консервативными.
Среди общей совокупности полиморфных сайтов можно выделить
филогенетически информативные. Например, замещения 221 Т-A и 366 G-A
объединяют кластер D.a.americana, D.a.texana и D.novamexicana. То же самое
относится к замещению 140 A-G, объединяющему D.montana, D.flavomontana и
D.lacicola. Несмотря на низкую вариабельность 3’-концевого фрагмента,
наблюдаются обратные и конвергентные мутации (гомоплазия). Так замещение
140 A-G, характерное для филады montana, должно было произойти независимо
у предка D.montana, D.lacicola и D. flavomontana и у более филогенетически
удаленного от них вида D. ezoana.
1.3. Изменчивость фрагмента гена COI (цитохром с оксидаза,
субъединица 1) в группе virilis. Ген COI располагается на главной нити
мтДНК между генами ND2 и тРНК-лейцина. Исследованный фрагмент гена
COI длиной 630 п.о. находится в первой трети гена и соответствует позициям
57 – 687 гена COI D.virilis (GenBank ID: BK006340).
Всего во фрагменте обнаружено 154 полиморфных сайта, из которых 95
являются филогенетически информативными. Мутации представлены в
основном транзициями. Средняя величина генетических расстояний (P) в
группе по данному признаку составляет 0,088. Наименьшее значение - между
D.americana и D.novanexicana - 0,003, наибольшее - у D.flavomontana - 0,118.
Значения гентических дистанций представлены в табл. 1. Филогения группы
virilis, построенная по данным фрагмента гена COI, представлена на рис. 4.
D. montana 1021.19.seq
86
98
D. lacicola 0991.0.seq
68
D. flavomontana 0981.0.seq
D. borealis 0961.0.seq
44
37
D. littoralis 1013 H1.seq
67
D. ezoana 0971.0.seq
D. kanekoi 1061.0.seq
D. virilis 1.seq
D. lummei 200.seq
94
D. americana. tex 423.seq
60
100
57
D. novamexicana.seq
D. americana am. 405.seq
D. melanogaster.seq
0.05
Рис. 4.
Филогения группы virilis, построенная по данным изменчивости гена субъединицы 1
цитохром с оксидазы (COI). Дендрограмма посторена по методу ближайшего соседа
(Neighbor-Joining) с bootstrap-поддержкой - 1000 псевдореплик. В качестве внешней группы
используется вид D.melanogaster (GenBank ID: AF200828).
10
Несмотря на то, что значения генетических расстояний (Р) в группе по
гену COI значительно выше, чем по гену 16S рРНК, вероятность повторных
замещений, занижающих истинную степень дивергенции, невысока. Об этом
свидетельствует значение соотношения транзиций и трансверсий (Ts/Tv),
которое внутри группы virilis не опускается ниже единицы (табл. 1). При
сравнении D.virilis с представителем другого подрода - D.melanogaster
количество трансверсий резко возрастает. Соотношение Ts/Tv – 0,76. В случае с
белок-кодирующими митохондриальными генами такое соотношение может
свидетельствовать о насыщении синонимичных положений мутациями, что не
позволяет корректно оценивать генетические дистанции.
Табл. 1. Характеристика изменчивости мтДНК в группе virilis.
Группа virilis
Филада virilis
Филада montana
Филада vir/mont
Грп. virilis/D.melanogaster
(F)
0,24
0,48
0,17
0,14
-
16S рРНК
(P)
0,009
0,005
0,01
0,009
-
COI
(P)
0,088
0,038
0,089
0,102
0,126
Ts/Tv
1,7
1,735
2,575
1,189
0,76
(F) – средняя доля общих рестрикционных фрагментов HinfI для набора линий; (P) – средние
значения попарных генетических дистанций; Ts/Tv – соотношение транзиций и трансверсий.
16S рРНК – фрагмент последовательности гена 16S рРНК; COI – фрагмент
последовательности гена COI.
2. Внутривидовой полиморфизм мтДНК в группе virilis.
Мы провели исследование внутривидового полиморфизма мтДНК у
четырех видов группы virilis: D.littoralis, D.americana, D.virilis, D.montana.
2.1.1. ПДРФ-анализ мтДНК D.littoralis. D.littoralis – вид, образующий
природные популяции в умеренном и субтропическом поясах Евразии от
Финляндии до Ирана. Ареал фрагментирован.
Всего было проанализировано 255 изосамочных линий D.littoralis из 7и
географических точек в разных частях ареала. При помощи метода ПДРФ с
рестрикционной эндонуклеазой HinfI в популяциях D.littoralis был выявлен
полиморфизм мтДНК. Было получено 14 мт-гаплотипов, отличающихся одним
или несколькими сайтами рестрикции HinfI (рис. 5). Популяция из Ростовской
области (РО) (пос. Рыбинский) представлена наибольшей выборкой – 206
линий. Ее генетическая структура складывается из 2х мажорных мт-гаплотипов
(H1 и H2), находящихся в соотношении 55/35, и 11 минорных, представленных
единичными находками. Генетические структуры популяций Ростовской и
Московской (МО) областей сходны. В грузинской популяции одним из
доминирующих гаплотипов является Н7. Из полученных данных также следует,
что гаплотип H1 широко распространен и встречается по всему ареалу
распространения D.littoralis.
11
Рис. 5.
Полиморфизм
длин
рестрикционных
фрагментов
HinfI мтДНК D.littoralis. Маркер
молекулярной массы – двойное
расщепление ДНК фага λ ЕсоRI
и HindIII. Длины фрагментов
(сверху вниз): 21,226; 5,148;
4,973; 4,268; 3,530; 2,027; 1,904;
1,584; 1,375; 0,947; 0,831; 0,564
т.п.о.
Карта рестрикции мтДНК D.littoralis представлена на рис. 6. Сайты,
мутации в которых приводят к взаимным превращениям трех мажорных
гаплотипов (Н1, Н2 и Н7), находятся в точках с низким уровнем давления
отбора: сайт 15.298 (H1 <-> H2) находится в гипервариабельной области
некодирующего АТ-района; сайт 8.582 (H1 <-> H7) – в одном из третьих
положений кодона высокополиморфного гена ND4. Следовательно, возможно
многократное возникновение этих гаплотипов в истории вида.
Рис. 6.
Рестрикционная карта
митохондриального генома
D.littoralis с локализацией
специфичных
для
мтгаплотипов сайтов HinfI.
Короткие радиальные
штрихи
обозначают
консервативные сайты HinfI;
средние – полиморфные
сайты HinfI; длинные –
сайты HinfI, мутации в
которых
приводят
к
взаимным
превращениям
трех мажорных гаплотипов
(Н1, Н2 и Н7).
12
Из карты рестрикции следует, что полиморфизм распределен
неравномерно по длине молекулы. Выделяется две полиморфные области,
соответствующие регуляторному АТ-району и блоку полиморфных генов ND4
– ND6. Во фрагменте последовательности, соответствующем блоку
полиморфных генов ND4 – ND6 были выделены потенциальные сайты HinfI
(пятинуклеотидные мотивы, замещение в которых приводит к возникновению
сайта HinfI). Всего было выявлено 19 потенциальных HinfI сайтов. Исходя из
того, что нами в этой области было выявлено 5 полиморфных сайтов, можно
сказать, что обнаружено около ¼ всего полиморфизма, возможного в данной
области. По данным карты рестрикции была построена схема трансформаций
мт-гаплотипов в результате мутаций в сайтах рестрикции HinfI, из которой
следует, что мт-гаплотипы могут быть объединены в три мт-гаплогруппы: H1,
H2 и H7 (схема не приведена). Минорные мт-гаплотипы располагаются
радиально вокруг трех мажорных, формируя “звездчатую” генеалогию, что
свидетельствует о недавней дивергенции.
2.1.2. Внутривидовая изменчивость фрагмента гена COI D.littoralis.
При анализе изменчивости гена COI в выборке линий D.littoralis из различных
частей ареала обнаружен 41 полиморфный сайт. Филогенетический анализ
исследованного фрагмента гена COI D.littoralis, приведен на рис. 7. Из
дендрограммы следует, что данный набор линий подразделяется на 4 кластера.
Первым отделяется кластер, который включает в себя линии из Закавказья,
линию из Ирана и часть линий из пос. Дивноморское (Краснодарский край).
Выделение данного кластера обнаруживает зависимость сходства мтгаплотипов от их географического распространения, в связи с чем он может
быть обозначен как южный. Данный кластер преимущественно состоит из
линий мт-гаплогруппы H7. Другие три кластера представлены линиями
D.littoralis из Ростовской области, Московской области, Финляндии, Хакасии и
частью линий из пос. Дивноморское, Краснодарского края. Однако
дендрограмма не обнаруживает какого-либо географического подразделения
внутри этой группы, в связи с чем данные выборки могут быть обозначены как
северная группа популяций. В рамках северной группы выделяются три
кластера. Первым отделяется небольшой кластер, состоящий из трех линий, две
из которых имеют гаплотип Н7. Два других могут быть обозначены как
кластеры мт-гаплогрупп Н1 и H2. Численная характеристика изменчивости
представлена в табл. 1. Обнаружено 4 аминокислотные замены, одна из
которых является филогенетически информативной и разделяет северную и
южную популяции.
Величины генетических дистанций (D) внутри локальных популяций
северной группы равны или превышают величину D между локальными
популяциями северной группы. Величина D между северной и южной
популяциями намного выше внутрипопуляционных значений D, что говорит о
13
дифференциации вида на северную и южную популяции и об отсутствии
дифференциации внутри северной группы популяций.
Рис. 7. Филогения D.littoralis по гену субъединицы 1 цитохром c оксидазы (COI).
Дендрограмма построена с помощью метода ближайшего соседа (Neighbor-Joining) с
Bootstrap-поддержкой - 1000 псевдореплик в программе MEGA 4.1. В качестве внешней
группы взята D.virilis. Буквы в начале названий линий обозначают место сбора, цифры – год
сбора и номер линии. В конце названия указан митохондриальный HinfI-гаплотип. РО –
пос. Рыбинский (Ростовская обл.); МО – пос. Куликово (Московская обл.); DVN – пос.
Дивноморское (Краснодарский кр.); лабораторные линии из коллекции лаборатории
генетики ИБР РАН даны под номерами: 340, 327, 357 – Грузия, 1971; 360 – Хакасия, 2003;
1013 – Швеция, 1970; 1001.3 – Иран; 1091.0 – Канада
Статистический парсимониальный нетворк (SNP) мт-гаплотипов
D.littoralis. Парсимониальная сеть митохондриальных гаплотипов, построенная
по данным изменчивости фрагмента гена COI и ПДРФ тотальной мтДНК
D.littoralis приведена на рис. 8. Из полученной схемы следует, что предковым
является гаплотип H7. Наиболее распространенные в северных популяциях
гаплотипы, Н1 и Н2, возникали в истории вида неоднократно (рис. 8).
Интересен тот факт, что часть линий из популяции Дивноморского (DVN)
попала в кластер южной популяции. Это может быть объяснено тем, что между
территориями северной и южной популяций пролегает Кавказский хребет,
который служит преградой, препятствующей потоку генов между этими
популяциями. Однако по побережью возможна миграция, благодаря чему на
14
Черноморском побережье Краснодарского края могла возникнуть зона
вторичного контакта северной и южной популяций.
PO 04-5 H2
PO 04-8 H1
PO 05-35 H1
PO 03-6 H6
360 H1
1001.3
PO 05-2 H1
340 H11
PO 99-2 H2
PO 01-2 H2
PO 03-2 H2
MO 06-1 H1
PO 99-9 H10
PO 04-9
PO 04-14 H1
PO 06-86 H1
357 H7
PO 04-7 H2
PO 06-83 H2
DVN 2 H2
DVN 3 H2
DVN H2
MO 06-2 H7
DVN 05-5 H7
327 H7
PO 00-8 H8
PO 99-4 H4
1091.0 H2
1013 H1
PO 00-2 H2
PO 05-14 H12
DVN 05-4 H7
PO 06-16 H7
PO 99-7 H7
PO 06-17a H1
Рис. 8.
Парсимониальная сеть митохондриальных гаплотипов, построенная по данным
изменчивости фрагмента гена COI и ПДРФ тотальной мтДНК D.littoralis. Обозначения
линий такие же, как на рис. 7.
2.2.1. ПДРФ-анализ мтДНК D.americana. Другой вид, у которого была
изучена изменчивость мтДНК в природных популяциях – D.americana (филада
virilis). По признаку наличия или отсутствия слияния 4й и Х-хромосом вид
подразделяется на два подвида (D.americana americana и D.americana texana).
Рис. 9.
Полиморфизм
длин
рестрикционных
фрагментов HinfI мт ДНК D.americana. Маркер
молекулярной массы – двойное расщепление ДНК
фага λ ЕсоRI и HindIII. Длины фрагментов (сверху
вниз): 21,226; 5,148; 4,973; 4,268; 3,530; 2,027;
1,904; 1,584; 1,375; 0,947; 0,831; 0,564 т.п.о.
15
У D.americana americana Х-хромосома и 4-я хромосома слиты, тогда как у
D.americana texana этого слияния нет.
Мы проанализировали изменчивость мтДНК D.americana обеих
хромосомных форм в выборках из природных популяций при помощи метода
ПДРФ с рестриктазой HinfI. В работе использовались 45 изосамочных линий из
6 географических точек. Всего было выявлено 10 митохондриальных HinfIгаплотипов (Рис. 9). Выявлено доминирование двух гаплотипов (Ha1 и Ha8).
Данные гаплотипы встречались у обоих подвидов D.americana.
В сравнении с D.littoralis изменчивость мтДНК D.americana имеет
некоторые особенности. 1). Индексы генетического сходства мт-гаплотипов,
рассчитанные как доли общих фрагментов (F) в случае с D.americana, ниже
чем в случае с D.littoralis, что говорит о более значительной дивергенции
между мт-гаплотипами D.americana (табл. 2). Средние значения F для мтгаплотипов D.americana и D.littoralis составляют 0,615 и 0,706 соответственно.
В большинстве случаев один мт-гаплотип D.americana может быть получен из
другого в результате более чем одной мутации в сайте HinfI. У D.littoralis
только в одном случае (H5) для трансформации одного мт-гаплотипа в другой
необходимо два мутационных события в сайтах HinfI. 2) Различалось также
богатство генетических вариантов и их относительное распределение выравненность (Е). Был рассчитан индекс генетического разнообразия (Н)
(индекс Шеннона), отражающий эти два параметра. Значения величин Н для
D.littoralis и D.americana составляют 1,71 и 2,65 соответственно. Различия
статистически достоверны по критерию Стьюдента, td = 2,81 > tst{2,0; 2,6; 3,3},
что соответствует второму порогу вероятности безошибочных прогнозов.
Причиной такого различия может быть индивидуальная филогеографическая
история видов, в частности “бутылочное горлышко” в истории D.littoralis и
последующая демографическая экспансия на Северо-Европейской части ареала.
Табл. 2. Характеристика изменчивости мтДНК D.littoralis и D.americana.
D.littoralis
D.litt Сев.
D.litt Южн.
D.litt Сев./Южн.
D.americana
D.americana F
D.americana U
D.americana F/U
(F)
0,706
0,62
-
(P) COI
0,013
0,009
-
Ts/Tv COI
6,7
3,2
-
(D) COI
0,007
0,010
0,260
0,010
0,008
0,009
(H)
1,71
2,65
-
(F) – средняя доля общих рестрикционных фрагментов HinfI для набора линий; (P) – средние
значения попарных генетических дистанций; Ts/Tv – cоотношение транзиций и трансверсий;
(D) - внутри- и межпопуляционные генетические дистанции; (H) - генетическое разнообразие
(индекс Шеннона). COI – фрагмент последовательности гена COI. D.americana F –
хромосомная форма со слиянием 4й и X хромосом (F-fused); D.americana U - хромосомная
форма без слияния 4й и X хромосом (U-unfused).
16
2.2.2. Внутривидовая изменчивость фрагмента гена COI у
D.americana. Анализ вариабельности мт-генома D.americana проведен на
основе изменчивости последовательности фрагмента гена COI. Было
проанализировано 23 линии D.americana обеих хромосомных форм с
известными рестрикционными мт-гаплотипами из 6 популяций обоих подвидов
(рис. 10). Характеристика нуклеотидной изменчивости приведена в табл. 2.
Было обнаружено 43 полиморфных сайта. Аминокислотных замен не
обнаружено. Значения генетических дистанций D не выявляют
дифференциации популяций D.americana ни по географическому, ни по
хромосомному признакам. Величины D внутри каждой хромосомной расы не
отличаются от величины D между ними (табл. 2). Полученные результаты
вместе с другими молекулярными данными указывают на единство генофонда
вида.
Рис. 10. Филогения D.americana по гену субъединицы 1 цитохром c оксидазы (COI).
Дендрограмма построена с помощью метода ближайшего соседа (Neighbor-Joining) с
Bootstrap-поддержкой – 1000 псевдореплик в программе MEGA 4.1. В качестве внешней
группы взята D.virilis. Буквы в начале названий линий обозначают место сбора, цифры – год
сбора и номер линии.
В конце названия указан митохондриальный HinfI-гаплотип и
хромосомная форма: F (fused) – наличие слияния 4й и Х хромосом; U (unfused) – отсутствие
слияния 4й и Х хромосом; S (segregated) – гетерозигота по слиянию. ML – Монро (Monroe),
Луизиана; FP - Национальный рефугиум Белая Река (White River) недалеко от парка Фудгейт
(Foodgate Park), Арканзас; LA - Национальный рефугиум Черная Река (Black River) недалеко
от озера Ашбау (Ashbough), Арканзас; PM – Национальный рефугиум Болото Минго (Mingo)
недалеко от Паксико (Puxico), Миссури; HI – Южная банка реки Миссури недалеко от
заповедной территории Остров Хоуэлл (Howell) к западу от Сент-Луиса (St. Louis), Миссури;
SB – Мускатайн (Muscatine), Айова.
17
2.3. ПДРФ-анализ мтДНК D.virilis. Drosophila virilis – единственный
синантропный вид группы virilis, в связи с чем его биология имеет ряд отличий
от других видов группы. D.virilis способен образовывать плотные популяции,
развиваясь в массе на различных антропогенных субстратах, например, на
отходах
виноделия,
претерпевая
резкие
колебания
численности.
Электрофореграмма рестрикционной изменчивости мтДНК D.virilis из разных
географических точек (рис. 11) обнаруживает крайне низкий уровень
внутривидовой изменчивости D.virilis. Единственное обнаруженное отличие
найдено у мух, собранных на Сейшельских островах. ДНК митохондрий в этой
линии содержит один дополнительный HinfI сайт. Возможное объяснение столь
низкого полиморфизма этого вида на огромном ареале, состоит в том, что мухи
заселили его недавно, распространившись из одной популяции.
Рис. 11.
Внутривидовой
полиморфизм
длин
рестрикционных фрагментов по
HinfI митохондриальной ДНК
D.virilis
различного
географического происхождения.
Обозначения
к
дорожкам
соответствуют номерам линий.
2.4. ПДРФ-анализ мтДНК D.montana. Еще один вид группы virilis,
D.montana, широко распространен в северном полушарии. Он подразделен, как
минимум, на две хорошо дифференцированные популяции, североамериканскую
(D.m.standard)
и
европейскую
(D.m.ovivororum),
дивергировавшие примерно 0.55–0.95 миллионов лет назад (Pааllysaho et al.,
2005). У D.montana было выявлено три митохондриальных HinfI гаплотипа
(рис. 12). Мт-гаплотипы Hm1 и Hm2 характерны для популяций Европы и
Восточной Сибири. Hm3 был обнаружен у линий из Северной Америки.
Данный мт-гаплотип практически совпадает с гаплотипом вида D.lacicola,
обитающего с ним симпатрически, но имеющего ряд экологических отличий.
По гену COI обнаружен очень низкий уровень межвидового полиморфизма,
соответствующий внутривидовому у других исследованных видов (P = 0,019).
Полученные данные вместе с данными по скрещиваемости видов D.montana и
18
D.lacicola позволяют предполагать возможность
интрогрессивной гибридизации между этими двумя
видами на территории Северной Америки. Другим
объяснением может быть парафилия видов
D.montana и D.lacicola.
Рис. 12.
Схема паттернов рестрикции HinfI мт-гаплотипов
D.montana. Hm1 и Hm2 характерны для популяций Евразии;
Hm3 – для популяций Северной Америки. Lc – D.lacicola.
Цифры обозначают длину фрагментов в т.п.о.
3. Внутрипопуляционная изменчивость.
3.1. Динамика внутрипопуляционного полиморфизма D.littoralis.
ПДРФ-анализ сборов D. littoralis, проведенных в природной популяции (пос.
Рыбинский, Ростовская обл.) на протяжении десяти лет, выявил ежегодные
колебания численности мух. При этом соотношение частот мажорных
митохондриальных гаплотипов оставалось постоянным. Минорные гаплотипы
представлены единичными находками.
Судя по количеству пойманных самок, численность D.littoralis
значительно колеблется в разные годы (рис. 13). Если бы митохондриальные
гаплотипы были эволюционно нейтральными,
то резкие колебания
численности популяции неизбежно привели бы к изменению частот гаплотипов
и даже к полной потере некоторых из них. Так как в популяциях D. littoralis
вместо ожидаемой изменчивости имеет место постоянное соотношение частот
основных гаплотипов, мы пришли к выводу, что либо гаплотипы имеют
самостоятельное
приспособительное
значение,
либо
маркируют
географические расы, образующие зону смешения на исследуемой территории,
либо, что более вероятно, служат маркерами нескольких экологических рас,
занимающих одну территорию.
Рис. 13.
Популяционная
динамика
митохондриальных
гаплотипов
природной популяции D.littoralis
(пос. Рыбинский, Ростовская обл.
(РО)).
Столбцы
показывают
численность выборок и соотношение
мт-гаплотипов в разные годы.
80
70
60
50
40
30
20
10
0
1999
2000
2001
2002
Н1
Н2
2003
2004
2005
2006
2007
2008
Минорные гаплотипы
19
3.2. Сопряженная изменчивость митохондриальных и ядерных
маркеров. Анализ динамики изменчивости мтДНК природных популяций
D.littoralis позволил предположить наличие расовой сруктуры природных
популяций этого вида. Наличие частично репродуктивно изолированных в
природе рас можно проверить, определив сопряженность изменчивости
митохондриальных и полиморфных ядерных маркеров. Длительное частично
изолированное существование должно привести к формированию достоверных
отличий по высокоизменчивым ядерным маркерам и, независимо от них, к
фиксации различных митохондриальных
гаплотипов в пределах расы.
Положительная корреляция между определенным митохондриальным
гаплотипом и ядерным маркером может послужить доказательством реальности
существования рас. В качестве высокополиморфного ядреного маркера мы
использовали аллельные формы длинных концевых повторов (ДКП)
ретротранспозона Tv1. Ретротранспозон Tv1 найден у всех представителей
группы virilis (Andrianov et al., 1999). На рис. 14 показан полиморфизм
изосамочных линий D. littoralis по аллельным формам ретротранспозона.
Рис. 14.
Полиморфизм
ПЦР-фрагментов
ретротранспозона Tv1.
длин
ДКП
Полиморфизм заключается в наличии одной или двух форм ДКП.
Клонирование и секвенирование длинной и короткой форм ДКП показало, что
полиморфизм вызван делецией внутреннего прямого повтора размером 48 п.о.
Вероятно, делеция произошла в результате гомологичной рекомбинации.
Интересно, что повтор специфичен для D.littoralis. Та же последовательность в
ДКП D.virilis существует в единственной копии. Сопряжение признаков
митохондриального гаплотипа и аллельных форм Tv1 показано в табл. 3.
Сравнение наблюдаемых значений таблицы с ожидаемыми в случае
независимости митохондриального гаплотипа от числа аллельных форм ДКП
Tv1 позволяет отвергнуть гипотезу о независимости этих признаков. Значение
критерия χ2 = 13,45>{3,84; 6,64; 10,83} при одной степени свободы позволяет
отклонить гипотезу о независимости признаков на уровне значимости 0,001.
Следовательно, экологические расы, маркированные митохондриальным
гаплотипом, действительно существуют в популяциях D. littoralis.
20
Табл. 3. Сопряжение признаков митохондриального гаплотипа и аллельных форм Tv1
в выборке изосамочных линий D. littoralis.
1 форма ДКП Tv1
2 формы ДКП Tv1
∑
Мт-гаплотип Н1
15
30
45
Мт-гаплотип Н2
25
8
33
∑
40
38
78
Цифры соответствуют количеству изосамочных линий.
ВЫВОДЫ
1. Анализ изменчивости мтДНК в группе virilis, проведенный при
помощи метода ПДРФ тотальной мтДНК и сравнения нуклеотидных
последовательностей генов 16S рРНК и COI, показал, что эволюционные
взаимоотношения между видами соответствуют филогении Трокмортона
(Trockmorton, 1982).
2. Характер внутривидовой изменчивости синантропного вида D.virilis и
видов, образующих природные популяции (D.littoralis, D.americana,
D.montana), различен. Синантропный вид D.virilis мономорфен, в то время как
виды, образующие природные популяции, представлены совокупностью
нескольких мт-гаплотипов.
3. Анализ изменчивости мтДНК D.littoralis на всем ареале позволяет
выделить две формы: северную и южную, образующие зону вторичного
контакта в области Черноморского побережья Краснодарского края, что в
сочетании с данными по инверсионному полиморфизму и частотам аллозимов
дает основание для выделения подвидов D.l.littoralis и D.l.imeretensis.
4. Данные по изменчивости митохондриального гена COI и ПДРФ
тотальной мтДНК указывают на единство митохондриального генофонда двух
подвидов D.americana (D.a.americana и D.a.texana) на фоне географической
клинальной изменчивости по слиянию 4й и Х хромосом.
5. Отсутствие различий между мт-гаплотипами D.montana из Северной
Америки и D.lacicola интерпретировано как митохондриальная интрогрессия
между данными видами.
6. Наблюдения за динамикой изменчивости мт-маркеров в природной
популяции D.littoralis (пос. Рыбинский, Ростовская обл.), проведенные в
течение 10-и лет, обнаружили равновесные колебания частот мт-гаплотипов.
7. Анализ сопряженности несцепленных ядерных и митохондриальных
маркеров в выборке из природной популяции D.littoralis (пос. Рыбинский,
Ростовская обл.) позволяет выявить подразделенность локальной популяции на
две симпатрические, генетически маркированные расы.
Публикации по материалам диссертации
1. Митрофанов В.Г., Сорокина С.Ю., Андрианов Б.В. Изменчивость
митохондриального генома в эволюции Drosophila // Генетика. 2002. Т. 38. № 8.
С. 1063-1077.
21
2. Андрианов Б.В., Сорокина С.Ю., Горелова Т.В., Митрофанов В.Г..
Полиморфизм митохондриальной ДНК природных популяций дрозофил
группы virilis // Генетика. 2003. Т. 39. № 6. С. 762-768.
3. Сорокина С.Ю. Генетическая структура популяции Drosophila littoralis
по данным анализа полиморфизма митохондриальной ДНК // Онтогенез. 2005.
Т. 36. № 3. С. 239.
4. Сорокина С. Ю. Изменчивость митохондриальной ДНК D. americana и
D. texana группы virilis // Онтогенез. 2006. Т. 37. № 4. С. 318.
5. Сорокина С.Ю., Мюге Н.С., Андрианов Б.В., Митрофанов В.Г.
Изменчивость 3’-концевого фрагмента гена 16S рРНК в группе
близкородственных видов дрозофил virilis // Генетика. 2005. Т. 41. № 8. С. 10491054.
6. Андрианов Б.В., Сорокина С.Ю., Мюге Н.С., Резник Н.Л., Митрофанов
В.Г. Популяционная динамика митохондриального полиморфизма в природной
популяции Drosophila littoralis // Генетика. 2008. Т. 44. № 2. С. 195-201.
Тезисы конференций:
1. Sorokina S.Yu., Mugue N.S., Mitrofanov V.G. 16S-rRNA gene
polymorphism in the Drosophila virilis species group // Abstracts of 45th Annual
Drosophila Research Conference, Washington, USA. 2004. Р. 402.
2. Sorokina S.Yu., Andrianov B.V., Mitrofanov V.G., Genetic structure of
natural; populations of Drosophila littoralis Maigen inferred from mitochondrial
HinfI RFLP analysis // Abstracts of 46th Annual Drosophila Research Conference.
San Diego, USA. 2005. P. 352.
3. Sorokina S.Yu., Andrianov B.V.,McAllister B.F., Mitrofanov V.G.,
Mitochondrial DNA HinfI restriction polymorphism in D.americana (D.virilis
species group) // Abstracts of 47th Annual Drosophila Research Conference.
Houston, USA. 2006. P. 325.
4. Sorokina S.Yu. Phylogenetic analysis of Drosophila virilis species group by
two different mtDNA approaches // Abstracts of 48th Annual Drosophila Research
Conference. Philadelphia, USA. 2007. P. 296.
5. Andrianov B.V., Mikhailovsky S.S., Sorokina S.Yu., Mugue N.S., Lazebny
O.E., Mitrofanov V.G. Analysis of the Balanced Mitochondrial Polymorphism in
Natural Population of Drosophila littoralis // In: XX International Congress of
Genetics. Berlin, Germany. 2008. Genetics - Understanding Living Systems Abstract Book, 2008. P.233.
6. Sorokina S.Yu., Andrianov B.V., Lazebny O.E.,McAllister B., Mitrofanov
V.G. HinfI Restriction Polymorphism of D.americana Mitochondrial DNA // In: XX
International Congress of Genetics. Berlin, Germahy. 2008. Genetics - Understanding
Living Systems - Abstract Book, 2008. P.233.
7. Сорокина С.Ю., Андрианов Б.В., Митрофанов В.Г. Анализ
сбалансированного полиморфизма мтДНК в природной популяции D.littoralis //
Тезисы докладов V Cъезда Вавиловского общества генетиков и селекционеров.
2009. Часть II. С.189.
22
23