ГЛАВА II Кинетика химических реакций
advertisement
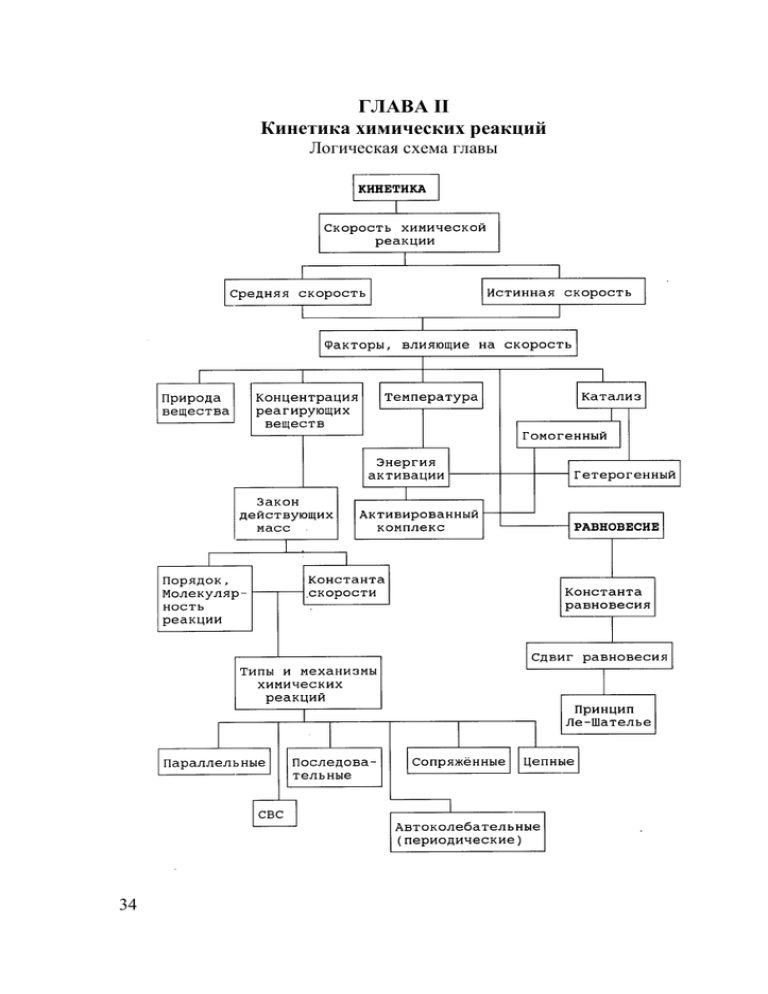
ГЛАВА II Кинетика химических реакций Логическая схема главы 34 Кинетика Раздел химии, изучающий скорости и механизмы химических реакций и факторы, влияющие на них, называется химической кинетикой. Это очень важный раздел химии, так как получение новых веществ и исследование их свойств возможно лишь при знании механизма химических процессов. Химические реакции идут с различной скоростью: одни очень быстро, другие – годами. Кроме того, чтобы реакции осуществлялись, необходимы определенные условия: давление, температура и др. Одна и та же реакция идет медленно при обычной температуре и очень быстро при высокой. Знание скоростей химических реакций имеет очень большое значение для науки и практики. Кинетика изучает скорости химических реакций и их зависимость от различных факторов. Скорость химической реакции – это число элементарных актов реакции, происходящих в единицу времени в единице объема. Почему же скорость определяется числом элементарных актов взаимодействия? Дело в том, что взаимодействие происходит только в случае столкновения молекул друг с другом. Правда, как мы увидим позже, далеко не каждое столкновение молекул приводит к реакции. Необходимы еще соответствующая ориентация электронных облаков взаимодействующих молекул, а так же определенная энергия, которой молекулы должны обладать. Измеряется скорость химической реакции изменением концентрации реагирующих веществ в единицу времени. Пусть C1 – это количество реагирующих веществ во времени t1; а C2 – количество реагирующих веществ во время t2. Тогда V = (C2 – C1)/(t2 – t1) = ∆C/∆t. Так определяется средняя скорость. Но скорость изменяется непрерывно, и истинная скорость химической реакции находится как предел средней скорости при t → 0, т.е. lim ∆C/∆t = dC/dt = V. t→0 Скорость реакции определяется по любому веществу. И часто выражение для скорости реакции A + B = AB приводится в виде d[AB]/dt = K[A][B]. При рассмотрении вопроса о скорости химической реакции надо учитывать, в какой системе идет реакция. 35 Различают гомогенные и гетерогенные системы. Гомогенной называется система, состоящая из одной фазы (газовые смеси, растворы). Гетерогенной называется система, состоящая из нескольких фаз (вода + лед; насыщенный раствор + осадок). Фаза – это часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачкообразно. Если реакция идет в гомогенной системе, то она идет во всем объеме: H2SO4 + Na2S2O3 → Na2SO4 + SO2 + S + H2O. Если же реакция идет в гетерогенной системе, то она идет только на поверхности раздела фаз, образующих систему: Zn + 2HCl → ZnCl2 + H2. Скорость химической реакции зависит от очень многих факторов: –концентрации реагирующих веществ; –температуры реакции; –природы реагирующих веществ; –катализаторов; –степени измельчения (твердые вещества); –среды (для реакций, идущих в растворе); –интенсивности облучения и т.д. Самыми главными и общими для большинства химических реакций являются первые четыре фактора. Другие же факторы действуют на определённые типы реакций. Tак, интенсивность облучения влияет на фотохимические реакции. Влияние концентрации реагирующих веществ Чем больше концентрация реагирующих веществ, тем выше скорость химической реакции. Это действительно так. Чем больше концентрация веществ, тем чаще сталкиваются молекулы друг с другом. В 1867 г. К. Гульдберг и П. Вааге открыли закон, который определяет скорость реакции в зависимости от концентрации. Он называется законом действующих масс: Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Если A + B = C , то V = K[A][B] или V = KCACB. (1) 36 (2) В общем случае nA + mB = C, то V = K[A]n[B]m. K – коэффициент пропорциональности, который называется константой скорости данной реакции. K = V при [A]=[B] = 1. Для гетерогенных систем скорость определяется концентрацией вещества в жидком или газообразном состоянии. Пример: C(тв.) + O2 = CO2, в этом случае V = K[O2]. Константа скорости зависит от природы реагирующих веществ, температуры и не зависит от концентрации реагирующих веществ. Но не для всех реакций можно рассчитать скорость по уравнениям (1-2). 8HNO3 + 6KI = 3I2 + 2NO + 6KNO3 + 4H2O. Если написать выражение для скорости этой химическойреакции как V = K[HNO3]8[KI]6, то вычисленное значение даст неверный результат. Скорость по этим уравнениям нельзя вычислить, так как эта реакция идет в несколько стадий.Закон действующих масс применим только к одной стадии реакции, однако большинство химических реакций имеет сложный механизм. По числу реагирующих молекул химические реакции делят: а) на мономолекулярные; б) бимолекулярные (принимают участие две молекулы); в) тримолекулярные (принимают участие три молекулы). Наиболее вероятными процессами являются бимолекулярные. Молекулярность реакции определяет кинетический порядок реакции. Порядок реакции – это сумма показателей степеней концентраций отдельных реагентов в выражении закона действующих масс. Сумма показателей определяет общий порядок реакции, а отдельный показатель степени – порядок по каждому из компонентов. Различают реакции первого, второго, третьего и другого порядков. H2 + I2 = 2HI V = K[H2][I2] n = 2; N2O5 = NO2 + NO + O2 V = K[N2O5] n = 1. Скорость реакции первого порядка определяется следующим выражением: V = K[A] = KCA. 37 Для реакции второго порядка возможны два варианта выражения для скорости реакции: V = K[A]2 = KCA2 при участии в реакции одного компонента. V = K[A][B] = KCACB при участии двух компонентов. Если концентрации компонентов А и В равны, то второе уравнение превращается в первое: V = K[A][B] = K[A]2 при [A] = [B]. Если же [A]>>[B] и в процессе взаимодействия расходуется небольшая часть компонента А, то формально данное уравнение сводится к уравнению для реакции первого порядка. Скорости реакций третьего порядка могут быть описаны следующими уравнениями: V = KCA3; V = KCA2CB; V = KCACBCC. Размерность скорости химической реакции – моль/л.с или молекул/см3⋅с. Размерность константы скорости зависит от порядка реакции. Для реакции первого порядка размерность скорости [K] = C–, для реакций второго порядка [K] = л/моль⋅с или [K] = см3/молекул2⋅с. Константа реаций третьего порядка имеет размерность [K] = л2/моль2⋅с или [K] = см3/молекул2⋅с. Практика показывает, что реакции выше третьего порядка прак-тически не встречаются. Но не всегда можно определить порядок реакции повыражению для скорости реакции. HIO3 + 3H2SO3 = HI + 3H2SO4, V = K[H2SO3]3. По формуле это реакция третьего порядка (по H2SO3), а экспериментально – первого, так как идет по нескольким стадиям: HIO3 + H2SO3 = HIO2 + H2SO4, медленная стадия HIO2 + H2SO3 = HIO + H2SO4, быстрые стадии HIO + H2SO3 = HI + H2SO4, Скорость реакции определяется самой медленной стадией реакции. Закон действующих масс справедлив для каждой стадии. Молекуляр38 ность реакции представляет молекулярно-кинетическую характеристику системы. Понятие же порядка реакции следует из формальнокинетического описания. Для простых гомогенных одностадийных реакций понятия порядка и молекулярности совпадают. Мономолекулярная реакция – это реакция первого порядка, бимолекулярная – реакция второго порядка. Для сложных реакций порядок и молекулярность не совпадают. Порядок реакции – это чисто экспериментальный параметр, который описывает только экспериментально полученный вид кинетического уравнения. Но порядок реакции не позволяет делать никаких выводов о механизме реакции. Порядок реакции может иметь дробное и даже нулевое значение. Нулевое значение порядка реакции бывает при взаимодействии твердого вещества с жидким, а также в реакциях разложения некоторых веществ на поверхности твердых веществ, когда скорость распада веществ не зависит от концентрации их в объеме. Реакции дробного порядка наблюдаются при многостадийных процессах, когда скорости их соизмеримы, но самые медленные стадии имеют различный порядок. Молекулярность реакции также достаточно сложно определить по её уравнению. Чтобы указать молекулярность реакции, необходимо иметь сведения о механизме реакции. Даже реакции, уравнения которых имеют подобный вид, часто не совпадают по молекулярности. Очень хорошо это иллюстрируют реакции галогенов с водородом. Уравнение реакции водорода и йода приведена выше. Константа скорости этой реакции имеет вид: V = K[H2][I2]. Cкорость данной реакции пропорциональна концентрациям водорода и иода, взятым в первой степени. Правда, это не означает, что реакция осуществляется в результате столкновения одной молекулы водорода с одной молекулой иода. Были получены доказательства, что это не так. Реакция между газообразными водородом и бромом совершенно отличается от реакции с иодом, хотя их уравнения подобны: H2 + Br2 = 2HBr. Экспериментально установленная зависимость скорости образования бромистого водорода от концентраций реагентов и продуктов сильно отличается от аналогичной зависимости для иода K[H2][Br2]1/2 39 V = . 1 + K’[HBr]/[Br2] В это выражение входят две константы – К и К’. Hельзя говорить о молекулярности этой реакции, так как она является результатом сложной цепи реакций. Образование хлористого водорода происходит ещё более сложным способом. Это цепная реакция, протекание которой инициируется светом и ингибируется присутствием примесей кислорода, а также осложняется побочными процессами, протекающими на стенках реакционного сосуда. Полученные результаты иногда зависят от размеров и формы сосуда. По механизму реакции можно разделить на 6 типов: 1 2 а) последовательные реакции: A → B → C. Последовательными называются реакции, в которых продукт реакции В является реагентом для следующей стадии, т.е. промежуточным. Скорость такой реакции по веществу А определяется выражением V1(A) = –dCA/dt = K1CA. Cкорость накопления вещества В в соответствии с реакцией превращения А (1) описывается выражением V1(B) = dCB/dt = K2CB. Соответственно, скорость расхода вещества В определяется выражением V2(B) = -dCB/dt = K2CB. Так как вещество В участвует одновременно в двух реакциях, то его концентрация изменяется в соответствии с разностью скоростей накопления и расходования: VB = (K1 – K2)CB. Скорость накопления вещества С определяется выражением V2(C) = dCC/dt = K2CC. Cтадии последовательных реакций протекают с различной скоростью. Самая медленная стадия и определяет общую скорость химической реакции. Стадия, константа скорости которой минимальна, называ- 40 ется лимитирующей. Она определяет кинетическую закономерность реакции в целом; б) параллельные реакции: B ← A → C Параллельными называются реакции, имеющие одни и те же исходные реагенты, которым соответствуют различные продукты.Скорости параллельных процессов реакции определяются выражениями V1 = K1CA и V2 = K2CA. Суммарная скорость процесса определяется выражением V = V1 + V2 = (K1 + K2)CA. Отсюда видно, что скорость параллельных реакций равна сумме скоростей отдельных реакций. Это правило применимо и для бимолекулярных параллельных химических реакций: A + B = C + D; A + B = M + N; V = (K1 + K2)CACB; в) сопряженные реакции (одна реакция идет в присутствии другой). Примером такого процесса являются следующие реакции: 1. HBrO3 + 3H2SO3 = HBr + 3H2SO4; 2. HBrO3 + 3H3AsO3 = HBr + 3H3AsO4. Вторая реакция идет только в присутствии первой, так как H2SO3 более сильный восстановитель, чем H3AsO3, и в системе протекают реакции 1) HBrO3 + H2SO3 = HBrO2 + H2SO4HBrO2– более сильный окислитель, чем H3AsO3. Отсюда 2) HBrO2 + 2H3AsO3 = HBr + 2H3AsO4. В процессах данного типа одна реакция как бы индуцирует протекание другой. Это явление называется химической индукцией. г) цепные реакции Цепные реакции распространены в химии. Эти реакции вызываются свободными радикалами, активными частицами, образовавшимися из валентнонасыщенных молекул. По цепному механизму протекают мно41 гие фотохимические реакции, реакции горения. Теория цепных реакций разработана академиком H.H. Семёновым (СССР), С.Н. Хиншельвудом (Англия) и др. Основными стадиями цепных реакций являются: зарождение, продолжение, разветвление и обрыв цепи. Различают два типа цепных реакций: реакции с неразветвлёнными и с разветвлёнными цепями. Зарождение цепи – это стадия цепной реакции, в результате которой возникают радикалы из валентнонасыщенных молекул.Образование радикалов может происходит за счёт или внешнего источника энергии ( световое излучение, тепло, электроразряди др.), или обменного взаимодействия молекул, или введенияпосторонних веществ, неустойчивых в данных условиях (пероксиды, гидропероксиды). Например, при взаимодействии водорода с хлором образование радикалов происходит под действием кванта света: H2 + Cl2 = 2HCl Cl2 + hν = 2Cl Cl. + H2 = HCl + H H. + Cl2 = HCl + Cl H . + H. = H2 Cl. +Cl. = Cl2 зарождение цепи; продолжение цепи; продолжение цепи; обрыв цепи; обрыв цепи. Продолжение цепи – стадия цепной реакции, протекающая с сохранением общего числа свободных радикалов. Разветвление цепи – это стадия, в которой единичная реакция одного свободного радикала приводит к образованию нескольких свободных радикалов (число свободных связей увеличивается). Примером такого процесса служит реакция окисления водорода: H2 + O2 = 2H2O H2 + O2 = H. + HO2. H. + O2 = OH. + .O. OH. + H2 = H2O + H. . . O + H2 = OH. + H. H. + стенка = 1/2H2 42 зарождение цепи; разветвление цепи; продолжение цепи; разветвление цепи; обрыв цепи. Обрыв цепи – стадия реакции, в результате которой исчезают свободные радикалы. Это может произойти в результате или рекомбинации свободных радикалов (образование исходныхмолекул), или столкновения со стенкой сосуда, или взаимодействия радикала с примесями, если они не являются источниками свободных радикалов. Поэтому скорость цепной реакции чувствительна к наличию примесей и к форме сосуда. Так, содержание в реакционной смеси хлора с водородом долей процента кислорода во много раз уменьшает длину цепи. Возникающее огромное количество радикалов приводит к лавинообразному течению процесса, которое может вызвать взрыв. Общая скорость неразветвлённой цепной реакции определяется выражением V = VOn = VO(Vпрод./Vобр.), где n – длина цепи; VO – скорость зарождения цепи; Vпрод. – вероятность продолжения цепи; Vобр. – вероятность обрыва цепи. Под длиной цепи понимают среднее количество элементарных стадий продолжения цепи после возникновения свободного радикала до его исчезновения (обрыва цепи); д) периодические реакции (автоколебательные реакции). Эти реакции открыты Б.П. Белоусовым, исследованы А.М. Жаботинским и др. (СССР). Периодические реакции – это сложные многостадийные автокаталитические реакции с участием нескольких веществ. В этих реакциях происходит периодическое колебание концентраций окисленной и восстановленной форм веществ, участвующих в реакции. Частота и форма колебаний зависят от концентраций исходных веществ, кислотности, температуры. Примером таких реакций могут являться взаимодействия броммалоновой кислоты с броматом калия в кислой среде. Катализатором служит соль церия. В системе идут следующие реакции: BrO3Ce →Ce4+; (1) C3H4BrO4 Ce4+ →Ce3+ + Br –. (2) 3+ Реакция (1) является автокаталитической, в основе которой лежит размножение активных промежуточных частиц (таких как H2BrO2, HBrO, BrO2, BrO, Br, BrO2). Выделяющийся в результате реакции ион Br– является сильным ингибитором реакции (1), имеющей цепной харак43 тер. Поэтому пока в системе присутствует Се4+ и в результате реакции (2) выделяется Br–, реакция (1) не может начаться. В результате реакции весь церий переходит в трёхвалентное состояние. После этого протекает быстрая реакция (1), и цикл начинается сначала. Периодические реакции имеют большое значение для биологических объектов, где реакции подобного рода широко распространены. За открытие и исследование периодических реакций Б.П. Белоусову и группе исследователей была присвоена Ленинская премия; е) реакции твёрдофазного горения (реакции самораспространяющегося высокотемпературного синтеза – СВС). Открыты в 1967 г. в институте химической физики АН СССР А.Г. Мержановым и И.Г. Боровинской. Сущность метода СВС заключается в том,что после локального инициирования реакции взаимодействия реагентов фронт реакции горения самопроизвольно распространяется по всей системе благодаря теплопередаче от горячих продуктов к исходным веществам, инициируя протекание в них реакции взаимодействия. Таким образом осуществляется процесс горения, который является и причиной, и следствием протекания реакции. Механизм протекания реакций СВС является достаточно сложным и включает в себя процессы реакционной диффузии. Термин “реакционная диффузия” определяет совокупность явлений, происходящих при взаимодействии двух химически различных компонентов, способных образовывать химические соединения в виде твёрдых фаз. Продукты химического взаимодействия образуют сплошной слой, отличающийся по своему строению от исходных компонентов, но не мешающий протеканию дальнейшего взаимодействия. Такие гетерогенные реакции связано с переносом атомов через образующийся продукт. Известно много моделей описания процессов, происходящих на поверхности реагирующих фаз, и все они включают стадию диффузии реагентов через слой продукта реакции. Но подробное рассмотрение их является делом специальных работ, посвящённых реакциям СВС. Изучение механизма химических реакций является очень сложной задачей. Ведь мы же не можем проводить прямые наблюдения за ходом взаимодействия молекул. Часто о предполагаемом механизме можно сказать, что он не противоречит полученным результатам. Иногда одни и те же результаты можно объяснить, используя другой механизм. Очень хорошим примером этого является реакция H2 + I2 = 2HI. 44 Данная реакция считалась классическим примером бимолекулярной реакции второго порядка, но в 1967 г. Н.Н. Семенов, Г. Эйринг и Дж. Салливэн показали, что она имеет сложный характер. Данная реакция оказалась тримолекулярной и идёт в две стадии: I2 = 2I H2 + 2I = 2HI – первая стадия; – вторая стадия. Мы не можем также наблюдать за ориентацией молекул приих взаимодействии. Мы способны только с помощью теории вероятности оценить вероятность должной ориентации молекул, приводящей к взаимодействию. Изучение скоростей химических реакций можно проводить спомощью метода скрещенных молекулярных пучков. В этом методепучки молекул или ионов пропускают сквозь друг друга. Моле-кулы реагируют в точке пересечения пучков, и продукты рассеи-ваются. Но наиболее часто для изучения скоростей используютобъемные методы, наблюдая за изменением концентрации продуктов или исходных веществ физическими или химическими методами. Влияние температуры на скорость химической реакции Скорость химических реакций очень чувствительна к действию температуры. Для подавляющего числа реакций с повышением температуры скорость растёт. Экспериментально установлено, что при увеличении температуры на каждые 10 оС скорость реакции увеличивается в 2-4 раза. Это правило было установлено Вант-Гоффом: K T +10 = 2÷4; KT T2 −T1 V (T2 ) = γ 10 , V (T1 ) γ = где γ – температурный коэффициент скорости. С чем же связано такое увеличение скорости химической реакции? Это не подтверждается увеличением числа соударений молекул, так как при повышении температуры на 10 оС скорость движения частиц увеличивается лишь на 1-2%. Кроме того, соударение молекул не является обязательным условием взаимодействия. Ведь если бы каждое соударение сопровождалось взаимодействием, реакции протекали бы со скоростью взрыва. 45 При разности температур ∆T = 100, коэффициент γ = 3, тогда скорость реакции при температуре Т2 будет больше скорости при Т1(VT2/VT1) примерно в 310 ≈ 59000 раз, а, согласно молекулярнокинетической теории, с увеличением температуры на 100о С число столкновений увеличивается пропорционально T1/2, и тогда VT2/VT1 = (373/273)1/2 = 1.2, т.е. скорость реакции возрастает всего в 1,2 раза. Почему же наблюдается такое противоречие? Дело в том, что реакция между молекулами начинается при соударении их друг с другом. Но оказывается, что далеко не всякое соударение приводит к реакции. Для того, чтобы произошло взаимодействие, необходимо разорвать или ослабить связи между атомами в молекулах исходных веществ. На это затрачивается определенное количество энергии. Если сталкивающиеся молекулы не обладают такой энергией, то столкновение не будет эффективным, следовательно, не приведет к реакции. И только в том случае, если кинетическая энергия молекул будет достаточна для разрыва связей, произойдет взаимодействие. Пусть у нас будет множество частиц в каком-то определенном объеме. Если мы изобразим распределение этих частицпо энергии, то увидим, что не все частицы обладают достаточной энергией для реакции. Это распределение частиц по энергиям носит название кривой Максвелла – Больцмана (рис. 2.1). Рис. 2.1. Распределение молекул по энергии при различных температурах Для того чтобы частица прореагировала, ей надо сообщить энергию выше средней энергии для частиц: энергиюЕА, измеряемую в кДж/моль. ЕА – это энергия активации. 46 Энергия активации – та избыточная энергия по сравнению со средней энергией, которую надо сообщать частицам, чтобы произошло взаимодействие. Или ЕА – этотот барьер, который надо преодолеть, чтобы произошла реакция. При увеличении температуры до Т2 число частиц, имеющих энергию ЕА, резко возрастает. Энергия активации отличается для различных реакций. Для некоторых реакций она мала, для других велика. Если ЕА очень мала (меньше 40 кДж/моль), то значительная часть столкновений частиц приводит к реакции. Скорость таких реакций очень велика (ионные реакции в растворах). Если энергия активации велика (>125 кДж/моль), то скорость реакции очень мала, так как очень незначительное число частиц вступает в реакцию. Если же ЕА лежит в пределах 40-125 кДж/моль, то скорость реакции можно измерить. Реакции с большой энергией активации всегда начинаются с разрыва или ослабления связей между атомами в молекулах исходных веществ. При этом образуются неустойчивые промежуточные состояния, у которых большой запас энергии, так называемый активированный комплекс (АК). Пример: Рассмотрим реакцию H2 + I2 = 2HI. Данная реакция идет через образование активированного комплекса АК HH H H H H + → → + → 2HI. II I I I I АК – это активированный комплекс, в котором возможен разрыв одних связей и образование других. Почему же образование АК более выгодно, чем просто атомизация молекул? Затраты энергии на процесс атомизации значительно выше, чем на процесс образования активированного комплекса. Энергия атомизации много выше энергии активации, потому образование АК более выгодно. Так, для реакции H2 + I2 = 2HI энергия атомизации равна 571 кДж/моль, а энергия активированного комплекса – 168 кДж/моль (рис. 2.2). 47 Ï îòåí ö è à ë üí à ÿ ýíå ð ãè ÿ H 2À +2 1 Å ‘Ý À 2=  2 À 2+  2 H í à÷. 2 Å ‘Ý ∆H A B +A B Í êî í . Ï óòü ð å à êö è è Рис. 2.2. Изменение энергии реакции при прохождении её через атомизацию молекул реагентов (кривая 1) и через образование активированного комплекса (кривая 2) Энергия активации зависит от пути процесса. В обратном направлении энергия активации экзотермического процесса много больше, чем в прямом. Для той же реакции H2 + I2 = 2HIEакт.обр.= EАКпрям.реак + ∆Hреак = 168 + 17 = = 185 кДж/моль(∆Hреак = –17 кДж/моль). Теория активированного комплекса исходит из того, что между активированным комплексом и реагентами существует равновесие, константу которого будем изображать в виде К*. Тогда можно записать для реакции: A + B = AB*; [AB*] K* = . [A][B] Отсюда концентрацию активированного комплекса можно выразить в следующем виде: [AB*] = K*[A][B]. 48 Для бимолекулярных реакций скорость распада активированного комплекса является величиной постоянной и зависит только от температуры: V расп . = kT , h где k – константа Больцмана; h – постоянная Планка. Вероятность образования продуктов реакции, а не исходных веществ, называется трансмиссионным коэффициентом, который обозначается χ. Для большинства реакций величина трансмиссионного коэффициента лежит в пределах от 0,5 до 1. Тогда полная скорость реакции А + В = С выразится уравнением − d [A] kT ∗ K [A][B ] . =χ dt h Константа скорости бимолекулярной реакции К2 выразится уравнением K2 = χ kT ∗ K . h Константа равновесия К* связана с изобарно-изотермическим потенциалом образования активированного комплекса: –RTlnK* = ∆G* = ∆H* – T∆S*, следовательно, выражается через энтальпию и знтропию образования активированного комплекса. Энтальпия активированного комплекса мало отличается от энергии активации. Отсюда константу скорости бимолекулярной реакции можно выразить соотношением S H kT R − RT K=χ e e . h Из последнего уравнения видно, что скорость реакции тем ниже, чем выше энергия активации. Это уже известно из теории активных соударений. Чем выше энергия активации, тем меньшая часть молекул имеет достаточно энергии для реакции. Но из этого же уравнения следует, что скорость реакции тем выше, чем выше энтропия активации, т.е. чем больше неупорядоченность активированного комплекса по сравнению с реагентами, тем больше скорость реакции. В этом случае велика кон49 центрация активированного комплекса. Если же образование активированного комплекса ограничено строгими условиями, то реакция замедляется. Энтропия реакции в бимолекулярных реакциях имеет почти всегда большое отрицательное значение, так как образование активированного комплекса сопровождается уменьшением энтропии. Энтропия активации позволяет судить о структуре активированного комплекса. Например, если вычисленная энтропия активации положительна, то это значит, что высокоупорядоченные активированные комплексы в реакции не образуются. Рассмотрим в качестве примера две следующие реакции: R3C – Br + OH- → R3C – OH + Br-. Эти реакции осуществляются по двум механизмам в зависимости от природы групп R. Один из механизмов включает удаление Br при приближении группы ОН. В этом случае активированный комплекс представляет собой комбинацию R R – – R3C – Br + OH → Br .. .. С .... ОН → Br +R3C – OH. R Реакция при этом происходит по так называемому ассоциа-тивному механизму SN2. Это означает, что замещается одна группа другой, эти группы нуклеофильны (отдают электроны) и являются основаниями Льюиса, а также в реакции принимаютучастие две молекулы. Другой механизм заключается в следующем. Молекула R3C-Br самопроизвольно диссоциирует на Br- и на карбониевый ион R3C+. На следующей стадии ионы ОН- быстро реагируют со свободными карбониевыми ионами. Активированным комплексом в этом случаеявляется сам реагент R3C-Br непосредственно перед реакцией. Реакция проходит в две стадии: R3C–Br → [R3C–Br]* → R3C+ + Br-; R3C+ + OH- → R3C–OH. Такой механизм называют диссоциативным и обозначают SN1, так как это нуклеофильное замещение, в котором наиболее медленная стадия включает диссоциацию отдельной молекулы. Различие между этими механизмами должно проявляться в энтропииактивации. Механизм SN2 должен характеризоваться большой отрицательной энтропией активации, так как активированный комплекс образуется из двух частиц. Ме50 ханизм SN1 должен характеризоваться почти нулевым значением энтропии активации, так как активированный комплекс мало отличается от исходной молекулы реагента. Более строго зависимость скорости реакции от температуры устанавливается уравнением Аррениуса (1869 г.): K = Aexp(–EА/RT), где A – предэкспоненциальный множитель, связанный с вероятностью столкновения; K – константа скорости; EА – энергия активации. Прологарифмируем уравнение Аррениуса и получим lnK = lnK0 – EА/RT; lnK0 = A = const, EА/R –постоянная величина для данной реакции. Таким образом, изменяется только 1/T, т.е. зависимость lnK от 1/Т является линейной. Форма большинства молекул несферическая, поэтому они небезразличны к ориентации электронных облаков во время столкновений. Для них только то из соударений оказывается эффективным, при котором в месте соприкосновения находятся атомы с соответствующей ориентацией электронных облаков. В связи с этим в формулу Аррениуса вводят поправочный множитель Р, называемый стерическим фактором: К = РАехр(–EА/RT). Влияние катализаторов Одним из наиболее распространенных методов ускорения реакции является катализ. Катализ – это явление изменения скорости реакции, происходящее под действием некоторых веществ (катализаторов). Катализатор – вещество, изменяющее скорость химической реакции за счет участия в промежуточном химическом взаимодействии с компонентами химической реакции, но восстанавливающее после каждого цикла промежуточного взаимодействия свой химический состав. Различают катализ положительный, если реакция ускоряется, и отрицательный, если реакция замедляется. Вместе с отрицательным катализатором часто используют ингибиторы. Ингибиторы – это вещест- 51 ва, замедляющие реакцию и входящие в состав продукта реакции. Hапример, Са(НСО3)2 – ингибитор коррозии железа. Надо уяснить тот факт, что катализатор не влияет на положение равновесия, а лишь изменяет скорость, с которой достигается это равновесие. Величина константы равновесия не изменяется, так как увеличивается скорость как прямой, так и обратной реакции. Различают катализ гомогенный и гетерогенный. Гомогенный катализ идет в тех случаях, когда и катализатор, и реагенты находятся в одной фазе (жидкости, газы). Гетерогенный катализ имеет место, когда катализатор и регенты находятся в разных фазах. Ускоряющее действие в гомогенном катализе объясняется тем, что катализатор образует активированный комплекс с реа-гентами, имеющий меньшую энергию активации: A+B→В A+B→A B → AB. В присутствии катализатора схема реакции имеет вид: A + B + K → AK + B → A..K..B → AB + K. Графическая схема этого процесса приведена на рисунке 2.3: Гомогенный катализ наиболее распространён в растворах. Гомогенно-каталитические реакции принято делить на кислотно-основные и окислительно-восстановительные с участием комплексных соединений. К кислотно-основному типу относятся реакции изомеризации, гидратации и дегидратации, гидролиза, этерификации, алкилирования и др. В зависимости от типа кислоты или основания эти реакции делят на следующие группы: 1) общий кислотный катализ, осуществляемый любыми кислотами; 2) общий основной катализ, осуществляемый любыми основаниями; 3) специфический кислотный катализ ионами Н3О+; 4) cпецифический основной катализ ионами ОН–. 52 ∆Å êàò. à ΣÅ è ñõ. ΣÅ è ñõ. Рис. 2.3. Изменение энергии взаимодействия в реакции, протекающей без катализатора (кривая 1) и с гомогенным катализатором ( кривая 2) При помощи гомогенного катализа комплексными соединения-ми переходных металлов проводят реакции восстановления-окисления, гидрирования и гидратации, полимеризации и изомеризации. Примером такого процесса может служить окисление этилена до ацетальдегида в водной среде. Катализатором является галогенидный комплекс палладия PdCl42–: C2H4 + PdCl42– + H2O →CH3COH +4Cl– + 2H+ + Pd. Образующийся металлический палладий окисляется ионом Cu2+: Pd + 4Cl– + 2Cu2+→PdCl42– + 2Cu+. Ион Cu+ окисляется кислородом воздуха до Cu2+: 2Cu+ + 2H+ + 1/2O2→2Cu2+ + H2O. Более сложeн механизм гетерогенного катализа. Гетерогеннокаталитические процессы протекают на границе раздела фаз твёрдое тело – газ, твёрдое тело – жидкость. В этом случае важную роль играет поглощение реагирующих веществ поверхностью катализатора. Это многостадийный процесс. За счёт диффузии частицы реагентов подводятся к поверхности катализатора и поглощаются его поверхностью. Этот процесс сопровождается сближением молекул и повышением их химической активности за счёт возмущения электронных оболочек мо53 лекул силовыми полями поверхностных атомов катализатора. Вследствие этого взаимодействия снижается энергия активации. Схема гетерогенного катализа приведена на рисунке 2.4. Рис. 2.4. Путь каталитического процесса при гетерогенном катализе: ∆Екат. – уменьшение энергии активации под влиянием катализатора; 1 – исходные вещества; 2 – продукты реакции; 3 – адсорбированные исходные вещества; 4 – адсорбированные продукты реакции; а’’ – энергия активации адсорбированного активированного комплекса; а’ – энергия активации адсорбированных исходных веществ; а’’’ – энергия активации адсорбированных продуктов После реакции на поверхности катализатора продукты покидают поверхность и за счёт диффузии переходят в объём. Самая медленная стадия определяет скорость процесса в целом. В гетерогенном катализе промежуточными являются поверхностные соединения. Процесс формирования промежуточных соединений происходит на активных участках поверхности катализатора (активные центры). Активные центры составляют небольшую часть поверхности катализатора. Для увеличения числа активных центров, увеличения поверхности катализатора его тонко измельчают и осаждают на носитель с высокоразвитой поверхностью (пемза, силикагель, активированный уголь и др.). Характер взаимодействия сильно зависит от электронной структуры твердого катализатора. Так, активные металлы с их легкоподвижными электронами образуют прочные связи с реагентами и поэтому не пригодны к использованию в качестве катализаторов. Диэлектрики имеют небольшую концентрацию свободных электронов и плохо образуют поверхностные комплексы. Их тоже не используют в качестве катализато54 ров. Чаще всего в качестве катализаторов используют полупроводники и малоактивные металлы. Преимущество гетерогенного катализа объясняется большим удобством гетерогенных катализаторов, лёгкостью их отделения от реагирующих веществ. В таблице 2.1 приведены примеры промыш-ленных каталитических процессов. В отсутствие катализатора энергия активации химической реакции значительно выше, чем при использовании катализатора. Так, например, для реакции Н2 + I2 = 2HI использование в качестве катализатора золота снижает энергию активации со 168 кДж/моль до 104.6 кДж/моль, а использование в качестве катализатора платины снижает энергию активации до 58.6 кДж/моль. Таблица 2.1 Примеры промышленных каталитических процессов Название процесса Kаталитическая реакция Окисление NH -> NO 3 SO -> SO 2 3 CO+H O -> CO +H 2 2 2 CH OH -> CH O Pt V O ,V O 2 5 2 4 Fe, Fe O 3 4 Ag, Ag O N +3H -> 2NH 2 2 3 CO+2H -> CH OH Fe, Mo, Os Cu, ZnO, Zn - Cr O 3 Синтез Kатализатор 2 2 3 2 2 Гидрирование и дегидрирование 3 Оксиды и сульфиды переходных металлов Отличительная черта катализаторов – избирательность их действия. C 2 H 5OH Al 2O3 C2 H 4 + H 2O 350 − 360! C 55 C2 H 5OH Cu CH 3CHO + H 2 200 − 250! C Другим свойством катализаторов является их специфичность. Катализатор, ускоряющий одну реакцию, часто совершенно неэффективен для другой. Но бывает так, что для одной реакции существует целый набор катализаторов. Так, разложение хлората калия KClO3 ускоряется в присутствии оксидов железа(III), хрома(III) и диоксида марганца. Групповая специфичность определяется тем, что катализатор ускоряет целую группу однотипных реакций. Например, оксид ванадия(V) является катализатором окисления диоксида серы, аммиака и др. Биологические катализаторы – ферменты – обладают индивидуально-специфическим действием; ускоряют только одну химическую реакцию. Универсальные катализаторы могут ускорять самые разнообразные реакции. К ним относятся вода и платиновые металлы. Химическое равновесие Все химические реакции можно разделить на обратимые и необратимые. Обратимые – это реакции, идущие как в прямом, так и в обратном направлении: H2 + I2 ↔ 2HI. Необратимые реакции идут только в одном направлении: AgNO3 + KCl → AgCl + KNO3. Рассмотрим обратимые реакции. В первый момент при взаимодействии двух веществ скорость прямой реакции значительно больше, чем обратной. Но постепенно исходные вещества расходуются, и скорость прямой реакции падает, а обратной нарастает. При равенстве скоростей прямой и обратной реакции наступает химическое равновесие. Различают равновесие истинное и ложное (замороженное). Истинное химическое равновесие характеризуется следующими признаками: при 56 отсутствии внешних воздействий состояние равновесия сохраняется во времени неизменным. Если же внешние воздействия изменяются, то изменяется и состояние равновесия. Но при восстановлении исходных условий восстанавливается и состояние равновесия. Ложное равновесие описывает процессы, которые при обычных условиях должны бы идти, но не идут. Однако при введении соответствующих реагентов, например катализаторов, эти процессы идут до установления истинного химического равновесия. Примером таких равновесий являются реакции водорода с азотом и окисление диоксида серы. Химическое равновесие – динамическое равновесие. Это значит, что в системе идут и прямая, и обратная реакции, но их скорости равны. Рассмотрим реакцию H2 + I2 = 2HI. По закону действующих масс V1 = K1[H2][I2]; V2 = K2[HI]2 при V1 = V2 K1[H2][I2] = K2[HI]2 или K1/K2 = [HI]2/[H2][I2] = Kравн. Kравн. – константа равновесия данной реакции. В левой части уравнения стоят равновесные концентрации реагирующих веществ. В общем случае для реакции aA + bB ) nP + mC; K = [P]n[C]m/[A]a[B]b. Таким образом, при T = const константа обратимой реакции представляет собой постоянную величину, показывающую соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которые устанавливаются при равновесии. Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Изменение концентрации одного вещества обязательно изменяет концентрации всех других веществ, участвующих в реакции. Для гетерогенных систем в уравнение константы равновесия входят концентрации тех веществ, которые находятся в газовой фазе или в растворе. CO2 + Cтв = 2CO, Kр = [CO]2/[CO2] или Kр = P2СО/PСО; CaCO3(к) = CaO(к) + CO2(г), Kр = PСО2. 57 Величина Kравн не зависит только от концентрации, но зависит от других факторов: природы реагирующих веществ, температуры, растворителя и др. Константа равновесия химической реакции связана с величиной изобарно-изотермического потенциала: ∆G = –RTlnKравн. или Kравн. = e(–∆G/RT). Соотношение между ∆G и K процесса характерно для любого равновесия: диссоциации, кипения, растворения вещества, электрохимического процесса и т.д. ∆G = –RTlnK = 19,113 TlgK. Чем более отрицательна величина ∆G, тем больше величина константы равновесия, т.e. в системе преобладают продукты реакции. Если ∆G > 0, то в смеси преобладают исходные вещества. При ∆G = 0 получим Kравн = 1. Смещение химического равновесия Если система находится в равновесии, то она будет пребывать в таком состоянии до тех пор, пока внешние условия не изменятся. При изменении условий система выйдет из состояния равновесия. Это происходит при изменении концентрации реагентов, давления и температуры. 1. Влияние изменения концентрации на химическое равновесие. Рассмотрим реакцию H2 + I2 ↔ 2HI; KP = [HI ]2 . [H 2 ][I 2 ] Система находится в равновесии. Прибавим в систему водород. Тогда по закону действующих масс увеличение концентрации водорода увеличивает скорость прямой реакции (увеличение [H2] вызывает увеличение [HI], так как K = const, а скорость обратной реакции не изменяется). В результате реакции концентрации водорода и паров йода будут уменьшаться, поэтому скорость прямой реакции также будет уменьшаться, а концентрация паров HI будет увеличиваться, значит скорость обратной реакции будет увеличиваться. Через некоторое время скорости прямой и обратной реакций сравняются, и в системе снова установится равновесие, но при других равновесных концентрациях реагентов. 58 Процесс изменения концентраций, вызванный нарушением равновесия, называется смещением или сдвигом равновесия. Причем, если равновесие смещается в сторону продуктов реакции, то говорят, что равновесие сместилось вправо, и наоборот, если произошло смещение равновесия в сторону исходных веществ, то говорят, что равновесие сместилось влево. Таким образом, при увеличении концентрации какого-либо исходного реагента равновесие реакции смещается в сторону расходования его, т.е. вправо (с образованием продуктов реакции). Равновесие можно сместить вправо, если уменьшать концентрацию продукта. Несмотря на изменение равновесия, установившиеся концентрации веществ отличаются от исходных, но константа реакции не изменяется. Для реакций в газообразной фазе на химическое равновесие сильно влияет давление. При увеличении давления на систему равновесие сдвигается в сторону уменьшения числа молекул газов, т.е. в сторону понижения давления. При уменьшении давления равновесие сдвигается в сторону увеличения числа молекул газов, т.е. в сторону увеличения давления. Рассмотрим реакцию N2 + 3H2 ↔ 2NH3; V1 = K1[N2][H2]3 V2 = K2[NH3]2. Увеличим давление в два раза, т. е. концентрация газов увеличится вдвое, концентрация водорода будет равна 2[H2], а азота – 2[N2], аммиака – 2[NH3]. Тогда скорости прямой и обратной реакции будут равны V1' = K12[N2](2[H2])3 = 16K1[N2][H2] = 16V1; V2' = K2(2[NH3])2 = 4K2[NH3]2 = 4V2. Отсюда видно, что при увеличении давления в 2 раза скорость прямой реакции увеличивается в 16 раз, а скорость обратной увеличивается только в 4 раза. После установления нового равновесия концентрация продуктов увеличивается. Из уравнения реакции видно, что в реакцию вступило 4 моля газа, а получилось 2, что равносильно уменьшению давления в два раза. В том случае, если реакция протекает без изменения числа молей газа, то равновесие не нарушается при изменении давления, например, в реакции H2 + I2 ↔ 2HI. 59 На состояние химического равновесия оказывает влияние и температура. При рассмотрении влияния температуры на химическое равновесие надо учитывать тепловой эффект реакции. В зависимости от экзотермичности или эндотермичности реакции и определяется действие температуры на равновесие. Если реакция экзотермическая, то увеличение температуры сдвигает равновесие влево, т.е. в сторону исходных веществ. Если же реакция эндотермическая, то повышение температуры сдвигает равновесие в сторону продуктов реакции. Отсюда ясно, что при экзотермической реакции необходимо тепло отводить, а при эндотермической – подводить. N2 + 3H2 ↔ 2NH3; ∆H = –90.95 кДж/моль; N2 + O2 ↔ 2NO; ∆H = +180.75 кДж/моль. Но не всегда таким образом в практике решается вопрос о смещении равновесия. Необходимо учитывать еще и кинетические факторы. Примером может служит реакция получения аммиака. Несмотря на то, что это реакция экзотермическая, процесс проводят при повышенной температуре. Все рассмотренные случаи нарушения равновесия представляют собой случаи общего принципа сдвига равновесия, так называемого закона смещения химического равновесия Ле Шателье: Если на систему, находящуюся в равновесии, оказывается какое-либо воздействие, то система стремится противодействовать этому воздействию. Противодействуя изменению, система переходит из одного состояния равновесия в другое, соответствующее новым условиям. Это связано с тем, что внешнее воздействие в разной степени изменяет скорости двух взаимно противоположных процессов. Термодинамический анализ реакции Закон смещения химического равновесия Ле-Шателье указывает, как должна протекать химическая реакция при воздействии различных факторов, но не дает объяснение этому. Какова причина изменения состояния равновесия при изменении температуры? Для ответа на этот вопрос 60 следует выяснить, как изменяются с изменением температуры величины изобарно-изотермических потенциалов (свободной энергии Гиббса), энтальпии, энтропии. Рассмотрим влияние температуры на реакцию разложения триоксида серы SO3: 2SO3(г) <=> 2SO2(г) + O2(г). Эта реакция является эндотермической. Термодинамические параметры этой реакции при 298 К равны: ∆G = 2(–300,4) – 2(–370,4) = +140,0 кДж/2моль; ∆H = 2(–296,9) – 2(–395,2) = +196,6 кДж/2моль; S = 2(–248,5) + 205,0 – 2(256,2) = +189,6 Дж/К 2моль. Все расчёты приведены на 2 моля разложившегося триоксида серы. ∆G = –RTlnKравн. Вычисленные по данному уравнению константы равновесия при различных температурах для данной реакции приведены в таблице 2.2. Как видно из таблице 2.2, с повышением температуры величина изобарно-изотермического потенциала становится всё более отрицательной, а константа равновесия возрастает. Равнoвесие реакции должно всё более смещаться вправо. Приведённые данные позволяют вычислить энтальпию и энтропию реакции при соответствующей температуре. Величины энтальпии, энтропии и изобарно-изотермического потенциала связаны при заданной температуре выражением ∆G = ∆H – T∆S. Разделив левую и правую части данного уравнения на Т, получим соотношение ∆G/T = ∆H/T – ∆S. Построив график зависимости величины ∆G/T от 1/T, по величине тангенса угла наклона графика к оси абсцисс в каждой точке графика получим значение ∆Н при соответствующей температуре. Таблица 2.2 Значение величин ∆G и Kравн. реакции разложения SO3 при различных температурах 61 T, K ∆G , кДж на 2 моля SO 3 K равн . 298 140,0 2,82 .10 -25 400 120,7 1,78 .10 -16 500 101,5 2,51 .10 -11 600 82,1 1,94 .10 -8 700 63,6 1,82 .10 -5 800 44,4 1,29 .10 -3 900 27,7 0,0248 1000 11,1 0,264 1100 -5,9 1,89 1200 -23,0 10,0 1300 -40,2 40,8 1400 -57,0 132 Тангенс угла наклона в любой точке даёт энтальпию реакции в этой точке. Энтальпия диссоциации SO3 незначительно изменяется в интервале температур 298 – 1400 К. Среднее значение тангенса угла наклона графика даёт среднее значение энтальпии реакции +195 кДж. Экспериментальное значение энтальпии при 298 К равно 296,6 кДж. Поэтому можно считать, что энтальпия реакции при всех температурах постоянна. 62 Рис. 2.5. Приведенная функция Гиббса для реакции разложения SO3 на SO2 и O2 при различных температурах Рис. 2.6. Зависимость энтальпии, энтропии и изобарноизотермического потенциала реакции разложения SO3 от температуры Рассмотрим изменение энтальпии ∆Н и изобарно-изотермического потенциала ∆G реакции от температуры (рис. 2.6). Разность между этими величинами ∆H – ∆G в любой точке графика равна Т∆S. Если приближённо считать изменение ∆H и ∆G от температуры Т прямолиней63 ными, то ∆S также приближённо не зависит от температуры. Экстраполировав зависимости ∆H и ∆G в сторону низких температур, получим, что они пересекаются в точке абсолютного нуля. При 0 К выполняются соотношения T∆S = 0 и ∆H = ∆G. Что же происходит с реакцией разложения SO3 при нагревании? Как видно из уравнения реакции, при разложении 2 молекул SO3 происходит разрыв двух связей S-O и образование одной связи O-O. На это затрачивается 195 кДж тепла. Это очень большая величина, и можно пренебречь менее важными изменениями, происходящими в результате реакции, т.е энтропийный фактор полностью предотвратил бы разложение молекулы SO3. Расcмотрим действие второго энтропийного фактора химической реакции. Образование в качестве продуктов двух молекул SO2 и одной молекулы O2 приводит систему к большей неупорядоченности, чем 2 молекулы SO3. Молярные энтропии этих молекул достаточно близки: Молекула So, Дж/К•моль O2 SO2 205,03 248,5 SO 256,2 Это приводит к выводу, что решающим фактором реакции является изменение числа молекул в результате реакции, так как результирующее изменение энтропии равно ∆S = 2(248,5) + 205,03 – 2(256,2) = +189,6 Дж/К. Сама по себе энтропия, так же, как и энтальпия, не очень сильно зависит от температуры. Возрастание неупорядоченности в расчёте на один моль реакции при 298 К приблизительно совпадает с тем, что получается при 1400 К. Но влияние энтропийного фактора Т∆S при высоких температурах значительно сильнее, чем при низких, так как в него входит температура. И чем выше температура, тем более сильное влияние на реакцию оказывает возрастание неупорядоченности. Учёт влияния различных факторов на химическое равновесие позволяет выбрать наиболее оптимальные условия проведения того или иного процесса, получить максимальный выход продукта. Контрольные вопросы 64 1. Как определяется константа скорости химической реакции? Что означают химические символы в квадратных скобках? 2. В чем различие между порядком и молекулярностью химической реакции? 3. К реакциям какого типа неприменимо понятие молекулярности? 4. Как определить, что данная реакция является реакцией первого порядка? 5. Почему увеличение скорости движения молекул не является достаточно убедительным для объяснения резкого увеличения скорости химической реакции при нагревании? 6. Какой физический факт позволяет ввести понятие об энергии активации? 7. Как изменяется при постоянной температуре энтальпия реакции при изменении энергии активации прямой реакции? 8. Как можно изменить энергию активации? 9. Почему столкновения молекул не всегда приводят к взаимодействию, даже если молекулы обладают энергией активации? 10. Что представляет собой активированный комплекс? 11. Как влияют на протекание химических реакций большие положительные значения энтальпий активации и большие положительные энтропии активации? 12. Чем отличаются механизмы SN1 и SN2? Чем характеризуется активированный комплекс в каждом из этих механизмов? 13. Какой из двух механизмов: SN1 или SN2 – должен иметь большую энергию активации? 14. На каком основании можно утверждать, что реакция H2 + I2 = 2HI не является простой бимолекулярной реакцией? 15. Каков механизм реакций: SN1 или SN2 – более вероятен для реакций с участием октаэдрических комплексных ионов? 16. Каков отличительный признак сопряженной реакции? 17. Каков отличительный признак цепной реакции? 18. Какой советский ученый получил Нобелевскую премию за исследования в области цепных реакций? 19. Объясните принцип действия катализатора. Чем отличается ингибитор от катализатора? 20. Какова причина высокой скорости реакций, протекающих в растворах? 21. Какова причина высокой эффективности кислотного катализа? 22. Как влияет катализатор на константу равновесия? 65 23. На что указывает выражение для константы равновесия? 24. Как связана константа равновесия с величиной изобарноизотермического потенциала? 25. Почему многие химические реакции, разрешенные с точки зрения величины изобарно-изотермического потенциала, не протекают самопроизвольно? 26. Что означает выражение “селективность катализатора”? 27. Почему при производстве аммиака вместе с увеличением давления увеличивают и температуру, хотя эта реакция экзотермическая? 28. Какова основная причина использования катализаторов при производстве различных химических веществ? 29. Как катализатор влияет на энтальпию и энтропию реакции? 30. Какие основные факторы влияют на химическое равновесие? Задачи 1. Реакция 2NO + O2 = 2NO2 имеет первый порядок по давлению кислорода и второй порядок по давлению оксида азота. Запишите уравнение скорости этой реакции. 2. Реакция 2HCrO4- + 3HSO3- +5H+ →2Cr3+ +3SO42- +5H2O описывается следующим кинетическим уравнением: V = K[HCrO4-][HSO3-]2[H+]. Почему скорость этой реакции не пропорциональна числу ионов соответственно стехиометрическим коэффициентам уравнения реакции? 3. Вычислите энергию активации реакции, для которой повышение температуры от 20 до 30 оС увеличивает скорость в три раза. 4. Вычислите изменение величины изобарно-изотермического потенциала при стандартных условиях и константу равновесия реакции (при вычислениях используйте справочные данные): 2C6H6(г)→ 3CH4(г) + 9C(графит). 5. Для некоторой химической реакции при Р,Т = const установлено, что ∆Н = Т∆S. Находится ли данная система в равновесии? Почему для системы, находящейся в равновесии, величины ∆Н и ∆S не могут иметь разные знаки? 6. Известны значения констант равновесия для следующих реакций: K = 0,3; 2BaO2(т) → 2BaO(т) + O2(г), 66 K = 1.106. 4Al(т) +3O2(г) → 2Al2O3(т), Какие вещества – продукты или реагенты – преобладают в равновесной смеси? 7. Определите, в какую сторону сместится равновесие реакций Fe2O3(т) +3CO(г) --> 2Fe(т) + 3CO2(г); CO2(г) + H2(г) ---> CO(г) + H2O(г) при следующих воздействиях: добавлении диоксида углерода, нагревании, изменении давления (для ответа используйте справочные данные). 8. Температурный коэффициент скорости некоторой реакции равен 1,5. Во сколько раз увеличится скорость данной реакции при повышении температуры на 30° С? 9. Константа равновесия К реакции 2NO2 → N2O4 равна при некоторой температуре 0,25. Вычислите равновесные концентрации компонентов системы, если первоначальная концентрация NO2 равна 9,2 г/л. 10. При некоторой температуре состав равновесной смеси в объеме 10 л был следующий: 11,2 г CO, 14,2 г Cl2, 19,8 г СОCl2. Вычислите константу равновесия реакции: CO + Cl2 → COCl2 Дополнительная литература 1. Ахметов Н.С. Общая и неорганическая химия. М.: Высш. школа, 1989. С. 172. 2. Диккерсон Р., Грей Г., Хейт Дж. Основные законы химии. М:. Мир, 1982. С. 350-404. 3. Новиков Г.И. Основы общей химии. М.: Высш. школа, 1988. С. 103. 4. Угай Я.А. Общая химия. М.: Высш. школа, 1977. С. 140-165. 5. Карапетьянц М.Х. Введение в теорию химических процессов. М.: Высш. школа, 1975. С. 103. 6. Белоусов Б.П. Периодически действующая реакция и её механизм // Сб. рефератов по радиационной медицине за 1958 г. М.: Медицина, 1959. 7. Жаботинский А.М. Периодические колебательные реакции в жидкой фазе // ДАН 1964. Т. 157. №2. C. 392. 67 8. Стромберг А.Г., Семенченко Д.П. Физическая химия. М.: Высш. школа, 1988. С. 284, 427. 9. Спицын В.И., Мартыненко Л.И. Неорганическая химия. М.: Издво МГУ, 1991. С. 410-424. 68


