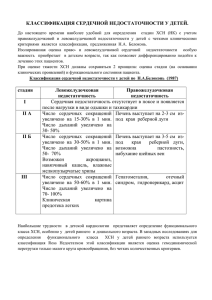
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ
advertisement

ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ Н.И. ПИРОГОВА» МИНЗДРАВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ На правах рукописи Пинчук Татьяна Витальевна Клинические и лабораторно-инструментальные эффекты терапии симвастатином у больных с хронической сердечной недостаточностью 14.01.05 - «кардиология» Диссертация на соискание ученой степени кандидата медицинских наук Научный руководитель: Доктор медицинских наук, профессор Федулаев Ю.Н. Москва-2014 СОДЕРЖАНИЕ Название раздела № п/п 1 1.1 Стр. Список сокращений 4 Введение 6 Использование статинов в комплексной терапии хронической сердечной недостаточности (литературный обзор) Синтезирование и дальнейшее изучение статинов. 13 13 Историческая справка 1.2 Механизм действия статинов 14 1.3 Иммунные механизмы воспаления при хронической 16 сердечной недостаточности 1.4 Противовоспалительные эффекты терапии статинами у 21 больных с сердечной недостаточностью 1.5 Гиполипидемические эффекты статинов у больных с 25 хронической сердечной недостаточностью 1.6 Антиишемическое действие статинов 27 1.7 Антиаритмический эффект статинов 29 Патофизиологическое обоснование применения 29 1.7.1 статинов при желудочковых нарушениях ритма 1.7.2 Клинические и экспериментальные подтверждения 31 эффективности статинов при желудочковых аритмиях 1.7.3 Патофизиологическое обоснование применения 32 статинов при предсердных аритмиях 1.7.4 Клинические и экспериментальные данные об 33 эффективности статинов при фибрилляции предсердий 1.8 Патофизиологические аспекты диастолической 34 сердечной недостаточности 1.9 1.10 Вариабельность сердечного ритма у больных с хронической систолической и диастолической сердечной недостаточностью Дисперсия интервала QT: методология оценки, 2 38 41 клиническая и прогностическая значимость 1.11 Альтернация Т-зубца: понятие, методология оценки, 43 патофизиологический смысл, клиническая значимость 1.12 Турбулентность сердечного ритма: понятие, патофизиологический смысл, прогностическая значимость Диастолическая сердечная недостаточность и статины: мало изученные патофизиологические, диагностические, лечебные и прогностические аспекты Материалы и методы исследования 45 2.1 Характеристика групп больных 50 2.2 Методы исследования 52 Результаты собственных исследований 56 3.1 Гиполипидемические эффекты терапии симвастатином 56 3.2 Динамика показателей глобальной сократимости левого 57 1.13 2 3 47 50 желудочка 3.3 Динамика показателей трансмитрального кровотока 57 3.4 Динамика качественных и количественных показателей 58 преходящей ишемии миокарда 3.5 Динамика корригированной дисперсии интервала QT 60 3.6 Динамика проявлений аритмического синдрома 61 3.7 Динамика количества пациентов с патологическими 61 значениями турбулентности сердечного ритма 3.8 Динамика показателей микроальтернации зубца Т 62 3.9 Динамика временных и спектральных показателей 63 вариабельности сердечного ритма 3.10 4 Динамика провоспалительных маркеров 64 Обсуждение полученных результатов 80 Выводы 89 Практические рекомендации 90 Список использованной литературы 91 3 СПИСОК СОКРАЩЕНИЙ HF – высокие частоты спектрального анализа LF – низкие частоты спектрального анализа LF/HF – соотношение низких и высоких частот PNN50 – процентное различие интервалов RR более чем на 50 мсек. QTdс – корригированная дисперсия интервала QT RMSSD – корень квадратный суммы разностей последовательных интервалов RR; SDNN – стандартное отклонение всех анализируемых RR интервалов; TWA - микроальтернации зубца Т АД – артериальное давление АКШ - аортокоронарного шунтирования АЛТ – аланинаминотрансфераза АСТ – аспартатаминотрансфераза ВКС – внезапная коронарная смерть ВСР – вариабельность сердечного ритма ГБ – гипертоническая болезнь ДКМП - дилятационная кардиомиопатия ЖА – желудочковые аритмии ЖЭ – желудочковые экстрасистолы ИЛ – интерлейкин ИММлж – индекс массы миокарда левого желудочка Е -максимальная скорость кровотока в фазу быстрого наполнения А - максимальная скорость кровотока в систолу предсердия Е/А - отношение максимальных скоростей раннего и позднего наполнения. IVRT - время изоволюмического расслабления левого желудочка DT - время замедления раннего диастолического наполнения ОКС – острый коронарный синдром КДР – конечный диастолический размер левого желудочка КМЦ – кардиомиоциты 4 КФК – креатинфосфокиназа ЛДГ – лактатдегидрогеназа ЛЖ – левый желудочек ЧССИМ – минимальная ЧСС, индуцирующая ишемию миокарда ОИМ – острый инфаркт миокарда ОХ – общий холестерин П↓ST – площадь депрессии сегмента ST СМ ЭКГ – суточное мониторирование электрокардиограммы СРБ – С-реактивный белок СЭ – суправентрикулярные экстрасистолы ТS - Turbulence slope ТО - Turbulence onset ТГ – триглицериды Тзслж – толщина задней стенки левого желудочка Тмжп – толщина межжелудочковой перегородки ТСР – турбулентность сердечного ритма ФАТ - фактор активации тромбоцитов ФВ – фракция выброса левого желудочка ФК - функциональных класс ФНО-a - фактор некроза опухоли a ФП – фибрилляция предсердий ХС ЛПВП - холестерин липопротеидов высокой плотности ХС ЛПНП – холестерин липопротеидов низкой плотности ХСН – хроническая сердечная недостаточность ЧСС – частота сердечных сокращений ЩФ – щелочная фосфотаза ЭКГ – электрокардиография 5 ВВЕДЕНИЕ Актуальность проблемы. Хроническая сердечная недостаточность (ХСН) представляет многокомпонентным собой сложный патогенезом, клинический синдром формирующийся в с результате повреждения миокарда различной этиологии в результате разнообразных заболеваний сердечно-сосудистой системы, приводящих, как правило, к прогрессирующей систолической и/или диастолической дисфункции ЛЖ и дисбалансу между гемодинамической потребностью организма и возможностями сердца, хронической гиперактивации нейрогуморальных систем [13]. ХСН является исходом многих сердечно-сосудистых заболеваний как воспалительной, так и невоспалительной природы и в большинстве случаев приводит к стойкой инвалидизации больных, существенному ограничению их физической и социальной активности и уменьшению продолжительности жизни населения [4]. В настоящее время самой частой причиной развития хронической сердечной недостаточности (ХСН) и основным поводом для госпитализации по поводу декомпенсации ХСН является диастолическая дисфункция миокарда левого желудочка (ЛЖ) [36]. Согласно эпидемиологическим данным, за последние 20 лет число пациентов с симптомами ХСН, сохраненной сократительной способностью ЛЖ и нарушением его диастолической функции увеличилось с 38% до 54% [56]. В России, согласно результатам исследования ЭПОХА-О-ХСН, 56,8% больных с симптомной ХСН имеют нормальную сократимость миокарда (фракция выброса ЛЖ > 50%), и число таких пациентов постоянно увеличивается [18, 35]. В то же время известно, что прогноз при диастолической систолической ХСН столь же недостаточности неблагоприятен, кровообращения, как и при а частота госпитализаций в связи с декомпенсацией при ХСН с сохраненной фракцией выброса (ФВ) ЛЖ даже несколько выше [101]. 6 Несмотря на значительную распространенность, специфических методов лечения пациентов с диастолической ХСН не существует. Современные рекомендации имеют «симптоматический» характер, то есть предполагается, что эффективная медикаментозная терапия артериальной гипертонии (АГ), сахарного диабета, ишемической болезни сердца (ИБС) может обеспечить предупреждение или регресс симптомов ХСН [21]. Известно, что одним из обязательных компонентов терапии больных с АГ, ИБС, сахарным диабетом являются статины. Данные по их эффективности противоречивы и требуют систематически исключались уточнения, из и безопасности поскольку большинства при ХСН больные ХСН крупномасштабных исследований со статинами [151]. Связано это с неоднозначностью данных об ассоциативных взаимосвязях между уровнем ХС и ХСН. Фрамингемское исследование показало, что дислипидемия служит фактором риска развития ХСН [62], что подтверждается данными и других исследований. Однако при детальном анализе результатов Фрамингемского исследования была выявлена положительная корреляционная взаимосвязь между уровнем ХС и общей смертностью у больных до 40 лет, незначимая — у пациентов в 50–70-летнем возрасте и отрицательная — у больных 80 лет и старше [70]. В ряде исследований было отмечено, что у больных ХСН, в отличие от больных ишемической болезнью сердца (ИБС), высокий уровень ХС ассоциируется с более благоприятным течением заболевания [129]. Традиционная взаимосвязь между высоким уровнем ХС и повышением заболеваемости и смертности не обнаруживается у пожилых пациентов с тяжелыми острыми и хроническими заболеваниями. Выявлена обратная корреляционная взаимосвязь между уровнем ХС и внутрибольничной смертностью среди пациентов с инфекционными заболеваниями и острыми воспалительными процессами, сопровождающимися кахексией [119]. 7 Статины могут позитивно влиять на течение сердечной недостаточности не только и не столько за счет липидснижающего действия, но благодаря противовоспалительным, их известным плейотропным антифибротическим [24, эффектам: 107, 143], антигипертрофичским [64], антиоксидантным, вазопротективным [151] и другим. Поскольку большинство этих факторов играет важную роль в патогенезе сердечной недостаточности, можно предполагать, что применение статинов в дополнение к стандартной терапии ХСН может оказывать позитивное влияние не только на липидный спектр, но и на основные показатели структурно-функционального состояния миокарда у пациентов с сохраненной сократительной способностью ЛЖ. Цель исследования: Оценка клинических особенностей течения, лабораторных, инструментальных и прогностических критериев на фоне шестимесячной терапии симвастатином у больных с диастолической сердечной недостаточностью ишемического генеза. Задачи исследования: 1. Провести качественную и количественную оценку гиполипидемических и побочных эффектов терапии симвастатином. 2. Оценить динамику показателей глобальной сократимости миокарда левого желудочка и индекса массы миокарда левого желудочка на фоне терапии симвастатином, а также оценить динамику показателей трансмитрального кровотока на фоне шестимесячной терапии симвастатином в зависимости от типа диастолической сердечной недостаточности. 3. Провести динамическую оценку качественных и количественных показателей преходящей ишемии миокарда, проишемического маркера – корригированной дисперсии интервала QT, а также оценить динамику количества наджелудочковых проаритмогенных микроальтернации маркеров: зубца и желудочковых турбулентности Т на 8 фоне экстрасистол, сердечного шестимесячной ритма и терапии симвастатином в зависимости от типа диастолической сердечной недостаточности. 4. Провести динамическую оценку временных и спектральных показателей сердечного ритма на фоне шестимесячной терапии симвастатином в зависимости от типа диастолической сердечной недостаточности. 5. Оценить динамику провоспалительных маркеров на фоне шестимесячной терапии симвастатином в зависимости от типа диастолической сердечной недостаточности. 6. Провести внутригрупповое корреляционное сопоставление отдельных изучаемых показателей в зависимости от типа диастолической сердечной недостаточности. Научная новизна исследования. Впервые проведена комплексная динамическая клинико-лабораторная и инструментальная оценка допплеровских показателей трансмитрального кровотока, качественных и количественных показателей преходящей ишемии миокарда и проишемических маркеров с использованием 12-канальной холтеровской регистрации, аритмического синдрома и проаритмогенных показателей, временных и спектральных показателей вариабельности сердечного ритма, провоспалительных маркеров в зависимости от типа диастолической сердечной недостаточности на фоне шестимесячной терапии симвастатином у больных ИБС и ГБ с сохраненной фракцией выброса ЛЖ. Проведено корреляционное сопоставление отдельных лабораторных и инструментальных показателей у больных с различными типами диастолической сердечной недостаточности. Показано, что на фоне терапии симвастатином достоверно улучшились амплитудные и временные показатели трансмитрального кровотока, ишемические маркеры, аритмические и проаритмогенные показатели исключительно у пациентов с диастолической дисфункцией ЛЖ в виде нарушенной релаксации. В структуре ишемических 9 показателей максимальной информативностью обладает площадь смещения сегмента ST, оцененная по результатам 12-ти канальной холтеровской регистрации. Достоверная положительная динамика временных показателей вариабельности сердечного ритма (ВСР) на фоне терапии симвастатином отмечена у пациентов с различными типами диастолической дисфункцией левого желудочка в равной степени исключительно за счет парасимпатической составляющей. симвастатина Достоверные отмечены у противовоспалительные пациентов с эффекты различными типами диастолической дисфункции ЛЖ в равной степени с максимальной информативностью лабораторной динамики по показателям С- реактивного белка и интерлейкина – 6. Практическая значимость лабораторно-инструментальных работы. маркеров, Определен несущих перечень максимальную информацию об эффективности симвастатина у больных ИБС и ГБ с сохраненной фракцией выброса. Так у пациентов с диастолической сердечной недостаточности в виде нарушенной релаксации, кроме характеристик амплитудного соотношения пиков трансмитрального кровотока, максимальная достоверная положительная динамика отмечена по следующим показателям: суточная продолжительность ишемии миокарда, площадь смещения сегмента ST, количество эпизодов ишемии миокарда, количество экстрасистол, ритма, маркеры суправентрикулярных патологические микроальтернация вариабельности значения зубца Т, сердечного и желудочковых турбулентности сердечного парасимпатические временные ритма, С-реактивный белок, интерлейкин-6. А у пациентов с диастолической дисфункцией левого желудочка в виде псевдонормализации трансмитрального кровотока наиболее достоверными характеристиками эффективности симвастатина оказались: площадь смещения сегмента ST, патологические значения турбулентности сердечного ритма 10 и микроальтернации зубца Т, парасимпатические временные маркеры вариабельности сердечного ритма, С-реактивный белок, интерлейкин-6. Основные положения, выносимые на защиту. 1. Комбинированная терапия с использованием симвастатина у больных с I типом диастолической сердечной недостаточности по большинству изучаемых показателей трансмитрального кровотока была более эффективной в отличие от терапии пациентов со II типом диастолической сердечной недостаточности и от терапии пациентов, которые статины не получали. 2. Использование симвастатина в дозе 20 мг/сутки в течение 6 месяцев в комплексной терапии диастолической сердечной недостаточности привело к достоверному уменьшению суточной продолжительности ишемии миокарда, площади смещения сегмента ST, количества эпизодов ишемии миокарда, количества суправентрикулярных и желудочковых экстрасистол, в основном, у больных с I типом диастолической сердечной недостаточности. 3. Включение симвастатина в комплексную терапию диастолической сердечной недостаточности привело к положительному влиянию на проаритмогенные маркеры: турбулентность сердечного ритма и микроальтернация зубца Т, а также на парасимпатическую составляющую вариабельности сердечного ритма у пациентов с I и II типом диастолической сердечной недостаточности. 4. Корригированная дисперсия интервала QT оказалась недостаточно информативным маркером эффективности терапии симвастатином у больных с изолированной диастолической сердечной недостаточностью. 5. Повышенный исходный уровень СРБ, ИЛ-6, ФНОα характерен для I и II типа диастолической сердечной недостаточности и достоверно не различается в зависимости от типа недостаточности. 11 диастолической сердечной 6.Включение в комплексную терапию симвастатина в дозе 20 мг/сутки в течение 6 месяцев у больных с I и II типами диастолической сердечной недостаточности привело к достоверному снижению СРБ и ИЛ-6, а также ХС ЛПНП в равной степени вне зависимости от типа диастолической сердечной недостаточности. Внедрение в практику. Результаты исследований внедрены в клиническую практику терапевтического и кардиологических отделений ГКБ №13 г. Москвы и используются в процессе обучения студентов на кафедре факультетской терапии педиатрического факультета ГБОУ ВПО «РНИМУ им. Н.И. Пирогова» Минздрава РФ. Апробация работы и публикации. Апробация диссертации состоялась 4 сентября 2013 года на совместной конференции сотрудников кафедры факультетской терапии педиатрического факультета ГБОУ ВПО «РНИМУ им. Н.И. Пирогова» Минздрава РФ и сотрудников городской клинической больницы №13 Департамента здравоохранения г. Москвы (протокол №2). Отдельные положения диссертационной работы доложены на съезде Российского научного медицинского общества терапевтов в 2010 году и Конференции молодых ученых Юго-Восточного административного округа г. Москвы в 2012 году. По теме диссертации опубликовано 4 научные работы, из них - 3 статьи в рецензируемых журналах, рекомендованых ВАК РФ. Структура и объем диссертации. Диссертация изложена на 107 страницах компьютерного текста и состоит из введения, обзора литературы, описания материалов и методов исследования, главы собственных результатов, их обсуждения, выводов, практических рекомендаций, списка литературы. Диссертация иллюстрирована 2-мя клиническими литературы примерами, включает в 15 себя таблицами 159 отечественных и 104 зарубежных. 12 и 1рисунком. источников, из Список которых 55 ГЛАВА 1 Использование статинов в комплексной терапии хронической сердечной недостаточности (Литературный обзор) 1.1 Синтезирование и дальнейшее изучение статинов. Историческая справка В 1971 году японские ученые Акиро Эндо и Масао Курода начал интенсивный поиск микробных агентов, способных блокировать биосинтез холестерина (ХС). Было протестировано более 6000 образцов и, наконец, из плесневого грибка Pythiumultimum был получен антибиотик цитринин, способный снижать уровень ХС in vitro. В 1976 году Акиро Эндо выделил из штамма Penicillium молекулу вещества, ингибирующего ключевой фермент в синтезе ХС — ГМГ-КоА-редуктазу — и назвал его компактином. Так появился первый представитель статинов — мевастатин. Были получены доказательства эффективного снижения им уровня ХС у животных и людей с наследственной гиперхолестеринемией [78]. В 1978 году сотрудники компании Merck Sharp & Dohme выделили из грибка Aspergillisterreus субстрат, обладающий эффектом ингибитора ГМГ-КоА-редуктазы, названный ловастатином. В дальнейшем были созданы правастатин и симвастатин. В 90-х годах прошлого века был синтезирован аторвастатин [79]. В связи с 30-летием создания японским исследователем первого статина два лауреата Нобелевской премии в области биохимии атеросклероза M.S. Brawn и J. Goldstein (2004), отметив выдающийся вклад Акиро Эндо в медицину, назвали отца статинов открывателем “пенициллина” для холестерина. С конца 80-х годов прошлого столетия ингибиторы ГМГКоА-редуктазы интенсивно испытывались в контролируемых клинических исследованиях. В настоящее время терапия cтатинами является неотъемлемым компонентом в первичной и вторичной профилактике коронарной болезни сердца атеросклеротического генеза, а 13 для ряда больных, например перенесших острый инфаркт миокарда (ОИМ) или операцию аортокоронарного шунтирования (АКШ), — обязательным стандартом. Статины различают по способу их получения: так, симвастатин, ловастатин и правастатин являются природно–синтезированными соединениями, получаемыми из продуктов жизнедеятельности некоторых видов грибов, в то время как флувастатин, аторвастатин и розувастатин являются синтезированными препаратами. В России зарегистрированы статины: симвастатин, ловастатин, правастатин, флувастатин, аторвастатин и розувастатин. Общепринятой классификации хронологическом статинов нет, порядке, обычно согласно статины их указывают появлению. в Можно классифицировать статины по гидрофильности, по их метаболизму системой цитохрома Р450, по силе гиполипидемического действия. Особенностью статинов нового поколения (аторвастатин, розувастатин) является то, что они способны снижать уровень ХС у больных с резистентностью к другим гиполипидемическим средствам. Эти препараты оказывают более выраженный гиполипидемический эффект по сравнению с другими статинами. Кроме того, эффективность аторвастатина и розувастатина связывают с тем, что они значительно снижают уровень ТГ и лучше повышают уровень ЛПВП [25]. 1.2 Механизм действия статинов Статины являются ингибиторами ГМГ–КоА–редуктазы, фермента, определяющего скорость синтеза ХС на раннем этапе превращения гидроксиметил–глутарил коэнзима–А в мевалоновую кислоту. В результате развивающегося относительного дефицита внутриклеточного холестерина печеночная клетка увеличивает количество апоВ–Е рецепторов на своей мембране, которые связывают ХС ЛПНП и снижают его концентрацию в крови и выводят из системной циркуляции [79]. В итоге липидный профиль плазмы изменяется следующим образом: 14 снижается содержание общего холестерина, ЛПНП, ТГ, повышается содержание антиатерогенных ЛПВП [86]. Кроме прямых гиполипидемических эффектов статины обладают рядом терапевтических свойств, не связанных напрямую с основным действием [31,69,79,87,157]. К наиболее значимым нелипидным эффектам статинов относится влияние на функцию эндотелия, характеризующееся повышением экспрессии и активности эндотелиальной NO-синтетазы, усилением синтеза оксида азота (NO) и снижением синтеза мощнейшего вазоконстриктора – эндотелина - 1 [80,83,106]. Антиоксидантный эффект проявляется повышением устойчивости к процессам перекисного окисления [71,125]. Противовоспалительный эффект определяется снижением адгезии лейкоцитов и эндотелиальных клеток, продукцией провоспалительных цитокинов, экспрессии молекул комплекса гистосовместимости класса II [7,30,43,44,62,94,130]. В основе эффектов, определяющих стабильность атеросклеротической бляшки, лежат: снижение миграции и пролиферации гладкомышечных клеток с некоторым усилением в них апоптоза; снижение пролиферации и миграции макрофагов; подавление экспрессии и секреции металлопротеаз макрофагами [5,48]. Антитромботические эффекты связаны с предупреждением активации тромбоцитов и экспрессии макрофагами тканевых факторов, ослаблением экспрессии гладкомышечными и эндотелиальными клетками ингибитора активатора плазминогена – 1, усилением экспрессии эндотелиальными клетками тканевого активатора плазминогена [81]. Антиангиогенный эффект связан с подавлением миграции эндотелиоцитов, экспрессией сосудистых факторов роста и снижением сосудистой экспрессии металлопротеиназ [110,117]. Проангиогенный эффект зависит от уровня стимуляции развития предшественников – эндотелиоцитов [68]. Кардиопротективный эффект связан уменьшением с зоны предупреждением некроза при гипертрофии инфаркте кардиомиоцитов, миокарда. Важным нелипидным эффектом статинов целесообразно считать повышение 15 чувствительности тканей к инсулину, нарушение которой лежит в основе развития сахарного диабета 2 типа [58, 67,70,75, 137]. 1.3 Иммунные механизмы воспаления при хронической сердечной недостаточности Причастность иммунной сердечной недостаточности системы (ХСН) к патогенезу хронической лишь на первый взгляд может показаться странной: хорошо известно, что иммунная защита организма "срабатывает" не только при инфекционных агрессиях, но реагирует также на любое стрессовое воздействие, в том числе ишемию, гемодинамическую воздействия, перегрузку, которые недостаточности [13, интоксикацию являются 50]. причиной Существует и т.д., т.е. развития несколько на те сердечной взаимосвязанных компонентов иммунной системы, которые могут быть задействованы в патогенезе ХСН, и главные из них - провоспалительные цитокины, молекулы адгезии, аутоантитела, оксид азота и эндотелин-1 [13]. Все большее внимание в иммунологических исследованиях при сердечной недостаточности в последнее время уделяется хемокинам (белкам, индуцирующим миграцию моноцитов в миокарде), а также иным молекулярным образованиям (неоптерин, шоковые белки, компоненты оксидативного стресса), роль которых в процессе формирования синдрома ХСН пока окончательно не определена[13] . Провоспалительные цитокины являются наиболее важным и хорошо изученным классом биологически активных веществ, оказывающих иммунное и/или воспалительное действие и имеющих отношение к сердечной недостаточности. К основным провоспалительным цитокинам относятся фактор некроза опухоли a (ФНО-a), интерлейкин 1 (ИЛ-1) и ИЛ-6. Наиболее "важный" для развития ХСН цитокин - фактор некроза опухоли ФНО-a был открыт в сыворотке больных со злокачественными новообразованиями еще в 1975 как низкомолекулярное белковое вещество, обусловливающее распад опухоли. Десятилетием позже было 16 доказано участие этого медиатора в молекулярных механизмах развития кахексии, в том числе и при сердечных заболеваниях [59]. Однако прямая связь ФНО-a с синдромом сердечной недостаточности была установлена лишь 10 лет назад: в 1990 г. Levine и соавт. [150] впервые показали, что уровень ФНО-a в сыворотке больных с тяжелой сердечной недостаточностью (III-IV функциональный класс NYHA) на порядок выше, чем у здоровых лиц: 115+25 U/ml против 9+3 U/ml соответственно. Причем повышение активности ФНО-a было более выраженным (> 39 U/ml) у пациентов с более тяжелыми клиническими проявлениями декомпенсации, большей степенью кахексии (массой тела 82% от идеального) и повышенной активностью РААС. В последующих работах неоднократно подтверждалась тесная корреляционная связь уровня ФНОa, ИЛ-1b и ИЛ-6 с тяжестью клинических проявлений [146, 147] и активностью нейрогуморального фона больных ХСН [107, 129]. Механизм реализации гемодинамического и клинического влияния провоспалительных цитокинов при сердечной недостаточности является предметом специальных исследований. На сегодняшний день, очевидно, что это влияние складывается по крайней мере из четырех ключевых составляющих [37]: ремоделирования 1) сердца отрицательного инотропного действия; 2) дилатация полостей и (необратимая гипертрофия кардиомиоцитов (КМЦ); 3) нарушения эндотелий-зависимой дилатации артериол; 4) усиления процесса апоптоза кардиомиоцитов (КМЦ) и клеток периферической мускулатуры. Логично предположить, что отрицательное инотропное действие цитокинов может лежать в основе таких характерных гемодинамических признаков ХСН, как низкий сердечный выброс и высокое внутрисердечное давление, а в сочетании с нарушением регуляции тонуса периферических артериол - быть причиной гипотонии, свойственной поздним стадиям компенсаторного сердечной механизма, недостаточности. каким 17 является Утрата важного эндотелий-зависимая релаксация артериол [149] в периферической мускулатуре, может обусловливать появление таких клинических симптомов ХСН, как снижение толерантности к физическим нагрузкам и уменьшение силы и выносливости скелетной мускулатуры. Но, пожалуй, наиболее важными для формирования синдрома ХСН являются "долговременные" эффекты провоспалительных разрушением цитокинов, внеклеточного проявляющиеся коллагенового постепенным матрикса миокарда, дилатацией желудочков и гипертрофией КМЦ. Как было показано в ряде исследований, данные изменения, лежащие в основе феномена ремоделирования сердца, носят необратимый характер [64] и наряду с цитокин-индуцированным усилением апоптоза КМЦ способствуют возникновению и прогрессированию ХСН и ухудшению прогноза этих больных. Существуют данные, свидетельствующие о том, что высокая концентрация растворимой формы рецептора ФНО-a (pФНО-a-P) является наиболее независимым предиктором неблагоприятного прогноза больных ХСН, превосходящим по своей точности и специфичности все другие прогностические маркеры, даже такие признанные, как фракция выброса, функциональный класс ХСН и потребление кислорода на максимуме нагрузки (VO2max) [127]. Факт патогенетической взаимосвязи сердечной недостаточности и повышенной экспрессии цитокинов в настоящее время уже ни у кого не вызывает сомнений. Основная дискуссия ведется вокруг вопроса о причинно-следственном характере этой связи. Усиление застоя и нарастающая гипоксия периферических тканей и самого миокарда, свойственные сердечной недостаточности, вполне могут стать первопричиной активации иммунной системы и приводить к росту ФНО-a и других провоспалительных цитокинов. Такая "последовательность" событий косвенно зависимостью уровня подтверждается ФНО-a от прямопропорциональной тяжести ХСН: чем выше функциональный класс ХСН, тем более выражена реакция иммунной 18 системы и выше уровень цитокинов. И наоборот: уменьшение степени гипоксии понижает активность иммунного ответа [90]. Однако большинство исследователей отводят экспрессии провоспалительных цитокинов не подчиненную роль, а ставят ее в ряд первопричин развития и прогрессирования ХСН [146]. Косвенным подтверждением этой теории являются положительные результаты применения препаратов, способных снижать синтез цитокинов и улучшать при этом клиническое течение ХСН [147]. Прямые же доказательства ведущей роли цитокинов в патогенезе ХСН получены в классической экспериментальной работе Bozkurt и соавт., в которой длительная инфузия ФНО-a приводит не только к снижению сократимости миокарда, но и к необратимой дилатации желудочков сердца крыс [64]. Причем существуют данные, что умеренная экспрессия ФНО-a в миокарде мышей и человека, сочетающаяся с классическими клиническими и морфологическими признаками дилятационной кардиомиопатии (ДКМП), сопровождается минимальными воспалительными изменениями сердечной мышцы [147]. Последний факт подчеркивает независимую (от воспаления) роль цитокинов в патогенезе ХСН, но вызывает вопрос об их источнике у больных с недостаточностью кровообращения [60]. Основная причина активации иммунитета у больных ХСН при отсутствии воспаления остается не ясной. Существуют три гипотезы, объясняющие причины и механизм повышения уровня цитокинов (и ФНО-a как ведущего из них) при сердечной недостаточности. Самой популярной является гипотеза миокардиальной продукции цитокинов. Известно, что здоровое сердце не "производит" показывают, цитокинов. что КМЦ Однако способны экспериментальные продуцировать исследования ФНО-a, причем количество "производимого" цитокина находится в прямой зависимости от степени напряжения стенки миокарда ("диастолического стресса") и тем больше, чем выше уровень конечно-диастолического давления в левом желудочке [88]. Эта закономерность 19 касается и других биологически активных веществ, таких как фактор роста или шоковые белки. Гипотеза миокардиальной терапевтическую эффективность продукции препаратов, цитокинов объясняет способных уменьшать диастолическое напряжение миокарда у больных ХСН: сердечных гликозидов, диуретиков, вазодилататоров, ИАПФ. Однако, эта гипотеза не объясняет применяются эффективности при ХСН, но тех не средств, обладают которые с свойством успехом устранять диастолический стресс, например, бета-адреноблокаторов. Кроме того, трудно представить, что количество одних только "миокардиальных" цитокинов будет достаточно для системных изменений в периферических тканях и мускулатуре (потеря массы, похудание), характерных для поздних стадий ХСН. Поэтому согласно другой гипотезе важнейший источник провоспалительных цитокинов при сердечной недостаточности - периферические ткани и скелетная мускулатура. Вторая гипотеза экстрамиокардиальная продукция цитокинов стимулируется тканевой гипоксией и избытком свободных радикалов, возникающим вслед за повреждением миокарда и падением сердечного выброса [56]. Избыток цитокинов в свою очередь нарушает механизм эндотелий-зависимой релаксации периферических сосудов [37] и в еще большей степени способствует усилению тканевой гипоксии и нарушению окислительных процессов: так замыкается очередной "порочный" круг патогенеза ХСН. Согласно третьей гипотезе причиной повышения уровня цитокинов у больных ХСН являются бактериальные эндотоксины, проникновение которых в организм осуществляется через отечную стенку кишечника. Венозный застой в кишечнике, неизбежный при повреждении миокарда и падении сердечного выброса, способствует повышению проницаемости стенки для бактерий и/или их токсинов, которые, проникая в кровоток и взаимодействуя с CD14-рецептором иммунокомпетентных клеток, запускают синтез ФНО-a и других цитокинов [60]. Эта оригинальная гипотеза, впервые высказанная Anker и соавт. [60], имеет немало веских 20 доказательств. Так, например, было показано, что моноциты больных ХСН, как правило, демонстрируют повышенную чувствительность к липополисахаридам, входящим в состав клеточной мембраны бактерий [94]. У больных ХСН концентрация эндотоксина в плазме тем выше, чем более выражен отек кишечной стенки [150], причем применение диуретиков снижает уровень как эндотоксина, так и ФНО-a [150]. "Кишечное" происхождение эндотоксина у больных ХСН подтверждается тем фактом, что его концентрация в печеночных венах достоверно выше, чем в левом желудочке или легочных венах [129]. Тем не менее в рамки этой эндотоксиновой гипотезы не укладывается тот факт, что повышение уровня цитокинов отмечается у больных ХСН уже на ранних стадиях заболевания, когда застойные явления на периферии (в кишечнике) еще не так выражены цитокинов [147]. практически недостаточностью, Повышение отсутствует развившейся на уровня у провоспалительных больных почве легочной с сердечной гипертензии, констриктивного перикардита или диастолической дисфункции [88]. 1.4 Противовоспалительные эффекты терапии статинами у больных с сердечной недостаточностью Противовоспалительные свойства этих препаратов обусловлены как липидными, так и нелипидными механизмами их действия: 1. Снижение высвобождения NO из эндотелиальных клеток ассоциируется с повышением адгезии ряда молекул, находящихся на их поверхности, например Р-селектина и ICAM-1 — интрацеллюлярной молекулы-1 адгезии [91]. В эксперименте повышение адгезии лейкоцитэндотелиальных клеток можно вызвать длительным системным назначением окисленных ЛПНП, что наблюдается, например, при гиперхолестеринемии [90]. Молекулы адгезии — это белки, расположенные на поверхности различных, в том числе эндотелиальных, клеток. Благодаря им осуществляются межклеточные взаимодействия и продвижение клеток под эндотелий [97]. Известны три вида адгезивных 21 молекул — интегрины, селектины и надсемейство Ig. Место локализации интегринов — клеточная мембрана лейкоцитов; E- и P-селектинов, Ig VCAM, ICAM и PECAM-Е- и Р-селектинов — эндотелиоциты. При хронической сердечной недостаточности (ХСН) содержание адгезивных молекул существенно повышается [90], в частности, растворимых в крови sVCAM, sICАM-1, SP- и sE-селектинов, что приводит к более легкой миграции лейкоцитов через эндотелий и инфильтрации сосудов нейтрофилами/макрофагами. В эксперименте было установлено, что флувастатин, не оказывая существенного влияния на уровень липидов, может ослаблять действие таких стимулов воспаления, как лейкотриен В4 и фактор активации тромбоцитов (ФАТ) [97]. Липиднезависимый противовоспалительный эффект подтвержден в эксперименте R.Scalia et al., A.M. Lefer et al. [136] при использовании симвастатина и церивастатина, действие которых (по отношению к адгезивной способности моноцитов к эндотелию) осуществлялось иным путем — как посредством угнетения актин-обусловленной полимеризации мембран, так и воздействием на интегрин-адгезирующие молекулы (в физиологических условиях) СD 11а, СD 18 и VLA-4 [91]. 2. Aнтивоспалительные эффекты статинов обусловлены и совершенно иными механизмами их действия. Вторым по изученности (не исключено, что и по перспективе практического использования) является установленный факт снижения рядом статинов продукции провоспалительных цитокинов, обладающих свойством подавления продукции сосудами eNOS. Не вдаваясь в подробности огромного количества данных по этому вопросу, полученных в эксперименте, отметим, что еще в 1999 г. U. Ikeda et al. установили, что флувастатин и симвастатин (но не правастатин) существенно ингибировали ангиотензин 2-индуцированную секрецию интерлейкина-6 (ИЛ-6) в культуре клеток ГМК человека. Это сопровождалось снижением уровня С-реактивного белка — важного маркера воспаления. На модели асептического 22 воспаления, вызываемого инъекцией экстракта из ирландского мха (carrageenan), было показано, что профилактический пероральный прием симвастатина (за 1 час до инъекции) уменьшает выраженность отека на 48% [143]. Эффект был получен у мышей, не имевших изменений липидного спектра крови. 3. На сегодняшний день четко установлена тесная связь между уровнем такого «классического» острофазного белка воспаления, как СРБ, и риском возникновения наиболее грозных сердечно-сосудистых заболеваний у здоровых людей, например острого инфаркта миокарда, и их осложнений [130]. Другими словами, чем выше уровень СРБ в плазме крови пациента (или обследуемого здорового человека), тем выше частота осложнений атеросклероза и смертность от них или шанс их возникновения у здоровых людей. Причина проста: высокий уровень СРБ приводит к существенному повышению содержания цитокинов в эндотелиальных клетках и повышению адгезивности ряда молекул, расположенных на их поверхности [120, 121]. Кстати, показано, что симвастатин (но не традиционный противовоспалительный препарат аспирин) оказывает благоприятное действие по снижению провоспалительного эффекта СРБ [121]. 4. Статины могут оказывать свое противовоспалительное действие посредством иммуномодулирующего механизма. Теоретическим обоснованием является факт снижения (in vitro) цитотоксического влияния Т-лимфоцитов при совместном применении правастатина и циклоспорина за счет синергизма, а также степени выраженности гистопатологического действия ряда молекул, например МНС-II, что достигается подавлением активности опосредованного влияния интерферона-гамма [99]. Рядом исследований (CARE и др.) было показано, что многие статины способны снижать содержание в плазме крови СРБ независимо от уровня холестерина [130]. Заметим, что именно статины (например, 23 симвастатин), но не традиционные противовоспалительные препараты (тот же аспирин) вызывают противовоспалительный эффект [121]. В результате ретроспективного анализа крупного шотландского исследования WOSCOРS (1998) установлено, что в двух сопоставимых по конечному уровню холестерина (от 140 до 180 мг/дл, или 3,62—4,65 ммоль/л) группах — плацебо и у лиц, получавших правастатин, риск сердечно-сосудистых событий был совершенно разный: у больных, леченных правастатином, он оказался на 36% ниже, чем в группе плацебо, имевшей нормальный уровень ОХС [131]. Из результатов исследований, проведенных ранее in vivo [130], известно, что некоторые статины могут оказывать антивоспалительное действие посредством снижения плазменного СРБ. К настоящему времени сложилось мнение, что уровень СРБ может служить прогностическим критерием эффективности терапии статинами в плане первичной профилактики неблагоприятных коронарных событий у лиц с системным воспалением, но без существенно выраженной гиперлипидемии [120]. Более того, в масштабном исследовании CАRE [130] показано, что наиболее выраженный успех в предупреждении эпизодов неблагоприятных коронарных событий при использовании правастатина у постинфарктных пациентов, находящихся в стабильном состоянии, достигнут в подгруппе с исходно высоким уровнем СРБ независимо от исходного уровня ОХС, триглицеридов (ТГ), ХС ЛПНП и ХС ЛПВП. Спустя 3 года [154] было установлено, что и у пациентов со стенозирующим имплантированными атеросклерозом стентами риск коронарных развития сосудов с сердечно-сосудистых осложнений под влиянием терапии статинами наиболее убедительно снижался в случаях с исходно высоким уровнем СРБ. 24 1.5 Гиполипидемические эффекты статинов у больных с хронической сердечной недостаточностью Гиперхолестеринемия относится к общеизвестным факторам риска развития ИБС, а также заболеваемости и смертности от сердечно сосудистой патологии. Однако традиционная взаимосвязь между высоким уровнем холестерина и повышением заболеваемости и смертности не обнаруживается хроническими у пожилых заболеваниями. Более взаимосвязь между корреляционная внутрибольничной заболеваниями пациентов смертностью и сопровождающимися тяжелыми того, с 118, 154, и обратная холестерина и инфекционными воспалительными [93, острыми выявлена уровнем пациентов острыми кахексией с 134]. процессами, По данным Фрамингемского исследования, дислипидемия является фактором риска развития ХСН [133], что подтверждается данными и других исследований [158]. Однако при детальном анализе результатов Фрамингемского исследования была выявлена положительная корреляционная взаимосвязь между уровнем холестерина и общей смертностью у больных до 40 лет, незначимая – у пациентов в 50–70–летнем возрасте и отрицательная у больных 80 лет и старше [133]. При этом хорошо известно, что распространенность ХСН значительно увеличивается с возрастом. Вместе с тем доказано, что статины весьма эффективны у пожилых пациентов [114]. В некоторых исследованиях описана взаимосвязь между уровнем холестерина и исходом ХСН. В 1998 году D.I. Vredevoe с соавт. была обнаружена значимая зависимость между низким уровнем холестерина и высокой смертностью у больных тяжелой ХСН неишемического генеза [152]. По данным других исследований, напротив, высокий уровень холестерина ассоциировался с более низкой смертностью пациентов с ХСН как ишемической, так и неишемической этиологии [92, 113,129]. По результатам ROC–анализа пороговое значение концентрации холестерина при оценке смертности больных ХСН в исследовании T.B. Horwich с 25 соавт. составило 4,9 ммоль/л (с 70% чувствительностью предсказания смертности в течение 5 лет) [92], а в работе M. Rauchhaus с соавт. – 5,2 ммоль/л (с 80% чувствительностью и 63% специфичностью предсказания смертности в течение года) [128]. При снижении общего холестерина на 1 ммоль/л ниже порогового уровня смертность возрастала на 25%. С другой стороны, у пациентов с дилатационной кардиомиопатией уровень холестерина не являлся независимым предиктором смертности, а служил лишь маркером тяжести сердечной недостаточности [73]. Подобное явление «перевернутой» эпидемиологии ХСН отмечается не только для холестерина, но и для таких показателей, как индекс массы тела и диастолическое АД [95]. Следует отметить, что вышеуказанные исследования по изучению роли холестерина в прогнозе ХСН являются обсервационными и не обладают значительной доказательной ценностью. Низкий уровень холестерина, как и кахексия, может быть маркером прогрессирования нарушенных метаболических возможностей организма и тяжелого общего состояния у больных ХСН [59]. Так, недавно была показана высокая степень корреляции между уровнем холестерина и чувствительным маркером нутритивного статуса – преальбумином у больных ХСН, не принимавших статины (r=0,84, p<0,001) [61]. С другой стороны, пациенты с повышенным уровнем холестерина при ХСН могут представлять собой отдельную подгруппу, имеющую генетические или приобретенные особенности, защищающие их от воздействия гиперхолестеринемии. Все вышеперечисленное не исключает того, что холестерин и при ХСН является проатерогенным фактором. Необходимо проведение дальнейших исследований для уточнения роли холестерина в патогенезе ХСН (маркер или причина/следствие). До завершения специально спланированных рандомизированных клинических исследований статинов у больных ХСН вопрос об их назначении остается открытым. Несмотря на благотворную взаимосвязь гиперхолестеринемии и клинического состояния больных ХСН, в настоящее время превалирует 26 точка зрения, согласно которой назначение статинов таким пациентам оправдано и не противоречивые приводит данные к отрицательному относительно результату. прогностического А влияния статинов при ХСН могут объясняться различием между истинным и фармакологически Справедливость индуцированным последнего низким утверждения уровнем холестерина. подтверждается данными проспективного обсервационного исследования у 900 больных ХСН, в котором «перевернутая» взаимосвязь между уровнем холестерина и смертностью отмечалась только у пациентов, не получавших статины [105]. При этом на фоне терапии статинами прослеживалась прямая зависимость между уровнем холестерина и смертностью, как при ИБС. Аналогичные результаты были получены при анализе исследования Val– HeFT, в котором было показано, что наибольшее снижение смертности при терапии статинами отмечалось в подгруппе больных с наименьшим исходным уровнем холестерина [100]. 1.6 Антиишемическое действие статинов В основе антиишемического действия статинов лежат три основных компонента, при этом все три компонента во многом обусловлены положительным их действием на эндотелий сосудов [6, 22, 53]. Первый отмеченное в многочисленных работах уменьшение приступов стенокардии, продолжительности и степени выраженности эпизодов преходящей ишемии миокарда при проведение стресс-тестов и СМ ЭКГ в период, когда отсутствуют признаки атеросклеротической регрессии, обусловлено улучшением функционального состояния эндотелия [91, 124]. Второй – тромбоцитарный компонент, обусловленный повышенной агрегацией тромбоцитов в условиях гиперлипидемии (изменение статинами содержания холестерина в мембране тромбоцитов), а также за счет снижения уровня изопростаноидов, являющихся маркерами окислительного стресса и мощными активаторами тромбоцитов, на фоне приема статинов [126]. Кроме того, известно, что статины опосредованно 27 влияют на систему свертывания крови, снижая экспрессию моноцитами тканевого фактора и фрагментов тромбина, могут активировать фибринолитическую активность крови [101,130]. Рядом работ показано, что статины ингибируют активность плазминогена на поверхности гладкомышечных клеток, усиливают выделение тканевого активатора плазминогена и эти влияния статинов носят дозозависимый характер [116,131]. Третий компонент – обусловлен состоянием васкуляризации атеросклеротической бляшки. В качестве стимулятора ангиогенеза, способствующего росту коллатеральных сосудов при наличии значимого коронарного атеросклероза выступает преходящая ишемия миокарда. При этом, рост новых сосудов отмечается и в самой атеросклеротической бляшке, что оказывает отрицательное действие на течение заболевания. Опыт введения эндотелиального фактора роста сосудов экспирементальным животным приводил к значительному ускорению роста атеросклеротической бляшки с параллельным увеличением содержания в ней макрофагов и эндотелиальных клеток, при этом использование статинов приводит к подавлению выделения этого фактора и его подавление не связано с прямыми гиполипидемическими эффектами [8, 9]. Дополнительным положительным фактором влияния статинов в атерогенезе является подавление матриксных металлопротеиназ, отвечающих за внеклеточный протеолиз [63, 132]. Клиническое статинов отображение представлено рядом антиишемической фундаментальных эффективности работ, так, в исследовании 4S (Scandinavian Simvastatin Survival Study) была изучена частота осложнений и смертность у 4444 больных ИБС в течение 5 лет [135]. В исследование были включены пациенты со стабильным течением стенокардии, перенесенным инфарктом миокарда, уровнем холестерина 5,5–8,0 ммоль/л, рандомизированные на группы, получавщие симвастатин или плацебо. На фоне приема симвастатина уровень общего холестерина снизился на 25%, 28 ЛПНП – на 35%, а уровень ЛПВП повысился на 8%. Выживаемость пациентов в группе симвастатина оказалась достоверно большей и составила 91,3%, при этом наиболее высоким данный показатель был в подгруппе больных старше 65 лет. Снижение общей смертности в группе симвастатина составило 42%, риска осложнений ИБС – 34%. 1.7 Антиаритмический эффект статинов В основе плейотропные антиаритмического эффекты: атеросклеротической бляшки, действия статинов противоспалительный, улучшение лежат стабилизация эндотелиальной функции, антиокислительный эффект, кардиопротективный эффект, улучшение автономной функции, антитромботический эффект, эффект на кардиальные ионные каналы – повышение активности каналов IСа,L и IКs, Nа+ помпы и Nа+/Са2+ обменного канала, активности hКv 1,5, Kv 4,3 и ImК каналов и повышение активности КATP каналов [26]. 1.7.1 Патофизиологическое обоснование применения статинов при желудочковых нарушениях ритма Известно, что ВКС может быть вызвана ЖА в основном вследствие острой миокардиальной ишемии и/или формирования рубцов в миокардиальной ткани. Несмотря на то, что четко показана корреляция между повышенным уровнем ХС и ВКС, постулируется, что статины обладают целым рядом эффектов, которые могут косвенно (не только через снижение ХС) влиять на факторы, вызывающие развитие ЖА у больных ИБС. В частности, статины в соответствующей дозировке способны не только останавливать рост АБ, но даже способствовать ее регрессу [116]. Был продемонстрирован противовоспалительный и антипролиферативный эффекты этого класса препаратов на примере снижения С реактивного белка (СРБ) [48]. Дисфункция эндотелия также может быть мишенью действия статинов, например, через индукцию образования эндотелиального оксида азота (NO) [23]. Что касается 29 непосредственно самой АБ, то статины способны обеспечивать ее стабилизацию и могут изменять в ней соотношение липопротеидов различной плотности [148]. Указанные воздействия на АБ способны улучшить миокардиальную перфузию во время острого коронарного синдрома и снизить риск ее разрыва, уменьшая, тем самым, ишемию миокарда и блокируя электрофизиологические эффекты, вызываемые ишемией миокарда желудочков и способствующие развитию ЖА [72]. Статины могут влиять на проводимость и возбудимость в желудочках, модулируя соотношение жирных кислот и физиологических параметров сарколеммы, что приводит к изменению свойств трансмембранных сарколемальных ионных каналов [100]. Прием статинов помогает снизить индуцированный миокардиальной ишемией окислительный стресс (ОС), ведущий к саркоплазматическому повреждению и перегрузке КМЦ кальцием, т.е. к факторам, способствующим развитию ЖА [132]. Изменения снижением вариабельности сердечного парасимпатической ритма активности, (ВСР), являются вызываемые известным предиктором ВКС [108]. Статины, при длительном приеме, способны повышать ВСР, увеличивая тонус парасимпатического отдела вегетативной нервной системы [123]. В небольшом исследовании 80 больных с сердечной недостаточностью (СН) III-IV функциональных классов (ФК) по классификации Ньюйоркской ассоциации сердца (NYHA) были рандомизированы в 2 группы по 40 человек в каждой и получали стандартную терапию [153]. Пациенты одной из групп принимали аторвастатин в дозировке 10 мг/сут. Через 2 месяца у всех больных была зарегистрирована электрокардиограмма высокого разрешения и были проанализированы следующие ее показатели: ВСР, вариабельность интервала QT и вариабельность корригированного интервала QT (QTс). В группе пациентов, принимающих аторвастатин, достоверно увеличилась ВСР, снизилась вариабельность и продолжительность интервала QT, что потенциально может уменьшить 30 риск развития фатальных ЖА. Желудочковые поздние потенциалы отражают наличие в миокарде зон со сниженным или негомогенным проведением и являются маркерами неблагоприятного прогноза в плане развития ЖА [55]. Некоторые статины, такие как правастатин и аторвастатин у больных в постинфарктном периоде также снизили частоту распространения желудочковых поздних потенциалов, и, соответственно, уменьшили развитие ЖА в первые дни после острого инфаркта миокарда (ОИМ) [96]. Терапия правастатином в эксперименте уменьшала даже гипертрофию КМЦ после ИМ, которая, как известно, является еще одним фактором, увеличивающим риск развития ЖА [102]. 1.7.2 Клинические и экспериментальные подтверждения эффективности статинов при желудочковых аритмиях В клинических исследованиях статины показали свою важную роль в снижении частоты развития ЖА у больных ОИМ [82], перенесших коронарную реваскуляризацию [77, 119], ИБС и с имплантированным кардиодефибриллятором (КД) [85, 112]. Раннее назначение статинов после ИМ уменьшает возможность возникновения аритмий и, прежде всего ЖА, которые ассоциируются с постинфарктной смертностью. В частности, в ретроспективном исследовании на большом количестве пациентов было показано, что раннее (до 24 ч) назначение статинов после ОИМ способно достоверно (р<0,001) снизить частоту возникновения ЖА [82]. В двух исследованиях статины оказывали благоприятный эффект на частоту возникновения ЖА после коронарных вмешательств: внутрикоронарный тромболизис и коронарное шунтирование (КШ). При ретроспективной оценке распространенности различных аритмий у больных, лечившихся и не лечившихся статинами после кардиоваскулярных вмешательств (через 60 дней и через год) частота возникновения аритмий в первой группе оказалась 31 достоверно меньшей (р<0,01) [77]. Еще в одном ретроспективном анализе данных 1663 пациентов, перенесших КШ, назначение статинов хоть и не изменило частоту развития ЖА, но снизило общую смертность [119]. 1.7.3 Патофизиологическое обоснование применения статинов при предсердных аритмиях Существует достаточное количество данных, подтверждающих влияние воспаления и ОС на возникновение, рецидивирование и персистенцию ФП. Эти процессы усиливают воспаление миокардиальной ткани и в последующем служат субстратом развития аритмий. Например, один из маркеров воспаления – СРБ четко коррелировал с частотой возникновения способность и персистенции статинов соответственно, ФП уменьшать содержание рандомизированном, [74]. ОС, СРБ Выше снижать [144]. сравнительном была В исследовании упомянута воспаление и, частности, в ФАРВАТЕР (ЭФфективность действияАтоРВАстатина на сосудисТую стЕнку и СРБ), проведенном в Российской Федерации [49], изучалось влияние аторвастатина (Аторис, КRКА, Словения) на уровни липидов крови и состояние эндотелиальной стенки, концентрации фибриногена и СРБ у пациентов с ИБС и ДЛП. Помимо непосредственно ХС – снижающего действия препарата: через 24 недели уровень ЛНП снизился на 34,9% при дозе 10 мг/сут. и на 43,9% – при дозе 20 мг/сут.; ЛВП вырос на 11,4% и 11,8%, соответственно, отмечена тенденция к снижению СРБ на 27,2% через 24 недели при дозе препарата 10 мг/сут. (р>0,05) и достоверное снижение на 43% при дозе 20 мг/сут. (р<0,05). Аторис достоверно повысил эндотелийзависимую вазодилатацию (ЭЗВД), растяжимость и жесткость сосудистой стенки; причем при дозе 20 мг/сут. изменения были более существенными. соответствие между Неоднократно возникновением было ФП и продемонстрировано активностью ренин- ангиотензиновой системы (РАС). Повышение активности РАС негативно влияет на состояние КМЦ: усиливает апоптоз, ремоделирование и 32 фиброз, вызывает перегрузку КМЦ кальцием [84]. Статины же способны снижать уровень ХС и ОС, что, в свою очередь, уменьшает активность РАС. Учитывая ДЛП как один из факторов риска при развитии ФП, можно предположить, что статины снижают частоту развития этой патологии. Факт модуляции ВНС статинами при гиперсимпатотонии в послеоперационном периоде, рецидивированию ФП, позволяет ингибиторов ГМГ использования предрасполагающей Ко к предположить А редуктазы развитию или возможность при данном клиническом состоянии [104]. 1.7.4 Клинические и экспериментальные данные об эффективности статинов при фибрилляции предсердий Существует ряд клинических и экспериментальных исследований, подтверждающих позитивную роль статинов в отношении ФП. В частности, было отмечено, что назначение статинов ассоциируются со снижением частоты ФП (отношение рисков 0,49) у 449 больных стабильной стенокардией при наблюдении на протяжении 5 лет. Однако следует отметить, что исследование не было рандомизированным [159]. В ретроспективном исследовании также наблюдали снижение на 44% частоты рецидивов у пациентов с персистирующей ФП, перенесших кардиоверсию и принимавших после нее терапию ингибиторами ГМГ КоА редуктазы в течение 3 месяцев при наблюдении на протяжении последующих 2 лет. Только в одном проспективном РКИ при назначении правастатина в дозе 40 мг/сут. у больных с персистирующей ФП в течение 6 недель не было отмечено достоверного снижения частоты рецидивов [139], что может быть связано с недостаточным временем для развития эффектов этого класса препаратов. Ингибиторы ГМГ КоА редуктазы снижали риск развития послеоперационной ФП в случаях с некардиальными торакальными хирургическими вмешательствами и при КШ [57, 76]. Эти данные подтверждают результаты исследования ARMYDA 3 (Atorvastatin for Reduction of Myocardial Disrhythmia After 33 cardiac surgery), в котором аторвастатин в дозе 40 мг/сут., назначенный за 1 неделю до кардиохирургического вмешательства по поводу АКШ, у 200 пациентов снизил частоту развития послеоперационной ФП в сравнении с плацебо на 22% [109] (соотношение рисков 0,39; р<0,017). В единственном и достаточно крупном метаанализе (n=7402), выполненном по данным 15 РКИ, в которых статины применялись при различных формах ФП, они оказали весьма благоприятный эффект [122]. Их использование снизило риск развития любой формы ФП на 45%, впервые выявленной ФП – на 32%, рецидивов ФП – на 57%, рецидивов ФП после кардиоверсии – на 42% и после операционной ФП – на 58%. 1.8 Патофизиологические аспекты диастолической сердечной недостаточности Патофизиологическим субстратом ишемии миокарда является дисбаланс между потребностью кислорода и его доставкой к миокарду, приводящий к уменьшению продукции макроэргических соединений в кардиомиоцитах из-за перехода на анаэробный путь утилизации глюкозы, отражается на расслаблении миокарда и снижении миокардиального резерва. Увеличивающаяся относительная кислородная недостаточность, приводящая к усилению ригидности стенок миокарда, удлиняет неишемизированные участки сердечной мышцы (сохранение ударного объема по закону Франка-Старлинга) с дальнейшим увеличением напряжения стенки желудочка за счет увеличения конечного диастолического давления в полости ЛЖ, приводящим к возрастанию жесткости и ригидности миокарда [29]. Клеточный механизм диастолической дисфункции, в основном, представлен депонированием кальция в цистернах саркоплазматического ретикулума, являясь энергозависимым процессом, который на фоне ишемии миокарда уменьшается и приводит к нарушению расслабления миофибрилл [115]. По мере прогрессирования диастолической дисфункции ЛЖ от начальных к умеренным и до выраженных 34 проявлений, принято выделять соответствующие им гипертрофический псевдонормальный и дисфункции При [1]. (нарушенная декомпенсированный начальных релаксация), (рестриктивный) проявлениях типы диастолической дисфункции ЛЖ отмечается снижение скорости раннего наполнения ЛЖ с соответствующим увеличением времени этой фазы, а показатели второй фазы – наполнения ЛЖ при повышении давления в полости левого предсердия – увеличены. Качественные и количественные проявления начальных проявлений диастолической дисфункции соответствуют таковым при гипертрофии ЛЖ, что и позволило назвать этот тип дисфункции гипертрофическим или нарушенной релаксацией. Умеренно выраженные проявления диастолической дисфункции ЛЖ сопряжены с начальными дистрофическими изменениями в полости левого предсердия, в связи с чем показатели второй фазы уменьшаются, соотношение периодов наполнения ЛЖ по своей структуре похожи на нормальное и этот тип получил название псевдонормального. Выраженные проявления диастолической дисфункции представлены выраженной декомпенсацией левого предсердия с уменьшением как временных, так и скоростных показателей позднего наполнения ЛЖ, при этом скоростные показатели раннего наполнения ЛЖ возрастают – это декомпенсированный или рестриктивный тип дисфункции [11,50,66]. Многочисленные данные оценки трансмитрального потока в импульсном доплеровском режиме у больных ИБС и, в первую очередь, ассоциирующиеся с прогрессированием сердечной недостаточности, достаточно единодушно трактуют соотношение скоростей раннего и позднего наполнения ЛЖ в зависимости от функционального класса сердечной недостаточности [40]. Так, при отсутствии признаков сердечной недостаточности соотношение скоростей раннего и позднего наполнения ЛЖ оказалось равным около 160%; по мере прогрессирования сердечной недостаточности, характеризующейся уменьшением скорости раннего наполнения ЛЖ, соотношение 35 периодов наполнения ЛЖ составило от 100 характеризующийся до 110%; период относительно псевдонормализации, равноценным ухудшением количественных показателей обеих фаз наполнения ЛЖ, увеличивает это соотношение до 130%; декомпенсационные показатели соотношения превышают 240% [40, 111]. Однако, прогрессирующее ухудшение диастолической дисфункции ЛЖ не является специфичным в отношении нарастания проявлений сердечной недостаточности [98]. В основе тесной корреляции диастолической функции ЛЖ и максимального потребления кислорода лежит изменение напряжения кислорода в крови как рефлекс, обусловленный раздражением артериальных хеморецепторов, чувствительность которого высока даже при отсутствии критериев диагностически значимого атеросклероза. Так, возникновение тахикардии у пациентов без признаков ИБС отмечается на фоне снижения напряжения кислорода всего на 3%, при этом количественные и качественные показатели гипоксии в организме выявить не удается, что, безусловно, говорит о тесной зависимости активного расслабления ЛЖ от снабжения миокарда кислородом [71]. При наличии диагностического значимого коронарного атеросклероза с учетом его выраженности, протяженности и локализации эта взаимосвязь возрастает многократно [54]. В качестве дополнительных факторов, влияющих на диастолическую функцию ЛЖ в условиях ишемии миокарда, определенная роль отводится неоднородности распределения нагрузки, диастолическому ремоделированию ЛЖ и внутрижелудочковому давлению в момент открытия митрального клапана, что суммарно определяет присасывающую функцию ЛЖ (феномен Вентури), характеризующую объемные и скоростные показатели перемещения части объема крови из левого предсердия в ЛЖ [10]. В работах, в которых доказана зависимость нарушений диастолической функции ЛЖ от уровня ишемии миокарда у больных ИБС, в качестве основной причины этой взаимосвязи рассматривается влияние гипоксии кардиомиоцитов на трансмембранный 36 транспорт кальция. Однако, морфологически указанная взаимосвязь не всегда подтверждается [140, 145]. По-видимому, только наличие дополнительных факторов, таких как развитие метаболического ацидоза, параллельно развивающейся систолической дисфункции, снижения скоростных и объемных показателей внутрижелудочковой гемодинамики, скорости развития гипоксии и особенно ее длительности (и соответственно, степени выраженности гибернации миокарда) позволяет функционально и морфологически оценить влияние кислородной недостаточности на растяжимость ЛЖ [98]. В ряде работ отмечено повышение жесткости миокарда на фоне относительной коронарной недостаточности, обусловленной гипертрофией миокарда у больных ИБС, приводящей к существенному ухудшению центральной гемодинамики и способствующей возникновению или прогрессированию ранее существовавшей систолической дисфункции ЛЖ [138]. Но существует и другая точка зрения, отводящая гипертрофии кардиомиоцитов минимальное значение в формировании жесткости миокарда, а ведущую роль - избыточному накоплению коллагена в интерстициальном пространстве [2, 8]. Прогноз дисфункцией у больных ЛЖ ИБС, значительно сочетающейся ухудшается по с диастолической мере увеличения жесткостных характеристик ЛЖ, что делает задачу медикаментозной коррекции диастолической дисфункции ЛЖ актуальной [138, 151]. Небольшое количество работ, в основном экспериментальных, посвящено изучению влияния различных антиангинальных препаратов, а также ингибиторов миокарда, АПФ при использования на этом показатели диастолического наибольшая эффективность антагонистов кальция, расслабления отмечена селективных от бета-1- адреноблокаторов, нитратов, ингибиторов АПФ [85]. Комбинированная терапия диуретиками и ингибиторами АПФ эффективна у 25% пациентов с сочетанием систолической и диастолической функции ЛЖ [20]. При 37 наличии ишемии миокарда устранение диастолической дисфункции ЛЖ определяется индивидуальным подбором медикаментозной терапии или хирургической реваскуляризации миокарда и влияние патогенетически оправданной терапии статинами может дополнительно улучшить показатели растяжимости ЛЖ. 1.9 Вариабельность сердечного ритма у больных с хронической систолической и диастолической сердечной недостаточностью Ишемическое ремоделирование левого желудочка, ассоциирующиеся с прогрессированием сердечной недостаточности, приводит к усилению симпато-симпатических, рефлексов, усилению афферентной вследствие механического симпато-вагальных симпатической раздражения нервных стимуляции окончаний и рефлекторному ослаблению парасимпатических влияний на сердце, а также ослабляет ответ нейрогуморальных клеток механизмов, синусового что узла на ассоциируется изменение с низкими показателями ВСР, при этом, у пациентов с хронической сердечной недостаточностью III-IV функционального класса по NYHA снижение показателей ВСР достигает критически низких значений [39]. В появлении и развитии симптомов ХСН важное значение имеет активация симпатической нервной системы, которая, наряду с повышением активности ренин-ангиотензин-альдостероновой системы, приводит к задержке ионов натрия и воды [3], к вазоконстрикции и снижению сократительной функции левого желудочка сердца. J. Nolan и соавт. изучили ценность ВСР как независимого предиктора смерти у 433 амбулаторных больных с ХСН (средний возраст 62±9,6 года I–III ФК по NYHA; ФВ ЛЖ 41±17%). Период наблюдения составил 482±161 день. Ежегодный уровень смертности населения для исследования в подгруппах SDNN составил 5,5% для SDNN более 100 мс, 12,7% – для SDNN от 50 до 100 мс, и 51,4% – для SDNN меньше 50 мс. Сниженные показатели SDNN идентифицировали пациентов с увеличенным риском 38 смерти от прогрессирующей ХСН лучше, чем другие обычные клинические измерения [65]. Однако у пациентов с тяжелой ХСН индексы ВСР не всегда являлись независимыми прогностическими предикторами [108]. Позже М. La Rovere и соавт. продемонстрировали, что уменьшенный индекс НЧ во время дыхания, показывающий повышенный риск ВСС у пациентов с ХСН, независим от многих других клинических переменных [89]. Ponikovwski и соавт. обследовали 102 пациента с ХСН (средний возраст 58 лет, I–IV ФК по NYHA, ФВ ЛЖ – 26%, максимальное потребление кислорода – VO2max – 16,9 мл/кг/мин). В течение одного года умерли 19% больных. Основными предикторами смертности являлись: функциональный класс по NYHA (р=0,003), VO2max (р=0,01), ФВ ЛЖ (р=0,02), желудочковые нарушения ритма (р=0,05) и такие параметры временного и спектрального анализа ВСР, как SDNN (р=0,004), SDANN (р=0,003) и НЧ (р=0,003). Корреляции между параметрами ВСР и функциональным классом ХСН, ФВ ЛЖ, VO2max и желудочковыми аритмиями не было. Установлено, что годичная выживаемость больных при SDNN менее 100 мс была ниже в сравнении с теми, у кого SDNN был больше 100 мс (78 и 95% соответственно, р=0,008). Сочетание SDNN менее 100 мс и VO2max менее 14 мл/мин/кг дало возможность выделить 18 больных с наибольшим риском смерти по сравнению с остальными обследованными. Авторы делают вывод, что сниженная ВСР является независимым прогностическим фактором смертности и осложнений у больных с ХСН. Аналогичное мнение приводят в своей работе M. Malik и соавт. [151]. Обследованы 592 больных с ХСН, перенесших ИМ (средний возраст 60,5±9,3 года, ФВ ЛЖ менее 40%), которым проводилось суточное мониторирование ЭКГ с временным анализом ВСР. Обнаружено, что у 79 умерших пациентов средняя ЧСС за сутки служила достоверным предиктором смертности, равно как и сниженная ВСР (чувствительность 19,9–40%). J. Nolan и соавт. [89] исследовали связь различных показателей инструментальных и 39 биохимических исследований с механизмами смерти при ХСН. У 433 пациентов (средний возраст – 62±9,6 года, I–III ФК по NYHA, ФВ ЛЖ – 42±17%) были исследованы протоколы суточного мониторирования ЭКГ с анализом ВСР, данные эхокардиографии, рентгенографии грудной клетки и биохимические показатели крови. Установлено, что кардиоторакальное отношение, конечный диастолический размер левого желудочка, желудочковая аритмия и уровень калия в крови достоверно связаны с внезапной смертью, а SDNN, уровни креатинина и натрия – со смертностью от прогрессирования ХСН. По мнению авторов, достоверно более точным предиктором является снижение SDNN. Подобные выводы сделали M. Galinier и соавт. [39]. Они обследовали 190 больных с ХСН и синусовым ритмом (средний возраст 61±12 года, II–IV ФК по NYHA, кардиоторакальный индекс 57,6±6,4%, ФВ ЛЖ – 28,2±8,8%), из которых 85 человек были с ишемической и 105 – с идиопатической дилатационной кардиомиопатией. За 6 мес наблюдения 55 больных умерли, 21 из них – внезапно. По данным одномерного анализа, предикторами внезапной смерти были ИБС, кардиоторакальный индекс 60% и выше, ФВ ЛЖ менее 30%, SDANN менее 55 мс, r-MSSD менее 14 мс, дневная TF менее 2,4 мс2/Гц и дневная НЧ менее 3,3 мс2; а по данным многомерного анализа – ИБС и дневная НЧ. Авторы считают, что показатели временного анализа ВСР являются независимыми прогностическими факторами общей смертности при ХСН, а спектрального – внезапной. Таким образом, анализ вариабельности сердечного ритма является доступным и высокоинформативным методом определения состояния вегетативной нервной системы у больных с ХСН. Обычно используются временной и частотный способ оценки ее тонуса. Показано, что по изменениям ВСР можно судить о степени эффективности программ реабилитации пациентов с ХСН. Наряду с определением таких параметров, как максимальное характеризовать VО2 и степень ФВ ЛЖ, тяжести 40 исследование ХСН и ВСР выделять позволяет предикторы выживаемости у этих больных. Установлено, что использование метода спектрального анализа помогает прогнозировать риск развития внезапной смерти у больных с ХСН, а использование метода временного анализа – прогнозировать общую смертность [14]. 1.10 Дисперсия интервала QT: методология оценки, клиническая и прогностическая значимость В последние годы в клинической кардиологии проблема дисперсии интервала QT (QTd) привлекает к себе пристальное внимание отечественных и зарубежных исследователей как фактор, приводящий к внезапной смерти [16]. QTd интервала это разница между максимальными и минимальными значениями QT интервала, измеренного в различных отведениях ЭКГ: Д QT = QTmax QTmin. с поправкой на обратно пропорциональную зависимость интервалов ЭКГ по Базетту при оценке корригированной дисперсии интервала QT (QTdc). В последние вариабельности годы большое (дисперсии) внимание величины QT уделяется изучению интервала маркера негомогенности процессов реполяризации, поскольку увеличенная QTdc также является показателем неодинаковой скорости проведения импульса в различных отделах миокарда как следствия очага ишемии или кардиосклероза в области проводящей системы сердца, а также являющейся предиктором развития ряда серьезных нарушений ритма, включая внезапную смерть [15, 45]. Наиболее распространенная методика выявления QTd регистрация стандартной ЭКГ в течение 35 минут при скорости записи 25 мм/час. Используют также холтеровское мониторирование ЭКГ, что позволяет анализировать колебания дисперсии QTс (QTcd) в течение суток [28]. Однако ряд методологических аспектов данного метода находятся в стадии разработки. Так, отсутствует единое мнение о верхней границе нормальных значениях QTdc. По мнению одних авторов, предиктором желудочковых тахиаритимий является 41 QTcd более 45, другие исследователи предлагают считать верхней границей нормы QTcd 70 мс и даже 125 мс [141]. При развитии острой ишемии миокарда также достоверно повышается QTdc. Установлено, что QTdc увеличивается уже в первые часы острого инфаркта миокарда. Отсутствует единое мнение о величине QTd, которое является четким предиктором внезапной смерти у больных острым инфарктом миокарда. Установлено, что при передних инфарктах миокарда дисперсия более 125 мс прогностически неблагоприятный фактор, свидетельствующий о высоком риске летального исхода [28]. Ряд авторов выявили еще более значительное повышение QTd при реперфузии (после коронарной ангиопластики) [141]. Однако другие исследователи, наоборот, обнаружили уменьшение QTd во время реперфузии у больных острым инфарктом миокарда, а увеличение QTd отметили в тех случаях, когда реперфузия не была достигнута. Поэтому некоторые авторы рекомендуют использовать снижение QTd интервала в качестве маркера успешной реперфузии [45]. У больных с острым инфарктом миокарда также нарушается циркадный ритм QTd: она повышена в ночные и утренние часы, что повышает риск внезапной смерти в это время суток. Ряд ситуаций, не позволяющих оценивать традиционные критерии преходящей ишемии миокарда (нарушение внутрижелудочковой проводимости и т.д.) показатель QTdc делает наличие значимых ее показателей достоверным косвенным маркером преходящей ишемии миокарда [17, 143]. Отсутствует единое мнение о прогностическом значении увеличения QTd у больных постинфарктным кардиосклерозом: часть авторов выявили у этих пациентов четкую взаимосвязь между увеличением продолжительности и QTd и риском развития пароксизмов желудочковой тахикардии, другие исследователи подобной закономерности не обнаружили. В тех случаях, когда у пациентов с постинфарктным кардиосклерозом в покое величина QTd не увеличина, 42 следует оценить этот параметр при проведении пробы с физической нагрузкой (208). У больных постинфарктным кардиосклерозом QTdc на фоне нагрузочных проб многие исследователи считают более информативной для верификации преходящей ишемии миокарда и риска развития желудочковых нарушений ритма [41, 52]. Автономная нейропатия также увеличивает величину интервала QT и его дисперсию, поэтому данные синдромы имеют место у больных сахарным диабетом I и II типов. Представляют интерес данные о суточных ритмах QTd, полученных при холтеровском мониторировании ЭКГ (75). Обнаружено достоверное увеличение QTd в ночные и ранние утренние часы, что, возможно, и повышает риск внезапной смерти в это время у больных с различными сердечно-сосудистыми заболеваниями (ишемия и инфаркт миокарда, сердечная недостаточность и др.). Полагают, что увеличение QTd в ночные и утренние часы связано с повышенной симпатической активностью в данное время суток [33]. Общеизвестно удлинение QT при острой ишемии миокарда и инфаркте миокарда. Стойкое (более 5 дней) увеличение интервала QT, особенно при сочетании с ранними желудочковыми экстрасистолами, прогностически неблагоприятно. У этих пациентов выявлено значительное (в 56 раз) повышение риска внезапной смерти [19]. Аналогичные прогностически неблагоприятные параллели выявлены также при сопоставлении увеличенного интервала QT (в том числе значительно систолической увеличенных и показателей диастолической дисперсии сердечной интервала QT), недостаточности и сниженных временных показателей вариабельности сердечного ритма [38, 46]. 1.11 Альтернация Т-зубца: понятие, методология оценки, патофизиологический смысл, клиническая значимость Впервые термин «альтернация» появился в 1909 году [27], когда Hearing был описан случай изменения полярности зубца Т у пациента на 43 фоне эмоциональной нагрузки. Большинство исследователей придерживалось мнения, что это связано с дисфункцией миокарда, возникающей на фоне нарушения процессов реполяризации. Двумя годами позже Thomas Lewis объяснил альтернацию с точки зрения патофизиологии сердца: «Альтернация зубца Т возможна либо при учащенном сердечном ритме здорового сердца, либо в поврежденном сердце при нормальном ритме». В работе [47], исследуя процессы проводимости левого желудочка, пришли к выводу, что альтернация предшествует желудочковой тахикардии. Понятие «электрическая альтернация» характеризуется наличием морфологической разнородности ЭКГ-комплексов. Альтернация Т-зубца не что иное, как изменение формы, полярности или амплитуды зубца Т в нескольких следующих друг за другом кардиоциклах. Электрическая альтернация, включающая в себя варианты морфологических изменений ЭКГ - волны, комбинируется из двух типов альтернаций: де - и реполяризационной. Деполяризационная альтернация QRS-комплекса, характерна тахиаритмий с узкими комплексами. для пароксизмальных QRS-альтернация – явление ритмозависимое и тесно связанное с механизмом тахикардии [27]. Реполяризационная альтернация, наоборот, регистрируется при тахиаритмиях с широкими комплексами, и характеризуется изменениями сегмента ST помимо изменений морфологии Т-зубца. Такие тахикардии (чаще всего это желудочковая тахикардия и антидромная реципрокная тахикардия) вариантной развиваются у стенокардией лиц с острым Принцметала инфарктом и миокарда, кардиомиопатией. Электрическая альтернация – признак электрической нестабильности сердца, которая развивается при изменении процессов реполяризации [47]. Замедление реполяризации может быть обусловлено первичными (врожденный синдром удлиненного QT-интервала) и вторичными причинами (ишемия миокарда, электролитный дисбаланс). Разработана гипотеза о механизме альтернации зубца Т из-за нарушения способности 44 ионных каналов к восстановлению исходного состояния потенциала покоя за время диастолы перед возникновением следующего потенциала действия. В зависимости от возможности визуализации изменений зубца Т альтернацию условно подразделяют на: макро- и микро-альтернацию. Макроальтернация оценивается по стандартной ЭКГ и при проведении статических нагрузочных проб по динамике непрерывно регистрируемой ЭКГ. Критериями наличия альтернации являются изменения амплитуды, полярности и формы сегмента ST и зубца Т [47]. Изолированное изменение зубца Т при нагрузочных пробах имеет низкую специфичность относительно прогноза злокачественных тахиаритмий. Запись ЭКГ в течение 24 часов показывает, что у ≈30% здоровых людей встречаются преходящие изменения зубца Т. К ним относятся: увеличение его амплитуды в ≥2 раза или, наоборот, снижение амплитуды вплоть до перехода зубца Т в отрицательный. Эти изменения часто связаны с тахикардией, нервным возбуждением, умственной или физической активностью, изменением положения тела, приемом пищи, курением и пр. Снижение амплитуды зубца Т на 25% во время и/или после нагрузки по сравнению с исходной величиной в покое вызывает подозрение, а снижение амплитуды на 50% и более может указывать на коронарную недостаточность. Появление этих признаков при отсутствии других проявлений ишемии или диссинергии миокарда должно насторожить врача. 1.12 Турбулентность сердечного ритма: понятие, патофизиологический смысл, прогностическая значимость В настоящее время доказана роль оценки сократимости миокарда (фракции выброса левого желудочка) и вегетативной регуляции сердечной деятельности для выявления лиц, страдающих ИБС с повышенным риском развития злокачественных аритмий. Вариабельность сердечного ритма и определение чувствительности барорецепторов позволяют изучать вегетативные и рефлекторные влияния на функцию 45 сердца [47]. Значения вариабельности сердечного ритма не являются специфичными для сердечной патологии, так как на нее оказывает воздействие множество различных факторов, как внутренних, так и внешних [27]. В этом плане чувствительность барорецепторов лучше отражает функциональное состояние сердца. В основе метода лежит измерение отношений между давлением крови и частотой сердечных сокращений, что позволяет оценить адаптационную способность сердечного ритма при рефлекторной провокации. В 1999 г. опубликованы [155] итоги наблюдений за колебаниями синусового ритма, возникающими после единичных желудочковых экстрасистол (ЖЭ). Авторы обратили внимание, что после ЖЭ ЧСС вначале возрастает в течение двух первых синусовых сокращений, а затем уменьшается, длительность RR- интервала после ЖЭ начинает расти вновь с 3-го синусового сокращения; пик брадикардии 77 ± 111 мс (M ± SD) по сравнению с базовым уровнем приходится на 8-й кардиоцикл. Этот феномен имеет название «турбулентность сердечного ритма. В работе [155] предложено два числовых выражения турбулентности: Turbulence onset (ТО) и Turbulence slope (ТS). Turbulence onset (ТО%) определяется, как отношение разности между средними значениями величин первых двух нормальных компенсаторной синусовых паузы предшествующими интервалов (RR1+RR2) экстрасистоле – и RR, следующих двумя (RR-2+RR-1) после RR-интервалами, к сумме двух предэктопических синусовых интервалов RR, выраженное в процентах. Измерения ведутся для каждой индивидуальной ЖЭ в суточной записи ЭКГ, а затем усредняются, давая интегральную характеристику реакции кардиоритма на ЖЭ. Turbulence slope (ТS мс/RR) – максимальный позитивный наклон линии регресса, проведенной вдоль любой последовательности пяти синусовых RR-интервалов в пределах 20 постэкстрасистолических интервалов RR. 46 Клинические исследования позволили определить оптимальные диагностические критерии для ТО и TS [156]. Значения начальной турбулентности в норме должны быть ≤0 (ТО < 0), а ТS>2,5 мс/RR. Была также выявлена корреляция между турбулентностью и ВСС. При анализе холтеровских данных проспективных исследований MPIP и EMIAT было наглядно продемонстрировано, что у пациентов с постинфарктным кардиосклерозом, имеющих высокий риск развития аритмических осложнений, турбулентность сердечного ритма значительно снижена или отсутствует [155]. При наблюдении за 577 пациентами, перенесшими острый инфаркт миокарда в исследовании MPIP (Multicentre Post Infarction Program) показано, что при ТО≥0% показатели смертности в течение первых 2-х лет выросли до 20% против 11% у больных с ТО<0%. В исследовании EMIAT (European Myocardial Infarction Amiodarone Trial) холтеровские данные 614 постинфарктных больных показали, что при ТО≥0% показатели смертности были 24% против 11% у больных с ТО<0%. При оценке TS у тех же лиц в исследовании MPIP получилось, что при TS >2,5 и TS ≤2,5 мc/RR показатели смертности составили 9% и 27%. В исследовании EMIAT показатели смертности в сходных группах больных составляли 9% и 26%. Сочетание обоих признаков ТО ≥0% и TS ≤2,5 мc/RR увеличило положительную предсказывающую ценность неблагоприятного исхода до 33% (р. <0,001). 1.13 Диастолическая сердечная недостаточность и статины: мало изученные патофизиологические, диагностические, лечебные и прогностические аспекты Патофизиологическим и морфологическим субстратом диастолической сердечной недостаточности у больных с самым часто сочетаемым нозологическим тандемом ИБС и ГБ является наличие как абсолютной коронарной недостаточности в рамках диагностически значимого коронарного атеросклеротического 47 поражения, так и относительной коронарной недостаточности, ассоциированной с гипертрофией миокарда левого желудочка [51]. Полиэтиологичность такого сочетания в виде «фиксированного» стеноза, несоответствия массы гипертрофированного миокарда возможностям его кровоснабжения, нарушенного взаиморасположения кардиомиоцитов, повышенной потребности миокарда в кислороде в условиях его гиперконтрактильности, структурных изменений в коронарных артериях мышечного типа, повышения конечного диастолического давления с особенно негативным его влиянием на субэндокардиально расположенные коронарные артерии и т.д. предполагает широкий спектр и диагностических маркеров, подтверждающих эту полиэтиологичность и более широкий спектр медикаментозных точек воздействия [12, 51]. В традиционном качественных и наборе наиболее количественных информативных ишемических маркеров для абсолютной коронарной недостаточности в большей степени характерны: ЧСС, индуцирующая преходящую ишемию миокарда; амплитуда максимального смещения сегмента ST [55]. При сочетанном характере коронарной недостаточности большее диагностическое и прогностическое значение приобретают интегральные ишемические маркеры: общая продолжительность ишемии миокарда и площадь смещения сегмента ST (по данным суточного мониторирования ЭКГ), динамику критериев которых также эффективности целесообразно проводимой клинического использования динамической оценки данных состояния использовать терапии маркеров коронарного [32, для и в качестве 55]. Опыт исходной и миокардиального резервов на фоне использования различных групп препаратов крайне скуден, а опыт оценки этих критериев по 12-ти канальной холтеровской записи вообще отсутствует, что делает возможность изучения антиишемической активности статинов у больных с диастолической 48 сердечной недостаточностью с использованием этих интегральных ишемических показателей актуальной. Дисперсия интервала QT, а также ее корригированное значение, в многочисленных работах доказала свою информативную значимость как в качестве проаритмогенного маркера при патологических ее значениях, а также в качестве косвенного критерия преходящей ишемии миокарда, особенно при однососудистом стенозирующем коронарном поражение [32, 33, 42, 43]. Клинического опыта изучения корригированной дисперсии интервала QT у больных с диастолической сердечной обнаружено. недостаточностью В корригированной связи с дисперсии в изученной чем, мы интервала литературе сочли QT изучение по 12-ти нами не динамики канальной холтеровской записи у больных с абсолютным и относительным характером коронарной недостаточности уместным. Проаритмогенные маркеры: турбулентность сердечного ритма и микроальтернация зубца Т у больных с диастолической сердечной недостаточностью на фоне терапии статинами ранее не изучались, что позволило нам эти показатели использовать в работе в качестве абсолютно новых. 49 ГЛАВА 2 МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ 2.1 Характеристика групп больных С 2009 по 2013 год было отобрано 125 больных с ХСН, из них 48 мужчин и 77 женщин, средний возраст составил 63,7 ± 5,8, находящихся на стационарном лечении, а затем под амбулаторным наблюдением в течение 6 месяцев. Среди обследуемых больных были выделены 2 группы: основная группа, включающая 66 пациентов, и группа контроля, состоящая из 59 пациентов (Таблица 1). В свою очередь в основной группе проводился внутригрупповой анализ в зависимости от типа диастолической сердечной недостаточности (ДСН) – тип с замедленным расслаблением (n=37) и псевдонормализацией (n=29). В основной группе 66 больных с ХСН ишемического генеза с сохраненной фракцией выброса, гипертонической болезнью, гиперхолестеринемией и признаками умеренной гипертрофии левого желудочка по данным ЭхоКГ, которые помимо стандартной терапии ХСН, согласно национальным рекомендациям ВНОК и ОССН по диагностике и лечению ХСН (третий пересмотр) [34], получали симвастатин 20 мг в сутки в течение 6 месяцев. В контрольной группе наблюдали 59 пациентов с теми же исходными показателями, которые терапию статинами не получали. Таблица 1 Характеристика больных по возрасту и полу Группа Основная группа (n=66) Контрольная группа(n=59) Возраст 63,9 ± 5,9 63,5 ± 5,7 Мужчины 28 (42,4%) 20 (33,9%) Женщины 38 (57,6%) 39 (66,1%) Типы ДСН I тип (n=37) II тип (n=29) I тип (n=31) II тип (n=28) Возраст 60,5 ± 6, 8 59,5 ± 6, 5 61,4 ± 5,7 60,2 ± 5,9 Мужчины 16 (43,2%) 12 (41,4%) 11 (35,5%) 9 (32,1%) Женщины 21 (56,8%) 17 (58,6%) 20(64,5%) 19 (67,9%) 50 Критерии включения в исследование: пациенты с ХСН ишемического генеза с сохраненной фракцией выброса ЛЖ; наличие гипертонической болезни в анамнезе; наличие дислипидемии; наличие эхокардиографических признаков умеренно выраженной гипертрофии ЛЖ; наличие эхокардиодопплерографических признаков патологического трансмитрального кровотока в виде нарушения релаксации (I тип) и псевдонормализации (II тип). Критерии исключения из исследования: пациенты со сниженной фракцией выброса ЛЖ (<50%); пациенты с рестриктивным типом диастолической дисфункции ЛЖ; артериальной гипертензией систолического давления пациенты (с с некоррегируемой повышением свыше 220 мм.рт.ст. артериального и повышением диастолического артериального давления свыше 110 мм.рт.ст.); пациенты с нарушениями предсердий, сердечного желудочковая ритма и проводимости экстрасистолия (фибрилляция выше 3 градации желудочковых экстрасистол по Лауну, полные блокады ножек пучка Гиса, наличие искусственного водителя ритма); больные, перенесшие Qобразующий мозгового инфаркт миокарда; кровообращения больные, менее 3-х перенесшие месяцев назад; нарушение больные с тромбофлебитом нижних конечностей; больные с паренхиматозными заболеваниями печени в активной фазе с увеличением уровня изоферментов аминотрансфераз; пациенты с клиническими проявлениями миопатии и артралгии первичного и вторичного характера. Условия досрочного исключения пациента из исследования: добровольный отказ пациента от дальнейшего участия в исследовании; развитие клинических и биохимических побочных реакций при проведении терапии симвастатином. Важным аспектом в формировании групп пациентов было то, что количество пациентов со сходными качественными характеристиками фоновой патологии в основной и контрольной группах было примерно 51 одинаково, в связи анамнестические с данные чем особенно (наличие тщательно гипертонической оценивались болезни, ее длительность, степень и стадия; характеристики нарушений сердечного ритма, особенности проводимой антиаритмической терапии; особенности течения сахарного диабета при его наличии; топические характеристики ранее перенесенного Q-необразующего ИМ и их сопоставление с состоянием локальной сократимости ЛЖ на момент включения в исследование; длительность и выраженность проявлений ХСН, частота госпитализаций по поводу декомпенсации ХСН в течение последнего года). Оценка клинической, инструментальной и лабораторной картины состояния пациента проводилась при первичной госпитализации в стационар и последующего лабораторного обследования клинического, на фоне инструментального 6-ти месячной и терапии симвастатином. 2.2 Методы исследования Электрокардиографический контроль с регистрацией 12-ти стандартных отведений проводили с помощью электрокардиографа «Schiller Cardiovit» АТ-5 (Швейцария). Биохимические представлены: общим показатели холестерином сыворотки (ОХ), ммоль/л; крови были холестерином липопротеидов низкой плотности (ХС ЛПНП), ммоль/л; холестерином липопротеидов высокой плотности (ХС ЛПВП), ммоль/л; триглицеридами (ТГ), ммоль/л; лактатдегидрогеназой (ЛДГ) Ед/л; креатинфосфокиназой (КФК), Ед/л; щелочной фосфатазой (ЩФ), Ед/л; аланинаминотрасферазой (АЛТ), Ед/л; аспарагинаминотрансферазой (АСТ), Ед/л. Провоспалительные маркеры были представлены: С-реактивным белком (СРБ), мг/л; интерлейкином 6 (ИЛ – 6), пг/мл; фактором некроза опухолей - α (ФНОα), пг/мл. 52 Эхокардиодопплерографию проводили с помощью следующего аппарата «Medison. ЕКО 7» (Корея) с определением: фракции выброса левого желудочка по формуле Симпсона (ФВ ЛЖ), %; толщину задней стенки левого желудочка в диастолу (ТЗС ЛЖ), мм; толщину межжелудочковой перегородки в диастолу (ТМЖП), мм; индекса ММ ЛЖ (ИММ ЛЖ), г/м2, по формуле: ММ ЛЖ/ППТ, где ППТ, м2 – площадь поверхности тела, вычисленная по формуле Костефф: (4Р+7)/Р+90, где Р – масса тела, выраженная в кг; передне-заднего конечного диастолического размера левого предсердия (КДР ЛП), мм; конечного диастолического размера ЛЖ (КДР ЛЖ), мм; конечного систолического размера ЛЖ (КДР ЛЖ), мм; конечного диастолического объема ЛЖ (КДО ЛЖ), мл; конечного систолического объема ЛЖ (КСО ЛЖ), мл. Допплеровские характеристики трансмитрального кровотока оценивали по методике Appleton С. (1988) с определением: максимальной скорости кровотока в фазу быстрого наполнения (пик Е, см/с); максимальной скорости кровотока в систолу предсердия (пик А см/с); отношения максимальных скоростей раннего и позднего наполнения; времени изоволюмического расслабления ЛЖ (IVRT, мс); времени замедления раннего диастолического наполнения (DT, мс). Суточное мониторирование ЭКГ проводилось с помощью 12-ти канального монитора «Кама» и оргинальной программы «DiaСard» (версия 2.1.12) с продолжительностью непрерывной записи до 72 часов. В течение всего исследования пациенты вели самостоятельно дневник, где фиксировали свои субъективные ощущения, прием лекарственных препаратов, совершаемые действия. Оценку аритмического синдрома проводили по традиционным критериям единичных, экстрасистол; оценку редких и желудочковой критериям Lown В., Wolf М. (1975). 53 частых суправентрикулярных экстрасистолии проводили по При оценке показателей преходящей ишемии миокарда оценивали: максимальное смещение сегмента ST (мкВ); минимальное ЧСС, индуцирующее ишемию миокарда; общую продолжительность эпизодов ишемии миокарда (мин./сутки); площадь смещения сегмента ST как произведение общей продолжительности эпизодов ишемии миокарда и величины сверхреферентного смещения сегмента ST (мин./мкВ.) по критериям В.А. Алмазова (1989); количество эпизодов ишемии миокарда. Дисперсию корригированного интервала QТ (DQTc) оценивали как разность интервала между QT в максимальным 12-ти и отведениях минимальным с поправкой значениями на обратно пропорциональную зависимость ЧСС и QT (H.Bazett). Временные и спектральные показатели вариабельности сердечного ритма (ВСР) оценивали по суточному массиву интервалов RR с определением во временном анализе: SDNN (мс) - стандартное отклонение всех анализируемых RR интервалов; RMSSD (мс); корень квадратный суммы разностей последовательных интервалов RR; PNN50 (%) - процентная представленность эпизодов различия последовательных интервалов RR более чем на 50 мс. В спектральных (частотных) показателях ВСР изучали два основных диапазона частот и их соотношение между собой: высокие частоты (волны 0,15 - 0,40 Гц (high frequence - HF); низкие частоты (волны 0,04 - 015 Гц), (low frequence LF); соотношение низких и высоких частот LF/ HF. Турбулентность показателям: сердечного ритма оценивали по двум начало турбулентности (Turbulence Onset) и наклон турбулентности (Turbulence Slope). Значения ТО<0% и TS>2,5 мс/RR – нормальные значения, ТО>0% и TS<2,5 мс/RR – патологические. Микроальтернацию реполяризации зубца желудочков, Т (TWA, отражающую мкВ) ее как дисперсию нестабильность, рассматривали в качестве патологической при значении более 40 мкВ. 54 Статистическая обработка материала проводилась согласно общепринятой методике при использовании программ STATIATICA v.7.0. Количественные признаки с нормальным распределением представлены как М±σ (среднее ± стандартное отклонение). При оценке значимости различий между группами количественных показателей применяли 2 тип критерия Стьюдента для равных дисперсий и 3 тип для двухвыборочного теста с неравными дисперсиями. При сравнении 2 исследуемых групп применяли однофакторный дисперсионный анализ и, при отвержении нулевой гипотезы, для анализа различий между 2 группами использовали критерий Стьюдента с поправкой Бонферрони для небольшого числа сравнений (не более 8). Корреляционных анализ проводили с использованием корреляционного критерия ( r) К. Пирсона для количественных величин. При статистически значимыми. 55 р<0,05 различия считались ГЛАВА 3 РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ 3.1 Гиполипидемические эффекты терапии симвастатином Использование симвастатина в дозе 20 мг/сутки на протяжении 6 месяцев в комплексной терапии диастолической сердечной недостаточности привело в основной группе к достоверному снижению уровня ОХ на 28,2% (р=0,004), а уровень ХС ЛПНП достоверно снизился на 32,5% (р=0,002), при этом уровни ХС ЛПВП и ТГ достоверно не изменились. В контрольной группе (без использования статинов) отмечалось также достоверное снижение ОХ и ХС ЛПНП соответственно на 4,9% (р=0,04) и 7,4% (р=0,04) (Таблица 2). Таблица 2 Динамика показателей липидного спектра у больных основной и контрольной группах Показатели Основная группа Контрольная группа n=66 n=59 Исх. 6 мес. р Исх. 6 мес. р ОХ, ммоль/л 6,4±0,9 4,6±0,7 0,004* 6,2±0,8 5,9±0,7 0,04* ХС ЛПНП, 4,0±0,5 2,7±0,4 0,002* 4,1±0,6 3,8±0,5 0,04* 1,2±0,3 1,3±0,4 0,2 1,3±0,3 1,4±0,4 0,2 1,6±0,3 1,4±0,4 0,07 1,4±0,4 1,5±0,5 0,2 ммоль/л ХС ЛПВП, ммоль/л ТГ, ммоль/л * -достоверное изменение показателя через 6 месяцев от начала наблюдения Случаев развития клинических побочных эффектов среди 66 пациентов основной группы, ассоциированных с использованием симвастатина, а также превышения биохимического уровня рабдомиолиза свыше допустимого не отмечено. 56 3.2 Динамика показателей глобальной сократимости левого желудочка Показатели глобальной сократимости левого желудочка и ИММлж за весь период наблюдения как в основной, так и контрольной группе достоверно не изменились, за исключением КДР, который в основной группе достоверно увеличился на 4,1% (р=0,03). 3.3 Динамика показателей трансмитрального кровотока На фоне полугодовой терапии симвастатином в основной группе достоверно на наполнения ЛЖ 14,1% и (р=0,0007) на 18,7% увеличился (р=0,001) показатель достоверно раннего увеличилось соотношение обеих фаз заполнения ЛЖ; показатель времени замедления раннего диастолического наполнения достоверно уменьшился на 7,8% (р=0,01). В контрольной группе в течение 6 месяцев достоверного изменения показателей трансмитального кровотока не произошло (Таблица 3). Таблица 3 Динамика показателей трансмитрального кровотока, характеризующих состояние диастолической функции левого желудочка у больных основной и контрольной групп ПоказаОсновная группа Контрольная группа тели n=66 n=59 Исходно 6 мес. р Исходно 6 мес. р Е, см/с 54,3±8,1 63,2±7,7 0,0007* 58,9±10,7 57,6±9,0 0,31 А, см/с 74,3±21,2 69,1±9,6 0,51 73,1±13,1 72,2±10,1 0,66 Е/А 0,74±0,09 0,91±0,08 0,001* 0,81±0,07 0,79±0,09 0,22 DT, мс 206,2±61,6 190,3±58,3 0,01* 198,0±57,3 204,9±62,9 0,17 IVRT, мс 108,2±22,6 101,6±18,3 0,12 106,5±19,9 107,9±20,5 0,96 * -достоверное изменение показателя через 6 месяцев от начала наблюдения Через 6 месяцев использования симвастатина при внутригрупповом сопоставлении пациентов основной группы отмечалось достоверное увеличение пика Е на 19,2% (р=0,05 ) и снижение скорости пика А на 57 17,5% (р=0,02) с соответствующим увеличением соотношения обеих фаз заполнения ЛЖ на 33,0% (р=0,02) у больных с первым типом диастолической дисфункции ЛЖ. У больных с псевдонормализацией трансмитрального кровотока отмечено достоверное снижение только одного показателя - пика Е на 1,5% (р=0,04) (Таблица 4). Таблица 4 Динамика показателей трансмитрального кровотока у больных основной группы в зависимости от варианта диастолической сердечной недостаточности ПоказаЗамедленное расслабление Псевдонормализация тели n=37 Исходно n=29 6 р Исходно месяцев 6 р месяцев Е, см/с 48,2±5,0 59,6±9,6 0,05 ⃰ 61,2±7,2 60,3±7,1 0,04* А, см/с 79,1±6,8 65,3±9,9 0,02* 52,3±5,4 53,8±10,9 0,68 Е/А 0,61±0,08 0,91±0,16 0,02* 1,2±0,09 1,2±0,10 1,0 DT, мс 238,7±17,9 221,4±31,6 0,16 140,2±9,4 142,1±46,1 0,94 IVRT, мс 119,1±18,0 102,3±8,9 0,09 89,9±10,1 94,7±16,6 0,33 * -достоверное изменение показателя через 6 месяцев от начала наблюдения 3.4 Динамика качественных и количественных показателей преходящей ишемии миокарда При преходящей оценке качественных ишемии миокарда и в количественных основной группе показателей достоверно уменьшились: продолжительность ишемии миокарда - на 32,7% (р=0,003), площадь смещения ST – на 35,7% (р=0,00005) и количество эпизодов ишемии миокарда – на 30,3% (р=0,0005) (Таблица 5). В контрольной группе ни один из изучаемых показателей достоверно не изменился. При сопоставление динамики показателей преходящей ишемии миокарда в основной группе в зависимости от типа диастолической дисфункции выявлено, что у пациентов с нарушенной 58 релаксацией продолжительность ишемии миокарда достоверно уменьшилась на 44,5% (р=0,006), площадь смещения сегмента ST – на 43,9% (р=0,0004), а количество эпизодов ишемии миокарда достоверно уменьшилось на 36,2% (р=0,004). У пациентов с псевдонормализацией трансмитрального потока достоверно снизилась только площадь смещения сегмента ST на 11,8% (р=0,04) (Таблица 6). Таблица 5 Динамика суточных показателей преходящей ишемии миокарда в основной и контрольной группах Показатели Макс.↓ST, мкВ Мин.ЧСС, инд. ИМ Прод.ИМ, мин./сутки Площ.↓ST, мин./мкВ Кол-во эпиз. ИМ Основная группа n=66 Исходно 6 мес. р 179,3 171,4 0,16 ±22,4 ±16,3 91,3 95,3 0,07 ±4,5 ±5,1 88,2 59,4 0,003* ±10,3 ±7,6 15814,3 10181,2 0,00005* ±826,1 ±756,2 8,6 6,0 0,0005* ±1,1 ±1,2 *- р<0,05 59 Контрольная группа n=59 Исходно 6 мес. р 188,5 185,2 0,24 ±23,1 ±19,6 89,9 90,4 0,16 ±6,2 ±5,8 91,3 88,7 0,23 ±11,2 ±10,6 17210,1 16427,2 0,41 ±937,3 ±965,3 8,7 8,5 0,26 ±1,0 ±1,0 Таблица 6 Динамика суточных показателей преходящей ишемии миокарда в основной группе в зависимости от варианта диастолической сердечной недостаточности Показатели Замедленное расслабление Псевдонормализация n=37 n=29 Исходно 6 мес. р Исходно 6 мес. р Макс.↓ST, 165,5 160,1 0,32 191,4 183,6 0,72 мкВ ±18,3 ±19,9 ±20,2 ±19,1 Мин.ЧСС, 94,7 98,9 89,5 91,9 инд. ИМ ±6,2 ±6,6 ±5,5 ±5,8 Прод.ИМ, 89,3 49,6 94,4 87,0 мин./сутки ±11,3 ±5,8 ±8,8 ±9,2 Площ.↓ST, 14136,2 7940,1 18068,2 15937,2 мин./мкВ ±612,2 ±824,4 ±931,3 ±840,2 Кол-во эпиз. 8,0 5,1 9,1 7,1 ИМ ±1,3 ±1,4 ±1,6 ±1,2 0,34 0,006* 0,0004* 0,004* 0,75 0,09 0,04* 0,11 *- р<0,05 3.5 Динамика корригированной дисперсии интервала QT При исходной оценке корригированной дисперсии интервала QT у всех пациентов этот показатель носил патологический характер с превышением верхнего нормального значения свыше 40 мс. При динамической оценке в основной группе этот показатель снизился на 17,9% (р=0,11), в контрольной – на 13,3% (р=0,62). У пациентов с замедленным расслаблением недостоверное снижение корригированной дисперсии интервала QT составило 19,3% (р=0,34), а у больных с псевдонормализацией – 14,9% (р=0,42). При этом, к концу наблюдения ни в одной из наблюдаемых групп и подгрупп показатель корригированной дисперсии непатологических значений. 60 интервала QT не достиг 3.6 Динамика проявлений аритмического синдрома При динамической оценке количества СВЭ и ЖЭ отмечено достоверное их уменьшение в основной группе соответственно на 24,5% (р=0,008) и 27,9% (р=0,0005) исключительно за счет пациентов с I типом ДСН, в отличие от пациентов контрольной группы и больных с псевдонормализацией основной группы, у которых достоверной динамики количества СВЭ и ЖЭ не отмечено (Таблица 7). Таблица 7 Динамика количества суправентрикулярной и желудочковой экстрасистолии в основной, контрольной группах и подгруппах основной группы Показатели Основная группа n=66 Исходно 6 месяцев р СВЭ 286,4±31,4 216,3±42,6 0,008* ЖЭ 205,5±19,6 148,3±17,3 0,0005* ПоказаЗамедленное расслабление тели (Основная группа) n=37 Исходно 6 месяцев р СВЭ 265,4±27,3 182,4±22,3 0,001* ЖЭ 189,4±20,1 130,9±18,1 0,004 * Контрольная группа n=59 Исходно 6 месяцев р 310,9±30,7 294,3±36,9 0,43 194,6±20,2 211,1±18,4 0,71 Псевдонормализация (Основная группа) n=29 Исходно 6 месяцев р 328,8±39,6 302,1±49,7 0,71 208,8±31,6 204,3±44,7 0,92 *- р<0,05 3.7 Динамика количества пациентов с патологическими значениями турбулентности сердечного ритма Патологические значения ТСР были выявлены у 1/3 пациентов основной и контрольной групп. На фоне терапии симвастатином количество пациентов с патологическими значениями ТСР в основной группе уменьшилось с 21 (31,8%) до 13 (19,7%), в контрольной – с 18 (30,5%) до 17 (28,8%). В зависимости от типа диастолической дисфункции в основной группе при исходном нарушенном расслаблении количество пациентов с патологическими уменьшилось с 6 (16,2%) до 4 (10,8%) (Рисунок 1) 61 показателями ТСР Рисунок 1 Динамика количества пациентов, у которых выявлены патологические значения турбулентности сердечного ритма в основной и контрольной группе и в зависимости от варианта диастолической сердечной недостаточности Контрол ьная группа n=59 6 месяцев, 28,80% Основна я группа n=66 Исходно, 31,80% Замедлен ное расслабле ние n=37 Исходно Псевдоно р-­‐ция n=29 6 месяцев Псевдоно р-­‐ция n=29 Исходно Основна я группа n=66 6 месяцев, 19,70% Контрол ьная группа n=59 Исходно, 30,50% Замедлен ное расслабле ние n=37 6 месяцев 3.8 Динамика показателей микроальтернации зубца Т Исходные показатели микроальтернации зубца Т (TWA) во всех группах пациентов носили патологический характер и превышали 40 мкВ. На фоне терапии симвастатином в основной группе произошло достоверное снижение TWA на 25,9% (р=0,02 ) без достоверного различия этого снижения в зависимости от типа диастолической дисфункции ЛЖ. Так у пациентов с замедленным расслаблением TWA достоверно уменьшилась на 30,3% (р=0,009), а у больных с псевдонормализацией трансмитрального потока – на 25,7% (р=0,007) при недостоверно большем исходном значении этого показателя. контрольной группе TWA достоверно не изменилась (Таблица 8). 62 В Таблица 8 Динамика микроальтернации зубца Т у больных основной и контрольной групп и подгруппах основной группы Показатели TWA, мкВ Показатели TWA, мкВ Основная группа n=66 Исходно 6 месяцев р 90,8±14,9 67,3±10,2 0,02* Контрольная группа n=59 Исходно 6 месяцев р 129,9±27,1 122,4±34,3 0,22 Замедленное расслабление (Основная группа) n=37 Исходно 6 месяцев р 85,0±10,1 59,3±8,7 0,009* Псевдонормализация (Основная группа) n=29 Исходно 6 месяцев р 101,2±9,6 75,2±8,2 0,007* *- р<0,05 3.9 Динамика временных и спектральных показателей вариабельности сердечного ритма При оценке динамики исходно умеренно сниженных показателей вариабельности сердечного ритма (ВСР) отмечено, что на фоне терапии симвастатином в основной группе произошло достоверное увеличение временных и спектральных показателей, характеризующих парасимпатическую составляющую. Так, PNN50 увеличился на 28,9% (р=0,04), а HF – на 20,5% (р=0,04). В контрольной группе динамики временных и спектральных показателей не отмечено. В подгруппах основной группы произошло достоверное увеличение только временных показателей, так PNN50 у больных с I типом диастолической дисфункции увеличился на 28,4% (р=0,02), а у пациентов со II типом - на 32,5% (р=0,002 ) (Таблица 9). 63 Таблица 9 Динамика временных и спектральных показателей вариабельности сердечного ритма в основной и контрольной группах и подгруппах основной группы Показатели SDNN, мс RMSSD, мс PNN50,% HF, н.е. LF, н.е. LF/HF Показатели SDNN, мс RMSSD, мс PNN50,% HF, н.е. LF, н.е. LF/HF Основная группа n=66 Исходно 6 мес. р 94,4 109,5 0,31 ±10,4 ±9,2 23,7 32,1 0,13 ±5,9 ±5,4 5,9±0,9 8,3±0,8 0,04* 21,4±3,6 26,9±3,0 0,04* 43,3±4,7 53,3±3,5 0,06 2,1±0,6 2,0±0,5 0,23 Замедленное расслабление (Основная группа) n=37 Исходно 6 мес. р 101,4 117,3 0,31 ±11,7 ±8,8 27,5 34,6 0,23 ±4,7 ±6,6 6,3±1,1 8,8±0,9 0,02 * 23,3±4,2 28,1±4,2 0,55 46,0±5,8 55,1±6,2 0,64 2,0±0,7 2,0±0,9 1 Контрольная группа n=59 Исходно 6 мес. р 94,1 85,5 0,23 ±10,1 ±12,0 22,5 18,5 0,21 ±5,9 ±6,8 6,4±0,9 5,1±1,1 0,81 23,8±3,9 19,7±4,2 0,22 43,8±4,9 38,9±5,3 0,49 1,8±0,7 2,0±1,2 0,56 Псевдонормализация (Основная группа) n=29 Исходно 6 мес. р 88,3 99,1 0,62 ±9,2 ±10,7 23,7 29,1 0,25 ±5,9 ±7,2 5,2±0,8 7,7±0,5 0,002* 19,1±4,0 24,8±4,4 0,24 39,8±5,6 49,9±6,0 0,05 2,1±0,7 2,0±0,5 0,89 *- р<0,05 3.10 Динамика провоспалительных маркеров Исходный повышенный уровень СРБ, ФНО-α и ИЛ-6 в сыворотке крови определялся у 125 (100%) больных ХСН. Использование симвастатина в дозе 20 мг/сутки на протяжении 6 месяцев в комплексной терапии диастолической сердечной недостаточности привело в основной группе к достоверному снижению уровня СРБ на 47,4% (р=0,006), а уровень ИЛ-6 достоверно снизился на 24 % (р=0,009), при этом снижение 64 ФНО-α на 13,1% (р=0,32) носило недостоверный характер. В контрольной группе ни один из трех изучаемых показателей достоверно не изменился (Таблица 10). Таблица 10 Динамика провоспалительных маркеров у больных основной и контрольной групп Показатели СРБ, мг/л ФНОα, пг/мл ИЛ-6, пг/мл Основная группа n=66 Исходно 6 мес р 7,8±1,3 4,1±0,8 0,006* 56,4±7,7 49,0±5,3 0,32 Контрольная группа n=59 Исходно 6 мес р 8,1±1,6 7,1±1,2 0,51 54,2±8,6 55,1±9,7 0,49 48,3±6,2 46,0±5,9 36,7±4,4 0,009* 47,9±7,0 0,82 * - достоверное изменение показателя по сравнению с исходным уровнем Таблица 11 Динамика провоспалительных маркеров у больных основной группы в зависимости от варианта диастолической сердечной недостаточности Показатели Замедленное расслабление Псевдонормализация n=37 n=29 Исх. 6 мес. р Исх. 6 мес. р СРБ, мг/л 6,7±1,2 3,8±0,9 0,04* 8,0±1,1 5,0±1,3 0,008* ФНОα, пг/мл 51,1±6,8 45,2±5,5 0,24 59,9±8,2 53,2±5,8 0,41 ИЛ-6, пг/мл 44,1±6,0 33,9±4,9 0,04* 51,3±7,6 40,1±5,5 0,01* * - достоверное изменение показателя по сравнению с исходным уровнем При оценке динамики провоспалительных маркеров у больных основной группы в зависимости от типа диастолической дисфункции ЛЖ отмечено, что у пациентов с замедленным расслаблением уровень СРБ 65 Таблица 12 Корреляционная взаимосвязь отдельных изучаемых показателей у больных с диастолической дисфункцией в виде нарушенного расслабления по K.Peerson Примечание: в таблице жирным шрифтом выделены показатели со средней (от 0,3 до 0,69) и сильной (от 0,7 до 1,0) корреляционной связью. 66 Таблица 13 Корреляционная взаимосвязь отдельных изучаемых показателей у больных с диастолической дисфункцией в виде псевдонормализации по K.Peerson Примечание: в таблице жирным шрифтом выделены показатели со средней (от 0,3 до 0,69) и сильной (от 0,7 до 1,0) корреляционной связью. 67 достоверно снизился на 43,3% (р=0,04), а уровень ИЛ-6 – на 23,1% (р=0,04), при этом снижение ФНО-α на 11,5% (р=0,24) носило недостоверный характер. У больных с псевдонормализацией трансмитрального кровотока на фоне терапии симвастатином уровень СРБ достоверно уменьшился на 37,5% (р=0,008), ИЛ-6 – на 21,9% (р=0,01), а показатель ФНО-α недостоверно снизился на 11,2% (р=0,41) (Таблица 11). При сопоставлении отдельных изучаемых показателей по критериям К.Пирсона выявлено, что у пациентов с I типом ДСН сильная корреляционная показателей: взаимозависимость продолжительностью отмечена ишемии между миокарда, 21 парой площадью смещения сегмента ST, аритмическими проявлениями, соотношением фаз наполнения ЛЖ, микроальтернацией зубца Т, парасимпатическим компонентом ВСР и провоспалительным маркером – СРБ. При этом, подавляющее число изучаемых показателей составили пары (180) со средней силой корреляции (таблица 12). У пациентов с II типом ДСН сильную корреляционную пару составили два показателя: временной парасимпатический компонент и СРБ. Количество пар сопоставления со средней силой корреляции составило 89 (таблица 13). В качестве клинических наблюдений, соответствующих задачам исследования, приводим фрагменты истории болезни: Клинический пример 1. П-в Н.И., 59 лет, учитель. Жалобы: кратковременные давящие боли за грудиной при ходьбе ускоренным темпом, купирующиеся в покое и нитроглицерином. Одышку при физической нагрузке. Из анамнеза: пациент работает, проф. вредности отрицает, наследственность в отношении ССЗ, со слов пациентки, отягощена: отец умер в возрасте 64-х лет от острого инфаркта миокарда; мать с 55-летнего возраста страдает гипертонической болезнью и с 60-летнего возраста – 68 стенокардией напряжения. Курит более 20 сигарет в день. Аллергоанамнез не отягощен. Физическая активность – низкая. Около 4-х лет периодически отмечает головные боли в области затылка, сопровождающиеся повышением АД до 170/100 мм.рт.ст., принимает препараты из группы ингибиторы АПФ, эпизодически диуретики. За две недели до госпитализации пациент стал отмечать более частые эпизоды повышенного повышения давления артериального беспокоили давящие давления. боли за На фоне грудиной. Участковым терапевтом направлена на госпитализацию ГКБ №13. Объективный статус: состояние при поступлении относительно удовлетворительное. Положение активное. Кожные покровы обычной окраски и влажности, отёков нет. Индекс массы тела – 30 кг/м² Лимфоузлы не увеличены. Органы дыхания: грудная клетка правильной формы; перкуторный звук – легочный, аускультативно - дыхание везикулярное, проводится во все отделы, хрипов не выслушивается. Органы кровообращения: границы сердца не расширены, тоны сердца приглушены, ритмичны, шумов нет. ЧСС 64 уд/мин. АД 170/90 мм. рт. ст. Органы пищеварения: аппетит не нарушен, глотание не затруднено. Язык влажный, без налета. Живот мягкий, безболезненный. Печень – нижний край на уровне реберной дуги. Селезенка не пальпируется. Органы мочевыделения: мочеиспускание свободное. Симптом Пастернацкого отрицательный. Неврологический статус: Сознание ясное, когнитивных нарушений нет. Менингеальная симптоматика не выявляется. Данные лабораторных исследований. Общий анализ крови: эритроциты 4,63х10(12)/л, гемоглобин 128 г/л, лейкоциты 6,6х10(9)/л, палочкоядерные 3%, сегментоядерные 71%, лимфоциты 23%, моноциты 3%, тромбоциты 180 тыс., СОЭ 5 мм/час. Первичный биохимический анализ крови: ОХ – 6,5 ммоль/л, ХС ЛПНП – 4,2 ммоль/л, ХС ЛПВП – 1,3 ммоль/л, ТГ – 1,7 ммоль/л; сахар крови – 6,1 ммоль/л, ЛДГ 92 МЕ, КФК – 39 МЕ/л, ЩФ – 1,5 мккат/л, АЛТ 69 – 9 МЕ, АСТ – 12 МЕ, СРП – 6,2 мг/л, ФНОα – 51,1 пг/мл, ИЛ – 6 – 44,1 пг/мл. Данные инструментальных исследований. ЭКГ – ритм синусовый правильный, отклонение ЭОС влево. Признаки умеренно выраженной гипертрофии левого желудочка. ЭхоКГ и ДопплерЭхоКГ – Аорта несколько уплотнена. Левое предсердие не расширено. Полость левого желудочка не расширена. Нарушение локальной сократимости ЛЖ нет. Правый желудочек не расширен, правое предсердие не расширено. Признаки умеренной гипертрофии ЛЖ. Нижняя полая вена не расширена. Признаков легочной гипертензии нет. Створки аортального клапана не уплотнены, амплитуда раскрытия нормальная. Митральный клапан: створки не уплотнены, противофаза есть. При допплерокардиографии – гемодинамически незначемые клапанные регургитации (митральная 1 ст, трикуспидальная 1 ст). Диастолическая дисфункция ЛЖ I типа (с нарушенной релаксацией). СМЭКГ – суправентрикулярные экстрасистолы – 270, поздние монотопные желудочковые экстрасистолы – 191. На фоне увеличения ЧСС свыше 97 в мин. В отведение V5 регистрируется депрессия сегмента ST до 165,5 мкВ. Площадь смещения сегмента ST составила 14020 мин./мкВ. Продолжительность ишемии миокарда - 88,2 мин./сутки, количество эпизодов ишемии миокарда – 8. Дисперсия интервала QT на максимальных значениях ЧСС составила 60 мс. Микроальтернации зубца Т составила 85 мкВ. Временные показатели ВСР: SDNN – 104 мс, RMSSD – 29 мс, PNN50% - 6. Спектральные показатели ВСР: HF-24 НЕ, LF – 48 НЕ, LF/HF – 1,9 (нормальные значения). Тест 6 – минутной ходьбы - 426-550 м (соответствует I ФК). На основании проведенных исследований больному поставлен диагноз: ИБС, стенокардия напряжения II ФК. Хроническая сердечная недостаточность I ФК (NYHA), диастолическая сердечная недостаточность I типа. Редкая 70 суправентрикулярная экстрасистолия. Редкая поздняя монотопная желудочковая экстрасистолия (1 градация по Лауну). Гипертоническая болезнь 2 степени, III стадии, риск ССО 3. Больному назначено лечение: бисопролол 5 мг х 1 раза в день, периндоприл 5 мг х 1 раз в день, тромбоАСС 100 мг/сутки, симвастатин 20 мг/сутки, диета с ограничением жиров животного происхождения (менее 30% от объема пищи), отказ от курения, ограничение интенсивности физической нагрузки (ограничение максимальной ЧСС при физической нагрузке не более 95 уд/мин.). Контроль через 6 месяцев. Объективный статус: состояние удовлетворительное. Положение активное. Кожные покровы обычной окраски и влажности, отёков нет. Индекс массы тела – 28 кг/м² Лимфоузлы не увеличены. Органы дыхания: грудная клетка правильной формы; перкуторный звук – легочный, аускультативно - дыхание везикулярное, проводится во все отделы, хрипов не выслушивается. Органы кровообращения: границы сердца не расширены, тоны сердца приглушены, ритмичны, шумов нет. ЧСС 64 уд/мин. АД 120/90 мм. рт. ст. Органы пищеварения: аппетит не нарушен, глотание не затруднено. Язык влажный, без налета. Живот мягкий, безболезненный. Печень – нижний край на уровне реберной дуги. Селезенка не пальпируется. Органы мочевыделения: мочеиспускание свободное. Симптом Пастернацкого отрицательный. Неврологический статус: Сознание ясное, когнитивных нарушений нет. Менингеальная симптоматика не выявляется. Данные лабораторных исследований. Биохимический анализ крови: ОХ – 4,6 ммоль/л, ХС ЛПНП – 2,7 ммоль/л, ХС ЛПВП – 1,3 ммоль/л, ТГ – 1,4 ммоль/л; сахар крови – 5,0 ммоль/л, ЛДГ 204 МЕ, КФК – 47 МЕ/л, ЩФ – 1,7 мккат/л, АЛТ – 25 МЕ, АСТ – 27 МЕ, СРП – 3,8 мг/л, ФНОα – 45,1 пг/мл, ИЛ – 6 – 33,9 пг/мл. Данные инструментальных исследований. 71 ЭКГ – ритм синусовый правильный, отклонение ЭОС влево. Признаки умеренно выраженной гипертрофии левого желудочка (без динамики). ЭхоКГ и ДопплерЭхоКГ – Нарушение локальной и глобальной сократимости ЛЖ нет. Аорта несколько уплотнена. Левое предсердие не расширено. Полость левого желудочка не расширена. Правый желудочек не расширен, правое предсердие не расширено. Признаки умеренной гипертрофии ЛЖ. Нижняя полая вена не расширена. Признаков легочной гипертензии нет. Створки аортального клапана не уплотнены, амплитуда раскрытия нормальная. Митральный клапан: створки не уплотнены, противофаза есть. Диастолическая дисфункция ЛЖ I типа (с нарушенной релаксацией. Таблица 14 (к клиническому примеру №1) Месяцы исследования Исходно 6 месяцев Показатель СВЭ ЖЭ TWA, мкВ DQTc, мс SDNN, мс RMSSD, мс PNN50,% HF, н.е. LF, н.е. LF/HF Макс.↓ST, мкВ Прод.ИМ,мин./сутки Площ.↓ST,мин./мкВ Кол-во эпиз. ИМ Тзслж, мм Тмжп, мм КДР, мм ФВ,% СМЭКГ 270 191 85 60 104 29 6 24 48 1,9 165,5 88,2 14020 8 ЭхоКГ и ДопплерЭхоКГ 12,8 12,9 51,9 61 72 184 130 59 44,5 117,3 34,6 8,8 28 55 1,9 160,1 59 7940,1 6 12 12,5 53,9 60,8 ИММлж, г/м² Е, см/с А, см/с Е/А DT, мс IVRT, мс 153,9 48,2 59,6 0,61 238,7 119,1 155,2 59,6 65,3 0,91 221,4 102,3 СМЭКГ – суправентрикулярные экстрасистолы – 184, поздние монотопные желудочковые экстрасистолы – 130. На фоне увеличения ЧСС свыше 98 в мин. В отведение V5m регистрируется депрессия сегмента ST до 160,1 мкВ. Площадь смещения сегмента ST составила 7940,1 мин./мкВ, Продолжительность ишемии миокарда - 59 мин./сутки, количество эпизодов ишемии миокарда – 6,0. Дисперсия интервала QT на максимальных значениях ЧСС составила 44,5. Микроальтернации зубца Т составила 59 мкВ. Временные показатели ВСР: SDNN – 117,3 мс, RMSSD – 34,6 мс, PNN50% - 8,8. Спектральные показатели ВСР: HF-28 НЕ, LF – 55 НЕ, LF/HF – 1,9 (нормальные значения). Таким образом, у пациента с исходной гиперхолестеринемией на фоне приема симвастатина в дозе 20 мг/сутки достижение целевых уровней по показателям ОХ и ХС ЛПНП отмечено к 6-му месяцу лечения. При оценке нелипидных эффектов терапии симвастатином обращает на себя внимание то, что достигнутый к 6-му месяцу лечения противовоспалительный эффект в виде снижения уровня СРБ на 37,7%, ИЛ – 6 – 11,7% и ФНО – 23,1% от исходного. Оценивая в динамике другие нелипидные эффекты симвастатина в дозе 20 мг/сутки обращает на себя внимание изменения большинства из них: по основным изучаемым показателям трансмитрального кровотока отмечается положительная динамика; достоверному уменьшению суточной продолжительности ишемии миокарда, площади смещения сегмента ST; количества эпизодов ишемии миокарда; количества суправентрикулярных и желудочковых экстрасистол; к положительному влиянию на микроальтернацию зубца Т, а также на парасимпатическую 73 составляющую вариабельности сердечного ритма. Корригированная дисперсия интервала QT оказалась недостаточно информативным маркером эффективности симвастатина. Клинический пример 2. Пациент А-в Н.М., 60 лет, врач – стоматолог. Жалобы: кратковременные давящие боли за грудиной и одышку при ходьбе ускоренным темпом, подъеме в гору, купирующиеся в покое. Из анамнеза: Пациент работает, проф. вредности отрицает, наследственность в отношении ССЗ отягощена - отец 76 лет трижды перенес острый инфаркт миокарда и острое нарушение мозгового кровообращения; мать с 60-летнего возраста страдает гипертонической болезнью и стенокардией напряжения. Курит более 30 сигарет в день. Физическая активность – низкая. Около 6-ти лет периодически отмечает в утренние часы головные боли разлитого характера, сопровождающиеся повышением АД свыше 180/110 мм. рт. ст., по поводу которых за медицинской помощью не обращался и медикаментозными препаратами пользовался изредка. При проведении диспансеризации около года назад у пациента выявлена гипергликемия до 7,6 ммоль/л по поводу которой эндокринологом пациенту рекомендовано соблюдение диеты. На кануне госпитализации у пациента артериальное давление поднялось до цифр 185/100 мм. рт. ст., сопровождалось сильной головной болью, диспепсическими явлениями виде тошноты, дискомфортом за грудиной. Самостоятельно справиться с гипертоническим кризом не удалось, госпитализирован в ГКБ № 13. Объективный статус: состояние при поступлении относительно удовлетворительное. Положение активное. Индекс массы тела – 32 кг/м². Кожные покровы обычной окраски и влажности, отёков нет. Лимфоузлы не увеличены. Органы дыхания: грудная клетка правильной формы; перкуторный звук – легочный, аускультативно - дыхание везикулярное, проводится во все отделы, хрипов 74 не выслушивается. Органы кровообращения: границы сердца не расширены, тоны сердца приглушены, ритмичны, шумов нет. ЧСС 90 уд/мин. АД 180/100 мм. рт. ст. Органы пищеварения: аппетит не нарушен, глотание не затруднено. Язык влажный, без налета. Живот мягкий, безболезненный. Печень – нижний край на уровне реберной дуги. Селезенка не пальпируется. Органы мочевыделения: мочеиспускание свободное. Симптом Пастернацкого отрицательный. Неврологический статус: Сознание ясное, когнитивных нарушений нет. Менингеальная симптоматика не выявляется. Данные лабораторных исследований. Общий анализ крови: эритроциты 4,9х10(12ст)/л, гемоглобин 137 г/л, лейкоциты 6,6х10(9ст)/л, палочкоядерные 3%, сегментоядерные 71%, лимфоциты 23%, моноциты 3%, тромбоциты 190 тыс. СОЭ 4 мм/час. Первичный биохимический анализ крови: ОХ – 6,2 ммоль/л, ХС ЛПНП – 4,1 ммоль/л, ХС ЛПВП – 1,3 ммоль/л, ТГ – 1,4 ммоль/л; сахар крови – 8,2 ммоль/л, ЛДГ 84 МЕ, КФК – 35 МЕ/л, ЩФ – 1,4 мккат/л, АЛТ – 12 МЕ, АСТ – 16 МЕ, СРП – 8,0 мг/л, ФНОα – 59,9 пг/мл, ИЛ – 6 – 53,3 пг/мл. Данные инструментальных исследований. ЭКГ – ритм синусовый правильный, горизонтальное положение ЭОС. Признаки невыраженной гипертрофии левого желудочка. ЭхоКГ и ДопплерЭхоКГ – Полости сердца не расширены. Сократительная функция левого желудочка не нарушена. Диастолическая дисфункция ЛЖ II типа (псевдонормализация). Уплотнения корня аорты и створок аортального клапана умеренно выраженые. Уплотнение фиброзного кольца МК. Митральная регургитация 0-1 степени. Трикуспидальная регургитация 1 степени. Давление в легочной артерии в пределах нормы. СМЭКГ – суправентрикулярные экстрасистолы – 328, поздние монотопные желудочковые экстрасистолы – 208. На фоне увеличения 75 ЧСС свыше 94 в мин. В отведение V5m регистрируется депрессия сегмента ST до 191 мкВ. Площадь смещения сегмента ST составила 18068 мин./мкВ. Продолжительность ишемии миокарда - 94 мин./сутки, количество эпизодов ишемии миокарда – 9. Дисперсия интервала QT на максимальных значениях ЧСС составила 71,3 мс. Микроальтернации зубца Т составила 101,2 мкВ. Временные показатели ВСР: SDNN – 94,1 мс, RMSSD – 22,5 мс, PNN50% - 5,2. Спектральные показатели ВСР: HF19,1 НЕ, LF – 39,8 НЕ, LF/HF – 2,1 (нормальные значения). Тест 6 – минутной ходьбы - 426-550 м (соответствует I ФК). На основании проведенных исследований больному поставлен диагноз: ИБС, стенокардия напряжения II ФК. Хроническая сердечная недостаточность I ФК (NYHA), диастолическая сердечная недостаточность экстрасистолия. II Редкая типа. Редкая поздняя суправентрикулярная монотопная желудочковая экстрасистолия (1 градация по Лауну). Гипертоническая болезнь 3 степени, III стадии, риск ССО 3. Больному назначено лечение: бисопролол 5 мг х 1 раза в день, периндоприл 5 мг х 1 раз в день, тромбоАСС 100 мг/сутки, симвастатин 20 мг/сутки, диета с ограничением жиров животного происхождения (менее 30% от объема пищи), отказ от курения, ограничение интенсивности физической нагрузки (ограничение максимальной ЧСС при физической нагрузке не более 95 уд/мин). Контроль через 6 месяцев. Объективный статус: состояние удовлетворительное. Положение активное. Кожные покровы обычной окраски и влажности, отёков нет. Индекс массы тела – 30 кг/м². Лимфоузлы не увеличены. Органы дыхания: грудная клетка правильной формы; перкуторный звук – легочный, аускультативно - дыхание везикулярное, проводится во все отделы, хрипов не выслушивается. Органы кровообращения: границы сердца не расширены, тоны сердца приглушены, ритмичны, шумов нет. ЧСС 70 уд/мин. АД 130/90 мм. рт. ст. 76 Органы пищеварения: аппетит не нарушен, глотание не затруднено. Язык влажный, без налета. Живот мягкий, безболезненный. Печень – нижний край на уровне реберной дуги. Селезенка не пальпируется. Органы мочевыделения: мочеиспускание свободное. Симптом Пастернацкого отрицательный. Неврологический статус: Сознание ясное, когнитивных нарушений нет. Менингеальная симптоматика не выявляется. Данные лабораторных исследований. Биохимический анализ крови: ОХ – 5,9 ммоль/л, ХС ЛПНП – 3,8 ммоль/л, ХС ЛПВП – 1,4 ммоль/л, ТГ – 1,5 ммоль/л; сахар крови – 5,8 ммоль/л, ЛДГ 90 МЕ, КФК – 40 МЕ/л, ЩФ – 2,6 мккат/л, АЛТ – 32 МЕ, АСТ – 39 МЕ, СРП – 5 мг/л, ФНОα – 53,12 пг/мл, ИЛ – 6 – 40,1 пг/мл. Данные инструментальных исследований. ЭКГ – ритм синусовый правильный, горизонтальное положение ЭОС. Признаки невыраженной гипертрофии левого желудочка (без динамики). ЭхоКГ и допплерЭхоКГ – Нарушение локальной и глобальной сократимости миокарда ЛЖ не выявлено. Систолическая функция ЛЖ сохранена (ФВ 60%). Умеренная гипертрофия миокарда ЛЖ. Склеротические изменения стенки аорты, створок аортального клапана. Диастолическая дисфункция ЛЖ II типа (псевдонормализация). СМЭКГ – суправентрикулярные экстрасистолы – 302, поздние монотопные желудочковые экстрасистолы – 204. На фоне увеличения ЧСС свыше 95 в мин. В отведение V5m регистрируется депрессия сегмента ST до 183,6 мкВ. Площадь смещения сегмента ST составила 15937 мин./мкВ. Продолжительность ишемии миокарда - 87 мин./сутки, количество эпизодов ишемии миокарда – 7. Дисперсия интервала QT на максимальных значениях ЧСС составила 60,7 мс. Микроальтернации зубца Т составила 75,2 мкВ. Временные показатели ВСР: SDNN – 99,1 мс, RMSSD – 29,1 мс, PNN50% - 7,7. Спектральные показатели ВСР: HF24,8 НЕ, LF – 49,9 НЕ, LF/HF – 2 (нормальные значения). 77 Таким образом, у пациента с исходной гиперхолестеринемией на фоне приема симвастатина в дозе 20 мг/сутки в течение 6 месяца отмечено снижение показателей ОХ и ХС ЛПНП. На фоне приема этой дозы препарата к 6-му месяцу наблюдения клинических признаков непереносимости препарата не отмечено. Таблица 15 (к клиническому примеру №2) Месяцы исследования Исходно 6 месяцев Показатель СМЭКГ СВЭ 328 302 ЖЭ 208 204 TWA, мкВ 101,2 75,2 DQTc, мс 71,3 60,7 SDNN, мс 94 99 RMSSD, мс 22,5 29,1 PNN50,% 5,2 7,7 HF, н.е. 19,1 24,8 LF, н.е. 39,8 49,9 LF/HF 2,1 2 Макс.↓ST, мкВ 191 183,6 Прод.ИМ, 94 87 18068 15937 9 7 мин./сутки Площ.↓ST, мин./мкВ Кол-во эпиз. ИМ ЭхоКГ и ДопплерЭхоКГ Тзслж, мм 12,6 12,3 Тмжп, мм 12,8 12,5 КДР, мм 51,7 53,9 ФВ,% 61 64 ИММлж, г/м² 153,9 155,2 Е, см/с 61,2 60,3 А, см/с 52,3 53,8 Е/А 1,2 1,2 78 DT, мс 140,2 142,1 IVRT, мс 89,9 94,7 При оценке нелипидных эффектов терапии симвастатином обращает на себя внимание то, что исходно повышенный уровень СРП, ФНОα, ИЛ – 6 уменьшились к 6-му месяцу лечения на фоне приема симвастатина в дозе 20 мг/сутки. СРБ достоверно уменьшился на 37,5%, ИЛ-6 – на 21,9%, а показатель ФНО-α недостоверно снизился на 11,2%. Оценивая в динамике другие нелипидные эффекты симвастатина в дозе 20 мг/сутки обращает на себя внимание изменения следующих из них: по основным изучаемым показателям трансмитрального кровотока отмечено достоверное снижение только одного показателя - пика Е на 1,5%; снизилась только площадь смещения сегмента ST на 11,8%; произошло достоверное снижение TWA на 25,7%, а также положительное влияние на парасимпатическую составляющую вариабельности сердечного ритма. Корригированная дисперсия интервала QT оказалась недостаточно информативным маркёром эффективности симвастатина. 79 ГЛАВА 4 ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ Эффективность гиполипидемических свойств ингибиторов ГМГ– КоА–редуктазы (cтатинов) сердечно-сосудистых в структуре заболеваний в вторичной настоящее профилактики время является, безусловно, доказанной [4]. При этом, до настоящего времени в структуре самого распространенного сердечно-сосудистого синдрома – хронической сердечной недостаточности до конца не определены положительные и негативные позиции, которые могут быть ассоциированы с использованием статинов. В некоторых исследованиях рассматриваются альтернативные позиции статинов у больных ИБС и ХСН, в связи с положительными прогностическими гиполипидемическими эффектами статинов при ИБС в отличие от более благоприятного прогноза течения ХСН на фоне умеренной гиперлипидемии [9]. Кроме того, сама структура ХСН настолько разнообразна, что не позволяет использовать единообразных подходов к применению статинов при разных ее проявлениях [12]. Это разнообразие обусловлено состоянием глобальной сократимости ЛЖ – сниженной или сохраненной ФВ ЛЖ, степенью выраженности эндотелиальной дисфункции, различной значимостью воспалительного компонента в механизме формирования ХСН, различными патогенетическими механизмами формирования коронарной недостаточности качественных – и абсолютной или количественных относительной, характеристик значимостью сопутствующего аритмического синдрома и преходящей ишемии миокарда, наличием или отсутствием сопутствующей эндокринологической патологии и т.д. [22]. С нашей точки зрения, наиболее интересной и наименее изученной является проблема изучения эффективности статинов у пациентов с сохраненной глобальной сократимостью ЛЖ, поскольку эта категория больных является наиболее массовой – сочетание ИБС и гипертонической болезни, в основе формирования коронарной недостаточности у этой 80 категории пациентов лежат и механизмы абсолютного (атеросклеротического) поражения коронарных артерий и комплекс причин, приводящих к формированию относительной коронарной недостаточности (гипертрофия миокарда, приводящая к нарушению заполнения ЛЖ, повышению конечного диастолического давления в ЛЖ, ухудшению кровотока по судэндокардиальным артериям мышечного типа; изменение структурного взаиморасположения кардиомиоцитов в гипертрофированном миокарде; структурные изменения в мышечном слое коронарных артерий и т.д.) [23]. Недостаточно изучены качественноколичественные значимость характеристики отдельных преходящей компонентов ишемии вегетативной миокарда, регуляции, особенности динамики провоспатительных показателей на фоне терапии статинами у данной категории пациентов. Прогностическая значимость таких маркеров как общая продолжительность ишемии миокарда и площадь смещения сегмента ST, корригированная дисперсия интервала QT в режиме 12-канальной холтеровской записи, проаритмогенные показатели – микроальтернация зубца Т и турбулентность сердечного ритма – ранее практически не изучалась. Гиполипидемические эффекты минимальных лечебных доз симвастатина у больных с ХСН в настоящее время рассматриваются как наиболее взвешенная лечебно-профилактическая позиция, поскольку возрастная детализация результатов Фрамингемского исследования выявила положительную корреляционную взаимосвязь между уровнем холестерина и общей смертностью только в молодой возрастной категории, в старшей возрастной категории – активная (агрессивная) гиполипидемическая терапия приводит к отрицательной корреляционной связи между показателями гиперлипидемии и общей смертностью [133]. Безусловно, данные Фрамингемского исследования не могут быть положены в основу отказа от гиполипидемической терапии в старшей возрастной группе, поскольку они не учитывают детализации состояния 81 внутрисердечной гемодинамики в виде сохраненной или сниженной сократительной способности миокарда. В связи с чем, наш подход использованию симвастатина у больных с ХСН основывался на его использовании в минимальной лечебной дозе у больных средней возрастной группы при сохраненной сократительной способности миокарда ЛЖ, что привело к достоверному снижению уровня ОХ на 28,2% (р=0,004), а уровень ХС ЛПНП достоверно снизился на 32,5% (р=0,002) и отсутствию традиционных побочных эффектов статинотерапии. Традиционные антиишемические эффекты симвастатина в первую очередь рассматриваются поражением в рамках у больных с изолированной абсолютным ИБС, коронарным что приводит к положительным эндотелиальным эффектам с последующим клиническим уменьшением количества приступов стенокардии, уменьшением продолжительности и выраженности эпизодов преходящей ишемии миокарда [91, 124]. Больные с ХСН при сохраненной сократительной способности миокарда – более сложная категория пациентов: кроме диагностически значимого этиологическим механизмом, коронарного лежащим в атеросклероза основе важным качественных и количественных характеристик преходящей ишемии миокарда, является относительная коронарная недостаточность, безусловно усиливающая общеишемическую ишемического картину в компонента миокарде. происходит В ответ на повышение усиление агрегации тромбоцитов и снижение фибринолитической активности крови, что в свою очередь усиливает и поддерживает ишемию миокарда [101,126,130]. В нашей работе, мы значительно переориетировались в отношении маркеров преходящей ишемии миокарда и сочли явно недостаточным традиционный набор ишемических и проишемических показателей в результате чего наиболее информативными маркерами преходящей ишемии миокарда оказались интегральные 82 показатели: общая продолжительность ишемии миокарда, площадь смещения сегмента ST. У пациентов с нарушенной релаксацией продолжительность ишемии миокарда достоверно уменьшилась на 44,5% (р=0,006), площадь смещения сегмента ST – на 43,9% (р=0,0004), а количество эпизодов ишемии миокарда достоверно уменьшилось на 36,2% (р=0,004). У пациентов с псевдонормализацией трансмитрального потока достоверно снизилась только площадь смещения сегмента ST на 11,8% (р=0,04). Такое значимое различие между I и II типом диастолической сердечной недостаточности, по-видимому, обусловлено относительной обратимостью (в нашем случае, на фоне терапии симвастатином) морфофункциональных изменений в миокарде ЛЖ у пациентов с I типом ДСН и относительной необратимостью этих изменений у больных с II типом ДСН. Эти данные согласуются с современными представлениями о механизмах прогрессирования ДСН - патофизиологическим субстратом ишемии миокарда является дисбаланс между потребностью кислорода и его доставкой к миокарду, приводящий к уменьшению продукции макроэргических соединений в кардиомиоцитах из-за перехода на анаэробный путь утилизации глюкозы, отражается на расслаблении миокарда и снижении миокардиального резерва. Увеличивающаяся относительная кислородная недостаточность, приводящая к усилению ригидности стенок миокарда, удлиняет неишемизированные участки сердечной мышцы (сохранение ударного объема по закону ФранкаСтарлинга) с дальнейшим увеличением напряжения стенки желудочка за счет увеличения конечного диастолического давления в полости ЛЖ, приводящим к возрастанию жесткости и ригидности миокарда [29]. Клеточный механизм диастолической дисфункции, в основном, представлен депонированием кальция в цистернах саркоплазматического ретикулума, являясь энергозависимым процессом, который на фоне ишемии миокарда уменьшается и приводит к нарушению расслабления миофибрилл [115]. 83 Комплекс нелипидных эффектов статинов, приводящих к антиаритмическому действию, как на эктопический, тригерный механизм, так и на механизм противоспалительный, улучшение повторного стабилизация эндотелиальной кардиопротективный входа, разнообразен атеросклеротической функции, эффект, очень бляшки, антиокислительный улучшение - эффект, автономной функции, антитромботический эффект, эффект на кардиальные ионные каналы [26]. В нашей работе получен достоверный антиаритмический эффект симвастатина и выделить основную причину этого положительного действия весьма затруднительно. По нашему мнению, с учетом корреляционного сопоставления отдельных изучаемых показателей у больных с I типом ДСН наибольшее значение в связи с аритмическим синдромом сыграли такие маркеры как общая продолжительность ишемии миокарда, площадь смещения сегмента ST и провоспалительный маркер – СРБ. У больных с II типом ДСН (с меньшей степенью корреляционной связи) – дисбаланс в парасимпатическом компоненте ВНС и также провоспалительный маркер – СРБ. Оценка показателей доплеровском режиме у трансмитрального больных ИБС потока и, в в импульсном первую очередь, ассоциирующиеся с прогрессированием сердечной недостаточности, достаточно единодушно трактуют соотношение скоростей раннего и позднего наполнения ЛЖ в зависимости от функционального класса сердечной недостаточности [40]. При этом, прогрессирующее ухудшение диастолической дисфункции ЛЖ не является специфичным в отношении нарастания проявлений сердечной недостаточности [98]. В основе тесной корреляции диастолической функции ЛЖ и максимального потребления кислорода лежит изменение напряжения кислорода в крови как рефлекс, обусловленный раздражением артериальных хеморецепторов, чувствительность которого высока даже при отсутствии критериев диагностически значимого атеросклероза. При наличии диагностического 84 значимого коронарного атеросклероза с учетом его выраженности, протяженности и локализации эта взаимосвязь возрастает многократно [54]. В качестве дополнительных факторов, влияющих на диастолическую функцию ЛЖ в условиях ишемии миокарда, определенная роль отводится неоднородности распределения нагрузки, диастолическому ремоделированию ЛЖ и внутрижелудочковому давлению в момент открытия митрального клапана, что суммарно определяет присасывающую функцию ЛЖ (феномен Вентури), характеризующую объемные и скоростные показатели перемещения части объема крови из левого предсердия в ЛЖ [10]. В работах, в которых доказана зависимость нарушений диастолической функции ЛЖ от уровня ишемии миокарда у больных ИБС, в качестве основной причины этой взаимосвязи рассматривается влияние гипоксии кардиомиоцитов на трансмембранный транспорт кальция, кроме того необходимо учитывать значимость и других факторов, таких как метаболический ацидоз, скоростные и объемные показатели жесткости миокарда, внутрисердечной избыточное гемодинамики, содержание инрстициальном пространстве [2, 8, 138, 140, 145]. состояние коллагена в Исходя из наших данных, определяющим в состоянии показателей трансмитрального кровотока являются два фактора – это обратимость или необратимость жескостных характеристик левого желудочка, а также состояние кровотока в субэнокардиальных артериях, определяющего интегральные показатели ишемического синдрома. Снижение показателей ВСР определяется степенью ишемического патологического ремоделирования ЛЖ, которое ассоциирующиеся с прогрессированием сердечной недостаточности, приводит к усилению симпато-симпатических, симпато-вагальных рефлексов, усилению афферентной симпатической стимуляции вследствие механического раздражения нервных окончаний и рефлекторному ослаблению парасимпатических влияний на сердце, а также ослабляет ответ клеток 85 синусового узла на изменение нейрогуморальных механизмов [39]. Активация симпатической парасимпатического нервной компонента), системы которая, наряду (в с ущерб повышением активности ренин-ангиотензин-альдостероновой системы, приводит к задержке ионов натрия и воды, к вазоконстрикции и снижению сократительной функции ЛЖ – также важная составляющая, приводящая к вегетативному дисбалансу. Сниженная ВСР является независимым прогностическим фактором смертности и осложнений у больных с ХСН [39, 89, 151]. При этом, в структуре сниженной значимости парасимпатического компонента отмечено, что показатели временного анализа ВСР являются независимыми прогностическими факторами общей смертности при ХСН, а спектрального – внезапной. Показано, что по изменениям ВСР можно судить о степени эффективности программ лечения пациентов с ХСН [14]. В нашей работе отмечено, что симвастатин оказал положительный эффект на парасимпатический компонент ВНС как во временном, так и спектральном аспекте, таким образом положительно повлияв на общую и внезапную смертность. В последние дисперсии годы интервала QT большое как внимание маркера уделяется изучению негомогенности процессов реполяризации, поскольку увеличенное его значение (а особенно корригированные значения интервала QT – QTdc) также является показателем неодинаковой скорости проведения импульса в различных отделах миокарда как следствия очага ишемии или кардиосклероза в области проводящей системы сердца, а также являющейся предиктором развития ряда серьезных нарушений ритма, включая внезапную смерть [15, 45]. В многочисленных работах доказала свою информативную значимость как в качестве проаритмогенного маркера при патологических ее значениях, а также в качестве косвенного критерия преходящей ишемии миокарда, особенно при однососудистом стенозирующем коронарном поражение [32, 33, 42, 43]. Клинического опыта изучения 86 корригированной дисперсии интервала QT у больных с диастолической сердечной недостаточностью обнаружено. В связи корригированной с в изученной чем, дисперсии мы литературе сочли интервала QT изучение по 12-ти нами не динамики канальной холтеровской записи у больных с абсолютным и относительным характером коронарной недостаточности уместным. Полученные в нашей работе результаты в виде исходных патологических значений QTdc и осутствия достоверного изменения этого показателя на фоне терапии симвастатином не является следствием неудачного выбора критерия эффективности лечения – наши данные подтверждают патофизиологический смысл формирования этого феномена, который является в большей степени маркером одно и двухсосудистого коронарного поражения и возникающей вследствие этого негомогенности коронарного кровоснабжения в отличие от формирования системной ишемии миокарда у пациента с относительной коронарной недостаточностью, что заставляет использовать QTdc корректно только у пациентов с явной негомогенностью коронарного кровотока. Патофизиологическим и морфологическим субстратом ДСН у больных с самым часто сочетаемым нозологическим тандемом ИБС и ГБ является наличие как абсолютной коронарной недостаточности в рамках диагностически значимого поражения, и так коронарного относительной атеросклеротического коронарной недостаточности, ассоциированной с гипертрофией миокарда левого желудочка [12, 51]. Полиэтиологичность такого сочетания в виде «фиксированного» стеноза, несоответствия массы гипертрофированного миокарда возможностям его кровоснабжения, нарушенного взаиморасположения кардиомиоцитов, повышенной потребности миокарда в кислороде в условиях его гиперконтрактильности, структурных изменений в коронарных артериях мышечного типа, повышения конечного диастолического давления с 87 особенно негативным его влиянием на субэндокардиально расположенные коронарные артерии и т.д. предполагает широкий спектр и диагностических маркеров, подтверждающих эту полиэтиологичность и более широкий спектр медикаментозных точек воздействия. Ранее не изучавшиеся проаритмогенные маркеры: турбулентность сердечного ритма и микроальтернация зубца Т у больных с диастолической сердечной недостаточностью на фоне терапии статинами ранее не изучались, что позволило нам эти показатели использовать в работе в качестве абсолютно новых для оценки эффективности терапии симвастатином у больных с сохраненной ФВЛЖ. 88 ВЫВОДЫ 1. Эффективность комбинированной терапии с использованием симвастатина у больных с ДСН по большинству изучаемых показателей трансмитрального кровотока была более высокой в отличие от терапии пациентов, которые статины не получали. При внутригрупповом сопоставлении пациентов с I и II типом ДСН, по подавляющему числу критериев значимые эффекты были получены только у больных I типом ДСН. 2. Использование симвастатина в дозе 20 мг/сутки в течение 6 месяцев в комплексную терапию диастолической сердечной недостаточности привело к достоверному уменьшению суточной продолжительности ишемии миокарда, площади смещения сегмента ST, количества эпизодов ишемии миокарда, количества суправентрикулярных и желудочковых экстрасистол, в основном, у больных с I типом ДСН. 3. Включение симвастатина в комплексную терапию диастолической сердечной недостаточности привело к положительному влиянию на проаритмогенные и проишемические маркеры турбулентности сердечного ритма и микроальтернации зубца Т, а также на парасимпатическую составляющую вариабельности сердечного ритма у пациентов с I и II типом ДСН. 4. Корригированная дисперсия интервала QT оказалась недостаточно информативным маркером эффективности симвастатина при сочетании абсолютной и отностительной коронарной недостаточности у пациентов с ишемической болезнью сердца и гипертонической болезнью с изолированной диастолической сердечной недостаточностью. 5. У больных с диастолической сердечной недостаточностью отмечается исходное превышение референтных показателей СРБ, ИЛ-6, ФНОα вне зависимости от типа ДСН. 6. В результате 6-месячной терапии симвастатином у больных с различными типами ДСН отмечено достоверное снижение СРБ и ИЛ-6 в равной степени. Уровень ФНОα у больных с замедленным расслаблением и псевдонормализацией снизился недостоверно. 89 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ 1. У пациентов с ишемической болезнью сердца и гипертонической болезнью сердца с сохраненной фракцией выброса левого желудочка с целью объективизации диагностики целесообразно включать: суточное мониторирование синдрома, ЭКГ площади с определением смещения проявлений сегмента ST (по аритмического 12-ти каналам), микроальтернации зубца Т, турбулентности сердечного ритма (при наличии желудочковых нарушений ритма); определение С-реактивного белка и интерлейкина-6. 2. Эффективность терапии симвастатином у больных с диастолической сердечной недостаточностью I типа целесообразно оценивать по динамике следующих показателей: продолжительность ишемии миокарда, площадь смещения сегмента ST, количество суправентрикулярных и желудочковых экстрасистол, соотношение фаз наполнения ЛЖ, микроальтернация зубца Т, парасимпатические компоненты временного анализа вариабельности сердечного ритма, уровень С-реактивного белка. 3. В комплексную инструментально-лабораторную оценку эффективности терапии симвастатином у больных с диастолической сердечной недостаточностью II типа целесообразно обязательно включать динамику временных показателей вариабельности сердечного ритма, отражающих парасимпатический компонент, а также динамику С-реактивного белка. 90 СПИСОК ЛИТЕРАТУРЫ 1. Агеев Ф.Т., Джахангиров Т.М., Гхани П. и др. Возможности ультразвуковой допплерографии в оценке нарушения диастолической дисфункции сердца у больных с хронической сердечной недостаточностью // Кардиология. 1994. Т.34. №11-12. С.12-17. 2. Агеев Ф.Т., Овчинников А.Г., Мареев В.Ю., Беленков Ю.Н. Как лечить диастолическую дисфункцию сердца? // Consilium medicum. Том 4, №3, 2002, С.114-117. 3. Агеев Ф.Т. Диастолическая сердечная недостаточность: 10 лет знакомства. Журнал сердечная недостаточность. 2010. Т. 11. № 1. С. 69-76. 4. Агеев Ф.Т., Арутюнов Г.П., Беленков Ю.Н. Хроническая сердечная недостаточность. М: ГЭОТАР-Медиа 2010:49-64. 5. Аронов Д.М. Плейотропные эффекты статинов. РМЖ, 2001; 9: 6. Аронов Д.М. Симвастатин. Новые данные и перспективы. – М: 13–4. Триада-Х, 2002. – 80 с. 7. Арутюнов Г.П. Статины и острые коронарные синдромы. Мы на пороге нового стандарта лечения // Клин. фармакол. и терапия.– 2001.– Т.3, №10.– С. 2–7. 8. Арутюнов Г. П., Розанов А. В. Клинические исследования, завершения в 2002 году, в свете кордиологического континуума // Клиническая фармакология. 2003. – Т. 12 – №3. – С. 20-26. 9. Арутюнов Г.П. Коронарный атеросклероз. Новые данные для нового взгляда на вечную проблему//Сердце. 2005, том 4 №1(19) С.4-10. 10. Барац С.С., Закроева А.Г. Диастолическая дисфункция сердца по показателям трансмитрального кровотока и потока в легочных венах: дискуссионные вопросы патогенеза, терминологии и классификации // Кардиология. 1998. №5. С.69-76. 91 11. Беленков Ю.Н., Агеев Ф.Т., Мареев В.Ю. Диагностика диастолического наполнения и диастолического резерва левого желудочка у больных сердечной недостаточностью при применении различных типов медикаментозного лечения: сравнительные допплер эхокардиографические исследования // Кардиология. 1996. Т.36. №9. С.38-49. 12. Беленков Ю.Н. Эпидемиология и прогноз сердечной недостаточности / Ю.Н. Беленков, Ф.Т. Агеев // Русский медицинский журнал. 1999.-Т.7, №2. - С.51-55. 13. цитокины Беленков Ю.Н., Агеев Ф.Т., Мареев В.Ю. Нейрогормоны и при сердечной недостаточности: новая теория старого заболевания? // Сердечная недостаточность. 2000. № 4. С. 135—138. 14. Бокерия Л. А., Бокерия О. Л., Волковская И. В. Вариабельность сердечного ритма: методы измерения, интерпретация, клиническое использование. Анналы аритмологии, № 4, 2009, С 21. 15. Бузиашвили Предикторы ишемической Ю.И., электрической болезнью Кабулова Р.И., нестабильности сердца (обзор Хананашвили миокарда на у актуальную Е.М. больных тему) // Кардиоваскулярная терапия и профилактика. 2004, №3(1) С.103-109. 16. Бутаева Т.Д., Трешкур Т.В., Овечкина М.А. Врожденный и приобретенный синдром удлиненного интервала QT // С-Пб. 2002, С.48. 17. Васильева Е.Ю., Артамонов В.Г., Карпман М.Л., Шпектор А.В. Динамика дисперсии корригированного интервала QT при стресстесте и ее прогностическое значение // Кардиоваскулярная терапия и профилактика. 2003. №1 С.75-80. 18. Ватутин недостаточность, Н.Т., Калинкина обусловленная Н.В. Хроническая ишемической болезнью сердечная сердца. // Сердечная недостаточность. 2010. №2. С. 95. 19. Гринь В.К., Виталии В.Т., Кетинг Е.В., Калинкина Н.В. Дисперсия интервала QT // Донецк: Каштан.— 2003.— 196 с. 92 20. Драпкина О.М., Ашихмин Я.И. Хроническая сердечная недостаточность с сохраненной фракцией выброса: патофизиология, диагностика, стратегии лечения. Кардиология. 2009. Т. 49. № 9. С. 90-95. 21. Статины Драпкина О.М., Корнеева О.Н., Палаткина Л.О., Ивашкин В.Т. при лечении хронической сердечной недостаточности. Атеросклероз и дислипидемии. 2012. № 1 (6). С. 32-36. 22. Драпкина О.М., Корнеева О.Н., Палаткина Л.О., Ивашкин В.Т. Статины при лечении хронической сердечной недостаточности: за гранью гиполипидемических свойств. Артериальная гипертензия. 2012. Т. 18. № 1. С. 11-17. 23. Драпкина О., Палаткина Л., Зятенкова Е. Плейотропные эффекты статинов. Влияние на жесткость сосудов. Врач. 2012. № 9. С. 59. 24. Драпкина О.М., Кабурова А.Н. статины и хроническая диастолическая сердечная недостаточность: правда или вымысел? Российские медицинские вести. 2013. Т. 18. № 2. С. 14-23. 25. Житникова Л.М. «Новые» статины – новые возможности для врача и пациента. Русский медицинский журнал. 2011. Т. 19. № 29. С. 1832-1834. 26. Загидуллин Н.Ш., Michels G., Загидуллин Ш.З. Статины и их антиаритмическая активность. Кардиоваскулярная терапия и профилактика. 2007; 6(8), С. 116. 27. Иванов Г.Г., Дворников В.Е., Попов В.В., Грибанов А.Н. Новые методы ЭКГ и реографической диагностики // Вестник РУДН 2006. N2, С. 33-38. 28. Кирилина В.Ю., Енисеева Е.С. Дисперсия QT при нагрузочных пробах у больных с ИБС // Вестник аритмологии. 2005, №39 (приложение А), С.50. 29. Королева Т.В., Георгадзе З.О., Васильева А.Е. Диастолическая функция миокарда у больных ишемической болезнью сердца и сахарным 93 диабетом 2 типа // Кардиоваскулярная терапия и профилактика. 2004, №3(5) С. 65-68. 30. Кремнева Л.В., Шалаев С.В. Липопротеиды низкой плотности и воспаление как факторы риска ИБС. Плейотропные эффекты статинов в профилактике сердечно-сосудистых осложнений. Клиническая фармакология и терапия. М., 2003, 12 (3), С.36-39. 31. Кухарчук В.В. Кому сегодня необходима терапия статинами в России? Атмосфера. Кардиология. М., 2003, №4, С.46. 32. Макаров Л.М. Холтеровское мониторирование.- М.: Медпрактика.- 2008.- 214 с. 33. Макаров Л.М. Особенности динамики и изменения интервала Q—T при холтеровском мониторировании // Кардиология. 2002. № 1. С. 98—102. 34. Мареев В. Ю., Агеев Ф. Т., Арутюнов Г. П., Коротеев А. В., Ревишвили А. Ш.. Национальные рекомендации ВНОК И ОССН по диагностике и лечению ХСН (третий пересмотр). Утверждены конференцией ОССН 15 декабря 2009 года. 35. рабочей Мареев В. Ю., Даниелян М. О., Беленков Ю. Н. От имени группы исследования ЭПОХА-О-ХСН. Сравнительная характеристика больных с ХСН в зависимости от величины ФВ по результатам Российского многоцентрового исследования ЭПОХА-ОХСН. Журнал Сердечная Недостаточность. 2006;7 (4): 164-171. 36. Мареев В.Ю. О рекомендациях по диагностике и лечению ХСН и согласованных мнениях экспертов ОССН. Журнал сердечная недостаточность. 2011. т. 12. № 2. С. 115-116. 37. Насонов Е.Л., Самсонов Иммунопатология застойной М.Ю., Беленков Ю.Н., Фукс Д. сердечной недостаточности: роль цитокинов. Кардиология 1999; 3: 66-73. 38. Никитин Ю.П., Кузнецов А.А., Шабалина В.Н., Малютина С.К. и др. Прогностическое значение замедленной и негомогенной 94 реполяризации желудочков и сниженной вариабельности сердечного ритма у мужчин с артериальной гипертензией//Артериальная гипертензия. 2003, №6 (9) 12 с. 39. Новикова Р.А., Александров Д.А., Богушевич Н.Ф. Использование анализа параметров вариабельности сердечного ритма в определении хронической сердечной недостаточности малых функциональных классов // Минск. 2003. С. 2-4. 40. аспекты Овчинников А.Г., Агеев Ф.Т., Мареев В.Ю. Методические применения диастолической допплер-эхокардиографии дисфункции левого в желудочка диагностике // Сердечная недостаточность. 2000. Том 1. С. 14-21. 41. дисперсии Пархоменко и А.Н., Шумаков вариабельности А.В., интервала Иркин Q-T ЭКГ: О.И. Анализ возможности практического применения // Кардиология.- 2001.- №7.- С. 89-93. 42. Пархоменко А.Н., Шумаков А.В., Иркин О.И. Интервал Q—T ЭКГ: значение его дисперсии в качестве маркера аритмогенеза // Кардиология. 2001. № 4. С. 83—86. 43. Пархоменко А.Н., Лутай Я.М. Раннее применение симвастатина у больных с острым коронарным синдромом: влияние на динамику маркеров воспаления и результаты клинического наблюдения // Укр. кардіол. журн. – 2005. – № 3. – С. 36-45. 44. Покровская Е. В., Ваулин Н.А., Грацианский Н.А. Острый коронарный синдром без подъемов ST на ЭКГ: агрегация тромбоцитов и маркеры воспаления при раннем применении аторвастатина и правастатина. Кардиология 2003; 01:7–18. 45. Сапожникова И.Е., Тарловская Е.И., Тарловский А.К., Соболев А.А. Дисперсия интервалов Q-T и J-T у больных с артериальной гипертензией в сочетании с метаболическими нарушениями в рамках инсулинрезистентного синдрома // Вестник аритмологии. 2001, №24, С. 22-26. 95 46. Сперанская С.М., Баканова Н.В., Шутов А.М. Дисперсия интервалов QT у больных гипертонической болезнью // Артериальная гипертензия. 2003 №4, том 9, С.139-141. 47. Сула А.С., Рябыкина Г.В., Гришин В.Г. Метод дисперсионного картирования ЭКГ. Биофизические основы метода дисперсионного картирования. // Новые методы электрокардиографии / Под ред. С.В. Грачева, Г.Г. Иванова, А.Л. Сыркина.- М.: Техносфера, 2007.- С. 369-425. 48. Сусеков А.В. Влияние статинов на нелипидные маркеры ишемической болезни сердца: С-реактивный белок и фибриноген. Атмосфера. Кардиология. М., 2003, №4, 21-24. 49. Сусеков А., Рожкова Т., Зубарева М. Эффективность действия аторвастатина на сосудистую стенку и СРБ. Кардиология 2006; 9: 4-9. 50. 32. Терещенко С.Н., Бармотин Г.В., Соколовская А.А. Апоптоз и иммунный статус больных острым инфарктом миокарда и сердечной недостаточностью // Успехи клинич. Иммунологии и аллергологии. Т. 1. / Под ред. А.В. Караулова. М.: Изд-во РАЕН, 2000. С. 179—190. 51. Шальнова С.А., Деев А.Д., Карпов Ю.А. Артериальная гипертония и ишемическая болезнь сердца в реальной практике врачакардиолога. Кардиоваскулярная Терапия и Профилактика 2006; (1): 73-80. 52. Шварц Ю.Г., Маршалкина Н.А., Елисеев Д.В. Показатели воспаления, Chlamydia pneumoniae и дисперсия интервала QT у больных ишемической болезнью сердца и пароксизмальной фибрилляцией предсердий // Вестник аритмологии. 2001, №23 С. 43-47. 53. Шевченко О.П., Шевченко А.О. Статины. Ингибиторы ГМГ– КоА редуктазы. Реафарм, Москва, 2002, 112 с. 54. Шевченко Ю.Л., Бобров Л.Л., Обрезан А.Г. Диастолическая функция левого желудочка // М. Гэотар-мед. 2002. С. 90-128. 55. Федулаев Ю.Н., Лебедева А.Ю., Гордеев И.Г., Клыков Л.Л., Щелкунова И.Г., Ромашенко О.В. О взаимосвязи дисперсии интервала QT, продолжительности ишемии миокарда и степени выраженности 96 коронарного атеросклероза у больных ИБС с безболевыми эпизодами ишемии миокарда. Российский кардиологический журнал. 2006. № 5. С. 29-33. 56. Adams V., Jiang H., Yu J. et al. Apoptosis in skeletal myocytes of patients with chronic heart failure is associated with exercise intolerance. J Am Coll Cardiol 1999; 33: 959-65. 57. Amar D, Zhang H, Heerdt PM, et al. Statin use is associated with a reduction in atrial fibrillation after noncardiac thoracic surgery independent of C-reactive protein. Chest 2005; 128: 3421-7. 58. American Diabetes Association: Management of Dyslipidemia in Adults with Diabetes. Diabetes Care 27 (Suppl. 1), 2004: S68-S71. 59. Anker S.D., Chua T.P., Ponikowski P., Harrington D., Swan J.W., Kox W.J. et al. Hormonal Changes and Catabolic/Anabolic Imbalance in Chronic Heart Failure and Their Importance for Cardiac Cachexia. Circulation 1997; 96:526–34. 60. Anker S.D., Egerer K., Volk H-D. et al. Elevated soluble CD 14 receptors and altered cytokines in chronic heart failure. Am J Cardiol 1997; 79: 1426-30. 61. mild to Araujo J.P. et al. Cholesterol—A marker of nutritional status in moderate heart failure. Int J Cardiol, 2007, doi:10.1016/j.ijcard.2007.05.026. 62. Bezafibrate and simvastatin combination therapy for diabetic dyslipidaemia: efficacy and safety. J. Intern. Med. 2000 May; 247(5):563-9. 63. Bocan T.M. Pleiotropic effects of HMG-CoA reductase inhibitors // Curr. Opin. Investig. Drugs. – 2002. – Vol. 3, № 9. – P. 1312-1317. 64. Bozkurt B., Kribbs S.B., Clubb F.J. et al. Pathophysiologically relevant concentrations of tumor necrosis factor-a promote progressive left ventricular dysfunction and remodeling in rats. Circulation 1998; 97: 1382-91. 97 65. Boveda S., Galinier M., Pathak A. et al. Prognostic value of heart rate variability in time domain analysis in congestive heart failure // Interv. Card. Electrophysiol. – 2001. – Vol. 5. – P. 181–187. 66. Braunwald E. Heart disease. 8-th Ed. W.B. Saunders company. 2008. P.657. 67. Bustos C.C., Hemandez–Presa M.A., Ortego M. et al. HMG–CoA reductase inhibition by reduces neointimal inflammation in a rabbit model of atherosclerosis. J Am Coll Cordial. 1998; 2:2057–2064. 68. Callahan A.S. Vascular pleiotropy of statins: clinical evidence and biochemical mechanisms. Curr. Atherosclerosis Rep. 2003; 5: 33–37. 69. Cannon C.P., Steinberg B.A., Murphy S.A. et al. Meta-Analysis of Cardiovascular Outcomes Trials Comparing Intensive Versus Moderate Statin Therapy. J Am Coll Cardiol. Aug. 1, 2006;48:438–45. 70. Cannon C.P., Braunwald E., McCabe C.H. et al. For the Pravastatin or atorvastatin evaluation and infection therapy – trombolysis in myocardial infarction 22 investigators. Intensive versus moderate lipid lowering with statins after acute coronary syndromes // New Engl. J. Med. – 2004. – Vol. 350. – P. 1495-1504. 71. Cargill R.I., Kiely D.G., Lipworth B.J. Adverse effects of hypoxaemia on diastolic filling in humans // Сlin. Sci. 1995. Vol.89. № 2. P.165-169. 72. Cascio WE. Myocardial ischemia: what factors determine arrhythmogenesis? J Cardiovasc Electrophysiol 2001; 12: 726-9. 73. Christ M., Klima T., Grimm W., Mueller H.H., Maisch B. Prognostic significance of serum cholesterol levels in patients with idiopathic dilated cardiomyopathy. Eur Heart J 2006; 27:691–9. 74. Chung MK, Martin DO, Sprecher D, et al. C'reactive protein in patients with atrial arrhythmias: inflammatory mechanisms and persistence of atrial fibrillation. Circulation 2001; 104: 2886-91. 98 75. Costa J., Borges M., David C., Vaz Carneiro A. Efficacy of lipid lowering drug treatment for diabetic and non-diabetic patients: meta-analysis of randomised controlled trials. BMJ. May 13, 2006; 332;1115-1124. 76. Dernellis J, Panaretou M. Relationship between C-reactive protein reduction on paroxysmal atrial fibrillation. Am Heart J 2004; 150: 1064. 77. Donati MI, Elnicki DM, Jain AC, Gibson CM. Effect of preoperative statin therapy and cardiac outcomes after coronary bypass grafting. Am J Cardiol 2000; 86(10): 1128-30. 78. Endo A. The discovery and development of HMG-CoA reductase inhibitors // J. Lipid Res. — 1992. — Vol. 33, № 11. — P. 1569–1582. 79. Faergeman O. Evolution of statin therapy: an ongoing story, Europ Heart J, 2004, v.6, suppl A: A3–A7. 80. Farmer J.A. Pleitropic effevts of statins.Curr Atherosclerosis report 2000; 2: 208–217. 81. Frenette P.S. Lockin a leukocyte integrin with statin. New Engl J Med 2001; 345: 1419–1421. 82. Fonarow GC, Wright RS, Spencer FA, et al. National registry of myocardial infarction 4 investigators: effect of statin use within 24 the first 24 hours of admission for acute myocardial infarction on early morbidity and mortality. Am J Cardiol 2005; 26: 611-6. 83. Futterman L.G., Lemberg L. Statin pleiotropy: fact or fiction? // Amer. J. Crit. Care. – 2004. – Vol. 13. – № 3. – P. 244-249. 84. Gensini F, Padeletti L, Fatini C, et al. Angiotensin-converting enzyme and endothelial nitric oxide synthase polymorphisms in patients with atrial fibrillation. Pacing Clin Electrophysiol 2003; 26: 295-8. 85. Goldberger J, Subacius H, Schaechter A. Effects of statin therapy on arrhythmic events and survival in patients with nonischemic dilated cardiomyopathy. JACC 2006; 6: 1230-3. 86. Grines C.L. The role of statins in reversing atherosclerosis: what the latest regression studies show. J Interv Cardiol, 2006 Feb; 19(1): 3–9. 99 87. Gupta E.K., Ito M.K. Ezetimibe: The First in a Novel Class of Selective Cholesterol-Absorption Inhibitors. Heart Dis 2002;4:399-409. 88. Gurlek A., Kilikcap M., Dandachi R. et al. Tumor necrosis factor- alpha in diastolic heart failure. Eur J Heart failure 2000; 2 (Suppl. 2): P28/10381. 89. Guzzetti S., La Rovere M. T., Pinna G. D. et al. Different spectral components of 24 h heart rate variability are related to different modes of death in chronic heart failure // Ibid. – 2005. – Vol. 26. – P. 357–362. 90. Hasper D., Hummel L., Kleber F.X. et al. Systemic inflammation in patients with heart failure. Eur Heart J 1998; 19: 761-5. 91. Effects Hernandez–Perera O., Perez–Sala D., Navarro–Anlolin J. еt al. of the 3–hydroxy–3–methylglutaryl–CoA reductase inhibitors, atorvastatin and simvastatin on the expression of endothelin–1 and endothelial nitric oxide synthase in vascular endothelial cells. J Clin Invest 1998:101:2711–2719. 92. Horwich T.B., Hamilton M.A., Maclellan W.R., Fonarow G.C. Low serum total cholesterol is associated with marked increase in mortality in advanced heart failure. J Card Fail 2002; 8:216–24. 93. Iribarren C. Cohort study of serum total cholesterol and in– hospital incidence of infectious diseases. Epidemiol Infect 1998; 121:335–47. 94. Inoue I., Goto S., Mootani K. et al. Lipophilic HMG–CoA reductase inhibitor has an anti–inflammatory effect: reduction of MRNA levels for interleukin–1 beta, interleukin–6. cyclooxygenase–2, and p22phox by regulation of peroxisome proliferator–activated receptor alpha (PPARalpha) in primary endothelial cells. Life Sci 2000:67:863–876. 95. Kalantar–Zadeh K., Block G., Horwich T., Fonarow G.C. Reverse epidemiology of conventional cardiovascular risk factors in patients with chronic heart failure. J Am Coll Cardiol 2004; 43:1439–44. 100 96. Kayikcioglu M, Can L, Evrengul H, et al. The effect of statin therapy on ventricular late potentials in acute myocardial infarction. Int J Cardiol 2003; 90: 63-72. 97. Kimura M, Kurose I, Russell J et al. Effects of fluvastatin on leukocyte– endothelial cell adhesion in hypercholesterolemic rats. Arterioscler Thromb Vasc Biol 1997; 17:1521–6. 98. Kosmala W., Spring A., Witkowska M. Relationship between systolic and diastolic function of the left ventricle in patients with impaired relaxation of the left ventricle without symptoms of heart failure. Attempt at quantitative estimation of diastolic function in the impaired relaxation stage // Pol.Arch.Med.Wewn. 1997. Vol. 98. №11. P.414-423. 99. Kwak B., Mulhaupt F., Myit S., Mach F. Statins as a newly recognized type of immunomodulator // Nat Med. 2000, Dec; 6: 1399–1402. 100. Krum H. et al. Statins and symptomatic chronic systolic heart failure: A post–hoc analysis of 5010 patients enrolled in Val–HeFT. Int J Cardiol 2007, 119:48–53. 101. Kureishi Y. Luo Z., Shiojima I. et al. HMG–CoA reductase inhibitor simvastatin activates the protein kinase Akt and promotes angiogenesis m normocholesterolemic animals . Nat Med 2000:6:1004–1010. 102. Lee TM, Chou TF, Tsai CH. Effects of pravastatin on cardiomyocyte hypertrophy and ventricular vulnerability in normolipidemic rats after myocardial infarction. J Mol Cell Cardiol 2003; 35: 1449-59. 103. Liao J.K. Isoprenoids as mediator of the biological effect of statins. J Clin Invest, 2002; v. 110: 285–288. 104. Liu T., Li G.P. Statins may prevent postoperative atrial fibrillation through autonomic modulation. Am J Cardiol 2006; 97: 1266. 105. Loh P.H. et al. The effects of initiation or continuation of statin therapy on cholesterol level and all–cause mortality after the diagnosis of left ventricular systolic dysfunction Am Heart J 2007; 153:537–44. 101 106. McFarline S.I., Muniyappa R., Francisco R., Sowers J.R. Pleiotropic effects of statins: lipid reduction and beyond. J Clin Endocrinol Metab. 2002; 87: 1451–1458. 107. MacGowan G., Mann D.L., Kormos R.L. et al. Circulating interleukin-6 in severe congestive heart failure. Am J Cardiol 1997; 79: 112831. 108. Makikallio T. H., Huikuri H. V., Hintze U. et al. Fractal analysis and time- and frequency-domain measures of heart rate variability as predictors of mortality in patients with heart failure // Am. J. Cardiol. – 2001. – Vol. 87. – P. 178–182. 109. Marin F, Pascual DA, Roldan V, et al. Statins and postoperative risk of atrail fibrillation following coronary artery bypass grafting. Am J Cardiol 2006; 97(1): 55-60. 110. Mason J.C. Statins and their role in vascular protection // Clin. Sci (Lond.). – 2003. – Vol. 105, № 3. – Р. 251-266. 111. Mikami T. Cardiovascular ultrasound: applications for the assessment of cardiac function // J. Rinsho Byori 2001; 49; 325-333. 112. Mitchell L.B., Powel J.L., Gillis A.M., et al. AVID investigators: are lipid-lowering drugs also antiarrhythmic drugs? An analysis of the Antiarrhythmics versus Implantable Defibrillators (AVID) trial. JACC 2003; 42: 81-7. 113. Mozaffarian D., Nye R., Levy W.C. Statin therapy is associated with lower mortality among patients with severe heart failure. Am J Cardiol 2004; 93:1124–9. 114. Mungall M.M., Gaw A. Statin therapy in the elderly. Curr Opin Lipidol, 2004, 15:453–457. 115. Nishimura R.A., Tajik A.J. Evaluation of diastolic filling of left ventricle in health and disease: Doppler echocardiography in the clinician’s Rosetta Stone // J. Am. Coll. Cardiol. 1997. Vol.30.N 1. P.8-18. 102 116. Nissen S.E., Nicholls S.J., Sipahi I. et al. Effect of Very HighIntensity Statin Therapy on Regression of Coronary Atherosclerosis. The ASTEROID Trial. JAMA. Mar. 13, 2006; 295. 117. Omi H., Okayama N., Shimizu M. et al. Statins inhibit high glucose-mediated neutrophil-endothelial cell adhesion through decreasing surface expression of endothelial adhesion molecules by stimulating production of endothelial nitric oxide // Microvasc. Res. – 2003. – Vol. 65, № 2. – P. 118-124. 118. Onder G., Landi F., Volpato S., Fellin R., Carbonin P., Gambassi G. et al. Serum cholesterol levels and in–hospital mortality in the elderly. Am J Med 2003;115:265–71. 119. Pan W, Pintar T, Anton J, et al. Statins are associated with a reduced incidence of perioperative mortality after coronary artery bypass graft surgery. Circulation 2004; 110: II45-9. 120. Pasceri V., Willerson J. Т., Yeh Е. Т. Direct proinflammatory effect of C-reactive protein on human endothelial cells. Circulation 2000; 102: 2165-2168. 121. Pasceri V., Chang J., Willerson J.T., Yeh E.T. Modulation of Creactive protein-mediated monocyte chemoattractant protein-1 induction in human endothelial cells by anti-atherosclerosis drugs. Circulation 2001;103:2531—2534. 122. Patel AA, White M, Shah S, et al. The relationship between statin use and atrial fibrillation. Curr Med Res and Opin 2007; 5: 1177-85. 123. Pehlivanidis AN, Athyros VG, Demitrias DS, et al. Heart rate variability after long-term treatment with atorvastatin in hypercholesterolaemic patients with or without coronary artery disease. Atherosclerosis 2001; 157: 463-9. 124. Poredos P. Endothelial dysfunction in the pathogenesis of atherosclerosis. Clin. Appl. Thromb. Hemost. 2001; 7(4):276-80. 103 125. Portal V.L., Moriguchi E.H., Vieira J.L., Schio S., Mastalir E.T., Buffe F., Bortolini E.B., Bruch R.S., Rodrigues R. «Comparison of the effect of two HMG CoA reductase inhibitors on LDL susceptibility to oxidation» Arq Bras Cardiol. 2003; 80 (2):156–61, 150–5. 126. Prandoni P., Bilora F., Marchiori A. et al. An association between atherosclerosis and venous thrombosis. New Engl J Med 2003; 348: 1435– 1441. 127. Rauchhaus M., Dohner W., Koloczek V. et al. Systemically measured cytokines are independently predictive for increased mortality in patients with chronic heart failure. J Am Coll Cardiol 2000; 35 (Suppl. A): 1183. 128. Rauchhaus M., Clark A.L., Doehner W., Davos C., Bolger A., Sharma R., Coats A.J., Anker S.D. The relationship between cholesterol and survival in patients with chronic heart failure. J Am Coll Cardiol 2003; 43:1933–40. 129. Rauchhaus M., Koloczek V., Volk H., Kemp M., Niebauer J., Francis D.P. et al. Inflammatory cytokines and the possible immunological role for lipoproteins in chronic heart failure. Int J Cardiol 2000; 76:125–33. 130. Ridker Р.М. et all. C-Reactive Protein Levels and Outcomes after Statin Therapy. N Engl J Med Jan. 6, 2005; 352:20-8. 131. Ridker P.M., Morrow D.A., Rose L.M. et al. Relative Efficacy of Atorvastatin 80 mg and Pravastatin 40 mg in Achieving the Dual Goals of Low-Density Lipoprotein Cholesterol <70 mg/dl and C-Reactive Protein <2 mg/l. An Analysis of the PROVE-IT TIMI-22 Trial. J Am Coll Cardiol. May 17, 2005; 45:1644–8. 132. Rikitake Y., Kawashima S., Takeshita S. et al. Anli–oxidative properties of fluvastatin, an HMG–CoA reductase inhibitor, contribute to prevention of atherosclerosis in cholesterol–fed rabbits. Atherosclerosis 2001:154:87–96. 104 133. Rosolova H., Cech J., Simon J., Spinar J., Jandova R.,Widimsky sen J. et al. Short to long term mortality of patients hospitalised with heart failure in the Czech Republica report from the EuroHeart Failure Survey. Eur J Heart Fail 2005; 7:780–3. 134. Schatz I.J., Masaki K., Yano K., Chen R., Rodriguez B.L., Curb J.D. Cholesterol and all–cause mortality in elderly people from the Honolulu Heart Program: a cohort study. Lancet 2001; 358:351–5. 135. Scandinavian Simvastatin Survival Study Group. Randomized trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet, 1994, 344: 1383–1389. 136. Scalia R, Gooszen M E , Jones S.P et al. Simvastatin exerts both anti-inflammatory and cardioprotective effects in apolipoprotcin H-deficicnt mice. Circulation. 2001, 103: 2598-2603. 137. Sever P.S., Poulter N.R., Dahlof B. et al. Reduction in cardiovascular events with atorvastatin in 2,532 patients with type 2 diabetes: Anglo-Scandinavian Cardiac Outcomes Trial-lipid-lowering arm (ASCOTLLA). Diabetes Care 2005; 28 (5): 1151–7. 138. Shamsham F., Mitchell I. Essentials of the diagnosis of heart failure // Cover article.-Cardiovascular medicine update. - 2000. - V. 61 (5). Р. 1319- 1327. 139. Siu C. W., Lau C. P., Tse H. F. Prevention of atrial fibrillation recurrence by statin therapy in patients with lone atrial fibrillation after successful cardioversion. Am J Cardiol 2003; 92(11): 1343-5. 140. Soto J., Beller G. Clinical Benefit of Noninvasive Viability Studies of Patients with Severe Ischemic Left Ventricular Dysfunction // Clin. Cardiol. - 2001. – №24 - P. 428-434. 141. Spargias K.S., Lindsay S.J., Kawar G.I. et al. QT dispersion as a predictor of long-term mortality in patients with acute myocardial infarction and clinical evidence of heart failure//Eur. Heart J. 1999. Aug.20 (16): 11581165. 105 142. Sparrow CP, Burton CA, Hernandez M, et al. Simvastatin has antiinflammatory and antiatherosclerotic activities independent of plasma cholesterol Arterioscler. Thromb. Vasc. Biol.lowering. 2001;21:115-121. 143. Sredniawa В., Musialik Lydka А., Pasyk S. Dispersion of the QT interval in unstale angina pectoris//Pol. Arch. Med. Wewn.— 2000.— Vol. 103.— P. 41 — 45. 144. Strandberg T.E., Vanhanen H, Tikkonen M.J. Effect of statins on C-reactive protein in patients with coronary artery disease. Lancet 1999; 353: 118-9. 145. Sutton M., Sharpe N. Left Ventricular Remodeling After Myocardial nfarction. Pathophysiology and Therapy // Circulation. - 2000. №101 - p. 2981-2987. 146. Teasta M., Yeh M., Lee P. et al. Circulating levels of cytokines and their endogenous modulators in patients with mild to severe congestive heart failure due to coronary artery disease or hypertension. J Am Coll Cardiol 1996; 28: 964-71. 147. Torre-Amione G., Kapadia S., Benedict C. et al. Proinflammatory cytokine levels in patients with depressed left ventricular ejection fraction: a report from of SOLVD. J Am Coll Cardiol 1996; 27: 1201-6. 148. Tsiara S, Elisaf M, Mikhalaidis DP. Early vascular benefits of statin therapy. Curr Med Res Opin 2003; 19: 540-56. 149. Vanderheyden M., Kersschot E., Paulus W. Pro-inflammatory cytokines and endothelium-dependent vasodilatation in the forearm. Eur Heart J 1998; 19: 747-52. 150. Van der Harst P., Voors A.A., van Gilst W.H., Bohm M., van Veldhuisen D.J. Statins in the treatment of chronic heart failure: A systematic review // PloS Med. — 2006. — Vol. 3, № 8, e333. — P. 1403–1413. 151. Vasan R.S., Benjamin E.J., Levy D. Congestive heart failure with normal left ventricular systolic function. Arch. Intern. Med. 1996. №156. P.146-157. 106 152. Vredevoe D.L., Woo M.A., Doering L.V., Brecht M.L., Hamilton M.A., Fonarow G.C. Skin test anergy in advanced heart failure secondary to either ischemic or idiopathic dilated cardiomyopathy. Am J Cardiol 1998; 82:323–8. 153. Vrotcek B, Okrajcek R, Golicnik A, et al. Atrovastatin Therapy Increases Heart Rate Variability, Decraeses QT Variablility, and shortens QTc Interval Duration in Patients With Advanced Chronic Heart Failure. J Card Fail 2005; 9: 684-90. 154. Walter D.H., Fichtischerer S., Britten M.B.Р. 2006—2012. et al. // J. Amer. Coll. Cardiol. — 2001. — V. 38. 155. Watanabe M.A. Heart Rate Turbulence: a Review // Indian Pacing Electrophysiol. J.- 2003.- Vol.3.- P.10-22. 156. Weverling–Rijnsburger A.W.E., Blauw G.J., Lagaay A.M., Knook D.L., Meinders A.E., Westendorp R.G.J. Total cholesterol and risk of mortality in the oldest old. Lancet.1997;350:1119–23. 157. Wierzbicki A.S., Poston R., Ferro A. The lipid and non-lipid effects of statins // Pharmacol. Ther. – 2003. – Vol. 99, № 1. – P. 95-112. 158. Wilhelmsen L. Heart failure in the general population of men— morbidity, risk factors and prognosis. J Intern Med 2001; 249:253–61. 159. Young-Xu Y, Jabbour S, Goldberg R, et al. Usefulness of statin drugs against atrial fibrillation in patients with coronary artery disease. Am J Cardiol 2003; 92(12): 1379-83. 107