ВОПРОСЫ ДЛЯ ПОДГОТОВКИ К ЗАЧЕТУ ПО ХИМИИ
advertisement

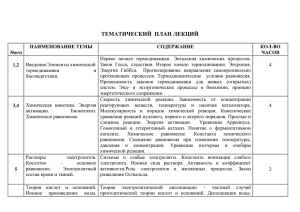
ВОПРОСЫ ДЛЯ ПОДГОТОВКИ К ЗАЧЕТУ ПО ХИМИИ ДЛЯ СТУДЕНТОВ СТОМАТОЛОГИЧЕСКОГО ФАКУЛЬТЕТОВ 2013-2014 УЧ.Г. 1. Основные понятия термодинамики. Интенсивные и экстенсивные свойства системы. Внутренняя энергия. Работа и теплота - две формы передачи энергии. Типы термодинамических систем (изолированные, открытые, закрытые) и процессов (изотермические, изобарические, изохорические). 2. Первое начало термодинамики. Энтальпия. Стандартная энтальпия образования, стандартная энтальпия сгорания. Закон Гесса. Термохимические процессы. Применение первого начала термодинамики к биосистемам. Примеры экзэргонических и эндэргонических процессов, протекающих в организме. 3. Второе начало термодинамики Обратимые и необратимые в термодинамическом смысле процессы. Энтропия. Энергия Гиббса. Стандартная энергия Гиббса. Прогнозирование направления самопроизвольного процесса в изолированной и закрытой системах. Роль энтальпийного и энтропийного факторов. 4. Химическое равновесие. Обратимые и необратимые по направлению реакции. Термодинамические условия равновесия. Константы химического равновесия. Прогнозирование смещения химического равновесия. 5. Предмет и основные понятия химической кинетики. Химическая кинетика как основа для изучения скоростей и механизмов биохимических процессов. Скорость реакции. Классификации реакций, применяющиеся в кинетике: реакции гомогенные, гетерогенные; реакции простые и сложные. Молекулярность реакции. Кинетические уравнения. Порядок реакции. Период полупревращения. 6. Зависимость скорости реакции от концентрации реагентов Кинетические уравнения реакций первого, второго и нулевого порядков. 7. Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции и его особенности для биохимических процессов. Понятие о теории активных соударений. Энергетический профиль реакции; энергия активации; уравнение Аррениуса. 8. Катализ. Гомогенный катализ, гетерогенный катализ. Особенности каталитической активности ферментов. 9. Роль воды и растворов в жизнедеятельности. Физико-химические свойства воды, обуславливающие её уникальную роль как единственного биорастворителя.; влияние внешних условий на растворимость. Термодинамика растворения. 10. Понятие об идеальном растворе. Константа растворимости. Условия растворения и образования осадков. 11. Коллигативные свойства разбавленных растворов неэлектролитов и электролитов. Закон Рауля и следствия из него; понижение температуры кристаллизации, повышение температуры кипения растворов, осмос. Осмотическое давление, закон Вант-Гоффа. Осмотические свойства растворов электролитов. Гипо-, гипер- и изотонические растворы. Изотонический коэффициент. Понятие об изоосмии (электролитном гомеостазе). Роль осмоса в биологических системах. Плазмолиз и гемолиз 12. Элементы теории растворов электролитов. Сильные и слабые электролиты. Константа ионизации слабого электролита. Закон разведения Оствальда. Ионная сила раствора. Активность и коэффициент активности ионов. Электролиты в организме. 13. Основные положения протолитической теории кислот и оснований Бренстеда-Лоури; сопряженная протолитическая пара, амфолиты. Теория Льюиса. 14. Автопротолиз воды. Константа автопротолиза воды. Водородный показатель. 15. Типы протолитических реакций. Понятие о гидролизе. Роль гидролиза в биохимических процессах. Ацидиметрия и алкалиметрия. 16. Буферные системы; их классификация и механизм действия. Буферные системы крови: бионеорганические и биоорганические. Буферная емкость. Кислотно-основный баланс организма. 17. Лигандообменные реакции. Основные положения координационной теории Вернера. Комплексообразователь, лиганды, координационное число, дентатность. 18. Пространственное строение комплексных соединений. Классы комплексных соединений. Внутрикомплексные, анионные, катионные, нейтральные комплексы. 19. Комплексоны, их применение в медицине. Ионные равновесия в растворах комплексных соединений. Константа нестойкости комплексного иона. Сложные органические лиганды. Представление о строении металлоферментов.Механизм токсического действия тяжелых металлов на основе жестких и мягких кислот и оснований ( ЖМКО). 20. Понятие биогенности химических элементов. Биосфера, круговорот биогенных элементов. Классификация биогенных элементов по их функциональной роли: органогены, элементы электролитного фона, микроэлементы, ксенобиотики. Окружающая среда: химические аспекты охраны окружающей среды. 21. Квантово—механическая модель атома. Применение системы квантовых чисел для характеристики энергетического состояния электрона. основное и возбужденное состояние атома. 22. Основные характеристики ковалентной связи. Механизмы образования ковалентной связи (обменный, донорно—акцепторный). Полярная и неполярная ковалентные связи. Насыщаемость и направленность ковалентной связи. Гибридизация атомных орбиталей. Геометрия связей и пространственная структура молекул. 23. Химия элементов s-блока. Электронные структуры атомов и катионов. Сравнение свойств ионов элементов 1А- и 2А-групп (комплексообразование, образование осадков). Биологическая роль натрия, калия, кальция, магния. Химическое сходство и биологический антагонизм (натрийкалий, магний-кальций). 24. Химия элементов d-блока. Электронные структуры атомов и катионов. Наиболее важные элементы d-блока. Биологическая роль железа, марганца, хрома, цинка, серебра, меди. Образование комплексных соединений. Гидроксокомплексы; амминокомплексы; образование нерастворимых соединений. Аналитические реакции на некоторые катионы d—элементов. 25. Химия элементов p-блока. Электронные структуры атомов и ионов. Наиболее важные элементы р-блока. Реакции открытия карбонат—, фосфат- (гидрофосфат-), сульфат-, оксалат-, нитрат—ионов. 26. Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Поверхностное натяжение. Адсорбция. Поверхностноактивные, неактивные и инактивные вещества. Ориентация молекул в поверхностном слое и структура биомембран. 27. Адсорбционные равновесия на неподвижных границах раздела фаз. Физическая адсорбция и хемосорбция. Адсорбция газов на твёрдых телах. Адсорбция из растворов. Зависимость величины адсорбции от различных факторов. Избирательная адсорбция. 28. Классификация дисперсных систем: по степени дисперсности, по агрегатному состоянию фаз, по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсионной средой. Природа коллоидного состояния. Молекулярно-кинетические свойства коллоидно-дисперсных систем. 29. Оптические свойства: рассеяние света. Электрокинетические свойства: электрофорез и электроосмос. Строение двойного электрического слоя. 30. Электрокинетический потенциал и его зависимость от различных факторов. Устойчивость дисперсных систем. Устойчивость коллоидных систем. Коагуляция. Порог коагуляции и его определение. Коллоидная защита и пептизация. Коагуляция в биологических системах.. 31. Коллоидные ПАВ. Биологически важные коллоидные ПАВ (мыла, детергенты, желчные кислоты). Мицеллообразование в растворах ПАВ. Липосомы. 32. Титриметрический анализ. Химический эквивалент вещества. Молярная концентрация эквивалента вещества. Закон эквивалентов. Точка эквивалентности и способы её фиксирования. Ацидиметрия и алкалиметрия: титранты, индикаторы. 33. Окислительно-восстановительное титрование. Перманганатометрия и иодометрия: титранты, индикаторы. 34. Электродные потенциалы и механизмы их возникновения. Уравнение Нернста для вычисления электродных потенциалов. 35. Окислительно-восстановительные системы. Окислительновосстановительные потенциалы, механизм их возникновения, биологическое значение. Потенциометрия. 36. Жидкости и ткани организма как проводники второго рода. Удельная и эквивалентная электропроводимости, их изменение с разведением раствора. Эквивалентная электропроводимость при бесконечном разведении. Абсолютная скорость движения и подвижность ионов. Закон Кольрауша о независимой подвижности ионов. Гидратация ионов. Расчетные задачи на темы: Термодинамика Кинетика Химическое равновесие Коллигативные свойства растворов электролитов и неэлектролитов Кислотно-основное равновесие ( pH, гидролиз, буферные растворы) Константа растворимости (KS), комплексные соединения (KН) Титриметрия. Определение направления ОВР.