Лекарственные стенты 2012
advertisement
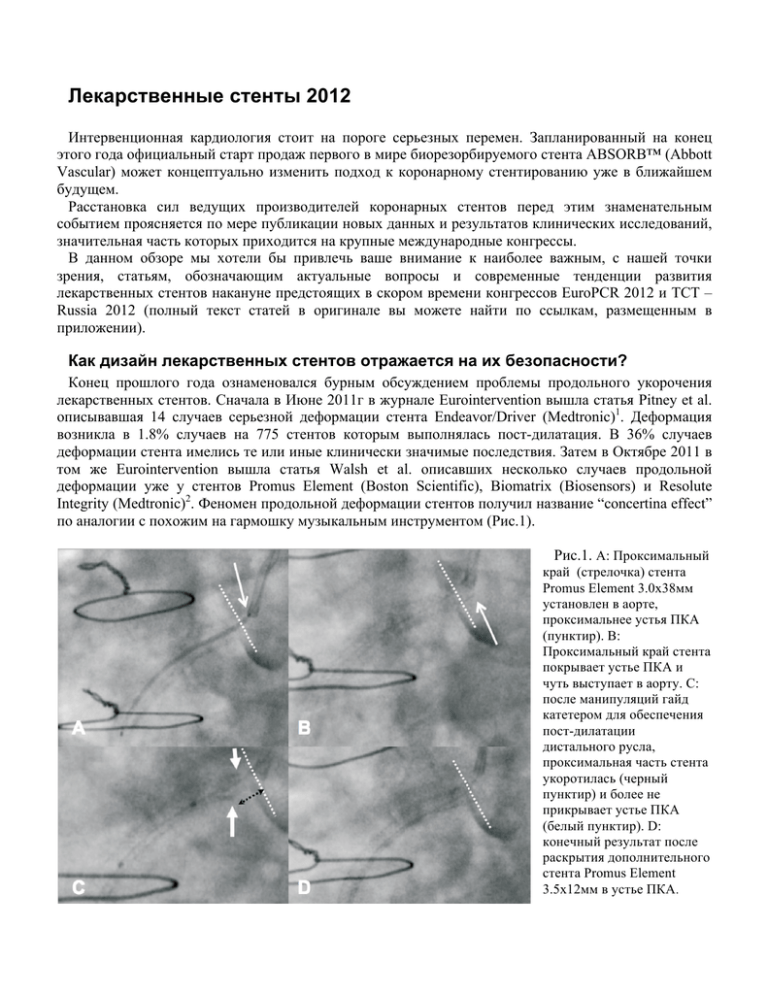
Лекарственные стенты 2012 Интервенционная кардиология стоит на пороге серьезных перемен. Запланированный на конец этого года официальный старт продаж первого в мире биорезорбируемого стента ABSORB™ (Abbott Vascular) может концептуально изменить подход к коронарному стентированию уже в ближайшем будущем. Расстановка сил ведущих производителей коронарных стентов перед этим знаменательным событием проясняется по мере публикации новых данных и результатов клинических исследований, значительная часть которых приходится на крупные международные конгрессы. В данном обзоре мы хотели бы привлечь ваше внимание к наиболее важным, с нашей точки зрения, статьям, обозначающим актуальные вопросы и современные тенденции развития лекарственных стентов накануне предстоящих в скором времени конгрессов EuroPCR 2012 и TCT – Russia 2012 (полный текст статей в оригинале вы можете найти по ссылкам, размещенным в приложении). Как дизайн лекарственных стентов отражается на их безопасности? Конец прошлого года ознаменовался бурным обсуждением проблемы продольного укорочения лекарственных стентов. Сначала в Июне 2011г в журнале Eurointervention вышла статья Pitney et al. описывавшая 14 случаев серьезной деформации стента Endeavor/Driver (Medtronic)1. Деформация возникла в 1.8% случаев на 775 стентов которым выполнялась пост-дилатация. В 36% случаев деформации стента имелись те или иные клинически значимые последствия. Затем в Октябре 2011 в том же Eurointervention вышла статья Walsh et al. описавших несколько случаев продольной деформации уже у стентов Promus Element (Boston Scientific), Biomatrix (Biosensors) и Resolute Integrity (Medtronic)2. Феномен продольной деформации стентов получил название “concertina effect” по аналогии с похожим на гармошку музыкальным инструментом (Рис.1). Рис.1. А: Проксимальный край (стрелочка) стента Promus Element 3.0x38мм установлен в аорте, проксимальнее устья ПКА (пунктир). В: Проксимальный край стента покрывает устье ПКА и чуть выступает в аорту. С: после манипуляций гайд катетером для обеспечения пост-дилатации дистального русла, проксимальная часть стента укоротилась (черный пунктир) и более не прикрывает устье ПКА (белый пунктир). D: конечный результат после раскрытия дополнительного стента Promus Element 3.5х12мм в устье ПКА. В Ноябре 2011 появилось сразу несколько аналитических публикаций на эту тему. Williams и Mamas попытались проанализировать частоту данного феномена за четыре года своей практики. Продольная деформация была отмечена почти в 1% случаев использования Promus Element (Boston Scientific) по сравнению с 0.2% для других стентов3. Авторы продолжили исследование данной проблемы и попытались выяснить частоту этого осложнения и возможные предрасполагающие факторы на основании анализа электронной базы данных FDA Manufacturer and User Facility Device Experience (MAUDE) где с 1996 года производители стентов добровольно фиксируют случаи осложнений с медицинскими устройствами с целью выявления серьезных побочных эффектов. В статье, опубликованой ими в Eurointervention в Марте 2012 указывается, что за период с 1992 по 2011 год в базе MAUDE ими было обнаружены отчеты о 57 случаях продольной деформации, при этом оказалось, что «в 2010 и 2011, 45 из 50 доложенных случаев (90%) затрагивали платинхромовую платформу Element Boston Scientific»4. При этом авторы убеждены «этот сигнал, означает, что повышенная частота случаев этого осложнения связана с появлением платформы стента Element» (Рис.2). Рис.2. Частота случаев продольной деформации стентов, внесенных в базу MAUDE по годам. Кроме того, авторы подчеркивают, что продольная деформация стента не является «классэффектом» или свойством всех тонкостенных стентов: «платформа Vision (используемая для лекарственного стента Xience V) существенно превосходит в продольной целостности платформу стента Element, несмотря на идентичную толщину стенки (81 µm). Скорее всего за низкую продольную силу ответственен уникальный дизайн стента Element с перемычками вершина-квершине со смещением и всего лишь двумя коннекторами между кольцами... также маловероятно, что рентгеноконтрастность является единственным объяснением различий в частоте событий между этими платформами». Предрасположенность определенных стентов к деформации была наглядно продемонстрирована в серии независимых тестов, проведенных Ormiston et al. и опубликованных в JACC Intervention5. В ходе теста на специально оборудованом стенде на стенты в продольном направлении прикладывалось одинаковое усилие в 0.5 Newton (N) приводящее к компрессии или растяжению стента. В результате была показана четкая разница в степени компрессии и растяжимости между различными платформами стентов, наиболее выраженная у Promus Element (Boston Scientific) и Driver (Medtronic) (Рис.3, 4). Рис.3. Сравнительное укорочение стентов при одинаковой компрессии. Рис.4. Сравнительная деформация стентов при одинаковом растяжени. В качестве основной причины продольной нестабильности, автор предположил желание производителей увеличить гибкость и доставляемость своих стентов за счет уменьшения числа коннекторов между соседними кольцами стента. У Element и Driver их всего 2, по сравнению с 3-мя у Xience или даже с 6-ю у Cypher. С этим согласны и авторы вышедшей примерно в то же время статьи Prabhu et al. протестировавшие на предмет продольного укорочения уже 14 современных платформ стентов. Однако в качестве дополнительной причины предрасположенности Promus Element к укорочению они указали также на специфический тип дизайна стента по типу «вершина-квершине» со смещением6. Кроме этого Prabhu et al. подробно перечислили возможные клинические ситуации, в которых расправленный стент может подвергнуться продольной деформации: « (1) обратный ход ВСУЗ катетера проходящего через раскрытый стент для оценки его расправления, (2) извлечение доставляющей системы стента, когда баллон застревает в ячейках раскрытого стента, (3) прохождение ранее раскрытого стента доставляющей системой стента для лечения дистального поражения, (4) прохождение ранее раскрытого стента баллоном для постдилатации стента и (5) касание гайд-катетером ранее раскрытого стента вследствие его устьевого расположения или глубокой посадки гайда». Для Boston Scientific эти публикации стали проблематичными главным образом потому, что в отличие от Medtronic, заменившего дизайн своего нового лекарственного стента на платформу Integrity, платформа Omega Element является основой для всех новых поколений стентов Boston Scientific. Кроме того, FDA обязала Boston Scientific включить предупреждение о возможности возникновения продольной деформации в инструкцию к Promus Element и Promus Element Plus, продающихся на территории США. Возможно поэтому в Марте 2012 при финансовой поддержке этой компании в Eurointervention вышла статья Kereiakes et al., проанализировавших частоту продольной деформации стентов в исследованиях PERSEUS и PLATINUM, где авторы не обнаружили случаев продольной деформации стентов на платформе Element, имплантированных пациентам в этих исследованиях7. Однако, по мнению Williams и Mamas, ранее изучавших частоту этого феномена, продольная деформация не была отмечена в исследованиях PLATINUM или PERSEUS потому, что «эти исследования включали относительно простые коронарные поражения de novo и сложные поражения...исключались....Большинство случаев ПДС, вошедших в наш анализ, соответствуют, по меньшей мере, одному из критериев исключения и не вошли бы в эти исследования» 4. Хотя дебаты относительно клинической значимости продольной деформации все еще продолжаются, данные литературы свидетельствуют, что в значительной части случаев ее возникновения требуется постдилатация и/или имплантация дополнительного лекарственного стента. То есть, как минимум, возможны ощутимые экономические последствия за счет удлинения вмешательства и увеличения затрат на инструментарий. При этом ряд ведущих интервенционистов считает эту проблему отнюдь не тривиальной с клиничечкой точки зрения. В интервью сайту TCTMD Джефри Мозес (Jeffrey W. Moses) из госпиталя NewYork-Presbyterian/University Hospital of Columbia and Cornell в частности сказал: «проблема не всегда может быть исправлена постдилатацией...Вы можете расправить стент, но вы не можете (и дальше) не деформировать его... В стенте начинает происходить множество манипуляций, увеличивается траффик». Мозес считает, что складки баллона для пост-дилатации могут зацепить деформированные ячейки и еще больше сдвинуть их. «Также вы можете получить непрекрытую диссекцию, которая приведет к окклюзии», сказал он, но «опасенее всего, что это может стать очагом образования тромба». Возможно, лучший способ минимизировать риски, это стать более разборчивым в выборе стентов c предрасположенностью к деформации, советует Мозес. «С чего бы вам захотеть использовать (такой) стент?» спрашивает он. «Я бы хотел лучше понимать какие такие преимущества в дизайне могут заставить меня иметь дело с возможными последствиями» 8. Каков стандарт современного лекарственного стента? Учитывая непрерывное развитие технологий в интервенционной кардиологии и постоянное совершенствование стентов с лекарственным покрытием (СЛП), это непростой вопрос. Для того, чтобы какой-либо СЛП можно было бы считать стандартом, он должен отвечать целому ряду критериев. Такой стент должен занимать лидирующие позиции на рынке, демонстрировать стабильную эффективность и безопасность в нескольких крупных многоцентровых рандомизированных клинических исследованиях, включающих не только простых пациентов, но и пациентов из групп с высоким риском осложнений (диабетики, протяженные поражения, сосуды малого диаметра, пациенты с острым коронарным синдромом и т.д.). При этом стент должен демонстрировать высокую степень безопасности не только по результатам рандомизированных исследований с пусть даже и сложными, но, все-же, отобранными пациентами, но также и в крупных регистрах, отражающих «реальную» клиническую практику применения различных стентов в течении нескольких лет. В качестве примера последнего вот уже много лет используется крупнейший в мире Шведский национальный регистр SCAAR (Svenska Coronar Angiografi- och Angioplastik Registret), фиксирующий результаты применения всех стентов, применяющихся в Швеции с 1989г. В мартовском номере European Heart Journal за 2012 год опубликованы результаты исследования 94384 пациентов с 2006г (время начала имплантации первых лекарственнх стентов в Швеции) до Октября 2010 куда вошли различные пациенты из реальной клинической практики, включая пациентов с ОИМ, трех-сосудистыми поражениями и/или поражением ствола ЛКА, бифуркационными поражениями, поражениями шунтов, рестенозами и ХТО9. Исследование продемонстрировало что ангиопластика с лекарственными стентами последнего поколения (Endeavor Resolute; Xience V; Promus) по сравнению с СЛП первого поколения (Cypher; Taxus; Endeavor) снижает риск клинически значимого рестеноза на 38%, риск тромбоза на 43% а риск смерти на 23% (Рис.5,6.). Следует особо отметить, что снижение риска смертни с применением новых СЛП было отмечено впервые, т.к. до этого они превосходили старое поколение СЛП только по частоте реваскуляризации и тромбозов. По сравнению с непокрытыми стентами новые лекарственные стенты показали снижение риска смерти на 45%. Рис.5. Объединенный выровненный риск рестеноза (A) и подтвержденного тромбоза стента (B) до 2х лет для непокрытых стентов (BMS), старых (o-DES) и новых (n-DES) лекарственных стентов. Рис.6. Объединенный выровненный риск рестеноза смерти до 2х лет для непокрытых стентов (BMS), старых (o-DES) и новых (n-DES) лекарственных стентов. По данным того же регистра на 19 Октября 2011г среди новых лекарственных стентов Xience V демонстрирует наименьший риск возникновения рестеноза за 3 года наблюдения (Рис.7) 10. Рис.7. Различные стенты по совокупному риску рестеноза на 19 Октября 2011г. Не менее масштабным исследованием является сетевой метанализ, результаты которого опубликованы Palmerini et al. в журнале Lancet в Марте 201211. Он объединил в себе данные 49 рандомизированных исследований лекарственных стентов у 50844 пациентов (Рис.8). Рис.8. Комбинации результатов исследований вошедших в сетевой метанализ Palmerini et al. Важно заметить, что данный метанализ является крупнейшим и наиболее полным исследованием когда-либо сравнивавшим лекарственные и непокрытые стенты. Согласно полученным результатам, «в отличие от других лекарственных стентов, кобальт-хромовый эверолимус выделяющий стент (CoCr-EES) ассоциируется со значительно меньшей частотой подтвержденного тромбоза стента за 1 и 2 года по сравнению с непокрытыми металлическими стентами; снижение тромбоза стента с CoCrEES по сравнению с непокрытыми металлическими стентами было отмечено и для ранних и для поздних тромбозов (возникающих ранее 30 дней и между 31 днем и 1 годом); CoCr-EES также ассоциируется с существенно меньшей частотой подтвержденного тромбоза стента за 1 год чем другие лекарственные стенты первого и второго поколений, включая PES, SES, PC-ZES и Re-ZES». (Рис.9). Рис.9. Частота тромбоза Xience по отношению к другим стентам в метанализе Palmerini et al. Авторы также отмечают, что «низкая частота тромбоза стента с CoCr-EES может являться следствием тромборезистентной природы флюорополимера или более быстрой эндотелизации или и того и другого.» Рис.10. Относительная тромбогенность ex vivo у металлического стента (BMS) (MULTILINK [ML] VISION), толстостенного BMS (thick-strut [TS] VISION) и лекарственного стента (XIENCE V)12. Интересно, что «концепция того, что покрытый полимером лекарственный стент безопаснее непокрытого металлического стента представляет собой сдвиг парадигмы, но она соотносится с экспериментальными данными, недавно опубликованными Kolandaivelu et al. 12. В этом исследовании, толщина ячейки и геометрия стента были ключевыми факторами определявшими тромбогенность стента и частота тромбоза стента была снижена у стентов покрытых полимеров по сравнению с эквивалентными непокрытыми металлическими стентами». (Рис.10). В сопутствующей статье Palmerini et al. редакторской заметке, John A Ormiston (Mercy Hospital, Auckland, New Zealand) и Mark W I Webster (Auckland City Hospital, New Zealand) написали: «Низкая частота тромбоза стента в течение первых двух лет после установки CoCr-EES очень убедительна. На основании этих данных, CoCr-EES стенты (Xience) должны рассматриваться в качестве стандарта для сравнения будущих улучшений дизайна (лекарственных стентов)». Д-р Ормистон также добавил, что «полученные данные могут также приостановить тех, кто разрабатывает (металлические) стенты с биорезорбируемым покрытием предполагая, что так называемые стенты эквивалентные-непокрытым-металлическим были бы менее тромбогенны». Можно ли в ближайшее время ожидать пересмотра сроков назначения двойной антиаггрегантной терапии? Имея в своем распоряжении такой безопасный лекарственный стент как Xience с исключительно низкой частотой тромбоза и даже более безопасный, чем непокрытые стенты, само собой возникает вопрос о возможности пересмотра действующих рекомендаций по длительности назначения двойной антиаггрегантной терапии (ДААТ). Впервые такая возможность начала обсуждаться еще на конгрессе ACC в 2010 году после презентации Cox et al. результатов анализа комплаинса пациентов к тиенопиридинам и частоты тромбоза стентов в исследовании Spirit III за 3 года13. Уже тогда у пациентов с XienceV, в отличие от Taxus, прекращение приема Плавикса после 6 месяцев не приводило к увеличению частоты тромбоза стента по сравнению с теми, кто продолжал принимать Плавикс положенный срок вплоть до 3х лет наблюдения. Однако на том этапе, относительно небольшой размер исследования Spirit III, включавшего около 1000 пациентов и редкость тромбоза стента как явления, позволяли лишь сгенерировать гипотезу для дальнейшего исследования. Рис.11. Тромбоз стента и досрочная отмена ДААТ за 2 года наблюдения. Слева – без отмены ДААТ за 2 года. Справа – полная отмена ДААТ 1-6 мес, 6-12 мес и 12-14 мес соответственно. Спустя два года результаты исследования SPIRIT-COMPARE DAPT Permanent Discontinuation представленного на АСС 2012 подтвердили эти данные уже на большем количестве пациентов и даже с более впечатляющими результатами (Рис.11)14. Вывод, который сделал доктор Kedhi звучал как «отмена ДААТ в любой период времени после 1 месяца ее приема не отражалась на частоте тромбоза стента за 2 года наблюдения у пациентов леченных Xience». Остается надеяться, что эти и другие результаты позволят уже в ближайшее время пересмотреть требования к срокам назначения ДААТ, по крайней мере, для одного лекарственного стента - Xience. Какие возможности открывает применение биорезорбируемых стентов? Биорезорбируемые стенты могут в ближайшее время изменить парадигму коронарной реваскуляризации. Об этом говориться в обзорной статье написанной Patrick W.Serruys et al. в Январском номере European Heart Journal за 201215. О самой возможности иметь каркасную конструкцию, имплантируемую в коронарную артерию лишь на время и исчезающую после того, когда нобходимость в ней пропадает, интервенционные кардиологи мечтали давно. Начать хотя бы с того, что необходимость в имплантации металлического стента сама по себе возникла как способ лечения диссекции сосуда, неконтролируемо возникающей при баллонной ангиопластике. При этом объем неоинтимы, образовывавшейся в ответ на имплантацию первых металлических стентов (0.65мм), фактически, был даже больше того, что возникает в ответ на баротравму при баллонной ангиопластике (0.32мм). В результате появилось новое ятрогенное заболевание – рестеноз в стенте. Лекарственные стенты частично решили эту проблему, спровоцировав, однако, другую в виде отдаленных тромбозов, профилактика которых требует назначения длительной антиагрегантной терапии, которая, в свою, очередь ассоциирована с большим риском кровотечений и т.д. Поэтому использование временных биорастворимых стентов могло бы не только уменьшить риски всех этих осложнений, но и позволить артерии восстановить свои естественные физиологические функции, например, вазомоторику. К тому же, такой подход позволяет расширить возможности дальнейшего лечения, прежде всего, для молодых пациентов с первой манифестацией заболевания коронарных артерий. Однако, авторы данного обзора, на основании данных фундаментальных исследований, а также своего уникального опыта с биорезорбируемым стентом BVS/ABSORB предполагают куда более далеко идущие последствия применения этой технологии. И хотя их гипотезы требуют дальнейшего подтверждения, они открывают перед интервенционными кардиологами совершенно фантастические перспективы. Если кратко, то, по мнению авторов, стенка артерии, будучи «скована» металлическим стентом имеет два альтернативных сценария дальнейшей адаптации или ремоделирования. Один из них направлен в сторону уменьшения просвета артерии, вследствие гиперплазии неоинтимы (рестеноз), который даже будучи снижен или отсрочен цитостатическим препаратом приводит, в конечном итоге, к дегенерации и атеросклеротическому перерождению неоинтимы, а затем дальнейшему прогрессу атеросклероза в стентированой артерии. В другом сценарии, цитостатический или цитотоксический препарат сохраняющийся на стенте, фундаментально изменяет метаболизм сосудистой стенки, ослабляя ее структуры, что в итоге приводит к ретракции стенки от сдерживающего ее металлического каркаса, и формированию поздней мальапозиции стента. На ОСТ этот феномен проявляется изображением артерии в форме «цветной капусты» (Рис.12). В тоже время данные ВСУЗ виртуальной гистологии при наблюдении за пациентами с имплантированными биорезорбируемыми стентами обнаружили интересные факты, свидетельствующие о небольшом позднем увеличении просвета артерии (10.9%) с существенным уменьшением объема атеросклеротической бляшки (12.7%) и без значимых изменений площади стенки артерии (Рис. 13). Рис.12. Уменьшение просвета и ремоделирование стентированной артерии. Рис.13. Увеличение просвета артерии после лечения биорезорбируемым стентом. В настоящее время природа этих изменений до конца не объяснена и требует дальнейшего изучения. Одна из гипотез отталкивается от результатов in vivo экспериментов на животных, в которых Эверолимус запускал цепочку биологических реакций, активирующих гены, отвечающие за аутофагию макрофагов, составляющих одну из основ атеросклеротической бляшки, обуславливая тем самым ее косвенное «самоочищение». Другим возможным механизмом может являться ингибирование липопротеин-ассоциированной фосфолипазы А2 (Lp-PLA2) отвечающей за развитие атеросклероза. Каковы бы ни были механизмы взаимодействия биорезорбируемых стентов на сосудистую стенку, этот вид терапии уже сейчас называют «реставрационной», противопоставляя традиционному стентированию. В заключение, мы надеемся, что в скором времени биорезорбируемые стенты откроют нам новую страницу интервенционной кардиологии и позволят ей совершить очередной качественный скачок в своем развитии. Приложение: 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. Pitney M, Pitney K, Jepsom N, et al. Major stent deformation/pseudofracture of 7 crown Endeavor/Micro Driver stent platform: incidence and causative factors. EuroIntervention 2011;7:256–62 Hanratty C, Walsh S. Longitudinal compression: a new complication with modern coronary stent platforms--time to think beyond deliverability? EuroIntervention 2011;7(7):872-7. Williams PD, Mamas MA, Morgan KP, El-Omar M, Clarke B, Bainbridge A, Fath-Ordoubadi F, Fraser DG. Longitudinal stent deformation: a retrospective analysis of frequency and mechanisms. EuroIntervention 2011, Nov 4. [Epub ahead of print]. Mamas M, Williams P. Longitudinal stent deformation: insights on mechanisms, treatments and outcomes from the Food and Drug Administration Manufacturer and User Facility Device Experience database. Published ahead of print on March 2, 2012 Ormiston JA, Webber B, Webster MW. Stent Longitudinal Integrity. Bench Insights Into a Clinical Problem. JACC Cardiovasc Interv 2011;4:1310-1317. Prabhu S, Schikorr T, Mahmoud T, Jacobs J, Potgieter A, Simonton C. Engineering assessment of the longitudinal compression behaviour of contemporary coronary stents. EuroIntervention 2011; Nov 7. [Epub ahead of print]. Longitudinal stent deformation: quantitative coronary angiographic analysis from the PERSEUS and PLATINUM randomised controlled clinical trials Kereiakes D, Popma J, Cannon L, Kandzar D, Kimmelstiel C, Meredith I, Teirstein P, Verheye S, Allocco D, Dawkins K, Stone G. Published ahead of print on March 25, 2012 http://www.tctmd.com/show.aspx?id=110376 Sarno G, et al. Lower risk of stent thrombosis and restenosis with unrestricted use of ‘new-generation’drug-eluting stents: a report from the nationwide Swedish Coronary Angiography and Angioplasty Registry (SCAAR). Eur Heart J 2012; 33, 606-613 http://www.ucr.uu.se/scaar/index.php/stent-reports Palmerini T, Biondi-Zoccai G, Della Riva D, et al. Stent thrombosis with drug-eluting and bare-metal stents: Evidence from a comprehensive network meta-analysis. Lancet 2012; DOI:10.1016/S0140-6736(12)60324-9. Available at: http://www.thelancet.com. Kolandaivelu K, Swaminathan R, Gibson WJ, et al. Stent thrombogenicity early in high-risk interventional settings is driven by stent design and deployment and protected by polymer-drug coatings. Circulation 2011; 123: 1400–09. David Alan Cox, Krishnankutty Sudhir, James B. Hermiller, Robert J. Applegate, Paul C. Gordon, Julie Doostzadeh, Lalitha K. Jonnavithula, Kai Koo, Thomas H. Maloney, Alexandra J. Lansky, Charles A. Simonton, and Gregg W. Stone. Evaluation of Thienopyridine Compliance and Stent Thrombosis Rates after Everolimus-Eluting and PaclitaxelEluting Stent Implantation: 3-Year Results from the SPIRIT III Analysis. J. Am. Coll. Cardiol. 55: A191.E1791. Kedhi, E. Stent Thrombosis: Insights on Outcomes and Impact of Dual Antiplatelet Therapy Permanent Discontinuation: SPIRIT II, SPIRIT III, SPIRIT IV, COMPARE. ACC 2012. Patrick W. Serruys, Hector M. Garcia-Garcia, and Yoshinobu Onuma. From metallic cages to transient bioresorbable scaffolds: change in paradigm of coronary revascularization in the upcoming decade? Eur Heart J (2012) 33(1): 16-25