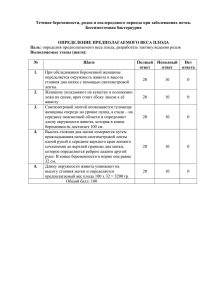
А.П. Милованов Патолого-анатомический анализ причин
advertisement

А.П. Милованов Патолого-анатомический анализ причин материнских смертей Москва — 2003 Милованов А.П. Патолого-анатомический материнских смертей. - М.: Медицина, 2003. - 76 с. анализ причин Милованов Андрей Петрович — доктор медицинских наук, профессор, член-корреспондент РАЕН, руководитель отдела патологической анатомии (дир. — доктор медицинских наук, профессор Л.В. Кактурский) НИИ морфологии человека РАМН, консультант Московского городского центра патолого-анатомических исследований. Рецензент: Калитеевский Павел Федорович, докотор медицинских наук, профессор. ВВЕДЕНИЕ Значительное количество материнских смертей (МС) — актуальнейшая проблема современного здравоохранения во многих странах. По данным 1-го Всемирного конгресса по проблемам материнской смертности (Марокко, 1997), из 600 тыс. ежегодно погибающих женщин от акушерских кровотечений умирает 130 тыс., сепсиса — 130 тыс., эклампсии — 110 тыс., последствий абортов — 80 тыс., разрывов матки, эмболии околоплодными водами — 80 тыс. и от экстрагенитальных заболеваний -- 80 тыс. Для объективного и сопоставимого учета количеств, МС важно иметь единую интерпретацию их первоначальных причин в соответствии с Международной статистической классификацией болезней и проблем, связанных со здоровьем (МКБ-10). Анализ причин гибели беременных женщин самый трудный раздел работы врачей-патологоанатомов и судебно-медицинских экспертов, поскольку каждый такой случай имеет особое социальное и юридическое значение и, как правило, является финалом многих оперативных вмешательств, массивного лекарственного и трансфузиопного лечения, длительной реанимации. Имеются и организационные несогласованности разобщение работы патологоанатома, проводящего вскрытие умершей женщины, и патологоанатома, который изучает ампутированную матку, послед или погибший плод, новорожденного. Эти сложности усугубляются тем, что до настоящего времени в системе повышения квалификации патологоанатомов отсутствовал специальный цикл усовершенствования, посвященный углубленному изучению акушерских и жстрагенитальных причин МС. Патоморфология органов умерших матерей представлена в редких статьях (Н.Ф. Каньшина, Т.Ф. Симонова, 1989; О.А.Леденева, 1986; Г.П. Титова, Н.И. Тихомирова, 1995) и монографиях (H.L. Sheehan, J. B. Lunch, 1973; Н.К. Пермяков, 1979; Д.Д. Зербино, Л. Л. Лукасевич, 1989; И.В. Тимофеев, 1999). Обобщив опыт изучения более 100 аутопсий беременных женщин в Москве и регионах России, мы предложили новый, системный подход в определении причин МС, осуществляя его в рамках всей репродуктивной системы мать—плацентарное ложе матки—плацента—плод (А. II. Милованов и соавт., 1999). Такое объединение необходимо потому, что морфологические изменения плацентарного ложа матки и последа являются наиболее информативными. Они полнее и ярче отражают первоначальную причину МС, чем данные последующей, как правило, отсроченной аутопсии, поскольку смерть женщины наступает чаще всего спустя несколько дней или даже педель после родов, интенсивной терапии и реанимации. Одной из главных задач патолого-анатомической службы России является обеспечение достоверности данных о причинах смерти населения, в том числе и МС, что всецело зависит от единых правил формулировки патолого-анатомического диагноза, заполнения медицинского свидетельства о смерти и последующего кодирования основного заболевания. Столь же важной представляется и заключительная задача, стоящая перед патологоанатомом, — сопоставление заключительного клинического и патолого-анатомического диагнозов МС, а также определение категорий и причин их расхождения, т. е. контроль качества диагностики и лечения умерших женщин. Цель данного приложения заключается в том, чтобы: 1) охарактеризовать проблему МС в целом по России и в отдельных ее регионах; 2) понять исходные механизмы акушерских и экстрагенитальных осложнений, берущих, как правило, начало в геста-ционной перестройке систем и органов женщины; 3) обосновать практическую необходимость комплексного анализа системы мать—маточно-плацентарная область-плацента—плод; 4) представить морфологические критерии диагностики первоначальных причин МС и оформления их в соответствии с МКБ-10; 5) напомнить требования к оценке расхождения заключительного клинического и патолого-анатомического диагнозов. В приложении широко используются нормативные материалы и статистические показатели материнской смертности, представленные Минздравом РФ (1997, 1998, 2000), в том числе и разработанные нами Методические указания № 2001/193 "Принципы построения заключительного клинического и патологоанатомического диагнозов при материнской смерти" (М., 2001). 1. ТРЕБОВАНИЯ МКБ-10 ПО АНАЛИЗУ ПРИЧИН МАТЕРИНСКИХ СМЕРТЕЙ 1.1. Дефиниции. Материнская смертность в России В МКБ-10 среди акушерских заболеваний (класс 15) представлены нозологические формы, соответствующие следующим дефинициям: МС определяется как обусловленная беременностью (независимо от ее продолжительности и локализации) смерть женщины, наступившая в период беременности или в течение 42 дней после ее окончания от какой-либо причины, связанной с беременностью, отягощенной ею или ее ведением, но не от несчастного случая или случайно возникшей причины. Случаи МС подразделяются на две группы. Смерть, непосредственно связанная с акушерскими причинами: смерть в результате акушерских осложнений состояния беременности (т. е. беременности, родов и послеродового периода), а также в результате вмешательств, упущений, неправильного лечения или цепи событий, последовавших за любой из перечисленных причин. Смерть, косвенно связанная с акушерскими причинами: смерть в результате существовавшей прежде болезни или болезни, развившейся в период беременности вне связи с непосредственной акушерской причиной, но отягощенной физиологическим воздействием беременности. С целью учета МС применяются различные показатели. В приказе Минздрава СССР от 24 октября 1989 г. № 584 "О переходе на расчеты показателя материнской смертности в соответствии с определением ВОЗ" подчеркнуто, что показатель материнской смертности (ПМС) рассчитывается путем деления числа умерших беременных женщин, рожениц и родильниц в данном городе или в административном регионе за 1 год на число живорожденных за это же время и умножения на 100 000. Как и раньше в СССР, в РФ сохраняется очень высокий ПМС. Так, этот показатель в 1986 г. составил 47,7, в 1987 г. — 46,3, в 1988 г. - 43,0, в 1993 г. - 63,9, в 1994 г. - 63,3 и в 1995 г. — 58,7, что намного выше, чем среднеевропейский ПМС (примерно 36). В Норвегии и Швейцарии он составляет 6, в Финляндии — 11, во Франции — 15, в США — 24—26. При более благополучной ситуации с материнской смертностью в центральночерноземных областях, где ПМС равен 30—45, в большинстве регионов России он превышает 60, а в 15 областях оказывается выше 80 (Калмыкия, Тына, Хакасия, Якутия, Приморский и Хабаровский края и т. д.). В Москве ПМС был равен: в 1993 г. 65,7, к 1994 г. — 69,3 и в 1995 г. — 60,7, или 30—35 женщин в год. В последую щие годы ПМС в Москве сохраняется на таком же уровне. По данным Минздрава РФ (2000 г.), общий ПМС в России в 1997 г. составил 54,8, в 1998 г. — 49,9 и в 1999 г. — 48,3, в абсолютных цифрах — это 690, 640 и 587 женщин соответственно. При незначительных ежегодных колебаниях среди нозологических причин МС в России на первое место выходят акушерские кровотечения (24—25%), на второе — так называемые гес-тозы (20—25%), на третье — экстрагенитальные заболевания (16—18%), на четвертое — септические осложнения (14—15%), на пятое — анестезиологические осложнения (7,5—8%), на шестое — эмболия околоплодными водами и воздушная эмболия (6—7%), на седьмое — тромбоэмболия легочной артерии — ТЭЛА (4—5%), на восьмое — разрывы матки (3,6—4%), на девятое — прочие акушерские осложнения. В качестве причины МС могут быть только нозологические формы или осложнения, которые отвечают вышеприведенным определениям и перечислены в 15-м классе "Беременность, роды и послеродовой период (ООО—О99)", кроме нескольких исключений: — болезнь, вызванная ВИЧ; — травмы, отравления и другие последствия внешних причин; — акушерский столбняк; — послеродовой некроз гипофиза; — послеродовая остеомаляция. 15-й класс — это специфически сгруппированный перечень нозологических форм, имеющих приоритет перед классами, построенными по органному принципу. Он содержит 8 блоков, которые включают не только вероятные причины МС, но и несмертельные акушерские болезни, поводы медицинской помощи, что в определенной степени затрудняет выбор шифра. Для облегчения шифрования МС ее основные коды приведены в тексте при характеристике нозологических форм либо в приложении. 1.2. Единые рубрики заключительного клинического и патолого- анатомического диагнозов. Заполнение медицинского свидетельства о смерти. В МКБ-10 основным статистическим критерием введено понятие «первоначальная причина смерти», которая определена как болезнь, вызвавшая цепь болезненных процессов, непосредственно приведших к смерти. Важно подчеркнуть, что заключительный клинический и патологоанатомический диагнозы формулируются по единым правилам, в ясных определениях, соответствующих МКБ-10, и в обязательном порядке записываются по следующим рубрикам: основное заболевание (первоначальная причина смерти), осложнение (-ия) основного заболевания, сопутствующие заболевания, фоновые заболевания. Основное заболевание — это болезнь (нозологическая форма в редакции МКБ-10), характеризующая первоначальную причину смерти. В акушерстве она определяется как болезнь или ятро-генная причина, вызвавшая цепь болезненных процессов, непосредственно приведших к смерти беременной, роженицы или родильницы. В структуре заключительного клинического диагноза понятие "основное заболевание" определяет, насколько верно или неправильно врач акушер обозначил главное звено в этой цепи патологических процессов или его клиническое мышление и использованный арсенал лечебных мер были направлены на серьезные, но второстепенные осложнения. У некоторых женщин с неблагоприятным анамнезом и длительным течением нескольких заболеваний трудно определить единственную первоначальную причину смерти, поэтому акушеры и патологоанатомы фиксируют в этой рубрике две или даже несколько нозологических форм. Нередко подобный поликаузальный подход является результатом неглубокого анализа клинических или морфологических проявлений и танатогенеза. Однако в отдельных случаях и рубрике основного заболевания допускается указывать две нозологические формы, которые составляют так называемое комбинированное основное заболевание. Оно представлено конкурирующими заболеваниями (две нозологические формы совпали по времени у одной больной и каждая могла привести к летальному исходу), сочетанными заболеваниями (две нозологические формы совпали по времени у одной больной, каждая из них в отдельности не вызвала бы летального исхода, но в комбинации, развиваясь одновременно и отягощая друг друга, они привели к легальному исходу), основным и фоновым заболеваниями (фоновое заболевание — это нозологическая форма, которая патогенетически не связана с основным заболеванием, но способствовала возникновению, отягощала течение основного заболевания, следствием чего явился летальный исход). Типичными ошибками акушеров при установлении основной причины смерти беременной женщины, роженицы или родильницы являются: 1. Заключительный клинический диагноз представлен хронологическим перечнем клинических состояний, оперативных вмешательств и осложнений, т.е. без необходимой его рубрикации. Такой диагноз расценивается как неверно оформленный, поскольку он непригоден для сопоставления с патолого-анатомическим диагнозом. 2. В рубрике основного заболевания приводятся не нозологические формы (по МКБ-10), а осложнения, в том числе несмертельные осложнения беременности, такие, как состояние околоплодных вод, физиологической первичная слабость незрелости, или раннее излитие дискоординация родовой деятельности и т. д. Происходит подмена основного заболевания фоновым или сопутствующим. 3. В качестве основною заболевания, например, записано: "Беременность 4-я. 33 34 нсд. Длительно протекающая водянка беременных на фоне ожирения. Эклампсия". В данном случае следует оставить только эклампсию, поскольку эклампсия — более тяжелое, потенциально смертельное заболевание — поглощает несмертельную форму водянки беременных. 4. Основное заболевание обозначается обобщающим понятием, таким, как ОПГ-гестоз (отеки, протеинурия, гипертензия), т. е. без уточнения тех конкретных нозологических форм, которые приведены в МКБ-10. Обобщающие формулировки не могут фигурировать в любой рубрике диагноза. Фоновое заболевание – это заболевание (нозологическая единица), которое патогенетически связано с основным, явилось одной из причин его развития и далее отягощало его течение. Осложнения основного заболевания — это синдромы, симптомокомплексы и патологические процессы, которые патогенетически (прямо или косвенно) связаны с первоначальной причиной смерти. Среди них вначале нужно обозначить смертельное, осложнение (непосредственная причина смерти). В этой рубрике нельзя указывать механизмы танатогенеза (интоксикация, сердечная недостаточность, полиорганная недостаточность и т. д.). Иными словами, перечень осложнений не должен быть хронологическим или случайным. Изложенная акушером-гинекологом последовательность осложнений основного заболевания с выделением на первом месте важнейшего из них должна отражать примененную тактику лечения. Сопутствующие заболевания — это одна или несколько нозологических форм, которые не связаны непосредственно с основным заболеванием и не играли решающей роли в наступлении смерти. Кроме перечисленных рубрик, в заключительном клиническом диагнозе при акушерской патологии необходимы и подрубрики, такие как оперативные вмешательства, осложнения реанимационных мероприятий и интенсивной терапии, патология плода и последа, а также указание о продолжительности послеродового (после аборта, внематочной беременности) периода. Так, после основного заболевания отдельной строкой указываются вид и дата оперативного вмешательства, если операция была направлена на его устранение. В том случае, когда оперативные вмешательства были направлены на устранение осложнений основного заболевания, их нужно представить отдельной строкой после рубрики "осложнения". В заключительном клиническом диагнозе отдельной строкой после рубрики "осложнения основного заболевания" обязательно указываются реанимационные мероприятия, интенсивная терапия и их осложнения, например искусственная вентиляция легких (ИВЛ) с длительностью в днях, осложнения гсмотрансфузии и наркоза, кроме тех ситуаций, когда они становятся основным заболеванием. Патология плода и последа указывается в специальной строке после рубрики "сопутствующие заболевания": антенатальная гибель плода и степень мацерации, целостность родившегося или удаленного при операции последа и т. д. Время от момента аборта, самопроизвольных родов или оперативного родоразрешения до момента смерти указывается в целых часах (первые сутки) или в целых днях. Пример заключительного клинического диагноза приведен в приложении (см. Приложение, пример 1).Поскольку медицинское (врачебное) свидетельство о смерти является единственным документом для статистического учета МС, то его форма регламентирована международными правилами и утверждена приказом Минздрава РФ от 7 августа 1998 г. № 241 "О совершенствовании медицинской документации, удостоверяющей случаи рождения и смерти, в связи с переходом на МКБ-10". Врачебное свидетельство о смерти является одновременно медицинским, юридическим и статистическим документом. В случаях смерти пациентки в стационаре оно всегда заполняется врачом-патологоанатомом либо при передаче тела умершей на судебномедицинскую экспертизу врачом — судебно-медицинским экспертом. Допускается выдача предварительного свидетельства о смерти сразу после аутопсии. В окончательном его варианте (оформляется не позже 30 дней после вскрытия) все записи должны соответствовать уточненному патологоанатомическому заключению о причине смерти (после гистологического и иного исследования органов и тканей, решения клинико-экспертной комиссии). Свидетельство о смерти содержит в п. 8 "Причина смерти" две основные части. Часть I представлена 4 строками (а, б, в, г); их заполнение осуществляется в обратной последовательности рубрик патолого-анатомического диагноза. Так, основное заболевание или состояние, явившееся началом цепи болезненных процессов, приведших к смерти (первоначальная причина смерти), указывается в нижней из трех (а, б, в) заполняемых строк. При комбинированном основном заболевании только первая нозологическая форма указывается в части I, а вторая выносится в часть II. В строке "а" указывается непосредственная причина смерти (смертельное осложнение). В строку не включаются симптомы и явления, сопровождающие наступление смерти (танатогенез), такие, как остановка сердца, нарушения дыхания и др. Строка "б" используется для записи промежуточных патологических состояний, которые привели к возникновению непосредственной причины смерти (смертельного осложнения). В строке "в" указывается основное заболевание — первоначальная причина смерти. Только оно кодируется по МКБ-10 и используется в статистических разработках МС. Пропуски строк при заполнении части I не допускаются. Если строка "б" не заполняется, то на нее поднимается основное заболевание. В случае МС в стационаре целесообразно заполнение всех строк. Строка "г" не используется для учета МС. Часть II предназначена для регистрации конкурирующего, фонового или сочетанного заболевания при комбинированном основном заболевании, а также прочих важных состояний, способствующих смерти, но не связанных с основным заболеванием. Здесь же указывается срок беременности (если смерть наступила в период беременности), продолжительность послеродового периода (аборта, внематочной беременности) в часах или днях, перечисляются оперативные вмешательства с указанием дат. Кроме того, дополнительно следует обвести цифру 1 в пункте 19 — материнская смертность (умерла в течение 42 дней после окончания беременности, родов). 2. ГЕСТАЦИОННАЯ ПЕРЕСТРОЙКА ЖЕНСКОГО ОРГАНИЗМА, РОДЫ (САМОПРОИЗВОЛЬНЫЕ И КЕСАРЕВО СЕЧЕНИЕ), ПОСЛЕРОДОВОЙ ПЕРИОД Во время беременности в организме здоровой женщины происходят глубокие структурные изменения, которые касаются всех органов и систем. Начальная перестройка обусловлена главным образом гормонами и белками беременности, в частности хорионическим гонадотропином, прогестероном, эстрогенами, а также возрастающими метаболическими запросами эмбриона и плода. Примерно к середине беременности к этим изменениям добавляются анатомические факторы за счет механического давления увеличивающейся матки. Знание так называемой нормы беременности необходимо патологоанатому, анализирующему причины смерти рожениц и родильниц. 2.1. Эндокринная система. Репродуктивная функция женщины — это четко скоординированный процесс, требующий регламентированной по времени подготовки различных отделов головного мозга, перестройки яичников, эндометрия, эпителия маточных труб и влагалища. Началом его является момент овуляции. Первые изменения регистрируются в том яичнике, из которого вышла яйцеклетка. Разорвавшийся фолликул спадается, его края смыкаются на поверхности яичника. Оставшиеся фолликулярные клетки быстро увеличиваются и превращаются в гранулезные (лютеиновые) клетки, которые накапливают липиды и придают желтоватую окраску формирующемуся желтому телу яичника. Оно увеличивается в диаметре до 1,5—2,0 см и активно секретирует прогестерон и эстрадиол. В случае наступления беременности, примерно с 4—5-го дня после оплодотворения (п.о.), бластоциста начинает синтезировать хорионический гонадотропин, который является мощным сигнальным фактором для дальнейшего развития желтого тела яичника. Оно продолжает расти, активно продуцировать прогестерон и к 3-му месяцу беременности достигает в диаметре 3 см. В дальнейшем, по мере развития плаценты начинается медленная инволюция желтого тела за счет пролиферации фибробластов и образования соединительной ткани на месте погибающих гранулезных клеток. Гормональная функция желтого тела заключается в возрастающем объеме синтезе прогестерона, который в свою очередь вызывает децидуализацию эндометрия вначале в зоне имплантации бластоцисты, а затем постепенно по всему эндометрию. миофибробласты в Под зоне влиянием адвентиции прогестерона спиральных фибробласты артерий или эндометрия превращаются вначале в промежуточные (диаметром 15 мкм), а затем – в высокодифференцированные децидуальные клетки эпителиоидного типа (диаметром более 25 мкм). Они синтезируют особый эндометриальный белок РР12 (в отечественной литературе ПАМГ), который влияет как паракринный детектор на инвазию цитотрофобласта (см 2.2). Кроме того, эпителиоциты маточных желез синтезируют другой эндометриальный белок – РР14 или АМГФ – микроглобулин фертильности, который, будучи мощным иммуносупрессором, обеспечивает сохранность свободной бластоцисты в полости матки, а затем – во время ее имплантации, что объясняет т.н. « иммунологический парадокс беременности» на ранних ее этапах. В материнской крови максимум концентрации РР14 соответствует 9-ой неделе после оплодотворения (р.о.), начиная с 16- 20-ой недель после менструального срока (р.м.) его уровень прогрессивно падает, что совпадает по времени с деструкцией и атрофией эпителия маточных желез. Во второй половине беременности у женщин отмечается повышение функции коры надпочечников (концентрация суммарных кортикостероидов), а также увеличение почти в 2 раза диаметра гипофиза. 2.2. Маточно-плацентарная область и миометрий. После фиксации и внедрения бластоцисты через маточный эпителий в эндометрий начинается формирование маточно-плацентарной области, то есть места непосредственного контакта ворсин ранней плаценты с эндометрием матки. Маточно-плацентарная область – это обобщенное понятие, которое по срокам беременности называется разными терминами. Так, в момент начальной инвазии симпластических комплексов и продвижения бластоцисты вглубь эндометрия эта зона обозначается инвазивным щитом или имплантационной площадкой (2, 3 и 4-ые недели р.о.). Затем, по мере развития первой волны инвазии цитотрофобласта из оснований якорных ворсин и миграции его в сторону эндометриальных сегментов спиральных артерий, она обозначается как базальный эндометрий в отличие от париетальной части (остальной эндометрий матки). Результатом первой волны инвазии цитотрофобласта является последовательное вскрытие устьев спиральных артериол или артерий (с этого момента их лучше называть маточно-плацентарными артериями); возникает постоянный приток артериальной крови матери в межворсинчатое пространство плаценты, то есть формирование маточно-плацентарного, а затем – плацентарно-эмбрионального кровообращения. Это обеспечивает постоянный приток кислорода, аминокислот, глюкозы и других полезных веществ через плаценту к тканям эмбриона, а затем – плода. Для патологоанатома важно представлять гистологические критерии полноты гестационной эндометрия перестройки или спиральных плацентарного ложа артерий матки. в составе Под базального влиянием инвазии цитотрофобласта и выделения им особых металлопротеаз происходит лизис мышечных и эластических элементов стенок артерий с замещением их массами фибриноида. Постепенно спиральные артерии превращаются в эктазированные мешки без эндотелиальной выстилки. Из радиальных артерий матки обычного строения в эктазированные спиралевидные сосуды поступает артериальная кровь под системным давлением (120/80 мм рт. ст.). В результате этого давление крови резко уменьшается и из устьев маточно-штацентарных артерий она пульсирующими струйками (давление на выходе 30—40 мм рт. ст.) поступает в межворсинчатое пространство плаценты. Замещение фибриноидом всех компонентов стенок бывших спиральных артерий, в том числе и иннервационного аппарата, обеспечивает полную автономию маточно- плацентар-ного кровотока от нейрогенных влияний материнского организма. Первая волна инвазии цитотрофобласта продолжается в течение 5—8-й недели п.о. Она формирует адекватное кровоснабжение эмбриона в самый ответственный период закладок основных органов и систем. С 9—10-й недели п.о. процессы инвазии цитотрофобласта затухают до 15-й недели п.м. Ранее вскрытых устьев маточно-плацентарных артерий становится недостаточно для дальнейшего развития плода. Возникает гипоксический стимул к возобновлению инвазии цитотрофобласта — второй волны его миграции (16— 18-я неделя п.м.). Кроме интерстициального цитотрофобласта, появляется его внутрисосудистый вариант, проникающий в новые просветы артерий, расположенных в прилежащих слоях миометрия. Другими словами, вторая волна инвазии цитотрофобласта обусловливает аналогичную гестационную перестройку более крупных, радиальных артерий в пограничных слоях миометрия. Это приводит к постепенному 5-кратному увеличению маточно-плацентарного кровотока до конца беременности. Кроме ключевых гемодинамических процессов, в базальном эндометрии осуществляются дальнейшая децидуализация, достигающая максимума к середине беременности, а также регресс эндометриальных желез, которые вначале исчезают из зоны контакта плаценты с базальным эндометрием, а затем — из париетального эндометрия, по мере формирования к 18—20-й неделе плодных оболочек, сливающихся со стенкой матки. Собственно миометрий по мере роста матки гипертрофируется: миоциты гиперплазируются, укрупняются и сближаются. Между ними появляется больше щелевых контактов. За счет внутренней кооперации мышечных пучков матка способна противостоять прогрессирующему увеличению объема плодного мешка. 2.3. Кровообращение, дыхание и гемостаз. Основная роль в обеспечении дополнительных метаболических нагрузок организма беременной женщины принадлежит сердечно-сосудистой системе. Ее гестационная перестройка складывается из следующих морфофункциональных механизмов: увеличение сердечного выброса и частоты сокращений, прогрессирующая гиперволемическая гемодилюция и снижение периферического сосудистого сопротивления при длительном сохранении основных гемодинамических констант (артериальное и венозное давление). В III триместре существенное значение приобретает аортокавальная компрессия. Увеличение сердечного выброса начинается с 8—10-й недели п.о. и достигает максимума в состоянии покоя к 28—32-й неделе (+32%). Аналогичная тенденция выявлена в отношении минутного объема сердца, который к 36-й неделе увеличивается до 6— 7 л/мин. По данным эхокардиографии у беременных женщин увеличиваются общая масса миокарда и размеры преимущественно левого отдела сердца. При рентгенологическом исследовании в III триместре сердце приобретает "митральную" конфигурацию вследствие смещения диафрагмы вверх из-за увеличения размеров матки. У некоторых женщин выявляется формирования так дилатация полости левого называемой околородовой желудочка вплоть до кардиомиопатии, т. е. значительного расширения всех полостей сердца в течение нескольких месяцев до и после родов. Одновременно возрастает объем циркулирующей крови (ОЦК): достоверное его увеличение регистрируется уже с 6—8-й недели п.о. и он достигает максимума к 30-й неделе. Дополнительный объем крови реализуется для заполнения увеличивающихся матки, молочных желез, почек, растянутых мышц и сосудов передней брюшной стенки, а также для интенсивной маточноплацентарной циркуляции. Рост ОЦК имеет двоякое компенсаторное значение: во-первых, это улучшает обмен дыхательными газами между матерью и плодом, а также питательными веществами и метаболитами через плаценту; вовторых, это облегчает обязательную кровопотерю в родах. Однако гиперволемия крови у женщин сопровождается гемо-дилюцией и снижением гематокрита, уменьшением концентрации гемоглобина (физиологическая анемия беременных). Но это состояние компенсируется увеличением числа эритроцитов, ростом синтеза эритропоэтина, повышением эритропоэза и появлением в эритроцитах фетального гемоглобина (НвФ), который обладает большим сродством к кислороду, чем взрослый тип гемоглобина (НвА). Компенсаторная гипертрофия сердца развивается в условиях низкого периферического сосудистого сопротивления, что достигается посредством прогрессивно увеличивающегося плацентарного шунта, т. е. формирования маточно-плацентарного кровотока. Если в небеременном состоянии матка получает менее 3% сердечного выброса крови, то в конце беременности — до 20—25% сердечного выброса, проходящего через межворсинчатое русло плаценты. В последние недели беременности плацента из шунтирующего механизма становится органом, депонирующим кровь матери. Это приводит к уменьшению нагрузки на сердце. Функциональная интеграция вышеописанных гемодинамических реакций сопровождается незначительным снижением систолического и диастолического давления крови (на 5—10 мм рт. ст.) в конце II триместра, но затем в III триместре эти показатели нормализуются. Следует особо подчеркнуть, что пик рабочей нагрузки на систему кровообращения приходится на 28—29-ю неделю, поскольку именно в этот период резко ухудшается состояние беременных женщин с различной сердечно-сосудистой патологией. Среди анатомически обусловленных нарушений в III триместре наибольшее клиническое значение имеет синдром аортокавольной компрессии, т. е. сдавление увеличенной маткой аорты, нижней полой вены и других магистральных сосудов брюшной полости в положении женщины на спине. Компрессия нижней полой вены снижает веночный возврат крови к правому отделу сердца, а сдавление аорты и ее брюшных ветвей ведет к частичной редукции почечного и маточно-плацентарного кровотока. У большинства беременных аортокавальная компрессия не достигает угрожающей степени, но у 10% женщин с нормальной беременностью она может вызвать резкую и продолжительную артериальную гипотензию с клиническими нарушениями (А. П. Зильбер и Е. М. Шифман, 1997). Таким образом, при физиологической беременности происходят существенные сдвиги системного кровообращения, которые требуют включения структурнофункциональных адаптационных механизмов сердца и кровеносных сосудов, снижая тем самым предел компенсаторных возможностей организма женщины. В связи с этим более опасны ситуации, обусловливающие возникновение гиповолемии и гипотонии, так как они быстро приводят к синдрому "малого сердечного выброса" с резким уменьшением маточно-плацентарного кровотока и развитием острой гипоксии плода. Как и система кровообращения, органы дыхания подвергаются весомой структурной перестройке во время беременности. Увеличение ОЦК и компенсаторная вазодилатация вызывают полнокровие микроциркуляторного русла как верхних дыхательных путей, крупных и средних бронхов, так и респираторного отдела легких. Это приводит к набуханию или отеку слизистых оболочек носа, ротоглотки, гортани и трахеи, что в свою очередь обусловливает трудности интубации трахеи и повышенную ее травматизацию. Вследствие обусловленной прогестероном релаксации бронхиальной мускулатуры сопротивление дыхательных путей снижено, интубационная трубка может вызвать серьезную травму трахеи и даже профузное кровотечение. Постепенно ко II триместру увеличивающаяся матка поднимает диафрагму вверх и уменьшает вертикальный размер грудной клетки на 4—5 см. Но существенного уменьшения общего объема легких не происходит, так как одновременно увеличивается реберный угол от 68 до 102°. В результате горизонтальная окружность грудной клетки увеличивается на 5—7 см. Следовательно, в конце беременности формируются анатомические изменения грудной клетки, которые сопровождаются значительным снижением тонуса брюшных, диафрагмальных и межреберных мышц, поэтому к III триместру при резком увеличении матки преобладает диафрагмальный тип дыхания. Прогрессивное увеличение минутного объема начинает выявляться уже в I триместре, достигая максимума (+50%) в начале II триместра. Это увеличение на 40% обусловлено повышением дыхательного объема и лишь на 10% — увеличением частоты дыхания. В дальнейшем подключаются вышеописанные анатомические факторы, которые в сумме обеспечивают компенсаторное увеличение альвеолярной вентиляции на 70% в конце беременности. В итоге органы дыхания беременной женщины обеспечивают потребностей плода, поскольку суммарное потребление им постепенно увеличивается на 20%. Однако сочетание рост кислорода повышенного потребления кислорода с понижением функционального остаточного объема обусловливает значительное функциональное напряжение альвеолярной вентиляции у женщин в конце беременности. В связи с этим стратегическое положение легких как органа, через который проходит весь увеличенный сердечный выброс крови, предрасполагает к умеренному накоплению жидкости в интерстициальной легочной ткани. Подобная тенденция компенсируется уменьшением коллоидноосмотического давления в интерстиции, а также большей емкостью лимфатических коллекторов в межуточной ткани легких, способствующих выводу излишней жидкости в лимфатическое русло. Однако включение этих дополнительных механизмов оттока интерстициальной жидкости из легких уменьшает соответственно общий ресурс компенсации в тех ситуациях, когда развивается отек легких (см. 3.1). Накопление интерстициальной жидкости происходит во всех органах и тканях беременной женщины, так общий ее объем возрастает на 2—2,5 л, что является фактором, предрасполагающим к возникновению периферических отеков даже при физиологической беременности. Кроме респираторной функции легких, в гестационную перестройку включается и легочный кровоток как часть общей системы циркуляции крови. Параллельно с увеличением сердечного выброса происходит расширение просвета легочных артерий и емкости капиллярного русла альвеол, т. е. суммарное снижение сопротивления легочному кровотоку. Давление в правом желудочке сердца и в легочной артерии сохраняет нормальные константы. Вместе с тем при беременности происходит генерализованное снижение вазоактивности в легких, что предрасполагает к появлению парадоксальных гемодинамических реакций, например снижению прессорной реакции на внутрилегочную гипоксию. Таким образом, органы дыхания беременной женщины подвергаются существенному морфофункциональному напряжению и это касается не только дополнительной дыхательной нагрузки, но и нереспираторных функций капиллярного русла альвеол, а также более интенсивного обмена интерстициальной жидкости. В отношении гестационной перестройки легкие тесно взаимодействуют с сердечно-сосудистой системой. По мере прогрессирования беременности в крови матери усиливается коагуляционный потенциал за счет прироста количества фибриногена. Его концентрация в плазме крови повышается с 3-го месяца гестации и достигает пика (4—6 г/л) в конце III триместра. Кроме того, постепенно увеличивается активность факторов (VIII, IX, XI, XII), составляющих внутренний путь свертывания крови, а также факторов внешнего пути (V, VII, X), вызывающих повышение протромбинового индекса. В целом к концу беременности возникает состояние гиперкоагуляции — повышенной свертываемости крови у женщины, что весьма целесообразно перед неизбежной кровопотерей в родах. Следовательно, материнская кровь, выходящая из многочисленных устьев маточно-плацентарных артерий, несет в себе преимущественно гемокоагулирующие факторы, такие, как перечисленные выше, а также тромбоксан (ТХА2), тканевый фактор и др. Но свертывания крови в межворсинчатом пространстве не происходит, поскольку на поверхности ворсин плаценты существует мощная тромболитическая система, представленная такими специфическими факторами, как мембраны щеточной каймы синцитиотрофобласта, плацентарный белок (аннексии V или РР4), тромбомодулин и оксид азота. Во время физиологической беременности функционирует многокомпонентная, сбалансированная система гемостаза и состояние гиперкоагуляции многочисленными материнской плацентарными факторами крови на ворсинчатого дерева (А. П. Милованов и соавт., 2001). нейтрализуется огромной площади 2.4. Желудочно-кишечный тракт, почки и печень. Изменения желудочно-кишечного тракта в процессе беременности связаны главным образом с анатомическим его смещением увеличивающейся маткой. Ось желудка меняет свое положение от вертикального к горизонтальному, что ведет к нарастанию внутрижелудочного давления и изменению угла соединения желудка с пищеводом. Это в свою очередь приводит к относительной недостаточности пищеводного сфинктера. Если у небеременных женщин внутрижелудочное давление составляет около 20 см вод. ст., а внутрипищеводное — всего 2 см вод. ст. и регургитации пищевых масс препятствуют усилия желудочно-пищеводного сфинктера, то у беременных в III триместре внутрижелудочное давление на 6—7 см вод. ст. выше, а сфинктерное давление на 10 см вод. ст. ниже нормального, что способствует возникновению желудочно-пищеводного рефлюкса. Это объясняет частоту изжоги у здоровых беременных женщин. Замедление эвакуации желудочного содержимого и возрастание активности желудочной секреции приводят к повышению кислотности желудочного сока. Таким образом, при сроке беременности 36 нед и более тонус желудочно-пищеводного сфинктера устанавливается ниже обычной нормы, а кислотность желудочного содержимого, напротив, резко увеличивается, что создает условия для регургитации слизи высокой кислотности и ее аспирации (см. 5.5). Беременность вызывает существенные изменения в почках; почечный кровоток и темпы гломерулярной фильтрации начинают нарастать уже в течение I триместра, а в дальнейшем эти функциональные показатели увеличиваются на 50—60% от исходного уровня. Это происходит параллельно с увеличением ОЦК и сердечного выброса, а также с интерстициальной гипергидратацией беременных. К III триместру масса почек увеличивается на 20% за счет гипертрофии клубочков и они напоминают рабочую или викарную гипертрофию у лиц, перенесших одностороннюю нефрэктомию. Усиление гломерулярной фильтрации может превысить способность к реабсорбции, поэтому нормальную беременность может сопровождать незначительная глюкозурия или протеинурия. С 13-й недели п.м. массивный выброс прогестерона снижает тонус мышечных клеток и вызывает дилатацию или атонию почечных лоханок и мочеточников. В III триместре матка сдавливает мочеточники в полости таза, усугубляя их расширение. Застой в мочевыводящих путях способствует возникновению или рецидиву инфекции в почках. Снижение никотиновой, реабсорбции аскорбиновой и проявляется фолиевой увеличением кислот и экскреции жизненно важных микроэлементов. Следовательно, почки при беременности работают в повышенном режиме гломерулярной фильтрации и подвергаются рабочей гипертрофии. Это имеет важное клиническое значение при дальнейшем обсуждении акушерской и соматической патологии почек и мочевыводящих путей у беременных женщин. В дополнение к усилению общего обмена и потребления кислорода существенные изменения выявляются в печени. Резко увеличивается белковый обмен для обеспечения потребностей плаценты и плода. Жировой обмен характеризуется повышением содержания всех липидных фракций в крови, в частности ли-попротеинов высокой плотности, что связано с повышенным синтезом эстрогенов. Однако наиболее значительные сдвиги происходят в обмене углеводов, поскольку беременная женщина находится в условиях дополнительного глюкозного "голодания". Все энергетические потребности плода реализуются за счет использования глюкозы матери. Поэтому уровень глюкозы в крови беременной находится в узких пределах — 4,5—5,5 ммоль/л, а клинические признаки гипогликемии определяются уже ниже значения 3,3 ммоль/л. В морфологическом плане печень у беременной женщины обладает нормальной структурой долек, но в некоторых случаях отмечаются умеренное расширение желчных канальцев либо признаки внутрипеченочного холестаза, так как тонус желчного пузыря понижен, а эвакуация желчи затруднена. В целом обнаруживаются признаки напряжения или рабочей гипертрофии печеночных долек. Вместе с тем трудно выделить какие-либо морфологические эквиваленты гестационного эффекта в печени, поскольку их перекрывают другие, более выраженные патологические реакции при любой причине гибели женщины (шок, ДВС-синдром и т. д.). Подобные сложности трактовок касаются гестационных изменений и других систем и органов беременной женщины. 2.5. Периоды родов. Факторы кесарева сечения. Если описанные выше системные перестройки в организме беременной происходят постепенно, по нарастающей степени, то в период родов адаптивные реакции женщины подвергаются серьезному дополнительному испытанию, проходящему на предельных рубежах гомеостаза. Первый период родов (период раскрытия) начинается регулярной родовой деятельностью и завершается полным раскрытием шейки матки, достаточным для прохождения головки плода. Продолжительность его у первородящих — 12—18 ч, у повторнородящих — 6—9 ч. Родовой акт представляет собой процесс взаимодействия трех компонентов — изгоняющих сокращений матки, родового канала и самого плода. Конечным звеном сократительной деятельности матки является энергетически весьма затратный механизм синтеза сократительного белка — актомиозина в тесно связанных между собой миоцитах. Однако непосредственные механизмы изгнания плода и раскрытия шейки матки еще не расшифрованы. Считается, что средняя оболочка матки стремится к укорочению, т. е. подтягивается к связочному аппарату на границе тела и шейки матки, поэтому во время схватки тело матки смещается к выходу из таза. Во время паузы матка возвращается в исходное состояние. В ходе чередования схваток и пауз возникает физическая основа генерации бегущих волн в миометрии. В паузах кровь депонируется в мио-метриальном сосудистом сплетении и бегущими волнами сокращений нагнетается в кавернозное сплетение внутрицервикальное шейки давление, матки. которое Создается вызывает отек избыточное и растяжение коллагеновых волокон — основных структурных элементов шейки. В конечном итоге наступает раскрытие шейки матки. Затем происходят разрыв плодных оболочек над внутренним зевом и излитие передних околоплодных вод. Сокращения миометрия изменяют маточно-плацентарный и плацентарноплодный кровотоки. В период схваток сдавливаются венозные коллекторы и происходит депонирование крови в межворсинчатом пространстве плаценты. В паузы вступает в действие обратный эффект "насоса" и межворсинчатое пространство частично опорожняется. Второй период родов (период изгнания) начинается после полного раскрытия маточного зева, своевременного излития околоплодных вод; он осуществляется поступательным движением плода по родовому каналу. В это время к самым сильным схваткам присоединяются потуги. Период изгнания продолжается от 30 мин до 2 ч. Третий период (послеродовой) самый короткий (5—10 мин), он начинается с момента рождения ребенка и продолжается до отделения последа. Возобновившиеся схватки и потуги обеспечивают отслоение плаценты и плодных оболочек. Этот период опасен резким нарушением прежних условий гемостаза: удаление плаценты как мощного антикоагуляционного фактора сопровождается усилением гиперкоагуляции материнской крови, что приводит к быстрому местному тромбозу маточно-плацен-тарных артерий. Наряду с сокращением матки тромбоз многочисленных устьев маточно-плацентарных артерий и венозных коллекторов прекращает кровопотерю в области плацентарной площадки, ограничивая ее 250 мл, или 0,5% от массы тела роженицы. Таким образом, даже обычный родовой акт в конце физиологической беременности — сильный и продолжительный стресс для организма роженицы. Наибольшему напряжению подвергаются ее сердце, система кровообращения, дыхания и гемостаза, а также системы жизнеобеспечения плода. Оперативное родоразрешение составляет сейчас в России 13,8% от числа всех родов. На 1000 родов в 1995 г. приходилось 100,9 оперативного родоразрешения, в 1996 г. — 110,6, в 1997 г. — 121,5, в 1998 г. — 128,8 и в 1999 г. — 134,3. Благодаря совершенствованию техники кесарева сечения и анестезиологического обеспечения подобные плановые операции стали реальным резервом снижения перинатальной смертности. Однако в целом оперативное родоразрешение и особенно операции, выполненные по экстренным показаниям, являются факторами повышенного риска для женщины. При неподготовленном желудочно-кишечном тракте велика опасность регургитации желудочного содержимого, а также синдрома сдавления нижней полой вены у женщин с многоводием, многоплодной беременностью. Сдавление крупного венозного ствола приводит к уменьшению венозного возврата к сердцу, уменьшению сердечного выброса и артериальной гипотензии. Во время кесарева сечения, даже при адекватной анестезии, возможны резкие гемодинамические нарушения, которые следует учитывать при объяснении внезапной гибели женщины на операционном столе: — при извлечении плода до отделения плаценты может резко снизиться венозное давление и возникнуть присасывающий эффект крови из сосудов системы нижней полой вены (опасность тромбоэмболии); — во время операции в результате быстрого сокращения матки из ее венозной системы одномоментно уходит большой объем крови (1200—1500 мл), вызывая резкую перегрузку сердца или острую левожелудочковую недостаточность; — существует возможность проникновения околоплодных вод в венозную систему роженицы при травмах матки, патологии плаценты, т. е. без значительного повышения давления вод в плодовместилище; — наркоз маскирует начало реологических нарушений, которые "внезапно" выявляются после завершения кесарева сечения. 2.6. Послеродовой период и инволюция матки. Трудности послеродового периода связаны, как правило, с нарушениями местного гемостаза в области плацентарного ложа матки; они обусловлены мышечным, внутрисосудистым и тканевым факторами. Главный фактор — это интенсивное сокращение миометрия вообще и в области плацентарной площадки в частности. Первыми сдавливаются венозные коллекторы, и начинается тромбообразование в спавшихся устьях маточно-пла-центарных артерий. Спустя 2—3 ч после родов или оперативного родоразрешения в области плацентарного ложа определяются плотные фибриновые тромбы в просветах маточно-плацентар-ных артерий. Средний диаметр ложа сразу после рождения плаценты сокращается до 9—10 см при глубине 0,5 см. Во избежание серьезных ошибок патологоанатом должен хорошо представлять себе гистологическую картину инволюции матки. Для этого нужно точно определить время с момента отделения последа или завершения кесарева сечения до того, когда была ампутирована матка или наступила смерть родильницы. Через 1 сут после родов диаметр ложа уменьшается до 7—8 см; дно представлено некротизированными массами эндометрия, среди них появляются сегментоядерные лейкоциты. Маточно-плацентарные артерии резко сужены и полностью тромбированы на всем протяжении, со стороны их адвентиции накапливаются воспалительные клетки. Глубокие слои базального эндометрия и прилежащие пучки миометрия остаются сохранными, среди них выявляются интерстициальный цитотрофобласт и многоядерные гигантские клетки, а также обычные децидуальные клетки. Через 2—3 сут после родов практически весь эндометрий в области плацентарного ложа и остальной поверхности матки некротизирован, а на границе некротических масс и миометрия четко виден разграничительный воспалительный вал, который не проникает в глубь миометрия. В сжатых маточно-плацентар-ных артериях, кроме фибриновых тромбов, остаются только контуры стенок из фибриноида. В тромбах определяются признаки организации — появление первых фибробластов. В прилежащем миометрии выявляются только контуры гигантских многоядерных клеток и децидуальных элементов. Через 5—7 сут после родов наблюдается полное отторжение некротизированного эндометрия с четкой его демаркацией. Со стороны миометрия появляются новые узкие железы, митозы в эпителиоцитах. В бывших миометриальных сегментах маточно-плацентарных артерий виден гиалиноз тромбов и стенок. Через 2 нед область плацентарного ложа не определяется. Происходят очищение внутренней поверхности матки и дальнейший прирост ветвящихся эндометриальных желез. Воспалительный компонент отсутствует. Таким образом, знание постгестационной перестройки, или инволюции матки, в частности плацентарного ложа, исключает возможные ошибочные заключения. Во-первых, местный тромбоз вен и маточно-плацентарных артерий — это физиологическое явление, которое не может быть истолковано как патология или место возникновения тромбоэмболов, например, для объяснения тромбоэмболии легочной артерии (ТЭЛА). Во-вторых, воспалительный вал в зоне отторгающегося эндометрия нельзя рассматривать как гистологический признак послеродового эндометрита. 3. ХАРАКТЕРИСТИКА ОБЩЕПАТОЛОГИЧЕСКИХ РЕАКЦИЙ 3.1. Отек легких и геморрагический шок. Как показано выше, даже при физиологически протекающей беременности возможно развитие легочной гипергидрации. В нормальных условиях 10- 15% внутрисосудистого объема жидкости вмещают легочные артерии, капилляры и вены (около 500- 750 мл). В конце беременности внутрисосудистый объем воды в легких увеличивается до 1200 мл. Любая патология беременности, например, гестозы, приводит к коллоидно-осмотическому дисбалансу и быстрому развитию отека легких. Так, характерный для преэклампсии артериолоспазм сопровождается увеличением тонуса прекапиллярных сфинктеров и генерализованным повреждением легочного эндотелия; в этих условиях дополнительная жидкость устремляется в интерстиций легочной ткани. Кроме того, по мнению анестезиологов А.П. Зильбера, Шифмана Е.М. (1997), частая токолитическая терапия β- адреномиметиками для нормализации сердечного выброса и снижения бронхиального сопротивления у беременных приводит к антидиуретическому эффекту. Комбинация β- адреномиметиков и кортикостероидов, применяемых для ускорения созревания легких плода, значительно увеличивает риск развития отека легких у беременных женщин. Столь же опасна гипертрансфузия в родах, что приводит к резкому увеличению онкотического давления плазмы. Следовательно, частота развития отека легких у беременных обусловлена как гестационным напряжением органов дыхания, так и патофизиологическими предпосылками для возникновения легочной гипергидрации. Морфологически складывается картина "шокового легкого": капиллярная гиперемия, повреждения эндотелиоцитов, микротромбоз, интерстициальный, периваскулярный и перибронхиальный отек, внутриальвеолирное накопление макрофагов — сидерофагов и появление фрагментов гиалиновых мембран в альвеолярных ходах и альвеолах. Шок — это тяжелое, нередко терминальное состояние кровообращения после сверхсильного воздействия на гемостаз. Различают три основных типа шока: гиповолемический, кардиоген-ный и септический. Значительно реже встречаются нейрогенный шок после осложнений наркоза и анафилактический шок, вызываемый реакциями гиперчувствительности. В акушерской практике встречаются все эти типы шока, но наиболее часто гиповолемический шок после острой кровопотери (акушеры называют его геморрагическим шоком). Следует подчеркнуть, что среди акушеров бытует "спокойное" отношение к острой кровопотере, поскольку потеря 250—300 мл крови при физиологических родах или 500—600 мл во время кесарева сечения — это норма. Родильница за счет гемодилюции и мобилизации крови из депо может самостоятельно восполнить до 15% ОЦК, или примерно 1000 мл. Поэтому нижней границей массивного кровотечения считается 1200 мл. В этом заложена частая ошибка акушеров в оценке объема кровопотери, поскольку существуют факторы, снижающие толерантность женщины к кровопотере, например вторичная гиповолемия при экстрагенитальной патологии — 36%, гестозы — 62%, возраст беременной — 40,5%, анемия — 12%, применение диуретиков — 61%, гипотензивных средств — 14% (В. Н. Серов и соавт., 1997). Женщины с такими осложнениями реагируют значительными изменениями гемодинамики на кровопотерю 700—900 мл. Патогенез геморрагического шока складывается из кризиса макро- и микроциркуляции: при кровопотере более 20% ОЦК аутогемодилюция не способна ее восполнить. Последующие гемодинамические реакции протекают в три этапа. Первый из них — это централизация кровотока, когда нарастающая гиповолемия компенсируется ангиоспазмом в мышцах и внутренних органах, который "выжимает" кровь из периферических отделов кровообращения для адекватного кровоснабжения головного мозга и сердца. Так называемая фаза компенсации центрального кровотока продолжается 30—60 мин. Второй этап — это кризис микроциркуляции во внутренних органах, где кровоток быстро падает до нуля и развивается необратимая ишемия органов и тканей. Третий, терминальный, этап — это острый ДВС-синдром с остановкой кровотока в микрососудах обмена, сладж-реакцией и секвестрацией крови (потоков плазмы и форменных элементов). Мозг и миокард вовлекаются в последнюю очередь, в то время как печень, почки и гипофиз — значительно раньше. Патологическая анатомия геморрагического шока представлена при изложении акушерских кровотечений. 3.2. ДВС-синдром. Около 50% острых форм ДВС-синдрома приходится на акушерскую патологию, так как именно в этих ситуациях происходят массивный выброс в кровоток тканевых, тромбопластических субстанций и распространенное поражение эндотелия (отслойка плаценты, длительно сохраняющийся мертвый плод, септический аборт, токсины и т. д.). Трудности морфологической диагностики этого состояния обусловлены стадийностью гемореологических нарушений (Д. Д. Зербино и Л. Л. Лукасевич, 1989). 1-я стадия — гемокоагуляция и внутрисосудистая агрегация клеток крови: фибриновые тромбы в венулах, артериолах или глобулярные, сетчатые тромбы, когда на поверхности сладжиро-ванных эритроцитов видны мелкие тельца и гранулы гемосиде-рина. По мере гемолиза эритроцитов из телец или гранул образуется сеточка внутри просвета капилляра. Сетчатые тромбы характерны для акушерских ситуаций, возникающих на фоне гиперкоагуляции крови у беременных женщин (см. 2.3). Длительность 1-й стадии ДВС-синдрома бывает различной — от нескольких часов (при массивном поступлении тромбопластических субстанций) до нескольких дней. 2-я стадия — это коагулопатия потребления, т. е. гиперкоагуляция, переходящая в гипокоагуляцию. Возникают выраженная кровоточивость, кожные геморрагии и кровотечение из родовых путей и операционных ран. Длительность 2-й стадии от нескольких часов до нескольких суток. 3-я стадия — восстанавливается активизация фибринолиза, проходимость путем лизиса микроциркуляторного тромбов русла, но одновременно фибринолиз приобретает генерализованный характер и кровоточивость возрастает. Доминирует органная недостаточность. Среди органов при ДВС-синдроме наиболее часто поражаются матка, легкие, почки, печень и аденогипофиз. Матка — основной орган-мишень, поскольку после родов она представляет собой открытую раневую поверхность; в результате возникает метроррагия, т. е. кровотечение в полость матки (гематометра). При развернутой 2-й стадии ДВС-синдрома стенка матки, окружающие связки и клетчатка заполнены тромбами (матка Кувелера). Легкие столь же часто подвергаются внутрисосудистой коагуляции; обычно выявляются фибриновые микротромбы, обтурирующие капиллярную сеть альвеол либо свободно лежащие в мелких артериях и венах легких. Вместе с тем при позднем вскрытии или удлинении периода жизни за счет интенсивной терапии выявляются только единичные микротромбы. В почках преобладают дистрофические изменения эпителия извитых канальцев. Окклюзия капилляров клубочков микрогромбами носит очаговый характер либо развивается сладжирование эритроитов в расширенных капиллярных петлях. 3.3. Инфекционно-токсический шок. Инфекционно-токсический шок в акушерстве - это прежде всего тяжелое осложнение криминального аборта или послеродового сепсиса. Мы согласны с мнением В.Н. Серова и др. (1997) о том, что данный термин более адекватно отражает эти акушерские ситуации, поскольку первая его часть подразумевает не только грамотрицательные бактерии, но и вирусы, грибы и другие инфекционные агенты, а вторая часть акцентирует внимание на токсемии (эндо- и экзогенной, метаболической и тд). Другие же обозначения такие как септический шок, грамотрицательная септицемия или бактериально - токсический шок имеют более узкий смысл. По современным представлениям, сам возбудитель или даже микст-инфекция не имеют решающего значения, тем более в условиях массивной антибиотикотерапии. Главную запускающую роль играют эндо - или экзотоксины. Эндотоксин представляет собой липополисахариды из внешней оболочки грамотрицательных микроорганизмов. Молекула эндотоксина состоит из фиксирующего липида А, скомбинированного из длинных цепей и связанного со стержневой цепью сахара. Агрессивные свойства эндотоксина обусловлены главным образом липидом А и опосредуются с помощью каскада цитокинов, в частности фактора некроза опухоли (ТNFα), высвобождаемого в огромном количестве системой моноцит/макрофаг в ответ на появление в крови женщины липида А. Несмотря на кратковременность всплеска концентрации фактора некроза опухоли (5- 8 часов), он запускает другие важные медиаторы инфекционно-токсического шока –это оксид азота (NO), различные эйкосаноиды, в том числе простагландины, лейкотриены, интерлейкины 1, 2, 6, 8 и другие цитокины. Вирулентность других возбудителей, например, энтеротоксической кишечной палочки зависит грамоположительных от экспрессии стрептококков ими – адгерентных протеинов, определяется а фибриллами, покрывающими их поверхность. Примером экзотоксина является α- токсин, вырабатываемый грамположительной анаэробной палочкой Clost. Perfringens. Он способен разрушать мембраны эритроцитов, лейкоцитов и эндотелиальных клеток, приводя к массивным повреждениям тканей. Главным объектом цитокинового выброса становится миокард левого желудочка вследствие прямого повреждающего действия токсинов и цитокинов на миокардиоциты. В результате возникает катастрофическое уменьшение фракции изгнания левого желудочка и как следствие – прогрессирует гиповолемия, которая в комплексе с эндотоксинемией приводит к ишемии внутренних органов. В первую очередь возникает некроз поджелудочной железы, респираторный дистресс - синдром взрослых, нефросклероз и поражение ретикуло- эндотелиальной системы печени. 3.4. Сердечный, легочный и мозговой типы терминального состояния. При анализе причин МС существенное значение имеет определение на аутопсии конкретного типа терминального состояния: сердечного, легочного и мозгового (И. В. Тимофеев, 1999). Эти типы важны для дифференциальной диагностики акушерской и экстрагенитальной патологии, которая может завершиться по левожелудочковому типу недостаточности (массивные кровопотери), или по правожелудочковому типу (эмболия околоплодными водами, ТЭЛА), или по легочному типу (синдром Мендельсона), или по мозговому типу (смерть от эклампсии). Кроме того, выделение вышеперечисленных типов терминального состояния целесообразно для оценки адекватности или неадекватности лекарственной или аппаратной реанимации. Левожелудочковый тип характеризуется преимущественным поражением миокарда левого желудочка и гемодинамическими нарушениями большого круга кровообращения. В миокарде это резкий интерстициальный отек, контрактурные изменения или фрагментация кардиомиоцитов вплоть до глыбчатого их распада. При ШИК-реакции выявляются характерные очаги исчезновения гликогена в цитоплазме кардиомиоцитов как проявление острой гипоксии сердца. В легких макро- и микроскопически преобладают явления отека интерстиция, висцеральной плевры на фоне полнокровия венозного русла. В случаях острой и массивной кровопотери (более 2000 мл) легкие, напротив, суховаты, микроскопически преобладают компенсаторная очаговая эмфизема, а также "пятна Минакова" — кровоизлияния под эпикард левого желудочка малокровного сердца. Как свидетельство невосполненной кровопотери выявляются лейкостазы в капиллярном русле печени, легких, миокарда, головного мозга и почек; это связано с краевым стоянием лейкоцитов при постепенной редукции кровотока в капиллярах. Правожелудочковый тип отличается от предыдущего преимущественным поражением миокарда правого желудочка и малого крута кровообращения. На вскрытии правый отдел сердца, включая устья полых вен, перерастянут, содержит темно-красную жидкую кровь, либо красные сгустки. Иногда удается отметить утолщение стенки правого желудочка (более 0,3 см). Микроскопически преобладает выраженный интерстициальный отек миокарда правого желудочка с разобщением пучков кардиомиоцитов. По органам доминирует картина венозного застоя и ДВС-синдрома с микротромбами различных типов (см. 3.2), в то время как система микроциркуляции в органах затронута в меньшей степени. В печени отмечается резкое полнокровие центральных вен. В легких нет каких-либо отличительных признаков, если они не поражены первоначально (эмболии, кровоизлияния и т. д.). Легочный тип терминального состояния характерен для острой дыхательной недостаточности, обычно с присоединением гипер-тензии в малом круге кровообращения. Клинически это цианоз верхней половины туловища, а макроскопически — отсутствие спадания легких после вскрытия плевральных полостей. Правый отдел сердца обычно переполнен сгустками крови. Гистологически в легких преобладает картина резко выраженного альвеолярного отека за счет заполнения их жидкостью, богатой белком. Нередко можно наблюдать начальные проявления гиалиновых мембран, даже в отсутствие ИВЛ. В сердце — однотипная картина умеренного отека, полнокровия левого и правого желудочков. Мозговой тип встречается при коматозных состояниях, когда на вскрытии выявляются резкий отек и ишемические повреждения ткани мозга. 3.5. Критика понятия "синдром полиорганной недостаточности". В последнее десятилетие в акушерской практике появилось новое понятие — "синдром полиорганной недостаточности", которым обозначают конечную стадию течения гестозов, массивных кровотечений, геморрагического шока, сепсиса (В. Н. Серов и соавт., 1997), когда на базе системного поражения микроциркуляции в процесс вовлекаются легкие, почки, печень, т. е. все паренхиматозные органы. Поначалу рациональная идея подчеркнуть межорганный или межсистемный характер поражения организма женщины постепенно трансформировалась полиорганной недостаточности, среди которым акушеров так в легко удобное можно понятие объяснить безуспешность выбранной тактики лечения роженицы или родильницы. При анализе заключительных клинических диагнозов умерших женщин выявлено, что синдром полиорганной недостаточности нередко занимает место смертельного осложнения основного заболевания (см. 1.2). Фактически же распространенное поражение или срыв системы микроциркуляции есть механизм танатогенеза (умирания) и поэтому не соответствует данной рубрике заключительного диагноза. Наш опыт патолого-анатомического анализа причин МС свидетельствует о том, что даже после длительной, интенсивной терапии и реанимации у женщины удается установить основной орган-мишень, в котором возникла первоначальная причина МС и который, как правило, манифестирует по клиническим признакам в дальнейшем течении болезни. Так, даже при длительном течении преэклампсии основным органом-мишенью остаются почки с последующей анурией и финальным синдромом полиорганной недостаточности. Другой пример — это так называемая шоковая матка (В. Н. Серов и соавт., 1997) при послеродовом гипотоническом кровотечении. Авторы справедливо подчеркивают наличие при этом состоянии общих механизмов патогенеза, таких, как кризис микроциркуляции, реологии крови, перфузии тканей матки, но даже объективная констатация этих фактов приводит к неверному, на наш взгляд, суждению, что "шоковая матка" — это одно из типичных проявлений общего синдрома полиорганной недостаточности. Учитывая временной фактор и наибольший объем поражения матки, в конкретной ситуации именно ее следует считать основным органом-мишенью. Другими словами, стремление акушера от органа-мишни сразу перейти к финальной стадии заболевания уводит его от первоначальной причины гибели женщины — послеродового атонического кровотечения, а при клиникоанатомическом обсуждении затушевывает основной вопрос — об оптимальном времени оперативного удаления необратимо пораженной матки. Таким образом, не отрицая в целом полезности понятия синдрома полиорганной недостаточности как одного из механизмов танатогенеза, мы видим опасность неоправданного его использования, поскольку оно затрудняет выявление первоначальной причины гибели женщины. Более правильной представляется тактика быстрого выявления основного органа-мишени, т. е. приближения к расшифровке первоначальной причины или основного заболевания (см. 1.2). 4. АЛГОРИТМЫ АУТОПСИИ УМЕРШИХ БЕРЕМЕННЫХ, РОЖЕНИЦ И РОДИЛЬНИЦ И ИЗУЧЕНИЯ МАТКИ 4.1. Организационные аспекты. В соответствии с п. 3 раздела И Положения о порядке проведения патологоанатомических вскрытий Приказа Минздрава РФ от 29 апреля 1994 г. № 82 все погибшие в стационарах беременные женщины, роженицы и родильницы подлежат обязательному патолого-анатомическому вскрытию. Каждый случай отказа от патолого-анатомического вскрытия при МС подлежит обсуждению в вышестоящей инстанции (см. Методические указания № 2001/193. Минздрав РФ. — М., 2001). После искусственного криминального или неуточненного аборта, произведенного вне лечебного учреждения, или при неустановленной личности умершей беременной женщины, последняя подлежит судебно-медицинскому исследованию. Микроскопическое изучение органов для установления диагноза осуществляется вышеуказанные высококвалифицированным случаи смерти от патологоанатомом. непосредственных или Все косвенных акушерских причин учитываются как МС. В противоположность этому случаи смерти беременных женщин, рожениц и родильниц от насильственных причин не включаются в ПМС. Вскрытия в случаях МС относятся к наиболее сложным в прозекторской практике. Они должны проводиться только высококвалифицированным специалистом на базе централизованных патолого-анатомических отделений (бюро), специализированных патолого-анатомических центров по исследованию акушерской патологии. В том случае, когда невозможно быстро транспортировать тело умершей в региональный центр, вскрытие по полной схеме и взятие кусочков органов осуществляет патологоанатом местного лечебно-профилактического учреждения или судебно-медицинский эксперт. Но микроскопическое исследование органов и тканей, составление окончательного патолого-анатомического диагноза контролирует выделенный для этого специалист из регионального центра. В некоторых регионах используется рациональная практика выезда главного патологоанатома и акушера- гинеколога в районную больницу для проведения и обсуждения результатов аутопсии умершей беременной женщины, роженицы или родильницы, взятия материала органов и предварительного разбора МС. 4.2. Особенности аутопсии. Вскрытию предшествует детальный анализ патологоанатомом клинических данных, наркозной карты, описания операций. При аутопсии должны присутствовать акушеры-гинекологи, а также иные специалисты (анестезиологи-реаниматологи и др.), принимавшие участие в наблюдении и лечении умершей на всех этапах. Вскрытие проводится в максимально ранние сроки после смерти (до 48 ч), так как в дальнейшем происходят аутолитические процессы и становятся невозможными бактериологические анатомическое вскрытие должно и другие строго исследования. соответствовать Патолого- нормативным документам Минздрава РФ, в частности быть максимально полным, с обязателным взвешиванием органов (только линейные размеры органов неинформативны). Крайне важно подробное описание кожных покровов, мест венопункций, выхода дренажей, операционных ран, швов и рубцов, а также наружных половых органов. При вскрытии плевральных полостей, особенно на стороне катетеризации подключичной вены, обязательно проводятся воздушные пробы и пробы на воздушную эмболию сердца. Помимо измерения толщины стенок правого и левого желудочков, желательно также провести раздельное взвешивание отделов сердца. Внимательно осматриваются гортань, надгортанник, трахея и пищевод, особенно при указании на трудности интубации. Регистрируются все мелкие надрывы и царапины, а также инородные массы при регургитации. Тщательно исследуется легочная артерия для обнаружения тромбов и тромбоэмболов и связи их с интимой сосудов. Столь же подробно изучаются венозная система легких и другие вены, включая вены нижних конечностей и малого таза, на предмет возможных источников тромбоэмболов. При подозрении на все виды сепсиса, бактериальнотоксический шок, ВИЧ-инфицирование следует методически правильно осуществить забор крови из полостей сердца и кусочков внутренних органов для бактериологического или вирусологического анализа. В связи с частыми дефектами инфузионной терапии патологоанатом должен точно измерить объемы жидкостей, особенно крови, во всех полостях тела. Если вскрытие осуществлено в пределах суток, то желателен биохимический анализ крови, выпотных жидкостей и мочи. Особое значение приобретают осмотр органов малого таза и их топографические взаимоотношения с беременной маткой или с ее культей (полнота гемостаза, варикоз, спайки, гнойные затеки и т. д.). Детали изучения матки представлены ниже. Следует также тщательно осмотреть мочевой пузырь, измерить количество мочи в нем, исследовать мочеточники для исключения травматических и иных дефектов. Дополнительные детали аутопсии приведены при изложении отдельных нозологических форм МС. Важным этапом аутопсии является взятие кусочков для гистологического исследования. Их количество определяется врачом, проводящим аутопсию, в связи с предполагаемым диагнозом. Так, если заподозрена эмболия околоплодными водами или тромбоэмболия легочной артерии, следует взять не менее 8—10 кусочков из разных участков легких, а также кусочки для приготовления замороженных срезов с последующей их окраской на жир. При подозрении на сепсис больше кусочков вырезается из матки, селезенки и регионарных лимфатических узлов. Во всех случаях подробно исследуются эндокринная система — аденогипофиз, щитовидная железа, надпочечники, тимус, а также другие органы-мишени — почки, печень и головной мозг. При вырезке сердца обязательно маркируются кусочки, взятые из стенок правого и левого желудочков. Кроме окраски гематоксилином и эозином, необходимы дополнительные методы, особенно для диагностики эмболии околоплодными водами: несколько кусочков из легких окрашиваются реактивом Шиффа или толуидиновым синим. Парафиновые гистологические срезы после их окрашивания следует заливать бальзамом и закрывать покровными стеклами. Не допускается использование некачественного полистирола и аналогичных веществ, так как их быстрая кристаллизация исключает возможность последующей экспертной оценки микропрепаратов. В связи с тем что случаи МС часто являются предметом разбирательства в органах прокуратуры и судебно-следственных органов, гистологические препараты и парафиновые блоки должны храниться не менее 3 календарных лет после окончания года, когда была произведена аутопсия. 4.3. Макро- и микроскопическое изучение матки Поскольку матка — это ключевой орган для верификации причины МС, то следует подробно остановиться на особенностях ее изучения в операционном материале (после гистерэктомии) и во время аутопсии. Удаленную матку, трубы и яичники желательно исследовать свежими, без фиксации формалином, которая делает матку более жесткой и меняет прижизненную окраску эндометрия. Прежде всего описываются операционный разрез, полнота гемостаза, сохранность стенок. Далее следует продолжить операционный разрез и обнажить всю поверхность эндометрия. Патологоанатом обязан найти плацентарную площадку (ложе) матки. Это легко сделать на свежем макропрепарате. Обычно в области дна, на задней или одной из боковых поверхностей матки выявляется кратерообразное углубление, покрытое темнокрасными сгустками крови. При атипичной локализации плацентарное ложе определяется в нижних сегментах матки с частичным или полным перекрытием внутреннего зева. В фиксированной формалином матке найти плацентарное ложе труднее из-за общего сероватого фона эндометрия. Поэтому в направлении на гистологическое исследование (форма № 014/у) удаленной матки должна быть указана локализация прикрепления плаценты. Макроскопически (лучше с помощью лупы) оценивается поверхность плацентарного ложа: есть сгустки крови или их нет, имеются ли фрагменты плацентарной ткани. Из плацентарного ложа вырезаются две параллельные полоски шириной и глубиной по 0,5 см, проходящие через центр ложа и захватывающие часть окружающего эндометрия; затем эти полоски разрезаются на отдельные фрагменты и обязательно маркируются для того, чтобы при микроскопии можно было различать центральные и периферические участки плацентарного ложа. В дальнейшем, после проводки материала, эти кусочки выкладываются на блоки так, чтобы в микропрепаратах оказалась зона перехода базального эндометрия в миометрий. Только при такой строгой ориентации и маркировки микропрепаратов возможна полноценная диагностика степени гестационной перестройки эндометриальных и миометриальных сегментов маточно-плацентарных артерий — самого раннего и надежного морфологического маркера нефропатии, преэклампсии и эклампсии. В целом из плацентарного ложа матки вырезается 10—15 кусочков; срезы лучше окрашивать гематоксилином и эозином (общий обзор), азокармином по Маллори (замещение стенки артерий фибриноидом), комбинированным способом по Ван-Гизону и фукселином (сохранность эластомышечных элементов). Это позволяет более четко определить объем фибриноидного замещения эластомышечных компонентов в стенках маточно-плацентарных артерий, а также в достаточной площади ложа диагностировать или отвергать приращение ворсин плаценты как причину послеродового кровотечения. Отдельные фрагменты матки, оставшиеся после вырезки кусочков, желательно зафиксировать в формалине и сохранить до гистологической верификации плацентарного ложа (при неудаче можно ими воспользоваться). Маточные трубы и яичники обследуются и вырезаются в обычном порядке. В яичниках макроскопически важно определить наличие кист и желтого тела беременности (его размеры), чтобы прицельно взять кусочки из зоны перехода желтого тела в ткань яичника. Таким образом, плацентарное ложе матки является важным объектом по своей морфологической информативности. Из этого следует обязательное условие для анализа МС. Если матка удалена и исследована гистологически в другом медицинском учреждении, то патологоанатом или судебно- медицинский эксперт, вскрывающий тело умершей, должен внести эту информацию в микроскопическое описание органов, а лучше всего — затребовать микропрепараты удаленной матки, пересмотреть их и обязательно учесть при анатомического диагноза. составлении окончательного патолого- 5. ПЕРВОНАЧАЛЬНЫЕ АКУШЕРСКИЕ ПРИЧИНЫ МАТЕРИНСКИХ СМЕРТЕЙ В этом разделе представлены нозологические формы акушерских причин МС в том порядке и в тех формулировках, как они приведены в МКБ-10. Приводятся также коды наиболее частых нозологических форм и их патологоанатомических диагнозов с врачебными заключениями о смерти (см. приложение). 5.1. Беременность с абортивным исходом. Здесь фигурирует патология беременности от момента оплодотворения до 28 нед. По данным за 1997 г., подобные МС составили 41,2% от общего числа МС в России. До 1989 г. в СССР данная когорта умерших беременных женщин не учитывалась в официальной статистике МС. 5.1.1. Эктопическая беременность с разрывом маточной трубы (шифр О00.1). Эктопическая беременность с разрывом маточной трубы встречается намного чаще, чем другие редкие внематочные локализации, такие, как брюшинная, яичниковая, шеечная, в роге матки, интралигаментная. Каждый год в России проводится 45— 47 тыс. экстренных операций по поводу внематочной беременности, причем послеоперационная летальность остается на высоком уровне: в 1995 г. — 56, в 1997 г. — 52 и в 1999 г. — 50 женщин, или 8,5% всех случаев МС. Стабильным фактом остается позднее поступление женщин в стационар (25—26% женщин доставлены позже 24 ч). Патолого-анатомическая диагностика прогрессирующей трубной беременности основывается на обнаружении веретенообразного утолщения оперативно удаленной трубы с разрывом ее стенки, наличия в просвете эмбриона и кровоизлияний по месту прикрепления плаценты. Различают два основных анатомических варианта: А. Аррозия инвазирующим цитотрофобластом артериального сосуда в адвентиции трубы с первичным ее разрывом и быстрым, массивным внутрибрюшным кровотечением. Обычно микроскопически выявляется сквозная инвазия цитотрофобласта резко истонченной мышечной оболочки трубы. В этих случаях эмбрион, плацента и оболочки оказываются сохранными (пример 2). Б. Преобладающий гемосальпингс, когда полость трубы целиком заполнена гематомой с вторичным разрывом стенки, при частичном или полном лизисе фрагментов эмбриона и оболочек. Как правило, якорные ворсины и неглубокая инвазия цитотрофобласта сохраняются. Труднее диагностировать полный трубный аборт эмбриона в брюшную полость: в этих случаях бластоциста имплантируется в истмическом отделе трубы. По мере роста эмбриона окружающий его хориальный мешок отслаивается и изгоняется в брюшную полость. Излившаяся кровь стекает в прямокишечно-маточное пространство, где формируется гематома. Для подтверждения частичного или полного трубного аборта следует более тщательно изучить удаленный сегмент трубы (не менее 8—10 уровней) с целью обнаружения ворсин и имплантационной площадки. Кроме того, рекомендуется собрать в отдельную салфетку сгустки крови и все включения из брюшной полости во время операции или аутопсии для гистологического исследования. На аутопсии выявляется картина типичного геморрагического шока вследствие массивной кровопотери: 1) тотальная бледность кожных покровов; 2) жидкое состояние крови в полостях сердца и крупных сосудов при резко выраженном малокровии внутренних органов; 3) проявления ДВС-синдрома. Микроскопия органов соответствует этим изменениям: чаще всего отмечаются секвестрация крови или микротромбы в сосудах микроциркуляции, а также гипоксические повреждения клеток и тканей. При исключении патологии труб на аутопсии следует искать апоплексию яичника, яичниковую или более редкую локализацию эктопической беременности. По суммированной экспертной оценке Минздрава РФ наиболее весомыми факторами риска МС от внематочной беременности являются: — несвоевременная или недостаточная диагностика; — поздняя госпитализация, обусловившая массивную крово-потерю; поступление женщин в непрофильные стационары; дефекты ведения беременных женщин. 5.1.2. Смерть после прерывания беременности до 28 недель. Несмотря на постепенное снижение общего количества абортов в России (1995 г. — 2575 тыс., 1997 г. - 2321 тыс., 1999 г. — 2060 тыс.) и возрастание среди них доли мини-абортов, за последние 5 лет в 1,5 раза увеличилось число абортов по социальным показаниям, которые наносят значительный вред репродуктивному здоровью. Другой тревожный факт — рост количества криминальных и неуточненных абортов. В 1995 г. криминальные аборты составили 3,90% от всех абортов, в 1999 г. — 4,43%, а среди подростков 15—19 лет — соответственно 4,68 и 4,95%. Как закономерное следствие этого регистрируется высокий уровень МС после абортов: 1995 г. — 246 женщин (31,1% от всех МС), 1997 г. - 205 (29,7%) женщин, 1999 г. - 179 (30,5%) женщин. По данным за 1997 г. среди 205 женщин, умерших после абортов, выявлено следующее соотношение причин прерывания беременности: 23,4% (48) составили женщины, погибшие после прерывания беременности по медицинским показаниям со стороны матери и плода, 6,8% (14) — по социальным показаниям, 4% (8,2) — после артифициальных абортов, 11,2% (23) — после самопроизвольного аборта, 33,7% (69) — после криминальных вмешательств, 21,5% (44) — после неуточненных абортов. В МКБ-10 среди абортов для учета заболеваемости фигурируют следующие виды: 1) самопроизвольный аборт или выкидыш (ООЗ); 2) медицинский аборт, т. е. легальное прерывание беременности по медицинским и социальным показаниям (О04); 3) другие уточненные виды аборта, включая криминальные (О05); 4) аборт неуточненный, без дополнительных указаний (О06). Для определения причины МС требуется их дополнительная верификация на неполный аборт (с задержкой в матке продуктов зачатия) и полный либо неуточненный аборт. В отношении медицинского аборта как причины МС введены определения "неудачная попытка аборта" и "неудачный медицинский аборт" с перечнем тяжелых осложнений, таких, как инфекции половых путей, сильные кровотечения, эмболии и т. д. Криминальный, неполный, аборт, осложнившийся инфекцией половых путей и тазовых органов (О05.0), составляет существенную часть среди причин МС. Как правило, женщины с помощью резинового баллона со стеклянным наконечником через шеечный канал вводят в матку различные жидкости (сода с мылом, стиральные порошки, растворы с антибиотиками и т. д.) обычно при больших сроках беременности (3 мес и более). Спустя 1—2 сут рождается мацерированный плод при усиливающемся маточном кровотечении. Состояние женщины быстро ухудшается, температура тела повышается до 39—40°С, и женщина поступает в стационар в тяжелейшем септическом состоянии. При срочном выскабливании из матки удаляются остатки некротизированных оболочек, плаценты, иногда фрагменты плода. В дальнейшем у женщины доминирует клиническая картина прогрессирующего инфекционно- токсического шока. Патолого-анатомические изменения складываются из травматических и химических повреждений шейки и эндометрия матки, в частности некроза оставшихся тканей плаценты и оболочек. В маточно-плацентарной области артерии и вены закрыты асептическими фибриновыми тромбами, но если женщина умирает на 3—5-е сутки после криминального аборта, то в строме базального эндометрия бактериологическом фиксируется исследовании воспалительная материала из реакция. постабортной При матки выявляются разнообразные сочетания микроорганизмов. По мнению Н. К. Пермякова (1959, 1979), возникающая после внебольничных абортов патолого-анатомическая картина не соответствует типичной септицемии, поскольку в крови из полости сердца обычно не выявляется микробной флоры. К тому же на вскрытии находят жидкое состояние крови в крупных сосудах, неравномерное полнокровие внутренних органов и их дистрофические изменения лимфатических узлов. при отсутствии Характерны гиперплазии двусторонняя селезенки апоплексия и коры надпочечников, нередко в сочетании с некрозом коркового слоя обеих почек и некрозом железистой доли гипофиза, т. е. морфологические признаки острой надпочечниковой недостаточности. В целом на первый план выступает мощный выброс токсинов и цитокинов из органа-мишени (матка). Вместе с тем у части женщин с ослабленным иммунитетом, наркоманок и страдающих алкоголизмом, встречаются более типичные формы септицемии с высевом из крови золотистого стафилококка и стрептококка, устойчивых к антибиотикам (пример 3), а также классические септикопиемии и подострые формы полипозно-язвенного эндокардита трехстворчатого клапана. Неудачные медицинские аборты (О07) составляют существенную часть причин МС после прерывания беременности до 28 нед. Среди них наиболее часто регистрируются легальные аборты, осложнившиеся длительным или чрезмерным кровотечением вследствие неполного выскабливания и задержки части плацентарной ткани, которая оказывает значительное местное антикоагулирующее действие в маточно-плацентарной области (пример 4). Встречаются также изолированные перфорации стенки матки либо в сочетании с повреждением тазовых органов. Особую группу представляют собой осложнения поздних медицинских абортов путем внутриматочного введения гипертонического раствора (хлорида натрия): в тех случаях, когда в полость матки попадает избыточное его количество (более 300 мл) или нормальный объем раствора оказывается в межворсинчатом пространстве плаценты, а оттуда попадает в кровоток матери, сразу возникает гипернатриемия с развитием гиперосмолярной комы. В нашем консультативном материале наблюдался подобный случай МС, когда женщина погибла в конце введения хлорида натрия. На вскрытии были обнаружены умеренный отек внутренних органов и другие признаки внеклеточной гипергидрации. Смерть наступила в результате непосредственного действия гипернатриемии на сердечную мышцу. Характерно, что в матке обнаружены признаки острого химического повреждения эндометрия и выраженного некроза эпителия ворсин плаценты. Другим опасным осложнением позднего медицинского аборта является неоправданно длительное пребывание мацерирован-ного плода в полости матки (более 2 сут), если по каким-то причинам не проводится необходимой стимуляции родовой деятельности или она оказывается неэффективной. В этих случаях развивается острейший ДВС-синдром в результате мощного выброса тромбопластических субстанций в кровоток матери. Следовательно, для полного учета абортов и их осложнений в МКБ-10 введено существенное исключение: в качестве первоначальной причины смерти определяется внешнее воздействие — вид искусственного прерывания беременности. В то же время традиционные нозологические формы (эмболии, септицемии и т. д.) фигурируют как осложнения основного "заболевания", т. е. медицинского или криминального аборта. Патология анестезии при медицинских абортах рассматривается в разделе 5.5. Таким образом, своеобразной платой за рекордные цифры медицинских абортов в России (примерно 2,0 млн в год) становятся 170—200 случаев МС в год, в том числе 70—80 смертей после криминальных абортов. Что заставляет российских медицинских женщин абортов при абсолютной прибегать к доступности криминальным, мини-абортов и внебольничным вмешательствам? Поскольку среди них преобладают жительницы сельских районов, скорее всего это объясняется недостатком медицинской культуры и боязнью огласки, т. е. утечки этой информации из медицинских учреждений. 5.2. Так называемые гестозы. Сборные понятия "гестозы" или "ОПГ-гестозы" трактуются отечественными акушерами как отдельная нозологическая форма, соответствующая в целом термину "нефропатия". В англоязычной литературе близкие по клинике водянка, нефропатия и преэклампсия объединяются под общим термином "преэклампсия", которая наряду с эклампсией составляет потенциально смертельную форму ОПГ-гестозов. Данный раздел 15-го класса МКБ-10 представлен детализированными формами гестозов по преобладанию какоголибо из перечисленных выше симптомов. К сожалению, можно лишь догадываться, какие из этих разновидностей гестозов могут быть первоначальной причиной МС. Вместе с тем несомненным достижением МКБ-10 стало выделение существовавшей ранее гипертензии, осложнявшей беременность, роды и послеродовой период: во-первых, она разграничена с гипертензионным компонентом гестозов, что должно способствовать их дифференциальной диагностике; во-вторых, предсуществовавшая гипертензия включена отдельным шифром в 15-й класс и соответственно выведена из других экстрагени-тальных сердечно-сосудистых заболеваний (см. раздел 6). В соответствии с общими принципами МКБ-10 предлагается в данной группе заболеваний для заключительного клинического и патолого-анатомического диагнозов использовать только три нозологические формы: 1) существовавшая ранее гипертензия; 2) преэклампсия (нефропатия) средней и выраженной тяжести; 3) эклампсия. 5.2.1. Существовавшая ранее гипертензия (010). Существовавшая ранее гипертензия представлена, если пользоваться отечественными терминами, гипертонической болезнью — кардиоваскулярной формой (010.1), почечной формой (О10.2) или сочетанной формой (О10.3). По разным источникам, частота артериальной гипертензии составляет от 20 до 35% среди гипертензионных состояний во время беременности. Возрастная структура четко "привязана" к репродуктивному возрасту: до 19 лет она выявлена у 14,8% беременных, от 20 до 25 лет — у 30,7%, от 26 до 30 лет — у 25,7%, старше 31 года — у 28,8% (Н. В. Протопопова, 1999). Важным клиническим фактом является то, что артериальная гипертензия в 69,2% случаев оставалась ранее незамеченной и впервые выявлялась при обращении в женскую консультацию по поводу беременности. Вместе с тем она неблагоприятно влияла на течение беременности. У 13,6% женщин была отмечена угроза ее прерывания, у 65,1% развивалась хроническая плацентарная недостаточность и гипотрофия плода в зависимости от степени гипертонической болезни. Аутопсийная диагностика существовавшей ранее гипертонической болезни у погибших беременных женщин проводится по констатации достоверной гипертрофии левого желудочка (как правило, концентрического типа), его толщина превышает 1,5 см, в то время как правый желудочек остается интактным. При микроскопии органов выявляется гипертрофия кардиомиоцитов левого желудочка, а также мышечной оболочки артериол и мелких артерий, чаще в почках и мягких мозговых оболочках. По нашим данным (А. П. Милованов, 1999), важным признаком существовавшей ранее гипертонической болезни является общность поражения спиральных артерий базального и париетального эндометрия. В матках умерших женщин обнаружены выраженный эндосклероз и сужение просвета спиральных артерий не только в составе плацентарного ложа, но и в париетальной части матки. При исследовании плодных оболочек отмечена аналогичная артериолопатия в децидуальной их части. В плацентах низкой массы преобладали склерозированные, хаотичные ворсины и инфаркты различной давности. Иными словами, эндосклероз спиральных артерий матки был частью системного поражения артериол и мелких артерий большого круга кровообращения. Следовательно, речь идет о стертых, или "мягких", формах существовавшей ранее гипертонической болезни сердца или почек, которая в процессе беременности приобрела агрессивный характер, поскольку гестационная перестройка сердца и периферических сосудов усугубила бывший артериолосклероз. Создается впечатление, что склероз стенок спиральных артерий в зоне прикрепления плаценты явно сдерживает инвазию цитотрофобласта и снижает объем гестационной перестройки маточно-плацентарных артерий, приводя к перманентной редукции ма-точно-плацентарного кровотока. 5.2.2. Преэклампсия (014.0 и 014.1). Преэклампсия объединяет вызванную беременностью гипертензию со значительной протеинурией и подразделяется по выраженности клинических симптомов на преэклампсию (нефропатию) средней тяжести и тяжелую. В России в 1995 г. погибли от гестозов 96 женщин, в 1997 г. — 67 и в 1999 г. — 76 женщин, что составило 10—12% от всех МС. Критериями тяжести преэклампсии являются: 1) систолическое артериальное давление 160 мм рт. ст. и более; 2) протеинурия до 5 г в сутки и более; 3) олигурия — менее 400 мл в сутки; 4) тромбоцитопения и гипокоагуляция; 5) нарушение функции печени. Патолого-анатомическая диагностика выявлении органа-мишени; характерного обусловленная предсуществующей преэклампсии чаще патологией основывается всего почек. это на нефропатия, Гистологически обнаруживаются резкий отек эндотелиоцитов и сужение просвета капилляров клубочков (гломерулярный эндотелиоз), наличие ШИК-положительного материала в субэндотелиальных пространствах, гиалиноз и склероз артериол коркового вещества. Если в клинической картине преэклампсии превалирует патология почек, то смерть женщин наступает от острой уремии. В почках выявляются "злокачественный" неф-росклероз, тотальный некроз эпителия канальцев, фибриновые тромбы в капиллярах клубочков и расщепление гломерулярных базальных мембран (Н. L. Sheehan и J. В. Lunch, 1973). В условиях интенсивного лечения почечной недостаточности (многократный диализ) картина нефропатии может быть не столь убедительной, тогда определяющим признаком для диагностики преэклампсии становится неполная гестационная перестройка главным образом миометриальных сегментов маточно-плацентарных артерий, т. е. недостаточность второй волны инвазии цитотрофобласта (см. 2.2). Значительно реже (4—5% случаев преэклампсии) патологический процесс характеризуется преимущественной локализацией в печени; данный симптомокомплекс обозначается в современной зарубежной литературе как HELLP-синдром. Свое название он получил по первым буквам составляющих признаков в английской транскрипции: 1) гемолиз (микроангиопатическая гемолитическая анемия); 2) повышение концентрации ферментов печени в плазме; 3) низкое число тромбоцитов. На аутопсии выявляется характерный внешний вид печени, где видны крупные пятнистые кровоизлияния под капсулой, нередко с микроразрывами и умеренным кровотечением в брюшную полость. Гистологически в печеночной ткани обнаруживаются центролобулярные некрозы, окруженные лейкоцитарным валиком, очаги перипортальных некрозов и геморрагии, тромбы из фибрина в синусоидах долек и капиллярах портальных трактов, плазматическое пропитывание и признаки васкулита в ветвях печеночной артерии. Вместе с тем эти изменения следует дифференцировать с острым гепатозом беременных. Для него более характерна рассеянная, мелкокапельная жировая дистрофия гепатоцитов и в меньшей степени — крупноочаговые некрозы. HELLP-синдром пока отсутствует в МКБ-10, поэтому он шифруется как Преэклампсия неуточненная (014.9). 5.2.3. Эклампсия. Эклампсия дифференцируется на три формы — во время беременности (О15.0), в родах (О15.1), в послеродовом периоде (015.2) — в зависимости от времени появления первых судорог и потери сознания. Патолого-анатомической картине этого состояния соответствуют значительный отек, набухание мозговой ткани с последующей гипоксией нервных клеток (эклампсичеекая энцефалопатия), кровоизлияния в коре, множественные очаги ишемического размягчения. В 15—20% случаев видны / крупные кровоизлияния в белом веществе или базальных ганглиях либо в варолиевом мосту с прорывом в желудочки (пример 5). По сводным данным Н. L. Sheehan и J. В. Lunch (1973), ос- нованным на изучении мозга у 75 женщин, погибших от эклампсии, срок от судорожного периода до летального внутримозговых исхода кровоизлияний. зависит от В первые локализации часы и характерны характера крупные геморрагии в белое вещество, базальные ганглии и варолиев мост, через сутки и более — субарахноидальные кровоизлияния, кортикальные петехии и мультифокальные мелкие некрозы. Иными словами, главным патогенетическим фактором является первоначальный объем поражения мозга. В последние годы при активной терапии и реанимационных мероприятиях морфологические эквиваленты эклампсии в головном мозге нередко "стираются", в частности отмечается меньшая выраженность кровоизлияний, отека и некроза мозговой ткани, поэтому на первый план выходят ранние признаки эклампсии в матке. К таковым относятся узкие просветы эндо-и миометриальных сегментов маточно-плацентарных артерий при сохранении в них эластомышечных компонентов и неполном их замещении фибриноидом. Это объясняется тем, что экстирпация матки проводится, как правило, в 1-е сутки после судорожного приступа, а смерть женщины наступает на 3—5-е сутки, после интенсивной терапии. В качестве дополнительного критерия диагностики всей группы гестозов важной становится оценка гистопатологии плаценты: она всегда небольшой массы (250—300 г), в ней преобладают хаотичные, склерозированные ворсины со скудными компенсаторными реакциями, т. е. диагностируется хроническая плацентарная недостаточность, обусловленная вышеприведенными изменениями маточно-плацентарных артерий. Следовательно, подчеркивается общность патогенетических механизмов дизадаптации материнского организма, маточно-плацентарной области и плаценты. Возникает порочный круг: недостаточность второй волны инвазии цитотрофобласта—редукция маточно-плацентарного кровотока—хроническая плацентарная дисфункция—высвобождение тромбопластина и биологически активных субстанций—эндотелиоз клубочков почек и артериол внутренних органов—спазм артериол—повышение сосудистого сопротивления— гипертензия—артериолосклероз базального эндометрия—снижение инвазивной активности цитотрофобласта в маточно-плацентарной области. Экспертная оценка историй родов женщин, погибших от преэклампсии и эклампсии, показала, что 67,3% летальных исходов были обусловлены: 1) недочетами в работе консультаций, несвоевременной госпитализацией и неадекватной терапией; 2) в стационарах — длительным, безуспешным лечением, нерациональным ведением родов, в том числе запоздалым кесаревым сечением. 5.3. Венозные осложнения. Сахарный диабет. Венозные осложнения во время беременности и в послеродовом периоде (О22 и О87) редко бывают первоначальными причинами МС, исключение составляет тромбоз церебральных вен. Однако варикозное расширение вен нижних конечностей и вен малого таза может стать источником тромбоэмболов, в частности ТЭЛА, которая фигурирует в другой рубрике 15-го класса МКБ-10. В настоящее время считается, что, кроме анатомически обусловленного венозного стаза (сдавление вен увеличенной маткой), в развитии венозных осложнений существенную роль играет антифосфолипидный синдром — наличие в крови женщин аутоантител к собственным фосфолипидам из разрушенных клеточных мембран (кардиолипин, этаноламин, глицерол и т. д.). Впервые они были обнаружены у больных красной волчанкой и поэтому получили общее название — волчаночный антикоагулянт. Косвенным признаком антифосфолипидного синдрома является наличие у женщины варикозной болезни с прогрессированием ее во время беременности. Критерии посмертной диагностики этого синдрома пока не разработаны. 5.3.1. Сахарный диабет при беременности (О24). Сахарный диабет при беременности имеет столь важное значение в акушерстве, что выделен в составе 15-го класса, в то время как остальная эндокринная патология фиксируется среди экстрагенитальных заболеваний. Это обусловлено тем, что обменные и гормональные перестройки, свойственные физиологической беременности, оказывают диабетогенное влияние и повышают потребность в инсулине, особенно во II и III триместрах. Выделяют три основные формы сахарного диабета. Инсулинзависимый сахарный диабет типа 1, или юношеский (ювенильный) тип, характеризуется острым началом в детском или юношеском возрасте. Эта наследственно обусловленная форма определяется наличием в крови антител к клеткам островков Лангерганса поджелудочной железы и является абсолютным противопоказанием к беременности либо поводом для ее прерывания в ранние сроки. Однако многие женщины их игнорируют, тогда беременность протекает с многочисленными осложнениями: ухудшение фоновой ретинопатии, кетоацидоз вплоть до комы и диабетический гломерулосклероз. Сахарный диабет типа 1 может стать причиной МС, поскольку трудно под- дается инсулинотерапии. Инсулинзависимый сахарный диабет типа 2 — это диабет, возникающий у взрослых, после 30—35 лет. Он протекает более благоприятно, и при тщательно подобранной диете с применением сахароснижающих препаратов во время беременности возможны срочные роды или оперативное родоразрешение. Эта форма редко бывает причиной МС, но может быть конкурирующим основным заболеванием или фоновым состоянием. Сахарный диабет, развившийся во время беременности, или гестационный диабет, обычно легко корригируется лекарственными препаратами и диетой. Изредка он фигурирует в качестве сопутствующего состояния при других причинах МС. 5.4. Кровотечения и акушерские травмы. Акушерские кровотечения занимают одно из первых мест среди причин МС: в 1995 г. погибла 91 женщина, в 1997 г. — 72 и в 1999 г. — 98, что составило от 12 до 18% всех МС. Основные причины кровотечений — это преждевременная отслойка нормально расположенной плаценты (30%), плотное ее прикрепление (20%) или центральное предлежание (10%), а также гипо- и атония матки (30%), разрывы матки (10%). Все женщины погибли после родов: 50% умерли в течение 1-х суток, из них 40% в первые 4 ч, 30% — через 3 сут, 10% — через 5 сут. 5.4.1. Предлежание плаценты (О44.1). Предлежание плаценты в настоящее время все реже становится первоначальной причиной МС, так как обязательное ультразвуковое исследование в III триместре выявляет атипично низкую локализацию плаценты с перекрытием внутреннего зева. Такие женщины идут на плановое оперативное родоразрешение. Вместе с тем даже в Москве среди приезжих лиц, наркоманов и страдающих алкоголизмом встречаются женщины, не наблюдавшиеся в консультации и поступающие с недиагностируемым частичным или полным предлежанием плаценты и кровотечением. Клинико-морфологическая диагностика предлежания плаценты основывается на макроописании ее локализации акушером на операции или в родах и тщательном гистологическом анализе плацентарного ложа матки по приведенной выше схеме (см. 4.3). Как правило, выявляются неравномерная толщина или общее истончение слоя децидуальной ткани, вросшие ворсины, очаги склероза, расслаивающие кровоизлияния различной давности. На аутопсии доминируют проявления массивной кровопотери, геморрагического шока при остром малокровии внутренних органов. 5.4.2. Преждевременная отслойка нормально расположенной плаценты с нарушением свертываемости крови (О45.0). Эта патология составляет весомую часть среди причин акушерских кровотечений в III триместре, хотя летальные исходы бывают лишь при массивном кровотечении (пример 6). Принципиальным диагностическим приемом патологоанатома является суммирование объема имбибиции кровью стенки матки и окружающей клетчатки, т. е. локального внутрисосудистого свертывания, с объемом ретроплацентарной гематомы или межворсинчатого кровоизлияния (расчет общей кровопотери). Важным дополнением к диагнозу должна стать гистологическая оценка давности ретроплацентарной гематомы и расслаивающих кровоизлияний в миометрии, что нередко становится весомым аргументом для констатации нарушений акушерской тактики ведения данной женщины в консультации (на этапе наблюдения) или в родильном доме. Следует собрать в отдельную салфетку фрагменты ретроплацентарной гематомы и в обязательном порядке прислать для гистологического изучения. По ее морфологии можно с точностью в пределах 1 — 1,5 сут определить давность образования гематомы, а макроскопическая оценка плаценты в целом позволяет уточнить наличие артифициальных дефектов, разрывов и охарактеризовать объем межворсинчатого кровоизлияния. В других органах умершей женщины выявляются обычно макро- и микроскопические признаки массивной кровопотери, геморрагического шока, малокровия внутренних органов или ДВС-синдрома. 5.4.3. Кровотечение в третьем периоде родов (О72.0). Кровотечение в третьем периоде родов связано обычно с задержкой, приращением или ущемлением плаценты. Поэтому обязательным условием исследования матки должно быть обнаружение плацентарного ложа и тщательное его гистотопографическое изучение, чтобы подтвердить или отвергнуть наличие оставшихся или вросших ворсин. Наш опыт свидетельствует, что достаточно выявить несколько ворсин, находящихся в глубоких бухтах ба-зальной пластинки или в прилежащем эндо- и миометрии. Столь же обязательным является углубленное макро- и микроскопическое изучение родившейся или выделенной плаценты с целью выявления ее дефектов. В других органах умершей женщины выявляется обычно картина геморрагического шока или ДВС-синдрома. 5.4.4. Кровотечение в раннем послеродовом периоде (О72.1). Кровотечение в раннем послеродовом периоде возникает после рождения плаценты и объясняется главным образом гипотонической дисфункцией матки (атоническое кровотечение). Для патолого-анатомической диагностики этого тяжелого состояния необходимо тщательное изучение плацентарного ложа матки в целях исключения участков приращения плацентарных ворсин и оценки состояния маточно-плацентарных артерий, которые продолжают зиять и служат основным источником массивной кро-вопотери. Отсутствие должного сокращения их просвета и лишь частичный тромбоз открытых устьев маточноплацентарных артерий обусловлены, как правило, недостаточной контракцией матки после родов. Гистологически это объясняется значительным отеком или имбибицией кровью межмышечных прослоек, выраженной дистрофией и очаговым миолизом разобщенных мышечных клеток. В части подобных случаев к вышеописанным признакам добавляется воспалительная реакция интерстиция: накопление сегментоядерных лейкоцитов и дегранулированных тучных клеток, что дает основание предположить участие в этом процессе цито-кинового каскада и биологически активных агентов. Аутопсийная диагностика основывается на вышеописанных проявлениях массивной кровопотери, геморрагического шока и ДВС-синдрома (пример 7). Трудности снижения уровня МС от кровотечений связаны с несвоевременной помощью, низкой оперативной активностью акушеров, ошибками при проведении анестезиолого-реанимаци-онных мероприятий. Ключевым моментом остается объективное определение объема кровопотери. Самый распространенный метод — взвешивание операционного белья и салфеток — весьма неточен. Ошибка его колеблется в пределах 15—20% из-за трудно учитываемой доли околоплодных вод. В отечественном акушерстве принята средняя кровопотеря после кесарева сечения порядка 600 мл, а допустимая кровопотеря — 900—1000 мл. По материалам 1-го Всемирного конгресса по проблемам МС (1997), потеря 500 мл крови и более при снижении гематокрита на 5% это уже патологическое состояние, требующее специального лечения. В неправильной оценке кровопотери весовым способом (она всегда занижена) кроется 20% врачебных ошибок. Следовательно, акушерские кровотечения, составляющие существенную долю среди причин МС, остаются важнейшей, трудноразрешимой проблемой отечественного акушерства. Несмотря на очевидную причинную связь с геморегуляторной функцией плаценты, многие детали патогенеза массивных кровотечений остаются нерасшифрованными до сего дня. Родовой травматизм остается весомой причиной МС. Так, разрывы матки составили в 1995 г. 3,6%, в 1997 г. 1,7% и в 1999 г. 3,6% всех причин МС. Разрывы матки принято подразделять на спонтанные и насильственные. Спонтанные дефекты возникают при наличии миомы, миометрита. Они бывают полными, сквозными или неполными с повреждением эндо- и миометрия при сохранном периметрии и брюшины. Насильственные разрывы возникают в результате добавочного растяжения нижнего сегмента во время родов. Причинами самопроизвольных разрывов шейки или тела матки являются предсуществующие изменения воспалительного или склеротического (рубцы) характера. Многие предпосылки для возникновения разрывов, в частности ригидность шейки и тела матки у пожилых первородящих, должны учитываться и предупреждаться акушерами. Насильственные разрывы шейки и тела матки возникают обычно при оперативном родоразрешении (щипцы), повороте и извлечении плода, плодоразрушающих операциях и т. д. Наиболее грозными осложнениями разрывов матки бывают массивные внутрибрюшные кровотечения (пример 8) и перитонит. Разрывы промежности 1—4-й степени, возникшие в родах, нередко становятся входными воротами для послеродового сепсиса либо являются источником умеренного кровотечения. Акушерские разрывы шейки матки и верхнего отдела влагалища обычно приводят к более массивным кровотечениям, поскольку кровь проникает в параметральную клетчатку и образует гематому таза. Реже встречается отрыв влагалищных сводов, когда возникает значительное растяжение сводов влагалища, обычно вместе с высоким стоянием и максимальным растяжением наружного зева шейки матки. Многие формы родового травматизма не диагностируются своевременно и спустя 2—3 ч после родов приводят к скрытым кровотечениям либо к последующему инфицированию и развитию послеродового сепсиса, расхождению швов, рубцовых процессов и формированию шеечно-влагалищных свищей. Подводя итог, можно констатировать, что уровень родового травматизма является объективным показателем, характеризующим степень организации, объем профессиональных знаний, опыт и отношение к работе врачей-акушеров конкретного родовспомогательного учреждения. 5.5. Анестезиологические осложнения. В МКБ-10 внутри 15-го класса представлены три раздела, отражающие осложнения анестезии в период беременности (О29), во время родов (О74) и в послеродовом периоде (О89). Сюда входят осложнения у матери, вызванные проведением общей или местной анестезии, применением болеутоляющих или седативных препаратов. Количество анестезиологических осложнений в качестве причины МС остается на высоком уровне в России. Так, в 1995 г. погибли 49 женщин, в 1997 г. — 45, в 1999 г. — 37 женщин, что составило соответственно 6,8, 6,5 и 4,1% МС. Среди 88 женщин, погибших за 1994—1995 гг., выявлены следующие осложнения: 6 женщин погибли от аспирационного пневмонита, 14 — в результате осложнений интубации, 8 — от передозировки анестетиков, 18 — от дефектов катетеризации, 30 — от неожиданной реакции на анестетики и 12 — от прочих ятрогенных причин. Все эти случаи соответствуют определению акушерской смерти (см. 1.1), обусловленной вмешательствами, упущениями или неправильным лечением. 5.5.1. Аспирационный пневмонит, или синдром Мендельсона. Этот синдром получил свое название по имени автора (С. L. Mendelson, 1946), который проанализировал 66 случаев аспирации при общей анестезии в родах и выделил особую астмоподобную реакцию на кислое желудочное содержимое без обтурации пищевыми массами. Для беременных женщин типична регургитация, или пассивный желудочно-пищеводный рефлюкс, возникающий, когда давление в желудке выше, чем в пищеводе (см. 2.4). По современным представлениям (А. П. Зильбер и Е. М. Шиф-ман, 1997), речь идет о кислотно-аспирационном гиперергическом пневмоните вследствие рефлекторной реакции верхних дыхательных путей на желудочное содержимое. Первичный эффект — это ларинго- и бронхоспазм, а также брадикардия вплоть до остановки сердца, возникающие как вагусный рефлекс на химическое раздражение гортани, трахеи и бронхиального дерева. Смерть женщины может наступить на первом этапе (пример 9), но чаще острая легочно-сердечная недостаточность переходит в подострую фазу и женщины погибают на 4—8-е сутки от аспирационной или абсцедирующей пневмонии. На аутопсии макроскопически определялись массивные, отечные легкие. При осмотре трахеи и крупных бронхов иногда видны желудочное содержимое и мелкие кусочки пищи (при быстрой смерти). Микроскопическая картина органов дыхания зависела от времени с момента регургитации до летального исхода. Собственно гиперергический пневмонит — это обширное некротическое поражение эпителия трахеи, крупных и средних бронхов (инициальные изменения). Десквамированный эпителий заполнял просветы бронхиол и респираторных путей. На 3—4-е сутки в легких возникали обширные поля некроза с перифокальным серозно-геморрагическим, а затем гнойным воспалением. На 5—12-е сутки формировались абсцедирующие очаги пневмонии, и без соответствующего анестезиологического анамнеза установить первоначальную регургитацию желудочного содержимого весьма трудно. Таким образом, синдром Мендельсона является демонстративным примером, когда увеличенная матка меняет топографию желудка и пищевода, способствуя тем самым регургитации кислого желудочного сока в трахеобронхиальное дерево при общей анестезии. В зависимости от времени развития аспирационного пневмонита и последующей гибели женщины эти случаи определяются различными кодами: в период беременности (О29), родов (О74), послеродовом периоде (О89). 5.5.2. Смерть, связанная с трудной или неудачной интубацией (О29.6, О 74.7 и О89.6). Смерть, связанная с интубацией, наступает чаще всего при экстренном выполнении кесарева сечения без необходимой подготовки женщины. Как правило, неудачная интубация осуществляется анестезиологом "общего профиля", который уверен, что интубация должна быть выполнена любой ценой. Факторами, предрасполагающими к этому, могут быть: 1) антропометрические особенности (короткая шея, узкий рот с выступающим сводчатым твердым небом и т. д.), в связи с этим патологоанатому полезно измерить расстояние от надгортанника до бифуркации трахеи; 2) масса тела более 100 кг; 3) эклампсия, жидкостная перегрузка и инфекция верхних дыхательных путей, при которых высок риск отека гортани. При интубации возможны следующие осложнения: случайная интубация пищевода с острым расширением желудка (пример 10), неправильное положение трубки (попадание ее в один из главных бронхов), травма зубов, губ, языка, глотки и гортани, перелом или вывих шейного отдела позвоночника, с местным нередко массивным кровотечением. Смерть наступает быстро, на операционном столе вследствие невозможности вентиляции легких и острой гипоксии мозга. Патолого-анатомическая диагностика данных форм ятрогенной патологии весьма сложна, если она не зафиксирована или скрывается причинная связь с неудачной интубацией трахеи. В этих условиях особенно внимательно осматриваются верхние дыхательные пути и пищевод. Все царапины, линейные надрывы, кровоподтеки и кровоизлияния регистрируются в протоколе. Желательно подозрительные участки взять на гистологическое исследование. Во время аутопсии описываются положение и форма желудка, паратрахеальная клетчатка, асинхронная воздушность легких (гипервоздушность одного и ателектаз другого), а также петехиальные кровоизлияния на перикарде и слизистых оболочках (смерть от острой асфиксии). Среди других осложнений анестезии возможна внезапная остановка сердца в начальном периоде наркоза при введении обычной дозы тубарина либо как проявление индивидуальной гиперреакции на комплекс медикаментов для вводного наркоза. Существует потенциальная опасность некоторых современных препаратов; так, дроперидол может вызвать двигательное возбуждение и затруднить интубацию, а пропанидид (сомбревин, эпонтол) — вызвать аллергический шок и остановку сердца. Пропанидид противопоказан при аллергизации женского организма (В. И. Кулаков и соавт., 2000). Встречается также остановка дыхания при внутривенном введении омнопона в дозе, превышающей нормативы. В редких случаях выраженные гемодинамические сдвиги отмечаются при неадекватном (неполном) анестезиологическом обеспечении малых акушерских операций. Остается высоким уровень осложнений при катетеризации подключичных вен — сквозных ранений вен и куполов плевральных полостей с пневмотораксом, особенно при многократных попытках катетеризации. Вместе с тем в данной рубрике кодируются осложнения катетеризации, которые возникают только в случаях, когда пункция вены осуществлена в рамках подготовки или проведения наркоза. Остальные случаи (вне наркоза) фиксируются в другой рубрике (см. 5.8). В большинстве случаев так называемая наркозная смерть обусловлена неожиданными аллергическими реакциями или идиосинкразией на вещества, используемые анафилактическая реакция для анестезии. реализуется в В максимальной гладкомышечной степени оболочке бронхиального дерева посредством бронхо- и бронхиолоспазма. Известны также случаи чрезмерной реакции на компоненты вводного наркоза (тиопенталнатрий, дитилин, фентанил и др.). Лекарственная идиосинкразия возможна при добавлении к вводному или основному наркозу препаратов, стимулирующих выделение гистамина (кодеин, атропин и др.). Клинико-анатомический анализ осложнений анестезии (наркозная смерть) — самый трудный раздел работы патологоанатома и судебно-медицинского эксперта, тем более в условиях вполне возможного сокрытия или переписывания истории родов, анестезиологической карты и других дефектов медицинской документации. Выход один — вникать в детали самому, желательно с помощью оппонента-анестезиолога, перед разбором случая на клинико-анатомической конференции. Так, при изучении наркозной карты особого внимания заслуживают неожиданные приступы тахи- или брадикардии, аритмии, артериальной и(или) венозной гипер- и гипотонии; их следует сопоставить с хронологией наркоза и временем введения конкретных лекарственных препаратов. Если регистрируется внезапное повышение систолического давления в сочетании с тахикардией, то это является отражением реакции на чрезмерное болевое раздражение (неглубокий наркоз). Появление цианоза и участие вспомогательных мышц в дыхании — признаки дыхательной или правожелудочковой недостаточности. Своевременно ли анестезиолог компенсировал газообмен и кровообращение? Если он промедлил, то правожелудочковая недостаточность быстро приводит к коллапсу и остановке сердца. Следует подчеркнуть, что чаще всего внезапная смерть женщины на операционном столе обусловлена недостаточной анальгезией и редко — передозировкой анестетиков. Аутопсия и последующая микроскопия органов дают лишь косвенные признаки для подтверждения наркозных осложнений. К таковым относятся бронхоспастические реакции, избирательное венозное полнокровие мозга и его оболочек, печени, почек и селезенки при передозировке анестетиков. При внезапной смерти от острой дыхательной недостаточности во время наркоза важно оценить степень акроцианоза — ногтевых фаланг и подушечек пальцев — маркеров правожелудочковой недостаточности. Дистрофические и некробиотические изменения паренхиматозных органов появляются позднее — через 8—12 ч после наркоза, если смерть наступила в течение 1-х или 2-х суток. Диагностике способствуют также тщательная хронология деталей наркоза и сопоставление их с патоморфологическими находками. К сожалению, на клинико-анатомических конференциях редко удается установить дополнительные детали хода анестезии и ее осложнений. Следовательно, анестезиологические осложнения как причины МС остаются серьезной проблемой в акушерстве, хотя большинство из них предотвратимо, кроме индивидуальной реакции на анестетики. Чаще всего приходится идти методом исключения всех других возможных причин внезапной смерти. 5.6. Гнойно-септические заболевания В 15-м классе септические осложнения по времени их появления подразделяются на: 1) возникшие вследствие неудачного медицинского или криминального аборта, осложнившегося инфекцией половых путей и тазовых органов (см. 5.1.2), 2) септицемию в родах, 3) послеродовой сепсис, 4) инфекцию хирургической акушерской раны. В России ежегодно 12—20 женщин погибают от сепсиса после 28 нед беременности. Интересно, что и в США за последние 3 года отмечен рост МС от инфекций — 12%, причем в 505 случаях причиной МС были последствия септических абортов. Во многом это объясняется меньшей эффективностью антибиотикотерапии вследствие смены возбудителей. Так, в 50—60-е годы преобладали золотистый стафилококк и Clostridium perfringens, грамотрицательные в анаэробы, 60—70-е в 80-е годы годы — — кишечная палочка, условно-патогенные и грамотрицательные микроорганизмы, а в 90-е годы — стрептококки (А) и пневмококки, микобактерии туберкулеза, энтерококки, грамотрицательные анаэробы и стафилококки. В патогенезе приведенных выше форм акушерского сепсиса много общих механизмов и прослеживается единая последовательность событий, а именно: — индуктивная фаза, т. е. поступление в кровоток микробного эндотоксина — липида А, который служит пусковой субстанцией при гнойно-септических заболеваниях; — фаза синтеза и секреции цитокинов активированными макрофагами; — каскадная фаза генерализованного воспаления вследствие накопления эндогенных медиаторов септического состояния (см. 3.3); — в дальнейшем развивается инфекционно-токсический шок. Вместе с тем отдельные формы гнойно-септических заболеваний имеют клинико-морфологические особенности, определяемые главным образом входными воротами для инфекционных агентов. 5.6.1. Септицемия в родах (О75.3). Септицемия в родах известна в отечественном акушерстве как эндометрит в родах, или синдром амниотической инфекции (хориоамнионит). Инфицирование возникает при преждевременном разрыве плодных оболочек либо ранее — из хронических очагов гениталий или мочевыводящих путей. В последние годы среди возбудителей хориоамнионита чаще выявляются анаэробы (27,3%), энтерококки (18,2%), стрептококки (22%) и стафилококки (11,7%), в остальных случаях определяется микстинфекция. Опасность генерализации инфекции увеличивается при длительных родах и безводном периоде. Оптимальная акушерская тактика в этих случаях — своевременное экстраперитонеальное кесарево сечение, а при пропитывании матки зловонными околоплодными водами — экстирпация матки. Как правило, развитие сепсиса происходит сразу или в ближайшие дни после родов. Патолого-анатомическая верификация септицемии требует ее подтверждения в посевах крови из полостей сердца. Кроме того, желательна морфологическая констатация раннего инфицирования плодных оболочек (подтверждение дородового амнионита и эндометрита), т. е. генерализованного воспалительного поражения системы мать—плацента—плод. Патологоанатомы редко диагностируют септицемию в родах как первоначальную причину МС, поскольку при традиционном подходе ее трудно дифференцировать с послеродовым сепсисом. Однако между ними имеются принципиальные патогенетические различия. При септицемии в родах доминирует инициальное, антенатальное инфицирование с развитием клиники в течение длительных родов. Это требует ее своевременной диагностики, быстрого оперативного родоразрешения и массивного противовоспалительного лечения (В. Н. Серов и соавт., 1997). 5.6.2. Послеродовой сепсис (О85). Это наиболее частое и тяжелое гнойно-септическое заболевание в акушерстве. По данным В.Н. Серова и соавт. (1997), септицемия возникала на фоне эндометрита — у 91% женщин, при наличии абсцессов после инъекций и травм промежности — у 3%, при мастите — у 3%, при апостематозном пиелонефрите — у 3% родильниц. В отличие от септицемии в родах послеродовой сепсис развивается позднее, на 3—5-е сутки после родоразрешения, так как основными входными воротами является обширная внутренняя поверхность матки после отделения плаценты и плодных оболочек. Несмотря на частое присутствие выраженного эндометрита, послед остается, как правило, интактным. На аутопсии выявляются признаки инфекционно-токсического шока (см. 3.3), поражение миокарда левого желудочка, органов-мишеней (почки, поджелудочная железа и др.), умеренная гиперпластическая реакция селезенки, а также проявления ДВС-синдрома. Патолого-анатомическая диагностика послеродового сепсиса не вызывает обычно серьезных затруднений, особенно при гибели родильницы на 2—3-й неделе после родоразрешения (пример 11). Обязательным признаком сепсиса является наличие в крови какого-либо инфекционного агента, подтверждающее септицемию. Поскольку для лечения женщины, как правило, используют весь арсенал современных антибиотиков, то пиемические очаги или генерализованная реакция селезенки, как правило, не выявляются. У женщин с подтвержденной наркоманией или алкоголизмом возможно подострое течение послеродового сепсиса — по типу септического эндокардита. В случаях быстрого развития сепсиса, в течение 1-й недели после родов, возникает необходимость дифференцировать его с септицемией в родах (см. выше). В МКБ-10 в рубрику "Послеродовой сепсис" входит также перитонит, возникший как осложнение кесарева сечения, хотя отечественными акушерами выделяется специальная форма — акушерский перитонит. К сожалению, в комментариях к МКБ-10 не уточняется, каким шифром следует воспользоваться в подобных случаях. Поскольку в патологической анатомии давно утвердился подход на выявление входных ворот для септического процесса, то более правильно, на наш взгляд, рассматривать перитонит после кесарева сечения в отдельном, нижеследующем разделе. 5.6.3. Инфекция хирургической акушерской раны (О86.0), или акушерский перитонит. Это одно из грозных осложнений послеродового периода. Входными воротами для инфекционного процесса являются чаще всего расхождение швов на матке после кесарева сечения или шва промежности, хориоамнионит в родах, послеродовой эндометрит. Матка с открытой раневой поверхностью — это удобный плацдарм для резорбции бактериальных и тканевых токсинов. Выделяют три возможных механизма инфицирования брюшной полости. При первом из них источником инфицирования становится содержимое матки, попадающее в брюшную полость в процессе кесарева сечения ("ранний" перитонит); клиника появляется уже на 1—2-е сутки при сохранении герметичности швов на матке. Второй вариант — это возникновение пареза кишечника с повышенной проницаемостью его стенок для токсинов и бактерий. Третий, наиболее частый вариант обусловлен инфицированием брюшной стенки из-за расхождения швов на матке. Финальные стадии акушерского перитонита протекают по типу прогрессирующей интоксикации, усиленного выведения калия в экссудат брюшной полости, обезвоживания, олигурии и почечной недостаточности либо ДВС-синдрома. Инфекционно-токсический шок встречается реже. Патологоанатомическая диагностика акушерского перитонита определяется установлением четкой причинной связи с осложнениями кесарева сечения и соответствующими макро- и микроскопическими находками в брюшной полости и матке. Часто возникновению инфекционного процесса по месту акушерской раны способствуют вторичный иммунодефицит и ослабление защитных сил организма родильницы. Таким образом, гнойно-септические акушерские заболевания представляют собой серьезную проблему для своевременного и полноценного лечения. Они часто становятся первоначальной причиной МС. Вместе с тем нередко они присоединяются в финале других заболеваний, например при травмах матки, и становятся осложнениями основного заболевания. Порой только тщательный клинико-морфологический анализ позволяет разграничить эти состояния у конкретных родильниц. 5.7. Акушерские эмболии. Самыми загадочными причинами МС остаются акушерские эмболии, в частности воздушная, эмболия амниотической жидкостью или сгустками крови. В 1995 г. в российских регионах от эмболии околоплодными водами погибли 27 женщин и от ТЭЛА — 18, в 1997 г. — соответственно 17 и 15 женщин, в 1999 г. — 22 и 16 женщин, что в целом составляет 5—6% МС. 5.7.1. Воздушная эмболия (О88.0). Воздушная эмболия — это прямое попадание воздуха в вену двумя путями: пассивное проникновение воздуха в сосуд и внут-рисосудистое его нагнетание. Более характерная для нейрохирургических операций со вскрытием венозных синусов или для операций с искусственным кровообращением газовая эмболия иногда становится причиной МС, особенно при кесаревом сечении. Первое сообщение о газовой эмболии, приведшей к смерти женщины в родах, относится к 1850 г. (J. R. Cormack). По данным А. П. Зильбера и Е. М. Шифмана (1997), для возникновения газовой эмболии у беременных женщин должны быть предрасполагающие условия (дополнено нами): 1. Контакт венозных сосудов с атмосферным воздухом: — операция кесарева сечения; — отслойка плаценты или плодоразрушающая операция; — аборт медицинский или криминальный; — прямая пункция подключичной вены с подсасыванием воздуха; — разгерметизация системы переливания крови. 2. Различные вмешательства на матке: — ручное отделение плаценты; — ушивание матки. 3. Введение газа, жидкости под давлением: — газоконтрастные диагностические исследования; — ускоренная внутривенная трансфузия жидкости или крови. 4. Гиповолемия: — тяжелая преэклампсия или сахарный диабет; — применение диуретиков; — массивная кровопотеря. Патологическое действие газового эмбола зависит от многих факторов. Наиболее опасно быстрое поступление большого объема воздуха (не менее 250—300 мл для женщины массой 70 кг); он сразу скапливается в правых отделах сердца и блокирует кровоток. Если не заращено овальное окно, то газовые эмболы могут проникать в артериальную систему. Важное обстоятельство: во время наркоза закисью азота для развития тяжелой газовой эмболии потребуется гораздо меньше воздушных пузырьков (всего 70—100 мл), чем при других ситуациях, например при разгерметизации системы переливания крови. В случаях проникновения большого объема воздуха в правые отделы сердца смерть наступает в считанные минуты при симптоматике острого легочного сердца. При подозрении на воздушную эмболию требуется особо тщательное, желательно срочное, вскрытие с обязательной воздушной пробой под водой правых полостей сердца (до вскрытия черепной полости). Мы рекомендуем использовать для этого короткую пункционную иглу большого диаметра; ее целиком погружают в воду и потом прокалывают стенку правого предсердия. При появлении первых пузырьков воздуха (желательно посчитать их общее число) следует выдавить содержимое полости правого желудочка, а затем — верхней полой вены. Внимание (!) — при поздней аутопсии (на 2—3-й сутки), особенно летом при жаркой погоде, в венозной системе и в правых полостях сердца обнаруживается пенистая кровь как следствие трупного аутолиза; подобные пузырьки не имеют никакого отношения к газовой эмболии. В целом патологоанатом или судебно-медицинский эксперт для постановки диагноза "акушерская воздушная эмболия" должен тщательно проанализировать, существовали ли предпосылки для ее возникновения и достаточен ли ее объем для объяснения внезапной смерти женщины. Все сомнения в этом отношении, например при обнаружении лишь нескольких пузырьков при воздушной пробе, должны трактоваться как аргумент против данного диагноза. Без проведения убедительной воздушной пробы подобный диагноз невозможен. 5.7.2. Эмболия околоплодными водами (О88.1). Это достаточно частая причина МС: в 1995 г. от нее погибли 27, в 1997 г. — 19, в 1999 г. — 22 женщины, что составило 3,5— 4% МС. Начало систематическому изучению эмболии околоплодными водами положили американские акушеры P. E. Steinег и С. С. Lushbaugh (1941): они описали 8 женщин, погибших внезапно в родах. На аутопсиях в их легких были выявлены фрагменты амниотической жидкости в капиллярном русле. С тех пор акушеры все случаи внезапной смерти беременных женщин трактуют как эмболии околоплодными водами. Гипердиагностикой этого смертельного состояния "грешат" и патологоанатомы, не утруждая себя тщательными поисками соответствующих морфологических эквивалентов в легочных капиллярах и артериолах. Только в последние годы патолого-анатомическая диагностика эмболии околоплодными водами стала более объективной и обоснованной, поскольку сейчас требуются обязательное использование комплекса гистологических методов для выявления всех компонентов околоплодных вод в легочных капиллярах, а также констатация гемодинамических предпосылок. Для возникновения эмболии легких околоплодными водами необходимы по крайней мере два патофизиологических условия (А. П. Зильбер и Е. М. Шифман, 1997): — во-первых, превышение амниотического давления над венозным давлением в матке, что возможно при стремительных родах, тазовом предлежании плода, многоводии, крупном плоде, а также при чрезмерной стимуляции сократительной деятельности матки окситоцином или его аналогами; кроме того, такая ситуация имеет место при гиповолемии, т. е. падении диастолического давления, когда возникает присасывающий эффект венозной крови; — во-вторых, зияние сосудов тела или шейки матки, которое наблюдается при преждевременной отслойке или предлежании плаценты, при любом оперативном вмешательстве на матке (кесарево сечение, ручное обследование матки, плодоразрушающие операции), в частности при введении в полость послеродовой матки 1% взвеси полимерного препарата "Полисорб" (В. Л. Коваленко и соавт., 2000). Реальным плацдармом для эмболии задней порции околоплодных вод становятся разрывы шейки матки, в которой находится мощное венозное сплетение, либо травматический непроникающий разрыв матки. Однако наиболее частым путем проникновения околоплодных вод в кровоток матери являются многочисленные венозные коллекторы в составе плацентарного ложа матки в случаях, когда происходит краевая отслойка плаценты. Если разрез матки при кесаревом сечении прошел через краевой синус плаценты, где сконцентрировано большое число венозных сосудов, то особенно велика возможность эмболии. Патолого-анатомическая верификация эмболии околоплодными водами требует тщательной аутопсии (лучше вначале вскрыть грудную клетку, выделить легкие и через бронхи зафиксировать их формалином) и последующей микроскопии легких, плацентарного ложа матки. Рекомендуется взять 15—20 мл венозной крови из нижней полой вены и правых полостей сердца; после легкого центрифугирования ее разделяют на отдельные слои: нижний — эритроциты, верхний — плазма. Если в крови имеются компоненты околоплодных вод, то они сконцентрируются в верхнем слое (И. В. Тимофеев, 1999). Желательно также из верхнего слоя или цельной венозной крови сделать мазок, окрасить его по Романовскому—Гимзе или нильским голубым для выявления клеточных компонентов околоплодных вод. Кроме того, во время вырезки легких следует взять не менее 10—15 кусочков из разных сегментов, преимущественно нижних зон, с учетом посмертного накопления там крови. Помимо окраски гематоксилином и эозином следует использовать ШИКреакцию (для выявления слизи), а также окраску на жир замороженных срезов. В нашем материале встречались случаи, когда в просвете мелких артерий и капилляров легких погибших женщин выявлялись только ШИК-позитивная слизь или только жировой компонент (не путать с капельками жира в альвеолярных макрофагах) при отсутствии твердых частиц околоплодных вод и, наоборот, только чешуйки эпидермиса, волоски или бронхиальные, слущенные клетки, частички мекония. Изредка в отдельных капиллярах встречаются многоядерные гигантские симпласты, которые отрываются от эпителиального покрова ворсин плаценты; они не имеют отношения к эмболии околоплодными водами, так как их попадание в капилляры — нормальная физиологическая реакция во время беременности (А. П. Милованов, 1999). Важно подчеркнуть, что главным патогенетическим механизмом эмболии околоплодными водами служит не объем блокады капиллярного кровотока, а чрезвычайно агрессивный, чужеродный состав околоплодной жидкости. Она содержит мукопротеиды с высоким содержанием углеводов и липидов, включая сыровидную смазку кожи, а также много белка в концентрации 210— 390 мг%. Кроме того, в ее состав входят адреналин, норадреналин, гистамин, простагландины, цитокины и эйкосаноиды. Относительно крупные и твердые фрагменты околоплодных вод имеют скорее второстепенное значение, являясь лишь гистологическими признаками эмболии. Следовательно, главное — это жидкие, слизистые и жировые компоненты околоплодных вод, которые являются активными вазоконстрикторными и тромбопластическими факторами для легочного эндотелия и оттекающей артериальной крови. Экспериментально доказано, что перфузия изолированного сердца животных отфильтрованными околоплодными водами вызывала выраженный спазм коронарных сосудов и снижение сердечного выброса, т. е. острую сердечную недостаточность вследствие прямой ишемии миокарда. У женщин быстро развивается фибрилляция желудочков либо кардиопульмональный шок с последующим быстрым отеком легких. Если смерть не наступила сразу, то дальнейшее течение эмболии околоплодными водами развивается как острейшая коагулопатия или ДВС-синдром и больные умирают через 2—4 ч (пример 12). Следовательно, диагноз эмболии околоплодными водами должен быть клинико-морфологическим, т. е. ставиться на основании наличия при внезапной смерти цианоза верхней части туловища, патофизиологических предпосылок эмболии и выявления компонентов амниотической жидкости в артериях и капиллярном русле легких. Порой требуются кропотливые поиски чешуек, волосков или слизи, капель жира хотя бы в нескольких артериях и капиллярах легких. Выборочная проверка нескольких протоколов и микропрепаратов легких погибших женщин с подобным диагнозом из регионов России выявила очевидную гипердиагностику эмболии околоплодными водами, так как патологоанатомы шли "в фарватере" заключительного клинического диагноза, без необходимого гистологического подтверждения эмболии компонентами околоплодных вод. 5.7.3. Эмболия сгустками крови (тромбами). Эмболия тромбами более известна как ТЭЛА, или акушерская легочная эмболия (О88.2) в послеродовом периоде. Обычно на 4—7-е сутки после родов внезапно развивается острое легочное сердце с правожелудочковой недостаточностью и системной гипотензией (кардиальный синдром) либо преобладают нарушения дыхания: нарастающая одышка, боли в груди, ортопноэ и кровохарканье (респираторная форма). ТЭЛА является относительно частой причиной МС: в 1995 г. погибли 27, в 1997 г. — 19 и в 1999 г. — 16 женщин, что составило от 6 до 3% всех МС. Акушеры считают ТЭЛА самостоятельным заболеванием и так выделяют ее среди причин МС, в то время как патологоанатомы по аналогии с подобными ситуациями в соматической патологии трактуют ТЭЛА как осложнение, считая первопричиной отрыв тромбоэмбола, например вследствие тромбофлебита вен нижних конечностей. По нашему мнению, в акушерстве ТЭЛА должна фигурировать как несомненная первоначальная причина МС, поскольку она приведена в одной рубрике с акушерской воздушной и амниотической эмболиями. В этом убеждают следующие факты. Во-первых, в конце беременности отмечается такая особенность гемостаза, как гиперкоагуляция (см. 2.3), что способствует тромбообразованию в венах малого таза и нижних конечностей. Во-вторых, ТЭЛА возникает в послеродовой период — в момент резкой перестройки системы свертывания крови матери после рождения плаценты, когда ранее сбалансированный гемостаз лишается мощного противосвертывающего компонента. В-третьих, появляются данные о том, что ТЭЛА обусловлена скрытым антифосфолипидным синдромом — наличием в крови родильниц антител против кардиолипина и других факторов (см. 5.3). Следовательно, акушерская легочная тромбоэмболия, представленная отдельным кодом в 15-м классе МКБ-10, тесно связана с резкими изменениями гемостаза в послеродовом периоде и должна выделяться в качестве первоначальной причины МС. Аутопсийная диагностика ТЭЛА основывается на обнаружении тромбоэмболов в просвете легочного ствола, его главных ветвей либо долевых или сегментарных артерий, т. е. блокирования легочного кровообращения. Однако в ряде случаев обтурирующие тромбы в крупных легочных стволах отсутствуют, а максимум тромботических поражений выявляется в сегментарных и мелких артериях одного из легких. По клинике они соответствуют рецидивирующему течению ТЭЛА с повторным возникновением очаговых легочных инфарктов и развитием подострого типа легочного сердца. Эти варианты ТЭЛА трудно дифференцировать с хроническим течением ДВС-синдрома. Необходима особая нацеленность патологоанатома на поиски места отрыва тромбоэмболов. Для этого тщательно исследуются вены матки, малого таза, крестца и нижних конечностей. Следует предостеречь от ошибок в оценке местного тромбоза венозных коллекторов плацентарного ложа, который расценивается как проявление нормальной инволюции матки. Места возникновения тромбоэмболов обнаруживаются чаще при массивном тромбозе ствола и главных ветвей легочной артерии. В сводную группу акушерских эмболии включены также пие-мическая и септическая эмболии, но они имеют прямое отношение к течению акушерского сепсиса, способствуя возникновению вторичных гнойных очагов в финале этого заболевания. Акушерская жировая эмболия не встречалась в нашей практике. 5.8. Ятрогенная патология. Ятрогения — это осложнение основного заболевания или сама первоначальная причина смерти, вызванная ошибочными или неадекватными действиями врача, либо заболевания, патологические процессы, необычные реакции, обусловленные медицинским воздействием в ходе обследования больных, выполнения диагностических и профилактических процедур (В. В. Некачалов, 1998). В МКБ-10 ятрогениями считаются неблагоприятные последствия лечебных или диагностических мероприятий и манипуляций, мероприятий, выполняемых по ошибочному диагнозу, случайного нанесения вреда больному в ходе плановой или экстренной операции, переливания иногруппной или некачественной крови, а также осложнения лекарственной терапии. В 15-м классе ятрогенная патология в акушерстве представлена не общей рубрикой, а разбросана в различных разделах, например в акушерской травме, анестезиологических осложнениях. Чтобы избежать "прокурорского" подхода, патологоанатом должен понимать, что некоторые ятрогении даже со смертельным исходом, но при правильно оказанной медицинской помощи или рациональной оперативной тактике следует рассматривать как осложнение основного заболевания, поскольку тяжесть их течения объясняется главным образом ослаблением организма женщины основным заболеванием. Вместе с тем в акушерской практике встречаются случайные повреждения соседних органов при оперативном родоразрешении (пересечение мочеточника, крупного сосуда и т. д.), которые по своему объему становятся первоначальными причинами МС. Более часто патологоанатом или судебномедицинский эксперт анализирует неадекватные реакции на лекарственные препараты, переливание иногруппной или некачественной крови, кровезаменителей. Все они включаются в рубрику О75.4 "Осложнения, вызванные акушерским оперативным вмешательством и другими процедурами", кроме осложнений анестезии, хирургической раны, расхождения швов, гематомы и инфекции. Понятие "процедуры" соответствует той части определения акушерских причин МС, где говорится об упущениях и неправильном лечении (см. 1.1). Реакции на лекарственные препараты изредка фигурируют как первоначальные причины МС. Так, в нашем консультативном материале встречались летальные исходы при внутримышечном введении пенициллина (анафилактический шок), внутривенном введении но-шпы при первоначальном удовлетворительном состоянии женщины. Патолого-анатомическая верификация индивидуальной реакции на лекарственные препараты чрезвычайно сложна и основывается, как правило, на хронологическом совпадении резкого ухудшения состояния женщины сразу после введения лекарства. По данным И. В. Тимофеева (1999), среди лекарственных препаратов, вызывающих иногда анафилактическую реакцию у соматических больных, на первом месте оказываются антибиотики, особенно пенициллин, бициллин, стрептомицин, тетрациклин и т. д. За ними следуют пиразолидиновые препараты (анальгин, амидопирин), местно- анестезирующие средства (новокаин, дикаин, анестезин), а также вакцины и гормоны (питуитрин, маммофизин, преднизолон). Этот перечень следует учитывать и в акушерской практике, так как многие из этих препаратов используются в течение беременности и в послеродовом периоде. К сожалению, не уменьшается число матерей, умерших при переливании крови — гемолизированной, бактериально загрязненной, перегретой и даже иногруппной (5—7 женщин в год). В настоящее время в акушерстве доминирует весьма осторожное отношение к переливанию цельной консервированной крови. В нашей стране определяется групповая ее принадлежность только по системе АВО и резус-фактору, до сих пор не типируется кровь донора и реципиента по системе HLA. Консервированная кровь быстро подвергается биохимическим и морфологическим изменениям: образуются микросгустки, число которых уже к 10—12-му дню хранения достигает опасного уровня — 100 000 в 1 мл. Быстрое введение цитратной крови приводит к накоплению в плазме калия и массивному гемолизу эритроцитов. Более того, 1/4 общей кислородной емкости перелитой донорской крови не утилизируется в организме реципиента. Считается, что единственным поводом к трансфузии цельной консервированной крови служит полное отсутствие у врача других средств лечения. При переливании некачественной крови возникает по-сттрансфузионный шок, обусловленный токсическими свойствами гемолизированных эритроцитов и денатурированных белков плазмы. Бактериальное загрязнение крови может быть результатом ее неправильной заготовки, транспортировки, хранения и неадекватной методики трансфузии: повторные прокалывания иглой через пробку, использование остатков крови и т. д. Как правило, изосерологические свойства крови донора соответствуют таковым реципиента, но после переливания (через 20— 40 мин) возникает клиника инфекционно-токсического шока: у женщины появляются потрясающий озноб, гипертермия, тошнота и коллапс, затем — коматозное состояние из-за отравления токсинами. Патолого-анатомическая картина при переливании загрязненной или гемолизированной крови не отличается от таковой при резус-конфликте (см. далее). Для установления диагноза крайне важным элементом является исследование остатков перелитой крови, которые должны храниться не менее 6 ч после трансфузии. Кроме того, возможен цитратный шок, который наблюдается при быстром струйном введении больших объемов консервированной крови и объясняется прямым токсическим действием цитрата натрия — гемоконсерванта. Достаточно ввести 100—150 мл крови в течение минуты, чтобы возникла опасность цитратной интоксикации и резких изменений соотношения кальция и натрия. Синдром массивных трансфузий (кровь, кровезаменители и другие жидкости) возникает, если в кровяное русло в течение суток вводят более 30—40% от должного ОЦК. Возникают тромбоцитопения, лейкопения и сосудистый коллапс, а в дальнейшем — нарушения гемостаза, гипокалиемия, фибрилляция желудочков сердца, острая почечная или дыхательная недостаточность. Несовместимость перелитой крови по системе АВО и резус-фактору протекает в две фазы. Первая фаза характеризуется признаками шока уже при переливании 25—100 мл крови: внезапные сильные боли в пояснице и животе, повышение температуры, озноб и тахикардия. Во второй фазе быстро прогрессирует почечная недостаточность — олигурия, затем анурия и повышение артериального давления. Присоединяются нарушения гемостаза — ДВС-синдром в результате массивного гемолиза эритроцитов. В финале появляются желтушное окрашивание кожных покровов и токсические признаки шока. На аутопсии превалирует картина анафилактического шока: жидкое состояние крови в крупных сосудах, внутрисосудистый гемолиз, желтое прокрашивание интимы аорты либо проявления острой почечной недостаточности (пример 13). При массивной кровопотере у женщины и нехватке одногруппной крови используют универсальную кровь I (0) группы, которая содержит собственные антитела, вызывающие иногда тяжелую посттрансфузионную реакцию. В этих случаях' особенно важно повторное определение совместимости крови донора и реципиента в ее остатке из флакона и трупной крови женщины, если аутопсия выполнена в пределах суток после смерти. Среди смертельных осложнений переливания крови изредка встречается острый ДВС-синдром после интраоперационной ре-инфузии крови из брюшной полости, обычно после внематочной беременности и отслойки плаценты. Аспирированная кровь содержит фибриновые тромбы, микрочастицы плацентарной ткани, компоненты брюшного секрета, которые являются мощными тромбопластическими субстанциями. Надежная очистка аутоэритроцитов достигается только с помощью специальных, дорогостоящих аппаратов (В. И. Кулаков и соавт., 2000). При простой фильтрации аутокрови через марлю сохраняются ее тромбопластические свойства. Анализ ятрогенной патологии — самый трудный раздел работы патологоанатома и судебно-медицинского эксперта, поскольку им приходится балансировать на "тонкой грани", с одной стороны которой излишне жесткий подход к лечащему врачу, с другой — мнимая коллегиальность, административная зависимость от главного врача. Важно подчеркнуть, что окончательное решение о наличии ятрогенной патологии как первоначальной причины МС определяется на клинико-анатомической конференции. В тех случаях, когда патологоанатом не согласен с решением конференции, он должен записать свое особое мнение. В конце раздела "Акушерские причины" приведены также кардиомиопатия в послеродовом периоде, гепаторенальный синдром и послеродовой тиреоидит, которые не встретились в нашем материале. Завершает его рубрика "Акушерская смерть при неуточненной причине" (О95). Она используется, если на аутопсии причина гибели женщины не определена, а микроскопическое исследование органов по какой-то невозможным, например вследствие органов. объективной причине оказалось выраженного аутолиза внутренних 6. БОЛЕЗНИ МАТЕРИ, ОСЛОЖНЕННЫЕ БЕРЕМЕННОСТЬЮ, РОДАМИ И ПОСЛЕРОДОВЫМ ПЕРИОДОМ Внутри 15-го класса МКБ-10 имеется завершающий раздел, который включает многочисленные экстрагенитальные заболевания, отвечающие второй части определения "материнская смерть" (см. 1.1). Они охватывают все многообразие соматической патологии, которая отягощается физиологическим воздействием беременности. Экстрагенитальные причины МС составляют несколько объединенных рубрик с общими кодами. Рубрики О98—О99 используются для обозначения конкретных нозологических форм, но регистрируются только под общими кодами из 15-го класса МКБ-10. По данным А. Л. Гридчика (2001), в Московской области в 1971 — 1987 гг. экстрагенитальные заболевания составляли 18,0% всех причин МС, в то время как в 1993—1999 гг. они составляли уже 24,4% в качестве основного диагноза и в 8,4% МС конкурировали или сочетались с кровотечениями, гестозами и сепсисом. В структуре экстрагенитальных заболеваний на первое место вышли заболевания сердечно-сосудистой системы (36,4%), на второе — мочевыделительной системы (13,7%), на третье — патология легких (9,9%). Поскольку патологическая анатомия экстрагенитальных заболеваний у беременных женщин существенно не отличается от таковой в других когортах взрослого населения, то ограничимся лишь перечнем наиболее часто встречающихся нозологических форм, но в той последовательности, которая соответствует МКБ-10. Инфекционные и паразитарные заболевания (О98), в частности гепатиты А, В, С и Е с печеночной комой, нередко бывают причинами МС. Другие болезни матери (О99), осложняющие беременность, отягощенные беременностью или являющиеся главной причиной гибели женщины. Анемии (О99.0) встречаются у 15—30% беременных женщин. Как правило, это железодефицитные (гипохромные) анемии. Они не бывают основной причиной МС, но могут фигурировать как фоновое заболевание, утяжеляя кровопотерю при кровотечениях. Болезни крови и кроветворных органов (О99.1), в частности лейкозы, лимфогранулематоз, болезнь Верльгофа, болезнь Вил-лебранда, а также врожденные иммунодефициты, регистрируются в качестве причин МС, что, вероятно, объясняется значительной гестационной нагрузкой на органы кроветворения. Болезни эндокринной системы (О99.2), кроме представленных выше сахарного диабета и послеродового тиреоидита, включают болезнь Аддисона (хроническая недостаточность надпочечников), а также обширную патологию щитовидной железы. Болезни системы кровообращения (О99.4), кроме существовавшей ранее гипертензии, включают митральный стеноз, приобретенные аортальный ревматические пороки сердца, врожденные пороки сердца, стеноз, искусственный водитель ритма. Болезни органов дыхания (О99.5) — в качестве причины МС могут быть бронхиальная астма (астмоидный статус) и острая пневмония, особенно у женщин, страдающих алкоголизмом и наркоманиями, а также смертельные формы туберкулеза. Болезни органов пищеварения (О99.6), в частности аппендицит с перитонитом, острая кишечная непроходимость, могут фигурировать в патолого- анатомическом диагнозе МС. Другие уточненные болезни (О99.8) включают новообразования, болезни мочеполовой и костно-мышечной систем, а также врожденные аномалии. Таким образом, наряду с акушерскими причинами МС регламентирована и разнообразная экстрагенитальная патология матери. Она обозначена в обобщенных рубриках в рамках 15-го класса МКБ-10 и поэтому фиксируется в национальных статистиках, входя в ПМС. В настоящее время отмечается неуклонный рост экстрагенитальных заболеваний в качестве причин гибели беременных женщин. Патологоанатом должен правильно их кодировать, чтобы экстрагенитальные заболевания вошли в общий ПМС города, региона и в целом по России. 7. ПРАВИЛА СОПОСТАВЛЕНИЯ ЗАКЛЮЧИТЕЛЬНОГО КЛИНИЧЕСКОГО И ПАТОЛОГО-АНАТОМИЧЕСКОГО ДИАГНОЗОВ Кроме объективизации и правильного учета МС, важной задачей патологоанатома является контроль качества диагностики и лечения умерших женщин с помощью сопоставления заключительного клинического и патологоанатомического диагнозов (О. В. Зайратьянц и соавт., 2001). После завершения всего комплекса исследований аутопсийного материала (включая бактериологическое, вирусологическое, биохимическое и др.) патологоанатом устанавливает окончательный диагноз с обоснованием основного заболевания, осложнений и сопутствующих заболеваний. Все без исключения случаи МС подлежат обсуждению на клинико-экспертных комиссиях различного уровня (в том числе на комиссии по родовспоможению) и клинико-анатомической конференции с обязательным назначением независимых экспертов (оппонентов). Если данные аутопсии и микроскопии органов не позволяют патологоанатому до или во время обсуждения на клинико-экспертной комиссии определить первоначальную причину смерти, то он направляет необходимые материалы (подробную выписку из истории родов, протокол аутопсии с эпикризом, гистологические препараты и парафиновые блоки) для дополнительной независимой экспертизы в головное учреждение — НИИ морфологии человека РАМН. Экспертиза осуществляется на хозрасчетных условиях. Уточненное заключение выносится на обсуждение клиникоэкспертной комиссии и клинико-анатомической конференции. Кроме того, патологоанатом может поставить перед оппонентами конкретные вопросы по тактике ведения беременной и оказания медицинской помощи на всех этапах лечения. Так, например, для подтверждения диагноза воздушной эмболии или эмболии околоплодными водами важно знать, существовали ли патофизиологические предпосылки или условия для возникновения эмболии в конкретной клинической ситуации. клинического и При патолого-анатомического расхождении заключительного диагнозов патологоанатом представляет на клинико-экспертную комиссию обоснованные категорию и причины их расхождения. Понятия "совпадение" и "расхождение" диагнозов применяется только при сопоставлении основного заболевания, поэтому так важна рубрикация заключительного клинического диагноза на основное заболевание, осложнения основного заболевания и сопутствующие заболевания. Расхождением диагнозов считается несовпадение основного заболевания (любой из нозологических единиц, входящих в комбинированное основное заболевание) по нозологии, этиологии или локализации патологического процесса. Для оценки расхождения диагнозов используют три категории и выявляют их причины (одну из объективных или субъективных). 1-я категория расхождения — в данном лечебном учреждении установление правильного диагноза было невозможно и диагностическая ошибка (нередко допущенная ранее в другом лечебно-профилактическом учреждении) не повлияла на исход родов в этом лечебном учреждении. Причины этой категории расхождения всегда объективны и включают: — краткость пребывания женщины в стационаре (решается в зависимости от конкретного заболевания); для острых ситуаций, требующих экстренной, интенсивной терапии, в том числе ургентной хирургии (кесарево сечение, гистерэктомия), этот срок индивидуален (минуты, часы). Для большинства заболеваний, в том числе и акушерских, нормативный срок диагностики составляет 3 сут; — трудность имеющиеся в диагностики основного заболевания лечебно-профилактическом (использованы учреждении все диагностические методы, но атипичность, стертость клиники, редкость данной патологии и другие причины не позволили установить правильный диагноз); — тяжесть состояния женщины (обследование пациентки было невозможно в полном объеме из-за риска ухудшения состояния). 2-я категория расхождения — установление правильного диагноза в данном лечебном учреждении было возможно, однако диагностическая ошибка не повлияла на летальный исход. Причины расхождения диагнозов по 2-й категории могут быть объективными (см. выше) или субъективными (см. ниже). Важно подчеркнуть, что нерубрифицированный заключительный клинический диагноз должен расцениваться как расхождение диагнозов по 2-й категории. Субъективные причины расхождения диагнозов: — недостаточное обследование; — недоучет или переоценка анамнеза; — недоучет или переоценка клинических данных; — недоучет или переоценка дополнительных методов исследования (лабораторных, рентгенологических, УЗИ и др.); — недоучет или переоценка заключения консультанта; — неверная формулировка заключительного клинического диагноза. 3-я категория расхождения — установление правильного основного диагноза в данном лечебном учреждении было возможно и допущенная диагностическая ошибка повлекла за собой неправильную врачебную тактику (недостаточное либо несвоевременное терапевтическое или хирургическое лечение), что сыграло Итогом решающую разбора анатомической МС роль на в смертельном клинико-экспертной конференции является исходе комиссии коллегиальное заболевания. или клинико- заключение об окончательном диагнозе, категории и причинах расхождения диагнозов (если таковое имеется). Заключение конференции фиксируется в протоколе аутопсии. Если формулировка патолого-анатомического диагноза была изменена, то патологоанатом должен срочно внести его в протокол вскрытия и в новое, повторное свидетельство о смерти матери с пометкой "взамен предварительного", которое пересылается органам ЗАГС или медицинской статистики для изменения причины смерти женщины. 8. ЗАКЛЮЧЕНИЕ Прошло 14 лет с тех пор, как в бывшем СССР (1989) стали определять ПМС по правилам ВОЗ. Ранее он рассчитывался со срока беременности 28 нед на 10 000 родов, поэтому примерно 45—50% МС, в частности от осложнений медицинских и криминальных абортов, не учитывались в официальной статистике. Анализ ПМС по международным правилам показал, что по уровню МС Россия занимает промежуточное место между про-мышленно развитыми и развивающимися странами, отставая в 4 раза от Швеции, Канады, Норвегии и в 2 раза от Японии, Германии, Англии и США. Для реального снижения уровня МС в России нужны совместные усилия всех заинтересованных реаниматологов, сторон (акушеров-гинекологов, организаторов здравоохранения) при анестезиологовусловии общего улучшения экономической ситуации и дальнейшего развития отечественной медицины. Свой посильный вклад в решение данной проблемы должна внести и патолого-анатомическая служба, поскольку на нее сейчас возложены важные функции нозологического анализа МС в соответствии с требованиями МКБ-10. Высококвалифицированная патолого-анатомическая диагностика первоначальных причин МС возможна при соблюдении трех условий. Во-первых, патологоанатом, специально занимающийся анализом МС, должен быть ориентирован в смежных разделах акушерства, представлять рациональную тактику при различных клинических ситуациях, уметь учитывать объем кровопотери и трансфузионной терапии, оценивать наркозные карты, чтобы на одном профессиональном языке обсуждать спорные вопросы с клиницистами. Во-вторых, для патологоанатома необходимо знание гестационной перестройки основных органов и систем женщины, поскольку многие патологические реакции являются прямым продолжением так называемой нормы беременности. В-третьих, патологоанатом должен использовать системный подход, привлекая к данным аутопсии и микроскопии органов умершей женщины дополнительную информацию в рамках всей репродуктивной системы мать— плацентарное ложе матки—плацента—плод. Мы надеемся, что настоящее приложение для враче и-патологоанатомов позволит им лучше ориентироваться в трудном разделе патологической анатомии — акушерской патологии. 9. ПРИЛОЖЕНИЕ Пример 1 Основное заболевание (Осн): эклампсия, судорожная форма в начальном периоде родов при беременности 39 нед. Операция 1 — лапаротомия, кесарево сечение (дата). Осложнения (Осл): отек головного мозга, респираторный дистресс-синдром, ДВС-синдром с преимущественным поражением матки, легких и почек. Маточное кровотечение (кровопотеря 500 мл). Операция 2 — экстирпация матки (дата). Патология плода: синдром задержки внутриутробного развития плода, масса 2540 г. Реанимация: ИВЛ после второй операции в течение 2 дней, гемотрансфузии, непрямой массаж сердца, смерть (дата). Сопутствующие заболевания (Соп): анемия беременных I степени. Послеродовой период — 3 дня. Пример 2 Осн: разрыв правой маточной трубы вследствие эктопической беременности 6 нед — инвазия цитотрофобласта с аррозией крупной артерии, якорные ворсины, части эмбриона и плодных оболочек в правой маточной трубе. Операция — лапаротомия, резекция правой маточной трубы (дата). Осл: геморрагический шок. Внутрибрюшное кровоизлияние (кровопотеря 1800 мл), шоковые почки, респираторный дистресс-синдром. ДВС-синдром — продолжающееся кровотечение из операционной раны, свежие фибриновые тромбы в мелких сосудах легких, печени, головного мозга, селезенки. Острое общее малокровие. Инфузионная терапия: интра- и послеоперационное переливание 750 мл желатиноля и полиглюкина. Свидетельство о смерти 1: а) геморрагический шок; б) внутрибрюшное кровотечение; в) разрыв правой маточной трубы вследствие эктопической беременности (О00.1). 2. Операция — правосторонняя тубэктомия (дата). Послеродовой (послеоперационный) период — 2 сут. Пример 3 Осн: криминальный неполный медицинский аборт на 18-й неделе беременности, осложнившийся септицемией, — в посеве крови — золотистый стафилококк, некротизированные плацента и оболочки в полости матки. Операция 1 — удаление плацентарной ткани и выскабливание полости матки (дата). Операция 2 — экстирпация матки с трубами (дата). Осл: инфекционно-токсический шок. ДВС-синдром. Гиперплазия селезенки. Шоковые почки. Выраженная дистрофия паренхиматозных органов. Реанимация: ИВЛ — 2 сут, гемотрансфузии. Свидетельство о смерти 1: а) инфекционно-токсический шок; б) септицемия; в) криминальный неполный аборт на 18-й неделе беременности, осложнившийся септицемией (О05.0). 2. Операции — удаление остатков плацентарной ткани и выскабливание полости матки (дата), экстирпация матки с трубами (дата). Послеабортный (послеродовой) период — 5 сут. Пример 4 Осн: неудачный медицинский аборт при беременности 10 нед, осложнившийся кровотечением, — задержка фрагментов плаценты в матке. Операция — экстирпация матки без придатков (дата). Осл: геморрагический шок. Профузное маточное кровотечение (2500 мл). Шоковые почки. Респираторный дистресс-синдром. Афибриногенемия. Острое общее малокровие. Реанимация: ИВЛ в течение 2 сут, массивные трансфузии. Свидетельство о смерти 1: а) геморрагический шок; б) маточное кровотечение; в) неудачный медицинский аборт, осложнившийся кровотечением (О07.1). 2. Срок беременности 10 нед. Операция — экстирпация матки без придатков (дата). Послеабортный (послеродовой) период — 7 сут. Пример 5 Осн: эклампсия, судорожная форма, в послеродовом периоде (3-й сутки после первых срочных родов) — множественные некрозы паренхимы печени, кортикальные некрозы почек, пластинчатое субарахноидальное кровоизлияние на базальной и боковой поверхности правого полушария головного мозга. Осл: отек головного мозга с дислокацией его ствола. Двусторонняя мелкоочаговая пневмония VII—X сегментов легких. Соп: двусторонний хронический пиелонефрит в стадии ремиссии. Свидетельство о смерти 1: а) дислокация ствола головного мозга; б) субарахноидальное кровоизлияние; в) эклампсия в послеродовом периоде (015.2). 2. Самопроизвольные своевременные роды, послеродовой период — 3 сут. Пример 6 Осн: преждевременная отслойка нормально расположенной плаценты при беременности 33—34 нед — ретроплацентарная гематома, первые преждевременные оперативные роды мертвым плодом в тазовом предлежании. Операция — кесарево сечение (дата), ручное обследование стенки послеродовой матки. Осл: геморрагический шок, профузное маточное кровотечение (кровопотеря 3000 мл). ДВС-синдром. Шоковые почки, шоковые легкие. Острое общее малокровие. Отек головного мозга. Реанимация: ИВЛ — 3 сут, гемотрансфузии. Свидетельство о смерти 1: а) геморрагический шок; б) профузное маточное кровотечение; в) преждевременная отслойка низко расположенной плаценты (О45.0). 2. Оперативное родоразрешение путем кесарева сечения в срок 33—34 нед. Послеродовой период — 3 сут. Пример 7 Осн: массивное атоническое маточное кровотечение (кровопотеря 2700 мл) при самопроизвольных родах на 38-й неделе беременности в раннем послеродовом периоде — выраженный отек, расслаивающие кровоизлияния миометрия, зияние маточно-плацентарных артерий. Операция — экстирпация матки (дата). Фоновое: первичная слабость родовой деятельности, затяжные роды. Осл: геморрагический шок. ДВС-синдром — массивная гематома в клетчатке малого таза. Шоковые почки, респираторный дистресс-синдром. Острое общее малокровие. Свидетельство о смерти 1: а) геморрагический шок; б) ДВС-синдром; в) атоническое маточное кровотечение в раннем послеродовом периоде (О72.1). 2. Первичная слабость родовой деятельности. Самопроизвольные роды при сроке беременности 38 нед. Операция — экстирпация матки без придатков (дата). Послеродовой период — 8 ч. Пример 8 Осн: полный самопроизвольный разрыв тела матки по левому ребру при беременности 38 нед, пятые самостоятельные стремительные роды. Фоновое: преэклампсия средней тяжести. Осл: геморрагический шок. Профузное кровотечение из артерий в месте разрыва стенки матки и левой маточной артерии (общая кровопотеря около 4000 мл), гематома в параметральной клетчатке (около 450 мл). Жидкое состояние крови в полостях сердца и магистральных артериях, множественные петехиальные кровоизлияния в слизистых оболочках. Отек легких и головного мозга. Операция — экстирпации матки с придатками (дата). Интранатальная гибель плода. Реанимация: ИВЛ, массивные гемотрансфузии. Свидетельство о смерти 1: а) геморрагический шок; б) маточное кровотечение; в) полный разрыв тела матки (О71.1). 2. Преэклампсия средней тяжести. Самопроизвольные стремительные роды на 38-й неделе беременности, послеродовой период — 4 сут. Пример 9 Осн: массивный кислотно-аспирационный пневмонит (синдром Мендельсона) во время вводного наркоза с целью оперативного ро-доразрешения (кесарева сечения) при беременности 38 нед — тотальный некроз эпителия трахеи и главных бронхов. Операция — кесарево сечение (дата). Осл: выраженный отек легких. Распространенные обтураци-онные ателектазы, очаги острой эмфиземы. ДВС-синдром. Диа-педезные кровоизлияния в серозные и слизистые оболочки. Реанимация: ИВЛ — 3 дня. Свидетельство о смерти 1: а) отек легких; б) обтурационные ателектазы; в) кислотно-аспирационный пневмонит (синдром Мендельсона) во время вводного наркоза (О29.0). 2. Оперативное родоразрешение путем кесарева сечения в срок беременности 38 нед. Послеродовой период — 3 сут. Пример 10 Осн: неудачная интубация — стояние трубки в пищеводе при наркозе перед оперативным родоразрешением (кесарево сечение) при сроке беременности 39 нед — линейные надрывы пищевода, острое вздутие желудка. Операция — кесарево сечение (дата) по поводу клинически узкого таза. Осл: постгипоксическая энцефалопатия — очаги некроза в коре и подкорковых ядрах больших полушарий головного мозга. Отек легких, обширные ателектазы, петехиальные кровоизлияния в перикарде и слизистых оболочках. Реанимация: ИВЛ — 2 сут. Патология плода: интранатальная гибель плода. Свидетельство о смерти 1: а) постгипоксическая энцефалопатия; б) неудачная интубация — стояние трубки в пищеводе (О74.7). 2. Оперативное родоразрешение путем кесарева сечения при сроке беременности 39 нед. Послеродовой период — 2 сут. Пример 11 Осн: послеродовой сепсис (септицемия) при беременности 38 нед —Pseudomonas aeruginoza при бактериологическом исследовании, острый гнойный эндомиометрит, гиперплазия пульпы селезенки, интерстициальные нефрит, гепатит, миокардит. Осл: инфекционно-токсический шок. ДВС-синдром — состоявшееся желудочное кровотечение, множественные субплевральные кровоизлияния, множественные петехиальные подкожные кровоизлияния. Отек легких и головного мозга. Реанимация: ИВЛ. Свидетельство о смерти 1: а) инфекционно-токсический шок; б) послеродовой сепсис (О85). 2. Самопроизвольные роды при сроке беременности 38 нед. Послеродовой период — 11 сут. Пример 12 Осн: акушерская эмболия околоплодными водами в родах при сроке беременности 34 нед — меконий, капли жира и чешуйки эпителия в капиллярах и артериолах легких. Операция — кесарево сечение (дата). Фоновое: преэклампсия средней тяжести. Осл: выраженный отек легких. ДВС-синдром — множественные мелкоочаговые кровоизлияния в слизистых и серозных оболочках. Фибриновые тромбы в просвете капилляров легких, почек, сердца. Острое общее венозное полнокровие. Жидкое состояние крови в полостях сердца и в магистральных артериях. Отек головного мозга. Свидетельство о смерти 1: а) отек легких; б) ДВС-синдром; в) акушерская эмболия околоплодными водами (О88.1). 2. Преэклампсия средней степени тяжести. Оперативное родоразрешение путем кесарева сечения при сроке беременности 34 нед (дата). Послеродовой период — 7ч. Пример 13 Осн: несовместимость перелитой иногруппной крови на 2-е сутки после самопроизвольных родов на 39-й неделе беременности. Фоновое: анемия беременных II степени. Осл: посттрансфузионный токсический шок, анурия. Острая почечная недостаточность. Жировой гепатоз. Свидетельство о смерти 1: а) посттрансфузионный токсический шок; б) острая почечная недостаточность; в) несовместимость перелитой иногруппной крови (О75.4). 2. Анемия беременных II степени. Самопроизвольные своевременные роды. Послеродовой период — 36 ч. 10. ЛИТЕРАТУРА 1. Гридчик А. Л. /I Тезисы докл. III Российского Форума "Мать и дитя". - М., 2001. - С. 42-43. 2. Зайратьянц О. В., Кактурский Л. В., Автандилов Г. Г. Правила построения патолого-анатомического диагноза, оформления медицинского свидетельства о смерти, сопоставления клинического и патолого-анатомического диагнозов в соответствии с требованиями МКБ-10: Метод, рекомендации. — М., 2001. 3. Зербино Д. Д., Лукасевич Л. Л. Диссеминированное внутри-сосудистое свертывание крови. — М., 1989. 4. Зильбер А. П., Шифман Е. М. Акушерство глазами анестезиолога. — Петрозаводск, 1997. 5. Каныиина Н. Ф., Симонова Т. Ф. // Арх. пат. — 1989. — Вып. 7. - С. 78-80. 6. Коваленко В. Л., Лесных А. Ю., Каточкова И. М. // Там же. - 2000. - Вып. 3. С. 46-48. 7. Кулаков В. И., Серов В. Н. и др. Анестезия и реанимация в акушерстве и гинекологии. — М., 2000. 8. Леденева О. А. // Арх. маг. - 1980. — Вып. 1. - С. 33-38. 9. Материнская смертность в Российской Федерации за 1995 год (информационное письмо). — М., 1997. 10. Материнская смертность в Российской Федерации за 1997 год (информационное письмо). — М., 1998. 11. Международная статистическая классификация болезней и проблем, связанных со здоровьем. — 10-й пересмотр. — Женева, 1995. -Т. 1. - Ч. 2. 12. Милованов А. П., Зайратьянц О. В., Добряков А. В. // Арх. пат. - 1999. Вып. 4. - С. 26-30. 13. Милованов А. П. Патология системы мать—плацента—плод. - М., 1999. 14. Милованов А. П., Кирющенков П. А. и др. // Акуш. и гин. — 2001. - № 3. С. 3-6. 15. Некачалов В. В. Ятрогения (патология диагностики и лечения). - СПб, 1998. 16. Пермяков Н. К. Общая гнойная инфекция после аборта: Ав-тореф. дис.... дра мед. наук. — М., 1959. 17. Пермяков Н. К. Основы реанимационной патологии 18. Принципы построения заключительного клинического и па-тологоанатомического диагнозов при материнской смерти: Метод, указания / Милованов А. П., Фокин Е. И., Зайрать-янц О. В. и др. — М., 2001. 19. Протопопова Н. В. Роль изменений метаболизма и гемодинамики в патогенезе осложнений беременности при артериальной гипертензии: Автореф. дис.... д-ра мед. наук. — Иркутск, 1999. 20. Серов В. Н., Стрижаков А. Н., Маркин С. А. Руководство по практическому акушерству. — М., 1997. 21. Служба охраны здоровья матери и ребенка в 1999 году. — М., 2000. 22. Тимофеев И. В. Патология лечения. — СПб, 1999. 23. Титова Г. П., Тихомирова Н. И. // Арх. пат. — 1995. — Вып. 2. - С. 46-52. 24. Cormack J. R. // London. Med. J. - 1850. - Vol. 2. - P. 928-939. 25. Mendelson C. L. // Am. J. Obstet. Gynecol. - 1946. - Vol. 52. - P. 191-205. 26. Sheehan H. L., Lunch J. B. Pathology of Toxemia of Pregnancy. — Baltimore, 1973. ll.Steiner P. E., Lushbaugh C. C. // J. A. M. A. - 1941. -Vol. 117. - P. 1245-1260.
![проблема абортов в современном мире... [37 кб]](http://s1.studylib.ru/store/data/000747972_1-07ed5115045a19e355bb74389540437e-300x300.png)