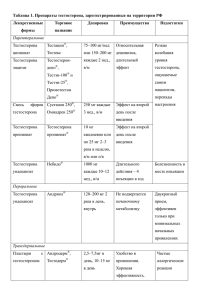
dissertation Kassim MA - Астраханский государственный
advertisement

Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Саратовский государственный университет имени Н.Г. Чернышевского» На правах рукописи МОХАНАД АБДУЛИЛАХ КАССИМ СОСУДИСТЫЕ ЭФФЕКТЫ АНДРОГЕНОВ И ИХ РОЛЬ В МЕХАНИЗМАХ СТРЕССА И АДАПТАЦИИ 03.03.01 – физиология Диссертация на соискание ученой степени кандидата биологических наук Научный руководитель: доктор биологических наук, доцент Семячкина-Глушковская Оксана Валерьевна Саратов 2015 СОДЕРЖАНИЕ стр. Перечень сокращений 4 Введение 5 Глава I Обзор литературы 14 1.1 Половые особенности кардиоваскулярной стресс-реактивности 14 1.2 Роль и 19 1.3 Механизмы сосудистых эффектов андрогенов и их вклад в 24 андрогенов в регуляции сосудистого тонуса кардиоваскулярной стресс-реактивности развитие артериальной гипертензии Глава II Материалы и методы исследований 35 Глава III Результаты исследований 40 3.1 Влияние различных видов стресса на секрецию тестостерона и 40 уровень артериального давления у крыс 3.2 Изменение экспрессии андрогенных рецепторов в мозге и 55 висцеральных органах на фоне снижения секреции тестостерона в условиях стресс-индуцированного повышения артериального давления 3.3 Сравнение устойчивости к запредельному стрессу на фоне естественного и патологически 65 низкого содержания андрогенов в отношении 69 регуляции 69 тестостерона в крови у крыс 3.4. Ограничивающие эффекты сосудистой стресс-реактивности и их механизмы 3.4. 1 Изучение холинергических механизмов сосудистой стресс-реактивности в условиях мужских половых гормонов рецепторов 2 и дефицита блокады андрогенных 3.4.2. Влияние дефицита андрогенов на адренергическую 80 гормональную активацию в условиях стресса на фоне нормального и патологически высокого уровня артериального давления 3.4.3 Влияние кастрации на активацию сигнальных молекул стресса (бета-аррестина-1) при различных 83 состояниях организма 3.5. Оценка эффективности фармакологической коррекции 86 низкого уровня тестостерона в отношении устойчивости к развитию стресс-индуцированного инфаркта мозга у гипертензивных крыс Глава IV Обсуждение результатов исследования 90 Выводы 101 Список литературы 103 3 ПЕРЕЧЕНЬ СОКРАЩЕНИЙ АГ – артериальная гипертензия АД – артериальное давление КА - катехоламины ССС – сердечно-сосудистая система ср.АД – среднее артериальное давление ЧСС – частота сердечных сокращений 4 ВВЕДЕНИЕ Тесная взаимосвязь между уровнем половых гормонов и стрессом показана во многих исследованиях (King, 2005; Шерстюк, 2007; Oskui, 2013; Semyachkina-Glushkovskaya, 2014). Известно также, что половые гормоны оказывают мощное управляющее и модулирующее влияние на стрессреактивность и стресс-устойчивость организма (Анищенко, 1993, Игошева, 2009, Семячкина-Глушковская, 2010, Семенова, 2005). При этом женским половым гормонам отводят защитную роль в отношении развития стресс-индуцированных сосудистых заболеваний, в то время как мужские половые гормоны остаются вне поля зрения ученых (Мамбетова, 2000; Dubey, 2001; Deschams, 2010). Кардиопроекторные эффекты андрогенов были впервые показаны в 1977 г. профессором Jaffe (1977), который первым предложил лечить миокардиальную ишемию у мужчин с помощью тестостерона. Впоследствии применение тестостерона в кардиологической практике стало одним из направлений в терапии различных коронарных нарушений. Антиишемические эффекты андрогенов в миокарде были выявлены в исследованиях как с хроническим применением их синтетических аналогов pes оs в больших дозах (Wu, 1993) и подкожно (English, 2000б), так и при экстренной помощи с использованием внутривенных и внутрикоронарных инъекций (Webb, 1999а, 1999б). В экспериментах на приматах и кроликах, получающих в течение длительного времени дегидроэпиандростерон, была выявлена защитная роль андрогенов в устойчивости к развитию атеросклероза (Gordon, 1988; Eich, 1993; Christopher-Hennings, 1995). Предполагается, что в основе кардиопротективных эффектов андрогенов лежат их вазорелаксирующие эффекты, обнаруженные в многочисленных опытах in vitro на коронарных артериях, взятых у разных видов животных (Yue, 1995; Crews, 1999; Murphy, 1999; English, 2000в; Deenadayalu, 2001). Кроме коронарных артерий, релаксирующие воздействия 5 тестостерона были выявлены и на других типах артерий, включая грудную аорту (Yue, 1995; Honda, 1999; Perusquia, 1999; Ding, 2001), брыжеечные (Tep-Areenan, 2002), легочные (English, 2001) артерии. Выдвигается предположение, что патологические сдвиги в андрогензависимых механизмах регуляции сосудистого тонуса могут лежать в развитии артериальной гипертензии (АГ) и обеспечивать половые различия в данном заболевании (Sullivan, 1998; Honda, 1999; Dubey, 2002; Khalil, 2005). Так, в опытах с кастрацией показаны про-гипертензивные эффекты андрогенов (Iams, 1977; Masubuchi, 1982; Cambotti, 1984; Malyusz, 1985; Share, 1988; Ganten, 1989; Chen, 1991; Rowland, 1992; Crofton, 1993; Reckelhoff, 2000). С другой стороны, существуют работы, в которых выявлена гипотестостеронемия у гипертензивных объектов (Khaw, 1988; Hughes, 1989; Jaffe, 1996; Fogari, 2002; Ishikura, 2008). На фоне стресса показаны неоднозначные реакций со стороны андрогенов в мужском и женском организме. Так, в исследованиях выявлено, что уровень тестостерона клинических снижается ежедневном воздействии психологического стресса, причем при наиболее выраженно это происходит у мужчин по сравнению с женщинами среднего возраста (King, 2005). В этих условия уровни кортизола, как основного гормона стресса, изменяются менее выраженно по сравнению с тестостероном (Francis, 1981). В экспериментах на крысах также показано, что хронический стресс сопровождается подавлением секреции мужских половых гормонов, что влечет за собой снижение активности различных форм нитроксидсинтазы, ксантиноксидазы и NADPH-диафоразы (Шерстюк, 2007). Однако, не только в условиях хронического стресса, но и экстремальные кратковременные стрессы, такие как острые эмоции, которые испытывают молодые мужчины при прыжках с парашютом или с дельтапланом, также сказываются на функции половых желез в виде снижения их секреторной деятельности (Chatterton, 1997). 6 Таким образом, научные сведения о продукции андрогенов и их регулирующих влияниях на сосуды нуждаются в более детальных исследованиях и структурированности для формирования более четкого видения роли мужских половых гормонов в процессах стресса и адаптации. Вышеизложенное определило цель и задачи настоящих исследований. Целью исследования явилось изучение роли андрогенов в механизмах регуляции сосудистой стресс-реактивности и стресс-устойчивости, а также изучение системных и молекулярных механизмов, лежащих в основе этих процессов. Задачи исследования: 1. Изучить влияние стресса на процесс образования тестостерона и установить взаимосвязь между секрецией гормона и стрессиндуцированными изменениями в уровне АД при использовании моделей легких физиологических, хронических и запредельных стрессов; 2. Исследовать стресс-индуцированные изменения в экспрессии андрогенных рецепторов в мозге и висцеральных органах на фоне хронически высокого АД и развития в этих условиях гипотестостеронемии с применением метода иммунофлуоресценции и модели АГ у крыс длительно проживающих в условиях социального стресса; 3. Выявить взаимосвязь между низким содержанием тестостерона в крови и устойчивостью к развитию стресс-индуцированных сосудистых «катастроф» в мозге с использованием естественной и патологической моделей гипотестостеронемии новорожденных и взрослых гипертензивных крыс, соответственно. 7 у 4. Исследовать андроген-зависимые механизмы регуляции сосудистой стресс-реактивности у крыс с применением методов гонадэктомии и блокады андрогенных рецепторов на фоне фармакологической модуляции холинергических влияний атропином; 5. Установить эффекты андрогенов в отношении регуляции интенсивности адреналового ответа при стрессе на гормональном и молекулярном уровнях, изучая эффекты дефицита мужских половых гормонов на секрецию адреналина и бета-аррестина-1 в крови; 6. Оценить эффективность фармакологической коррекции низкого содержания тестостерона путем введения сустанона в отношении устойчивости к стресс-индуцированому развитию инфаркта мозга у гипертензивных крыс. Научная новизна Впервые было изучено влияние различных видов стресса на продукцию тестостерона у самок и самцов крыс. Новыми являются уточняющие данные о том, что стрессы – хронические (для мужского организма) и запредельные (для мужского и женского организма) являются важными факторами в подавлении секреции тестостерона. Впервые с применением оригинальных моделей естественного и патологически низкого уровня андрогенов у установлено, что низкий уровень тестостерона не является крыс прямым показателем снижения сосудистой стресс-устойчивости, однако, подавление секреции гормона в динамике сопряжено с критическим состоянием механизмов адаптации к стрессу и нарушением сосудистого гомеостаза. В экспериментах на моделях легкого эмоционального, хронического и запредельного стрессов впервые было выявлено, что индуцированные стрессом изменения в уровне АД и содержании тестостерона в крови не сопряжены напрямую друг с другом. Впервые на модели стресс- индуцированной АГ установлено, что гипотестостеронемия в этих условиях 8 сопряжена со снижением экспрессии ядерных андрогенных рецепторов в семенниках и церебральных сосудах, что свидетельствует о подавлении регуляторных возможностей андрогенов в отношении процессов синтеза мужских половых гормонов, а также ассоциируется с низкой устойчивостью к развитию геморрагического инфаркта мозга. Оригинальными являются данные о том, что сосудистые эффекты андрогенов заключаются в ограничении интенсивности сосудистой стресс-реактивности опосредовано через холинергические влияния, а также подавления адреналового представительства на сосудах как со стороны гормонального звена (адреналин), так и сигнальных систем стресса (бета-аррестин-1). Впервые выявлено, что фармакологическое замещение низкого уровня тестостерона в крови путем введения сустанона на фоне хронически высокого уровня АД не улучшает течение гипертензии и не повышает устойчивость к стрессиндуцированному повреждению церебральных сосудов, сопровождающих развитие интракраниальных геморрагий. Показано, что эффекты андрогенов в отношении сосудистой лимитирующие стресс-реактивности проявляются как второстепенные запасные механизмы на фоне прямых процессов поддержания сосудистого гомеостаза. Научно-практическая значимость Полученные результаты существенно расширяют научные представления о роли андрогенов в сосудистой стресс-устойчивости и в механизмах адаптации к стрессу. На большом экспериментальном материале было показано, что сосудистые эффекты андрогенов определяются исходным состоянием организма, проявляясь преимущественно в критические периоды стресса. Важным результатом явился тот факт, что изменения в секреции мужских половых гормонов не зависят напрямую от уровня АД, а строго определяются стрессогенным фоном. При этом, развитие АГ является фактором, провоцирующим подавление секреции андрогенов у 9 мужских особей, но не у женских. Эти данные имеют важное значение для уточнения алгоритмов назначения гормон-заместительной терапии гипертензивным пациентам. Яркими результатами явились данные по резкому снижению тестостерона в крови вне зависимости от пола на фоне запредельных стрессов при развитии геморрагического инфаркта мозга и язвенного кровотечения. При этом, предварительные исследования по возможности устойчивости церебральных сосудов при помощи коррекции стресс- фармакологического восстановления уровня андрогенов в крови не дали положительных результатов. Однако, было обнаружено, что андрогены выполняют функции «запасного аэродрома» при снижении адаптивных возможностей организма за счет проявления лимитирующих эффектов в отношении стресс-реактивности адренергической системы (адреналин) и активации сигнальных молекул стресса (бета-аррестин-1). Эти результаты могут быть «золотым ключиком» в открытии новых терапевтических подходов в восстановлении секреции мужских половых гормонов за счет модуляции экспрессии бета-аррестина-1. В условиях стресса, как было нами показано, введение с у с т а н о н а – синтетического анлога тестотстерона, «не видеться» организмом, несмотря на визуальное повышение содержания гормона в крови. Это означает, что в критических ситуациях на фоне запредельного стресса андрогены теряют доступ к механизмам регуляции сосудистой стресс-реактивности, возможно, за счет подавляющего воздействия бета-аррестина-1. В открытиях последних лет показано, выраженные что модуляция активности бета-аррестина-1 оказывает терапевтические эффекты при стресс-индуцированных мутагенных изменениях в тканях, включая семенники. На основе этих данных, тестирование выдвинутой гипотезы о возможной коррекции секреции андрогенов с помощью блокады бета-аррестина-1 и повышения сосудистой стресс-устойчивости в клинических и экспериментальных исследованиях может явится одним из основных векторов новых научных работ в этом направлении. 10 Выявлено, что андрогены оказывают лимитирующие влияния прессорные эффекты стресса опосредованно через на холинергические механизмы и ограничения адреналового доступа на сосуды. Эти факты являются важной теоретической основой для развития нового фармакологического направления в лечении сосудистых патологий с помощью гормон-заместительной терапии. Интересным фактом, требующим детальных и дальнейших исследований, явилась «модель» низкого содержания андрогенов в крови у новорожденных крыс, но более высокой их устойчивости к запредельным стрессам по сравнению со взрослыми гипертензивными животными. Использование данной модели в сравнении с половозрелыми особями позволит понять какие механизмы выходят из строя в условиях тяжелых стрессов, требующих подключения «запасного аэродрома» в виде андрогенов. Положения, выносимые на защиту 1. Уровень тестостерона определяется силой и продолжительностью стресса. Снижение секреции гормона в динамике отражает критическое состояние адаптивных и резервных возможностей организма. 2. Сосудистые эффекты андрогенов выполняют функцию «запасного аэродрома» в адаптивных механизмах организма, проявляясь в виде второстепенных процессов «обороны» или сдерживания интенсивности сосудистой стресс-реактивности за счет модулирования холинергических влияний, а также лимитирования адреналового представительства на сосудах со стороны гормонов (адреналин) и сигнальных систем стресса (бета-аррестин-1). 3. Фармакологическое замещение низкого уровня тестостерона на фоне хронически высокого артериального давления не повышает устойчивость к стресс-индуцированным «сосудистым катастрофам». 11 Апробация работы Результаты исследования были представлены на международной конференции по фотонике (Саратов, Россия, 25-26 сентября 2013 г. и 23-26 сентября 2014 г.); на международном конгрессе «Наука будущего» (Санкт-Петербург, Россия, 17-20 сентября 2014 г.); на 6-й международной конференции по фотонике и оптической электронике (Вухан, Китай, 21-23 мая 2013 г.); на международной конференция по нелинейной динамике детерминированных и стохастических систем (Саратов, Волжские Дали, Россия, 19-23 мая 2014 г.). Материалы диссертации докладывались и обсуждались на открытом заседании кафедры физиологии человека животных федерального образовательного учреждения и высшего профессионального образования “Саратовский государственный университет имени Н.Г. Чернышевского”. Объем и структура работы Диссертация состоит из введения, обзора литературы, описания материалов и методов исследования, результатов собственных исследований, обсуждения результатов исследований и выводов. Общий объем диссертации 124 страницы с 26 рисунками и 9 таблицами. Список цитированной литературы включает 192 источников, в том числе 24 отечественных и 168 иностранных. Публикации По материалам диссертации опубликовано 14 научных работ, в том числе рекомендованных ВАК РФ - 7, 1 патент РФ на изобретение. 12 Декларация личного участия автора Экспериментальные исследования выполнялись автором лично, либо при его непосредственном участии в коллективных работах, выполненных по гранту президента РФ для молодых докторов наук МД-2216.2014.4, 2014-2015 гг.; гранту РНФ Соглашение № 14-15-00128, 2014-2016 гг.; грант РФФИ a-11-02-00560, 2011-2013 гг.; гранту ФЦП, государственный контракт NK-1063P, соглашение 14.B37.21.0216, 2012-2013 гг.; гранту Минобрнауки РФ, конкурсная часть задания 3.1340.2014/К, гранту Правительства РФ для государственной поддержки научных исследований, проводимых под руководством ведущих учёных в российских образовательных учреждениях высшего профессионального образования (договор №14.Z50.31.0004 от 4 марта 2014 г.). В совместных публикациях вклад автора составил 50-70%. 13 1. 1.1 ОБЗОР ЛИТЕРАТУРЫ Половые особенности кардиоваскулярной стресс-реактивности Женский организм имеет более выраженную устойчивость к разным неблагоприятным условиям, чем мужской , это проявляется в более высокой продолжительности жизни (Комфорт, 1967). Половые различия в стрессреактивности и стресс-устойчивости сердечно-сосудистой системы (ССС), является важнейшей биологической проблемой, которая была еще сформулирована Ч. Дарвином. Однако, научной исследований в этой области крайне мало. Пик популярности среди ученых по изучению данной проблематики пришелся на 90 е годы прошлого столетия. Современные исследования в основном сконцентрированы на половых особенностях в молекулярных, и генетических аспектах, что не дает целостного представления о процессах, лежащих в основе данного феномена. (Ingalhalikar, 2014; Willis, 2014). Повышенная стойчивость женского организма по сравнению с мужским к неблагоприятным факторам проявляется уже в эмбриональном периоде и сразу после рождения. По данным Бедного М.С. (1979), смертность среди мальчиков выше,чем среди девочек на 12% в период зародышевого развития и на 30% в первые сутки после рождения. В критические периоды онтогенеза сердечно-сосудистой деятельности (6 лет и 12-14 лет) у мальчиков наблюдается более резкое, чем у девочек, ухудшение функциональных и адаптивных возможностей сердечной деятельности (Гринене,1990). Интересно отметить, что аналогичная тенденция наблюдается и среди животных. Так при отсутствии меди в пище, у самцов крыс по сравнению с самками в более резкой форме происходили биохимические изменения в крови (Kramer, 1988). В наше время данная проблема половых различий в выживаемости и продолжительности жизни приобретает высокую актуальность. Самым ярким примером является, что во многих странах мира продолжительность жизни у мужчин короче чем у женщин. В последние два десятилетия произошли изменения в структуре смертности и на первое место вышли, так называемые болезни цивилизации, к 14 ним относятся такие болезни как: заболевания сердца и сосудов: инфаркт миокарда, гипертония, ишемическая болезнь сердца, атеросклероз (Stoney, 1987, Федоров, 1991, Чазов, 1992, Судаков, 1992.). От сердечно - сосудистых заболеваний страдают больше мужчины, чем женщины. (Stoney, 1987, TunstallPedoe, 1994, Lawler, 1995, Roger, 1998, Glyn,1999,). Поэтому половые различия в продолжительности жизни в настоящее время определяется прежде всего устойчивостью женщин и мужчин к стрессорным воздействия. Однако механизмы половых различий к стрессу исследованы недостаточно хорошо. Тем не менее в последние два десятилетия внимания многих ученых привлек вопрос о половых особенностях реакций ССС на различный стресс. Стрессовые влияния приводят к возникновению заболеваний системы органов коровообращения, что подтверждается многими исследователями.(Falkner, 1981, Dlin, 1983, Krantz,мManuck, 1984). Повышение уровня смертности среди мужчин от заболеваний сердца и сосудов объясняется предположительно отличиями у мужчин и женщин в реакции на стресс. (Stoney,1987). У разных исследователей существует диаметрально противоположные мнения о причине повышения уровня смертности у мужчин от сердечно – сосудистых заболеваний по сравнению с женщинами. Некоторые исследователи, Не находят каких-либо гендерных отличий в базальных и стрессорных уровнях сердечных сокращений (Frankenhaeuser, 1976, Gotshall, 1994). Другие исследователи экспериментально доказали, что женщины по сравнению с мужчинами имеют более высокие базальные и стрессорные уровни ЧСС (Eiff, 1990, McAdoo, 1990, Allen, 1993). У мужчин систалическое артериальное давление при стресс индуцированной тахикардии нарастает в значительно большей степени по сравнению с женщинами. Все выше сказанное свидетельствует в пользу предположения о том, что с понижением базального уровня артериального давления у женщин снижается риск развития сердечно - сосудистых заболеваний вызванных стрессом.(Hastrup, Light, 1984, Van Doorner, 1986, Weidner, Helmig, 1991).Такие отличия 15 объясняются особенностями энергетического обмена у мужчин и женщин так у мужчин потребность миокарда в кислороде выше чем у женщин, восполнение данной потребности происходит благодаря повышению работы сердца за счет увеличения уровня АД, У женщин потребность миокарда в кислороде решалось за счет возрастания ЧСС и минутного объема крови. (Меерсон Ф.З. (1984). Исходя из вышесказанного исследователи приходят к выводу, что при стрессвовых воздействиях в организме женщин создаются наиболее оптимальные условия, способствующие поддержанию уровня АД на относительно на невысоком уровне. Ведяев Ф П 1990. Женский организм за счет экономного типа гемодинамических реакций оказывается в юолее выгодных условиях по сравнению с мужским так как их коронарные сосуды защищены лучше этим и объясняется наиболее частое встречаемость ишемической болезни сердца у мужчин.(Tatchum-Talom2000). Мужской организм реагирует на стресс максимальной мобилизацией аппарата кровообращения, проявляющейся в максимальном напряжении механизмов регуляции АД, в отличие от женщин, в условиях эмоционально- стрессорного напряжения у них усиливается преимущественно центральное управление сердечным ритмом, что по мнению Бутяевой В.В. (1991), ухудшает адаптацию ССС к стрессу. Белова Е.В.,Голованова Г.Б. (1982) отмечают, более выраженные у женщин в отличие от мужчин хронотропные преимущественно на эффекты в норадреналовое условиях стресса обеспечение указывают эмоционального напряжения,что способствует максимальной оптимизации функционирования ССС и лучшей подготовке к экстренной мобилизации. В мужском организме гемодинамические изменения при стрессе имеют преимущественно адреналовое происхождение, что значительно снижает адаптацию ССС к стрессорному воздействию. Половые особенности проявляются и после стрессорного воздействия Girdler (1990) Возникшие у них отклонения кардиоваскулярной системы в ответ на действие физиологических стрессов сохраняются в период релаксации. У женщин после отмены стрессорного воздействия, почти все показатели гемодинамики возвращаются к исходным 16 величинам. Литературные источники доказывают, что половые особенности в стресс-реактивности ССС, обеспечивались многочисленными системными механизмами, могут в большей степени обуславливать неодинаковую адаптацию ССС к эмоциональным нагрузкам в женском и мужском организме. Известно, что женский организм в отличие от мужского, имеет значительные преимущества в востанивлении ССС к стрессам, в следствие эффективной работы механизмов компенсации. По мнению авторов, этим объясняется большая устойчивость ССС женских особей к повреждающему пагубному воздействию стресса (Van Doorner, 1986, Stoney, 1987, Бутяева, 1991). Изучение половых проводимые на различий людях, кардиоваскулярной дополняются стресс- экспериментами реактивности на животных. Возможность отрегулировать на животных закономерности реакций ССС пагубного воздействия стресса, характерных для человека, имеет важное методологическое значение, расширяя возможности изучение механизмов этих закономерностей. В исследованиях кафедры физиологии человека и животных СГУ представлены кардиоваскулярной характерные для стресс-устойчивости, человека которые половые различия в воспроизводятся в экспериментах на крысах. Так, вусловиях тяжелого звукового стресса самки в отличие от самцов проявляли высокую устойчивость к стресс-индуцированным кардио-и цереброваскулярным повреждениям (Анищенко, 1992а, 1995). Результаты более поздних работ (Анищенко,1997, 2000) доказали, что динамика кардиоваскулярных ответов на различные стрессы имеет половые особенности, также общие для человека и животных. Эти осо бенности заключаются в том, что у женщин, несмотря на существенные уровни стресс-индуцированной тахикардии, абсолютные значения АД и амплитуда его увеличения при стрессах не превышала, как у мужчин. Аналогичные результаты на животных были получены и другими исследователями.Так и Zukowska-Grogec (1991) отмечает, действии физиологических стрессов (взятие в руки, -воздействие холодовое воздействие ) у самок, несмотря на сильное увеличение ЧСС, показатели 17 средних цифр АД возрастают меньше, чем у самцов. При этом высокая реактивность ССС по показателям ЧСС у самок сопровождается с такой же более высокой скоростью восстановления исходного уровня сердцебиений и ср.АД. Отметим, что у самцов повышение АД в течение стресса более продолжительное, по сравнению с самками и повышенные уровни ЧСС наблюдаются на всем протяжении восстановительного периода. Поскольку, частые и длительные повышения АД на психоэмоциональные воздействия считаются предвестниками для развития гипертонии (Stoney, 1987), преимущества "женского" типа динамики АД очевидны при стрессах. Судаков К.В. (1981) показал, что у самок кроликов при длительном эмоциональном стрессе активно включаются депрессорные функции организма, защищающие его от развития гипертонии с возможным исходом в виде острого инфаркта миокарда, как это происходит у самцов. В опытах на изолированном сердце установлено, что вызванные гипоксией нарушения энергетического метаболизма и сократительной функции миокарда у самцов крыс проявляются значительно раньше и протекают тяжелее, чем у самок (Корнеев,1990). Отсюда следует, как у животных, так и у людей есть важдные половые различия в стрессреактивности ССС. Механизмы, обуславливающие эти различия, могут обеспечивать высокую эффективную адаптацию ССС женского организма к воздействиям стресса, продолжительности жизни что является женщин по более высоким сравнению с проявлением мужчинами.Чем обусловлены половые различия в стресс-реактивности и стресс-устойчивости ССС? В последнее время, активно обсуждается влияние половых гормонов в этих процессах, чему посвящена следующая глава. 18 1.2 Роль андрогенов в регуляции сосудистого тонуса и кардиоваскулярной стресс-реактивности Следует обратить внимание, на то что большинство исследований по изучению кардиоваскулярныхвлияний половых гормонов, были направлены на изучение роли эстрогенов и их рецепторов в регуляции ССС в нормальном состоянии и состоянии патологии. В это же время, кардиоваскулярные эффекты мужских половых гормонов остаются малоизученными. Наличие рецепторов андрогенов в клетках сосудов указывает на функциональную роль этих гормонов как модуляторовсосудистого тонуса. В последние годы увеличилось число исследований, в которых показано, что мужские половые гормоны стимулируют эндотелий-зависимые механизмы вазодилатации и ингибируют механизм сокращения гладкой мускулатуры коронарных артерии (Wu, 2003; Khalil, 2003). Действительно, в исследованиях in vitro установлено, что тестостерон снижает тонус активированных коронарных сосудов и аорты (Oparil, 1997). Так,кратковременная внутрикоронарная инфузия тестостерона вызывает расширение сосудов и увеличивает кровоток в коронарных артериях. В связи с чем терапия андрогенами может быть использована для улучшения сердечной деятельности и увеличения коронарного кровотока (Pugh, 2000). Блокаторы андрогенных рецепторов не оказывают влияние на быстрые сосудорасширяющих эффекты тестостерона, что свидетельствует об их негенномном происхождении. Полагают, что вазодилататорные эффекты тестостерона опосредуются через АТФ-чувствительные калиевые каналы гладкомышечных клеток (Sader, 2002), а также за счет ингибирования внутриклеточного тока ионов кальция (Chen, 1991) Наряду с прямыми сосудорасширяющими эффектами описанными выше, тестостерон активирует механизмы, вызывающие сокращение сосудов и увеличение АД. Доказано, что у крыс самцов линий SHR, Dahl –чувствительных к соли, новозеландских генетически гипертензивных крыс АД выше, по сравнению с самками соответствующих линий. Удаление семенников у самцов 19 Крыс SHR и Dahl в раннем возрасте ослабляет последующее развитие гипертензии (Reckelhoff, 1998). В тоже время инъекции тестостерона нормотензивным гонадоэктомированным самцам и самкам повышает АД до значений, характерных для интактных самцов (Reckelhoff, 1998). Необратимое увеличение АД наблюдается у самок с удаленной почкой после продолжительных инъекций тестостерона (Oudar, 1991). При изучении механизмов, обеспечивающих гипертензивные эффекты андрогенов было доказано, что тестостерон может вызывать увеличение АД посредством повышения уровня гомоцистеина в крови, Повышение плотности рецепторов тромбоксана А2 (McLaughlin, 2007), высвобождения нейропептида У (НПУ) из окончаний симпатических нервов, (Zukowska- Grojec, 1995), усиления сократительных эффектов эндотелина I (Teoh., 2000). У самцов крыс гипертензивной линии SHR отмечается повышенный уровень KA (Kumai, 1994), который снижается до показателей интактных самцов после удаления семенников (Kumai., 1995), что указывает на прямое стимулирующее влияние тестостерона на синтез КА.Вышеприведенные данные доказывают, что тестостерон оказывает модулирующее действие на сосудистый тонус посредством как сосудорасширяющих и сосудосужиющих механизмов. Баланс между этими механизмами и определяет конечный эффект тестостерона на сосудистый тонус и, в конечном счете АД.Литературные данные о кардиальных эффектах андрогенов малочисленны и носят противоречивый характер. Так, согласно клиническим исследованиям, введение тестостерона мужчинам уменьшает тяжесть атеросклеротического повреждения коронарных сосудов (McLaughlin, 2007) и значительно улучшает восстановление при общей ишемии миокарда (Callies, 2003). Показано также, что у мужчин с кардиоваскулярными заболеваниями концентрация тестостерона в крови ниже, чем у здоровых мужчин (Jaffe, 1996). Вместе с тем в исследованиях на людях было показано, то прием анаболических стероидов, которые являются синтетическими производными тестостерона, вызывает ремоделирование желудочков сердца, инфаркт миокарда и внезапную смерть (Sullivan, 1998). Введение экзогенного 20 тестостерона или его метаболитов самцам крыс приводит к Современное общепринятое мнение заключается в том, что физиологические дозы андрогенных препаратов благоприятно или нейтрально оказывают воздействие на обмен липиднов в организме, возможно улучшая течение кардиоваскулярных заболеваний у мужчин. Но не смотря на это, для безопасности назначения заместительной терапии препаратами андрогенов пожилым мужчинам следует провести исследования, результатом которых будут не лабораторные сдвиги, а клинические исходы , степень заболеваемости и смертности от сердечнососудистых заболеваний на фоне терапии указанными выше препаратами (Wu, 2003). Данные клиники и эксперементов свидетельствуют об участии половых гормонов в регуляции кардиоваскулярных реакции и вегетативного гомеостаза в состоянии стресса (Phillips, 2006). Необходимоуказать, что внимание исследователей направлено в основном на изучение роли женских половых гормонов как возможных модуляторов кардиоваскулярной стресс- реактивности, в то время как данные о участии мужских половых гормонов в реакциях ССС при стрессорных воздействиях почти отсутствуют. У ряда авторов было показано ограничивающее влияние женских половых гормонов на кардиоваскулярные и вегетативные изменения при воздействии стресса (Ueyama, 2007). Уменьшение амплитуды стрессорного увеличения АД отмечаось у овариэктомированных самок крыс спонтанно-гипертензивной линии SHR после комбинированной терапии эстрогеном и прогестероном. У овариэктомированных самок крыс нормотензивных линий регистрировали уменьшение базальной активности почечного симпатического нерва при однократном введении эстрогена (Connell, 2003). Однако введение тестостерона гонадоэктомированным самцам приводит к повышению стрессорного уровня АД (van den Buuse, 2000). О влиянии женских половых гормонов на чувствительность ССС к стрессу показывают данные об изменении кардиоваскулярной стресс-реактивности в зависимости от фазы полового цикла у женских особей. Так, у самок SHR в стадии диэструса, в сравнении с самками в стадии эструса и самцами, отмечались наиболее высокие стрессорные 21 показатели ЧСС и АД (van den Buuse, 2000). Согласно данным Manhem, (1991) и Light, (1994), у женщин в фолликулярную фазу показатели гемодинамических параметров при стрессорном воздействии были ниже, чем в лютеиновой фазе цикла. Полагают, что модулирующие эффекты эстрогенов на кардиоваскулярный стресс реактивность опосредуются путем многообразных и комплексных влияний этих гормонов на вегетативные механизмы регуляции (Phillips, 2006). В большинстве экспериментов на людях и животных было показано, что дефицит эстрогенов сопровождается смещением вегетативного гомеостаза в сторону превосходства симпатических влияний в регуляции сердечного ритма (Serova, Maharjan, 2005). Sabban, Заместительная гормональная терапия с использованием эстрогена снижает у женщин активность СНС и оказывают стимулирующее воздействие на парасимпатический отдел вегетативной нервной системы (Kaya, 2003). В литературе практически отсутствуют данные по изучению влияния тестостерона и прогестерона на вегетативные механизмы регуляции. Полагают, что большинство центральных эффектов тестостерона реализуется через рецепторы эстрогенов после превращения этого гормона в эстрадиол (de Ronde, 2003). Но механизмы, участвующие в регуляции этого процесса, остаются до настоящего времени малоизученными. Данные указанные выше свидетельствуют о большом значении половых гормонов в обеспечении половых различий в действие ССС в условиях покоя и при воздействии стрессфакторов. Однако, существуют работы, которые не позволяют рассматривать половые гормоны как доминантный фактор различий чувствительности ССС к стрессорным воздействиям в мужском и женском организме. Установлено, что в пожилом возрасте после наступления менопаузы, адаптация женского организма по показателям сердечно-сосудистой деятельности к производственным (Баевский, Берсенева, Барсукова, 1985), физическим (Otterstad, 1990) и умственным нагрузкам (Matthews, 2001), психоэмоциональным стрессам (Traustadottir, 2003) и негативным факторам 22 окружающей среды Баевский, 1997) протекает благополучнее чем у мужского организма. Половые различия в кардиоваскулярной стресс- реактивности наблюдаются и до наступления половой зрелости. Так, у мальчиков ухудшение функциональных возможностей сердечной деятельности при адаптации к школьным нагрузкам наблюдается чаще чем у девочек. (Бутяева, 1991) Резюмируя приведенные данные, можно прийти к заключению, что в обеспечении половых различий в кардиоваскулярной стресс-реактивности и стресс-устойчивости играют роль половые гормоны, однако данный механизм не является единственным. 23 Механизмы сосудистых эффектов андрогенов и их вклад в развитие 1.3. артериальной гипертензии Феномен половых различий в выживаемости и продолжительности жизни в последнее время приобретает особое звучание в силу прогрессивного роста численности кардиоваскулярных заболеваний, склонность к которым среди мужчин значительно выше, чем среди женщин репродуктивного возраста (Кобрин, 2000; Reckelhoff, 2001, 2005; Orshal, 2004). Атеросклероз, коронарные болезни, инфаркт миокарда и другие сердечно-сосудистые патологии составляют основу гендерной проблемы (Wingard, 1983; Jousilahti, 1999; Sader, 2002; Jones, 2003; Liu, 2003; Malkin, 2003; Wu, 2003). Особое положение в этом списке занимает АГ. В эпидемиологических исследованиях на людях (Anastos, 1991; Reckelhoff, 2001), а также на многочисленных моделях АГ у животных (Iams, 1979; Masubuchi, 1982; Ouchi, 1987; Ganten, 1989; Ashton, 1991; Chen, 1991; Rowland, 1992; Crofton, 1993; Reckelhoff, 2000; Анищенко, 2007; Игошева, 2010; Бердникова, 2011), доказано, что принадлежность к мужскому полу является самостоятельным фактором риска в генезе данного заболевания. Половые гормоны могут быть ключевым звеном в механизмах половых различий в устойчивости к развитию АГ (Sullivan, 1998; Dubey, 2002; Khalil, 2005). Уже с момента пубертатного периода, когда половые железы начинают активно функционировать, отмечается повышение уровня АД, базальные значения которого у юношей выше, чем у девушек (Bachmann, 1987; Harshfield, 1994). Данная тенденция сохраняется и на последующих сроках онтогенеза до момента естественного снижения половой функции, когда гендерные различия по данному показателю нивелируются (Stamler, 1976; Staessen, 1990; Khoury, 1992; Yong, 1993; Himmelmann, 1994; Burl, 1995; Wiinber, 1995; August, 1999). 24 В многочисленных научных обзорах андрогены рассматриваются «прогипертензивные» гормоны (Dubey, 2002; Orshal, как 2004; Reckelhoff, 2001, 2005; Khalil, 2005). Действительно, в экспериментах на гипертензивных животных существуют убедительные свидетельства того, что тяжесть АГ значительно облегчается в условиях дефицита андрогенов, вызванного кастрацией (Iams, 1977; Masubuchi, 1982; Cambotti, 1984; Malyusz, 1985; Share, 1988; Ganten, 1989; Chen, 1991; Rowland, 1992; Crofton, 1993; Reckelhoff, 2000). Аналогичные результаты были получены и в опытах с хронической блокадой андрогенных рецепторов (Reckelhoff, 1999). Длительное введение тестостерона в физиологических дозах кастрированным самцам с генетической формой АГ сопровождается развитием у них более тяжелой АГ, чем в естественных условиях (Chen, 1991; Reckelhoff, 1998). Подобные эксперименты были проделаны на нормотензивных свиньях с билатеральной орхидектомией, в которых было выявлено значительное повышение тонуса церебральных сосудов при длительном получении андрогенов (Geary, 2000). В исследованиях на молодых юношах с нормальным уровнем АД показано, что применение тестостерон энантата в дозе 3,5 мг/кг в течение 12 недель сопровождалось повышением систолического артериального давления на 10 мм рт.ст. (Giorgi, 1999). Однако, в экспериментах на пожилых мужчинах (White, 1999) или с использованием другого препарата - тестостерон андеканоат в дозе 120 мг/кг в течение 5 дней (Whitworth, 1992) не были получены аналогичные результаты, что, возможно, связано с разными возрастными группами испытуемых, сроками проведения опытов и видами фармакологических аналогов андрогенов. В хронических опытах на животных с применением низких доз андрогенов было также выявлено повышение тонуса церебральных и коронарных артерий (Farhat, 1995; Geary, 2000; Penotti, 2001). Таким образом, экспериментальные исследования, проводимые как на людях, так и на животных свидетельствуют о прогипертензивных эффектах андрогенов, механизмы которых остаются малоизученными. В силу 25 отсутствия системных исследований в этой области затруднено формирование обобщенной точки зрения на эти процессы. Существуют работы, в которых показано, что повышение уровня АД у спонтанно-гипертензивных самцов ассоциируется с ростом концентрации катехоламинов в крови (Kumai, 1994). При этом удаление гонад у животных оказывает антигипертензивный эффект, который сопровождается снижением уровня адренергических гормонов, циркулирующих в плазме (Kumai, 1995). Этот эффект можно объяснить стимулирующими влияниями тестостерона на активность тирозингидроксилазы, обнаруженными в других экспериментах (Kumai, 1995, 1995а). Таким образом, одним из механизмов прогипертензивных эффектов андрогенов может быть повышение активности адренергической системы, имеющей место при различных формах АГ (Lillie, 2006; Grassi, 2008, 2009). Большинство форм АГ характеризуется нарушением работы почек (Одинцова, 2006; Суворов, 2006; Шеметова, 2007; Маколкин, 2008; Шарипова, 2008). В ряде исследований описывается содействие андрогенов развитию патофизиологических процессов в почках у гипертензивных животных. Так, кастрация повышает гломерулярную фильтрацию, снижает протеинурию и повышает натрийурез у гипертензивных самцов крыс (Baylis, 1994;Reckelhoff, 1999). Известно наличие андрогенных рецепторов в ренальной ткани (Reckelhoff, 1999, 1999б), блокада которых флутамином у гипертензивных самцов существенно снижает уровень АД и нормализует концентрацию натрия в моче (Reckelhoff, 1999; Caplea, 2001). Введение тестостерона сопровождается дозозависимым повышением концентрации ренина в крови (Reckelhoff, 1998, 1999б, 2001). Активность мРНК, кодирующей синтез ангиотензиногена, выше у самцов крыс по сравнению с самками. При этом кастрация снижает содержание мРНК в ренальных клетках самцов до уровня самок (Ellison, 1989; Chen, 1992). Все эти факты указывают на вовлечение андрогенов в ренальные механизмы 26 формирования АГ. Адренергический гипертонус и ренальная дисфункция связаны с эндотелиальными повреждениями, которые развиваются при нарушениях в нейрогуморальных звеньях регуляции уровня АД (Toda, 2003). В ряде работ показано, что андрогены подавляют эндотелиальную релаксацию в мелких артериях (Ba, 2004) и повышают активность ренальной аргиназы (Kumar, 1984). Эти эффекты андрогенов можно объяснить их стимулирующими влияниями в отношении активности вазоконстрикторных факторов эндотелина I (Porderman, 1993; Teoh, 2000), нейропептида Y (ZukowskaGrojec, 1995), тромбоксана А2 (Wynne, 2003). Таким образом, содействие андрогенами формированию АГ может быть связано с их стимулирующими эффектами в отношении активности адренергических, ренальных и эндотелиальных факторов вазоконстрикции. Однако, несмотря на убедительные экспериментальные доказательства прогипертензивных эффектов андрогенов, в клинических наблюдениях показана четкая взаимосвязь между снижением устойчивости к развитию различных сердечно-сосудистых заболеваний и снижением уровня тестостерона в крови. Так, гипотестостеронемия выявлена у мужчин с сердечной недостаточностью, инфарктом миокарда, коронарными болезнями (Kalin, 1990; Phillips, 1993, 1994; Alexandersen, 1996; English, 1997, 2000а). Развитие АГ также ассоциируется со снижением синтеза андрогенов (Khaw, 1988; Hughes, 1989; Jaffe, 1996; Fogari, 2002; Ishikura, 2008). Низкий уровень тестостерона в плазме крови рассматривается как фактор риска в генезе атеросклероза (Duell, 1990; Hromadova, 1991; Khaw, 1991; Jones, 2003а; Malkin, 2003). Эти факты свидетельствуют о защитных эффектах андрогенов в поддержании кардиоваскулярного гомеостаза. Впервые в 1977 г. профессором Jaffe (1977) была предпринята успешная попытка лечения миокардиальной ишемии у мужчин долговременным, в течение 8 недель, внутримышечным введением тестостерона. Впоследствии применение тестостерона в кардиологической практике стало одним из направлений в терапии различных коронарных нарушений. Антиишемические 27 эффекты андрогенов в миокарде были выявлены в исследованиях как с хроническим применением их синтетических аналогов pes оs в больших дозах (Wu, 1993) и подкожно (English, 2000б), так и при экстренной помощи с использованием внутривенных и внутрикоронарных инъекций (Webb, 1999а, 1999б). В экспериментах на приматах и кроликах, получающих в течение длительного времени дегидроэпиандростерон, была выявлена защитная роль андрогенов в устойчивости к развитию атеросклероза (Gordon, 1988; Eich, 1993; Christopher-Hennings, 1995). Предполагается, что в основе кардиопротективных эффектов андрогенов лежат их вазорелаксирующие свойства, обнаруженные в многочисленных опытах in vitro на коронарных артериях, взятых у разных видов животных (Yue, 1995; Crews, 1999; Murphy, 1999; English, 2000в; Deenadayalu, 2001). Исследования in vivo в этом направлении практически не проводятся, что связано с применением сверхфизиологических дох андрогенов с целью обнаружения их дилатирующих эффектов. Первые попытки в этом направлении были предприняты Chou (1996), который в опытах in vivo на собаках с применением внутрикоронарных инъекций тестостерона и использованием доплеровского мониторинга коронарного кровотока выявил вазорелаксирующие эффекты андрогенов. Кроме коронарных артерий, релаксирующие воздействия тестостерона были выявлены и на других типах артерий, включая грудную аорту (Yue, 1995; Honda, 1999; Perusquia, 1999; Ding, 2001), брыжеечные (TepAreenan, 2002), легочные (English, 2001) артерии. Можно предположить, что применение сверхфизиологических доз андрогенов, в тысячу раз превышающих естественный фон мужских гормонов в крови, может не отражать реальных механизмов их сосудистых эффектов. Так, в опытах in vitro было показано, что тестостерон в низких дозах оказывает вазоконстрикторые эффекты на коронарные артерии (Ceballos, 1999; Teoh, 2000). Однако в других экспериментах использование физиологических 28 доз тестостерона позволило выявить релаксацию изолированных брыжеечных артерий под его воздействием (Tep-Areenan, 2002). Клинические данные также свидетельствуют о том, что внутрикоронарное введение низких тестостерона оказывает противоспазматический эффект у мужчин доз с миокардиальной ишемией (Webb, 1999а). Эти факты органично согласуются с результатами исследований, полученными как in vitro, так in vivo с использованием супрафизиологических доз андрогенов, что подтверждает адекватность полученных таким образом данных реальным событиям. Поскольку регуляция различных физиологических функций в организме мужскими половыми гормонами реализуются через их взаимодействие с ядерными анрогенными рецепторами, можно предположить, что именно такой классический путь является механизмом сосудистых эффектов андрогенов. Действительно, в опытах in vitro было показано, что индуцированное тестостероном повышение плотности тромбооксановых рецепторов А2 в культуре клеток аорты полностью блокировалось с условиях добавление блокатора андрогенных рецепторов – гидроксифлутамина (Masuda, 1991, 1994), что подтверждает вышеуказанное предположение. Однако, известно, что геномные пути реализации физиологических эффектов андрогенов занимают длительное время (от 40 мин до 1 часа), которое требуется на проникновение гормона в клетку, связь его со специфическим рецептором, активацией определенных локусов ДНК и впоследствии мРНК, запуском синтеза белков и т.д. (Jones, 2003). Вазорелаксирующие эффекты андрогенов развиваются быстро (в течение 1 мин, максимум 20 мин), что свидетельствует об их негеномной природе (Webb, 1999а; Jones, 2003). Подтверждением этого факта являются результаты исследований, в которых показано, что предварительная блокада андрогенных рецепторов не отменяет вазодилатацию, вызванную введением тестостерона (Yue, 1995; Jones, 2002а; Tep-Areenan, 2002). Аналоги тестостерона, не способные запускать геномные механизмы, вызывают более выраженную релаксацию сосудов по сравнению натуральным мужским гормоном 29 (Yue, 1995; Ding, 2001). Эти факты свидетельствуют о том, что расслабляющие воздействия андрогенов на сосудистую стенку не реализуются через взаимодействие с андрогенными рецепторами и подключением классического геномного пути. На сегодняшний момент общепризнанна точка зрения о том, что эстрогены оказывают релаксирующее воздействие практически на все сосуды организма (Кобрин, 2000; Chester, 1995; Browne, 1999; Salom, 2001; Dubey, 2002; Orshal, 2004; Khalil, 2005; Reckelhoff, 2005). Поскольку тестостерон при определенных условиях способен конверсироваться в 17βэкстрадиол под воздействием фермента ароматазы, то этот механизма может лежать в основе вазодилатирующих эффектов андрогенов. Однако, данное предположение не нашло своего подтверждения в многочисленных экспериментах. Так, предварительная блокада фермента ароматазы (Yue, 1995; Tep-Areenan, 2002) или эстрогенных рецепторов (Chou, 1996) не подавляет расслабления сосудистого тонуса, вызванного введением тестостерона. Дегидротестостерон, неспособный конверсироваться в 17βэстрадиол, вызывает релаксацию сосудов, аналогично тестостерону (Deenadayalu, 2001). Легочная кровеносная система более чувствительна к дилатирующим эффектам тестостерона по сравнению с 17β-эстрадиолом (English, 2001). Таким образом, экспериментальные данные свидетельствуют о том, что расслабляющие эффекты тестостерона на сосуды реализуются преимущественно не за счет его взаимодействия со специфическими андрогенными рецепторами или конверсией в 17 β-эстрадиол, а через прямое воздействие на эндотелиальные и неэндотелиальные механизмы вазорелаксации. Эндотелийзависимые механизмы вазорелаксирующих эффектов андрогенов были обнаружены в ряде исследований (Farhat, 1995; Herman, 1997; Hutchison, 1997). В частности, в опытах in vitro на грудной аорте крыс было показано, что предварительная обработка изолированного сосуда 30 блокатором синтеза NO подавляет тестостерон-индуцированую дилатацию (Costarelle, 1996). В других экспериментах in vivo на собаках было выявлено, что тестостерон вызывает релаксацию коронарных сосудов частично за счет вовлечения NO-зависимых механизмов (Chou, 1996). Клинические исследования на мужчинах с миокардиальной ишемией свидетельствуют о том, что как длительное употребление физиологических доз тестостерона per os (Kang, 2002), так и внутривенное его введение (Ong, 2000) улучшают сосудистую чувствительность к факторам, стимулирующим эндотелийзависимую релаксацию. Эти факты согласуются с результатами исследований, в эндотелиальной которых было NO-синтазы выявлено при повышение длительном активности применении дегидроэпиандростерона per os (Simoncini, 2003). Однако, существуют и противоположные данные, указывающие на повышение эндотелийзависимой релаксации сосудов в условиях дефицита мужских половых гормонов. Так, у мужчин после билатеральной орхидектомии или длительного применения по медицинским показаниям блокаторов андрогенных рецепторов были обнаружены более выраженные сосудистые реакции на нитроглицерин, являющейся экзогенным донором NO, по сравнению с исходным состоянием (Herman, 1997). В работе Honda (1999) были сделаны интересные выводы, указывающие на то, что релаксация сосудов тестостероном реализуется в норме преимущественно за счет активации К+-каналов, а в условиях развития АГ к этим процессах подключаются эндотелиальные механизмы, возможно, как компенсаторная реакция. В большом количестве исследований in vitro с использованием различных типов сосудов, взятых у нормотензивных животных указывается, что удаление эндотелия не предотвращает проявления вазодилатирующие эффекты андрогенов (Yue, 1995; Crews, 1999; Honda, 1999; Murphy, 1999; Perusquia, 1999; Deenadayalu, 2001). Аналогичные результаты были получены в опытах с применением блокаторов 31 NO-синтазы, гуантилациклазы, простагландинов (Yue, 1995; Honda, 1999; Deenadayalu, 2001; Jones, 2002а). Эти факты свидететльствуют о том, что снижение тонуса сосудов андрогенами реализуется преимущественно Косвенным подтверждением через данного неэндотелиальные факта является механизмы. результаты, отражающие пониженную способность эндотелия к вазорелаксации, а также более низкое содержание NO в крови, моче и в стенках различных типов сосудов у самцов по сравнению с самками (Forte, 1998; English, 2002; Sader, 2002), у которых доказана эндотелийзависимая природа вазорелаксирующих эффектов эстрогенов (Кобрин, 2000; Reckelhoff, 2001; Dubey, 2002; Orshal, 2004; Khalil, 2005). Таким образом, современная точка зрения на изучение сосудистых эффектов мужских половых гормонов оценивает их как преимущественно прямое влияние андрогенов на гладкую мускулатуру сосудов. Однако, в отношении механизмов данных эффектов существует большое разногласие, которое объясняется многообразием методических подходов, сроков проведения экспериментов, линий животных и доз препаратов, используемых при исследованиях. На данный момент сформировались две точки зрения, в которых ведущую роль в механизмах андрогенной вазорелаксации отводят либо их стимулирующим влияниям на активность К+-каналов (Yue, 1995; Honda, 1999; Deenadayalu, 2001; Ding, 2001; Tep-Areenan, 2002; Jones, 2003), либо подавляющим эффектам в отношении деятельности Са2+-каналов (Perusquia, 1999; English, 2002; Jones, 2002а; Jones, 2003). Аргументы в пользу первой точки зрения базируются на большом количестве экспериментальных данных, полученных как в опытах in vivo, так и in vitro, указывающих на то, что блокаторы различных типов К-каналов подавляют вазорелаксирующие эффекты андрогенов (Yue, 1995; Honda, 1999; Deenadayalu, 2001; Ding, 2001; Tep-Areenan, 2002; Jones, 2003). Первые опыты по исследованию роли К-каналов в вазорелаксации андрогенами были сделаны 32 механизмах Yue (1995), который на изолированных коронарных сосудах и грудной аорте кроликов выявил, что предварительное добавление в среду инкубации блокаторов К V-и КСа-каналов полностью предотвращает дилатирующие эффекты андрогенов. В исследованиях in vivo на собаках было показано, что расширение коронарных артерий в ответ на внутрикоронарное введение тестостерона снимается блокадой КАТФ-каналов (Chou, 1996). Интересные результаты были получены Honda (1999), который выявил разные механизмы тестостерон-индуцированной релаксации аорты у нормотензивных и гипертензивных крыс. У нормотензивных животных эти процессы реализуются за счет преимущественного вовлечения КАТФ-каналов, а у гипертензивных крыс к этим процессам дополнительно подключаются КV и КСа-каналы как компенсаторный механизм. Альтернативная точка зрения свидетельствует о том, что расслабление сосудов анрогенами осуществляется за счет их подавляющих влияний на Саканалы. Первые результаты, послужившие основой для формирования указанного мнения получены в опытах Perusquia (1999), который показал, что констрикция изолированной грудной аорты, обработанная раствором норэпинефрина, стимулирующего Са2+ поток в клетки, подавляется при добавлении 5β-дегидротестостерона. При этом, если дополнительно использовался верапамил - блокатор Са-каналов, указанные эффекты не проявлялись. Аналогичные результаты были получены и в других работах с использованием коронарных и легочных артерий (English, 2002; Jones, 2002а). Однако, в большинстве других исследований было показано, что предварительная блокада Са-каналов не оказывает эффективного влияния на тестостерон-индуцированную релаксацию (Yue, 1995; Deenadayalu, 2001; Ding, 2001; Tep-Areenan, 2002). В опытах с удалением гонад у самцов крыс не были выявлены различия между интактными и кастрированными животными в васкулярной чувствительности к норэпинефрину, стимулирующему Саканалы (Crews, 1999; Kanashiro, 2001).Содержание Са2+ в стенках гладкой мускулатуры скелетных артерий выше у самцов по сравнению с самками. На 33 этом фоне норадреналин вызывает более интенсивный поток Са2+ в клетки у мужских особей, чем у женских. Но орхидектомия не изменяет чувствительность к норадреналину у самцов (Crews, 1999; Murphy, 2000). Таким образом, на сегодняшний день не существует единой точки зрения на механизмы васкулярных эффектов андрогенов в условиях нормы и при развитии АГ, что можно объяснить преимущественным проведением экспериментов на нормотензивных животных в опытах in vitro с применением сверхфизиологических доз андрогенов и многообразием методических подходов. Это не позволяет сформировать обобщенную точку зрения о механизмах влияния андрогенов на сосуды в целом организме. Принципиальные различия в процессах релаксации сосудов андрогенами между нормотензивными и гипертензивными животными указывают на прямую зависимость этих эффектов от физиологического состояния организма. Этот факт является предпосылкой для проведения более детальных исследований, направленных на изучение механизмов трансформации нормальных сосудистых эффектов андрогенов в патологические, приводящие к нарушению регуляции уровня артериального давления и развитию АГ. 34 ГЛАВА II МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ 2.1. Объекты исследования Исследования выполнены на 302 половозрелых, 22 новорожденных самцах и 73 самках белых беспородных крыс. Все экспериментальные процедуры проводились в соответствии с принципами Хельсинской декларации о гуманном отношении к животным. 2.2. Методы исследования Регистрацию бодрствующих крыс среднего артериального осуществляли на давления (ср.АД) у компьютерно-вычислительном комплексе для прямой регистрации кровяного давления у мелких животных (PowerLab/400 ML 401, ID Instruments, 2002, Австралия) с программным обеспечением Chart 4, оснащенным датчиками кровяного давления (MLT0699, PowerLab, ID Instruments). С этой целью за сутки до экспериментов животным вживлялся полиэтиленовый катетер в аорту через левую ветвь сонной артерии под общей нембуталовой анестезией (0.40 мг/кг, ip) (рис. 1). Стандартная операционная процедура по имплантации полиэтиленовых катетеров в сосуды подробно описана в следующих научных работах (Dworkin, 1980; FejesTothG., 1984; Мурашев, 1992; Глушковская-Семячкина, 2002). В экспериментах использовались полиэтиленовые катетеры (производство ClayAdams, Parsippany, NewYersey), маркированные как BB31695-PE/1 (наружный диаметр - 0.61 мм, внутренний диаметр – 0.28 мм) и BB31695-PE/3 (наружный диаметр - 0.96 мм, внутренний диаметр – 0.58 мм). Для постоперационного восстановления животные помещались в индивидуальные клетки (0.3×0.25×0.2 м). Эксперименты проводили спустя 24 часа после операции. Перед началом каждого опыта крысы адаптировались к экспериментальной обстановке в течение 30 мин. В этот период испытуемому животному через катетер вводили раствор гепарина для предотвращения 35 тромбообразования на его стенках (Biochemi, Vienna/Austria 25000 ED/5ml) из расчета 1000 ED/0.2 мл гепарина в 0.8 мл физиологического раствора в объеме 0,2 мл раствора гепарина). Рисунок 1 – Имплантация полиэтиленового катетера в сонную артерию: 1-3 – лигатуры, фиксирующие катетер на сосуде, 4 – сонная артерия Способ моделирования ренальной гипертензии (Патент РФ 68280) В основе данного метода лежит создание с помощью определенных хирургических манипуляций искусственного стеноза ренальной артерии. С этой целью под общей анестезией вскрывали брюшную полость, находили ренальную артерию и отделяли ее от соединительной ткани (рис. 2а). Предварительно в соответствии с возрастными и индивидуальными особенностями животного вырезали клипсу, ширина которой составляла 1/5 от визуальной длины ренальной артерии, длина – от 1 мм (для животных с массой от 50-150 гр.) до 2 мм (для крыс с массой от 150-350 гр.). Клипсу изготавливали из алюминиевой тонкой пластинки (0.5 мм), покрытой окисным инертным слоем (рис. 2б). Установку клипсы производили путем простого подведения ее в открытом виде под ренальный сосуд (рис. 2в). С помощью технических 36 щупов контролировали зазор клипсы, который составлял для крыс массой: от 50-100 гр. – 0.16 мм; от 100-150 гр. – 0.18 мм; от 150-200 гр. – 0.23 мм; от 200250 гр. – 0.25 мм; от 250-300 гр. – 0.29 мм; от 300-350 гр. – 0.29 мм. а г в б Рисунок 2 - Этапы наложения клипсы на ренальную артерию: а – отделение ренальной артерии от соединительной ткани; б – вид клипсы, в – захват с помощью клипсы ренальной артерии, г – клипсированная ренальная артерия Фиксирование клипсы на сосуде осуществляли путем загиба с помощью плоских хирургических пинцетов одного более длинного краевого конца клипсы на другой более короткий (рис. 2г). Устойчивые высокие показатели АД наблюдали спустя 7 недель после наложения клипсы на ренальную артерию. 37 Способ моделирования стресс-индуцированной артериальной гипертензии (Патент РФ 2409872) Выполнение поставленной задачи достигалось путем содержания крыс в течение 4 месяцев в условиях социального стресса (перенаселение или изоляция). Для соблюдения правил содержания животных небольшими группами (Лабораторные животные. 1993. № 2.) крысы должны проживать в клетке в следующем соотношении площади и массы тела: см2/г массы тела=1. В данной модели использовали проживание животных в условиях высокой популяционной плотности, когда указанное соотношение было (см2/г массы тела = 0,3), то есть в три раза превышающее нормативы. А также проживание животных в одиночестве (площадь клетки 350 см2). На протяжении 4 месяцев у части животных проводились контрольные измерения уровня АД в соответствии со стандартной операционной процедурой прямой регистрации сигналов кровяного давления. Через 4 месяца проживания крыс в условиях социального стресса у 100% животных под анестезией (для исключения влияния психоэмоциональных факторов) отмечался повышенный базальный уровнь АД, который соответствовал гипертензивному уровню. С целью изучения резервных возможностей ССС изучали структуру кардиоваскулярной стресс-реактивности в условиях тяжелого стресса, провоцирующего развитие церебро- и кардиоваскулярных повреждений (Анищенко, 1992; 1995). Моделирование тяжелого стресса, представляющего собой комбинированное воздействие иммобилизации и прерывистого звука 100 дБ в течение 120 мин, осуществляли по методу Т.П. Романовой (1989; 1990). У новорожденных крыс применяли модифицированную нами методику, описанную подробно в данном патенте (Патент РФ 2505805) Определение тестостерона, адреналина и бета-аррестина-1 в крови проводили иммуноферментным методом (Wilson, 1992) с использованием компьютерно-диагностического комплекса 38 IMMULITE 2000 (США). Определение экспрессии андрогенных рецепторов проводили с помощью иммуногистохимического и иммунофлуоресцентного методов с применением специфических антител (AN1-15, Santa Cruz sc 56824) и конфокального микроскопа Leica TCS SP5X (2014). Морфологические исследования тканей мозга осуществляли с помощью стандартной процедуры проводки и заливания парафином срезов тканей 4-5 мкм. Для окрашивания срезов исследуемых тканей применялись гистологические красители: гематоксилин и эозин. Оценку морфологических изменений в тканях осуществили с помощью микровизора µVizo-101 (ЛОМО). С целью изучения роли половых гормонов в регуляции базального и стрессорного уровней АД проводили гонадэктомию нормотензивных и гипертензивных самцов в соответствии со стандартной методикой кастрации (Коган, 1980). Для блокады андрогенных рецепторов применяли флутамид (10 мг/кг, per os), который применяли в течение 2-х недель. Для изучения устойчивости к стресс-индуцированному инфаркту мозга в условиях низкого содержания тестостерона крысам вводили однократно Сустанон-250 (10 мг/кг) разведенный в стерильном оливковом масле, внутримышечно двукратно с перерывом в одну неделю. Исследования гемодинамических параметров мозгового кровотока проводили с использованием 3D оптической когерентной томографии на установке OCS1300SS (США) и системы лазерной спекл визуализации. Подробное описание этих методов изложено в следующих публикациях (Semyachkina-Glushkovskaya, 2013 а, б). Статистическая обработка экспериментальных данных осуществлялась с помощью пакета программ Statistica 5.0. Различия считались достоверными при р<0.05. Данные представлены как среднеестандартная ошибка среднего. 39 ГЛАВА III. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ 3.1 Влияние различных видов стресса на секрецию тестостерона и уровень артериального давления у крыс На первом этапе исследований были проведены эксперименты на половозрелых самках и самцах белых крыс по изучению адаптивных и резервных возможностей системы продукции и секреции мужских половых гормонов на фоне различных по силе и продолжительности стрессов и связанными с этими процессами изменениями в уровне АД. Были выбраны следующие виды стресса: «легкие», такие как иммобилизация в течении 10 мин и взятие животного в руки в течении 5 мин на протяжении двух недель; хронические стрессы – проживание в условиях высокой популяционной плотности (перенаселение) и в одиночестве (изоляция) на протяжении 4 месяцев; запредельные, сопровождающиеся развитием необратимых нарушений в организме, в частности, стрессиндуцированное язвенное кровотечение и геморрагический инфаркт мозга. Критерием адаптивных и резервных возможностей системы продукции и секреции мужских половых гормонов явилась концентрация общего тестостерона в крови, которую определяли иммуноферментным методом. С целью мониторинга уровня АД, животным вживляли полиэтиленовые катетеры и тестировали значения ср.АД на специальной установке для прямой регистрации сигналов кровяного давления. Число животных в группах и результаты исследования представлены в таблице 1. Каждая группа включала свой контроль в силу проведения экспериментов в разное время года. Контрольными животными служили крысы, не подвергающиеся стрессу и проживающие в обычных для них стандартных условия вивария. 40 Легкие стрессы, иммобилизация и взятие крыс в руки на протяжении двух недель, сопровождались кратковременными стресс-индуцированными гипертензивными реакциями, которые быстро нормализовались после прекращения воздействия (рисунок 3,4). У самок прессорные реакции на стресс были менее выраженными и менее продолжительными, чем у самцов, что согласуется с результатами многих других исследователей (СемячкинаГлушковская О.В., 2010, 2011, 2012; Reckelhof 2005). При этом, несмотря на половые различия в стресс-реактивности по показателям уровня ср.АД в обоих моделях стресса, значения тестостерона в крови не изменялись ни у самцов, ни у самок. Хронические стрессы на протяжении 4 месяцев, перенаселение и изоляция, приводили к постепенному формированию устойчиво высоких значений АД (ежемесячно брали по 10 животных из общей группы для мониторинга уровня ср.АД). У самцов гипертензивные значения АД устанавливались в более быстрые сроки и у большего числа особей по сравнению с самками (рисунок 5-8). Стресс-индуцированная гипертензия также была более выраженная у самцов, чем у самок, как в опытах по перенаселению, так и с изоляцией (таблицы 2,3). 41 Таблица 1 Эффекты различных видов стресса на уровень артериального давления и содержание в крови общего тестостерона у крыс разного пола Виды стресса Самцы Иммобилизация, n=11(♀), n=10(♂) Контроль, n=10(♀), n=10(♂) Взятие в руки, n=11(♀), n=10(♂) Контроль, n=9(♀), n=10(♂) Перенаселение, n=10(♀), n=10(♂) Изоляция, n=12(♀), n=12(♂) Контроль, n=10(♀), n=10(♂) Геморрагический инфаркт, n=10 Язвенное кровотечение, n=17 Контроль, n=10(♀), n=10(♂) Самки «Легкие» стрессы ср.АД, Уровень мм рт.ст. тестостерона, (максимальные нмоль/л значения) (сред. значения) 121±3 *† 3.87±0.09 ср.АД, мм рт.ст. (максимальные значения) 107±2 * Уровень тестостерона, нмоль/л (сред. значения) 0.39±0.04 105±3 3,89±0.05 98±2 0.35±0.03 125±4 *† 3.91±0.07 112±3 * 0.33±0.03 100±2 3,83±0.07 103±2 0.37±0.08 Хронические стрессы (через 4 месяца исследования) 170±6 *† 2,25±0.03 * 144±6 * 0.31±0.01 182±3 *† 2,00±0.02 * 160±7 * 0.35±0.02 95±2 3,78±0.02 97±1 0.30±0.01 90±6 * Запредельные стрессы 1,12±0.04 * 83±9 * 0,12±0.01 * 85±4 * 1,23±0.02 * 77±5 * 0,14±0.02 * 110±4 4.02±0.03 107±6 0.36±0.02 *-p<0.05 относительно контрольной группы; † - разница в ср.АД между самками и самцами; - снижение уровня тестостерона; 42 - нет изменений в уровне тестостерона Рисунок 3 – Изменения ср.АД (%) у самок ( ) и самцов ( ) в течение иммобилизационного стресса и после его отмены: * - p<0.05 относительно базальных значений; † - p<0.05 между самками и самцами Рисунок 4 – Изменения ср.АД (%) у самок ( ) и самцов ( ) в условиях стресса «взятие крыс в руки» и после его отмены: * - p<0.05 относительно базальных значений; † - p<0.05 между самками и самцами 43 3 10 II месяца I месяц 4 III месяца IV месяца Рисунок 5 - Соотношение числа гипертензивных самцов крыс нормальными ( ) и высокими ( с ) показателями среднего артериального давления через 1, 2, 3 и 4 месяца проживания в условиях высокой популяционной плотности 44 12 I месяц II месяца 10 10 IV месяца III месяца Рисунок 6 - Соотношение числа самцов крыс с нормальными ( высокими ( ) и ) показателями среднего артериального давления через 1, 2, 3 и 4 месяца проживания в условиях изоляции 45 10 10 I месяц II месяца III месяца IV месяца Рисунок 7 - Соотношение числа самок крыс с нормальными( высокими ( ) и ) показателями среднего артериального давления через 1, 2, 3 и 4 месяца проживания в условиях высокой популяционной плотности 46 12 11 I месяц II месяца III месяца IV месяца Рисунок 8 - Соотношение числа самок крыс с нормальными ( высокими ( ) и ) показателями среднего артериального давления через 1, 2, 3 и 4 месяца проживания в условиях изоляции Хроническое стрессирование крыс и развитие более выраженной гипертензии у самцов по сравнению с самками сопровождалось снижением уровня тестостерона в крови у мужских особей, но не у женских (таблица 4,5). Однако, снижение уровня тестостерона в крови у самцов происходило не параллельно с изменениями АД. Как видно из индивидуальных значений изменений ср.АД и тестостерона на протяжении 4 месяцев наблюдения, гипертензивные значения АД устанавливались в более ранние сроки (начиная со второго месяца экспериментов), в то время как 47 гипотестостеронемия развивалась только с третьего месяца наблюдения. При этом, ни у всех гипертензивных особей на втором и третьем месяце исследований выявлялись низкие значения тестостерона. Яркие результаты по стресс-индуцированному развитию артериальной гипертензии и связанному с этим процессом подавлением секреции тестостерона были получены спустя 4 месяца проживания животных в условиях перенаселения и изоляции. Поскольку нами не была выявлена четкая корреляция между стрессиндуцированными изменениями в уровне АД и тестостерона в крови на протяжении развития стресс-индуцированной артериальной гипертензии, мы предполагаем, что снижение секреции тестостерона в этих условиях является отражением общих процессов снижения адаптационных и резервных возможностей организма, но не прямых механизмов нарушения регуляции сосудистого тонуса. Для подтверждения данного предположения были проведены дальнейшие исследования с целью поиска ответа на вопрос, как меняется секреция тестостерона у самок и самцов крыс на фоне действия запредельных стрессов, приводящих к развитию «сосудистых катастроф», которые сопровождаются гипотензией. Для этого использовали модели стресс-индуцированного геморрагического инфаркта (Романова Т.В., 1989) и язвенного кровотечения (Патент РФ 2472231). Каждая группа, в том числе контрольная (здоровые нестрессированные крысы), включала по 10 животных для самок и самцов. Результаты исследования представлены в таблице №1. Развитие стрессиндуцированного кровотечения сопровождалось гипотензий как у самок, так и у самцов. Половые различия в гипотензивных реакциях на фоне стрессиндуцированного повреждения сосудов мозга и желудка не выявлялись. При этом у животных обоего пола независимо от типа кровотечения наблюдалось резкое снижение содержания тестостерона в крови. Так, уровень гормона был снижен в 3,5 раза у самцов и в 3 раза у самок как при развитии мозговых, так и желудочных геморрагий, индуцированных стрессом. 48 Таблица 2 Индивидуальные значения среднего артериального давления (мм рт.ст.) у самцов крыс на протяжении 4 месяцев проживания в условиях высокой популяционной плотности и изоляции Период исследования Контроль I месяц II месяц III месяц IV месяц Перенаселение Изоляция Перенаселение Изоляция Перенаселение Изоляция Перенаселение Изоляция n=10 n=12 n=10 n=12 n=10 n=12 n=10 n=12 105 101 107 118 145 128 143 142 166 103 99 104 127 148 129 144 144 168 101 105 102 132 153 137 148 166 177 98 96 102 101 156 137 148 172 181 95 92 102 104 109 141 151 178 187 93 99 94 102 103 145 153 180 187 93 106 93 106 102 106 162 187 189 92 102 92 98 100 109 165 192 190 90 93 90 96 98 102 169 102 191 83 89 90 98 97 102 178 108 193 (n=10) 87 93 102 109 86 91 106 105 Красным цветом отмечен высокий уровень ср.АД 49 Таблица 3 Индивидуальные значения среднего артериального давления (мм рт.ст.) у самок крыс на протяжении 4 месяцев проживания в условиях высокой популяционной плотности и изоляции Период исследования Контроль I месяц II месяц III месяц IV месяц Перенаселение Изоляция Перенаселение Изоляция Перенаселение Изоляция Перенаселение Изоляция n=10 n=12 n=10 n=12 n=10 n=12 n=10 n=12 103 100 109 103 120 124 129 159 177 101 102 100 100 105 126 120 150 170 98 107 100 101 106 141 118 157 171 95 100 98 105 105 110 117 131 169 93 98 100 104 106 105 108 127 158 90 96 95 100 100 100 101 108 148 100 93 98 106 101 108 101 108 128 100 92 95 100 102 109 100 109 100 101 95 90 96 95 100 105 102 107 89 84 96 95 97 104 107 108 108 (n=10) 92 93 97 97 90 91 95 97 Красным цветом отмечен высокий уровень ср.АД 50 Таблица 4 Индивидуальные значения уровня тестостерона (нмоль/л) в крови у самцов крыс на протяжении 4 месяцев проживания в условиях высокой популяционной плотности и изоляции Период исследования Контроль I месяц II месяц III месяц IV месяц Перенаселение Изоляция Перенаселение Изоляция Перенаселение Изоляция Перенаселение Изоляция n=10 n=12 n=10 n=12 n=10 n=12 n=10 n=12 3.83 3.15 4.01 3.02 3.55 2.25 2.62 2.52 2.07 3.78 3.04 3.87 3.00 3.71 2.27 2.78 2.14 1.82 3.84 3.06 3.99 3.06 3.92 2.19 2.60 2.05 1.87 3.92 3.78 3.45 3.17 3.56 3.19 2.74 2.43 2.03 3.90 3.94 4.22 3.02 3.45 3.09 2.76 2.45 2.14 3.57 3.97 4.00 3.15 3.78 3.07 2.45 1.85 2.12 3.70 3.08 3.91 3.00 3.33 3.02 3.93 2.46 2.00 3.77 3.12 3.23 3.02 3.24 3.12 3.56 2.41 2.10 3.81 3.16 3.21 3.15 3.12 3.18 3.12 2.42 2.05 3.65 3.06 4.02 3.01 3.09 3.03 3.78 2.02 1.91 (n=10) 4.00 3.21 3.96 2.05 3.67 3.11 3.71 2.00 Красным цветом отмечен низкий уровень тестостерона 51 Таблица 5 Индивидуальные значения уровня тестостерона (нмоль/л) в крови у самок крыс на протяжении 4 месяцев проживания в условиях высокой популяционной плотности и изоляции Период исследования Контроль I месяц II месяц III месяц IV месяц Перенаселение Изоляция Перенаселение Изоляция Перенаселение Изоляция Перенаселение Изоляция n=10 n=12 n=10 n=12 n=10 n=12 n=10 n=12 0.30 0.27 0.34 0.31 0.20 0.35 0.27 0.3 0.21 0.27 0.24 0.28 0.21 0.25 0.32 0.22 0.32 0.42 0.23 0.24 0.22 0.21 0.38 0.21 0.29 0.33 0.45 0.32 0.20 0.25 0.28 0.40 0.29 0.24 0.29 0.37 0.34 0.21 0.33 0.24 0.23 0.27 0.37 0.31 0.38 0.29 0.19 0.27 0.33 0.28 0.38 0.35 0.3 0.35 0.30 0.22 0.21 0.30 0.24 0.40 0.39 0.31 0.40 0.31 0.22 0.30 0.25 0.35 0.41 0.42 0.29 0.38 0.33 0.24 0.19 0.30 0.38 0.33 0.32 0.31 0.37 0.35 0.16 0.29 0.32 0.41 0.34 0.44 0.33 0.35 (n=10) 0.35 0.19 0.41 0.24 0.31 0.26 0.21 0.28 52 В целом, полученные результаты позволяют заключить, что «легкие» стрессы на протяжении месяца не вызывали устойчивого повышения АД и каких-либо изменений в содержании тестостерона в крови ни у самцов, ни у самок. Хронические социальные стрессы продолжительностью 4 месяца сопровождались развитием АГ у животных обоего пола, но снижением уровня тестостерона у самцов, но не у самок. Отметим, что значения АД были значительно выше у самцов по сравнению с самками. Запредельные стрессы, провоцирующие развитие «сосудистых катастроф» (язвенное кровотечение и геморрагический инфаркт мозга) на фоне резкого снижения АД, вызывали подавление секреции тестостерона как у самцов, так и у самок, что отражалось на снижении уровня гормона в крови у крыс обоего пола. Снижение секреции тестостерона в условиях хронических стрессов отмечается также другими авторами в клинических и экспериментальных работах. Так, известно, что сильные депрессии, вызванные психоэмоциональными проблемами, сопровождаются снижение уровня гормона в крови как у мужчин, так и у женщин (Francis, 1981; Kunstmann, 2004). Однако, эмоциональные стрессы вызывают более выраженные изменения со стороны продукции андрогенов в мужском организме, чем в женском (King et al., 2005). При этом, подавление секреторной функции половых желез у мужчин отмечается не только в условиях длительного воздействия стрессов, но при острых сильных эмоциональных переживаниях (Chatterton, 1997). Анализ индивидуальных значений уровня АД и тестостерона в крови у самцов на протяжении всего срока развития стресс-индуцированной артериальной гипертензии не выявил прямой корреляции между процессами установления гипертензивных значений АД и снижения секреции гормона на ранних сроках развития болезни, однако, яркие результаты были получены на фоне снижения адаптивных возможностей организма при прогрессировании патологии. 53 Полученные данные позволяют заключить, что андрогены имеют отношение к процессам стресс-устойчивости сосудов, но не уровню АД как таковому. Их снижение в условиях хронических (у самцов) и, особенно, запредельных стрессов (у самцов и самок) позволяет предположить о том, что андрогены выполняют защитную функцию в отношении сосудистого гомеостаза. Защитные эффекты мужских половых гормонов показаны в клинических наблюдениях при лечении миокардиальную ишемию у мужчин с помощью применением тестостерона как синтетических его аналогов pes оs в больших дозах (Wu, 1993), так и подкожно (English, 2000б), а также при экстренной помощи с использованием внутривенных и внутрикоронарных инъекций (Jaffe, 1977, Webb, 1999а, 1999б). В исследованиях также выявлено, что экспериментальных длительное введение дегидроэпиандростерона повышает устойчивость к развитию атеросклероза у кроликов (Gordon, 1988; Eich, 1993; Christopher-Hennings, 1995). 54 3.2 Изменение экспрессии андрогенных рецепторов в мозге и висцеральных органах на фоне снижения секреции тестостерона в условиях стресс-индуцированного повышения артериального давления В предыдущей главе 3.1. было показано, что уменьшение секреции тестостерона проявляется только у самцов, но не у самок на фоне снижения резервных возможностей организма при развитии стресс-индуцированной АГ. На следующем этапе работ был поставлен вопрос, меняется ли экспрессия андрогенных рецепторов при снижении содержания тестостерона в крови у гипертензивных самцов. Для ответа на поставленный вопрос были проведены исследования по изучению экспрессии андрогенных рецепторов в мозге и периферических органах у крыс со стресс-индуцированной АГ и низким содержанием тестостерона в крови. Эксперименты были выполнены на 17 гипертензивных самцах, у которых устойчиво высокий уровень АД развивался при их длительном (4 месяца) проживании в условиях высокой популяционной плотности. Контролем служили 10 нормотензивных интактных самцов. Результаты исследования показали, что у гипертензивных особей с низким содержанием тестостерона в крови отмечалась сниженная экспрессия андрогенных рецепторов в тканях мозга, преимущественно в области церебральных сосудов (Рисунок 9-11). Аналогичные изменения были обнаружены в семенниках, где наблюдалось снижение плотности ядерных андрогенных рецепторов, что свидетельствует о подавлении регуляторных возможностей андрогенов в отношении геномных процессов синтеза мужских половых (Рисунок 12-14). 55 гормонов А Б Рисунок 9 – Экспрессия андрогенных рецепторов в тканях мозга у нормотензивного (А) и гипертензивного (Б) самца крыс (иммуногистохимический метод). Экспрессия андрогенных рецепторов показана коричневым цветом. 56 А Б Рисунок 10 – Экспрессия андрогенных рецепторов в сосудах мозга у нормотензивного (А) и гипертензивного (Б) самца крыс (иммуногистохимический метод). Экспрессия андрогенных рецепторов показана коричневым цветом. Увеличение х 400. А Б Рисунок 11 – Экспрессия андрогенных рецепторов в тканях мозга у нормотензивного (А) и гипертензивного (иммунофлуоресцетный метод). (Б) самца крыс Экспрессия андрогенных рецепторов показана зеленым цветом. Увеличение х 630 57 А Б Рисунок 12 – Экспрессия андрогенных рецепторов в семенниках у нормотензивного (А) и гипертензивного (Б) самца крыс (иммуногистохимический метод). Экспрессия андрогенных рецепторов показана коричневым цветом. 58 Рисунок 13 – Экспрессия андрогенных рецепторов в семенниках у нормотензивного (слева) и гипертензивного (справа) самца крыс (иммунофлуоресцентный метод). Экспрессия андрогенных рецепторов показана зеленым цветом. Верхняя панель - увеличение х 630, нижняя панель увеличение х 400 59 А Б Рисунок 14 – Экспрессия андрогенных рецепторов в семенниках (ядерная локализация) у нормотензивного (А) и гипертензивного (Б) самца крыс (иммуногистохимический метод). Экспрессия андрогенных рецепторов показана коричневым цветом. 60 В других периферических органах, таких как сердце (в коронарных сосудах), почки и надпочечники, активно вовлекаемые в регуляции уровня АД и стрессорную реакцию, не было обнаружено каких-либо изменений в экспрессии андрогенных рецепторов между контрольной и экспериментальной группами (Рисунок 15-17). Рисунок 15 – Экспрессия андрогенных рецепторов в миокарде у нормотензивного (слева) и гипертензивного (справа) самца Иммунофлуоресцентный метод, экспрессия андрогенных показана зеленым цветом. Увеличение х 400 61 крыс. рецепторов Рисунок 16 – нормотензивных Экспрессия (слева) и андрогенных гипертензивных рецепторов в почке (справа) самцов Иммунофлуоресцентный метод, экспрессия андрогенных у крыс. рецепторов показана зеленым цветом. Увеличение х 400 Рисунок 17 – Экспрессия андрогенных рецепторов в надпочечниках у нормотензивного (слева) и гипертензивного (справа) самцов Иммунофлуоресцентный метод, экспрессия андрогенных показана зеленым цветом. Увеличение х 400 62 крыс. рецепторов Важная роль андрогенов в развитии АГ показана во многих исследованиях, большинство из которых рассматривает мужские половые гормоны как прогипертензивный фактор (Blesson, 2014; Dubey, 2002; Orshal, 2004; Reckelhoff, 2001, 2005; Khalil, 2005). Однако, подавляющее число работ в этой области построены по стандартному алгоритму, когда создается искусственный дефицит андрогенов или блокируется доступ рецепторов к их воздействию. На этом фоне оценивается степень развития АГ. В частности, показано, что кастрация облегчает формирование АГ (Iams, 1977; Masubuchi, 1982; Cambotti, 1984; Malyusz, 1985; Share, 1988; Ganten, 1989; Chen, 1991; Rowland, 1992; Crofton, 1993; Reckelhoff, 2000). Аналогичные данные получены в опытах с хронической блокадой андрогенных рецепторов (Reckelhoff, 1999). Длительное введение тестостерона в физиологических дозах кастрированным самцам с генетической формой АГ сопровождается развитием у них более тяжелой АГ, чем в естественных условиях (Chen, 1991; Reckelhoff, 1998). Однако, не существует экспериментальных данных, объясняющих клинический факт гипотестостеронемии у гипертензивных мужчин (Khaw, 1988; Hughes, 1989; Jaffe, 1996; Fogari, 2002; Ishikura, 2008). В известной нам литературе отсутствуют данные относительного того, как изменяется экспрессия андрогенных рецепторов при формировании гипертензивного статуса. Существуют результаты, в которых показано на спонтанно- гипертензивных крысах, что блокада андрогенных рецепторов флутамидом снижает уровень АД у животных, однако, употребление финастерида не сопровождается подобными изменениями. Авторы сделали вывод о том, что конверсия тестостерона в дигидротестостерон не изменяется в этих условиях (Reckelhoff, 1999). В целом, результаты двух глав 3.1 и 3.2 позволяют заключить о том, что индуцированная стрессом АГ сопровождается снижением секреции тестостерона и подавлением экспрессии андрогенных рецепторов в мозге и 63 семенниках, что возможно, является одним из механизмов снижения стрессустойчивости на уровне сосудистой системы. 64 3.3 Сравнение устойчивости к запредельному стрессу на фоне естественного и патологически низкого содержания тестостерона в крови у крыс В предыдущей главе 3.1. было показано, что уровень тестостерона в крови определяется силой и продолжительностью стресса. Чем более сильный стресс и чем дольше он воздействует на организм, тем более выражено подавляется продукция мужского гормона. Тот факт, что низкий уровень тестостерона сочетается с высокой смертностью от многих стресс-индуцированных заболеваний, таких как коронарные болезни, диабет, сердечная недостаточность (Araujo, 2011; Haring, 2010; Menke, 2010; Vikan, 2009; Tivesten, 2009; Szulc, 2009; Laughlin, 2008; Khaw, 2007; Araujo, 2007; Shores, 2006; Smith, 2005) говорит о том, что нормальное содержание андрогенов критически необходимо для поддержания гомеостаза и сохранения резервных возможностей организма. Было выдвинуто предположение о том, что мужские половые гормоны играют важную роль в сосудистой стресс-устойчивости. Для проверки данной гипотезы были проведены эксперимены на новорожденных (1-2 дня после рожденья) крысах (n=22) с естественно низким фоном тестостерона в крови и на половозрелых самцах крыс (n=15), у которых содержание гормона снижается в силу прогрессирования ренальной гипертензии (СемячкинаГлушковская О.В., 2011). Животных подвергали воздействию запредельного звукового стресса с целью индуцирования развития геморрагического инфаркта мозга (Патент РФ № 2505860, Романова Т.П., 1989). Через сутки после воздействия оценивали площадь геморрагий в мозге гистологическим методом и проводили сравнение уровня тестостерона в крови до и после эксперимента. Рассмотрим данные результатов, представленные в таблице 6. Базальные значения тестостерона в крови у новорожденных крыс существенно ниже, чем у половозрелых нормотензивных особей (1.94±0.04 нмоль/л против 65 4.02±0.03 нмоль/л, p<0.05). Наложение клипсы на левую ренальную артерию сопровождалось развитием устойчивого высоких значений АД, которые через два месяца после операции устанавливались на гипертензивном уровне (187±9 мм рт.ст. против 110±4 мм рт.ст., p<0.05). При этом концентрация тестостерона в крови снижалась в 2 раза. Таким образом, мы получили модель естественного и патологического низкого содержания тестостерона в крови у новорожденных и гипертензивных крыс, у которых низкий уровень гормона не отличался (1.94±0.04 нмоль/л против 2.07±0.05 нмоль/л, соответственно). У новорожденных особей низкий уровень тестостерона обусловлен неактивной половой функцией; у гипертензивных – за счет патологических процессов нарушения кровоснабжения органов и нарушения работы эндокринной функции в условиях чрезмерно высоких значений АД. Таблица 6 Уровень тестостерона в крови и площадь кровоизлияния в мозге на фоне стрессиндуцированного развития геморрагического инфаркта мозга у новорожденных и половозрелых крыс Исследуемые показатели Новорожденные крысы Контроль n=10 Уровень тестостерона в крови, нмоль/л 1.94±0.04 † Площадь кровоизлияний в тканях мозга, мм2 срАД, мм рт.ст. Половозрелые крысы Стрессированные Нормотензивные Гипертензивные Стрессированные n=10 n=10 n=25 n=10 1.87±0.07 4.02±0.03 2.07±0.05 * 1.05±0.09 *# 0.007±0.0004† 43±4 † 45±3 0.082±0.007 110±4 187±9 * 78±5 *# (n=6) p<0.05 относительно: * - контроля; † - половозрелых крыс; # - гипертензивной группы без стресса 66 Воздействие в течение 2-х часов звуковым стрессом сопровождалось развитием геморрагического инфаркта мозга у всех испытуемых животных. При этом у 6 из 10 гипертензивных особей, но не у новорожденных крыс отмечалось снижение уровня АД до уровня гипотензивных значений. Площадь кровоизлияний в мозге у половозрелых крыс была выше, чем у новорожденных животных (0.082±0.007 мм2 против 0.007±0.0004 мм2, p<0.05). Типичный пример, отражающий более выраженные геморрагические поражения мозга у половозрелых животных по сравнению с новорожденными особями представлен на рисунке 18. Рисунок 18 – Типичный пример результатов гистологического исследования площади церебральных кровоизлияний при развитии стресс- индуцированного геморрагического инфаркта мозга у половозрелой (слева) и новорожденной (справа) крыс Таким образом, в опытах на новорожденных крысах, у которых неактивна половая функция и наблюдаются низкие значения тестостерона, было показано, что, несмотря на эти факты, их устойчивость к развитию стресс-индуцированных «сосудистых катастроф» в мозге выше, чем у половозрелых гипертензивных особей, имеющих также низкие значения гормона. При этом у них не наблюдается динамики в снижении секреции 67 тестостерона на фоне стресса, которая отмечается у взрослых животных (1.87±0.07 против 1.94±0.04 для новорожденных; 1.05±0.09 против 2.07±0.05, p<0.05 для взрослых крыс). Результаты данной серии экспериментов при моделировании ситуации низкого содержания тестостерона в естественных условиях и при сосудистой патологии (АГ) не выявили прямой зависимости между гипотестостеронемией и сосудистой устойчивостью к стрессу. Однако, нами была установлена закономерность о подавлении секреции тестостерона в зависимости от силы и длительности стресса (глава 3.1), а также при стресс-индицированному хроническом повышении уровня АД (главы 3.1, 3.3). Принимая во внимание эти факты можно заключить, что андрогены не играют прямой роли в поддержании сосудистого гомеостаза, а подключаются к его регуляции как второстепенные запасные механизмы при снижении адаптивных возможностей организма. На этом основании была выдвинута гипотеза о том, что андрогензависимые механизмы регуляции сосудистой стресс-устойчивости реализуются не как прямонаправленные процессы регуляции сосудистого тонуса и АД, а опосредованно через модулирование других регуляторных активности факторов, непосредственно сосудистого гомеостаза. 68 вовлекаемых в поддержание 3.4 Ограничивающие эффекты андрогенов в отношении сосудистой стресс-реактивности и их механизмы 3.4.1 Изучение холинергических механизмов регуляции сосудистой стресс-реактивности в условиях дефицита мужских половых гормонов и блокады андрогенных рецепторов На основании полученных экспериментальных данных, представленных в главах 3.1-3.3, нами была выдвинута гипотеза о том, что андроген-зависимые механизмы регуляции сосудистой стресс-устойчивости реализуются как запасные звенья поддержания сосудистого гомеостаза. Проявление этих механизмов происходит при снижении адаптивных и резервных возможностей организма через модуляцию активности факторов, принимающих непосредственное участие в регуляции стресс-реактивности и стрессустойчивости. Существуют работы, в которых показано, что андрогены оказывают стимулирующее влияние на активность КАТФ-каналов, которые релаксируют сосуды (Семячкина-Глушковская О.В., 2012). В условиях развития АГ (при ее устойчивых и злокачественных формах) снижается уровень тестостерона в крови, что сопровождается подавлением активирующей функции андрогенов в отношении КАТФ-каналов. Это в свою очередь влечет за собой нарушения эндотелиальной функции (синтеза оксида азота). Поскольку миогенная и эндотелиальная релаксация сосудов находится под контролем холинергической нервной системы, в данном исследовании мы изучали влияние кастрации и введения флутамида, блокирующего андрогенные рецепторы, на сосудистую стресс-реактивность в условиях блокады холинергических влияний атропином. В качестве модели стресса использовали широко применяемую в наших предыдущих исследованиях 2-х часовую иммобилизацию животных на спине (Semyachkina-Glushkovskaya O. 2011, 2010, 2008, 2006). 69 Атропин вводили в покое и на фоне стресса следующим группам животных: 1) интактные самцы (n=10); 2) кастрированные самцы (n=15); 3) самцы, получающие флутамид (n=12). У интактных самцов уровень ср.АД не изменялся на фоне введения атропина, что согласуется с литературными данными, указывающими об отсутствии сосудистых эффектов препарата в норме. Дефицит мужских половых гормонов, вызванный кастрацией самцов, а также блокада андрогенных рецепторов путем введения флутамида не сопровождались изменениями базального уровня ср.АД (107±2 мм рт.ст. против 104±3 мм рт.ст. для кастрированных крыс и 109±4 мм рт.ст. против 105±4 мм рт.ст. для группы с флутамидом). Однако, гонадэктомия самцов и блокада андрогенных рецепторов сопровождалась прессорными эффектами атропина. Действительно, у кастрированных самцов атропинизация приводила к длительному повышению уровня ср.АД, которое регистрировалось на протяжении 2-х часов наблюдения (Рисунок 19). Блокада андрогенных рецепторов сопровождалась аналогичными изменениями в уровне ср.АД на фоне введения атропина. Повышенные значения ср.АД отмечались на протяжении 60 мин эксперимента (Рисунок 20). 70 Рисунок 19 – Влияние атропина на уровень cр.АД (мм рт.ст. / %) в норме ( ) и на фоне дефицита андрогенов ( ): * - р<0,05 относительно исходного уровня; † - р<0,05 относительно интактных животных. 71 Рисунок 20 – Влияние атропина на уровень cр.АД (мм рт.ст / %) в норме ( ) и на фоне блокады андрогенных рецепторов ( ): * - р<0,05 относительно исходного уровня; † - р<0,05 относительно интактных животных. В условиях стресса, введение атропина интактным самцам не изменяло характер стрессорных реакция со стороны АД (рисунок 21). Так, уровень ср.АД повышался при стрессе с 105±2 мм рт.ст. до 125±4 мм рт.ст. (максимальные значения) у крыс без атропина и с 101±2 мм рт.ст. до 123±6 мм рт.ст. при введении препарата, что составило 19% (p<0.05) и 21% (p<0.05), соответственно. Длительность 72 стресс-индуцированных гипертензивных реакций также не отличалась до и после введения атропина интактным животным. Рисунок 21 – Сравнение стрессорной динамики ср.АД (мм рт.ст. / %) у интактных самцов без атропина ( ) и на фоне введения препарат ( ): * - р<0,05 относительно исходного уровня Кастрация животных и блокада андрогенных рецепторов не сопровождалась изменениями в стрессорной динамике ср.АД ни по амплитуде, ни по длительности (рисунок 22, 23). 73 Рисунок 22 - Сравнение стрессорной динамики ср.АД (мм рт.ст. / %) у интактных ( ) и кастрированных ( ) самцов. * - р<0,05 относительно исходного уровня 74 Рисунок 23 - Стрессорная динамика ср.АД в норме ( андрогенных рецепторов ( ) и на фоне блокады ) у самцов крыс: * - р<0,05 относительно исходного уровня У кастрированных самцов атропин, не изменяя интенсивность, существенно пролонгировал прессорные эффекты стресса (Рисунок 24). Действительно, если у кастрированных самцов до введения атропина повышенные значения ср.АД наблюдались только в первые 10 мин воздействия, то на фоне его введения - на всем протяжении стресса (60 мин) и в течение 20 мин после его отмены. 75 Блокада андрогенных рецепторов сопровождалась повышением амплитуды и продолжительности прессорных реакций при стрессе на фоне введения атропина (Рисунок 25). Рисунок 24 – Сравнение стрессорной динамики ср.АД (мм рт.ст. / %) у кастрированных самцов до ( ) и после ( ) введения атропина. * - р<0,05 относительно исходного уровня; † - р<0,05 между группами 76 Рисунок 25 – Сравнение стрессорной динамики ср.АД (мм рт.ст. / %) у самцов на фоне блокады андрогенных рецепторов до ( ) и после ( ) введения атропина. * - р<0,05 относительно исходного уровня; † - р<0,05 эффект атропина. 77 Таким образом, в условиях дефицита андрогенов и андрогенных рецепторов проявляются сосудистые эффекты блокады атропина, которые не выявляются в норме. В покое и при стрессе атропин у кастрированных самцов и у особей, принимающих флутамид, вызывает вазоконстрикцию, повышая сосудистую стресс-реактивность по длительности (кастрация) и по амплитуде и длительности (флутамид). Эти данные дают основание судить об «ограничивающих» эффектах андрогенов в отношении сосудистой стресс-реактивности через опосредованные влияния холинергической системы. Известно, что холинергическая система оказывает протективные эффекты по отношению к кардиоваскулярной устойчивости к стрессу (Ульянинский, 1994: Судаков, 1998; Горбунова, 2000), Во исследованиях на людях установлена зависимость от многих преобладания холинергических влияний на ССС и ее устойчивостью к эмоциональным стрессам (Хорева, 1988; Карлов, 1988). Преобладание парасимпатических влияний на работу сердца облегчает адаптацию системы кровообращения к психоэмоциональным нагрузкам у детей (Гавриков, 1990). Хайдарлиу С.Х. и соав. (1987) также отмечают, что в условиях хронического стресса умеренное усиление парасимпатической активности в сердце повышает стрессустойчивость ССС. Блуждающие нервы не только способны повышать пороги возникновения фибрилляции желудочков, но и препятствуют увеличению содержания катехоламинов и развитию структурных повреждений в миокарде при эмоциональном стрессе (Смирнов, 1967). По данным Kent et al. (1973) в условиях потенциальной возможности возникновения желудочковой фибрилляции при миокардиальной ишемии активация холинергической системы повышает электрическую стабильность сердца. В ряде работ продемонстрирована роль парасимпатических кардиотропных влияний в стабилизации уровня АД у крыс посредством влияния холинергических нейронов на чувствительность барорецепторов (Du, 1994, Голубинская, 1999). 78 Mezzacappa et al. (2001) отмечает, что отмена стрессорного воздействия сопровождается повышением вагальной модуляции кардиоваскулярной системы, а снижение активности холинергических влияний на ССС в период восстановления после стресса может являться причиной появления сердечнососудистых заболеваний. Таким образом, опосредованно через модуляцию активности холинергических влияний на ССС андрогены могут регулировать сосудистый гомеостаз во время стресса и расширять адаптационные возможности ССС. 79 3.4.2 Влияние дефицита андрогенов на адренергическую гормональную активацию в условиях стресса на фоне нормального и патологически высокого уровня артериального давления В главе 3.4.1. было показано, что андрогены ограничивают прессорные реакции в условиях стресса посредством влияния на холинергические механизмы управления АД. Поскольку сосудистый тонус регулируется вегетативной нервной системой, где адренергическим влияниям отводится ведущая роль, на следующем этапе экспериментов был поставлен вопрос, оказывают ли они какие-либо эффекты на адренергические механизмы управления стрессорной динамикой АД. С этой целью было изучено, как влияет искусственный дефицит андрогенов, вызванный путем гонадоэктомии, и естественный, сопровождающий развитие стресс-индуцированной и ренальной АГ, на стрессорную активацию гормонального звена адренергической системы (уровень адреналина в крови). Концентрацию адреналина в крови изучали с помощью иммуноферментного метода. В качестве стресса исследовали модель 2-х часовой иммобилизации животных. В эксперимент животных брали через 10 дней после кастрации (n=10); по окончанию 4 месяцев хронического стресса (перенаселение), когда устанавливались устойчиво высокие уровни АД (n=14); по истечению 2 месяцев наложения клипсы на ренальную артерию, когда отмечалась ярко выраженная АГ (n=10). Результаты исследований показали, что кастрация нормотензивных самцов не оказывала влияний на базальное содержание адреналина в крови (Таблица 7). Так, базальные значения адреналина в крови не различались между кастрированными и интактными самцами. Иммобилизация интактных самцов в течение 2-х часов сопровождалась повышением уровня адреналина в крови на 77% (p<0.05); у кастрированных – на 82% (p<0.05). Таким образом, дефицит андрогенов не оказывал влияний на интенсивность стрессорной активации адреналового ответа. Полученные данные позволяют сделать вывод 80 об отсутствии модулирующих влияний андрогенов на базальную и стрессорну секрецию адреналина в условиях нормы. Таблица 7 Содержание адреналина в крови у нормотензивных и гипертензивных крыс в покое и при стрессе в условиях тестостеронемии Нормотензивные Гипертензивные Гипертензивные самцы самцы самцы (стресс- (ренальная АГ) индуцированная АГ) Интактные Покой Стресс 776±19 1377±18 * животные Дефицит 762±22 андрогенов (гонадэктомия) 1389±20 * Покой Стресс Покой Стресс 765±25 1593±18 *† 737±27 1503±22 *† (дефицит (дефицит андрогенов андрогенов на фоне на фоне развития АГ) развития АГ) p<0.05 относительно: * - базальных значений; † - нормотензивных крыс В условиях патологии при развитии АГ разного генеза повышалось АД и снижалось содержание тестостерона в крови (ср.АД - 172±11 мм рт.ст. для стресс-индуцированной АГ (n=23) и 187±15 мм рт.ст. для ренальной АГ (n=25); тестостерон - 2.25±0.03 нмоль/л и 2.31±0.05 нмоль/л, соответственно). Контрольные значения (n=10) для срАД - 110±0.4 мм рт.ст. и уровень тестостерона в крови - 4.02±0.03 нмоль/л. Развитие АГ различного генеза не сопровождалось изменениями в базальном уровне адреналина в крови, несмотря на высокие значения ср.АД. Значения адреналина в плазме крови у гипертензивных животных были в пределах нормы (Таблица 7). Однако, в условиях стресса содержание адреналина резко увеличивалось по сравнению с интактными стрессированными самцами. Так, уровень адреналина у гипертензивных самцов увеличивался на 108% (p<0.05) – стресс-индуцированная АГ и на 103% (p<0.05) – ренальная АГ, что на 31% и 26% было больше, чем нормотензивных кастрированных самцов, соответственно. 81 у Данные результаты позволяют заключить, что андрогены сдерживают интенсивность адреналового ответа на стресс при патологическом повышении уровня АД. Полученные результаты подтверждают результаты других экспериментальных работ, в которых выявлены тестостерон-зависимые эффекты в отношении модуляции синтеза катехоламинов надпочечниками (Kumai, 1995), высвобождения нейропептида У из окончаний симпатических нервов, (Zukowska-Grojec, 1995) тирозингидроксилазы (Kumai, 1995, 1995а). 82 и регуляция активности 3.4.3 Влияние кастрации на активацию сигнальных молекул стресса (бета-аррестина-1) при различных состояниях организма В публикации Nature за 2001 год было показано, что хроническое повышение секреции адреналина при стрессе ведет к мутагенным повреждениям клеток и необратимым последствиям в отношении развития сосудистых заболеваний (Hara, 2011). Отражением данных процессов является гиперэкспрессия белков семейства бета-аррестина, которые выполняют роль ко-факторов в процессах трансформации нервного импульса при возбуждении адренорецепторов в активацию вторичных мессенджеров и фосфорилизацию специфических белков. Показано, что фармакологическая модуляция системы G-белка и бета-аррестина-1 может существенно повысить стресс- устойчивость клеток различных тканей при формировании многих патологий, включая метастатическую активность на фоне прогрессирования злокачественных опухолей, где прорастание сосудов в пораженную ткань и повышение ее микроциркуляции играет ключевую роль (Hara, 2013; Engineer, 2013; Powe, 2011). Интересно отметить, что развитие злокачественных изменений в семенниках сопровождаются резким снижением секреции андрогенов и значительным повышением экспрессии бета-аррестина-1 (Zhang, 2011). На основании этих данных была поставлена задача определить роль андрогенов в регуляции молекулярных механизмов стрессорного управления сосудами на основе изучения продукции бета-аррестина-1 в крови в условиях развития различных форм АГ. Для этого изучали как влияет дефицит андрогенов на базальные и стрессорные уровни бета-аррестина-1 в плазме у крыс, подвергнутых гонадэктомии (n=17), на фоне естественного снижения уровня тестостерона при прогрессировании стресс-индуцированной АГ (n=20) и ренальной АГ (n=23). 83 Бета-аррестин-1 определяли иммуноферментным методом. В качестве стресса применяли модель 2-х часовой иммобилизации. Кастрация вызывала снижение содержания тестостерона в крови на 69% (p<0.05), развитие АГ, индуцированное стрессом и окклюзией ренальной артерии, также сопровождалось подавление секреции гормона на 38% (p<0.05) и 45% (p<0.05), соответственно (4.51±0.06 нмоль/л в норме; 1.37±0.09 нмоль/л у кастрированных самцов; 2.82±0.05 нмоль/л у крыс со стресс- индуцированной АГ; 2.48±0.04 нмоль/л у крыс с ренальной АГ). Таблица 8 Базальные и стрессорные значения бета-арретина-1 в крови в норме и на фоне дефицита андрогенов у крыс Покой Стресс Норма Интактные здоровые 0.33±0.07 0.41±0.08 * животные Дефицит андрогенов Кастрация 0.35±0.05 0.54±0.07 * Стресс-индуцированная АГ 0.34±0.03 0.67±0.07 * Ренальная АГ 0.31±0.06 0.58±0.03 * p<0.05 относительно: * - базальных значений Базальные значения бета-аррестина-1 не различались между самцами с нормальным фоном андрогенов и в группах с дефицитом мужских половых гормонов (Таблица 8). Однако, стрессорная динамика в продукции бетааррестина-1 существенно различалась между нормой и состоянием дефицита андрогенов (Рис. 26).. Так, если в норме секреция бета-аррестина-1 увеличивалась на 24% (p<0.05), то на фоне дефицита андрогенов – на 54% (p<0.05) в группе с кастрацией, на 97% (p<0.05) в группе со стрессиндуцированной АГ и на 87% (p<0.05) в группе с ренальной АГ. 84 Рисунок 26 – Базальные и стрессорные значения бета-аррестина-1 в крови в норме и на фоне дефицита андрогенов у крыс: * - p<0.05 относительно базальных значений Таким образом, в условиях дефицита мужских половых гормонов стрессорный ответ со стороны активации молекулярных механизмов регуляции сосудистой стресс-реактивности, таких как синтез бета-аррестина1, становится высоким, по интенсивности существенно превышающим таковой в норме. Снижение уровня тестостерона влечет за собой чрезмерную активацию процессов адренергического «доступа» к сосудам при стрессе за счет повышенного синтеза ко-фактора (бета-аррестина- 1), координирующего клеточные процессы фосфорилирования специфических белков при стимуляции бета-адренорецепторов адреналином. 85 3.5 Оценка эффективности фармакологической коррекции низкого уровня тестостерона в отношении устойчивости к развитию стрессиндуцированного инфаркта мозга у гипертензивных крыс Как было показано в главе 3.1 подавление секреции тестостерона сопровождает процессы развития АГ и наиболее ярко проявляется при стрессиндуцированных сосудистых катастрофах, таких как мозговые и язвенные кровотечения. Целью данного эксперимента был поиск ответа на вопрос, возможно ли гормон-заместительной терапией, поднимая уровень тестостерона в крови фармакологическим путем, повысить сосудистую стресс-устойчивость на примере развития геморрагического инфаркта мозга у гипертензивных крыс. Для этого, вызывали развитие ренальной АГ у самцов крыс (n=20) и после достижения устойчиво высоких показателей АД по истечении 2-х месяцев после окклюзии ренальной артерии половине крыс (n=10) вводили однократно Сустанон-250 (разведенный в стерильном оливковом масле) в дозе 10 мг/кг, внутримышечно двукратно с перерывом в одну неделю. По истечению 14 дней после введения сустанона проводили исследования тестостерона в крови и определяли влияние сустанона на диаметр и скорость потока крови в различном типе сосудах (сагиттальный синус, сонная артерия, ренальная артерия, а также мозговые и брыжеечные артериолы) с помощью коммерческого оптического когерентного томографа, совмещенного с допплеровской системой и полнопольной лазерной спеклвизуализацией сосудов. Для мозговых и брыжеечных артериол считали среднее значение измеряемых показателей. Далее всех гипертензивных крыс, получающих и не получающих сустанон, подвергали воздействию сильного звукового стресса (Романова, 1989) с целью изучения их устойчивости к развитию геморрагического инфаркта мозга. Результаты данных исследований следующие. Введение сустанона 86 сопровождалось повышением уровня тестостерона в крови у всех гипертензивных крыс (4.73±0.3 против 2.17±0.05, p<0.05). Оптические исследования крупных и микро-сосудов мозга и на периферии выявили различия между нормотензивными и гипертензивными особями только в диаметре и скорости кровотока сагиттального синуса (Таблица 9). Диаметр данного сосуда был увеличен у гипертензивных крыс на фоне снижения скорости кровотока в нем, что свидетельствует о нарушении оттока венозной крови из мозга при развитии ренальной АГ. Однако, по церебральной и периферической микроциркуляции, а также оптическим показателям состояния сонной и ренальной артерии не были найдены различия в указанных группах крыс. Введение сустанона не оказывало эффектов на исследуемые сосуды ни у нормотензивных, ни у гипертензивных крыс, включая сагиттальный синус (Таблица 9). Патологические изменения в данном венозном сосуде мозга не были устранены путем повышения уровня тестостерона в крови у гипертензивных крыс. У всех гипертензивных крыс, получающих и не получающих сустанон, звуковой стресс вызывал повреждение мозговых сосудов в равной степени. Как число, так и площадь геморрагий у крыс не зависели от приема сустанона. Таким образом, результаты данных исследований свидетельствуют о том, что фармакологическое замещение уровня низкого уровня тестостерона, сопровождающего развитие АГ, не может быть использовано в качестве терапевтического подхода для решения проблем риска возникновения «сосудистых катастроф» в мозге на фоне прогрессирования болезни. 87 Таблица 9 Изменение диаметра и скорости потока крови в центральных периферических сосудах до и после введения сустанона Диаметр Скорость потока крови, мм/сек Сагиттальный Сонная Ренальная Брыжеечные Церебральные Сагиттальный Сонная Ренальная Брыжеечные Церебральные синус артерия артерия артериолы артериолы синус артерия артерия артериолы артериолы Нормотензивные крысы До введения сустанона Через 2 недели после введения сустанона 0.37±0.02 0.33±0.03 0.23±0.02 0.08±0.01 0.12±0.04 3.01±0.13 7.21±1.25 5.45±1.00 3.02±0.08 3.97±0.06 0.34±0.06 0.35±0.01 0.20±0.05 0.07±0.08 0.15±0.09 3.05±0.17 6.98±1.44 6.00±1.23 2.99±0.11 3.42±0.04 Гипертензивные крысы До введения сустанона Через 2 недели после введения сустанона 0.97±0.07 * 0.26±0.07 0.19±0.05 0.07±0.07 0.10±0.08 2.55±0.12 * 8.53±1.62 6.04±1.09 2.77±0.04 3.81±0.09 1.1±0.08 * 0.29±0.04 0.20±0.06 0.09±0.09 0.15±0.06 2.63±0.19 * 8.10±1.51 6.00±0.08 2.82±0.05 3.40±0.03 p<0.05 относительно: * - нормотензивных крыс 88 Отметим, что современные представления о гормон-заместительной терапии с применением синтетических аналогов тестостерона весьма противоречивые (Pongkan, 2015). Положительные результаты показаны в отношении коронарных заболеваний сердца (Basaria, 2010; Jaffe, 1977, Webb, 1999а, 1999б; Gordon, 1988; Eich, 1993; Christopher-Hennings, 1995). Однако, во многих других исследованиях на большом количестве пациентов с гипотестостеронемией либо не выявлены, либо показаны негативные эффекты применения синтетических аналогов тестостерона с целью повышения устойчивости к течению сосудистых патологий (Carol, 2005; Haddad, 2007; Fernandez-Barselles, 2010, Gluech, 2013). 89 ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЙ Целью данных исследований явилось изучение роли андрогенов в механизмах регуляции сосудистой стресс-реактивности и стресс- устойчивости, а также изучение системных и молекулярных механизмов, лежащих в основе этих процессов. Для достижения поставленной на первом этапе научных работ решались задача по изучению влияния различных видов стресса на процесс образование тестостерона, а также взаимосвязи между секрецией гормона и стресс-индуцированными изменениями в уровне АД. При использовании моделей легких физиологических, хронических и запредельных стрессов было установлено, что стрессы – хронические (для мужского организма) и запредельные (для мужского и женского организма) являются важными факторами в подавлении секреции тестостерона. При этом мужской организм по сравнению с женским более чувствителен к различным видам стресса по показаниям уровня тестостерона в крови. Постепенное умеренное снижение секреции тестостерона у них наблюдается уже в условиях хронических стрессов, в то время как в женском организме данные изменения отмечаются только при тяжелых стрессах. Важно отметить, что запредельные стрессы с одинаковой интенсивностью воздействуют на продукцию тестостерона как в мужском, так и в женском организме. В исследованиях на людях было также показано, что уровень тестостерона снижается при ежедневном воздействии психологического стресса, причем наиболее выраженно это происходит у мужчин по сравнению с женщинами среднего возраста (King, 2005). В опытах на хронически стрессированных крысах установлено, что снижение секреции мужских половых гормонов в этих условиях обусловлено в значительной степени подавлением активности различных форм нитроксидсинтазы, ксантиноксидазы и NADPH-диафоразы (Шерстюк, 2007). Интересно отметить, что в клинических исследованиях на пациентах с сильной депрессией и агрессией была обнаружена гипотестостеронемия, но, 90 при этом, сохранялись нормальные значения стрессорного гормона кортизола (Francis, 1981). Если в отношении хронического стресса и секрецией тестостерона существует достаточно много литературных данных, то острому стрессу в научной литературе уделяется меньше внимания. Существуют интересные данные по исследованию молодых мужчин, занимающихся прыжками с парашютом и на дельтаплане. В этих исследованиях показано, что резкое повышение активности адреналовой системы в условиях чрезмерного эмоционального стресса, который испытывают мужчины в момент выполнения сложных спортивных манипуляций, сопряжены с подавлением в течение нескольких дней секреции мужских половых гормонов (Chatterton, 1997). Результаты исследований также показали, что индуцированные стрессом изменения в уровне АД и содержании тестостерона в крови не сопряжены напрямую друг с другом. Подавление секреции тестостерона отмечается как при высоком уровне АД, например, в условиях хронического стресса, так и при низких показателях данного параметра, например, на фоне запредельного стресса, сопровождающего развитие «сосудистых катастроф», таких как геморрагический инфаркт мозга и язвенное кровотечение. Полученные данные позволили сделать вывод о том, что андрогены имеют отношение к процессам стресс-устойчивости сосудов, но не уровню АД как таковому. Их снижение в условиях хронических (у самцов) и, особенно, запредельных стрессов (у самцов и самок) позволяет предположить о том, что андрогены выполняют защитную функцию в отношении сосудистого гомеостаза. Кардиопротекторные эффекты мужских половых гормонов показаны и в других клинических и экспериментальных исследованиях. Так, применение синтетических аналогов тестостерона как pes оs в больших дозах (Wu, 1993), так и подкожно (English, 2000б), а также при экстренной помощи с использованием внутривенных и внутрикоронарных инъекций (Jaffe, 1977, 91 Webb, 1999а, 1999б) показано в качестве терапии при ишемических заболеваний сердца. В экспериментах на кроликах показано, что длительное введение дегидроэпиандростерона повышает устойчивость к развитию атеросклероза (Gordon, 1988; Eich, 1993; Christopher-Hennings, 1995). На модели хронического социального стресса и развития в этих условиях АГ показано, что прогрессирование стресс-индуцированных процессов тонуса нарушения регуляции сосудистого сопряжено с постепенным уменьшением секреции тестостерона и снижением экспрессии ядерных андрогенных рецепторов в семенниках и церебральных сосудах. Это свидетельствует о подавлении регуляторных возможностей андрогенов в отношении процессов синтеза мужских половых гормонов, а ассоциируется с низкой устойчивостью к развитию также геморрагического инфаркта мозга. Полученные результаты исследований согласуются с клиническими наблюдениями, свидетельствующими о гипотестостеронемии у гипертензивных мужчин (Khaw, 1988; Hughes, 1989; Jaffe, 1996; Fogari, 2002; Ishikura, 2008). Однако, существует достаточно много других данных, в которых показана важная роль андрогенов как прогипертензивных гормонов (Dubey, 2002; Orshal, 2004; Reckelhoff, 2001, 2005; Khalil, 2005). Подобные результаты построены на стандартных методах изучения вклада мужских половых гормонов в развитие АГ, которые основаны на создании искусственного дефицита андрогенов путем гонадэктомии и блокады доступа андрогенных рецепторов мужским гормонам за счет введения флутамида (Iams, 1977; Masubuchi, 1982; Cambotti, 1984; Malyusz, 1985; Share, 1988; Ganten, 1989; Chen, 1991; Rowland, 1992; Crofton, 1993; Reckelhoff, 1999, 2000). Следует отметить, что во всех подобных работах не рассматривали как изменяется эндогенное содержание мужских половых гормонов и как это отражается на экспрессии андрогенных рецепторов. Существуют результаты, 92 в которых показано на спонтанно-гипертензивных крысах, что конверсия тестостерона в дигидротестостерон не изменяется при формировании гипертензивного статуса (Reckelhoff, 1999). Поскольку в наших исследованиях было выявлено, что индуцированная стрессом АГ сопровождается снижением секреции тестостерона и подавлением экспрессии андрогенных рецепторов в мозге и семенниках, была выдвинута гипотеза что, андрогены могут играть важную роль в регуляции сосудистой стресс-устойчивости. Тот факт, что низкий уровень тестостерона сочетается с высокой смертностью от многих стресс-индуцированных заболеваний, таких как коронарные болезни, диабет, сердечная недостаточность (Araujo, 2011; Haring, 2010; Menke, 2010; Vikan, 2009; Tivesten, 2009; Szulc, 2009; Laughlin, 2008; Khaw, 2007; Araujo, 2007; Shores, 2006; Smith, 2005), говорит о том, что нормальное содержание андрогенов критически необходимо для поддержания гомеостаза и сохранения резервных возможностей организма. Для проверки выдвинутой гипотезы были проведены исследования, используя моделирование ситуации низкого содержания тестостерона в естественных условиях у новорожденных крыс (Kosyreva, 2014), при сосудистой патологии, такой как АГ (Семячкина-Глушковская, 2010) и изучения устойчивости в этих условиях к стресс-индуцированному развитию геморрагического инфаркта мозга. Результаты данной серии экспериментов не выявили прямой зависимости между гипотестостеронемией и устойчивостью церебральных сосудов к повреждающему воздействию стресса. Однако, нами была установлена закономерность о подавлении секреции тестостерона в зависимости от силы и длительности стресса, а также при стрессиндицированном хроническом повышении уровня АД. Принимая во внимание эти факты был сделан вывод, что андрогены не играют прямой роли в поддержании сосудистого гомеостаза, а подключаются к его регуляции как второстепенные запасные механизмы возможностей организма. 93 при снижении адаптивных На этом основании была выдвинута гипотеза о том, что андрогензависимые механизмы регуляции сосудистой стресс-устойчивости реализуются не как прямонаправленные процессы регуляции сосудистого тонуса и АД, а опосредованно через модулирование других регуляторных активности факторов, непосредственно вовлекаемых в поддержание сосудистого гомеостаза. Существуют данные, что андрогены оказывают влияние на активность КАТФ-каналов, стимулирующее которые релаксируют сосуды (Семячкина-Глушковская О.В., 2012). В условиях развития АГ (при ее устойчивых и злокачественных формах) снижается уровень тестостерона в крови, что сопровождается подавлением активирующей функции андрогенов в отношении КАТФ-каналов. Это в свою очередь влечет за собой нарушения эндотелиальной функции (синтеза оксида азота). Поскольку миогенная и эндотелиальная релаксация сосудов находится под контролем холинергической нервной системы, в данном исследовании изучали влияние кастрации и введения флутамида, блокирующего андрогенные рецепторы, на сосудистую стресс-реактивность в условиях подавления холинергических влияний атропином. Результаты исследования показали, что в условиях дефицита андрогенов и блокады андрогенных рецепторов проявляются сосудистые эффекты атропина, которые не выявляются в норме. В покое и при стрессе атропин у кастрированных самцов и у особей, принимающих флутамид, вызывает вазоконстрикцию, повышая сосудистую стресс-реактивность по длительности (кастрация) и по амплитуде и длительности (флутамид). Эти данные дают основание судить об «ограничивающих» эффектах андрогенов в отношении сосудистой стресс-реактивности через опосредованные влияния холинергической системы. Известно, что холинергическая система оказывает протективные эффекты по отношению к кардиоваскулярной устойчивости к стрессу (Ульянинский, 1994: Судаков, 1998; Горбунова, 2000), Так, 94 наиболее устойчивыми к действию экстремальных факторов, таких как недостаток кислорода и перегревание, являются мужчина-парасимпатотоники (Хорева, 1988). У парасимпатотоников по сравнению с симпатотониками отмечается меньшая степень напряжения регуляторных механизмов по показаниям сердечно-сосудистой деятельности (Карлов В.Н. с соав., 1988). Преобладание парасимпатических влияний на работу сердца облегчает адаптацию системы кровообращения к психоэмоциональным нагрузкам у детей (Гавриков, 1990). Хайдарлиу (1987) также отмечают, что в условиях хронического стресса умеренное усиление парасимпатической активности в сердце повышает стресс-устойчивость ССС. При исследовании на животных, устойчивых к эмоциональному стрессу, было установлено, что у них во время пролонгированного психоэмоционального воздействия преобладают парасимпатические влияния на сердце. У этих животных нарушения сердечного ритма отсутствуют за счет повышения порогов возникновения желудочковых аритмий. Преобладание парасимпатических влияний над симпатическими в условиях эмоционального стресса предотвращает у них не только развитие фибрилляций желудочков, но и появления ее предшественников – желудочковой экстрасистолии и желудочковой параксизмальной тахикардии. При внутривенном введении этим животным 0.5 мл 0.1% раствора атропина пороги возникновения желудочковых аритмий снижаются до исходных величин (Судаков К.В., 1987). Защитное действие блуждающих нервов на сердце отмечается и другими исследователями (Смирнов А.И., 1967). В этих работах показано, что блуждающие нервы не только способны повышать пороги возникновения фибрилляции желудочков, но и препятствуют увеличению содержания катехоламинов и развитию структурных повреждений в миокарде при эмоциональном стрессе. Не происходит и развития артериальной гипертензии. Аналогично этим данным Kent et al. (1973) установил, что в условиях потенциальной возможности возникновения желудочковой фибрилляции при 95 миокардиальной ишемии активация холинергической системы повышает электрическую стабильность сердца. В ряде работ продемонстрирована роль парасимпатических кардиотропных влияний в стабилизации уровня АД у крыс посредством влияния холинергических нейронов на чувствительность барорецепторов (Du, 1994, Голубинская, 1999). Mezzacappa et al. (2001) отмечает, что отмена стрессорного воздействия сопровождается повышением вагальной модуляции кардиоваскулярной системы, а снижение активности холинергических влияний на ССС в период восстановления после стресса может являться причиной появления сердечнососудистых заболеваний. Таким образом, опосредованно через модуляцию активности холинергических влияний на ССС андрогены могут регулировать сосудистый гомеостаз во время стресса и расширять адаптационные возможности. Адреналовая система одна из первых активируется при стрессе и играет ведущую роль в регуляции АД и сосудистого тонуса. Повышение адренергических влияний на ССС рассматривается как возможный механизм развития АГ (Lillie, 2006; Grassi, 2008, 2009). С целью исследований вклада андрогенов в управление адренергическими механизмами контроля за стрессорной динамикой АД далее изучали как влияет искусственный дефицит андрогенов, вызванный путем гонадоэктомии, и естественный, сопровождающий развитие стресс-индуцированной и ренальной АГ, на стрессорную активацию гормонального звена адренергической системы (уровень адреналина в крови). Результаты исследований показали, что развитие АГ различного генеза не сопровождалось изменениями в базальном уровне адреналина в крови по сравнению со здоровыми животными. Однако, в условиях стресса содержание адреналина резко увеличивалось по стрессированными самцами. 96 сравнению с интактными Полученные данные позволяют заключить, что андрогены сдерживают интенсивность адреналового ответа на стресс при патологическом повышении уровня АД. В ряде экспериментальных работ показано, что андрогены обладают прямыми эффектами в ношении модуляции синтеза катехоламинов надпочечниками (Kumai, 1995). Показаны тестостерон-зависимые процессы высвобождения нейропептида У из окончаний симпатических нервов, (Zukowska-Grojec, 1995) и регуляция активности тирозингидроксилазы (Kumai, 1995, 1995а). В литературе практически отсутствуют данные по изучению влияния тестостерона на вегетативные механизмы регуляции. Полагают, большинство центральных эффектов тестостерона реализуется рецепторы эстрогенов после превращения этого гормона в эстрадиол что через (de Ronde, 2003). Однако механизмы, участвующие в регуляции этого процесса, остаются до настоящего времени малоизученными. Бета-аррестин-1 является один из ко-факторов в процессах трансформации нервного импульса при возбуждении адренорецепторов в активацию вторичных мессенджеров и фосфорилизацию специфических белков. В открытиях последних лет было доказано, что хронические стрессы при повышенном образовании адреналина приводят к нарушению системы бета-адренорецепторы-бета-аррестин-1-G-белок, что лежит в основе развития стресс-индуцированных сосудистых заболеваний, включая АГ (Hara, 2011). На фоне снижения резервных возможностей организма, к примеру, при развитии онкологии в семенниках, резко снижается концентрация тестостерона, но возрастает продукция бета-ррестина-1 в данном органе (Zhang, 2011). На основании этих данных решалась задача по выявлению роли андрогенов в регуляции молекулярных механизмов стрессорного управления сосудами на основе изучения продукции бета-аррестина-1 в крови в условиях развития различны форм АГ. 97 Результаты исследования показали, что в условиях дефицита мужских половых гормонов стрессорная активация синтеза бета-арретисна-1 значительно увеличивается по интенсивности по сравнению с нормой. Эти данные позволяют заключить, что снижение уровня тестостерона влечет за собой чрезмерную активацию процессов адренергического «доступа» к сосудам при стрессе за счет повышенного синтеза ко-фактора (бетааррестина-1), координирующего клеточные процессы фосфорилирования специфических белков при стимуляции бета-адренорецепторов адреналином. Таким образом, эффекты андрогенов на ССС проявляются в виде сдерживания интенсивности сосудистой стресс-реактивности опосредовано через холинергические влияния, а также ограничения адреналового представительства на сосудах как со стороны гормонального звена (адреналин), так и сигнальных систем стресса (бета-аррестин-1). Поскольку в исследованиях было обнаружено подавление секреции тестостерона при развития АГ, и особенно, в условиях стресс- индуцированных сосудистых катастрофах, таких как мозговые и язвенные кровотечения, на следующем этапе решалась задача, возможно ли гормонзаместительной терапией, поднимая уровень тестостерона в крови фармакологическим путем, повысить сосудистую стресс-устойчивость на примере развития геморрагического инфаркта мозга у гипертензивных крыс. Результаты исследования показали, что фармакологические замещение низкого уровня тестостерона в крови на фоне хронически высокого уровня АД не улучшает течение гипертензии и не повышает устойчивость к стрессиндуцированному повреждению церебральных сосудов, сопровождающих развитие интракраниальных геморрагий. Эти данные позволяют заключить о том, что андрогены не выполняют прямой функции повышения стрессустойчивости. Однако, на основании вышеприведенных данных о лимитирующих эффектах андрогенов в отношении сосудистой стрессреактивности можно сделать вывод о том, что эти эффекты проявляются как 98 второстепенные запасные механизмы на фоне прямых процессов поддержания сосудистого гомеостаза. Отметим, что современные представления о гормон-заместительной терапии с применением синтетических аналогов тестостерона весьма противоречивые (Pongkan, 2015). Положительные результаты показаны в отношении коронарных заболеваний сердца (Basaria, 2010; Jaffe, 1977, Webb, 1999а, 1999б; Gordon, 1988; Eich, 1993; Christopher-Hennings, 1995). В последнее время появляется все больше научных обзоров, отражающие негативные эффекты заместительной терапии тестостероном или ее неэффективность. Carol (2005) в исследованиях на 651 мужчинах больше 45 лет с гипотестостеронемией показал, что введение тестостерона не повышало устойчивость к развитию злокачественных образований в семенниках. Haddad (2007) не обнаружил снижения систолического и диастолического АД, улучшения липидного профиля у 808 мужчин. Fernandez-Barselles (2010) показал, что синтетические аналоги тестостерона не повышали устойчивость 1031 испытуемых мужчин к инфаркту миокарда, аритмии, коронарным процессам реваскуляризации и онкологии семенников. Gluech (2013) указывает на риск развития венозного тромбоза и легочной эмболии у пациентов, находящихся на гормон-заместительной терапии андрогенами. В целом, результаты проведенных исследований показали, что секреция тестостерона определяется силой и продолжительностью стресса. Сосудистые эффекты андрогенов зависят от состояния организма и пола и проявляются как запасной механизм в процессах адаптации к стрессу. Мужские половые гормоны не обладают прямым доступом к сосудам, но активно вовлекаются в механизмы регуляции сосудистой стресс-реактивности и стресс-устойчивости за счет модуляции стрессорной активации холинергических и адренергических влияний на ССС. Нормальное содержание андрогенов необходимо для поддержания сосудистого гомеостаза, однако, фармакологические возмещение его уровня при гипотестостеронемии при АГ не оказывает положительных эффектов, что косвенно подтверждает вывод об 99 опосредованном влиянии андрогенов на сосуды через прямые процессы регуляции сосудистого тонуса. 100 ВЫВОДЫ 1. Стрессы – хронические (для мужского организма) и запредельные (для мужского и женского организма) являются важными факторами в подавлении секреции тестостерона. 2. Мужской организм по сравнению с женским более чувствителен к различным видам стресса по показаниям уровня тестостерона в крови. Постепенное умеренное снижение секреции тестостерона у них наблюдается уже в условиях хронических стрессов, в то время как в женском организме данные изменения отмечаются только при тяжелых стрессах. Важно отметить, что запредельные стрессы с одинаковой интенсивностью воздействуют на продукцию тестостерона как в мужском, так и в женском организме. 3. Индуцированные стрессом изменения в уровне артериального давления и содержании тестостерона в крови не сопряжены напрямую друг с другом. Подавление секреции тестостерона отмечается как при высоком уровне артериального давления, например, в условиях хронического стресса, так и при низких показателях данного параметра, например, на фоне запредельного стресса, сопровождающего развитие «сосудистых катастроф», таких как геморрагический инфаркт мозга и язвенное кровотечение. 4. Низкий уровень тестостерона не является прямым показателем снижения сосудистой стресс-устойчивости, однако, подавление секреции гормона в динамике сопряжено с критическим состоянием механизмов адаптации к стрессу и нарушением сосудистого гомеостаза. 5. На модели хронического социального стресса и развития в этих условиях артериальной гипертензии показано, что прогрессирование стресс-индуцированных процессов нарушения регуляции сосудистого тонуса сопряжено с постепенным уменьшением секреции тестостерона и снижением экспрессии ядерных 101 андрогенных рецепторов в семенниках и церебральных сосудах. Это свидетельствует о подавлении регуляторных возможностей андрогенов в отношении процессов синтеза мужских половых гормонов, а также ассоциируется с низкой устойчивостью к развитию геморрагического инфаркта мозга. 6. Сосудистые эффекты андрогенов проявляются в виде сдерживания интенсивности сосудистой стресс-реактивности опосредовано через холинергические влияния, а также ограничения адреналового представительства на сосудах как со стороны гормонального звена (адреналин), так и сигнальных систем стресса (бета-аррестин-1). 7. Фармакологическое замещение низкого уровня тестостерона в крови на фоне хронически высокого уровня АД не улучшает течение гипертензии и не повышает устойчивость к стресс-индуцированному повреждению церебральных сосудов, сопровождающих развитие интракраниальных геморрагий. Эти данные позволяют заключить о том, что андрогены не выполняют прямой функции повышения стресс-устойчивости. Однако, на основании вышеприведенных данных о лимитирующих эффектах андрогенов в отношении сосудистой стресс-реактивности можно сделать вывод о том, что эти эффекты проявляются как второстепенные запасные механизмы на фоне прямых процессов сосудистого гомеостаза. 102 поддержания СПИСОК ЛИТЕРАТУРЫ 1. Анищенко Т.Г. Половые особенности кардиоваскулярной стрессреактивности у здоровых и гипертензивных крыс / Т.Г. Анищнеко // Бюл. эксперим. биологии и медицины. - 2007. - Т.143. - №2. - С. 136-140. 2. Анищенко Т.Г. Половые особенности кардиоваскулярной стрессреактивности и их механизмы / Т.Г. Анищенко, Н.Б. Игошеваю, Л.Н. Шорина, О.В. Глушковская-Семячкина, Т.А. Якушева, Д.С. Лентьев, О.А. Климова // Доклады Российской академии Естественных наук.- 2000.- вып. 2.- Саратов: Сарат.гос.тех.ун-т. 2: 104112. 3. Анищенко Т.Г. Нормированная энтропия в оценке особенностей реакций сердечно-сосудистой системы на стрессорные воздействия у особей разного пола / Т.Г. Анищенко, Н.Б. Игошева, О.Н. Хохлова // Изд. Вузов «ПНД»- 1997 .- 5(1): С 81-91. 4. Анищенко Т.Г. Половые различия в степени активации перекисного окисления липидов повреждениям / Т.Г. и устойчивости к кардиоваскулярным Анищенко, Г.Е. Брилль, Т.П. Романова, Л.Н. Шорина // Бюл. эксперим.биол. и мед. - 1995.- 4:- С 354-357. 5. Анищенко Т.Г. Половые различия холинергического статуса у белых крыс/ Т.Г. Анищенко, Б.Н. Мамонтов, Л.Н. Шорина // Бюл. эксперим. биол. мед. – 1992. -10: - С 353-355. 6. Баевский, Р.М. Оценка адаптационных возможностей организма и риск развития заболеваний / Р.М. Баевский, А.П. Берсенева. М.: Медицина,1997. - 265c. 7. Бутяева В.В. О регуляции сердечной деятельности детей в условиях сенсомоторной деятельности / В.В. Бутяева, Трохимчук., Л.Ф И.Г.Романик, Т.И. Бабенко, О.И. Шквирина // Тез. докл. VI Всесоюз. симпоз. «Центральная регуляция кровообращения». Ростов-на-Дону. 103 1991.- С. 20-21. 8. Баевский Р.М. Возрастные особенности сердечного ритма у лиц с разной степенью адаптации к условиям окружающей среды / Р.М. Баевский, А.П. Берсенева, Ж.В. Барсукова 1985 // Физиол. человека. 1985. – Т.11. - №2. – С. 208 – 212. 9. Белова Е.В. Связь изменений вегетативных реакций с эффективностью умственной деятельности в условиях эмоционального напряжения / Е.В. Белова, Г.Б. Голованова // Физиол. человека. - 1982.- 8(2): - С 147-251. 10. Ведяев Ф.П. Типологический анализ кардиогемодинамики у юношей и девушек в покое и в условиях эмоционального напряжения/ Ф.П. Ведяев, В.А. Демидов, Ю.Г. Гаевский // Физиол. человека.- 1990 .-16(6): С 113-118. 11. Гринене Э.Ю. Особенности сердечного ритма школьников / Э.Ю. Гринене, В.Ю. Вайткавичус, Э. Марчинскене// Физ. Человека. – 1990. – Том. 16, №1. – С. 89–93. 12.Корнеев А.А. Индивидуальные особенности резистентности животных к гипоксии, связанные с полом // Патол. физиол. и эксперим. тер.- 1990. 5: 31-33. 13.Кобрин В. И. Механизмы действия эстрогенов на сердечно-сосудистую систему / В. И. Кобрин, Е. Е. Порман // Вестник аритмологии. – 2000. № 19. – С. 72-83 14.Комфорт А. Биология старения. Мир–1967. – 398 С. 15.Маколкин В. И. Поражение почек у больных артериальной гипертонией и сахарным диабетом 2-го типа / В. И. Маколкин // Терапевтический архив. - 2008. - Т. 80. - № 1. - С. 74-77. 16.Меерсон Ф.З. Адаптационная медицина: концепции долговременной адаптации / Ф.З. Меерсон . - М: Дело, 1993. - 301 с. 17.Одинцова Н.Ф. Функция почек и показатели суточного мониторирования артериального давления у больных артериальной 104 гипертонией старших возрастных групп / Н. Ф. Одинцова // Клиническая геронтология. - 2006. - Т. 12, № 10. - С. 17-22. 18.Судаков К.В. Стресс: постулаты, анализ с позиций общей теории функциональных систем // Патол. физиол. эксперим. тер. – 1992- 4:- С. 86-93. 19.Суворов В.А. Функциональное состояние почек у больных артериальной гипертонией с метаболическим синдромом / В.А. Суворов, Е. М. Стаценко, М. М.Землянская // Вестник Российского государственного медицинского университета. - 2006. - № 2. - С. 64-109 20.Федоров Б.М. Стресс и система кровообращения.Москва: Медицина.1991. - 319 c. 21.Чазов Е.И. Болезни сердца и сосудов. Москва: Медицина.- 1992 . 489 С. 22.Шарипова Г.Х. Особенности поражения почек при артериальной гипертонии с наличием и отсутствием метаболического синдрома / Г. Х. Шарипова, И. Е. Чазова // Российский кардиологический журнал. - 2008. - № 6. - С. 1-10. 23.Шеметова В.Г. Хроническая болезнь почек у амбулаторных больных с артериальной гипертонией / В. Г. Шеметова, Г. М. Орлова, М. С. Сасина // Сибирский медицинский журнал. - 2007. - Т. 69, № 2. - С. 36-38. 24. Шерстюк Б.В. Влияние стресс- идуцированногоснижения уровня тестстерона на гистохимические изменения половых органов крыс / В. Г. Шеметова, О.А. Дмитриева // Тихоокеанский медицинский журнал. 2007.-N 3.-С.55-57. 25. Ashton N. Sexual dimorphism in renal function and hormonal status of New Zealand genetically hypertensive rats. / N. Ashton , N. Ashton and R. J. Balment // Acta. Endocrinol. (Copenh).- 1991.- V.124.- P.91-97. 26. Allen M.T. Hemodynamic adjustments to laboratory stress: the influence of gender and personality/ M.T. Allen, C.M. Stoney, J.F Owens., K.A. 105 Matthews // Psychosom . Med. -1993-. V.55-P. 505-517. 27.Anastos K. Hypertension in women: what is really known? The Women’s Caucus, Working Group on Women’s Health of the Society of General Internal Medicine / K. Anastos, P. Charney, E. Cohen. // Ann Intern Med. - 1991. - V. 115. - P. 287-293. 28. Araujo A.B. Clinical review: Endogenous testosterone and mortality in men: a systematic review and meta-analysis./ A.B. Araujo ,Dixon, J.M. E.A. Suarez , Murad M.H., L.T . Guey., G.A. Wittert // J. Clin. Endocrinol Metab.- 2011. -V.-96(10)-P.3007-3019. 29. Araujo A.B. Sex steroids and all-cause and cause-specific mortality in men./ A.B. Araujo, V. Kupelian, S.T Page., D.J. Handelsman, Bremner, J.B. McKinlay // Arch. Intern. Med.- 2007.-V. 167(12)-P.1252-1260. 30.August P. Hypertension in women / P. August, S. Oparil // J Clin Endocrinol Metab. - 1999. - V. 84. - P. 1862-1866. 31.Ba Z. Gender differences in small intestinal endothelial function: inhibitory role of androgens / Z. Ba, Y. Yokoyama, B. Toth. // Am J Physiol Gastrointest Liver Physiol. - 2004. - V. 286. - P.G452-G457. 32.Baylis C. Age-dependent glomerular damage in the rat. Dissociation between glomerular injury and both glomerular hypertension and hypertrophy. Male gender as a primary risk factor / C. Baylis // J Clin Invest. - 1994. - V. 94. - P. 1823-1829. 33.Bachmann H. Blood pressure in children and adolescents aged 4 to 18: correlation of blood pressure values with age, sex, body height, body weight, and skinfold thickness / H. Bachmann, U. Horacek, M. Leowsky et al. // Monatsschrift Kinderheilkunde. - 1987. - Vol. 135. - P. 128-134. 34.Basaria S. Adverse events associated with testosterone administration./ S. Basaria , A.D.Coviello, T.G. Travison, T.W Storer, W.R. Farwell, A.M Jette, Eder R., S .Tennstedt , J. Ulloor, A. Zhang, K. Choong., Lakshman KM, Mazer NA, Miciek R, Krasnoff J, Elmi A, Knapp PE, B . Brooks, Appleman 106 E., S Aggarwal, Bhasin G, Hede-Brierley L, Bhatia A, Collins L., N. LeBrasseur, Fiore L.D., S. Bhasin // N. Engl. J. Med. - 2010 .V.363(2)-P.109122. 35.Browne M. Vascular actions of 17 beta-oestradiol in rat aorta and mesenteric artery / M. Browne, C. Connolly, J. Docherty // J. Autonom. Pharmacol. 1999. - V. 19. - P. 291-299. 36.Bertolini S. Chloramphenicol administration during brain development. Impairment of avoidance learning in adulthood / S. Bertolini, R. Pogglioli // Science. 1981 -V.213(4504)-P.238-239. 37. Blesson C.S. Prenatal testosterone exposure induces hypertension in adult females via androgen receptor-dependent protein kinase Cδ-mediated mechanism./ C.S. Blesson ,V. Chinnathambi, GD.Hankins, C.Yallampalli, K.Sathishkumar // Hypertension- 2015-V. 65(3)-P.683-690. 38.Burl V.L. Prevalence of hypertension in the US adult population: results from the Third National Health and Nutrition Examination Survey / V. L. Burl, E.J. Roccella, J.A. et al. //Hypertension. - 1995. - V. 25. - P. 305- 313. 39.Callies F. Administration of testosterone is associated with a reduced susceptibility to myocardial ischemia // Endocrinology.- 2003.- V.144.P.4478-4483. 40.Cabral A.M. Sex hormone modulation of ventricular hypertrophy in sinoaortic denervated rats // Hypertension.- 1988.- V.11.- P.I93-97. 41.Caplea A. Sodium-induced rise in blood pressure is suppressed by androgen receptor blockade / A. Caplea, D. Seachrist, G. Dunphy // Am J Physiol Heart Circ Physiol. - 2001. - V. 280. - P. H1793–H1801. 111 42.Ceballos G. Acute and non-genomic effects of testosterone on isolated and perfused rat heart / G. Ceballos, L. Figueroa, I. Rubio // J Cardiovasc Pharmacol. - 1999. - V. 33. - P. 691-697. 43.Chester A.H. Oestrogen relaxes human epicardial coronary arteries through non-endothelium-dependent mechanisms / A. H. Chester, J. A. Borland, M. 107 H. Yacoub et al. // Coron. Art. Dis. - 1995. - V. 6. - P. 417-422. 44.Costarelle C.E. Testosterone causes direct relation of rat thoracic aorta / C.E. Costarelle, J. N. Stallone, G. W. Rutecki, F. C. Whittier // J Pharmacol Exp Ther. - 1996. - V. 277. - P. 34-39. 45.Cambotti L.J. Neonatal gonadal hormones and blood pressure in the spontaneously hypertensive rat // Am. J. Physiol.- 1984.- V.247.- P.E258264 46.Chen Y.F. Androgen-dependent angiotensinogen and renin messenger RNA expression in hypertensive rats / Y.-F. Chen, A. J. Naftilan,S. T. Oparil // Hypertension. - 1992. - V. 19. - P. 456-463. 46.Chen Y.F. Sexual dimorphism of blood pressure in spontaneously hypertensive rats is androgen dependent / Y.-F Chen., Q.-M. Meng // Life Sci.1991. - V. 48. - P. 85-96. 47.Choi B.G. Why men's hearts break: cardiovascular effects of sex steroids / B. G. Choi, M. A. McLaughlin // Endocrinol. Metab. Clin. North. Am.- 2007.V.36.- P.365-377. 47. Chou T.M. Testosterone induces dilation of canine coronary conductance and resistance arteries in vivo / T. M. Chou, R. K. Sudhir, S. J. Hutchison et al. // Circulation. - 1996. - V. 94. - P. 2614-2619. 48. Christopher-Hennings J. The effect of high fat diet and dehydroepiandrosterone (DHEA) administration in the rhesus monkey / J. Christopher-Hennings, I. Kurzman, A. Haffa et al. // In Vivo. - 1995. - V. 9. - P. 415-420. 49. Chatterton R.T. Hormonal responses to psychological stress in men preparing for skydiving./ R.T Chatterton., KM.Vogelsong, Lu YC., GA. Hudgens // J. Clin. Endocrinol Metab.- 1997. -V.82(8) -P.2503-2509. 52. Calof O.M. Adverse events associated with testosterone replacement in middle-aged and older men: a meta-analysis of randomized, placebo108 controlled trials/ O.M. Calof, A.B.Singh, M.L Lee., A.M. Kenny, R.J . Urban., J.L. Tenover., S. Bhasin // J. Gerontol A. Biol. Sci. Med. Sci.- 2005 .-V. 60(11).-P.1451-1457. 53.Crew J.K. Antagonistic effects of 17 beta-oestradiol, progesterone, and testosterone on Ca2+ entry mechanisms of coronary vasoconstriction / J. K. Crews, R. A. Khalil // Arterioscler. Thromb Vasc. Biol. - 1999. - V. 19.- P. 1034-1040. 54.Crofton J.T. Role of vasopressin, the renin-angiotensin system, and sex in Dahl salt-sensitive hypertension / J.Y. Crofton, Y.-F. Chen, Q.-M. Meng // J Hypertens. - 1993. - V. 11. - P. 1031-1038. 55.Deenadayalu V.P. Testosterone relaxes coronary arteries by opening the large-conductance, calcium-activated potassium channel / V. P. Deenadayalu, R. E. White, J. N. Stallone // Am. J. Physiol. - 2001. - V. 281. - P. H1720H1727. 56.de Ronde W. The importance of oestrogens in males // Clin. Endocrinol. (Oxf).- 2003b.- V.58.- P.529-542. 57.Estrogen receptor activation and cardioprotection in ischemia reperfusion injury./ A.M. Deschamps , E. Murphy, J. Sun // Trends Cardiovasc Med.2010. 20(3):73-80. 58.Ding A.Q. Testosterone-induced relaxation of rat aorta is androgen structure specific and involves K+ channel activation / A. Q. Ding, J. N. Stallone // J. Appl. Physiol. - 2001. - V. 91. - P. 2742-2750. 59.Dlin R. Follow-up of normotensive men with exaggerated blood pressure response to exercise / R. Dlin, N. Hanne, D. Silverberg, O. Bar-Or // Am. Heart J. - 1983 .-V.106-P. 316-320. 60.Dubey R.K. Sex hormones and hypertension // Cardiovasc. Res. - 2002.- V. 53. - P. 688 - 708. 61.Duell P.B. The relationship between sex hormones and high-density lipoprotein cholesterol levels in healthy adult men / P. B. Duell, E. L. Bierman 109 // Arch. Int. Med. - 1990. - V. 150. - P. 2317-2320. 62.Eich D.M. Inhibition of accelerated coronary atherosclerosis with dehydroepiandrosterone in the heterotopic rabbit model of cardiac transplantation / D. M. Eich, J. E. Nestler, D. E. Johnson // Circulation. - 1993. - Vol. 87. - P. 261-269. 63.Ellison K.E. Androgen regulation of rat renal angiotensinogen messenger mRNA expression / K. E. Ellison, J. R. Ingelfinger, M. Pivor // J Clin Invest. - 1989. - V. 83. - P. 1941-1945. 64.English K.M. Gender differences in the vasomotor effects of different steroid hormones in rat pulmonary and coronary arteries / K. M. English, R. D. Jones, T. H. Jones et al. // Horm. Metabol. Res. - 2001. - V. 33. - P. 645-652. 65.Eiff A.W.M. The importance of hypothalamic centers for the pathogenesis of essential hypertension // Activ Nerv. Super. - 1990 .-V. 32-P. 184-186. 66.Eikelis N. Cardiovascular responses to open-field stress in rats: sex differences and effects of gonadal hormones / N. Eikelis, M. Van Den Buuse // Stress.- 2000.- V3.- P.319-334. 67.English K.M. Men with coronary artery disease have lower levels of androgens than men with normal coronary angiograms / K. M. English, R. P. Steeds, M. J. Diver et al. // Eur. Heart J. - 2000a. - V. 21.-P. 890– 894. 68.English K.M. Ageing reduces the responsiveness of coronary arteries from male Wistar rats to the vasodilatory action of testosterone / K. M. English, R. D. Jones, T. H. Jones et al. // Clin. Sci. - 2000в. - V. 99. - P. 77-82. 69.English K.M. Testosterone and coronary heart disease: is there a link / K. English, R. Steeds, T. Jones // Q. J. Med. - 1997. - V. 90.- P. 787-791. 70.Falkner B. Stress response characteristics of adolescents with genetic risk for essential hypertension: a five follow-up/ B. Falkner , G. Onesit, B. Hamstra // Clin. Exp. Hypertens. -1981.-V. 3-P. 583-591. 71.Fogari R. Sexual activity and plasma testosterone levels in hypertensive males / R. Fogari, A. Zoppi, P. Preti et al. // Am J Hypertens. - 2002. - V. 15, 110 no. 3. - P. 217-221. 72.Farhat M.Y. Effect of testosterone treatment on vasoconstrictor response of left anterior descending coronary artery in male and female pigs / M. Y. Farhat, M. L. Foegh, P. W. Ramwell // Cardiovasc Pharmacol.- 1995. - V. 25.-P. 495–500. 73.Fernández-Balsells M.M. Adverse effects of testosterone therapy in adult men: a systematic review and meta-analysis./ M.M. Fernández-Balsells M.H. Murad, M. Lane, J.F Lampropulos., Albuquerque F., R.J Mullan., Agrwal N., Elamin M.B., J.F.Gallegos-Orozco, Wang A.T., Erwin P.J., S.,Bhasin ,V.M Montori // J. Clin. Endocrinol Metab.- 2010. -V.95(6)-P.2560-2575. 74.Forte P. Evidence for a difference in nitric oxide biosynthesis between healthy women and men / P. Forte, B. Kneale, E. Milne et al. //Hypertension. - 1998. - V. 32. - P.730-734. 75.Frankenhaeuser M. Sex differences in sympathetic-adrenal medullary reactions induced by different stressors / M. Frankenhaeuser, Dunne E., Lundberg U. // Psychopharmacol. -1976-.V. 47-P. 1-5. 76.Francis K.T. The relationship between high and low trait psychological stress, serum testosterone, and serum cortisol.// Experientia.- 1981. V.37(12)P.1296-1307. 77.Ganten U. Sexual dimorphism of blood pressure in spontaneously hypertensive rats: effects of anti-androgen treatment / U. Ganten, G. Schroder, M. Witt et al. // J Hypertens. - 1989 - V. 7. - P. 721-726. 78.Giorgi A. Muscular strength, body composition and health responses to the use of testosterone enanthate: a double blind study / A. Giorgi, R. Weatherby, P. Murphy // J Sci Med Sport. - 1999.- V. 2. - P. 341-355. 79.Girdler S.S. Gender differences in blood pressure control during a variety of behavioral stressors / S.S. Girdler, J.R. Turner, A. Sherwood, Light K.C. // Psychosom. med. -1990-.V. 52-P.571-591. 80.Glueck C.J. Testosterone therapy, thrombophilia-hypofibrinolysis, and 111 hospitalization for deep venous thrombosis-pulmonary embolus: an exploratory, hypothesis-generating study./ C.J. Glueck, C. Richardson-Royer, R. Schultz, T. Burger, D. Bowe, J. Padda, P. Wang // Clin. Appl. Thromb. Hemost. -2014- .V. 20(3)-P.244-249. 81.Gotshall R.W. Difference in the cardiovascular response to prolonged sitting in men and women / R.W. Gotshall, L.A. Aten, S. Yumikura // Can. J. Appl. Physiol. -1994- V. 19: 215-225. 82.Geary G.G. Gonadal hormones affect diameter of male rat cerebral arteries through endothelial-dependent mechanisms / G. G. Geary, D. N. Krause, S. P. Duckles //Am J Physiol Heart Circ Physiol. - 2000. - V. 279. - P. H610H618. 83.Girdler S.S. Hemodynamic stress responses in men and women examined as a function of female menstrual cycle phase / S.S. Girdler, K.C. Light // Int. J. Psychophysiol. - 1994.- V. 17. - P. 233-248. 84.Gordon G.B. Reduction of atherosclerosis by administration of dehydroepiandrosterone. A study in the hypercholesterolemic New Zealand White rabbit with aortic intimal injury / G. B. Gordon, D. E. Bush, H. F.Weisman // J Clin Invest. - 1988. - V. 82. - P. 712-720. 85.Grassi G.A. ssessment of Sympathetic cardiovascular drive in human hypertension. achievements and perspectives / G. Grassi // Hypertension. 2009. - Vol.54. - P.690-702. 86.Harshfield G.A. Ambulatory blood pressure recordings in children and adolescents / G. A. Harshfield, B. S. Alpert, D. A. Pulliam // Pediatrics. - 1994. - V. 94. - P. 180-184. 87.Hastrup J.L. Sex differences in cardiovascular stress responses: modulation as a function of menstrual phases / J.L. Hastrup , K.C. Light // J. Psychosom. Res. - 1984. V.28-P. 475-483. 88.Haring R . Low serum testosterone levels are associated with increased risk of mortality in a population-based cohort of men aged 20-79./ R . Haring , H. Völzke, A. Steveling, A. Krebs, SB. Felix, C. Schöfl, M. Dörr, M. Nauck, H. 112 Wallaschofski // Eur. Heart J.- 2010.-V. 31(12)-P.1494-1501. 89.Haddad R.M. Testosterone and cardiovascular risk in men: a systematic review and meta-analysis of randomized placebo-controlled trials./ R.M. Haddad, C.C. Kennedy, S.M. Caples, M.J.Tracz, E.R. Boloña, K. Sideras, M.V.Uraga, P.J. Erwin, V.M. Montori // Mayo. Clin. Proc.- 2007.-V.82(1)P.29-39. 90.Herman S.M. Androgen deprivation is associated with enhanced endothelium-dependent dilatation in adult men / S. M. Herman, J. T. Robinson, R. J. Mc Credie et al. // Arterioscler Thromb Vasc Biol. - 1997. V. 17. - P. 2004-2009. 91.Himmelmann A. Influence of sex on blood pressure and left ventricular mass in adolescents: The Hypertension in Pregnancy Offspring Study /A. Himmelmann, A. Svensson, L. Hansson // J. Hum. Hypertens. - 1994. - V. 8. - P. 485-490. 92.Hutchison S.J. Testosterone worsens endothelial dysfunction associated with hypercholesterolemia and environmental tobacco smoke exposure in male rabbit aorta / S. J. Hutchison, T. M. Chou, R. E. Sievers et al. // J. Am. Coll. Cardiol. - 1997. - V. 29. - P. 800-807. 93.Honda A.H. Different mechanisms for testosterone-induced relaxation of aorta between normotensive and spontaneously hypertensive rats / A. H. Honda, T. H. Unemoto, H. G. Kogo // Hypertension. - 1999. - V. 34. - P. 1232-1236. 94.Hromadova M. Alterations of lipid metabolism in men with hypotestosteronemia / M. Hromadova, T. Hacik, E. Malatinsky // Horm. Metabol. Res. - 1991. - V. 23.- P. 392-394. 95.Hughes G.S. Sex steroid hormones are altered in essential hypertension / G. S. Hughes, R. S. Mathur, H. S. Margollus // J. Hypertens. - 1989. - V. 7. - P. 181-187. 96.Iams S.G. Retardation in the development of spontaneous hypertension in SH rats by gonadectomy / S. G. Iams, B. C. Wexler // J. Lab. Clin. Med. - 1977. 113 - V. 90. - P. 997 - 1003. 97. Iams S.G. Aldosterone, deoxycorticosterone, and prolactin changes during lifespan of chronically and spontaneously hypertensive rats / S. G. Iams, J. P. McMurtry, B. C. Wexler // Endocrinology. - 1979. - V. 104. - P. 357- 1363. 98.Ishikura F. Low testosterone levels in patients with mild hypertension recovered after antidepressant therapy in a male climacterium clinic / F. Ishikura, T. Asanuma, S. Beppu. // Hypertens Res. - 2008. - V. 31, no. 2. P. 243-248. 99.Jaffe A. Erectile dysfunction in hypertensive subjects. Assessment of potential determinants / A. Jaffe, Y. Chen, E. Kisch, et al. // Hypertension. 1996. - Vol. 28. - P. 859–862. 91. 100. Jones, R. D. Pulmonary vasodilatory action of testosterone: Evidence of a calcium antagonistic action / R. D. Jones, K. M. English, P. J. Pugh et al. // J. Cardiovasc. Pharmacol. - 2002a. - V. 39. - P. 814-823. 101. Jones R.D. The vasodilatory action of testosterone: a potassium- channel opening or a calcium antagonistic action?/ R. D. Jones, P. J. Pugh, T. H. Jones // Br. J. Pharmacol. - 2003. - V. 138, no. 5. - P. 733-744. 102. Jones R.D. Low levels of endogenous androgens increase the risk of atherosclerosis in elderly men: further supportive data / R. Jones, J. Malkin, K. Channer // J. Clin. Endocrinol. Metab. - 2003а. - V. 88. - P. 1403 - 1404. 102.Jousilahti P. Sex, age, cardiovascular risk factors, and coronary heart disease: a prospective follow-up study of 14 786 middle-aged men and women in Finland // Circulation. - 1999. - V. 99. - P. 1165-1172. 103 . Kajantie E. The effects of sex and hormonal status on the physiological response to acute psychosocial stress / E. Kajantie, D. I. Phillips // Psychoneuroendocrinology.- 2006.- V.31.- P.151-178. 104. Kalin M.F. Sex hormones and coronary artery disease: a review of clinical studies / M. F. Kalin,B. Zumhoff // Steroids. - 1990. - V. 55. - P. 330–352. 105. Kanashiro C.A. Gender-related distinctions in protein kinase C activity in 114 rat vascular smooth muscle / C. A. Kanashiro, A. K. Raouf // Am. J. Physiol. Cell. Physiol. Jan. - 2001. - V. 280. - P. C34 - C45. 106. Kang S. Effect of oral administration of testosterone on brachial arterial vasoreactivity in men with coronary artery disease / S. Kang, S. Mang, Y. Jang // Am. J. Cardiol. - 2002. - Vol. 89. - P. 862-864. 107. Kaya D. Single dose nasal 17beta-estradiol administration reduces sympathovagal balance to the heart in postmenopausal women // J. Obstet. Gynaecol. Res.- 2003a.- V.29.- P.406-411. 108. King J.A. Association of stress, hostility and plasma testosterone levels./ J.A. King , MC. Rosal, Y. Ma, GW. Reed // Neuro Endocrinol Lett. - 2005.V.26(4)-P. 355-360. 109. Khalil R.A. Sex Hormones as Potential Modulators of Vascular Function in Hypertension / R. A. Khalil // Hypertension. - 2005. - V. 46, no 2. P. 249 - 254. 110. Khaw K.T. Blood pressure and endogenous testosterone in men: an inverse relationship / K. Khaw, E. Barret-Connor // J. Hypertens. - 1988. - Vol. 6.- P. 329-332. 111. Khaw K.T. Endogenous sex hormones, high density lipoprotein cholesterol, and other lipoprotein fractions in men / K. T. Khaw, E.A. Barrett-Connor //Arterioscler. Thromb. - 1991. - Vol. 11. - P. 489–494. 112. Kosyreva A.M. The Sex Differences of Morphology and Immunology of SIRS of Newborn Wistar Rats // International Scholarly Research Notices.Volume 2014, Article ID 190749, 7 pages. 113. Khaw K.T. Endogenous testosterone and mortality due to all causes, cardiovascular disease, and cancer in men: European prospective investigation into cancer in Norfolk (EPIC-Norfolk) Prospective Population Study./ K.T. Khaw , M . Dowsett, E. Folkerd, S . Bingham, N. Wareham, R. Luben, A .Welch, N. Day // Circulation.- 2007. -V.116(23)-P. 2694-2701. 114. Kramer T. Influence of iron and the sex of rats on hematological, 115 biochemical and immunological changes during copper deficiency/ T. Kramer, W. Johnson , M. Briske-Anderson // J. Nutr. -1988 .-V,118(2)-P. 214-221. 115. Krantz D.S. Acute psychophysiological reactivity and risk of cardiovascular isease: A review and methodological critique / D.S. Krantz S.B. Manuck // Psychol. Bull.- 1984 .-V. 96-P. 435-464. 116. Kumai T. Influence of androgen on tyrosine hydroxylase mRNA in adrenal medulla of spontaneously hypertensive rats // Hypertension.- 1995.V.26.- P.208-212. 117. Kumai T. Possible involvement of androgen in increased norepinephrine synthesis in blood vessels of spontaneously hypertensive rats // Jpn. J. Pharmacol.- 1994.- V.66.- P.439-444. 118. Kunstmann A. Testosterone levels and stress in women: the role of stress coping strategies, anxiety and sex role identification // Anthropol Anz. 2004.-V. 62(3)-P.311-321. 119. Khoury S. Ambulatory blood pressure monitoring in a nonacademic setting: effects of age and sex / S. Khoury, S. Yarows, T. O’Brien // Am. J. Hypertens. - 1992. -V. 5. - P. 616-623. 120. Kumai T. Possible involvement of androgen in increased norepinephrine synthesis in blood vessels of spontaneously hypertensive rats // Jpn. J. Pharmacol.- 1994.- V.66.- P439-444. 121. Kumai T. Influence of androgen on tyrosine hydroxylase mRNA in adrenal medulla of spontaneously hypertensive rats // Hypertension.- 1995.- V.26.P.208-212. 122. Kumar A. Effect of steroid hormones on age dependent changes in rat arginase isoenzymes / A.Kumar, G. Kalyankar // Exp. Gerontol. - 1984. - V. 19, no 3. - P. 191-198. 123. Lawler K.A. Gender differences in pattern of dynamic cardiovascular 116 regulation / K.A. Lawler, Wilcox Z.C., Anderson S.F. // Psychosom. med. 1995. V . 57-P. 357- 365. 124. Laughlin G.A. Low serum testosterone and mortality in older men./ G.A. Laughlin, E. Barrett-Connor, J.Bergstrom // J. Clin. Endocrinol Metab.2008. V.93 (1)-P.68-75. 125. Light K.C. Race and gender comparison: I. Hemodynamic responses to a series of stressors/ K.C. Light , J.R. Turner, A.L. Hinderliter, A. Sherwood // Health Psychol. - 1993.-V. 12-P. 354-365. 126. Lillie E. Early phenotypic changes in hypertension. A role for the autonomic nervous system and heredity / E. Lillie, D. O’Connor // Hypertension.- 2006. - V.47. - P.331-355. 127. Liu P. Androgens and Cardiovascular Disease / P. Liu, A. Death, D. Handelsman // Endocr. Rev. - 2003. - V . 24, no 3. - P. 313 - 340. 128. Malkin C.J. Testosterone as a protective factor against atherosclerosisimmunomodulation and influence upon plaque development and stability / C. J. Malkin, P. J. Pugh, R. D. Jones // J. Endocrinol. - 2003. - V. 178. - P. 373 - 380. 129. Masubuchi Y. Gonadectomy-induced reduction in blood pressure in adult spontaneously hypertensive rats / Y. Masubuchi, T. Kumai, A. Uematsu // Acta Endocrinol (Copenh). - 1982. - V. 101. - P. 154-160. 130. Matthews K. Chronic work stress and marital dissolution increase risk of posttrial mortality in men from the Multiple Risk Factor Intervention trial / K. Matthews, B. Gump // Arch. Intern. Med. - 2002. - V.162. - P.309- 315. 131. Michelsen S. Blood pressure response during maximal exercise in apparently healthy men and women / S. Michelsen, S. Otterstad // J. Inter. Med. - 1990. - V. 227. - № 3. - P.157 - 163. 132. Malyusz M. Effect of castration on the experimental renal hypertension of the rat / M. Malyusz, H-J. Ehrens, P. Wrigge // Nephron. - 1985. - V. 40. - P. 96 99. 117 133. Menke A. Sex steroid hormone concentrations and risk of death in US Men / A. Menke, E. Guallar, S. Rohrmann, W.G. Nelson, N. Rifai, N. Kanarek, M. Feinleib, E.D. Michos, A. Dobs, E.A. Platz // Am. J. Epidemiol.-2010.V.171(5)-P. 583- 592. 134. Manhem K. Haemodynamic responses to psychosocial stress during the menstrual cycle // Clin. Sci. (Lond).- 1991.- V.81.- P.17-22. 135. Masuda A. Testosterone increases thromboxane A2 receptors in cultured rat aortic smooth muscle cells / A. Masuda, R. Mathur, P. Haluska // Circ Res. 1991. - V. 69. - P. 638-643. 136. McAdoo W.G. Race and gender influence hemodynamic responses to psychological and physical stimuli / W.G. McAdoo, M.H. Weinberger, J.Z. Miller, N.S . Fineberg , C.E. Grim // J. Hypertens. -1990.- V.8-P. 961-967. 137. Murphy J.G. Gender-specific reduction in contractility and [Ca2+] in vascular smooth muscle cells of female rat / J. G. Murphy, A. K. Raouf // Am J Physiol Cell Physiol. - 2000. - V. 278. - P. C834 - C844. 138. Murphy J.G. Decreased [Ca(2+)](i) during inhibition of coronary smooth muscle contraction by 17beta-estradiol, progesterone, and testosterone / J. G. Murphy, R. A. Khalil // J. Pharmacol. Exp. Ther. - 1999. - V. 291. - P. 44–52. 139. Ong P.J. Testosterone enhances flow-mediated brachial artery reactivity in men with coronary artery disease / P. J. Ong, W. C. Chong, C. M. Webb et al. // Am. J. Cardiol. - 2000. - V. 85. - P. 269-272. 140. Oparil S. Sexually dimorphic response of the balloon-injured rat carotid artery to hormone treatment // Circulation. - 1997. - V. 95. - P. 1301- 1307. 141. Orshal J. Gender, sex hormones, and vascular tone / J. Orshal, R. Khalil // Am. J. Physiol. Regul. Integr. Comp. Physiol . - 2004. - V. - 286. - P. R233-R249. 142. Ouchi Y. Sex difference in the development of deoxycorticosterone- salt hypertension in the rat / Y. Ouchi, L. Share, J. Crofton // Hypertension. 1987. - V. 9. – P. 172–177. 118 143. Perusquia A.M. Possible role of Ca2+ channels in the vasodilating effect of 5 beta-dihydrotestosterone in rat aorta / A. M. Perusquia, C. M. Villalon // Eur. J. Pharmacol. - 1999. - V. 371. - P. 169-178. 144. Penotti M. Effects of androgen supplementation of hormone replacement therapy on vascular reactivity of cerebral arteries / M. Penotti, L. Sironi, L. Cannata //Fertil Steril. - 2001. - V. 76. - P. 235-240. 145. Porderman K. Influence of sex hormones on plasma endothelin levels / K. Porderman, C. Stehouwer, G. van Kamp // Ann Intern Med. – 1993.- V. 118. - P. 429-432. 146. Pongkan W. Roles of Testosterone Replacement in Cardiac Ischemia– Reperfusion Injury / W. Pongkan, Chattipakorn C. S., Chattipakorn N.// J. Cardiovasc Pharmacol Ther.- 2015 1074248415587977. [Epub ahead of print] PMID: 26015457 147. Pugh P.J. Testosterone: a natural tonic for the failing heart? // Q. J. M.2000.- V.93.- P.689-694. 148. Phillips G.B. Sex hormones and hemostatic risk factors for coronary heart disease in men with hypertension / G. B. Phillips, T. Y. Jing, L. M. // J. Hypertens. - 1993. - V. 11. - P. 699-702. 149. Phillips G.B. The association of hypotestosteronemia with coronary artery artery disease in men / G. B. Phillips, B. H. Pinkernell, T. Y. Jing // Arterioscler Thromb Vasc Biol. - 1994. - V. 14. - P. 1701-1706. 150. Reckelhoff J.F. Gender differences in the renal nitric oxide (NO) system: dissociation between expression of endothelial NO synthase and renal hemodynamic response to NO synthase inhibition // Am. J. Hypertens.- 1998a.- V.11.- P.97-104. 151. Reckelhoff J.F. Role of androgens in mediating hypertension and renal injury / J. F. Reckelhoff, J. P.Granger // Clin Exp Pharmacol Physiol. 1999б. - V. 26. - P. 127-131. 152. Reckelhoff J.F. Gender differences in the regulation of blood pressure 119 / J. F. Reckelhoff // Hypertension.- 2001.- V.37.- P.1199-1208. 153. Reckelhoff J.F. Sex steroids, cardiovascular disease and hypertension // Hypertension. - 2005. - V. 45. - P. 170-180. 154. Reckelhoff J. Gender differences in the development of hypertension in SHR: role of the renin–angiotensin system / J. Reckelhoff, H. Zhang, K. Srivastava // Hypertension. - 2000. - V. 35. - P. 480-483. 155. Rowland N.E. Role of gonadal hormones in hypertension in the Dahl saltsensitive rat / N. E. Rowland, M. J. Fregly // Clin Exp Hypertens. 1992. - Vol. 14. - P. 367-375. 156. Roger V.L. Gender differences in use of stress testing and coronary heart disease mortality: a population-based study in Olmste Country, Minnesota / V.L. Roger, S.J. Jacobsen, P.A. Pellikka , T.D. Miller Bailey K.R., B.J. Gersh // American College of Cardiology. -1998.-V. 32(2)-P. 345-352. 157. Sader M.A. Endothelial function, vascular reactivity and gender differences in the cardiovascular system / M.A. Sader, D.S. Celermajer // Cardiovasc. Res. - 2002. - V.53. - P. 597 - 604. 158. Saleh M.C. Autonomic and cardiovascular reflex responses to central estrogen injection in ovariectomized female rats / M. C. Saleh, B. J. Connell, T. M. Saleh // Brain. Res.- 2000a.- V.879.- P.105-114. 159. Serova L.I. Estrogen modifies stress response of catecholamine biosynthetic enzyme genes and cardiovascular system in ovariectomized female rats / L. I. Serova, S. Maharjan, E. L. Sabban // Neuroscience.- 2005.- V.132.- P.249-259. 160. Stamler R. Hypertension screening of 1 million Americans. Community Hypertension Evaluation Clinic (CHEC) Program, 1973– 1975 / R. Stamler, W. Riedlinger // JAm. Med. Assoc. - 1976. - V. 235. - P. 2299-2306. 161. Stoney C. Sex differences in physiological responses to stress and 120 coronary heart disease: a causal link?/ C. Stoney, M. Davis, Matthews // Psychophysiol. - 1987.-V. 24-P. 127-131. 162. Sader M.A. Endothelial function, vascular reactivity and gender differences in the cardiovascular system / M.A. Sader, D.S. Celermajer // Cardiovasc. Res. - 2002. - V.53. - P. 597 - 604. 163. Salom J.B. Relaxant effects of 17-beta-estradiol in cerebral arteries through Ca(2+) entry inhibition / J. B. Salom, M. C. Burguete, F. J. PerezAsensio et al. // J. Cereb. Blood Flow Metab. - 2001. - V. 21. - P. 422- 429. 164. Shores M.M. Low serum testosterone and mortality in male veterans./ M.M. Shores , A.M. Matsumoto , K.L . Sloan , D.R . Kivlahan // Arch. Intern. Med. - 2006. V.166 (15)-P.1660-1665. 165. Shar L. Vasopressin: sexual dimorphism in secretion, cardiovascular actions and hypertension / L. Share, J. Crofton, Y. Ouchi. // Am. J .Med Sci. - 1988. - V. 295. - P. 314 - 319. 166. Simoncini T. Dehydroepiandrosterone Modulates Endothelial Nitric Oxide Synthesis Via Direct Genomic and Nongenomic Mechanisms /T. Simoncini, P. Mannella, L. Fornari et al. // Endocrinology. - 2003. - V. 144, no. 8. - P. 3449-3455. 167. Smith G.D. Cortisol, testosterone, and coronary heart disease: prospective evidence from the Caerphilly study/ G.D. Smith, Y. BenShlomo, A . Beswick, J .Yarnell , S . Lightman, P. Elwood // Circulation.- 2005. -V.112(3) -P.332-340. 168. Sullivan M.L. The cardiac toxicity of anabolic steroids / Prog. Cardiovasc. Dis.- 1998.- V.41.- P.1-15. 169. Szulc P. Serum concentrations of 17β-E2 and 25- hydroxycholecalciferol (25OHD) in relation to all-cause mortality in older men – the MINOS study / P. Szulc, B. Claustrat, P.D. Delmas // Clin. Endocrinol. (Oxf).- 2009.- V.71- P.594-602. 170. Tatchum-Talom R. Gender differences in hemodynamic responses to 121 endotelin-1/ R. Tatchum-Talom, C. Martel, C. Labrie, F. Labrie, A. Marette // J. Cardiovascular Pharmacol. -2000-.V. 36(1)- P. S102S104. 171. Tep-Areenan P. Testosterone-induced vasorelaxation in the rat mesenteric arterial bed is mediated predominantly via potassium channels / P. TepAreenan, D. Kendall, M. Randall // Br. J. Pharmacol. - 2002. - V. 135. - P. 735-740. 172. Teoh H. Differential effects of 17beta-estradiol and testosterone on the contractile responses of porcine coronary arteries // Br. J. Pharmacol.2000.- V.129.- P.1301-1308. 173. Tivesten A. Low serum testosterone and estradiol predict mortality in elderly men. / A. Tivesten , L. Vandenput, F. Labrie, M.K . Karlsson., Ljunggren O., D.Mellström, C. Ohlsson // J. Clin. Endocrinol Metab. 2009.- V.94(7)- P.2482-2488. 174. Toda N. The Pharmacology of Nitric Oxide in the Peripheral Nervous System of Blood Vessels Noboru Toda and Tomio Okamura / N. Toda, T. Okamura // Pharmacol. Rev. - 2003. - V. 55. - P. 271. 175. Traustadottir T. Gender differences in cardiovascular and hypothalamic- pituitary-adrenal axis responses to psychological stress in healthy older adult men and women / T. Traustadottir, P. R. Bosch, K. S. Matt // Stress. 2003. -V. 6. - P. 133 - 140. 176. Tunstall-Pedoe H. WHO MONICA Project. Myocardial infarction and coronary deaths in the Would Health Organization MONICA project: registration procedures, event rates and case fatality rates in 38 populations from 21 countries in four continents / H. Tunstall-Pedoe T. Traustadottir, Kuulasmaa K., Amouyel P., Arveiler D., Rajakangas AM., Pajak A., // Circulation. -1994 .-V.90- P. 583-612. 177. Van Doorner L. Sex differences in physiological reactions to real life stress and their relationship to psychological variables // Psychophysiol. 122 1986.-V. 23- P.657-662. 178. Vikan T. Endogenous sex hormones and the prospective association with cardiovascular disease and mortality in men: the Tromsø Study./ T. Vikan, H. Schirmer, I. Njølstad, J. Svartberg // Eur. J. Endocrinol.2009. V.161(3)- P.435-442. 179. Webb C.M. Effect of acute testosterone on myocardial ischaemia in men with coronary artery disease / C. M. Webb, D. L. Adamson, D. De Zeigler et al. // Am. J. Cardiol. - 1999a. - V. 83. - P. 437-439. 180. Webb C.M. Effects of testosterone on coronary vasomotor regulation in men with coronary heart disease / C. M. Webb, D. L. Adamson, D. De Zeigler // Circulation. - 1999б. - V. 100. - P. 1690-1696. 181. Weidner G. Cardiovascular stress reactivity and mood during the menstrual cycle / G. Weidner, L. Helming // Hypertension. - 1991.-V. 17(1)-P. 5-20. 182. White C.M. The effect of pharmacokinetically guided acute intravenous testosterone administration on electrocardiography and blood pressure / C. M. White, M. J. Ferraro-Borgida, N. M. Moyna // J. Clin. Pharmacol. - 1999. - V. 39. - P. 1038-1043. 183. Whitworth J.A. Haemodynamic and metabolic effects of short term administration of synthetic sex steroids in humans / J. A. Whitworth, B. A. Scoggins, P. M. Williamson // Clin. Exp. Hypertens. - 1992. - V. 14. - P. 905-922. 184. Wu F. Androgens and Coronary Artery Disease / F. Wu, A. von Eckardstein // Endocr. Rev., April 1 ,- 2003. - V. 24, no 2. - P. 183 - 217. 185. Wiinber N. 24-h Ambulatory blood pressure in 352 normal Danish subjects, related to age and gender / N. Wiinber, A. Hoegholm, H. Christensen // Am J Hypertens. - 1995. - V.8. - P. 978–986. 186. Wingard D. The sex differential in mortality from all causes and ischaemic heart disease / D. Wingard, L. Suarez, E. Barrett-Connor // Am. J. Epidemiol. - 1983. - V. 117. - P. 165-172. 123 187. Wynne F.L. Testosterone and coronary vascular tone: implications in coronary artery disease / F. L. Wynne // J. Endocrinol Invest. - 2003. V. 26. - P. 181-186. 188. Wynne F.L. Testosterone and coronary vascular tone: implications in coronary artery disease / F. L. Wynne // J. Endocrinol Invest. - 2003. V. 26. - P. 181-186. 189. Yeap B.B. Androgens and cardiovascular disease // Curr Opin Endocrinol Diabetes Obes. - 2010.-V. 17(3)- P.269-276. 190. Yong L.C. Longitudinal study of blood pressure changes and determinants from adolescence to middle age. The Dormont High School Follow-Up Study / L. C. Yong, L. H. Kuller, G. P. Rutan // Am. J. Epidemiol. -1993. - V. 138. - P. 973-983. 191. Yue P. Testosterone relaxes rabbit coronary arteries and aorta / P. Yue, Chatterjee J., C. Beale et al. // Circulation. - 1995. - V. 91. - P. 11541160. 192. Zukowska-Grojec Z. Neuropeptide Y. A novel sympathetic stress hormone // Ann N.Y. Acad Sci. - 1995. -V. 771. - P. 219–233. 124