ВЛИЯНИЕ ТИРОКСИНА И МЕРКАЗОЛИЛА НА
advertisement

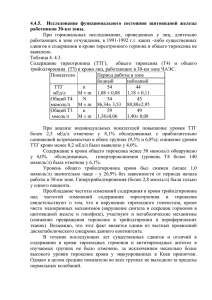
ВЛИЯНИЕ ТИРОКСИНА И МЕРКАЗОЛИЛА НА АНТИОКСИДАНТНУЮ СИСТЕМУ И ИЗОФЕРМЕНТНЫЕ СПЕКТРЫ ЛАКТАТДЕГИДРОГЕНАЗЫ ПЕСЦОВ С.Н.Калинина1, Л.А.Беличева2, А.Р.Унжаков1 1 Институт биологии Карельского научного центра РАН, г. Петрозаводск 2 Петрозаводский государственный университет, г. Петрозаводск, email: skalinina@bio.krc.karelia.ru В пушном звероводстве использу ются различные биологически актив ные вещества (БАВ) с целью улучше ния показателей хозяйственнополез ных признаков (Балакирев, Демина, Растимешина, 2000; Берестов, Кожев никова, 1981; Илюха и др., 2000). Одна ко для корректного проведения подоб ных мероприятий необходимо учиты вать ряд факторов (сезон, возраст, экологические особенности вида и др.), способных влиять на их эффектив ность. Исследования по влиянию БАВ на антиоксидантную систему (АОС) и изо ферментные спектры лактатдегидроге назы (ЛДГ) проводились в основном на лабораторных животных, утративших многие физиологобиохимические особенности своих диких предков, и полученные в ходе таких исследований результаты трудно экстраполировать на всех млекопитающих. Введённые в зоо культуру песцы обладают особенностя ми метаболизма, свойственными их предкам (Берестов, Кожевникова, 1981; Илюха и др., 2000). Ранее было уста новлено (Балакирев, Демина, Растиме шина, 2000; Берестов, Кожевникова, 1981; Илюха и др., 2000), что песцы от личаются от других видов пушных зве рей и лабораторных животных по чув ствительности к воздействию многих БАВ (необходимы другие дозы и учёт времени года для результативного вве дения препаратов). Известно, что гормоны щитовидной железы (йодтиронины) влияют на все типы клеточного обмена веществ (Кли ническая эндокринология, 1991), повы шая метаболизм и увеличивая погло щение кислорода тканями, т.е. прояв ляя калоригенный эффект. Для направ ленной регуляции обмена веществ при откорме животных применяются анти тиреоидные препараты, например, мерказолил. При их введении интен сивность обмена и окислительных про цессов на уровне митохондрий в орга низме временно снижается, энергети ческие затраты на поддержание жиз ни уменьшаются, что приводит к акти визации анаболических процессов (Размахнин, Драганов, 1990). Особенности метаболизма отража ются на функционировании АОС и спе цифическом для каждого типа тканей распределении изоферментных спек тров ЛДГ. Известно, что АОС, участву ющая в молекулярных механизмах не специфической резистентности орга низма к действию разнообразных фак торов среды (Хавинсон, 2003), и функ циональная гетерогенность изозимов ЛДГ, за счёт которой происходит пере ключение основных путей метаболиз ма, дают информацию о тонкой регуляции биохимических процессов в зави симости от экологической специализации, видовых особенностей животных, а также сообразно требованиям внешней среды (Кожевникова и др., 2004; Ленинджер, 1976). Целью данной работы явилось изучение влияния гормона щитовидной железы тироксина и антитиреоидного препарата мерказолила на изофер ментные спектры ЛДГ, а также на состояние АОС шести органов и тканей пес цов клеточного разведения. Экспериментальными животными служили 7месячные самцы и самки песцов (Alopex lagopus L.), разводимые в неволе, которые получали тироксин и мерказолил с питьевой водой в течение 5 дней в ноябре в два этапа с перерывом в 7 дней из расчета по 0,1 мг/животное тироксина и 10 мг/живот ное мерказолила соответственно. В образцах тканей (печени, почек, лёгких, селезёнки, сердечной и скелет ной мышечных тканей), отобранных в период планового забоя песцов, проана лизированы показатели ферментативного и неферментативного звеньев АОС. Спектрофотометрически определяли активность ферментов и содержание белка: супероксиддисмутазы (СОД) – по модифицированной адренохромной методике (Misra, Fridovich, 1975), каталазы – по количеству разложенной пе рекиси водорода (Bears, Sizes, 1952), белка – по Лоури (Lowry et al., 1951), с использованием в качестве стандарта бычьего сывороточного альбумина. В качестве интегрального показателя состояния АОС использовали хемилюми несцентный анализ с применением двух люминофоров (люминол, люциге нин) и двух активаторов свечения (сульфат железа (II), перекись водорода) (Klinger et al., 1996). Соотношение изоферментных спектров ЛДГ определяли электрофоретически в агаровом геле по методу Вайма (Wieme, 1959). Установлена высокая устойчивость АОС и системы изоферментов ЛДГ пес цов к влиянию исследованных БАВ. Были выявлены различия в реагировании ферментативного и неферментативного звеньев АОС – большим изменениям подвергается ферментативное звено АОС. Максимальные изменения АОС под влиянием мерказолила отмечены для почек и легких, под влиянием тироксина – для печени, почек и сердца. При исследовании влияния данных БАВ на изоферментный профиль ЛДГ изменения в соотношении различных фракций фермента наблюдались только в гомогенатах почек и селезёнки. Большее вли яние на указанную систему изоферментов оказало введение тироксина, под действием которого прослеживался сдвиг типа метаболизма в данных орга нах в сторону анаэробиоза. При применении мерказолила и тироксина отмечалось в основном угнете ние ферментативного и неферментативного звеньев АОС. Наибольшим изме нениям под влиянием мерказолила подверглась АОС почек песцов, под влия нием тироксина – АОС печени и сердца. Введение мерказолила привело к увеличению уровня генерации АФК в гомогенатах почек и к снижению функ ционирования АОС данного органа, о чём свидетельствует увеличение коли чества сигналов люминолзависимой железом (II) индуцированной хемилю минесценции (ХМЛ) (рис. 1А) по сравнению с контролем. В печени наблюда лось угнетение функционирования антиоксидантных ферментов под влияни ем введения как тироксина, так и мерказолила по сравнению каждого из них с контролем, о чём говорит возрастание количества импульсов люминолзави симой железом (II) индуцированной ХМЛ (рис. 1А). Только для гомогенатов сердца отмечено разнонаправленное влияние тироксина и мерказолила на ферментативное звено АОС (рис. 1А). Наблюдалось уменьшение индекса отношения активности СОД к активно сти каталазы в печени и повышение указанного индекса в легких. Разнонап равленность влияния тироксина и мерказолила на отношение активностей СОД и каталазы отмечена для легких (рис. 1Б). Тот факт, что достоверные изменения компонентов АОС наблюдались имен но в таких органах, как сердце, печень и почки, обусловлено тем, что эти орга ны являются мишенями действия гормонов щитовидной железы. Гормоны уве личивают частоту сердечных сокращений и стимулируют сердечную деятель ность. Метаболические превращения тироксина и мерказолила осуществля ются главным образом в печени и почках, и, видимо, с усилением функцио нальной нагрузки на данные органы и связаны наблюдаемые изменения. Изоферментные спектры ЛДГ изученных органов и тканей песца в основ ном отражали общие органоспецифические закономерности распределения изоформ данного фермента, определяющие метаболический профиль того или иного типа тканей (Кожевникова и др., 2004). Ìåæäóíàðîäíàÿ íàó÷íî-ïðàêòè÷åñêàÿ êîíôåðåíöèÿ 175 Ñîâðåìåííûå ïðîáëåìû ïðèðîäîïîëüçîâàíèÿ, îõîòîâåäåíèÿ è çâåðîâîäñòâà 176 Рис. 1. Влияние тироксина и мерказолила на люминолзависимую железом (II) индуцированную удельную ХМЛ (А) и на соотношение СОД/каталаза (Б) в различных органах песцов. Условные обозначения: * – различия между контрольной и опытной группой достоверны (Критерий Вилкоксона – Манна – Уитни); ◊ – различия между опытными группами достоверны (Критерий Вилкоксона–Манна–Уитни) Рис. 2. Влияние тироксина и мерказолила на изоферментные спектры ЛДГ в гомогенатах почек (А) и селезёнки (Б). Условные обозначения как на рисунке 1 Под влиянием тироксина и мерка золила достоверные изменения со держания изоферментов ЛДГ отмеча лись только в гомогенатах почек и се лезёнки (рис. 2). В изозимном профи ле ЛДГ почек, органе с преобладани ем аэробного типа гликолиза, под вли янием введения тироксина наблюдал ся сдвиг в сторону анаэробиоза по сравнению с контролем. Введение мерказолила привело к снижению со держания гибридной фракции ЛДГ3 в данном органе (рис. 2А). Данные из менения свидетельствуют об усиле нии функциональной нагрузки на дан ный орган и, как следствие, о преиму щественном протекании реакций ана эробного гликолиза, как наиболее бы строго, но менее эффективного спо соба получения энергии. В селезёнке выявлено разнонаправ ленное влияние тироксина и мерказо лила на аэробные фракции ЛДГ1 и ЛДГ2 (рис. 2Б), причём тироксин сни жал содержание указанных фракций фермента, увеличивая содержание анаэробной фракции ЛДГ4. Получен ные данные указывают на подавление протекания реакций аэробного глико лиза в селезёнке под влиянием введе ния тироксина по сравнению с мерка золилом, а также на сдвиг метаболиз ма в данном органе в сторону анаэро биоза под влиянием введения тирок сина по сравнению с контролем. Таким образом, в ходе исследова ния была установлена высокая устой чивость АОС и системы изоферментов ЛДГ органов песцов к влиянию тирок сина и мерказолила. Относительная невосприимчивость песцов к влиянию введения тироксина и мерказолила, очевидно, связана с тем, что экспери мент проводился в ноябре, когда в организме этих животных происходит пе рестройка эндокринных механизмов регуляции в соответствии со временем года с целью выжить в условиях полярного климата. СПИСОК ЛИТЕРАТУРЫ Балакирев Н.А., Демина Т.М., Растимешина О.В. 2000. Применение биоло гически активных веществ для повышения продуктивности норок // Пробле мы экологической физиологии пушных зверей. С. 7178. Берестов В.А., Кожевникова Л.К. 1981. Ферменты крови пушных зверей. – Ленинград: Наука. 184 с. Илюха В., Кожевникова Л., Валтонен М., Касанен С., Мелдо Х., Тютюнник Н. 2000. Влияние витамина Е на физиологическое состояние, состав молока и репродуктивные свойства песцов (Alopex lagopus L.) // Проблемы экологи ческой физиологии пушных зверей. С. 119131. Клиническая эндокринология (руководство): Под ред. Старковой. 1991. 256 с. Кожевникова Л.К., Тютюнник Н.Н., Унжаков А.Р., Мелдо Х.И. 2004. Адаптив ная роль изоферментов лактатдегидрогеназы органов млекопитающих раз личного экогенеза // Проблемы экологической физиологии пушных зверей. С. 827. Ленинджер А. 1976. Биохимия. 956 с. Размахнин Ю.Е., Драганов Н.Ф. 1990. Использование биостимуляторов при откорме сельскохозяйственных животных. – М.: 300 с. Хавинсон В.Х., Баринов В.А., Арутюнян А.В., Малинин В.В. 2003. Свобод норадикальное окисление и старение.СПб. 298 с. Bears R.F., Sizes I.N. 1952. A spectral method for measuring the breakdown of hydrogen peroxide by catalase // J. Biol. Chem. Vol. 195. № 1. P. 133140. Klinger W., Karge E., Kretzschmar M., Rost M., Schulze H.P., Dargel R., Reinemann C., Rein H. 1996. Luminoland lucigeninamplified chemiluminescence with rat liver microsomes. Kinetics and influence of ascorbic acid, glutathione, dimethylsulfoxide, Ntbutylaphenylnitrone, copperions and a copper complex, catalase, superoxide dismutase, hexobarbital and aniline // Exp. Toxicol. Pathol. Vol. 48. № 5. Р. 447460. Lowry O.H., Rosenbrough N.J., Farr A.L., Randan R.J. 1951. Protein measurement with the Folin phenol reagent // J. Biol. Chem. Vol. 193. № 1. Р. 265275. Misra H.P., Fridovich F. 1972. The role of superoxide anion in the autoxidation of epinephrine and a simple assay for superoxide dismutase // J. Biol. Chem. Vol. 247. № 10. Р. 31703175. Wieme R. 1959. Studies on agargel electrophoresis.Brussel. 519 p.