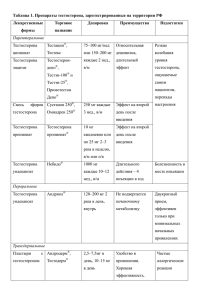
007431 Данное изобретение является частичным продолжением заявки на патент США с... номером 09/703753, поданной 1 ноября 2000 г., которая ...
advertisement

007431 Данное изобретение является частичным продолжением заявки на патент США с регистрационным номером 09/703753, поданной 1 ноября 2000 г., которая является частичным продолжением заявки на патент США с регистрационным номером 09/651777, поданной 30 августа 2000 г. Эта заявка также заявляет приоритет Предварительной заявки США с номером 60/292398, поданной 21 мая 2001 г. Эта заявка заявляет приоритет всех таких предыдущих заявок, и такие заявки включены здесь в качестве ссылки. Область техники, к которой относится изобретение Данное изобретение относится к способам, наборам, комбинациям и композициям для лечения депрессивного симптома у субъекта введением этому субъекту эффективного количества стероида в синтетическом пути тестостерона. Уровень техники В 1940-х годах несколько исследований продемонстрировали, что тестостерон и другие андрогены могут быть успешно использованы для лечения депрессивных синдромов у людей средних лет. Но с увеличением применения электрошоковой (электроконвульсивной) терапии и приходом трициклических антидепрессантов и ингибиторов моноаминоксидазы в 1950-х годах андрогены утратили их предпочтительность в качестве средства, применяемого в случае депрессии. Несколько исследований в 1970-х и 80х годах снова подтвердили эффективность андрогенов, таких как местеролон, в лечении людей с депрессией, но андрогены продолжали вызывать мало интереса, возможно, вследствие постоянного введения более новых классов антидепрессантов, из которых некоторые могли бы вводиться людям обоего пола без беспокойства, связанного с эффектами маскулинизации. В других исследованиях люди с депрессией обнаруживали сниженные уровни тестостерона, хотя эта ассоциация является сложной и, возможно, обусловленной дополнительными факторами. Гипогонадотропные люди часто обнаруживают депрессивные симптомы, и обычно тестостероновая заместительная терапия улучшает эти симптомы. Это открытие относится и к людям с ВИЧ-индуцированным гипогонадизмом, которые также, по-видимому, обнаруживают антидепрессантную реакцию на тестостерон. Кроме того, у людей, которые принимают явно сверхфизиологические дозы тестостерона и родственных андрогенов (люди, незаконно злоупотребляющие анаболическими стероидами), могут развиваться маниакальные или гипоманиакальные симптомы во время применения андрогена и депрессивные симптомы при прекращении приема андрогена. В более недавних исследованиях был пересмотрен потенциал тестостерона в качестве антидепрессанта. В одном исследовании Seidman, et al. (Seidman SN, Rabkin J., J Affective Disord 1998; 48:157-161) внутримышечный энантат тестостерона вводили при 400 мг каждые две недели пяти мужчинам, которые оставались депрессивными, несмотря на адекватное лечение селективными ингибиторами повторного использования серотонина (SSRI). Уровни общего тестостерона этих мужчин находились в низком или пограничном диапазоне (200-350 нг/дл; контрольный диапазон 300-900 нг/дл). Все пять субъектов показали улучшение. Их средние баллы оценки депрессии по шкале оценок депрессии Гамильтона (HAM-D) снижались с 19,2 при базовой линии (фоне) до 4,0 при восьми неделях. Затем четверым из этих пяти мужчин вводили инъекции плацебо, и трое из этих четверых имели рецидив в пределах двух недель. Продолжая это исследование, Seidman, et al. (J Clin Psychiatry 2001; 62:405-412) провели рандомизированное, контролируемое плацебо испытание энантата тестостерона на мужчинах с большим депрессивным нарушением, выбирая опять субъектов с уровнями тестостерона 350 нг/дл или менее. Однако это исследование отличалось от предыдущего открытого исследования тем, что субъекты не принимали одновременно антидепрессанты, а получали только тестостерон. После шести недель лечения исследователи не обнаружили значимого различия между тестостероном и плацебо по шкале оценок депрессии Гамильтона или по опроснику депрессии Бека (Beck Depression Inventory (BDI)). Приблизительно 40% получавших тестостерон субъектов имели положительную реакцию (определяемую 50%-ным или большим уменьшением по шкале оценок депрессии Гамильтона), но такую же положительную реакцию имела сравниваемая часть субъектов, получавших плацебо. Интересно, что из восьми не дающих положительную реакцию на плацебо, которым давали открыто тестостерон в конце этого исследования, шесть субъектов давали положительную реакцию. Признавая, что эти последние наблюдения были предметом связанного с ожиданием искажения, авторы сделали предположение, что тестостерон обладал вариабельным и, возможно, идиосинкразическим антидепрессантным действием в некоторых мужчинах и что может быть оправданным дальнейшее исследование. Трансдермальные препараты тестостерона обеспечили ценную систему доставки для нормализации сывороточных уровней тестостерона у гипогонадотропных людей и предупреждения клинических симптомов и долгосрочных эффектов андроген-недостаточных людей. Доступные трансдермальные препараты тестостерона включают в себя, например, TESTODERM®, TESTODERM® TTS и ANDRODERM®. Тестостерон доступен также в виде других композиций, в том числе в композициях, доступных в качестве инъекционных растворов, например, DEPO-TESTOSTERON® (ципионат тестостерона) и DELATESTRYL BTG® (энантат тестостерона), или в виде геля, например, ANDROGEL®, продаваемого Unimed Pharmaceuticals, Inc., Deerfield, Illinois, правопреемником этой заявки. У мужчин трансдермальные пластыри накладываются на скротальную кожу или другие части тела. Недавно гель однопроцентного тестостерона был одобрен для применения для мужчин, и он обеспечива-1- 007431 ет возможность вариабельных доз с минимальным раздражением кожи. Этот гель продается под названием ANDROGEL®. Однако, все существующие доступные трансдермальные продукты тестостерона специфически противопоказаны для применения в случае женщин в Соединенных Штатах. Кроме того, ни один из доступных в настоящее время способов лечения андрогеном для женщин, например, пероральный метилтестостерон, внутримышечные инъекции эфиров тестостерона или подкожные имплантаты тестостерона, не могут достигать воспроизводимых сывороточных уровней тестостерона на постоянной ежедневной основе. А. Андрогены у мужчин. Тестостерон, основной циркулирующий в кровотоке андроген у мужчин, синтезируется из холестерина. Приблизительно 500 миллионов клеток Лейдига в яичках секретируют более, чем 95% из 6-7 мг тестостерона, продуцируемого в сутки. Два гормона, продуцируемых гипофизом, лютеинизирующий гормон (LH) и фолликулостимулирующий гормон (FSH) необходимы для развития и поддержания тестикулярной функции и отрицательной регуляции продуцирования тестостерона. Циркулирующий тестостерон метаболизируется до различных 17-кетостероидов посредством двух различных путей. Тестостерон может метаболизироваться до дигидротестостерона (DHT) ферментом 5-альфа-редуктазой или до эстрадиола (Е2) ферментным комплексом ароматазы. Тестостерон циркулирует в крови, будучи на 98% связанным с белком. У мужчин, приблизительно 40% этого связывания является связыванием с высокоаффинным связывающим половые гормоны глобулином (SHBG). Остальные 60% являются слабо связанными с альбумином. Таким образом, ряд измерений на тестостерон возможны в клинических лабораториях. Термин «свободный» тестостерон, в данном контексте, относится к фракции тестостерона в крови, которая не связана с белком. Термин «общий тестостерон» или «тестостерон» означает в данном контексте свободный тестостерон плюс связанный с белком тестостерон. Термин «биодоступный тестостерон» относится в данном контексте к тестостерону, связанному не со связывающим половые гормоны глобулином, и включает в себя тестостерон, слабо связанный с альбумином. Следующая таблица из UCLA-Harbor Medical Center показывает диапазон концентрации этого гормона у нормальных взрослых мужчин: Таблица 1. Уровни гормона у нормальных мужчин В литературе сообщается, что имеет место значительное варьирование в полупериоде жизни тестостерона в диапазоне от 10 до 100 мин. Однако исследователи соглашаются с тем, что циркулирующий тестостерон имеет суточное изменение у нормальных молодых мужчин. Максимальные уровни присутствуют приблизительно в 6:00-8:00 ч до полудня, и уровни снижаются на протяжении дня. Характерные профили имеют максимальный уровень тестостерона 720 нг/дл и минимальный уровень 430 нг/дл. Однако, физиологическое значение этого суточного цикла, если он существует, является неясным. Поскольку было показано, что увеличение концентраций тестостерона изменяет сексуальную активность (способность) и либидо, исследователи изучали способы доставки тестостерона мужчинам. Эти способы включают в себя внутримышечные инъекции (43%), пероральное восполнение (24%), имплантаты в виде шариков (23%) и трансдермальные пластыри (10%). Результаты этих способов приведены в табл. 2. -2- 007431 Таблица 2. Способ применения и доза различных препаратов тестостерона Однако все способы восполнения тестостерона, используемые в настоящее время, страдают от одного или нескольких недостатков. Например, субдермальные имплантаты шариков и инъекции эфиров тестостерона являются болезненными и требуют визитов к доктору. Многие из этих способов, такие как способы с использованием перорального/сублингвального/буккального препаратов, страдают от нежелательного фармакокинетического профиля - образования сверхфизиологических концентраций тестостерона с последующим возвратом к базовой линии (фону). Трансдермальные пластыри обеспечивают менее, чем оптимальные фармакокинетические характеристики, являются мешающими для многих субъектов и связаны со значительным раздражением кожи. Таким образом, хотя в течение десятилетий существует потребность в эффективной заместительной методологии восполнения тестостерона, все еще не была разработана альтернативная заместительная терапия, которая преодолевает эти проблемы. В. Андрогены у женщин Экскреция андрогенных стероидов в моче взрослых женщин была продемонстрирована более, чем 50 лет назад. С этого времени физиологи и клиницисты исследовали источники и биологические функции тестостерона и других эндогенных андрогенных гормонов у женщин, см., например, Geist S.H., Androgen therapy in the human female, J. Clin. Endocrinol. 1941; 1:154-161. В настоящее время известно, что андрогены секретируются как яичниками, так и надпочечниками женщин. Каждый источник дает приблизительно 50% (непосредственно или посредством предшественников) (см., например, Abraham G.E., Ovarian and adrenal contribution to peripheral androgens during the menstrual cycle, J. Clin. Endocrinol. Metab. 1974; 39:340-346) относительно приблизительно 300 мкг тестостерона, продуцируемого в день у здоровых имеющих менструальный цикл женщин (см., например, Southern A.L., Further study of factors affecting the metabolite clearance rate of testosterone in man, J. Clin. Endocrinol. Metab. 1968; 28:1105-1112). В то время как неблагоприятные эффекты избытка продуцирования андрогенов, такие как встречающиеся при синдроме поликистоза яичников и некоторых андрогенпродуцирующих опухолях, были хорошо описаны (см., например, Lobo R.A., Chapter 20: Androgen excess in Infertility, Contraceptio and Reproductive Endocrinology, Third Edition. DR Mishell, V. Davajan and R. Lobo, Editors. Blackwell Scientific Publications, Boston, pp. 422-446, 1991), нормальные физиологические эффекты андрогенов у женщин были гораздо менее понятными. Как было установлено из исследований на животных, физиологии мужчин и симптомов женщин с недостаточным продуцированием андрогенов, основные физиологические эффекты андрогенов у нормальных женщин включают в себя, но не ограничиваются ими, анаболические действия на мышцы, кожу, волосы и костную ткань; стимулирующие действия на эритропоэз; модуляторные действия на иммунную функцию и физиологические действия на настроение, чувство благополучия и сексуальную функцию. Кроме того, эндогенные андрогены являются важными в развитии лобковых волос, и как считают, модулируют действие эстрогенов и прогестинов на различные репродуктивные ткани-мишени. Считается также, что андрогены играют роль в модуляции секреторной функции слезных желез. -3- 007431 Пятьдесят процентов циркулирующего тестостерона происходят из прямой секреции яичников в оболочковых (капсульных) клетках под контролем лютеинизирующего гормона. Другая половина происходит из периферического превращения предшественников андрогена надпочечников дегидроэпиандростерона, андростендиона и сульфата дегидроэпиандростерона. Тестостерон может быть также превращен в дигидротестостерон или эстрадиол. Таким образом, тестостерон служит как в качестве гормона, так и в качестве прогормона. Тестостерон циркулирует в крови, будучи на 98% связанным с белком. У женщин, приблизительно 66% этого связывания является связыванием с высокоаффинным связывающим половые гормоны глобулином. Остальные 34% являются слабо связанными с альбумином. Таким образом, ряд измерений на тестостерон возможны в клинических лабораториях. Термин «свободный» тестостерон, в данном контексте, относится к фракции тестостерона в крови, которая не связана с белком. Термин «общий тестостерон» или «тестостерон» означает в данном контексте свободный тестостерон плюс связанный с белком тестостерон. Термин «биодоступный тестостерон» относится в данном контексте к тестостерону, связанному не со связывающим половые гормоны глобулином и включает в себя тестостерон, слабо связанный с альбумином. Порядок аффинности в отношении стероидов, наиболее сильно связываемых связывающим половые гормоны глобулином, является следующим: дигидротестостерон > тестостерон > андростендион > эстроген. Связывающий половые гормоны глобулин слабо связывает дигидротестстерон, но не сульфат дигидротестостерона. Таблица 3 показывает средние уровни гормонов у нормальных предклимактерических женщин. Таблица 3. Уровни гормонов у нормальных предклимактерических женщин Однако не было общего мнения относительно того, что является «недостаточностью тестостерона» у женщин, так как исторически было невозможно разработать анализы, способные измерять такие низкие уровни гормонов. Это особенно касается измерения уровней свободного или биодоступного тестостерона. Поэтому, доступные в настоящее время лабораторные оценки, в том числе измерение уровней общего, свободного и биодоступного тестостерона в сыворотке не использовали достаточно интенсивно для идентификации гипоандрогенных женщин. В сравнении с состояниями недостаточности в отношении других гормонов, недостаточность в отношении тестостерона у женщин в значительной степени игнорировалась в качестве чего-то, реально существующего в клинике. Тем не менее, существуют хорошо определенные популяции, в которых продуцирование андрогенов является явно недостаточным и где была описана ассоциированная симптоматология, в том числе, например, молодые подвергнутые овариэктомии/экстирпации (удалению) матки женщины, женщины с дисфункцией надпочечников, женщины с индуцированной кортикостероидами супрессией надпочечников и ВИЧ-положительные женщины. Несмотря на явную пользу введения тестостерона как нормальным, так и тестостероннедостаточным женщинам, почти все препараты доставки тестостерона предназначены для гипогонадотропных мужчин, которые требуют значительно более высоких количеств тестостерона, чем тестостерон-недостаточные женщины. В результате, эти формы и приспособления являются непригодными для женщин, требующих низких доз тестостерона. Внутримышечная инъекция эфиров тестостерона, например, является популярной формой восполнения андрогенов для мужчин, но является неудовлетворительной для женщин вследствие очень высоких уровней тестостерона в первые 2-3 дня после инъекции. Кроме того, многие женщины сообщают об увеличении акне (угрей) и встречающейся иногда клиторомегалии в случае этого типа введения тестостерона. Субъекты, получающие лечение посредством инъекций, часто жалуются, что этот механизм доставки является болезненным и вызывает локальные кожные реакции. Ни один из существующих продуктов восполнения тестостерона, доступных для применения у женщин, не одобрен в Соединенных Штатах для продолжительного лечения состояния женского дефицита тестостерона, описанного здесь. Кроме того, существующие в настоящее время доступные продукты метилтестостерона, которые вводят перорально, уже не рекомендуются в качестве способа восполнения тестостерона для гипогонадотропных мужчин, см., например, Gooren LJ. G. and Polderman K.H., Safety aspects of androgens. In Testosteron: Action, Deficiency, Substitition. E. Nieschlag and HM. Behre, edi-4- 007431 tors, Springer-Verlag, Heidelberg, p. 136 (1990). Долгодействующие инъецируемые эфиры тестостерона, такие как энантат или ципионат, готовят для введения высоких доз мужчинам (например, 200-300 мг), и они продуцируют сверхфизиологические уровни гормона даже при предоставлении в более низких дозах женщинам (например, 50-100 мг) (см., например, Sherwin В.В. and Gelfand M.M., Differential symptom response to parental estrogen and/or androgen administration in the surgical menopause, Am. J. Obstet. Gynecol. 1985; 151:153-160). Имплантаты тестостерона, которые использовали экспериментально в прошлом, могут также продуцировать сверхфизиологические уровни гормона у женщин, см., например, Burger H.G. et al., The management of persistent menopausal symptoms with oestradiol-testosterone implants: clinical, lipid and hormonal results, Maturitas 1984; 6:351-358. Сверхфизиологические уровни андрогенов, связанные с этими продуктами, давали вирилизирующие (маскулинизирующие) побочные эффекты у некоторых субъектов, см., например, Burger H.G. et al., (1984). Также см., например, Sherwin B.B. and Gelfand M.M. (1985). См., также, например, Urman В., et al, Elevated serum testosterone, hirsutism and virilism associated with combined androgen-estrogen hormone replacement therapy, Obstst. Gynecol., 1991;7:595-598. Однако при признании вышеописанного, ESTRATEST®, который является комбинацией метилтестостерона и этерифицированных эстрогенов в пероральной форме таблетки, является наиболее часто используемым андрогенным продуктом, используемом для лечения женщин в Соединенных Штатах. В настоящее время его единственным одобренным показанием является использование для лечения умеренных - тяжелых симптомов, связанных с менопаузой, в тех субъектах, которым не помогают одни эстрогены. Фармакологические дозы метилтестостерона, более высокие, чем дозы, предлагаемые для гипогонадотропных мужчин, использовали также для лечения рака молочной железы у женщин. Однако пероральное введение продуцирует неподходящие уровни тестостерона и непредсказуемые картины всасывания среди субъектов (Buckler, 1998). Кроме того, поскольку печень метаболизирует этот препарат, существует риск гепатотоксичности, не говоря уже о пресистемном метаболизме. Имплантаты шариков тестостерона (50 мг или 100 мг тестостерона), вставляемые под местной анестезией в стенку брюшины, использовали вместе с имплантатами шариков эстрогена в течение многих лет. Уровни тестостерона дают пик спустя приблизительно один месяц после имплантации и затем возвращаются к уровню базовой линии (фона) на пятый или шестой месяц. Эти уровни тестостерона являются высокими и характеризуются существенными повышениями и падениями на протяжении нескольких месяцев и заметными индивидуальными вариациями в этом периоде. Кроме того, имплантаты требуют хирургической процедуры, которую многие мужчины и женщины просто не хотят переносить. У гипогонадотропных мужчин, например, терапия с использованием имплантата включает в себя риск экструзии (выталкивания) (8,5%), кровотечения (2,3%) или инфекции (0,6%). Учитывая наличие проблем, связанных со способами доставки инъецированного, вводимого перорально тестостерона и доставки на основе имплантата, исследователи начали недавно экспериментировать с препаратами более регулируемого высвобождения, которые могут обеспечивать стабильные и физиологические уровни тестостерона для женщин. В последнее десятилетие трансдермальная доставка эстрадиола стала признаваться как безопасный, физиологический и благоприятный для субъекта способ эстрогеновой заместительной терапии у женщин. Пластыри с эстрадиолом второго поколения, которые используют технологию адгезивного матрикса, стали недавно доступными в Соединенных Штатах и Европе. Матриксная технология существует теперь для трансдермального введения физиологических количеств одного тестостерона для лечения состояний дефицита андрогенов у женщин. Поскольку популяции субъектов, определенные выше, имеют приблизительно 50% дефицит продуцирования тестостерона, были сконструированы трансдермальные системы, предназначенные для доставки приблизительно половины нормальной суточной нормы тестостерона или приблизительно 150 мкг в сутки. Трансдермальное введение тестостерона на основе матриксной технологии использовали успешно для женщин при лечении истощения при синдроме приобретенного иммунодефицита и женской половой дисфункции после овариэктомии. В клинических исследованиях испытывали два пластыря с тестостероном. Buckler с сотрудниками исследовали тестостероновый пластырь (Ethical Pharmaceuticals, UK), досталяющий 840, 1100, 3000 мкг тестостерона в день при применении два раза в неделю к передней стенке брюшины, но не дали описания состава этого пластыря (Buckler 1998). Другой пластырь, пластырь TMTDS (Watson Laboratories, Salt City, UT) является прозрачным пластырем, имеющим площадь поверхности 18 см2, который использует моноолеат сорбитана в качестве усилителя проникновения, и гипоаллергенный акриловый адгезив, в не содержащем спирта матриксе. Среднее содержание тестостерона каждого пластыря равно 4,1 мг. Каждый пластырь предназначен для доставки тестостерона при номинальной дозе 150 г тестостерона в день на протяжении периода применения три-четыре дня. Таким образом, пластырь TMTDS применяют два раза в неделю (Javanbakht et al. 2000). Хотя клинические исследования сообщали, что тестостеронсодержащий пластырь способен увеличивать концентрации тестостерона у женщин за счет механизма регулируемого высвобождения, эти пластыри не обеспечивают гибкость в отношении дозы. Кроме того, их явная видимость может быть эстетически неприятной для некоторых женщин, и они имеют тенденцию сваливаться, особенно во время интенсивной физической нагрузки. -5- 007431 Таким образом, по этим и другим причинам было бы трудным, но очень желательным продвижение вперед в данной области для обеспечения эффективного подкожно вводимого стероида, участвующего в пути синтеза тестостерона, для нанесения непосредственно на кожу субъекта в форме, например, геля, мази или крема при лечении депрессивного симптома и, в частности, при лечении субъекта, который не отвечает на общепринятые антидепрессанты и/или который обнаруживает низкие или пограничные уровни тестостерона. Описание фигур Фиг. 1(a) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин перед получением 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластыря тестостерона (начальной группой лечения). Фиг. 1(b) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин в первый день лечения 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырем тестостерона (начальной группы лечения). Фиг. 1(c) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин на 30 день лечения 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырем тестостерона (начальной группы лечения). Фиг. 1(d) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин на 90 день лечения 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырем тестостерона (начальной группы лечения). Фиг. 1(e) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин на 180 день лечения 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырем тестостерона (конечной группы лечения). Фиг. 1(f) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин на 0, 1, 30, 90 и 180 день лечения 5,0 г/день AndroGel®. Фиг. 1(g) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин на 0, 1, 30, 90 и 180 день лечения 10,0 г/день AndroGel®. Фиг. 1(h) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин на 0, 1, 30, 90 и 180 день лечения пластырем тестостерона. Фиг. 2(a) является графиком, показывающим 24-часовой фармакокинетический профиль свободного тестостерона у гипогонадотропных мужчин на 1 день лечения 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырем тестостерона (начальной группы лечения). Фиг. 2(b) является графиком, показывающим 24-часовой фармакокинетический профиль свободного тестостерона у гипогонадотропных мужчин на 30 день лечения 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырем тестостерона (начальной группы лечения). Фиг. 2(c) является графиком, показывающим 24-часовой фармакокинетический профиль свободного тестостерона у гипогонадотропных мужчин на 90 день лечения 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырем тестостерона (начальной группы лечения). Фиг. 2(d) является графиком, показывающим 24-часовой фармакокинетический профиль свободного тестостерона у гипогонадотропных мужчин на 180 день лечения 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырем тестостерона (конечной группы лечения). Фиг. 2(e) является графиком, показывающим 24-часовой фармакокинетический профиль свободного тестостерона у гипогонадотропных мужчин на 0, 1, 30, 90 и 180 день лечения 5,0 г/день AndroGel®. Фиг. 2(f) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин на 0, 1, 30, 90 и 180 день лечения 10,0 г/день AndroGel®. Фиг. 2(g) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин на 0, 1, 30, 90 и 180 день лечения пластырем тестостерона. Фиг. 3 является графиком, показывающим концентрации DHT на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 4 является графиком, показывающим отношение DHT/T на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 5 является графиком, показывающим концентрации общих андрогенов (DHT+T) на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 6 является графиком, показывающим концентрации Е2 на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 7 является графиком, показывающим концентрации SHBG на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). -6- 007431 Фиг. 8(a) является графиком, показывающим концентрации FSH на 0-180 день у мужчин, имеющих первичный гипогонадизм и получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 8(b) является графиком, показывающим концентрации FSH на 0-180 день у мужчин, имеющих вторичный гипогонадизм и получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 8(c) является графиком, показывающим концентрации FSH на 0-180 день у мужчин, имеющих связанный с возрастом гипогонадизм и получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 8(d) является графиком, показывающим концентрации FSH на 0-180 день у мужчин, имеющих гипогонадизм неизвестного происхождения и получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 9(a) является графиком, показывающим концентрации LH на 0-180 день у мужчин, имеющих первичный гипогонадизм и получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 9(b) является графиком, показывающим концентрации LH на 0-180 день у мужчин, имеющих вторичный гипогонадизм и получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 9(c) является графиком, показывающим концентрации LH на 0-180 день у мужчин, имеющих связанный с возрастом гипогонадизм и получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 9(d) является графиком, показывающим концентрации LH на 0-180 день у мужчин, имеющих гипогонадизм неизвестного происхождения и получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 10(a) является графиком, показывающим оценки сексуальной мотивации на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. Фиг. 10(b) является графиком, показывающим оценки общего полового влечения на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. Фиг. 10(c) является графиком, показывающим оценки сексуального наслаждения (с партнером) на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. Фиг. 11(a) является графиком, показывающим оценки сексуальной активности на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. Фиг. 11(b) является графиком, показывающим оценки удовлетворительного выполнения эрекции на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. Фиг. 11(c) является графиком, показывающим оценки эрекции в процентах на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. Фиг. 12(a) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин перед получением 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластыря тестостерона (исходной группой лечения). Фиг. 12(b) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин в первый день лечения 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырем тестостерона (начальной группы лечения). Фиг. 12(c) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин на 30 день лечения 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырем тестостерона (начальной группы лечения). Фиг. 12(d) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин на 90 день лечения 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырем тестостерона (начальной группы лечения). Фиг. 12(e) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин на 180 день лечения 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырем тестостерона (конечной группы лечения). Фиг. 12(f) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин на 0, 1, 30, 90 и 180 день лечения 5,0 г/день AndroGel®. Фиг. 12(g) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин на 0, 1, 30, 90 и 180 день лечения 10,0 г/день AndroGel®. -7- 007431 Фиг. 12(h) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин на 0, 1, 30, 90 и 180 день лечения пластырем тестостерона. Фиг. 13(a) является графиком, показывающим 24-часовой фармакокинетический профиль свободного тестостерона у гипогонадотропных мужчин на 1 день лечения 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырем тестостерона (начальной группы лечения). Фиг. 13(b) является графиком, показывающим 24-часовой фармакокинетический профиль свободного тестостерона у гипогонадотропных мужчин на 30 день лечения 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырем тестостерона (начальной группы лечения). Фиг. 13(c) является графиком, показывающим 24-часовой фармакокинетический профиль свободного тестостерона у гипогонадотропных мужчин на 90 день лечения 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырем тестостерона (начальной группы лечения). Фиг. 13(d) является графиком, показывающим 24-часовой фармакокинетический профиль свободного тестостерона у гипогонадотропных мужчин на 180 день лечения 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырем тестостерона (конечной группы лечения). Фиг. 13(e) является графиком, показывающим 24-часовой фармакокинетический профиль свободного тестостерона у гипогонадотропных мужчин на 0, 1, 30, 90 и 180 день лечения 5,0 г/день AndroGel®. Фиг. 13(f) является графиком, показывающим 24-часовой фармакокинетический профиль свободного тестостерона у гипогонадотропных мужчин на 0, 1, 30, 90 и 180 день лечения 10,0 г/день AndroGel®. Фиг. 13(g) является графиком, показывающим 24-часовой фармакокинетический профиль тестостерона у гипогонадотропных мужчин на 0, 1, 30, 90 и 180 день лечения пластырем тестостерона. Фиг. 14 является графиком, показывающим концентрации DHT на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 15 является графиком, показывающим отношение DHT/T на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 16 является графиком, показывающим концентрации общих андрогенов (DHT+T) на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 17 является графиком, показывающим концентрации Е2 на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 18 является графиком, показывающим концентрации SHBG на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 19(a) является графиком, показывающим концентрации FSH на 0-180 день у мужчин, имеющих первичный гипогонадизм и получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 19(b) является графиком, показывающим концентрации FSH на 0-180 день у мужчин, имеющих вторичный гипогонадизм и получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 19(c) является графиком, показывающим концентрации FSH на 0-180 день у мужчин, имеющих связанный с возрастом гипогонадизм и получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 19(d) является графиком, показывающим концентрации FSH на 0-180 день у мужчин, имеющих гипогонадизм неизвестного происхождения и получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 20(a) является графиком, показывающим концентрации LH на 0-180 день у мужчин, имеющих первичный гипогонадизм и получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 20(b) является графиком, показывающим концентрации LH на 0-180 день у мужчин, имеющих вторичный гипогонадизм и получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 20(c) является графиком, показывающим концентрации LH на 0-180 день у мужчин, имеющих связанный с возрастом гипогонадизм и получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фигура № 20(d) является графиком, показывающим концентрации LH на 0-180 день у мужчин, имеющих гипогонадизм неизвестного происхождения и получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 21(a) является диаграммой в виде столбцов, показывающей изменение BMD тазобедренного сустава у гипогонадотропных мужчин после 180 дней лечения 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырем тестостерона. -8- 007431 Фиг. 21(b) является диаграммой в виде столбцов, показывающей изменение BMD позвоночника у гипогонадотропных мужчин после 180 дней лечения 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырем тестостерона. Фиг. 22 является графиком, показывающим концентрации РТН на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 23 является графиком, показывающим концентрации SALP на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 24 является графиком, показывающим концентрации остеокальцина на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 25 является графиком, показывающим концентрации проколлагена типа I на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 26 является графиком, показывающим отношение N-телопептид/Cr на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 27 является графиком, показывающим отношение Са/Cr на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона (начальной группы лечения). Фиг. 28а(а) является графиком, показывающим оценки сексуальной мотивации на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. Фиг. 28(b) является графиком, показывающим оценки общего полового влечения на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. Фиг. 28(c) является графиком, показывающим оценки сексуального наслаждения (с партнером) на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. Фиг. 29(a) является графиком, показывающим оценки сексуальной активности на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. Фиг. 29(b) является графиком, показывающим оценки удовлетворительного выполнения эрекции на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. Фиг. 29(c) является графиком, показывающим оценки эрекции в процентах на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. Фиг. 30(a) является графиком, показывающим оценки позитивного настроения на 0-180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. Фиг. 31 (а) является диаграммой в виде столбцов, показывающей изменение в силе ног на 90 и 180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. Фиг. 31(b) является диаграммой в виде столбцов, показывающей изменение в силе рук на 90 и 180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. Фиг. 32(a) является диаграммой в виде столбцов, показывающей изменение в общей массе тела на 90 и 180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. Фиг. 32(b) является диаграммой в виде столбцов, показывающей изменение в нежирной массе тела на 90 и 180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. Фиг. 32(c) является диаграммой в виде столбцов, показывающей изменение в массе жира на 90 и 180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. Фиг. 32(d) является диаграммой в виде столбцов, показывающей изменение в процентах жира тела на 90 и 180 день у гипогонадотропных мужчин, получающих 5,0 г/день AndroGel®, 7,5 г/день AndroGel®, 10,0 г/день AndroGel® или пластырь тестостерона. -9- 007431 Фиг. 33 является блок-схемой, показывающей прогресс субъекта в восьминедельном рандомизированном контролируемом плацебо испытании действия на депрессию трансдермального геля тестостерона. Фиг. 34 является линейным графиком, показывающим оценки в баллах по шкале оценок депрессии Гамильтона в восьминедельном рандомизированном контролируемом плацебо испытании действия на депрессию трансдермального геля тестостерона. Фиг. 35 является линейным графиком, показывающим баллы общего клинического впечатления в восьминедельном рандомизированном контролируемом плацебо испытании действия на депрессию трансдермального геля тестостерона. Фиг. 36 является линейным графиком, показывающим баллы по опроснику депрессии Бека в восьминедельном рандомизированном контролируемом плацебо испытании действия на депрессию трансдермального геля тестостерона. Сведения, подтверждающие возможность осуществления изобретения Хотя данное изобретение может быть осуществлено во многих различных формах, здесь обсуждаются несколько характерных вариантов с пониманием того, что данное раскрытие должно рассматриваться только как пример принципов данного изобретения и не предназначено для ограничения данного изобретения иллюстрированными вариантами. Когда данное изобретение иллюстрируется здесь с конкретной ссылкой на тестостерон, должно быть понятно, что любой другой стероид в путь синтеза тестостерона может, если желательно, заменять в целом или частично тестостерон в способах, наборах, комбинациях и композициях, описанных здесь. Когда данное изобретение иллюстрируется здесь с конкретной ссылкой на метилтестостерон, должно быть понятно, что любой другой агент, который ингибирует синтез связывающего половые гормоны глобулина (SHBG), может, если желательно, заменять в целом или частично метилтестостерон в способах, наборах, комбинациях и композициях, описанных здесь. Когда данное изобретение иллюстрируется здесь с конкретной ссылкой на эстроген, должно быть понятно, что любой другой эстрогенный гормон может, если желательно, заменять в целом или частично эстроген в способах, наборах, комбинациях и композициях, описанных здесь. Данное изобретение относится к способам, наборам, комбинациям и композициям для лечения, предупреждения или уменьшения риска развития депрессивного нарушения или симптомов, связанных с ним, или нарушения, родственного депрессивному нарушению, у субъекта, нуждающемся в таком лечении или предупреждении. Этот способ предусматривает введение, например, чрезкожно субъекту эффективного в отношении депрессивного нарушения количества стероида в синтетическом пути тестостерона, например, тестостерона. Данное изобретение включает в себя способы обращения, задержки или замедления прогрессирования депрессивного нарушения, как только оно становится клинически очевидным, или лечения симптомов, ассоциированных с депрессивным нарушением или родственных депрессивному нарушению. Субъект может уже иметь депрессивное нарушение в момент введения или может находиться при риске развития депрессивного нарушения. В данное изобретение включен также способ введения субъекту, нуждающемуся в таком введении, стероида в путь синтеза тестостерона, например, тестостерона. В одном варианте, этот способ предусматривает введение субъекту эффективного в отношении депрессивного нарушения количества чрезкожно доставляемой композиции, состоящей из фармацевтически приемлемого стероида в путь синтеза тестостерона, например, тестостерона, одного или нескольких низших спиртов, таких как этанол или изопропанол, усиливающего проникновение агента, загущающего агента и воды. В эти способы, наборы, комбинации и композиции данного изобретения включена также фармацевтическая композиция, содержащая эффективное в отношении депрессивного нарушения количество тестостерона. В одном варианте композицию тестостерона готовят в виде геля, мази, крема или пластыря. Еще в одном варианте осуществления композиция тестостерона является водно-спиртовым гелем. В другом варианте осуществления эта композиция является гелем, содержащим тестостерон, один или несколько низших спиртов, таких как этанол или изопропанол, агент усиления проникновения, загущающий агент и воду. Данное изобретение включает в себя также наборы, содержащие доставляемый чрескожно тестостерон. Эти наборы содержат также комплект инструкций для субъекта. В другом варианте осуществления эти способы, наборы, комбинации и композиции используют вместе с другим стероидом или фармацевтическим агентом, эффективным в лечении, предупреждении или уменьшении риска развития депрессивного нарушения. Фармацевтический агент, эффективный в лечении, предупреждении или уменьшении риска развития депрессивного нарушения, включает в себя, но не ограничивается ими, эстрогенный гормон, агент, который ингибирует синтез связывающего половые гормоны глобулина, и антидепрессант. В одном варианте осуществления композицию данного изобретения вводят один раз, два раза или три раза в день или столько раз, сколько это необходимо для достижения желаемого терапевтического эффекта. В другом варианте осуществления композицию данного изобретения вводят один раз, два раза или три раза в день в чередующиеся дни. В другом варианте осуществления композицию данного изо- 10 - 007431 бретения вводят один раз, два раза или три раза в день один раз в неделю, один раз в две недели или один раз в месяц. В одном варианте осуществления данное изобретение использует тестостерон вместе с фармакологически эффективным количеством эстрогенного гормона, агента, который ингибирует синтез связывающего половые гормоны глобулина, или антидепрессанта в той же самой дозированной форме или в отдельной дозированной форме. В другом варианте осуществления эти способы, наборы, комбинации и композиции используют с другим стероидом или фармацевтическим агентом, который увеличивает уровни тестостерона в субъекте, например, агентом, который ингибирует синтез связывающего половые гормоны глобулина, например, метилтестостероном или флуоксиместероном. Еще в одном варианте осуществления, данное изобретение использует пакет, имеющий полиэтиленовый вкладыш, совместимый с компонентами этого геля. В другом варианте осуществления способы, наборы, комбинации и композиции используют композицию, которую распределяют из жесткого многодозового контейнера (например, ручным насосом), причем внутри контейнера находится больший пакет из фольги, содержащий эту композицию. Такие большие пакеты могут также иметь полиэтиленовый вкладыш. Кроме того, способы, наборы, комбинации и композиции данного изобретения необязательно включают в себя соль, сложный эфир, амид, энантиомер, изомер, таутомер, пролекарство или производное агента данного изобретения, а также мягчительное средство, стабилизатор, антимикробный агент, ароматизирующий агент или пропеллент. Способы, наборы, комбинации и композиции данного изобретения обеспечивают повышенные возможности лечения депрессивного нарушения в субъекте, например, мужчине или женщине, в сравнении с доступными в настоящее время. Наряду с полезностью для лечения человека, данное изобретение применимо также для ветеринарного лечения домашних животных-млекопитающих, экзотических животных и сельскохозяйственных животных, в том числе, млекопитающих, грызунов и т.п. В одном варианте осуществления млекопитающее включает в себя лошадь, собаку или кошку. Класс стероидов в пути синтетическом тестостерона, применимый в способах, наборах, комбинациях и композициях данного изобретения, включает в себя стероиды в анаболическом или катаболическом пути тестостерона. В широком аспекте данного изобретения активные ингредиенты, применяемые в данном изобретении, могут включать в себя анаболические стероиды, такие как андроизоксазол, боластерон, клостебол, этилэстренол, формилдиенолон, 4-гидрокси-1-нортестостерон, метенолон, метилтриенолон, нандролон, оксиместерон, хинболон, стенболон, тренболон; андрогенные стероиды, такие как болденон, флуоксиместерон, местанолон, местеролон, метандростенолон, 17-α-метилтестостерон, 3-циклопентиленоловый эфир 17-альфа-метилтестостерона, норэтандролон, норметандрон, оксандролон, оксиметолон, прастерон, станлолон, станозолол, дигидротестостерон, тестостерон; и прогестогены, такие как анагестон, ацетат хлормадинона, ацетат делмадинона, демегестон, диметистерон, дигидрогестерон, этинилэстренол, этистерон, этинодиол, диацетат этинодиола, ацетат флурогестона, гестоден, капроат гестонорона, галопрогестерон, 17-гидрокси-16-метиленпрогестерон, 17-альфа-гидроксипрогестерон, капроат 17альфа-гидроксипрогестерона, медрогестон, медроксипрогестерон, ацетат мегестрола, меленгестрол, норэтиндрон, ацетат норэтиндрона, норэтинодрел, норгестерон, норгестимат, норгестрел, норгестриенон, 19-норпрогестерон, норвинистерон, пентагестрон, прогестерон, промегестон, хингестрон и тренгестон; и все соли, сложные эфиры, амиды, энантиомеры, изомеры, таутомеры, пролекарства и производные этих соединений. (Частично на основе перечня, обеспеченного в The Merck Index, Merck & Co. Rahway, N.J. (1998)). В описанных здесь способах, наборах, комбинациях и композициях могут быть использованы комбинации вышеуказанных стероидов. Антидепрессанты, применимые в способах, наборах, комбинациях и композициях данного изобретения, включают в себя, например, бициклические соединения, такие как бинедалин, кароксазон, циталопрам, диметазан, фенкамин, индалпин, гидрохлорид инделоксзина, нефопам, номифензин, окситриптан, оксипертин, пароксетин, сертралин, тиазезим и тразодон; гидразиды/гидразины, такие как бенмоксин, ипроклозид, ипрониазид, изокарбоксазид, ниаламид, октамоксин и фенелзин; пирролидоны, такие как котинин, ролициприн или ролипрам; тетрациклические соединения, такие как мапротилин, метралиндол, миансерин и митразепин; трициклические соединения, такие как адиназолам, амитриптилин, амитриптилиноксид, амоксаприн, бутриптилин, кломипрамин, демексиптилин, дезипрамин, дибензепин, диметакрин, дотиепин, доксепин, флуацизин, имипрамин, имипрамин-N-оксид, иприндол, лофепрамин, мелитрацен, метапрамин, нортриптилин, ноксиптилин, опипрамол, пизотилин, пропизепин, протриптилин, хинупрамин, тианептин и тримипрамин; и другие, такие как адрафинил, амоксапин, бенактизин, бупропион, бутацетин, диоксадрол, дулоксетин, этоперидон, фебарбамат, фемоксетин, фенпентадиол, флуоксетин, флувоксамин, гематопорфирин, гиперицин, левофацетоперан, медифоксамин, милнаципран, минаприн, моклобемид, мапротлин, миртазапин, нефазодон, оксафлозан, фенелзин, пибералин, пролинтан, пирисукцидеанол, ритансерин, роксиндол, хлорид рубидия, сулприд, тандоспирон, тозалинон, тофенацин, толоксатон, транилципромин, тразодон, L-триптофан, венлафакцин, вилоксазин и зимелдин; и все - 11 - 007431 все соли, сложные эфиры, амиды, энантиомеры, изомеры, таутомеры, пролекарства и производные этих соединений. (Частично на основе перечня, обеспеченного в The Merck Index, Merck & Co. Rahway, N.J. (1998)). В описанных здесь способах, наборах, комбинациях и композициях могут быть использованы комбинации вышеуказанных антидепрессантов. Другие классы антидепрессантов, применимые в способах, наборах, комбинациях и композициях данного изобретения, включают в себя, например, агенты против болезни Паркинсона, такие как амантадин, бенсеразид, биетанаутин, бипериден, бромокриптин, будипин, карбидопа, дексетимид, диэтазин, дроксидопа, этопропазин, этилбензгидрамин, лазабемид, леводопа, мофегилин, перголид, пирогептин, прамипексол, придинол, продипин, ропинирол, селегилин, талипексол, тергурид и гидрохлорид тригексилфенидила; антипсихотические агенты, такие как бензамиды: ализаприд, амисулприд, немоаприд, ремоксиприд, сулприд и сультоприд; бензизоксазолы, такие как рисперидон; бутирофеноны, такие как бенперидол, бромперидол, дроперидол, флуанизон, галоперидол, мелперон, моперон, пипамперон, спиперон, тимиперон и трифлуперидол; фенотиазины, такие как ацетофеназин, бутаперазин, карфеназин, хлорпроэтазин, хлорпромазин, клоспиразин, циамемазин, диксиранзин, флуфеназин, имиклопазин, мепазин, мезоридазин, метоксипромазин, метофеназат, оксафлумазин, перазин, перициазин, периметазин, перфеназин, пиперацетазин, пипотиазин, прохлорперазин, промазин, сульфоридазин, тиопропазат, тиопроперазин, тиоридазин, трифлуоперазин и трифлупромазин; тиоксантены, такие как хлорпротиксен, клопентиксол, тиотиксен; другие трициклические соединения, такие как бензхинамид, каприпрамин, клокапрамин, кломакран, клотиапин, клозапин, мозапрамин, оланзапин, опипрамол, протипендил, серокел®, тетрабеназин и зотепин; и другие агенты против болезни Паркинсона, такие как бурамат, флуспирилен, молиндон, пенфлуридол, пимозид, ципразидон; агонисты рецептора допамина, такие как бромокриптин, каберголин, кармоксирол, допексамин, фенолдопам, ибопамин, лизурид, перголид, прамипексол, хинаголид, ропинрол, роксиндол и талипексол; антагонисты рецептора допамина, такие как амисулприд, клебоприд, домперидон, метоклопрамид, мозапрамин, немонаприд, ремоскиприд, рисперидон, сулприд, султоприд, и ципразидон; ингибирующие моноаминоксидазу агенты, такие как ипроклозид, ипрониазид, изокарбоксазид, лазабемид, мофегилин, моклобемид, октамоксин, паргилин, фенелзин, феноксипропазин, пивалилбензгидразин, продипин, селегилин и толоксатон, транилципромин; и селективные ингибиторы повторного поглощения серотонина, такие как циталопрам, флуоксетин, флувоксамин, венлафаксин, сетралин, пароксетин; и все соли, сложные эфиры, амиды, энантиомеры, изомеры, таутомеры, пролекарства и производные этих соединений. (Частично на основе перечня, обеспеченного в The Merck Index, Merck & Co. Rahway, N.J. (1998)). В описанных здесь способах, наборах, комбинациях и композициях могут быть использованы комбинации вышеуказанных антидепрессантов. Иллюстративно, представляющие особенный интерес антидепрессанты, которые могут быть использованы в способах, наборах, комбинациях и композициях данного изобретения, включают в себя, но не ограничиваются ими, Ativan®, Librium®, Tranxene®, Valium®, Xanax®, Atarax®, BuSpar®, Effexor®, Mebaral®, Miltown®, Paxil®, Sinequan®, Triavil®, Vistaril®, Remeron®, Serzone®, Wellbutrin®, Nardil®, Parnate®, Celexa®, Prozac®, Zoloft®, Elavil®, Etrafon®, Norpramin®, Surmontil®, Vivactil®, Depakote®, Eskalith®, lithium, Lithobid®, Klonopin®, Clozaril®, Haldol®, Loxitane®, Moban®, Navane®, Orap®, Risperdal®, Seroquel®, Zyprexa®, Compazine®, Serentil®, Stelazine®, Thioridazine®, Trilafon® и Luvox®. В описанных здесь способах, наборах, комбинациях и композициях могут быть использованы комбинации вышеуказанных антидепрессантов. Класс стероидов или фармацевтических агентов, который увеличивает уровни тестостерона у субъекта, применимый в способах, наборах, комбинациях и композициях данного изобретения, включает в себя соединения, которые ингибируют синтез связывающего половые гормоны глобулина. Связывающий половые гормоны глобулин является сывороточным белком, и о нем известно, что он связывает тестостерон и эстрадиол, действуя на биологическую активность этих гормонов. Характерные представляющие интерес соединения, которые ингибируют синтез связывающего половые гормоны глобулина, включают в себя, но не ограничиваются ими, метилтестостерон и флуоксиместерон, и все соли, сложные эфиры, амиды, энантиомеры, изомеры, таутомеры, пролекарства и производные этих соединений. В описанных здесь способах, наборах, комбинациях и композициях могут быть использованы комбинации вышеуказанных соединений. Метилтестостерон доступен в настоящее время в различных формах, в том числе в формах для перорального введения, например, таких как ANDROID® и TESTRED®. Флуоксиместерон также доступен в настоящее время в различных формах, в том числе в формах для перорального введения, например, таких как HALOSTESTIN®. Не желая связывать себя теорией, авторы данного изобретения считают, что метилтестерон снижает синтез в печени эндогенных белков, таких как связывающий половые гормоны глобулин. Это снижение в синтезе приводит к снижению концентраций в крови связывающего половые гормоны глобулина, который является первичным средством транспорта эндогенных гормонов. Затем снижение связывающего половые гормоны глобулина вызывает увеличение концентрации свободных гормонов для связывания на рецепторе. Трансдермальное введение андрогена, например, тестостерона или эстрогена, например, эстрадиола, обходит пресистемный метаболизм и может обеспечивать средство увеличения концентраций гормонов в кровотоке. Таким образом, при применении в комбинации, метилтестостерон и чрескожно - 12 - 007431 введенный тестостерон (и необязательно эстрадиол) производят более сильное терапевтическое действие и обеспечивают средство увеличения концентраций гормонов в кровотоке. Метилтестостерон и тестостерон (и необязательно эстрадиол) производят более сильное терапевтическое действие, чем любой из них по отдельности, так как уменьшение способности связывания гормонов связано с увеличенной биодоступностью гормонов в связи с образованием более высоких концентраций свободных гормонов, чем концентрации, которые обеспечивал бы только тестостерон. В другом варианте осуществления данного изобретения эстрогенным гормоном, который может использоваться вместе с этими способами, наборами, комбинациями и композициями, является природно встречающийся эстроген 17-бета-эстрадиол (бета-эстрадиол; 1,3,5(10)-эстратриен-3,17-бета-диол). Могут быть использованы другие эстрогенные стероидные гормоны в частичной или полной замене 17-бетаэстрадиола, например, сложный эфир, который является биологически совместимым и может эффективно всасываться трансдермально. Этими эфирами могут быть, например, эстрадиол-3,17-диацетат; эстрадиол-3-ацетат; эстрадиол-15-ацетат; эстрадиол-3,17-дивалерат; эстрадиол-3-валерат; эстрадиол-17валерат; 3-моно-, 17-моно- и 3,17-дипропионатные эфиры, соответствующие ципионату, гептаноату, бензоату и подобным эфирам; этинилэстрадиол; эстрон и другие эстрогенные стероиды и их соли, энантиомеры, изомеры, таутомеры, пролекарства и производные, которые могут быть введены трансдермальным способом. Другие родственные эстрогену соединения, которые могут быть использованы в способах, наборах, комбинациях и композициях данного изобретения, включают в себя, но не ограничиваются ими, конъюгированные эстрогены (в том числе сульфат эстрона, эквилин и 17-альфа-дигидроэквилин), валерат эстрадиола, эстриол, эстрон, сульфат эстрона, эстропиапат, этинилэстрадиол, местранол и все соли, сложные эфиры, энантиомеры, изомеры, таутомеры, пролекарства и производные этих соединений. Эстрогенные гормоны доступны в настоящее время в различных формах, в том числе, но не только, в формах, доступных в виде крема, пессария, вагинального кольца, вагинальной таблетки, трансдермального препарата, геля и таблетки для перорального введения. Примеры вагинальных кремов включают в себя PREMARIN® (конъюгированный эстроген), ORTHO DIENOSTEROL® (диеностерол) и OVESTIN® (эстриол). Доступные формы пессариев включают в себя ORTHO-GYNEST® (эстриол) и TAMPOVAGAN® (стилбестрол). Примером формы вагинального кольца является ESTR1NG® (эстрадиол), а примером вагинальной таблетки является VAGIFEM® (эстрадиол). Доступные трансдермальные препараты эстрогена, содержащие эстрадиол, включают в себя ERC ALORA®, CLIMARA®, DERMESTRIL®, ESTRADERM®, ESTRADERM® TTS, ESTRADERM® MX, EVOREL®, FEMATRIX®, FEMPATCH®, FEMSEVEN®, MENOREST®, PROGYNOVA® TS и VIVELLE®. Гели эстрогена, содержащие эстрадиол, включают в себя ESTRAGEL (разрабатываемый заявителем) и SANDRENA®. Эстрадиол доступен также в виде шарика-имплантата, например, ESTRADIOL IMPLANT®. Формы таблеток включают в себя PREMARIN® (конъюгированный эстроген), ESTRATAB® (этерифицированный эстроген), ESTRATEST® (этерифицированный эстроген, метилтестостерон), MENEST® (этерифицированный эстроген), CLIMAGEST® (эстрадиол), CLIMAVAL® (эстрадиол), ELLESTE SOLO® (эстрадиол), ESTRACE® (эстрадиол), PROGYNOVA® (эстрадиол), ZUMENON® (эстрадиол), HORMONIN® (эстрадиол, эстрон, эстриол), HARMOEN® (эстрон), OGEN® (эстропипат), и ORTHO-EST® (эстропипат). В описанных здесь способах, наборах, комбинациях и композициях могут быть использованы комбинации вышеуказанных эстрогенных гормонов. В одном варианте осуществления тестостерон готовят в виде водно-спиртового геля. В другом варианте осуществления этот гель содержит тестостерон, один или более низших спиртов, таких как этанол или изопропанол, усиливающий проникновение агент, загущающий агент и воду. Кроме того, этот гель необязательно включает в себя соль, сложный эфир, амид, энантиомер, изомер, таутомер, пролекарство или производное тестостерона, а также мягчитель, стабилизатор, антимикробный агент, ароматизатор или пропеллент. Иллюстративно, некоторые формы данного изобретения доставляют приблизительно 0,01 г - приблизительно 100 г тестостерона, или его эквивалента, субъекту на одну дозированную единицу. В другом варианте осуществления данного изобретения, формы данного изобретения доставляют приблизительно 0,1 г -приблизительно 10 г тестостерона, или его эквивалента, субъекту на одну дозированную единицу. Еще в одном варианте осуществления данного изобретения, формы данного изобретения доставляют приблизительно 0,17 г - приблизительно 5 г тестостерона, или его эквивалента, субъекту на одну дозированную единицу. В другом варианте осуществления данного изобретения, формы данного изобретения доставляют приблизительно 1 г тестостерона, или его эквивалента, субъекту на одну дозированную единицу. Еще в одном варианте осуществления данного изобретения, формы данного изобретения доставляют приблизительно 0,25 г тестостерона, или его эквивалента, субъекту на одну дозированную единицу. Таким образом, например, гель, мазь, крем или пластырь тестостерона, приготовленный в виде единственной дозы для введения один раз в день, содержит приблизительно 0,17 г или приблизительно 0,25 г, или приблизительно 0,5 г тестостерона или приблизительно 1,0 г тестостерона, тогда как гель, мазь, крем или пластырь, приготовленный в виде единственной дозы для введения один раз в неделю, содержит приблизительно 1,19 г или приблизительно 1,75 г, или приблизительно 3,50 г тестостерона или приблизительно 7,0 г тестостерона, соответственно. - 13 - 007431 В одном варианте осуществления, эта форма представляет собой гель, мазь, крем или пластырь и состоит из тестостерона; усиливающего проникновение агента, такого как изопропилмиристат; загущающего агента, такого как карбопол; низшего спирта, такого как изопропанол; и воды. В другом варианте эта форма представляет собой гель, мазь, крем или пластырь и состоит из следующих веществ в приблизительных процентах: Таблица 4. Состав композиции тестостерона Иллюстративно, в 100 г композиция, гель, мазь, крем или пластырь может содержать приблизительно 0,01 г - 70 г тестостерона, приблизительно 0,01 г - приблизительно 50 г усиливающего проникновение агента, приблизительно 0,1 г - 50 г загущающего агента и приблизительно 30 г - приблизительно 98 г низшего спирта. В другом варианте, в 100 г композиция, гель, мазь, крем или пластырь может содержать приблизительно 0,1 г - 10 г тестостерона, приблизительно 0,1 г - приблизительно 5 г усиливающего проникновение агента, приблизительно 0,1 г - 5 г загущающего агента и приблизительно 45 г - приблизительно 90 г низшего спирта. Еще в одном варианте, эта композиция представляет собой гель, мазь, крем или пластырь, которые содержат высвобождающий гидроксид агент, такой как гидроксид натрия (например, 0,1н. NaOH) в количестве приблизительно 0,1% - приблизительно 10% (м/м) композиции. В одном варианте осуществления, эта форма представляет собой гель и содержит следующие вещества в приблизительных весовых количествах: Таблица 5. Композиция AndroGel® * Соответствует 67 г этанола. В другом варианте эта форма представляет собой гель и состоит из следующих веществ в приблизительных весовых количествах: Таблица 6. Композиция Relibra® * Соответствует 67 г этанола. Еще в одном варианте эта композиция содержит тестостерон в количестве, большем, чем 0,01%, усиливающий проникновение агент в количестве, большем, чем приблизительно 0,1%, загущающий агент в количестве, большем, чем приблизительно 0,1%, и низший спирт в количестве, большем, чем приблизительно 30% (м/м), этой композиции. Гель, мазь, крем или пластырь втирают или помещают на зону кожи субъекта и дают высохнуть. Например, гель, мазь или крем втирают на зону кожи, например, на верхней наружной части бедра и/или на тазобедренном суставе один раз в день. После нанесения субъект должен вымыть руки. Нанесение этого геля приводит к увеличенному уровню тестостерона, имеющему желаемый фармакокинетический профиль, эффективный для лечения, предупреждения или снижения риска развития депрессивного нарушения, или симптомов, связанных с депрессивным нарушением или родственных депрессивному нарушению, у субъекта. Таким образом, эта композиция применима для лечения ряда нарушений, состояний или заболеваний как у мужчин, так и у женщин. В одном варианте осуществления данного изобретения обеспечен способ для лечения, предупреждения или снижения риска развития депрессивного нарушения у субъекта, нуждающегося в этом, т.е. у субъекта, который, как показано, имеет депрессивное нарушение или находится при риске развития депрессивного нарушения. Этот способ предусматривает введение эффективного в отношении депрессив- 14 - 007431 ного нарушения количества композиции на зону кожи субъекта для доставки стероида в синтетическом пути тестостерона в сыворотку крови субъекта. Эта композиция содержит: (a) приблизительно 0,01% - приблизительно 70% (м/м) стероида в пути синтеза тестостерона; (b) приблизительно 0,01% - приблизительно 50% (м/м) усиливающего проникновение агента; (c) приблизительно 0,01% - приблизительно 50% (м/м) загущающего агента и (d) приблизительно 30% - приблизительно 98% (м/м) низшего спирта. Эта композиция способна высвобождать стероид после нанесения этой композиции на кожу при скорости и продолжительности, которые доставляют, по меньшей мере, приблизительно 10 мкг в день стероида в сыворотку крови данного субъекта. В одном варианте данного изобретения стероидом в пути синтеза тестостерона является тестостерон. В другом варианте способов, наборов, комбинаций и композиций данного изобретения эта композиция способна высвобождать тестостерон после нанесения этой композиции на кожу субъекта при скорости и продолжительности, которые достигают циркулирующей сывороточной концентрации тестостерона, большей, чем приблизительно 400 нг на дл сыворотки, во время периода времени, начинающегося спустя приблизительно 2 ч после введения и кончающегося спустя приблизительно 24 ч после введения. В другом варианте способов, наборов, комбинаций и композиций данного изобретения эта композиция способна высвобождать тестостерон после нанесения этой композиции на кожу субъекта при скорости и продолжительности, которые достигают циркулирующей сывороточной концентрации тестостерона, большей, чем приблизительно 400 нг тестостерона на дл сыворотки - приблизительно 1050 нг тестостерона на дл сыворотки. В другом варианте способов, наборов, комбинаций и композиций данного изобретения для каждого нанесения приблизительно 0,1 г в день композиции данного изобретения на кожу субъекта происходит увеличение, по меньшей мере, приблизительно 5 нг/дл сывороточной концентрации тестостерона у субъекта. В другом варианте способов, наборов, комбинаций и композиций данного изобретения композиция данного изобретения предоставляется субъекту для введения один раз в день в дозе приблизительно 0,1 г - приблизительно 10 г. Еще в одном варианте способов, наборов, комбинаций и композиций данного изобретения субъект, нуждающийся в лечении, имеет уровень сывороточного тестостерона перед первым нанесением (перед обработкой) композиции данного изобретения, меньший, чем приблизительно 300 нг/дл. В другом варианте способов, наборов, комбинаций и композиций данного изобретения, после, по меньшей мере, 30 дней введения один раз в день композиции данного изобретения сывороточная концентрация тестостерона у субъекта равна по меньшей мере 490 нг/дл - приблизительно 860 нг/дл. В еще одном варианте способов, наборов, комбинаций и композиций данного изобретения, после, по меньшей мере, 30 дней введения один раз в день композиции данного изобретения общая сывороточная концентрация андрогенов у субъекта равна по меньшей мере 372 нг/дл. В другом варианте способов, наборов, комбинаций и композиций данного изобретения композицию данного изобретения вводят субъекту один раз, два раза или три раза в день в течение, по меньшей мере, приблизительно 7 дней. Данное изобретение обеспечивает также способ лечения, предупреждения или снижения риска развития депрессивного нарушения у субъекта, нуждающегося в этом, т.е. субъекта, который, как показано, имеет депрессивное нарушение или находится при риске развития депрессивного нарушения, введением этому субъекту: (а) количества композиции, содержащей (i) приблизительно 0,01% - приблизительно 70% (м/м) стероида в пути синтеза тестостерона; (ii) приблизительно 0,01% - приблизительно 50% (м/м) усиливающего проникновение агента; (iii) приблизительно 0,01% - приблизительно 50% (м/м) загущающего агента и (iv) приблизительно 30% - приблизительно 98% (м/м) низшего спирта, и (b) количества терапевтического агента, содержащего антидепрессант, ингибитор синтеза связывающего половые гормоны глобулина или эстрогенного гормона. Эту композицию вводят на зону кожи субъекту для доставки стероида в путь синтеза пути тестостерона в сыворотку крови субъекта, и она способна высвобождать этот стероид после нанесения этой композиции на кожу при скорости и продолжительности, которые доставляют, по меньшей мере, приблизительно 10 мкг в день стероида в сыворотку крови данного субъекта. Это количество композиции и количество терапевтического агента вместе составляют эффективное в отношении депрессивного нарушения количество. В одном варианте способов, наборов, комбинаций и композиций данного изобретения эту композиция и терапевтический агент обеспечивают в виде отдельных компонентов в наборе. В другом варианте способов, наборов, комбинаций и композиций данного изобретения эту композицию и терапевтический агент вводят по существу одновременно или последовательно. - 15 - 007431 Еще в одном варианте способов, наборов, комбинаций и композиций данного изобретения этот терапевтическиий агент вводят перорально, чрескожно, внутривенно, внутримышечно или прямой абсорбцией через ткань слизистой оболочки. Данное изобретение обеспечивает также фармацевтическую композицию, содержащую: (i) приблизительно 0,01% - приблизительно 70% (м/м) стероид в пути синтеза тестостерона; (ii) приблизительно 0,01% - приблизительно 50% (м/м) усиливающего проникновение агента; (iii) приблизительно 0,01% - приблизительно 50% (м/м) загущающего агента и (iv) приблизительно 30% - приблизительно 98% (м/м) низшего спирта, и (v) терапевтический агент, содержащий антидепрессант, ингибитор синтеза связывающего половые гормоны глобулина или эстрогенный гормон. Эту композицию вводят на зону кожи субъекту для доставки тестостерона и терапевтического агента в сыворотку крови субъекта, и она способна высвобождать этот стероид после нанесения этой композиции на кожу при скорости и продолжительности, которые доставляют, по меньшей мере, приблизительно 10 мкг в день стероида в сыворотку крови данного субъекта. Это количество тестостерона и количество терапевтического агента вместе составляют эффективное в отношении депрессивного нарушения количество. Достижение желаемых скоростей доставки, демонстрируемое гелем тестостерона, может быть оценено из фармакокинетики в геле тестостерона у мужчин. Средние величины сывороточной концентрации (Cavg) у мужчин после нанесения варьирующихся количеств геля на верхнюю часть тела приведены ниже в табл. 7. Таблица 7. Средние концентрации сывороточного тестостерона и скорость доставки в день после введения геля 1% тестостерона у мужчин а Скорость метаболического клиренса вводимого один раз в день тестостерона = 600 л/день На основании результатов, полученных для мужчин, доза 0,5 граммов геля тестостерона доставляет приблизительно 300 мкг тестостерона в день. Иллюстративно, для взрослой женщины, эффективное в отношении депрессивного нарушения количество тестостерона на дозу для введения один раз в день доставляет в сыворотку крови обычно приблизительно 10 мкг тестостерона в день или приблизительно 25 мкг - приблизительно 150 мкг - приблизительно 300 мкг тестостерона в день. Таким образом, для достижения уровня в сыворотке крови приблизительно 100 мкг тестостерона эта композиция должна вводиться в дозе приблизительно 0,17 г/день, которая доставляет приблизительно 1,7 мг/день тестостерона на кожу, из которых приблизительно 0,1 мг абсорбируется; или для достижения уровня в сыворотке крови приблизительно 150 мкг тестостерона эта композиция должна вводиться в дозе приблизительно 0,25 г/день, которая доставляет приблизительно 2,5 мг/день тестостерона на кожу, из которых приблизительно 0,15 мг абсорбируется; или для достижения уровня в сыворотке крови приблизительно 300 мкг тестостерона эта композиция должна вводиться в дозе приблизительно 0,5 г/день, которая доставляет приблизительно 5,0 мг/день тестостерона на кожу, из которых приблизительно 0,3 мг абсорбируется. Фраза «депрессивное нарушение» относится к состоянию, нарушению или заболеванию, такому как нарушение настроения, пониженное либидо, меланхолия, реактивная депрессия, эндогенная депрессия, эндогенно-морфическая депрессия, анаклитическая депрессия или любой депрессивный симптом, достаточный для удовлетворения одному или нескольким критериям DSM-IV для текущего большого депрессивного нарушения, или любой депрессивный симптом, который увеличивает оценку депрессии по шкале оценок Гамильтона или по опроснику депрессии Бека. Термин «лечить» или «лечение», в применении здесь, относится к любому лечению состояния, нарушения или заболевания млекопитающего, связанного с депрессивным нарушением, и включает в себя, но не ограничивается ими, предотвращение появления состояния, нарушения или заболевания у субъекта, который может быть предрасположен к этому состоянию, нарушению или заболеванию, но еще не был диагностирован как имеющий это состояние, нарушение или заболевание; подавление этого состояния, нарушения или заболевания, например, задержки развития этого состояния, нарушения или заболевания; ослабление этого состояния, нарушения или заболевания, например, с вызыванием регресса этого состояния, нарушения или заболевания; или облегчения состояния, вызываемого этим заболеванием или нарушением, например, остановкой симптомов этого заболевания или нарушения. В одном варианте термин «лечить» или «лечение» включает в себя, например, улучшение или ослабление нарушения настроения, увеличение либидо, улучшение или ослабление одного или нескольких симптомов меланхолии, улучшение или ослабление одного или нескольких симптомов реактивной депрессии, улучшение - 16 - 007431 или ослабление одного или нескольких симптомов эндогенной депрессии, улучшение или ослабление одного или нескольких симптомов эндогенно-морфической депрессии, улучшение или ослабление одного или нескольких симптомов анаклитической депрессии или улучшение или ослабление любого депрессивного симптома, который удовлетворяет критериям DSM-IV для текущего большого депрессивного нарушения, или улучшение или ослабление любого депрессивного симптома, который увеличивает оценку депрессии по шкале оценок Гамильтона или по опроснику депрессии Бека. Термин «предупреждать» или «предупреждение» в отношении депрессивного состояния, нарушения или заболевания означает отсутствие депрессивного состояния, нарушения или заболевания, если оно не имело места, или отсутствие дальнейшего развития депрессивного состояния, нарушения или заболевания, если уже имелось развитие этого депрессивного состояния, нарушения или заболевания. «Действие на депрессивное нарушение» или «эффективное в отношении депрессивного нарушения количество» означают количество агента, требуемое для лечения или предупреждения депрессивного нарушения у субъекта или для облегчения в некоторой степени одного или нескольких симптомов, связанных с депрессивным нарушением или родственных депрессивному нарушению, у субъекта. В случае млекопитающих, этот термин включает в себя, но не ограничивается ими, улучшение или ослабление нарушения настроения, увеличение либидо, улучшение или ослабление одного или нескольких симптомов меланхолии, улучшение или ослабление одного или нескольких симптомов реактивной депрессии, улучшение или ослабление одного или нескольких симптомов эндогенной депрессии, улучшение или ослабление одного или нескольких симптомов эндогенно-морфической депрессии, улучшение или ослабление одного или нескольких симптомов анаклитической депрессии или улучшение или ослабление любого депрессивного симптома, который удовлетворяет критериям DSM-IV для текущего большого депрессивного нарушения, или улучшение или ослабление любого депрессивного симптома, который увеличивает оценку депрессии по шкале оценок Гамильтона или по опроснику депрессии Бека. Лечение субъекта способами, наборами, комбинациями и композициями данного изобретения включает в себя также, например, нормализацию гипогонадизма; улучшение половой дисфункции; нормализацию уровней холестерина; нормализацию атипичных электрокардиограмм субъектов и улучшение вазомоторных симптомов; улучшение диабетической ретинопатии, а также снижение требований инсулина диабетических субъектов; уменьшение процента жира в теле; нормализацию уровней глюкозы; уменьшение факторов риска для сердечно-сосудистого заболевания, в том числе, нормализацию гипертензии и лечение ожирения; предупреждение остеопороза, остеопении, вагинальной сухости и утончения вагинальной стенки; облегчение климактерических симптомов и «приливов»; улучшение когнитивной дисфункции; лечение, предупреждение или уменьшение появления сердечно-сосудистого заболевания, болезни Альцгеймера, деменции и катаракт; и лечение, предупреждение или уменьшение риска рака шейки матки, матки или молочной железы. При использовании композиций данного изобретения в "эффективном в отношении депрессивного нарушения количестве" этот термин означает, что концентрация терапевтического агента является такой, что терапевтический уровень агента доставляется на протяжении срока, в течение которого эта композиция должна быть использована. Такая доставка зависит от ряда переменных, в том числе от периода времени, в течение которого должна быть использована отдельная единица дозы, от скорости потока терапевтического агента, например, тестостерона, из геля, площади поверхности нанесения и т.д. Это количество терапевтического агента может быть определено на основании скорости потока лекарственного средства через гель, например, и через кожу при использовании с усилителями или без усилителей проникновения. Однако понятно, что конкретные уровни доз терапевтических агентов данного изобретения для любого конкретного субъекта зависят от ряда факторов, в том числе, от активности используемого конкретного соединения, возраста, массы тела, общего здоровья, пола и диеты субъекта, времени введения, скорости экскреции, комбинации лекарственных средств и тяжести конкретного нарушения, которое лечат, и формы введения. Дозы лечения обычно могут титроваться для оптимизации безопасности и эффективности. Обычно взаимосвязи доза-эффект из испытаний in vitro и/или in vivo могут начально обеспечить полезное руководство в отношении правильных доз для введения субъекту. Исследования на моделях животных обычно могут быть использованы для руководства в отношении эффективных доз для лечения менопаузы в соответствии с данным изобретением. В отношении протоколов лечения, должно быть понятно, что вводимая доза будет зависеть от нескольких факторов, в том числе от конкретного агента, который вводится, способа введения, состояния конкретного субъекта и т.д. Говоря в общем, желательно вводить количество агента, которое является эффективным в достижении сывороточных уровней, соизмеримых с концентрациями, которые, как было найдено, являются эффективными in vitro. Таким образом, когда показано, что агент демонстрирует активность in vitro, например, при 10 нг/мл, желательно вводить количество этого агента, который является эффективным для обеспечения in vivo концентрации приблизительно 10 нг/мл. Определение этих параметров находится вполне в рамках квалификации в данной области. Эти рассмотрения, а также эффективные композиции и процедуры введения хорошо известны в данной области и описаны в стандартных справочниках. Для измерения и определения количества тестостерона, которое должно быть доставлено в субъект для введения эффективного в отношении депрессивного нарушения количества, концентрации тестосте- 17 - 007431 рона в сыворотке могут быть измерены с использованием стандартных способов анализа. Например, уровни свободного сывороточного тестостерона измеряют с использованием недавно валидированного и высокочувствительного способа равновесного диализа, обсуждаемого в Sinha-Hikim et al., The Use of a Sensitive Equilibrium Dialysis Method for the Measurement of Free Testosterone Levels in Healthy, Cycling Women and in HIV-infected Women. 83 J. Clinical Endocrinology & Metabolism 1312-18. (1998), и эта статья включена здесь в качестве ссылки в ее полном виде. В данном контексте, фразы "андрогенная недостаточность" или "тестостероновая недостаточность" используются взаимозаменяемо и относятся к более низким сывороточным уровням свободного тестостерона в субъекте в сравнении со средними сывороточными уровнями для здорового субъекта того же самого возраста. Например, женщины с нормальным циклом производят приблизительно 300 мкг тестостерона в день. Их уровни общего сывороточного тестостерона обычно находятся в диапазоне приблизительно 20 нг/дл - приблизительно 80 нг/дл, в среднем приблизительно 40 нг/дл. Например, у здоровых молодых женщин средние уровни свободного тестостерона равны обычно приблизительно 3,6 пг/мл. Однако как на уровни общего, так и на уровни свободного тестостерона могут оказывать влияние несколько факторов. Например, у регулярно овулирующих женщин имеется небольшое, но значимое увеличение уровней тестостерона в плазме во время средней трети менструального цикла. Однако средние уровни тестостерона (1,2 нмоль/л или 33 нг/дл) и средние уровни свободного тестостерона (12,8 пмоль/л или 3,6 пг/мл) во время лютеиновой и фолликулярной фаз не являются значимо различными. Кроме того, продуцирование тестостерона снижается непрерывно после 30 лет, так что уровни тестостерона у 60летней женщины составляют только 50% от уровней у молодой 30-летней женщины. Хотя процент свободного тестостерона обычно не варьируется с возрастом, наблюдали абсолютное снижение свободного тестостерона. Это снижение не появляется внезапно при менопаузе, а вместо этого происходит постепенно и непрерывно в результате связанного с возрастом снижения продуцирования андрогенов как надпочечников, так и яичников. Таким образом, женщины начинают испытывать симптомы, ассоциированные с менопаузой, в непосредственно предменопаузальные годы. Снижение тестостерона после менопаузы происходит из комбинации яичниковой недостаточности, уменьшения почечной секреции и периферического превращения. Например, после овариэктомии концентрации тестостерона также уменьшаются на приблизительно 50%. Диагноз недостаточности тестостерона известен среднему врачу, практикующему в релевантной области медицины. Применение термина "около" в данном описании означает "приблизительно" и применение термина "около" указывает на то, что дозы, находящиеся слегка за рамками цитируемых диапазонов, также могут быть эффективными и безопасными, и такие дозы также включены в рамки данной формулы изобретения. Термин "пролекарство" относится к лекарственному средству или соединению, в котором фармакологическое действие (активный лечебный агент) происходит в результате превращения метаболическими процессами внутри тела. Пролекарства обычно считают предшественниками лекарственного средства, которые, после введения субъекту и последующей абсорбции превращаются в активные или более активные молекулы посредством некоторого процесса, например, метаболического процесса. Другие продукты из этого процесса превращения легко удаляются телом. Пролекарства обычно имеют химическую группу, присутствующую в пролекарстве, которая делает его менее активным и/или придает растворимость или некоторое другое свойство лекарственному средству. После отщепления этой химической группы от пролекарства образуется более активное лекарственное средство. Пролекарства могут быть сконструированы в виде обратимых производных лекарственных средств и использованы в качестве модификаторов усиления транспорта лекарственных средств к сайт-специфическим тканям. Конструирование пролекарств до настоящего времени проводили для увеличения эффективной растворимости в воде терапевтического соединения для нацеливания на районы, где вода является главным растворителем. Например, Fedorak, et al., Am. J. Physiol, 269:G210-218 (1995) описывают бексаметазон-бета-Dглюкуронид. McLoed, et al., Gastroenterol., 106:405-413 (1994) описывают дексаметазонсукцинатдекстраны. Hochhaus, et al., Biomed. Chrom., 6:283-286 (1992) описывают дексаметазон-21-сульфобензоат-натрий и дексаметазон-21-изоникотинат. Кроме того, J. Larsen and H. Bundgaard [Int. J. Pharmaceutics, 37, 87 (1987)] описывают оценку N-ацилсульфонамидов в качестве потенциальных производных пролекарств. J. Larsen et al., [Int. J. Pharmaceutics, 47, 103 (1988)] описывают оценку Nметилсульфонамидов в качестве потенциальных производных пролекарств. Пролекарства описаны также, например, в Sinkula et al., J. Pharm. Sci., 64:181-210 (1975). Термин «производное» относится к соединению, которое продуцируется из другого соединения сходной структуры заменой путем замещения одного атома, молекулы или группы другими. Например, атом водорода соединения может быть замещен алкилом, ацилом, амино и т.д. с получением производного этого соединения. Фраза "фармацевтически приемлемый" используется здесь в виде прилагательного для обозначения, что данный модифицированный продукт является пригодным для использования в фармацевтическом продукте. Фармацевтически приемлемые катионы включают в себя ионы металлов и органические ионы. Более предпочтительные ионы металлов включают в себя, но не ограничиваются ими, подходящие - 18 - 007431 соли щелочных металлов, соли щелочно-земельных металлов и другие физиологически приемлемые ионы металлов. Примеры ионов включают в себя ионы алюминия, кальция, лития, магния, калия, натрия и цинка в их обычных валентностях. Предпочтительные органические ионы включают в себя протонированные третичные амины и катионы четвертичного аммония, в том числе, частично, триметиламин, диэтиламин, N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, меглумин (Nметилглюкамин) и прокаин. Примеры фармацевтически приемлемых кислот включают в себя, без ограничения, хлористоводородную кислоту, бромистоводородную кислоту, фосфорную кислоту, серную кислоту, метансульфоновую кислоту, уксусную кислоту, муравьиную кислоту, винную кислоту, малеиновую кислоту, яблочную кислоту, лимонную кислоту, изолимонную кислоту, янтарную кислоту, молочную кислоту, глюконовую кислоту, глюкуроновую кислоту, пировиноградную кислоту, щавелевоуксусную кислоту, фумаровую кислоту, пропионовую кислоту, аспарагиновую кислоту, глутаминовую кислоту, бензойную кислоту и т.п. Фраза "усиливающий проникновение агент" относится к агенту, о котором известно, что он ускоряет доставку лекарственного средства через кожу. Эти агенты называют также ускорителями, адъювантами и промоторами абсорбции, и их совокупно называют здесь "усилителями (энхансерами)". Этот класс агентов включает в себя агенты с различными механизмами действия, в том числе агенты, которые имеют функцию улучшения растворимости и диффундируемости лекарственного средства, и агенты, которые улучшают чрезкожную абсорбцию посредством изменения рогового слоя удерживать влагу, смягчения кожи, улучшения проницаемости кожи, действия в качестве помощников проникновения или открывателей волосяных фолликулов или изменения состояния кожи, например, граничного слоя. Усиливающий проникновение агент данного изобретения является функциональным производным жирной кислоты, которое включает в себя изостерические модификации жирных кислот или некислотные производные карбоксильной функциональной группы жирной кислоты или их изостерические модификации. В одном варианте осуществления функциональным производным жирной кислоты является ненасыщенная алкановая кислота, в которой группа -СООН заменена ее функциональным производным, таким как спирты, полиолы, амиды и их замещенные производные. Термин "жирная кислота" означает жирную кислоту, которая имеет четыре (4) - двадцать четыре (24) атома углерода. Неограничивающие примеры усиливающих проникновение агентов включают в себя С8-С22-жирные кислоты, такие как изостеариновая кислота, октановая кислота и олеиновая кислота; С8-С22-жирные спирты, такие как олеиловый спирт и лауриловый спирт; низшие алкиловые эфиры С8-С22-жирных кислот, такие как этилолеат, изопропилмиристат, бутилстеарат и метиллаурат; ди(низший)алкиловые эфиры С6-С22-дикислот, такие как диизопропиладипат; моноглицериды С8-С22-жирных кислот, такие как глицерилмонолаурат; тетрагидрофурфуриловый спирт; простой эфир полиэтиленгликоля; полиэтиленгликоль, полипропиленгликоль; 2-(2-этоксиэтокси)этанол; монометиловый эфир диэтиленгликоля; простые алкилариловые эфиры полиэтиленоксида; монометиловые эфиры полиэтиленоксида; простые диметиловые эфиры полиэтиленоксида; диметилсульфоксид; глицерин; этилацетат; ацетоуксусный эфир; Nалкилпирролидон и терпены. Загущающие агенты, используемые здесь, могут включать в себя анионные полимеры, такие как полиакриловая кислота (Карбопол® B.F. Goodrich Specialty Polymers and Chemicals Division of Cleveland, Ohio), карбоксиполиметилен, карбоксиметилцеллюлоза и т.п., в том числе производные Кабопол®полимеров, такие как Carbopol® Ultrez 10, Carbopol® 940, Carbopol® 941, Carbopol® 954, Carbopol® 980, Carbopol® 981, Carbopol® ETD 2001, Carbopol® EZ-2 и Carbopol® EZ-3, и другие полимеры, такие как полимерные эмульгаторы Pemulen® и поликарбофилы Noveon®. Дополнительные загущающие агенты, усилители (энхансеры) и адъюванты могут быть обычно найдены в Remington's The Science and Practice of Pharmacy, Meade Publishing Co., United States Pharmacopeia/National Formulary. В данном контексте, термин «низший спирт», один или в комбинации, означает спиртовую молекулу с прямой или разветвленной цепью, содержащую один - приблизительно шесть атомов углерода. В одном варианте низший спирт содержит 1 - приблизительно 4 атома углерода, а в другом варианте низший спирт содержит 2 - приблизительно 3 атома углерода. Примеры таких спиртовых молекул включают в себя метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, втор-бутанол и трет-бутанол. В данном контексте, термин «низший алкил», один или в комбинации, означает имеющий прямую цепь или разветвленную цепь алкильный радикал, содержащий один - приблизительно шесть атомов углерода. В одном варианте низший алкил содержит 1 - приблизительно 4 атома углерода. Примеры таких радикалов включают в себя метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и третбутил. Уменьшенное продуцирование тестостерона в субъекте может быть вызвано несколькими факторами, хорошо известными в релевантной области медицины. Например, у женщины уменьшенное продуцирование тестостерона может быть вызвано использованием пероральных контрацептивов; хирургией, например, удалением матки (гистерэктомией), или удалением одного или обоих яичников (оофорэктомией/овариэктомией); эстрогеновой заместительной терапией в случае постменопаузальных женщин; преждевременной недостаточностью яичников; дисфункцией надпочечников, например, первичной не- 19 - 007431 достаточностью надпочечников; индуцированной кортикостероидом супрессии надпочечников; пангипопитуитаризмом и хронической болезнью, такой как системная красная волчанка, ревматоидный артрит, инфекция вирусом иммунодефицита человека (ВИЧ), хронической обструктивной болезнью легких и почечным заболеванием конечной стадии. Физиологические и психологические нарушения, ассоциированные с недостаточностью тестостерона в субъекте включают в себя, например, пониженное настроение, пониженное либидо и пониженная половая активность, уменьшенные минеральная плотность костей и связанные с этим маркеры, уменьшенный состав тела, синдром истощения, связанный с вирусом иммунодефицита человека, пониженная познавательная способность, пониженные настроение и самоуважение, уменьшенные мышечная масса и трудоспособность, предменструальный синдром и аутоиммунное заболевание. Тем не менее, существуют хорошо определенные популяции субъектов, у которых продуцирование тестостерона является явно недостаточным и в случае которых была описана ассоциированная симптоматология, и такие популяции рассматриваются как находящиеся в рамках данного изобретения. Субъекты, которые должны лечиться с использованием данного изобретения, включают в себя субъектов, находящиеся при риске развития депрессивного нарушения, или субъектов, уже испытывающих депрессивное нарушение. Стандартные факторы риска депрессивного нарушения известны среднему врачу, практикующему в релевантной области медицины. Предполагается, что субъекты, которые идентифицированы как имеющие один или несколько факторов риска, о которых в данной области известно, что они являются факторами риска развития депрессивного нарушения, включены в группу людей, считающихся находящимися при риске развития депрессивного нарушения. Кроме того, рассматриваемые способы, наборы, комбинации и композиции данного изобретения применимы для лечения недостаточности тестостерона у субъекта, который включает в себя субъекта, у которого продуцирование тестостерона является недостаточным, или субъекта, у которого ассоциированная симптоматология, относящаяся к недостаточному продуцированию тестостерона, является клинически очевидной. У мужчин, это включает в себя, например, возраст. У женщин, это включает в себя, например, овариэктомированную/гистерэктомированную женщину, постменопаузальную женщину, использующую заместительную эстрогеновую терапию, женщину, принимающую пероральные контрацептивы, женщину с овариэктомией, женщину с преждевременной недостаточностью яичников, женщину с дисфункцией надпочечников, женщину с индуцированной кортикостероидом супрессией надпочечников, женщину с пангипопитуитаризмом, женщину с первичной недостаточностью надпочечников и женщину, испытывающую хроническую болезнь, такую как системная красная волчанка, ревматоидный артрит, инфекция вирусом иммунодефицита человека (ВИЧ), хроническая обструктивная болезнь легких и почечное заболевание конечной стадии. В одном варианте данного изобретения способы, наборы, комбинации и композиции применимы для лечения женщины, которая подвергалась хирургии, например, билатеральной овариэктомии с гистерэктомией, и, в частности, женщины, которая подвергалась хирургии в молодом возрасте, до ее естественной менопаузы. Только в Соединенных Штатах более, чем 250000 женщин, подвергаются комбинированным процедурам овариэктомии/гистерэктомии ежегодно и являются явно недостаточными по продуцированию тестостерона. Уровни сывороточного тестостерона обычно уменьшаются на 50% у овариэктомированной женщины в сравнении с их предоперационными уровнями, однако, в некоторых случаях эти уровни могут все еще оставаться в пределах нормального среднего диапазона (приблизительно 20-80 нг/дл). Уровни эстрогена и прогестерона, которые, прежде всего, зависят от яичниковой секреции, также заметно уменьшаются после овариэктомии. Полученное состояние недостаточности многих гормонов связано с вазомоторными симптомами, остеопорозом с высоким оборотом и женской половой дисфункцией. Хотя эстрогеновая заместительная терапия является стандартной для лечения вазомоторных симптомов в овариэктомированных/гистерэктомированных женщинах, сопутствующая тестостероновая терапия не назначалась для лечения женской половой дисфункции и не упоминались ее действия с эстрогеновой заместительной терапией на метаболизм костей. Такие женщины также считаются включенными в рамки данного изобретения. В другом варианте осуществления данного изобретения, эти способы, наборы, комбинации и композиция применимы при лечении постменопаузальных женщин. В противоположность овариэктомированному состоянию, постменопаузальный яичник может продолжать синтезировать тестостероны в стромальной ткани при скоростях, которые необязательно являются более низкими, чем в предменопаузальном периоде. У некоторых постменопаузальных женщин уровни тестостерона увеличиваются как следствие стромальной реакции на повышенные уровни лютеинизирующего гормона, тогда как у других уровни тестостерона уменьшаются или остаются теми же самыми. Поскольку эстрогеновая заместительная терапия понижает уровни лютеинизирующего гормона, ожидается, что секреция яичникового тестостерона будет уменьшаться у постменопаузальных женщин, которые получают эстрогеновую заместительную терапию. При приеме пероральных препаратов эстрогеновой заместительной терапии падение уровней тестостерона может быть незаметным вследствие одновременного повышения уровней связывающего половые гормоны глобулина, который уменьшает клиренс тестостерона. Однако обнаружено, что уровни свободного и/или биодоступного тестостерона являются более низким у постменопаузальной - 20 - 007431 женщины, получающей эстрогеновую заместительную терапию. Хотя действия трансдермальной эстрогеновой заместительной терапии на статус андрогена/лютеинизирующего гормона постменопаузальных женщин не исследовались, можно было бы ожидать уменьшения уровней общего и свободного тестостерона, связанного с уменьшением уровней лютеинизирующего гормона. Поскольку многие постменопаузальные женщины испытывают симптомы женской половой дисфункции, которые не ослабляются эстрогеновой заместительной терапией, авторы считают, что недостаточность тестостерона является ответственным за это фактором, и эта группа женщин также попадает в объем данного изобретения. Еще в одном варианте данного изобретения эти способы, наборы, комбинации и композиции применимы при лечении женщин, которые используют пероральную контрацепцию. Пероральная контрацепция является наиболее обычным способом среди подростков, и в целом более чем приблизительно 46% сексуально активной популяции используют пероральную контрацепцию. Наиболее обычный тип перорального контрацептива содержит как эстроген, так и прогестин и, как было доказано, является эффективным на приблизительно 99%. Таким образом, почти половина всех предменопаузальных женщин (в возрасте <44 лет) потенциально принимают пероральные контрацептивы. В сравнении со здоровыми женщинами с менструальным циклом, уровни тестостерона у женщин, принимающих эстрогенсодержащие пероральные контрацептивы, являются заметно более низкими, в частности, в сравнении при предовуляторной фазой нормального цикла, когда уровни тестостерона являются наивысшими. Этот эффект происходит вследствие супрессии лютеинизирующего гормона, производимой пероральными контрацептивами, и является аналогичным действию эстрогеновой заместительной терапии, описанному выше. На психосексуальные аспекты перцепции действуют более низкие уровни тестостерона, и они могут быть связаны с клиническим наблюдением пониженного либидо у некоторых женщин, использующих пероральные контрацептивы. Еще в одном варианте осуществления данного изобретения эти способы, наборы, комбинации и композиции применимы при лечении женщин, которые были подвергнуты овариэктомии, например, посредством хирургии, химических средств, облучения или антагонистами высвобождающего гонадотропин гормона. Такая хирургия приводит к уменьшенному андрогенному продукту яичников. В другом варианте данного изобретения эти способы, наборы, комбинации и композиции применимы при лечении женщин с преждевременной недостаточностью яичников. Преждевременная недостаточность яичников, такая как связанная с синдромом Тернера или аутоиммунным или идиопатическим разрушением яичника, связаны с нарушенным продуцированием тестостерона. Еще в одном варианте данного изобретения эти способы, наборы, комбинации и композиции применимы при лечении субъекта, который имел уменьшенную функцию надпочечников. Снижение функции надпочечников, которое может происходить вследствие ряда причин, представляет другую категорию субъектов, у которых продуцирование тестостерона может быть уменьшено на, приблизительно, 50%. Первичная адренокортикальная недостаточность, или болезнь Аддисона, является редким эндокринным нарушением с множественными этиологиями, включающими в себя туберкулез и грибковые инфекции. По приблизительной оценке, преобладание у женщин равно приблизительно 5 на 100000. Вследствие потери секреции глюко- и минеральных кортикоидов, болезнь Аддисона может быть угрожающей жизни. Хотя некоторые исследователи отмечали ассоциированную с ней недостаточность тестостерона, заместительная терапия часто игнорируется. Поскольку адренокортикотропный гормон является, по-видимому, первичным стимулятором продуцирования андрогенов надпочечниками, недостаточная секреция адренокортикотропного гормона может также приводить к недостаточности тестостерона у женщин. Это может происходить вследствие заболевания гипофиза или хирургии, например, вторичной адренокортикальной недостаточности, или как результат фармакологического эффекта введения экзогенного кортикостероида, который может подавлять секрецию адренокортикотропного гормона. В одном варианте данного изобретения эти способы, наборы, комбинации и композиции применимы в лечении субъекта при проведении продолжительной терапии с введением кортикостероидов. Продолжительную терапию кортикостероидами используют для различных состояний, которые включают в себя ревматоидный артрит, системную красную волчанку, синдром Шегрена, иммуносупрессию в отношении трансплантатов, астму и т.д. Таким образом, индуцируемая кортикостероидом супрессия надпочечников может представлять наибольшую группу субъектов с недостаточным продуцированием надпочечникового андрогена. Недостаточность андрогенов считается фактором, ответственным за индуцированный кортикостероидами остеопороз. Стимуляцией образования костной ткани (активности остеобластов) восполнение тестостерона является благоприятным в лечении индуцированного кортикостероидами остеопороза у предменопаузальных женщин и благоприятным в эстрогеновой заместительной терапии при лечении постменопаузальных женщин. У субъекта с аутоиммунными нарушениями, такими как ревматоидный артрит и системная красная волчанка, недостаточность тестостерона может способствовать лежащей в их основе тенденции продуцировать аутоантитела, как наблюдалось в различных моделях аутоиммунного заболевания животных. Таким образом, восполнение тестостерона может само по себе способствовать ослаблению процесса аутоиммунного заболевания. Несмотря на эти факты, потенциальные терапевтические выгоды восполнения тестостерона при лечении субъектов, проявляющих супрессию, вызываемую кортикостероидами, в значительной степени игнорировались. - 21 - 007431 В другом варианте данного изобретения эти способы, наборы, комбинации и композиции применимы при лечении женщин, имеющих пангипопитуитаризм. Пангипопитуитаризм, возникающий из любой причины, сопровождается тяжелой недостаточностью тестостерона вследствие нарушения секреции андрогенов как яичниками, так и надпочечниками. Еще в одном варианте данного изобретения эти способы, наборы, комбинации и композиции применимы при лечении субъекта с первичной недостаточностью надпочечников. Первичная недостаточность надпочечников связана с недостаточностью тестостерона. В одном варианте данного изобретения эти способы, наборы, комбинации и композиции применимы при лечении субъекта с хронической болезнью. Хронические болезни в субъекте сопровождаются пониженными концентрациями циркулирующего в кровотоке тестостерона. Введение глюкокортикоидов ингибирует надпочечниковое продуцирование андрогенов вследствие их ингибирующих действий на секрецию адренокортикотропного гормона. Кроме того, глюкокортикоиды обладают также ингибирующими действиями на всех уровнях системы гипоталамус-гипофиз-яичники. Еще в одном варианте данного изобретения эти способы, наборы, комбинации и композиции применимы при лечении ВИЧ-(вирус иммунодефицита человека)-положительных мужчин или женщин. В отличие от ВИЧ-положительных мужчин, у которых недостаточность тестостерона является обычной, неизвестно, являются ли ВИЧ-(вирус иммунодефицита человека)-положительные женщины недостаточными по тестостерону. Аменорея, которая, по-видимому, увеличивается у женщин с синдромом приобретенного иммунодефицита (СПИДом), может быть указанием на то, что продуцирование яичниковых стероидов понижается. Функция надпочечников может быть также недостаточной в субъектах с синдромом приобретенного иммунодефицита (СПИДом) вследствие инфекции цитомегаловирусом, туберкулёза и грибковых инфекций. Ацетат мегестрола, относящийся к гестагенным агентом, используемый для стимуляции аппетита у инфицированных вирусом иммунодефицита человека лиц, подавляет гонадотропины и, как считается, снижает уровни тестостерона у женщин, что сходно с его эффектами в случае мужчин. Кроме того, применение пероральных контрацептивов ВИЧ-(вирус иммунодефицита человека)-положительными женщинами также снижает уровни тестостерона, как описано выше для здоровых женщин. Восполнение физиологического тестостерона может быть использовано в качестве анаболического агента для лечения/предупреждения синдрома истощения и для улучшения качества жизни женщин. Способы, наборы, комбинации и композиции данного изобретения применимы также для лечения ряда физиологических и психологических параметров, ассоциированных с недостаточностью тестостерона у мужчин или женщин, и включающих в себя, например, увеличение либидо и улучшение сексуальной активности и дисфункции, увеличение минеральной плотности костей и связанных с ней маркеров, улучшение состава тела, предупреждение синдрома истощения людей с вирусом иммунодефицита человека, улучшение познавательной способности, улучшение настроения и самооценки, улучшение мышечной массы и трудоспособности, лечение предменструального синдрома и лечение аутоиммунных заболеваний. В одном варианте данного изобретения способы, наборы, комбинации и композиции данного изобретения применимы для лечения либидо субъекта. Концентрации тестостерона явно влияют на либидо мужчин и женщин. На протяжении нескольких последних десятилетий несколько корреляционных исследований обнаружили, что более высокие уровни тестостерона были ассоциированы с меньшей сексуальной абстиненцией, большим сексуальным удовлетворением, большим количеством сексуальных фантазий, большей инициацией сексуальной активности, более высокими уровнями сексуального интереса и влечения и большей антисипацией (предвкушением) сексуальной активности. Более недавно, была обнаружена корреляция между сексуальным влечением и тестостероном в субпопуляции женщин, которые были ВИЧ-положительными. В одном варианте данного изобретения эти способы, наборы, комбинации и композиции применимы для лечения сексуальной активности (способности) субъекта. Исследования показали, что тестостерон влияет на сексуальную способность мужчин и женщин. У женщин, например, корреляционные исследования обнаружили, что тестостерон ассоциирован с более высокой сексуальной возбудимостью, как измерено по реакциям гиперемии сосудов на эротические фильмы, увеличенной частоте мастурбаций, увеличенной частоте коитуса и более высокому количеству сексуальных партнеров. Другое корреляционное исследование также показало, что тестостерон ассоциирован с пониженной вагинальной атрофией. В другом варианте данного изобретения способы, наборы, комбинации и композиции применимы для лечения женской сексуальной дисфункции у женщин. Хирургическая менопауза, т.е. общая абдоминальная гистерэктомия и билатеральная сальпинго-овариэктомия (билатеральное удаление придатков матки), произведенные до естественной менопаузы, вызывают синдром женской сексуальной дисфункции у значительного количества женщин, которая не ослабляется общепринятой эстрогеновой заместительной терапией. Сексуальные компоненты этого синдрома включают в себя либидо, пониженную возбудимость и пониженную способность получения оргазма. Психологические компоненты включают в себя пониженную энергию, подавленное состояние и общее снижение самочувствия. Они обычно являются отличными от классических симптомов недостаточности эстрогенов вагинальной атрофии, уменьшенной смазывающей способности, "приливов" и эмоциональной предрасположенности, которые могут - 22 - 007431 влиять на половую функцию и психологическое самочувствие у менопаузальных женщин, которые не получают адекватной эстрогеновой заместительной терапии. Скорее, гормональная основа этого синдрома связана с состоянием недостаточности тестостерона, а не с недостаточностью эстрогена, возникающим из отсутствия яичникового продуцирования тестостерона и его предшественников. В одном исследовании действия тестостерона у женщин с нарушенной половой функцией после хирургически индуцированной менопаузы оценивали с использованием трансдермального пластыря. Семьдесят пять женщин в возрасте 31-56 лет, которые подверглись овариэктомии и гистерэктомии, получали конъюгированные лошадиные эстрогены лошади (по меньшей мере, 0,625 мг в день перорально) и, в случайном порядке, 150 мкг тестостерона и 300 мкг тестостерона в день трансдермально в течение 12 недель, каждая. Полученные результаты включали в себя баллы BISF (Краткий каталог сексуального функционирования для женщин), PGWI (Каталог психологического хорошего самочувствия) и дневник половой функции, заполняемый по телефону. Средняя концентрация (± SD) свободного тестостерона в сыворотке увеличивалась с 1,2 ± 0,8 пг/мл во время получения плацебо до 3,9 ± 2,4 пг/мл и 4,9 ± 4,8 пг/мл во время лечения 160 и 300 мкг тестостерона в день, соответственно (нормальный диапазон 1,3 - 6,8 пг/мл). Несмотря на приемлемую реакцию на плацебо, более высокая доза тестостерона приводила к дополнительным увеличениям баллов для частоты сексуальной активности и наслаждения-оргазма в баллах BISF (Краткой индексации сексуального функционирования для женщин) (Р = 0,03 для обоих сравнений с плацебо). При более высокой дозе проценты женщин, которые имели сексуальные фантазии, мастурбировали или участвовали в коитусе по меньшей мере один раз в неделю, увеличивались в два-три раза в сравнении с уровнем базовой линии (фона). Положительное самочувствие, подавленное настроение и сводные баллы (PWBI) (Индексации психологического хорошего самочувствия) также улучшались при более высокой дозе (Р = 0,04, соответственно, для сравнения с плацебо), но баллы по дневнику, заполняемому по телефону, значимо не увеличивались. В другом варианте данного изобретения тестостероновую терапию использовали вместе с эстрогеновой терапией. Исследования показали, что восполнение тестостерона и эстрогена приводило к увеличенным сексуальному желанию, частоте сексуальных фантазий, сексуальной возбудимости и частоте коитуса или оргазмов в сравнении с женщинами, которые получали только эстроген или плацебо, и показали, что женщины, получающие эстроген плюс тестостерон, испытывали более увеличенные либидо, активность, удовлетворение, наслаждение, фантазии, оргазм и релевантные признаки в сравнении с женщинами, получающими только эстроген. Лечение премарином и метилтестостероном приводило к значимо увеличенным сообщениям наслаждения от мастурбации. Совсем недавно было обнаружено, что лечение трансдермально вводимым тестостероном у женщин после овариэктомии улучшало сексуальную функцию и психологическое чувство благополучия. Предполагается, что введение одного тестостерона будет иметь терапевтическую пользу при предоставлении без эстрогена. Например, женщины с гипоталамической аменореей обнаруживают вагинальную сосудистую гиперемию при лечении тестостероном в сравнении с плацебо. Еще в одном варианте данного изобретения эти способы, наборы, комбинации и композиции применимы в лечении пониженной плотности костей в субъекте, например, в женщине. Другим физиологическим параметром, связанным с введением тестостерона женщинам, является уменьшенная минеральная плотность костей. Несколько корреляционных исследований показали, что увеличенные концентрации тестостерона ассоциированы с увеличенной минеральной плотностью костей. Было обнаружено, что более высокие уровни биодоступного тестостерона были ассоциированы с более высокой минеральной плотностью костей в ультрадистальном отделе лучевой кости у женщин. Женщины, имеющие синдром поликистозного яичника, имели минеральную плотность шейки бедренной кости, положительно коррелирующую с уровнями свободного тестостерона. Минеральная плотность костей верхней части тела имела значимую корреляцию с тестостероном. Одномоментный (одновременный) поперечный углубленный анализ концентраций половых гормонов и минеральной плотности костей у женщин, участвующих в перспективном исследовании факторов риска в отношении остеопороза, обнаружил значимую положительную корреляцию между тестостероном и минеральной плотностью костей. Другое исследование включало в себя стратифицированную по возрастам пробу из 304 женщин, и в нем был обнаружен коэффициент корреляции между минеральной плотностью костей и тестостероном, показанный ниже в табл. 8. Таблица 8. Коэффициенты корреляции между тестостероном и минеральной плотностью костей* * Khosia S. et al., J Clin Endocrinol Metab. 1998 Jul; 83(7):2266-74. - 23 - 007431 Как в случае либидо и сексуальной активности, тестостерон часто вводят вместе с эстрогеном для предотвращения разрежения костной ткани или увеличения минеральной плотности костей. Например, в одномоментном (одновременном) поперечном углубленном исследовании было обнаружено, что подкожно вводимый эстрадиол (75 мг) и тестостерон (100 мг) предотвращали остеопороз и поддерживали нормальную минеральную плотность костей в постменопаузальных женщинах. В другом исследовании исследовали эффекты терапии с использованием эстрогена, даваемого отдельно, с эффектами терапии эстрогена плюс андрогена в постменопаузальных женщинах. В то время как группа, получающая только эстроген, имела снижение сывороточных маркеров костеобразования, женщины, получающие комбинацию эстрогена и тестостерона, имели увеличенные маркеры костеобразования. Подобным образом, было показано, что восполнение эстрогена и тестостерона имплантируемыми шариками увеличивает массу костей больше, чем только имплантаты эстрогена, увеличивает минеральную массу костей на 5,7% в области позвоночника и на 5,2% в области шейки бедренной кости. Лечение эстрогеном и метилтестостероном подобным образом приводит к увеличенной минеральной плотности костной ткани позвоночника и тазобедренного сустава. Также сообщалось, что вводимые перорально эстрогены и метилтестостерон предотвращали разрежение костей и увеличивали минеральную плотности костной ткани в позвоночнике и тазобедренном суставе. В другом варианте данного изобретения эти способы, наборы, комбинации и композиции применимы в лечении состояния тела субъекта. Например, тестостерон был связан с улучшенным состоянием тела у женщин. Тестостерон положительно коррелировал с индексом массы тела, и экзогенные андрогены влияли на состояние тела и регионарное распределение жира тела в страдающих ожирением постменопаузальных женщинах. Другие исследователи обнаружили увеличение не содержащей жира массы и уменьшенное отношение массы жира к не содержащей жира массе в постменопаузальных женщинах, получающих конкурентную терапию эстрогена-тестостерона. Таким образом, введение тестостерона здоровым женщинам или женщинам, имеющим недостаточность тестостерона, могут давать терапевтическое улучшение состояния тела. Еще в одном варианте данного изобретения эти способы, наборы, комбинации и композиции применимы при лечении или предупреждении синдрома истощения, вызываемого вирусом иммунодефицита человека, у субъекта. Например, в последние годы исследователи обнаружили, что введение тестостерона женщинам, инфицированным вирусом иммунодефицита человека, может лечить или предупреждать синдром истощения, вызываемый вирусом иммунодефицита человека. С использованием способа меченых аналогов были обнаружены более низкие уровни свободного тестостерона у инфицированных вирусом иммунодефицита человека женщин. Например, восполнение тестостерона в пластыре, доставляющем 150 мкг/день тестостерона в инфицированных вирусом иммунодефицита человека женщин, обеспечивало 4%-ное увеличение массы тела на протяжении 12 недель. Кроме того, эти субъекты имели улучшенное качество жизни. Таким образом, введение тестостерона может быть использовано в качестве способа предупреждения истощения у субъектов, страдающих от синдрома приобретенного иммунодефицита или родственных нарушений. Еще в одном варианте данного изобретения эти способы, наборы, комбинации и композиции применимы в лечении или предупреждении кратковременной и долговременной памяти и других когнитивных функций более высокого порядка у субъекта. Половые стероиды являются важными для кратковременной и долговременной памяти и других когнитивных функций более высокого порядка. Например, постменопаузальные женщины, получающие эстроген плюс тестостерон после овариэктомии, имели более высокие оценки в баллах в двух тестах кратковременной памяти, тесте долговременной памяти и тесте логического мышления. Сообщалось, что введение тестостерона связано с лучшей зрительнопространственной функцией и лучшими вербальными навыками. Женщины с высокими уровнями тестостерона оценивались более высокими баллами по специальным/математическим заданиям, чем женщины с низкими концентрациями тестостерона. Женщины с более высокими баллами Испытания Миниментального Состояния имели значимо более высокие средние концентрации общего и биодоступного тестостерона. И в этом случае, преимущества введения тестостерона в отношении когнитивных параметров могут быть также оптимизированы конкурентным введением эстрогена. Например, подкожные имплантаты эстрадиола (40 мг) и тестостерона (100 мг) показали увеличения концентрации. В одном варианте данного изобретения эти способы, наборы, комбинации и композиции применимы в лечении или предупреждении нарушения настроения или самоуважения у субъекта. Параметрами, связанными с сывороточными уровнями тестостерона у субъекта, являются настроение и самоуважение. Например, менопаузальные женщины, которые получали как эстроген, так и тестостерон, чувствовали себя более собранными, в приподнятом настроении и более энергичными, чем женщины, которые получали только эстроген. Подобным образом, концентрации тестостерона положительно коррелировали с самоуважением. Таким образом, предполагается, что тестостероновая терапия будет улучшать настроение при использовании отдельно или, в случае женщин, при использовании вместе с эстрогеном. В другом варианте данного изобретения эти способы, наборы, комбинации и композиции применимы для увеличения размера мышц и увеличения работоспособности у субъекта. Андрогены и анаболические стероиды использовали с давних пор для увеличения размера мышц и увеличения работоспособно- 24 - 007431 сти у мужчин. Недавно исследователи обнаружили также, что тестостерон является важной детерминантой большего размера мышц у женщин с синдромом поликистозного яичника. Таким образом, введение тестостерона здоровой женщине или женщине с недостаточностью тестостерона может быть полезным для улучшения мышечной массы и работоспособности. Многие симптомы у женщин, описанные выше, обычно рассматриваются как предменструальный синдром (PMS). Обычно более низкие уровни тестостерона на протяжении менструального цикла сообщались для женщин, которые страдают от предменструального синдрома, в сравнении с контролями. Пополнение тестостерона используется в настоящее время в качестве ослабления предменструального синдрома в Великобритании и в Австралии. Ослабление предменструального синдрома имплантатами эстрадиола/тестостерона приводило к улучшению либидо, сексуального наслаждения и ослаблению усталости. Таким образом, предполагается, что способы, наборы, комбинации и композиции данного изобретения могут быть применимы при лечении предменструального синдрома у женщин, особенно вместе с введением эстрогенного гормона. В одном варианте эстрогенный гормон готовят для чрескожного введения в виде водно-спиртового геля. Этот гель содержит один или более низших спиртов, усиливающий проникновение агент, загущающий агент и воду. Кроме того, эстрогенный гель при необходимости включает в себя соли, мягчители, стабилизаторы, антимикробные агенты, ароматизатор и пропелленты. Иллюстративно, эстрогенный гель состоит из следующих веществ, показанных ниже в табл. 9, в приблизительных количествах. Таблица 9. Композиция ESTRAGEL Специалисту с квалификацией в данной области будет понятно, что компоненты этой готовой формы могут варьироваться в количествах, все еще оставаясь в рамках идеи и объема данного изобретения. Например, эта композиция может содержать приблизительно 0,1 - приблизительно 10 г эстрадиола, приблизительно 0,1 - приблизительно 5,0 г Карбопола, приблизительно 0,1 - приблизительно 5,0 г триэтаноламина и приблизительно 30,0-98,0 г этанола. В одном варианте данного изобретения эти способы, наборы, комбинации и композиции применимы для супрессии как клеточно-опосредованных, так и иммунных реакций в субъекте. Андрогены, повидимому, подавляют как клеточно-опосредованные, так и гуморальные иммунные реакции. Многие исследователи пропагандировали увеличение уровней тестостерона у субъекта как защитное действие против аутоиммунного заболевания, такого как ревматоидный артрит. Таким образом, введение тестостерона рассматривается как эффективное при лечении субъекта с такими заболеваниями. Токсичность и терапевтическая эффективность терапевтических агентов данного изобретения могут быть определены стандартными фармацевтическими процедурами, например, для определения LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной в 50% популяции). Отношение доз между токсичными и терапевтическими эффектами является терапевтическим индексом, и он может быть выражен как отношение LD50/ED50. Соединения, которые обнаруживают высокие терапевтические индексы, являются предпочтительными. Хотя могут быть использованы соединения, которые обнаруживают токсичные побочные эффекты, следует заботиться о конструировании системы доставки, которая нацеливает такие соединения на участок пораженной ткани, чтобы минимизировать потенциальное повреждение неинфицированных клеток и, тем самым, уменьшить побочные действия. Активные агенты данного изобретения могут вводиться, если желательно, в форме соли, сложного эфира, амида, энантиомера, изомера, таутомера, пролекарства, производного или т.п., при условии, что эти соль, сложный эфир, амид, энантиомер, изомер, таутомер, пролекарство или производное являются подходящими фармакологически, т.е. эффективными в данных способах, наборах, комбинациях и композициях. Соли, сложные эфиры, амиды, энантиомеры, изомеры, таутомеры, пролекарства и другие производные этих активных агентов могут быть получены с использованием стандартных процедур, известных лицам с квалификацией в области синтетической органической химии и описанных, например, J. March, Advanced Organic Chemistry; Reactions, Mechanisms and Structure, 4th Ed. (New York: WileyInterscience, 1992). Например, кислотно-аддитивные соли получают из свободного основания с использованием общепринятой методологии, которая включает в себя реакцию с подходящей кислотой. Обычно, форму основания лекарственного средства растворяют в полярном органическом растворителе, таком как метанол или этанол, и добавляют к раствору кислоту. Полученную соль либо осаждают, либо извлекают из раствора добавлением менее полярного растворителя. Подходящие кислоты для получения ки- 25 - 007431 слотно-аддитивных солей включают в себя как органические кислоты, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, яблочную кислоту, малоновую кислоту, янтарную кислоту, малеиновую кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, паратолуолсульфоновую кислоту, салициловую кислоту и т.п., так и неорганические кислоты, например, хлористо-водородную кислоту, бромисто-водородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.п. Кислотно-аддитивная соль может быть превращена в свободное основание обработкой подходящим основанием. Особенно предпочтительными кислотно-аддитивными солями описанных здесь активных агентов являются галогенидные соли, такие, которые могут быть приготовлены с использованием хлористо-водородной или бромистоводородной кислот. В частности, предпочтительными щелочными солями являются соли щелочных металлов, например, соль натрия и соли меди. Получение сложных эфиров включает в себя функционализацию гидроксильной и/или карбоксильной групп, которые могут присутствовать в молекулярной структуре лекарственного средства. Сложные эфиры являются обычно ацилзамещенными производными свободных спиртовых групп, т.е. молекулами, которые произведены из карбоновых кислот формулы RCOOH, где R является алкилом и предпочтительно является низшим алкилом. Сложные эфиры могут быть превращены в свободные кислоты, если это желательно, с использованием общепринятых процедур гидрогенолиза или гидролиза. Амиды и пролекарства могут быть также получены с использованием способов, известных специалистам с квалификацией в данной области или описанных в соответствующей литературе. Например, амиды могут быть получены из сложных эфиров с использованием подходящих содержащих аминогруппу реагентов, или они могут быть получены из ангидрида или хлорангидрида реакцией с аммиаком или низшим алкиламином. Пролекарства обычно получают ковалентным присоединением части молекулы, которая приводит к соединению, которое является терапевтически неактивным, пока оно не будет метаболизировано метаболической системой индивидуума. Терапевтические агенты данного изобретения могут быть приготовлены в виде единой фармацевтической композиции, содержащей по меньшей мере один терапевтический агент, например, только тестостерон, или с антидепрессантом, или в виде независимых множественных фармацевтических композиций, причем каждая композиция содержит, по меньшей мере, один терапевтический агент. Фармацевтические композиции в соответствии с данным изобретением включают в себя композиции по меньшей мере с одним фармацевтическим агентом, приготовленные для чрескожного введения. Чрескожное введение включает в себя системы трансдермальной доставки, которые включают в себя пластыри, гели, ленты и кремы и могут содержать эксипиенты, такие как спирты, усиливающие проникновение агенты, высвобождающие гидроксид агенты и загущающие агенты, а также солюбилизаторы (например, пропиленгликоль, соли желчных кислот и аминокислоты), гидрофильные полимеры (например, поликарбофил и поливинилпирролидон) и адгезивы и повышающие клейкость вещества (например, полиизобутилены, адгезивы на основе силиконов, акрилаты и полибутен). Затем терапевтические агенты данного изобретения могут быть введены чрескожно в дозированных унифицированных (стандартных) формах, содержащих нетоксичные фармацевтически приемлемые наполнители, адъюванты и носители, если это желательно. Соединения данного изобретения могут вводиться любым общепринятым способом, доступным для использования вместе с фармацевтическими веществами, либо в виде индивидуальных терапевтических соединений, либо в виде комбинации терапевтических соединений. Композиции данного изобретения могут вводиться для лечения, предупреждения или уменьшения риска развития тестостероновой недостаточности у субъекта любыми способами, которые производят контакт этих соединений с местом их действия в теле, например, в подвздошной кишке, плазме или печени субъекта. Например, эти композиции могут вводиться перорально, ректально, местно, буккально или парентерально. Кроме того, способы, наборы, комбинации и композиции данного изобретения могут необязательно включать в себя соли, мягчители, стабилизаторы, антимикробные агенты, ароматизаторы и пропелленты. В другом варианте данного изобретения терапевтические агенты находятся в форме наборов или упаковок, содержащих тестостерон. Иллюстративно, наборы или упаковки содержат тестостерон в дозированной форме, пригодной для чрескожного введения, например, в форме геля, крема, мази или пластыря, в количествах для правильного введения доз этих лекарственных средств. Терапевтические агенты данного изобретения могут быть упакованы в форме наборов или упаковок, в которых суточные (или другие дозы для периодического введения) дозы помещены определенным образом для правильного последовательного или одновременного введения. Данное изобретение обеспечивает также набор или упаковку, содержащие множество дозированных единиц, адаптированных для последовательного введения один раз в день, причем каждая дозированная единица содержит, по меньшей мере, один из терапевтических агентов данного изобретения. Может быть использована система доставки лекарственного средства для облечения введения любого из различных вариантов этой терапевтической композиции. В одном варианте эта система содержит множество доз, которые должны вводиться один раз в день или один раз в неделю, где, по меньшей мере, одна из этих доз вводится чрескожным введением. В другом варианте - 26 - 007431 эта система содержит множество доз, которые должны вводиться один раз в день или один раз в неделю, где, по меньшей мере, одна из этих доз вводится чрескожным введением, и, по меньшей мере, одна из доз вводится перорально. Эти наборы или упаковки содержат также комплект инструкций для субъекта. Данные способы, наборы, комбинации и композиции могут быть также использованы в "комбинированной терапии" с другим стероидом или фармацевтическим агентом, который увеличивает уровни тестостерона у субъекта, или эстрогенным гормоном или другим фармацевтическим агентом, таким как, например, антидепрессант. Фраза "комбинированная терапия" включает в себя введение стероида в пути синтеза тестостерона вместе с другим стероидом или фармацевтическим агентом, который увеличивает уровни тестостерона в субъекте, или эстрогенным гормоном или другим фармацевтическим агентом, таким как, например, антидепрессант, в виде части специфической схемы лечения, предназначенной для обеспечения благоприятного эффекта в результате совместного действия этих терапевтических агентов для лечения депрессивного нарушения у субъекта. Благоприятный эффект этой комбинации включает в себя, но не ограничивается ими, фармакокинетическое или фармакодинамическое совместное действие, происходящее из этой комбинации терапевтических агентов. Введение этих терапевтических агентов в комбинации обычно проводят на протяжении определенного периода времени (обычно одновременно, в течение минут, часов, дней, недель, месяцев или лет в зависимости от выбранной комбинации). "Комбинированная терапия" обычно не предусматривает введение двух или более из этих терапевтических агентов как части отдельных программ монотерапии, которые случайным образом и произвольно приводят к комбинациям данного изобретения. "Комбинированная терапия" предназначена для введения этих терапевтических агентов последовательным образом, т.е. когда каждый терапевтический агент вводят в разное время, а также введения этих терапевтических агентов, или по меньшей мере двух из этих терапевтических агентов, по существу одновременно. По существу одновременное введение может быть выполнено, например, введением субъекту единственного геля, имеющего фиксированное отношение каждого терапевтического агента, или введением во множественных отдельных капсулах, таблетках или гелях для каждого из этих терапевтических агентов. Последовательное или по существу одновременное введение каждого терапевтического агента может выполняться любым подходящим способом, в том числе, но не только, пероральным способом, чрескожным способом, внутривенным способом, внутримышечным способом или прямой абсорбцией через ткани слизистой оболочки. Эти терапевтические агенты могут вводиться одним и тем же способом или различными способами. Например, первый терапевтический агент выбранной комбинации может вводиться перорально, тогда как другие терапевтические агенты этой комбинации могут вводиться чрескожно. Альтернативно, например, все терапевтические агенты могут вводиться внутримышечно, или все терапевтические агенты могут вводиться прямой абсорбцией через ткани слизистой оболочки. Последовательность, в которой вводят терапевтические агенты, не является особенно критической. "Комбинированная терапия" может также включать в себя введение терапевтических агентов, как описано выше, в дополнительной комбинации с другими биологически активными ингредиентами, такими как, но не только, агенты для улучшения сексуальной активности, такие как, например, агент, эффективный в ингибировании активности фосфодиэстеразы, и с нелекарственными терапиями, такими как, но не только, хирургия. Терапевтические соединения, которые используются в комбинированной терапии, могут быть комбинированной дозированной формой или находиться в виде отдельных дозированных форм, предназначенных, по существу, для одновременного введения. Терапевтические соединения, которые используются в комбинированной терапии, могут также вводиться последовательно, причем любое терапевтическое соединение вводят по схеме введения, называемой двухстадийным введением. Таким образом, схема введения может называться последовательным введением терапевтических соединений с пространственно разделенным введением отдельных активных агентов. Период времени между множественными стадиями введения может находиться в диапазоне от, например, нескольких минут до нескольких часов и до нескольких дней, в зависимости от свойств каждого терапевтического соединения, таких как активность, растворимость, биодоступность, полупериод существования в плазме и кинетический профиль терапевтического соединения, а также в зависимости от действия приема пищи и возраста и состояния конкретного субъекта. Циркадная вариация концентрации молекулы-мишени может также определять оптимальный интервал введения доз. Терапевтические соединения комбинированной терапии, независимо от того вводят ли их одновременно, по существу одновременно или последовательно, могут применяться в схеме введения, предусматривающей введение одного терапевтического соединения пероральным способом, а другого терапевтического соединения чрескожным способом. Независимо от того, вводят ли терапевтические соединения комбинированной терапии перорально, с использованием ингаляционного спрея, ректально, местно, буккально (например, сублингвально) или парентерально (например, подкожной, внутримышечной, внутривенной и интрадермальной инъекциями или инфузионными способами), раздельно или вместе, каждое такое соединение будет содержаться в подходящей фармацевтической форме фармацевтически приемлемых эксципиентов, разбавителей или других компонентов готовых форм. Примеры подходящих фармацевтически приемлемых готовых форм, содержащих эти терапевтические соединения, приведены выше. Кроме того, готовые формы лекарственных средств обсуждаются, - 27 - 007431 например, Hoover, John E., Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania 1975. Другое обсуждение форм лекарственных средств может быть найдено в Liberman, H.A. and Lachman, L., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y., 1980. Далее данное изобретение иллюстрируется следующими примерами, которые не должны рассматриваться как ограничивающие каким-либо образом данное изобретение. В приведенном ниже примере предполагается, что женщины с нормальным циклом продуцируют 300 мкг тестостерона в день, и их уровни тестостерона в сыворотке обычно находятся в диапазоне приблизительно 20 нг/дл - приблизительно 80 нг/дл, в среднем приблизительно 40 нг/дл. Билатеральная овариэктомия в предменопаузальных женщинах уменьшает продукцию тестостерона на приблизительно 50%, приводя к среднему общему сывороточному уровню приблизительно 20 нг/дл. С точки зрения физиологической перспективы, тестостероновая терапия у женщин с хирургически вызванной менопаузой, которые, например, испытывают женскую сексуальную дисфункцию, должна восполнять продуцирование тестостерона отсутствующего яичника приблизительно 150 мкг в день и восстанавливать уровни тестостерона и его активного андрогенного метаболита дигидротестостерона (DHT) до их прежних уровней в нормальном физиологическом диапазоне. Следующие примеры приведены в качестве примеров данного изобретения и не предназначены для ограничения каким-либо образом данного изобретения. Примеры Пример 1. Доза тестостерона в женщине после билатеральной овариэктомии. В одном варианте данного изобретения способы, наборы, комбинации и композиции используют чрескожно доставляемую форму тестостерона. В данном примере тестостерон готовят в виде геля для трансдермального введения, как описано выше в табл. 5а (Relibra®). В примере 24 предменопаузальных женщин, которые были подвергнуты билатеральной овариэктомии, рандомизируют для получения: (а) 1,7 г/день Relibra®, которые доставляют 1,7 мг/день тестостерона на кожу, из которых приблизительно 0,1 мг абсорбируется, в течение 30 дней; или (b) 2,5 г/день Relibra®, которые доставляют 2,5 мг/день тестостерона на кожу, из которых приблизительно 0,15 мг абсорбируются, в течение 30 дней; или (с) 5 г/день Relibra®, которые доставляют 5,0 мг/день тестостерона на кожу, из которых приблизительно 0,3 мг абсорбируются, в течение 30 дней; или (d) гель, содержащий плацебо, в течение 30 дней. Гель втирают на чистую сухую кожу верхней наружной части бедра и тазобедренного сустава один раз в день. После нанесения гелю дают высохнуть на воздухе. Субъект моет свои руки. Авторы изобретения ожидают, что с точки зрения физиологической перспективы, все тестпараметры будут показывать улучшение женской сексуальной дисфункции и улучшение в общих депрессивных симптомах в сравнении с плацебо. Таким образом, авторы изобретения ожидают, что эта композиция может применяться для улучшения женской сексуальной дисфункции и депрессивного нарушения в сравнении с плацебо в предменопаузальных женщинах, которые были подвергнуты билатеральной овариэктомии. Пример 2. Доза тестостерона и метилтестостерона в женщине после билатеральной овариэктомии. В одном варианте данного изобретения способы, наборы, комбинации и композиции используют чрескожно доставляемую форму тестостерона и перорально доставляемую форму метилтестостерона. В данном примере тестостерон готовят в виде геля для трансдермального введения, как описано выше в табл. 5а (Relibra®), a метилтестостерон готовят в виде капсулы для перорального введения и каждая единица дозы содержит 10 мг метилтестостерона. В примере 24 предменопаузальных женщин, которые были подвергнуты билатеральной овариэктомии, рандомизируют для получения ежедневной пероральной дозы 10 мг или 50 мг метилтестостерона в течение 30 дней плюс: (а) 1,7 г/день Relibra®, которые доставляют 1,7 мг/день тестостерона на кожу, из которых приблизительно 0,1 мг абсорбируется, в течение 30 дней; или (b) 2,5 г/день Relibra®, которые доставляют 2,5 мг/день тестостерона на кожу, из которых приблизительно 0,15 мг абсорбируются, в течение 30 дней; или (с) 5 г/день Relibra®, которые доставляют 5,0 мг/день тестостерона на кожу, из которых приблизительно 0,3 мг абсорбируются, в течение 30 дней; или (d) гель, содержащий плацебо, в течение 30 дней. Гель втирают на чистую сухую кожу верхней наружной части бедра и тазобедренного сустава один раз в день. После нанесения гелю дают высохнуть на воздухе. Субъект моет свои руки. Авторы изобретения ожидают, что с точки зрения физиологической перспективы, все тестпараметры будут показывать улучшение женской сексуальной дисфункции и улучшение в общих депрессивных симптомах в сравнении с плацебо. Таким образом, авторы изобретения ожидают, что Relibra® может вводиться вместе с метилтестостероном для улучшения женской сексуальной дисфункции и депрессивного нарушения в сравнении с плацебо в предменопаузальных женщинах, которые были подвергнуты билатеральной овариэктомии. Пример 3. Доза тестостерона и эстрогена в женщине после билатеральной овариэктомии. В одном варианте данного изобретения способы, наборы, комбинации и композиции используют чрескожно доставляемую форму тестостерона и неперорально доставляемый эстроген. В данном примере тестостерон готовят в виде геля для трансдермального введения, как описано выше в табл. 5а (Reli- 28 - 007431 bra®), а эстрадиол готовят в виде геля для трансдермального введения, как описано выше в табл. 9 (ESTRAGEL). В примере 24 предменопаузальных женщин, которые были подвергнуты билатеральной овариэктомии, рандомизируют для получения ежедневной дозы 5 мг или 10 мг ESTRAGEL в течение 30 дней плюс: (а) 1,7 г/день Relibra®, которые доставляют 1,7 мг/день тестостерона на кожу, из которых приблизительно 0,1 мг абсорбируется, в течение 30 дней; или (b) 2,5 г/день Relibra®, которые доставляют 2,5 мг/день тестостерона на кожу, из которых приблизительно 0,15 мг абсорбируются, в течение 30 дней; или (с) 5 г/день Relibra®, которые доставляют 5,0 мг/день тестостерона на кожу, из которых приблизительно 0,3 мг абсорбируются, в течение 30 дней; или (d) гель, содержащий плацебо, в течение 30 дней. Гель втирают на чистую сухую кожу верхней наружной части бедра и тазобедренного сустава один раз в день. После нанесения гелю дают высохнуть на воздухе. Субъект моет свои руки. Авторы изобретения ожидают, что с точки зрения физиологической перспективы, все тестпараметры будут показывать улучшение женской сексуальной дисфункции и улучшение в общих депрессивных симптомах в сравнении с плацебо. Таким образом, авторы изобретения ожидают, что эта композиция может вводиться вместе с эстрадиолом для улучшения женской сексуальной дисфункции и депрессивного нарушения в сравнении с плацебо в предменопаузальных женщинах, которые были подвергнуты билатеральной овариэктомии. Пример 4. Комбинация тестостерона и геля эстрогена. Этот гель втирают на чистую сухую кожу верхней наружной части бедра и тазобедренного сустава один раз в день. После нанесения гелю дают высохнуть на воздухе. Субъект моет свои руки. Нанесение этого геля приводит к увеличенному уровню тестостерона, имеющему желаемый фармакокинетический профиль, сходный с профилем в нормальной женщине. Таким образом, этот гель применим для лечения ряда состояний или заболеваний у женщин, таких как депрессивное нарушение. Пример 5. Способ улучшения сексуальной активности и увеличения либидо у гипогонадотропных мужчин. Один вариант данного изобретения включает в себя трансдермальное нанесение AndroGel® в качестве способа увеличения сексуальной активности и либидо у гипогонадотропных мужчин без вызывания значимого раздражения кожи. В этом примере набирали гипогонадотропных мужчин-добровольцев в 16 центрах в Соединенных Штатах и исследовали их. Эти пациенты имели возраст 19-68 лет и имели утренние уровни сывороточного тестостерона при скрининге, меньшие или равные 300 нг/дл (10,4 нмоль/л). Всего было зарегистрировано 227 пациентов: рандомизировали на 3 группы из 73, 78 и 76 человек первые получали 5,0 г/день AndroGel® (доставляющих 50 мг/день тестостерона на кожу, из которых абсорбируется приблизительно 10% или 5 мг), вторые 10,0 г/день AndroGel® (доставляющих 100 мг/день тестостерона на кожу, из которых абсорбируется приблизительно 10% или 10 мг) и третьи - тестостероновый пластырь ANDRODERM® ("Т-пластыря"; доставляющий 50 мг/день тестостерона), соответственно. Как показано в табл. 10, не было значимых, ассоциированных с какой-либо группой различий характеристик пациентов при базовой линии (фоне). - 29 - 007431 Таблица 10. Характеристики базовой линии (фона) гипогонадотропных мужчин Сорок один процент (93/227) субъектов не получали перед этим тестостероновую заместительную терапию. Ранее лечившиеся гипогонадотропные мужчины прекратили инъекции эфира тестостерона в течение, по меньшей мере, шести недель и прием пероральных или трансдермальных андрогенов в течение четырех недель перед началом скрининга. Не считая гипогонадизма, эти субъекты имели хорошее здоровье, что доказывается картой больного, физическим обследованием, полной формулой крови, анализом мочи и биохимией сыворотки. Если субъекты принимали понижающие липиды агенты или транквилизаторы, эти дозы были стабилизированы в течение, по меньшей мере, трех месяцев перед занесением в список для исследования. Менее 5% субъектов принимали дополнительно кальций или витамин D во время исследования. Эти субъекты не имели истории хронического медицинского заболевания, злоупотребления алкоголем или лекарственным средством. Они имели нормальные результаты ректального обследования, уровень PSA менее 4 нг/мл и скорость тока мочи 12 мл/с или более. Пациентов исключали, если они имели генерализованное кожное заболевание, которое могло подействовать на абсорбцию тестостерона, или предыдущую историю раздражимости кожи пластырем ANDRODERM®. Субъекты, имеющие массу менее, чем 80%, или более 140% их идеальной массы тела, также исключались из исследования. Это рандомизированное, многоцентровое, параллельное исследование сравнивало две дозы AndroGel® с тестостероновым пластырем ANDRODERM®. Это исследование было двойным слепым в отношении дозы AndroGel® и открытым в отношении группы с пластырем тестостерона. В течение первых трех месяцев исследования (дни 1-90) субъектов рандомизировали для получения 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или два не-скротальных пластыря. В течение следующих трех месяцев (дни 91180) субъектов подвергали одной из следующих обработок: 5,0 г/день AndroGel®, 10,0 г/день AndroGel®, 7,5 г/день AndroGel® или два не-скротальных пластыря. Пациенты, которые применяли AndroGel®, имели единственное определение сывороточного тестостерона перед нанесением, измеренное в день 60, и, если эти уровни были в нормальном диапазоне 300-1000 нг/дл (10,4-34,7 нмоль/л), то они оставались на их начальной дозе. Пациенты с уровнями тестостерона, меньшими, чем 300 нг/дл, которые были начально приписаны к группе для получения 5,0 г/день AndroGel®, и пациенты с уровнями тестостерона, большими, чем 1000 нг/дл, которые получали 10,0 г/день AndroGel®, переводились в группы для получения 7,5 г/день AndroGel® в течение дней 91-180. Таким образом, на 90 день проводили коррекции доз в группах AndroGel® на основе уровней сывороточного тестостерона перед нанесением в день 60. Двадцать субъектов в группе с 5,0 г/день AndroGel® имели дозу, увеличенную до 7,5 г/день. Двадцать пациентов в группе с 10,0 г/день получали дозу, уменьшенную до 7,5 мг/день. Были три пациента в группе с пластырем тестостерона, которые переводи- 30 - 007431 ли на 5,0 г/день AndroGel® вследствие непереносимости пластыря. Один субъект группы 10,0 г/день AndroGel® был приписан к группе для получения 5,0 г/день, и один субъект группы 5 г/день AndroGel® был переведен на дозу, скорректированную для получения 2,5 г/день. Таким образом, количество субъектов, внесенных в списки исследования в дни 91-180, состояло из 51, получающего 5,0 г/день AndroGel®, 40 получающих 7,5 г/день AndroGel®, 52 получающих 10,0 г/день AndroGel® и 52, продолжающих применять пластырь ANDRODERM®. Таким образом, группы лечения в этом примере могут характеризоваться двумя путями, либо "начальная", либо "конечная" группа лечения. Субъекты возвращались в центр исследования в дни 0, 30, 60, 90, 120 и 180 для клинического обследования, оценки раздражения кожи и оценки вредного действия. AndroGel® и пластырь ANDRODERM® Приблизительно 250 г AndroGel® упаковывали в многодозовые стеклянные флаконы, которые доставляли 2,25 г этого геля при каждом приведении в действие (запуске) этого насоса. Пациентам, приписанным к группе получения 5,0 г/день тестостерона AndroGel®, давали один флакон AndroGel® и один флакон плацебо (содержащий носитель, но не содержащий тестостерон), тогда как пациентам, приписанным к группе для получения 10,0 г/день AndroGel®, давали по два флакона активного AndroGel®. Затем пациентов инструктировали в отношении нанесения содержимого этих флаконов на правом и левом плечах/плечевых суставах и на правой и левой сторонах живота чередующимся образом. Например, в первый день исследования пациенты наносили два запуска из одного флакона, по одному на левое и правое плечо/плечевой сустав, и два запуска из второго флакона, по одному на левую и правую стороны живота. На следующий день лечения эти нанесения были обратными. Чередующиеся места нанесения продолжали использовать во всем этом исследовании. После нанесения геля на кожу гель сушили в пределах нескольких минут. Пациенты тщательно мыли их руки с мылом и водой сразу же после нанесения геля. Группа 7,5 г/день AndroGel® получала дозу открытым образом. Спустя 90 дней для субъектов, которым дозу уменьшали до 7,5 г/день AndroGel®, пациентам давали три флакона, один из которых содержал плацебо, а два другие AndroGel®. Этих субъектов инструктировали для нанесения одного запуска из флакона плацебо и трех запусков из флакона AndroGel® в четыре различных места тела, как описано выше. Эти места чередовали каждый день с использованием той же самой последовательности действий, какая описана выше. Пластыри тестостерона ANDRODERM®, каждый из которых доставлял 2,5 мг/день тестостерона, предоставляли приблизительно одной трети пациентов в данном исследовании. Этих пациентов инструктировали для нанесения двух пластырей тестостерона на чистую сухую кожу на спине, животе, плечах или бедрах один раз в день. Места нанесения чередовали с приблизительно семидневным интервалом между нанесениями в то же самое место. В дни исследований, когда пациентов оценивали, гель/пластыри наносили после предварительных оценок доз. В остальные дни гель или пластыри тестостерона наносили приблизительно в 8:00 часов до полудня в течение 180 дней. Способ и результаты исследования Фармакокинетика гормонов В дни 0, 1, 30, 90 и 180 пациенты сдавали множественные пробы крови для измерений тестостерона и свободного тестостерона до 30, 15 и 0 мин перед нанесением AndroGel® или пластыря и через 2, 4, 8, 12, 16 и 24 ч после нанесения AndroGel® и пластыря. Кроме того, субъекты возвращались в дни 60, 120 и 150 для взятия единственной пробы крови перед нанесением геля или пластыря. DHT, Е2, FSH, LH и SHBG в сыворотке измеряли на пробах, собранных перед нанесением геля в дни 0, 30, 60, 90, 120, 150 и 180. Сыворотки для всех гормонов хранили в замороженном виде при -20°С до анализа. Все пробы пациента на каждый гормон измеряли в одном и том же анализе, когда это было возможно. Затем анализы на гормоны проводили в Лаборатории эндокринных исследований (Endocrine Research Laboratory) Медицинского центра UCLA-Harbor. Таблица 11 суммирует фармакокинетические параметры, которые измеряли для каждого пациента. Таблица 11. Фармакокинетические параметры - 31 - 007431 Фармакокинетики тестостерона Способы Уровни сывороточного тестостерона измеряли после экстракции этилацетатом и гексаном при помощи специфического радиоиммуноанализа (РИА) с использованием реагентов от ICN (Costa Mesa, CA). Перекрестные реактивности антисыворотки, используемой в РИА тестостерона, были равны 2,0% для DHT, 2,3% для андростандиона, 0,8% для 3-β-андростандиола, 0,6% для этиохоланолона и менее, чем 0,01%, для всех остальных тестируемых стероидов. Нижний предел количественного определения (LLQ) для сывороточного тестостерона, измеряемого при помощи этого анализа, был 25 нг/дл (0,87 нмоль/л). Средняя точность этого анализа тестостерона, определенная введением в не содержащую стероидов сыворотку варьирующихся количеств тестостерона (0,9 нмоль/л - 52 нмоль/л), была 104% и находилась в диапазоне 92%-117%. Коэффициенты вариации внутри анализа и между анализами этого анализа тестостерона были 7,3 и 11,1%, соответственно, в диапазоне нормального взрослого мужчины. У нормальных взрослых мужчин диапазон концентраций тестостерона был 298-1042 нг/дл (10,33-36,17 нмоль/л), как определено в медицинском центре UCLA-Harbor. Концентрация базовой линии (фона) Как показано в таблице 12(а)-6(b) и на фиг. № 1(a), на базовой линии (фоне) средние сывороточные концентрации на протяжении 24 ч (Cavg) были сходными во всех группах и ниже диапазона нормального человека. Кроме того, вариации сывороточной концентрации (на основе максимальных и минимальных концентраций во время 24-часового периода, Сmax и Cmin, соответственно) в течение дня были также сходными в этих трех группах. Фиг. № 1(a) показывает, что средние уровни тестостерона имели максимальный уровень между 8 и 10 часами до полудня (т.е. при 0 и 2 часах) и минимальный уровень спустя 8-12 ч, что демонстрировало умеренную суточную вариацию сывороточного тестостерона. Приблизительно одна треть пациентов в каждой группе имела Cavg в пределах нижнего диапазона нормального взрослого мужчины в день 0 (24/73 для группы 0,5 г/день AndroGel®, 26/78 для группы 10,0 г/день AndroGel® и 25/76 для группы с тестостероновым пластырем). Все, за исключением трех субъектов, удовлетворяли критерию сывороточного тестостерона, требуемому для включения в исследование, т.е. менее, чем 300 нг/дл (10,4 нмоль/л), при поступлении. Таблица 12(a). Фармакокинетические параметры базовой линии (фона) в начальной группе обработки (Среднее ± SD) * Медиана (диапазон) Таблица 12(b). Фармакокинетические параметры тестостерона базовой линии (фона) в конечной группе обработки (Среднее ± SD) * Медиана (диапазон) День 1. Фигура № 1(b) и таблицы 12(c)-(d) показывают фармакокинетический профиль для всех трех начальных групп лечения (обработки) после первого нанесения трансдермального тестостерона. Обычно лечение (обработка) AndroGel® и пластырем тестостерона давали увеличения концентраций тестостерона, достаточно большие, чтобы привести пациентов в нормальный диапазон за всего лишь несколько часов. Однако даже в день 1 фармакокинетические профили заметно отличались в группах AndroGel® и группе с пластырем. Сывороточный тестостерон увеличивался наиболее быстро в группе с пластырем - 32 - 007431 тестостерона, достигая максимальной концентрации (Сmax) на приблизительно 12 час (Тmax). В противоположность этому, сывороточный тестостерон увеличивался стойко до нормального диапазона после нанесения AndroGel® с максимальными уровнями, достигаемыми на 22 и 16 час в группе с 5,0 г/день AndroGel® и группе 10,0 г/день AndroGel®, соответственно. Таблица 12(c). Фармакокинетические параметры тестостерона в день 1 в начальной группе обработки (Среднее ± SD) * Медиана (диапазон) Таблица 12(d). Фармакокинетические параметры тестостерона в день 1 в конечной группе обработки (Среднее ± SD) * Медиана (диапазон) Дни 30, 90 и 180. Фигуры № 1(c) и 1(d) показывают уникальный 24-часовой фармакокинетический профиль обработанных AndroGel® пациентов в дни 30 и 90. В группах AndroGel® сывороточные уровни тестостерона показали небольшие и вариабельные увеличения вскоре после введения доз. Затем эти уровни возвращались к относительно постоянному уровню. В противоположность этому, в группе с пластырем тестостерона пациенты обнаруживали увеличение на протяжении первых 8-12 ч, плато в течение следующих 8 ч и затем снижение до базовой линии (фона) предыдущего дня. Далее, после нанесения геля в оба дня 30 и 90 Cavg в группе 10,0 г/день была в 1,4 раза более высокой, чем в группе 5,0 г/день AndroGel®, и в 1,9 раз более высокой, чем в группе с пластырем тестостерона. Группа с пластырем тестостерона также имела Cmin по существу ниже нижнего предела нормального диапазона. В день 30 коэффициент накопления был 0,94 для группы с пластырем тестостерона, не обнаруживая накопления. Коэффициенты накопления при 1,54 и 1,9 были значимо более высокими в группе 5,0 г/день AndroGel® и в группе 10,0 г/день AndroGel®, соответственно. Различия в коэффициенте накопления среди этих групп сохранялись в день 90. Эти данные указывают на то, что препараты AndroGel® имели более длительные эффективные полупериоды существования в сыворотке, чем пластырь тестостерона. Фигура № 1(e) показывает 24-часовой фармакокинетический профиль этих групп обработки в день 180. Обычно, как показывает таблица 12(e), достигаемые сывороточные концентрации тестостерона и фармакокинетические параметры были сходными с концентрациями тестостерона и фармакокинетическими параметрами в дни 30 и 90 у пациентов, которые продолжали находиться в их начальных рандомизированных группах обработки. Таблица 12(f) показывает, что пациенты, переведенные в группу 7,5 г/день AndroGel®, не были однородными. Пациенты, которые ранее находились в группе 10 г/день, имели тенденцию иметь более высокие сывороточные уровни тестостерона, чем пациенты, которые ранее получали 5,0 г/день. В день 180 Cavg у пациентов в группе 10,0 г/день, которые были переведены в группу 7,5 г/день в день 90, была равна 744 нг/дл, которая была в 1,7 раз более высокой, чем Cavg 450 нг/дл, у пациентов, которые были переведены в группу 7,5 г/день из группы 5 г/день. Несмотря на коррекцию дозы на 2,5 г/день в сторону повышения в группе 5,0 → 7,5 г/день Cavg оставалась более низкой, чем у пациентов, оставшихся в группе 5,0 г/день. В группе 10,0 → 7,5 г/день Cavg становилась сходной с Cavg, достигаемой пациентами, оставшимися в группе 10,0 г/день без уменьшения дозы. Эти результаты предполагают, что многие, не дающие реакции пациенты, могут быть фактически менее старательными пациентами. Например, если пациент не наносит AndroGel® правильно (например, преимущественно из кон- 33 - 007431 тейнера с плацебо или незадолго перед принятием ванны), то увеличение дозы не даст никакой дополнительной пользы. Фигуры № l(f)-(h) сравнивают фармакокинетические профили для группы 5,0 г/день AndroGel®, группы 10,0 г/день AndroGel® и тестостеронового пластыря в дни 0, 1, 30, 90 и 180. В общем, средние сывороточные уровни тестостерона в группе с тестостероновым пластырем оставались на нижнем пределе нормального диапазона на протяжении всего периода обработки. В противоположность этому, средние сывороточные уровни тестостерона оставались приблизительно 490-570 нг/дл для группы 5,0 г/день AndroGel® и приблизительно 630-860 нг/дл AndroGel® для группы 10,0 г/день. Таблица 12(e). Фармакокинетические параметры тестостерона в день 1 в начальной группе обработки (Среднее ± SD) * Медиана (диапазон) - 34 - 007431 Таблица 12(f). Фармакокинетические параметры тестостерона в дни 30, 90, 180 в конечной группе обработки (Среднее ± SD) * Медиана (диапазон) Пропорциональность доз для AndroGel® Таблица 12(g) показывает увеличение AUC0-24 в дни 30, 90 и 180 от базовой линии (фона) перед обработкой (нетто AUC0-24), рассчитанное с использованием среднего арифметического. Для оценки пропорциональности доз выполняли оценку биологической эквивалентности на log-преобразованных AUC с использованием «обработки» в качестве единственного фактора. Эти AUC сравнивали после вычитания вклада AUC из эндогенной секреции тестостерона (AUC в день 0) и коррекции на двухкратное различие в применяемых дозах. Отношение AUC в день 30 было 0,95 (90% C.I.: 0,75-1,19), а в день 90 оно было 0,92 (90% C.I.: 0,73-1,17). При объединении данных дня 30 и дня 90 отношение AUC было 0,93 (90% C.I.: 0,79-1,10). - 35 - 007431 Эти данные показывают пропорциональность доз для обработки AndroGel®. Среднее геометрическое увеличения AUC0-24 от дня 0 до дня 30 или дня 90 было в 2 раза большим для группы 10,0 г/день, чем для группы 5,0 г/день. Среднее увеличение 125 нг/дл уровня Cavg сывороточного тестостерона получали на каждые 2,5 г/день AndroGel®. Другими словами, эти данные показывают, что доза 0,1 г/день AndroGel® давала в среднем увеличение на 5 нг/дл концентрации сывороточного тестостерона. Эта пропорциональность доз помогает врачу корректировать вводимые дозы. Поскольку AndroGel® продается в упаковках по 2,5 г (содержащих 25 мг тестостерона), каждая упаковка 2,5 г будет производить, в среднем, увеличение 125 нг/дл в Cavg-концентрации общего сывороточного тестостерона. Таблица 12(g). Нетто-AUC0-24 (нмоль*ч/л) в дни 30, 90 и 180 после трансдермального введения тестостерона Увеличения AUC0-24 от базовой линии (фона) перед обработкой, достигаемое группами 10,0 г/день и 5,0 г/день, были приблизительно в 2,7 раз и в 1,7 раз более высокими, чем увеличение при нанесении тестостеронового пластыря. Эти фигуры свидетельствуют также о том, что пластырь ANDRODERM®, который производит увеличение приблизительно 180 нг/дл Cavg, является эквивалентным приблизительно 3,5 г/день AndroGel®. Фармакокинетика концентрации свободного тестостерона в сыворотке Способы Свободный тестостерон в сыворотке измеряли при помощи РИА диализата после ночного равновесного диализа с использованием тех же самых реагентов РИА, которые использовали в анализе тестостерона. LLQ сывороточного свободного тестостерона с использованием способа равновесного диализа был оценен как 22 пмоль/л. При введении в не содержащую стероидов сыворотку увеличивающихся доз тестостерона в диапазоне взрослого мужчины увеличивающиеся количества свободного тестостерона извлекали с коэффициентом вариации в диапазоне 11,0-18,5%. Коэффициенты вариации свободного тестостерона внутри анализа и между анализами были 15% и 16,8% для величин взрослых нормальных мужчин, соответственно. Как определено в медицинском центре UCLA-Harbor, диапазон концентраций свободного тестостерон у нормальных взрослых мужчин был 3,48-17,9 нг/дл (121-620 пмоль/л). Фармакокинетические результаты В общем, как показано в таблице 13, фармакокинетические параметры сывороточного свободного тестостерона отражали фармакокинетические параметры сывороточного общего тестостерона, описанные выше. При базовой линии (день 0) средние концентрации сывороточного свободного тестостерона (Cavg) были сходными во всех трех группах, которые находились на нижнем пределе диапазона взрослых мужчин. Максимальная сывороточная концентрация свободного тестостерона имела место между 8 и 10 часами до полудня, а минимальная спустя 8-16 ч. Эти данные согласуются с умеренной суточной вариацией сывороточного тестостерона. Фиг. 2(a) показывает 24-часовые фармакокинетические профили для трех групп обработки в день 1. После нанесения пластыря тестостерона уровни сывороточного свободного тестостерона достигали максимума на 12 час, приблизительно на 4 часа раньше, чем максимальные уровни, достигаемые группами AndroGel®. Затем сывороточные уровни свободного тестостерона снижались в группе с пластырем тестостерона, тогда как в группах AndroGel® сывороточные уровни свободного тестостерона продолжали повышаться. Фиг. 2(b) и 2(c) показывают фармакокинетические профили свободного тестостерона в AndroGel®обработанных группах, сходные с уникальными профилями тестостерона на 30 и 90 день. После нанесения AndroGel® средние сывороточные уровни свободного тестостерона в этих трех группах были в пределах нормального диапазона. Подобно результатам для общего тестостерона, Cavg свободного тестостерона, достигаемая группой 10,0 г/день, была в 1,4 раза более высокой, чем в группе 5,0 г/день, и в 1,7 раз более высокой, чем в группе с пластырем тестостерона. Кроме того, коэффициент накопления для пластыря тестостерона был значимо более низким, чем коэффициент накопления группы 5,0 г/день и группы 10,0 г/день. Фиг. 2(d) показывает концентрации свободного тестостерона конечных групп обработки в день 180. В общем, концентрации свободного тестостерона обнаруживали сходную картину с картиной концентраций сывороточного тестостерона. 24-часовые фармакокинетические параметры были сходны с фармакокинетическими параметрами в дни 30 и 90 в тех субъектах, которые оставались в трех исходных рандомизированных группах. Опять в случае субъектов, переведенных на 7,5 г/день AndroGel®, эта группа была неоднородной. Cavg свободного тестостерона у пациентов с дозами, измененными с 5,0 на - 36 - 007431 7,5 г/день оставалась на 29% более низкой, чем Cavg субъектов, оставшихся в группе 5,0 г/день. Cavg свободного тестостерона у пациентов с дозами, уменьшенными с 10,0 до 7,5 г/день, была на 11% более высокой, чем у оставшихся пациентов в группе 10,0 г/день. Фиг. 2(e)-(g) показывают концентрации свободного тестостерона в трех группах субъектов на протяжении всего 180-дневного периода обработки. Опять уровни свободного тестостерона согласовались с уровнями тестостерона. Средние уровни свободного тестостерона во всех трех группах находились в нормальном диапазоне, причем группа 10,0 г/день сохраняла более высокие уровни свободного тестостерона, чем группа 5,0 г/день и группа с пластырем тестостерона. Таблица 13. Фармакокинетические параметры свободного тестостерона в группе конечной обработки (Среднее ± SD) - 37 - 007431 * Медиана (диапазон) Концентрации сывороточного DHT Сывороточный DHT измеряли при помощи РИА после обработки перманганатом калия пробы после экстракции. Способ и реагенты для анализа DHT были обеспечены DSL (Webster, TX). Перекрестные реактивности антисыворотки, используемой в РИА для DHT, были равны 6,5% для 3-β-андростандиола, 1,2% для 3-α-андростандиола, 0,4% для глюкуронида 3-α-андростандиола и 0,4% для тестостерона (после обработки перманганатом калия и экстракции) и менее, чем 0,01% для других испытанных стероидов. Эта низкая перекрестная реактивность против тестостерона дополнительно подтверждалась введением в не содержащую стероидов сыворотку 35 нмоль/л (1000 пг/дл) тестостерона и взятием проб с использованием анализа DHT. Результаты даже при введении более 35 нмоль тестостерона при измерении дали менее, чем 0,1 нмоль/л DHT. LLQ сывороточного DHT в этом анализе был равен 0,43 нмоль/л. Средняя точность (выход) этого анализа DHT, определенная введением в не содержащую стероидов сыворотку варьирующихся количеств DHT от 0,43 нмоль/л до 9 нмоль/л, была 101% и находилась в диапазоне 83%-114%. Коэффициенты вариации внутри анализа и между анализами этого анализа DHT были 7,8 и 16,6%, соответственно, для диапазона нормального взрослого мужчины. У нормальных взрослых мужчин диапазон концентраций DHT был 30,7-193,2 нг/дл (1,06-6,66 нмоль/л), как определено в медицинском центре UCLA-Harbor. Как показано в таблице 14, средние концентрации сывороточного DHT перед обработкой были между 36 и 42 нг/дл, которые были близкими к нижней границе нормального диапазона во всех трех начальных группах обработки. Ни один из пациентов не имел концентрации DHT, более высокие, чем верхняя граница нормального диапазона в день перед обработкой, хотя почти половина (103 пациента) имели концентрации, более низкие, чем нижняя граница. Фиг. 3 показывает, что после обработки различия между средними концентрациями DHT, ассоциированными с различными группами обработки, были статистически значимыми, причем пациенты, получающие AndroGel®, имели более высокую среднюю концентрацию DHT, чем пациенты, использующие пластырь, и обнаруживали дозовую зависимость средних концентраций сывороточного DHT. Конкретно, после нанесения пластыря тестостерона средние уровни сывороточного DHT повышались до приблизительно 1,3-кратного уровня выше базовой линии. В противоположность этому, сывороточный DHT увеличивался в 3,6 и 4,8 раза над базовой линией после нанесения 5,0 г/день и 10,0 г/день AndroGel®, соответственно. Таблица 14. Концентрации DHT (нг/дл) в каждый из дней наблюдения в группе начальной обработки (Среднее ± SD) Увеличение концентраций DHT связано, вероятно, с концентрацией и местоположением 5αредуктазы в коже. Например, большие количества 5α-редуктазы в скротальной коже предположительно вызывает увеличение концентраций DHT в пластыре TESTODERM®. В противоположность этому, пластыри ANDRODERM® и TESTODERM TTS ® дают небольшое изменение в уровнях DHT, так как площадь поверхности этого пластыря является маленькой и низкое количество 5α-редуктазы локализовано в не-скротальной коже. Предположительно, AndroGel® вызывает увеличение уровней DHT, так как этот гель наносят на относительно большую площадь кожи и, следовательно, экспонируют тестостерон большим количествам этого фермента. До настоящего времени не было сообщений о том, что повышенные уровни DHT имеют какие-либо вредные побочные клинические эффекты. Кроме того, существуют доказательства, позволяющие предполагать, что увеличенные уровни DHT могут ингибировать рак предстательной железы. - 38 - 007431 Отношение DHT/T Медицинский центр UCLA-Harbor сообщает отношение DHT/T 0,052-0,328 для нормальных взрослых мужчин. В этом примере средние отношения для всех трех обработок находились в пределах нормального диапазона в день 0. Как показано на фигуре № 4 и в таблице 15, имелись зависимые от обработки и от концентрации увеличения, наблюдаемые на протяжении 180-дневного периода. В частности, группы обработки AndroGel® показали наивысшее увеличение отношения DHT/T. Однако средние отношения для всех этих групп обработки оставались в пределах нормального диапазона во все дни наблюдения. Таблица 15. Отношение DHT/T в каждый из дней наблюденияв группе начальной обработки (Среднее ± SD) Общий андроген (DHT + Т) Медицинский центр UCLA-Harbor определил, что нормальная концентрация общих андрогенов равна 372-1350 нг/дл. Как показано на фигуре № 5 и в таблице 16, средние концентрации общих андрогенов перед введением для всех трех групп обработки были ниже нижней границы нормального диапазона в день 0 перед обработкой. Концентрации общих андрогенов для обеих групп AndroGel® были в пределах нормального диапазона во все дни наблюдения при всех обработках. В противоположность этому, средние концентрации для пациентов, получающих пластырь тестостерона, едва находились в пределах нормального диапазона в день 60 и 120, но были ниже нижней границы нормального диапазона в дни 30, 90, 150 и 180. Таблица 16. Общий андроген (DHT + T) (нг/дл) в каждый из дней наблюдения в группе начальной обработки Концентрации E2 Сывороточные уровни E2 измеряли прямым анализом без экстракции реагентами из ICN (Costa Mesa, CA). Коэффициенты вариации E2 внутри анализа и между анализами были 6,5 и 7,1%, соответственно. Медицинский центр UCLA-Harbor сообщил диапазон средних концентраций Е2 от 7,1 до 46,1 пг/мл (63-169 пмоль/л) для нормального диапазона взрослых мужчин. LLQ Е2 был 18 пмоль/л. Перекрестные реактивности антитела против Е2 были 6,9% для эстрона, 0,4% для эквиленина и менее, чем 0,01%, для всех других испытанных стероидов. Точность анализа Е2 оценивали введением в не содержащую стероидов сыворотку увеличивающегося количества Е2 (18-275 пмоль/л). Средний выход Е2 в сравнении с добавляемым количеством был 99,1% и находился в диапазоне от 95 до 101%. Фиг. 6 изображает концентрации Е2 на протяжении 180-дневного исследования. Средние концентрации Е2 перед обработкой для всех трех групп были 23-24 пг/мл. Во время исследования уровни Е2 увеличивались в среднем на 9,2 % в группе с пластырем тестостерона во время этого периода обработки, 30,9% в группе 5,0 г/день AndroGel® и 45,5% в группе 10,0 г/день AndroGel®. Все эти средние концентрации находятся в пределах нормального диапазона. - 39 - 007431 Таблица 17. Концентрация эстрадиола (пг/мл) в каждый из дней наблюдения в группе конечной обработки (Среднее ± SD) Считается, что Е2 является важным для сохранения нормальной костной ткани. Кроме того, Е2 оказывал положительное действие на профили сывороточных липидов. Концентрации сывороточного SHBG Уровни сывороточного SHBG измеряли при помощи иммунофлуоресцентного анализа (ИФА), полученного от Delfia (Wallac, Gaithersberg, MD). Коэффициенты вариации внутри анализа и между анализами были 5% и 12%, соответственно. LLQ был 0,5 нмоль/л. Медицинский центр UCLA-Harbor определил, что нормальный диапазон взрослых мужчин для анализа SHBG равен 0,8-46,6 нмоль/л. Как показано на фиг. 7 и в табл. 18, сывороточные уровни SHBG были сходными и находились в нормальном диапазоне взрослых мужчин в трех группах обработки при базовой линии (фоне). Ни одна из групп обработки не показала больших изменений от базовой линии в любой день визита для обработки. После пополнения тестостерона сывороточные уровни SHBG обнаруживали небольшое понижение во всех трех группах. Наиболее заметное изменение имело место в группе 10,0 г/день AndroGel®. Таблица 18. Концентрация SHBG (нмоль/л) в каждый из дней наблюдения в группе конечной обработки (Среднее ± SD) Гонадотропины Сывороточный FSH и LH измеряли при помощи высокочувствительных и специфических твердофазных анализов ИФА с использованием реагентов, поставляемых Delfia (Wallac, Gaitherdburg, MD). Коэффициенты вариаций внутри анализа для иммунофлуоресцентных анализов LH и FSH были 4,3 и 5,2%, соответственно; и коэффициенты вариации между анализами для LH и FSH были 11,0% и 12,0%, соответственно. Было определено, что как для анализа LH, так и для анализа FSH LLQ был равен 0,2 МЕ/л. Все пробы, полученные от одного и того же субъекта, измеряли в одном и том же анализе. Медицинский центр UCLA-Harbor сообщает, что диапазон нормальных взрослых мужчин для LH равен 1,0-8,1 Е/л, а для FSH он равен 1,0-6,9 Е/л. FSH Табл. 19(a)-(d) показывает концентрации FSH на протяжении 180-дневной обработки в зависимости от причины гипогонадизма: (1) первичный гонадизм, (2) вторичный, (3) ассоциированный с возрастом или (4) неизвестного происхождения. Пациенты с первичным гипогонадизмом обнаруживают интактный механизм обратной связи, заключающийся в том, что низкие концентрации сывороточного тестостерона ассоциируются с высокими концентрациями FSH и LH. Однако вследствие тестикулярной или других недостаточностей высокие концентрации LH являются неэффективными в стимуляции продуцирования тестостерона. Вторичный гипогонадизм включает в себя недостаточность идиопатического гонадотропина или высвобождения гормона LH. Поскольку пациенты с вторичным гипогонадизмом не демонстрируют механизма обратной связи, более низкие концентрации тестостерона не связаны с увеличенными уровнями LH или FSH. Таким образом, эти мужчины имеют низкие уровни сывороточного тестостерона, но имеют гонадотропины в нормальном или низком диапазоне. - 40 - 007431 Гипогонадизм может быть связан с возрастом. Мужчины испытывают медленное, но непрерывное снижение среднего сывороточного тестостерона после возраста приблизительно 20-30 лет. Эти не подвергнутые лечению дефициты тестостерона у более старых мужчин могут приводить к различным физиологическим изменениям. Нетто-результатом является гериатрический гипогонадизм или то, что называют «мужской менопаузой». Как обсуждалось выше, пациенты с первичным гипогонадизмом имеют интактный путь ингибирования по механизму обратной связи, но яички не секретируют тестостерон. В результате увеличение сывороточных уровней тестостерона должно приводить к уменьшению концентраций сывороточного FSH. В этом примере идентифицировали всего 94 пациента, имеющих первичный гипогонадизм. Для этих пациентов средние концентрации FSH в трех группах обработки в день 0 были 21-26 мМЕ/мл, т.е. выше верхней границы нормального диапазона. Как показано на фигуре № 8(a) и в таблице 19(a), средние концентрации FSH уменьшались во время обработки во всех трех схемах обработки. Однако только группа 10,0 г/день снижала средние концентрации до пределов нормального диапазона во время первых 90 дней обработки. Обработка группы 10,0 г/день AndroGel® требовала приблизительно 120 дней для достижения стационарного состояния. Средняя концентрация FSH у пациентов, применяющих 5,0 г/день AndroGel®, показала начальное снижение, которое завершалось на 30 день, и вторую фазу снижения в день 120, не прекращающуюся до конца обработки. Средние концентрации FSH в пациентах, получающих пластырь тестостерона, по-видимому, достигали стационарного состояния после 30 дней, но были значимо более высокими, чем нормальный диапазон. Табл. 19(a). Концентрации FSH (мМЕ/л) в каждый из дней наблюдений в группе начальной обработки для пациентов, имеющих первичный гипогонадизм (Среднее ± SD) Пациенты с вторичным гипогонадизмом имеют дефектную тестостероновую отрицательную систему обратной связи. Как показано на фигуре № 8(b), в 44 пациентах, идентифицированных как имеющие вторичный гипогонадизм, средние концентрации FSH снижались во время обработки, хотя это снижение на протяжении времени не было значимым для пластыря тестостерона. Пациенты в группе 5,0 г/день AndroGel® обнаруживали снижение средней концентрации FSH на, приблизительно, 35% в день 30, без дополнительного снижения, наблюдаемого на 60 день. После дня 90 средняя концентрация FSH в этих пациентах, по-видимому, медленно возвращается к величине, наблюдаемой перед обработкой. В день 30 все пациенты группы 10,0 г AndroGel® имели концентрации FSH, меньшие, чем нижняя граница нормального диапазона. Таблица 19(b). Концентрации FSH (мМЕ/л) в каждый из дней наблюдений в группе начальной обработки для пациентов, имеющих вторичный гипогонадизм (Среднее ± SD) Двадцать пять пациентов были диагностированы как имеющие ассоциированный с возрастом гипогонадизм. Как показано на фигуре № 8(c), группа 5,0 г/день AndroGel® имела среднюю концентрацию FSH перед обработкой выше нормального диапазона. Средняя концентрация для этой группы была в пределах нормального диапазона в день 30 и снижалась более, чем на 50%, в дни 90 и 180. Снижение - 41 - 007431 средней концентрации FSH в группе 10,0 г/день AndroGel® показало более быструю реакцию. Концентрации у всех шести пациентов снижались до уровня, который был ниже нижней границы нормального уровня в день 30 и оставался таким на протяжении всего исследования. Шесть пациентов, которые получали пластырь тестостерона, не обнаружили согласующейся картины среднего уровня FSH; однако, была общая тенденция в направлении более низких уровней FSH при продолжающейся обработке. Таблица 19(c). Концентрации FSH (мМЕ/л) в каждый из дней наблюдений в группе начальной обработки для пациентов, имеющих связанный с возрастом гипогонадизм (Среднее ± SD) Шестьдесят четыре пациента в данном исследовании страдали от неклассифицированного гипогонадизма. Как показано на фиг. 8(d), эти пациенты обнаружили заметное и сравнительно быстрое снижение концентрации FSH во всех трех группах, причем наибольшее снижение было в группе 10,0 г/день AndroGel®. Группа 10,0 г/день AndroGel® давала почти 90%-ное уменьшение средней концентрации FSH в день 30 и сохраняла этот эффект до дня 180. Группа 5,0 г/день AndroGel® давала приблизительно 75%-ное падение средней концентрации FSH в день 30 и оставалась на этом уровне в течение остальной обработки. 21 пациент, получающий пластырь тестостерона, имел 50%-ное уменьшение средней концентрации FSH в день 30, и эта тенденция продолжалась до дня 90, когда эта концентрация составляла приблизительно одну треть от величины перед обработкой. Таблица 19(d). Концентрации FSH (мМЕ/л) в каждый из дней наблюдений в группе начальной обработки для пациентов, имеющих гипогонадизм неизвестного происхождения (Среднее ± SD) Эти данные показывают, что ингибирование по механизму обратной связи секреции FSH до некоторой степени функционировало во всех трех субпопуляциях. Первичная гипогонадотропная популяция обнаружила зависимость от дозы как в степени, так и в скорости снижения уровней FSH. Чувствительность процесса механизма обратной связи, по-видимому, была пониженной во вторичной и связанной с возрастом группах, так как только наивысшие дозы тестостерона имели значимое и пролонгированное действие на секрецию FSH. В противоположность этому, путь ингибирования по типу обратной связи в пациентах неклассифицированной группы был вполне реагирующим даже при самой низкой дозе экзогенного тестостерона. LH Реакцию LH на тестостерон также исследовали раздельно для тех же самых четырех субпопуляций. Таблица 20(a)-(d) показывает концентрации LH на протяжении всего периода обработки. Как показано на фиг. 9(a) и в таблице 20(a), концентрации LH перед обработкой составляли приблизительно 175% верхней границы нормального диапазона у первичных гипогонадотропных пациентов. Средние концентрации LH уменьшались во время обработки во всех группах. Однако только в группах AndroGel® снижались средние концентрации LH достаточно, чтобы находиться в пределах нормального - 42 - 007431 диапазона. Как и в случае FSH, мужчины с первичным гипогонадизмом, получавшие AndroGel®, обнаруживали зависимость от дозы как скорости, так и степени LH-реакции. Таблица 20(a). Концентрации LH (мМЕ/л) в каждый из дней наблюдений для пациентов, имеющих первичный гипогонадизм (Суммирование средних ± SD) Мужчины с вторичным гипогонадизмом были менее чувствительными к экзогенному тестостерону. Для 44 пациентов, идентифицированных как имеющие вторичный гипогонадизм, средние концентрации перед обработкой были все в пределах нижней границы нормального диапазона. Средние концентрации LH уменьшались во время обработки при всех трех схемах обработки, как показано на фиг. 9(b) и в таблице 20(b). Таблица 20(b). Концентрации LH (мМЕ/л) в каждый из дней наблюдений для пациентов, имеющих вторичный гипогонадизм (Суммирование средних ± SD) Ни один из 25 пациентов, страдающих от связанного с возрастом гипогонадизма, не имел концентраций LH перед обработкой вне нормального диапазона, как показано на фигуре № 9(c) и в таблице 20(c). Общие эффекты времени и обработки были значимыми для пациентов группы AndroGel®, но не для пациентов, использующих пластырь тестостерона. Таблица 20(c). Концентрации LH (мМЕ/л) в каждый из дней наблюдений для пациентов, имеющих связанный с возрастом гипогонадизм (Суммирование средних ± SD) Из 64 пациентов, страдающих от неклассифицированного гипогонадизма, ни один из пациентов не имел концентрации LH перед обработкой выше верхней границы. Однако пятнадцать процентов имели - 43 - 007431 концентрации перед обработкой выше нормального диапазона. Неклассифицированные пациенты обнаружили сравнительно быстрые снижения во всех группах обработки, как показано на фигуре № 9(d) и в таблице 20(d). Таблица 20(d). Концентрации LH (мМЕ/л) в каждый из дней наблюдений для пациентов, имеющих гипогонадизм неизвестного происхождения (Суммирование средних ±SD) Резюме: LH и FSH. Пациенты, получающие AndroGel® или пластырь тестостерона, достигали «гормонального стационарного состояния» только после долгосрочной обработки. В частности, данные, относящиеся к FSH и LH, показывают, что эти гормоны не достигают стационарного состояния, пока не пройдут многие недели после обработки. Поскольку FSH и LH негативно ингибируют концентрации тестостерона, уровни тестостерона действительно не достигают истинного стационарного состояния, пока эти другие гормоны также не достигнут стационарного состояния. Однако, поскольку эти гормоны регулируют только эндогенный тестостерон (который очень низок у гипогонадных мужчин) по интактному механизму обратной связи (который может не присутствовать в зависимости от причины гипогонадизма), уровень FSH и/или LH может оказывать малое действие на фактические достигаемые уровни тестостерона. Итоговый результат заключается в том, что эти пациенты не достигают «гормонального стационарного состояния» в отношении тестостерона, даже хотя Cavg, Cmin и Cmax для тестостерона остаются относительно постоянными после нескольких дней обработки. Либидо и сексуальная активность Либидо и сексуальную функцию оценивали с использованием опросников (анкет) пациентов, отвечающих ежедневно в течение семи последовательных дней перед визитом в клинику в день 0 и в дни 30, 60, 90, 120, 150 и 180 во время нанесения геля и пластыря. Субъекты регистрировали, имели ли они сексуальные дневные фантазии, антиципацию (предвосхищение) секса, флирт, сексуальную интеракцию (например, параметры сексуальной мотивации) и оргазм, эрекцию, мастурбацию, эякуляцию, коитус (например, параметры сексуальной активности) в каждый из этих семи дней. Величина регистрировалась как 0 (отсутствие) или 1 (наличие какого-либо параметра) для анализов, и количество дней отмеченного субъектами параметра суммировали для этого семидневного периода. Среднее четырех параметров сексуальной мотивации принимали в качестве средней оценки сексуальной мотивации, а среднее пяти параметров сексуальной активности принимали в качестве средней оценки сексуальной активности (0-7). Эти субъекты оценивали также их уровень сексуального влечения, сексуального наслаждения и удовлетворения эрекции при помощи 7-балльной шкалы типа шкалы Ликерта (0-7), а процент полной эрекции 0-100%. Субъекты оценивали их настроение с использованием шкалы 0-7. Рассчитывали средние недельные баллы. Подробности этого опросника были описаны ранее и полностью включены в качестве ссылки. См. Wang et al., Testosterone Replacement Therapy Improves Mood in Hypogonadal Men - A Clinical Research Center Study, 81 J. Clinical Endocrinology & Metabolism 3578-3583 (1996). Либидо Как показано на фиг. 10(a) при базовой линии сексуальная мотивация была одинаковой во всех группах обработки. После трансдермальной обработки тестостероном общая сексуальная мотивация обнаружила значимое улучшение. Однако изменение в итоговом балле от базовой линии не различалось среди этих трех групп. Либидо также оценивали из реакций по линейной шкале: (1) общего сексуального влечения, (2) наслаждения сексуальной активности без партнера и (3) наслаждения сексуальной активности с партнером. Как показано на фиг. 10(b) и в табл. 21, в целом для групп, общее сексуальное влечение увеличивалось после трансдермальной обработки тестостероном без различий между группами. Сексуальное наслаждение с партнером и без партнера (фиг. 10(c) и табл. 22 и 23) также увеличивалось в целом для всех групп. - 44 - 007431 Таблица 21. Изменения общего сексуального влечения от дня 0 до дня 180 в начальной группе обработки (Среднее ± SD) Таблица 22. Изменения уровня сексуального наслаждения без партнера от дня 0 до дня 180 в начальной группе обработки (Среднее ± SD) Таблица 23. Изменения уровня сексуального наслаждения с партнером от дня 0 до дня 180 в начальной группе обработки (Среднее ± SD) Сексуальная активность Фиг. 11(a) показывает, что, в то время как все группы обработки имели одинаковую оценку сексуальной активности при базовой линии, оценка улучшалась обработкой трансдермальным тестостероном во всех группах. Кроме того, в целом для групп, самооценка удовлетворения эрекции субъектов (фиг. 11(b) и табл. 24) и процент полной эрекции (фиг. 11(c) и табл. 25) также увеличивались пополнением тестостерона без значимых различий между группами. Это улучшение сексуальной функции не было связано с дозой или способом доставки тестостерона. Улучшение не было также связано с уровнями сывороточного тестостерона, достигаемыми посредством различных препаратов тестостерона. Эти результаты предполагают, что после достижения порога (уровня сывороточного тестостерона, возможно, нижней границы нормального диапазона), происходит нормализация сексуальной функции. Увеличение уровней сывороточного тестостерона выше верхней границы нормального диапазона не улучшает дополнительно сексуальную мотивацию или активность. Таблица 24. Изменение удовлетворения продолжительностью эрекции от дня 0 до дня 180 в начальной группе обработки (Среднее ± SD) - 45 - 007431 Таблица 25. Изменение процента полной эрекции от дня 0 до дня 180 в начальной группе обработки (Среднее ± SD) Пример 6. Способ увеличения либидо у эугонадотропных (нормогонадотропных) мужчин, имеющих пониженное либидо. Как обсуждалось выше, трансдермальное введение тестостерона с использованием AndroGel® гипогонадотропным мужчинам приводит к улучшенному либидо и сексуальной активности. Исследователи обнаружили, что эугонадотропные (т.е. нормогонадотропные) мужчины, имеющие пониженное либидо, имеют значимое увеличение сексуального интереса после получения инъекций тестостерона. См. О'Carrol & Bancroft, Testosterone Therapy for Low Sexual Interest and erectile Dysfunction in Men: A Controlled Study, Brit. J. Psychiarty 145:146-151 (1984). Таким образом, данный пример относится к способу лечения пониженного либидо у эугонадотропных мужчин трансдермальным применением водноспиртового геля тестостерона к таким мужчинам. В одном варианте AndroGel® наносят на тело в соответствии с протоколом, суммированным в примере 1. Либидо измеряют, как в примере 1. Мужчины, получающие AndroGel®, обнаруживают увеличение их либидо. Пример 7. Способ увеличения либидо у эугонадотропных мужчин, имеющих нормальное либидо. Как обсуждалось выше, трансдермальное нанесение тестостерона с использованием AndroGel® гипогонадотропным мужчинам приводит к улучшенному либидо и улучшенной сексуальной активности. Исследования показали, что надфизиологические дозы тестостерона, вводимые эугонадотропным мужчинам, имеющим нормальное либидо, приводили к значимому увеличению либидо. См. Anderson et al., The effect of Exogenous Testosterone on Sexuality and Mood of Normal Men, J. Clinical Endocrinology & Metabolism 75:1505-1507 (1992); Bagatel et al., Metabolic & Behavioral Effects of High-Dose, Exogenous Testosterone in Healthy Men, J. Clinical Metabolism & Endocrinology 79:561-567 (1994). Таким образом, этот пример относится к способу увеличения либидо нормальных эугонадотропных мужчин нанесением трансдермального водно-спиртового геля тестостерона. В одном варианте осуществления AndroGel® наносят на тело в соответствии с протоколом, суммированным в примере 1. Либидо измеряют, как в примере 1. Мужчины, получающие AndroGel®, обнаруживают увеличение их либидо. Пример 8. Способ улучшения сексуальной активности у эугонадотропных мужчин, имеющих эректильную дисфункцию. В примере, 10 эугонадотропных мужчин в возрасте 18 лет и старше, имеющих эректильную дисфункцию, рандомизируют для получения (а) 5,0 г/день AndroGel® (доставляющих 50 мг/день тестостерона на кожу, из которых абсорбируется приблизительно 10% или 5 мг) в течение 30 дней или (b) 10,0 г/день AndroGel® (доставляющих 100 мг/день тестостерона на кожу, из которых абсорбируется приблизительно 10% или 10 мг) в течение 30 дней или (с) ничего. Эффективность AndroGel® в улучшении сексуальной активности и лечении эректильной дисфункции оценивают с использованием нескольких инструментов оценки. Первичной мерой является опросник в отношении сексуальной функции, Международный Каталог эректильной функции (IIEF). Два из вопросов из IIEF служат в качестве первичных конечных точек исследования; ясные (недвусмысленные) ответы должны быть получены о (1) способности достигать эрекций, достаточных для сексуального коитуса, и (2) сохранении эрекций после проникновения внутрь. Возможными ясными ответами на эти вопросы будут ответы (0) отсутствие попыток коитуса, (1) никогда или почти никогда, 2) несколько раз, (3) иногда, (4) в большинстве раз и (5) почти всегда или всегда. Собираемой также в качестве части IIEF является информация о других аспектах сексуальной функции, в том числе информация об эректильной функции, оргазме, влечении, удовлетворении коитусом и общем сексуальном удовлетворении. Информация о сексуальной функции также регистрируется пациентами в ежедневном дневнике. Кроме того, пациентам задается вопрос о глобальной эффективности и был введен необязательный опросник партнера. Кроме того, улучшение в эректильной дисфункции оценивается с использованием объективного измерения устойчивости и продолжительности эрекций (RigScan®) при сравнении AndroGel® с плацебо. Пример 9. Способ улучшения сексуальной активности у эугонадотропных мужчин, имеющих нормальные эрекции. В примере 10 эугонадотропных мужчин в возрасте 18 лет и старше, имеющих нормальные эрекции (т.е. не диагностированных как имеющие эректильную дисфункцию), рандомизируют для получения (а) - 46 - 007431 5,0 г/день AndroGel® (доставляющих 50 мг/день тестостерона на кожу, из которых абсорбируется приблизительно 10% или 5 мг) в течение 30 дней или (b) 10,0 г/день AndroGel® (доставляющих 100 мг/день тестостерона на кожу, из которых абсорбируется приблизительно 10% или 10 мг) в течение 30 дней или (с) ничего. Эффективность AndroGel® оцениваются с использованием нескольких инструментов оценки, как обсуждается в примере 4. Заявитель ожидает, что все тест-параметры будут обнаруживать увеличение интереса к сексуальной активности в сравнении с плацебо. Таким образом, заявитель ожидает, что AndroGel® может быть применен к нормальным мужчинам для увеличения сексуальной активности в сравнении с базовой линией (фоном). Пример 10. Лечение гипогонадизма у субъектов-мужчин. Один вариант данного изобретения включает в себя трансдермальное нанесение AndroGel® в качестве способа лечения мужского гипогонадизма. Как показано ниже, нанесение этого геля приводит к уникальному фармакокинетическому профилю тестостерона, а также одновременной модуляции нескольких других половых гормонов. Нанесение этого геля тестостерона на гипогонадотропных субъектов-мужчин приводит также к: (1) увеличенной минеральной плотности костей, (2) повышенному либидо, (3) повышенной эректильной способности и повышенному удовлетворению, (4) повышенному позитивному настроению, (5) увеличенной мышечной силе и (6) лучшему состоянию тела, т.е. увеличенной не содержащей жира массе тела и уменьшенной общей массе жира тела. Кроме того, этот гель не вызывает значимого раздражения кожи. Способы В этом примере набирали гипогонадотропных мужчин-добровольцев в 16 центрах в Соединенных Штатах и исследовали их. Эти пациенты имели возраст 19-68 лет и имели утренние уровни сывороточного тестостерона при скрининге, меньшие или равные 300 нг/дл (10,4 нмоль/л). Всего было зарегистрировано 227 пациентов, которых делили на 3 группы из: 73, 78 и 76 пациентов для получения 5,0 г/день AndroGel® (доставляющих 50 мг/день тестостерона на кожу, из которых абсорбируется приблизительно 10% или 5 мг), 10,0 г/день AndroGel® (доставляющих 100 мг/день тестостерона на кожу, из которых абсорбируется приблизительно 10% или 10 мг), и тестостеронового пластыря ANDRODERM® ("Тпластыря"; доставляющего 50 мг/день тестостерона), соответственно. Как показано в табл. 26, не было значимых, ассоциированных с какой-либо группой различий характеристик пациентов при базовой линии (фоне). Таблица 26. Характеристики базовой линии (фона) гипогонадотропных мужчин - 47 - 007431 Сорок один процент (93/227) субъектов не получали перед этим тестостероновую заместительную терапию. Ранее лечившиеся гипогонадотропные мужчины прекратили инъекции эфира тестостерона в течение по меньшей мере шести недель и прием пероральных или трансдермальных андрогенов в течение четырех недель перед началом скрининга. Не считая гипогонадизма, эти субъекты имели хорошее здоровье, что доказывается картой больного, физическим обследованием, полной формулой крови, анализом мочи и биохимией сыворотки. Если субъекты принимали понижающие липиды агенты или транквилизаторы, эти дозы были стабилизированы в течение, по меньшей мере, трех месяцев перед занесением в список для исследования. Менее 5% субъектов принимали дополнительно кальций или витамин D во время исследования. Эти субъекты не имели истории хронического медицинского заболевания, злоупотребления алкоголем или лекарственным средством. Они имели нормальные результаты ректального обследования, уровень PSA менее 4 нг/мл и скорость тока мочи 12 мл/с или более. Пациентов исключали, если они имели генерализованное кожное заболевание, которое могло подействовать на абсорбцию тестостерона, или предыдущую историю раздражимости кожи пластырем ANDRODERM®. Субъекты, имеющие массу менее, чем 80%, или более 140% их идеальной массы тела, также исключались из исследования. Это рандомизированное, многоцентровое, параллельное исследование сравнивало две дозы AndroGel® с тестостероновым пластырем ANDRODERM®. Это исследование было двойным слепым в отношении дозы AndroGel® и открытым в отношении группы с пластырем тестостерона. В течение первых трех месяцев исследования (дни 1-90) субъектов рандомизировали для получения 5,0 г/день AndroGel®, 10,0 г/день AndroGel® или два нескротальных пластыря. В течение следующих трех месяцев (дни 91180) субъектов подвергали одной из следующих обработок: 5,0 г/день AndroGel®, 10,0 г/день AndroGel®, 7,5 г/день AndroGel® или два не-скротальных пластыря. Пациенты, которые применяли AndroGel®, имели единственное определение сывороточного тестостерона перед нанесением, измеренное в день 60, и, если эти уровни были в нормальном диапазоне 300-1000 нг/дл (10,4-34,7 нмоль/л), то они оставались на их начальной дозе. Пациенты с уровнями тестостерона, меньшими, чем 300 нг/дл, которые были изначально приписаны к группе для получения 5,0 г/день AndroGel®, и пациенты с уровнями тестостерона, большими, чем 1000 нг/дл, которые получали 10,0 г/день AndroGel®, переводились в группы для получения 7,5 г/день AndroGel® в течение дней 91-180. Таким образом, на 90 день проводили коррекции доз в группах AndroGel® на основе уровней сывороточного тестостерона перед нанесением в день 60. Двадцать субъектов в группе с 5,0 г/день AndroGel® имели дозу, увеличенную до 7,5 г/день. Двадцать пациентов в группе с 10,0 г/день имели дозу, уменьшенную до 7,5 мг/день. Были три пациента в группе с пластырем тестостерона, которых переводили на 5,0 г/день AndroGel® вследствие непереносимости пластыря. Один субъект группы 10,0 г/день AndroGel® был приписан к группе для получения 5,0 г/день, и один субъект группы 5 г/день AndroGel® был переведен на дозу, скорректированную для получения 2,5 г/день. Таким образом, количество субъектов, внесенных в списки исследования в дни 91-180, состояло из 51, получающего 5,0 г/день AndroGel®, 40 получающих 7,5 г/день AndroGel®, 52 получающих 10,0 г/день AndroGel® и 52, продолжающих применять пластырь ANDRODERM®. Таким образом, группы обработки (лечения) в этом примере могут характеризоваться двумя путями, либо "начальная", либо "конечная" группа лечения. Субъекты возвращались в центр исследования в дни 0, 30, 60, 90, 120 и 180 для клинического обследования, оценки раздражения кожи и оценки вредного действия. Пробы крови на кальций, неорганический фосфор, паратиреоидный гормон (РТН), остеокальцин, проколлаген типа I и специфическую скелетную щелочную фосфатазу (SALP) брали натощак в дни 0, 30, 90, 120 и 180. Кроме того, сбор мочи после двух часов голодания для анализа на креатинин мочи, кальций и перекрестно-связанные с коллагеном типа 1 N-телопептиды (N-телопептиды) проводили в дни 0, 30, 90, 120 и 180. Выполняли также следующие другие тесты: (1) Гематология: гемоглобин, гематокрит, количество эритроцитов, тромбоциты, лейкоцитарная формула с дифференциальным анализом (нейтрофилы, лимфоциты, моноциты, эозинофилы и базофилы); (2) Химия: щелочная фосфатаза, аланинтрансфераза, сывороточная трансаминаза глутаминовойпировиноградной кислоты (ALT/SGPT), аспартатаминотрансфераза/сывороточная трансаминаза глута- 48 - 007431 мина/щавелевоуксусной кислоты (ACT/SGOT), общий билирубин, креатинин, глюкоза и электролиты (натрий, калий, хлорид, бикарбонат, кальций и неорганический фосфор); (3) Липиды: общий холестерин, липопротеин высокой плотности (HDL), липопротеин низкой плотности (LDL) и триглицериды; (4) Анализ мочи: цвет, вид, удельный вес, рН, белок, глюкоза, кетоны, кровь, билирубин и нитриты; и (5) Другие: PSA (дни скрининга 90-180), пролактин (скрининг) и тестостерон (скрининг), в том числе электролиты, глюкоза, тесты на функцию почек и печени и профиль липидов проводили при всех визитах в клинику. Минеральную плотность костей (BMD) анализировали в день 0 и день 180. A. AndroGel® и пластырь ANDRODERM®. Приблизительно 250 г AndroGel® упаковывали в многоразовые стеклянные флаконы, которые доставляли 2,25 г этого геля при каждом приведении в действие (запуске) этого насоса. Пациентам, приписанным к группе получения 5,0 г/день тестостерона AndroGel®, давали один флакон AndroGel® и один флакон плацебо (содержащий носитель, но не содержащий тестостерон), тогда как пациентам, приписанным к группе для получения 10,0 г/день AndroGel®, давали по два флакона активного AndroGel®. Затем пациентов инструктировали в отношении нанесения содержимого этих флаконов на правом и левом плечах/плечевых суставах и на правой и левой сторонах живота чередующимся образом. Например, в первый день исследования пациенты наносили два запуска из одного флакона, по одному на левое и правое плечо/плечевой сустав, и два запуска из второго флакона, по одному на левую и правую стороны живота. На следующий день лечения эти нанесения были обратными. Чередующиеся места нанесения продолжали использовать во всем этом исследовании. После нанесения геля на кожу гель сушили в пределах нескольких минут. Пациенты тщательно мыли их руки с мылом и водой сразу же после нанесения геля. Группа 7,5 г/день AndroGel® получала дозу открытым образом. Спустя 90 дней для субъектов, которым дозу уменьшали до 7,5 г/день AndroGel®, пациентам давали три флакона, один из которых содержал плацебо, а два другие AndroGel®. Этих субъектов инструктировали для нанесения одного запуска из флакона плацебо и трех запусков из флакона AndroGel® в четыре различных места тела, как описано выше. Эти места чередовали каждый день с использованием той же самой последовательности действий, какая описана выше. Пластыри тестостерона ANDRODERM®, каждый из которых доставлял 2,5 мг/день тестостерона, предоставляли приблизительно одной трети пациентов в данном исследовании. Этих пациентов инструктировали для нанесения двух пластырей тестостерона на чистую сухую кожу на спине, животе, плечах или бедрах один раз в день. Места нанесения чередовали с приблизительно семидневным интервалом между нанесениями в то же самое место. В дни исследований, когда пациентов оценивали, гели/пластыри наносили после предварительных оценок доз. В остальные дни гель или пластыри тестостерона наносили приблизительно в 8:00 часов до полудня в течение 180 дней. Способ и результаты исследования Фармакокинетика гормонов В дни 0, 1, 30, 90 и 180 пациенты сдавали множественные пробы крови для измерений тестостерона и свободного тестостерона за 30, 15 и 0 минут перед нанесением AndroGel® или пластыря и через 2, 4, 8, 12, 16 и 24 ч после нанесения AndroGel® и пластыря. Кроме того, субъекты возвращались в дни 60, 120 и 150 для взятия единственной пробы крови перед нанесением геля или пластыря. DHT, E2, FSH, LH и SHBG в сыворотке измеряли в пробах, собранных перед нанесением геля в дни 0, 30, 60, 90, 120, 150 и 180. Сыворотки для всех гормонов хранили в замороженном виде при -20°С до анализа. Все пробы пациента на каждый гормон измеряли в одном и том же анализе, когда это было возможно. Затем анализы на гормоны проводили в Лаборатории эндокринных исследований (Endocrine Research Laboratory) Медицинского центра UCLA-Harbor. Следующая таблица суммирует фармакокинетические параметры, которые измеряли для каждого пациента: Таблица 27. Фармакокинетические параметры - 49 - 007431 Фармакокинетики тестостерона Способы Уровни сывороточного тестостерона измеряли после экстракции этилацетатом и гексаном при помощи специфического радиоиммуноанализа (РИА) с использованием реагентов из ICN (Costa Mesa, CA). Перекрестные реактивности антисыворотки, используемой в РИА тестостерона, были равны 2,0% для DHT, 2,3% для андростандиона, 0,8% для 3-β-андростандиола, 0,6% для этиохоланолона и менее, чем 0,01%, для всех остальных тестируемых стероидов. Нижний предел количественного определения (LLQ) для сывороточного тестостерона, измеряемого при помощи этого анализа, был 25 нг/дл (0,87 нмоль/л). Средняя точность этого анализа тестостерона, определенная введением в не содержащую стероидов сыворотку варьирующихся количеств тестостерона (0,9 нмоль/л - 52 нмоль/л), была 104% и находилась в диапазоне 92%-117%. Коэффициенты вариации внутри анализа и между анализами этого анализа тестостерона были 7,3 и 11,1%, соответственно, в диапазоне нормального взрослого мужчины. У нормальных взрослых мужчин диапазон концентраций тестостерона был 298-1043 нг/дл (10,33-36,17 нмоль/л), как определено в медицинском центре UCLA-Harbor. Концентрация базовой линии (фона) Как показано в табл. 28(a) и (b) и на фиг. 12(a), на базовой линии (фоне) средние сывороточные концентрации на протяжении 24 ч (Cavg) были сходными во всех группах и ниже диапазона нормального человека. Кроме того, вариации сывороточной концентрации (на основе максимальных и минимальных концентраций во время 24-часового периода, Сmax и Cmin, соответственно) в течение дня были также сходными в этих трех группах. Фиг. 12(a) показывает, что средние уровни тестостерона имели максимальный уровень между 8 и 10 часами до полудня (т.е. при 0 и 2 ч) и минимальный уровень спустя 8-12 часов, что демонстрировало умеренную суточную вариацию сывороточного тестостерона. Приблизительно одна треть пациентов в каждой группе имела Cavg в пределах нижнего диапазона нормального взрослого мужчины в день 0 (24/73 для группы 0,5 г/день AndroGel®, 26/78 для группы 10,0 г/день AndroGel® и 25/76 для группы с тестостероновым пластырем). Все, за исключением трех субъектов, удовлетворяли критерию сывороточного тестостерона, требуемому для включения в исследование, т.е. менее, чем 300 нг/дл (10,4 нмоль/л) при поступлении. Таблица 28(a). Фармакокинетические параметры базовой линии (фона) в начальной группе обработки (Среднее ± SD) * Медиана (диапазон) Таблица 28(b): Фармакокинетические параметры тестостерона базовой линии (фона) в конечной группе обработки (Среднее ± SD) * Медиана (диапазон) - 50 - 007431 День 1. Фиг. 12(b) и табл. 28(c)-(d) показывают фармакокинетический профиль для всех трех начальных групп обработки после первого нанесения трансдермального тестостерона. Обычно обработка AndroGel® и пластырем тестостерона давала увеличение концентраций тестостерона, достаточно большое, чтобы привести пациентов в нормальный диапазон за всего лишь несколько часов. Однако даже в день 1 фармакокинетические профили заметно отличались в группах AndroGel® и группе с пластырем. Сывороточный тестостерон увеличивался наиболее быстро в группе с пластырем тестостерона, достигая максимальной концентрации (Сmax) на приблизительно 12 ч (Тmax). В противоположность этому, сывороточный тестостерон стойко увеличивался до нормального диапазона после нанесения AndroGel® с максимальными уровнями, достигаемыми на 22 и 16 час в группе с 5,0 г/день AndroGel® и группе 10,0 г/день AndroGel®, соответственно. Таблица 28(c). Фармакокинетические параметры тестостерона в день 1 в начальной группе обработки (Среднее + SD) * Медиана (диапазон) Таблица 28(d). Фармакокинетические параметры тестостерона в день 1 в конечной группе обработки (Среднее ± SD) * Медиана (диапазон) Дни 30, 90 и 180. Фиг. 12(c) и 12(d) показывают уникальный 24-часовой фармакокинетический профиль обработанных AndroGel® пациентов в дни 30 и 90. В группах AndroGel® сывороточные уровни тестостерона показали небольшие и вариабельные увеличения вскоре после введения доз. Затем эти уровни возвращались к относительно постоянному уровню. В противоположность этому, в группе с пластырем тестостерона пациенты обнаруживали увеличение на протяжении первых 8-12 ч, плато в течение следующих 8 ч и затем снижение до базовой линии (фона) предыдущего дня. Далее, после нанесения геля в оба дня 30 и 90 Cavg в группе 10,0 г/день была в 1,4 раза более высокой, чем в группе 5,0 г/день AndroGel®, и в 1,9 раз более высокой, чем в группе с пластырем тестостерона. Группа с пластырем тестостерона также имела Cmin по существу ниже нижнего предела нормального диапазона. В день 30 коэффициент накопления был 0,94 для группы с пластырем тестостерона, не обнаруживая накопления. Коэффициенты накопления при 1,54 и 1,9 были значимо более высокими в группе 5,0 г/день AndroGel® и в группе 10,0 г/день AndroGel®, соответственно. Различия в коэффициенте накопления среди этих групп сохранялись в день 90. Эти данные указывают на то, что препараты AndroGel® имели более длительные эффективные полупериоды существования в сыворотке, чем пластырь тестостерона. Фиг. 12(e) показывает 24-часовой фармакокинетический профиль этих групп обработки в день 180. В общем, как показывает таблица 28(e), достигаемые сывороточные концентрации тестостерона и фармакокинетические параметры были сходными с концентрациями тестостерона и фармакокинетическими параметрами в дни 30 и 90 у пациентов, которые продолжали находиться в их начальных рандомизированных группах обработки. Табл. 28(f) показывает, что пациенты, переведенные в группу 7,5 г/день AndroGel®, не были однородными. Пациенты, которые ранее находились в группе 10 г/день, имели тенденцию иметь более высокие сывороточные уровни тестостерона, чем пациенты, которые ранее получали 5,0 г/день. В день 180 Cavg у пациентов в группе 10,0 г/день, которые были переведены в группу 7,5 г/день в день 90, была равна 744 нг/дл, которая была в 1,7 раз более высокой, чем Cavg 450 нг/дл, у паци- 51 - 007431 ентов, которые были переведены в группу 7,5 г/день из группы 5 г/день. Несмотря на коррекцию дозы на 2,5 г/день в сторону повышения в группе 5,0 → 7,5 г/день Cavg оставалась более низкой, чем у пациентов, оставшихся в группе 5,0 г/день. В группе 10,0 → 7,5 г/день Cavg становилась сходной с Cavg, достигаемой у пациентов, оставшимися в группе 10,0 г/день без уменьшения дозы. Эти результаты предполагают, что многие, не дающие реакции пациенты могут быть фактически менее старательными пациентами. Например, если пациент не наносит AndroGel® правильно (например, преимущественно из контейнера с плацебо или незадолго перед принятием ванны), то увеличение дозы не даст никакой дополнительной пользы. Фиг. 12(f)-(h) сравнивают фармакокинетические профили для группы 5,0 г/день AndroGel®, группы 10,0 г/день AndroGel® и тестостеронового пластыря в дни 0, 1, 30, 90 и 180, соответственно. В общем, средние сывороточные уровни тестостерона в группе с тестостероновым пластырем оставались на нижнем пределе нормального диапазона на протяжении всего периода обработки. В противоположность этому, средние сывороточные уровни тестостерона оставались около 490-570 нг/дл для группы 5,0 г/день AndroGel® и приблизительно 630-860 нг/дл AndroGel® для группы 10,0 г/день. Таблица 28(e). Фармакокинетические параметры тестостерона в день 1 в начальной группе обработки (Среднее ± SD) * Медиана (диапазон) - 52 - 007431 Таблица 28(f). Фармакокинетические параметры тестостерона в дни 30, 90, 180 в конечной группе обработки (Среднее ± SD) * Медиана (диапазон) Пропорциональность доз для AndroGel® Таблица 28(g) показывает увеличение AUC0-24 в дни 30, 90 и 180 от базовой линии (фона) перед обработкой (нетто AUC0-24). Для оценки пропорциональности доз выполняли оценку биологической эквивалентности на log-преобразованных AUC с использованием «обработки» в качестве единственного фактора. Эти AUC сравнивали после вычитания вклада AUC из эндогенной секреции тестостерона (AUC в день 0) и коррекции на двухкратное различие в применяемых дозах. Отношение AUC в день 30 было 0,95 (90% C.I.: 0,75-1,19), а в день 90 оно было 0,92 (90% C.I.: 0,73-1,17). При объединении данных дня 30 и дня 90 отношение AUC было 0,93 (90% C.I.: 0,79-1,10). Эти данные показывают пропорциональность доз для обработки AndroGel®. Среднее геометрическое для увеличения AUC0-24 со дня 0 до дня 30 или дня 90 было в 2 раза большим для группы 10,0 г/день, чем для группы 5,0 г/день. Среднее увеличение 125 нг/дл уровня Cavg сывороточного тестостерона - 53 - 007431 получали на каждые 2,5 г/день AndroGel®. Другими словами, эти данные показывают, что доза 0,1 г/день AndroGel® давала в среднем увеличение на 5 нг/дл концентрации сывороточного тестостерона. Эта пропорциональность доз помогает врачу корректировать вводимые дозы. Поскольку AndroGel® продается в упаковках по 2,5 г (содержащих 25 мг тестостерона), каждая упаковка 2,5 г будет производить, в среднем, увеличение 125 нг/дл в Cavg-концентрации общего сывороточного тестостерона. Таблица 28(g). Нетто-AUC0-24 (нмоль*ч/л) в дни 30, 90 и 180 после трансдермального введения тестостерона Увеличения AUC0-24 от базовой линии (фона) перед обработкой, достигаемое группами 10,0 г/день и 5,0 г/день, были приблизительно в 2,7 раз и в 1,7 раз более высокими, чем увеличение при нанесении тестостеронового пластыря. Фармакокинетика концентрации свободного тестостерона в сыворотке Способы Свободный тестостерон в сыворотке измеряли при помощи РИА диализата после ночного равновесного диализа с использованием тех же самых реагентов РИА, которые использовали в анализе тестостерона. LLQ сывороточного свободного тестостерона с использованием способа равновесного диализа был оценен как 22 пмоль/л. При введении в не содержащую стероидов сыворотку увеличивающихся доз тестостерона в диапазоне взрослого мужчины увеличивающиеся количества свободного тестостерона извлекали с коэффициентом вариации в диапазоне 11,0-18,5%. Коэффициенты вариации свободного тестостерона внутри анализа и между анализами были 15% и 16,8% для величин взрослых нормальных мужчин, соответственно. Как определено в медицинском центре UCLA-Harbor, диапазон концентраций свободного тестостерон у нормальных взрослых мужчин был 3,48-17,9 нг/дл (121-620 пмоль/л). Фармакокинетические результаты В общем, как показано в табл. 29, фармакокинетические параметры сывороточного свободного тестостерона отражали фармакокинетические параметры сывороточного общего тестостерона, описанные выше. При базовой линии (день 0) средние концентрации сывороточного свободного тестостерона (Cavg) были сходными во всех трех группах, которые находились на нижнем пределе диапазона взрослых мужчин. Максимальная сывороточная концентрация свободного тестостерона имела место между 8 и 10 часами до полудня, а минимальная спустя 8-16 часов. Эти данные согласуется с умеренной суточной вариацией сывороточного тестостерона. Фиг. 13(a) показывает 24-часовые фармакокинетические профили для трех групп обработки в день 1. После нанесения пластыря тестостерона уровни сывороточного свободного тестостерона достигали максимума через 12 ч, приблизительно на 4 часа раньше, чем максимальные уровни, достигаемые группами AndroGel®. Затем сывороточные уровни свободного тестостерона снижались в группе с пластырем тестостерона, тогда как в группах AndroGel® сывороточные уровни свободного тестостерона продолжали повышаться. Фиг. 13(b) и 13(c) показывают фармакокинетические профили свободного тестостерона в Androgel®-обработанных группах, сходные с уникальными профилями тестостерона в дни 30 и 90. После нанесения AndroGel® средние сывороточные уровни свободного тестостерона в этих трех группах были в пределах нормального диапазона. Подобно результатам для общего тестостерона, Cavg свободного тестостерона, достигаемая группой 10,0 г/день, была в 1,4 раза более высокой, чем в группе 5,0 г/день, и в 1,7 раз более высокой, чем в группе с пластырем тестостерона. Кроме того, коэффициент накопления для пластыря тестостерона был значимо более низким, чем коэффициент накопления группы 5,0 г/день и группы 10,0 г/день. Фиг. 13(d) показывает концентрации свободного тестостерона конечных групп обработки в день 180. В общем, концентрации свободного тестостерона обнаруживали сходную картину с картиной концентраций сывороточного тестостерона. 24-часовые фармакокинетические параметры были сходны с фармакокинетическими параметрами в дни 30 и 90 у тех субъектов, которые оставались в трех исходных рандомизированных группах. Опять в случае субъектов, переведенных на 7,5 г/день AndroGel®, эта группа была неоднородной. Cavg свободного тестостерона у пациентов с дозами, измененными с 5,0 на 7,5 г/день оставалась на 29% более низкой, чем Cavg у субъектов, оставшихся в группе 5,0 г/день. Cavg свободного тестостерона у пациентов с дозами, уменьшенными с 10,0 до 7,5 г/день, была на 11% более высокой, чем у оставшихся пациентов в группе 10,0 г/день. Фиг. 13(e)-(g) показывают концентрации свободного тестостерона в трех группах субъектов на протяжении всего 180-дневного периода обработки. Опять уровни свободного тестостерона согласовались с уровнями тестостерона. Средние уровни свободного тестостерона во всех трех группах находились в - 54 - 007431 нормальном диапазоне, причем группа 10,0 г/день сохраняла более высокие уровни свободного тестостерона, чем группа 5,0 г/день и группа с пластырем тестостерона. Табл. 9. Фармакокинетические параметры свободного тестостерона в группе конечной обработки (Среднее ± SD) * Медиана (диапазон) - 55 - 007431 Концентрации сывороточного DHT Сывороточный DHT измеряли при помощи РИА после обработки перманганатом калия пробы после экстракции. Способ и реагенты для анализа DHT были обеспечены DSL (Webster, TX). Перекрестные реактивности антисыворотки, используемой в РИА для DHT, были равны 6,5% для 3-β-андростандиола, 1,2% для 3-α-андростандиола, 0,4% для глюкуронида 3-α-андростандиола и 0,4% для тестостерона (после обработки перманганатом калия и экстракции) и менее, чем 0,01% для других испытанных стероидов. Эта низкая перекрестная реактивность против тестостерона дополнительно подтверждалась введением в не содержащую стероидов сыворотку 35 нмоль/л (1000 пг/дл) тестостерона и взятием проб с использованием анализа DHT. Результаты даже при введении более 35 нмоль тестостерона при измерении дали менее, чем 0,1 нмоль/л DHT. LLQ сывороточного DHT в этом анализе был равен 0,43 нмоль/л. Средняя точность (выход) этого анализа DHT, определенная введением в не содержащую стероидов сыворотку варьирующихся количеств DHT от 0,43 нмоль/л до 9 нмоль/л, была 101% и находилась в диапазоне 83%-114%. Коэффициенты вариации внутри анализа и между анализами этого анализа DHT были 7,8 и 16,6%, соответственно, для диапазона нормального взрослого мужчины. У нормальных взрослых мужчин диапазон концентраций DHT был 30,7-193,2 нг/дл (1,06-6,66 нмоль/л), как определено в медицинском центре UCLA-Harbor. Как показано в табл. 30, средние концентрации сывороточного DHT перед обработкой были между 36 и 42 нг/дл, которые были близкими к нижней границе нормального диапазона во всех трех начальных группах обработки. Ни один из пациентов не имел концентрации DHT, более высокие, чем верхняя граница нормального диапазона в день перед обработкой, хотя почти половина (103 пациента) имели концентрации, более низкие, чем нижняя граница. Фиг. № 14 показывает, что после обработки различия между средними концентрациями DHT, ассоциированными с различными группами обработки, были статистически значимыми, причем пациенты, получающие AndroGel®, имели более высокую среднюю концентрацию DHT, чем пациенты, использующие пластырь, и обнаруживали дозовую зависимость средних концентраций сывороточного DHT. Конкретно, после нанесения пластыря тестостерона средние уровни сывороточного DHT повышались до приблизительно 1,3-кратного уровня выше базовой линии. В противоположность этому, сывороточный DHT увеличивался в 3,6 и 4,8 раза над базовой линией после нанесения 5,0 г/день и 10,0 г/день AndroGel®, соответственно. Таблица 30. Концентрации DHT (нг/дл) в каждый из дней наблюдения в группе начальной обработки (Среднее ± SD) Увеличение концентраций DHT связано, вероятно, с концентрацией и местоположением 5αредуктазы в коже. Например, большие количества 5α-редуктазы в скротальной коже предположительно вызывает увеличение концентраций DHT в пластыре TESTODERM®. В противоположность этому, пластыри ANDRODERM® и TESTODERM TTS ® дают небольшое изменение в уровнях DHT, так как площадь поверхности этого пластыря является маленькой и низкое количество 5α-редуктазы локализовано в не-скротальной коже. Предположительно, AndroGel® вызывает увеличение уровней DHT, так как этот гель наносят на относительно большую площадь кожи и, следовательно, экспонируют тестостерон большим количествам этого фермента. До настоящего времени не было сообщений о том, что повышенные уровни DHT имеют какие-либо вредные побочные клинические эффекты. Кроме того, существуют доказательства, позволяющие предполагать, что увеличенные уровни DHT могут ингибировать рак предстательной железы. Отношение DHT/T Медицинский центр UCLA-Harbor сообщает отношение DHT/T 0,052-0,328 для нормальных взрослых мужчин. В этом примере средние отношения для всех трех обработок находились в пределах нормального диапазона в день 0. Как показано на фиг. 15 и в табл. 31, имелись зависимые от обработки и от концентрации увеличения, наблюдаемые на протяжении 180-дневного периода. В частности, группы обработки AndroGel® показали наивысшее увеличение отношения DHT/T. Однако средние отношения для всех этих групп обработки оставались в пределах нормального диапазона во все дни наблюдения. - 56 - 007431 Таблица 31. Отношение DHT/T в каждый из дней наблюдения в группе начальной обработки (Среднее ± SD) Общий андроген (DHT + Т) Медицинский центр UCLA-Harbor определил, что нормальная концентрация общих андрогенов равна 372-1350 нг/дл. Как показано на фигуре № 16 и в таблице 32, средние концентрации общих андрогенов перед введением для всех трех групп обработки были ниже нижней границы нормального диапазона в день 0 перед обработкой. Концентрации общих андрогенов для обеих групп AndroGel® были в пределах нормального диапазона во все дни наблюдения при всех обработках. В противоположность этому, средние концентрации у пациентов, получающих пластырь тестостерона, едва находились в пределах нормального диапазона в день 60 и 120, но были ниже нижней границы нормального диапазона в дни 30, 90, 150 и 180. Таблица 32. Общий андроген (DHT + T) (нг/дл) в каждый из дней наблюдения в группе начальной обработки Концентрации Е2 Сывороточные уровни Е2 измеряли прямым анализом без экстракции реагентами из ICN (Costa Mesa, CA). Коэффициенты вариации Е2 внутри анализа и между анализами были 6,5 и 7,1%, соответственно. Медицинский центр UCLA-Harbor сообщил диапазон средних концентраций Е2 от 7,1 до 46,1 пг/мл (63-169 пмоль/л) для нормального диапазона взрослых мужчин. LLQ Е2 был 18 пмоль/л. Перекрестные реактивности антитела против Е2 были 6,9% для эстрона, 0,4% для эквиленина и менее, чем 0,01%), для всех других испытанных стероидов. Точность анализа Е2 оценивали введением в не содержащую стероидов сыворотку увеличивающегося количества Е2 (18-275 пмоль/л). Средний выход Е2 в сравнении с добавляемым количеством был 99,1% и находился в диапазоне от 95 до 101%. Фиг. 17 изображает концентрации Е2 на протяжении 180-дневного исследования. Средние концентрации Е2 перед обработкой для всех трех групп были 23-24 пг/мл. Во время исследования уровни Е2 увеличивались в среднем на 9,2 % в группе с пластырем тестостерона во время этого периода обработки, 30,9% в группе 5,0 г/день AndroGel® и 45,5% в группе 10,0 г/день AndroGel®. Все эти средние концентрации находятся в пределах нормального диапазона. Таблица 33. Концентрация эстрадиола (пг/мл) в каждый из дней наблюдения в группе конечной обработки (Среднее ± SD) Считается, что Е2 является важным для сохранения нормальной костной ткани. Кроме того, Е2 оказывал положительное действие на профили сывороточных липидов. - 57 - 007431 Концентрации сывороточного SHBG Уровни сывороточного SHBG измеряли при помощи иммунофлуоресцентного анализа (ИФА), полученного от Delfia (Wallac, Gaithersberg, MD). Коэффициенты вариации внутри анализа и между анализами были 5% и 12%, соответственно. LLQ был 0,5 нмоль/л. Медицинский центр UCLA-Harbor определил, что нормальный диапазон взрослых мужчин для анализа SHBG равен 0,8-46,6 нмоль/л. Как показано на фиг.18 и в табл. 34, сывороточные уровни SHBG были сходными и находились в нормальном диапазоне взрослых мужчин в трех группах обработки при базовой линии (фоне). Ни одна из групп обработки не показала больших изменений от базовой линии в любой день визита для обработки. После пополнения тестостерона сывороточные уровни SHBG обнаруживали небольшое понижение во всех трех группах. Наиболее заметное изменение имело место в группе 10,0 г/день AndroGel®. Таблица 34. Концентрация SHBG (нмоль/л) в каждый из дней наблюдения в группе конечной обработки (Среднее ± SD) Гонадотропины Сывороточный FSH и LH измеряли при помощи высокочувствительных и специфических твердофазных анализов ИФА с использованием реагентов, поставляемых Delfia (Wallac, Gaitherdburg, MD). Коэффициенты вариаций внутри анализа для иммунофлуоресцентных анализов LH и FSH были 4,3 и 5,2%, соответственно; и коэффициенты вариации между анализами для LH и FSH были 11,0% и 12,0%, соответственно. Было определено, что как для анализа LH, так и для анализа FSH LLQ был равен 0,2 МЕ/л. Все пробы, полученные от одного и того же субъекта, измеряли в одном и том же анализе. Медицинский центр UCLA-Harbor сообщает, что диапазон нормальных взрослых мужчин для LH равен 1,0-8,1 Е/л, а для FSH он равен 1,0-6,9 Е/л. FSH Табл. 35(a)-(d) показывает концентрации FSH на протяжении 180-дневной обработки в зависимости от причины гипогонадизма: (1) первичный гонадизм, (2) вторичный, (3) ассоциированный с возрастом или (4) неизвестного происхождения. Как обсуждалось выше, пациенты с первичным гипогонадизмом имеют интактный путь ингибирования по механизму обратной связи, но яички не секретируют тестостерон. В результате увеличение сывороточных уровней тестостерона должно приводить к уменьшению концентраций сывороточного FSH. В этом примере идентифицировали всего 94 пациента, имеющих первичный гипогонадизм. Для этих пациентов средние концентрации FSH в трех группах обработки в день 0 были 21-26 мМЕ/мл, т.е. выше верхней границы нормального диапазона. Как показано на фиг. 19(a) и в табл. 35(a), средние концентрации FSH уменьшались во время обработки во всех трех схемах обработки. Однако, только в группе 10,0 г/день снижались средние концентрации до пределов нормального диапазона во время первых 90 дней обработки. Обработка группы 10,0 г/день AndroGel® требовала приблизительно 120 дней для достижения стационарного состояния. Средняя концентрация FSH у пациентов, применяющих 5,0 г/день AndroGel®, демонстрировала начальное снижение, которое завершалось в день 30, и вторую фазу снижения в день 120, не прекращающуюся до конца обработки. Средние концентрации FSH у пациентов, получающих пластырь тестостерона, по-видимому, достигали стационарного состояния после 30 дней, но были значимо более высокими, чем нормальный диапазон. Таблица 35(a). Концентрации FSH (мМЕ/л) в каждый из дней наблюдений в группе начальной обработки для пациентов, имеющих первичный гипогонадизм (Среднее ± SD) - 58 - 007431 Пациенты с вторичным гипогонадизмом имеют дефектную тестостероновую отрицательную систему обратной связи. Как показано на фигуре № 19(b), у 44 пациентов, идентифицированных как имеющие вторичный гипогонадизм, средние концентрации FSH снижались во время обработки, хотя это снижение на протяжении времени не было значимым для пластыря тестостерона. Пациенты в группе 5,0 г/день AndroGel® обнаруживали снижение средней концентрации FSH на приблизительно 35% в день 30, без дополнительного снижения, наблюдаемого на 60 день. После дня 90 средняя концентрация FSH у этих пациентов, по-видимому, медленно возвращается к величине, наблюдаемой перед обработкой. В день 30 все пациенты группы 10,0 г AndroGel® имели концентрации FSH, меньшие, чем нижняя граница нормального диапазона. Таблица 35(b). Концентрации FSH (мМЕ/л) в каждый из дней наблюдений в группе начальной обработки для пациентов, имеющих вторичный гипогонадизм (Среднее ± SD) Двадцать пять пациентов были диагностированы как имеющие ассоциированный с возрастом гипогонадизм. Как показано на фигуре № 19(c), группа 5,0 г/день AndroGel® имела среднюю концентрацию FSH перед обработкой выше нормального диапазона. Средняя концентрация для этой группы была в пределах нормального диапазона в день 30 и снижалась более, чем на 50%, в дни 90 и 180. Снижение средней концентрации FSH в группе 10,0 г/день AndroGel® показало более быструю реакцию. Концентрации у всех шести пациентов снижались до уровня, который был ниже нижней границы нормального уровня в день 30 и оставался таким на протяжении всего исследования. Шесть пациентов, которые получали пластырь тестостерона, не обнаружили согласующейся картины среднего уровня FSH; однако, была общая тенденция в направлении более низких уровней FSH при продолжающейся обработке. Таблица 35(c). Концентрации FSH (мМЕ/л) в каждый из дней наблюдений в группе начальной обработки для пациентов, имеющих связанный с возрастом гипогонадизм (Среднее ± SD) Шестьдесят четыре пациента в данном исследовании страдали от неклассифицированного гипогонадизма. Как показано на фиг. 19(d), эти пациенты обнаружили заметное и сравнительно быстрое снижение концентрации FSH во всех трех группах, причем наибольшее снижение было в группе 10,0 г/день AndroGel®. Группа 10,0 г/день AndroGel® давала почти 90%-ное уменьшение средней концентрации FSH в день 30 и сохраняла этот эффект до дня 180. Группа 5,0 г/день AndroGel® давала приблизительно 75%-ное падение средней концентрации FSH в день 30 и оставалась при этом уровне в течение остальной обработки. 21 пациент, получающий пластырь тестостерона, имел 50%-ное уменьшение средней концентрации FSH в день 30, и эта тенденция продолжалась до дня 90, когда эта концентрация составляла приблизительно одну треть от величины перед обработкой. - 59 - 007431 Таблица 35(d). Концентрации FSH (мМЕ/л) в каждый из дней наблюдений в группе начальной обработки для пациентов, имеющих гипогонадизм неизвестного происхождения (Среднее ± SD) Эти данные показывают, что ингибирование по механизму обратной связи секреции FSH до некоторой степени функционировало во всех трех субпопуляциях. Первичная гипогонадотропная популяция обнаружила зависимость от дозы как в степени, так и в скорости снижения уровней FSH. Чувствительность процесса механизма обратной связи, по-видимому, была пониженной во вторичной и связанной с возрастом группах, так как только наивысшие дозы тестостерона имели значимое и пролонгированное действие на секрецию FSH. В противоположность этому, путь ингибирования по типу обратной связи в пациентах неклассифицированной группы был вполне реагирующим даже при самой низкой дозе экзогенного тестостерона. LH Реакцию LH на тестостерон также исследовали раздельно для тех же самых четырех субпопуляций. Таблица 36(a)-(d) показывает концентрации LH на протяжении всего периода обработки. Как показано на фигуре № 20(a) и в таблице 36(a), концентрации LH перед обработкой составляли приблизительно 175% верхней границы нормального диапазона в первичных гипогонадотропных пациентах. Средние концентрации LH уменьшались во время обработки во всех группах. Однако только в группах AndroGel® снижались средние концентрации LH достаточно, чтобы находиться в пределах нормального диапазона. Как и в случае FSH, мужчины с первичным гипогонадизмом, получавшие AndroGel®, обнаруживали зависимость от дозы как скорости, так и степени LH-реакции. Таблица 36(a). Концентрации LH (мМЕ/л) в каждый из дней наблюдений для пациентов, имеющих первичный гипогонадизм (Суммирование средних ± SD) Мужчины с вторичным гипогонадизмом были менее чувствительными к экзогенному тестостерону. У 44 пациентов, идентифицированных как имеющие вторичный гипогонадизм, средние концентрации перед обработкой были все в пределах нижней границы нормального диапазона. Средние концентрации LH уменьшались во время обработки при всех трех схемах обработки, как показано на фигуре № 20(b) и в таблице 36(b). Таблица 36(b). Концентрация LH (мМЕ/л) в каждый из дней наблюдений для пациентов, имеющих вторичный гипогонадизм (Суммирование средних ± SD) - 60 - 007431 Ни один из 25 пациентов, страдающих от связанного с возрастом гипогонадизма, не имел концентраций LH перед обработкой вне нормального диапазона, как показано на фигуре № 20(c) и в таблице 36(c). Общие эффекты времени и обработки были значимыми для пациентов группы AndroGel®, но не у пациентов, использующих пластырь тестостерона. Таблица 36(c). Концентрации LH (мМЕ/л) в каждый из дней наблюдений для пациентов, имеющих связанный с возрастом гипогонадизм (Суммирование средних ± SD) Из 64 пациентов, страдающих от неклассифицированного гипогонадизма, ни один из пациентов не имел концентрации LH перед обработкой выше верхней границы. Однако пятнадцать процентов имели концентрации перед обработкой выше нормального диапазона. Неклассифицированные пациенты обнаружили сравнительно быстрые снижения во всех группах обработки, как показано на фигуре № 20(d) и в таблице 36(d). Таблица 36(d). Концентрации LH (мМЕ/л) в каждый из дней наблюдений для пациентов, имеющих гипогонадизм неизвестного происхождения (Суммирование средних ± SD) Резюме: LH и FSH. Пациенты, получающие AndroGel® или пластырь тестостерона, достигали «гормонального стационарного состояния» только после долгосрочной обработки. В частности, данные, относящиеся к FSH и LH, показывают, что эти гормоны не достигают стационарного состояния, пока не пройдут многие недели после обработки. Поскольку FSH и LH негативно ингибируют концентрации тестостерона, уровни тестостерона действительно не достигают истинного стационарного состояния, пока эти другие гормоны также не достигнут стационарного состояния. Однако, поскольку эти гормоны регулируют только эндогенный тестостерон (который очень низок у гипогонадных мужчин) по интактному механизму обратной связи (который может не присутствовать в зависимости от причины гипогонадизма), уровень FSH и/или LH может оказывать малое действие на фактические достигаемые уровни тестостерона. Итоговый результат заключается в том, что эти пациенты не достигают «гормонального стационарного состояния» в отношении тестостерона, даже хотя Cavg, Cmin и Cmax для тестостерона остаются относительно постоянными после нескольких дней обработки. Минеральная плотность костей (BMD) и подобные маркеры BMD оценивали при помощи способа абсорбциометрии рентгеновского излучения с двойной энергией (dual energy X-ray absorptiometry (DEXA)) с использованием Hologic QDR 2000 или 4500 A (Hologic, Waltham, MA) в дни 0 и 180 в участках поясничного отдела позвоночника и левого тазобедренного сустава. BMD позвоночника рассчитывали с использованием средней BMD при LI - L4. BMD левого тазо- 61 - 007431 бедренного сустава, который включал в себя треугольник Варда, рассчитывали с использованием средней BMD из районов шейки, вертел и межвертельного района. Сканы анализировали и обрабатывали централизованно в Hologic. Оценки BMD выполняли в 13 из 16 центров (у 206 из 226 субъектов) вследствие отсутствия специального оборудования DEXA в некоторых местах. Табл. 37 и фиг. 21(а)-21(b) показывают, что BMD тазобедренного сустава или позвоночника не различались среди трех групп обработки. Значимые увеличения BMD имели место только в субъектах в группе 10,0 г/день AndroGel® и субъектах, которых переводили из группы 10,0 г/день в группу 7,5 г/день. Увеличения BMD были приблизительно 1% в тазобедренном суставе и 2% в позвоночнике во время шестимесячного периода. Средние увеличения BMD 0,6% и 1% наблюдали у субъектов, получающих 5,0 г/день AndroGel®, но не наблюдали увеличения в группе с пластырем тестостерона. Таблица 37. Концентрации BMD в день 0 и день 180 в группе конечной обработки (Среднее ± SD) BMD тазобедренного сустава и позвоночника при базовой линии и изменение BMD в день 180 не имели значимой корреляции со средней концентрацией сывороточного тестостерона в день 0. Изменения BMD в тазобедренном суставе и позвоночнике после пополнения тестостерона не отличались значимо у субъектов с гипогонадизмом, обусловленным первичными, вторичными причинами, старением, или гипогонадизмом неизвестного происхождения; они не были различными между субъектами, не получающими тестостерон, или субъектами с восполненным предварительно тестостероном. Изменение BMD в позвоночнике негативно коррелировало с величинами BMD базовой линии, что указывало на то, что наивысшее увеличение BMD имело место у субъектов с самым низким исходным уровнем BMD. Увеличение BMD в тазобедренном суставе (но не в позвоночнике) после обработки тестостероном коррелировало с изменением в уровнях сывороточного тестостерона. Маркеры активности костных остеобластов Результаты, описанные выше, подтверждали измерениями ряда маркеров костеобразования в сыворотке и моче. В частности, средние концентрации сывороточных маркеров (РТН, SALP, остеокальцина, проколлагена типа I) обычно увеличиваются во время обработки во всех группах обработки. Кроме того, отношения двух маркеров костеобразования мочи (отношение N-телопептид/креатинин и отношение кальций/креатинин) предполагают уменьшение резорбции костей. РТН (паратиреоидный или кальциотропный гормон). Сывороточный интактный РТН измеряли при помощи наборов для двухсайтного иммунорадиометрического анализа (IRMA) из Nichol's Institute (San Juan Capistrano, CA). Коэффициенты вариации внутри анализов и между анализами были 6,9 и 9,6%, соответственно. Ранее Медицинский центр UCLA-Harbor сообщал, что нормальный диапазон для взрослых мужчин равен 6,8-66,4 нг/л. В табл. 38 приведены концентрации РТН на протяжении 180-дневного исследования. Фигура № 22 показывает, что средние сывороточные уровни РТН находились в нормальном диапазоне у мужчин во всех группах обработки на базовой линии. Статистически значимые увеличения сывороточного РТН наблюдали во всех субъектах в целом в день 90 без различий между группами. Эти увеличения сывороточного РТН сохранялись в день 180 во всех трех группах. - 62 - 007431 Таблица 38. Концентрации РТН в каждый из дней наблюдений в конечной группе обработки (Среднее ± SD) SALP SALP определяли количественно при помощи IRMA с использованием реагентов, поставляемых Hybritech (San Diego, CA). LLQ для анализа SALP был 3,8 мкг/л; и коэффициенты точности внутри анализов и между анализами были 2,9 и 6,5%, соответственно. Медицинский центр UCLA-Harbor сообщал, что нормальный диапазон для взрослых мужчин концентрации SALP составляет 2,4-16,6 мкг/л. Концентрации SALP перед обработкой находились в нормальном диапазоне. Фигура № 23 и таблица 39 показывают, что уровни SALP увеличивались обработкой тестостероном в первые 90 дней и достигали статистического различия в группе с пластырем тестостерона. После этого сывороточный уровень SALP находился на плато во всех группах обработки. Таблица 39. Концентрации SALP в каждый из дней наблюдений в конечной группе обработки (Среднее ± SD) Остеокальцин Сывороточный остеокальцин измеряли при помощи IRMA из Immutopics (San Clemente, CA). LLQ был 0,45 мкг/л. Коэффициенты вариации внутри анализов и между анализами были 5,6 и 4,4%, соответственно. Медицинский центр UCLA-Harbor сообщает, что нормальный диапазон для взрослых мужчин концентрации остеокальцина составляет 2,9-12,7 мкг/л. Как показано на фиг. № 24 и в таблице 40, средние уровни сывороточного остеокальцина на базовой линии находились в нормальном диапазоне во всех трех группах. Во время первых 90 дней обработки средний сывороточный остеокальцин увеличивался пополнением тестостерона у всех субъектов в целом без значимых различий между группами. При продолжении обработки сывороточный остеокальцин либо находился на плато, либо обнаруживал снижение в день 180. Таблица 40. Концентрации остеокальцина в каждый из дней наблюдений в конечной группе обработки (Среднее ± SD) Проколлаген типа I Сывороточный проколлаген типа I измеряли с использованием набора РИА из Incstar Corp (Stillwater, MN). LLQ анализа проколлагена был 5 мкг/л, и коэффициенты точности внутри анализов и между анализами были 6,6 и 3,6%, соответственно. Медицинский центр UCLA-Harbor сообщает, что нормальный диапазон для взрослых мужчин концентрации проколлагена типа I составляет 56-310 мкг/л. Фиг. 25 и табл. 41 показывают, что сывороточный проколлаген обычно давал ту же самую картину, что и сывороточный остеокальцин. При базовой линии средние уровни были одинаковыми и находились в нормальном диапазоне во всех группах обработки. При трансдермальной обработке сывороточный проколлаген увеличивался значимо во всех субъектах в целом без различий между группами. Увеличение проколлагена было наивысшим в день 30, и затем он находился на плато до дня 120. В день 180 уровни сывороточного проколлагена возвращались к уровням базовой линии (фона). - 63 - 007431 Таблица 41. Концентрации проколлагена в каждый из дней наблюдений в конечной группе обработки (Среднее ± SD) Находящиеся в моче маркеры обновления костной ткани: отношения N-телопептид/Cr и Са/Cr. Кальций и креатинин мочи определяли приближенно с использованием стандартных процедур клинической химии с использованием автоматического анализатора в Лаборатории патологии UCLA-Harbor. Эти процедуры выполняли с использованием системы анализатора автоматической химии COBAS MIRA, изготовляемого Roche Diagnostics Systems. Чувствительность анализа на креатинин была 8,9 мг/дл, a LLQ был 8,9 мг/дл. Согласно Медицинскому центру UCLA-Harbor, уровни креатинина в нормальном диапазоне взрослых мужчин находятся в диапазоне 2,1 мМ -45,1 мМ. Чувствительность анализа на кальций была 0,7 мг/дл, a LLQ был 0,7 мг/дл. Нормальный диапазон для кальция в моче равен 0,21 мМ - 7,91 мМ. N-телопептиды измеряли твердофазным иммуноферментным анализом (ELISA) из Ostex (Seattle, WA). LLQ для анализа N-телопептида был 5 нМ эквивалента костного коллагена (ВСЕ). Точность внутри анализов и между анализами была 4,6 и 8,9%, соответственно. Нормальный диапазон для анализа Nтелопептида был 48-2529 нМ ВСЕ. Пробы, содержащие низкие или высокие уровни костных маркеров в сыворотке/моче, повторно анализировали после коррекции объема пробы или разбавления для гарантии того, что все пробы могут анализироваться в пределах приемлемой прецизионности и точности. Нормальный диапазон для взрослых мужчин для отношения N-телопептид/Cr равен 13-119 нМ ВСЕ/нМ Cr. Как показано на фиг. 26 и в таблице 42, отношения N-телопептид/Cr в моче были сходными во всех трех группах обработки при базовой линии, но значимо снижались в группе 10,0 г/день AndroGel®, но не в группе 5,0 г/день AndroGel® или группе пластыря тестостерона во время первых 90 дней обработки. Это снижение сохранялось, так что отношение N-телопептид/Cr оставалось более низким, чем базовая линия в группе 10,0 г/день AndroGel®, и в субъектах, которых переводили из группы 10,0 г/день в группу 7,5 г/день в день 180. Это отношение уменьшалось также в группе обработки пластырем тестостерона в день 180. Таблица 42. Отношение N-телопептид/Cr в каждый из дней наблюдений в конечной группе обработки (Среднее ± SD) Нормальный диапазон для отношения Са/Cr был 0,022-0,745 мМ/мМ. Фиг. 27 показывает отсутствие значимого различия в отношениях Са/Cr в моче при базовой линии в этих трех группах. С использованием трансдермальной тестостероновой заместительной терапии отношения Са/Cr в моче не обнаруживают значимого снижения ни в одной группе обработки в день 90. При продолжении пополнения тестостерона в день 180 отношение Са/Cr в моче обнаруживало заметную вариацию без значимых изменений в любой группе обработки. - 64 - 007431 Таблица 43. Отношение Са/Cr в каждый из дней наблюдений в конечной группе обработки (Среднее ± SD) Интересно, что изменение отношения Са/Cr от базовой линии в день 90 было обратно пропорциональным отношениям Са/Cr базовой линии. Подобным образом, изменение отношение N-телопептид/Cr было также обратно пропорциональным отношению N-телопептид/Cr базовой линии (r=-0,80, р=0,0001). Таким образом, субъекты с наивысшими маркерами резорбции костей на базовой линии обнаружили наибольшие уменьшения этих маркеров во время трансдермального восполнения тестостерона. Уменьшения маркеров резорбции костей в моче были наиболее выраженными в субъектах, которые имели наивысшие величины базовых линий, что предполагает, что субъекты с гипогонадизмом с наиболее тяжелым метаболическим заболеванием костей наиболее сильно реагировали на тестостероновую заместительную терапию. Сывороточный кальций Сывороточный кальций не показал значимых различий между группами при базовой линии, а также не показал значимых изменений после восполнения тестостерона. Уровни сывороточного кальция показали незначимые изменения во время восполнения тестостерона. Либидо, сексуальная активность и настроение Сексуальную функцию и настроение оценивали с использованием опросников (анкет) пациентов, отвечающих ежедневно в течение семи последовательных дней перед визитом в клинику в день 0 и в дни 30, 60, 90, 120, 150 и 180 во время нанесения геля и пластыря. Субъекты регистрировали, имели ли они сексуальные дневные фантазии, антиципацию (предвосхищение) секса, флирт, сексуальную интеракцию (например, параметры сексуальной мотивации) и оргазм, эрекцию, мастурбацию, эякуляцию, коитус (например, параметры сексуальной активности) в каждый из этих семи дней. Величина регистрировалась как 0 (отсутствие) или 1 (наличие какого-либо параметра) для анализов, и количество дней отмеченного субъектами параметра суммировали для этого семидневного периода. Среднее четырех параметров сексуальной мотивации принимали в качестве средней оценки сексуальной мотивации, а среднее пяти параметров сексуальной активности принимали в качестве средней оценки сексуальной активности (0-7). Эти субъекты оценивали также их уровень сексуального влечения, сексуального наслаждения и удовлетворения эрекции при помощи 7-балльной шкалы типа шкалы Ликерта (0-7), а процент полной эрекции 0100%. Субъекты оценивали их настроение с использованием шкалы 0-7. Оцениваемые параметры включали в себя положительные реакции настроения: бодрая, дружественная, полная энергии, хорошее самочувствие, а также негативные реакции настроения: сердитая, раздраженная, печальная, усталая, нервная. Рассчитывали средние недельные баллы. Подробности этого опросника были описаны ранее и полностью включены в качестве ссылки. См. Wang et al., Testosterone Replacement Therapy Improves Mood in Hypogonadal Men - A Clinical Research Center Study, 81 J. Clinical Endocrinology & Metabolism 3578-3583 (1996). Либидо Как показано на фиг. 28(a), при базовой линии сексуальная мотивация была одинаковой во всех группах обработки. После трансдермальной обработки тестостероном общая сексуальная мотивация обнаружила значимое улучшение. Однако изменение в итоговом балле от базовой линии не различалось среди этих трех групп. Либидо также оценивали из реакций по линейной шкале: (1) общего сексуального влечения, (2) наслаждения сексуальной активности без партнера и (3) наслаждения сексуальной активности с партнером. Как показано на фигуре № 28(b) и в таблице 44, в целом для групп, общее сексуальное влечение увеличивалось после трансдермальной обработки тестостероном без различий между группами. Сексуальное наслаждение с партнером и без партнера (фиг. 28(c) и табл. 45 и 26) также увеличивалось в целом для всех групп. Подобным образом, сексуальная активность значимо улучшалась во всех субъектах в целом. Улучшение сексуальной активности от базовой линии не различалось между трансдермальными препаратами. - 65 - 007431 Таблица 44. Изменения общего сексуального влечения от дня 0 до дня 180 в начальной группе обработки (Среднее ± SD) Таблица 45. Изменения уровня сексуального наслаждения без партнера от дня 0 до дня 180 в начальной группе обработки (Среднее ± SD) Таблица 46. Изменения уровня сексуального наслаждения с партнером от дня 0 до дня 180 в начальной группе обработки (Среднее ± SD) Сексуальная активность Фиг. 29(a) показывает, что, в то время как все группы обработки имели одинаковую оценку сексуальной активности при базовой линии, оценка улучшалась обработкой трансдермальным тестостероном во всех группах. Кроме того, в целом для групп, самооценка удовлетворения эрекции субъектов (фиг. 29(b) и табл. 47) и процент полной эрекции (фиг. 29(c) и табл. 48) также увеличивались пополнением тестостерона без значимых различий между группами. Это улучшение сексуальной функции не было связано с дозой или способом доставки тестостерона. Улучшение не было также связано с уровнями сывороточного тестостерона, достигаемыми посредством различных препаратов тестостерона. Эти результаты предполагают, что после достижения порога (уровня сывороточного тестостерона, возможно, низкого нормального диапазона), происходит нормализация сексуальной функции. Увеличение уровней сывороточного тестостерона выше верхней границы нормального диапазона не улучшает дополнительно сексуальную мотивацию или активность. Таблица 47. Изменение удовлетворения продолжительностью эрекции от дня 0 до дня 180 в начальной группе обработки (Среднее ± SD) - 66 - 007431 Таблица 48. Изменение процента полной эрекции от дня 0 до дня 180 в начальной группе обработки (Среднее ± SD) Настроение Позитивные и негативные суммарные реакции настроения на тестостероновую заместительную терапию показаны на фигуре № 30(a) и 30(b). Все три группы обработки имели сходные баллы при базовой линии, и все субъекты обнаружили улучшения позитивного настроения. Подобным образом, суммарные баллы негативного настроения были сходными во всех трех группах при базовой линии, и в целом реакции на нанесения трансдермального тестостерона обнаружили значимые уменьшения без проявления различий между группами. В частности, параметры позитивного настроения, такие как чувство благополучия и уровень энергии, улучшались, а параметры негативного настроения, такие как печаль и раздражимость, уменьшались. Улучшение настроения наблюдали в день 30, и оно сохранялось при продолжении обработки. Улучшение параметров настроения не зависело от размера увеличения уровней сывороточного тестостерона. После увеличения сывороточного тестостерона до низкого нормального диапазона, имело место максимальное улучшение параметров настроения. Таким образом, отвечаемость сексуальной функции и настроения в гипогонадотропных мужчинах на тестостероновую терапию, повидимому, зависит от достижения порога сывороточного тестостерона при низком нормальном диапазоне. Мышечная сила Мышечную силу оценивали в дни 0, 90 и 180. Способ одного повторяющегося максимума (1-RM) использовали для измерения мышечной массы в упражнениях по выжиму веса на станке и выжиму веса ногами в сидячем положении. Испытанные группы мышц включали мышцы в тазобедренных суставах, нижних конечностях, плечах, верхних конечностях и грудной клетке. Способ 1-RM оценивает способность генерирования максимальной силы мышц, используемых для выполнения данного теста. После 510-минутной ходьбы и периода разминки этот тест начинали с веса, который, как считали, представлял максимальную силу пациента. Этот тест повторяли с использованием увеличений веса на приблизительно 2-10 фунтов до тех пор, пока пациент уже не был способен поднять дополнительный вес с приемлемой формой. Мышечную силу оценивали в 167 из 227 пациентов. Четыре из 16 центров не участвовали в тестировании мышечной силы вследствие отсутствия требуемого оборудования. Реакции мышечной силы, тестируемой тестами выжима веса для верхних конечностей/грудной клетки и нижних конечностей, показаны на фигуре № 31(a) и 31(b) и в таблице 49. Не было статистически значимых различий в мышечной силе верхних конечностей/грудной клетки или нижних конечностей среди трех групп при базовой линии. Обычно, мышечная сила улучшалась как в верхних конечностях, так и в нижних конечностях во всех трех группах обработки без различий между группами как в день 90, так и в день 180. Эти результаты показали улучшение мышечной силы при днях 90 и 180, в большей степени в ногах, чем в руках, которое не различалось между группами обработки и в различные дни оценки. Коррекция дозы при дне 90 не оказывало значимого влияния на реакции мышечной силы на трансдермальные препараты тестостерона. - 67 - 007431 Таблица 49. Уровни мышечной силы в дни 0, 90 и 180 и изменение (фунты) от дня 0 до дня 90 и от дня 0 до дня 180 в конечной группе обработки Состав тела Состав тела измеряли при помощи абсорбциометрии рентгеновского излучения с двойной энергией (dual energy X-ray absorptiometry (DEXA)) с использованием Hologic QDR 2000 или 4500А в дни 0, 90 и 180. Эти оценки производили в 168 из 227 субъектов, поскольку оборудование biologic DEXA не было доступным в 3 из 16 центров исследования. Все измерения состава тела анализировали и обрабатывали централизованно в Hologic (Waltham, MA). При базовой линии не было значимых различий в общей массе тела (ТВМ), общей не содержащей жира массе (TLN), проценте жира (PFT) и общей массе жира тела (TFT) в этих трех группах обработки. Как показано на фиг. 32(a) и в таблице 50, все группы обработки имели общее увеличение ТВМ. Увеличение ТВМ было вызвано в основном увеличениями TLN. Фиг. 32(b) и таблица 50 показывают, что после 90 дней пополнения тестостерона увеличение TLN было значимо более высоким в группе 10,0 г/день AndroGel®, чем в двух других группах. В день 180 увеличения TLN дополнительно увеличивались или сохранялись во всех обработанных AndroGel® группах, а также в группе с тестостероновым пластырем. Фиг. 32(c) и (d) показывают, что TFT и PFT уменьшались во всех обработанных AndroGel® группах. В день 90 обработки TFT была значимо уменьшена в группах 5,0 г/день и 10,0 г/день AndroGel®, но не изменялась в группе с тестостероновым пластырем. Это уменьшение сохранялось в день 180. Соответственно, в день 90 и 180 уменьшение PFT оставалось значимо более низким во всех обработанных AndroGel® группах, но не уменьшалось значимо в группе с тестостероновым пластырем. Увеличение TLN и уменьшение TGT, связанные с тестостероновой заместительной терапией, обнаружило значимые корреляции с уровнем тестостерона, получаемом с тестостероновым пластырем и различными дозами AndroGel®. Тестостероновый гель, вводимый при 10,0 г/день, увеличивал не содержа- 68 - 007431 щую жира массу больше, чем группы тестостеронового пластыря и 5,0 г/день AndroGel®. Эти изменения были очевидными в день 90 и сохранялись или усиливались в день 180. Такие изменения в составе тела были значимыми даже при прекращении этими субъектами предыдущей тестостероновой терапии в течение шести недель. Уменьшение TFT и PFT было также связано с достигаемым уровнем тестостерона в сыворотке, и эти показатели также были различными между группами обработки. Обработка тестостероновым пластырем не обнаружила уменьшения PFT или TFT после 180 дней обработки. Обработка AndroGel® (5,0-10,0 г/день) в течение 90 дней уменьшала PFT и TFT. Это уменьшение сохранялось в группах 5,0 г/день и 7,5 г/день при 180 днях, но дополнительно понижалось с продолжением обработки более высокой дозой AndroGel®. Таблица 50. Среднее изменение параметров состава тела (DEXA) от базовой линии до дня 90 и от базовой линии до дня 180 в конечной группе обработки Профиль липидов и химия крови Сывороточные уровни общего, HDL- и LDL-холестерина при базовой линии не были значимо различными во всех группах обработки. В случае трансдермального пополнения тестостерона не было действия всех обработок и не было различий между группами сывороточных концентраций общего, HDL- и LDL-холестерина (фигура № 12(d)) и триглицеридов. Имелось значимое изменение концентраций сывороточного общего холестерина в целом на протяжении времени (р=0,0001), концентрации в дни 30, 90 и 180 были значимо более низкими, чем в день 0. Приблизительно 70-95% субъектов не имели значимого изменения в их профиле сывороточных липидов во время тестостероновой заместительной терапии. Уровни общего холестерина, которые исходно были высокими, снижались до нормального диапазона (в лаборатории каждого центра) в день 180 в 17,2, 20,4 и 12,2% субъектов с пластырем тестостерона, 5,0 г/день AndroGel® и 10,0 г/день AndroGel®, соответственно. Уровни сывороточного HDL-холестерина (исходно нормальные) уменьшались ниже нормального диапазона (в лаборатории каждого центра) в 9,8, 4,0, 9,1 и 12,5% субъектов в день 180 в группах с пластырем тестостерона, 5,0 г/день AndroGel® и 10,0 г/день AndroGel®, соответственно. Не было клинически значимых изменений в тестах на функцию почек или печени ни в одной группе обработки. Раздражения кожи Оценки раздражения кожи выполняли в момент каждого визита в клинику с использованием следующей шкалы: 0 = отсутствие эритемы; 1 = минимальная эритема; 2 = умеренная эритема с резко очерченными границами; 3 = интенсивная эритема с отеком; 4 = интенсивная эритема с отеком и с образованием пузырей/эрозии. Переносимость ежедневного нанесения AndroGel® в тестируемых дозах была лучшей, чем в случае пластыря тестостерона с усиленным проникновением. Минимальное раздражение кожи (эритема) в месте нанесения отмечали у трех пациентов в группе 5,0 г/день AndroGel® (5,7%) и других трех в группе 10,0 г AndroGel® (5,3%). Раздражение кожи, варьирующееся по интенсивности от минимального до тяжелого (от умеренной эритемы до интенсивной эритемы с пузырями) имело место в 65,8% пациентов в группе с пластырем. Из-за раздражения кожи пластырем тестостерона 16 субъектов прервали исследование; 14 из них имели умеренные-тяжелые кожные реакции в местах нанесения пластыря. Ни один пациент, получавший AndroGel®, не прерывал исследования из-за неблагоприятных кожных реакций. Откры- 69 - 007431 тая система и более низкая концентрация спирта в композиции AndroGel® заметно уменьшали раздражение кожи, приводя к лучшей переносимости и степени продолжения тестостероновой заместительной терапии. Кроме того, на основании различия в весе распределенных и возвращенных флаконов AndroGel® среднее соблюдение режима и схемы лечения пациентами было 93,1% и 96,0% для групп 5,0 г/день и 10,0 г/день AndroGel® во время дней 1-90, соответственно. Соблюдение режима и схемы лечения оставалось более 93% для трех групп AndroGel® со дня 91-180. В противоположность этому, на основании подсчета пластырей, возвращенных субъектами, соблюдение режима и схемы лечения с использованием тестостеронового пластыря было 65% во время дней 1-90 и 74% во время дней 91-180. Более низкое соблюдение режима и схемы лечения в группе с тестостероновым пластырем было в большей части обусловлено кожными реакциями, как видно из записей субъектов. Таблица 51. Частота связанных с кожей неблагоприятных событий: день 1 – день 180 в пациентах, которые оставались на начальной обработке Сывороточная концентрация глюкозы Табл. 52 показывает концентрацию глюкозы пациентов, у которых концентрация глюкозы в сыворотке была большей, чем 100 мг/дл, в начале исследования, для каждого из дней наблюдений в конечной группе обработки. Таблица 52. Концентрации глюкозы пациентов (Среднее; мг/дл) Табл. 53 показывает общее изменение глюкозы у пациентов, у которых концентрация глюкозы в сыворотке была большей, чем 110 мг/дл, в начале исследования, от дня 0 до дня 180 в начальной группе обработки. Таблица 53. Изменения общей глюкозы пациентов (Среднее; мг/дл) Таблица 54 показывает среднее изменение общей глюкозы для пациентов от дня 0 до дня 180. Таблица 54. Общая глюкоза (Среднее; мг/дл) - 70 - 007431 Пример 2. Дозированные формы и приспособления для доставки геля. Данное изобретение относится также к способу расфасовки и упаковки геля. В одном варианте данное изобретение включает в себя ручной насос, способный доставлять приблизительно 2,5 г геля тестостерона при каждом приведении в действие (запуске). В другом варианте этот гель упаковывают в пакеты из фольги, содержащие полиэтиленовый вкладыш. Каждый пакет содержит приблизительно 2,5 г геля тестостерона. Пациент просто разрывает пакет вдоль перфорированного края для вынимания геля. Однако, поскольку изопропилацетат связывается с полиэтиленовым вкладышем, в гель добавляют дополнительное количество изопропилмиристата, чтобы получить фармацевтически эффективный гель при использовании этого варианта доставки. В частности, при расфасовке геля с использованием пакета из фольги в составе этого геля используют приблизительно на 41% больше изопропилмиристата (т.е. приблизительно 0,705 г вместо приблизительно 0,5 г, приведенных в таблице 5) для компенсации этого явления. Пример 11. Способ лечения мужчин, имеющих эректильную дисфункцию, вместе с другими фармацевтическими веществами. Как обсуждалось выше, трансдермальное внесение тестостерона с использованием AndroGel® гипогонадотропному мужчине приводит к улучшенному либидо и улучшенной сексуальной активности. Этот пример относится к нацеленному применению AndroGel® в комбинации с фармацевтическими веществами, применимыми для лечения эректильной дисфункции. Такие фармацевтические вещества включают в себя любой агент, который является эффективным в ингибировании активности фосфодиэстеразы. Подходящие ингибиторы фосфодиэстеразы включают в себя, но не ограничиваются ими, ингибиторы фосфодиэстеразы типа III (цАМФ-специфической цГМФ-ингибируемой формы), фосфодиэстеразы типа IV (высокоаффинной - высокоспецифической в отношении цАМФ формы) и фосфодиэстеразы V (сГМФ-специфической формы). Дополнительные ингибиторы, которые могут использоваться с данным изобретением, являются ингибиторами цГМФ-специфической фосфодиэстеразы, другие, чем ингибиторы типа V. Примеры ингибиторов фосфодиэстеразы типа III, которые могут вводиться, включают в себя, но не ограничиваются ими, бипиридины, такие как милринон и амиринон, имидазолоны, такие как пироксимон, и эноксимон, дигидропиридазиноны, такие как имазодан, 5-метилимазодан, индолидан и ICI1118233, соединения хинолинона, такие как цилостамид, цилостазол и веснаринон, и другие молекулы, такие как беморадан, анергрелид, трехинзин, пимобендан, SKF-94120, SKF-95654, ликсазинон и изомазол. Примеры ингибиторов фосфодиэстеразы типа IV, подходящие для применения здесь, включают в себя, но не ограничиваются ими, ролипрам и производные ролипрама, такие как RO20-1724, нитраквазон и производные нитраквазона, такие как СР-77059 и RS-25344-00, производные ксантина, такие как денбуфиллин и ICI63197, и другие соединения, такие как EMD54622, LAS-31025 и этазолат. Примеры ингибиторов фосфодиэстеразы типа V включают в себя, но не ограничиваются ими, запринаст, MY5445, дипиридамол и зилденафил. Другие ингибиторы фосфодиэстеразы типа V описаны в публикациях РСТ с номерами WO 94/29802 и WO 96/16644. В предпочтительном варианте используют ингибитор фосфодиэстеразы типа V (PDE5), такой как Виагра® (цитрат силденафила USP). Соединения, описанные в публикации РСТ № WO 94/28902, являются пиразолопиримидинонами. Примеры этих ингибиторных соединений включают в себя 5-(2-этокси-5-морфолиноацетилфенил)-1метил-3-н-пропил-1,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-он, 5-(5-морфолиноацетил-2-н-пропоксифенил)-1-метил-3-н-пропил-1,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-он, 5-[2-этокси-5-(4-метил-1пиперазинилсульфонил)фенил]-1-метил-3-н-пропил-1,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-он, 5[2-аллилокси-5-(4-метил-1-пиперазинилсульфонил)фенил]-1-метил-3-н-пропил-1,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-он, 5-[2-этокси-5-[4-(2-пропил)-1-пиперазинсульфонил]]-1-метил-3-н-пропил-1,6дигидро-7Н-пиразоло[4,3-d]пиримидин-7-он, 5-[2-этокси-5-[4-(2-гидроксиэтил)-1-пиперазинсульфонил] фенил]-1-метил-3-н-пропил-1,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-он, 5-[5-[4-(2-гидроксиэтил)-1пиперазинсульфонил-2-н-пропоксифенил]-1-метил-3-н-пропил-1,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-он, 5-[2-этокси-5-(4-метил-1-пиперазинкарбонил)фенил]-1-метил-3-н-пропил-1,6-дигидро-7Нпиразоло[4,3-d]пиримидин-7-он и 5-[2-этокси-5-(1-метил-2-имидазолил)фенил]-1-метил-3-н-пропил-1,6дигидро-7Н-пиразоло[4,3-d]пиримидин-7-он. Ингибиторы фосфодиэстераз, описанные в публикации РСТ № WO 96/16644, включают в себя производные гризеоловой кислоты, производные 2-фенилпуринона, производные фенилпиридона, слитые и конденсированные пиримидины, производные пиримидопиримидина, пуриновые соединения, хиназолиновые соединения, производные фенилпиримидинона, производные имидазохиноксалинона или их азааналоги, производные фенилпиридона и другие. Характерные примеры ингибиторов фосфодиэстераз, описанные в WO 96/16644, включают в себя 1,3-диметил-5-бензилпиразоло[4,3-d]пиримидин-7-он, 2-(2пропоксифенил)-6-пуринон, 6-(2-пропок-сифенил)-1,2-дигидро-2-оксипиридин-3-карбоксамид, 2-(2-пропоксифенил)пиридо[2,3-d]пиримид-4(3Н)-он, 7-метилтио-4-оксо-2-(2-пропоксифенил)-3,4-дигидропиримидо[4,5-d]пиримидин, 6-гидрокси-2-(2-пропоксифенил)пиримидин-4-карбоксамид, 1-этил-3-метилимидазо[1,5-а]хиноксалин-4(5Н)-он, 4-фенилметиламино-6-хлор-2-(1-имидазоло-ил)хиназолин, 5-этил-8- 71 - 007431 [3-(N-циклогексил-N-метилкарбамоил)пропилокси]-4,5-дигидро-4-оксопиридо[3,2-е]пирроло[1,2-а]пиразин, 5'-метил-3'-(фенилметил)спиро[циклопентан-1,7'(8'Н)-(3'Н)-имидазо[2,1-b]пурин]-4'(5'Н)-он, 1-[6хлор-4-(3,4-метилендиоксибензил)аминохиназолин-2-ил]пиперидин-4-карбоновую кислоту, (6R,9S)-2-(4трифторметилфенил)метил-5-метил-3,4,5,6а,7,8,9,9а-октагидроциклопент[4,5]имидазо[2,1-b]пурин-4-он, 1-трет-бутил-3-фенилметил-6-(4-пиридил)пиразоло[3,4-d]пиримид-4-он, 1-циклопентил-3-метил-6-(4-пиридил)-4,5-дигидро-1Н-пиразоло[3,4-d]пиримид-4-он, 2-бутил-1-(2-хлорбензил)-6-этоксикарбонилбензимидазол и 2-(4-карбоксипиперидино)-4-(3,4-метилендиоксибензил)амино-6-нитрохиназолин и 2-фенил-8этоксициклогептимидазол. Другие ингибиторы фосфодиэстеразы типа V, применимые вместе с данным изобретением, включают в себя: IC-351 (ICOS); мононатриевую соль 4-бром-5-(пиридилметиламино)-6-[3-(4-хлорфенил) пропокси]-3-(2Н)пиридазинон; 1-[4-(1,3-бензодиоксол-5-илметил)амино]-6-хлор-2-хиназолинил-4-пиперидинкарбоновой кислоты; (+)-цис-5,6а,7,9,9,9а-гексагидро-2-4-(трифторметил)фенилметил-5-метилциклопент-4,5-имидазо[2,1-b]пурин-4(3Н)-он; фуразоциллин, цис-2-гексил-5-метил-3,4,5,6а,7,8,9,9а-окстагидроциклопент[4,5]имидазо[2,1-b]пурин-4-он; 3-ацетил-1-(2-хлорбензил)-2-пропилиндол-6-карбоксилат; 4-бром-5-(3-пиридилметиламино)-6-(3-(4-хлорфенил)пропокси)-3-(2Н)пиридазинон; 1-метил-5(5-морфолиноацетил-2-н-пропоксифенил)-3-н-пропил-1,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-он; мононатриевую соль 1-[4-[(1,3-бензодиоксол-5-илметил)амино]-6-хлор-2-хиназолинил]-4-пиперидинкарбоновой кислоты; Pharmaprojects No. 4516 (Glaxo Wellcome); Pharmaprojects No. 5051 (Bayer); Pharmaprojects No. 5064 (Kyowa Hakko; см. WO 96/26940); Pharmaprojects No.5069 (Schering Plough); GF196960 (Glaxo Wellcome) и Sch-51866. Другие ингибиторы фосфодиэстераз, которые могут быть использованы в способе этого изобретения, включают в себя неспецифические ингибиторы фосфодиэстераз, такие как теофиллин, IBMX, пентоксифиллин и папаверин, и прямые вазодилататоры, такие как гидралазин. Эти активные агенты могут вводиться, если желательно, в форме солей, сложных эфиров, амидов, пролекарств, производных и т.п., при условии, что эти соль, сложный эфир, амид, пролекарство или производное являются фармакологически приемлемыми, т.е. эффективными в данном способе. Соли, сложные эфиры, амиды, пролекарства и другие производные этих активных агентов могут быть получены с использованием стандартных процедур, известных лицам с квалификацией в области синтетической органической химии и описанных, например, J. March, Advanced Organic Chemistry; Reactions, Mechanisms and Structure, 4th Ed. (New York: Wiley-Interscience, (1992)). Например, кислотно-аддитивные соли получают из свободного основания с использованием общепринятой методологии, которая включает в себя реакцию с подходящей кислотой. Обычно, форму основания лекарственного средства растворяют в полярном органическом растворителе, таком как метанол или этанол, и добавляют к раствору кислоту. Полученную соль либо осаждают, либо извлекают из раствора добавлением менее полярного растворителя. Подходящие кислоты для получения кислотно-аддитивных солей включают в себя как органические кислоты, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, яблочную кислоту, малоновую кислоту, янтарную кислоту, малеиновую кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, пара-толуолсульфоновую кислоту, салициловую кислоту и т.п., так и неорганические кислоты, например, хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.п. Кислотно-аддитивная соль может быть превращена в свободное основание обработкой подходящим основанием. Особенно предпочтительными кислотно-аддитивными солями описанных здесь активных агентов являются галогенидные соли, такие, которые могут быть приготовлены с использованием хлористоводородной или бромистоводородной кислот. Напротив, получение основных солей кислотных частей молекул, которые могут присутствовать на молекуле ингибитора фосфодиэстеразы, получают сходным образом с использованием фармацевтически приемлемого основания, такого как гидроксид натрия, гидроксид калия, гидроксид аммония, гидроксид кальция, триметиламин или т.п. Особенно предпочтительными щелочными солями являются здесь соли щелочных металлов, например, соль натрия и соли меди. Получение сложных эфиров включает в себя функционализацию гидроксильной и/или карбоксильной групп, которые могут присутствовать в молекулярной структуре лекарственного средства. Сложные эфиры являются обычно ацилзамещенными производными свободных спиртовых групп, т.е. молекулами, которые произведены из карбоновых кислот формулы RCOOH, где R является алкилом и предпочтительно является низшим алкилом. Сложные эфиры могут быть превращены в свободные кислоты, если это желательно, с использованием общепринятых процедур гидрогенолиза или гидролиза. Амиды и пролекарства могут быть также получены с использованием способов, известных специалистам с квалификацией в данной области или описанных в соответствующей литературе. Например, амиды могут быть получены из сложных эфиров с использованием подходящих содержащих аминогруппу реагентов, или они могут быть получены из ангидрида или хлорангидрида реакцией с аммиаком или низшим алкиламином. Пролекарства обычно получают ковалентным присоединением части молекулы, которая приводит к соединению, которое является терапевтически неактивным, пока оно не будет метаболизировано метаболической системой индивидуума. - 72 - 007431 Могут быть также использованы другие соединения, применимые для лечения эректильной дисфункции. Они включают в себя: (а) пентоксифиллин (TRENTAL®); (b) гидрохлорид иохимбина (ACTIBINE®, YOCON®, YOHIMEX®); (с) апоморфин (UPRIMA®); (d) алпростадил (система MUSE®, TOPIGLAN®, CAVERJECT®); (е) папаверин (PAVABID®, CERESPAN®); (f) фентоламин (VASOMAX®, REGITINE®) и комбинации, соли, производные и энантиомеры всех описанных выше соединений. Содержащий тестостерон гель, такой как AndroGel®, вводят для увеличения и усиления терапевтической эффективности таких лекарственных средств либо в гипогонадотропных, либо нормогонадотропных мужчин, имеющих эректильную дисфункцию. В то время как такие фармацевтические вещества, как VIAGRA®, работают в основном посредством различных механизмов инициации и поддержания эрекции, гель тестостерона, используемый в соответствии с данным изобретением, играет благоприятную роль физиологически и стимулирует как сексуальную мотивацию (т.е. либидо), так и сексуальную активность. Тестостерон регулирует экспрессию гена синтазы оксида азота. См. Reilly et al., Androgenic Regulation of NO Availability in Rat Penile Erection, 18 J. Andrology 110 (1997); Park et al., Effects of Androgens on the Expression of Nitric Oxide Synthase nRNA in Rat Corpous Cavernosum, 83 BJU Int'l 327 (1999). Таким образом, тестостерон и другие андрогены явно играют роль в эректильной дисфункции. См. Lugg et al., The Role of Nitric Oxide in Erectile Function, 17 J. Andrology 2 (1995); Penson et al., Androgen and Pituitary Control of Penile Nitric Oxide Synthase and Erectile Function In the Rat, 55 Biology of Reproduction 576 (1996); Traish et al., Effects of Castration and Androgen Replacement on Erectile Function in a Rabbit Model, 140 Endocrinology 1861 (1999). Кроме того, восполнение тестостерона восстанавливает активность оксида азота. См. Baba et al., Delayed Testosterone Replacement Restores Nitric Oxide Synthase Containing Nerve Fibres and the Erectile Response in Rat Penis, BJU Int'l 953(2000); Garban et al., Restoration of Normal Adult Penile Erectile Response in Aged Rats by Long-Term Treatment with Androgens, 52 Biology of Reproduction 1365 (1995); Marin et al., Androgen et al., Androgen-dependent Nitric Oxide Release in Rat Penis Correlates with Levels of Constitutive Nitric Oxide Synthase Isoenzymes, 61 Biology of Reproduction 1012 (1999). Как описано здесь, адекватные уровни тестостерона в крови являются важными для эрекции. В одном варианте AndroGel® наносят на тело в соответствии с протоколом, суммированным в примере 1. Фармацевтическое средство для эректильной дисфункции принимают в соответствии с требованиями предписания. Например, препарат VIAGRA® обычно принимают за 20-40 мин перед коитусом в дозах 50 мг. Эта комбинация терапии особенно полезна в гипогонадотропных мужчинах, которые нуждаются в увеличенных уровнях тестостерона для оптимизации эффектов препарата VIAGRA® и сексуального переживания в целом. По существу, получают синергический эффект. AndroGel® предпочтительно наносят на тело в течение достаточного количества дней, так что достигаются стационарные уровни тестостерона. В примере, 10 мужчин в возрасте 18 лет и старше будут рандомизироваться для получения: (а) 5,0 г/день AndroGel® (доставляющие 50 мг/день тестостерона к коже, из которых абсорбируется приблизительно 10% или 5 мг) в течение 30 дней плюс 50 мг цитрата силденафила за 1 ч перед коитусом после по меньшей мере 1 дня терапии с AndroGel®; или (b) 10,0 г/день AndroGel® (доставляющие 100 мг/день тестостерона к коже, из которых абсорбируется приблизительно 10% или 10 мг) в течение 30 дней плюс 50 мг цитрата силденафила за 1 ч перед коитусом после по меньшей мере 1 дня терапии с AndroGel®; или (с) 5,0 г/день AndroGel® (доставляющие 50 мг/день тестостерона) в течение 30 дней и ничего перед коитусом. Либидо, эрекции и сексуальная активность будут исследоваться, как в предыдущих примерах. Заявитель ожидает, что все тестируемые параметры покажут улучшение с использованием этой комбинации. Пример 12. Способ лечения депрессивного состояния у субъекта. Восьминедельное рандомизированное контролируемое плацебо испытание трансдермального геля тестостерона (AndroGel®) проводили с 22 не поддающимися лечению депрессивными мужчинами с низкой или находящимися на пределе уровнями общего тестостерона (≤350 нг/дл). Гель тестостерона, добавляемый к имеющимся режимам и схемам приема антидепрессантов субъектов, оказался значимо превосходящим плацебо в антидепрессантной реакции по шкале HAM-D и CGI, хотя не по шкале BDI. Испытывали мужчин в возрасте 30-65 лет, принимающих в это время адекватную дозу антидепрессанта (как определено опубликованной информацией изготовителя) в течение, по меньшей мере, последних четырех недель, но все еще жалующихся на депрессивные симптомы, достаточные для удовлетворения критериям DSM-IV для текущего большого депрессивного нарушения. Субъектов сначала подвергали скринингу. Этот скрининг был спланирован таким образом, чтобы иметь тестостерон при дневном максимальном уровне (до 10 часов до полудня). Затем субъектов оценивали с использованием Структурированного Клинического Опросника на DSM-IV (SCID) для подтверждения диагноза текущего большого депрессивного нарушения. Затем субъектов оценивали с использованием Каталога симптомов Американской урологической ассоциации (AUA) на доброкачественную гиперплазию предстательной железы (ВРН), причем субъектов с оценкой в баллах, более высокой, чем 14, по этому показателю, исключали из исследования. Затем брали кровь для определения уровней общего тестостерона и PSA. - 73 - 007431 Мужчины, которые обнаруживали низкие или находящиеся на пределе нормального диапазона утренние уровни тестостерона (100-350 нг/дл; нормальный диапазон 270-1070 нг/дл) и нормальные уровни PSA (<1,5 нг/мл у мужчин в возрасте 30-39, <2,5 нг/мл у мужчин в возрасте 40-49, <3,5 нг/мл у мужчин в возрасте 50-59 и <4,0 нг/мл у мужчин в возрасте 60-54 лет) отбирали для оценки при помощи второго скрининга. Затем субъектов подвергали: 1) базовым демографическим вопросам; 2) остальной части опросника SCID; 3) вопросам в отношении истории предыдущего лечения с использованием антидепрессантов; 4) оценке по шкале HAM-D; 5) по шкале BDI; 6) по шкале Общего Клинического Впечатления (о больном) (CGI), 7) вопросам истории болезни; 8) физическому обследованию, включающему в себя признаки жизненности (энергичности), высоту, массу и пальцевое ректальное исследование предстательной железы; 9) лабораторным тестам на стандартные химию, гематологию, анализ мочи и серологию ВИЧ; 10) электрокардиограмме (ЭКГ) и 11) определению жира тела со специальными инструментами вместе с расчетом индекса не содержащей жира массы тела (FFMI), измерению мускулистости, ранее разработанному в лаборатории авторов. Субъектов исключали, если они обнаруживали 1) нарушение, касающееся применения любого вещества в пределах последнего года (или недозволенного анаболического стероида в любое время в их жизни); 2) текущие или имеющиеся в прошлом психотические симптомы; 3) историю биполярного нарушения; 4) любое отклонение от нормы при пальцевом ректальном обследовании или 5) присутствие другого клинически значимого медицинского заболевания на основании медицинской карты и физического обследования. Затем отобранные субъекты начинали однонедельное односторонне слепое вымывание с использованием геля плацебо. Всех субъектов просили продолжать прием прописанных им антидепрессантов вместе с любыми другими лекарственными средствами, которые им были прописаны, в их прописанной дозе на протяжении всего исследования. Базовая линия (Неделя 0): Субъектов оценивали для получения баллов по шкале HAM-D, BDI и в отношении CGI-тяжести болезни; неблагоприятных событий; симптомов жизненности (энергичности). Результаты из лабораторных тестов, производимых при скрининге, и результаты ЭКГ также просматривали. Субъектов исключали, если: а) они обнаруживали большее, чем 50%, улучшение по шкале HAM-D или BDI после обработки плацебо; или b) было обнаружено, что они имеют клинически значимое отклонение от нормы в лабораторных тестах или ЭГК. Затем субъектов рандомизировали для получения 10 граммов 1% геля тестостерона или плацебо ежедневно в течение 7 дней. Лекарственное средство и плацебо предоставляли в идентичных на вид пакетах, которые содержали либо 2,5 г AndroGel®, либо гель плацебо. Неделя 1: Субъектов оценивали на баллы по шкале HAM-D, BDI и CGI (как в отношении тяжести заболевания, так и в отношении улучшения в сравнении с базовой линией); на неблагоприятные события и симптомы жизненности (энергичности). У субъектов брали кровь на уровень общего тестостерона, по меньшей мере, через четыре часа после утреннего нанесения геля. Недели 2, 4, 6 и 8: Субъектов оценивали на 2, 4, 6 и 8 неделю по шкалам HAM-D, BDI, CGI, на неблагоприятные события и симптомы жизненности. На 8 неделю у субъектов дополнительно определяли PSA и проводили измерение массы и жира тела. Затем слепое проведение эксперимента прекращалось, и определяли точную идентичность приписывания обработки. Субъектов исключали перед неделей 8, если они: 1) добровольно хотели прекратить их участие в силу какой-либо причины; 2) проявляли неблагоприятное событие, оцениваемое исследователями как клинически значимое; или 3) не смогли соблюдать требования протокола. Статистический анализ: Характеристики базовой линии каждой группы сравнивали с использованием точного критерия Фишера для категоризованных переменных и t-критерия для непрерывных переменных. Определяли две популяции пациентов: (1) группу намеревающихся проводить лечение пациентов с по меньшей мере одним доступным измерением эффективности и (2) группу завершивших, определяемых как пациенты, которые завершали период 8-недельного лечения. Первичным определяемым протоколом анализом эффективности был рандомизированный регрессионный анализ повторных измерений, сравнивающий степень изменения баллов на шкалах HAM-D, BDI и CGI-тяжести во время периода лечения (обработки) между группами, с использованием способов, описанных Diggle et al. и Gibsons et al. Использовали модель для среднего значения полученной переменной, которая включала в себя выражения в виде обработки, времени и зависимости обработки от времени. Время моделировали в виде непрерывной переменной, причем недели находились в диапазоне от 0 (базовая линия) до 8 (после рандомизации). Измерением эффекта была зависимость обработки от времени (или различие в степени изменения на единицу времени, или различие в снижении относительно времени) измерения эффективности. Для поправки на корреляцию наблюдений в индивидуумах рассчитывали стандартные ошибки оценок параметров с использованием генерализованных уравнений оценок, с симметрией соединений в качестве рабочей ковариации, осуществляемой командой PROC GENMOD в программе SAS. В качестве вторичных анализов полученных измерений использовали два анализа изменения от базовой линии до конечной точки: 1) анализ намеревающихся проводить лечение с использованием последнего наблюдения, проводимый заблаговременно для всех субъектов, завершивших, по меньшей ме- 74 - 007431 ре, одну оценку после базовой линии, и (2) анализ завершивших с использованием всех субъектов, которые завершили период 8-недель рандомизированной обработки. Для сравнения различия между группами в изменении от базовой линии до конечной точки по шкале HAM-D, BDI и CGI-тяжести использовали t-критерий. Для лабораторных измерений, в том числе измерений жира тела и FFMI, использовали среднее различие между измерениями базовой линии и конечной точки и затем сравнивали группы обработки с использованием t-критерия. Коэффициенты корреляции рассчитывали с использованием проранжированных данных (ранговая корреляция Спирмана). Все статистические тесты были двусторонними с альфа=0,05. Внесение в списки исследования и прохождение участниками отбора: Средний возраст (SD) всех субъектов был 46,9 (9,2) лет (ранг 30-65); все 56 субъектов удовлетворяли критериям PSA и ВРН для описанного выше исследования. Уровни общего тестостерона мужчин, несмотря на то, что они измеряются около их суточного максимума, были явно низкими для их возрастного ранга (1,27), с медианой (интерквартильный ранг) только 376 (301, 477) нг/дл. Уровни общего тестостерона обратно коррелировали с возрастом, но лишь в слабой степени (ρ Спирмана = -0,25; Р = 0,06). Двадцать четыре (43,6%) субъекта обнаруживали уровни 350 нг/дл или менее. Уровень медианы их общего тестостерона базовой линии был 292 (266, 309) нг/дл. Всех остальных 22 субъекта рандомизировали при неделе 0. Из них 3 (14%) исключались во время последующего периода наблюдения, а 19 (86%) завершали полные 8 недель этого исследования (фигура № 33). Таблица 55. Демографические и клинические характеристики субъектов в - 75 - 007431 b - представляет оценку при базовой линии; все остальные переменные определены при скрининге. Характеристики базовой линии субъектов: 12 субъектов, рандомизированные по тестостерону, не отличались значимо от 10 рандомизированных для плацебо по их характерным признакам при скрининге (таблица 55), за исключением того, что субъекты группы плацебо были слегка тяжелее, чем субъекты группы тестостерона. Схемы приема антидепрессанта этих субъектов были SSRI (5 субъектов группы тестостерона, 8 субъектов группы плацебо), бупропион (2 из группы тестостерона), бупропион плюс SSRI (2 из группы плацебо), венлафаксин (3 из группы тестостерона), нефазодон (1 из группы тестостерона) и метилфенидат (1 из группы тестостерона). Анализы эффективности. Первичный анализ эффективности, включающий всех 22 субъекта с по меньшей мере одной оценкой полученных измерений, показал, что обработанные тестостероном пациенты имели значимо более высокую степень уменьшения оценок HAM-D, чем обработанные плацебо пациенты (фигура № 34). Это улучшение было очевидным как на подшкале вегетативных симптомов, так и на подшкале аффективных симптомов шкалы HAM-D (таблица 28). Тестостерон был также ассоциирован со значимо более высокими степенями уменьшения баллов CGI-тяжести (фигура № 35), хотя этого не было в случае оценок BDI (фигура № 36). Все данные по степени изменений суммированы в таблице 56. Анализы конечных точек давали сходные результаты, но со слегка меньшей статистической значимостью, чем лонгитюдный анализ. Таблица 56. Среднее изменение (SD) на полученных измерениях от базовой линии до конечной точки в группах обработки Общий балл а - последнее наблюдение, проводимое заблаговременно в качестве конечной точки; включает в себя всех субъектов, которые выполнили по меньшей мере один визит после базовой линии; b - неделя 8 в качестве конечной точки Среди завершивших полное исследование субъектов не было значимых различий между субъектами, получавшими тестостерон, и субъектами, получавшими плацебо, в процентах жира тела [-2,8 (1,7)% против -1,9 (2,6)%; t = 0,90, df = 17, р =0,38] или изменения в мышечной массе, выражаемой в виде FFMI [1,1 (0,9) против 0,6 (1,2)кг/м2; t = 1,03, df = 17, р = 0,32]. Средние уровни тестостерона на 1 неделю были 789 (519) нг/дл в группе тестостерона против 249 (68) нг/дл в группе плацебо (t = 3,26, df = 19, р = 0,004). Следует отметить, что 3 из 11 субъектов группы тестостерона обнаруживали увеличение ≤ 70 нг/дл в их уровнях общего тестостерона с этим гелем; те же самые субъекты обнаруживали также небольшое улучшение в депрессивных симптомах (изменения 0, 0 и 1, соответственно в CGI-тяжести при завершении исследования). Остальные 8 субъектов все достигали увеличения ≥ 200 нг/дл в уровнях тестостерона на 1 неделю; 4 (50%) из этих субъектов улучшали показатели на 2 балла или более по CGI-тяжести, в сравнении с ни одним из 10 субъектов, получавших плацебо (р = 0,023 по точному критерию Фишера, двухстороннему). Гель тестостерона был полезным в отношении психологических аспектов депрессии (таких как пункты депрессивного настроения, чувства вины и психологической тревожности по шкале HAM-D) почти в той же степени, что и в отношении соматических аспектов депрессии (таких как пункты шкалы HAM-D, включающие в себя сон, аппетит, либидо и соматические симптомы). Предварительные результаты предполагают, что в гораздо более низких дозах тестостерон может также вызывать антидепрессантные эффекты у женщин. - 76 - 007431 Содержимое всех цитируемых ссылок во всей заявке включено здесь специально в качестве ссылки. Практика данного изобретения будет использовать, если нет других указаний, общепринятые способы фармакологии и фармацевтики, которые находятся в рамках квалификации в данной области. Хотя данное изобретение было описано в отношении конкретных вариантов и примеров, должно быть понятно, что другие варианты, использующие идею данного изобретения, являются возможными без отклонения от объема данного изобретения. Данное изобретение определяется заявленными в формуле изобретения элементами и любыми и всеми модификациями, вариациями или эквивалентами, которые охватываются идеей и объемом, лежащими в основе принципов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения, предупреждения или уменьшения риска развития депрессивного нарушения у субъекта, нуждающегося в этом, предусматривающий введение эффективного в отношении депрессивного нарушения количества композиции на зону кожи субъекта для доставки стероида в путь синтеза тестостерона в сыворотку крови субъекта, где эта композиция включает в себя: (a) приблизительно 0,01% - приблизительно 70% стероида в пути синтеза тестостерона; (b) приблизительно 0,01% - приблизительно 50% усиливающего проникновение агента; (c) приблизительно 0,01% - приблизительно 50% загущающего агента и (d) приблизительно 30% - приблизительно 98% низшего спирта. где эта композиция способна высвобождать стероид после нанесения этой композиции на кожу при скорости и продолжительности, которые доставляют по меньшей мере приблизительно 10 мкг в день стероида в сыворотку крови данного субъекта; и проценты даны в виде массовых процентов относительно этой композиции. 2. Способ по п.1, где стероид в пути синтеза тестостерона содержит приблизительно 0,1% - приблизительно 10% тестостерона или его соли, сложного эфира, амида, энантиомера, изомера, таутомера, пролекарства или производного. 3. Способ по п.1, где стероид в синтетическом пути тестостерона содержит приблизительно 1% тестостерона или его соль, сложный эфир, амид, энантиомер, изомер, таутомер, пролекарство или производное. 4. Способ по п.2, где усиливающий проникновение агент содержит приблизительно 0,1% - приблизительно 5% изостеариновой кислоты, октановой кислоты, лаурилового спирта, этилолеата, изопропилмиристата, бутилстеарата, метиллаурата, диизопропиладипата, глицерилмонолаурата, тетрагидрофурфурилового спирта, простого эфира полиэтиленгликоля, полиэтиленгликоля, полипропиленгликоля, 2-(2этоксиэтокси)этанола, монометилового эфира диэтиленгликоля, простых алкилариловых эфиров полиэтиленоксида, простых монометиловых эфиров полиэтиленоксида, простых диметиловых эфиров полиэтиленоксида, диметилсульфоксида, глицерина, этилацетата, ацетоуксусного эфира, Nалкилпирролидона или терпена. 5. Способ по п.4, где усиливающий проникновение агент является изопропилмиристатом. 6. Способ по п. 2, где загущающий агент содержит приблизительно 0,1% - приблизительно 5% полиакриловой кислоты. 7. Способ по п. 6, где загущающий агент содержит приблизительно 0,9% полиакриловой кислоты. 8. Способ по п.6, где полиакриловая кислота является карбоксиполиметиленом. 9. Способ по п. 2, где низший спирт содержит приблизительно 45% - приблизительно 90% этанола или изопропанола. 10. Способ по п.2, где эта композиция содержит дополнительно приблизительно 0,1% - приблизительно 10% гидроксида натрия. 11. Способ по п.2, где эта композиция имеет массу, равную или меньшую чем приблизительно 100 г. 12. Способ по п.2, где эта композиция имеет массу приблизительно 1,0 г - приблизительно 10 г. 13. Способ по п.2, где эта композиция имеет массу приблизительно 2,5 г - приблизительно 7,5 г. 14. Способ по п.2, где эта композиция имеет массу приблизительно 5,0 г. 15. Способ по п.2, где эта композиция способна высвобождать тестостерон после нанесения этой композиции на кожу при скорости и продолжительности, которые обеспечивают циркулирующую сывороточную концентрацию тестостерона, большую чем приблизительно 400 нг тестостерона на децилитр сыворотки, во время периода времени, начиная от приблизительно 2 ч после введения и заканчивающегося через приблизительно 24 ч после введения. 16. Способ по п.15, где концентрация сывороточного тестостерона поддерживается между приблизительно 400 нг тестостерона на децилитр сыворотки и приблизительно 1050 нг тестостерона на децилитр сыворотки. 17. Способ по п.2, где на каждое нанесение приблизительно 0,1 г/день композиции на кожу у субъекта происходит увеличение, по меньшей мере, приблизительно на 5 нг/дл концентрации сывороточного тестостерона. - 77 - 007431 18. Способ по п.2, где эта композиция предоставляется субъекту для ежедневного введения в дозе приблизительно 0,1 г - приблизительно 10 г. 19. Способ по п.2, где количество композиции равно дозе 5 г, доставляющей приблизительно 5 мг приблизительно 500 мг тестостерона на кожу. 20. Способ по п.2, где количество композиции равно дозе 7,5 г, доставляющей приблизительно 7,5 мг - приблизительно 750 мг тестостерона на кожу. 21. Способ по п.2, где количество композиции равно дозе 10 г, доставляющей приблизительно 10 мг - приблизительно 1000 мг тестостерона на кожу. 22. Способ по п.2, где эта композиция предоставляется субъекту в одном или нескольких пакетах. 23. Способ по п.22, где пакет содержит полиэтиленовый вкладыш между композицией и внутренней поверхностью пакета. 24. Способ по п.2, где эта композиция предоставляется в виде отдельного компонента в наборе. 25. Способ по п.2, где субъект имеет концентрацию сывороточного тестостерона, меньшую чем приблизительно 300 нг/дл. 26. Способ по п.25, где после, по меньшей мере, приблизительно 30 дней ежедневного введения концентрация сывороточного тестостерона у субъекта равна, по меньшей мере, приблизительно 490 нг/дл - приблизительно 860 нг/дл. 27. Способ по п.25, где после, по меньшей мере, приблизительно 30 дней ежедневного введения общая концентрация сывороточных андрогенов у субъекта является большей чем приблизительно 372 нг/дл. 28. Способ по п.2, где эту композицию вводят один раз, два раза или три раза в день в течение, по меньшей мере, приблизительно 7 дней. 29. Способ лечения, предупреждения или снижения риска развития депрессивного нарушения у субъекта, нуждающемся в этом, предусматривающий введение этому субъекту: (a) количества композиции, содержащей (i) приблизительно 0,01% - приблизительно 70% стероида в пути синтеза тестостерона; (ii) приблизительно 0,01% - приблизительно 50% усиливающего проникновение агента; (iii) приблизительно 0,01% - приблизительно 50% загущающего агента и (iv) приблизительно 30% - приблизительно 98% низшего спирта, и (b) количества терапевтического агента, содержащего антидепрессант, ингибитор синтеза связывающего половые гормоны глобулина или эстрогенного гормона, где эта композиция вводится на зону кожи субъекта для доставки этого стероида в сыворотку крови субъекта и способна высвобождать этот стероид после нанесения этой композиции на кожу при скорости и продолжительности, которые доставляют, по меньшей мере, приблизительно 10 мкг в день стероида в сыворотку крови данного субъекта, и проценты даны в виде массовых процентов относительно этой композиции; и количество композиции и количество терапевтического агента вместе составляют эффективное в отношении депрессивного нарушения количество. 30. Способ по п.29, где стероид в пути синтеза тестостерона содержит приблизительно 0,1% - приблизительно 10% тестостерона или его соли, сложного эфира, амида, энантиомера, изомера, таутомера, пролекарства или производного. 31. Способ по п.29, где стероид в синтетическом пути тестостерона содержит приблизительно 1% тестостерон или его соль, сложный эфир, амид, энантиомер, изомер, таутомер, пролекарство или производное. 32. Способ по п.29, где усиливающий проникновение агент содержит приблизительно 0,1% - приблизительно 5% изостеариновой кислоты, октановой кислоты, лаурилового спирта, этилолеата, изопропилмиристата, бутилстеарата, метиллаурата, диизопропиладипата, глицерилмонолаурата, тетрагидрофурфурилового спирта, простого эфира полиэтиленгликоля, полиэтиленгликоля, полипропиленгликоля, 2-(2-этоксиэтокси)этанола, монометилового эфира диэтиленгликоля, простых алкилариловых эфиров полиэтиленоксида, монометиловых эфиров полиэтиленоксида, простых диметиловых эфиров полиэтиленоксида, диметилсульфоксида, глицерина, этилацетата, ацетоуксусного эфира, N-алкилпирролидона или терпена. 33. Способ по п.32, где усиливающий проникновение агент является изопропилмиристатом. 34. Способ по п.29, где загущающий агент содержит приблизительно 0,1% - приблизительно 5% полиакриловой кислоты. 35. Способ по п.34, где загущающий агент содержит приблизительно 0,9% полиакриловой кислоты. 36. Способ по п.34, где полиакриловая кислота является карбоксиполиметиленом. 37. Способ по п.29, где низший спирт содержит приблизительно 45% - приблизительно 90% этанола или изопропанола. 38. Способ по п.29, где эта композиция содержит дополнительно приблизительно 0,1% - приблизительно 10% гидроксида натрия. 39. Способ по п.29, где эта композиция и терапевтический агент обеспечены в виде отдельных компонентов в наборе. - 78 - 007431 40. Способ по п.29, где эту композицию и терапевтический агент вводят, по существу, одновременно или последовательно. 41. Способ по п.29, где терапевтический агент вводят перорально, чрескожно, внутривенно, внутримышечно или прямой абсорбцией через ткань слизистой оболочки. 42. Фармацевтическая композиция для введения в кожу субъекта, содержащая: (i) приблизительно 0,01% - приблизительно 70% стероида в пути синтеза тестостерона; (ii) приблизительно 0,01% - приблизительно 50% усиливающего проникновение агента; (iii) приблизительно 0,01% - приблизительно 50% загущающего агента и (iv) приблизительно 30% - приблизительно 98% низшего спирта, и (v) терапевтический агент, содержащий антидепрессант, ингибитор синтеза связывающего половые гормоны глобулина или эстрогенный гормон; и где эта композиция может быть введена на зону кожи субъекта для доставки стероида в пути синтеза тестостерона и терапевтического агента в сыворотку крови субъекта и способна высвобождать этот стероид после нанесения этой композиции на кожу при скорости и продолжительности, которые доставляют, по меньшей мере, приблизительно 10 мкг в день стероида в сыворотку субъекта, и проценты даны в виде массовых процентов относительно этой композиции; и количество стероида и количество терапевтического агента вместе составляют эффективное в отношении депрессивного нарушения количество. Фиг. 1(a) Фиг. 1(b) Фиг. 1(c) - 79 - 007431 Фиг. 1(d) Фиг. 1(e) Фиг. 1(f) Фиг. 1(g) - 80 - 007431 Фиг. 1(h) Фиг. 2(a) Фиг. 2(b) Фиг. 2(c) - 81 - 007431 Фиг. 2(d) Фиг. 2(e) Фиг. 2(f) Фиг. 2(g) - 82 - 007431 Фиг. 3 Фиг. 4 Фиг. 5 Фиг. 6 - 83 - 007431 Фиг. 7 Фиг. 8(a) Фиг. 8(b) Фиг. 8(c) - 84 - 007431 Фиг. 8(d) Фиг. 9(a) Фиг. 9(b) Фиг. 9(c) - 85 - 007431 Фиг. 9(d) Фиг. 10(a) Фиг. 10(b) Фиг. 10(c) - 86 - 007431 Фиг. 11(a) Фиг. 11(b) Фиг. 11(c) Фиг. 12(a) - 87 - 007431 Фиг. 12(b) Фиг. 12(c) Фиг. 12(d) Фиг. 12(e) - 88 - 007431 Фиг. 12(f) Фиг. 12(g) Фиг. 12(h) Фиг. 13(a) - 89 - 007431 Фиг. 13(b) Фиг. 13(e) Фиг. 13(d) Фиг. 13(e) - 90 - 007431 Фиг. 13(f) Фиг. 13(g) Фиг. 14 Фиг. 15 - 91 - 007431 Фиг. 16 Фиг. 17 Фиг. 18 Фиг. 19(a) - 92 - 007431 Фиг. 19(b) Фиг. 19(c) Фиг. 19(d) Фиг. 20(a) - 93 - 007431 Фиг. 20(b) Фиг. 20(c) Фиг. 20(d) Фиг. 21(a) - 94 - 007431 Фиг. 21(b) Фиг. 22 Фиг. 23 Фиг. 24 - 95 - 007431 Фиг. 25 Фиг. 26 Фиг. 27 Фиг. 28(a) - 96 - 007431 Фиг. 28(b) Фиг. 28(c) Фиг. 29(a) Фиг. 29(b) - 97 - 007431 Фиг. 29(c) Фиг. 30(a) Фиг. 30(b) Фиг. 31(a) - 98 - 007431 Фиг. 31(b) Фиг. 32(a) Фиг. 32(b) Фиг. 32(c) - 99 - 007431 Фиг. 32(d) Фиг. 33 Фиг. 34 - 100 - 007431 Фиг. 35 Фиг. 36 Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 101 -