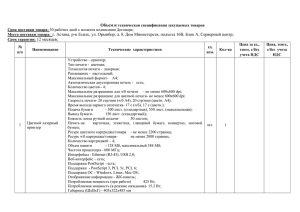
Федеральное государственное бюджетное научное учреждение «Научно-исследовательский институт комплексных проблем
advertisement

Федеральное государственное бюджетное научное учреждение «Научно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний» На правах рукописи Севостьянова Виктория Владимировна РОЛЬ СОСУДИСТОГО ЭНДОТЕЛИАЛЬНОГО ФАКТОРА РОСТА, ИНКОРПОРИРОВАННОГО В ПОЛИКАПРОЛАКТОНОВЫЕ ГРАФТЫ, В ФОРМИРОВАНИИ НОВОГО СОСУДА НА МЕСТЕ ИМПЛАНТАЦИИ 14.03.03 - патологическая физиология Диссертация на соискание ученой степени кандидата медицинских наук Научный руководитель: д-р мед. наук, Головкин Алексей Сергеевич д-р мед. наук, профессор Эльгудин Яков Львович Кемерово – 2015 2 ОГЛАВЛЕНИЕ ВВЕДЕНИЕ ................................................................................................................. 4 ГЛАВА 1 ВОЗМОЖНОСТИ ИСПОЛЬЗОВАНИЯ МОЛЕКУЛ VEGF ДЛЯ УЛУЧШЕНИЯ РЕГЕНЕРАЦИИ КРОВЕНОСНОГО СОСУДА НА ОСНОВЕ ТКАНЕИНЖЕНЕРНОГО ГРАФТА (ОБЗОР ЛИТЕРАТУРЫ) .. 11 1.1 Сосудистые графты малого диаметра ............................................................. 11 1.2 Реакция тканей на имплантируемый биоматериал и процесс восстановления тканей ......................................................................................................................... 17 1.3 Использование биосовместимых графтов для регенерации кровеносного сосуда in situ ............................................................................................................... 21 1.4 VEGF и его роль в ангиогенезе........................................................................ 27 1.5 Применение VEGF в тканевой инженерии кровеносных сосудов .............. 33 ГЛАВА 2 МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ ........................... 39 2.1 Изготовление сосудистых PCL графтов и PCL графтов, содержащих VEGF .. 39 2.2 Физико-механические испытания сосудистых графтов ................................. 40 2.3 Сканирующая электронная микроскопия поверхности сосудистых графтов .. 42 2.4 Кинетика выхода ростового фактора из PCL с VEGF графтов ...................... 42 2.5 Определение биологической активности VEGF после выхода из PCL графта in vitro ......................................................................................................................... 43 2.6 Культивирование эндотелиальных и мезенхимальных стволовых клеток на графтах ....................................................................................................................... 44 2.7 Внутрибрюшная имплантация PCL графтов и PCL графтов с VEGF ........... 45 2.8 Имплантация сосудистых графтов из PCL и PCL с VEGF в брюшную часть аорты крысы ............................................................................................................... 47 2.9 Статистические методы ...................................................................................... 48 ГЛАВА 3 ФИЗИКО-МЕХАНИЧЕСКИЕ СВОЙСТВА И МОРФОЛОГИЯ ПОЛИМЕРНЫХ СОСУДИСТЫХ ГРАФТОВ, ИЗГОТОВЛЕННЫХ МЕТОДОМ ЭЛЕКТРОСПИННИНГА ............................................................... 49 3 3.1 Зависимость свойств PCL графтов от параметров электроспиннинга .......... 49 3.2 Влияние инкорпорирования VEGF в PCL на структуру и прочностные свойства сосудистого графта ................................................................................... 56 ГЛАВА 4 ВЛИЯНИЕ VEGF НА БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ PCL ГРАФТА .................................................................................................................... 62 4.1 Определение выхода молекул VEGF из PCL графтов и их биоактивности . 62 4.2 Оценка влияния молекул VEGF на способность PCL графтов адгезировать клетки in vitro ............................................................................................................. 68 ГЛАВА 5 ОСОБЕННОСТИ ВОССТАНОВЛЕНИЯ ТКАНЕЙ НА ОСНОВЕ PCL ГРАФТА ПОД ВЛИЯНИЕМ VEGF ........................................................... 78 5.1 Изучение реакции тканей на PCL графт после введения ростового фактора в эксперименте in vivo ................................................................................................. 78 5.2 Формирование кровеносного сосуда на основе имплантированного PCL графта с VEGF ........................................................................................................... 88 ЗАКЛЮЧЕНИЕ ..................................................................................................... 101 ВЫВОДЫ ................................................................................................................ 108 СПИСОК ИСПОЛЬЗУЕМЫХ СОКРАЩЕНИЙ ............................................ 110 СПИСОК ЛИТЕРАТУРЫ ................................................................................... 112 4 ВВЕДЕНИЕ Актуальность темы исследования Артериальные реконструкции являются главным и наиболее действенным методом лечения заболеваний, связанных со значительным поражением коронарных и периферических кровеносных сосудов, но все же относятся к симптоматическим видам лечения и в большинстве случаев позволяют добиться лишь временного реваскуляризирующего эффекта [2]. Кроме того, существует дефицит аутотрансплантатов, которые используются в качестве золотого стандарта для проведения шунтирующих операций [168]. В связи с этим поиск альтернативного сосудистого имплантата привел к активному использованию для его создания подходов тканевой инженерии. Основной целью сосудистой тканевой инженерии является создание полноценного кровеносного сосуда из клеток пациента in vitro – в биореакторе, имитирующем физиологические условия, или in situ – непосредственно в месте имплантации [215]. Практически во всех случаях в качестве основы для формирования сосудов изготовленный из происхождения. выступает тканеинженерный биоматериалов Сосудистые природного графты имеют пористый или/и графт, синтетического архитектуру сходную с внеклеточным матриксом и выполняют опорную и трофическую функцию для клеток, что способствует формированию тканей [83]. Многообещающие результаты по разработке и исследованию тканеинженерных графтов отражают высокий терапевтический потенциал данного подхода. Тем не менее, прогрессу в данной области существенно мешают нежелательные особенности взаимодействия между клетками и биоматериалом, которые в ряде случаев приводят к хроническому воспалению, неконтролируемой клеточной пролиферации и фиброзу. Подобные реакции на биоматериал практически невозможно устранить с помощью лекарственных препаратов [103]. Однако, решение данной проблемы может заключаться не в подавлении клеточного 5 ответа на имплантат, а в направлении воспалительной реакции в сторону регенеративного процесса. Степень разработанности темы исследования В ряде исследований было показано, что процесс восстановления тканей можно регулировать с помощью биологически активных молекул [157, 189, 203]. Также было установлено, что среди биомолекул, которые могли бы способствовать формированию тканей кровеносного сосуда, наиболее перспективными являются ростовые факторы, стимулирующие ангиогенез [82, 144, 161]. Классическим представителем ангиогенных молекул является сосудистый эндотелиальный фактор роста (vascular endothelial growth factor, VEGF), обладающий высокой специфичностью к эндотелиальным клеткам, стимулирующий их миграцию и пролиферацию, что может способствовать образованию эндотелиального слоя, который препятствует тромбообразованию, моделирует поток крови и сосудистое сопротивление, регулирует иммунные и воспалительные реакции [111]. Ранее была показана эффективность некоторых способов иммобилизации VEGF на графтах для осуществления его локальной доставки, такие как ковалентное и электростатическое связывание с поверхностью [49, 58, 95]. Однако до сих пор не разработаны сосудистые графты, обеспечивающие пролонгированный выход VEGF в место имплантации. В связи с этим отсутствует однозначное представление о роли этого ростового фактора в патогенезе воспалительной реакции на имплантируемый биоматериал и в формировании тканей кровеносного сосуда при имплантации графта в артериальное русло. Цель исследования: оценить патогенетическую роль сосудистого эндотелиального фактора роста, инкорпорированого в поликапролактона, в формировании нового кровеносного сосуда. графт из 6 Задачи исследования 1. Определить оптимальные физико-механические свойства и морфологию графта из поликапролактона с инкорпорированным сосудистым эндотелиальным фактором роста для создания структуры, максимально идентичной межклеточному матриксу. 2. Изучить влияние высвобождаемого из структуры графта сосудистого эндотелиального фактора роста на процессы адгезии и пролиферации эндотелиальных и мезенхимальных стволовых клеток in vitro. 3. Изучить особенности воспалительной реакции и ангиогенеза в условиях пролонгированной доставки сосудистого эндотелиального фактора роста при перитонеальной имплантации графтов из поликапролактона. 4. Определить патогенетическую и саногенетическую значимость пролонгировано высвобождаемого из поликапролактонного графта сосудистого эндотелиального фактора роста при имплантации в инфраренальный отдел аорты крыс. Научная новизна исследования Показано, что инкорпорирование сосудистого эндотелиального фактора роста в структуру графта из поликапролатона по разработанной технологии сопровождается патогенетически незначимым изменением физико- механических свойств материала и сохранением морфологии, наиболее соответствующей межклеточному матриксу, что в совокупности обеспечивает необходимое физиологическое взаимодействие с клетками организма и способствует регенерации тканей. Установлено, что сосудистый эндотелиальный фактор роста пролонгированно высвобождается из разработанных поликапролактонных графтов с сохранением биологической активности в течение нескольких месяцев и способствует адгезии и пролиферации клеток, участвующих в регенерации кровеносного сосуда, на поверхности матриксов. 7 Экспериментально установлена патогенетическая значимость длительной непрерывной доставки сосудистого эндотелиального фактора роста, заключающаяся в усилении ангиогенеза на поликапролактонных матриксах. Доказана возможность использования графта из поликапролактона с инкорпорированным сосудистым эндотелиальным фактором роста в качестве временного протеза сосуда, который заселяется клетками, синтезирующими компоненты межклеточного вещества, и по мере деградации замещается тканями кровеносного сосуда. Установлено, что при имплантации в кровеносное русло графта из поликапролактона инкорпорированный сосудистый эндотелиальный фактор роста стимулирует ангиогенез в стенке протеза и сохраняет его проходимость, снижая тромбообразование. Теоретическая и практическая значимость работы Определены оптимальные параметры графта из поликапролактона с инкорпорированными молекулами сосудистого эндотелиального фактора роста для выполнения роли временного межклеточного матрикса. Доказана эффективность использования сосудистого эндотелиального фактора роста для усиления адгезии и пролиферации клеток на поверхности графтов из поликапролактона, стимуляции ангиогенеза в их стенках, снижения тромбообразования и улучшения проходимости. Полученные результаты являются основой для разработки эффективных методов стимуляции ангиогенеза с использованием биодеградируемых графтов. Методология и методы исследования Для достижения цели исследования изготовлены сосудистые графты из поликапролактона методом электроспиннинга, а также графты, содержащие сосудистый эндотелиальный фактор роста, проведены их физико-механические испытания и сканирующая электронная микроскопия поверхности. Для оценки высвобождения сосудистого эндотелиального фактора роста, его биологической 8 активности и влияния на регенерацию тканей проведены культуральные работы, имплантация графтов интраперитонеально и в брюшную часть аорты крыс, а также гистологические и гистохимические исследования эксплантированных образцов. Основные положения, выносимые на защиту 1. Графты из поликапролактона обладают физико-механическими свойствами и морфологией, характерными для межклеточного матрикса. Инкорпорирование молекул сосудистого эндотелиального фактора роста в графт из поликаролактона приводит к незначительному снижению прочности и эластичности материала с сохранением пористой структуры. Пролонгированное высвобождение сосудистого эндотелиального фактора роста обеспечивает адгезию эндотелиальных и мезенхимальных стволовых клеток и стимулирует пролиферацию эндотелиальных клеток в условиях in vitro. 2. Графт из поликапролактона с инкорпорированным сосудистым фактором роста при перитонеальной имплантации вызывает воспалительную реакцию тканей, типичную для биосовместимых материалов. Выделяемый сосудистый эндотелиальный фактор роста стимулирует ангиогенез в пористом полимерном материале. Поликапролактонный графт с сосудистым эндотелиальным фактором роста, имплантированный в артериальное русло крысы, заселяется клетками, ростовой фактор обеспечивает васкуляризацию стенки графта и улучшение его проходимости. Степень достоверности результатов О достоверности результатов диссертационного исследования свидетельствуют достаточно представительный объем экспериментального материала, широкий спектр проведенных лабораторных исследований, неоднократно повторенные испытания in vitro, использование современных методов исследования и статистической обработки полученных результатов. Автор непосредственно участвовала в получении исходных данных. 9 Апробация материалов диссертации Результаты настоящего исследования были доложены и обсуждены на Международном молодежном научном форуме «Ломоносов-2011» (11-15 апреля 2011, г. Москва), Инновационном конвенте «Кузбасс: образование, наука, инновации» (19-20 ноября 2011, г. Кемерово), Всероссийской научнопрактической конференции «Актуальные проблемы лабораторной диагностики и биотехнологии» (13-14 сентября 2012, г. Кемерово), Инновационном конвенте «Кузбасс: образование, наука, инновации» (22-23 ноября 2012, г. Кемерово), 1-ом Национальном конгрессе по регенеративной медицине (4-6 декабря 2013, г. Москва), Научной школе молодых ученых «Современная биология и биотехнологии будущего» (26 января - 1 февраля 2014, г. Москва), VII Всероссийском съезде трансплантологов (28-30 мая 2014, г. Москва). Публикации По материалам диссертации опубликовано 14 печатных работ, из них 2 в изданиях, рекомендованных ВАК для опубликования материалов диссертаций на соискание ученой степени. Получен 1 патент. Объем и структура диссертации Диссертация объемом 134 страницы печатного текста, написана на русском языке, состоит из введения, обзора литературы, описания материала и методов исследования, 3 глав результатов исследования и их обсуждения, заключения, выводов и практических рекомендаций. Диссертация содержит 2 таблицы, иллюстрирована 24 рисунками. Указатель использованной литературы содержит 5 работ отечественных и 219 работ иностранных авторов. Личный вклад автора Анализ литературы по теме диссертации, изготовление сосудистых графтов методом электроспиннинга, проведение исследований in vitro с использованием культуральных методов, эксперименты на лабораторных 10 животных, оценка результатов и статистическая обработка данных, написание диссертации и статей выполнены лично автором. Исследования физикомеханических свойств и морфологии графтов, имплантация графтов в аорту крыс, а также гистологические анализы проведены совместно с сотрудниками НИИ КПССЗ: канд. биол. наук Т. В. Глушковой, канд. мед. наук Д. Е. Филипьевым, канд. мед. наук А. Ю. Бураго и мл. науч. сотр. Г. Ю. Васюковым. 11 ГЛАВА 1 ВОЗМОЖНОСТИ ИСПОЛЬЗОВАНИЯ МОЛЕКУЛ VEGF ДЛЯ УЛУЧШЕНИЯ РЕГЕНЕРАЦИИ КРОВЕНОСНОГО СОСУДА НА ОСНОВЕ ТКАНЕИНЖЕНЕРНОГО ГРАФТА (ОБЗОР ЛИТЕРАТУРЫ) 1.1 Сосудистые графты малого диаметра Традиционным способом лечения заболеваний, связанных со значительным поражением коронарных и переферических артерий, является хирургическое вмешательство с имплантацией биологических или синтетических протезов. Золотым стандартом для хирургического лечения заболеваний сосудов малого диаметра на сегодняшний день является использование аутотрансплантатов. В качестве аутотрансплантатов наиболее часто применяют подкожную вену, а также грудную и лучевую артерии [181]. Однако использование аутологичных вен и артерий в большинстве случаев приводит к повторным операциям, связанным с деструктивными изменениями и окклюзией шунтов в течение 10 лет после имплантации. Кроме того, около 30% пациентов не обладают подходящими для трансплантации венами или артериями в результате уже перенесенных операций, либо других заболеваний [2, 182]. Потребность в альтернативной замене аутотрансплантатов привела к появлению биологических и синтетических протезов. Сосудистые протезы в отличие от клапанов сердца, имеющих ксеногенное происхождение, используются гораздо реже. Дело в том, что глютаральдегид, применяемый для консервации биологического материала, негативно влияет на последующую эндотелизацию внутренней поверхности протеза [98]. Для улучшения их биосовместимости осуществляют тщательную децеллюляризацию биоматериала. Кроме того, для этих целей возможно проведение генетической модификации тканей, либо временной иммуносупрессии [184]. Снижение 12 тромбогенности сосудистых биопротезов отмечается при связывании на внутренней поверхности имплантата молекул гепарина [133]. Относительно неплохие результаты клинического применения демонстрируют ксенопротезы, обработанные диглицидиловым эфиром этиленгликоля (диэпоксид). Исследование в отдаленный период эпоксиобработанных протезов в бедренноподколенно-берцовой позиции показало, что их проходимость в сроки до 6 месяцев, 3 и 7 лет составила 76,8%, 45,9% и 29,3%, соответственно. При этом в качестве осложнений преобладали тромбозы, а также неоинтимальные стенозы в зоне анастомозов [1]. В свою очередь, для реконструкции кровеносных сосудов достаточно широко применяются протезы из синтетических материалов. Наиболее известными являются трансплантаты из полиэтилентерефталата (polyethylene terephthalate, PET – Dacron) и политетрафторэтилена (polytetrafluoroethylene, PTFE – Teflon) [52]. Однако, данные графты демонстрируют свою эффективность при протезировании сосудов большого диаметра (>6 мм) с высокой скоростью кровотока. Клиническое же применение синтетических протезов для аортокоронарного шунтирования с использованием графтов малого диаметра (<5мм) привело к негативным последствиям. Низкая проходимость трансплантатов Dacron и Teflon в реконструкции артерий малого диаметра обусловлено низкой скорость кровотока в данных сосудах, что приводит к тромбозу и гиперплазии неоинтимы в зоне анастомоза. Во избежание подобных осложнений требуется проведение длительной антикоагулянтной терапии пациента [42]. Также многообещающими материалами для изготовления синтетических протезов являются полиуретаны, благодаря их тромборезистентности, способности препятствовать гиперплазии неоинтимы, а также стимулировать рост тканей вокруг имплантата [62]. Тем не менее, их клиническое применение ограничено низкой биологической стабильностью. В результате этого стали развиваться подходы по преодолению этого недостатка, например, улучшение стабильности протеза из полиуретанов с помощью поликарбонатного сегмента [40, 101]. 13 Ограничения в использовании сосудистых аутотрансплантатов, а также низкая эффективность синтетических протезов малого диаметра способствовали возникновению тканеинженерных подходов к искусственному созданию кровеносных сосудов. Первые попытки использовать прогресс клеточной биологии в сосудистой хирургии были осуществлены в 1970х годах. Mansfield предложил покрывать внутреннюю поверхность сосудистых графтов эндотелиальными клетками с целью снижения тромбогенности синтетического материала [124]. В последующем такие подходы к модификации синтетических протезов как покрытие внутренней поверхности эндотелиальными клетками, миофибробластами, клетками предшественниками, а также гепарином и полярными фосфолипидами продемонстрировали в экспериментальных и в клинических испытаниях, что использование биологического компонента приводит к улучшению проходимости графтов [106, 184]. Однако, даже после модификации протеза остается опасность осложнений, связанных с реакцией тканей на синтетический материал, которая может приводить к воспалению, стенозам или инфицированию. На решение данных проблем направлена разработка тканеинженерных кровеносных сосудов. Главной целью сосудистой тканевой инженерии является создание жизнеспособного графта, со свойствами аналогичными нативным сосудам [165]. Для изготовления тканеинженерного сосудистого графта преимуществено применяют эндотелиальные и гладкомышечные клетки, а также фибробласты пациента или донора [147]. Наибольшее предпочтение отдается аутологичным клеткам, так как аллогенные могут быть причинной иммунной реакции и отторжения трансплантата [131]. До недавнего времени в большей части работ выделенные использовали дифференцированные аутологичные из тканей, из зрелых например сегмента клетки, вены. Дифференцированные клетки уже обладают специальными функциями, но существует ряд сложностей, связанных с их выделением и низкой пролиферативной активностью, что приводит к увеличению времени клеточной 14 экспансии [170]. Также проблемой является низкая жизнеспособность клеток у пожилых пациентов с сердечно-сосудистыми заболеваниями [33]. В результате чего поиск альтернативных клеток для тканевой инженерии привел к использованию стволовых клеток, а именно гемопоэтических клеток, мезенхимальных стволовых клеток и предшественников эндотелиальных клеток. Данные клетки более доступны для выделения, так как их источниками является аспират костного мозга, кровь, пуповина, жировая ткань, полученная при липосакции, а также пуповина [22, 79, 141, 174]. Независимо от того, какой источник клеток используется, в подходах тканевой инженерии сосудов можно выделить технологию самосборки клеточных пластов, а также создание графтов на основе матриксов. Технология самосборки позволяет изготавливать тканевые пласты, состоящие из комплекса клеток и внеклеточного матрикса с механическими свойствами природного коллагена. Для этого фибробласты культивируют в среде, обогащенной аскорбиновой кислотой для стимуляции синтеза коллагена I типа [201]. После выработки достаточного количества внеклеточного вещества пласты последовательно скручивают в трубчатую конструкцию с помощью мандрела. После нескольких дней созревания внутреннюю поверхность полученного сосудистого графта эндотелизируют. В результате чего образуется три слоя: функциональный эндотелий, посаженный на «внутреннюю» мембрану, «медия», изготовленная из гладкомышечных клеток, а также «адвентиция» из живых фибробластов кожи [8]. «Внутреннюю мембрану» изготавливают путем нанесения фибробластов на цилиндрическую опору и культивируют до формирования гомогенной ткани. Затем полученную ткань децеллюляризируют. Роль внутренней мембраны заключается в предотвращении миграции гладкомышечный клеток в просвет графта и последующей гиперплазии неоинтимы. Сосудистые ткани, изготовленние с помощью технологии самосборки, как правило содержать в своем строении белки, подобные нативным тканям, включая коллаген I, III и IV типов, фибронекин, ламинин и хондроитин сульфаты. В экспериментах на иммуносупрессивных макаках такие графты в 15 течение 8 недель демонстрировали механическую стабильность, отсутствие аневризм и повреждений, сохранение проходимости, а также повторную эндотелизацию внутренней мембраны [7]. Кроме того, обнадеживающие результаты продемонстрировали клинические испытания данных графтов в качестве артериовенозного шунта для гемодиализа у пациентов в терминальной стадии почечной недостаточности [91, 183]. Также существенные успехи были достигнуты в тканевой инженерии кровеносных сосудов с использованием матриксов, или так называемых подложек. Матрикс представляет собой трехмерный каркас, который обеспечивает структурную поддержку при развитии ткани и влияет на клеточные функции, такие как адгезия, дифференцировка, миграция, пролиферация и секреция компонентов внеклеточного вещества [202]. Важной характеристикой тканеинженерных подложек является пористость материала, которая способствует миграции клеток, передачи сигналов, доставке питательных веществ и удалению продуктов метаболизма [27, 156]. Кроме того, матриксы могут обладать биостабильностью для обеспечения длительной механической поддержки, либо деградировать со скоростью эквивалентной скорости тканевой регенерации. Оба типа матриксов могут быть изготовлены как из природных, так и из синтетических материалов. Среди природных материалов чаще всего используют компоненты внеклеточного вещества, таких как коллаген, фибрин, эластин [104, 142, 154]. В ряде исследований было показано успешное применение как отдельных белков, так и их комбинаций, а также использование в качестве подложки внеклеточного матрикса, полученного децеллюляризацией алло- и ксенотрансплантатов [13, 145 200]. Децеллюляризированный внеклеточный матрикс сохраняет сложные взаимодействия между своими структурными компонентами, которые очень трудно воспроизвести из отдельных природных и синтетических полимеров in vitro. Это обеспечивает необходимую поддержку клеткам для формирования ткани. Однако, децеллюляризированные матриксы в некоторых случаях при 16 неполном удалении клеток могут вызывать иммунный ответ с последующими отторжением графта [45]. Графты, изготовленные из природных полимеров, наиболее биосовместимы, а также способны поддерживать прикрепление клеток, их рост, дифференцировку, и функционирование в организме после имплантации [215]. Тем не менее, данные материалы имеют недостатки, связанные с невозможность контролилировать их деградацию, а также с недостаточной прочностью и эластичностью. Так имплантация в заднюю полую вену кроликов сосудистых графтов из очищенного коллагена, предварительно засеянных клетками, показала хорошую интеграцию материала в нативные ткани, но также и быструю потерю прочности [88]. В свою очередь, синтетические полимеры, как правило, обладают хорошими механическими свойствами, а также позволяют контролировать скорость деградации изготовленных из них изделий. Наиболее широко в тканевой инженерии сосудов используются полиэфиры на основе гликолиевой и молочной кислот, и их сополимеры, а также полиуретаны [134, 202]. В 2001 группа японских ученых во главе с Shin'oka впервые выполнила реконструкцию легочной артерии у четырехлетней пациентки с использованием тканеинженерного сосудистого графта. Сосудистый графт представлял собой сетку из полигликолиевой кислоты, покрытой сополимером поликапролатона и полимолочной кислоты, с предварительно посаженными in vitro аутологичными клетками, которые были полученны биопсией периферической вены. Через 7 месяцев после имплантации на графте не было выявлено ни стенотических проявлений, ни аневризм [165]. Для равномерного заселения матриксов клетками, а также для формирования функционирующей ткани необходима динамическая среда культивирования. Создание физиологических условий осуществляется с использованием биореакторов, которые имитируют действие гемодинамических сил на формирующийся кровеносный сосуд [28]. 17 Основным ограничением в клиническом использовании полноценных сосудисты графтов, выращенных в биореакторе, является длительность в их изготовлении. Это делает невозможным их использование при необходимости проведения срочных операций. В связи с этим некоторые из недавно проведенных исследований были посвящены возможности формирования кровеносного сосуда на основе биодеградируемых графтов in vivo. Хорошие прочность, эластичность, а также эндотелизацию после имплантации в кровеносное русло крыс продемонстрировали графты из поликапролактона (polycaprolactone (PCL)), его комбинации с полигликолиевой и полимолочной кислотой, а также PCL графты, покрытые полиглицерол себакатом [30, 55, 221]. Тем не менее, в долгосрочных исследованиях было показано развитие гиперплазии неоинтимы в данных графтах, а также их недостаточная регенерация [119]. 1.2 Реакция тканей на имплантируемый биоматериал и процесс восстановления тканей Основная часть тканеинженерных конструкций кровеносных сосудов и других органов имеет в своем составе компоненты, изготовленные из природных или синтетических биоматериалов [44]. Известно, что имплантация в организм любого материала неаутологичного происхождения приводит к возникновению воспалительной реакции с последующим репаративным процессом [148]. Интенсивность воспалительного ответа и его продолжительность может оказывать влияние на долговечность и фукционирование имплантата, а в случае с тканеинженерными органами и на регенерацию тканей. Для изготовления тканеинженерных графтов используют биосовместимые материалы, которые в отличие от биоактивных вызывают слабую тканевую реакцию. Следует 18 отметить, что не существует полностью интактных материалов, которые бы не вызывали реакции тканей [4]. Имплантация в организм биосовместимого материала индуцирует неспецифическую адсорбцию на его поверхности белков крови и тканевой жидкости [159]. При этом степень реакции тканей на инородное тело напрямую зависит от свойств имплантата, а именно морфологии, пористости, шероховатости, формы, размера, стерильности и химического состава. Кроме того, большое значение имеет место имплантации и иммуногенность материала [31]. В результате имплантации в организм любого материала происходит повреждение ткани, которое запускает каскад процессов воспаления и регенерации или репарции, характерных для типичной реакции на инородное тело. В воспалительной реакции выделяют начальную острую фазу и последующую хроническую [127]. Острая фаза длиться от нескольких часов до нескольких дней и сопровождается некрозом клеток ткани с выделением из них токсических продуктов, вазоактивных и хемоатаксических веществ, которые вызывают расширение и повышение проницаемости капилляров. В результате повышения проницаемости кровеносных сосудов для жидкой части крови и высвобождения ряда цитокинов развивается отек, а также нейтрофильная реакция в зоне повреждения. В острую фазу также происходит формирование временного внеклеточного матрикса, который состоит преимущественно из фибрина и содержит компоненты гранул тромбоцитов (тромбоспондин, TGF-α, TGF-β, PDGF, фактор тромбоцитов 4 и тромбоцитарный фактор роста эндотелиальных клеток). Временный матрикс играет роль структурного и биохимического компонентов, обеспечивая адсорбцию белков, способствующих прикреплению и миграции клеток. Кроме того он участвует в регуляции в различных клеточных процессов [129]. В дальнейшем в очаг воспадения проникают моноциты, которые дифференцируются в макрофаги. Они фагоцитируют продукты распада тканей и имплантируемый материал, а также формируют барьеры, которые 19 отграничивают имплантат, что предшествует образованию грануляционной ткани, состоящей из макрофагов, фибробластов и капилляров. В дальнейшем грануляционная ткань заменяется внеклеточным матриксом, синтезированным фибробластами. Кроме того с их помощью формируется соединительнотканная капсула вокруг инородного тела [4, 16]. Постоянная или рецидивирующая воспалительная реакция приводит к хроническому воспалению [127]. Эта фаза как правило характеризуется наличием моноцитов, макрофагов и лимфоцитов, активным ростом кровеносных сосудов и фиброзированием. Кроме того некоторые авторы делают акцент на том, что из-за особенностей взаимодействия между материалом и организмом формирование грануляционной ткани и ее созревание является частью реакции на относительно биосовместимый материал и отличается от хронического воспаления [16]. Последний стадией в репаративном процессе является образование соединительной ткани и фиброзной капсулы [193]. Однако, могут быть случаи, когда соединительнотканная капсула не образуется, например при инфильтрации некоторых пористых материалов клетками, или их имплантация в костную ткань [4]. Восстановление тканей включает в себя два различных процесса: регенерацию с восстановлением паренхимы ткани клетками того же типа, а также репарацию с замещением поврежденных участков соединительной тканью. Эти процессы в основном зависят от пролиферативной способности клеток ткани или органа, в которые имплантируется биоматериал, или от сохранности внеклеточного матрикса [5]. По регенеративной способности клетки классифицируют на три группы: лабильные (делящиеся), стабильные (покоящиеся) и перманентные (неделящиеся). Лабильные клетки продолжают делиться на протяжении всей жизни, стабильные клетки сохраняют эту способность, но при нормальных условиях не пролиферируют, перманентные же клетки не могут воспроизводить себя [31]. 20 Идеальная регенерация тканей с формированием исходной структуры теоретически может происходить только в органах, состоящих и лабильных и стабильных клеток, в то время как повреждение тканей из перманентных клеток должно приводить к образованию соединительнотканной капсулы с восстановлением небольших участков. Так ткани, состоящие из перманентных клеток (миокардиоцитов, нервных и поперечнополосатых мышечных клеток), наиболее часто после повреждения замещаются соединительной тканью. В свою очередь органы из стабильных клеток (паренхиматозные клетки печени, поджелудочной железы, мезенхимальные клетки, эндотелиальные клетки кровеносных сосудов), а также лабильных (эпителиальные, лимфоидные и кроветворные клетки) в зависимости от характера повреждения могут как подвергаться фиброзу, так и восстанавливать структуру идентичную нативной. Кроме того, сохранение структуры внеклеточного матрикса является важным условием для нормального восстановления ткани [16]. Определенную роль в ремоделировании имплантируемого биоматериала играют системные и местные факторы. К системным факторам относятся гематологические и иммунологические расстройства, а также уже имеющиеся заболевания, например атеросклероз, сахарный диабет. Местные факторы включают место имплантации, кровоснабжение и вероятность инфицирования [125]. В свою очередь имплантированные сосудистые графты подвергаются процессам, сходными с описанными выше [220]. Так после первичного контакта с кровью, во время которого на внутренней поверхности протеза откладывается фибрин, вокруг материала начинается воспалительный процесс. На начальной стадии нейтрофилы и моноциты мигрируют к границе между имплантатом и поврежденными тканями. В течение грануляционной фазы фагоциты очищают рану и передают сигналы на фибробласты и гладкомышечные клетки для начала ремоделирования. Эта фаза длится 2-3 недели, и в идеале должна завершиться полным заживлением. Если реакция не прекращается в течение длительного времени процесс переходит в хроническое воспаление, которое приводит к 21 утолщению неоинтимы, избыточному росту тканей, фиброзу и кальцификации. Минерализация синтетических и биологических матриксов является терминальной стадией данного патологического процесса и, как правило, необратима. Также считается, что кальцификация не возникает в матриксах с низкой скоростью биодеградации и предрасположенных к ремоделированию [158]. Очевидно, что более глубокое понимание основных путей воспалительной реакции на сосудистые графты имеет большое значение для создания способов их регуляции с целью эффективного восстановления тканей без фиброза и дегенерации. 1.3 Использование биосовместимых графтов для регенерации кровеносного сосуда in situ Способность некоторых биосовместимых материалов обеспечивать регенерацию тканей делает возможным их использование не только в качестве матрикса для создания полноценных органов в условиях биореактора, но также и как самостоятельный графт для восстановления структуры тканей в месте повреждения [194]. К развитию данного направления тканевой инженерии привели некоторые ограничения классического подхода с предварительным заселением матриксов клетками пациента. Тканевая инженерия с использованием клеток хоть и демонстрирует многообещающие результаты, однако не может быть использована при необходимости проведения срочных операций, поскольку получение клеток у пациента, экспансия клеточных культур и заселение ими матриксов представляет собой достаточно длительный и трудоемкий процесс [20]. Кроме того, полученные культуры клеток в большинстве случаев неоднородны, что затрудняет их стандартизацию. В свою очередь, подход к восстановлению органа in situ основан на использовании 22 собственных регенеративных ресурсов организма и пористого биоматериала, способствующего привлечению специфических клеток в месте повреждения. Мобилизация тканеспецифичных клеток в зоне имплантации осуществляется путем высвобождения биоматериалом биологически активных молекул, которые в свою очередь и обеспечивают миграцию, пролиферацию и дифференцировку этих клеток, а также дальнейшее восстановление тканей [81, 96]. Регенерация ткани зависит главным образом от эффективного привлечения стволовых или прогениторных клеток в имплантированный графт и его инфильтрации клетками. Известно, что во взрослом организме имеются полустволовые клетки, которые способны дифференцироваться и могут быть выделены из различных тканей и органов: головного мозга, печени, миокарда, жировой ткани, циркулирующей крови и другие [38, 76, 77, 223]. Большинство таких клеток находится в состоянии покоя до возникновения регуляторных сигналов, запускающих процесс репарации. В дополнение к тканеспецифичным полустволовым клеткам существуют клетки предшествинники, основная часть которых располагается в костном мозге. К ним относятся гемопоэтические стволовые клетки (ГСК), мезенхимальные стволовые клетки (МСК) и эндотелиальные прогениторные клетки (ЭПК). Благодаря ГСК, осуществляется восстановление всех циркулирующих клеток крови. Кроме того, ГСК играют важную роль в процессах регенерации, обеспечивая паракринную регуляцию трансдифференцировки клеток в нужном направлении в зоне повреждения [53]. Другой популяцией клеток предшественников, находящейся в костном мозге являются МСК, которые могут дифференцироваться в различные типы клеток в зависимости от окружения. Многие исследования демонстрируют, что популяция МСК может быть выделена также из кости, хряща, мышц, сухожилий, жира и других соединительных тканей [36]. Эти клетки способны не только модулировать иммунную систему, но также секретировать биологически активные молекулы для тканеспецифичной регенерации [37]. Кроме того, важными клетками, участвующими в стимуляции ангиогенеза в зоне 23 повреждения, являются ЭПК. Они способствуют процессу регенерации кровеносных сосудов, а также васкуляризации ишемических органов [105]. Недавние исследования показали, что также большое значение в процессах восстановления тканей и ремоделирования принадлежит макрофагам, которые участвуют в воспалении и реакции на инородное тело [80]. Провоспалительные макрофаги с фенотипом M1 участвуют в хроническом воспалении и реакции на инородное тело, в то время как M2 макрофаги ассоциированы с противоспалительными, иммуномодулирующими процессами, а также с ремоделированием тканей [123, 187]. Попытка изучения клеточных популяций, которые инфильтрируют биологический материал была показана в исследовании Lee и соавторов с использованием нетканого пористого матрикса из полигликолиевой кислоты. В результате подкожной имплантации матриксов мышам и последующей оценке поверхностных маркеров клеток, мигрировавших в поры материала, и их способности дифференцироваться в различные линии было обнаружено, что небольшая часть из них обладала мультипотентностью [90]. Эффективная клеточная инфильтрация имплантированного графта может быть достигнута благодаря созданию биологически активной микросерды с помощью высокопористой структуры биосовместимого матрикса и локальной доставки необходимых биомолекул. Для создания сосудистых графтов преимущественно используют децеллюляризированный внеклеточный матрикс или биосовместимые биодеградируемые полимеры. К материалу, используемому для изготовления графта, предъявляют те же требования, что и к матриксу для тканеинженерных органов, выращенных в биореакторе. Но для него наиболее важным являются такие характеристики как высокопористость, механическая прочность и соответствие процессов деградации материала и формирования новой ткани. В связи с этим в настоящее время основные разработки и исследования направлены на изучение влияния химического состава, пористости, скорости деградации и биологической активности на регенеративный потенциал графтов [180]. 24 В одной из первых попыток продемонстрировать возможность использования бесклеточных матриксов для регенерации кровеносного сосуда in situ в качестве графта использовали децеллюляризированную подслизистую тонкого кишечника, обработанную гепарином [152]. Данный сосудистый протез состоял преимущественно из коллагена, при имплантации в кровеносное русло он интегрировался в ткани организма, подвергался ремоделированию и функционировал как кровеносный сосуд. Подобный подход с использованием децеллюляризации также применяли для создания графтов из нативных сосудов, например подкожной вены. Такие протезы демонстрировали снижение иммуногенности по сравнению с аллотрансплантатами, а также имели потенциал к заселению клетками [100]. Кроме того, недавние исследования показали возможность децеллюляризации целых органов, например сердца, легких, печени и почек с сохранением микрососудистой сети [136, 139, 150]. В свою очередь использование синтетических полимеров вместо внеклеточного матрикса для изготовления сосудистых графтов устраняет проблемы трансплантатов, связанные с иммуногенностью. Для изготовления синтетических протезов применяют различные методы такие как экструзия, плетение или отливка. Но в последнее десятилетие наибольшее предпочтение для изготовления электроспиннингу, тканеинженерных поскольку он сосудистых позволяет графтов создавать отдается высокопористые материалы, состоящие из нано- и микроволокон [109, 116, 143]. Трехмерные сосудистые матриксы могут быть изготовлены методом электроспиннинга из природных компонентов (коллагена, эластина, гиалуроновой кислоты, шелка), а также синтетических полимеров (сложные полиэфиры) [166]. Проникновение клеток внутрь графта и его ремоделирование во многом зависят от морфологии материала, в связи с этим большнство исследований в этой области направлено на увеличение размера пор и общей пористости, в том числе с использованием нестабильных волокон и порообразователей, а также на подбор диаметра полимерных нитей [46, 93, 179, 196]. Показано, что улучшения клеточной инфильтрации можно добиться последующей обработкой графта 25 ультрафиолетовым облучением, лазерной абляцией, иммобилизацией гепарина или включением в состав материала гиалуроновой кислоты [56, 70, 188, 198]. Модификация поверхности трансплантатов имеет критическое значение для предупреждения тромбообразования. Например, полиэтилен гликоль (polyethylene glycol (PEG)) и углеводные остатки образуют структуры на поверхности протеза, препятствующие адгезии тромбоцитов, а иммобилизированный гепарин или гирудин, могут локально ингибировать активность тромбина [114, 149]. Исследования показывают, что ковалентное прикрепление биологически активных молекул к материалу более предпочтительно в условиях гемодинамики по сравнению с их пассивной адсорбцией на поверхности. Для увеличения количества участков связывания на полиэстерах используют гидролитические методы или обработку плазмой [29, 41]. Так гепарин, конъюгированный на различных поверхностях предавал тромборезистентные свойства графтам из коллагена, PCL, PTFE и полиуретана в in vitro и in vivo экспериментах [50, 84, 86, 186, 188]. В доклинических исследованиях на собаках графт, изготовленный методом электроспиннинга и покрытый гепарином, в качестве бедренного артериовенозного шунта показал способность к раннему самовосстановлению со временем гемостаза после катетеризации, примерно в 10 раз превышающим данный показатель для PTFE [84]. Гистологический анализ свидетельствовал об эндотелизации, процессах заживления трансплантата, характеризующихся клеточной инфильтрацией стенки, и гемосовместимости. Аналогично, графты из PLA демонстрировали улучшение проходимости после конъюгирования на материал гирудина [19]. На ремоделирование сосудистых тканеинженерных графтов также может оказывать влияние и скорость их деградации. В недавнем исследовании было обнаружено, что быстрая деградация полимера позволяет ускорять процесс восстановления тканей. Так быстрое разрушение матриксов из эластомерного полиглицерол себаката приводило к инфильтрации графта клетками организма и регенерации с образованием структур, характерных для нативных кровеносных сосудов [221]. Такому конструктивному ремоделированию временного протеза 26 способствует мобилизация макрофагов с фенотипом М2. При этом эластомерная конструкция деградирует в течение 3 месяцев с практически полным формированием собственной артерии [122]. Однако необходимы дальнейшие исследования по определению оптимальной скорости деградации и механизмов регенерации, чтобы предупредить преждевременную потерю прочности графта с образованием аневризм или повреждением стенки. Антитромбогенные покрытия в физиологических условиях эффективны в течение непродолжительного времени. В связи с чем для поддержания проходимости сосудистого графта крайне желательна его эндотелизация. Поскольку эндотелий в человеческих кровеносных сосудах регенерирует очень медленно, протезам необходимо придать дополнительную способность привлекать на свою поверхность эндотелиальные прогениторные клетки, а также эндотелиальные и мезенхимальные стволовые клетки из окружающих тканей. Использование для этой цели антител к CD34, иммобилизованных на PTFE графтах, которые имплантировали в качестве артериовенозного шунта свиньям, ускоряло эндотелизацию данных протезов, но приводило к гиперплазии неоинтимы в зоне венозного анастомоза [102]. Пока остается неизвестным, что именно способствовало гиперплазии неоинтимы, паракринная сигнализация мобилизованных CD34-положительных клеток или их дифференцировка. Еще одним способом привлечения клеток является использование цитокинов, как молекул, способных повысить миграцию клеток из периферической крови, а также окружающих тканей. Среди них наиболее хорошие результаты по привлечению клеток в имплантированный графт продемонстрировал стромальный фактор 1α (sromal cell-derived factor-1α, SDF1α) [117, 171, 189]. Испытание тканных полиэфирных сосудистых протезов, модифицированных фибронектином и SDF-1α показало значительную мобилизацию ЭПК и улучшение эндотелизации [94]. Использование гепарина для прикрепления SDF-1α на поверхности имплантатов увеличивало стабильность хемокина на PLA графтах в статичных и проточных условиях. Кроме того, SDF-1α стимулировали привлечение гладкомышечных клеток, а 27 гепарин способствовал лучшему проникновению клеток в поры материала [191]. Точные механизмы, посредством которых данный цитокин осуществляет мобилизацию ЭПК и гладкомышечных клеток до конца не изучен, но вероятно он обусловлен эффектом хемотаксиса. Стоит отметить, что гепарин связывает не только хемокин, но и его рецептор, поэтому при его использовании в качестве аттрактанта к клеткам следует избегать системного введения антикоагулянта [85]. Другой подход заключается в использовании гранулоцитарного колониестимулирующего фактора (granulocyte colony-stimulating factor, G-CSF), который способствует увеличению циркулирующих ЭПК. Его подкожное введение приводит к выходу клеток-предшественников из костного мозга и повышает эндотелиализацию синтетических трансплантатов [207]. Также большим потенциалом для стимуляции эндотелизации графтов и регенерации сосудистых тканей обладают ангиогенные ростовые факторы, в особенности сосудистый эндотелиальный фактор роста, благодаря своей способности оказывать влияние на функции эндотелиальных клеток [130, 209]. 1.4 VEGF и его роль в ангиогенезе Сосудистый эндотелиальный фактор роста (VEGF) является важнейшим регулятором развития сосудов в эмбриогенезе (васкулогенез), а также их формирования во взрослом организме (ангиогенез). Семейство VEGF генов включает в себя как минимум 7 членов, в то время как семейство VEGFR насчитывает 3 или 4 рецептора в зависимости от вида организма [163, 164]. VEGF, также известый как VEGF-A, представляет собой белок, вызывающий увеличение проницаемости сосудов, и впервые был выделен из жидкости, секретированной опухолью [205]. Через несколько лет был получен и очищен белок с ангиогенной активностью, который был назван VEGF [212]. 28 Молекулярное клонирование, в свою очередь, показало, что эти два белка были идентичными и кодировались одним геном [71]. К семейству VEGF относятся VEGF-A, VEGF-B, VEGF-C, VEGF-D, PlGF (плацентарный ростовой фактор), VEGF-E (Orf-VEGF) и T. flavoviridis svVEGF. За исключением последних двух, 5 генов VEGFs существуют в геномах млекопитающих, включая человека. Все представители VEGFs имеют 8 консервативных остатков цистеина в фиксированных позициях, что делает их сходными с белками семейства PDGF (тромбоцитарный фактор роста). Из 8 цистеиновых остатков, 6 остатков образуют S-S внутримолекулярные связи и структурные петли. Оставшиеся 2 цистеина формируют S-S межмолекулярные связи, что способствует стабилизации структуры гомомерного VEGF [107]. В результате альтернативного сплайсинга возникают подтипы белка VEGF-A, представляющие собой пептидные последовательности из 121, 145, 148, 165, 183, 189 и 206 аминокислот [210]. Все пептиды, кроме VEGF-A 121, имеют основной участок рядом с C-концом. У VEGF-A 165 данный участок имеет слабое сродство к кислым веществам, таким как гепарин и гепарансульфат, и к нейролину-1, который представляет собой нейрональный белок, участвующий в регуляции нервных клеток и являющийся корецептором к VEGF-A. В свою очередь, VEGF-A 189 имеет высокое сродство к гепарину и гепарансульфату, в результате чего большинство молекул этого белка локализовано преимущественно на поверхности клеток и во внеклеточном матриксе [71]. Среди подтипов VEGF-A, наибольшее значение, как в количественном, так и в качественном отношении имеет VEGF-A 165. Maes с соавторами показали, что данная изоформа белка играет значительную роль в ангиогенезе [92]. Не так давно было установлено существование еще одного подтипа данного ростового фактора – VEGF-Axxxb, который более слабо активирует рецептор, однако может выступать в качестве физиологического конкурента для VEGF-A [68]. VEGF-A связывается с рецепторами VEGFR-1 и VEGFR-2 и активирует их, что приводит к стимуляции ангиогенеза, увеличению проницаемости сосудов и 29 клеточной миграции [163]. Кроме того, в своей работе Lee продемонстрировал, что функционирование эндотелия может регулироваться через аутокринную сигнализацию VEGF-A и системы его рецепторов на сосудистых эндотелиальных клетках [21]. Молекулы VEGF-B и PlGF имеют сродство только к рецептору VEGFR-1. В эксперименте было показано, что нокаутные мыши по генам VEGF-B и PlGF рождались без патологий, связанных с формированием кровеносных сосудов [178]. Такие результаты дали возможность предполагать, что эти гены не имеют значения в эмбриогенезе. Однако, установлено, что PlGF совместно с VEGF-A участвует в ангиогенезе при патологических состояниях, молекулы VEGF-B могут осуществлять защиту сенсорных нейронов при их дегенерации [132, 213]. Подтипы VEGF-C и VEGF-D продуцируются в незрелой форме, в дальнейшем они расщепляются под действием протеазы –фурина, как в амино-, так и в карбоксильно-концевой частях [146]. После этого данные молекулы приобретают высокое сродство к VEGFR-3, который располагается на эндотелиальных клетках лимфотических сосудов и является рецептором лимфангиогенеза. Кроме того, эти белки имеют слабую аффинность к VEGFR-2 и в некоторой степени способны стимулировать ангиогенез. При этом экспрессия VEGF-C происходит во время эмбриогенеза, а VEGF-D вырабатывается после рождения во взрослом периоде [164]. VEGF-E представляет собой ангиогенный белок, кодируемый геномом Orf вируса. Заражение этим вирусом обнаружено среди коз, овец, и в некоторых случаях людей, при этом он вызывает ангиогенез в местах инфекции на коже. VEGF-E обладает уникальной специфичность к VEGFR-2, которая не свойственна никаким молекулам в человеческом организме [10]. Также VEGFподобной молекулой является T. flavoviridis svVEGF, которая содержится в яде змеи Хабу. Takahashi с соавторами обнаружили, что данный подтип ростового фактора слабо стимулирует ангиогенез, но при этом вызывает сильнейшую проницаемость стенки кровеносных сосудов. Интересно, что данный белок плотно связывается с VEGFR-1 и слабо с VEGFR-2. Т. flavoviridis svVEGF был 30 выделен только из яда, и при этом он не оказывал токсичного действия на клетки млекопитающих. В результате предполагается, что его основная функция заключается в усилении проницаемости сосудов млекопитающих, для улучшения попадания токсинов в кровь жертвы [9]. VEGFRs являются типичными тирозикиназными (TKRs) рецепторами, имеющими внеклеточный домен для связывания с лигандом, а также трансмембранный и цитоплазматический, включая участок тирозинкиназы [217]. На эндотелии сосудов располагается два рецептора, это VEGFR-1 и VEGFR-2. Оба рецептора гомологичны по аминокислотному составу на 44% [108]. Наиболее функционально значимые сигналы опосредуются через VEGFR2. Специфичность к данному рецептору обладают молекулы VEGF-A и VEGF-E. Связывание этих лигандов с рецептором приводит к его конформационным изменениям: димерезации и аутофосфорилированию по остаткам тирозина. Фосфорилированные остатки тирозина являются мишенями для SH2, SH3 и адапторных белков, содержащих фосфотирозин-связывающий домен, или киназ. VEGF-A-индуцированная активация VEGFR-2 привод к ассоциации с Shc, Grb2 c-Src, Nck и двумя тирозиновыми фосфатазами SHP-1 и SHP-2, которые могут дефосфорилировать внутриклеточные TKRs. В сигнальные результате пути. чего запускаются различные VEGFR-2 индуцирует Стимуляция миграцию, пролиферацию и выживание клетки, выработку оксида азота (NO), сосудистую проницаемость и модулирует экспрессию генов [89]. VEGFR-1 проявляет более слабую киназную активность по сравнению с VEGFR-2 [195]. Наиболее характерными реакциями, опосредованными этим рецептором, являются стимуляция миграции моноцитов и повышение экспрессии тканевого фактора в моноцитах и эндотелиальных клетках. Кроме того, показано, что VEGFR-1 может выступать в качестве негативного регулятора VEGFR-2. Растворимые формы этого рецептора (sVEGFR-1) ингибируют VEGF-индуцированную миграцию и пролиферацию эндотелиальных клеток микрососудов и HUVEC, формируя неактивные коплексы с VEGF и VEGFR-2 [108]. 31 Механизм, посредством которого VEGF-A обеспечивает выживание эндотелиальных клеток, основан на его антиапоптотическом действии. Было обнаружено, что VEGF-A ингибирует апоптоз HUVEC путем активации Akt/PBK через фосфоинозитол-3-киназа-зависимого путь. Также данный ростовой фактор индуцирует экспрессию антиапоптотических белков Bcl-2 и А1, которые подавляют активность каспаз и участвуют в up-регуляции двух членов семейства IAP (ингибиторы апоптоза): сурвивина и IAP, связанного с X хромосомой. Эти белки блокируют концевые продомены каспаз [35]. Также через VEGFR-2 рецептор VEGF-A стимулирует пролиферацию различных типов эндотелиальных клеток. В этом случае основную роль в передаче сигнала играют MAP киназы ERK1/2, также возможен путь через активацию JNK. Было показано, что VEGF активирует несколько транскрипционных факторов таких как Ets1, NFAT или Stat, а также регулирует экспрессию некоторых генов, например NOS, тканевого фактора, антиапоптотических белков и металлопротеиназ [214]. Первым ключевым шагом к формированию кровеносных сосудов является миграция эндотелиальных клеток [111]. VEGF-A индуцирует фосфорилирование тирозина киназы фокальной адгезии (FAK) и паксиллина, а также использует FAK для обеспечения формирования фокальной адгезии в HUVIC. Стимуляция FAK происходит через C-концевой хвост VEGFR-2, а потеря VEGF-Aиндуцированной активности FAK в клетках, экспрессирующих мутантный VEGFR-2, коррелирует с утратой способности к миграции, регулируемой фосфоинозитол-3-киназой. Кроме того, было показано, что белок теплового шока Hsp90 облегчает FAK фосфорилирование и VEGF-A-индуцированную миграцию. Через другой независимый путь VEGF-A может активировать p38 MAP-киназы в HUVIC. При этом реорганизация актина и миграция клеток может быть остановлена при использовании специфического ингибитора киназы p38, тогда как ингибитор ERK1/2 МАР-киназы не оказывает влияния на эти процессы [138]. Также имеются данные, VEGF-A может стимулировать миграцию клеток 32 через синтез NO, который регулирует формирование фокальной адгезии и фосфорилирование FAK в эндотелиальных клетках [111]. Все перечисленные выше процессы, которые запускаются VEGF-A через VEGFR-2 на эндотелиальных клетках, играют основную роль в росте кровеносных сосудов. Так, в ангиогенезе выделяют 4 этапа. Эндотелиальные клетки могут активироваться при воздействии ряда факторов, таких как ацидоз, гипоксия или цитокины. Это сопровождается локальной вазодилатацией и повышенной проницаемостью сосудов, под действием VEGF. Первый этап ангиогенеза заключается в деградации базальной мембраны кровеносного сосуда. На втором этапе эндотелиальные клетки мигрируют в направлении ангиогенного стимула и выстраивают стенку капилляра, обеспечивая рост сосуда. Далее клетки пролиферируют, что способствует удлинению растущего сосуда. Созревание кровеносного сосуда происходит на последнем этапе и сопровождается восстановлением базальной мембраны и появлением перицитов. Новые капилляры, а также кровеносные сосуды, которые стимулируются VEGF, имеют повышенную проницаемость, что приводит к внесосудистому накоплению фибрина. Фибрин, в свою очередь, выполняет функцию временного матрикса, далее он постепенно удаляется, замещаясь другими внеклеточными компонентами [47]. Деградация внеклеточного матрикса, которая способствует миграции эндотелиальных клеток и выходу цитокинов, происходит под действием протеолитических ферментов и является регулируемым процессом. Кроме того, в деградации внеклеточного матрикса и высвобождении ростовых факторов важную роль играют макрофаги. Они секретируют плазминоген и матричные протеиназы, которые разрушают связи между компонентами внеклеточного вещества. Также они инактивируют гепарансульфат, который связывает многие ростовые факторы, что способствует выходу цитокинов. Наконец, макрофаги сами вырабатывают многие ангиогенные факторы такие как bFGF, TGF-β, VEGF и ангиотропин, а также молекулы, ингибирующие ангиогенез. Эти клетки являются важными регуляторами воспаления и заживления тканей, в свою 33 очередь ангиогенез представляет собой неотъемлемую часть этих процессов [135]. 1.5 Применение VEGF в тканевой инженерии кровеносных сосудов Возможность регуляции ангиогенеза, на сегодняшний день, нашла свое применение в тканевой инженерии для васкуляризации тканеинженерных органов, а также для создания кровеносных сосудов на основе искусственных матриксов [160]. Одним из способов регуляции формирования кровеносных сосудов является использование молекул VEGF. Хотя VEGF и оказывает влияние на миграцию и пролиферацию эндотелиальных клеток, а также вазодилятацию, было показано, что неконтролируемое введение этого ростового фактора приводит к неупорядоченному росту кровеносных сосудов с образованием гемангиомы, стимулирует ангиогенез в злокачественных опухолях, а также вызывает формирование сосудов с повышенной проницаемостью стенки [25, 89]. Таким образом, физиологическая функция VEGF в развитии и поддержании кровеносных сосудов контрастирует с его способностью индуцировать некорректный ангиогенез. Однако в эксперименте с введением в организм миобластов с трансфекцией гена VEGF, в результате чего клетки осуществляли постоянную выработку ростового фактора, было продемонстрировано формирование стабильной капиллярной сети [87]. Эти данные свидетельствуют о том, что обеспечение тщательно контролируемого выхода VEGF в зону регенерации тканей, может быть использовано для васкуляризации тканеинженерных конструкций, а также для стимуляции ангиогенеза на сосудистых графтах. Успехи в использовании VEGF в тканевой инженерии были продемонстрированы в различных работах. Так усиление активации и 34 пролиферации эндотелиальных клеток на тканеинженерных матриксах, содержащих в своей структуре биоактивный VEGF, было показано в исследованиях in vitro. Sharon и Puleo наблюдали увеличение роста культуры эндотелиальных клеток на PLGA (poly(lactic-co-glycolic acid))-матриксах, нагруженных VEGF [161]. Такие же данные были получены Backer и его коллегами. Они фиксировали VEGF через цистеиновый остаток на поверхности пластикового материала, покрытого фибронектином, и наблюдали повышение количества эндотелиальных клеток, экспрессирующих на своей поверхности VEGFR-2 [175]. В исследовании Shen с соавторами была продемонстрированна способность VEGF усиливать проникновение эндотелиальных клеток в трехмерный коллагеновый матрикс и их пролиферацию. Более того, в этом же эксперименте наблюдалось повышение жизнеспособности культуры эндотелиальных клеток в образцах с ростовым фактором, конъюгированным на коллагене с применением N-(-3-диметиламинопропил)-N’-этилкарбодиимид хлорида, по сравнению с использованием растворимой формы VEGF [162]. Различные исследованиях in vivo при подкожной имплантации грызунам пористых материалов и гелей, содержащих инкорпорированный VEGF, показали активацию ангиогенеза в окружающих тканях с последующим образованием капиллярной сети в сами матрицах [73]. Кроме того, помещая биодеградируемые PLG (poly(lactide-co-glycolid))-матрицы, содержащие VEGF в ишимизированные конечности мышей, Sun и его коллеги наблюдали увеличение плотности капилляров и улучшение реперфузии ткани [177]. Особое значение для эффективности вводимого в тканеинженерные матриксы VEGF имеет способ его доставки, что связано с неустойчивостью ростового фактора. При этом, считается, что контроль выхода VEGF может быть достигнут при использовании в качестве материала для искусственного матрикса полимеров, способных обеспечить медленное высвобождение биомолекул [192]. Elcin с соавторами исследовал in vitro кинетику выхода VEGF из PLGAгубок и оценивал их ангиогенную эффективность in vivo на крысах [60]. По сравнению с губками, не содержащими ростовой фактор, а также с болюсной 35 инъекцией на исследуемом материале имелись значительные васкуляризированные участки. Другую попытку по регуляции доставки VEGF в зону регенерации осуществили Patel с соавторами, которые адсорбировали ростовой фактор на желатиновых микрочастицах и вводили их в биодеградируемый матрикс [99]. Результаты показали, что степень сшивки желатина влияет на высвобождение VEGF и следовательно на его ангиогенный эффект. В свою очередь Ennett с коллегами предположили, что временного регулируемого высвобождения VEGF в условиях in vivo можно добиться путем введения ростового фактора в полимер, который будет выполнять функцию носителя [67]. Они сравнивали эффект от VEGF, непосредственно прикрепленного к PLG материалу, с VEGF, преинкапсулированного в PLG микросферы, которые впоследствии использовали для изготовления матрикса. Было показано, что применение микросфер приводило к замедлению выхода VEGF, в окружающие ткани, но при этом сохранялась способность биомолекул стимулировать рост сосудов, а также наблюдались незначительные системные эффекты. Эффективность преинкапсуляции VEGF также была исследована в эксперименте с оценкой ангиогенной активности гидрогеля Matrigel и PLGAматриксов, содержащих ростовой фактор. Результаты продемонстрировали, что биоматериалы с биомолекулами, предварительно инкапсулированными в наночастицы из хитозана и декстрансульфата, значительно лучше прорастали капиллярами по сравнению с матриксами с неинкапсулированным VEGF при подкожной имплантации мышам. Использование наночастиц в качестве носителя способствовало стабильности ростового фактора и его устойчивого выхода из биодеградируемых имплантатов [6]. Кроме того, в ряде исследований были осуществлены попытки добиться улучшения эндотелизации и ремоделирования сосудистых графтов с использованием VEGF. В работе Crombez при тестировании сосудистых протезов из PTFE (polytetrafluoroethylene) c конъюгированным на полимерном 36 материале ростовым фактором было показано усиление миграции эндотелиальных клеток к поверхности графта, их адгезии и пролиферации [95]. Также отмечали увеличение адгезии клеток, активный рост клеточной культуры с формированием слоя эндотелиальных клеток, которые образовывали прочные межклеточные взаимодействия и экспрессировали на своей поверхности маркер CD31, на поверхности сосудистого биосовместимого протеза из сополимера молочной кислоты и поликапролактона (poly(L-lactide-co-ε-caprolactone, PLCL) [130]. При этом ростовой фактор иммобилизовывали на полимере с использованием полидофамина, который осаждается на материале, образуя стабильный слой, и обеспечивает конъюгирование биомолекул с сохранением их активности. В своей работе Zhou M. с соавторами также показал увеличение пролиферации эндотелиальных клеток на децеллюляризированной сонной артерии собаки, покрытой гепарином и VEGF. В этом же эксперименте проводили имплантацию исследуемых графтов в сонную артерию собак. Результаты показали лучшую проходимость протезов, содержащих ростовой фактор, по сравнению с немодифицированными, в течение 6 месяцев исследования [57]. Быстрая эндотелизация синтетических графтов из PTFE, покрытых матригелем, содержащим VEGF, была обнаружена при имплантации данных протезов в брюшную аорту крыс сроком на 30 дней. Ростовой фактор способствовал образованию непрерывного эндотелиального слоя, но вместе с тем отмечали значительную гиперплазию неоинтимы, сопровождающуюся ростом числа гладкомышечных клеток. Авторы предполагают, что такой эффект может быть связан с повышением синтеза bFGF и TGF-β эндотелиальными клетками, индуцированными VEGF. В свою очередь bFGF и TGF-β оказывают митогенное влияние на гладкомышечные клетки сосуда [58]. При имплантации в кровеносное русло на срок до 12 недель сосудистых графтов, изготовленных из децеллюляризированной брюшной аорты крысы и покрытых поли-D,L-молочной кислотой ((poly-(D,L)-lactide acid, PDLLA), 37 содержащей VEGF, Heidenhain соавторами обнаружили увеличение на материале протеза количества гигантских многоядерных клеток инородных тел. Однако, такую тканевую реакцию исследователи связывают с передозировкой используемого ростового фактора [72]. Исследования в области сосудистой тканевой инженерии, несомненно, демонстрируют определенные успехи в использовании ангиогенных ростовых факторов для улучшения проходимости сосудистых графтов. Однако, до сих пор не определены оптимальное сочетание биоматериала и ростовых факторов, а также наиболее эффективный способ доставки ростовых факторов для полной регенерации кровеносного сосуда. Резюме Проведенный анализ литературных данных позволил выделить основные моменты, отражающие современное состояние проблемы использования ростовых факторов для улучшения регенерации кровеносного сосуда на основе тканеинженерных графтов. Различные попытки искусственного создания полноценных кровеносных сосудов демонстрируют, что наиболее перспективным подходом сосудистой тканевой инженерии является использование биодеградируемых матриксов для регенерации in vivo. При этом стимуляция миграции клеток в имплантированный графт может быть достигнута использованием ростовых факторов. Свою эффективность в эндотелизации графтов и росте кровеносных сосудов демонстрирует сосудистый эндотелиальный фактор роста, что обусловлено его способностью регулировать функции эндотелиальных клеток. Иммобилизация молекул VEGF на поверхности тканеинженерных сосустых графтов уже показала улучшение их эндотелизации в краткосрочных исследованиях на животных. Однако, в настоящее время не изучена возможность использования биодеградируемого сосудистого графта с инкорпорированными внутрь полимерных волокон биологически активными молекулами в качестве 38 временного протеза для восстановления тканей кровеносного сосуда в месте имлантации. Кроме того, остаются недостаточно раскрытыми вопросы, связанные с процессами биодеградируемых регенерации матриксов и сосудистой влиянием на ткани них на основе непрерывной пролонгированной доставки такого ангиогенного ростового фактора, как VEGF. Изучению данных проблем и посвящено настоящее исследование. 39 ГЛАВА 2 МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ В настоящем исследовании для изготовления сосудистых графтов малого диаметра применяли синтетический биодеградируемый полимер поликапролактон (polycaprolactone, PCL) с молекулярной массой 80000 (SigmaAldrich Co. LLC, США). В качестве биологически активных молекул для инкорпорирования в PCL графт с целью стимуляции процессов регенерации кровеносного сосуда использовали рекомбинантный сосудистый эндотелиальный фактор крысы (R&D Systems, США). Ростовой фактор лиофилизировали в фосфатно-солевом буфере (Gibco, США) до концентрации 1 мкг/мл. 2.1 Изготовление сосудистых PCL графтов и PCL графтов, содержащих VEGF Сосудистые PCL графты диаметрами 2 и 4 мм изготавливали методом электроспиннинга. В основе электроспиннинга лежит процесс возникновения постоянных электростатических зарядов на молекулах полимера в растворе, помещенного в электрическое поле. Высокая плотность одноименных зарядов приводит к их отталкиванию друг от друга, вытягиванию из раствора струи и образованию тонкого полимерного волокна. Данный метод позволяет изготавливать пористые материалы, состоящие из нано- и микроволокон. Изготовление PCL графтов осуществляли на приборе Nanon-01A (MECC CO, Япония). Для этого раствор поликапролактона в хлороформе помещали в шприц объемом 5 мл, который соединяли с иглой диаметром 0,5 мм, имеющей тупой конец. В работе изучали несколько режимов работы элетроспиннинга: растворы полимера в концентрации 10%, 12%, 14% и 16%, напряжение на конце иглы 15 40 кВ и 25 кВ. Скорость подачи полимерного раствора составляла 1 мл/ч, расстояние до коллектора – 15 см, в качестве коллектора использовали вращающиеся штифты диаметром 2 и 4 мм. Процесс электроспиннинга продолжали до получения протеза с толщиной стенки 100-120 мкм. Сосудистый протез с такой толщиной стенки наиболее удобен для имплантации в аорту мелких лабораторных животных. Для инкорпорирования молекул ростового фактора в полимерное волокно использовали метод двухфазного электроспиннинга [169]. Раствор поликапролактона, выбранной концентрации, тщательно смешивали с раствором VEGF (1 мкг/мл) в соотношении 20:1 в течение 60 секунд с использованием вортекса до получения суспензии. Полученную смесь помещали в шприц (5 мл) и проводили электроспиннинг, как описано выше при выбранном оптимальном напряжении. 2.2 Физико-механические испытания сосудистых графтов Важными параметрами для сосудистых графтов являются их физикомеханические свойства, обуславливающие адекватное функционирование в кровеносном русле и долговечность протезов. Для определения графта с наилучшими показателями прочности и упруго-деформативных свойств, а также для оценки изменения данных параметров после введения в полимер молекул ростового фактора проводили физико-механические испытания в условиях одноосного растяжения. Исследование осуществляли с использованием универсальной испытательной машины «Zwick/roell» - 2.5Н (Германия) в соответствии с ГОСТ 270-75. Предварительно образцы вырезали из PCL графтов и PCL графтов с VEGF диаметром 4 мм с помощью пресса и вырубной матрицы S3 (Zwick/roell, Германия). 41 Изучаемые образцы помещали в зажимы таким образом, чтобы длина рабочего сегмента составляла 1 см. Для большей точности измерений и правильного положения образцов к ним применяли предварительную нагрузку – 0,01 Н. При проведении испытания скорость перемещения траверсы составляла 10,0 мм/мин. Прочность оценивали по максимальному напряжению при растяжении по формуле (1), упруго-деформативные свойства – по относительному удлинению до нарушения целостности образца по формуле (2) и модулю упругости (Емод) по формуле (3). σ= Fmax S , (1) где σ – разрушающее напряжение при растяжении, Мпа, Fmax – разрушающая нагрузка, Н, S – площадь поперечного сечения образца, мм2. Для определения площади поперечного сечения у каждого образца с помощью окуляра-микрометра измеряли толщину (h) и ширину (d) рабочего сегмента. ε= Lmax −L0 L0 × 100% , (2) где ε – относительное удлинение, %, L0 – исходная длина образца, мм, Lmax – максимальное удлинение образца до начала разрушения, мм. σ Eмод = , ε (3) где Емод – модуль Юнга, Н/мм2. Для оценки физико-механических свойств сосудистых графтов было исследовано в группе протезов из чистого PCL 80 образцов, по 10 в каждой 42 серии. Кроме того, в группе протезов PCL с VEGF также было испытано 10 образцов. 2.3 Сканирующая электронная микроскопия поверхности сосудистых графтов Диаметр волокон и морфологию сосудистых графтов изучали с помощью сканирующей электронной микроскопии. Для этого из PCL и PCL с VEGF графтов с помощью острых хирургических ножниц вырезали образцы размером 0,5×0,5 см. Полученные образцы покрывали золотым токопроводящим напылением толщиной в 30 нм и далее изучали на сканирующем электронном микроскопе S3400N (Hitachi, Япония). 2.4 Кинетика выхода ростового фактора из PCL с VEGF графтов Оценку высвобождения ростового фактора из полимера в процессе его деградации проводили путем инкубирования образцов протезов с VEGF в фосфатно-солевом буфере с определением количества биомолекул в растворе через определенные промежутки времени [169]. При этом из графтов диаметром 4 мм, содержащих молекулы VEGF, вырезали кусочки 1×2 см2 с помощью острых хирургических ножниц. Предварительно все матриксы обрабатывали 70% этиловым спиртом в течение 10 мин, а затем отмывали фосфатно-солевым буфером. Каждый образец помещали в пробирки с объемом 1,5 мл и инкубировали при 37ºС и 5% СО2. Через установленные промежутки времени (12ч, 24ч, 48ч и далее через каждые 48 часов) в течение 80 суток, из каждой 43 пробирки отбирали 200 мкл раствора и восстанавливали исходный объем свежим буфером. В собранных образцах определяли количественное содержание ростового фактора с использованием наборов для иммуноферментного анализа VEGF (R&D System, США). Для этого в лунки 96-луночного планшета, покрытые моноклональными антителами к VEGF, вносили по 50 мкл каждого образца и стандарты VEGF и инкубировали в течении 2 часов при комнатной температуре. Далее планшет промывали и в лунки добавляли по 100 мкл антител к крысиному VEGF, конъюгированных с пероксидазой хрена, и инкубировали 1 час. После чего промывку лунок повторяли и в каждую вносили перекись водорода с тетраметилбензидином. Ферментативную реакцию останавливали через 30 минут добавлением раствора серной кислоты. Измерение поглощения проводили при длине волны 450 нм на планшетном спектрофотометре Униплан (Пикон, Россия). После чего определяли концентрацию ростового фактора в каждом из образцов с использованием полученной стандартной кривой. Расчет количества VEGF, вышедшего в каждую точку исследования, проводили с учетом ростового фактора в ранее взятых пробах для проведения анализа. 2.5 Определение биологической активности VEGF после выхода из PCL графта in vitro Для изучения биологической активности VEGF использовали перевиваемую линию эндотелиальных клеток человека EA.Hy 926, которая была любезно предоставлена Dr. Cora-Jean C. Edgell из Университета Северной Каролины, США. Клетки EA.Hy 926 культивировали в питательной среде DMEM/F12 (Sigma-Aldrich Co. LLC, США), содержащей 10% эмбриональной телячьей сыворотки (Gibco, США), 1% раствора L-глутамина с пенициллином и стрептомицином (Gibco, США), 0,4% амфотирицина Б (Gibco, США), 1% HEPES 44 буфера (Gibco, США), 2% HAT (Sigma-Aldrich Co. LLC, США) при 5% CO2 и температуре 37º. Пролиферацию эндотелиальных клеток под действием VEGF оценивали с помощью MTT-теста [18]. В 96-луночный планшет для культивирования клеток помещали клетки EA.Hy 926 по 4000 на лунку и инкубировали 24 часа в питательной среде. После чего к клеткам добавляли по 150 мкл буферного раствора, инкубированного с графтом PCL с VEGF в течение 12ч, 24ч, 48ч и далее каждые 48 часов до 80 суток (п. 2.4). Клетки оставляли еще на 72 часа при 5% CO2 и температуре 37º. Затем среду удаляли и заменяли ее на 200 мкл свежей. В каждую лунку вносили 20 мкл раствора MTT (3-[4,5-dimethylthia-zol-2-yl]- 2,5diphenyltetrazolium bromide) (Sigma-Aldrich Co. LLC, США) и инкубировали 4 часа при 37º. Далее среду удаляли, в лунки добавляли по 200 мкл диметилсульфксида (Gibco, США) и тщательно перемешивали. Через 10 мин определяли оптическую плотность при длине волны 530 нм с использованием планшетного спектрофотометра Униплан (Пикон, Россия). В качестве контроля использовали клетки культивированные в среде, не контактировавшей с ростовым фактором, отрицательный контроль представлял собой среду с добавлением MTT. 2.6 Культивирование эндотелиальных и мезенхимальных стволовых клеток на графтах Способность PCL и PCL с VEGF графтов адгезировать на своей поверхности клетки изучали с использованием культуры мезенхимальных стволовых клеток (МСК) костного мозга крысы и эндотелиальных клеток человека линии EA.Hy 926. МСК выделяли из костного мозга крыс популяции Wistar и культивировали в питательной среде DMEM (Gibco, США) c добавлением 10% 45 эмбриональной телячьей сыворотки (Gibco, США), 1% раствора L-глутамина с пенициллином и стрептомицином (Gibco, США), 0,4% амфотирицина Б (Gibco, США), 1% HEPES буфера (Gibco, США). Для проведения эксперимента использовали клетки 3 пассажа. Эндотелиальные клетки EA.Hy 926 культивировали как было описано в п. 2.5. Из PCL и PCL с VEGF графтов диаметром 4 мм острыми ножницами вырезали плоские образцы диаметром 1,93 см2 по размеру лунки 24-луночного планшета. Полученные матриксы помещали в планшет и инкубировали с культуральной средой для МСК и отдельно со средой для эндотелиальных клеток в течение 24 часов. После инкубации на каждый полимерный образец наносили суспензию клеток в количестве 25000. Для каждой комбинации вида материала и типа клеток проводили по 5 дублирующих исследований. В качестве контроля использовали клетки, культивированные на поверхности лабораторного пластика без графтов. Определение адгезии клеток осуществляли через 2 суток культивирования. Кроме того, через 4 и 6 суток оценивали количество клеток на матриксах. Для этого образцы окрашивали витальным флуоресцентным красителем PKH26 (Sigma-Aldrich Co. LLC, США). Далее матриксы изучали на инвертированном микроскопе Axio Observer Z1 (Carl Ziess, Германия) с использованием программного модуля ApoTome. 2.7 Внутрибрюшная имплантация PCL графтов и PCL графтов с VEGF Для оценки биологической активности инкорпорированного VEGF и реакции тканей матрицы (1×2 см2) вырезали из PCL и PCL с VEGF сосудистых графтов с внутренним диаметром 4 мм. Полученные образцы помещали в 70% этиловый спирт на 10 мин, отмывали стерильным физиологическим раствором и имплантировали внутрибрюшинно самцам крыс популяции Wistar (250-300 г) 46 (n=60). Предварительно животных вводили в наркоз внутрибрюшинной инъекцией этаминала натрия – 40 мг/кг. После антисептической обработки операционного поля проводили срединную лапаратомию. Каждой крысе к внутренней стороне брюшной стенки подшивали матрикс из PCL или PCL c VEGF с использованием шовного материала из нейлона 5-0. Далее разрез ушивали послойно. Животных содержали в условиях вивария при свободном доступе к пище и воде на рационе питания, соответствующем нормативам ГОСТа. Опыты проводили, соблюдая принципы гуманного обращения с животными, регламентированные требованиями Европейской конвенции (Страсбург, 1986). Через 2, 3 и 4 месяца животных выводили из эксперимента передозировкой этаминала натрия (100 мг/кг) путем внутрибрюшинной инъекцией. Матрицы выделяли вместе с прилежащими тканями и помещали в 10% формалин для дальнейших гистологических и гистохимических исследований. Образцы заключали в парафин и изготавливали срезы. Для оценки реакции тканей препараты окрашивали гематоксилином и эозином. Количество кровеносных сосудов определяли гистохимической окраской к CD31 (PECAM-1). Для этого гистологические срезы инкубировали с первичными антителами к CD31 крыс (Spring Bioscience, USA). Первичные антитела визуализировали с помощью Reveal-Biotin-Free Polyvalent DAB системы (Spring Bioscience, USA). Так как CD31-позитивные клетки имеют коричневую окраску, для контрастирования препарат дополнительно окрашивали гематоксилином. Количество капилляров считали в десяти полях зрения на каждом из трех срезов отдельного животного. Данные выражали как количество CD31-положительно окрашенных кровеносных сосудов на 1 мм2. 47 2.8 Имплантация сосудистых графтов из PCL и PCL с VEGF в брюшную часть аорты крысы Сосудистые графты с внутренним диаметром 2 мм и толщиной стенки ~100 мкм после 10 минутной обработки 70% этиловым спиртом и отмывания стерильным физиологическим раствором имплантировали в брюшную часть аорты крыс. Самцов крыс линии Wistar массой 400-450г (n=10) вводили в наркоз 3% изофлураном. Во время операции все животные получали ингаляционный наркоз 1,5% изофлурана. После проведения срединной лапаратомии открывали забрюшинное пространство и выделяли аорту. Далее аорту пережимали ниже почечной артерии и выше уровня бифуркации. Проксимальный анастомоз выполняли с использованием шовного материала 8-0. Графт промывали и аорту повторно пережимали. Дистальный анастомоз выполняли подобным образом. После имплантации разрез ушивали послойно. Животных содержали в условиях вивария при свободном доступе к пище и воде на рационе питания. Опыты проводили, соблюдая принципы гуманного обращения с животными, регламентированные требованиями Европейской конвенции (Страсбург, 1986). Контроль проходимости графтов осуществляли с помощью ультразвукового исследования с допплерометрией через 1, 3, 7 и 10 месяцев после имплантации. Спустя 10 месяцев животных выводили из эксперимента внутрибрюшинной инъекцией этаминала натрия (100 мг/кг), графт выделяли вместе с прилежащими участками аорты. Зону анастомоза и сам PCL графт оценивали на наличие кровотечений, тромбообразования. Гиперплазию неоинтимы, а также степень заселения графта клетками изучали методом световой микроскопии с окраской препаратов гематоксилином-эозином, а также по Ван-Гизон. 48 2.9 Статистические методы Статистическую обработку полученных результатов проводили с использованием пакета прикладных программ «STATISTICA 6.0» (StatSoft Inc., США). Нормальность распределения оценивали при помощи критерия Колмогорова-Смирнова. Достоверность различий определяли с помощью непараметрического критерия Манна-Уитни, а также непараметрического дисперсионного анализа Краскела-Уоллиса. Различия считали статистически значимыми при р<0,01 среднее±стандартное и p<0,05. отклонение для Данные данных, представлены имеющих в виде нормальное распределение, или как медиана и 25-ый и 75-ый процентили (25%<Мe<75%) для распределения, отличного от нормального. 49 ГЛАВА 3 ФИЗИКО-МЕХАНИЧЕСКИЕ СВОЙСТВА И МОРФОЛОГИЯ ПОЛИМЕРНЫХ СОСУДИСТЫХ ГРАФТОВ, ИЗГОТОВЛЕННЫХ МЕТОДОМ ЭЛЕКТРОСПИННИНГА 3.1 Зависимость свойств PCL графтов от параметров электроспиннинга Важной задачей в данной работе является подбор сосудистого графта с оптимальными физико-механическими свойствами, так как он должен выдерживать нагрузку, оказываемую током крови. Кроме того, большое значение имеет и морфология поверхности протеза, поскольку это один из факторов обуславливающих воспалительную реакцию ткани на имплантат. Известно, что воспалительный ответ на имплантацию пористых полимеров или биоматериалов является более интенсивным по сравнению с непористыми материалами [224]. Существуют различные методы создания полимерных пористых сосудистых графтов. Однако, выбор того или иного метода в значительной степени оказывает влияние на механические свойства, а также микро- и наноструктуру конечного продукта. С одной стороны, идеальный искусственный графт должен обладать механическими свойствами, соответствующими нативным артериям. С другой стороны, он также должен имитировать морфологию внеклеточного матрикса, что может быть обеспечено высокопористой поверхностью, состоящей из нано- и микроволокон [140]. Одним из методов, привлекающим внимание в решении данной проблемы, является электроспиннинг электроспиннига позволяет растворов и расплавов изготавливать полимеров. трехмерные Метод высокопористые полимерные матрицы, состоящие из микро- и нановолокон [185]. Для электроспиннига могут быть использованы природные деградируемые материалы, такие как коллаген, гиалуроновая кислота или фибриноген [61, 64, 50 190]. К сожалению, эти полимеры обладают низкой прочностью и чаще используются в качестве покрытий для синтетических сосудистых протезов. Синтетические же деградируемые полимеры, такие как большинство алифатических полиэстеров, сополимер молочной и гликолиевой кислот, а также производные карбонатов, хотя и используются в качестве биоматериалов и систем доставки лекарственных препаратов, но достаточно быстро теряют механическую прочность в результате ускоренной биодеградации in vivo [64, 65]. В отличие от упомянутых синтетических полимеров, поликапролактон известен хорошими физико-механическими свойствами, и механизм его деградации in vivo обусловлен медленным гидролитическим процессом, что делает этот материал наиболее приемлемым для изготовления сосудистых графтов [97]. Ранее было показано, что физико-механические свойства и морфология материала, изготовленного методом электроспиннинга, напрямую зависят от множества параметров, таких как молекулярная масса и структура полимера, свойства растворителя, режимы процесса и условия среды. Но особое влияние на морфологию и прочность оказывает изменение подаваемого напряжения и концентрация полимера в растворе [140]. В связи с этим, в настоящем исследовании проведено сравнение физикомеханических свойств и морфологии сосудистых графтов из поликапролактона, изготовленных при напряжениях 15 кВ и 25кВ и в диапазоне концентрации раствора полимера 10-16%. Данные значения напряжения и концентрации полимера были выбраны на основе анализа литературных данных, как параметры, при которых происходит электроспиннинг поликапролактона. Принимая во внимание, что сосудистые графты устанавливают в кровеносное русло, при изготовлении протеза необходимо учитывать его физико-механические свойства. Проведенные испытания показали, что наибольшей прочностью (p<0,05) среди исследуемых образцов обладали PCL графты из 14 и 16% растворов полимера как при напряжении 15 кВ, так и 25 кВ (Таблица 1). Наименьшую прочность продемонстрировали образцы из 10% PCL. 51 При этом не наблюдалось достоверных отличий между графтами, изготовленными при 15 кВ и 25 кВ (p>0,05). Таблица 1 – Физико-механические свойства сосудистых графтов, изготовленных при различных концентрациях PCL Прочность, Относительное Емод, Концентрация Напряжени МПа удлинение, % Н/мм2 полимера е, кВ Мe Мe Мe (25%; 75%) (25%; 75%) (25%; 75%) 0,34 109,0 0,74 (0,30; 0,40) (109,0; 120,3) (0,74; 1,05) 1,57 249,9 2,07 (1,49; 1,75) (168,8; 262,9) (1,74; 2,42) 2,35 478,5 1,81 (2,15; 2,44) (315,5; 739,4) (1,42; 2,33) 1,96 305,0 1,13 (1,81; 2,48) (261,6; 345,3) (0,94; 1,92) 2,64* 669,2* 1,92 (2,40; 2,81) (589,2; 849,1) (1,41; 2,13) 3,09** 609,2** 1,65 (2,75; 3,49) (588,3; 632,2) (1,56; 1,95) 2,34* 564,7* 2,00 (3,23; 2,88) (488,6; 632,7) (1,90; 2,84) 3,41** 617,1** 2,01 (3,23; 3,42) (604,6; 638,1) (1,93; 2,51) 1,26*** 95,4*** 0,28*** (0,85; 1,42) (79,8; 100,6) (0,24; 0,34) PCL 10% (n=10) PCL 12% (n=10) PCL 14% (n=10) PCL 16% (n=10) Ксенопротез (n=10) 15 25 15 25 15 25 15 25 _ Примечание: *- p<0,05 по сравнению с PCL 10% при 15кВ ** - p<0,05 по сравнению с PCL 10% и 12% при 25кВ *** - p<0,05 сравнению с PCL 14% и 16 % при 15 и 25 кВ 52 Оценка упруго-деформативных свойств PCL графтов показала изменение эластичности материала с возрастанием концентрации полимера. Относительное удлинение при максимальном напряжении для графтов, изготовленных в режиме 15 кВ, возрастало от 109,0% для концентрации 10% до 669,2% и 564,7% для 14% и 16% растворов соответственно. Похожие различия наблюдались также между графтами, изготовленными при подаваемом напряжении в 25 кВ. При этом достоверных различий данного параметра между графтами из одной концентрации PCL, но изготовленными при разных значениях напряжения, не отмечали (p>0,05). Кроме того, важной характеристикой для материала, имплантируемого в организм, является его упругость, то есть способность возвращать прежнюю форму после деформации. Упругость материала характеризуется модулем Юнга. Результаты проведенного исследования не показали отличий по упругости материала между всеми группами сосудистых графтов из PCL (p>0,05). Для образцов, изготовленных из высоких концентраций PCL 14 и 16% (15 кВ), среднее значение модуля Юнга в пределах физиологического давления составило 1,92 и 2,00 Н/мм2 соответственно, а для образцов, изготовленных при 25 кВ, – 1,65 и 2,01 Н/мм2. Полученные данные демонстрировали значительное влияние концентрации полимера в растворе на физико-механические свойства графтов. В то же время, напряжение, подаваемое на полимер при проведении электроспиннинга, не оказывало существенного влияния на прочность и эластичность протезов. Хорошие прочностные и упруго-деформативные свойства имели сосудистые графты из 14 и 16% PCL, которые достоверно превосходили по данным параметрам образцы из 10 и 12% полимера. Важно, чтобы тканеинженерный графт обладал физико-механическими свойствами близкими к свойствам нативных сосудов [63]. Для того, чтобы определить, как соотносятся прочность и эластичность PCL графтов с биологической тканью, данные показатели сравнивали с результатами физикомеханических испытаний ксенопротезов. Эти биологические сосудистые 53 протезы, изготовленные из грудной артерии крупного рогатого скота и консервированные диглицидиловым эфиром этиленгликоля, в настоящее время применяют в хирургической практике для реконструкций кровеносных сосудов малого и среднего диаметра [3]. Средние значения для ксенопротезов составили: прочность – 1,26 МПа, относительное удлинение – 95,4%, модуль Юнга – 0,28 Н/мм2. Полученные данные характерны для большинства биологических материалов и связаны с наличием в тканях эластина, коллагена и гликозаминогликанов, которые обеспечивают прочность и эластичность стенки кровеносного сосуда. В частности эластиновые волокна вносят основной вклад в эластичность ткани, а плотно расположенные волокна коллагена влияют на способность выдерживать напряжение, оказываемое током крови. И наконец, гликозаминогликаны являются ключевыми компонентами для обеспечения упругости ткани [219]. В свою очередь однокомпонентный материал из PCL не способен повторить сложные биомеханические свойства нативной ткани. Однако, благодаря своей высокой эластичности и прочности, которые превышают показатели для биопротезов в данном исследовании (p<0,05), сосудистый графт из PCL может быть использован в качестве временного сосудистого протеза при имплантации в кровеносное русло. Заселения PCL графта клетками в месте имплантации должно способствовать синтезу компонентов внеклеточного матрикса и постепенному замещению полимера с улучшением биомеханики сосуда. Изучение PCL графтов с помощью сканирующей электронной микроскопии показало изменение поверхности материала с увеличением концентрации полимера. Средний диаметр волокон при напряжении 15 кВ составил 446 нм, 1,78 мкм, 2,01 мкм, 2,74 мкм и при 25 кВ – 840 нм, 1,12 мкм, 2,62 мкм, 2,68 мкм для концентраций 10, 12, 14 и 16% соответственно. Полученные результаты свидетельствовали об увеличении диаметра волокна с возрастанием концентрации раствора PCL (Рисунок 1). 54 Изменение режимов проведения электроспиннинга также может оказывать влияние и на однородность полимерных волокон (Рисунок 2). Так волокна из 10% раствора PCL по всей длине имели большое количество утолщений, так называемых “бусин”. Такая закономерность наблюдалась на образцах, изготовленных как при напряжении 15 кВ, так и 25 кВ. мкм ** * 3,5 3,0 2,5 2,0 1,5 1,0 0,5 0,0 ** * ** * 15 кВ 25 кВ 10% PCL 12% PCL 14% PCL 16% PCL * – p<0,01 относительно 10 и 12% PCL при 15 и 25 кВ ** – p<0,01 относительно 14% PCL при 15 кВ Рисунок 1 – Зависимость диаметра волокна от концентрации PCL при напряжении электроспиннинга 15 и 25 кВ Рисунок 2 – Сканирующая электронная микроскопия PCL графтов, изготовленных при различных параметрах электроспиннинга. Увеличение ×500 55 В свою очередь в графтах из 12% полимера дефекты волокна были менее выражены. А на образцах из 14% и 16% PCL утолщений и других значительных нарушений структуры волокон выявлено не было. Полученные результаты согласуются с данными исследований процесса электроспиннинга, представленных в ряде работ [43, 69]. Концентрация оказывает влияние на вязкость и поверхностное натяжение раствора, поэтому при недостаточной концентрации полимера во время электроспиннинга формируются капли, которые при высыхании полимерной нити образуют утолщения на волокне [167]. Следовательно в данном исследовании оптимальную морфологию имели сосудистые графты из 14 и 16% PCL. Из растворов с выбранной концентрацией наименьший диаметр имели волокна, изготовленные при 15 кВ (p<0,01). Размер волокна от десятков нанометров до нескольких микрометров имеет важное значение в создании тканеинженерных конструкций, так как волокна графта должны имитировать фибриллярные белки, входящие в состав внеклеточного матрикса, например коллаген. Диаметр волокон и их топография играют важную роль в адгезии и пролиферации клеток: чем тоньше волокна образующие нетканый биоматериал, тем больше площадь доступной поверхности для взаимодействия. Большая поверхность взаимодействия не только способствует лучшему прикреплению клеток, но также обеспечивает транспорт питательных веществ и удаление продуктов метаболизма. В то же время, некоторые авторы отмечает, что слишком тонкие полимерные волокна, имеющие наноразмеры, могут препятствовать инфильтрации материала клетками, поскольку образуют слишком мелкие поры [167]. Вероятно, что наиболее предпочтительными будут графты, состоящие из микроволокон, так как клеткам необходимо иметь возможность ориентироваться вокруг волокон и прикрепляться к ним, а размер большинства человеческих клеток лежит в диапазоне 2-120 мкм [74, 140]. На основании результатов физико-механических испытаний и сканирующей электронной микроскопии можно заключить, что сосудистый PCL графт, изготовленный из 14% раствора полимера при 15 кВ, обладает высокой 56 прочностью и эластичностью, и при этом имеет в своем составе волокна меньшего диаметра по сравнению с графтами, имеющими подобные физикомеханические свойства, но сделанными в других режимах электроспиннинга. Данный сосудистый графт был выбран для модификации молекулами VEGF и дальнейшего проведения испытаний in vitro и in vivo. 3.2 Влияние инкорпорирования VEGF в PCL на структуру и прочностные свойства сосудистого графта Для формирования новой ткани на основе тканеинженерного графта важным является баланс между искусственным матриксом и биологически активными молекулами [137]. Инкорпорирование в волокна полимерного графта таких биомолекул, как ростовые факторы представляет собой многообещающий подход для восстановления поврежденных тканей [112]. Потенциально пригодным для привлечения эндотелиальных клеток, стимуляции ангиогенеза и регенерации тканей является сосудистый эндотелиальный фактор роста. VEGF представляет собой ключевой регулятор ангиогенеза при физиологических и патологических состояниях, поскольку он является потенциальным митогеном для эндотелиальных клеток, индуцирующим их миграцию и пролиферацию через ряд интегриновых рецепторов [208]. При этом введение молекул VEGF непосредственно внутрь PCL волокон способно обеспечит локальную доставку ростового фактора в зону повреждения. Метод двухфазного электроспиннинга позволяет инкапсулировать лекарственные и биологически активные молекулы в полимер и изолировать их от окружающей среды [32]. При этом раствор полимера в органическом растворителе смешивается с водным раствором биомолекул до получения суспензии. Находясь в полярном растворителе – воде или фосфатном буфере, молекулы ростового фактора не контактируют с неполярным растворителем и, 57 следовательно, не подвергаются денатурации. Однако дополнительное введение в полимер водной фазы может оказать значительное влияние на морфологию и физико-механические свойства материала, изготовленного данным методом. Исследование световой микроскопии демонстрировало наличие в волокнах с VEGF доменов, содержащих ростовой фактор и расположенных преимущественно внутри полимерного волокна (Рисунок 3). 1, 3 – PCL волокна, 2, 4 – PCL волокна с VEGF Рисунок 3 – Световая микроскопия полимерных волокон, изготовленных методом электроспиннинга Оценка морфологии PCL матриксов с использованием сканирующей электронной микроскопии показала, что все образцы состояли из хаотично переплетенных полимерных волокон. При этом волокна PCL матриксов были равномерными по толщине и не имели выраженных дефектов. Средний диаметр волокон составил 2,521±0,490 мкм. Матриксы, содержащие VEGF, в свою очередь, были образованы волокнами, значительно варьирующими по диаметру от 0,142 до 10,714 мкм (Рисунок 4). Появление в PCL образцах после 58 инкорпорирования молекул VEGF волокон, имеющих размеры значительно ниже, чем в матриксах с чистым PCL, вероятно, связано с увеличением проводимости и диэлектрической проницаемости в результате введения водной фазы в раствор полимера перед проведением электроспиннинга [14]. 1 – PCL графт, 2 – PCL графт с VEGF Рисунок 4 – Сканирующая электронная микроскопия поверхности сосудистых графтов. Несмотря на возникновение неоднородности диаметра волокон графта, к которой привело введение в полимер ростового фактора, сохранялась пористая структура материала. Кроме того, образовавшиеся наноразмерные волокна сделали материал более сходным по структуре с внеклеточным матриксом, для которого характерны фибриллярные белки, имеющие наноразмеры. Волокна же с большим диаметром способствовали формированию крупных пор, которые должны обеспечить лучшее проникновение клеток внутрь полимерных матриксов. Также некоторые недостатки в структуре полимерного графта, отличающие его от нативного внеклеточного матрикса, могут быть компенсированы in vivo созданием биологически активной среды для пролиферации клеток с помощью ростового фактора. Для того, чтобы оценить изменение прочности и эластичности сосудистых графтов после инкорпорирования молекул ростового фактора, было проведено 59 сравнение данных изготовленными параметров при образцов аналогичных из условиях 14% PCL с протезами, электроспиннинга, но с добавлением VEGF. Как и ожидалось, после введения биомолекул в полимерное PCL волокно происходило значительное снижение показателей прочности, а также упруго-деформативных свойств материала (Таблица 2). Так показатель прочности уменьшался до 1,13 Мпа, эластичности – до 175,10%, а модуль Юнга для материала PCL с VEGF составил 1,40 Н/мм2. Это связано с тем, что водные домены создают внутри волокна дополнительные точки, не способные выдерживать нагрузку. В этих местах чаще всего происходит повреждение полимерной нити. Тем не менее, по своим физико-механическим свойства PCL графтов с VEGF не уступали используемым на сегодняшний день сосудистым ксенопротезам (p>0,05). Таблица 2 – Физико-механические свойства сосудистых графтов Графт PCL (n=10) PCL с VEGF (n=10) Ксенопротез (n=10) Прочность, Относительное Емод, МПа удлинение, % Н/мм2 Мe Мe Мe (25%; 75%) (25%; 75%) (25%; 75%) 2,64* 669,2* 1,92* (2,40; 2,81) (589,2; 849,1) (1,41; 2,13) 1,13 175,10 1,40 (1,11; 1,24) (154,62; 182,54) (1,20; 1,49) 1,26 95,4 0,28 (0,85; 1,42) (79,8; 100,6) (0,24; 0,34) Примечание: *- p<0,05 по сравнению с ксенопротезом Данные результаты свидетельствуют о существенном влиянии введения молекул VEGF в структуру PCL в процессе электроспиннига на толщину волокна. Но при этом отмечается сохранение высокопористой структуры материала. В то же время, сосудистые графты, полученные методом двухфазного 60 электроспиннинга имеют оптимальные физико-механические свойства, что сделало возможным их исследование в экспериментах in vivo в качестве временных матриксов для регенерации тканей кровеносного сосуда. Резюме На основании результатов проведенного исследования, можно заключить, что при изготовлении сосудистых графтов из PCL методом электроспиннинга существенное влияние на свойства материала оказывает концентрация полимера в растворе. Так с увеличением концентрации возрастала прочность и эластичность сосудистых графтов. Наилучшими показателями физико- механических свойств обладали образцы из 14 и 16 % PCL (p<0,05 ). Кроме того, по своим показателям упруго-деформативных свойств данные PCL графты превосходили биологические сосудистые протезы. Различий по прочностным характеристика между образцами из одной концентрации полимера, изготовленными при значениях напряжения 15 кВ и 25 кВ, обнаружено не было. Концентрация полимера также влияла и на морфологию поверхности материла. Графты из 10% PCL были образованы волокнами со множеством утолщений, при этом с увеличением концентрации полимера количество дефектов на нитях заметно снижалось. Образцы из 14 и 16% не имели в своем составе волокон с выраженными дефектами. Также возрастание концентрации полимерного раствора приводило к увеличению диаметра волокна. По результатам сравнения графт, состоящий из волокон с наименьшим диаметром и без дефектов, был изготовлен из 14% PCL при напряжении 15 кВ. Основываясь на особенностях физико-механических свойств и морфологии материала, для модификации ростовым фактором был выбран PCL графт, изготовленный из 14% раствора PCL при 15 кВ. Это обусловлено тем, что хорошие прочностные свойства, а также высокопористая структура данных матриксов наиболее близка к свойствам биологического межклеточного матрикса. 61 Инкорпорирование молекул VEGF в структуру полимерного волокна методом двухфазного электроспиннинга привело к изменению морфологии графта, а именно волокна значительно варьировали по диметру, но при этом не имели утолщений в форме “бусин” и других дефектов. Кроме того, сохранялась пористая структура материала. Также, наблюдали снижение прочности и эластичности графтов с VEGF относительно образцов из чистого PCL. Однако, значения физико-механических свойств сосудистых графтов из PCL с VEGF достоверно не отличались от данных показателей для сосудистых ксенопротезов. Таким образом, сосудистые графты, изготовленные методом электроспиннинга из 14% PCL при напряжении 15 кВ, как с инкорпорированным VEGF, так и не содержащие в своем составе биомолекул, обладают оптимальными физико-механическими свойствами и высокопористой структурой. Все это сделало возможным дальнейшее использование данных материалов в качестве временных протезов для восстановление кровеносного сосуда и проведение исследований по оценке влияния VEGF на биологические свойства PCL графтов как in vitro, так и in vivo экспериментах. 62 ГЛАВА 4 ВЛИЯНИЕ VEGF НА БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ PCL ГРАФТА 4.1 Определение выхода молекул VEGF из PCL графтов и их биоактивности Важным свойством полимерных конструкций, содержащих ростовые факторы, является оптимальная кинетика выхода этих молекул в месте имплантации. Скорость выхода ростового фактора и сохранение его биологических свойств имеет большое значение для поддержания процесса восстановления тканей. Кинетику выхода молекул VEGF из матриц и их биоактивность изучали в течение 80 дней, поскольку в первые месяцы после имплантации происходит эндотелизация кровеносных протезов, кроме того, этот период важен для регуляции процессов, происходящих в тканях в результате взаимодействия с чужеродным материалом [69, 204]. Перед проведением эксперимента все образцы обрабатывали 70% раствором этилового спирта, а затем отмывали в фосфатно-солевом буфере, таким же образом, как и при подготовке графтов для имплантации. Сосудистый PCL графт помещали в инкубационную среду, в качестве которой использовали фосфатно-солевой буфер. В каждую контрольную точку эксперимента в образце определяли количество вышедшего ростового фактора и его биологическую активность. Результаты, полученные при оценке количества вышедшего VEGF, показали, что выделение ростового фактора из графта происходило на протяжении всего эксперимента, при этом за 80 дней из матрицы выделилось 531,88 пг VEGF (Рисунок 5). В первые четыре дня наблюдался значительный выброс биологически активных молекул, который в среднем составил 207 пг. Далее начиная с пятых суток исследования, выделение ростового фактора в 63 буфер происходило с относительно постоянной скоростью – 30,08±2,82 пг в 4 дня. пг 600 500 400 300 200 100 0 1 2 4 8 12 16 20 24 28 32 40 48 64 сут 80 Рисунок 5 – Динамика накопления VEGF в буфере (80 суток) Однако, в ряде работ по выходу биомолекул из полимерных матриксов, изготовленных методом электроспиннинга, отмечается быстрый выход молекул в первые 12-24 часа, с последующим замедлением скорости высвобождения [155, 176]. Данная закономерность связана с процессами, происходящими при деградации полимера. Во время изготовления матриц методом электроспиннинга белковые молекулы растворяют в фосфатно-солевом буфере. После изготовления внутри полимерного волокна образуются водные резервуары с растворенными ростовыми факторами (Рисунок 6). Кроме этого, ростовые факторы располагаются и в порах на поверхности полимерных нитей [169]. После того, как матрицу погружают в водную среду, белок с поверхности волокна смывается, открывая поры, которые связаны с внутренними резервуарами, содержащими ростовые факторы. Ростовые факторы диффузно выходят через заполненные жидкостью поры. Этим обуславливается высокий уровень высвобождения молекул в первые часы эксперимента. Со временем полимер начинает деградировать, что приводит к увеличению подвижности полимерных цепей, раскрытию других участков волокна и облегчению диффузии белков из матрикса [172]. Так как PCL представляет собой медленно 64 деградируемый полимер, то последующий выход ростовых факторов значительно замедляется. I. Ростовые факторы располагаются в III. Ростовые факторы выходят через поры из резервуарах фосфатно-солевого буфера и в внутренних резервуаров порах на поверхности волокна. IV. Увеличение подвижности полимерных II. После погружения материала в водный цепей и дальнейший выход молекул из раствор, волокна. молекулы ростовых факторов вымываются с поверхностных пор. Рисунок 6 – Описание гипотезы механизма высвобождения ростовых факторов из PCL матриксов. В свою очередь, низкая скорость выхода молекул VEGF из PCL, полученная в данном исследовании, может быть обусловлена тем, что в результате антисептической обработки образцов и их отмывкой в фосфатносолевом буфере, произошло удаление ростового фактора с поверхности волокон и поверхностных пор. Следовательно, выход VEGF из сосудистых PCL графтов происходил за счет высвобождения из внутренних резервуаров волокна и деградации полимера. При этом возможно, что более быстрое высвобождение 65 VEGF в первые четверо суток было связано с его вымыванием через поры. Дальнейший же выход биомолекул осуществлялся в процессе деградации PCL. Кроме того, учитывая слабую устойчивость VEGF, нельзя предполагать, что после выхода ростового фактора из PCL матрикса, он может сохраняться в растворе в течении 80 дней. Вероятнее всего концентрация VEGF в растворе поддерживалась и увеличивалась также за счет его постоянного выхода из полимерных волокон. Медленный выход VEGF обусловлен низкой скоростью деградации полимера. Тем не менее, такая кинетика высвобождения биомолекул способна обеспечить пролонгированную доставку ростового фактора в место имплантации для формирования новой ткани. Кроме того, длительный период деградации полимера и медленное высвобождение вещества в окружающие ткани снижают риск быстрого выделения большой дозы ростового фактора и, в случае сосудистых графтов, последующих системных побочных эффектов при попадании в кровь. Сохранение биологической активности молекул VEGF после выхода из PCL графта является критическим моментом данной работы. Биоактивность ростового фактора эндотелиальных изучали клеток. по Для способности проведения вызывать исследования пролиферацию использовали эндотелиальные клетки человека перевиваемой линии EA.Hy926. Клетки линии EA.Hy926 воспроизводят основные морфологические, фенотипические и функциональные характеристики, присущие эндотелиальным клеткам макрососудов [11]. Для определения активности ростового фактора клетки культивировали в течение 72 часов в питательной среде с добавлением раствора, который содержал VEGF, высвобожденный из полимера. Биоактивность ростового фактора определяли в течение 80 дней в тех же временных точках, что и количество вышедшего VEGF. В качестве контроля использовали культуральную среду с фосфатно-солевым буфером, не контактировавшим с графтом и не содержащим биологически активных молекул. 66 Ростовой фактор, выделившийся из полимерного материала за первые двое суток, не показал выраженного влияния на пролиферацию эндотелиальных клеток по отношению к отрицательному контролю (Рисунок 7). Значительную биологическую активность (p<0,01) продемонстрировала инкубационная среда с раствором VEGF, вышедшим в течение 4 суток, по сравнению с контрольной средой, а также фосфатно-солевым буфером, взаимодействовавшим с материалом графта в течение 2 суток. С увеличение времени инкубации PCL графтов в VEGF растворе, наблюдали усиление его способности оказывать пролиферативное действие на эндотелиальные клетки. Наибольший уровень пролиферации клеток отмечался в среде с добавлением раствора, контактировавшего с полимерным образцом в течение 80 суток. ОП 1 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0 сут Рисунок 7 – Пролиферация клеток EA.Hy 926 в среде, контактировавшей с графтом PCL с VEGF разные интервалы времени в течении 80 суток При оценке пролиферации клеток определили зависимость способности VEGF вызывать клеточный ответ от его концентрации, данные результаты представлены на графике (Рисунок 8). Согласно полученной кривой минимальная концентрация вышедшего из полимерных волокон ростового 67 фактора, которая стимулировала пролиферацию эндотелиальных клеток, составила 79,57 пг/мл. Дальнейшее увеличение содержания VEGF в питательной среде приводило к усилению пролиферативной активности клеток. В свою очередь, известно, что VEGF может стимулировать деление эндотелиальных клеток in vitro уже при концентрации 50 пг/мл [211]. ОП 1 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0 0 50 100 200 пг/мл 150 Рисунок 8 – Пролиферация клеток EA.Hy 926 при различных увеличении концентрации VEGF в культуральной среде Данные, полученные при оценке пролиферации эндотелиальных клеток, которые культивировали в питательной среде, содержащей различные концентрации VEGF, показали, что молекулы ростового фактора после выхода из PCL графта сохраняли свою биологическую активность. Кроме того, выброс биомолекул из графта в очень низких дозах обуславливал способность VEGF поддерживать плавный митогенный эффект на эндотелиальных клетках. Полученные результаты позволяют заключить, что полимерные сосудистые графты с VEGF способны обеспечить высвобождение ростового фактора в окружающую среду как минимум в течение первых 80 дней. Выход биомолекул происходит из глубоких пор полимерного волокна и в процессе 68 деградации PCL. Вышедшие молекулы ростового фактора сохраняют свою биологическую активность, что проявляется в их способности стимулировать пролиферацию эндотелиальных клеток в условиях in vitro. 4.2 Оценка влияния молекул VEGF на способность PCL графтов адгезировать клетки in vitro Важным феноменом, оказывающим влияние на морфологию клеток, их миграцию, рост и дифференцировку на поверхности биоматериала является адгезия [206]. На сегодняшний день известны свойства синтетических биодеградируемых полимеров, позволяющие использовать их в качестве искусственного матрикса для культивирования клеток. При этом особое внимание уделяется матриксам, изготовленным методом электроспиннинга [153]. Их преимущества относительно пористых материалов, полученных с использованием других методов, заключаются в морфологии, которая оказывает влияние на прикрепление клеток. Значительная площадь поверхности данных материалов способствует абсорбции большого количества белков, которые обеспечивают сайты связывания для клеток [173]. В различных исследованиях были осуществлены удачные попытки посадить клетки на синтетические биодеградируемые матриксы, изготовленные методом электроспиннинга. В частности показано прикрепление клеток к чистому PCL, а также к PCL с обработкой для усиления адгезивных свойств материала. Так в экспериментах с матриксами из PCL, а также из PCL с полиэтилен оксидом была продемонстрирована адгезия и пролиферация фибробластов кожи человека на исследуемых материалах, кроме того была установлена зависимость изучаемых показателей от размера пор [121]. Кроме того, в ряде работ получены результаты по возможности культивирования на PCL матриксах кератиноцитов, мезенхимальных клеток и др [51, 173]. клеток надкостницы, хондроцитов, 69 Для оценки сродства клеток к материалу наиболее широко используют метод культивирования клеток на поверхности образцов [75]. Учитывая влияние морфологии искусственных матриксов, изготовленных методом электроспиннинга на способность адгезировать клетки, в данном разделе работы исследовали прикрепление клеток к поверхности сосудистых PCL графтов, а также влияние на этот процесс молекул VEGF, введенных в полимер. Для проведения эксперимента использовали эндотелиальные клетки линии EA.Hy926 и мезенхимальные стволовые клетки крысы. Эндотелиальные клетки имеют значение в формировании новой сосудистой ткани, а именно, образуя монослой, они обеспечивают тромборезистентность внутренней поверхности кровеносного сосуда, а также препятствуют гиперплазии неоинтимы, ингибируя биомолекулы, стимулирующие миграцию гладкомышечных клеток, их пролиферацию и синтез внеклеточного матрикса [216]. В свою очередь мезенхимальные стволовые клетки мигрируют в зону повреждения и, осуществляя секрецию растворимых факторов, создают микросреду благоприятную для регенерации тканей. Также известна способность МСК приобретать характеристики гладкомышечных стволовых клеток, при воздействии различных биохимических факторов [26]. Кроме того, исследования in vitro и in vivo позволили четко определить, что МСК костного мозга вносят значительный вклад в формирование кровеносных сосудов у взрослых, так называемый неоваскулогенез [24]. Оценку адгезии эндотелиальных и мезенхимальных стволовых клеток к PCL и PCL с VEGF графтам проводили через 2, 4 и 6 дней после начала культивирования с помощью окрашивания полимерных матриксов с клетками флуоресцентным красителем. Результаты культивирования клеток на графтах продемонстрировали низкую адгезию мезенхимальных стволовых клеток к образцам из PCL как чистым, так и с ростовым фактором (Рисунок 9). О чем свидетельствует меньшее число клеток на обоих видов полимерных материалов по сравнению с МСК, 70 адгезированными к поверхности планшетов после 2 суток культивирования (p<0,01). Рисунок 9 – Адгезия и пролиферация МСК 926 на графтах PCL и PCL с VEGF. Флуорисцентное окрашивание PKH26. Увеличение ×100 Среднее число МСК на образцах из PCL составило 44 клетки/поле зрения, на PCL с VEGF – 47,5 клеток/поле зрения, а в группе контроля – 79,5 клеток/поле зрения (Рисунок 10). При этом не было обнаружено достоверных различий между матриксами из PCL и PCL c VEGF (p>0,01). В течение всего исследования не наблюдали значительного роста клеточной культуры на обоих видах графтов по сравнению с контролем. К 6 суткам количество клеток на культуральном пластике превышало число клеток на PCL примерно в 7 раз и на PCL c VEGF – в 4,3 раза. 71 Несмотря на отсутствие различий между культурами клеток на обоих видах полимерных образцов, результаты флуоресцентной микроскопии показали, что на PCL графтах без ростового фактора мезенхимальные стволовые клетки располагались преимущественно на поверхности (Рисунок 11). В то же время на графтах с VEGF клетки находились не только на поверхности, но и проникали в глубину матрикса между волокнами. клеток в поле зрения 300 250 Без матрикса PCL PCL с VEGF 200 150 100 * 50 * ** ** *** *** 0 2 суток 4 суток 6 суток * - p<0,01 относительно образцов, культивированных без матрикса 2 суток ** - p<0,01 относительно образцов, культивированных без матрикса 4 суток *** - p<0,01 относительно образцов, культивированных без матрикса 6 суток Рисунок 10 – Количество МСК на PCL графтах и на PCL графтах с VEGF через 2, 4 и 6 суток культивирования Эндотелиальные клетки также демонстрировали адгезию к PCL и PCL с VEGF графтам, что было отмечено при микроскопии после двух суток культивирования (Рисунок 12). Разницы в количестве клеток между двумя видами материала не было обнаружено (Рисунок 13). С 2 до 4 суток культивирования количество клеток на обоих полимерных образцах увеличивалось. На матриксах из PCL рост клеточной культуры был незначительным – c 183 до 297,5 клеток/поле зрения, а на PCL с VEGF наблюдали выраженную пролиферацию c возрастанием числа EA.Hy 926 с 141,5 до 632,5 клеток/поле зрения. При этом через 4 дня их число на PCL графтах, 72 содержащих VEGF, превышало данный показатель на чистых PCL матриксах в 2,1 раза. 1– МСК на PCL, 3 – EA.Hy 926 на PCL, 2 – МСК на PCL с VEGF, 4 – EA.Hy 926 на PCL с VEGF Рисунок 11 – Клетки, адгезированные на полимерных графтах через 2 суток культивирования. Флуоресцентное окрашивание PKH26. Увеличение ×100. Такая же картина наблюдалась и через 6 суток: количество клеток увеличилось относительно 4 суток наблюдения на всех образцах, в то же время на графтах с ростовым фактором их число значительно преобладало. Так среднее количество клеток на образцах графтов с ростовым фактором составляло 1384 клетки/поле зрение, что было в 2,2 больше данного показателя на этом же виде матрикса на 4 сутки эксперимента. Кроме того, наличие VEGF в структуре PCL способствовало увеличению числа клеток на материале в 3,3 раза по сравнению с чистым PCL образцом. На 6 сутки культивирования клетки полностью покрывали матрикс с VEGF, а также значительно инфильтрировали во внутренние слои. Также отмечали, что в отличие от мезенхимальных стволовых 73 клеток эндотелиальные клетки проникали через поры в толщу матрикса не только на образцах с ростовым фактором, но также и из чистого PCL (Рисунок 11). Рисунок 12 – Адгезия и пролиферация эндотелиальных клеток EA.Hy 926 на графтах PCL и PCL с VEGF. Флуорисцентное окрашивание PKH26. Увеличение ×100 PCL представляет собой гидрофобный полимерный материал. Угол смачивания для изделий из данного полимера, как пленочных так и состоящих из волокон, превышает 80º. Известно, что материалы с такими свойствами без дополнительной модификации препятствуют клеточной адгезии и пролиферации [110]. Данный эффект может объяснять сравнительно небольшое количество мезенхимальных стволовых клеток прикрепившихся к поверхности PCL графта, а также низкую их скорость пролиферации в течение 6 дней. 74 клеток в поле зрения *** 1600 1400 1200 1000 800 600 400 200 0 Без матрикса PCL PCL с VEGF ** * 2 суток 4 суток 6 суток * - p<0,01 относительно образцов, культивированных без матрикса 2 суток ** - p<0,01 относительно образцов, культивированных без матрикса и на PCL 4 суток *** - p<0,01 относительно образцов, культивированных без матрикса и на PCL 6 суток Рисунок 13 – Количество эндотелиальных клеток EA.Hy 926 на PCL графтах и на PCL графтах с VEGF через 2, 4 и 6 суток культивирования Введение в полимер молекул VEGF никак не повлияло на адгезию и размножение МСК. Однако, в работе Ball S.G. соавторами было показано, что VEGF способен индуцировать миграцию и пролиферацию МСК через связывание с рецепторами PDGFRα и PDGFRβ, для обнаружения данного эффекта авторы использовали ростовой фактор в концентрации 10 нг/мл [23]. В настоящем исследовании подобного влияния матриксов с VEGF на клетки не наблюдалось, что может быть связано с недостаточной концентрацией биомолекул, вышедших из графта за время культивирования. Несмотря на свою слабую адгезивную способность PCL матриксы, как с ростовым фактором так и без него, выступали в качестве механической основы и способствовали поддержанию жизнеспособности прикрепившихся клеток, так как не было обнаружено достоверного снижения количества МСК на протяжении эксперимента. Быстрый рост числа эндотелиальных клеток на полимерных графтах в течение всего эксперимента по сравненю с МСК обусловлен высокой скоростью пролиферации клеток линии EA.Hy 926. Значительное увеличение количества 75 эндотелиальных клеток на PCL графтах с VEGF относительно образцов без ростового фактора через 4 и 6 суток после начала культивирования, вероятно, связана с достаточным накоплением к этому времени ростового фактора после его выхода из полимерных волокон в питательной среде для проявления митогенной активности, что было показано в п. 4.1. Особый интерес вызывает разница в расположении клеток в структуре полимерных графтов. МСК на PCL матриксах находились в основном на поверхности материала, в то же время на образцах с VEGF клетки данной культуры были обнаружены между полимерными волокнами в более глубоких слоях. Очевидно, что проникновение МСК во внутрь графта PCL с VEGF обусловлено более крупными волокнами данного матрикса по сравнению с чистым PCL. Увеличение диметра полимерных волокон после введения молекул ростового фактора привело к укрупнению пор в материале, что способствовало миграции клеток внутрь графта и его заселению. В то же время эндотелиальные клетки могли проникать между волокнами как в PCL так и в PCL с VEGF графтах, что обусловлено меньшим размером EA.Hy 926 клеток относительно МСК. Так размер МСК, адгезированных на поверхности полимерных образцов, составлял 37,44±6,65 мкм, а эндотелиальных клеток – 17,63±2,99 мкм. Способность обеспечивать миграцию клеток внутрь стенки является важной характеристикой тканеинженерного графта. Это связано с тем, что на искусственных матриксах клетки в большинстве случаев быстро адгезируются и пролиферируют по внешнему краю, препятствуя клеточной инфильтрации материала и формированию ткани [15]. Таким образом, структура PCL матриксов с икорпорированным VEGF была благоприятна для клеточной инфильтрации материала. Она способствовала оптимальному функционированию клеток, а именно их миграции и адгезии между волокнами. Кроме того, ангиогенный ростовой фактор создавал биологически активное окружение, приводя к активной пролиферации эндотелиальных клеток in vitro. Такие свойства PCL графтов с VEGF сходны с функциями нативного внеклеточного матрикса, который формирует 76 функциональную среду для передачи сигналов и питательных веществ к клеткам, обеспечивая поддержание их жизнедеятельности [199]. Результаты исследования позволяют заключить, что матриксы из PCL несмотря на слабые адгезивные свойства могут способствовать прикреплению на свою поверхность МСК и эндотелиальных клеток. Также, введение VEGF в структуру полимера не оказывает влияния на адгезию и пролиферацию МСК, но при этом обеспечивает быстрый рост культуры эндотелиальных клеток на полимерном матриксе. Кроме того, инкорпорирование молекул VEGF в PCL приводит к увеличению волокон и пор материала, изготовленного методом электроспиннинга, что в свою очередь способствует миграции во внутрь графта как эндотелиальных клеток, так и более крупных МСК. Резюме Результаты настоящей работы демонстрируют, что молекулы ростового фактора высвобождались из графтов PCL с VEGF через глубокие поры в волокне, а также в процессе деградации полимера. Относительно быстрый выход биомолекул происходил в течение первых четырех суток – 207 пг. Далее средняя скорость увеличения концентрации ростового фактора в растворе составляла 30,08±2,82 пг в 4 дня и сохранялась постоянной до конца периода наблюдения. После выхода из полимерного матрикса VEGF демонстрировал сохранение своей биологической активности, что определяли по его способности стимулировать пролиферацию эндотелиальных клеток. Ростовой фактор проявлял биологическую активность при достижении концентрации 79,57 пг/мл. Увеличение концентрации ростового фактора в среде приводило к усилению пролиферации клеток. В проведенном исследовании не было отмечено разницы в способности адгезировать клетки между PCL и PCL с VEGF графтами. Однако, выход биологически активного VEGF из PCL графта стимулировал пролиферацию эндотелиальных клеток на поверхности материала. При этом матриксы с 77 ростовым фактором не оказывали влияние на увеличение количества адгезированных МСК в течение 6 суток культивирования Кроме того, увеличение диаметра волокон и пор в графтах после введения молекул VEGF облегчало проникновение и МСК, и эндотелиальных клеток в внутрь стенки графта, что способствовало ее инфильтрации клеточными культурами. Таким образом, PCL графты, содержащие инкорпорированный VEGF, могут обеспечивать пролонгированное высвобождение ростового фактора в окружающую среду с сохранением его биологической активности. Данные матриксы способны адгезировать МСК и эндотелиальные клетки, а инкорпорированный VEGF стимулирует пролиферацию эндотелильных клеток. 78 ГЛАВА 5 ОСОБЕННОСТИ ВОССТАНОВЛЕНИЯ ТКАНЕЙ НА ОСНОВЕ PCL ГРАФТА ПОД ВЛИЯНИЕМ VEGF 5.1 Изучение реакции тканей на PCL графт после введения ростового фактора в эксперименте in vivo Имплантация в организм любых биоматериалов сопровождается хирургической процедурой, приводящей к нарушению целостности тканей, и способствует возникновению ответной реакции на инородное тело и повреждение [4]. имплантированным Обычной реакцией материалом является организма процесс при контакте репарации, а с не регенеративное восстановление тканей [17]. Это связано с тем, что репарация направлена на быстрое восстановление функций поврежденных органов, и при этом не происходит формирования структур, обладающих свойствами исходной ткани. Такой репаративный ответ организма может быть причиной осложнений, например, при имплантации сосудистых протезов и тканеинженерных графтов для регенерации in situ. Образование фиброзной капсулы вокруг имплантата может препятствовать миграции клеток внутрь пор, его полной инфильтрации, а также васкуляризации [59]. Для того чтобы оценить реакцию тканей на PCL графт и PCL графт с VEGF, изготовленные методом электроспиннинга, образцы данных материалов имплантировали внутрибрюшинно крысам на срок 2, 3 и 4 месяца с последующим проведением гистологических исследований. Кроме того, учитывая выраженную функцию VEGF – стимулировать ангиогенез, изучали влияние данного ростового фактора после инкорпорирования в полимер на степень прорастания материала капиллярами. Для этого проводили гистохимический анализ обоих видов PCL графтов с использованием антител к CD31, маркеру эндотелиальных клеток. 79 Макроскопическое исследование графтов через 2, 3 и 4 месяца после имплантации, показало прорастание образцов капиллярной сетью во всех точках эксперимента. При этом визуально на PCL графтах, содержащих VEGF, капиллярная сеть была обширнее, чем на графтах из чистого PCL. При гистологическом исследовании PCL и PCL с VEGF графтов, а также окружающих их тканей обнаружена полная инфильтрация всех образцов грануляционной тканью (Рисунок 14). Рисунок 14 – Гистологическое исследование сосудистых графтов из PCL и PCL с VEGF через 2, 3 и 4 месяца после имплантации в брюшную полость крыс. Световая микроскопия, окраска гематоксилин и эозин. Увеличение ×200 80 В гранулеме обнаружены гигантские многоядерные клетки, ядра которых расположены в виде кольца или полулуния, а также отмечали наличие фибробластов, единичных макрофагов и большое количество внеклеточного матрикса, состоящего из коллагеновых и эластиновых волокон, на всех образцах (Рисунок 15). Образование капсулы из соединительной ткани вокруг имплантатов наблюдали уже в первой контрольной точке, то есть ко второму месяцу исследования (Рисунок 16). Фиброзная капсула вокруг полимерных образцов с ростовым фактором и без него имела относительно небольшую толщину, состояла из параллельно расположенных коллагеновых волокон и фибробластов. Признаков острого воспаления не было отмечено ни в одном из случаев. 1 – PCL графт, 2 – PCL графт с VEGF Рисунок 15 – Гигантские многоядерные клетки инородных тел в грануляционной ткани, ифильтрирующей сосудистые графты из PCL и PCL с VEGF через 4 месяца после имплантации в брюшную полость крыс. Световая микроскопия, окраска гематоксилин и эозин. Увеличение ×400 81 1 – PCL графт, 2 – PCL графт с VEGF Рисунок 16 – Фиброзная капсула вокруг сосудистых графтов из PCL и PCL с VEGF через 2 месяца после имплантации в брюшную полость крыс. Световая микроскопия, окраска гематоксилин и эозин. Увеличение ×100 Ангиогенные свойства материалов исследовали путем определения количества капилляров на 1 мм2 по CD31-положительной окраске эндотелиальных клеток, образующих стенки мелких кровеносных сосудов, на графтах из PCL и PCL с VEGF после внутрибрюшной имплантации (Рисунок 17). При подсчете учитывали капилляры, которые были образованы несколькими расположенными по кругу CD31-окрашенными клетками. Единичные клетки с CD31-положительной окраской не учитывали. Ко второму месяцу на PCL графтах, содержащих ростовой фактор, количество капилляров превышало аналогичный показатель на чистых PCL образцах (p<0,01) (Рисунок 18). Далее к третьему месяцу исследований наблюдали достоверное увеличение количества капилляров на PCL с VEGF по сравнению с образцами, эксплантированными во второй месяц. Такая же закономерность наблюдалась и в третью контрольную точку эксперимента: количество капилляров на материале PCL с VEGF через 4 месяца после имплантации превышало их число в первую и вторую точку исследования (p<0,01). При этом уже через 3 месяца на графтах с ростовым фактором, обнаружены кровеносные сосуды, диаметром, превышающем 82 диаметр капилляра. В свою очередь не было обнаружено различий по количеству капилляров на матриксах без VEGF между 2, 3 и 4 месяцами исследования. Рисунок 17 – Гистохимическая окраска CD31-положительных кровеносных сосудов в тканях на PCL и PCL с VEGF графтах через 2, 3 и 4 месяца после имплантации в брюшную полость крыс. Световая микроскопия, дополнительная окраска гематоксилин и эозин. Увеличение ×200 83 капилляров / мм2 160 140 120 100 80 * 60 40 20 0 2 месяца *** ** PCL PCL+VEGF 3 месяца 4 месяца * - p<0,01 относительно PCL через 2 месяца имплантации ** - p<0,01 относительно PCL через 3 месяца имплантации *** - p<0,01 относительно PCL через 4 месяца имплантации Рисунок 18 – Количество капилляров на PCL и PCL с VEGF матриксах через 2, 3 и 4 месяца после внутрибрюшной имплантации Обширная инфильтрация клетками образцов из PCL и PCL с VEGF через 2 месяца после имплантации в брюшную полость крыс свидетельствовала о том, что оба вида материала обладали оптимальной морфологией, способствующей их прорастанию тканями in vivo. Материал из PCL, изготовленный методом электроспиннинга, играл роль временного матрикса и тем самым выполнял опорную функцию для клеток, а также обеспечивал механическую прочность ткани. Кроме того, благодаря высокопористой структуре PCL матриксы были способны адсорбировать на своей поверхности огромное количество адгезивных белков после имплантации в организм. Известно, что многие белки, которые обеспечивают адгезию клеток, а также участвуют в регуляции реакции воспаления, адсорбируются на поверхности имплантата непосредственно при контакте с физиологическими жидкостями [34]. К таким белкам относятся фибронектин, фибриноген, иммуноглобулины, витронектин и др. В ряде исследований также отмечается, что поведение клеток зависит от гидрофобности материала, это может быть связано с влиянием смачиваемости на количество адсорбированных белков и их видов [59]. Гидрофобные поверхности, как правило, адсорбируют больше белков, а в то время как гидрофильные – 84 препятствуют адсорбции [222]. Белки на поверхности искусственного матрикса опосредуют клеточную адгезию, а также способствуют передачи сигналов в клетки через рецепторы клеточной адгезии, преимущественно интегрины. Адгезированные на материале клетки могут осуществлять передачу сигналов в окружающие ткани с помощью активных биологических молекул, регулируя тем самым продукцию и депонирование внеклеточного матрикса, а также пролиферацию и дифференцировку клеток [39]. Вероятно, гидрофобность и пористая структура изучаемых в данной работе PCL и PCL с VEGF графтов способствовали адсорбции большого количестваа адгезивных белков, что в результате привело к активному росту ткани внутрь полимерного матрикса. Также, на обоих видах графтов отмечали наличие гигантских многоядерных клеток инородных тел. Гигантские многоядерные клетки инородных тел образуются на поверхности имплантата в результате слияния цитоплазмы нескольких макрофагов и участвуют в реакции на инородное тело. Несмотря на то, что PCL является биосовместимым, большое влияние на реакцию тканей оказывает форма, в которой используется материал. Так на пористых материалах, имеющих высокое значение отношения площади поверхности к объему, после имплантации наблюдается большее количество макрофагов и гигантских многоядерных клеток инородных тел, чем на гладких имплантатах [17]. Адекватная реакция на инородное тело способна поддерживаться в течение всего периода пребывания имплантата в организме. Все это объясняет присутствие гигантских многоядерных клеток инородных тел как на PCL, так и на PCL с VEGF графтах в течение 4 месяцев после внутрибрюшинной имплантации крысам. В то же время значительного различия в количестве данных клеток на матриксах с ростовым фактором и без него не отмечали. Однако, важным элементом в формировании характера и степени реакции гигантских многоядерных клеток инородных тел является цитокиновый профиль, ассоциированный с воспалительным ответом [126]. Heidenhain с соавторами в своей работе по испытанию на модели крысы 85 децеллюляризированного сосудистого графта, покрытого полилактидом с инкорпорированными молекулами VEGF, отмечали значительное количество гигантских клеток на образцах, содержащих ростовой фактор, по сравнению с контролем [72]. Такие результаты позволили авторам предположить, что VEGF каким-то образом способен провоцировать, либо стимулировать уже начавшееся образование гигантских клеток на имплантируемом материале. В настоящей работе подобных закономерностей выявлено не было, что может быть связано как с количеством ростового фактора, поступающего в окружающие ткани, так и с особенностями биодеградации полимеров. Известно, что полилактид имеет быструю скорость деградации, что способствует выбросу инкорпорированных биомолекул в значительном количестве. Кроме того, продуктом расщепления полилактида является молочная кислота, которая способствуют закислению среды в месте имплантации, что также может быть причиной образования большого количества гигантских многоядерных клеток инородных тел [78]. PCL в свою очередь в процессе деградации не приводит к изменению pH в окружающих тканях и обеспечивает выделение ростового фактора в низких дозах. Фибробласты пронизывающие и обширные пористые образцы участки PCL и соединительной PCL с VEGF ткани, графтов свидетельствовали о нормальном протекании реакции ремоделирования искусственного биодеградируемого матрикса. В результате взаимодействия с таким материалом макрофагальная реакция не ослабевает. Макрофаги и гигантские клетки продолжают фагоцитировать и резорбировать материал, чем в свою очередь и усиливают протекающую реакцию. Клетки постепенно проникают в поры синтетического матрикса, где активно синтезируют внеклеточное вещество, постепенно замещая материал соединительной тканью, которая впоследствии частично или полностью восстанавливается. Время протекания макрофагальной реакции напрямую зависит от скорости деградации полимера. PCL, как медленно деградируемый материал, способен поддерживать данную реакцию на протяжении не менее 4 месяцев, о чем свидетельствуют 86 полученные результаты. Кроме того, вокруг графтов обоих видов имелась соединительнотканная капсула, характерная для биоинертных материалов [4]. Различий в строении фиброзной капсулы вокруг имплантатов в двух группах сосудистых графтов не отмечали. На основе полученных результатов можно заключить, что, вероятно, VEGF после выхода из волокон PCL графта не оказывает влияния на скорость протекания воспалительно-репаративной реакции и образование фиброзной капсулы вокруг полимерного материла при имплантации в организм. На сегодняшний день показано, что доставка VEGF в зону регенерации тканей с помощью инкорпорирования в биодеградирумые полимеры способствует прорастанию кровеносных сосудов в пористые искусственные матриксы [6]. Но в тоже время остается неизвестным насколько стабильным является процесс неоваскуляризации полимерного материала, индуцированной молекулами VEGF после их выхода в окружающие ткани, в долгосрочном периоде. Большое значение в поддержания васкуляризации полимерного матрикса имеет длительность выделения ростового фактора. Тем не менее, продолжительность доставки, по-видимому, является не единственным фактором, влияющим на стабильность кровеносных сосудов, что было показано в эксперименте с включение и выключением продукции VEGF на модели трансгенных мышей. Авторы не обнаружили влияния периода выработки VEGF на стабильность кровеносных сосудов трахеи, формирование которых было индуцировано ростовым продемонстрировали фактором важность [151]. концентрации Davies с доставляемого соавторами VEGF в поддержании роста кровеносных сосудов на матриксах из полиуретана. Так, высокие концентрации VEGF приводили к быстрому росту кровеносных сосудов, но также вызывали их регрессию даже при продолжении доставки ростового фактора. Напротив, матриксы, содержащие средний уровень VEGF, не только индуцировали образование кровеносных сосудов, но и поддерживали их рост даже через 2 месяца после прекращения выделения ростового фактора [54]. 87 В настоящем исследовании было продемонстрировано, значительное увеличение количества капилляров на графтах, PCL содержащих инкорпорированные молекулы VEGF, по сравнению с образцами без ростового фактора через 2 месяца после имплантации в брюшную полость крыс. Полученные данные свидетельствуют о способности ростового фактора стимулировать васкуляризацию материала в результате устойчивой доставки биомолекул в место имплантации. Дальнейший рост сосудов на протяжении следующих двух месяцев свидетельствует об эффективности концентраций, в которых молекулы VEGF выделялись в окружающие ткани. Известно, что в организме VEGF имеет достаточно короткий период полураспада, который при системном введении ростового фактора составляет не более 30 мин [12]. Таким образом, его пролонгированное действие, показанное в данном исследовании, может быть связано с медленным высвобождением биомолекул из полимера. Пролонгированный выброс VEGF индуцировал образование более крупных капилляров, пронизывающих PCL матрикс, через 3 месяца после имплантации по сравнению с образцами без ростового фактора. Механизм определения диаметра кровеносного сосуда в процессе его роста в настоящее время раскрыт не до конца, но вероятно, что в него вовлечены взаимодействия между растворимыми программированием. факторами, Nakatsu с гемодинамикой соавторами в и генетическим своем исследовании продемонстрировали, что одним из способов контролировать диаметр сосуда является локальное изменение концентрации VEGF. Увеличение местной секреции или введения молекул VEGF вызывает усиление пролиферации эндотелиальных клеток, что является достаточным для стимуляции сборки сосуда с большим диаметром [218]. На основании результатов эксперимента с внутрибрюшинной имплантацией образцов сосудистых графтов из PCL и PCL с VEGF можно сделать заключение, что данные искусственные матриксы вызывают ответную реакцию организма на инородное тело с образованием грануляционной ткани и последующим ее созреванием в фиброзную ткань, что является характерным для 88 биосовместимых материалов. При этом выделение ростового фактора в месте имплантации из образцов, содержащих VEGF, не оказывает влияния на скорость протекания процессов инкорпорирование воспаления ростового и фактора регенерации в PCL тканей. графты Однако, способствует значительному усилению ангиогенеза на протяжении как минимум 4 месяцев, а также приводит к образованию кровеносных сосудов большего диаметра. 5.2 Формирование кровеносного сосуда на основе имплантированного PCL графта с VEGF Конечной целью сосудистой тканевой инженерии является создание на основе биоматериала графта, который будет не просто обеспечивать адгезию, миграцию и пролиферацию клеток in vitro и in vivo, но также и сможет взаимодействовать с тканями организма как полноценный функционирующий орган. В идеале, такой сосудистый графт должен подвергаться ангиогенезу и ремоделированию in vivo, постепенно заменяясь аутологичными тканями [215]. Возможно, процесс формирования кровеносного сосуда на основе полимерного графта можно оптимизировать с помощью использования ростовых факторов. Некоторые исследования демонстрируют положительный эффект ростовых факторов на ремоделирование имплантатов [66, 96]. Наиболее важным для стимуляции и контролирования ангиогенеза является VEGF. Zhou и соавторы показали, что покрытие децеллюляризированных сосудистых трансплантатов малого диаметра гепарином и молекулами VEGF значительно улучшало их проходимость [57]. Инкорпорирование VEGF в микросферы из полилактидов для локальной доставки способствовало усилению ангиогенеза в месте введения. Кроме того, в ряде работ было показано, что VEGF способствует эндотелизации, что гипотетически, может способствовать подавлению гиперплазии неоинтимы в сосудистых графтах [57, 58]. В то же время, в этих 89 работах демонстрируются эффекты VEGF на процесс ангиогенеза при кратковременной доставке ростового фактора в место имплантации. Данная часть работы посвящена исследованию формирования структур кровеносного сосуда на биодеградируемом PCL графте после его имплантации в кровеносное русло, а также влияния на этот процесс инкорпорированного VEGF. Сосудистые графты из PCL и PCL с VEGF с внутренним диаметром 2 мм имплантировали в брюшную часть аорты крыс с использованием прецизионной техники (Рисунок 19). Полимерные графты как с ростовым фактором так и без него продемонстрировали удобство в имплантации и прочное удерживание шовного материала. Кровотечений не наблюдали ни в одной из групп. Все животные дожили до конца наблюдения. 1 – операция по имплантации, 2 – имплантированный графт Рисунок 19 – Имплантация сосудистого графта из PCL в брюшную часть аорты крысы: Результаты ультразвукового мониторинга с допплерометрией через 1, 3, 5, 7 и 10 месяцев после имплантации демонстрировали проходимость всех протезов (Рисунок 20). За период наблюдения не было выявлено стенотических и аневризматических изменений, как самих графтов, так и в зонах анастомозов. 90 Рисунок 20 – Оценка проходимости сосудистых графтов с помощью ультразвукового исследования с допплерометрией через 10 месяцев после имплантации в брюшную часть аорты крысы. При макроскопическом исследовании эксплантированных графтов не было обнаружено кровотечений и видимых повреждений стенки (Рисунок 21). Графты обеих групп выглядели одинаково. На продольном разрезе отмечали образование внутренней выстилки, граница между графтом и нативной аортой в зоне анастомоза не визуализировалась. 1 – графт, имплантированный в 2 – поперечный разрез, брюшную аорту крысы, 3 – продольный разрез Рисунок 21 – Макроскопическая оценка эксплантированного сосудистого PCL графта. Гистологический анализ образцов показал образование в просвете всех PCL графтов, не содержащих ростовой фактор, пристеночного тромба, который 91 значительно препятствовал току крови (Рисунок 22). В свою очередь образцы, содержащие VEGF, имели пристеночный тромб в зоне анастомоза с сохранением просвета сосудистого протеза (Рисунок 23). Cтенка графтов в обеих группах была полностью инфильтрирована макрофагами и миофибробластами. Клеточная инфильтрация сопровождалась деградацией полимера и накоплением межклеточного вещества, о чем свидетельствуют волокна коллагена и эластина, расположенные по всей толщине и длине PCL протеза. Снаружи имплантата располагались параллельно направленные волокна коллагена. В свою очередь, в стенке сосудистых графтов с VEGF наблюдали большое количество кровеносных сосудов, заполненных эритроцитами. Ни в одном из образцов не было участков острого воспаления. Биодеградируемые полимерные матриксы, изготавливаемые методом электроспиннинга и состоящие из нано- и микроволокон, активно применяются в тканевой инженерии кровеносных сосудов [55]. Это обусловлено такими характеристиками как высокая пористость, относительно небольшие поры, значительная площадь поверхности и маленький диаметр волокон, которые делают полимерный материал по структуре сопоставимым с межклеточным матриксом нативных тканей организма. Однако, большинство полимерных материалов после проведения электроспиннинга не могут обеспечить достаточную прочность сосудистых графтов или их долговечность. Например, графты из коллагена и эластина, основных компонентов внеклеточного матрикса нативных сосудов, не способны выдерживать механическую нагрузку, оказываемую током крови [194]. Использование полидиоксанона, а также смеси полидиоксанона с полилактидом приводило к преждевременной потери прочности сосудистого графта и образованию аневризмы в эксперименте с имплантацией в аорту крысы [55]. В свою очередь, используемый в данной работе медленно деградируемый полиэстер – PCL обладает хорошими механическими свойствами. 92 Рисунок 22 – Гистологическое исследование сосудистого PCL графта через 10 месяцев после имплантации в брюшную аорту крысы. Окраска гематоксилин и эозин, и по Ван-Гизон. Увеличение ×50, ×200, ×400 93 Рисунок 23 – Гистологическое исследование сосудистого PCL графта, содержащего VEGF через 10 месяцев после имплантации в брюшную аорту крысы. Окраска гематоксилин и эозин, и по Ван-Гизон. Увеличение ×50, ×200, ×400 94 На процесс восстановления тканей на сосудистом графте могут оказывать влияние артериальное давление и кровоток [113]. Первое может привести к нарушению структурной целостности в результате механического воздействия, приводящего к дилатации и образованию турбулентного тока, а последний способен оказывать влияние на степень клеточной инфильтрации и ангиогенез. Поэтому большое внимание в изучении процессов формирования тканевых структур на PCL и PCL с VEGF графтах было направлено на испытания данных трансплантатов в физиологичных условиях. Проведенное исследование с имплантацией PCL графта в брюшную аорту крыс показало сохранение структурной целостности полимерных трансплантатов в течение 10 месяцев без признаков образования аневризм и разрыва стенки. Результаты проведения операции по имплантации, УЗИ с допплерометрией, а также макроскопическое исследование после эксплантации позволяют предположить, что графт из PCL не подвергается деформациям, обусловленным деградацией полимера и способен функционировать в гемодинамических условиях in vivo достаточно длительное время. Кроме того, PCL графты, содержащие икорпорированные молекулы VEGF, демонстрировали аналогичные свойства. Несмотря на снижение прочности и эластичности материала после введения ростового фактора по сравнению с образцами из чистого PCL (гл. 3, п. 3.2), физико-механические свойства данных графтов были оптимальны для их функционирования в физиологичных условиях. Одной из основных проблем использования синтетических сосудистых графтов является тромбоз и тромбоэмболические окклюзии. В некоторой степени все синтетические сосудистые трансплантаты являются тромбогенными [197]. Практически всегда обтурации тромботическими массами подвергаются графты диаметром меньше 2 мм, кроме того трансплантаты 4-6 мм часто демонстрируют полную или частичную окклюзию, даже не смотря на антикоагулянтную терапию. Причинами этого является низкая скорость тока крови в сосудах малого диаметра, местное изменение гемодинамики, повреждение стенки кровеносного сосуда в результате хирургического 95 вмешательства и низкая тромборезистентность самого материала [118]. На сегодняшний день исследуются различные подходы к снижению тромбогенности сосудистых графтов: разработка новых тромборезистентных полимерных материалов, покрытие внутренней поверхности трансплантата эндотелиальными клетками, местная доставка антикоагулянтов, а также биологически активных молекул для ускорения эндотелизации [19, 48, 128]. Инкорпорирование в сосудистые графты из PCL молекул VEGF, проведенное в настоящем исследовании, способствовало снижению тромботической окклюзии трансплантата. Так в просвете графтов, не содержащих ростовой фактор, отмечалось наличие пристеночного тромба, значительно закрывающего просвет имплантата. В то время как графты с VEGF имели пристеночный тромб в области анастомоза с сохранением просвета. Вероятной причиной тромбообразования как с окклюзией в случае трансплантатов из чистого PCL, так и с образованием пристеночных тромбов в образцах с VEGF, может быть несовпадение диаметров графта и аорты, так как диаметр аорты крысы не достигает 2 мм, что приводит к нарушению гемодинамики в зоне анастомоза и образованию турбулентных потоков крови. В то же время во всех случаях в тромботических массах отмечалось наличие каналов, что возможно объясняет проходимость графтов, наблюдаемую в течение 10 месяцев на УЗИ с допплерометрией. Известно, что основным фактором, предупреждающим тромбообразование в сосудистых протезах малого диаметра является наличие монослоя эндотелиальных клеток, который обеспечивает тромборезистентность поверхности при непосредственном контакте с кровью. Эндотелизация сосудистого графта развивается несколькими путями: миграция эндотелиальных клеток в просвет графта из участков нативного сосуда, прилегающих к анастомозу, проникновение клеток через микропоры имплантата из капилляров гранулематозной ткани, инфильтрирующей стенку графта, а также осаждение клеток из циркулирующей крови [224]. Среди факторов роста потенциально способных модулировать заживление сосудистых графтов, особую роль играет 96 VEGF в связи с его свойствами, обеспечивающими стимуляцию миграции и пролиферации эндотелиальных клеток [130]. В работе Pektok с соавторами было показано, что полная эндотелизация немодифицированного сосудистого PCL графта диаметром 2 мм происходила через 6 недель после имплантацию в аорту крысы [55]. Принимая во внимание митогенные свойства VEGF в отношении эндотелиальных клеток и формирование эндотелиального слоя в первые месяцы после имплантации графта, можно предположить, что локальная доставка ростового фактора в настоящем исследовании посредством его инкорпорирования в биодеградируемый полимер, вероятно, привела к более быстрой эндотелизации трансплантата на начальных этапах, что способствовало снижению тромбообразования. Важными характеристиками заживления сосудистого графта являются образование внутренней эндотелиальной выстилки, инфильтрация стенки трансплантата клетками и его прорастание капиллярной сетью. Усиление клеточной инфильтрации и ангиогенеза в материале графта без воспалительной реакции тканей на полимер может биосовместимости и, следовательно, способствовать сохранению увеличению проходимости и функциональности имплантата. Имплантация PCL графтов с VEGF и без ростового фактора в брюшную аорту крыс продемонстрировала интегрирование сосудистых полимерных трансплантатов в нативные ткани с глубокой клеточной инфильтрацией представлены стенки. Клеточные фибробластами, синтезированного межклеточного элементы преимущественно окруженными большим матрикса. Межклеточное были количеством вещество, состоящее из волокон коллагена и эластина, располагалось по всей толщине и длине графта. В свою очередь, коллаген в достаточном количестве должен выступать в качестве основы, способствующей укреплению стенки имплантата, в то время как происходит деградация синтетического полимера. Образование обширных участков межклеточного вещества между волокнами биодеградируемого полимера обеспечивает механическую прочность графта в процессе формирования тканей кровеносного сосуда до их полного созревания. 97 В случае если деградация материала будет осуществляться слишком быстро, это может стать причиной образования аневризм или разрыва стенки графта [120]. В проведенном исследовании низкая скорость разрушения PCL и активный синтез фибробластами внеклеточного вещества в графтах с VEGF и без ростового фактора способствовали целостности имплантата в условиях кровообращения на протяжении 10 месяцев. Неоваскуляризацию стенки сосудистого графта отмечали в образцах с инкорпорированным VEGF, при этом в имплантатах без биомолекул значительного количества капилляров обнаружено не было. Интересно, что похожую картину наблюдали и ученые в работе Valence S. по имплантации сосудистого PCL графта в брюшную аорту крысы, где было показано, что через 6 месяцев после имплантации наступает регрессия капилляров [119]. Это происходит в результате того, что через 6 месяцев из грануляционной ткани начинают постепенно исчезать макрофаги, которые секретируют ангиогенные факторы, стимулирующие образование новых сосудов и поддерживающие капиллярную сеть. Однако, как было показано в настоящем исследовании, выделение VEGF из PCL графта может обеспечивать васкуляризацию стенки имплантата в течении как минимум 10 месяцев. В свою очередь поддержание ангиогенеза в стенке имплантата способствует доставке кислорода и питательных веществ к клеткам. Кроме того, в клеточном инфильтрате обоих видов графтов не были обнаружены гигантские многоядерные клетки инородных тел, являющиеся реакцией ткани на чужеродный материал и способствующие инкапсуляции трансплантата. Это может свидетельствовать о том, что VEGF, выделяемый из PCL графта, не стимулирует образование гигантских клеток. Также не было отмечено фиброзирования трансплантата, которое бы препятствовало клеточной миграции в поры материала. Отсутствие признаков острого и хронического воспаления на графтах с ростовым фактором и без такового свидетельствовали о биосовместимости материалов и их пригодности для использования в сосудистой регенерации. 98 На основе полученных результатов и изученных литературных данных была составлена схема процесса формирования кровеносного сосуда in vivo на биодеградируемом графте под действием пролонгированной доставки VEGF в место имплантации (Рисунок 24). Рисунок 24 – Схема процесса формирования кровеносного сосуда на основе PCL графта под действием пролонгированной доставке VEGF Таким образом, проведенное исследование продемонстрировало результаты, которые не могли бы быть полученные в экспериментах in vitro, либо при краткосрочных испытаниях in vivo. Так с помощью имплантации сосудистых графтов из PCL и PCL с VEGF в кровеносное русло крыс было показано, что графты обоих видов полностью инфильтрируются клетками, преимущественно фибробластами, с формированием обширного межклеточного матрикса, способствующего поддержанию механических свойств имплантата при одновременной деградации полимера. Кроме того, введение в PCL молекул 99 VEGF способствует улучшению проходимости графта, а также васкуляризации его стенки в отдаленный период наблюдения Резюме Полученные в данной работе результаты свидетельствовали, что при внутрибрюшинной имплантации крысам сосудистые графты из PCL и PCL с VEGF полностью инфильтрировались грануляционной тканью, в которой уже через 2 месяца наблюдения преобладали фибробласты, синтезирующие межклеточный матрикс, а также присутствовали макрофаги и гигантские многоядерные клетки инородных тел. Кроме того, реакцию тканей на чужеродных материал отмечали в течение 4 месяцев исследования. При этом не было обнаружено влияния VEGF на клеточную инфильтрацию, а также на образование межклеточного вещества между волокнами полимера. Тем не менее, инкорпорирование ростового фактора в PCL способствовало стимуляции и поддержанию ангиогенеза в полимерном материале. Это выражалось в стойком увеличении количества капилляров на графтах VEGF, наблюдаемом через 2, 3 и 4 месяца после имплантации. Кроме того, пролонгированный выход ростового фактора из PCL приводил к увеличению диаметра кровеносных сосудов, пронизывающих полимерный материал графта. Исследование графтов PCL и PCL с VEGF в физиологичных условиях путем имплантации в брюшную аорту крыс продемонстрировало способность данных трансплантатов выдерживать механическую нагрузку, оказываемую током крови. По всему просвету протеза без ростового фактора располагался пристеночный тромб, препятствующий току крови. Введение молекул VEGF в PCL приводило к улучшению проходимости сосудистого имплантата относительно образцов без ростового фактора, что проявлялось наличием пристеночного тромба в зоне анастомоза с сохранением просвета графта. Активная трансмуральная инфильтрация клетками, синтезирующими межклеточный матрикс, была обнаружена в обоих видах графтов и обеспечивала восстановление тканей. Кроме того, введение VEGF в PCL графт способствовало 100 ангиогенезу в стенке трансплантата и поддержанию васкуляризации в течение 10 месяцев. Таким образом, высокая биосовместимость пористых материалов из PCL с VEGF и без ростового фактора, изготовленных методом электроспиннинга, а также их способность выполнять функцию временного матрикса для восстановления тканей in vivo делают их перспективной основой для создания сосудистых графтов. Ведение VEGF в сосудистый PCL графт обеспечивает сохранение проходимости имплантата, а также его васкуляризацию, что в свою очередь способствует регенерации кровеносного сосуда. 101 ЗАКЛЮЧЕНИЕ Существующая на сегодняшний день потребность в сосудистых протезах малого диаметра, которые могли бы стать эффективной альтернативой аутологичных артерий и вен для проведения операций по реконструкции поврежденных кровеносных сосудов, является одной из проблем сердечнососудистой хирургии [42]. В связи с этим активно развивается ряд подходов тканевой инженерии к выращиваю кровеносных сосудов из клеток пациента [115]. Поскольку в основе большинства тканеинженерных сосудов лежит пористый графт из биоматериала природного и/или синтетического происхождения, то в некоторых случаях возможны реакции тканей на имплантат, имеющие неблагоприятный исход, а именно хроническое воспаление, неконтролируемая пролиферация клеток и фиброз [103]. Такие последствия не возможно предупредить с помощью лекарственных препаратов, что в результате приводит к нарушению функций протеза. Поэтому большое внимание оказывают изучению особенностей реакции тканей на имплантаты из того или иного вида материала, различной формы и структуры [4, 16]. Также одной из главных задач является поиск способа стимулирования регенерации тканей с формированием структур, сходных с нативными тканями. Для регуляции восстановления тканей кровеносного сосуда на основе графтов перспективным является использование ростовых факторов, как биологически активных молекул, способных оказывать влияние на функции клеток [112]. В качестве потенциального ростового фактора для создания биологически активной среды в зоне имплантации графта выступает VEGF, поскольку он способен стимулировать миграцию и пролиферацию эндотелиальных клеток [111]. Активное привлечение данных клеток может обеспечить быструю эндотелизацию протеза, а следовательно усиление его тромборезистентности и улучшению гемодинамических свойств. 102 В связи с этим настоящая работа была направлена на изучение влияния сосудистого фактора роста, инкорпорированного в биодеградируемый графт из поликапролактона, на процессы формирования тканей кровеносного in vivo. На начальном этапе исследования была проведена оценка влияния параметров электроспиннинга и инкорпорирования в полимер молекул VEGF на физико-механические свойства и морфологию сосудистых PCL графтов. Была установлена зависимость свойств полимерного материала, изготовленного методом электроспиннинга, от используемой концентрации раствора PCL в хлороформе. Увеличение используемой концентрации приводило к возрастанию прочности и эластичности сосудистых графтов. Образцы из 14 и 16% PCL демонстрировали наилучшие физико-механические свойства и превосходили по данным показателям сосудистые ксенопротезы. В свою очередь не отмечали значительной разницы между образцами из одной концентрации полимера, изготовленными при подаваемом напряжении 15 кВ и 25 кВ. Морфология материала также зависела от концентрации полимера. Увеличение процентного содержания PCL в растворе приводило к исчезновению на волокнах утолщений и неровностей. Так образцы из 14 и 16% растворов состояли из более однородных полимерных нитей по сравнению с графтами из 10 и 12% PCL, которые были образованы волокнами, имеющими значительные дефекты. Кроме того, возрастание концентрации полимерного раствора способствовало увеличению диаметра волокна. В результате чего меньший диаметр полимерных нитей, не имеющих дефектов, наблюдался в графтах из 14%, изготовленных при 15 кВ. Благодаря хорошим показателям прочности и эластичности, а также высокопористой структуре, которые делают материал близким по свойствам к биологическому внеклеточному матриксу, PCL графт, изготовленный из 14% раствора PCL при 15 кВ, был выбран для дальнейшей модификации ростовым фактором. 103 Введение в структуру полимерного волокна молекул VEGF с помощью метода двухфазного электроспиннинга привело к значительному изменению морфологии PCL графта. Отмечали образование волокон, варьирующих по диаметру от 0,142 до 10,714 мкм, при этом размер полимерных нитей в образцах из чистого PCL в среднем составлял 2,521±0,490 мкм. Однако, волокна, содержащие ростовой фактор, имели ровную поверхность без выраженных деформаций и образовывали необходимую пористую структуру, имитирующую нативный межклеточный матрикс. Формирование внутри полимерных волокон водных доменов с ростовым фактором приводило к возникновению участков, не способных выдерживать большие механические нагрузки, что способствовало снижению показателей упруго-деформативных свойств графтов с VEGF по сравнению с образцами из чистого PCL. Но при этом не отмечали различий между физико-механическими свойствами исследуемых графтов и сосудистыми ксенопротезами, применяемыми в клинической практике. Полученные результаты демонстрировали оптимальные физико- механические свойства и высокопористую структуру сосудистых графтов, изготовленных методом электроспиннинга из 14% PCL при напряжении 15 кВ, как с инкорпорированным VEGF, так и не содержащие в своем составе биомолекул. В связи с этим дальнейшее исследование было направлено на оценку возможности их использования в качестве временных протезов для восстановление кровеносного сосуда и изучение влияния молекул ростового фактора на биологические свойства PCL графтов в in vitro и in vivo экспериментах. Биологические свойства PCL графтов, содержащих VEGF, во многом зависят от кинетики выхода ростового фактора в окружающую среду. Для ее оценки образцы протезов инкубировали в фосфатно-солевом буфере в течение 80 дней с последующим определением количества вышедшего из полимера VEGF через равные промежутки времени. В результате было установлено относительно быстрое накопление биомолекул в течение первых четырех суток 104 – 207 пг. Далее средняя скорость увеличения концентрации ростового фактора в растворе составляла 30,08±2,82 пг в 4 дня и сохранялась постоянной до конца периода наблюдения. Такая кинетика обусловлена диффузией биомолекул из глубоких пор PCL волокна, а также увеличением подвижности цепей полимера в процессе его деградации. Кроме того, медленное высвобождение VEGF обеспечивало его пролонгированную доставку в зону имплантации графта. Ключевым моментом настоящего исследования является сохранение биологической активности ростового фактора после его высвобождения из PCL волокон. В связи с чем, была проведена оценка биоактивности образцов VEGF, полученных в предыдущем эксперименте, по их способности стимулировать пролиферацию эндотелиальных клеток линии EA.Hy 926. Было показано, что биологической активностью обладал раствор, содержащий ростовой фактор, накопленный к 4 суткам инкубации PCL графта с VEGF. Далее с увеличением времени инкубации возрастала способность раствора стимулировать пролиферацию эндотелиальных клеток. Это связано с накоплением ростового фактора. При этом зависимость пролиферативной активности клеток от содержания VEGF показала, что наименьшая концентрация, которая приводила к достоверному увеличению количества EA.Hy 926 составила 79,57 пг/мл. Последующее увеличение концентрации ростового фактора способствовало поддержанию плавного митогенного эффекта. Способность тканеинженерного матрикса адгезировать на своей поверхности клетки и поддерживать их жизнедеятельность напрямую зависит от морфологии материала. Исследование данных свойств PCL графтов, а также влияние на них инкорпорированного VEGF показало, что матриксы как чистые, так и с ростовым фактором могут адгезировать на своей поверхности эндотелиальные характеризуются клетки, а слабыми также МСК. адгезивными Однако, оба свойствами, вида что графтов связано с гидрофобностью используемого полимера. В течение 6 суток эксперимента не наблюдали увеличения количества МСК ни на PCL, ни на PCL с VEGF матриксах. Но при этом отмечали 105 поддержание жизнеспособности адгезированной культуры. Среднее количество клеток на поле зрения через 2, 4 и 6 суток культивирование составило на PCL графтах – 44, 32 и 34, а на PCL с ростовым фактором - 47,5, 34 и 56,5. Культивирование на PCL и PCL с VEGF графтах эндотелиальных клеток линий EA.Hy 926 показало активную пролиферацию клеток на поверхности материала, содержащего ростовой фактор. В присутствии VEGF на матриксах отмечали через 2, 4, и 6 суток исследования - 141,5, 632,5 и 1384 клеток на поле зрение соответственно. При этом через 4 дня число эндотелиальных клеток на PCL графтах, содержащих биомолекулы, превышало данный показатель на чистых PCL матриксах в 2,1 раза, а через 6 дней – в 3,3 раза. Появление отдельных полимерных нитей с большим диаметром, а следовательно и пор в графтах, к которому привело введения молекул VEGF, способствовала лучшему проникновению МСК и EA.Hy 926 между волокнами и лучшей инфильтрации материала клеточными культурами. Таким образом, пролонгированное высвобождение ангиогенного ростового фактора с сохранением его биологической активности, а также морфология PCL матрикса, способствующая миграции клеток внутрь материала и поддержания их жизнедеятельности, создавали благоприятную биологическую среду для оптимального функционирования клеток и формирования тканей. Изучение влияние ростового фактора, инкорпорированного в PCL графты, на тканевую реакцию in vivo, проводили с помощью имплантации PCL и PCL с VEGF матриксов в брюшную полость крыс. Оценка реакции тканей на имплантированные материалы показала, что через 2 месяца оба вида графтов были полностью инфильтрированы грануляционной тканью, содержащей макрофаги и гигантские многоядерные клетки инородных тел, а также фибробласты, синтезирующие межклеточный матрикс. Обширная клеточная инфильтрация матриксов, вероятно, обусловлена их высокопористой структурой, которая создает большую площадь поверхности для адсорбирования адгезивных белков и механическую опору клеткам. Гигантские многоядерные клетки инородных тел являются основными участниками реакции тканей на 106 инородное тело. Их наличие на графтах как с ростовым фактором, так и без него, а также отсутствие признаков хронического воспаления в течение всех 4 месяцев исследования подтверждали наличие ответной реакции организма на имплантаты, характерной для биоинертных материалов. Фибробласты и обширные участки соединительной ткани, пронизывающие пористые образцы PCL и PCL с VEGF графтов и замещающие резорбируемый полимер, свидетельствовали о нормальном протекании реакции ремоделирования искусственного биодеградируемого матрикса. Влияния VEGF на протекание процессов воспаления и репарации не отмечали. Однако инкорпорирование ростового фактора в PCL и его выход в окружающие ткани способствовали стимуляции и поддержанию ангиогенеза в полимерном материале. Это выражалось в стойком увеличении количества капилляров на графтах с VEGF, наблюдаемом через 2, 3 и 4 месяца после имплантации. Кроме того, непрерывный пролонгированный выход ростового фактора из PCL приводил к увеличению диаметра кровеносных сосудов, пронизывающих полимерный материал графта к третьему месяцу имплантации. Исследование формирования структур кровеносного сосуда на биодеградируемом PCL графте и влияние на этот процесс инкорпорированного VEGF проводили в физиологичных условиях путем его имплантации в инфраренальный отдел аорты крыс сроком в 10 месяцев. PCL и PCL с VEGF графты демонстрировали достаточную механическую прочность с сохранением структурной целостности без образования аневризм и повреждений стенки. УЗИ мониторинг на протяжении всего эксперимента свидетельствовал о проходимости обоих видов протезов. При гистологическом исследовании отмечали наличие пристеночного тромба, значительно препятствующего току крови, по всей длине просвета графтов без ростового фактора. Во всех случаях тромб имел каналы и был проходим. Сосудистые протезы из PCL, содержащие VEGF, имели пристеночный тромб в зоне анастомоза с сохранением просвета сосудистого протеза. Вероятно, локальная доставка ростового фактора в место регенерации 107 сосуда могла способствовать более быстрой эндотелизации трансплантата в первые недели после имплантации за счет активного привлечения эндотелиальных клеток, что способствовало снижению тромбообразования. Активная трансмуральная инфильтрация клетками, синтезирующими внеклеточный матрикс, была обнаружена в обоих видах графтов и обеспечивала восстановление тканей и укрепление стенки сосуда в процессе деградации полимера. Между волокнами, образующими сосудистый графт с инкорпорированным VEGF, отмечали наличие мелких кровеносных сосудов, заполненных эритроцитами. Следовательно, введение ростового фактора в PCL графт способствовало также ангиогенезу в стенке трансплантата и поддержанию васкуляризации в течение 10 месяцев. Полученные результаты исследований in vivo свидетельствовали о высокой биосовместимости пористых материалов из PCL с VEGF и без ростового фактора, изготовленных методом электроспиннинга, а также их способности выполнять функцию временного матрикса для регенерации тканей. Таким образом, результаты настоящего исследования доказывают, что поликапролактонный графт с инкорпорированными молекулами сосудистого эндотелиального фактора роста обладает оптимальными физико-механическими свойствами и морфологией, позволяющими использовать его в качестве временного искусственного матрикса, чтобы обеспечить среду, благоприятную для формирования тканей кровеносного сосуда. Непрерывное пролонгированное высвобождение молекул сосудистого эндотелиального ростового фактора из сосудистого графта стимулирует пролиферацию эндотелиальных клеток на его поверхности и приводит к улучшению проходимости протеза во время функционирования в кровеносном русле, а также к стимуляции и поддержанию васкуляризации стенки имплантата в отдаленный период. 108 ВЫВОДЫ 1. Сосудистые графты из поликапролактона, изготовленные методом электроспиннинга, характеризуются высокими показателями прочности, упругодеформативных свойств и морфологией, имитирующей межклеточный матрикс. Оптимальным режимом изготовления является использование 14% раствора поликапролактона в хлороформе при напряжении 15 кВ. Введение в полимер сосудистого эндотелиального фактора роста приводит к патогенетически незначительному снижению прочности и эластичности материала с сохранением пористой структуры. 2. Сосудистый эндотелиальный фактор роста высвобождается из поликапролактона пролонгированно с сохранением биологической активности, что способствует усилению адгезии эндотелиальных и мезенхимальных стволовых клеток на поверхности графтов и стимулирует пролиферацию эндотелиальных клеток в условиях in vitro. 3. При перитонеальной имплантации графт из поликапролактона с инкорпорированным сосудистым эндотелиальным фактором роста развивается воспалительная реакция, которая не отличается от таковой при имплантации биосовместимых материалов, а пролонгировано выделяемый ростовой фактор стимулирует ангиогенез в графте, что проявляется в значительном увеличении количества капилляров, по сравнению с графтами без сосудистого эндотелиального фактора роста. 4. При эндотелиального пролонгированном фактора роста высвобождении из сосудистого поликапролактонного графта, имплантированного в инфраренальный отдел аорты крысы, происходит заселение клетками и стимуляция ангиогенеза в стенке графта, что обеспечивает формирование кровеносного сосуда и улучшение его проходимости по сравнению с графтом без ростового фактора. 109 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ Для стимуляции регенерации кровеносного сосуда на основе полимерного биодеградируемого графта рекомендуется пролонгированная доставка сосудистого эндотелиального фактора роста в место имплантации, которая может быть обеспечена инкорпорированием ростового фактора в полимер. Инкорпорирование осуществления их молекул ростового пролонгированного фактора высвобождения, в графт, для целесообразно проводить методом двухфазного электроспиннинга с использованием раствора поликапролактона, смешанного с раствором биологических молекул в фосфатно-солевом буфере, в соотношении 20:1. 110 СПИСОК ИСПОЛЬЗУЕМЫХ СОКРАЩЕНИЙ ГСК - гемопоэтические стволовые клетки МСК - мезенхимальные стволовые клетки ЭПК - эндотелиальные прогениторные клетки Bcl-2 - B-cell lymphoma 2, B-клеточная лимфома 2 (фактор регуляции апоптоза) bFGF - basic fibroblast growth factors, фактор роста фибробластов CD - cluster of differentiation, кластер дифференцировки DMEM - Dulbecco's Modified Eagle's Medium ERK 1/2 - extracellular signal-regulated kinases, киназы, регулируемые внеклеточным сигналом FAK - focal adhesion kinase, киназа фокальной адгезии G-CSF - granulocyte colony-stimulating factor, гранулоцитарный колониестимулирующий фактор HUVEC - human umbilical vein endothelial cell, эндотелиальные клетки вены пуповины человека IAP - inhibitors of apoptosis, ингибитор апоптоза JNK - c-Jun N-terminal kinases, Янус киназа MAP - mitogen-activated protein, митоген-активированный белок PBK - protein kinase B, протеинкиназа Б PCL - polycaprolactone, поликапролактон PDGF - platelet-derived growth factor, тромбоцитарный фактор роста PDLLA - poly-(D, L) lactide acid, поли-D,L- молочная кислота PEG - polyethylene glycol, полиэтиленгликоль PET - poly(ethylene terephthalate), полиэтилентерефталат PLA - poly(lactic acid), полилактид PLCL - poly(L-lactide-co-ε-caprolactone), сополимер L-молочной кислоты и поликапролактона PLG - polylactic glycol, гликоль-полимолочная кислота 111 PLGA - poly(lactic-co-glycolic acid), сополимер молочной и гликолиевой кислот PlGF - placental growth factor, плацентарный ростовой фактор PTFE - polytetrafluoroethylene, политетрафторэтилен SDF-1α - stromal cell-derived factor 1 alpha, стромальный фактор 1 альфа sVEGFR - soluble receptors of vascular endothelial growth factor, растворимый рецептор сосудистого эндотелиального фактора роста svVEGF - snake venom vascular endothelial growth factor, сосудистый эндотелиальный фактор роста яда змеи TGF - transforming growth factor , трансформирующий ростовой фактор TKR - tyrosine kinase receptor, тирозинкиназный рецептор VEGF - vascular endothelial growth factor, сосудистый эндотелиальный фактор роста VEGFR - vascular endothelial growth factor receptor, рецептор сосудистого эндотелиального фактора роста 112 СПИСОК ЛИТЕРАТУРЫ 1. Иванов, С. В. Ксеногенные биоматериалы, обработанные диэпоксидом, в реконструктивной хирургии артерий : автореф. дис. … д-ра мед. наук : 14.00.44 / С. В. Иванов. – Новосибирск, 2005. – 305 с. 2. Повторные операции у больных ишемической болезнью сердца – современное состояние проблемы / Л. А. Бокерия, И. И. Беришвили, Л. Э. Солнышков и др. // Бюллетень НЦССХ им. Бакулева РАМН. – 2009. – Т. 10, № 3. – С. 5-27. 3. Сравнительный анализ применения биопротезов артерий с различной антитромботической модификацией / Л. С. Барбараш, Н. Н. Бурков, Ю. А. Кудрявцева и др. // Ангиология и сосудистая хирургия. – 2012. – Т. 18, № 2. – С. 21-25. 4. Шехтер, А. Б. Тканевая реакция на имплантацию различных материалов / А. Б. Шехтер // Биосовместимые материалы. - М. : Медицинское информационное агентство, 2011. – С. 130-158. 5. Ямскова, В. П. К вопросу о механизмах, лежащих в основе процессов восстановления и репарации в тканях / В. П. Ямскова, М. С. Краснов, И. А. Ямсков // Клеточные технологии в биологии и медицине. – 2010. – № 1. – С. 32-35. 6. 3D systems delivering VEGF to promote angiogenesis for tissue engineering / A. des Rieux, B. Ucakar, B. P. Mupendwa et al. // J. Control. Release. – 2011. – Vol. 150, № 3. – P. 272-278. 7. A completely biological tissue-engineered human blood vessel / N. L’Heureux, S. Paquet, R. Labbe et al. // FASEB J. – 1998. – Vol. 12, № 1. – P. 47-56. 8. A novel single-step self-assembly approach for the fabrication of tissueengineered vascular constructs / R. Gauvin, T. Ahsan, D. Larouche et al. // Tissue Eng. Part A. – 2010. –Vol. 16, № 5. –P. 1737-1747. 113 9. A novel snake venom vascular endothelial growth factor (VEGF) predominantly induces vascular permeability through preferential signaling via VEGF receptor-1 / H. Takahashi, S. Hattori, A. Iwamatsu et al // J. Biol. Chem. – 2004. – Vol. 279, № 44. – P. 46304-46314. 10. A novel vascular endothelial growth factor encoded by Orf virus, VEGF-E, mediates angiogenesis via signalling through VEGFR-2 (KDR) but not VEGFR-1 (Flt1) receptor tyrosine kinases / M. Meyer, M. Clauss, A. Lepple-Wienhues et al. // EMBO J. – 1999. – Vol. 18, № 2. – P. 363-374. 11. A permanent human cell line (EA.hy926) preserves the characteristics of endothelin converting enzyme from primary human umbilical vein endothelial cells / K. Ahn, S. Pan, K. Beningo et al. // Life Sci. – 1995. – Vol. 56, № 26. – P. 2331-2341. 12. A target-mediated model to describe the pharmacokinetics and hemodynamic effects of recombinant human vascular endothelial growth factor in humans / S. M. Eppler, D. L. Combs, T. D. Henry et al. // Clin. Pharmacol. Ther. – 2002. – Vol. 72, № 1. –P. 20-32. 13. Allogeneic human tissue-engineered blood vessel / C. Quint, M. Arief, A. Muto et al. // J. Vasc. Surg. – 2012. – Vol. 55, № 3. – P.790-798. 14. An introduction to electrospinning and nanofibers / S. Ramakrishna, K. Fujihara, W.-E. Teo et al. – Singapore: World Scientific, 2005. – 382 p. 15. Analysis of cell growth in three-dimensional scaffolds / J. Dunn, W. Chan, V. Cristini et al. // Tissue Eng. – 2006. – Vol. 12, № 4. –P. 705-716. 16. Anderson, J. M. Biological responses to materials / J. M. Anderson // Annu. Rev. Mater. Res. – 2001. – № 31. – P. 81-110. 17. Anderson, J. M. Foreign body reaction to biomaterials / J. M. Anderson, A. Rodriguez, D. T. Chang // Semin. Immunol. – 2008. – Vol. 20, № 2. – P. 86-100. 18. Antiangiogenesis response of endothelial cells to the antitumour drug 10methoxy-9-nitrocamptothecin / X. Yang, P. Luo, B. Yang et al. // Pharmacol. Res. – 2006. – Vol. 54, № 5. – P. 334-340. 114 19. Antithrombogenic modification of small-diameter microfibrous vascular grafts / C. K. Hashi, N. Derugin, R. R. Janairo et al. // Arterioscler. Thromb. Vasc. Biol. – 2010. – Vol. 30, № 8. – P. 1621-1627. 20. Atala, A. Engineering tissues, organs and cells / A. Atala // J. Tissue Eng. Regen. Med. – 2007. – Vol. 1, № 2. – P. 83-96. 21. Autocrine VEGF signaling is required for vascular homeostasis / S. Lee, T. T. Chen, C. L. Barber et al. // Cell. – 2007. – Vol. 130, № 4. – P. 691-703. 22. Bajpai, V. K. Stem cell sources for vascular tissue engineering and regeneration / V. K. Bajpai, S. T. Andreadis // Tissue Eng. Part B, Rev. – 2012. – Vol. 18, № 5. – P. 405-425. 23. Ball, S. G. Mesenchymal stem cells and neovascularization: role of plateletderived growth factor receptors / S. G. Ball, C. A. Shuttleworth, C. M. Kielty // J. Cell. Mol. Med. – 2007. – Vol. 11, № 5. – P. 1012-1030. 24. Ball, S. G. Vascular endothelial growth factor can signal through plateletderived growth factor receptors / S. G. Ball, C. A. Shuttleworth, C. M. Kielty // J. Cell Biol. – 2007. – Vol. 177, № 3. – P. 489-500. 25. Bates, D. O. Vascular endothelial growth factors and vascular permeability / D. O. Bates // Cardiovasc. Res. – 2010. – Vol. 87, № 2. – P. 262-271. 26. Behaviour of human mesenchymal stem cells in fibrin-based Vascular Tissue Engineering Constructs / E. D. O’Cearbhaill, M. Murphy, F. Barry et al. // Ann. Biomed. Eng. – 2010. – Vol. 38, № 3. – P. 649-657. 27. Berglund, J. D. Designer blood vessels and therapeutic revascularization / J. D. Berglund, Z. S. Galis. // Br. J. Pharmacol. – 2003. – Vol. 140, № 4. – P. 627-636. 28. Bilodeau, K. Bioreactors for tissue engineering : focus on mechanical constraints : a comparative review / K. Bilodeau, D. Mantovani // Tissue Eng. – 2006 –Vol. 12, № 8. – P. 2367-2383. 29. Bioactive nanofibers : synergistic effects of nanotopography and chemical signaling on cell guidance / S. Patel, K. Kurpinski, R. Quigley et al. // Nano Lett. – 2007. – Vol. 7, № 7. – P. 2122-2128. 115 30. Bioengineered three-layered robust and elastic artery using hemodynamicallyequivalent pulsatile bioreactor / K. Iwasaki, K. Kojima, S. Kodama et al. // Circulation. – 2008. – Vol. 118, № 14, Suppl. – P. S52-S57. 31. Biomaterials science : an introduction to materials in medicine / B. D. Ratner, A. S. Hoffman, F. J. Schoen et al. – Oxford : Academic Press, 2012. –1573 p. 32. Biomimetic and bioactive nanofi brous scaffolds from electrospun composite nanofibers / Y. Z. Zhang, B. Su, J. Venugopa et al. // Int. J. Nanomedicine. – 2007. – Vol. 2, № 4. – P. 623-638. 33. Blood vessels engineered from human cells / M. Poh, M. Boyer, A. Solan et al. // Lancet. – 2005. – Vol. 365, № 9477. – P. 2122-2124. 34. Brynda, E. Protein packing in adsorbed layers studied by excitation energy transfer / E. Brynda, V. Hlady, J. Andrade // J. of Colloid and Interface Science. – 1990 – Vol. 139. – P. 374-380. 35. Byrne, A. M. Angiogenic and cell survival functions of vascular endothelial growth factor (VEGF) / A. M. Byrne, D. J. Bouchier-Hayes, J. H. Harmey // J. Cell. Mol. Med. – 2005. – Vol. 9, № 4. – P. 777-794. 36. Caplan, A. I. Adult mesenchymal stem cells for tissue engineering versus regenerative medicine / A. I. Caplan // J. Cell. Physiol. – 2007. – Vol. 213, № 2. – P. 341-347. 37. Caplan, A. I. The MSC : an injury drugstore / A. I. Caplan, D. Correa // Cell. Stem Cell. – 2011. – Vol. 9, № 1. – P. 11-15. 38. CD31- but not CD31+ cardiac side population cells exhibit functional cardiomyogenic differentiation / O. Pfister, F. Mouquet, M. Jain et al. // Circ Res. – 2005. – № 97. – P. 52-61. 39. Cell Adhesion on Artificial Materials for Tissue Engineering / L. Bacakova, E. Filova, F. Rypacek et al. // Physiol. Res. – 2004. – № 53, Suppl. 1. – P. S35-S45. 40. Cellular engineering of conduits for coronary and lower limb bypass surgery: role of cell attachment peptides and pre-conditioning in optimising smooth muscle cells (SMC) adherence to compliant poly(carbonate-urea)urethane (MyoLinkTM) scaffolds 116 / S. T. Rashid, H. J. Salacinski, M. J. Button et al. // Eur. J. Vasc. Endovasc. Surg. – 2004. – Vol. 27, № 6. – P. 608-616. 41. Cheng, Q. Plasma-assisted heparin conjugation on electrospun poly(llactide) fibrous scaffolds / Q. Cheng, K. Komvopoulos, S. Li // J. Biomed. Mater. Res. Part A. – 2014. – Vol. 102, № 5. – P. 1408-1414. 42. Chlupaс, J. Blood vessel replacement: 50 years of development and tissue engineering paradigms in vascular surgery / J. Chlupaс, E. Filova, L. Bacakova // Physiol. Res. – 2009. – № 58, Suppl. 2. – P. S119-S139. 43. Chowdhury, M. Effect of experimental parameters on the morphology of electrospun nylon 6 fibres / M. Chowdhury, G. Stylios // International Journal of Basic & Applied Sciences. – 2010. – Vol. 10, № 6. – P. 70-78. 44. Concise review : tissue-engineered vascular grafts for cardiac surgery : past, present, and future / H. Kurobe, M. W. Maxfield, C. K. Breuer et al. // Stem Cells Trans. Med. – 2012. – Vol. 1, № 7. – P. 566-571. 45. Consequences of ineffective decellularization of biologic scaffolds on the host response / T. J. Keane, R. Londono, N. J. Turner et al. // Biomaterials. – 2012. – Vol. 33, № 6. –P. 1771-1781. 46. Controlling the porosity of fibrous scaffolds by modulating the fiber diameter and packing density / S. Soliman, S. Sant, J. W. Nichol et al. // J. Biomed. Mater Res A. – 2011. – Vol. 96, № 3. – P. 566-574. 47. Conway, E. M. Molecular mechanisms of blood vessel growth / E. M. Conway, D. Collen, P. Carmeliet // Cardiovasc. Res. – 2001. – Vol. 49, № 3. – P. 507-521. 48. Covalent linkage of heparin provides a stable anti-coagulation surface of decellularized porcine arteries / D. Liao, X. Wang, P. Lin et al. // J. Cell. Mol. med. – 2009. – Vol. 13, № 8b. – P. 2736-2743. 49. Covalently conjugated VEGF-fibrin matrices for endothelialization / A. H. Zisch, U. Schenk, J. C. Schense et al. // J. of Controll. Release. – 2001. – Vol. 72, № 1-3. – P. 101-113. 117 50. Covalently-bound heparin makes collagen thromboresistant / J. F. Keuren, S. J. Wielders, A. Driessen et al. // Arterioscler. Thromb. Vasc. Biol. – 2004. – Vol. 24, № 3 – P. 613-617. 51. Cytotoxicity and cell adhesion properties of human mesenchymal stem cells in electrospun nanofiber polymer scaffolds / Z. Welcome, H. Wu, E. Nyairo et al. // International Journal of advanced biotechnology and bioinformatics. – 2012. – Vol. 1, № 1. – P. 41-47. 52. Dacron vs. PTFE as bypass materials in peripheral vascular surgery – systematic review and meta-analysis / S. Roll, J. Muller-Nordratnern, T. Keil et al. // BMC Surgery. – 2008. – Vol. 8. – P. 22. 53. Dahlberg, A. Ex vivo expansion of human hematopoietic stem and progenitor cells / A. Dahlberg, C. Delaney, I. Bernstein // Blood. – 2011. – Vol. 117, № 23. – P. 6083–6090. 54. Davies, N. The dosage dependence of VEGF stimulation on scaffold neovascularization / N. Davies, S. Dobner, D. Bezuidenhout // Biomaterials. – 2008. – Vol. 29, № 26. – P. 3531-3538. 55. Degradation and healing characteristics of small-diameter poly(ɛcaprolactone) vascular grafts in the rat systemic arterial circulation / E. Pektok, B. Nottelet, J. Tille et al. // Circulation. – 2008. – Vol. 118, № 24. – P. 2563-2570. 56. Degradation of electrospun nanofiber scaffold by short wave length ultraviolet radiation treatment and its potential applications in tissue engineering / D. Yixiang, T. Yong, S. Liao et al. // Tissue Eng. Part A. – 2008. – Vol. 14, № 8. – P. 1321-1329. 57. Development and validation of small-diameter vascular tissue from a decellularized scaffold coated with heparin and vascular endothelial growth factor / M. Zhou, Z. Liu, Z. Wei et al. // Artif Organs. – 2009. – Vol. 33, № 3. – P. 230-239. 58. Dual role of VEGF in pretreated experimental ePTFE arterial grafts / B. Randone, G. Cavallaro, A. Polistena et al. // J. Surg. Res. – 2005. – Vol. 127, № 2. – P. 70-79. 118 59. Elbery, D. Regenerative medicine and tissue engineering - cells and biomaterials / D. Eberli. – Rijeka : InTech, 2011. – 588 p. 60. Elcin, A. E. Localized angiogenesis induced by human vascular endothelial growth factor-activated PLGA sponge / A. E. Elcin, Y. M. Elcin // Tissue eng. – 2006. –Vol. 12, № 4. – P. 959-968. 61. Electrospinning collagen and elastin: Preliminary vascular tissue engineering / E. D. Boland, J. A. Matthews, K. J. Pawlowski et al. // Front Biosci. – 2004. – № 9. – P. 1422-1432. 62. Electrospun polyurethane vascular grafts : in vitro mechanical behavior and endothelial adhesion molecule expression / C. Grasl, H. Bergmeister, M. Stoiber et al. // J. Biomed. Mater. Res. A. – 2010. – Vol. 93, № 2. – P. 716-723. 63. Electrospun vascular grafts with improved compliance matching to native vessels / R. M. Nezarati, M. B. Eifert, D. K. Dempsey et al. // J. Biomed. Mater. Res B Appl. Biomater. – 2014. – Vol. 00B, № 00. – P. 1-11. 64. Endothelial and vascular smooth muscle cell function on poly(lacticcoglycolic acid) with nano-structured surface features / D. C. Miller, A. Thapa, K. M. Haberstroh et al. // Biomaterials. – 2004. – Vol. 25, № 1. – P. 53-61. 65. Engineering of vascular grafts with genetically modified bone marrow mesenchymal stem cells on poly (propylene carbonate) graft / J. Zhang, H. X. Qi, H. J. Wang et al. // Artif. Organs. – 2006. – Vol. 30, № 12. – P. 898-905. 66. Enhancing the vascularization of three-dimensional porous alginate scaffolds by incorporating controlled release basic fibroblast growth factor microspheres / A. Perets, Y. Baruch, F. Weisbuch et al. // J. Biomed. Mater. Res A. – 2003. – Vol. 65, № 4. – P. 489-497. 67. Ennett, A. B. Temporally regulated delivery of VEGF in vitro and in vivo / A. B. Ennett, D. Kaigler, D. J. Mooney // J. Biomed. Mater. Res A. –2006. – Vol. 79, № 1. – P. 176-184. 68. Expression of VEGF(xxx)b, the inhibitory isoforms of VEGF, in malignant melanoma / R. O. Pritchard-Jones, D. B. Dunn, Y. Qiu, et al. // Br. J. Cancer. – 2007. – Vol. 97, № 2. – P. 223-230. 119 69. Factorial design optimization and in vivo feasibility of poly(epsiloncaprolactone)-micro- and nanofiber-based small diameter vascular grafts / B. Nottelet, E. Pektok, D. Mandracchia et al. // J. Biomed. Mater. Res A. – 2009. – Vol. 89, № 4. – P. 865-875. 70. Femtosecond laser ablation enhances cell infiltration into three-dimensional electrospun scaffolds / B. L. Lee, H. Jeon, A. Wang et al. // Acta Biomater. – 2012. – Vol. 8, № 7. – P. 2648-2658. 71. Ferrara, N. Angiogenesis as a therapeutic target / N. Ferrara, R. S. Kerbel // Nature. – 2005. – Vol. 438, № 7070. – P. 967-974. 72. Fibroblast and vascular endothelial growth factor coating of decellularized vascular grafts stimulates undesired giant cells and graft encapsulation in a rat model / C. Heidenhain, A. Veeravoorn, B. Vachkov et al. // Artif. Organs. – 2011. – Vol. 35, № 1. – P. E1-E10. 73. Freeman, I. The influence of the sequential delivery of angiogenic factors from affinity-binding alginate scaffolds on vascularization / I. Freeman, S. Cohen // Biomaterials. – 2009. – Vol. 30, № 11.– P. 2122-2131. 74. Freitas, R. A. Nanomedicine. Volume I : Basic Capabilities / R. A. Freitas. – Georgetown : Landes Bioscience, 1999. – 510 p. 75. Functionalization of electrospun poly(e-caprolactone) scaffold with heparin and vascular endothelial growth factors for potential application as vascular grafts / Z. Wang, B. Sun, M. Zhang et al. // J. Bioactiv. Compatibl. Polymers. – 2012. – Vol. 28, № 2. – P. 154-166. 76. Future of fat as raw material for tissue regeneration / D. A. de Ugarte, P. H. Ashjian, A. Elbarbary et al. // Ann. Plast. Surg. – 2003 – Vol. 50, № 2. –P. 215-219. 77. Gage, F. H. Mammalian neural stem cells / F. H. Gage // Science. – 2000. – Vol. 287, № 5457. – P. 1433-1438. 78. Garlotta, D. A. Literature review of poly(lactic acid) / D. A. Garlotta // Journal of polymers and the environment. – 2001. – Vol. 9, № 2. – P. 63-84. 120 79. Gong, Z. D. Small-diameter human vessel wall engineered from bone marrow-derived mesenchymal stem cells (hMSCs) / Z. D. Gong, L. E. Niklason // FASEB J. – 2008. – Vol. 22, № 6. – P. 1635-1648. 80. Gordon, S. Monocyte and macrophage heterogeneity / S. Gordon, P. R. Taylor // Nat. Rev. Immunol. – 2005. – Vol. 5, № 12. – P. 953-964. 81. Green, E. M. Proteins and small molecules for cellular regenerative medicine / E. M. Green, R. T. Lee // Physiol. Rev. – 2013 – Vol. 93, № 1. – P. 311-325. 82. Guan, J. Biodegradable elastomeric scaffolds with basic fibroblast growth factor release / J. Guan, J. J. Stankus, W. R. Wagner // J. Control. Release. – 2007. – Vol. 120, № 1-2. – P. 70-78. 83. Hasana, A. Electrospun scaffolds for tissue engineering of vascular grafts / A. Hasana, A. Memic, N. Annabi // Acta Biomaterialia. – 2014. – Vol. 10, № 1. – P. 11-25. 84. Hashi, C. K. Preclinical results of a prosthetic, early-stick graft with functional endothelium / C. K. Hashi, M. H. Glickman // J. Vasc. Access. – 2011. – Vol. 12, № 3. – P. 231-238. 85. Heparin disrupts the CXCR4/SDF-1 axis and impairs the functional capacity of bone marrow-derived mononuclear cells used for cardiovascular repair / F. H. Seeger, T. Rasper, A. Fischer et al. // Circ. Res. – 2012. – Vol. 111, № 7. – P. 854-862. 86. Heparin-modified small-diameter nanofibrous vascular grafts / R. R. Janairo, J. J. Henry, B. L. Lee et al. // IEEE Trans. Nanobiosci. – 2012. – Vol. 11, № 1. – P. 2227. 87. High-throughput flow cytometry purification of transduced progenitors expressing defined levels of vascular endothelial growth factor induces controlled angiogenesis in vivo / H. Misteli, T. Wolff, P. Fuglistaler et al. // Stem Cells. – 2010. – Vol. 11, № 28. –P. 611-619. 88. Hirai, J. Self-organized, tubular hybrid vascular tissue composed of vascular cells and collagen for low-pressure-loaded venous system / J. Hirai, T. Matsuda // Cell Transplant. – 1995. – Vol. 4, № 6. – P. 597-608. 121 89. Hiroyuki, T. The vascular endothelial growth factor (VEGF)/VEGF receptor system and its role under physiological and pathological conditions / T. Hiroyuki, M. Shibuya // Clin. Science. – 2005. – Vol. 109, № 3. – P. 227-241. 90. Host cell mobilization for in situ tissue regeneration / S. J. Lee, M. van Dyke, A. Atala et al. // Rejuvenation Res. – 2008. – Vol. 11, № 4. – P. 747-756. 91. Human tissue-engineered blood vessels for adult arterial revascularization / N. L'Heureux, N. Dusserre, G. Konig et al. // Nat. Med. – 2006. – Vol. 12, № 3. – P. 361-365. 92. Impaired angiogenesis and endochondral bone formation in mice lacking the vascular endothelial growth factor isoforms VEGF164 and VEGF188 / C. Maes, P. Carmeliet, K. Moermans et al. // Mech. Dev. – 2002. – Vol. 111, № 1-2. – P. 61-73. 93. Improved cellular infiltration in electrospun fiber via engineered porosity / J. Nam, Y. Huang, S. Agarwal et al. // Tissue Eng. – 2007. – Vol. 13, № 9. – P. 2249-2257. 94. Improved endothelialization and reduced thrombosis by coating a synthetic vascular graft with fibronectin and stem cell homing factor SDF-1α / G. de Visscher, L. Mesure, B. Meuris et al. // Acta Biomater. – 2012. – Vol. 8, № 3. – P. 1330-1338. 95. Improving arterial prosthesis neo-endothelialization: application of a proactive VEGF construct onto PTFE surfaces / M. Crombez, P. Chevallier, R. Gaudreault et al. // Biomaterials. – 2005. – Vol. 26, № 35. – P. 7402-7409. 96. In situ tissue regeneration through host stem cell recruitment / I. Ko, S. Leу, A. Atala et al. // Exp. Mol. Med. – 2013. – № 45 – e57. 97. In vitro and in vivo degradation of non-woven materials made of poly(ecaprolactone) nanofibers prepared by electrospinning under different conditions / N. Bolgen, Y. Menceloglu, K. Acatay et al. // J. Biomater. Sci. Polym. Ed. – 2005. – Vol. 16, № 12. – P. 1537-1555. 98. In vitro and in vivo endothelialization of glutaraldehyde treated bovine pericardium / C. Leukauf, C. Szeles, L. Salaymeh et al. // J. Heart Valve Dis. – 1993. – Vol. 2, № 2. – P. 230-235. 122 99. In vitro and in vivo release of vascular endothelial growth factor from gelatin microparticles and biodegradable composite scaffolds / Z. S. Patel, H. Ueda, M. Yamamoto et al. // Pharm Res. – 2008. – Vol. 25, № 10. – P. 2370-2378. 100. In vivo behavior of decellularized vein allograft / N. D. Martin, P. J. Schaner, T. N. Tulenko et al. // J. Surg. Res. – 2005. – Vol. 129, № 1. – P. 17-23. 101. In vivo biostability of a poly (carbonate-urea) urethane graft / A. M. Seifalian, H. J. Salacinski, A. Tiwari et al. // Biomaterials. – 2003. – Vol. 24, № 14. – P. 2549-2557. 102. In vivo cell seeding with anti-CD34 antibodies successfully accelerates endothelialization but stimulates intimal hyperplasia in porcine arteriovenous expanded polytetrafluoroethylene grafts / J. I. Rotmans, J. M. Heyligers, H. J. Verhagen et al. // Circulation. – 2005. – № 112. – P. 12-18. 103. Inflammation in cardiovascular tissue engineering: the challenge to a promise: a minireview / A. Simionescu, J. Schulte, G. Fercana et al. // Int. J. Inflam. – 2011. –Vol. 2011. – 958247. 104. Isenberg, B. Long-term cyclic distention enhances the mechanical properties of collagen-based media-equivalents / B. Isenberg, R. Tranquillo // Ann. of Biomed. Eng. – 2003. – Vol. 31, № 8. – P. 937-939. 105. Isolation of putative progenitor endothelial cells for angiogenesis / T. Asahara, T. Murohara, A. Sullivan et al. // Science. – 1997. – Vol. 275, № 5302. – P. 964-967. 106. Kapadia, M. R. Modified prosthetic vascular conduits / M. R. Kapadia, D. A. Popowich, M. R. Kibbe // Circulation. – 2008. – Vol. 117, № 14. – P. 1873-1882. 107. Kiba, A. A set of loop-1 and -3 structures in the novel VEGF family member, VEGF-ENZ-7, is essential for the activation of VEGFR-2 signaling / A. Kiba, N. Yabana, M. Shibuya // J. Biol. Chem. – 2003. – Vol. 278, № 15. – P. 13453-13461. 108. Kliche, S. VEGF receptor signaling and endothelial function / S. Kliche, J. Waltenberger // IUBMB Life. – 2001. – Vol. 52, № 1-2. – P. 61-66. 123 109. Kong, H. J. Microenvironmental regulation of biomacromolecular therapies / H. J. Kong, D. J. Mooney // Nat. Rev. Drug Discov. – 2007. – Vol. 6, № 6. – P. 455463. 110. Kosorn, W. Surface modification of polycaprolactone scaffolds by plasma treatment for chondrocyte culture / W. Kosorn, B. Thavornyutikarn, P. Uppanan // IPCBEE. – 2012. – № 43. – P. 44-48. 111. Lamalice, L. Endothelial cell migration during angiogenesis / L. Lamalice, F. Boeuf, J. Huot // Circulation Research. – 2007. – Vol. 100, № 6. – P. 782-794. 112. Lee, K. Growth factor delivery-based tissue engineering: general approaches and a review of recent developments / K. Lee, E. A. Silva, D. J. Mooney // J. R. Soc. Interface. – 2011. – Vol. 8, № 55. – P. 153-170. 113. Lepidi, S. In vivo regeneration of small-diameter (2 mm) arteries using a polymer scaffold / S. Lepidi, G. Abatangelo, V. Vindign // FASEB J. – 2006. – Vol. 20, № 1. – P. 103-105. 114. Li, S. Nonthrombogenic approaches to cardiovascular bioengineering / S. Li, J. J. Henry // Annu. Rev. Biomed. Eng. – 2011. – № 13. – P. 451-475. 115. Li, S. Vascular tissue engineering: from in vitro to in situ / S. Li, D. Sengupta, S. Chien // Wiley Interdiscip. Rev. Syst. Biol. Med. – 2014. – Vol. 6, № 1. – P. 61-76. 116. Liang, D. Functional electrospun nanofibrous scaffolds for biomedical applications / D. Liang, B. S. Hsiao, B. Chu // Adv. Drug Deliv. Rev. – 2007. – Vol. 59, № 14. – P. 1392-1412. 117. Local delivery of protease-resistant stromal cell derived factor-1 for stem cell recruitment after myocardial infarction / V. F. Segers, T. Tokunou, L. J. Higgins et al. // Circulation. – 2007. – Vol. 116, № 15. – P. 1683-1692. 118. Local hemodynamic disturbance accelerates early thrombosis of smallcaliber expanded polytetrafluoroethylene grafts / S. Lu, X. Sun, P. Zhang et al. // Perfusion. – 2013. – Vol. 28, № 5. – P. 440-448. 119. Long term performance of polycaprolactone vascular grafts in a rat abdominal aorta replacement model / S. de Valence, J. Tille, D. Mugnai et al. // Biomaterials. – 2012. – Vol. 33, № 1. – P. 38-47. 124 120. Long-term patency of small-diameter vascular graft made from fibroin, a silk-based biodegradable mate / S. Enomoto, M. Sumi, K. Kajimoto et al. // J. Vasc. Surg. – 2010. – Vol. 51, № 1. – P. 155-164. 121. Lowery, J. Effect of fiber diameter, pore size and seeding method on growth of human dermal fibroblasts in electrospun poly(3-caprolactone) fibrous mats / J. Lowery, N. Datta, G. Rutledge // Biomaterials. – 2010. – Vol. 31, № 3. – P. 491-504. 122. Macrophage phenotype and remodeling outcomes in response to biologic scaffolds with and without a cellular component / B. N. Brown, J. E. Valentin, A. M. Stewart-Akers et al. // Biomaterials. – 2009. – Vol. 30, № 8. – P. 1482-1491. 123. Macrophage phenotype as a determinant of biologic scaffold remodeling / S. F. Badylak, J. E. Valentin, A. K. Ravindra et al. // Tissue Eng. Part A. – 2008. – Vol. 14, № 11. – P. 1835-1842. | 124. Mansfield, P. B. Preventing thrombus on artifical vascular surfaces : true endothelial cell linings / P. B. Mansfield, A. R. Wechezak, L. R. Sauvage // Trans. Am. Soc. Artif. Intern. Organs. – 1975. – № 21. – P. 264-272. 125. Martin, W. Local risk factors for implant therapy / W. Martin, E. Lewis, A. Nicol // Int. J. Oral Maxillofac. Implants. – 2009. – Vol. 24, suppl. – P. 28-38. 126. McNallya, A. K. Foreign body-type multinucleated giant cellsinduced by interleukin-4 express select lymphocyte co-stimulatory molecules and are phenotypically distinct from osteoclasts and dendritic cells / A. K. McNallya, J. M. Anderson // Exp. Mol. Pathol. – 2011. –Vol. 91, № 3. – P. 673-681. 127. Mitchell, R. N. Acute and chronic inflammation / R. N. Mitchell, R. S. Cotran // Robbins basic pathology. – Philadelphia: Saunders, 2002. – P. 33-60. 128. Modulating expanded polytetrafluoroethylene vascular graft host response via citric acid-based biodegradable elastomers / J. Yang, D. Motlagh, J. Allen et al. // Advanced Materials. – 2006. – Vol. 18, № 12. – P. 1493-1498. 129. Morais, J. M. Biomaterials/tissue interactions: possible solutions to overcome foreign body response / J. M. Morais, F. Papadimitrakopoulos, D. J. Burgess // The AAPSJ. – 2010. – Vol. 12, № 2. – P. 188-196. 125 130. Mussel-inspired immobilization of vascular endothelial growth factor (VEGF) for enhanced endothelialization of vascular grafts / Y. M. Shin, Y. B. Lee, S. J. Kim et al. // Biomacromolecules. – 2012. – Vol. 13, № 7. – P. 2020-2028. 131. Nerem, R. M. Vascular tissue engineering / R. M. Nerem, D. Seliktar // Annu. Rev. Biomed. Eng. – 2001. – № 3. – P. 225-243. 132. Neuronal FLT1 receptor and its selective ligand VEGF-B protect against retrograde degeneration of sensory neurons / J. Dhondt, E. Peeraer, A. Verheyen et al. // FASEB J. – 2011. – Vol. 25, № 5. – P.1461-1473. 133. New antithrombogenic RV-PA valved conduit / Y. Ichikawa, Y. Noishiki, T. Soma et al. // ASAIO J. – 1994. – Vol. 40, № 3. – P. M714-M718. 134. New prostheses for use in bypass grafts with special emphasis on polyurethanes / A. Tiwari, H. Salacinski, A. M. Seifalian et al. // Cardiovasc. Surg. – 2002. – Vol. 10, № 3. – P. 191-197. 135. Nucera, S. The interplay between macrophages and angiogenesis in development, tissue injury and regeneration / S. Nucera, D. Biziato, M. de Palma // Int. J. Dev. Biol. – 2011. – Vol. 55, № 4-5. – P. 495-503. 136. Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix / B. E. Uygun, A. Soto-Gutierrez, H. Yagi et al. // Nat. Med. – 2010. – Vol. 16, № 7. – P. 814-820. 137. Owen, S. C. Design of three-dimensional biomimetic scaffolds / S. C. Owen, M. S. Shoichet // J. of biomed. Mater. Resear. A. – 2010. – Vol. 94a, № 4. – P. 13211331. 138. p38 MAP kinase activation by vascular endothelial growth factor mediates actin reorganization and cell migration in human endothelial cells / S. Rousseau, F. Houle, J. Landry et al. // Oncogene. – 1997. – Vol. 15, № 18. – P. 2169-2177. 139. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart / H.C. Ott, T. S. Matthiesen, S. Goh et al. // Nat Med. – 2008. – № 14. – P. 213–221. 126 140. Pham, Q. Electrospinning of polymeric nanofibers for tissue engineering applications: A Review / Q. Pham, U. Sharma, A. Mikos // Tissue engineering. – 2006. – Vol. 12, № 5. – P. 1197-1211. 141. Pluripotent stem cell differentiation into vascular cells: a novel technology with promises for vascular re(generation) / N. M. Kane, Q. Xiao, A. H. Baker et al. // Pharmacol. Ther. – 2011. – №. 129. – P. 29-49. 142. Polyphenol-stabilized tubular elastin scaffolds for tissue engineered vascular grafts / T. Chuang, C. Stabler, A. Simionescu et al. // Tissue Eng. Part A. – 2009. – Vol. 15, № 10. – P. 2837-2851. 143. Potential of nanofiber matrix as tissue-engineering scaffolds / Z. Ma, M. Kotaki, R. Inai et al. // Tissue Eng. – 2005. – № 11. – P. 101-109. 144. Proliferation of neointimal smooth muscle cells after arterial injury: dependence on interactions between fibroblast growth factor receptor-2 and fibroblast growth factor-9 / A. Agrotis, P. Kanellakis, G. Kostolias et al. // J. Biol. Chem. – 2004. – № 279. – P. 42221-42229. 145. Properties of engineered vascular constructs made from collagen, fibrin, and collagen–fibrin mixtures / C. Heidenhain, A. Veeravoorn, B. Vachkov et al. // Biomaterials. – 2004. – Vol. 25, № 17. – P. 3699-3706. 146. Proprotein convertases promote processing of VEGF-D, a critical step for binding the angiogenic receptor VEGFR-2 / B. K. McColl, K. Paavonen, T. Karnezis et al. // FASEB J. – 2007. – Vol. 21, № 4. – P. 1088-1098. 147. Rabkin, E. Cardiovascular tissue engineering / E. Rabkin, F. J. Schoen // Cardiovasc. Pathol. – 2002. – Vol. 11, № 6. – P. 305-317. 148. Ratner, B. D. Biomaterials: where we have been and where we are going / B. D. Ratner, S. J. Bryant // Annu Rev Biomed Eng. – 2004. – № 6. – P. 41-75. 149. Ravi, S. Biomaterials for vascular tissue engineering / S. Ravi, E. L. Chaikof // Regen Med. – 2010. – Vol. 5, № 1. – P. 107-120. 150. Regeneration and orthotopic transplantation of a bioartificial lung / H. C. Ott, B. Clippinger, C. Conrad et al. // Nat. Med. – 2010. – Vol. 16, № 8. – P. 927-933. 127 151. Regulated angiogenesis and vascular regression in mice overexpressing vascular endothelial growth factor in airways / P. Baluk, C. Lee, H. Link et al. // Am. J. Pathol.– 2004 – Vol. 165, № 4. – P. 1071-1085. 152. Remodeling of an acellular collagen graft into a physiologically responsive neovessel / T. Huynh, G. Abraham, J. Murray et al. // Nat. Biotechnol. – 1999. – Vol. 17, № 11. – P. 1083-1086. 153. Rim, N. G. Current approaches to electrospun nanofibers for tissue engineering / N. G. Rim, C. S. Shin, H. Shin // Biomed. Mater. – 2013. – Vol. 8, № 1. – P. 1-14. 154. Ross, J. ECM gene expression correlates with in vitro tissue growth and development in fibrin gel remodeled by neonatal smooth muscle cells / J. Ross, R. Tranquillo // Matrix Biol. – 2003. – Vol. 22, № 6. – P. 477-490. 155. Said, S. S. Controlled delivery of fibroblast growth factor-9 from biodegradable poly(ester amide) fibers for building functional neovasculature / S. S. Said, J. G. Pickering, K. Mequanint // Pharm Res. – 2014. – P. 1-13. 156. Scaffolds and biomaterials for tissue engineering: a review of clinical applications / A. Vats, N. S. Tolley, J. M. Polak et al. // Otolaryngol. Allied Sci. – 2003. – Vol. 28, № 3. – P. 165-172. 157. Schantz, J. T. Cell guidance in tissue engineering: SDF-1 mediates sitedirected homing of mesenchymal stem cells within three-dimensional polycaprolactone scaffolds / J. T. Schantz, H. Chim, M. Whiteman // Tissue Eng. – 2007. – Vol. 13, № 11. – P. 2615-2624. 158. Schoen, F. J. Heart valve tissue engineering : quo vadis? / F. J. Schoen // Curr. Opin. Biotechnol. – 2011. – Vol. 22, № 5. – P. 698-705. 159. Schoen, F. J. Host response to biomaterials and their evaluation / F. J. Schoen, J. M. Anderson // Biomaterials science: an introduction to materials in medicine, 2nd. – San Diego: Elsevier, 2004. – P. 293-296. 160. Serbo, J. V. Vascular tissue engineering: biodegradable scaffold platforms to promote angiogenesis / J. V. Serbo, S. Gerecht // Stem Cell Res. Ther. – 2013. – Vol. 4, № 1. – P. 1-8. 128 161. Sharon, J. L. Immobilization of glycoproteains, such as VEGF, on biodegradable substrates / J. L. Sharon, D. A. Puleo // Acta Biomater. – 2008. – Vol. 4, № 4. – P. 1016-1023. 162. Shen, Y. H. Vascular endothelial growth factor immobilized in collage scaffold promotes penetration and proliferation of endothelial cells / Y.H. Shen, M. S. Shoichet, M. Radisic // Acta Biomaterialia. – 2008. – Vol. 4, № 3. – P. 477-489. 163. Shibuya, M. Signal transduction by VEGF receptors in regulation of angiogenesis and lymphangiogenesis / M. Shibuya, L. Claesson-Welsh // Exp. Cell Res. – 2006. – Vol. 312, № 5. – P. 549-560. 164. Shibuya, M. Vascular endothelial growth factor (vegf) and its receptor (vegfr) signaling in angiogenesis: a crucial target for anti- and pro-angiogenic therapies / M. Shibuya // Genes Cancer. – 2011. – Vol. 2, № 12. – P. 1097-1105. 165. Shin’oka, T. Transplantation of a tissue-engineered pulmonary artery / T. Shin’oka, Y. Imai, Y. N. Ikada // Engl. J. Med. – 2001. – Vol. 344, № 7. – P. 532-533. 166. Silk-based electrospun tubular scaffolds for tissue-engineered vascular grafts / L. Soffer, X. Wang, X. Zhang et al. // J. Biomater. Sci Polym Ed. – 2008. – Vol. 19, № 5. – P. 653-664. 167. Sill, T. J. Electrospinning: Applications in drug delivery and tissue engineering / T. J. Sill, H. A. von Recum // Biomaterials. – 2008. – Vol. 29, № 13. – P. 1989-2006. 168. Small-diameter vascular tissue engineering / D. G. Seifu, A. Purnama, K. Mequanint et al. // Nat. Rev. Cardiol. – 2013. – Vol. 10, № 7. –P. 410-421. 169. Smith, M. Biologicaly functional scaffolds for tissue engineering and drug delivery, produced through electrostatic processing: dissertation / M. Smith. Cleveland (OH) : Case Western Reserve Univ. – 2010. – 161 p. 170. Stegemann, J. P. Review: advances in vascular tissue engineering using protein-based biomaterials / J. P. Stegemann, S. N. Kaszuba, S. L. Rowe // Tissue Eng. – 2007. – Vol. 13, № 11. – P. 2601-2613. 129 171. Stromal cell-derived factor-1 effects on ex vivo expanded endothelial progenitor cell recruitment for ischemic neovascularization / J. Yamaguchi, K. F. Kusano, O. Masuo et al. // Circulation. – 2003. – Vol. 107, № 9. – P. 1322-1328. 172. Structure and morphology changes during in vitro degradation of electrospun poly(glycolide-co-lactide) nanofibre membrane / X. Zong, S. Ran, K. Kim et al. // Biomacromolecules. – 2003. – Vol. 4, № 2. – P. 416-423. 173. Study on cell adhesion detection onto biodegradable electrospun PCL scaffolds / B. Mijovic, M. Trcin, A. Agic et al. // J. of fiber bioengineering and informatics. – 2012. – Vol. 5, №1. – P. 33-40. 174. Sundaram, S. Smooth muscle and other cell sources for human blood vessel engineering / S. Sundaram, L. E. Niklason // Cells Tissues Organs. – 2012. – Vol. 195, № 1-2. – P. 15-25. 175. Surface immobilization of active vascular endothelial growth factor via a cysteine-containing tag / M. V. Backer, V. Patel, B. T. Jehning et al. // Biomaterials. – 2006. – Vol. 27, № 31. – P. 5452-5458. 176. Sustained Release of Proteins from Electrospun Biodegradable Fibers / S. Chew, J. Wen, E.Yim et al. // Biomacromolecules. – 2005. – Vol. 6, № 4.– P. 20172024. 177. Sustained vascular endothelial growth factor delivery enhances angiogenesis and perfusion in ischemic hind limb / Q. Sun, R. R. Chen, Y. Shen et al. // Pharm. Res. – 2005. – Vol. 22, № 7. – P. 1110-1116. 178. Synergism between vascular endothelial growth factor and placental growth factor contributes to angiogenesis and plasma extravasation in pathological conditions / P. Carmeliet, L. Moons, A. Luttun et al. // Nat Med. – 2001. – Vol. 7, № 5. – P. 575583. 179. Synovial stem cells and their responses to the porosity of microfibrous scaffold / B. L. Lee, Z. Tang, A. Wang et al. // Acta Biomater. – 2013. – Vol. 9, № 7. – P. 7264-7275. 130 180. Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering / M. P. Lutolf, J. A. Hubbell // Nat. Biotechnol. – 2005. – Vol. 23, № 1. – P. 47-55. 181. Taggart, D. P. Current status of arterial grafts for coronary artery bypass grafting / D. P. Taggart // Ann. Cardiothorac. Surg. – 2013. – Vol. 2, № 4. – P. 427430. 182. Taylor, L. M. Present status of reversed vein bypass grafting: five-year results of modern series / L. M. Taylor, J. M. Edwards, J. M. Porter // J. Vasc. Surg. – 1990. – Vol. 11, № 2. – P. 193-205. 183. Technology insight: the evolution of tissue-engineered vascular grafts--from research to clinical practice / N. L'Heureux, N. Dusserre, A. Marini et al. // Nat. Clin. Pract. Cardiovasc. Med. – 2007. – Vol. 4, № 7. – P. 389-395. 184. Teebken, O. E. Tissue engineering of small-diameter vascular grafts / O. E. Teebken, A. Haverich // Eur. J. Vasc. Endovasc. Surg.Graft. – 2002. – Vol. 23, № 6. – P. 475-485. 185. Teo, W. Technological advances in electrospinning of nanofibers / W. Teo, R. Inai, S. Ramakrishna // Sci Technol. Adv. Mater. – 2011. – № 12. – P. 1-19. 186. The blood and vascular cell compatibility of heparin-modified ePTFE vascular grafts / R. A. Hoshi, R. van Lith, M. C. Jen et al. // Biomaterials. – 2013. – Vol. 34, № 1. – P. 30-41. 187. The chemokine system in diverse forms of macrophage activation and polarization / A. Mantovani, A. Sica, S. Sozzani et al. // Trends Immunol. – 2004. – Vol. 25, № 12. – P. 677-686. 188. The effect of fiber alignment and heparin coating on cell infiltration into nanofibrous PLLA scaffolds / K. T. Kurpinski, J. T. Stephenson, R. R. Janairo et al. // Biomaterials. – 2010. – Vol. 31, № 13. – P. 3536-3542. 189. The effect of incorporation of SDF-1alpha into PLGA scaffolds on stem cell recruitment and the inflammatory response / P. T. Thevenot, A. M. Nair, J. Shen et al. // Biomaterials. – 2010. – Vol. 31, № 14. – P. 3997-4008. 131 190. The effect of sodium ascorbate on the mechanical properties of hyaluronanbased vascular constructs / C. Arrigoni, D. Camozzi, B. Imberti et al. // Biomaterials. – 2006. – Vol. 27, № 4. – P. 623-630. 191. The effect of stromal cell-derived factor-1α/heparin coating of biodegradable vascular grafts on the recruitment of both endothelial and smooth muscle progenitor cells for accelerated regeneration / J. Yu, A. Wang, Z. Tang et al. // Biomaterials. – 2012. – Vol. 33, № 32. – P. 8062-8074. 192. The effect of sustained delivery of vascular endothelial growth factor on angiogenesis in tissue-engineered intestine / F. G. Rocha, C. A. Sundback, N. J. Krebs et al. // Biomaterials. – 2008. – Vol. 29, № 19. – P. 2884-2890. 193. The fibrotic response to implanted biomaterials: implications for tissue engineering / B. Rolfe, J. Mooney, B. Zhang et al. // Regenerative medicine and tissue engineering - cells and biomaterials. – Rijeka : InTech, 2011. – P. 551-567. 194. The in vivo stability of electrospun polycaprolactone-collagen scaffolds in vascular reconstruction / B. Tillman, S. Yazdani, S. Lee et al. // Biomaterials. – 2009. – Vol. 30, № 4. – P. 583-588. 195. The phosphorylated 1169-tyrosine containing region of Flt-1 kinase (VEGFR-1) is a major binding site for PLCγ / A. Sawano, T. Takahashi, S. Yamaguchi, et al. // Biochem. Biophys. Res. Commun. – 1997. – Vol. 238, № 2. – P. 487-491. 196. The potential to improve cell infiltration in composite fiber-aligned electrospun scaffolds by the selective removal of sacrificial fibers / B. M. Baker, A. O. Gee, R. B. Metter et al. // Biomaterials. – 2008. – Vol. 29, № 15. – P. 2348-2358. 197. The use of antithrombotic therapies in reducing synthetic small-diameter vascular graft thrombosis / M. Tatterton, S. P. Wilshaw, E. Ingham et al. // Vasc. Endovascular Surg. – 2012. – Vol. 46, № 3. – P. 212-222. 198. The use of hyaluronan to regulate protein adsorption and cell infiltration in nanofibrous scaffolds / L. Li, Y. Qian, C. Jiang et al. // Biomaterials. – 2012. – Vol. 33, № 12. – P. 3428-3445. 132 199. The use of natural polymers in tissue engineering : a focus on electrospun extracellular matrix analogues / S. Sell, P. Wolfe, K. Garg et al. // Polymers. – 2010. – № 2. – P. 522-553. 200. Three-dimensional microfabricated scaffolds with cardiac extracellular matrix-like architecture / E. Rosellini, G. Vozzi, N. Barbani et al. // Int. J. Artif. Organs. – 2010. – Vol. 33, № 12. – P. 885-894. 201. Tissue engineering by self-assembly / M. Peck, N. Dusserre, T. N. McAllister et al. // Materials today. – 2011. – № 14. – P. 218-224. 202. Tissue engineering of blood vessel / W. J. Zhang, W. Liu, L. Cui et al. // Cell. Mol. Med. – 2007. – Vol. 11, № 5. – P. 945-957. 203. Tissue response to poly(ether)urethane-polydimethylsiloxane-fibrin composite scaffolds for controlled delivery of pro-angiogenic growth factors / P. Losi, E. Briganti, A. Magera et al. // Biomaterials. – 2010. – Vol. 31, № 20. – P. 5336-5344. 204. Tissue response to subcutaneously implanted recombinant spider silk : an in vivo study / C. Fredriksson, M. Hedhammar, R. Feinstein et al. // Materials. – 2009. – № 2. – P. 1908-1922. 205. Tumor cells secrete a vascular permeability factor that promotes accumulation of ascites fluid / D. R. Senger, S. J. Galli, A. M. Dvorak et al. // Science. – 1983. – Vol. 219, № 4587. – P. 983-985. 206. Use of modified 3D scaffolds to improve cell adhesion and drive desired cell responses / S. Rigogliusoa, F. Paviab, V. Brucatob et al. // Chemical engineering transactions. – 2012. – № 27. – P. 415-420. 207. Utilizing granulocyte colony-stimulating factor to enhance vascular graft endothelialization from circulating blood cells / Q. Shi, V. Bhattacharya, W.M. HongDe et al. // Ann Vasc Surg. – 2002. – Vol. 16, № 3 – P. 314-320. 208. Vascular endothelial cell growth factor (VEGF), an emerging target for cancer chemotherapy / S. Shinkaruk, M. Bayle, G. Lain et al. // Curr. Med. Chem. Anticancer Agents. – 2003. – Vol. 3, № 2. – P. 95-117. 209. Vascular endothelial growth factor (VEGF) and its receptors / G. Neufeld, T. Cohen, S. Gengrinovitch et al. // FASEB J. – 1999. – Vol. 13, № 1. – P. 9-22. 133 210. Vascular endothelial growth factor and angiogenesis / A. Hoeben, B. Landuyt, M. S. Highley et al. // Pharmacol Rev. – 2004. – Vol. 56, № 4. – P. 549-580. 211. Vascular endothelial growth factor and cellular chemotaxis: a possible autocrine pathway in adult t-cell leukemia cell invasion / T. Hayashibara, Y. Yamada, T. Miyanishi et al. // Clin. Cancer Res. – 2001. – Vol. 7, № 7. – P. 2719-2726. 212. Vascular endothelial growth factor is a secreted angiogenic mitogen / D. W. Leung, G. Cachianes, W. Kuang et al. // Science. – 1989. – Vol. 246, № 4935. – P. 1306-1309. 213. Vascular endothelial growth factor-B-deficient mice display an atrial conduction defect / K. Aase, G. von Euler, X. Li et al. // Circulation. – 2001. – Vol. 104, № 3. – P. 358-364. 214. Vascular endothelial growth factor-induced endothelial cell proliferation is regulated by interaction between VEGFR-2, SH-PTP1 and eNOS / J. Cai, W. Jiang, A. Ahmed et al. // Microvasc Res. – 2006. – Vol. 71, № 1. – P. 20-31. 215. Vascular tissue engineering: recent advances in small diameter blood vessel regeneration / V. Catto, S. Fare, G. Freddi et al. // ISRN Vascular Medicine. – 2014. – Vol. 2014. – P. 1-27. 216. Vascular tissue engineering: towards the next generation vascular grafts / Y. Naito, T. Shinoka, D. Duncan et al. // Adv. Drug. Deliv. Rev. – 2011. – Vol. 63, № 45. – P. 312-323. 217. VEGF receptor signalling — in control of vascular function / A. Olsson, A. Dimberg, J. Kreuger et al. // Nat. Rev. Mol. Cell. Biol. – 2006. – Vol. 7, № 5. – P. 359-371. 218. VEGF121 and VEGF165 regulate blood vessel diameter through vascular endothelial growth factor receptor 2 in an in vitro angiogenesis model / M. Nakatsu, R. Sainson, S. Pérez-del-Pulgar et al. // Laboratory investigation. – 2003. – Vol. 83, № 12. – P. 1873-1885. 219. Wagenseil, J. Vascular extracellular matrix and arterial mechanics / J. Wagenseil, R. Mecham // Physiol. rev. – 2009. – Vol. 89, № 3. – P. 957-989. 134 220. Williams, D. F. On the mechanisms of biocompatibility / D. F. Williams // Biomaterials. – 2008. – Vol. 29, № 20. – P. 2941-2953. 221. Wu, W. Fast-degrading elastomer enables rapid remodeling of a cell-free synthetic graft into a neoartery / W. Wu, R. A. Allen, Y. Wang et al. // Nat. Med. – 2012. – Vol. 18, № 7. – P. 1148-1153. 222. Xu, L. C. Effect of surface wettability and contact time on protein adhesion to biomaterail surfaces / L. C. Xu // Biomaterials. – 2007. – Vol. 28, № 22. – P. 32733283. 223. Zhang, Y. Hepatic stem cells: existence and origin / Y. Zhang, X. F. Bai, C. X. Huang // World J. Gastroenterol. – 2003. – Vol. 9, № 2. – P. 201-204. 224. Zilla, P. Tissue engineering of prosthetic vascular grafts / P. Zilla, H. Greisler. – Georgetown : R.G. Landes Company, 1999. – 620 p.