ЛЕКАРСТВЕННЫЙ ПАТОМОРФОЗ ЭКСПЕРИМЕНТАЛЬНОГО
advertisement
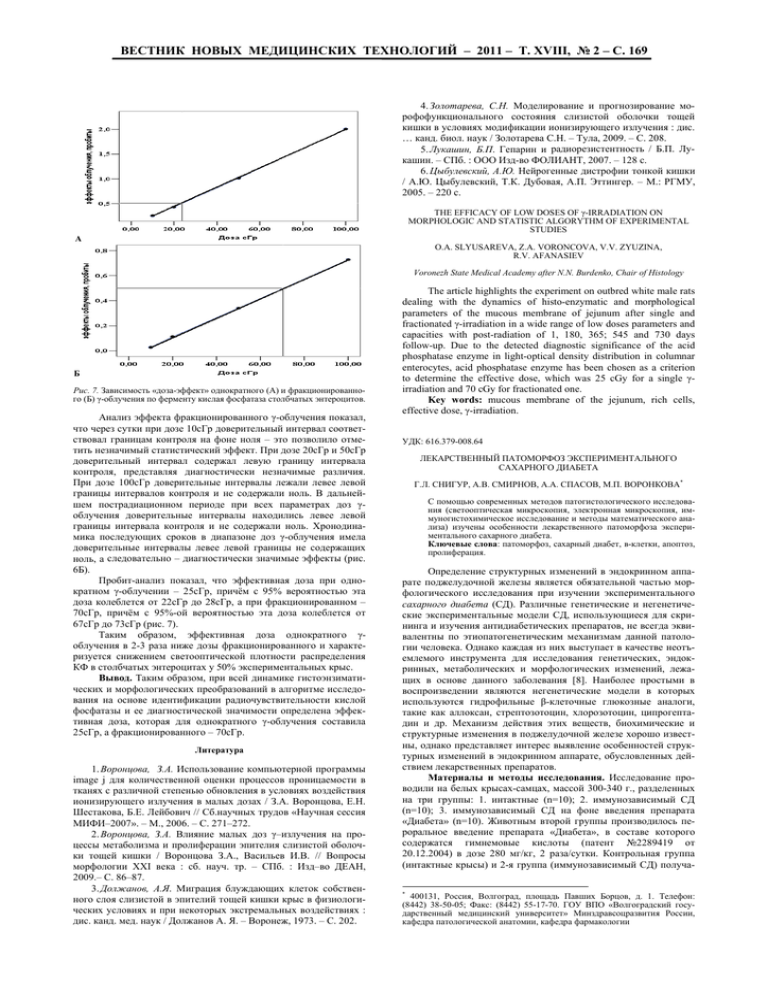
ВЕСТНИК НОВЫХ МЕДИЦИНСКИХ ТЕХНОЛОГИЙ – 2011 – Т. ХVIII, № 2 – С. 169 4. Золотарева, С.Н. Моделирование и прогнозирование морофофункционального состояния слизистой оболочки тощей кишки в условиях модификации ионизирующего излучения : дис. … канд. биол. наук / Золотарева С.Н. – Тула, 2009. – С. 208. 5. Лукашин, Б.П. Гепарин и радиорезистентность / Б.П. Лукашин. – СПб. : ООО Изд-во ФОЛИАНТ, 2007. – 128 с. 6. Цыбулевский, А.Ю. Нейрогенные дистрофии тонкой кишки / А.Ю. Цыбулевский, Т.К. Дубовая, А.П. Эттингер. – М.: РГМУ, 2005. – 220 с. THE EFFICACY OF LOW DOSES OF γ-IRRADIATION ON MORPHOLOGIC AND STATISTIC ALGORYTHM OF EXPERIMENTAL STUDIES А O.A. SLYUSAREVA, Z.A. VORONCOVA, V.V. ZYUZINA, R.V. AFANASIEV Voronezh State Medical Academy after N.N. Burdenko, Chair of Histology Б Рис. 7. Зависимость «доза-эффект» однократного (А) и фракционированного (Б) γ-облучения по ферменту кислая фосфатаза столбчатых энтероцитов. Анализ эффекта фракционированного γ-облучения показал, что через сутки при дозе 10сГр доверительный интервал соответствовал границам контроля на фоне ноля – это позволило отметить незначимый статистический эффект. При дозе 20сГр и 50сГр доверительный интервал содержал левую границу интервала контроля, представляя диагностически незначимые различия. При дозе 100сГр доверительные интервалы лежали левее левой границы интервалов контроля и не содержали ноль. В дальнейшем пострадиационном периоде при всех параметрах доз γоблучения доверительные интервалы находились левее левой границы интервала контроля и не содержали ноль. Хронодинамика последующих сроков в диапазоне доз γ-облучения имела доверительные интервалы левее левой границы не содержащих ноль, а следовательно – диагностически значимые эффекты (рис. 6Б). Пробит-анализ показал, что эффективная доза при однократном γ-облучении – 25сГр, причём с 95% вероятностью эта доза колеблется от 22сГр до 28сГр, а при фракционированном – 70сГр, причём с 95%-ой вероятностью эта доза колеблется от 67сГр до 73сГр (рис. 7). Таким образом, эффективная доза однократного γоблучения в 2-3 раза ниже дозы фракционированного и характеризуется снижением светооптической плотности распределения КФ в столбчатых энтероцитах у 50% экспериментальных крыс. Вывод. Таким образом, при всей динамике гистоэнзиматических и морфологических преобразований в алгоритме исследования на основе идентификации радиочувствительности кислой фосфатазы и ее диагностической значимости определена эффективная доза, которая для однократного γ-облучения составила 25сГр, а фракционированного – 70сГр. Литература 1. Воронцова, З.А. Использование компьютерной программы image j для количественной оценки процессов проницаемости в тканях с различной степенью обновления в условиях воздействия ионизирующего излучения в малых дозах / З.А. Воронцова, Е.Н. Шестакова, Б.Е. Лейбович // Сб.научных трудов «Научная сессия МИФИ–2007». – М., 2006. – С. 271–272. 2. Воронцова, З.А. Влияние малых доз γ–излучения на процессы метаболизма и пролиферации эпителия слизистой оболочки тощей кишки / Воронцова З.А., Васильев И.В. // Вопросы морфологии XXI века : сб. науч. тр. – СПб. : Изд–во ДЕАН, 2009.– С. 86–87. 3. Должанов, А.Я. Миграция блуждающих клеток собственного слоя слизистой в эпителий тощей кишки крыс в физиологических условиях и при некоторых экстремальных воздействиях : дис. канд. мед. наук / Должанов А. Я. – Воронеж, 1973. – С. 202. The article highlights the experiment on outbred white male rats dealing with the dynamics of histo-enzymatic and morphological parameters of the mucous membrane of jejunum after single and fractionated γ-irradiation in a wide range of low doses parameters and capacities with post-radiation of 1, 180, 365; 545 and 730 days follow-up. Due to the detected diagnostic significance of the acid phosphatase enzyme in light-optical density distribution in columnar enterocytes, acid phosphatase enzyme has been chosen as a criterion to determine the effective dose, which was 25 cGy for a single γirradiation and 70 cGy for fractionated one. Key words: mucous membrane of the jejunum, rich cells, effective dose, γ-irradiation. УДК: 616.379-008.64 ЛЕКАРСТВЕННЫЙ ПАТОМОРФОЗ ЭКСПЕРИМЕНТАЛЬНОГО САХАРНОГО ДИАБЕТА Г.Л. СНИГУР, А.В. СМИРНОВ, А.А. СПАСОВ, М.П. ВОРОНКОВА* С помощью современных методов патогистологического исследования (светооптическая микроскопия, электронная микроскопия, иммуногистохимическое исследование и методы математического анализа) изучены особенности лекарственного патоморфоза экспериментального сахарного диабета. Ключевые слова: патоморфоз, сахарный диабет, в-клетки, апоптоз, пролиферация. Определение структурных изменений в эндокринном аппарате поджелудочной железы является обязательной частью морфологического исследования при изучении экспериментального сахарного диабета (СД). Различные генетические и негенетические экспериментальные модели СД, использующиеся для скрининга и изучения антидиабетических препаратов, не всегда эквивалентны по этиопатогенетическим механизмам данной патологии человека. Однако каждая из них выступает в качестве неотъемлемого инструмента для исследования генетических, эндокринных, метаболических и морфологических изменений, лежащих в основе данного заболевания [8]. Наиболее простыми в воспроизведении являются негенетические модели в которых используются гидрофильные β-клеточные глюкозные аналоги, такие как аллоксан, стрептозотоцин, хлорозотоцин, ципрогептадин и др. Механизм действия этих веществ, биохимические и структурные изменения в поджелудочной железе хорошо известны, однако представляет интерес выявление особенностей структурных изменений в эндокринном аппарате, обусловленных действием лекарственных препаратов. Материалы и методы исследования. Исследование проводили на белых крысах-самцах, массой 300-340 г., разделенных на три группы: 1. интактные (n=10); 2. иммунозависимый СД (n=10); 3. иммунозависимый СД на фоне введения препарата «Диабета» (n=10). Животным второй группы производилось пероральное введение препарата «Диабета», в составе которого содержатся гимнемовые кислоты (патент №2289419 от 20.12.2004) в дозе 280 мг/кг, 2 раза/сутки. Контрольная группа (интактные крысы) и 2-я группа (иммунозависимый СД) получа* 400131, Россия, Волгоград, площадь Павших Борцов, д. 1. Телефон: (8442) 38-50-05; Факс: (8442) 55-17-70. ГОУ ВПО «Волгоградский государственный медицинский университет» Минздравсоцразвития России, кафедра патологической анатомии, кафедра фармакологии ВЕСТНИК НОВЫХ МЕДИЦИНСКИХ ТЕХНОЛОГИЙ – 2011 – Т. ХVIII, № 2 – С. 170 ли питьевую воду в аналогичном объеме. Через неделю во 2-й и 3-й группах, однократно осуществляли п/к инъекцию 0,2 мл полного адъюванта Фрейнда и ежедневные в/в инъекции стрептозотоцина в дозе 20 мг/кг в течение 5 дней. Животные содержались в стандартных условиях вивария, на полнорационной сбалансированной по содержанию питательных веществ диете для лабораторных животных (мышей и крыс) ГОСТ Р 50258-92. При работе с животными руководствовались правилами лабораторной практики при проведении доклинических исследований в РФ (ГОСТ З51000.3-96 и 51000.4-96) и решением независимого регионального этического комитета (№43-2006). На 3, 7, 14 и 21 дни исследования определяли содержание глюкозы в цельной крови хвостовой вены (натощак) глюкозооксидазным методом. Ежедневно фиксировали объем потребляемой воды и массу тела каждой крысы. Для определения концентрации инсулина на 21 день проводился забор крови из брюшной аорты под эфирным наркозом с дальнейшим определением его концентрации на автоматическом иммуноферментном анализаторе «SUNRISE» фирмы TECAN (Австрия) с наборами DRG Insulin Elisa Kit (Австрия). Спустя три недели, соблюдая принципы гуманного отношения, животных выводили из эксперимента и осуществляли гистологическое исследование. Ткань поджелудочной железы фиксировали в течение 24 часов в 10% растворе нейтрального забуференного формалина и заливали в парафиновые блоки с последующей окраской гематоксилином и эозином по общепринятым гистологическим методикам. Иммуногистохимическое исследование проводили в соответствии с протоколами фирм производителей антител с использованием систем детекции «LSAB» и «En Vision» и хромогеном – диаминобензидином, используя протокол высокотемпературной демаскировки антигенов в миниавтоклаве. Достоверность полученных результатов контролировали с помощью позитивных и негативных контролей антигенов, а также негативных контролей антител. Использовали моноклональные антитела к каспазе 3, TRAIL, MDM2, Bcl2 и поликлональные антитела к инсулину, белкам p53 и Bax. Характер иммуногистохимической реакции оценивали визуально в баллах с учетом интенсивности окраски и количества окрашенных клеток по шкале Allred D.C. et al. (1998). Для электронно-микроскопического исследования фиксацию фрагментов поджелудочной железы размером 1 мм3 производили в течение 12 часов в 4%-м растворе параформа на 0,1М какодилатном буфере с последующей постфиксацией в течение 2 часов в 1% растворе тетраокиси осмия на 0,1М какодилатном буфере (рН = 7,4) при температуре +4º С. После промывки в растворе какодилатного буфера материал дегидратировали в спиртах возрастающей концентрации и заливали в смесь эпона и аралдита. Изготавливали полутонкие срезы с последующей окраской метиленовым синим. Ультратонкие срезы толщиной 50-90 нм получали на ультрамикротоме LKB-8800 и монтировали на медные сетки. После контрастирования в 2,5%-м растворе уранилацетата на 50% этаноле в течение 40 минут и 0,3%-м растворе цитрата свинца в течение 20 минут срезы изучались в электронном микроскопе Tesla BS-500 при ускоряющем напряжении 60 кВ с фотодокументированием результатов. Проводили морфометрический анализ с помощью программы анализа изображений «ВидеоТестМорфо-4». Определяли процентное соотношение площади, занимаемой вэндокриноцитами к общей площади островка (100%), объемную долю (ОД) островков по отношению к экзокринной части железы, объёмную долю (%) и диаметр (нм) секреторных гранул инсулоцитов, индекс апоптоза и пролиферации (число инсулоцитов панкреатических островков с признаками апоптоза и пролиферации на 100 клеток). Статистическую обработку данных проводили с использованием пакета программ Statistica 5.1. (StatSoft, США) и Excel 2000 (MS Office 2000, США). Проводился расчет базовых статистических показателей, характеризующих вариационные ряды (среднее арифметическое значение M, стандартная ошибка средней арифметической m), с использованием парного tкритерия Стьюдента, критерия Манна-Уитни и ANOVA (Newman-Keuls test). Результаты и их обсуждение. В контрольной интактной группе уровень глюкозы в плазме крови был в пределах физиологической нормы. В группе животных с моделью СД отмечалось развитие стойкой гипергликемии (рис. 1). В группе крыс, получавших препарат «Диабета», отмечалось также увеличение содержания глюкозы в крови, однако данные явления имели мень- шую выраженность. Так, к 7 дню концентрация глюкозы уменьшилась в 1,8 раза, к 14 дню – в 2 раза, к 21 дню – в 2,3 раза, причем отличия от контрольной группы на 14 и 21 день исследования были достоверными. Рис. 1. Концентрация глюкозы в плазме крови крыс (М±m). Примечание: стрелками показаны моменты введения стрептозотоцина на фоне подкожной инъекции адъюванта Фрейнда. Аналогичная зависимость определена и для объема потребляемой жидкости крысами с экспериментальным СД (рис. 2). Так, потребление воды на 7 день после первой инъекции стрептозотоцина увеличилось в 4,8 раза. Затем количество потребляемой жидкости уменьшилось. Так, на 14-21 день потребление воды уменьшилось в 4,5 раза по сравнению с исходными данными. Препарат «Диабета» препятствовал столь интенсивной полидипсии. Так, на седьмой день уровень потребления воды увеличился только в 3 раза, при этом отличия от контрольной группы животных являлись достоверными. Меньшая степень полидипсии была отмечена и в остальные дни исследования (статистически достоверны по сравнению с интактным контролем). При развитии диабета отмечалось снижение массы тела крыс до 15,9% от исходной массы к 21 дню эксперимента (рис. 3). В группе крыс, получавших препарат «Диабета», отмечалось не существенное снижение массы тела животных. Рис. 2. Динамика потребления воды крысами (М±m). Примечание. Стрелками показаны моменты введения стрептозотоцина на фоне подкожной инъекции адъюванта Фрейнда. Вертикальные штрихи соответствуют стандартной ошибке средней величин. -25 Рис. 3. Динамика изменения массы тела крыс (М±m). Примечание. Стрелками показаны моменты введения стрептозотоцина на фоне подкожной инъекции адъюванта Фрейнда. Вертикальные штрихи соответствуют стандартной ошибке средней величин. Таким образом, установлено уменьшение выраженности гипергликемии, полидипсии, потери массы тела под влиянием препарата «Диабета» у крыс с экспериментальным сахарным диабетом. При сахарном диабете фиксировалось стойкое снижение содержания инсулина в плазме крови крыс (рис. 4). Так, на 22 день исследования уровень инсулинемии снизился на 32,2% по сравнению с животными интактной контрольной группы, что свидетельствовало о выраженном повреждении в-клеток пан- ВЕСТНИК НОВЫХ МЕДИЦИНСКИХ ТЕХНОЛОГИЙ – 2011 – Т. ХVIII, № 2 – С. 171 креатических островков. В группе крыс, получавших препарат «Диабета», отмечалось также снижение содержания инсулина в крови, однако данные явления имели меньшую выраженность (23,4%) и были не достоверны по отношению к группе контрольных крыс. Рис. 4. Содержание инсулина в плазме крови (M±m). Примечание. Вертикальные штрихи соответствуют стандартной ошибке средней величины. * - данные достоверны по отношению к интактной группе крыс, ANOVA, Newman-Keuls test (р<0,05). При морфологическом исследовании в интактной группе отмечалось альвеолярно-трубчатое строение экзокринной части поджелудочной железы с четким разделением на дольки прослойками соединительной ткани. Экзокриноциты сохраняли полярную дифференцировку при формировании ацинусов. Междольковые выводные протоки были выстланы однослойным кубическим эпителием. Панкреатические островки имели округлую или овальную форму и располагались поодиночке вблизи внутридольковых выводных протоков. Объемная доля островков, расположенных в желудочной и селезеночной зонах почти в два раза превышала объемную долю островков кишечной зоны. Центральные отделы панкреатических островков содержали в основном инсулин-позитивные клетки. Максимальная площадь, занимаемая инсулин-позитивными клетками отмечалась в селезеночной зоне, а в желудочной и кишечной зонах соотношение площади, занимаемой в-инсулоцитами уменьшалось (табл. 1). В отдельных в-клетках отмечалась слабая или умеренная ядерная экспрессия факторов пролиферации: PCNA-позитивные клетки составляли – 3%, Ki-67-позитивные – 1,5%. Экспрессия белка Bax была негативной во всех островковых клетках. Определялось слабое позитивное цитоплазматическое окрашивание инсулоцитов центральных отделов островка к протеину Bcl-2. Ядра единичных в-эндокриноцитов слабо экспрессировали белок p53. Большинство в-инсулоцитов имели позитивную ядерную экспрессию MDM2. В отдельных в-эндокриноцитах цитоплазматическая экспрессия каспазы 3 и TRAIL носила слабо выраженный характер (табл. 2). Апоптотический индекс был низким (табл. 3). В в-эндокриноцитах отмечалось равномерное расположение свободных рибосом и митохондрий, гранулярной эндоплазматической сети. Комплекс Гольджи был представлен хорошо различимыми уплощенными цистернами, вакуолями и большим количеством эндосекреторных гранул с характерной электроноплотной сердцевиной округлой формы, которая отделялась от поверхности окружающей мембраны светлым аморфным ободком. Секреторные гранулы занимали объемную долю – 14%, а их диаметр колебался в пределах 383,4±43,3 нм. У крыс с иммунозависимым СД определялся отек междольковой соединительной ткани. В панкреатических островках отмечалась умеренная лимфоцитарная инфильтрация. Капилляры островков были резко полнокровны, эндокриноциты, расположенных в центральных зонах были некротизированы, а расположенные в периферических отделах островка гипертрофированны. Объемная доля островков расположенных в кишечной, желудочной и селезеночной зонах уменьшалась по сравнению с интактной контрольной группой. Инсулин-позитивные клетки располагались поодиночке или в виде мелких скоплений в центральных отделах островков вокруг полнокровных капилляров. Происходило значительное уменьшение площади, занимаемой вэндокриноцитами, во всех зонах поджелудочной железы по сравнению с контрольной интактной группой животных. В кишечной зоне площадь уменьшилась в 1,7 раза (р<0,05), в желудочной и селезеночной – 1,5 (р<0,05) и 1,6 (р<0,05) раза (табл. 1). Отмечалась умеренная экспрессия факторов пролиферации в гипертрофированных клетках островков Лангерганса: PCNA-позитивные клетки составляли 9%, Ki-67-позитивные – 2,3%. Отмечалась слабая экспрессия протеинов p53, Bax, MDM2 и Bcl-2 в единичных в-инсулоцитах. В большинстве в-эндокриноцитов усиливалась экспрессия TRAIL и каспазы 3 (табл. 2). Происходило достоверное увеличение в-эндокриноцитов, находящихся в состоянии апоптоза, по сравнению с контрольной группой животных (табл. 3). При электронно-микроскопическом исследовании в большинстве инсулоцитов, имевших неправильную форму, резко вакуолизированную цитоплазму с неравномерным распределением в ней органелл, визуализировались набухшие митохондрии, кариопикноз, фрагменты разрушенной гранулярной эндоплазматической сети и комплекса Гольджи, секреторные гранулы не определялись или были единичные. Секреторные гранулы располагались хаотично как вокруг ядра, так и у плазмолеммы в виде единичных скоплений. Их электронно-плотная сердцевина становилась более крупной по сравнению с группой интактных животных, а светлый аморфный ободок уменьшался. Размеры гранул составляли 435,4±61,2 нм, а объемная доля – 1,7%. У крыс с иммунозависимым СД на фоне приема препарата «Диабета» в панкреатических островках отмечалась умеренная лимфоцитарная инфильтрация, полнокровие капилляров, деструкция отдельных эндокриноцитов. Центральные и периферические отделы островков занимали в-клетки. Определялись мелкие островки, которые располагались в тесной связи с внутридольковыми выводными протоками. Определялась умеренно выраженная гипертрофия в-эндокриноцитов. Объемная доля островков кишечной, желудочной и селезеночной зон увеличивалась по сравнению с СД, однако не достигала показателей интактной контрольной группы. Увеличивалась площадь, занимаемая инсулин-позитивными клетками во всех зонах поджелудочной железы по сравнению с СД. В кишечной и селезеночной зонах площадь увеличивалась в 1,6 раза (р<0,05), в желудочной в 1,5 раза (р<0,05) (табл. 1). Рядом с протоками и среди ацинарных клеток отмечались единичные клетки или скопления из 3-7 инсулинпозитивных клеток. Экспрессия факторов пролиферации носила выраженный характер: PCNA-позитивные клетки составляли 13,1%, Ki-67-позитивные – 3,2%. Выявлялись PCNA-позитивные и Ki-67-позитивные клетки эпителия протоков и единичные клетки, расположенные в ацинарной ткани и в непосредственной близости от островков. Экспрессия белков p53, Bcl-2 носила слабо выраженный характер, Bax не экспрессировалась. В большинстве в-клеток островков Лангерганса нарастала экспрессия протеина MDM2. В единичных в-инсулоцитах панкреатических островков отмечалась слабая экспрессия каспазы 3 и TRAIL (табл. 2). Количество в-клеток в состоянии апоптоза по сравнению с животными с иммунозависимым СД достоверно уменьшалось (табл. 3). Электронно-микроскопически определялись в-клетки с секреторными гранулами расположенными преимущественно у одного из полюсов клетки (объемная доля – 15,6%). Гранулы диаметром 393,2±41,6 нм имели электронноплотную сердцевину округлой формы и светлый аморфный ободок. Таблица 1 Морфометрические показатели панкреатических островков (M±m) Группы Интактный контроль Сахарный диабет «Диабета» Объемная доля островков, % 13,8±17,3 11,8±10,5 12,8±10,3 в-эндокриноциты, % 78,2±6,1 47,7±8,2* 77,3±11,0** Примечание: * – достоверно по отношению к интактному контролю. ** – достоверно по отношению к группе СД. Таблица 2 Иммуногистохимические характеристики в-эндокриноцитов Группы Интактный контроль Сахарный диабет «Диабета» Интактный контроль Сахарный диабет «Диабета» Маркеры апоптоза p53 Каспаза 3 TRAIL Bax Интенсивность экспрессии + + + +++ +++ + + ++ ++ Количество клеток + + + ++ ++ + + + + Bcl-2 MDM2 + + ++ + ++ + +++ + ++ + ВЕСТНИК НОВЫХ МЕДИЦИНСКИХ ТЕХНОЛОГИЙ – 2011 – Т. ХVIII, № 2 – С. 172 Таблица 3 Индексы апоптоза и пролиферации в-эндокриноцитов Группы Индекс апоптоза, % Интактный контроль Сахарный диабет «Диабета» 4,1±0,2 35,2±2,9* 13,3±1,1** Индекс пролиферации, % PCNA-позитивные Ki-67-позитивные клетки клетки 3,0±0,2 1,5±0,3 10,1±0,7* 2,3±0,1* 13,1±1,9 3,2±0,2** Примечание: * – достоверно по отношению к интактному контролю. ** – достоверно по отношению к группе СД. Полученные нами результаты подтверждают существующее мнение [4], что апоптоз играет значительную роль в процессах элиминации в-эндокриноцитов панкреатических островков при сахарном диабете. Являясь запрограммированной формой клеточной гибели, апоптоз может активироваться разными повреждающими агентами. Центральное место в развитии апоптоза занимает семейство цистеиновых протеаз - каспаз, которые образуют разветвленный каскад, взаимно активируя друг друга [3,10]. Значимое увеличение экспрессии эффекторной каспазы 3 в инсулоцитах и возрастание индекса апоптоза свидетельствуют о выраженном необратимом повреждении островкового аппарата поджелудочной железы в данной экспериментальной модели. В качестве индукторов апоптоза могут выступать вне- и внутриклеточные факторы, которые стимулируют «внешний» и «внутренний» сигнальные пути апоптоза. «Внутренний» путь является митохондриальным и обусловлен повреждением ДНК в результате токсического воздействия на клетку [3]. «Внешний» путь является рецептор-опосредованным и реализуется за счет активации мембранных протеинов, в т.ч. и рецептора TRAIL. Выявленное нами увеличение экспрессии протеина TRAIL у животных с иммунозависимым сахарным диабетом свидетельствует о возможности активации апоптоза по «внешнему» пути, с последующей активацией инициаторных и эффекторных каспаз. Скорость развития апоптоза при активации «внешнего» пути выше, поэтому он играет существенную роль в деструкции панкреатических в-инсулоцитов. Токсическое действие стрептозотоцина на в-клетки панкреатических островков реализуется за счёт алкилирования ДНК и образования токсических соединений – супероксид аниона, пероксинитрита и оксида азота. Повреждения ДНК и внутриклеточных структур сопровождаются развитием апоптоза вэндокриноцитов островков Лангерганса. Пусковым моментом запрограммированной клеточной гибели в данном случае является «внутренний» путь. В результате повреждения мембран митохондрий и активации протеина Bax возникает высвобождение в цитозоль апаптотических факторов в т.ч. цитохрома с и белка AIF [3]. Цитохром с активирует инициаторную каспазу 9, которая стимулирует эффекторную каспазу 3. Белок Bcl-2, напротив, способствует стабилизации мембран митохондрий и блокирует выход из них апоптогенных факторов. Увеличение экспрессии Bax у животных с иммунозависимым сахарным диабетом свидетельствует об активации «внутреннего» пути апоптоза. В группе животных получавших препарат «Диабета» отмечается экспрессия протеина Bcl-2, являющегося антиапоптогенным фактором. Таким образом, митохондриальный путь также может играть важную роль в развитии прогрессирующей убыли в-инсулоцитов панкреатических островков при экспериментальном сахарном диабете, а гимнемовые кислоты, входящие в состав препарата «Диабета» предотвращают развитие апоптоза [4]. Возможность регуляции апоптоза в-инсулоцитов, путем фармакологической коррекции и влияния на его потенциальные пусковые факторы, в настоящее время является перспективным направлением фармакологии [2]. Ингибирование апоптоза вклеток, обусловленная, введением препарата «Диабета», может быть объяснена инкретиномиметическим эффектом гимнемовых кислот, входящих в его состав, т.е. стимуляцией GLP-1, который регулирует баланс клеточной популяции островков Лангерганса угнетая апоптоз [7,12]. Медленное обновление клеточной популяции выражается низким индексом пролиферации эндокриноцитов островков Лангерганса в контрольной группе животных, что согласуется с литературными данными [1]. Достоверное увеличение индекса пролиферативной активности эндокриноцитов при иммунозависимом СД можно объяснить активацией репаративных процессов эндокринной части поджелудочной железы. Из экспериментальных данных следует, что гимнемовые кислоты, входящие в состав «Диабета» обладают выраженным стимулирующим действием на процессы клеточной репарации, что вполне согласуется с опытом зарубежных исследователей [2,12]. Различия в количестве Кi-67-позитивных и PCNA-позитивных клеток, могут быть обусловлены продолжительным периодом разрушения белка PCNA (около 20 часов) и его экспрессией не только в G0 фазе клеточного цикла, но и при репарации ДНК клеток [11]. В связи с этим, более достоверным для расчетов индекса пролиферации является протеин Ki-67 [3]. При ультрамикроскопических исследованиях выявлено, что конверсия проинсулина в инсулин происходит в секреторных гранулах комплекса Гольджи. По мере созревания гранул происходит уменьшение количества проинсулина и увеличение количества инсулина, что морфологически подтверждается появлением электроно плотной сердцевины в центральных отделах гранулы. В дальнейшем зрелые гранулы мигрируют к плазматической мембране, для дальнейшего слияния с ней и выброса инсулина в интерстициальное пространство, межклеточную жидкость и кровеносные капилляры. Известно, что при увеличении потребности в инсулине в инсулоцитах вначале происходит увеличение количества зрелых гранул и их объемной доли, с преимущественным скоплением в периферических отделах клетки. По мере увеличения секреции инсулина количество зрелых секреторных гранул на периферии клетки уменьшается, а количество гранул без электронно плотной сердцевины в цитоплазме увеличивается, что отражает высокую степень функциональной активности вэндокриноцита [5,6,9]. Выявленные нами ультраструктурные изменения в эндокриноцитов у животных с иммунозависимым СД свидетельствуют о нарушении процессов созревания секреторных гранул в в-клетках. У животных с СД на фоне лечения отмечено некоторое восстановление ультраструктуры вэндокриноцитов и размеров их секреторных гранул. Таким образом, комплексные морфофункциональные изменения, обнаруживаемые при клинико-лабораторных и морфологических исследованиях на различных уровнях, отражают основные стадии морфогенеза сахарного диабета и свидетельствуют об адекватности используемой экспериментальной модели сахарного диабета. Кроме того, у животных с клиникой сахарного диабета, получавших препарат «Диабета», на фоне характерных для данного заболевания структурных изменений в эндокринной части поджелудочной железы обнаружены особенности патоморфоза, проявлявшиеся в усилении репаративной регенерации в-инсулоцитов и уменьшении количества необратимо поврежденных в-клеток, находящихся в состоянии апоптоза, что подтверждается данными иммуногистохимического и электронномикроскопического исследований. Выводы. В условиях моделирования иммунозависимого СД на различных уровнях морфологического исследования выявлены комплексные структурные изменения в островковом аппарате поджелудочной железы, которые отражают основные стадии морфогенеза сахарного диабета. Уменьшение количества в-клеток и их секреторных гранул, объемной доли островков на фоне умеренно выраженного инсулита и появления патогномоничных клинико-лабораторных признаков сахарного диабета свидетельствуют об адекватности используемой экспериментальной модели. У крыс с клиникой сахарного диабета, получавших препарат «Диабета», обнаружены особенности патоморфоза в виде значимого увеличения количества Кi-67-позитивных и PCNAпозитивных инсулоцитов на 39,1% и 29,7% соответственно, а также достоверного снижения индекса апоптоза на 37,8%, что свидетельствует об усилении репаративной регенерации инсулоцитов и уменьшении числа клеток, подвергшихся апоптозу. Ультраструктурные изменения в эндокриноцитах у животных с иммунозависимым СД на фоне введения препарата «Диабета» характеризовались восстановлением компартментализации в-клеток, структуры их секреторных гранул и стабилизацией ультраморфометрических показателей. Литература 1. Акмаев И.Г. Руководство по гистологии (частная гистология органов и тканей) /Под ред. И.Г.Акмаева, В.Л. Быкова, О.В. Волкова. В 2 т. – Санк-Петербург.: СпецЛит, 2001. – 735 с. ВЕСТНИК НОВЫХ МЕДИЦИНСКИХ ТЕХНОЛОГИЙ – 2011 – Т. ХVIII, № 2 – С. 173 2. Воронкова М.П. Противодиабетическая активность гимнемовых кислот. Дисс. … д-ра биол. наук. – Волгоград. – 2009.– с. 338. 3. Мушкамбаров Н.Н., Кузнецов С.Л. Молекулярная биология. – М.: «МИА». – 2003. – 544 с. 4. Писарев В.Б., Снигур Г.Л., Спасов А.А. с соав. Механизмы токсического действия стрептозотоцина на в-клетки островков Лангерганса // Бюлл. эксп. биол. и мед. – 2009. – Т. 148. – N. 12. – c. 700-702. 5. Севергина Э.С. Инсулинозависимый сахарный диабет – взгляд морфолога. М.: Издательский дом Видар-М, 2002. 152 с. 6. Aughsteen A.A., An ultrastructural study on the effect of streptozotocin on the islets of Langerhans in mice // J. Electron Microscopy. – 2000. – Vol. 49. – №. 5. – P. 681-690. 7. Drucker D.J. Glucagon-like peptide-1 and the islet β-cell: augmentation of cell proliferation and inhibition of apoptosis // Endoc., Vol. 144, № 1, Р. 5145-5148, 2003. 8. Islam S., Loots D.T. Experimental rodent models of type 2 diabetes: a rewiev // Methods Find Exp Clin Pharmacol. – 2009. - 31 Vol. 4. - № 31. – Р. 249-261. 9. Koji Y., Junichiro M., Masako W., et al. Proliferation and differentiation of pancreatic в-cells: ultrastructural analysis of the pancreas in diabetic mice induced by selective alloxan perfusion // Medical Electron Microscopy. 1997. – Vol. 30. – №. 3. – P. 170-175. 10. Nakayama T., Hattori M., Uchida K., et al. The regulatory domain of the inositol 1,4,5-trisphosphate receptor is necessary to keep the channel domain closed: possible physiological significance of specific cleavage by caspase 3 // Biochem J. – 2004. – Vol. 377. – № 2. - Р. 299-307. 11. Tirakotai W., Bian L.G., Bertalanffy H., et al. Immunohistochemical study in dural arteriovenous fistula and possible role of ephrin-B2 for development of dural arteriovenous fistula // Chinese Medical Journal. – 2004. – Vol. 117. – № 12. – P. 1815-20. 12. Trucco M. Reregeneration of the pancreatic β-cell. // J. Clin. Investigation. – 2005. – Vol. 115 №1. – P. 5-12. MEDICINAL PATHOMORPHISM OF EXPERIMENTAL DIABETES MELLITUS G.L. SNIGUR, A.V. SMIRNOV, A.A. SPASOV, M.P. VORONKOVA Volgograd State Medical University, Chair of Anatomical Pathology, Chair of Pharmacology By means of modern methods pathohistology researches (light microscopy, electronic microscopy, immunohistochemical research and mathematical analysis methods) features of medicinal pathomorphism of experimental diabetes mellitus are studied. Key words: pathomorphism, diabetes mellitus, b-cells, apoptosis, proliferation. УДК: 611.451:615.849.19 ГОРМОНАЛЬНЫЙ СТАТУС НАДПОЧЕЧНИКОВ ПРИ ЛОКАЛЬНОМ ВОЗДЕЙСТВИИ ЛАЗЕРНОГО ОБЛУЧЕНИЯ Л.А. ТИТОВА, З.А. ВОРОНЦОВА* При облучении области надпочечников низкоинтенсивным лазерным излучением с частотой 80Гц в эксперименте обнаружен адекватный стимулирующий эффект, позволяющий считать ее оптимальной при лечении бронхиальной астмы. Ключевые слова: пучковая зона коры надпочечников, низкоинтенсивное лазерное излучение. Высокий уровень заболеваемости населения планеты бронхиальной астмой (БА) вызывает необходимость поиска новых направлений по оптимизации ее терапии. В настоящее время доказано, что в патогенезе бронхиальной астмы основное место занимает процесс воспаления бронхов. Глюкокортикостероиды (ГКС) являются наиболее эффективными противовоспалительными препаратами в терапии БА и согласно национальным и международным согласительным документам отнесены к препаратам первой линии при всех формах персистирующей бронхиальной астмы. Но, несмотря на то, что ГКС являются высокоэффективными препаратами риск развития побочных эффектов и тяжелых осложнений очень высок. Поэтому при длиельном применении желательно * ГОУ ВПО «Воронежская государственная медицинская академия им. Н.Н. Бурденко» Минзравсоцразвития России, тел. 8 (473) 253-02-93, e-mail: z.vorontsova@mail.ru максимально возможное снижение их дозы [1,5]. Вместе с этим нельзя не учитывать роль гормональных нарушений в патогенезе бронхиальной астмы. В частности у большинства больных БА отмечается глюкокортикоидная недостаточность, которая приводит к ослаблению их противовоспалительного действия, так как эндогенные глюкокортикоиды являются физиологическими антагонистами бронхоконстриктивных веществ. Перспективным является использование низкоинтенсивного лазерного излучения (НИЛИ) для активизации собственных глюкокортикоидов, определяющих противовоспалительное и десенсебилизирующее действие, улучшающее микроциркуляцию, репаративностимулирующее и иммуннокоррегирующее действие. В то же время глюкокортикоидные эффекты, не могут быть изолированными и индукционные процессы должны определить динамику событий на уровне органа [2]. В условиях возникающего хронического стресса, на фоне заболеваний происходит изменение продукции и метаболизма глюкокортикоидов, что может являться одной из причин нарушений бронхиальной проходимости. Легкие активно участвуют в обмене биогенных аминов и глюкокортикоидов, регулируя бронхиальный тонус. Снижение функции коры надпочечников четко коррелирует с тяжестью течения бронхиальной астмы и недостаточностью глюкокортикоидных гормонов способствующее прогрессированию этого процесса. Локальное воздействие низкоинтенсивного лазерного облучения надпочечниковой области усиливает микроциркуляцию, повышая функцию коркового вещества надпочечников выбросом в кровь кортикостероидных гормонов и проявляется морфологически. Такие данные позволяют констатировать, что локальное воздействие лазерного облучения применимо для стимуляции их функции, обусловленной непосредственным его влиянием на гормонпродуцирующие клетки. Имеются данные о модулирующем эффекте низкоинтенсивного лазерного облучения на продукцию глюкокортикоидов у больных бронхиальной астмой, поэтому анализ морфофункциональных изменений в пучковой зоне коры надпочечников важен для понимания процессов лежащих в основе их модификации у больных бронхиальной астмой. Немаловажная роль принадлежит катехоламинам мозгового вещества, как стимулятора кортикостероидов, причем с приспособительным эффектом к деятельности структурных образований в изменяющихся условиях. Их метаболические эффекты повышают интенсивность окислительных процессов, способствующих расслаблению гладких мышц бронхов, повышая дыхательный объем. Причем, нельзя исключать опосредованное действие кортикостероидов по отношению к катехоламинам, которые усиливают реакцию органа на катехоламины. В связи с этим представляется актуальным рассмотрение особенностей реагирования структурных образований коркового во взаимосвязи с мозговым веществом надпочечников для оценки адекватности изменений в условиях локального применения в эксперименте лазерного облучения [3,4]. Цель исследования – выявить морфофункциональные особенности состояния структурных образований коры надпочечников и мозгового вещества при локальном воздействии низкоинтенсивного лазерного излучения инфракрасного спектра, с различной частотой импульсов. Материалы и методы исследования. Проведение экспериментального исследования было обусловлено необходимостью обоснования характера влияния НИЛИ инфракрасного спектра, с различной частотой импульсов на морфофункциональное состояние коры надпочечников и мозгового вещества. Объектом изучения являлись 28 половозрелых белых крс-самцов массой 200230 грамм. В соответствии с методикой эксперимента были сформированы группы животных. Численность каждой группы составляла 7 животных. Для сравнения эффектов воздействия была сформирована интактная группа, а также группа контрольных животных, которая испытывала только иммобилизацию без последующего воздействия. Крысы остальных групп подвергались локальному воздействию низкоинтенсивного лазерного облучения инфракрасного спектра с частотой 80Гц и 1500Гц. Эксперимент продолжался пять суток (табл.1). Взятие биологического материала производили через сутки после последнего облучения. Крыс умерщвляли декапитацией. Надпочечники после взятия взвешивали, затем фиксировали в 10% формалине с последующей заливкой одного из них в парафин после стандартного обезвоживания и замораживания друго-