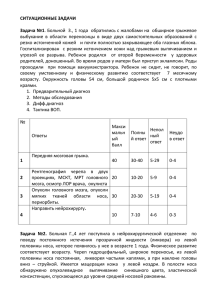
нейроонкология - Российская нейрохирургия
advertisement

ÍÅÉÐÎÎÍÊÎËÎÃÈß Íåéðîîíêîëîãèÿ ÎÏÛÒ ÓÄÀËÅÍÈß ÎÏÓÕÎËÅÉ ÑÔÅÍÎÏÅÒÐÎÊËÈÂÀËÜÍÛÕ ÌÅÍÈÍÃÈÎÌ Àâäîíèíà Þ. Ä., Ðîãîæêèí Ñ. Á., Ðåõàëîâ À. Ô., Ïîëþøêîâ À. Þ., Ìåäÿíèê È. À. Îáëàñòíàÿ êëèíè÷åñêàÿ áîëüíèöà èì. Í. À. Ñåìàøêî, Íèæíèé Íîâãîðîä В нейрохирургическом отделении в период с 1993 года было прооперировано 19 больных с опухолями (менинги омами) сфенопетрокливальной локализации. Большин ство больных поступили в стадии умеренной декомпенса ции. В клинической картине ведущими симптомами были гипертензионный синдром и недостаточность черепных нервов, пирамидная недостаточность и мозжечковая атак сия. Средние размеры опухолей составляли 3/4/5 см по КТ. Все больные оперированы в положении сидя. Выпол нялась краниотомия затылочной и височной костей с вре менным удалением костного лоскута. Сторона доступа выбиралась в зависимости от преимущественного распро странения опухоли. ТМО вскрывалась вдоль поперечно го синуса, при необходимости синус пересекался вместе с тенториумом. Опухоль поэтапно удалялась. Тотальное удаление удалось у 17 больных, субтотальное у 2. После операции 3 больным пришлось выполнять трахеостомию в связи с бульбарными нарушениями. 2 больных погибли после операции на 2 и 8 сутки, один от гнойных осложне ний, один от тромбэмболии легочной артерии. Продол жительность операций составила от 3,5 до 12 часов. ÑÒÐÓÊÒÓÐÀ ÏÅÐÂÈ×ÍÛÕ ÎÏÓÕÎËÅÉ ÖÍÑ Â ÒÀÒÀÐÑÒÀÍÅ Àëåêñååâ À. Ã., Äàíèëîâ Â. È., Äþäèí Ë. Ï., Èâàíîâ B. C., Äóáðîâèí Í. Â., Ãðîçäîâ À. Ï., Âàëüâà÷åâà Ô. Ø., Ìàëååâ Ì. Â. Ãîñóäàðñòâåííûé ìåäèöèíñêèé óíèâåðñèòåò, Êàçàíü, Òàòàðñòàí, Эпидемиологии опухолей ЦНС за рубежом уделяется большое внимание. В России эта проблема изучена недо статочно. Заболеваемость первичными опухолями ЦНС населения Татарстана не исследовалась. В работе проведен анализ структуры, диагностики и результатов лечения больных с первичными опухолями головного и спинного мозга, находившихся на обследо вании и лечении в нейрохирургических отделениях (НХО) РКБ МЗ РТ, ДРКБ МЗ РТ, БСМП (г. Набережные Чел ны) за период 19912000 гг. Эти учреждения являются ней роонкологическими центрами в республике. Состояние диагностики и лечения больных с опухоля ми головного и спинного мозга изучено за период после появления современных методов нейровизуализации. Всем больным, анализируемым в настоящей работе, вы полнена МРТ или РКТ мозга. За весь период исследования зарегистрировано 1826 пациентов с первичными опухолями ЦНС. Возраст боль ных колебался от 7 дней до 84 лет. В 2000 году заболевае мость составила у взрослых 6,2 на 100000 , у детей до 15 лет – 3,2 на 100000 . У взрослых опухоли головного мозга выявлены у 1418 человек, опухоли спинного мозга – у 188. Соответственно Международной классификации ВОЗ (1993 г.), опухоли головного мозга (ОГМ) распределялись: в 43,7% – опухоли нейроэпителиальной ткани, в 30,5% – мозговых оболочек, 9,3% – опухоли области турецкого седла, в 7,5% – черепных нервов, 9,0% составили все дру гие гистологические варианты опухолей. Нейроэпителиальные опухоли чаще встречались у муж чин. Опухоли мозговых оболочек, гипофиза и гипофизар ного хода, черепных нервов преобладали у женщин во всех возрастных группах. Среди всех диагностированных опухолей преобладали ОГМ супратенториальной локализации. 188 пациентов были госпитализированы с клиникой поражения спинного мозга опухолевым процессом. В по давляющем большинстве случаев опухоли были менин гиомами (42,5%) и невриномами (31,9%) экстрамедулляр ной локализации. Структура опухолей ЦНС у детей име ла ряд особенностей. 75% больных – дети с нейроэпите лиальными опухолями, преимущественно субтенториаль ного расположения, у 14% выявлены опухоли хиазмаль носеллярной области. В 73% опухоли располагались вблизи средней линии мозга. Несмотря на доступность неинвазивных методов ис следования (МРТ, РКТ), подавляющее количество боль ных поступило на стадии выраженной декомпенсации. Это свидетельствует о неверном представлении о вариан тах клинического течения опухолей мозга и недостаточ ной онкологической настороженности участковых тера певтов, неврологов и эндокринологов поликлиник и ста ционаров. Необходимо повышение квалификации ука занных специалистов в вопросах нейроонкологии. Результаты лечения больных на протяжении 10 лет улучшались. Послеоперационная летальность в 2000 году составила 6,5%. Этому во многом способствовало внедре ние микрохирургической техники. Вместе с этим существуют проблемы в организации лечения нейроонкологических больных. С целью умень шения травматичности вмешательств необходимо внедре ние стереотаксической хирургии, эндоскопических посо бий. Необходимо оснащение операционных современны ми микроскопами с навигационными системами. Следу ет внедрить интраоперационный мониторинг функций ствола головного мозга. К достижениям нейроонкологической службы респуб лики относится организация системы комплексного ле чения детей с опухолями ЦНС в ДРКБ (гл. врач Е. В. Кар пухин) на базе НХО, отделения онкогематологии и луче вой терапии Клинического онкологического диспансера МЗ РТ. Внедрены современные стандарты комбиниро ванного лечения у детей с медуллобластомами, анаплас тическими астроцитомами, глиобластомами, герминоген ными опухолями. Используются протоколы, предусмат ривающие лучевую и/или химиотерапию в различной последовательности и комбинации цитостатических хи миопрепаратов в зависимости от гистологического вари анта опухоли, стадии опухолевого процесса, возраста больного (HIT91, HIT2000, PCV, SIOP, CNS GDT, CPT 2000, M2000, монотерапия темодалом). Важной проблемой представляется создание системы проведения комплексного лечения у взрослых. Анализ полученных данных позволяет определить зада чи для оптимизации лечения больных с этой патологией. ÈÍÒÐÀÎÏÅÐÀÖÈÎÍÍÎÅ ÐÅÃÓËÈÐÎÂÀÍÈÅ ÂÍÓÒÐÈ×ÅÐÅÏÍÎÃÎ ÄÀÂËÅÍÈß ÏÐÈ ÒÐÀÍÑÑÔÅÍÎÈÄÀËÜÍÎÌ ÓÄÀËÅÍÈÈ ÁÎËÜØÈÕ È ÃÈÃÀÍÒÑÊÈÕ ÀÄÅÍÎÌ ÃÈÏÎÔÈÇÀ Ñ ÂÛÐÀÆÅÍÍÛÌ ÑÓÏÐÀÑÅËËßÐÍÛÌ ÐÎÑÒÎÌ Àëåêñååâ Ñ. Í., Òðóíèí Þ. Ê., Êàäàøåâ Á. À., Âîðîíèíà È. À., Àíçèìèðîâ Â. Ë., Ñîêîëîâñêàÿ È. Ý. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Одной из основных проблем при трансназальном уда лении эндосупраселлярных аденом является ограничение инструментальной и визуальной доступности супрасел III ñúåçä íåéðîõèðóðãîâ Ðîññèè 78 Íåéðîîíêîëîãèÿ лярной части аденомы. Многие хирурги использовали метод повышения внутричерепного давления во время операции для дислокации супраселлярной части опухоли и капсулы в полость седла. Способы повышения внутричерепного давления делят ся на две группы – прямые (введение воздуха, кислорода, физиологического раствора, ликвора эндолюмбально) и опосредованные, когда повышение внутричерепного дав ления достигается за счет повышения венозного давления – маневр Вальсальвы и сдавление яремных вен, однако они не позволяют эффективно увеличить давление, что делает их применение ограниченным. Разработанная нами методика кратковременного по вышения внутричерепного давления при трансназосфе ноидальном удалении эндосупраселлярных макроаденом гипофиза относится к прямым контролируемым методам управляемой внутричерепной гипертензии. Она приме нена у 96 больных с эндосупраселлярными макроадено мами гипофиза, у которых супраселлярная часть адено мы была равна или превышала по размеру эндоселлярную. Обязательным условием было отсутствие локальных вы ростов в супраселлярной части, что верифицировалось данными МРТ и КТГ. После начала общего наркоза устанавливаются два люмбальных катетера диаметром 1 мм (один катетер для инфузии и удаления жидкости, второй для манометричес кого контроля). Производилось повышение внутричереп ного давления путем инфузии физиологического раство ра через люмбальный катетер. Пределы повышения внут ричерепного давления, позвляющие низвести капсулу в полость турецкого седла, составили от 70 до 1200 мм вод. ст., что позволило радикально удалить супраселлярную часть опухоли и коагулировать капсулу. Длительность манипуляции не превышала 5 минут, после чего внутри черепное давление снижалось до исходного уровня. Для упрощения анализа полученного материала наблюдения ранжированы на четыре группы по градации повышения давления. От 70 до 280 (15 наблюдений), от 280 до 560 (68 наблюдений) от 560 до 840 (12 наблюдений), и от 840 до 1200 (6 наблюдений). В двух случаях изначально высокое внутричерепное давление (180 и 200 мм вод. ст.), наоборот, потребовало уменьшить давление до 0, чтобы ликвидировать спон танное выбухание капсулы в трепанационное отвер стие, мешающее удалению эндоселлярной части опу холи. Применяемые во время операции ЭЭГ и доппле рография не выявили какихлибо изменений в первой группе. У части больных второй группы на ЭЭГ наблю далось появление билатеральносинхронных групп рит мических тетаколебаний, эпилептиформных острых потенциалов в центральных областях коры. У 4х из них отмечались короткие билатеральные вспышки повы шенной амплитуды альфаволн. Указанные изменения фиксировались на стадии повышения внутричерепно го давления и полностью регрессировали при достиже нии исходного уровня внутричерепного давления; та кие же изменения в разной степени выраженности при сутствовали и у всех больных третьей группы. У двух больных в четвертой группе на высоте воздействия раз вились общемозговые изменения ЭЭГ в виде появле ния ритмической тета и дельтаактивности. Одновре менно при локации средней мозговой артерии опреде лялось кратковременное прекращение мозговой цирку ляции с реверберирующим типом допплеровской кри вой. Отмеченные изменения ЭЭГ и гемодинамики рег рессировали при возвращении к исходному уровню внутричерепного давления. Во всех случаях достигнуто полное удаление опухоли. В 87 случаях из 96 супраселлярная экспансия опухоли проявлялась хиазмальным синдромом. У 25 больных дос тигнуто полное восстановление зрительной функции, а у 48 отмечено улучшение зрения, у оставшихся 8 больных динамики со стороны зрительной функции к моменту выписки не выявлено. Таким образом, проведенные исследования показали эффективность как самого метода повышения внутриче репного давления, так и комплексного физиологическо го контроля ЭЭГ и ультразвуковой допплерографии, по зволивших считать безопасным повышение внутричереп ного давления до 280 мм вод. ст. (1 группа), относительно безопасным до 560 (2 группа). Повышение выше указан ного предела потенциально опасно и в настоящее время нами не применяется. ÌÅÒÎÄ ÏËÀÑÒÈÊÈ ÎÑÍÎÂÀÍÈß ×ÅÐÅÏÀ ÏÎÑËÅ ÒÐÀÍÑÑÔÅÍÎÈÄÀËÜÍÛÕ ÎÏÅÐÀÖÈÉ Ñ ÈÑÏÎËÜÇÎÂÀÍÈÅÌ ÁÀËËÎÍ-ÊÀÒÅÒÅÐÀ Àëåêñååâ Ñ. Í., Òðóíèí Þ. Ê., Øêàðóáî À. Í., Êóòèí Ì. À., Êðàñíîïåðîâ È. Â. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà В в е д е н и е . Несмотря на большой опыт транссфено идальной хирургии опухолей основания черепа (адено мы гипофиза, краниофарингиомы, хордомы, дермоиды эпидермоиды и др.), сохраняется достаточно высокое ко личество случаев послеоперационной назальной ликво реи (до 18% при дизэмбриогенетических опухолях и 5% при аденомах гипофиза). Большинству больных с этим серьезным осложнением производилась пластика седла по традиционной методике – в полость седла укладыва лась гемостатическая губка, трепанационный дефект закрывался костным фрагментом от носовой перегород ки, иногда в полость основной пазухи укладывалась жи ровая ткань. Изза глубины, узости раны и малой зоны доступности пластику основания черепа делать крайне сложно. С 1989 года нами используется метод пластики основания с применением баллонкатетера оригиналь ной конструкции, позволяющий бороться с назальной ликвореей. М а т е р и а л и м е т о д ы . По нашему методу это было проведено у 28 пациентов в возрасте от 18 до 54 лет. Из них 19 – с эндоэкстраселлярными аденомами гипофи за, 5 – с эндосупраселлярными краниофарингиомами, 2 – с хордомами основания черепа, 2 – с низкодиффе ренцированным раком основания черепа. Всем пациен там в полость сфеноидальной пазухи устанавливали бал лонкатетер оригинальной конструкции, причем конст руктивные особенности баллонкатетера, полость кото рого наполняли рентгенконтрастным антисептическим веществом, позволяют использовать как отделяемый баллон, так и неотделяемый баллонкатетер в сборе: «Ус тройство для устранения послеоперационной назальной ликвореи» (патент Российской Федерации на изобрете ние № 2179547). 9 пациентам при интраоперационной ликворее в по лость пазухи устанавливали неотделяемый баллонкате тер, который находился в полости пазухи в течение 610 дней. В 3 случаях произведена замена баллонакатетера в связи с разгерметизацией конструкции. У 19 пациентов послеоперационная ликворея развилась в сроки от 5 до 9 дней после операции, 9 из них произве дена установка отделяемого баллонкатетера в полость сфеноидальной пазухи, а 10 установлен неотделяемый 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 79 Íåéðîîíêîëîãèÿ баллонкатетер, который находился в полости пазухи на срок 710 дней. Всем больным баллонкатетер устанавли вался на фоне наружного люмбального дренирования. 5 пациентов реоперированы по поводу продолжающейся ликвореи. Базальные менингиты наблюдались у 2 паци ентов. Нагноения в области основной пазухи в данной серии наблюдений не было. З а к л ю ч е н и е . Таким образом, несмотря на то, что данная методика полностью не решает вопроса лечения послеоперационной назальной ликвореи, она может быть адекватной альтернативой прямому методу лечения послеоперационных ликворей, учитывая тот факт, что она проводится под внутривенным кетаминовым нарко зом и длительность этой процедуры не превышает 30 минут. Итак, определение содержания общих сульфгидриль ных групп в плазме крови больных между курсами хими отерапии может служить критерием наличия продолжен ного роста опухоли. Проведены исследования содержания безбелковых сульфгидрильных групп в плазме крови со злокачествен ными опухолями головного мозга после действия проти воопухолевых препаратов. Высокое содержание безбелковых SHгрупп в плазме крови больных после действия препаратов свидетельству ет о резистентности опухоли. Таким образом, проведенные исследования показали целесообразность применения внутриартериального се лективного и суперселективного методов введения хими опрепаратов как при первичных, так и при метастатичес ких опухолях головного мозга. ÊÎÌÁÈÍÈÐÎÂÀÍÍÎÅ ËÅ×ÅÍÈÅ ÇËÎÊÀ×ÅÑÒÂÅÍÍÛÕ ÎÏÓÕÎËÅÉ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ (ÏÅÐÂÈ×ÍÛÕ È ÌÅÒÀÑÒÀÒÈ×ÅÑÊÈÕ) ÏÐÈ ÂÍÓÒÐÈÀÐÒÅÐÈÀËÜÍÎÌ ÑÓÏÅÐÑÅËÅÊÒÈÂÍÎÌ È ÑÅËÅÊÒÈÂÍÎÌ ÂÂÅÄÅÍÈÈ ÕÈÌÈÎÏÐÅÏÀÐÀÒΠÀííèí Å. À., Ùåãëîâ Â. È., Îëåéíèê Ã. Ì., Áóöêî Ñ. Íàó÷íî-ïðàêòè÷åñêèé Öåíòð ýíäîâàñêóëÿðíîé íåéðîðåíòãåíîõèðóðãèè ÀÌÍ Óêðàèíû ÏÐÎÃÍÎÇÈÐÎÂÀÍÈÅ ÇËÎÊÀ×ÅÑÒÂÅÍÍÎÉ ÒÐÀÍÑÔÎÐÌÀÖÈÈ ÄÎÁÐÎÊÀ×ÅÑÒÂÅÍÍÛÕ ÎÏÓÕÎËÅÉ ÖÅÍÒÐÀËÜÍÎÉ ÍÅÐÂÍÎÉ ÑÈÑÒÅÌÛ Àíòîíîâ À. Â., Áàøêàòîâ Ñ. À., Ñàôèí Ø. Ì. Ðåñïóáëèêàíñêàÿ êëèíè÷åñêàÿ áîëüíèöà èì. Ã. Ã. Êóâàòîâà, Óôà, Áàøêîðòîñòàí Проведено комбинированное лечение 21 больного с MTS в головной мозг и 24 больных с первичными злока чественными опухолями головного мозга. Показано, что для решения тактики лечения необхо димо проведение детального обследования больного, ко торое включает АКТ, МРТ, радиоизотопное исследова ние, тотальную церебральную АГ и оценку кровоснабже ния опухоли. При наличии опухоли мозга и единичных MTS при компенсированном состоянии больных показано хирур гическое удаление опухоли. Обязательным является пос ледующее проведение химиотерапии, которая включает селективную внутриартериальную фармакоперфузию и прочие пути введения препаратов. При назначении про тивоопухолевых препаратов обязательным является оп ределение индивидуальной чувствительности. Препарат хлофиден оказался наиболее эффективным при MTS го ловного мозга (93% чувствительных опухолей). Проведено определение индивидуальной чувствитель ности злокачественных опухолей головного мозга по плаз ме крови больных к пяти противоопухолевым препара там (ломустин, кармубриз, хлофиден, цисплатин, бипекс). Отмечено выраженное противоопухолевое действие пре парата кармубриз – 85,7% больных были чувствительные к данному препарату. По активности препараты можно расположить по нарастающей прямой: хлофиден, ломус тин, бипекс, цисилатин. После введения препаратов направленность изменений биохимических показателей плазмы крови больных со злокачественными опухолями головного мозга аналогич но енграмам при чувствительности и нечувствительнос ти опухолей. Проведенная оценка эффективности курса лечения больных со злокачественными опухолями головного мозга показала, что предсказание чувствительности и эффектив ность курса лечения совпадало в 86% случаев. Исследование содержания общих сульфгидрильных групп в плазме крови одного и того же больного при про ведении нескольких курсов химиотерапии без продол женного роста опухоли показало, что в начале следую щего курса лечения данный показатель не повышается в сравнении с таким в конце предшествующего курса лечения. Распространенность опухолей ЦНС составляет около 7% от общего числа новообразований. Глиальные опухо ли (астроцитомы, олигодендроглиомы) охватывают 45 70% новообразований центральной нервной системы. Многие доброкачественные формы с течением времени переходят в злокачественную. Именно поэтому представ ляется важной для практической медицины разработка подходов к надежному прогнозированию их возможного озлокачествления. В настоящее время доказана важная роль гетерополи сахаридов из класса гликозаминогликанов (ГАГ) в про цессах клеточной пролиферации и дифференцировки. В литературе имеются отдельные сведения о сопряженнос ти системы ГАГ с процессами опухолевого роста, в том числе об изменении их общего содержания в сыворотке крови при онкологических заболеваниях. В основу методики определения концентрации и фрак ционного состава ГАГ в малых количествах сыворотки крови (34 мл) положен метод извлечения протеоглика нов ионообменной хроматографией на DЕАЕцеллюло зе или DЕАЕсефагеле, уравновешенных концентриро ванным раствором мочевины с детергентом. Использованная методика была осуществлена в усло виях нейрохирургического отделения Республиканской клинической больницы (РКБ) им. Г. Г. Куватова. Был обследован 131 пациент с полудоброкачественными и доб рокачественными опухолями головного мозга – астроци томой и менингиомами – в следующие сроки: до опера тивного вмешательства, в ближайшие дни после опера ции (1012 сутки), в отдаленный послеоперационный пе риод (1012 месяцев). Контрольную группу составили 20 практически здоровых лиц. В опытной и контрольной группах определяли уровень ГАГ и их фракций: хондрои тинсульфатов (ХС), гепарансульфатов (ГС) и гиалуроно вой кислоты (ГК). Содержание ГАГ до оперативного вме шательства у лиц с верифицированной астроцитомой в сыворотке крови были ниже нормы в 2 раза. При этом показатели ХС снизились в 3,2 раза, а фракция гепаран сульфатов была обнаружена в следовых количествах. В послеоперационном периоде на десятые сутки отме чалось увеличение концентрации ГАГ на 9%. Уровень ГК приблизился к показателям нормы. Доля ХС уменьши лась в 1,2 раза относительно их содержания до оператив III ñúåçä íåéðîõèðóðãîâ Ðîññèè 80 Íåéðîîíêîëîãèÿ ного вмешательства. Через 1 год показатели оставались ниже значений контрольной группы: ГАГ – в 1,7 раза, ХС – в 3,6 раза и ГС – в 2,9 раза. При сравнении с группой лиц до оперативного вмешательства отмечалось увеличе ние ГС на 160%. Изучение биохимических показателей группы паци ентов с менингиомами установило, что содержание ГАГ в сыворотке крови до оперативного вмешательства было в 2,4 раза меньше нормы: ГК – в 1,3 раза, ХС – в 7,7 раза и ГС – в 27,7 раза. Через десять суток уровень ГАГ дос тигал 50% от нормального, но был в 1,2 раза больше, чем до операции. Содержание ХС составляло 30% от конт рольных значений и в 2,7 раза больше, чем до операции. Уровень ГС в этот период был в 3 раза меньше, чем в кон трольной группе и в 9 раз больше, чем до операции. Че рез год содержание ГАГ составляло 59% от контрольных значений. Концентрация ГК в это время находилась в пределах нормы, а содержание ХС и ГС было соответ ственно в 3,6 и 2,1 раза ее ниже. По сравнению с показа телями до оперативного вмешательства уровни ГАГ и ГК выросли в 1,4 раза, а ХС – в 2,1 и ГС – в 13,2 раза. При сопоставлении данных двух групп с различны ми опухолями головного мозга – астроцитомой и ме нингиомой – отмечается низкое содержание или пол ное отсутствие гепарансульфатов в сыворотке крови после радикальной операции в течение длительного времени, что не исключает в дальнейшем рецидива опу холевой болезни. Таким образом, для опухолей ЦНС с высокой вероят ностью озлокачествления характерно снижение содержа ния ГАГ в сыворотке крови в 22,5 раза, а также хондрои тин и гепарансульфатов в 3,5 и 100 раз соответственно, высокий уровень гиалуроновой кислоты в первые сутки после оперативного вмешательства и низкий уровень ге парансульфатов и хондроитинсульфатов, с последующим ростом их содержания. ÊÎÌÏËÅÊÑ ÆÈÐÎÐÀÑÒÂÎÐÈÌÛÕ ÂÈÒÀÌÈÍÎÂ È ÊÀÐÎÒÈÍÎÈÄΠ ÊÎÌÁÈÍÈÐÎÂÀÍÍÎÌ ËÅ×ÅÍÈÈ ÁÎËÜÍÛÕ Ñ ÃËÈÀËÜÍÛÌÈ ÎÏÓÕÎËßÌÈ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Áàëÿçèí Â. À., Ïîëÿê À. È., Ðóìáåøò Â. Í., ×åðíèêîâà È. Â., Êðàâ÷åíêî Å. Ã., ×óâåíêîâ À. Ô. Ãîñóäàðñòâåííûé Ìåäèöèíñêèé Óíèâåðñèòåò, Ðîñòîâ-íà-Äîíó Результаты комбинированного лечения больных с гли альными опухолями головного мозга, представленного хирургическим методом, лучевой и химиотерапией, не могут на сегодняшний день удовлетворить специалистов, работающих в этой области. Поиск новых методов лече ния, позволяющих увеличить продолжительность и улуч шить качество жизни пациентов с глиальными опухоля ми, является одной из ключевых задач современной ней роонкологии. Нами предлагается включение в комбини рованное лечение этих больных комплекса жирораство римых витаминов и каротиноидов (КЖВ). Всего было исследовано 90 больных с глиальными опу холями головного мозга супратенториальной локализа ции, разделенных на группы больных с опухолями III и IIIIV степени злокачественности, проведен анализ кли нических, катамнестических данных, а также оценка иммунного статуса этих пациентов. Из этой большой группы нами было выделено 3 подгруппы, которым про водилось назначение КЖВ: I – больные с опухолями головного мозга III и IV сте пени злокачественности по классификации ВОЗ (глиоб ластомы, анапластические астроцитомы) – 17 человек; II – больные с опухолями I и II степени злокачествен ности (фибриллярные астроцитомы, олигоастроцитомы, олигодендроглиомы) – 20 человек; III – больные с опухолями, занимающими функцио нально значимые зоны – 16 человек. Остальные больные, не получавшие КЖВ, составили группу контроля. Верификация диагноза в I и II группах больных была интраоперационная и гистологическая, в III группе – кли ническая, по данным длительного катамнестического на блюдения и результатам МРТисследования. I группа больных подвергалась хирургическому лечению с после дующей лучевой терапией, II группа – только хирурги ческому лечению с тотальным, субтотальным или частич ным удалением опухоли. Препарат назначался на 45 сутки после операции, и прием его продолжался во всех случаях более 6 месяцев, у многих больных до 34 лет. По литературным данным, медиана выживаемости у больных с глиобластомами, которым проводилось ком бинированное лечение (хирургия + лучевая терапия), – от 11 до 12 месяцев, с анапластическими астроцито мами – 2425 месяцев (Kaplan R., 1995; Levin V., 1992; Black B., 1998). Медиана выживаемости в I группе на ших больных, которые, кроме хирургического лечения и лучевой терапии, получали КЖВ, составила 14,3 ме сяцев для глиобластом и 27 месяцев – для анапласти ческих астроцитом. В группе больных с доброкачествен ными глиальными опухолями медиана выживаемости была 96 месяцев. У многих больных с фибриллярными астроцитомами и олигодендроглиомами, принимавшими каротиноиды, отмечена медиана безрецидивного периода более 15 лет, отсутствие рецидивов подтверждено данными КТ и МРТ. Анализ катамнестического наблюдения за III группой больных, у которых опухоли занимали функционально з начимые зоны, показал длительное сохранение высокого качества жизни, отсутствие прогрессирования опухолево го роста на фоне приема только КЖВ и противосудорож ной терапии. Продолжительность жизни этих пациентов составила 70 месяцев. В основу математической обработки наших данных, прогноза и методологии диагностики положена множе ственная регрессионная модель пропорциональных ин тенсивностей Кокса. Начальный анализ выживаемости проводился по методу КапланаМайер. Анализ полученных данных показал, что основными прогностически значимыми факторами, влияющими на продолжительность жизни больных с глиальными супра тенториальными опухолями, являются: возраст, распро страненность объемного процесса, объем оперативного вмешательства, гистологические характеристики опухо ли, давность анамнеза и наличие признаков внутричереп ной гипертензии. Таким образом, нами отмечено существенное влияние КЖВ на ускорение реабилитации в послеоперационном периоде, улучшение качества жизни больных с глиальны ми опухолями. Положительный клинический эффект коррелировал с динамикой иммунологических показате лей. Анализ длительного катамнестического наблюдения за этими пациентами в течение 10 лет позволяет сделать заключение о значительном влиянии назначения комп лекса жирорастворимых витаминов и каротиноидов, включенного в комбинированную терапию, на продол жительность жизни больных с глиальными супратенто риальными опухолями головного мозга. 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 81 Íåéðîîíêîëîãèÿ ÄÂÓÕËÎÑÊÓÒÍÛÉ ÑÓÁÔÐÎÍÒÀËÜÍÛÉ ÄÎÑÒÓÏ Ê ÎÏÓÕÎËßÌ ÎÑÍÎÂÀÍÈß ×ÅÐÅÏÀ Áåêÿøåâ À. Õ., ×åðåêàåâ Â. À., Áåëîâ À. È., Âèíîêóðîâ À. Ã., Öèêàðèøâèëè Â. Ì. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Внедрение современных базальных доступов явилось отражением существенного прогресса нейрохирургии за последние два десятилетия. Этот прогресс связан с совер шенствованием методов диагностики (КТ, МРТ, ангиог рафия), с новыми технологиями в обеспечении операций (высокоскоростные боры, ультразвуковые отсосы, мик роинструменты, системы интраоперационной навига ции), с достижениями в нейроанестезиологии и нейроре анимации. В НИИ нейрохирургии им. Н. Н. Бурденко РАМН про блема разработки методов диагностики и лечения соче танной патологии глазницы, околоносовых пазух и осно вания черепа имеет глубокие традиции. Одним из совре менных и эффективных методов хирургического лечения данной патологии является двухлоскутный субфронталь ный доступ. Двухлоскутный субфронтальный доступ включает в себя низкую субфронтальную трепанацую. После этого выделяется лобноорбитальный костный лоскут, который включает передние отделы крыш глазниц, супраорбиталь ные края и основание лобной кости между лобноносо вым швом и петушиным гребнем. По завершении опера ции дно передней черепной ямки укрывается фрагмен том жировой клетчатки и лоскутом надкостницы. После этого фиксируется лобноорбитальный блок. Затем фик сируется субфронтальный костный лоскут. Двухлоскутный субфронтальный доступ показан при опухолях, локализованных по средней линии основания черепа, таких как: хордомы, больших размеров менинги омы передней черепной ямки, распространяющиеся на бугорок турецкого седла, опухоли хиазмальноселлярной области с ростом в основную пазуху. Краткая характеристика доступа. Границы доступа: спереди – кости носа; латерально – кавернозные синусы; снизу – носоглотка, кзади – боль шое затылочное отверстие и С2позвонок. Преимущества доступа: широкий операционный обзор хиазмальноселлярной области спереди и снизу; экстра дуральный подход к передней черепной ямке, пазухам носа, скату; носоглотке, кавернозным синусам, спинке турецкого седла; минимальная тракция лобных долей. Недостатки доступа: частичная или полная потеря обо няния; повышенный риск назальной ликвореи и рино синусогенных воспалительных осложнений. За последние 3 года в НИИ нейрохирургии с примене нием этого доступа было прооперировано 25 больных (15 женщин и 10 мужчин) в возрасте от 19 до 65 лет с различ ными гистологическими диагнозами (18 менингиом, 3 фиброзных дисплазии, 1 аденома гипофиза, 1 адаманти нома, 1 хондрома, 1 ангиофиброма). Анализ произведенных операций позволил сделать сле дующие выводы в пользу данного доступа: экстракрани альный подход, хороший косметический эффект, мини мальная тракция лобных долей. Двухлоскутный субфрон тальный подход наиболее целесообразен при экстра и интрадуральной локализации опухоли основания черепа. Клинические наблюдения показали преимущества двух лоскутного субфронтального доступа при новообразова ниях основания передней черепной ямки, распространя ющихся в околоносовые пазухи, носоглотку, когда вся опухоль может быть удалена в один этап. Тщательная пла стика дефектов твердой мозговой оболочки и основания черепа позволила избежать назальной ликвореи и инфек ционных осложнений. ÐÀÄÈÎÒÅÐÀÏÈß ÇËÎÊÀ×ÅÑÒÂÅÍÍÛÕ ÃËÈÎÌ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ ÍÀ ÔÎÍÅ ÐÀÄÈÎÑÅÍÑÈÁÈËÈÇÀÖÈÈ ÏÐÅÏÀÐÀÒÎÌ ÃÈÄÐÅÀ Áåíöèîí Ä. Ë., Ôèàëêî Í. Â. Óðàëüñêèé ìåæîáëàñòíîé íåéðîõèðóðãè÷åñêèé öåíòð èìåíè ïðîô. Ä. Ã. Øåôåðà, ÃÓÇ ÑÎÎÄ ÌÍÏÖ «Îíêîëîãèÿ», Åêàòåðèíáóðã Медиана выживаемости при комбинированном лече нии злокачественных глиом (ЗГ) зависит от гистологичес кой структуры и составляет при глиобластомах от 11 до 14,5 месяцев, анапластических астроцитомах (АА) – до 40 месяцев. Данные радиобиологических исследований свидетель ствуют, что лишь 10% клеток большинства глиом явля ются радиочувствительными. Основная масса клеток на ходится в радиорезистентном состоянии: непролифери рующий пул и клетки, находящиеся в фазе синтеза. В свя зи с этим разработаны и применяются схемы облучения с радиомодификаторами, среди которых наиболее часто используются производные нитрозомочевины, гидрокси мочевина, 5фторурацил, винкристин и др. Они прони кают через гематоэнцефалический барьер и способству ют сенсибилизации опухоли к облучению. С 1999 года в радиотерапевтическом отделении центра использовался препарат Гидреа, который ингибирует фер менты, участвующие в синтезе ДНК и подавляет восста новление ДНК после сублетальных лучевых повреждений. Кроме этого, препарат, накапливаясь в клетках, задержи вает их в фазе синтеза, способствует их временной синх ронизации и одновременному переходу в радиочувстви тельную фазу. В проспективное исследование включены 37 пациен тов с гистологически верифицированными опухолями III IV степени злокачественности (по ВОЗ): мультиформные глиобластомы (МГБ) – 23, 14 – АА. У трех больных луче вую терапию проводили в самостоятельном варианте, у 32 после парциального, субтотального удаления, у 2 пос ле повторного удаления по поводу рецидива. Препарат назначали с первого дня облучения по 500 мг внутрь че рез каждые 6 часов ежедневно на протяжении всего курса радиотерапии до суммарной дозы 50 грамм. Облучение проводили в режиме классического фракционирования по 2 Гр в день, 5 фракций в неделю до СОД 5560 Гр на область опухоли или ее ложа на установках «АгатР» и ЛУЭ 6 МэВ. Облучение выполняли статическим способом че рез 2 встречных поля или с двух полей под углом. Разме ры полей варьировали от 36 до 100 кв. см. В терапию со провождения были включены гормоны, мочегонные, со судистые препараты. В качестве группы сравнения ис пользовали контрольную группу, в которую вошли паци енты с ЗГ, подвергнутые облучению в аналогичных усло виях без Гидреи в предыдущие годы. После окончания лечения пациенты находились под динамическим наблю дением с частотой 1 раз в 3 месяца (осмотр нейрохирурга, ОАК, КТ или МРТ). Лечение в полном объеме проведено 33 пациентам, у одного пациента в связи с нарастанием неврологическо го дефицита лечение было прервано на дозе 30 Гр. Ток сичность лечения была следующей: тошнота наблюдалась у одного пациента (9%), лейкопения, возникшая во вто рой половине курса и не потребовавшая перерыва в лече III ñúåçä íåéðîõèðóðãîâ Ðîññèè 82 Íåéðîîíêîëîãèÿ нии и снижения дозы Гидреи, у трех (27%), стоматит у од ного пациента (9%). Других побочных эффектов отмече но не было. В контрольной группе токсичность была со поставимой. Медиана выживаемости в исследуемой группе соста вила для глиобластомы 13 месяцев. Все пациенты с АА на настоящий момент живы: 5 пациентов живут 26 ме сяцев, 2 – 28, в контрольной группе медиана выживае мости составила для глиобластомы – 11, для АА – 34. Переносимость курса оценивается как удовлетвори тельная. Использование Гидреи в качестве радиосенси билизатора увеличивает медиану выживаемости с 11 до 13 месяцев при МГБ, не препятствует проведению стан дартного курса лучевой терапии в полном объеме и не ухудшает качества жизни пациента. Предполагается продолжить наблюдение, проследить отдаленные ре зультаты комбинированного лечения глиом, начато применение комбинированного лечения с адъювантной химиотерапией. ÒÐÀÍÑÃËÀÁÅËËßÐÍÛÉ ÒÐÀÍÑÝÒÌÎÈÄÀËÜÍÛÉ ÄÎÑÒÓÏ ÏÐÈ ÓÄÀËÅÍÈÈ ÀÄÅÍÎÌ ÃÈÏÎÔÈÇÀ Áèêìóëëèí Â. Í., Øóëåâ Þ. À., Ðçàåâ Ä. À., Ðóäåíêî Â. Â., Êîëîòîâ À. À., Ðû÷êîâ Â. Ë., Âîðîáüåâ À. Â. Ãîðîäñêàÿ Ìíîãîïðîôèëüíàÿ áîëüíèöà ¹ 2, Ìåäèöèíñêàÿ Àêàäåìèÿ ïîñëåäèïëîìíîãî îáðàçîâàíèÿ, Ñàíêò-Ïåòåðáóðã При использовании трансэтмоидального доступа не представляется возможным эффективно ревизовать пре хиазмальное пространство. Применение трансбазально го доступа (Diaz Day, 1996) весьма травматично. Сочета ние доступа через ячейки решетчатого лабиринта с одно сторонней парамедианной резекцией дна ПЧЯ суще ственно расширяет зону хирургического обзора и может быть выполнено из небольшого Тобразного разреза в области glabella. (H.D. Jho, 1999). Ц е л ь . Исследовать возможность увеличения зоны об зора и хирургических манипуляций при использовании трансглабеллярного трансэтомидального доступа. М а т е р и а л ы и м е т о д ы . Проанализирован опыт лечения 7 пациентов с верифицированными по результа там КТ и ЯМРТ опухолями хиазмальноселлярной обла сти с преимущественным инфраселлярным ростом, опе рированных за период с июня по декабрь 2001 года в пер вом нейрохирургическом отделении ГМПБ № 2. У пяти больных отмечены инфраселлярные опухоли, распрост раняющиеся пара и ретроселлярно. Показаниям к опе рации явились клинические проявления гормонально активных опухолей, зрительные и глазодвигательные рас стройства. Рассматриваемый доступ был применен в слу чаях, когда основная масса опухоли располагалась инф раселлярно и была труднодоступна для интракраниаль ного вмешательства. Костная резекция выполнялась мик рокраниотомом с выпиливанием костей фрагмента носо вого отростка лобной кости, лобного отростка верхней челюсти и двух носовых костей. При необходимости рас ширение трансэтмоидального доступа достигалось одно сторонней парамедианной резекцией дна ПЧЯ. Техничес кое оснащение – операционный микроскоп «OPMI Zeiss», эндоскоп Karl Storz 281628 W 30, пневмодрель, микрохирургический набор для транссфеноидального доступа. Р е з у л ь т а т ы . Во всех случаях достигнута надежная визуализация основной пазухи, турецкого седла, верх них отделов ската. Была обеспечена возможность кон тролируемого удаления интракапсулярной части опу холи, а также отделения капсулы опухоли от верхних от делов ската, из межножковой цистерны. Для улучше ния обзора боковых флангов основной пазухи доступ обеспечивает комфортные возможности введения в глу бокие отделы раны эндоскопа. Важно, что этим дости гается сочетание преимуществ эндоскопического обзо ра с манипуляциями штатными микрохирургическими инструментами, применяемыми непосредственно через рану. Нами отмечены следующие преимущества транглабел лярного трансэтмоидального доступа: малоинвазивность, сокращение дистанции до основной пазухи, комфортное положение хирурга со стороны вертекса, достаточный обзор без использования ретракторов, возможность при менения в операционном поле моно и биполярной коа гуляции, высокооборотистой дрели, ультразвукового ас пиратора, эндоскопа. Проблема гидростаза решалась герметизацией основ ной, решетчатой и лобных пазух лоскутами подкожно жировой клетчатки без тягостной для больного тампона ды носовых ходов ватномарлевыми тампонами. Назаль ная ликворея не отмечена ни в одном случае. Все боль ные активизированы со 2х суток после операции. У всех пациентов отмечен регресс зрительных и частично глазод вигательных расстройств. З а к л ю ч е н и е . Применение трансглабеллярного трансэтмоидального доступа при удалении опухолей ги пофиза с инфраселлярным ростом отвечает современ ным требованиям малоинвазивной нейрохирургии, по зволяет достичь тотального или субтотального удаления опухоли, значительно сократить послеоперационный стационарный период, избежать косметических изъя нов. ÕÈÐÓÐÃÈ×ÅÑÊÎÅ ËÅ×ÅÍÈÅ ÃËÈÎÌ ÇÐÈÒÅËÜÍÎÃÎ ÍÅÐÂÀ, ÂÐÀÑÒÀÞÙÅÃÎ Â ÃËÀÇÍÎÅ ßÁËÎÊÎ Áîðèñîâà È. À. Èíñòèòóò íåéðîõèðóðãèè èì. àêàä. À. Ï. Ðîìîäàíîâà ÀÌÍ Óêðàèíû, Êèåâ, Óêðàèíà Глиомы оптических путей включают опухоли, которые могут произрастать в любом отделе оптической системы, начинаясь cразу за глазным яблоком и распространяясь через хиазму, оптический тракт на всем протяжении до латеральных коленчатых тел и до коркового зрительного анализатора. Глиомы зрительных путей встречаются нечасто, состав ляя 35% всех опухолей головного мозга и 7,3% всех опу холей глазницы. Они являются преимущественно добро качественными медленно растущими опухолями (фиб риллярнопротоплазматическими астроцитомами), чаще встречающимися в детском и юношеском возрасте. Сре ди опухолей оптических путей 10% новообразований ло кализуется в пределах самого нерва (его ретробульбарной, интракраниальной либо той и другой части). Наше исследование посвящено редкой разновиднос ти глиом зрительного нерва – глиомам, врастающим в глазное яблоко. Среди 34х наблюдений глиом зритель ного нерва у больных детей в возрасте от 2 до 7 лет, лечив шихся в Институте нейрохирургии им. акад. А. П. Ромо данова за последние 10 лет, у 6 человек отмечалось врас тание глиомы зрительного нерва в глазное яблоко (17,6%). Клинические проявления, а также данные дополни тельных методов обследования (краниография, КТ, МРТ головного мозга и орбит) при глиомах зрительных нервов, врастающих в орбиту, не отличались от таковых при гли омах без врастания в орбиту. 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 83 Íåéðîîíêîëîãèÿ Распространение опухоли в глазное яблоко обычно обнаруживалось во время оперативного вмешательства по поводу глиомы зрительного нерва ретробульбарной лока лизации. В последующем дети направлялись для лечения к офтальмохирургам, которые проводили операцию энук леации глазного яблока с последующим его протезирова нием. В одном наблюдении проведено одномоментное удаление глиомы зрительного нерва с энуклиацией. Гис тологическое исследование проводилось как при нейро хирургическом, так и при офтальмологическом вмеша тельствах. При этих исследованиях установлен идентич ный гистологический диагноз: в 4 случаях астроцитома фибриллярнопротоплазматическая, в 2 – анапластичес кая астроцитома. В послеоперационном периоде проводился КТ, МРТ контроль через 135 лет. Во всех случаях признаков про долженного роста не выявлено. По нашему мнению, наиболее целесообразно не рас членять оперативное вмешательство на два этапа (нейро хирургический и офтальмологический), а выполнять его одномоментно двумя бригадами специалистов, что позво ляет сократить сроки лечения и предупредить возможные осложнения. ÐÅÇÓËÜÒÀÒÛ ËÅ×ÅÍÈß ÁÎËÜÍÛÕ Ñ ÏÅÐÂÈ×ÍÛÌÈ ÃËÈÎÌÀÌÈ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Áóðíèí Ê. Ñ., Óëèòèí À. Þ., ×åñíîêîâà Å. À., Øåâ÷åíêî Å. Í. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã Исследовали результаты лечения первичных глиальных опухолей головного мозга по данным нейрохирургичес ких стационаров СанктПетербурга. Послеоперационная летальность составила 15%. Необ ходимо оговорить, что в специализированных нейрохи рургических учреждениях таковая не превышает 34%, и, таким образом, практически полностью «обеспечивает ся» нейрохирургическими отделениями многопрофиль ных стационаров. Больше половины смертей в структуре нейроонкологической патологии нейрохирургических отделениях города – 54,5% – приходится на больных с нейроэктодермальными опухолями. Среди лиц мужско го и женского пола цифры летальности существенно не отличаются. При выписке из стационара состояние 84,1% больных расценивается как улучшение; 8,7% выписываются с ухуд шением; 7,2% – без перемен. Средняя выживаемость больных глиальными опухоля ми составила 91,8% через год; 77,4% – через два года; 63,5% через три года; 45,6% через четыре года после лечения. Большинство из них (65%) – это больные злокачествен ными видами опухолей (глиобластома, астроцитома с высокой степенью анаплазии). Для них 4х летняя выжи ваемость составила 9,8%. Индекс Карновского при выписке больных с глиаль ными опухолями из стационара был равен 80,7; через 2 года – 78; через 4 года – 75,2. В подавляющем большинстве случаев больные с глио мами – это инвалидизированные люди, вынужденные от казываться от активной трудовой деятельности. В нашем исследовании через 2 года после операции инвалидов 1 группы было 32,7%; 2 группы – 40,7%; 3 группы – 16%. Через 4 года эти цифры составили 47,6%, 33,3%, 9,5% со ответственно. Выживаемость больных глиомами составила через год – 93,4%; через 2 года – 80,4%; через 3 года – 63%; через 4 года – 45,6%. ÎÏÓÕÎËÈ ÑÐÅÄÍÅÃÎ ÌÎÇÃÀ Âåðáîâà Ë. Í., Øàâåðñêèé À. Â. Èíñòèòóò íåéðîõèðóðãèè èì. àêàä. À. Ï. Ðîìîäàíîâà ÀÌÍ Óêðàèíû, Êèåâ, Óêðàèíà Опухоли ствола мозга, по данным различных авторов, составляют от 10% до 20% всех интракраниальных опухо лей. Чаще всего эти опухоли встречаются у детей в возра сте от 6 до 8 лет и охватывают 515% всех опухолей голов ного мозга детского возраста и 1025% всех опухолей зад ней черепной ямы. Глиомы среднего мозга составляют 10% всех опухолей ствола мозга. Лечение указанной группы опухолей является слож ным, а тактика – противоречивой. Затруднения в лече нии первичных опухолей среднего мозга связаны с их глу бинным расположением. Работа посвящена изучению особенностей клиники, диагностики и методов лечения больных с опухолями среднего мозга. М а т е р и а л ы и м е т о д ы . С 1991 по 2001 г. в Инсти туте нейрохирургии им. акд. А. П. Ромоданова находились на лечении 56 больных с первичными опухолями средне го мозга. Из них было 40 детей и 16 взрослых. Одинаково часто болели и женщины, и мужчины. Средний возраст больных в детской популяции составил 11 лет (колеблясь от 1,5месячного возраста до 16летнего), во взрослой по пуляции средний возраст составил 28 лет (от 17 до 28 лет). По локализации все опухоли среднего мозга (56 наблю дений) были разделены на три группы: 1) опухоли пластинки четверохолмия – 45 больных (32 ребенка и 13 взрослых) (80% всех опухолей среднего моз га); 2) опухоли водопровода мозга – 1 больной (1 ребенок); 3) опухоли покрышки – 10 больных (7 детей и 3 взрос лых). Длительность проявления заболевания до поступления в Институт составляла в среднем 6 месяцев. У 90% боль ных в клинической картине заболевания имел место ги пертензионногидроцефальный синдром. Компьютерная томография головного мозга произведена 13 больным, компьютерная томография и магнитнорезонансная то мография головного мозга – 43 больным. Были использованы следующие виды лечения: тоталь ное удаление – 2 больных, субтотальное удаление (оста ток опухоли меньше, чем 5% от исходного объема опухо ли) – 2 больных, частичное удаление опухоли – 3 боль ных, ликворошунтирующая операция – 21 больной, лик ворошунтирующая операция и лучевая терапия – 26 боль ных, динамическое наблюдение – 2 больных. Для удаления опухолей были использованы следующие доступы: субокципитальныйтранстенториальный – 2 больных, надмозжечковыйподтенториальный – 5 боль ных. В 10 наблюдениях была верифицирована гистострук тура опухоли – астроцитома фибриллярнопротоплазма тическая. Причинами смерти у 4 умерших больных оказались: отек ствола мозга – 1 больной и менингоэнцефалит – 3 больных. Катамнез исследований у 26 больных в сроки в сред нем 26 месяцев для больных с опухолями пластинки чет верохолмия (от 6 до 132 месяцев) и 34 месяца для больных с опухолями покрышки (от 6 до 132 месяцев). З а к л ю ч е н и е . Исследование катамнеза у больных с опухолями пластинки четверохолмия выявило медленный темп роста данных новообразований на протяжении ряда лет. Это позволяет выбрать тактику лечения, включающую III ñúåçä íåéðîõèðóðãîâ Ðîññèè 84 Íåéðîîíêîëîãèÿ в себя ликворошунтирующие операции (при наличии ги пертензионногидроцефального синдрома) и динамичес кое наблюдение за больным с использованием магнитно резонансной томографии. В случае выявления прогрессирования процесса целе сообразно проводить хирургическое лечение, направлен ное на удаление опухоли в пределах возможного. У боль ных с опухолями покрышки четверохолмия показано мак симальное удаление опухоли, после чего должен быть про веден курс лучевой терапии. ÊËÈÍÈÊÎ-ÍÅÉÐÎÔÈÇÈÎËÎÃÈ×ÅÑÊÈÅ ÎÑÎÁÅÍÍÎÑÒÈ Ó ÁÎËÜÍÛÕ Ñ ÏÑÈÕÈ×ÅÑÊÈÌÈ ÍÀÐÓØÅÍÈßÌÈ ÏÐÈ ÎÏÓÕÎËßÕ ÁÀÇÀËÜÍÎ-ÄÈÝÍÖÅÔÀËÜÍÎÉ ËÎÊÀËÈÇÀÖÈÈ Â ÄÎ- È ÏÎÑËÅÎÏÅÐÀÖÈÎÍÍÎÌ ÏÅÐÈÎÄÅ Âîðîíèíà È. À., Ãðèíäåëü Î. Ì., Áðàãèíà Í. Í., Êàäàøåâ Á. À., Âîðîíîâ Â. Ã., Ñêîðÿòèíà È. Ã., Ñèäíåâà Þ. Ã. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Проведено до и послеоперационное клиниконейро физиологическое исследование 97 больных с опухолями базальнодиэнцефальной локализации разной гистологи ческой структуры (глиомы III желудочка, интравентри кулярные краниофарингиомы, эндосупраселлярные аде номы гипофиза, менингиомы бугорка турецкого седла, опухоли шишковидной железы, коллоидные кисты) с це лью выявления нейрофизиологических коррелятов имев шим место психическим нарушениям. Больные с разной структурой и степенью выраженности психических и мне стических нарушений были разделены на 3 групы: а) с Корсаковским синдромом; б) с личностным дефектом в виде анозогнозии, эйфории, умеренных мнестических расстройств; в) с легкой фиксационной амнезией. Боль ные были правши. ЭЭГ проводили по стандартной мето дике до операции, в первые и седьмые сутки после нее по специально разработанному комплексу программ для выявления особенностей спектральнокогерентных ха рактеристик, отражающих межцентральные отношения коры, и выявляли локализацию дипольных источников патологической активности. Выявлено, что структура когерентных связей коррели ровала преимущественно с особенностями психических расстройств, а не с наличием гипертензионногидроце фального синдрома или вариантом операционного дос тупа (транскаллезный, субфронтальный). При развернутом Корсаковском синдроме у больных наблюдается полный или почти полный распад межпо лушарных оптимальных когерентных связей в диапазоне основного коркового ритма (преимущественно в лобных областях). Внутриполушарные когерентные связи в пра вом полушарии были значительно повышены в тетадиа пазоне и снижены в альфаритме. У больных с анозогнозией, эйфорией, умеренными расстройствами памяти на фоне снижения оптимального уровня и нарушения пространственного распределения когерентных связей в передних отделах полушарий выяв ляется преимущественное нарушение структуры их в ди апазоне альфаритма в центральнолобных отделах пра вого полушария. У больных с легкими мнестическими расстройствами структура межполушарных когерентных связей в диапа зоне основного коркового ритма в передних отделах со хранена, выявляется лишь небольшое снижение их уров ня, больше в правом полушарии. При супраселлярных менингиомах и аденомах гипо физа выявлялись лишь отдельные компоненты Корсаков ского синдрома: фиксационная амнезия, негрубая дезо риентировка во времени, эмоциональноличностный де фект в виде снижения критики к своему состоянию, бла годушие. Структура межполушарных когерентных связей была нарушена в меньшей степени, чем при полном Кор саковском синдроме. Локализация дипольных источников патологической активности у больных в целом соответствовала проекции диэнцефальных структур, при наличии Корсаковского синдрома выявлялась большая «размытость» источников патологической тетаактивности с преобладанием их ло кализации в правой лобновисочной области. Распад лобных, лобновисочных связей в диапазоне основного коркового ритма, повышение выше оптималь ного уровня когерентных связей в диапазоне тетаритма в сочетании с локализацией источников патологической активности в передних отделах правого полушария, отра жая грубые психические расстройствами, являются, на наш взгляд, прогностически неблагоприятными призна ками развития осложненного течения раннего послеопе рационного периода. Неосложненному послеоперационному течению и рег рессу психопатологической симптоматики соответствует восстановление не только структуры межполушарных и внутриполушарных (несколько хуже в правом полушарии) когерентных связей, но и повышение их среднего уровня до максимально приближенного к исходному. При осложненном течении раннего послеоперацион ного периода с развитием Корсаковского синдрома вы являются описанные выше изменения, соответствующие его спектральнокогерентным характеристикам. ÍÅÊÎÒÎÐÛÅ ÀÑÏÅÊÒÛ ÕÈÐÓÐÃÈ×ÅÑÊÎÃÎ ËÅ×ÅÍÈß ÌÍÎÆÅÑÒÂÅÍÍÛÕ ÎÁÚ¨ÌÍÛÕ ÏÐÎÖÅÑÑΠÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Ãàñàíîâ Ð. Ñ., Ýõòèáàðëû Ñ. À., Àëèåâ Ð. À., Àõìåäîâ Í. Ï. Êóðñ íåéðîõèðóðãèè Ìåäèöèíñêîãî óíèâåðñèòåòà, Áàêó, Àçåðáàéäæàíñêàÿ ðåñïóáëèêà Проблема хирургической помощи больным со множе ственными объемными процессами головного мозга ста ла актуальной по мере накопления материала после вне дрения в медицинскую практику КТ и МРТ. На протяже нии 19852001 гг. в нейрохирургической клинике опери рованы 320 больных со множественными объемными про цессами головного мозга различной этиологии. Объемные образования одновременно локализовались в обоих полушариях (174 наблюдения), на разных «эта жах» одного полушария (95 наблюдений), в одном полу шарии и ЗЧЯ (30 наблюдений) и в обоих полушариях и ЗЧЯ (21 наблюдение). Диагноз верифицировался на операции и гистологи ческом исследовании биопсического материала. По ха рактеру заболеваний больных разделили на 5 групп. Пер вую группу составили 64 больных с хроническими субду ральными гематомами. Во вторую группу вошли больные с множественными абсцессами и эмпиемами (57 наблю дений), в третью – больные с эхинококкозом головного мозга (80 наблюдений), в четвертую – больные с менин готелиоматозом (56 наблюдений), в пятую – больные с метастазами в головной мозг (63 наблюдения). Всем больным проведено комплексное клиническое обследование, в котором ведущую роль играл динамичес кий многократный КТ и МРТ контроль. Общим для всех больных являлось наличие прогредиентной общемозго вой и полиморфноочаговой неврологической симптома тики. В зависимости от нозологической специфичности 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 85 Íåéðîîíêîëîãèÿ заболевания, количества, локализации и величины объем ных процессов, состояния больных производилось два или более хирургических вмешательств в один или не сколько этапов. При этом чаще всего применялись микрохирургичес кие приемы. Повторное оперативное лечение проводи лось после стабильного восстановления жизненно важ ных функций, улучшения общего состояния больных и хотя бы частичного регресса неврологической симптома тики (в сроки от 2 месяцев до 5 лет). Двухсторонние хронические субдуральные гематомы во всех случаях удалялись одномоментно с обеих сторон. Тактика лечения множественных абсцессов и эмпием была более сложной. Наряду с применением костнопла стической трепанации с тотальным удалением абсцессов, использовали методику наложения фрезевых отверстий с многодневным дренированием полостей абсцесса или эмпием с промыванием дезинфицирующими растворами на фоне общей мощной противовоспалительной терапии. Последней методике отдавали приоритет, в том числе у больных с дислокационным синдромом (почти в 2/3 слу чаев). Глубина расположения абсцесса также предопре деляла выбор щадящего метода операции. У больных третьей группы создавали оптимальные ус ловия для удаления эхинококковых кист неповрежденны ми. Этого практически всегда удавалось достичь путем при менения методики гидродинамической препаровки. Пер вым этапом удаляли наиболее крупную кисту. Повторные вмешательства всегда проводились не ранее чем через 4 недели, после повторного КТ или МРТ обследований. В четвертой группе больных с множественными менин геомами критериями первоочередности обладали опухоли критической величины, а также вызывающие вазогенный или цитостатический полилобарный отек мозга, а также об разования небольшого размера, но тампонирующие комму тирующие пути ликворооттока с синдромом вентрикуломе галии, а также блокирующие основные магистральные вены. При прочих равных условиях в первую очередь удаляли опу холь, чье удаление могло быть сопряжено. В пятой группе больных с множественным метастати ческим поражением мозга «работали» те же критерии от бора, что и при менингеомах. Однако в ряде случаев не больших метастазов, при которых вышеуказанные вто ричные признаки объемного процесса были невыражен ными, в первую очередь удаляли узел, достигший разме ров, достаточных для его обнаружения во время операции (т. е. выбор осуществлялся от обратного). ÈÍÒÐÀÎÏÅÐÀÖÈÎÍÍÀß ÈÄÅÍÒÈÔÈÊÀÖÈß È ÌÎÍÈÒÎÐÈÍà ÑÎÑÒÎßÍÈß ÄÂÈÃÀÒÅËÜÍÛÕ ÑÒÐÓÊÒÓÐ ÑÒÂÎËÀ ÌÎÇÃÀ Ãèìðàíîâ Ð. Ô., Ùåêóòüåâ Ã. À., Êîíîâàëîâ À. Í., Ïèöõåëàóðè Ä. È., Êóðäþêîâà Å. Í., Õóõëàåâà Å. À. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Проведение операций на стволе мозга сопряжено с высоким риском послеоперационной инвалидизации из за наличия большого количества компактно расположен ных сенсорных, двигательных, вегетативных структур в его пределах. Предложенные подходы к опухолям ствола моз га через безопасные зоны на основании топографоана томических данных часто не являются реально безопас ными вследствие дислокации стволовых структур. Значи тельную помощь в определении безопасного доступа к но вообразованию ствола может оказать физиологическая идентификация двигательных нервов и их ядер в преде лах ствола мозга. Такое физиологическое картирование осуществляется путем прямой электрической стимуляции области четверохолмия, дна IV желудочка, продолговатого мозга с помощью электродазонда и регистрации двига тельных реакций больного визуально, механографичес ки или электромиографически. Основной задачей данной работы явилось определение ценности метода идентификации двигательных структур области четверохолмия, дна IV желудочка и продолгова того мозга с помощью электростимуляции для поиска зоны, через которую возможен наименее травматичный подход к объемному новообразованию. Больные с объемными процессами в области ствола мозга были в возрасте от 2 до 69 лет. Из 105 больных у 32 объемные процессы были выше моста, у 53 на уровне мо ста и у 20 ниже уровня моста. Диагноз был поставлен на основании данных МРТ и КТ. Во время операции прово дили регистрацию спонтанной ЭМГ и Мответов при ЭС для оценки состояния двигательных структур ствола моз га. У больных с объемными процессами, располагавши мися выше моста, мониторировали функцию III, V, VI, VII пар ЧМН. При объемных процессах на уровне моста оценивали состояние V, VI, VII, XI пар ЧМН. А при объем ных процессах ниже моста мониторировали функцию VII, IX, XI, XII пар ЧМН. Игольчатые электроды располагали на мышцах иннервируемых ЧМН: III – m. inferior rectus; V – m. masseter; VI – m. lateral rectus; VII – m. orbicularis oris; IX – m. velum palatinum; XI – m. trapezius, XII – m. lingualis. Мониторинг состояния двигательных структур ствола мозга проводили на 8канальном нейроусредни теле фирмы Nicolet «VikingIVP». При регистрации ЭМГ и Мответов частотная полоса усилителя была 303000 Гц. Эпоха анализа при регистрации спонтанной ЭМГ состав ляла 5 сек, а Мответов 20 мс в реальном режиме времени. Электростимуляцию проводили биполярным коаксиаль ным электродом с длительностью импульсов 0,1 мс. Только у 3 больных с опухолями, располагающимися выше моста мозга, удалось получить Мответы при элек трической стимуляции двигательного ядра III нерва с обе их сторон. Сила тока в среднем была 8,7 мА. Мответы при электрической стимуляции двигательных ядер V и VII пары ЧМН у этой группы больных удалось получить с обеих сторон при средней силе тока 4,3 мА. Мответы при стимуляции двигательного ядра VI нерва получить не уда лось. Озвучивание ЭМГсигнала позволило нейрохирур гу слышать ответы в виде низкочастотного щелчка раз личной громкости, в зависимости от его амплитуды, и благодаря этому существенно быстрее определять место расположения искомой структуры. У всех 53 больных с опухолями, располагающимися на уровне моста мозга, Мответы при стимуляции двигатель ного ядра VII нерва удалось получить с обеих сторон. Сила тока в среднем была 4,6 мА. При раздельной регистрации двигательных функций правой и левой стороны в наблю дениях с очагами, расположенными близко к средней ли нии, определение структур слева и справа не представля ло трудностей, однако такая идентификация требовала времени на более тщательное зондирование поверхности и подбор интенсивности стимула. Регистрация Мотве тов при электрической стимуляции двигательных ядер V пары ЧМН у этой группы больных также не вызывала сложности. Мответы при стимуляции двигательного ядра VI пары ЧМН получить не удалось. Идентификация и мониторинг состояния двигатель ных структур при локализации опухоли на уровне ниже моста мозга не вызывала особых трудностей. Из 20 боль ных у 18 Мответы удалось получить с обеих сторон при стимуляции ядер IX, XII пар ЧМН. Сила тока в среднем III ñúåçä íåéðîõèðóðãîâ Ðîññèè 86 Íåéðîîíêîëîãèÿ была 6,5 мА. Получение Мответов при стимуляции дви гательных ядер VII пары ЧМН также не вызывало слож ностей. У 9 удалось получить Мответы при стимуляции двигательных ядер XI пары ЧМН. Идентификация и мониторинг состояния двигательных структур ствола мозга позволяет нейрохирургу определять наиболее безопасный подход к опухоли и контролировать свои манипуляции, что позволяет уменьшить вероятность послеоперационных неврологических осложнений. ÈÍÒÅÐÑÒÈÖÈÀËÜÍÀß ÕÈÌÈÎÒÅÐÀÏÈß ÇËÎÊÀ×ÅÑÒÂÅÍÍÛÕ ÃËÈÎÌ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ ÏÎÑÐÅÄÑÒÂÎÌ ÐÅÇÅÐÂÓÀÐÀ OMMAYA Ãëàâàöêèé À. ß., Õìåëüíèöêèé Ã. Ñ., Ëûñåíêî Ñ. Í. Èíñòèòóò íåéðîõèðóðãèè èì. àêàä. À. Ï. Ðîìîäàíîâà ÀÌÍ Óêðàèíû, Êèåâ, Óêðàèíà В настоящее время общепринятой является тактика комбинированного лечения злокачественных глиом, в состав которого обязательно входит и антибластическая химиотерапия. Системное введение химиопрепаратов связано с рядом проблемных вопросов: а) системная хи миотерапия, как правило, проводится значительными дозами препаратов, вызывающими выраженное общеток сическое воздействие на весь организм; б) значительное количество препарата инактивируется ферментативными системами крови и печени; в) наличие, хотя и деформи рованного, гематоэнцефалического барьера (опухолевое воздействие, операция) затрудняет проникновение хими опрепаратов в опухолевую ткань. В связи с этим, на наш взгляд, является перспективным метод интерстициальной (местной) химиотерапии, кото рый позволяет получить оптимальную концентрацию хи миопрепарата в опухолевой ткани при введении существен но меньших доз, что приводит к снижению его токсичес кого действия на весь организм. При таком пути введения заданное количество химиопрепарата воздействует непос редственно на опухолевую ткань и перифокальную зону, почти не инактивируясь ферментативными системами кро ви и печени. Местное воздействие антибластических аген тов на активно пролиферирующую опухолевую ткань, ко торая находится среди мозговых структур с низкой проли ферирующей активностью, значительно снижает вероят ность повреждения окружающих тканей мозгового веще ства в процессе лечения злокачественных глиом. В работе представлен опыт применения интерстици альной химиотерапии, базирующейся на введении хими опрепарата в ложе удаленной опухоли посредством резер вуара Ommaya. Интраоперационная имплантация резер вуара Ommaya, кроме того, позволяет в послеоперацион ном периоде проводить динамический иммуномонито ринг ликвора и/или кистозной жидкости в ложе удален ной опухоли (при проведении химиотерапии, лучевой те рапии и других адъювантных методов лечения), а также следить за возможностью развития септических осложне ний со своевременным проведением местной антибиоти котерапии. При формировании в области удаленной опу холи больших ликворных или опухолевых кист появляет ся возможность проводить их асептическую аспирацию через резервуар, что позволяет в ряде наблюдений суще ственно продлить клиническую ремиссию. Местная химиотерапия через имплантируемый во вре мя операции резервуар Ommaya произведена 63 больным. Общее состояние пациентов в дооперационном периоде оценено в среднем в 65 баллов по шкале Карновского (от 60 до 75 баллов). Во время операций в 38 (60,3%) наблюде ниях опухоли удалялись по перифокальной зоне, в 16 (25,4%) проведено субтотальное удаление новообразова ний, в 9 (14,3%) частичное. Патоморфологические иссле дования выявили у 3 (4,8%) больных относительно добро качественные глиомы (III степени анаплазии), у 8 (12,7%) анапластические глиомы (III степени анаплазии) и в 52 (82,5%) глиобластомы (IV степени анаплазии). Всем паци ентам первый курс местной химиотерапии проводился в остром послеоперационном периоде: на 812 день после оперативного вмешательства. Индекс Карновского у боль ных перед химиотерапией составил в среднем 67 баллов (от 65 до 75 баллов). Местно вводили в режиме монохимиоте рапии: препараты платины; цисплатина вводилась 7 боль ным, новый украинский антибластический препарат «нук леоплат» 29 пациентам. Интерстициальная полихимиоте рапия проведена 27 больным: нуклеоплат+адриамицин (4 наблюдения), нуклеоплат+фторафур (16 наблюдений); 7 больным проведен курс циклической местной химиотера пии: 1 курс цисплатины и 2 курса нуклеоплата. Нуклеоплат – антибластический препарат, в котором платина конъюгирована на молекулах ДНК. Активно про лиферирующие опухолевые клетки включают в свой ме таболизм этот конъюгированный комплекс, который и оказывает антибластический эффект. Препараты цисплатины местно назначались курсовой дозой от 2,9 мг/м2 до 14,7 мг/м2, нуклеоплат – от 2,5 мг/м2 до 15,0 мг/м2, адриамицин – от 0,51 мг/м2 до 0,88 мг/м2, фторафур – от 0,5 мг/м2 до 0,9 мг/м2. В среднем каждый больной получил по 3 курса интерстициальной химиоте рапии (от 1 до 5) с интервалом в 48 недель. При местном применении цисплатины у 15,2% боль ных наблюдался выраженный интоксикационный синд ром, который сопровождался отеком мозгового вещества. У 39,5% пациентов наблюдались умеренные проявления интоксикационного синдрома. У части больных (15,2%) отмечено повышение температуры до 37,338,3°C после местного введения цисплатины на 214 день, которая со временем самостоятельно нормализовалась. Мы наблю дали кумулятивный эффект токсического воздействия интерстициальной химиотерапии цисплатиной: после 3 4 курсов лечения интоксикационный синдром наблюдал ся в 63,2% наблюдений, выраженная интоксикация – в 34,6%, что говорит о нецелесообразности проведения бо лее 2 курсов местной химиотерапии цисплатиной. Местная моно и полихимиотерапия с использовани ем нуклеоплата не вызывала существенных осложнений; лишь у одной больной после первого курса лечения на блюдалось повышение температуры тела до 37,7°C, а во время второго курса – аллергическая реакция на препа рат (сыпь на коже, зуд), в связи с чем лечение было при остановлено. У другого больного после 4 курса лечения нуклеоплатом наблюдались явления умеренной интокси кации (тошнота, рвота), которые легко купировались. Предварительные исследования показали клиничес кий эффект представленного метода химиотерапии, что обосновывает дальнейший поиск более перспективных для местного введения антибластических препаратов. ÒÐÀÍÑÑÔÅÍÎÈÄÀËÜÍÎÅ ÓÄÀËÅÍÈÅ ÎÏÓÕÎËÅÉ ÃÈÏÎÔÈÇÀ Ãîáååâ Â. Õ., Ðîãîæêèí Ñ. Á., Ðåõàëîâ À. Ô., Ïîëþøêîâ À. Þ., Àâäîíèíà Þ. Ä., Ìåäÿíèê È. À., Õîìåíîê Â. Â. Îáëàñòíàÿ êëèíè÷åñêàÿ áîëüíèöà èì. Í. À. Ñåìàøêî, Íèæíèé Íîâãîðîä С ноября 1998 года в нейрохирургическом отделении внедрен транссфеноидальный подход к опухолям гипо физа. За этот период выполнено 56 операций. По харак 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 87 Íåéðîîíêîëîãèÿ теру опухолей больные распределились следующим обра зом: 15 соматотропином, в 3 случаях – синдром пустого турецкого седла, в 3 – полипоз основной пазухи, 35 про лактином. По размерам опухоли распределились: 17 микроаденом размерами до 8 мм, 9 эндоселярные аденомы размерами до 20 мм, 23 аденомы с супраселлярным ростом размера ми до 5060 мм. 7 больных с параселлярным ростом были 2 этапом оперированы транскраниально. Все операции выполнялись с использованием операционного микро скопа с этапа рассечения слизистой перегородки носа. Летальных исходов не было. В 4 случаях отмечалась лик ворея, которая ликвидировалась через 3 дня после уста новки люмбального дренажа. В одном случае после опе рации развился менингит. В среднем больные находились в стационаре 7 дней (от 3 до 9 дней) ÍÅÉÐÎÖÈÒÎÌÛ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ, ÐÅÇÓËÜÒÀÒÛ ËÅ×ÅÍÈß Ãîëàíîâ À. Â., Êîíîâàëîâ À. Í., Êîðøóíîâ À. Ã., Ïðîíèí È. Í., Ìàðÿøåâ Ñ. À. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Нейроцитомы – это нейроэктодермальные опухоли с признаками как глиальной, так и нейрональной диффе ренцировки, располагающиеся, как правило, в области прозрачной перегородки, встречающиеся у молодых па циентов и характеризующиеся благоприятным прогно зом. Это достаточно редко встречающиеся опухоли цент ральной нервной системы, которые, тем не менее, состав ляют около половины всех интравентрикулярных опухо лей у взрослых. Несмотря на то, что к настоящему време ни в мировой литературе описано около 300 наблюдений, вопросы диагностики, хирургического лечения, целесо образности назначения лучевой и химиотерапии после операции остаются во многом не решенными. С 1992 по август 2001 года в Институте нейрохирургии РАМН прооперированы 66 пациентов с центральной ней роцитомой головного мозга. Возраст больных колебался от 15 до 58 лет, средний возраст составил 27 лет. Мужчин и женщин было равное количество, по 33. Длительность анамнеза от 2 месяцев до нескольких лет, при средних сро ках развития симптомов заболевания – 7 месяцев. Веду щими в клинической картине в 90% (60 пациентов) были гипертензионногидроцефальный синдром, пирамидный синдром у 21 пациента (30%), синдром поражения глазод вигательных нервов у 15 пациентов (21. 5%), пароксиз мальная симптоматика у 12 пациентов (17%). Нейроци томы располагались в основном в просвете боковых же лудочков мозга, с тенденцией к локализации в области прозрачной перегородки, в 88% случаев с инфильтраци ей эпендимы боковых желудочков или прорастанием в мозговое вещество. На КТ центральные нейроцитомы были представлены ограниченными опухолями смешан ной (гетерогенной) плотности, часто содержащие единич ные и множественные петрификаты и кисты. При МРТ в режиме Т1 в 66% случаев (43 наблюдения) интенсивность сигнала от опухоли близка к получаемой от коры голов ного мозга. При контрастировании (по данным КТ и МРТ) чаще отмечалось накопление средней интенсивно сти, что было отмечено в нашей серии в 78,5% случаев. У 17 больных была выполнена селективная церебральная ангиография. В 9 наблюдениях имелись данные за сосу дистую сеть. Кровоснабжение осуществлялось из пере дней хориодальной артерии, латеральной и медиальной лентикулостриальных артерий. При выраженной сосуди стой в двух случаях дополнительно кровоснабжение осу ществлялось из передних талямоперфорирующих артерий и задней хориоидальной артерии. У 65 больных было произведено удаление опухоли, в одном наблюдении – стереотаксическая биопсия для ве рификации гистологического диагноза. При удалении опухолей в 56% случаев использовался передний межпо лушарный транскаллезный доступ, реже, в 30% случаев, был применен транскортикальный в премоторной обла сти. 13 пациентов прошли курс лучевой терапии после удаления опухоли. Гистологическая картина была сход ной с олигодендроглиомами и эпендимомами. Верифи цировать нейроцитомы возможно лишь с помощью элек тронной микроскопии и/или иммуногистохимического метода, который позволяет выявить признаки нейрональ ной дифференцировки. Для иммунофенотипа нейроци том головного мозга высокоспецифична иммунореактив ность нейроспецифической энолазы (НСЭ), синаптофи зина и нейрофиламентов. У 10 пациентов были выявле ны митозы, некрозы и пролиферация эндотелия. Р е з у л ь т а т ы х и р у р г и ч е с к о г о л е ч е н и я . По данным МРТ, после операции тотальное удаление было у 7 пациентов (12%), субтотальное удаление – у 37 паци ентов (65%), частичное удаление – у 13 пациентов (23%). Удаление опухоли сопровождалось значительным рис ком осложнений и высокой летальностью – 11,6%, что связано с интенсивным кровоснабжением, наличием ве нозных каверн в структуре опухоли, инфильтрацией моз гового вещества на значительном протяжении. У 13 па циентов (20%) были произведены ревизии операцион ной раны и удалены гематомы из ложа удаленной опухо ли. У 49 пациентов удалось получить катамнестические данные в сроки от 6 месяцев до 14 лет. За этот период времени у шести больных отмечен продолженный рост опухоли в сроки от 1 года до 3 лет. Два пациента проопе рированы повторно, одна больная прошла курс лучевой терапии в связи с продолженным ростом, три оставлены под наблюдением изза отсутствия нарастания очаговой симптоматики. Пятилетняя выживаемость составила 85% – это доброкачественные образования с благопри ятным прогнозом. Несмотря на встречающиеся призна ки злокачественности, центральные нейроцитомы – это медленно растущие доброкачественные опухоли с низ ким пролиферативным потенциалом, методом выбора лечения которых является их радикальное хирургичес кое удаление. Проведение лучевой терапии можно реко мендовать при продолженном росте после повторного удаление опухоли. ÐÅÇÓËÜÒÀÒÛ ÊÎÌÁÈÍÈÐÎÂÀÍÍÎÃÎ ËÅ×ÅÍÈß ÃËÈÎÁËÀÑÒÎÌ ÁÎËÜØÈÕ ÏÎËÓØÀÐÈÉ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Ãîëàíîâ À. Â., Êîðøóíîâ À. Ã. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Среди первичных опухолей головного мозга наиболее распространенными являются глиобластомы, которые составляют до 15% от всех интракраниальных новообра зований, с частотой возникновения до трех новых случа ев на 100 000 населения ежегодно. Это наиболее злокаче ственная нейроэктодермальная опухоль со средней про должительностью жизни после комбинированного лече ния около 50 недель. В настоящем исследовании проанализированы резуль таты лечения трехсот взрослых пациентов Института ней рохирургии с первичными глиобластомами больших по лушарий головного мозга, которые были разделены на две группы: получившие комбинированное лечение в 1993 III ñúåçä íåéðîõèðóðãîâ Ðîññèè 88 Íåéðîîíêîëîãèÿ 96 гг. и в 19972000 гг. Стандартное комбинированное ле чение больных включало радикальное удаление опухоли с последующим курсом лучевой терапии с суммарной оча говой дозой до 60 Грей. Приблизительно у половины боль ных была также проведена химиотерапии препаратами нитрозомочевины в основном в режимах «PCV» или «PNV», которая назначалась после первой или чаще по вторной операции в связи с продолженным ростом опу холи. Для уточнения степени радикальности проведенных операций использовалась компьютерная и/или магнит норезонансная томография с контрастным усилением. Помимо рутинных гистологических методов, при изуче нии биоптатов выполнялось иммуногистохимическое исследование с различными маркерами. В настоящем исследовании средняя продолжитель ность жизни больных составила 14 месяцев. Годичная, 2 летняя и 5летняя выживаемость составили соответствен но 51, 16 и 7%. Согласно полученным данным, считаю щаяся в настоящее время оптимальной лечебная тактика при глиобластомах (радикальное удаление опухоли с пос ледующим курсом лучевой и химиотерапии) не приносит ощутимого улучшения результатов, поскольку сравнение показателей средней продолжительности жизни в двух группах больных, получивших комбинированное лечение в 199396 гг. и 19972000 гг., выявило их абсолютную иден тичность. Установлено, что клинические факторы имеют го раздо меньшее влияние на прогноз при глиобластомах по сравнению с некоторыми гистологическими и иммуногистохимическими характеристиками опухоли. Так, низкие показатели апоптозного индекса в опухо ли и наличие экспрессии эпидермального фактора ро ста статистически достоверно сокращают показатели продолжительности жизни у больных с глиобластома ми. Из клинических факторов наибольшее значение для прогноза имеют лишь «тотальное» удаление опухоли и повторная операция. При этом максимально радикаль ные операции не сопровождаются более высокими по казателями осложнений и летальности. Возраст, ис пользование химиотерапии, состояние больного на момент операции, площадь поражения и глубина рас пространения не оказывают существенного влияния на прогноз. В результате исследования четко установлено, что глиобластомы – это гетерогенная группа опухолей, включающая три гистобиологических варианта: изо морфноклеточный, полиморфноклеточный и гемисто цитарный. Эти варианты имеют четкие клинические, цитологические и молекулярнобиологические отли чия, что проявляется в разных сроках продолжительно сти жизни: соответственно 9, 15 и 20 месяцев. На осно вании полученных данных разработан дифференциро ванный подход к назначению химиотерапии препара тами нитрозомочевины для различных типов глиобла стом: у больных с изоморфноклеточной глиобластомой – химиотерапия целесообразна при «тотальном» удале нии опухоли, при полиморфноклеточном типе – она показана во всех случаях, в том числе при частичном удалении опухоли, а при гемистоцитарной форме на значение химиотерапии лишь ухудшает прогноз. Со гласно проведенному исследованию, наиболее перспек тивными из новых методов лечения следует признать разработку различных методов фармакологической сти муляции апоптоза в опухоли наряду с реконструктив ной генной терапией, а также методов целенаправлен ного блокирующего воздействием на рецепторы эпи дермального фактора роста с помощью векторных ан тител с различными цитотоксическими лигандами. ÈÍÒÐÀÎÏÅÐÀÖÈÎÍÍÛÅ ÊÐÎÂÎÒÅ×ÅÍÈß Â ÝÍÄÎÑÊÎÏÈ×ÅÑÊÎÉ ÒÐÀÍÑÑÔÅÍÎÈÄÀËÜÍÎÉ ÕÈÐÓÐÃÈÈ ÀÄÅÍÎÌ ÃÈÏÎÔÈÇÀ Ãîôìàí Â. Ð., ×åðåáèëëî Â. Þ., Ïîëåæàåâ À. Â. Êàôåäðû ËÎÐ è íåéðîõèðóðãèè ÂÌåäÀ, Ñàíêò-Ïåòåðáóðã Стремление к тотальному селективному удалению аде номы и снижению частоты интраоперационных повреж дений содержимого кавернозных синусов, зрительных нервов и диафрагмы турецкого седла обусловило исполь зование эндоскопической техники. Результаты вмешательств свидетельствуют о таких ос новных преимуществах методики, как возможность па норамного обзора полости клиновидной пазухи и турец кого седла, четкой дифференциации опухолевой и нор мальной ткани гипофиза, ранней диагностики и устране ния ликвореи, верификации источника кровотечения. Параселлярный рост достаточно часто встречается при больших и гигантских аденомах гипофиза различной ги стоструктуры. Особенно часто боковое распространение опухоли наблюдается при эозинофильных СТГпродуци рующих аденомах гипофиза, причем в этой ситуации опу холь, зачастую не успевая вырасти за пределы турецкого седла, уже имеет параселлярный рост. Все исследователи сходятся во мнении, что приблизи тельно в половине наблюдений параселлярное распрост ранение сопровождается инвазией кавернозных синусов. Стремление к тотальности при удалении аденом гипофи за подвигает хирурга на необходимость манипулировать на параселлярных отделах. При этом вероятность интра операционного кровотечения из кавернозного синуса чрезвычайно высока. Использующиеся традиционные средства остановки кровотечения в глубоком и узком операционном канале зачастую не позволяют легко купировать его, иногда ос тановка кровотечения происходит только тогда, когда прогрессируют витальные нарушения. Нами использовался капрофер для остановки интрао перационного кровотечения. Аппликация турунды с кап рофером на источник геморрагии на 23 минуты доста точно для того, чтобы купировать кровотечение из сину са. Использованный способ чрезвычайно прост в приме нении, быстр в использовании и не обладает побочными эффектами, что позволяет его рекомендовать для широ кого применения. Применяемый эндоскопический ви деомониторинг дает возможность легко верифицировать источник геморрагии, проследить за адекватностью и пол ноценностью гемостаза. Использование капрофера более чем в 100 наблюдениях позволяет сформулировать вывод о безопасности и высокой эффективности данного пре парата. ÃÈÑÒÎËÎÃÈ×ÅÑÊÈÅ È ÕÈÐÓÐÃÈ×ÅÑÊÈÅ ÊÎÐÐÅËßÖÈÈ ÏÐÈ ÌÅÍÈÍÃÈÎÒÅËÈÀËÜÍÛÕ ÎÏÓÕÎËßÕ Ãðèãîðüåâ Ä. Ã., Õàìàøòà Õ. Ñ., Øàíüêî Þ. Ã., Áåççóáèê Ñ. Ä. ÍÈÈ íåâðîëîãèè, íåéðîõèðóðãèè è ôèçèîòåðàïèè ÌÇ ÐÁ, Ãîñóäàðñòâåííûé ìåäèöèíñêèé óíèâåðñèòåò, Ìèíñê, Áåëàðóñü К менинготелиальным опухолям относятся разнооб разные формы менингиом – новообразований централь ной нервной системы (ЦНС), происходящих из менин готелиальных (арахноидальных) клеток. Эти опухоли встречаются преимущественно у взрослых, составляя при мерно 1319% всех онкологических заболеваний ЦНС. Чаще они растут экспансивно, однако в ряде случаев как 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 89 Íåéðîîíêîëîãèÿ доброкачественных, так и злокачественных форм могут инвазировать окружающие ткани, что определяет как сте пень травматичности хирургического вмешательства, так и степень функциональных нарушений в послеопераци онном периоде. Согласно «Гистологической классификации опухолей ЦНС» (ВОЗ, 1993), выделяют 14 форм менингиом, раз личающихся по своему строению. Однако основное кли никохирургическое значение имеют такие свойства этих новообразований, как инвазивность роста, степень малиг низации и способность к метастазированию. В связи с э тим все менингиомы можно разделить на три группы: 1) Типичные, или доброкачественные менингиомы (I ст. злокачественности), составляющие абсолютное боль шинство этих опухолей (менинготелиальная, фиброзная, переходная, псаммоматозная, ангиоматозная, микроки стозная, секреторная, светлоклеточная, хордоидная, лим фоплазмоцитарная и метапластическая). 2) Атипичная и папиллярная менингиомы (IIIII ст. злокачественности), которые биологически более агрес сивны, растут инвазивно и метастазируют. 3) Анапластическая (малигнизированная) менингио ма (III ст. злокачественности), обладающая выраженны ми признаками злокачественности, и менингиальный саркоматоз (IV ст. злокачественности). Нами изучено 100 случаев безвыборочной серии ме нинготелиальных опухолей, оперированных за период 19992001 гг. В исследованной группе было 23 мужчины и 77 женщин в возрасте от 21 до 80 лет (преимущественно 4150 лет – 36 случаев). Опухоли имели супратенториаль ную локализацию в 92 случаях и субтенториальную – в 8, всегда в виде плотного и четко отграниченного узла в твер дой мозговой оболочке. При этом сферическая форма новообразования имела место в 74 случаях, а т. н. плоская – в 26. Согласно полученным гистологическим данным, в структуре менингиом ведущее положение заняли типич ные (доброкачественные) менингиомы (83%) – переход ная (32 случая), менинготелиальная (22), фиброзная (20) и псаммоматозная (9). Кроме этого, выявлено 2 случая атипичной менингиомы и 15 редких форм менинготели альных опухолей (15%): ангиоматозная (6 случаев), свет локлеточная (2), микрокистозная (1), секреторная (3), метапластическая (2), а также 1 случай необычной фор мы менингиомы, не описанный ранее в литературе. Пос ледняя, условно обозначенная как «смешанноклеточная менингиома», сочетала в себе признаки мениготелиома тозной, светлоклеточной, ангиоматозной, микрокистоз ной и хордоидной менингиом. Наиболее важные в хирургическом отношении харак теристики менингиом (форма опухолевого узла, степень инвазивности) имели некоторую зависимость и связь с их гистологическими особенностями. Отмечено, что наибо лее агрессивной в отношении роста является менинготе лиальная менингиома, которая наиболее часто инвазирует в мягкую и паутинную оболочки и ткань мозга, более ин тимно бывает сращена с прилежащими сосудами. Степень инвазивности типичных, или доброкачественных менин гиом напрямую зависит от длительности заболевания. Современные возможности МРТдиагностики позволя ют достаточно отчетливо установить наличие инвазивно го роста новообразования, хотя и не дают основания пред положить заранее его гистологическую природу. Мы полагаем, что расширение спектра нозологических форм менингиом приводит к неоправданной путанице, а разнообразный гистологический вид следует рассматри вать в рамках одной опухоли – менингиомы. Для разре шения этого вопроса требуются дальнейшие сравнитель ные клиникоморфологические исследования. В то же время определение прогноза заболевания должно бази роваться не только на учете используемых в настоящее время гистологических признаков степени злокачествен ности, а учитывать характер роста опухоли и ее локализа цию. ÐÅÇÓËÜÒÀÒÛ ÒÐÀÍÑÌÀÊÑÈËËßÐÍÎÃÎ ÒÐÀÍÑÍÀÇÀËÜÍÎÃÎ ÓÄÀËÅÍÈß ÎÏÓÕÎËÅÉ ÎÑÍÎÂÀÍÈß ×ÅÐÅÏÀ Ãðèãîðÿí Þ. À., Êàäèí Ë. À. Ãîñóäàðñòâåííûé ìåäèöèíñêèé öåíòð ÌÇ ÐÔ, Ôåäåðàëüíûé öåíòð íåéðîõèðóðãèè áîëè Ãîñóäàðñòâåííîãî ìåäèöèíñêîãî öåíòðà ÌÇ ÐÔ, Ìîñêâà Обобщен первоначальный опыт использования трансмаксиллярного трансназального доступа к опухо лям основания черепа. В течение 19942000 гг. опериро вано 19 пациентов (из них 10 женщин и 9 мужчин в воз расте от 15 до 57 лет), которым проведено 21 вмешатель ство. Локализация опухолей, их взаимоотношение с при лежащими отделами лицевого скелета и интракраниаль ными структурами оценивались путем рентгеновской и магнитнорезонансной томографии. Наиболее частые клинические симптомы в анализируемой группе паци ентов возникали в результате опухолевой обтурации но совых ходов с различным по характеру отделяемым (10 случаев), перекрытия евстахиевой трубы с дисфункцией среднего уха (9 случаев), прорастания новообразований в глазницу, вдоль ската и в область кавернозного синуса с соответствующими неврологическими выпадениями (16 случаев). Хирургическое вмешательство проводилось верх ним сублабиальным разрезом с резекцией передней стенки гайморовой полости. Формировалась единая назомаксиллярная полость путем удаления латераль ной стенки грушевидного отверстия, верхних носовых раковин, парциальной резекции и смещения перего родки носа. На данном этапе оперативного подхода возможно удаление новообразований из придаточных пазух, носовых ходов и глазницы, а также верхних и средних отделов ската. Удаление задней стенки гаймо ровой пазухи обеспечивало подход к крылонебной ямке, а область кавернозного синуса становилась дос тупной посредством резекции передней и латеральной стенок основной пазухи. Оперативный подход проводился со стороны преиму щественного расположения опухоли. В 11 случаях трансмаксиллярный трансназальный доступ осуществлен справа, в 8 – слева и в 2 – с обеих сторон. Радикальность удаления новообразований оценива лась с помощью КТ и МРТ в раннем послеоперационном периоде. Тотальное удаление произведено в 8, субтоталь ное – в 11 и частичное в 2 наблюдениях. По гистологи ческой структуре опухоли были представлены различны ми формами рака в 9 случаях, хордомами – в 2, полипами – в 2, менингиомами в 2, папилломой, неврилеммомой, ангиофибромой и гранулематозным воспалением в ос тальных 4 наблюдениях. Летальный исход наблюдался в 1 случае вследствие послеоперационной тромбоэмболии легочной артерии. Наружное люмбальное дренирование было произведено в 2 случаях для устранения послеоперационной назаль ной ликвореи. Анализ неврологических симптомов в ближайшем пос леоперационном периоде выявил уменьшение или исчез III ñúåçä íåéðîõèðóðãîâ Ðîññèè 90 Íåéðîîíêîëîãèÿ новение экзофтальма во всех наблюдениях. Парез отво дящего нерва полностью регрессировал в 2 из 5 случаях. В 12 случаях отмечалось полное исчезновение или значи тельное снижение интенсивности лицевого болевого син дрома. Во всех наблюдениях выявлено уменьшение чув ствительных расстройств. Регресса зрительных наруше ний и мидриаза вследствие поражения глазодвигательного нерва не отмечалось. В 9 наблюдениях регрессировал бо левой синдром в области уха, связанный с нарушением дренажной функции евстахиевой трубы. Пациентам со злокачественными новообразованиями проводилась лучевая и/или химиотерапия. Летальный исход в отдаленном периоде отмечен в 5 наблюдениях вследствие генерализации опухолевого процесса. Повторные хирургические вмешательства проведены 2 пациентам с продолженным ростом хордомы и хондро саркомы основания черепа. Представленная хирургическая методика наиболее эффективна для удаления экстрадуральных новообразо ваний основания черепа и может быть использована как один из этапов комплексного хирургического лечения комбинированных экстраинтракраниальных новообра зований. ÊËÈÍÈ×ÅÑÊÈÉ ÑËÓ×ÀÉ ÀÒÈÏÈ×ÍÎÉ ÒÅÐÀÒÎÈÄ-ÐÀÁÄÎÈÄÍÎÉ ÎÏÓÕÎËÈ IV ÆÅËÓÄÎ×ÊÀ Ãðèíåâ È. Ï., Íèñèÿìà Ê., Ìîðè Õ., Òàíàêà Ð. Êàôåäðà íåéðîõèðóðãèè Ãîñóäàðñòâåííîé ìåäèöèíñêîé àêàäåìèè, Êðàñíîÿðñê, Ðîññèÿ; Êàôåäðà íåéðîõèðóðãèè Èíñòèòóòà èññëåäîâàíèé ìîçãà, Óíèâåðñèòåò Íèèãàòà, ßïîíèÿ Атипичная тератоидрабдоидная опухоль (АТ/РО) цен тральной нервной системы – крайне злокачественное но вообразование у детей в возрасте до 2х лет. Мы представ ляем опыт лечения случая этой опухоли с помощью хи рургического вмешательства, химиотерапии и лучевой терапии. О п и с а н и е с л у ч а я . Пациент (9 месяцев, мальчик), проживающий в России, был госпитализирован в боль ницу по месту жительства. У матери во время беременно сти выявлены антитела цитомегаловируса. При госпита лизации: вялость, заторможенность, частая рвота. МРТ: разнородное образование различной интенсивности до 3 х сантиметров в диаметре без признаков гидроцефалии или дессеминации. В дальнейшем пациент был переве ден в больницу при Университете г. Ниигата для хирур гического лечения. Опухоль прорастала в продолговатый мозг. Нами была выполнена субтотальная резекция. Гис тологический диагноз – атипичная тератоидрабдоидная опухоль (АТ/РО). Затем был проведен курс химиотерапии (carboplatin и etoposide). Последующая МРТ выявила ос трое возобновление роста оставшейся части опухоли и пациент получил курс лучевой терапии (46 Гр). Рост опу холи был остановлен, и пациент вернулся в Россию. Од нако через несколько месяцев мы получили сообщение от его родителей, что быстрый рост опухоли возобновил ся и состояние ребенка ухудшилось. О б с у ж д е н и е . АТ/РО IV желудочка часто ошибочно диагностируется как медуллобластома, но воздействие стандартной терапии на АТ/РО совершенно отличается и прогноз чаще всего неудовлетворителен. Некоторые ав торы отмечают, что химиотерапия высокими дозами эф фективна даже для АТ/РО. Мы провели курс лучевой те рапии и эффект был временный. Химиотерапия высоки ми дозами препаратов в различных сочетаниях, возмож но, один из вариантов лечения АТ/РО. ÒÀÊÒÈÊÀ ÕÈÐÓÐÃÈ×ÅÑÊÎÃÎ ËÅ×ÅÍÈß ÌÍÎÆÅÑÒÂÅÍÍÛÕ ÈÍÒÐÀÊÐÀÍÈÀËÜÍÛÕ ÌÅÍÈÍÃÈÎÌ Ãóëÿåâ Ä. À., Ìàñëîâà Ë. Í., Óëèòèí À. Þ., Òàñòàíáåêîâ Ì. Ì. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã В настоящее время под множественными менингио мами подразумевают несколько (две и более) отдельно расположенных опухоли, не имеющие явной связи меж ду собой. Данные новообразования могут быть выявлены одновременно при нейрорадиологическом исследовании или во время операции либо появляться позднее вне зоны первичного опухолевого роста. Частота встречаемости множественных менингиом колеблется, по данным ряда авторов, от 0,9 до 16%. В группе больных с центральной формой нейрофиброматоза более чем у половины диаг ностируются менингиомы, причем у 1230% из них мно жественные. Распределение по полу, как и в случае со спо радическими менингиомами, указывает на преобладание данных опухолей у женщин. В РНХИ им. проф. А. Л. Поленова в период с 1984 по 2001 г. на обследовании и лечении находилось 54 боль ных с множественными интракраниальными менингио мами. Это составило 3% от общего количества пациентов с одиночными опухолями данной гистологической струк туры. В 70% наблюдений диагноз был установлен до опе рации, в остальных случаях во время хирургического вме шательства. Средний возраст больных составил 53±3 года (от 17 до 74 лет). Было 12 мужчин и 42 женщины. Соотно шение мужчин к женщинам составило 1:3,5. Все больные были оперированы. Нами разработана дифференциро ванная тактика хирургического лечения такого рода па циентов. Соглашаясь с мнением большинства авторов по принципиальным стратегическим подходам к лечению данной группы больных, мы детализировали некоторые тактические аспекты. Так, в группе наблюдений с нейро фиброматозом 2 типа принята активно выжидательная тактика лечения ввиду того, что причиной социальной дезадаптации является проградиентный рост неврином боковых цистерн моста. Этапное хирургическое вмеша тельство, предпринимаемое в случае с первичномноже ственными недифференцируемыми менингиомами, по зволяет даже у тяжелых, соматически отягощенных боль ных пожилого возраста добиться высокого уровня соци альной адаптации в послеоперационном периоде. В та ких случаях встает вопрос: «Какой опухолевый узел уда лят в первую очередь?» Такая проблема выступала на пер вый план при сочетании супратенториальной и субтен ториальной менингиомы. В данной ситуации на основа нии анализа клинической картины заболевания выявля ли симптомпродуцирующий опухолевый узел, определя ющий ведущий клинический симптомокомплекс. Как правило, по данным дополнительных методов исследо вания, это была большая по размеру опухоль, вызываю щая смещение желудочковой системы, компрессию ба зальных цистерн и дислокацию стволовых структур голов ного мозга. Общеизвестны опасности наружной декомпрессии, несоответствующей локализации опухоли, особенно при расположении новообразования в задней черепной ямке. Такие действия могут быть фатальны для больного. При прочих равных условиях купирование височнотентори ального вклинения технически проще – наружное дре нирование желудочков мозга по Арендту. В случае же с мозжечковотенториальным вклинением такая процеду ра не только не принесет успеха, но и грозит усугублени 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 91 Íåéðîîíêîëîãèÿ ем дислокации. Исходя из вышеизложенных теоретичес ких предпосылок, при данном сочетании новообразова ний первым этапом удаляли опухоль из задней черепной ямки, что позволяло снизить уровень внутричерепной ги пертензии и устранить возможную причину орального вклинения. Ни в одном из наших наблюдений в после операционном периоде не возникло экстренных, угрожа ющих жизни состояний. У части пациентов с неотягощен ным соматическим статусом и локализацией опухолей в одном полушарии применение широких костнопласти ческих трепанаций позволило провести одноэтапное ра дикальное хирургическое вмешательство с минимальным повреждением мозга. Использование изложенных выше тактических подхо дов к лечению больных множественными интракраниаль ными менингиомами позволило добиться улучшения со стояния больных в 95,9% наблюдений. ÕÈÐÓÐÃÈß ÌÅÍÈÍÃÈÎÌ ÂÅÐØÈÍÛ ÏÈÐÀÌÈÄÛ ÂÈÑÎ×ÍÎÉ ÊÎÑÒÈ Ãóëÿåâ Ä. À., Òèãëèåâ Ã. Ñ, Ìàñëîâà Ë. Í., Ùåðáèíèí À. Â. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã Большую часть опухолей мостомозжечкового угла со ставляют акустические невриномы; однако от 10 до 15% новообразований этой локализации – менингиомы. Рас сматривая эти новообразования как доброкачественные, мы подразумеваем не только возможность, но и целесо образность их радикального удаления. Однако до 1970 года в литературе описано лишь 10 выживших после операции из 26 больных – лишь у одного опухоль была удалена пол ностью. Применение микрохирургической техники в со вокупности с новыми системами анестезиологического обеспечения позволили в последние десятилетия актив но вмешиваться на ранее, казалось, неоперабельных но вообразованиях. Однако послеоперационная летальность в настоящее время все еще значима и составляет, по дан ным ряда авторов, от 2 до 8%. Из 160 наблюдений больных менингиомами ЗЧЯ, лечив шихся в РНХИ им. проф. А. Л. Поленова с 1974 по 2001 г., опухоль имела исходный рост из твердой мозговой оболоч ки в области верхушки пирамиды височной кости в 45,6% (73 больных) случаев, причем более половины (58,9%) из них имели преимущественный рост в боковую циcтерну моста мозга, а в 41,1% случаев менингиома имела и супратентори альный рост. Клиническая картина заболевания была пред ставлена прежде всего поражением черепных нервов на сто роне опухоли, статической или динамической атаксией, го ловной болью, пирамидной симптоматикой. Выраженность клинических проявлений и, как следствие, уровень соци альной адаптации, больше зависели от размеров новообра зования, а не от ее локализации. В плане дооперационной диагностики следует отметить, что только комплексное об следование пациента с использованием всего спектра совре менного оборудования позволяло правильно спланировать хирургическое вмешательство, исходя из предполагаемой ги стоструктуры и локализации опухоли. 55 женщинам и 18 мужчинам было произведено частичное (47 больных) или тотальное (26) удаление опухоли. Использовались следую щие доступы: односторонний субокципитальный, транспи рамидный супратранстенториальный, ретросигмовидный и различные комбинации супра и субтенториальных досту пов. Вне зависимости от доступа старались на ранних эта пах операции провести декомпрессию ствола путем рассе чения свободного края намета мозжечка при распростране нии опухоли за границу последнего. Троим больным были проведены ликворошунтирующие операции. Хирургичес кие вмешательства проводили с применением микрохирур гической техники, а в последнее время и жесткого эндоско па. Действия хирурга в непосредственной близости от ство ла головного мозга контролировались электрофизиологом на основании анализа ЭЭГ и ВП. Основными критериями оценки нарушений СВПМС служили: отсутствие одного либо нескольких компонентов СВПМС, изменение времен ных параметров (абсолютная латентность ЛП и межпико вая латентность МПИ). Учитывали также изменения амп литуды и характера рисунка СВПМС. Как известно, одной из основных проблем в хирургии опухолей боковой цистерны моста является идентифика ция и сохранение функции черепных нервов. Эта задача решалась путем интраоперационной, часто транскапсуляр ной «дозированной» электростимуляции. Послеопераци онная летальность за период с 1974 по 1997 г. составила 9%, за последние три года летальных исходов не отмечено. При чиной летальных исходов послужили вторичные ишеми ческие нарушения в стволе головного мозга. Ухудшение состояния в послеоперационном периоде было обуслов лено как нарастанием стволовой симптоматики, так и по явлением поражения черепных нервов. Средний балл по шкале Карновского при выписке составил 60. На основании проведенного исследования следует от метить, что хирургия менингиом боковой цистерны мос та в настоящее время далека от совершенства. Основной причиной неудовлетворительных результатов является дисфункция ствола головного мозга и поражение в той или иной степени черепных нервов. Объем таких поврежде ний является единственным существенным фактором в определении результатов лечения. Совершенствование микрохирургической техники, применение современных методов нейровизуализации, интраоперационный мони торинг функции ствола головного мозга и черепных не рвов – факторы, способствующие, на наш взгляд, сниже нию послеоперационной летальности и повышению уров ня социальной адаптации больных менингиомами боко вой цистерны моста. ÏÎÑËÅÎÏÅÐÀÖÈÎÍÍÛÅ ÃÍÎÉÍÎ-ÈÍÔÅÊÖÈÎÍÍÛÅ ÎÑËÎÆÍÅÍÈß È ÍÀÇÀËÜÍÀß ËÈÊÂÎÐÅß Ó ÁÎËÜÍÛÕ Ñ ÎÏÓÕÎËßÌÈ ÎÑÍÎÂÀÍÈß ×ÅÐÅÏÀ Ãóëÿåâà Î. À., ×åðåêàåâ Â. À., Áåëîâ À. È., Ãëàçìàí Ë. Þ. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Применение базальных доступов изменило структуру осложнений у больных с опухолями основания черепа. Если раньше на первом плане стояли осложнения, свя занные с непосредственным воздействием на мозг (трак ция, компрессия и т. д.), то при базальных доступах, свя занных с открытием околоносовых пазух или сосцевид ного отростка, значительно увеличивается риск ликвореи и гнойновоспалительных осложнений. Цель настоящей работы – анализ современного состоя ния проблемы послеоперационных гнойноинфекционных осложнений у больных с опухолями основания черепа. Все возможные послеоперационные осложнения хи рургии основания черепа, по данным разных авторов, мо гут быть разделены на несколько категорий: 1) по харак теру осложнений: неврологические, сосудистые, инфек ционные; 2) по срокам: на ранние – менее 14 дней и по здние – более 14 дней; 3) по распространенности: локаль ные и системные. III ñúåçä íåéðîõèðóðãîâ Ðîññèè 92 Íåéðîîíêîëîãèÿ По некоторым данным, частота послеоперационных осложнений у больных со злокачественными краниофа циальными опухолями может достигать 50,5%. Наиболее часто встречаются хирургические осложнения – ликво рея (11,2%), менингит (4,8%), расхождение швов (15%), асистемные – пневмония (6,5%), заболевания сердечно сосудистой системы (4,7%), нарушение гомеостаза (3,7%). Самым частым хирургическим осложнением у больных с опухолями основания черепа, распространяющимися в глазницу и околоносовые пазухи, является назальная лик ворея. Среди всех осложнений транссфеноидальной хирургии ликворея составила 3,9% с 1,5% развившимися менинги тами (Ivan Ciric). По данным литературы у больных с кра ниофациальными опухолями с вовлечением в процесс основания черепа, оперированных с применением пере дней краниофациальной резекции, все послеоперацион ные осложнения встречались в 48,6%. Важным фактором, связанным с появлением осложнений, являлись грани цы краниофациальной резекции. Инвазия твердой моз говой оболочки и тип реконструкции основания черепа были наиболее существенными причинами появления ликвореи и менингита (Dias FL). Применение специаль ных низких базальных доступов (транспирамидных, ор битозигоматических и др.) позволяет уменьшить риск ос ложнений и повысить радикальность операции (Черека ев В. А.). Ликвореи в практике после операции встречаются не скольких видов: из основной или лобной пазухи, из ев стахиевой трубы, «раневая» ликворея. В большинстве слу чаев истечение ликвора проявляется в ближайшее время после операции. Близость базальных цистерн к зоне вме шательства, широкое открытие параназальных синусов во время хирургической резекции предрасполагает к появ лению ликвореи. Проводимая предоперационная лучевая терапия этой зоны намного повышает риск появления ликвореи после операции. В этом случае использование хорошо васкуляризированной ткани для первичной пла стики дефекта весьма актуально. Это может быть надкос тничный или надкостничноапоневротический лоскут височной мышцы на ножке. Установка люмбального дренажа перед операцией по зволяет в большинстве случаев справиться в послеопера ционном периоде с невыраженной ликвореей. В таком случае количество дренируемой жидкости регулируется до 3050 мл каждые 8 часов, для того чтобы избежать пнев моцефалии. Продолжительность такого дренирования может составлять 45 дней. Постоянная ликворея или большое количество вытекаемого ликвора является пока занием к хирургическому вмешательству. Ликворея из основной пазухи, так же как и ликворея из дефекта пере дней черепной ямки, может быть остановлена после биф ронтальной краниотомии с широким открытием площад ки основной кости и тампонированием лобной либо ос новной пазухи лоскутом фасции или жиром с использо ванием фибринтромбинового клея, с укрытием сверху большим лоскутом надкостницы. Даже если нет очевид ной интраоперационной ликвореи, использование кусоч ка жира с гемостатической марлей (Surgicel) во время опе рации для закрытия стенок турецкого седла помогает пре дотвратить возможное истечение ликвора в послеопера ционном периоде (Laligam N. Sekhar, Ivan Ciric). Неадекватное закрытие дефекта основания черепа мо жет привести в дальнейшем к ликворее, присоединению инфекции и неблагоприятному исходу (Bachert С). Про должительные и повторные операции повышают риск инфицирования. ÊËÈÍÈ×ÅÑÊÀß ÊÀÐÒÈÍÀ È ×ÀÑÒÎÒÀ ÑÈÍÄÐÎÌÀ ÀÑÅÏÒÈ×ÅÑÊÎÃÎ ÌÅÍÈÍÃÈÒÀ Ó ÁÎËÜÍÛÕ Ñ ÎÏÓÕÎËßÌÈ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ  ÐÀÍÍÅÌ ÏÎÑËÅÎÏÅÐÀÖÈÎÍÍÎÌ ÏÅÐÈÎÄÅ Äàíèëîâ Â. È., Íåìèðîâñêèé À. Ì., Öèáóëüêèíà Â. Í. Ãîñóäàðñòâåííûé ìåäèöèíñêèé óíèâåðñèòåò, Êàçàíü, Òàòàðñòàí Синдром асептического менингита – неинфекционное воспаление оболочек мозга, встречающееся преимуще ственно после операций на головном мозге у больных с различной нейрохирургической патологией (опухоли, травматические поражения, пороки развития). Этот тер мин в литературу ввел H. Cushing в 1931 году. Клиническая картина асептического менингита имеет сходство с таковой при гнойном менингите, однако ле чебная тактика при гнойном и асептическом менингите существенно отличается. Проблема асептического менин гита в современной литературе обсуждается редко. По данным доступной литературы для синдрома асеп тического менингита характерны повышение температу ры, плеоцитоз при исследовании цереброспинальной жидкости (ЦСЖ) и отсутствие признаков роста микробов при бактериологическом исследовании ЦСЖ. Обычно клиническая картина развивается остро на 3 5 сутки после операции. Температура поднимается (до 38 40°), в течение суток она меняется незначительно, сни жается по мере уменьшения выраженности воспалитель ного процесса. Появляются признаки менингеального синдрома: положительные оболочечные знаки, головная боль; сальность кожных покровов лица. При этом опера ционная рана не имеет воспалительных изменений. В общем анализе крови наблюдается лейкоцитоз без выраженного сдвига, высокая СОЭ. ЦСЖ имеет цвет от желтого до коричневого, при микроскопии выявляется плеоцитоз до тысячи, причем цитоз преимущественно лимфоцитарный, повышено содержание белка. Результа ты посева ЦСЖ с целью выявления бактериальной куль туры отрицательные. Эффект от антибактериальной терапии не выражен. Клиническая картина, изменения крови и ЦСЖ отчетли во регрессируют от терапии стероидами. Течение обычно не менее 23 недель после операции. Возможно самопроизвольное излечение. Прогноз благо приятен. Проанализированы истории болезней 1508 больных с опухолями головного мозга различной локализации и ги стологической структуры, находившихся на стационар ном лечении и прооперированных в нейрохирургических отделениях республиканской и детской республиканской клинической больницах Министерства здравоохранения Республики Татарстан, за период в 20 лет. Синдром асептического менингита наблюдался в 4,93% случаев среди всех пациентов с опухолями головного мозга после удаления опухоли. Наиболее часто он встречался при внутримозговых глиальных опухолях. Среди опухолей у больных с синдромом асептическо го менингита чаще всего встречались астроцитомы. Их доля среди всех опухолей составила 35,21%; фибрилляр ная астроцитома – 60%, протоплазматическая – 15%, анапластическая – 25%. У больных с олигодендроглио мами синдром асептического менингита встречался с ча стотой 5,63%, с глиобластомами – 12,67%, с менингио мами – 11,26%, с гемангиобластомами – 1,4%, с неври номами VII нерва – 8,45%, с хориоидпапилломами боко вого желудочка – 1,4%, с медуллобластомами – 1,4%, с эпендимомами – 4,23%, с аденомами гипофиза – 1,4%, с 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 93 Íåéðîîíêîëîãèÿ краниофарингиомами – 5,63%, с метастазами перифери ческого рака – 1,4%, с меланомами – 1,4%. Среди боль ных с глиомами кистозные составляли 28,17%. Мужчины среди больных с синдромом асептического менингита после удаления опухолей головного мозга со ставляли 70,42%, женщины – 29,58%. В возрасте от 1 до 10 лет синдром асептического менин гита наблюдался с частотой 12,68%, от 10 до 20 лет – 16,9%, в возрастной группе 2030 лет – 12,68%, 3040 лет – 18,31%, 4050 лет – 15,49%, 5060 лет – 19,72%, 6070 лет – 1,4%. У больных старше 70 лет данное осложнение не наблюдалось. Учитывая высокую частоту синдрома асептического менингита у больных с опухолями головного мозга в ран нем послеоперационном периоде представляется актуаль ным изучение изменений иммунной системы у пациен тов с церебральными новообразованиями в до и после операционном периодах, что позволит оптимизировать патогенетическую терапию. ÀÍÀËÈÇ ÁÓËÜÁÀÐÍÛÕ ÎÑËÎÆÍÅÍÈÉ Ó ÁÎËÜÍÛÕ Ñ ÎÏÓÕÎËßÌÈ ÎÑÍÎÂÀÍÈß ÇÀÄÍÅÉ ×ÅÐÅÏÍÎÉ ßÌÊÈ (ÄÀÍÍÛÅ ÐÀÍÄÎÌÈÇÈÐÎÂÀÍÍÎÃÎ ÈÑÑËÅÄÎÂÀÍÈß) Äåäåãêàåâ À. Â., Àì÷åñëàâñêèé Â. Ã., Øåëåñêî À. À. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Хирургическое лечение опухолей основания задней черепной ямки (ЗЧЯ) занимает одно из ведущих мест в проблеме удаления опухолей головного мозга и в частно сти основания черепа. Сложность топографических вза имоотношений анатомических структур этой области, а также их крайне важная функциональная значимость предполагает изначально повышенный риск хирургичес кого вмешательства в этой области. Несмотря на исполь зование микрохирургической техники, применение но вых доступов к основанию ЗЧЯ, осложнения, связанные с угрозой повреждения стволовых отделов мозга изза близкого расположения к ним новообразований не исчез ли полностью. Весьма актуальным на сегодняшний день остается раз витие послеоперационных специфических (бульбарных) осложнений. Так, по данным ряда авторов (Olivесгопа; Revilla; Pool и Pava) частота нарушений функций каудаль ной группы черепномозговых нервов при удалении опу холей ЗЧЯ составляет от 45% до 23%. Определение степени повреждения IXXII пар нервов в раннем послеоперационном периоде и их возможная коррекция является перспективным направлением. Дан ная задача является актуальной, поскольку послеопера ционное ведение больных с клиническими симптомами дисфункции каудальной группы черепномозговых не рвов, длительное время нуждающихся в дыхании через трахеостому, в зондовом питании, сопряжено с интенсив ным длительным наблюдением и уходом за данным кон тингентом больных, послеоперационное течение которых нередко осложняется аспирационной пневмонией, раз витием трахеопищеводного свища и т. д. Мы провели анализ развития нарушений функций ка удальной группы нервов у больных. оперированных с мая по декабрь 2001 г. (преимущественно оценивалась функ ция глогания). Больных с опухолями основания ЗЧЯ было прооперированно 80. Из них с менингиомами – 21,25% (17), невриномами V нерва – 3,75% (3), невриномами VIII нерва – 50% (40), невриномами яремного отверстия – 5% (4), холестеатомами – 2,5% (2), хордомами – 13,75% (11), хондросаркомами – 1,25% (1), остеобластомами – 1,25% (1), невриномами краниовертебрального перехода – 1,25% (1). В ближайшем послеоперационном периоде бульбарный синдром (БС) развился у 25% больных (20), причем у 85% (17) расстройства отмечались до операции и носили ком пенсированный характер. В дальнейшем динамика боль ных с БС была следующей: у 35% (7) отмечался регресс дис функции каудальной группы ЧМН; у 40% (8) дисфункция сохранялась и носила компенсированный характер; у 25% (5) отмечено нарастание БС. Следует отметить, что среди пациентов с менингиомами ЗЧЯ (30% – 6) ни у одного не отмечалась положительная динамика. Ухудшение же сре ди этой группы отмечено в 50% (3). У больных с неврино мами (40,5% – 9) регресс БС наблюдался в 66,7% (6); от сутствие динамики в 11,1% (1); ухудшение в 22,2% (2). Таким образом, основываясь на представленном ма териале, можно сказать, что у пациентов с менингио мами основания ЗЧЯ риск развития БС, а также деком пенсация функции каудальной группы выше, чем у па циентов с опухолями другой природы, что требует по вышенной «хирургической» настороженности во вре мя операции. Наиболее частыми причинами развития БС в послеопе рационном периоде являются: сегментарные очаговые поражения ствола мозга как следствие гемодинамических расстройств; отек ствола мозга и мозжечка; травма кореш ков IX, X, XII пар нервов и каудальных отделов ствола; компрессия ствола сформировавшейся гематомой. На сегодняшний день разработан комплекс мероприятий по интенсивной терапии и реанимации развившихся буль барных осложнений. В то же время решение задач, направ ленных на коррекцию одних из самых основных «этио патогенетических» факторов развития данных осложне ний, в часгности непосредственное восстановление фун кционирования поврежденной группы каудальных не рвов, до сих пор не освещены и не разработаны. Обоснование возможных методов предупреждения и коррекции послеоперационных бульбарных осложнений у больных с опухолями основания задней черепной ямки позволит повысить радикальность оперативного удаления опухолей данной локализации, снизить частоту осложне ний в позднем послеоперационном периоде, ускорить социальную адаптацию данной группы больных. Ê ÂÎÏÐÎÑÓ ÕÈÐÓÐÃÈ×ÅÑÊÎÃÎ ËÅ×ÅÍÈß ÊÐÀÍÈÎÑÏÈÍÀËÜÍÛÕ ÎÏÓÕÎËÅÉ Äæóìàíîâ Ê. È., Ñàáóðåíêî Þ. Ô., Õàëèêóëîâ Ý., Èøìóõàìåäîâ Ñ. Í., Ñàèäîâ Ê. Ðåñïóáëèêàíñêèé íàó÷íûé öåíòð íåéðîõèðóðãèè, Êàôåäðà íåéðîõèðóðãèè, ÂÏÕ ÒàøÃîñÌÈ-1, Òàøêåíò, Óçáåêèñòàí Краниоспинальные опухоли до настоящего времени являются актуальной проблемой в нейрохирургии. Это обусловлено сложностью анатомического строения кра ниовертебральной области, разнообразием клинических проявлений, высокой летальностью больных с опухоля ми краниоспинальной области. Но с внедрением в пос леднее время современной диагностической техники, в частности компьютерной томографии (КТ) и ядерноман гитнорезонансной (ЯМР) томографии, облегчило рас познавание этой патологии и стала значительно улучшать ся техника оперативных вмешательств. Произведен ана лиз данных комплексного обследования и результатов хи рургического лечения у 18 больных, находившихся в Рес публиканском Научном Центре Нейрохирургии в пери од 19982001 гг. III ñúåçä íåéðîõèðóðãîâ Ðîññèè 94 Íåéðîîíêîëîãèÿ Хирургически удалены краниоспинальные опухоли у 13 больных, у 5 больных оперативное лечение не произ ведено по социальным и техническим причинам. Всем больным произведен комплекс нейрохирургичес ких исследований (включая КТ и ЯМР). При выборе так тики хирургического лечения учитывалась длительность заболевания, степень неврологических нарушений. Из оперированных 13 больных гистологическая структура опухолей распределялась следующим образом: у 9 боль ных обнаружены менингеомы, в 2х случаях глиобласто ма, в одном случае невринома, в одном случае обнаруже ны атипичные клетки с признаками малигнизации. Расположение опухолей относительно спинного моз га распределилось следующим образом: у 9 больных опу холь располагалась экстрамедуллярно, в 3 случаях интра медуллярное расположение опухоли и в 1 случае интра и экстрамедуллярное расположение. Тотальное удаление опухоли произведено в 6 случаях, субтотальное удаление в 6 случаях и в 1 случае произведе на пункция опухоли со взятием биопсии в связи с боль шим размером опухоли. В послеоперационном периоде улучшение неврологи ческой картины отмечалось у 6 больных без какойлибо динамики у 1 больного и у 3 больных углубление невро логического дефицита, в 3 случаях больные умерли в пос леоперационном периоде. Выраженность неврологического дефицита и тяжесть общего состояния играет существенную роль в послеопе рационном восстановлении нарушенных функций. Нами отмечено более быстрое восстановление утрачен ных функций у больных с минимальным неврологичес ким дефицитом и, напротив, ухудшение состояния и уг лубление неврологической картины у больных с длитель ным анамнезом заболевания и глубокими неврологичес кими нарушениями. Таким образом, эффективность оперативного лечения зависит от длительности заболевания, глубины невроло гических нарушений, локализации опухоли и сроков опе ративного вмешательства. ÒÀÊÒÈÊÀ ÕÈÐÓÐÃÈ×ÅÑÊÎÃÎ ËÅ×ÅÍÈß ÎÏÓÕÎËÅÉ ÒÐÅÒÜÅÃÎ ÆÅËÓÄÎ×ÊÀ Äîëæåíêî Ä. À., Ëåòÿãèí Ã. Â., Àóë Ø. À., Öèáèðîâ À. À. Êðàåâàÿ êëèíè÷åñêàÿ áîëüíèöà, Áàðíàóë Одним из наиболее сложных и до конца не решенных вопросов является лечение опухолей III желудочка. Опу холи, локализуясь на пути оттока цереброспинальной жидкости, полностью или частично заполняют полость желудочка, окклюзируя межжелудочковые отверстия или сильвиев водопровод. Радикальность при удалении кра ниофарингиом достигается редко и тогда приходится идти на их частичное удаление. Часть хирургов после установ ления диагноза ограничивается проведением ликворо шунтирующих операций. При коллоидных кистах используется как прямое вме шательство, направленное на радикальное удаление, так и стереотаксическая пункция с опорожнением их содер жимого. Классическое их удаление (транскаллезный, трансвентрикулярный доступ) травматично. Более щадя щим является стереотаксический доступ. Однако аспира ция содержимого кисты при неудаленной секретобразу ющей капсуле приводит к высокой частоте рецидивов, и пациенты в дальнейшем нуждаются в открытой операции. С развитием нейроэндоскопической техники появи лась возможность при минимальной травматизации про извести аспирацию содержимого кисты с фенестрацией дна III желудочка, что также в дальнейшем приводит к рецидиву заболевания. В литературе описаны лишь еди ничные случаи тотального удаления коллоидных кист III желудочка эндоскопическим методом. Ряд ученых выс казывает прямо противоположное суждение, считая, что современные эндоскопические инструменты не позволя ют тотально удалить коллоидную кисту. Исходя из выше изложенного, следует, что на сегодняшний день нет еди ной концепции лечения опухолей III желудочка. Каждый метод имеет как положительные, так и отрицательные сто роны. Цель исследования – изучение возможностей исполь зования эндовидеотехники при опухолях III желудочка. Все опухоли (12) в зависимости от локализации были раз делены на 3 группы: коллоидные кисты (3) – передние от делы, краниофарингиомы (5) – заполняли, как правило, всю полость желудочка, пинеаломы, герминомы (4) – про растали дно, заднюю стенку, ствол мозга. У всех пациен тов отмечалась окклюзионная гидроцефалия IIIII степе ни. При коллоидных кистах создавался микрохирургичес кий трансвентрикулярный доступ справа. Кора мозга рас секалась на протяжении 23 см. Вещество мозга раздви гали шпателями, фиксированными пружинными ретрак торами. Дальнейшие манипуляции осуществлялись мик роинструментами, погружаемыми поосно с диагностичес ким эндоскопом под видеоконтролем. После вскрытия капсулы кисты удаляли аспиратором ее содержимое. Ди агностический эндоскоп менялся на манипуляционный, вводимый через отверстие Монро в III желудочек, что позволяло рассмотреть сосуды, идущие к капсуле. Кап сула осторожно смещалась, сосуды коагулировались и пе ресекались. Эндовидеоконтроль делает возможным про извести мобилизацию и удаление капсулы, не повредив недоступные прямому обзору сосуды противоположной стороны. При краниофарингиомах осуществлялся аналогичный доступ. При осмотре медиальной стенки обнаруживали увеличенное в размерах межжелудочковое отверстие и опухоль, закупоривающую его. При необходимости отвер стие Монро расширялось. После чего микроинструмен тами, погружаемыми поосно эндоскопу, контролируя все движения по экрану монитора, проводилось интракапсу лярное удаление опухолевой ткани. В случаях, когда кап сула была интимно связана с веществом мозга, приходи лось ограничиться ее частичным удалением. При росте опухоли из дна и задних отделов III желу дочка без четких границ с веществом мозга производились чисто эндоскопические операции, преследующие две цели: устранить окклюзию ликворных путей путем пер форации дна III желудочка и произвести взятие биопсий ного материала. Перфорацию дна осуществляли в преде лах так называемой премамиллярной мембраны тупым зондом по средней линии в промежутке между верхуш кой основной артерии и выбухающей спинкой турецкого седла с обязательной ревизией межножковой цистерны. Убедившись в свободном поступлении ликвора из желу дочка в базальные цистерны, производили забор биопсий ного материала. З а к л ю ч е н и е . На сегодняшний день имеющиеся ди агностические возможности позволяют заранее сплани ровать оперативное вмешательство. Так, при опухолях пе редних отделов III желудочка возможно их тотальное уда ление микрохирургическим доступом в сочетании с ра ботой диагностического, а затем манипуляционного эн доскопов. При опухолях выполняющих большую часть 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 95 Íåéðîîíêîëîãèÿ или весь желудочек, достичь радикализма практически невозможно. В этой ситуации эндовидеоконтроль позво ляет, насколько можно, более щадяще удалить ее боль шую часть. При опухолях, задних отделов и дна III желу дочка, не имеющих четких границ и бесперспективных в оперативном плане, надо производить чисто эндоскопи ческое вмешательство, направленное на восстановление ликворооттока со взятием биопсийного материала. ÕÈÐÓÐÃÈ×ÅÑÊÎÅ ËÅ×ÅÍÈÅ ÎÏÓÕÎËÅÉ ÏÎÇÂÎÍÎ×ÍÈÊÀ Äóëàåâ À. Ê., Îðëîâ Â. Ï., Íàäóëè÷ Ê. À. Âîåííî-ìåäèöèíñêàÿ àêàäåìèÿ, Ñàíêò-Ïåòåðáóðã Авторы располагают опытом хирургического лечения 56 больных (29 мужчин и 27 женщин) с опухолями позво ночника в период с 1991 по 1999 г. Средний возраст боль ных составил 36,2±3,5 года. По нозологическим формам пациенты распределились следующим образом: метаста тические поражения тел позвонков – 38 человек (67,9%), гемангиомы – 4 человека (7,1%), поражение позвоночно го столба при миеломной болезни – 8 человек (14,3%), хондрома – 3 человека (5,3%), гигантоклеточная опухоль – 3 человека (5,3%). Опухолевые поражения позвонков наиболее часто встречались в грудном и поясничном от делах 16 (28,6%) и 28 (50,0%) соответственно, реже были диагностированы опухоли шейного отдела позвоночни ка – 12 пациентов или 21,4%. Основными показаниями к оперативному вмешательству явились: 1) наличие и про грессирование неврологических расстройств; 2) патоло гические переломы тел позвонков с синдромом неста бильности позвоночника; 3) установленный в ходе дина мического наблюдения быстрый рост опухоли с высоким риском развития неврологических расстройств или пато логического перелома. Все операции проводились с уче том принципов онкологической хирургии. Больным были выполнены следующие вмешательства: резекции тел по звонков с удалением опухоли в пределах здоровых тканей с передним спондилодезом аутотрансплантатом (37, или 66,1%), в сочетании с передней декомпрессией спинного мозга и его корешков (33, или 48,9%), ламинэктомия (9, или 16,1%). Внутреннюю коррекцию и стабилизацию по звоночника металлическими имплантатами использова ли во всех наблюдениях, как в сочетании с декомпресси ей нервнососудистых образований позвоночного кана ла и костнопластической реконструкцией опорных структур позвоночника (46, или 82,2%), так и в чистом виде (10, или 17,8%). Стабилизацию позвоночного стол ба осуществляли использованием дистракторов – 13 (23,2%), сочетанием дистрактора и контрактора – 27 (48,2%), транспедикулярными фиксаторами фирмы Sofamor Danek – 14 (25,0%), в 12 (21,4%) наблюдениях были использованы нательные пластины типа Zplate. У 8 пациентов с доброкачественными опухолями по звоночника достигнуты хорошие анатомические и функ циональные результаты и отсутствие рецидива опухоле вого роста на протяжении всего срока наблюдений (от 2 до 7 лет). У оставшихся 2 пациентов с доброкачественны ми опухолями тел позвонков (1 пациент с хондромой и 1 с гигантоклеточной опухолью) в сроки от 1 года до 3 лет возникли рецидивы опухоли, потребовавшие проведения повторных вмешательств. У 82% пациентов с наличием неврологического дефицита после выполнения операции был достигнут существенный регресс неврологической симптоматики. У других 18% спинальных больных изза необратимых изменений со стороны спинного мозга не врологический дефицит сохранился, однако стабилиза ция позвоночного столба значительно облегчила уход за ними. У 33 из 38 больных с метастатическими поражени ями позвоночника декомпрессивностабилизирующие и стабилизирующие вмешательства на позвоночнике в со четании с рациональной химио и лучевой терапией по зволили значительно улучшить качество жизни. Анализ полученных результатов показывает, что актив ная хирургическая тактика лечения больных с опухолями позвоночника, направленная на радикальное удаление опухоли (доброкачественные новообразования), деком прессию спинного мозга и его корешков, реконструкцию опорных структур, коррекцию и стабилизацию позвоноч ного столба позволяет добиться хороших анатомических и функциональных результатов, а в случаях злокачествен ного процесса значительно улучшить качество жизни па циентов. ÊÎÌÏËÅÊÑÍÎÅ ËÅ×ÅÍÈÅ ÎÏÓÕÎËÅÉ IV ÆÅËÓÄÎ×ÊÀ Åâäîêèìîâ Ñ. À., Ãóëÿåâ Ä. À., Ôàäååâà Ò. Í. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã Первичные и вторичные опухоли IV желудочка у взрос лых составляют 68% всех новообразований центральной нервной системы (1618% всех опухолей субтенториаль ной локализации). Особенности клинических проявлений опухолей IV желудочка, тактика комплексного их лечения, существен но зависят от исходного места и направления роста опу холей в полости IV желудочка, а также структурнобио логических свойств новообразования. За период 19992001 гг. в отделении хирургии опухо лей головного и спинного мозга пролечено 16 больных с первичными (10 больных) и вторичными (6 больных) опу холями IV желудочка. К первичным опухолям отнесены новообразования, растущие из эпендимы, субэпендимарного слоя и хорио идного сплетения IV желудочка, к вторичным – новооб разования, распространяющиеся в полость IV желудочка из полушарий и червя мозжечка, метастазы, а также опу холи, происходящие из зачатков эпидермиса. Из 16 боль ных было 7 женщин, 9 мужчин. Возраст варьировал от 17 до 64 лет. В клинической картине заболевания гипертен зионногидроцефальный синдром отмечался в 10 наблю дениях, мозжечковый – в 13, бульбарный – в 6, дислока ционный – в 2 и поражение черепных нервов – у 15 боль ных. МРТ и МРАГ исследования позволили выявить со отношение новообразования с функционально значимы ми отделами ствола, сосудами и черепными нервами. Признаки инфильтративного роста были обнаружены у 12 больных. Всем больным выполнено оперативное вмешательство: удаление опухоли из срединного субокципитального до ступа. В 2 случаях опухоль удалена тотально, в 2 – субто тально, в 12 – частично. Гистологический диагноз: астро цитома – 6, эпендимома – 4, эпидермоидная киста – 2, метастазы рака – 2, глиосаркома – 1, медуллобластома – 1. Оперативные вмешательства производились с исполь зованием операционных микроскопов «OPTON», «MNT 4 САША» и микрохирургических инструментов. Интраоперационно проводилось исследования стволо вых вызванных потенциалов, что позволяло судить о фун кциональном состоянии ствола головного мозга во время удаления опухоли. Предварительное шунтирование желудочковой систе мы произведено в 3 случаях. Комбинированная химиоте рапия проведена 10 больным. Лучевое лечение в после операционном периоде проведено 10 больным. III ñúåçä íåéðîõèðóðãîâ Ðîññèè 96 Íåéðîîíêîëîãèÿ После проведенного комплексного лечения выписано с улучшением 12 больных, без выраженной положитель ной динамики – 2 больных, умерло 3 больных. Причина ми смерти были: быстрый продолженный рост опухоли, асептический менингоэнцефалит и основное заболевание – рак легкого. ÄÈÀÃÍÎÑÒÈÊÀ È ÕÈÐÓÐÃÈ×ÅÑÊÎÅ ËÅ×ÅÍÈÅ ÀÑÒÐÎÖÈÒÎÌ ÑÏÈÍÍÎÃÎ ÌÎÇÃÀ Åâçèêîâ Ã. Þ., Øàøêîâà Å. Â. Êëèíèêà íåðâíûõ áîëåçíåé èì. À. ß. Êîæåâíèêîâà ÌÌÀ èì. È. Ì. Ñå÷åíîâà, Ìîñêâà Спинальные внутримозговые опухоли составляют 15% опухолей спинного мозга и 23% от общего количества опухолей центральной нервной системы. Среди внутри мозговых спинальных опухолей астроцитомы составля ют около 30% случаев, у взрослых часто встречаются пи лоцитарные астроцитомы, относящиеся к узловым фор мам. При диффузных астроцитомах (фибриллярные, про топлазматические) преобладают опухоли низкой степени злокачественности. Кистообразование отмечается в 40% наблюдений. Традиционно большинство операций при этих опухо лях заканчивалось декомпрессивной ламинэктомией с биопсией опухоли. В последнее время хирургическая ак тивность и степень радикальности операций значитель но возросли. Целью работы явился анализ результатов удаления (парциального, субтотального, радикального) спиналь ных астроцитом. М а т е р и а л и м е т о д ы . В нейрохирургическом от делении клиники в течение последних 5 лет по поводу ас троцитом спинного мозга оперированы 12 больных. Муж чин – 8, женщин – 4. Средний возраст – 37 лет. Опухоли располагались в шейном отделе спинного мозга в 2 слу чаях, в шейногрудном – в 7, в грудном – в 3. В клиничес кой картине заболевания перед операцией двигательные и чувствительные расстройства отмечались во всех наблю дениях, нарушение функции тазовых органов – у 7 паци ентов, болевой синдром – у 6 пациентов. Интенсивность клинических проявлений соответствовала частичному поперечному поражению спинного мозга у 9 больных, полному поперечному поражению у 3 больных. При гис тологическом исследовании материала опухолей в 5 слу чаях выявлены пилоцитарные астроцитомы, в 7 случаях диффузные (протоплазматические, фибриллярные). При диффузных опухолях вторая степень злокачественности отмечена в 5 наблюдениях, третья – в 2 наблюдениях. Диагноз опухоли, ее расположение и распространен ность устанавливали с помощью МРТ, в 7 наблюдениях с дополнительным контрастированием. Для пилоцитарных астроцитом было характерно интенсивное накопление контраста в опухолевых узлах и четкая граница с окружа ющей мозговой тканью. При диффузных астроцитомах контрастирование было менее четким и неоднородным. В 11 наблюдениях астроцитомы располагались интраме дуллярно. В 1 наблюдении пилоцитарная астроцитома располагалась интраэкстрамедуллярно с формировани ем узла над поверхностью мозга. Диффузные астроцито мы распространялись в среднем на 7 сегментов мозга, пи лоцитарные – на 4. Наличие кист отмечено в 3 наблюде ниях (1 – пилоцитарная, 2 – фибриллярные). Р е з у л ь т а т ы и и х о б с у ж д е н и е . Радикальное уда ление опухолей произведено в 2 наблюдениях (солидные пилоцитарные астроцитомы), субтотальное удаление – 3 наблюдения (2 солидные и 1 кистозная пилоцитарная ас троцитома), парциальное удаление и дренирование опу холевых кист – 7 наблюдений (диффузные астроцитомы). В 11 наблюдениях с целью удаления опухоли проводи ли миелотомию в проекции задней продольной щели, в случае интраэкстрамедуллярного расположения внутри мозговая часть образования удалена через спонтанную миелотомию в области DREZзоны. Результат операции оценивался на момент выписки из стационара через 34 недели после операции. Частичный регресс неврологичес ких расстройств после операции отмечен у 4 пациентов, без динамики – 5, нарастание неврологической симпто матики – 3 наблюдения. Болевой синдром регрессировал в 5 наблюдениях. Нарастание симптоматики, отмечавше еся у больных с частичным поперечным поражением спинного мозга, не привело к развитию картины полного поперечного поражения. При нарастании неврологичес кой симптоматики, как правило, отмечалось усугубление расстройств глубокой чувствительности за счет травмати зации задних столбов спинного мозга. После радикаль ного и субтотального удаления улучшение отмечено в 3 наблюдениях, без динамики – 1, ухудшение – 1. После парциального удаления улучшение отмечено в 1 наблю дении, без динамики – 4, ухудшение – 2. У пациентов с клинической картиной полного поперечного поражения спинного мозга улучшения состояния после проведенных операций не отмечалось. ÊËÈÍÈÊÀ, ÄÈÀÃÍÎÑÒÈÊÀ È ÕÈÐÓÐÃÈ×ÅÑÊÎÅ ËÅ×ÅÍÈÅ ÝÏÅÍÄÈÌÎÌ ÊÎÍÓÑÀ È ÊÎÍÅ×ÍÎÉ ÍÈÒÈ Åâçèêîâ Ã. Þ., Ðîçåí À. È. Êëèíèêà íåðâíûõ áîëåçíåé èì. À. ß. Êîæåâíèêîâà ÌÌÀ èì. È. Ì. Ñå÷åíîâà, Ìîñêâà Эпендимомы являются наиболее частыми интрамедул лярными опухолями у взрослых. Они составляют 13% всех опухолей спинного мозга и 65% глиальных интрамедулляр ных образований. Кистообразование в ткани опухолей от мечается в 20% наблюдений. Сирингомиелические кисты выявляются в 60% случаев. 5060% спинальных эпендимом расположены в области конуса и конечной нити. Целью работы явился анализ особенностей диагности ки и результатов хирургического лечения 26 больных, опе рированных по поводу эпендимом конуса и конечной нити в нейрохирургическом отделении клиники в период с 1997 по 2001 г. М а т е р и а л и м е т о д ы . Мужчин – 16, женщин – 10. Средний возраст – 39 лет. Изолированное поражение ко нечной нити отмечено в 4 наблюдениях, поражение ко нуса и конечной нити в 22 наблюдениях. Средняя протя женность опухолей составила 4 позвонка. При гистоло гическом исследовании материала опухолей злокаче ственные (анапластические) формы обнаружены в 7 на блюдениях. В клинической картине заболевания к моменту прове дения операций синдромы двигательных и чувствитель ных расстройств различной степени выраженности, а так же болевой синдром выявлялись у всех пациентов. Нару шение функции тазовых органов отмечено в 15 наблюде ниях (выдавливание мочи дополнительным напряжени ем мышц передней брюшной стенки – 6, полная задерж ка мочеиспускания – 3, ишурия парадокса – 2, учащен ные болезненные позывы – 4). Развитие клинических проявлений заболевания носило медленный, програди ентный характер у 19 больных. Болевой синдром являлся первым клиническим проявлением в большинстве случа ев. В 4 наблюдениях отмечались эпизоды резкого ухудше ния состояния больных (псевдоинультное течение). 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 97 Íåéðîîíêîëîãèÿ Диагноз опухоли, ее расположение и распространен ность устанавливался с помощью МРТисследования с дополнительным контрастированием. При внутривенном конрастировании отмечалось быстрое и гомогенное по вышение интенсивности сигнала от солидного компонен та опухолевой ткани. Опухолевые кисты выявлены у 4 па циентов, признаки сирингомиелии – у 11. Операции проводились с использованием микрохирур гической техники в положении больного на животе. Р е з у л ь т а т ы и и х о б с у ж д е н и е . Радикальное уда ление опухолей произведено в 12 наблюдениях (4 опухо ли конечной нити, 8 опухолей конуса и конечной нити), субтотальное удаление – 14 наблюдений (все случаи – сочетанное поражение конуса и конечной нити). Удале ние опухоли из конуса проводили через спонтанную мие лотомию в области конечной нити и резко расширенную заднюю продольную щель без дополнительного рассече ния спинного мозга в 16 наблюдениях. В 7 наблюдениях производилась дополнительная миелотомия в проекции задней продольной щели для удаления оральных отделов опухоли. Спаянность опухоли с корешками конского хво ста может иметь различную степень выраженности. Счи таем целесообразным использование ультразвукового де зинтегратора для удаления опухоли только в случаях, ког да корешки легко отделяются от ткани опухоли и предва рительно изолируются ватниками. При плотном сраще нии корешков с поверхностным слоем опухолевой ткани удаление производили с помощью микродиссекторов и «окончатых» микропинцетов. При субтотальном удале нии, как правило, не удалялись фрагменты опухоли, плот но фиксированные к мозговой ткани в области конуса. Результаты операций оценивались через 34 недели после вмешательства, на момент выписки пациента из стационара. Частичный или полный регресс болевого син дрома отмечен во всех случаях. Различная степень регресса чувствительных и двигательных расстройств наблюдалась у 17 больных, отсутствие динамики – у 9. Положительная динамика при тазовых расстройствах – 8 пациентов, без динамики – 5, усугубление симптоматики – 3. Полная нормализация на момент выписки наблюдалась только в тех случаях, когда предоперационные нарушения носили характер затрудненного или учащенного мочеиспускания. ËÅ×ÅÍÈÅ ÃËÀÇÎÄÂÈÃÀÒÅËÜÍÛÕ ÐÀÑÑÒÐÎÉÑÒÂ Ó ÁÎËÜÍÛÕ Ñ ÀÄÅÍÎÌÀÌÈ ÃÈÏÎÔÈÇÀ  ÐÀÍÍÅÌ ÏÎÑËÅÎÏÅÐÀÖÈÎÍÍÎÌ ÏÅÐÈÎÄÅ Æäàíîâà Â. Í., Ãóê À. Í., Çàäîÿííûé Ë. Â., Öûìáàëþê Â. È. Èíñòèòóò íåéðîõèðóðãèè èì. àêàä. À. Ï. Ðîìîäàíîâà ÀÌÍ Óêðàèíû, Êèåâ, Óêðàèíà Комплексное восстановительное лечение глазодвига тельных расстройств (ГДР) различной степени выражен ности при аденомах гипофиза проведено у 84 больных в раннем послеоперационном периоде. Дисфункция III, IV, VI черепных нервов отмечалась до операции как следствие компрессии или врастания опу холи в пещеристые пазухи у 60 (72%) больных, в основ ном при инвазивном характере роста новообразования. В остальных наблюдениях (28%) ГДР были связаны с ослож нениями по ходу операции («осложнения средней линии» при транссфеноидальной хирургии, а также в связи с хи рургическими манипуляциями на стенках кавернозной пазухи). Наиболее выраженные одно и двусторонние ГДР до операции отмечены у больных с гипофизарной апоп лексией (18 пациентов). Методика комплексного восстановительного лечения, разработанная в Институте нейрохирургии, включала ме дикаментозную терапию и комплекс физиотерапевтичес ких методов, как правило, применяемых в течение двух недель. Сочетание сосудистых, антихолинэстеразных пре паратов, витаминов группы В с проведением ультразву ковой терапии и нейромышечной электростимуляции, массажа и специального комплекса лечебной физкульту ры давало быстрый восстановительный эффект. Полное восстановление функций в период пребывания в стацио наре после операции отмечено у 12 больных. У 49 оно было частичным, однако за период наблюдения 34 месяца до стигало степени полного восстановления. При сочетан ном поражении III, IV, VI нервов раньше восстанавлива лась функция VI нерва. При грубом страдании функций нервов до степени офтальмоплегии применение комплексного восстанови тельного лечения способствовало положительной дина мике уже с 34 сеансов, однако полного восстановления не наблюдалось. Полное восстановление происходило в течение 6 месяцев у больных с гипофизарной апоплекси ей. Отсутствие восстановления ГДР отмечено только у 5 больных с частичным удалением опухоли, имевшей вы раженное параселлярное распространение. По нашему мнению, применение комплексного лече ния способствует улучшению качества жизни пациентов и устранению тягостных субъективных ощущений, обес печивает высокую социальную реадаптацию оперирован ных больных. Таким образом, использование комплексного восста новительного лечения ГДР в раннем послеоперационном периоде у больных с аденомами гипофиза указывает на высокую эффективность разработанного метода и позво ляет рекомендовать его для широкого практического при менения. ÌÀÃÍÈÒÍÎ-ÐÅÇÎÍÀÍÑÍÀß È ÊÎÌÏÜÞÒÅÐÍÀß ÒÎÌÎÃÐÀÔÈß Â ÎÖÅÍÊÅ ÐÅÇÓËÜÒÀÒΠÊÎÌÏËÅÊÑÍÎÃÎ ËÅ×ÅÍÈß ÃËÈÀËÜÍÛÕ ÎÏÓÕÎËÅÉ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Æóðàâëåâ À. Â., Øåðøåâåð À. Ñ., Áåëîäåä Â. Ì., Óñîëüöåâà Å. Å., Æóðàâëåâà Ì. À., Ôèàëêî Í. Â. Óðàëüñêèé ìåæîáëàñòíîé íåéðîõèðóðãè÷åñêèé öåíòð èì. ïðîô. Ä. Ã. Øåôåðà, ÑÎÎÄ ÌÍÏÖ «Îíêîëîãèÿ», Åêàòåðèíáóðã Разработана методика МРТ и КТконтроля за резуль татами оперативного и последующего лучевого лечения глиальных опухолей головного мозга. Производилось из мерение размеров опухоли и плотности опухолевой и нор мальной тканей головного мозга на симметричных учас тках до и после оперативного лечения и лучевой терапии. На каждом этапе МРТ или КТконтроля за результата ми лечения дается качественная оценка состояния голов ного мозга и измерение характеризующих его количе ственных показателей. В качестве инструментальных средств получения и об работки данных используется спиральный компьютерный томограф 4 поколения Tomoscan AVE и магнитнорезо нансный томограф Gyroscan NT5 (0. 5T) фирмы Philips. Расчет объема интересующей области производился на рабочей станции Easy Vision (фирмы Philips). Компьютер ная программа рабочей станции позволяет рассчитать объем интересующей области и произвести денситомет рический анализ в плоскости сечения опухоли. При каждом обследовании оценивались: 1) до опера ции – объем глиомы и объем опухоли вместе с перифо кальным отеком; 2) в 1е сутки после операции – возмож ные ранние послеоперационные осложнения и объем ло кальных послеоперационных изменений ткани мозга; 3) III ñúåçä íåéðîõèðóðãîâ Ðîññèè 98 Íåéðîîíêîëîãèÿ на 10е сутки – объем формирующихся глиознокистоз ных изменений, неудаленных частей опухоли и локаль ного отека; 4) то же самое через 2030 дней, одновремен но с топометрической предлучевой подготовкой больно го для лучевой терапии; 5) сразу и через 1 и 3 месяца после курса лучевой терапии – те же параметры, что и в пп. 3 и 4. Двухмерный денситометрический анализ проводился в каждом срезе внутри выбранного объема. Рассчитыва лось среднее значение плотности внутри выбранного объема. Проанализировано 40 случаев глиальных опухолей. Из них в 21 случае выявлена глиобластома, в 6 случаях – про топлазматическая астроцитома, в 10 – анапластическая астроцитома. В 3 случаях гистологическая структура гли омы не установлена. Все больные были прооперированы, послеоперационый период протекал гладко, без ослож нений. По объему произведенного оперативного вмеша тельства все пациенты разделены на 2 группы: 28 случаев – субтотальное удаление опухоли, 12 – тотальное удале ние. Степень удаления опухоли оценивалась визуально в ходе операции. Максимальный срок наблюдения соста вил 6 месяцев после операции. Макроскопические изменения ткани мозга в ответ на оперативное и лучевое лечение оценены по МРТ и КТ следующим образом: Размеры остаточного объема опухоли без динамики – 7 (17,5%). Уменьшение размеров остаточного объема опухоли – 5 (12,5%). Продолженный рост опухоли (после субтотального уда ления) – 16 (40,0%). Продолженный рост опухоли (после тотального удале ние) – 4 (10,0%). Кистозноглиозные изменения без признаков продол женного роста опухоли – 8 (20,0%). Из 16 случаев продолженного роста в 14 величина пе рифокального отека составляла более 50% от всего объе ма изменений ткани мозга до операции. Основным направлением работы является развитие методик контроля за изменением размеров и плотности опухоли в процессе комбинированного лечения. Наличие количественных сведений об изменении структуры опу холи и нормальных тканей позволяет врачу более правиль но определять тактику дальнейшего лечения. ÎÏÛÒ ÏÐÎÔÈËÀÊÒÈÊÈ ÂÒÎÐÈ×ÍÎÃÎ ÑÈÍÄÐÎÌÀ «ÏÓÑÒÎÃλ ÒÓÐÅÖÊÎÃÎ ÑÅÄËÀ È ÍÀÇÀËÜÍÎÉ ËÈÊÂÎÐÅÈ ÏÎÑËÅ ÓÄÀËÅÍÈß ÎÏÓÕÎËÅÉ ÕÈÀÇÌÀËÜÍÎ-ÑÅËËßÐÍÎÉ ÎÁËÀÑÒÈ Çàèòîâ È. Ì., Ñàôèí Ø. Ì., ßíáîðèñîâ Ò. Ì., Íèãìàòóëëèí Ð. Ò., Ñåëüñêèé Í. Å. Ðåñïóáëèêàíñêàÿ êëèíè÷åñêàÿ áîëüíèöà èì. Ã. Ã. Êóâàòîâà, Óôà, Áàøêîðòîñòàí Хирургия основания черепа является одним из слож ных разделов нейрохирургии, в котором проблема совре менных методов лечения больных, страдающих опухоля ми хиазмальноселлярной области (ХСО), занимает важ ное место. Несмотря на появление новых методов диаг ностики, в нейрохирургические стационары еще нередко поступают больные с большими опухолями ХСО, при которых послеоперационные осложнения и летальность встречаются чаще. Одними из таких осложнений являются кровоизлия ние в остатки опухоли, ликворея и зрительные наруше ния, которые во многом определяют дальнейшею соци альную и трудовую адаптацию оперированных больных. По данным катамнестической оценки результатов хирур гического лечения, в послеоперационном периоде ухуд шение зрения наступает в 31% случаев (24,6% при ранней стадии зрительных нарушений и 37,7% при поздней ста дии), также возможно развитие острой потери зрения в раннем послеоперационном периоде (0,6%1,0%). В период с 1996 по 2001 г. по разработанной совместно с Всероссийским центром глазной и пластической хирур гии методике оперировано 24 больных с опухолями ХСО. Все больные оперированы с применением микрохирур гической техники и операционного микроскопа: бифрон тальным доступом – 18, комбинированным (бифронталь ный + трансназосфеноидальный) – 2, трансназосфенои дальным – 4. Всем больным после удаления опухолей в ложе укладывался аллотрансплантат для замещения объемных дефектов тканей (алллотрансплантаты серии «Аллоплант», ТУ 42253797), позволявший восстановить анатомическую конфигурацию основания черепа. По данным гистологических исследований основную группу составили аденомы гипофиза – 17, краниофарен гиома – 5, злокачественная параганглиома – 1, ангиоре тикулема – 1. У 23 больных ранний послеоперационный период про текал гладко. Один больной умер на восьмые сутки, вто рой – через два месяца после операции. Причиной смер ти в первом случае послужила ишемия дна III желудочка, а во втором продолженный рост злокачественной опухо ли. Во время операции у двух больных, оперированных бифронтальным доступом, в конце отмечалось умеренное кровотечение из передних отделов ложа опухоли, вери фицировать которое было невозможно изза отсутствия возможности визуализировать эту зону. Попытки остано вить кровотечение традиционными способами не имели успеха. После укладки трансплантата, дополнительно на сыщенного тромбином, кровотечение было остановлено в течение 35 мин. Диаметр ниши в основании черепа пос ле удаления опухолей составлял от 2 см до 5 см. В послеоперационном периоде каждые 810 дней про водился осмотр окулиста, контрольные исследования КТ или МРТ головного мозга перед выпиской. Через неделю временное снижение зрения на 0,10,2 зафиксировано у четверых больных. Улучшение остроты и расширение полей зрения начиналось с первой недели у 15 больных, а ко второй неделе у 18. У 9 за это время уровень зрения вер нулся к исходному. В дальнейшем контрольные обследо вания больных проводились в разные сроки – в среднем один раз в 34 месяца. У одного больного через 1,5 месяца после операции visus от 0,01 улучшился до 1,0 и держится на этом уровне 26 мес. У другого больного на третий ме сяц visus изменился от 0,0 до 0,3, а через 6 мес. до 0,5. В среднем улучшение зрения в наблюдаемой группе соста вило 32%. За период наблюдения не было ни одного ре цидива опухоли. По данным контрольных КТ и МРТ, объем трансплан тата не изменялся, и в динамике были выявлены призна ки замещения его собственными тканями больного, что было подтверждено при изучении секционного материа ла от двух умерших больных. Ни в одном из наблюдений не зарегистрировано ликвореи и кровоизлияний в ложе опухоли. В контрольной группе, состоявшей из 44 больных, от мечено ухудшение зрения в 27,3%, острая потеря зрения у одного больного, назальная ликворея в 2,7%, кровоиз лияние в ложе удаленной опухоли в 4,5%. По данным кон трольной МРТ больного с облитерацией ложа удаленной опухоли фрагментом аутожира, выявлено рассасывание аутотрансплантата с формированием кистозной полости. Процент рецидивов составил 9%. 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 99 Íåéðîîíêîëîãèÿ При анализе полученных результатов установлено, что применение данной методики позволяет уменьшить ве роятность возникновения послеоперационных осложне ний, связанных с анатомическими особенностями ХСО, а также показывает преимущество аллотрансплантата пе ред использовавшимися ранее. ÊÐÀÍÈÎÔÀÖÈÀËÜÍÛÅ ÁËÎÊ-ÐÅÇÅÊÖÈÈ ÏÐÈ ÇËÎÊÀ×ÅÑÒÂÅÍÍÛÕ ÎÏÓÕÎËßÕ ÎÑÍÎÂÀÍÈß ×ÅÐÅÏÀ Çàéöåâ À. Ì., ×åðåêàåâ Â. À., Ðåøåòîâ È. Â., Áåëîâ À. È. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Проблема лечения больных со злокачественными кра ниофациальными опухолями включает в себя совершен ствование диагностики с целью выявления ранних стадий заболеваний, разработку эффективных методов лечения, включая до и послеоперационную лучевую, химиотера пию и хирургическое удаление патологического процес са в пределах здоровых тканей. По литературным данным, правильно выбранная тактика лечения позволяет добить ся 5летнего безрецидивного периода в 4060%наблюде ний. Разработка эффективных методов реконструктивной и пластической хирургии явилась основой для выполнения блокрезекции у больных со злокачественными опухоля ми основания черепа, когда удаляется опухоль единым блоком с прилежащими нормальными тканями (твердой мозговой оболочкой, мышцами, костями основания че репа и лицевого скелета, слизистой, тканями глазницы, кожей). Краниофациальная блокрезекция является одним из этапов комплексного лечения больных со злокачествен ными опухолями основания черепа. Злокачественные опухоли краниофациальной локализации имеют склон ность к местному распространению и редко дают как ре гионарные, так и отдаленные метастазы. На этом основа на концепция возможности излечения больного от зло качественной краниофациальной опухоли путем ее уда ления блоком с участком прилежащих здоровых тканей. При подготовке больного к блокрезекции важно тща тельное обследование для исключения метастазирования и четкого определения локализации и распространенно сти процесса с целью планирования объема резекции и метода пластики дефекта. Существует два основных метода блокрезекции: 1) Передняя краниофациальная блокрезекция. В блок включаются носоглотка, решетчатая и основные пазухи, ольфакторная ямка. В зависимости от распространенно сти патологического процесса блок расширяется за счет глазницы, верхнечелюстной пазухи и крылонебной ямки. Дефекты твердой мозговой оболочки закрываются сво бодными фрагментами жировой клетчатки и сверху ук ладывается перемещенный лоскут надкостницы. Возни кающие обширные дефекты костей и мягких тканей зак рываются кожномышечным лоскутом на сосудистой ножке с формированием из его кожной поверхности об ласти неба и основы для глазного протеза. Кожномышеч ный лоскут формируется из широчайшей мышцы спины, передней зубчатой мышцы, большой грудной мышцы, прямой мышцы живота. При распространенном наруше нии целостности твердой мозговой оболочки эти дефек ты целесообразнее закрывать лоскутом большого сальни ка на сосудистой ножке. 2) Боковая краниофациальная блокрезекция. В блок включаются структуры формирующие подвисочную ямку, суставной и венечный отростки нижней челюсти, наружные отделы пирамиды височной кости, верхнече люстной пазухи, глазницы, включая основание передней черепной ямки, формирующей крышу глазницы. Дефек ты закрываются по тем же принципам, что и при пере дних блокрезекциях. Перед краниофациальной блокрезекцией устанавли вается люмбальный дренаж, который удаляется в среднем через 68 дней после операции. В настоящее время в Институте внедрена в практику методика краниофациальных блокрезекций злокаче ственных опухолей основания черепа. Операции выпол няются совместно с онкологами и пластическими хирур гами МНИОИ им. П. А. Герцена. Производится удале ние опухоли блоком с прилежащим участком здоровых тканей и пластикой дефектов кожномышечным лоску том или лоскутом большого сальника с последующей косметической коррекцией. За период с 1996 по 2001 г. в ИНХ у 23 больных была выполнена блоковая резекция с первичной пластикой дефекта. По гистологической структуре опухоли распределялись следующим образом: почти в 90% случаев эпителиальные опухоли, остальные 10% саркомы, злокачественные хон дромы, эстезионейроэпителиомы. При сроках наблюдения до 5ти лет выживаемость больных составила 61%. (За исследуемый период време ни, из 23 больных, которым выполнялась блоковая резек ция умерло 9 человек, что составило 39%.) Средний возраст составил 40,1 года. ÊÐÀÍÈÎÎÐÁÈÒÀËÜÍÛÅ ÐÅÇÅÊÖÈÈ Â ËÅ×ÅÍÈÈ ÌÅÒÀÑÒÀÒÈ×ÅÑÊÈÕ ÏÎÐÀÆÅÍÈÉ ÎÑÍÎÂÀÍÈß ÏÅÐÅÄÍÅÉ ×ÅÐÅÏÍÎÉ ßÌÊÈ Çàëóöêèé È. Â., Øàíüêî Þ. Ã., Æàðêîâ Â. Â., Áåëîöåðêîâñêèé È. Â. ÍÈÈ îíêîëîãèè è ìåäèöèíñêîé ðàäèîëîãèè èì. Í. Í. Àëåêñàíäðîâà, ÍÈÈ íåâðîëîãèè, íåéðîõèðóðãèè è ôèçèîòåðàïèè, Ìèíñê, Áåëàðóñü Злокачественные опухоли полости носа, орбиты, вер хней челюсти составляют 12% всех злокачественных опу холей. Большинство больных с новообразованиями этих локализаций поступает для специализированного лечения с 34 стадией заболевания, когда опухоль выходит за пре делы одной анатомической зоны и поражает смежные от делы: мягкие ткани лица, орбиту, скуловую кость, осно вание черепа, мозговые оболочки, мозг. Такое распрост ранение злокачественных образований ранее рассматри валось как противопоказание к оперативному лечению, а больные направлялись на паллиативную лучевую или хи миолучевую терапию. Мы располагаем опытом 12 краниоорбитальных резек ций, которые были произведены больным с метастатичес кими поражениями основания передней черепной ямки. По гистологической структуре преобладали злокачествен ные эпителиальные опухоли (8 чел.), реже встречались неэпителиальные новообразования (4 чел.). Все больные ранее неоднократно оперированы, получали лучевое и химиотерапевтическое лечение. Как правило, опухоль локализовалась в верхнезадних отделах орбиты и распро странялась в переднюю черепную ямку, лобную пазуху, решетчатый лабиринт. Диагноз верифицирован на осно вании клинического, КТ и МРТ обследований. Операция начиналась с костнопластической трепана ции черепа, ревизии эпи и субдурального пространства. После визуального и гистологического (экспрессбио III ñúåçä íåéðîõèðóðãîâ Ðîññèè 100 Íåéðîîíêîëîãèÿ псия) уточнения зоны опухолевого роста производилась резекция полюснобазальных отделов лобной доли, при лежащих к узлу новообразования. Затем выпиливался уча сток основания передней черепной ямки вокруг опухоле вого узла. В абсолютном большинстве случаев (10 чел.) эта манипуляция была односторонней, с включением в блок резецируемых тканей крыши орбиты, ее медиальной и латеральной стенок и решетчатого лабиринта, а у двоих больных произведены более широкие резекции в меди альном направлении. Костные структуры удалялись в еди ном блоке с тканями орбиты и лицевого скелета. Закры тие дефекта твердой мозговой оболочки осуществлялось свободным лоскутом широкой фасции бедра, с создани ем интрадурального резервного пространства и гермети зацией шва за счет аппликации пластинок тахокомба. Полость носа изолировалась надкостничным лоскутом. Производилось ушивание кожной раны. В трех случаях кожные лоскуты вследствие постлучевых изменений были несостоятельны, что потребовало использования переме щенных кожнофасциальных лоскутов свода черепа. Хирургическое вмешательство обычно переносилось больными хорошо. Послеоперационная терапия прово дилась по стандартным схемам. Имел место один леталь ный исход, причиной которого были отек и дислокация головного мозга. Ни в одном случае не отмечено гнойно воспалительных осложнений. У четверых оперированных была кратковременная послеоперационная ликворея, которая регрессировала самостоятельно, без дополнитель ных хирургических пособий. Более существенной явля ется проблема грубого послеоперационного косметичес кого дефекта, а ее решение видится в более широком ис пользовании возможностей психотерапии. Таким образом, комбинированный мультидисципли нарный подход к хирургическому лечению метастатичес ких поражений краниоорбитальной области дает основа ние считать операбельной группу больных, которой ра нее проводилась только паллиативная химиолучевая те рапия. ÈÑÑËÅÄÎÂÀÍÈÅ ÄÍÊ ÏÎËÈÎÌÀÂÈÐÓÑΠ ÃËÈÎÌÀÕ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ ×ÅËÎÂÅÊÀ Çîçóëÿ Þ. À., Âàñèëüåâà È. Ã., ×îïèê Í. Ã., Ãàëàíòà Å. Ñ. Èíñòèòóò íåéðîõèðóðãèè èì. àêàä. À. Ï. Ðîìîäàíîâà ÀÌÍ Óêðàèíû, Êèåâ, Óêðàèíà Развитие некоторых злокачественных опухолей чело века, таких как медуллобластома, нейробластома, в пос леднее время связывают с нейроонкогенными полиома вирусами: JC (JCV), BK (BKV) и Simian virus 40 (SV40). (Altschuler E. L., 2001) По данным эпидемиологических исследований, они обнаруживаются в крови у 40% людей (Strickler H. D. et al., 1998). Особенностью полиомавирусов является спо собность находиться в организме в латентной персисти рующей форме. В условиях же иммуносупрессии поли омавирусы быстро редуплицируются и накапливаются в клетках в количествах, достигающих миллиардов копий. Полиомавирусы обладают сильным тропизмом к гли альным клеткам in vivo. В значительной степени это обус ловлено соответствием метаболизма глии к экспрессии вирусов. Суть этого соответствия состоит в том, что фак тор транскрипции глиальных клеток, в том числе Tst1/ Oct6/SCIP, взаимодействует с вирусными промоторны ми последовательностями. Кроме того, экспрессия гли ального фактора транскриции Tst1/Oct6/SCIP может быть дозозависимым способом активирована большим Т антигеном (БТ) – ранним генным продуктом JC вируса. Сейчас уже доказана связь между JCV и глиальными нео плазиями у людей. В клетках глиальных опухолей выяв лены БТ, вирусная ДНК и РНК (Rencic A. et al., 1996). Учитывая приведенные выше литературные данные, мы поставили перед собой задачу исследовать операци онный материал глиом головного мозга человека на при сутствие ДНК полиомавирусов. Исследования проводились по методу ПЦР с исполь зованием общих праймеров, комплементарных консер вативному региону вирусных геномов, кодирующих боль шой и малый Тантиген JCV, SV40 и BKV. Обследовано 47 опухолей, из них 19 анапластических астроцитом, 1 ас троцитома протоплазматическая, 6 астроцитом фибрил лярнопротоплазматических, 4 олигодендроастроцитомы, 3 олигодендроглиомы, 2 эпендимоастроцитомы анаплас тических, 5 глиобластом, 1 нейробластома, 1 лимфогра нуломатоз, 1 лимфосаркома, 1 менингиома, 1 метастаз меланомы и 1 метастаз рака. Исследование показало на личие ДНК полиомавирусов в 3 анапластических астро цитомах (15%), 3 астроцитомах фибриллярнопротоплаз матических (50%), в 2 глиобластомах (40%), в 2 олигоден дроглиомах (50%), 2 олигодендроастроцитомах (67%). Полученные результаты коррелируют с данными ли тературы о тропности полиомавирусов к глиальным клет кам. Особенно необходимо отметить высокий процент выявления ДНК полиомавирусов среди опухолей, кото рые происходят из олигодендроцитов. Взаимосвязь между инфицированием олигодендроци тов полиомавирусами и их пролиферацией пока не ясна, однако исследования подтверждают, что вирусный белок Тантиген связывается с p53, что может быть причиной инактивации проапоптического белка р53 и содействия пролиферации возникающих опухолевых клонов олиго дендроцитов (Chretien F. et al., 2000). Считается, что су ществуют соответствующие предшественники олигоден дроглиом и астроцитом. Как показали Holland E. C. et al. (2000), смешанные глиомы генерируются из трансформи рованных in vivo ГФКБ (glial fibrillary acidic protein)пози тивных клеток (дифференцированных астроцитов) сред ним Тантигеном (СТ) полиомавируса. СТ – мощный он коген, который активирует значительное количество сиг нальных путей трансдукции, включая и те, которые, как считается, задействованы в глиомогенезе и индуцируют клетки опухоли различных типов. Специфическая транс формация СТ ГФКП позитивных клеток in vivo с исполь зованием техники переноса гена соматическим клеткам дала возможность выявить формирование смешанных морфологических черт анапластических глиом. Из этого следует, что ГФКБэкспрессирующие астроциты с соот ветствующими сигнальными нарушениями могут быть клетками, которые дают начало олигодендроглиомам, ас троцитомам и смешанным глиомам. Доказано, что вирус ный геном присутствует как в первичных, так и во вто ричных опухолях, а вирусный онкопротеин ВТ выявля ется только при рецидивных глиобластомах. Соответ ственно уровень индуцибельных клеточных факторов транскрипции, включая р65 субъединицы NFkappaB и YB1, которые способны стимулировать экспрессию ге нов вируса, были обнаружены в большом количестве в ткани рецидивирующих глиобластом. Эти наблюдения подтверждают, что индукция регуляторных факторов пос ле резекции первичной опухоли может реактивировать экспрессию генов JC вируса, что приводит к повторному развитию опухоли мозга (Del Valle L. et al., 2000). Таким образом, полученные результаты указывают на высокий процент выявления ДНК полиомавирусов в об разцах глиом головного мозга человека, что важно для 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 101 Íåéðîîíêîëîãèÿ разработки эффективной стратегии лечения глиом при наличии вирусного заражения. Учитывая высокую веро ятность заражения ткани опухоли вирусом, считаем це лесообразным проведение предварительной вирусологи ческой диагностики с целью выявления вируса в ЦСЖ. Высокая склонность зараженных вирусом опухолей к про долженному росту делает обоснованным проведение опе рации после предварительной эффективной антивирус ной терапии под последующим контролем присутствия вируса в цереброспинальной жидкости. Обнаружение вируса в ЦСЖ больных после хирургического вмешатель ства позволит считать показанным продолжение проти вовирусной терапии для снижения вероятности рециди вирующего роста глиом. ÏÐÈÌÅÍÅÍÈß ÎÔÝÊÒ C 99ÌÒÑ-MÈÁÈ ÄËß ÏÐÎÃÍÎÇÈÐÎÂÀÍÈß ÕÈÌÈÎÐÅÇÈÑÒÅÍÒÍÎÑÒÈ ÃËÈÎÌ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Çîçóëÿ Þ. À., Ìàêååâ Ñ. Ñ. Èíñòèòóò íåéðîõèðóðãèè èì. àêàä. À. Ï. Ðîìîäàíîâà ÀÌÍ Óêðàèíû, Êèåâ, Óêðàèíà Возможность дооперационного прогнозирования хи миорезистентности новообразований может содейство вать значительному повышению эффективности лечеб ной тактики, благодаря выбору адекватных химиотерапев тических средств. Применение однофотонной эмиссионной компьютер ной томографии (ОФЭКТ) и таких туморотропных радио фармпрепаратов (РФП), как 99мТсметоксиизобутилизо нитрил (99мТсMИБИ) представляет новые возможности для определения химиорезистентности различных видов опухолей. Проведенные исследования показали наличие активного транспорта 99мТсMИБИ из опухолевых кле ток, реализуемого при участии механизмов, ответственных за выведение многих цитотоксических агентов, таких как алкалоиды винка, эпиподофиллотоксины, антрациклины, актиномицин Д и др. Поэтому степень накопления МИБИ в опухолевой ткани может быть использована в качестве значимого показателя для оценки резистентности опухо левой ткани к действию химиопрепаратов. Ц е л ь . Изучить возможности использования 99мТс МИБИ для прогнозирования химиорезистентности гли ом головного мозга. М а т е р и а л и м е т о д ы . При помощи ОФЭКТ с 99мТсМИБИ обследовано 25 больных в возрасте от 20 до 66 лет (43) с верифицированными глиомами головно го мозга высокой степени злокачественности. Исследо вание проводилось до и после проведения курса химио терапии. ОФЭКТ выполнялась на эмиссионном томог рафе «E. Cam» (Siemens) по стандартной методике (мат рица 64х64, проекций – 64, длительность – 30 сек). Ре конструкция срезов осуществлялась с использованием фильтра Butterworth (cutoff 0.7). 99мТсМИБИ («Polatom», Польша), активностью 555740 МБК, вводился каждому больному в локтевую вену. Томография проводилась че рез 15 мин. после инъекции РФП. Для полуколичествен ной оценки изображения опухоли на томограммах рассчи тывали коэффициент асимметрии (КА), который вычис лялся как отношение радиоактивности опухолевого оча га к радиоактивности контрлатерального участка голов ного мозга. Р е з у л ь т а т ы и и х о б с у ж д е н и е . Все глиоми пред ставлены на эмиссионных томограмах очагами повышен ного накопления радиоиндикатора. Средний КА в этих опухолях до проведения химиотерапии находился на уров не 22,0 (1,8121,4). После окончания курса химиотерапии отмечалось снижение КА до уровня 13,4 (1,756,6). Одна ко у 7 больных с глиомами мозга такое снижение было не значительным или же вовсе отсутствовало, что свидетель ствовало о химиорезистентности этих новообразований и совпадало с низкой эффективностью лечения. В опухо лях с высоким накоплением РФП отмечалось резкое сни жение КА после проведенного лечения, что свидетель ствовало о высокой чувстительности опухолей к приме няемым химиопрепаратам. В ы в о д ы . Применение ОФЭКТ с 99мТсМИБИ мо жет служить объективным критерием для для прогнози рования химиорезистентности глиом головного мозга. ÕÈÐÓÐÃÈ×ÅÑÊÀß ÒÀÊÒÈÊÀ ÏÐÈ ÌÍÎÆÅÑÒÂÅÍÍÛÕ ÎÏÓÕÎËßÕ ÃÎËÎÂÍÎÃÎ È ÑÏÈÍÍÎÃÎ ÌÎÇÃÀ Çîðèí Í. À., Ñèðêî À. Ã. Ãîñóäàðñòâåííàÿ ìåäèöèíñêàÿ àêàäåìèÿ, Äíåïðîïåòðîâñê, Óêðàèíà Особый интерес в нейроонкологии представляют мно жественные опухоли. Возможности современных методов инструментальных исследований (МРТ, КТ, ПЭТ, ОФЭКТ) позволяют на дооперационном этапе диагнос тировать множественность опухолевого поражения. Од нако и в настоящее время вопросы выбора тактики лече ния больных с множественными первичными опухоля ми головного и спинного мозга остаются актуальными. В нашей клинике с 1993 по 2001 год находилось на ле чении 34 больных с множественными первичными опу холями головного и спинного мозга. Среди них 10 муж чин (29,41%) и 24 женщины (70,59%). Диагноз верифи цирован во всех случаях гистологическим исследовани ем. Возраст больных от 16 до 65 лет. Множественные опу холи головного мозга выявлены у 27 больных, спинного – у 4 больных, а у 3 больных выявлено сочетание новооб разований головного и спинного мозга. Опухоли пред ставлены множественными менингиомами у 12 больных (35,29%), невриномами у 8 больных (23,54%), сочетани ем неврином и менингиом – у 5 больных (14,7%), сочета нием нейроэктодермальных опухолей разной гистологи ческой природы – у 9 больных (26,47%). У 22 больных (64,7%) множественные новообразования нервной сис темы были выявлены одновременно. У оставшихся 12 больных (35,3%) диагностика опухолей других локализа ций с момента выявления первого опухолевого узла за нимала период времени от четырех месяцев до 20 лет на основании появления новой клинической картины и/или данных повторных КТ и МРТисследований. Оперированы все больные, которым в целом произве дено 54 операции, включая 4 повторных операции по по воду рецидивов опухоли и 1 шунтирующую операцию (как I этап при тяжелом общем состоянии больной). Удалено 98 опухолей, из них 55 менингиом, 31 невринома, 5 эпен димом, 3 астроцитомы, 2 глиобластомы и 2 олигодендрог лиомы. Одномоментное удаление множественных опухолей произведено 13 больным (38,23%), поэтапное 17 больным (50%), удаление только одной из опухолей – 4 больным (11,77%). При внутримозговых супратенториальных опухолях производилось одномоментное их удаление. При супра тенториальных менингиомах одномоментное удаление произведено 8 больным, у которых опухоли удалось уда лить из одного трепанационного окна, а 1 больному вы полнено двухэтапное удаление опухолей, расположенных в разных полушариях головного мозга. Первым этапом удалена большая по размерам опухоль, вызывающая не врологическую симптоматику. III ñúåçä íåéðîõèðóðãîâ Ðîññèè 102 Íåéðîîíêîëîãèÿ При множественных внемозговых супрасубтентори альных опухолях первичному удалению подвергалась суп ратенториальная опухоль. Только одной больной с окк люзионными явлениями, обусловленными субтентори альной опухолью большого размера, произведено ее пер вичное удаление. Хирургическое лечение двусторонних неврином VIII черепного нерва произведено 7 больным. Из них двухэ тапное удаление – 4 больным, а 3 больным невринома уда лена только с одной стороны. Первую операцию произ водили на той стороне, где опухоль больше, вторую – на другой стороне через 16 мес. в зависимости от состояния больного. Ни в одном случае после первого этапа опера тивного вмешательства не было осложнений, связанных с дислокацией ствола мозга оставшейся с противополож ной стороны опухолью. С множественными опухолями головного и спинного мозга оперировано 3 больных (8,8%). У всех выявлены типичные симптомы болезни Реклингхаузена. Первым этапом больным производилось удаление невриномы слу хового нерва, вызывающей нарушение ликворооттока с развитием окклюзионной гидроцефалии. Вторым этапом одной больной удалена невринома слухового нерва с про тивоположной стороны с последующим удалением ней рофибром на трех уровнях в грудном отделе позвоночни ка. Двум другим больным вторым этапом удалены пара сагиттальные менингиомы. При опухолевом поражении спинного мозга одному больному выполнено одномоментное удаление менинги ом на двух уровнях, а трем другим больным поэтапное удаление опухолей. Первым этапом удалялась опухоль, вызывающая двигательные и чувствительные проводни ковые расстройства. Послеоперационная летальность в группе больных, оперированных по поводу множественных опухолей, со ставила 2,94%. Умерла одна больная. У нее была выявле на парасагиттальная опухоль в лобной доле слева (до 2,5 см в диаметре) и опухоль задней черепной ямки больших размеров (более 5 см в диаметре). Произведено удаление менингиомы намета мозжечка. Смерть больной наступи ла в раннем послеоперационном периоде в результате на рушения кровообращения в стволе мозга. Остальные больные выписаны из отделения в удовлетворительном состоянии с улучшением. Хирургическая тактика множественных опухолей го ловного и спинного мозга в каждом конкретном случае должна определяться на основании комплексной оценки размеров и локализации каждой опухоли, выраженности клинических проявлений, наличия дислокационного и окклюзионногидроцефального синдрома. ÌÅÒÎÄÈÊÀ ÑÒÅÐÅÎÒÀÊÒÈ×ÅÑÊÎÃÎ ÎÄÍÎÊÐÀÒÍÎÃÎ ÎÁËÓ×ÅÍÈß ÖÅÐÅÐÁÐÀËÜÍÛÕ ÌÅÒÀÑÒÀÇΠÌÅËÀÍÎÌÛ Èçâåêîâà Î. Â., Wannenmacher M. Îáëàñòíîé îíêîëîãè÷åñêèé äèñïàíñåð, Ãîñóäàðñòâåííûé ìåäèöèíñêèé óíèâåðñèòåò, Êóðñê, Ðîññèÿ; Óíèâåðñèòåòñêàÿ ðàäèîëîãè÷åñêàÿ êëèíèêà, Öåíòð èññëåäîâàíèÿ ðàêà, Õàéäåëüáåðã, Ãåðìàíèÿ Рост заболеваемости и смертности населения от мела номы, когдато редкого заболевания, приобретает эпиде мические пропорции, особенно в США, Австралии, раз витых странах Европы и России. Удвоение заболеваемо сти происходит каждые 68 лет. Меланома способна ме тастазировать в любой орган и на любом сроке после, ка залось бы, радикального лечения, за что получила назва ние «сифилиса онкологии». Как известно, две трети он кологических пациентов принадлежат к пожилому и стар ческому возрасту, имеют сочетание злокачественного процесса с сопутствующей соматической патологией, пер вично множественными злокачественными опухолями. Это существенно ограничивает возможности диагности ки и лечения у них. Наличие дистантных отсевов значи тельно ограничивает качество и длительность жизни боль ных. Пациенты с церебральными метастазами оценива ются как прогностически крайне неблагоприятный кон тингент. Развиваясь достаточно быстро в условиях замк нутого внутричерепного пространства, в течение 12 ме сяцев церебральные очаги приводят к необратимому на рушению функций головного мозга. Результаты лучевого, хирургического, химиогормоно иммунотерапевтического лечения редко позволяют про длить жизнь таких больных на несколько месяцев. Мела нома известна малой чувствительностью к большинству применяемым сегодня химиотерапевтических препара тов. Наличие интактного гематоэнцефалического барь ера при небольших размерах церебральных метастазов также ограничивает поступление в них ряда фармаколо гических препаратов. Длительное время меланома счита лась радиорезистентной опухолью, и применение луче вой терапии при ней лимитировалось. Это обусловило со вершенствование активных лечебных и диагностических тактик, определяющих выживаемость больных. Стерео тактическое облучение церебральных поражений прово дят в мире относительно недавно и лишь в единичных спе циально оснащенных центрах, одним из которых являет ся ДКФЦ. Мы располагаем данными о 78 пациентах с ги стологически верифицированным первичным диагнозом меланомы и данными КТМРТ диагнозов 153 церебраль ными метастазами меланомы, леченными однократным стереотактическим облучением. Набор клинического ма териала начался в ДКФЦ с 1983 года. Все пациента на раз личных этапах лечения получали различные варианты комплексного лечения (химиогормоноиммунотерапия, хирургическое и лучевое лечение). Возрастные, эндокри нологические, гематологические изменения у больных генерализованными формами меланомы, а также при пер вичномножественных опухолях не являлись лимитиру ющими к применению стереотактической радиохирургии. Современные модальности лучевой терапии при цереб ральных метастазах включают дистанционное фракцио нированное облучение, интерстициальное стереотакти ческое облучение (перманентную имплантацию Ir 192, J 125 или брахикюритарепию (afterloading), чрезкожное стереотаксическое фракционированное облучение в тех нике гамманож или линакскальпель. Известно, что ус пех лучевого лечения на 25% определяется радиочувстви тельностью опухоли, на 50% техническим оснащением процесса лучевой терапии и на 25% точностью воспроиз ведения плана лечения от сеанса к сеансу. Современная радиохирургия является стандартной те рапевтической перспективой при сложности оператив ного удаления, прогрессии или рецидивах церебральных метастазов после конвенциональной терапии у больных с хорошим индексом Карновского и контролируемым те чением основного заболевания. Основой такого лечения является наличие современной диагностической и ра диотерапевтической аппаратуры, компьютерных про грамм планирования 3D (трехмерного) стереотактичес кого прецизионного облучения на основе КТ или МРТ срезов, изготовления иммобилизирующих устройств, применения микро мультилепестковых коллиматоров, специально подготовленного персонала. Работа по пред 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 103 Íåéðîîíêîëîãèÿ лучевому планированию облегчена и ускорена в ДКФЦ графическиориентироваными программами. Возмож но симультанное представление полей облучения на со ответствующих поперечных, сагиттальных и фронталь ных МРТ срезах. Beam’s Eye View (видимый глазом луч) симулирует на 3D модели пациента направление цент рального луча. Это дает возможность точно определять критические органы и изменять оптимальное располо жение полей в объеме цели по величине и форме. Дос тигается строго локальное расположение изодоз, тесно охватывающих опухоль в соответствии с ее анатомичес ким расположением и геометрической формой, резкий градиент доз по краю поля облучения во всех 3х проек циях. Реализация таких планов облучения немыслима без точнейшей фиксации головы пациента. Для наруж ного оптического наведения перекреста центральных лазерных лучей из 3х перпендикулярных плоскостей в геометрическом центре объема церебральной мишени перед стереотаксическим облучением головного мозга с точностью до 0,1 мм служит стереотаксическая cъемная локализационная координатная система. Методика хорошо переносилась всеми пациентами, не было отмечено ранних лучевых реакций. Клинико МРТ параллели течения церебральных метастазов убе дительно демонстрировали высокую клиническую эф фективность их комплексного лечения с применением однократного стереотаксического облучения. Наиболь шие регрессионные изменения церебральных метаста зов меланомы наблюдались при сроках МРТнаблюде ния более трех месяцев после проведения радиохирур гического лечения. Особенностью исследованных МР томограмм являлось статистически достоверное, на вы соком уровне значимости (р<0,0005, t>0,7) уменьшение содержания или полное исчезновение меланина и раз меров обогащенных гадолинием церебральных метаста зов меланомы после проведенного однократного стерео таксического облучения. Средняя выживаемость пациентов после стереотакси ческого однократного облучения церебральных метаста зов меланомы составила 9,5 месяцев, что превышает из вестные литературные данные. Методика была хорошо совместима с системным лечением по поводу единичных и множественных экстрацеребральных метастазов. Церебральные метастазы меланомы при достижении стабилизации или ремиссии со стороны экстрацеребраль ных отсевов не являлись финалом течения заболевания. Возможно увеличение длительности и значительное по вышение качества жизни больных с церебральными ме тастазами меланомы при использовании радиохирурги ческой методики их лечения до наступления нового эта па системного прогрессирования. ÈÍÔÎÐÌÈÐÎÂÀÍÍÎÅ ÑÎÃËÀÑÈÅ ÍÀ ËÓ×ÅÂÎÅ ËÅ×ÅÍÈÅ Ó ÁÎËÜÍÛÕ Ñ ÌÅÒÀÑÒÀÒÈ×ÅÑÊÈÌ ÏÎÐÀÆÅÍÈÅÌ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ  ÔÐà Èçâåêîâà Î. Â., Wannenmacher M., Äðîçäîâ Ñ. Â. Îáëàñòíîé îíêîëîãè÷åñêèé äèñïàíñåð, Ãîñóäàðñòâåííûé ìåäèöèíñêèé óíèâåðñèòåò, Êàôåäðà ïñèõîëîãèè Ãîñóäàðñòâåííîãî ïåäàãîãè÷åñêîãî óíèâåðñèòåòà, Êóðñê, Ðîññèÿ; Óíèâåðñèòåòñêàÿ ðàäèîëîãè÷åñêàÿ êëèíèêà, Öåíòð èññëåäîâàíèÿ ðàêà, Õàéäåëüáåðã, Ãåðìàíèÿ; Крайне неблагоприятный прогноз у пациентов с мета статическим поражением головного мозга связан как с генерализацией основного заболевания, так и с высоким риском неотложных ситуаций, которые должны быть ого ворены с больным до начала лечения. В развитых странах практикуется подписание пациентом так называемого информированного согласия на лечение, называемого в ФРГ «пониманием разъяснения». Этот документ вклады вается в протокол до начала лечения больного. Оптималь ным является после разъяснения пересылка его пациен том в клинику по факсу, во избежание подписания в со стоянии эмоциональной неадекватности. Аспекты сообщения диагноза не являются законода тельной нормой в России. Сегодняшнее состояние меди цины и общества пока не позволяют сделать их нераздель ной частью работы врача с больным. Еще недавно каза лось неэтичным сообщать больному правду о заболева нии. «Ложь во благо» породила «деонтологические» диаг нозы в онкологии, а полная информация классифициро валась как ятрогения. Информированность, конечно, из бавляет пациента и врача от многих недоразумений и вто рого от необоснованных претензий со стороны родствен ников больного в последующем. В онкологических учреж дениях необходима действенная психотерапевтическая служба, облегчающая психологическую адаптацию и пос ледующую реабилитацию больных на этапах диагности ки и лечения, особенно при неблагоприятном прогнозе заболевания. Она призвана помогать врачу, больным и их родственниками общаться в процессе специального ле чения, сохранять привычный уклад жизни пациента. Со временными онкологами и лучевыми терапевтами воп росы качества жизни в процессе и после специальных методов лечения ставятся выше, чем ожидаемая ее про должительность. Начавшиеся реформы отечественной медицины по буждают изучать и перенимать передовой опыт мировых клинических центров. Обращают внимание следующие строки в принятии разъяснения в ФРГ: «После объяснения врачом особен ностей моего заболевания, а также возможных изменений после лучевого лечения, мне точно понятны его цель и влияние, профилактические мероприятия, а также воз можные сопутствующие и последующие изменения. Мне было точно разъяснено о побочных эффектах, которые, несмотря на врачебное искусство, не могут быть абсолют но исключены, а также мои профессиональные измене ния и возможное ухудшение моего заболевания вслед ствие вмешательства. К тому же врач не может превзойти определенные гарантии по желаемым результатам свои ми усилиями. Я информирован о возможных поврежде ниях, которые вследствие моей особенной конституции имеют повышенную опасность, которые врач не мог пре дусмотреть. На все мои вопросы были получены соответ ственные ответы и разъяснения. Были обсуждены другие методики лечения, до и после облучения, факторы, опре деляющие их успех и возможные осложнения. Лучевое лечение с его последствиями и предусмотренное другое лечение отделены друг от друга. При анонимном научном озвучивании моего заболевания я понял все. Я отделяю врачей отделения от врачебной ответственности по моей безопасности». Пациентом подписывается лист с гербом старейшего в Европе университета, к которому относится радиологи ческая клиника, и с ее реквизитами. Пациентка указыва ет на отсутствие беременности. В случае недееспособно сти пациента, его детского возраста, подпись ставят ро дители или опекун вместе с подписью врача. Безусловно, социальноэкономические, исторические различия в финансировании, организации и функциони III ñúåçä íåéðîõèðóðãîâ Ðîññèè 104 Íåéðîîíêîëîãèÿ ровании онкологической и радиологической служб в Рос сии и развитых странах Запада ставят на повестку дня с особой остротой вопросы этики и деонтологии в лечении онкологических пациентов, определяемые финансирова нием служб, подготовкой специалистов, материально техническим оснащением процесса лечения, его доступ ностью и гарантиям качества оказания медицинской по мощи. ÃÅÍÅÒÈ×ÅÑÊÈÅ È3ÌÅÍÅÍÈß Â ÃËÈÎÌÀÕ ÐÀÇËÈ×ÍÎÉ ÑÒÅÏÅÍÈ ÇËÎÊÀ×ÅÑÒÂÅÍÍÎÑÒÈ È ÊËÈÍÈÊÎ-ÈÌÌÓÍÎËÎÃÈ×ÅÑÊÈÅ ÏÐÎßÂËÅÍÈß ÇÀÁÎËÅÂÀÍÈß Êàâñàí Â. Ì., Çîçóëÿ Þ. À., Ëèñÿíûé Í. È., Ãðèäèíà Í. ß., Ðîçóìåíêî Â. Ä., Ñåìåíîâà Â. Ì., Áîëòèíà È. Â., Äìèòðåíêî Â. Â., Øîñòàê Å. À. Èíñòèòóò íåéðîõèðóðãèè èì. àêàä. À. Ï. Ðîìîäàíîâà ÀÌÍ Óêðàèíû, Èíñòèòóò ìîëåêóëÿðíîé áèîëîãèè è ãåíåòèêè ÍÀÍ Óêðàèíû, Èíñòèòóò ýêîãèãèåíû è òîêñèêîëîãèè èì. Ë. È. Ìåäâåäÿ ÌÇ Óêðàèíû, Êèåâ, Óêðàèíà В с т у п л е н и е . Прогрессия глиальных опухолей свя зана с последовательным накоплением генетических из менений в их клетках. Задача настоящего исследования состояла в поиске специфических генов, дифференциаль но экспрессирующихся в тканях злокачественных опухо лей головного мозга, и включает проведение корреляци онного анализа между молекулярногенетическими изме нениями в глиомах различной степени злокачественнос ти и клиникоиммунологическими характеристиками за болевания. М а т е р и а л ы и м е т о д ы и с с л е д о в а н и я . Комп лексными методами исследований изучены показатели 135 пациентов с глиомами различной степени анаплазии. Из них – 19 с глиомами I степени анаплазии, 17 – с опу холями II степени анаплазии, 66 – с глиомами III степени анаплазии и 33 – с глиомами IV степени анаплазии. Во всех случаях опухоли были верифицированы стандартны ми гистологическими исследованиями. Для сравнения результатов комплексных исследований были изучены соответствующие показатели у 25 доноров. Идентификацию генов в глиальных опухолях прово дили при помощи дифференциальной гибридизации «организованных» библиотек кДНК головного мозга че ловека с пробами кДНК образцов глиальных опухолей. Для проведения цитогенетических анализов в клетках крови получение мононуклеаров периферической крови проводили стандартным способом в градиенте фиколлве рографина (d=1,077). Для определения пролиферативной и супрессорной активности лимфоцитов изучали реакцию бласттранс формации лимфоцитов в ответ на различные митогены. Результаты исследовании и их обсужде н и е . Из 52 тысяч проанализированных клонов кДНК библиотек эмбрионального и постнатального головно го мозга человека около 2000 клонов обнаружили разни цу в интенсивности гибридизационных сигналов с про бами нормальных и опухолевых тканей головного мозга человека. 21 клон кДНК отличался в клетках нормаль ного мозга от кДНК клеток глиобластомы. Дифферен циальная экспрессия генов была подтверждена для 16 нуклеотидных последовательностей, выделенных из биб лиотек кДНК эмбрионального и постнатального голов ного мозга человека. Выявлено изменение экспрессии наиболее вариабельных генов глиальных опухолей в за висимости от степени злокачественности (по отноше нию к гену Вактина в условных единицах). Так, эксп рессия трех из пяти исследованных генов в глиальных опухолях была снижена, и лишь одного гена – повыше на. Это – ген ДНКсвязывающего белка, который эксп рессирован при глиомах в 2 раза сильнее, чем в норме. Наиболее существенные изменения происходят в эксп рессии гена TSC22, отмечающиеся пропорционально степени анаплазии опухоли, причем в глиобластомах его содержание в 10 раз ниже, чем в ткани здорового мозга, и в 4 раза меньше, чем в анапластических астроцитомах. Была изучена также экспрессия генов куллина, аполи попротеина Е (АроЕ) и сmyc. По предварительным дан ным, именно ген TSC22 можно отнести к семейству ге новсупрессоров опухолевого роста. Цитогенетический анализ лимфоцитов периферичес кой крови больных с глиомами по мере увеличения сте пени их анаплазии показал тенденцию к увеличению про цента аберраций хромосом. Среднегрупповая частота ане уплоидных клеток у больных с опухолями статистически достоверно выше, чем в контрольной группе. Спектр абер раций хромосом у всех обследованных больных смещен в сторону хроматидных аберраций. Установлена также по ложительная достоверная корреляционная связь между степенью злокачественности и частотой хроматидных аберраций. При иммунологических исследованиях обнаружены два вида изменений: зависимые и независимые от степе ни злокачественности опухолей. Они могут быть объяс нены как действием на иммунную систему гуморальных факторов, выделяемых клетками глиом, так, вероятно, и возникновением определенных генетических нарушений в иммунной системе, что подтверждается результатами цитогенетического анализа клеток крови. При этом толь ко глиомы IV степени анаплазии характеризуются: 1) вы сокой пролиферативной активностью лимфоцитов при действии митогенов, например, ФГА; 2) повышенной способностью к спонтанной цитотоксичности и продук ции определенных провоспалительных цитокинов, таких как ФНО; 3) отсутствием чувствительности лимфоцитов крови к тормозящему иммунорегуляторному действию простагландинов. Установлено, что удаление значитель ной части опухоли не вызывает восстановления изменен ных иммунных показателей, а лишь уменьшает степень их выраженности. Проводилось также изучение особенностей клини ческого течения заболевания, данных компьютерной и магнитнорезонансной томографии и данных протоко лов оперативных вмешательств. По мере возрастания степени анаплазии глиом отмечался более выраженный перифокальный отек мозга, а рост опухоли сопровож дался некротическим кистообразованием. В крови больных отмечалась лимфопения, на фоне которой пос леоперационный период нередко осложнялся бронхоп невмонией. Практически всем больным в послеопера ционном периоде проводились курсы рентгено и хи миотерапии. В ы в о д . Проведенные молекулярногенетические исследования позволили обнаружить ряд новых, ранее неизвестных генов, участвующих в процессах опухоле вой прогрессии глиом головного мозга человека. Корре лятивный анализ показал тесную взаимосвязь клиничес кого течения заболевания с определенными изменения ми в опухолевом геноме, а также с соответствующими иммунологическими изменениями в системе крови больных с глиомами различной степени злокачествен ности. 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 105 Íåéðîîíêîëîãèÿ ÑÐÀÂÍÈÒÅËÜÍÛÉ ÀÍÀËÈÇ ÐÅÇÓËÜÒÀÒΠÒÐÀÍÑÊÐÀÍÈÀËÜÍÛÕ È ÒÐÀÍÑÍÀÇÀËÜÍÛÕ ÎÏÅÐÀÖÈÉ ÏÐÈ ÝÍÄÎ-ÑÓÏÐÀÑÅËËßÐÍÛÕ ÀÄÅÍÎÌÀÕ ÃÈÏÎÔÈÇÀ Êàäàøåâ Á. À., Ãðèãîðüåâ À. Þ., Òðóíèí Þ. Ê., Êàëèíèí Ï. Ë., Àëåêñååâ Ñ. Í., Äåðåâÿøêèíà Ë. È., Ãðèãîðüåâà Í. Í. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Если в 1980 г. трансназальным доступом оперировано около 30% от всех аденом гипофиза, то в настоящее вре мя этот показатель увеличился до 70%. Такая тенденция полностью оправдана при аденомах гипофиза, распола гающихся в структурах основания черепа. Однако, как показывает анализ нашего материала, существенно воз росла и доля эндосупраселлярных аденом гипофиза, уда ленных трансназально. В этих условиях целесообразно провести сравнительное исследование в группах больных с эндосупраселлярными аденомами гипофиза, которые удалялись как трансназальным, так и транскраниальным доступами. М а т е р и а л . В исследование включено 494 пациента, 436 из которых оперированы в период с 198894 гг. («ста рая» серия), и 58 больных в 2001 г. («новая» серия). Оценивались такие показатели, как динамика зрения и эндокринных функций, структура и частота различных осложнений, а также послеоперационная летальность. Р е з у л ь т а т ы . Динамика зрения: после транскраниаль ных операций зрение улучшилось у 57,9% больных, оста лись без динамики – 24,6%, ухудшилось зрение у 17,5%; при трансназальном доступе эти показатели распредели лись следующим образом: 54,1%, 38,7%, 7,2% соответствен но. Важно отметить, что в группе транскраниально опери рованных больных при этом значительно преобладали аде номы гипофиза большого и гигантского размеров – 40% против 11% при трансназальных операциях. В связи с этим было проведено исследование среди опухолей одинаково го, в основном среднего размера, которое выявило полную идентичность достигнутых результатов: улучшение – 70%, без динамики – 20%, ухудшение – 10%. Динамика эндокринных функций: различные симпто мы гипопитуитаризма после транскраниальных и транс назальных вмешательств стали менее выраженными у 8% и 25% больных, а ухудшение гормонального статуса про изошло у 20% и 5% соответственно. Это связано, скорее всего, с тем, что при транснкраниальных вмешательствах более грубо нарушаются функции центрального регуля торного звена, но также нельзя исключить и упомянутые выше различия по размеру опухолей. Осложнения: легкие осложнения – ликворея, менин гит, преходящие зрительные нарушения, гипопитуитар ные расстройства и др. при транскраниальных вмешатель ствах отмечены у 28%, а после трансназальных операций у 16% больных. Среднетяжелые и тяжелые осложнения при транскраниальном доступе чаще всего были представ лены: гематомой, ишемическим синдромом, эмоциональ ноличностными нарушениями и отмечены у 5,6%. Сред нетяжелые и тяжелые осложнения при трансназальных операциях представлены в основном тяжелыми менин гитами на фоне послеоперационной ликвореи и гемато мами в ложе опухоли и встретились у 4% больных. Летальность с 1988 по 2001 г. при транскраниальных операциях составила около 3,5% (основные причины по частоте: ишемические, соматические, менингиты, трав ма сосуда и кровоизлияние в остатки опухоли). Средняя летальность при трансназальных вмешательствах состав ляет около 1,5% (основные причины по частоте: сомати ческие, гематома в ложе удаленной опухоли). В ы в о д ы . Несмотря на то, что некоторые показатели после транскраниальных вмешательств хуже, нежели пос ле трансназальных, следует еще раз подчеркнуть опреде ленную разнородность сравниваемых групп по размеру опухоли. Можно предположить, что при равных услови ях эти типы операций по результатам существенно не от личались бы. В связи с краткостью катамнеза у значительной части больных нами не изучалась частота рецидивирования, однако предварительные данные, полученные среди всех аденом, показывают, что в группе эндосупраселлярных аденом гипофиза средний срок до появления рецидива после транскраниальных операций составляет 9,7 лет, а после трансназальных – 5,6 лет. В течение первых 5 лет после операции рецидивируют около 5% опухолей, уда ленных транскраниальным и около 8%, удаленных транс назальным доступами. Это связано, скорее всего, с тем, что при транскраниальных вмешательствах мы обычно ис секаем супраселлярную часть капсулы опухоли, т. е. про водим более радикальную операцию. ÀÍÀËÈÇ ÎÑËÎÆÍÅÍÈÉ È ÏÐÈ×ÈÍ ÏÎÑËÅÎÏÅÐÀÖÈÎÍÍÎÉ ËÅÒÀËÜÍÎÑÒÈ ÏÐÈ ÀÄÅÍÎÌÀÕ ÃÈÏÎÔÈÇÀ Êàäàøåâ Á. À., Êàñóìîâà Ñ. Þ., Ãðèãîðüåâ À. Þ., Øèôðèí Ì. À. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Исследование проведено среди 2208 больных, опери рованных в НИИ НХ им. Н. Н. Бурденко с 1988 по 1997 г. (умерло 86 больных, летальность 3,9%). Из них: а) 1981 больной был оперирован первично (умер 71 че ловек, летальность 3,6%); из них транскраниально опе рирован 751 больной (умерло 48, летальность 6,4%); транс назально – 1230 больных (умерло 23, летальность 1,9%). б) 249 больных были оперированы повторно (умерло 14, летальность 5,6%); из них транскраниальные опера ции проведены в 111 случаях (умерло 11, летальность 9,9%); трансназальные в 138 (умерло 3, летальность 2,2%). в) В 39 случаях, преимущественно при гигантских аде номах с одновременной масссивной инвазией как интрак раниально, так и в структуры основания черепа, произве дено двухэтапное удаление опухоли – чаще всего сначала транскраниальным, а затем трансназальным доступами (умер 1, летальность 2,6%). Основные причины смерти среди этих 86 наблюдений были следующие: После транскраниальных вмешательств они распреде лились следующим образом: нарушение мозгового кро вообращения (НМК) по геморрагическому типу – 20 набл. (33,8%) (из них гематомы – 6 набл. (10,2%), кровоизлия ние в остатки опухоли – 12 набл. (20,2%), травма сосудов – 2 набл. (3,4%)); НМК по ишемическому типу – 14 набл. (23,7%), из них в одном случае ишемия развилась вслед ствие клипирования магистрального сосуда; НМК по сме шанному типу – 4 набл. (6,8%); соматические – 7 набл. (11,9%); НМК + соматические причины – 4 набл. (6,8%); менингиты – 7 набл. (11,9%); анафилактический шок – 1 набл. (1,7%); без вскрытия – 1 набл. (1,7%) – наиболее вероятной причиной летального исхода явилась тромбэм болия ветвей легочной артерии, разрыв недиагносциро ванной (как при обследовании, так и при удалении аде номы гипофиза) аневризмы супраклиноидного отдела внутренней сонной артерии – 1 набл. (1,7%). После трансназальных операций: кровоизлияние в ос татки опухоли – 5 набл. (17,9%); травма сосуда с образо ванием гематомы в ложе удаленной опухоли – 2 набл. III ñúåçä íåéðîõèðóðãîâ Ðîññèè 106 Íåéðîîíêîëîãèÿ (7,1%); НМК по ишемическому типу – 3 набл. (10,7%), из них в одном случае была травма внутренней сонной артерии с развитием ее тромбоза и последующего НМК; НМК по смешанному типу – 1 набл. (3,6%); соматичес кие – 5 набл. (17,9%); менингиты – 7 набл. (24,9%); раз рыв недиагносцированной артериовенозной мальформа ции в области прозрачной перегородки – 1 набл. (3,6%); отек головного мозга после эпилептического статуса – 1 набл. (3,6%); без вскрытия – 3 набл. (10,7%), из них наи более вероятными причинами летальных исходов яви лись: НМК по ишемическому типу, сердечнососудистая недостаточность и гемотампонада желудочковой системы. Кроме того, у ряда выживших после операции больных отмечались изолированные или комбинированные ослож нения различной степени тяжести, характер которых зави сел от доступа к опухоли. Легкие осложнения после транс краниального доступа были следующие: снижение остроты зрения – 20%, нарастание или появление гормональных нарушений – 17,9%, гематома лобной области – 1,9%, эпи дуральная гематома – 1,9%, гематома в ложе удаленной опу холи – 0,6%, ишемия подкорковой области – 0,6%, ишемия лобной области – 0,6%, нарушения функций глазодвига тельных нервов – 13,6%, эмоциональноличностные нару шения – 4,9%, эпилептический приступ – 0,6%, гемипарез – 0,6%, ликворея – 1,2%; после трансназального доступа они были следующими: снижение остроты зрения – 3,8%, на растание или появление гормональных нарушений – 9,8%, назальная ликворея – 3,5%, гематома в ложе удаленной опу холи – 0,3%, менингит – 0,3%, нарушения функции глазод вигательных нервов – 1,5%, эмоциональноличностные на рушения – 1,3%, нарастание болевого синдрома – 0,3%, усу губление соматической патологии – 1,3%, интраназальные осложнения – 1%. Среднетяжелые и тяжелые осложнения после транс краниального доступа были следующими: снижение ост роты зрения – 11,2%, гематома в лобной области – 2,5%, глазодвигательные нарушения – 1,6%, кровоизлияние в остатки опухоли – 0,6%, гематома в ложе удаленной опу холи – 0,6%, ишемия подкорковых структур – 1,9%, тром боз внутренней сонной артерии – 0,6%, тяжелый менин гит – 0,6%, гемиплегия – 5,6%, эпилептический приступ – 0,6%, соматические – 1,9%, ликворея – 0,6%; после трансназального доступа они распределились так: сниже ние остроты зрения – 1,5%, гематома в ложе удаленной опухоли – 1%, тяжелый менингит – 2%, глазодвигатель ные нарушения – 0,4%, ишемия подкорковой области – 0,3%, пневмония – 0,3%, ликворея – 3%, гемиплегия – 0,3%, ларингоспазм – 0,3%. Таким образом, выявлены определенные различия в характере осложнений в зависимости от доступа к опухо ли. Так, при транскраниальном доступе преобладают: сни жение остроты зрения, глазодвигательные, эмоциональ ноличностные нарушения, послеоперационные гемор рагические осложнения (гематомы); при трансназальном доступе на первый план выходят ликворея и менингит. При транскраниальных операциях основные причины смерти связаны с различными сосудистыми нарушения ми или кровоизлиянием в остаток опухоли. При трансна зальных вмешательствах на первое место выходят менин гит, кровоизлияние в остаток опухоли и соматические проблемы. Кроме этого, выявлена зависимость частоты случаев летального исхода от размера опухоли (если при опухолях небольшого размера она составила 1,2%, то при опухолях гигантского размера – 20,6%); от возраста (в возрастной группе до 60 лет летальность равна 3,4%, а в группе стар ше 60 лет – 7,8%). ÊËÈÍÈ×ÅÑÊÀß ÑÈÍÄÐÎÌÎËÎÃÈß ÊÐÀÍÈÎÔÀÖÈÀËÜÍÛÕ ÎÏÓÕÎËÅÉ Êàäàøåâà À. Á., ×åðåêàåâ Â. À. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Хирургия опухолей краниофациального распростране ния всегда относилась к компетенции специалистов раз ного профиля, что зависело от преимущественной лока лизации новообразований: глазница, придаточные пазу хи носа, костные структуры лицевого скелета, основания черепа. Поражение тех или иных указанных анатомичес ких структур вело к распределению больных между оку листами, отоларингологами, челюстнолицевыми хирур гами, общими онкологами. нейрохирургами. На основе обобщенного нейрохирургами опыта при современных возможностях компьютерных рентгеновской и магнитно резонансной томографии активно развивается новое на правление в медицине – краниофациальная онкология. В краниофациальной онкологии можно выделить два раздела: доброкачественные и злокачественные опухоли. Тактика лечения этих больных принципиально отлича ется, и неправильно выбранный план лечения может по влечь тяжелые последствия для больного, поэтому важно по данным клиники, КТ и МРТ в первую очередь опреде лить показания к биопсии. Клинические проявления этой патологии недостаточ но изучены вследствие сложности этой комплексной про блемы, синдромология практически не описана в лите ратуре, хотя очевидна ее значимость для ранней диагнос тики новообразований, разработки хирургической такти ки, определения прогноза заболевания, а также оценки послеоперационной клиники и тяжести возникающих неврологических осложнений. Важную информацию привносят клинические иссле дования. В литературе выделены синдромы поражения структур основания черепа, глазницы, пазух, характерные для каждого из типов опухолей основания черепа, распро страняющихся в глазницу, придаточные пазухи носа, под височную ямку и др. При оценке анамнестических и кли нических данных признаки манифестации заболевания можно выявить значительно раньше очевидных для всех экзофтальма или деформации лицевого скелета. За истекший период было проанализировано 53 боль ных, из них 14 пациентов (27%) со злокачественными опу холями, 26 больных (49%) с преимущественно экстрак раниальным распространением опухоли. Анализ изученного материала позволил выявить цереб ральную патологию не только при выраженном интрак раниальном компоненте опухолей. Также представляет ся возможным оценить динамику развития симптомов в зависимости от направления роста опухоли (интраэкст ра или экстраинтракраниального), от темпов роста опу холи. У больных с выраженным интракраниальным компо нентом, с наличием опухоли в ПЧЯ, СЧЯ наличие соот ветствующей неврологической симптоматики является закономерным. Представляет интерес наличие признаков заинтересованности церебральных структур при интакт ной твердой мозговой оболочке у больных с преимуще ственно экстракраниальной локализацией опухоли: уже на ранних стадиях заболевания можно отметить появле ние цефалгического синдрома, эмоциональноличност ных, мнестических расстройств, астенического синдро ма, нарушение ритма снабодрствования, нередко наблю даются пароксизмальные состояния, пирамидная симп томатика. 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 107 Íåéðîîíêîëîãèÿ Повидимому, такие проявления могут быть связаны с различными патогенетическими механизмами: опосредо ванными сосудистыми расстройствами, нарушением иннер вации твердой мозговой оболочки, раздражением медиоба зальных, диэнцефальных, лобных структур. Эти предполо жения находят свое подтверждение при анализе результа тов проводимых у пациентов дополнительных методов об следования: ультразвуковой транскраниальной допплерог рафии, электроэнцефалографии; выявляется изменение кровотока по близким к очагу поражения артериям, затруд нение венозного оттока, признаки патологической биоэлек трической активности мозга в соответствующих зонах. Указанные синдромы, выявляемые при клиническом обследовании больных, делают возможной раннюю ди агностику краниофациальных новообразований, позво ляют более точно судить о характере и направлении роста патологического процесса, выявлять достоверные призна ки возможных рецидивов опухолей, своевременно на правлять больных на компьютерную рентгеновскую или магнитнорезонансную томографию. ÎÑÎÁÅÍÍÎÑÒÈ ÊËÈÍÈ×ÅÑÊÎÃÎ ÏÐÎßÂËÅÍÈß ÊÈÑÒÎÇÍÛÕ ÎÏÓÕÎËÅÉ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Êàäûðáåêîâ Ð. Ò., Ìèðçàåâ À. Ì. Ðåñïóáëèêàíñêèé íàó÷íûé öåíòð íåéðîõèðóðãèè, Êàôåäðà íåéðîõèðóðãèè, ÂÏÕ ÒàøÃîñÌÈ-1, Òàøêåíò, Óçáåêèñòàí К полостьсодержащим патологическим образованиям головного мозга, по предложению академика Ю. А. Зозу ли, относят кистообразующие опухоли головного мозга, абсцессы, хронические внутричерепные гематомы, пара зитарные кисты. В последнее время по территории ЦентральноАзиат ского региона отмечается рост числа диагностированных случаев полостьсодержащих образований. Это связано с увеличением арсенала современных высокоинформати вых методов диагностики. Тем не менее, большинство больных обращается за медицинской помощью несвоевременно, в стадии суб или декомпенсации в клинической картине. Вопросы дифференциальной диагностики этих образований пред ставляют значительные трудности в связи с похожей кли нической картиной и нередко – отсутствием достоверных признаков при КТ и МРТ исследованиях. Целью исследования является изучение характерных клинических симптомов полостьсодержащих образова ний головного мозга и выбор рациональной хирургичес кой тактики в зависимости от нозологической формы и степени компенсации. М а т е р и а л и м е т о д ы и с с л е д о в а н и я . Обследо вано 155 больных с кистозными опухолями, из них: 34 больных эпилептическим синдромом (1я группа), 45 больных с менингиальным синдромом (2я), 36 – с синд ромом психопатологических нарушений (3я), 40 – с син дромом поражений задней черепной ямы. Средний возраст обследованных 1й группы составил 31±4,2 года; 2й – 34,2±3,2 года; 3й – 40,4±2,4 года; 4й – 43,4±2,2 года. Состояние гемодинамики головного мозга изучали методом реоэнцефалографии на четырехканальном реог рафе 4Р2М с использованием в качестве регистрирую щего устройства восьмиканальный ЭЭГ8 «Медикор». Всем группам больных произведено аксиальное ком пьютерное томографическое исследование. Р е з у л ь т а т ы и о б с у ж д е н и е . Первая группа (34 больных с элептическим синдромом) – эпилептический симптомокомплекс характеризовался генерализованны ми или очаговыми припадками, наблюдающимися дли тельное время (иногда десятилетия и больше) без каких либо других признаков новообразования. Такие больные трактуются обычно как «генуинные» эпилептики либо припадки связываются с перенесенным нейроинфекци онным процессом. В ряде случаев кистозные опухоли могут протекать настолько компенсированно, что произ веденная пневмоэнцефалограмма не обнаруживает пато логических изменений либо они оказываются столь сла бо выраженными, что им не придается должного внима ния. Подобные ошибки приводят к позднему распозна ванию опухолей, которые уже неоперабельны. Во второй группе течение болезни, как правило, уско рено, с быстрым развитием клинической картины и час тыми осложнениями. Это подтверждается и длительнос тью заболевания до постановки диагноза: у пациентов первой группы она составила 2,6±0,42, а во второй – 0,3±0,12 г. Менингиальный синдром, возникающий нередко очень рано на фоне умеренной головной боли, общей сла бости, рассматривается как проявление серозного или туберкулезного менингита. Такие больные попадают в различные стационары, где им производят серии пояснич ных проколов (иногда с введением в спинномозговой ка нал лекарственных веществ), которые довольно часто при водят к резкому ухудшению их состояния в связи с дисло кацией мозга. В третьей группе течение болезни более мягкое, с мед ленным развитием клинических симптомов. Длитель ность заболевания до постановки диагноза составляет 3,4±0,5 г. Не менее сложным в диагностическом отношение яв ляется раннее возникновение нарушений психики при кистозных опухолях. Как правило, эти пациенты попада ют в психиатрические больницы. Нейропатологическая настороженность психиатров и консультация нейрохи рурга могут предотвратить диагностические ошибки. Синдром поражения задней черепной ямки, оформля ющийся при супратенториальных кистозных опухолях, нередко в виде вынужденного положения головы и ство ловых дислокационных симптомов, приводит к роковым ошибкам и, с другой стороны, требует безотлагательного уточнения локализации поражения и оперативного вме шательства. Наличие стволовых дислокационных феноменов, даже слабо выраженных, является грозным симптомокомплек сом, особенно при кистозных новообразованиях, т. к. ухудшение состояния и его лавинообразное нарастание может привести к гибели в течение нескольких минут. Клиническое течение кистозных супратенториальных опухолей, кроме перечисленных, имеет еще ряд особен ностей, которые отличают их от солидных. Прежде всего следует подчеркнуть общую закономерность – значитель ное превалирование общемозговых симптомов над оча говыми. Последние обычно выражены нерезко и харак теризуется относительной мягкостью и нечеткостью. Другой очень важной особенностью клиники кистоз ных опухолей является ремиттируюшее течение. Регрес су подвергаются как общемозговые, так и очаговые сим птомы, что приводит нередко к отрицанию опухолевой природы заболевания, а уменьшение или исчезновение симптоматики приписывается успешному консерватив ному лечению. В ы в о д ы . Таким образом, основным механизмом в возникновении указанных феноменов является колеба ние объема кистозной полости. Как показали результаты III ñúåçä íåéðîõèðóðãîâ Ðîññèè 108 Íåéðîîíêîëîãèÿ исследования, регресс общемозговых и очаговых симп томов возникает не только при уменьшении кисты или стабилизации ее объема, но даже при увеличении после днего. Указанные изменения являются пусковым меха низмом сосудисторефлекторных, ликвороциркулятор ных и других изменений. Скорость наполнения кистозной полости имеет, по видимому, решающее значение в темпе развертывания клинической картины заболевания. Приведенные данные свидетельствует о том, что распознавание кистозного про цесса представляет значительные трудности. Дифференциальный диагноз между компактной (со лидной) и кистозной опухолью, по нашим наблюдениям, не только возможен, но и нужен. Два момента определя ют диагноз супротенториальной кисты: 1. Преобладание общемозговых симптомов над очаго выми. 2. Ремиттирующее течение заболевания. Совершенно очевидно, что приведеные признаки яв ляются основанием лишь для предложения кистозного характера процесса. ÈÍÒÅÃÐÀÒÈÂÍÀß ÏÀÒÎËÎÃÈß Â ÊËÈÍÈÊÅ ÍÅÉÐÎÎÍÊÎËÎÃÈ×ÅÑÊÈÕ ÁÎËÜÍÛÕ Êàí Å. Ë., Êàìàëîâà Ã. Ì., Ìàñëîâà Ë. Í., ×èêîâà Å. Á., Êóçÿåâ À. È. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã В работе представлены результаты комплексного ис следования динамики состояния различных систем орга низма в процессе формирования защитноприспособи тельных и адаптивных реакций при стрессовых воздей ствиях на ЦНС, вызванных объемными новообразовани ями в головном мозге. Опухоли головного мозга вовлекают в патологический процесс психическую и висцеральнометаболическую сферы, приводящие нередко к развитию церебровисце ральной патологии (ЦНД) и собственным заболеваниям сердечнососудистой системы (ССС), в частности гипер тонической болезни (ГБ). Своевременной и актуальной является проблема ран ней, доклинической диагностики патологии ССС у боль ных с опухолевым поражением головного мозга. Наиболь шие затруднения представляет дифференциальная диаг ностика ЦНД по гипертензионному типу и ГБ разной на правленности. Нераспознавание и непроведение соответ ствующей корригирующей терапии может привести к тя желым осложнениям во время операции и в послеопера ционном периоде. Материалом анализа явились результаты комплексно го психологического, клиникофизиологического и био химического исследования 72 больных с аденомой гипо физа (средний возраст 39,5±1,9 лет) и 73 больных с ме нингиомой (средний возраст 50,5±1,3 лет). Общее состо яние больных было компенсированным, без гипертензи онного синдрома. Все больные проходили стационарное лечение в нейроонкологическом отделении института в 199498 гг. Показано, что у 59,0±3,2% больных менингиомой вы явлен гиперкинетический тип кровообращения и у боль ных аденомой гипофиза – у 46,3±2,3%. Менее благопри ятный в отношении прогноза является гипокинетический характер кровообращения, который имел место при аде номе гипофиза в 31,5±2,2% наблюдений и в 41,7±2,3% у больных менингиомой. Уровень реактивности ССС оце нивался по характеру ответной гемодинамической реак ции на применение функциональной нагрузочной про бы (стресстест). Неадекватный гипокинетический характер показате лей центральной гемодинамики у нейроонкологических больных как в базисном исследовании (до нагрузки), так и после моделируемого стрессового воздействия являет ся предпосылкой к возможному развитию гемодинами ческих осложнений во время оперативного вмешательства и в восстановительный период. Гипокинетическая реак ция на стресстест свидетельствует о неэффективной адаптации к стрессовым ситуациям (в т. ч. к самой опера ции) и о снижении резервных возможностей организма. Функциональная проба позволила выявить скрыто протекающую ГБ, которая никак не проявлялась в состо янии покоя, у 33% больных аденомой гипофиза и у 54% больных менингиомой. Для получения интегрального заключения в автоматизированном режиме о функцио нальном состоянии ССС нами был разработан алгоритм и его программное обеспечение с учетом реакции на мо делируемое психоэмоциональное напряжение. Системность при поражении головного мозга подтвер ждена и путем исследования катехоламинового обмена. Стресстест обусловил активацию как гормонального, так и гуморального звеньев регуляции. Соответственно при рост экскреции адреналина к исходному уровню соста вил 151% и норадреналина – 153%. Психологическое тестирование состояния и личност ных свойств позволило отметить определенные наруше ния. У больных аденомой гипофиза доминирует тревож нодепрессивный фон поведения, подавленность, высо кий уровень беспокойства, раздражительность, насторо женность. У больных менингиомой повышен тонус эмо циональной возбудимости и моторной подвижности, уко рочение латентного периода простой сенсомоторной ре акции, высокий уровень фрустрации. Проведенное исследование показало, что гипокинети ческий тип кровообращения является неблагоприятным фактом для прогнозирования течения как оперативного вмешательства, так и для непредсказуемых послеопера ционных осложнений (гипертонические кризы, острая перегрузка левых отделов сердца, острые нарушения моз гового кровообращения). ÈÑÏÎËÜÇÎÂÀÍÈÅ ÊÀÂÈÒÐÎÍÍÎÉ ÑÈÑÒÅÌÛ CUSA EXCEL  ÍÅÉÐÎÎÍÊÎËÎÃÈÈ Êàðàõàí Â. Á., Øóâàåâ Ê. Þ., Êóâøèíîâ Ê. Â. Êàôåäðà íåâðîëîãèè è íåéðîõèðóðãèè ÌÃÌÑÓ, Ãîðîäñêîé íåéðîõèðóðãè÷åñêèé öåíòð, Ìîñêâà В настоящее время роль нейрохирургических техноло гий, обеспечивающих безопасное удаление обширных опухолевых масс, возрастает в связи с преобладанием но вообразований крупных и гигантских размеров, окружен ных ранимыми невральными и сосудистыми структура ми. Клиническое использование феномена кавитации качественно улучшает процесс удаления новообразова ний, однако проблема мощности и селективности воздей ствия требует дальнейшего углубленного решения. При клинической апробации усовершенствованной модели ультразвукового аспиратора CUSA Excel с ее по мощью удалены опухоли (18 внутричерепных, 2 спиналь ных) достаточно широкого гистологического и топогра фического спектра (менингиомы менинготелиоматозные, ангиоматозные, астроцитомы, эпендимомы, глиобласто мы, рак, меланома при конвекситальном, парасагитталь ном, краниобазальном, кранионазальном, внутрижелу дочковом, ретробульбарном орбитальном расположении 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 109 Íåéðîîíêîëîãèÿ внутричерепных очагов; грудной и поясничный уровни спинальных опухолей). Все операции проведены под эн доскопическим видеомониторингом с двойным оптичес ким контролем при увеличении до х10. В зависимости от гистологической структуры новооб разования выделены следующие особенности выполне ния этапа кавитронной аспирации. При менингиомах ос новным техническим приемом является ультразвуковая (УЗ) «микропрепаровка» опухолевого узла с последова тельным удалением мягкотканных элементов с обнаже нием стромальных балок. Очаговая УЗ деваскуляризация участков опухоли обеспечивает последующее поэтапное иссечение крупных ее фрагментов с помощью обычных микроножниц. Внутриузловая микропрепаровка крупных опухолевых сосудов позволяет провести временное их клипирование и быструю фрагментацию опухолевого узла. Внеузловая микропрепаровка наслоений пережива ющей мозговой ткани при вовлечении арахноидальной оболочки в капсулу менингиомы предусматривает обна ружение и последовательную коагуляцию множественных мелких и среднего калибра питающих сосудов. При вы явлении кальцинатов в опухолевом узле (если узел нельзя удалить единым блоком) даже применение наиболее мощ ного фрагментатора (частотой 23 кГц) не обеспечивает их дезинтеграцию, но легко выполняется их вычленение раз рушением менее плотных окружающих масс. Избиратель ный подбор мощности и программы деструкции – аспи рации (имеется 4 режима рабочих циклов с различной длительностью паузы) обеспечивает отделение глиальных новообразований от перифокальных тканей с надежным гемостазом за счет приваривания просвета мелких сосу дов. При ангиоматозных менингиомах, инвазивном раке с врастанием в селлярную зону контроль кровотечения достигается при сочетании эффекта коагуляции сосудов с введением в обрабатываемый участок опухоли полоски Surgicel. Крупные многоузловые вегетации меланомы лег ко удалимы с помощью микроаспиратора (частота 36 кГц). В зависимости от топографии новообразования ис пользованы следующие технологические приемы. При краниобазальных новообразованиях оптимальным явля ется рабочий орган с частотой 36 кГц и изогнутым нако нечником. Особенно эффективен данный инструмент при удалении новообразований через субфронтальный транс сфеноидальный доступ (клиновидная площадка резеци руется с помощью высокооборотной фрезы Stryker). При парасагиттальных менингиомах перед и в процес се удаления полюсных краеобразующих отделов опухоли при тракции ее с формированием зазора с окружающей мозговой тканью проводится эндоскопический контроль для адекватной оценки расположения и калибра окружа ющих опухоль парасагиттальных вен; при ультразвуковом выделении латеральных отделов опухолевого узла микро препаровку его нижней поверхности также проводили под эндоскопическим контролем через формирующуюся щель между мозгом и новообразованием для визуализа ции возможных питающих опухоль корковых артерий. При эпендимомах IV желудочка кавитронный дезин тегратор обеспечивает безопасное и быстрое обнажение задних нижних мозжечковых артерий вблизи срединной апертуры желудочка, позволяет определить и сохранить деформированных ткани миндалин мозжечка и умень шить протяженность рассечения его червя. Для удаления опухолей повышенной плотности необ ходим изогнутый наконечник к высокомощностным фрагментаторам. Субфронтальный доступ к орбите допус кает использование любого из созданных наконечников. При подходе к зрительному нерву и глазничной артерии целесообразно переходить на режим кавитации с удлинен ной (до 40 мсек) паузой. При спинальных ангиоматозных менингиомах после внепроекционной эндоскопической оценки полюсов но вообразований и исключения подхода крупных питающих артерий проводили удаление опухоли по длиннику с пос ледующим укладыванием в ложе полоски Surgicel. Таким путем удается полностью удалить опухоль протяженнос тью 22,5 см за 12 мин. Следует отметить, что высокая эффективность кавит ронной дезинтеграции достигается при использовании ее в комплексе с другими современными технологиями (вы сокооборотная микродрель, высокоразрешающие эндос копы и др.) и расходными материалами (полоски Surgicel, пластины TachoComb, мембраны Gore Tex). Преимущества системы CUSA Excel по сравнению с существующими аналогами состоят в возможности ис пользования разномощностных фрагментаторов с быст рой их сменой в процессе операции; подбора оптималь ного кавитационного режима, способного преодолеть механическое сопротивление опухолевой ткани без по вреждения окружающих структур. Все это повышает бе зопасность, уменьшает длительность удаления внутриче репных, спинальных новообразований и интраопераци онную кровопотерю. ÍÅÊÎÒÎÐÛÅ ÊËÈÍÈ×ÅÑÊÈÅ ÀÑÏÅÊÒÛ ÌÅÒÀÑÒÀÇÈÐÎÂÀÍÈß ÌÅËÀÍÎÌÛ ÊÎÆÈ Â ÃÎËÎÂÍÎÉ ÌÎÇà Êàðï Â. Í., Ñóñèí Â. Ì., Ïðîíüêî À. Â., Äèêîâèöêàÿ È. Ã. 5 Öåíòðàëüíûé âîåííûé êëèíè÷åñêèé ãîñïèòàëü ÂÂÑ, Êðàñíîãîðñê По данным экспертов ВОЗ, в настоящее время отме чается и прогнозируется на будущее рост злокачествен ных новообразований кожи. Доля меланом в общей струк туре злокачественных новообразований человека состав ляет 13%, причем этот показатель удваивается каждые 10 15 лет. Несмотря на то, что кожа является идеальным ор ганом для ранней диагностики злокачественных новооб разований, летальность при меланомах кожи составляет 17,3% и обусловлена бурным гематогенным и лимфоген ным метастазированием, достигая в этих случаях 100%. Статистические сведения о частоте метастатических опухолей головного мозга отличаются широким диапазо ном и составляют от 1,2 до 37% от общего числа всех опу холей головного мозга. Из них до 20% источником мета стазирования являются меланомы. Мы наблюдали 2 случая метастазов меланомы кожи в головной мозг. При этом отмечены некоторые особенно сти: метастазировала узловая меланома кожи спины, ранее выполнено радикальное удаление первичного очага с последующим комбинированным лечением, время клинического проявления метастазов в голов ной мозг – около 3 лет, основными клиническими проявлениями являлись выраженные головные боли и другая общемозговая сим птоматика при минимальных очаговых проявлениях, метастазы были множественными, что подтвержде но в одном случае при КТ, в другом – при вскрытии, резкое ухудшение состояния больных было обуслов лено кровоизлиянием в опухоль, летальный исход. Расчитывать на благоприятный результат лечения мож но только при раннем радикальном удалении первичного очага. Учитывая неуклонный рост заболеваемости, выяв ление признаков меланомы должно явиться первоочеред III ñúåçä íåéðîõèðóðãîâ Ðîññèè 110 Íåéðîîíêîëîãèÿ ной задачей любого врача, вне зависимости от профиля специальности. ÈÑÑËÅÄÎÂÀÍÈÅ ÃÎÐÌÎÍÎ×ÓÂÑÒÂÈÒÅËÜÍÎÑÒÈ ÌÅÍÈÍÃÈÎÌ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Êâàøà Ì. Ñ. Èíñòèòóò íåéðîõèðóðãèè èì. àêàä. À. Ï. Ðîìîäàíîâà ÀÌÍ Óêðàèíû, Êèåâ, Óêðàèíà Менингиомы головного мозга (МГМ) не принадлежат к числу абсолютно гормонозависимых опухолей, но в на учной литературе возрастает количество данных, указы вающих на то, что эндокринные нарушения имеют важ ную роль в этиологии и патогенезе этого заболевания. Наиболее часто для лечения МГМ применялись антиэст рогены – тамоксифен и синтетические прогестагены (Ru 486, норколут), но не было получено убедительных резуль татов эфективности лечения, а было лишь высказано мне ние о 3040% успешности гормональной терапии. При чиной низкой эффективности стало отсутствие четких критериев индивидуального отбора больных, выбора пре паратов и отсутствие определения гормоночувствитель ности опухоли. В последующем для характеристики гор мональной чувствительности МГМ критерием для иссле дователей была концентрация рецепторов стероидных гормонов (РСГ) в цитозоле. Имеющиеся публикации о содержании рецепторов прогестерона (РП) и эстрогенов (РЭ) в МГМ часто противоречивы и не дают четкого от вета на вопрос о целесообразности определения рецепто ров и назначения гормональной терапии. Задачей исследования было изучение наличия и кон центрации РП и РЭ в ткани менингиомы в зависимости от различных клиникоморфологических характеристик опухоли и прогноза заболевания. Объектом исследования были 18 пациентов (12 жен щин и 6 мужчин), которым для определения гормоноза висимости МГМ выполнено иммуногистохимическое исследование удаленных менингиом на наличие рецеп торов эстрадиола и прогестерона (РЭ и РП). В предопе рационном периоде больным обследуемой группы про ведено исследование уровня эстрадиола и прогестерона в сыворотке крови. В результате исследования удалось выявить РЭ и РП в ткани МГМ, а также появилась возможность судить о свя зи количественного и качественного состава рецепторов со степенью дифференцировки менингиомы. Наши наблю дения свидетельствуют о том, что для низкодифференци рованных – анапластических менингиом (3 набл.) харак терно отсутствие, для атипических (4 набл.) – низкий уро вень (3050%), а для высокодифференцированных – вы сокий уровень (70100%) РЭ и особенно РП (11 набл.). Высокое содержание РП и РЭ в ткани менингиомы должно, рассматриваться как указание на гормоночув ствительность, и напротив, отсутствие в опухолях обоих видов рецепторов – на резистентность к гормонотерапии. Концентрация РП и РЭ в опухоли зависела от степени инвазии опухоли в кость и в мозговое вещество. Так, кон центрация рецепторов выше при неглубокой или умерен ной инфильтрации прилежащих тканей. Нами не выявлено корреляций между уровнями РЭ и РП в опухолях с учетом возраста пациентов, массы тела, пола и длительности менопаузы. Однако отмечено дос товерное снижение количества РП у больных в менопау зе с низкодифференцированными МГМ, особенно четко прослеживается эта закономерность в соотношении РП/ РЭ, которое у больных этой группы в несколько раз ниже, чем у больных в климактерическом периоде. Уровень РП в МГМ больных, находившихся в климактерическом пе риоде и получавших дексаметазон до операции, достовер но выше, чем у больных в менопаузе. Возможно, этим объясняется тот факт, что гормональное лечение более эффективно у молодых. Предварительные результаты указывают на то, что уро вень РП в МГМ зависит от величины опухоли. Высокий уровень РП удалось выявить в плоскостных опухолях. Таким образом, половые стероидные гормоны прини мают участие в регуляции роста внутричерепных менин гиом, а следовательно, определяют чувствительность опу холи к антиэстрогенам или прогестагенам. Поэтому мож но говорить и о возможности использования их в лечении неоперабельных, часто рецидивирующих и множествен ных менгингиом, учитывая результаты иммуногистохими ческого исследования в послеоперационном периоде. ÎÑÎÁÅÍÍÎÑÒÈ ÒÈÐÅÎÈÄÍÎÃÎ ÃÎÌÅÎÑÒÀÇÀ Ó ÁÎËÜÍÛÕ ÌÅÍÈÍÃÈÎÌÀÌÈ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Êâàøà Ì. Ñ., Êîíäðàòþê Â. Â. Èíñòèòóò íåéðîõèðóðãèè èì. àêàä. À. Ï. Ðîìîäàíîâà ÀÌÍ Óêðàèíû, Êèåâ, Óêðàèíà В комплексе гормональных нарушений, связанных с возникновением, развитием и прогрессированием внут ричерепных менингиом (ВМ), важную роль играют гор моны щитовидной железы (ГЩЖ). Актуальность изуче ния этой проблемы определяется полиморфным влияни ем ГЩЖ на все виды обмена (белковый, углеводный, ли пидный, водносолевой) и на энергетические процессы в клетке, в первую очередь связанные с процессами мито хондриального окисления. Целью нашей работы стало: оценить функциональное состояние системы гипоталамус – гипофиз – щитовид ная железа до операции и в раннем послеоперационном периоде у больных МГМ в зависимости от возраста боль ных, локализации опухоли, особенностей гистострукту ры и проводимого лечения. Для оценки тиреоидного гомеостаза было выполнено: количественное определение содержания в сыворотке крови тиреотропного гормона ТТГ, общего и свободного тироксина Т4, трийодтиронина (Т3) с помощью радио иммунологических наборов IMMUNOTECH производ ства Чехии. Обследовано 64 пациента: 20 практически здоровых людей (контрольная группа) и 44 больных с МГМ базаль ной и конвекситальной локализации. Анализ состояния тиреоидного гомеостаза по базаль ным концентрациям в крови ТТГ, общего и свободного Т4 и Т3 выявил три типа нарушений системы гипотала мус – гипофиз – щитовидная железа у больных с ВМ: 1) Первый тип – гиперреактивный, характеризовался достоверным повышением уровня ТТГ в крови и соответ ствующим увеличением концентрации Т3 и свободного Т4. Этот тип изменений выявлен у 18% обследованных и был характерным при базальных менингиомах, воздей ствующих на передние отделы гипоталамуса (менингио мах бугорка турецкого седла, площадки основной кости, риноольфакторной области и конвекситальной локали зации, сопровождающихся синдромом внутричерепной гипертензии). 2) Второй тип – гипореактивный (35% обследованных) – характеризовался достоверным снижением содержания ТТГ в крови в сравнении с контрольной группой. Выяв лено снижение содержания в крови свободного Т4, иног да достигавшее гипотиреоидных концентраций. Уровень общего Т4 и Т3 находился в пределах нормальных вели 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 111 Íåéðîîíêîëîãèÿ чин. Такой тип нарушений был характерным для базаль ных менингиом в области передней и средней черепных ям, сопровождавшихся синдромом внутричерепной ги пертензии. 3) Третий тип – гипометаболический – характеризовал ся тем, что на фоне повышенного содержания ТТГ наблю далось достоверное снижение концентрации в крови Т3. Этот тип нарушений был характерным для атипических, анапластических менингиом и менингиальных сарком. Возможно, снижение Т3 явилось следствием системного влияния новообразования на организм, что выразилось в изменении конверсии Т4 в сторону реверсивного Т3. Как показывают наши наблюдения, у большинства больных с МГМ по мере прогрессирования заболевания наблюдалось развитие гипотиреоидного состояния вслед ствие снижения тиреотропной функции гипофиза. У больных с МГМ при благоприятном течении раннего пос леоперационного периода выявлена однонаправленность реакции тиреоидного гомеостаза на операционную трав му, которая характеризуется снижением в крови уровня ТТГ и Т3, повышением концентрации общего и свобод ного Т4 в день операции и на 24 день послеоперацион ного периода, с тенденцией к нормализации общего и сво бодного Т4 к 8му, а Т3 к 1012 дню. Для осложненного течения послеоперационного пери ода характерно снижение Т3, свободного и общего Т4 в сыворотке крови до гипотиреоидных концентраций. Если в послеоперационном периоде у больных с ослож ненным течением после удаления МГМ появляется ги потермия, снижение артериального давления, брадикар дия на фоне снижения тиреоидных гормонов, в комплек се реанимационных мероприятий целесообразно прово дить введение тиреотропных гормонов. Эти дополнитель ные меры позволят нормализовать состояние тиреоидного гомеостаза, активизировать метаболизм и улучшить состо яние больных. ÏÅÐÑÏÅÊÒÈÂÛ ÕÈÌÈÎÒÅÐÀÏÈÈ Â ÍÅÉÐÎÎÍÊÎËÎÃÈÈ Êîáÿêîâ Ã. Ë., Êîíîâàëîâ À. Í., Ëè÷èíèöåð Ì. Ð., Ëîøàêîâ Â. À., Êîðøóíîâ À. Ã., Ãîëàíîâ À. Â., Ïèöõåëàóðè Ä. È. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, ÐÎÍÖ èì. Í. Í. Áëîõèíà ÐÀÌÍ, Ìîñêâà В последние два десятилетия все большее значение в лечении злокачественных опухолей головного мозга, по мимо лучевой терапии, приобретает химиотерапия. При чем при ряде опухолей (анапластическая олигодендрог лиома, медуллобластома, лимфома, герминогенные опу холи, рак придаточных пазух носа), наряду с радиотера пией, химиотерапия является важнейшим лечебным ме тодом. Такова ситуация в большинстве развитых стран мира. Однако в России химиотерапия остается малоос военным и неубедительным терапевтическим методом для большинства врачей, имеющих отношение к лечению больных с опухолями головного мозга. Опыт НИИ ней рохирургии им. Н. Н. Бурденко РАМН, приобретенный нами в последние 10 лет (19922001), позволяет сформу лировать подход к практическому использованию и пла нированию научных исследований эффективности хими отерапии у больных с опухолями головного мозга. При выборе режима химиотерапии необходимо ру ководствоваться прежде всего данными гистологичес кого диагноза. Поэтому гистологическую верификацию опухоли мы считаем необходимой даже у тех больных, которым не показано удаление опухоли изза ее лока лизации. Большинство взрослых больных со злокачественными опухолями головного мозга составляют больные со зло качественными глиомами. Стандартным режимом хими отерапии этой группы больных является PCV (прокарба зин, ломустин, винкристин). Мы исследовали также эф фективность модификации данного режима – PNV (про карабазин, нидран, винкристин). В группе 74 больных с АА больших полушарий головного мозга, подвергнутых операции с последующей лучевой терапией и химиотера пией в режимах PCV (n=32) или PNV (n=42), медиана вы живаемости составила 34 месяца от момента операции. В группе 124 больных с глиобластомой (ГБ), получивших такое же комплексное лечение, медиана выживаемости составила 14 месяцев. В группе из 34 больных (10 ГБ, 13 АА, 8 АО, 3 АОА), получавших комбинированное лече ние (радиотерапия+химиотерапия, n=15) или только хи миотерапию в качестве основного метода лечения после верификации диагноза путем стереотаксической биопсии, медиана выживаемости составила 12 месяцев для больных с ГБ и более 30 месяцев для больных с АА и АО. В группе больных с медуллобластомой (n=14) химиоте рапия использовалась в режиме цисплатин+этопозид+ци токсан после удаления опухоли и лучевой терапии. Прогрес сирование опухоли выявлено только у 2 больных, у которых были признаки спинальных метастазов на момент первич ной операции. В остальных 12 случаях достигнута полная ремиссия с медианой безрецидивной выживаемости более 38 месяцев. Непосредственная эффективность данного ре жима химиотерапии отмечена также при использовании у 6 из 9 больных с прогрессированием болезни (локальный ре цидив и/или субарахноидальное метастазирование). Высока эффективность химиотерапии в режиме цисп латин+этопозид у больных с первичными герминогенны ми опухолями головного мозга. В настоящее время про водится изучение эффективности комбинированного ле чения (химиотерапия+лучевая терапия СОД 24Гр) у боль ных с «чистыми» герминомами (после гистологической верификации диагноза). Полный ответ на инициацион ный курс химиотерапии получен у 9 из 11 больных. Выявлена также непосредственная эффективность хи миотерапии в различных режимах при иных гистологи ческих формах интракраниальных опухолей (пинеоблас тома, хороидкарционома, первичная лимфома, рак при даточных пазух носа). Таким образом, опыт использования химиотерапии при злокачественных опухолях головного мозга в НИИ нейрохирургии им. Н. Н. Бурденко показывает, что она должна быть стандартным методом комплексного лече ния больных с анапластическими глиомами, медуллобла стомой, гермионогенными опухолями, пинеобластомой, раке придаточных пазух носа. Кроме того, необходмо про ведение рандомизированных исследований по эффектив ности противоопухолевого лечения с использованием новых режимов, а возможно, и методик лечения различ ных злокачественных опухолей головного мозга, и преж де всего – глиобластомы. ÄÈÀÃÍÎÑÒÈÊÀ È ÊÎÌÏËÅÊÑÍÎÅ ËÅ×ÅÍÈÅ ÏÀÐÀÑÀÃÈÒÒÀËÜÍÛÕ ÌÅÍÈÍÃÈÎÌ Êîçëîâ À. Â., Êàëèíèíà Å. Å., Êàäàøåâà À. Á., Òèìèðãàç Â. Â., Ñìèðíîâ Ð. À. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Радикальность операции является одним из основных факторов, определяющих прогноз при менингиомах. Большинство (30%) внутричерепных менингиом локали III ñúåçä íåéðîõèðóðãîâ Ðîññèè 112 Íåéðîîíêîëîãèÿ зуются в парасагиттальной области, топографоанатоми ческие особенности которой затрудняют и иногда делают невозможным полное удаление опухоли. Однако в оцен ке функциональных последствий («физиологической доз воленности», по Н. Н. Бурденко) тех или иных хирурги ческих манипуляций и соответственно в решении вопро са о допустимой радикальности удаления парасагитталь ной менингиомы (ПСМ) обычно присутствует субъекти визм. Также на сегодня не существует общепринятого комплекса диагностических и терапевтических меропри ятий при ПСМ, что, помимо клинического, имеет и эко номическое значение. Настоящее исследование предпринято с целью опре деления влияния различных составляющих диагностичес кого и лечебного комплекса на ближайшие и отдаленные результаты лечения ПСМ. М а т е р и а л и м е т о д ы . На первом этапе проведено изучение 1605 наблюдений больных с ПСМ, оперирован ных в 19541994 годах в Институте нейрохирургии, пре имущественно профессором Г. А. Габибовым. Статисти чески анализировались результаты предоперационных ис следований, особенности клиники, хирургической техни ки, гистологии, послеоперационного течения заболева ния (всего 77 факторов). На втором (продолжающемся) этапе исследования на материале 145 наблюдений больных, оперированных в 19952001 годах, изучается клиническая обоснованность выработанных рекомендаций, завершен анализ 18 пара метров. Р е з у л ь т а т ы . Достигнуто снижение послеоперацион ной летальности с 24,3% в 195464 до 3,1% в 198594 и до 0% в 19952001 годах. Произошло повышение среднего показателя индекса Карновского с 71 при выписке и 79 через год после операции в 5060 годы до соответственно 82 и 87 к настоящему времени. Однако вероятность реци дива ПСМ в течение 15 лет после операции составляет в среднем 29,3%, что снижает показатели качества жизни больных. Применение магнитнорезонансной томографии (МРТ) в комплексе предоперационной диагностики дос товерно улучшает результаты лечения. Роль компьютер ной томографии (КТ) является менее существенной. Кра ниография, электроэнцефалография, гаммаэнцефалог рафия и каротидная ангиография позитивного влияния на результаты лечения в нашем материале не оказывали. Среди факторов, улучшающих результаты хирургичес кого лечения ПСМ, оказались двусторонняя трепанация даже при односторонних ПСМ, применение микрохирур гической техники, начало удаления опухоли с ее внутрен них отделов (а не с отделения от места исходного роста), разумное повышение радикальности, первичная пласти ка дефектов твердой мозговой оболочки и кости. Ближай шие и отдаленные результаты были достоверно худшими при плановонерадикальных и двухэтапных вмешатель ствах, а также при использовании транскортикального доступа. Частота рецидивов ПСМ была меньшей у боль ных, получавших глюкокортикостероиды в послеопера ционном периоде. Сосудорасширяющие и ноотропные препараты влияния на исход лечения не оказывали. Все упомянутые различия математически достоверны. О б с у ж д е н и е . Некоторые из полученных результа тов, в первую очередь касающиеся предоперационных ис следований, не могут считаться абсолютно объективны ми (поскольку в основе их лежит субъективный опыт хи рургов одной школы). Поэтому мы не считаем возмож ным, например, однозначно рекомендовать отказаться от ангиографии при ПСМ, ибо для других нейрохирургов это и другие исследования могут оказаться важными в пла нировании тактики операции. Однако большинство результатов исследования удов летворяют требованиям доказательной медицины, по скольку основаны на оценке роли конкретного фактора при прочих равных условиях, включая и индивидуальную хирургическую технику. Полученные данные позволяют оптимизировать комплекс диагностических и лечебных мероприятий при ПСМ, в том числе за счет отказа от ряда традиционно применяемых, но не влияющих на исход лечения методик. З а к л ю ч е н и е . Разработка стандартов диагностики и лечения больных с ПСМ имеет значение с позиций не только клиники, но и страховой медицины. Обоснован ное повышение радикальности удаления ПСМ не ведет к дополнительной инвалидизации больных, но лишь улуч шает ближайшие и отдаленные результаты операций. ÊÎÌÏËÅÊÑÍÎÅ ËÅ×ÅÍÈÅ ÂÍÓÒÐÈ×ÅÐÅÏÍÛÕ ÌÅÍÈÍÃÈÎÌ Êîçëîâ À. Â., Êîíîâàëîâ À. Í., ×åðåêàåâ Â. À., Êîðøóíîâ À. Ã., Êðûìñêèé Â. À., Êàëèíèíà Å. Å., Êîáÿêîâ Ã. Ë., Ëîáàíîâ Ã. Â., Àíäðîíîâ À. Â. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà С XVIII века хирургическое вмешательство считалось единственно эффективным способом лечения внутриче репных менингиом. Анализ мирового опыта и собствен ного материала заставляет значительно расширить такую традиционную точку зрения. М а т е р и а л и м е т о д ы . С 1932 по 2000 г. в Институте нейрохирургии оперировано 10213 больных с внутриче репными менингиомами. Исследование проведено как на всем материале, так и в выборочных группах больных с менингиомами парасагиттальной (1605) и базальной (ос нование передней черепной ямки) локализации (870). Лучевое лечение получили 139 больных (из них 70 – ра диохирургическое), химиотерапия проведена в 7 наблю дениях. Для оценки данных клинических и нейровизуа лизационных исследований, особенностей хирургической техники, гистологии и молекулярной биологии опухоли, эффективности дополнительных методов лечения ис пользованы методы математической статистики. Р е з у л ь т а т ы . Достигнуто снижение послеоперацион ной летальности с 39,1% в 30е годы до 1,8% к настояще му времени (0% в указанных выборочных группах боль ных). Произошло повышение среднего показателя индек са Карновского с 71 при выписке и 79 через год после опе рации в 5060 годы до соответственно 82 и 87 к настояще му времени. Выявлена достоверная тенденция снижения вероятности рецидива менингиомы у больных, опериру емых с применением современного технологического комплекса. Тем не менее, вероятность рецидива менин гиомы у оперируемых сегодня больных составляет около 30%, что достоверно снижает показатели качества жизни в отдаленные сроки после операции. Установлено влия ние на вероятность рецидива менингиомы четырех неза висимых факторов – первичности операции, ее радикаль ности, гистологической злокачественности менингиомы и лучевой терапии. Подтверждены различия в биологи ческом поведении менингиом различных гистологичес ких типов, отмечено более доброкачественное клиничес кое течение менингиом основания черепа. О б с у ж д е н и е . Радикальность первого хирургическо го вмешательства является одним из основных факторов, определяющих прогноз при менингиомах. Однако нео правданное повышение радикальности ведет к достовер 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 113 Íåéðîîíêîëîãèÿ ному снижению качества жизни больных. Создается впе чатление, что совершенствование хирургической техни ки достигло некоего «потолка», подтверждается это отсут ствием динамики показателей летальности и инвалиди зации как в нашем материале, так и в других клиниках мира за последние годы. В настоящее время ведется интенсивная разработка способов комплексного лечения менингиом. Ранее счи тавшаяся противопоказанной лучевая терапия стала неотъемлемым компонентом лечения, позволяющим в ряде случаев отказаться от прямого хирургического вме шательства. Другие способы лечения (гормональная, хи миотерапия, иммунотерапия и др.) находятся на стадии клинического эксперимента, полученные результаты но сят противоречивый характер. Изучение молекулярной биологии показало генетичес кую неоднородностью объединяемых в группу менинги ом опухолей. Недоучет этого фактора в планировании исследований во многом объясняет противоречивость части полученных данных. Более того, назначение лекар ственных препаратов (и иногда даже лучевой терапии) без учета молекулярнобиологических и цитологических осо бенностей конкретной опухоли снижает эффективность лечения и может вести к обратному результату. Первыми попытками клинического применения вы явленных закономерностей явилось использование гор мональной и иммунной терапии при рецидивирующих и химиотерапии – при злокачественных менингиомах. Выводы. 1. Менингиомы представляют собой неоднородную в молекулярнобиологическом и клиническом плане груп пу опухолей. 2. Радикальное удаление опухоли является эффектив ным, но не всегда возможным способом лечения. 3. Адекватное лучевое лечение значительно улучшает результаты и в ряде случаев позволяет отказаться от пря мого хирургического вмешательства. 4. Дальнейшее улучшение результатов лечения менин гиом связано с комплексным подходом к проблеме. ÃËÀÇÎÄÂÈÃÀÒÅËÜÍÛÅ ÍÀÐÓØÅÍÈß Ó ÁÎËÜÍÛÕ Ñ ÎÏÓÕÎËßÌÈ ÑÓÏÐÀÒÅÍÒÎÐÈÀËÜÍÎÉ ËÎÊÀËÈÇÀÖÈÈ È ÈÕ ÂÎÑÑÒÀÍÎÂÈÒÅËÜÍÎÅ ËÅ×ÅÍÈÅ Â ÏÎÑËÅÎÏÅÐÀÖÈÎÍÍÎÌ ÏÅÐÈÎÄÅ Êîíäðàòþê Â. Â., Çàäîÿííûé Ë. Â., Æäàíîâà Â. Ì., Êâàøà Ì. Ñ. Êëèíèêà âíåìîçãîâûõ îïóõîëåé, Èíñòèòóò íåéðîõèðóðãèè èì. àêàä. À. Ï. Ðîìîäàíîâà ÀÌÍ Óêðàèíû, Êèåâ, Óêðàèíà Нарушение функции III, IV и VI черепных нервов (ЧН) наблюдается как в до, так и в послеоперационном пери одах у больных с опухолями головного мозга супратенто риальной локализации. Глазодвигательные нарушения (ГДН), возникающие вследствие дисфункции III, IV и VI ЧН, имеют временный или стойкий характер и приводят к инвалидизации больных. Ц е л ь р а б о т ы . изучение анатомотопографическо го расположения глазодвигательных нервов, определение причин развития ГДН и выбор реабилитационных мероп риятий в послеоперационном периоде. М а т е р и а л ы и м е т о д ы . Проведен анализ историй болезни 792 больных, которые находились на лечении в отделении внемозговых опухолей института нейрохирур гии на протяжении 19962001 г. Женщин было 504, муж чин – 288. Средний возраст больных – 42 года. ГДН вы явлены у 41 (5,2%) больного в дооперационном и у 53 (6,5%) больных в послеоперационном периодах. Клини коинструментальное обследование включало осмотр нейрохирурга, офтальмолога, отоневролога, проведение компьютерной и магнитнорезонансной томографий, каротидной ангиографии. Р е з у л ь т а т ы . Выделены две группы больных по раз витию ГДН. В первую группу включили 41 больного с ГДН в дооперационном периоде. Основной причиной разви тия дисфункции III, IV и VI ЧН был дислокационный синдром (27 больных), у 14 больных – врастание опухоли в кавернозный синус. Другая группа – 53 больных, у ко торых ГДН появились в послеоперационном периоде и обусловлены особенностями анатомотопографического расположения опухоли и ее врастанием в кавернозный си нус (34 больных) и 19 больных с краниоорбитальными опухолями. Регресс ГДН в послеоперационном периоде быстрее наступал у больных первой группы, тогда как ле чение этих нарушений у больных второй группы требова ло длительного времени и в некоторых случаях не приво дило к восстановлению функции III, IV и VI ЧН. Среди реабилитационных мер, направленных на вос становление функции глазодвигательных нервов, исполь зовали комплекс медикаментозного и физиотерапевти ческого лечения. Физиотерапевтические методы включа ли ультразвуковую терапию с последующей нейромышеч ной электростимуляцией глазодвигательных нервов, ЛФК, массаж глазных мышц. Выводы. 1. Глазодвигательные нарушения у больных с супратен ториальными опухолями имеют место в до и послеопе рационном периодах и носят изолированную или соче танную дисфункцию III, IV и VI ЧН. 2. Использование микрохирургической техники при удалении опухолей предотвращает травму нервов, что спо собствует быстрому регрессу ГДН. 3. Стойкие ГДН в послеоперационном периоде зави сят от анатомотопографического соотношения опухоли и корешков III, IV и VI нервов, травматизацией их во вре мя операции и развитием дегенеративных изменений не рвов. 4. Использование медикаментозного и физиотерапев тического лечения позволяет достичь регресса ГДН у большинства больных. ÌÍÎÆÅÑÒÂÅÍÍÛÅ ÌÅÍÈÍÃÈÎÌÛ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ: ÄÈÀÃÍÎÑÒÈÊÀ È ËÅ×ÅÍÈÅ Êîíäðàòþê Â. Â., Êâàøà Ì. Ñ. Êëèíèêà âíåìîçãîâûõ îïóõîëåé, Èíñòèòóò íåéðîõèðóðãèè èì. àêàä. À. Ï. Ðîìîäàíîâà ÀÌÍ Óêðàèíû, Êèåâ, Óêðàèíà Одним из проявлений нейрофиброматоза бывают множественные менингиомы головного мозга. Также множественные менингиомы выделяют в самостоятель ную группу без связи с нейрофиброматозом. По типу клинического течения выделяем две группы больных: первая – с относительно благоприятным течением забо левания, когда с момента постановки диагноза до опе рации проходит несколько лет, и вторая – с быстрым развитием очаговой неврологической симптоматики и гипертензионного синдрома с последующим появлени ем новых менингиом и неврином слуховых нервов. На протяжении 19962001 гг. в клинике внемозговых опу холей института нейрохирургии обследовано 28 и опе рировано 25 больных с множественными менингиома ми головного мозга. Средний возраст оперированных больных – 36 лет (от 24 до 61 года). Женщин было 14, III ñúåçä íåéðîõèðóðãîâ Ðîññèè 114 Íåéðîîíêîëîãèÿ мужчин – 11. В двух случаях имели место множествен ные менингиомы семейного типа. Клиникоинструмен тальное обследование включало осмотр нейрохирурга, офтальмолога, отоневролога, проведение компьютерной и магнитнорезонансной томографии, каротидной или селективной ангиографии. Комплексная оценка полу ченных данных позволяет выбрать тактику лечения и определить этапность удаления опухолей. Максималь ное количество диагностированных опухолей в доопе рационном периоде – 12 (у одного больного). Размеры диагностированных опухолей от 0,5 до 7 см в диаметре. У 4 больных опухоли располагались субсупратентори ально: двое больных (женщины) имели двухсторонние невриномы слуховых нервов и двое мужчин краниоспи нальные опухоли. Значительная часть больных (24) име ли 23 менингиомы, у двоих больных – по 4 опухоли, у двух других – 8 и 12 менингиом. Максимальное количе ство одномоментно удаленных менингиом – 24. У двух больных множественные опухоли (по 3) возникли рядом с местом удаленной первичной опухоли. Наибольшее ко личество операций у одного больного – 4. Два пациента умерли в послеоперационном периоде. Все удаленные опухоли направлялись для гистологического исследова ния. Среди гистологических форм менингиом наиболее часто встречались фибробластические – 9, менинготе лиальные – 6, смешанной структуры –6, анапластичес кие – 4. При первичномножественных менингиомах, которые локализуются в разных долях головного мозга, целесообразно проведение оперативного вмешательства с формированием широкого костного лоскута, направ ленного на одномоментное удаление большого количе ства опухолей. Обязательным условием в этих случаях должна быть тщательная ревизия твердой мозговой оболочки с целью выявления опухолевых узлов незна чительных размеров. При локализации менингиом в раз личных анатомических областях, при которых невоз можно одномоментное удаление опухолей, преимуще ство отдается оперативному вмешательству, направлен ному на удаление новообразования, которое обусловли вает ведущий клинический синдром. Больные с множе ственными менингиомами нуждаются в динамическом наблюдении и регулярном компьютернотомографичес ком обследовании. Среди научнопрактических заданий в диагностике и лечении множественных менингиом следует выделить группу риска (особенно в семьях с нейрофиброматозом), определить варианты фенотипического проявления ней рофиброматоза в семейных формах множественных ме нингиом, определить гормонозависимость опухолей в за висимости от гистоструктуры. ÊËÈÍÈ×ÅÑÊÈÅ ÎÑÎÁÅÍÍÎÑÒÈ È ÊÎÌÁÈÍÈÐÎÂÀÍÍÎÅ ËÅ×ÅÍÈÅ ÃËÈÎÌ ÕÈÀÇÌÛ È ÄÍÀ III ÆÅËÓÄÎ×ÊÀ Êîíîâàëîâ À. Í., Ãîðåëûøåâ Ñ. Ê., Ñåðîâà Í. Ê., Îçåðîâà Â. È., Êðûìñêèé Â. À., Ìàçåðêèíà Í. À., Êîðøóíîâ À. Ã. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Исследование выполнено на основе анализа 319 боль ных с глиомами хиазмы и дна III желудочка, наблюдав шихся в Институте нейрохирургии в период с 1982 по 2001 год. Глиомы хиазмы и дна III желудочка являются гетерогенной группой опухолей (экзофитные и эндофит ные опухоли), различающихся как по клиническим про явлениям, так и по показаниям к различным видам ле чения. Экзофитные опухоли (276 набл.) обладают ярко выра женным асисимметричным узловым ростом и прогреди ентным течением заболевания. Они характеризуются асимметричными зрительными нарушениями и гипертен зионными симптомами на фоне очень мягких эндокрин ных расстройств. Топография опухоли, своеобразие кли нической картины и необходимость использования оп ределенного хирургического доступа для ее удаления за висят от исходного места роста опухоли в одном из отде лов зрительного пути: интракраниальной части зритель ного нерва и переднего угла хиазмы, средней части хиаз мы, заднего угла хиазмы, зрительного тракта и гипотала мической части дна III желудочка. У 216 больных было произведено хирургическое уда ление опухоли (18% – практически полное, 25% – субто тальное, 57% – частичное). Общая послеоперационная ле тальность составила 8%, однако в течение последних 7 лет летальных исходов не наблюдалось. Рецидивы возникли у 25% больных (при наблюдении от 1 до 16 лет, среднее – 6,7 лет). Хирургическое удаление опухоли является эф фективным методом лечения и как первый этап показано у всех больных с экзофитными глиомами. Послеопераци онный период протекает без осложнений у подавляюще го большинства больных. Наиболее частыми причинами осложнений являются: гематома в месте удаленной опу холи, гипоосмолярногипонатриемический синдром, на растание гидроцефалии и субдуральные гидромы. В отдаленном периоде зрительные функции у боль шинства больных улучшаются (28%) или остаются неиз менными (48%), мало страдает рост детей, половое раз витие и нейросекреция, однако может появиться выра женное ожирение и синдром преждевременного полово го развития. Наиболее благоприятными по прогнозу для зрительных функций являются глиомы дна, а также анте хиазмальные; наиболее неблагоприятными являются соб ственно глиомы хиазмы (интра и ретрохиазмальные). Основными факторами, снижающими вероятность продолженного роста опухоли, являются: тотальное уда ление опухоли, лучевая терапия и наличие дегенератив ных изменений в опухоли. Применение лучевой терапии показано прежде всего у больных с частичным удалением опухоли вне зависимости от наличия пролиферации эн дотелия сосудов, а также у больных с анапластическими астроцитомами вне зависимости от радикальности удале ния. Методом выбора в лечении рецидивов является повтор ная операция с последующей лучевой терапией, даже при отсутствии нарастания к этому времени клинических сим птомов. Результаты повторных операций при экзофитных глиомах не хуже первичных (летальность, рецидивы, тя жесть послеоперационного периода и прогноз для зри тельных функций достоверно не различаются). Пункци онное лечение кистозных рецидивов является нецелесо образным. Эндофитные опухоли зрительных путей (43 набл.) ха рактеризуются инфильтративностью роста по отношению к зрительным путям, двусторонностью их поражения, более низкой скоростью роста (и стабилизацией процес са у 1/2 больных), наличием нейрофиброматозаI, про явлением симптоматики в раннем детстве, ускорением полового развития, отчетливым преобладанием у девочек (2:1) и наличием врожденных аномалий развития. При выявлении эндофитной опухоли оперативное лечение не показано; необходимо наблюдение с использованием МРТ с контрастированием и при появлении признаков продолженного роста можно рекомендовать проведение лучевой терапии у детей старше 4 лет. 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 115 Íåéðîîíêîëîãèÿ ÕÈÐÓÐÃÈ×ÅÑÊÎÅ ËÅ×ÅÍÈÅ ÊÐÀÍÈÎÔÀÐÈÍÃÈÎÌ Êîíîâàëîâ À. Í., Ñåìåíîâà Æ. Á., Ëóêüÿíîâ Â. È. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Краниофарингиомы остаются одной из наиболее слож ных проблем в нейроонкологии. Несмотря на введение новых технологий, радикальное удаление этих опухолей в ряде случаев ограничено. На сегодняшний день очевид но, что краниофарингиомы представляют собой гетеро генную группу опухолей, отличающихся по топографии, структуре, размерам и биологической активности. Мы поставили перед собой цель: оценить результаты хирургического лечения и выявить прогностически небла гоприятные факторы, влияющие на радикальность уда ления опухоли. С 1990 по 2001 год произведено 372 операции 335 па циентам. Из них 281 больной оперирован первично и 91 пациент оперирован по поводу рецидива заболевания. Возраст больных варьировал от 1 года до 68 лет. Для удаления опухоли использовались субфронталь ный, птериоинальный, транскаллезный и комбинирован ный доступы. Решение о характере операции и выборе наиболее адекватного доступа к опухоли определялись строго индивидуально и зависели от топографии кранио фарингиомы и ее структуры. Для удаления значительного числа краниофарингиом, располагающихся в турецком седле и выходящих за его пределы, наиболее обоснованным является транссфено идальное удаление. Применение транскраниального под хода обосновано в тех случаях, когда по данным исследо ваний, в первую очередь магнитнорезонансной томог рафии, можно предположить интимное срастание опухо ли с дном III желудочка и другими жизненно важными структурами. Для удаления стебельных краниофарингиом могут быть использованы как субфронтальный, так и птериональный доступы, в отдельных случаях возникает необходимость в использовании двухстороннего субфронтального доступа При краниофарингиомах, выполняющих переднеба зальные отделы III желудочка, удаление интравентрику лярной части возможно через разрез в конечной пластин ке при субфронтальном или птериональном доступах. Для достижения радикального удаления краниофарин гиом, выполняющих всю или большую часть полости же лудочка, использовались транскаллезный или комбини рованный доступы. Эндосупраселлярные краниофарингиомы составили 69 наблюдений, стебельные – 126 наблюдений и краниофа рингиомы III желудочка – 180 наблюдений. По поводу ги гантских краниофарингиом осуществлено 113 операций (34%). В зависимости от гистологического варианта опухоли выделены адамантиномоподобные краниофарингиомы – 291 наблюдение и папилломатозные – 44 наблюдения. Тотальное удаление опухоли осуществлено в 57% на блюдений, субтотальное – 30,2%, частичное – 12,8%. Об щая летальность составила 8%. Анализ хирургического лечения краниофарингиом показал, что к прогностически неблагоприятным факто рам, влияющим на радикальность хирургического лече ния краниофарингиом, относятся гигантские размеры опухоли, инфильтративный характер роста, повторные хирургические вмешательства (p<0,02). К наиболее опасным послеоперационным осложнени ям относится коллапс мозга с формированием субдураль ных гематом или гидром после удаления гигантских кра ниофарингиом или краниофарингиом III желудочка с выраженной сопутствующей гидроцефалией. Основной причиной поздних осложнений в послеоперационном периоде являются специфические нарушения мозгового кровообращения в диэнцефальной области, больших по лушариях и в стволе мозга. Рецидивы заболевания возникли у 14% больных и в пер вую очередь определялись радикальностью хирургическо го лечения и биологической активностью самой опухоли. Так, при тотальном удалении рецидивы заболевания воз никли в 8% наблюдений, а при субтотальном и частичном – 19 и 25% соответственно. При иммуногистохимическом исследовании биоптатов рецидивировавших опухолей с использованием индекса мечения KIS1 выявлены высо кие показатели пролиферативной активности. Наиболее эффективный путь улучшения результатов хирургического лечения краниофарингиом – ранняя ди агностика заболевания и раннее хирургическое вмеша тельство. ËÎÊÀËÜÍÀß ÕÈÌÈÎÒÅÐÀÏÈß ÖÈÑÏËÀÒÈÍÎÌ Â ËÅ×ÅÍÈÈ ÑÓÏÐÀÒÅÍÒÎÐÈÀËÜÍÛÕ ÃËÈÀËÜÍÛÕ ÎÏÓÕÎËÅÉ Êîðîòêåâè÷ Å. À., Ñìåÿíîâè÷ À. Ô., Øàíüêî Þ. Ã., Ëóêàøåéêî Þ. Í., Æàâðèä Ý. À., Øåëåã Ñ. Â., Õàìàøòà Õ. Ñ., Îøàðèí Â. Â. ÍÈÈ íåâðîëîãèè, íåéðîõèðóðãèè è ôèçèîòåðàïèè ÌÇ ÐÁ, ÍÈÈ îíêîëîãèè è ìåäèöèíñêîé ðàäèîëîãèè èì. Í. Í. Àëåêñàíäðîâà ÌÇ ÐÁ, Ìèíñê, Áåëàðóñü Глиальные опухоли относятся к наиболее частым но вообразованиям головного мозга. В Республике Беларусь они составляют 54,7% среди новообразований головного мозга, и абсолютное большинство из них (73%) имеют супратенториальную локализацию. Лечение глиальных опухолей остается на сегодняшний день одной из самых актуальных проблем нейрохирургии и онкологии. Несмотря на использование в комплексном лечении этого заболевания практически всего арсенала противоопухолевых методов терапии, средняя продолжи тельность жизни больных с низкодифференцированными глиомами, как правило, не превышает 12 месяцев. Широ кая распространенность заболевания, наклонность к реци дивированию после оперативного удаления обусловили необходимость внедрения новых технологий комплексного подхода к этой до настоящего времени нерешенной про блеме. С позиции биологии опухолевого роста НГ пред ставляют собой местный процесс, что обусловливает ши рокие возможности локальных методов противоопухоле вого лечения, прежде всего локальной химиотерапии (ЛХ). С 1998 г. нами применяется метод ЛХ супратентори альных глиом головного мозга с имплантацией в ложе уда ленного новообразования противоопухолевого препара та цисплатина, депонированного на рассасывающемся полимере 6карбоксицеллюлозе. Известно, что циспла тин обладает выраженным цитостатическим и радиосен сибилизирующим действием. Препарат представляет со бой 20 полимерных пластинок 1,5х1,5 см суммарной пло щадью 45 см2, что соответствует средней площади после операционного ложа удаленного новообразования голов ного мозга. Концентрация цисплатина составляла 1 мг на 1 см2 рассасывающегося полимера. Метод интраоперационной ЛХ применен у 65 больных с супратенториальными опухолями головного мозга. У 43 (66,2%) больных диагностированы низкодифференциро ванные глиомы (Grade IIIIV), у 20 (30,8%) – менее зло качественные глиомы (Grade II), у 2 (3,0%) – метастати ческие новообразования головного мозга. III ñúåçä íåéðîõèðóðãîâ Ðîññèè 116 Íåéðîîíêîëîãèÿ Хирургическое вмешательство проводилось традици онными методами, с использованием вакуумной и ульт развуковой аспирации опухоли в пределах видимой не измененной мозговой ткани. Ложе удаленного новообра зования выстилалось пластинками полимерлекарствен ной формы цисплатина в виде «черепицы» с последую щим удалением костного лоскута с целью декомпрессии и ушиванием операционной раны. Побочных и токсичес ких воздействий цисплатина на ткань мозга не отмечено. Опухоли удалены радикально у 55 (84,6%) человек и частично – у 10 (15,4%). На 1019 сутки оперированные переводились в онкологический стационар, где им про водился курс лучевой терапии: 1й этап – тотальное об лучение головного мозга (РОД – 4 Гр, 5 фракций/нед., СОД – 20 Гр, что изоэквивалентно 30 Гр режима тради ционного фракционирования); 2й этап, который прово дился сразу же после первого – дооблучение в режиме тра диционного фракционирования ложа удаленной опухо ли до СОД, изоэквивалентной 60 Гр. Контроль радикальности удаления опухоли и состоя ния имплантированного препарата осуществлялся по вторными КТ, МРТ исследованиями. КТ позволяла чет ко визуализировать пластинки цисплатина в виде полос ки, облегающей ложе удаленного новообразования, с рен тгенологической плотностью по шкале Хаусфильда +60 70 ед. Эффективность локальной химиотерапии супратенто риальных глиом головного мозга оценивалась по длитель ности безрецидивного периода в сравнении с контрольной группой. Последнюю составили 30 больных с глиомами Grade IV, которым проводилось комбинированное лече ние без интраоперационной ЛХ. Динамическое наблю дение осуществлялось методами КТ или МРТ через каж дые 1,5 месяца от момента выписки из стационара, а так же при ухудшении состояния больного. При анализе результатов установлено, что длительность безрецидивного периода у больных с глиобластомами (17 чел. – 26,2%), которым применялась ЛХ, составляла в среднем 38 недель, в то время как в контрольной группе – 22 недели. Анализ длительности безрецидивного периода у пациентов с более высокодифференцированными опу холями (Grade IIIII) в настоящее время еще не завершен, хотя у некоторых из них он уже превышает 3 года. Результаты комплексного лечения больных глиомами головного мозга с использованием ЛХ депонированной формой цисплатина несколько обнадеживают и могут найти практическое применение при дальнейшей разра ботке новых методов комплексного лечения этих заболе ваний. ÌÈÊÐÎÕÈÐÓÐÃÈ×ÅÑÊÎÅ ËÅ×ÅÍÈÅ ÝÊÑÒÐÀÌÅÄÓËËßÐÍÛÕ ÈÍÒÐÀÄÓÐÀËÜÍÛÕ ÎÏÓÕÎËÅÉ ÑÏÈÍÍÎÃÎ ÌÎÇÃÀ È ÊÎÐÅØÊΠÊÎÍÑÊÎÃÎ ÕÂÎÑÒÀ Êî÷åðåæêèí Á. À., Êà÷êîâ È. À., Áèêòèìèðîâ Ð. Ã., Ðóñèíîâ À. È., Êàðÿêèí Í. Í., Êåäðîâ À. Â. Êëèíèêà íåéðîõèðóðãèè Îáëàñòíîãî íàó÷íîèññëåäîâàòåëüñêîãî êëèíè÷åñêîãî èíñòèòóòà èì. Ì. Ô. Âëàäèìèðñêîãî, Ìîñêâà Клиникоинструментальному обследованию и опера тивному лечению подверглись 62 пациента, разделенные на основную (ОГ) (36 человек) и контрольную (КГ) (26 пациентов) группы. ОГ составили пациенты, у которых удаление менингиом производилось разработанным в от делении микрохирургическим способом, а удаление не врином осуществлялось ультразвуковым отсосом (УЗО) или микрохирургическим методом. В КГ вошли пациен ты, у которых опухоль удалялась ранее применяемыми методами. Больные в основной группе находились в воз расте от 14 до 71 лет. Средний возраст пациентов соста вил 49,5 лет. В контрольной группе больные были в воз расте от 20 до 73 лет. Средний возраст составил 51 год. В ОГ мужчин 5 (14%), женщин 31 (86%), в КГ мужчин 6 (23%), женщин 20 (77%). В ОГ менигиомы встречались в 27 (75%) наблюдениях, невриномы – в 9 (25%) случаях. В КГ менигиомы встречались в 17 (65%) наблюдениях, не вриномы – в 9 (35%) случаях. В ОГ менингиомы чаще встречались на среднегрудном и нижнегрудном уровне и на уровне утолщений, а невриномы на уровне корешков конского хвоста и на уровне шейного утолщения. По от ношению к поперечнику спинного мозга менингиомы чаще встречались вентролатерального, дорзолатерально го и дорзального расположения, а невриномы вентраль ного, вентролатерального расположения и на уровне ко решков конского хвоста. В КГ менигиомы, как и в ОГ, чаще встречались на среднегрудном уровне и на уровне утолщений, а невриномы на уровоне корешков конского хвоста, нижнегрудном уровне и на уровне поясничного утолщения. По отношению к поперечнику спинного моз га менингиомы чаще отмечались вентролатерального и дорзолатерального расположения, а невриномы на уров не корешков конского хвоста и вентролатерально. Оперативное лечение больных основной группы про изводилось под микроскопом с использованием микро хирургической техники и инструментария. Менингиомы удалялись разработанным нами микрохирургическим способом. Способ включает в себя вскрытие капсулы опу холи, удаление интракапсулярной части опухоли острым путем, мелкими фракциями по 35 мм, а также выпарива ние ткани опухоли биполярной коагуляцией. Постепен ное уменьшение опухоли в объеме позволяет атравматич но отделять острым путем ее оставшиеся фрагменты от спинного мозга, его корешков и сосудов. Затем, также острым путем, производилось отделение капсулы опухо ли от прилежащей ткани спинного мозга и ее удаление. Удаление неврином осуществлялось в основном при по мощи УЗО, а при их высокой плотности – микрохирур гическим способом. Во всех случаях опухоль удалена то тально. В 13 сутки после операции в основной группе хо роший результат отмечался в 80,6% (29), удовлетворитель ный – 16,6% (6), неудовлетворительный – 2,8% (1). В кон трольной группе: хороший результат у 42,3% (11) пациен тов, удовлетворительный – 46,2% (12), неудовлетвори тельный – 11,5% (3). На момент выписки пациентов из стационара в основной группе хороший результат выяв лен в 86,1% (31), удовлетворительный – 8,3% (3), неудов летворительный – 2,8%. Летальность составила 2,8% (1). В контрольной группе хороший результат отмечен в 53,8% (14), удовлетворительный – 34, 6% (9), неудовлетвори тельный – 11,6% (3), летальность – 0. Ê ÂÎÏÐÎÑÓ Î ÏÀÒÎÃÅÍÅÇÅ ÏÎÑËÅÎÏÅÐÀÖÈÎÍÍÎÃÎ ÎÒÅÊÀ ÌÎÇÃÀ ÏÐÈ ÓÄÀËÅÍÈÈ ÃËÈÀËÜÍÛÕ ÎÏÓÕÎËÅÉ Êðàâåö Ë. ß., Øåëóäÿêîâ À. Þ. Êàçàêîâ Â. Â. ÍÈÈ òðàâìàòîëîãèè è îðòîïåäèè, ÈÏÔ ÐÀÍ, Íèæíèé Íîâãîðîä Послеоперационный отек мозга – нередкое осложне ния после удаления полушарных глиом. Он носит вазо генный характер и связывается с непосредственной трав мой мозга и высвобождением большого количества вазо активных продуктов. Известны также предположения об изменениях механических свойств головного мозга при развитии отека. От этих свойств зависит величина давле 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 117 Íåéðîîíêîëîãèÿ ния интерстициальной жидкости мозга – одного из фак торов, определяющих переход воды из крови в интерсти циальные пространства. До последнего времени трудность исследования этой проблемы прежде всего связана с не достатком адекватных методик. Нами была поставлена задача разработки и реализации методики определения вязкоупругих свойств головного мозга во время нейрохирургических операций и клини ческой оценки полученных данных. Совместно с институтом прикладной физики АН РФ был изготовлен измеритель упругости мозга в виде при ставки к персональному компьютеру. Для исследования механических характеристик мозга был выбран квазиста тический способ дозированного погружения индентора в поверхность мозга. Сущность способа заключается в том, что одновременно с внедрением индентора измеряется сила F и глубину вдедрения А. Зависимость А (F) называ ется деформационнонагрузочной характеристикой (ДНХ). Параметры усилий и перемещений поступали в мик ропроцессор и при последующей компьтерной обработ ке ДНХ высчитывался модуль упругости и другие пара метры вязкоупругих свойства мозга. Полученные данные о механических свойствах мозга сопоставлялись также с результатами интраоперационно го тепловидения (камера Agema470) и уровнем микро циркуляции, по данным лазерной допплеровской флоу метрии (ЛДФ) ДНХ мозга определены у 20 больных с супратентори альными глиальными опухолями (8 – астроцитом III сте пени злокачественности и 12 – IIIIV ст.) Выполнено 76 измерений: в проекции опухоли – 22, перифокальной зоне – 28, на отдалении – 26. Начальная серия измерений про изводилась на этапе ревизии мозга, заключительная – после удаления опухоли. При доброкачественных глио мах по мере приближения к опухоли отмечалось «уплот нение» вещества мозга с возрастанием модуля упругости (Е) до 1,7 кПа и на ближайшем расстоянии от опухоли – до 2 кПа. При злокачественных глиомах с выраженным периту моральным отеком и латеральной дислокацией мозга (смещением прозрачной перегородки от 9 до 13 мм) из менения ДНХ мозга отличались значительным снижени ем модуля упругости в перифокальной зоне опухоли (в ин тервале 0,250,3 кПа), при этом наблюдалась значитель ная остаточная деформация и гистерезис. На максималь но удаленном от опухоли участке в пределах трепанаци онного окна наблюдалось возрастание «жесткости» моз га при относительно невысоких значениях модуля упру гости (1,21,4 кПа). Суммарный анализа ДНХ мозга при супратенториаль ных опухолях позволил вынести следующие суждения: 1) рост новообразования сопровождается развитием про странственных градиентов вязкоупругих свойств мозга; 2) понижение физической плотности ткани мозга харак терно для перифокальной зоны злокачественных глиом; 3) повышение физической плотности ткани мозга харак терно для перифокальной зоны доброкачественных опу холей. Если охарактеризовать кратко, то при опухолях проис ходят разнонаправленные изменения физической плот ности мозга: доброкачественные «уплотняют» структуру мозга, злокачественные «размягчают». Удаления опухоли сопровождаются заметным измене нием вязкоупругих свойств мозга, как на отдалении от опухоли, так и в ее бывшей перифокальной зоне. ДНХ мозга приобретают характер ступенчатой нелинейной за висимости с возрастанием податливости и снижением модуля упругости до 0,40,6 кПа. Практическое значения изменений ДНХ мозга после удаления опухолей состоит в том, что снижение модуля упругости мозга тем больше выражено, чем ближе к опе рационной ране производились измерения. Формируют ся однонаправленные градиенты упругости с наиболее податливостью участков мозга у ложа опухоли. Если сопоставить эти изменения с высокой частотой развития отека мозга после удаления глиальных опухолей, то во многом становятся понятны его механизмы. По фи зическим законам перемещение жидкости через полупро ницаемую мембрану идет в сторону более растяжимого и податливого пространства. Именно такие условия склады ваются в участках мозга, смежных с мозговой раной. Спо собствует развитию послеоперационного вазогенного отека мозга и реактивная гиперемия, регистрируемая с помощью интраоперационного тепловидения и лазерной допплеров ской флоуметрии вокруг операционной раны. Особенно потенциальна опасна ситуация гиперреперфузии – при значительном перифокальном размягчении это может при вести к кровоизлиянию в ложе удаленной опухоли. ÄÈÇÝÌÁÐÈÎÃÅÍÅÒÈ×ÅÑÊÈÅ ÊÈÑÒÛ ÖÍÑ Êðàâ÷åíêî Ì. È., Ôîìèíà-×åðòîóñîâà Í. À., Ìîëäîâàíîâ Â. À. Êàôåäðà íåðâíûõ áîëåçíåé è íåéðîõèðóðãèè Ãîñóäàðñòâåííîãî ìåäèöèíñêîãî óíèâåðñèòåòà, Ðîñòîâ Дизэмбриогенетические кисты развиваются в период эмбриогенеза и являются следствием неполного разделе ния нейрональной и покровной эктодермы. К ним отно сятся дермоидная, эпидермоидная, эпиндемальная, кол лоидная кисты. В клинике нейрохирургии РГМУ за 19982001 гг. на блюдалось 20 больных в возрасте от 2 до 52 лет с дизэмб риогенетическими кистами, которые верифицированы на операции. Анализ наших наблюдений позволил определить воз раст манифестации симптомов и наиболее характерную локализацию дермоидной, эпидермоидной, эпиндемаль ной и коллоидной кист. Дермоидные кисты (дермоиды) дебютировали в пер вые два десятилетия и локализовались преимущественно в параселлярной области, вокруг моста, по средней ли нии. Для эпиндемальных кист также был характерен ранний дебют с локализацией в желудочковой системе мозга и цистернах. Эпидермоидные кисты (эпидермоиды), как холестеа томы (эпидермоиды, содержащие жир), так и кисты, не содержащие жировых включений (трудно отличимые от арахноидальных кист), дебютировали на 34 десятилетии и располагались в мостомозжечковом углу, предмостовой цистерне, параселлярной области, четверохолмии, желу дочковой системе. Коллоидная киста манифестировала в этот же жизнен ный период (34десятилетие) и располагалась в III желу дочке, что вызывало окклюзионную гидроцефалию. При этом размеры кисты варьировали от 57 мм до 34 см. В дооперационный период все больные были тщатель но обследованы на предмет выявления множественных стигм дизэмбриогенеза (малых аномалий развития), а так же пороков развития внутренних органов. Это помогло избежать анестезиологических осложнений, возникаю щих на фоне грубых пороков развития. III ñúåçä íåéðîõèðóðãîâ Ðîññèè 118 Íåéðîîíêîëîãèÿ Анализ наших наблюдений позволил сделать следую щие выводы: 1. Манифестация симптомов дермоидных и эпидермо идных кист приходится на более ранние возрастные пе риоды (12 десятилетие). Симптомы эпиндемальных и коллоидных кист проявляются в более позднем возрасте (34десятилетие). 2. Эпидермоидные, дермоидные и эпиндемальные ки сты имеют определенную локализацию. 3. У больных с дизэмбриогенетическими кистами вы являются множественные стигмы дизэмбриогенеза, по роки развития внутренних органов, которые необходимо учитывать при определении хирургической тактики. ÎÏÛÒ ÏÐÈÌÅÍÅÍÈß ÈÍÒÐÀÎÏÅÐÀÖÈÎÍÍÎÃÎ ÓËÜÒÐÀÇÂÓÊÎÂÎÃÎ ÑÊÀÍÈÐÎÂÀÍÈß ÏÐÈ ÓÄÀËÅÍÈÈ ÍÎÂÎÎÁÐÀÇÎÂÀÍÈÉ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Êðàñèêîâ Ê. Í., Ùèãîëåâ Þ. Ñ. Ãëàâíûé âîåííûé êëèíè÷åñêèé ãîñïèòàëü èì. àêàä. Í. Í. Áóðäåíêî, Ìîñêâà Полноценность диагностики, а также радикальность и малотравматичность при удалении новообразований го ловного мозга всегда являлись одними из основных задач нейрохирургии. В последние годы для решения этих про блем используются современные методы диагностики: компьютерная и магнитнорезонансная томография, сте реотаксис, навигационные системы. Все более широкое распространение стала получать и интраоперационная ультразвуковая диагностика. Нами проанализированы результаты применения дан ного метода у 112 больных в возрасте от 22 до 63 лет (43 женщины, 69 мужчин) с объемными образованиями го ловного мозга. Из них у 74 пациентов были глиальные опухоли, у 9 – оболочечные опухоли, у 27 – солитарные метастазы, у 2 – абсцессы. Исследования проводились аппаратом AI5200S, датчик 7,5 мгц. Стерилизация дат чика осуществлялась 0,5% спиртовым раствором хлоргек сидина. В предоперационном периоде выполняли МРТ и (или) КТ головного мозга, после которых производили разметку для краниотомии. Для уточнения размеров, локализации и распростране ния образования выполняли УЗсканирование до или пос ле вскрытия твердой мозговой оболочки. Данный метод использовался и для контроля радикальности хирургичес кого вмешательства, а также надежности гемостаза. Зону энцефалотомии выбирали с учетом минимальной травма тизации функционально нагруженных участков коры моз га. Особенно это было важно при локализации объемного образования в левом (доминантном) полушарии. Приме нение ультразвукового контроля при внепроекционном доступе к новообразованию значительно упрощало эту за дачу. В случае глубинной локализации опухоли и невоз можности ее удаления ввиду анатомической недоступнос ти и физиологической недозволенности проводили пунк ционную биопсию с последующей лазерной вапоризаци ей (2 случая). У больного с множественными (3) абсцесса ми головного мозга через трефинационные окна под кон тролем УЗИ выполняли пункцию и дренирование гнойни ка с последующим проточным промыванием. Интраоперационное применение ультразвукового ска нирования в реальном масштабе времени позволило наи более достоверно определить истинные размеры опухо ли, так как в случае наличия у больного низкодифферен цированной глиальной опухоли данные КТ и МРТ, даже с контрастированием, не всегда являются достоверными. Во всех случаях УЗизображение глиальных опухолей было в той или иной мере гиперэхогенным (в зависимос ти от степени анаплазии) и отчетливо визуализируемым. У одного пациента удалось обнаружить и удалить «дочер ний» метастаз меланомы небольших размеров, который не был выявлен при МРТ. Минимизация инвазивности и хирургической агрес сии, обеспечиваемые применением интраоперационно го ультразвукового сканирования, позволили снизить уро вень неврологического дефицита и, как следствие, инва лидизацию больных; достичь большей радикальности при удалении новообразований мозга, создав тем самым пред посылки для увеличения межрецидивного периода при глиальных опухолях. Простота в обращении, незначитель ная затрата времени на исследование, доступность аппа ратного обеспечения делают данный метод альтернатив ным стереотаксическому и навигационному, и, следова тельно, он может быть рекомендован к более широкому применению в нейрохирургической практике. ÍÅÉÐÎÍÀÂÈÃÀÖÈß Â ÌÀËÎÈÍÂÀÇÈÂÍÎÉ ÕÈÐÓÐÃÈÈ ÎÏÓÕÎËÅÉ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Êðèâîøàïêèí À. Ë., Ñåìèí Ï. À., Ìåëèäè Å. Ã., Êàíûãèí Â. Â. Íåéðîõèðóðãè÷åñêèé öåíòð ÃÓ ÄÊÁ, Íîâîñèáèðñê Тенденция в современной нейрохирургии к минималь ной инвазии и высокой точности, наряду с совершенство ванием микрохирургической техники, привела к широ кому внедрению навигационных технологий. Целью настоящей работы стало изучение эффективно сти использования нейронавигационной системы в ма лоинвазивной хирургии опухолей центральной нервной системы. М а т е р и а л и м е т о д ы . В работе использован ней ронавигатор Voyager (Picker) с программной оболочкой версии ZKAT 2001г. Комплекс состоит из двух основных элементов: рабочей станции и оптической локализацион ной системы. Рабочая станция представляет собой ком пьютер, программное обеспечение которого позволяет получать и обрабатывать томографические данные КТ, МРТ и МРА, а также магнитной энцефалографии, про изводить слияние КТ и МРТ данных. Локализационная система состоит из двух чувствительных к инфракрасно му излучению цифровых камер и нескольких рабочих ин струментов с диодами, излучающими в инфракрасном спектре. Навигационная система объединяет в единой системе координат в реальном времени данные томогра фии, оперируемого пациента и действия хирурга. Пере нос данных с КТ и МРТ сканеров происходит посредством локальной компьютерной сети в предоперационном пе риоде. Привязка изображения уже полученных КТ и МРТ данных к пациенту в реальном времени происходила пу тем расположения радиологических маркеров на интере сующую область перед проведением томографии и их пос ледующей регистрацией непосредственно перед операци ей. Для проведения минимальноинвазивной нейрохи рургии использованы операционный микроскоп Leica OHS1; ультразвуковой деструктораспиратор CUSA Exсel (Valleylab) с возможностью применения сменных фраг ментаторов 36 кГц и 23 кГц и совмещенный с электрохи рургическим генератором «Force FX»; нейросонограф Acuson «Aspen» с использованием линейного датчика 5 МГц. Нейроэндоскопический видеомониторинг осуще ствлялся с помощью ригидного эндоскопа Storz и видео системы Sony. Указанный нейрохирургический комплекс использо ван при проведении 57 операций на опухолях головного 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 119 Íåéðîîíêîëîãèÿ мозга. Из них опухоли основания черепа были у 19, кон векситальные полушарные опухоли у 14, полушарные опухоли глубинной локализации у 15, опухоли желудоч ковой системы у 9 больных. Р е з у л ь т а т ы . При использовании нейронавигатора время предоперационной регистрации составило в сред нем 1015 минут. Среднее отклонение при регистрации координаторных точек было 2,1±1,3 мм (допустимое мак симальное отклонение, установленное производителем – 5 мм). При наложении 5 и более маркеров прибор позво ляет добиться точности попадания в интересующую цель до 1 мм. Ультразвуковой деструктораспиратор позволял радикальное удаление внутримозговых опухолей по гра ницам, очерченным нейронавигатором, при минималь ной травматизации окружающей ткани. В зависимости от плотности опухоли устанавливалась различная степень мощности фрагментации. Для удаления плотных опухо лей основания с выраженным фиброзным компонентом было целесообразно использовать 23 кГц фрагментатор. При работе на мягких парастволовых и стволовых ново образованиях выгоднее применение 36 кГц фрагментато ра. При удалении обширных внутримозговых опухолей с выраженным кистозным компонентом опорожнение со держимого кист приводило к потере нейронавигацион ных ориентиров. В этом случае использование интраопе рационной нейросонографии позволяло корректировать данные навигационной модели и оценивать радикаль ность удаления опухоли. При операциях на опухолях селлярной области трансназальным, транссфеноидальным доступом нави гация позволила уменьшить число рентгеновских экс позиций, необходимых для определения положения ин струмента, а также контролировать направление инст рументов в аксиальной проекции. Эндоскопический видеомониторинг под нейронавигационным контролем позволял оценить радикальность удаления опухоли. Использование навигатора позволило существенно со кратить время хирургического вмешательства за счет улучшения ориентации в структурах головного мозга. Все операции прошли без осложнений. При этом доб рокачественные образования были удалены тотально, а злокачественные в пределах малоизмененного мозго вого вещества. З а к л ю ч е н и е . Использование нейронавигатора по зволяет существенно уменьшить инвазивность хирурги ческого лечения за счет предоперационного планирова ния оптимального доступа к патологическому образова нию с учетом функционально важных зон и сосудов в ме сте хирургического воздействия, сократить площади тре панационного окна с возможность проведения операций по типу «замочной скважины». Современный комплекс хирургических инструментов уменьшает травматичность вмешательств при увеличении радикальности удаления новообразований. ÑÐÀÂÍÈÒÅËÜÍÀß ÎÖÅÍÊÀ ÐÀÇËÈ×ÍÛÕ ÄÎÑÒÓÏÎÂ Ê ÀÄÅÍÎÌÀÌ ÃÈÏÎÔÈÇÀ, ÂÐÀÑÒÀÞÙÈÌ Â ÊÀÂÅÐÍÎÇÍÛÉ ÑÈÍÓÑ Êóòèí Ì. À., Êàëèíèí Ï. Ë., Êàäàøåâ Á. À. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà С 1994 по 2001 г. нами прослежено 214 выживших пос ле операций первичных пациентов с аденомами гипофи за, врастающими в кавернозный синус. Операции прове дены: традиционным транссфеноидальным доступом – 154, транскраниальным интрадуральным доступом (лоб новисочным и субфронтальным) – 53, и 7 пациентов опе рировано с применением комбинации интра и экстра дурального транскраниального доступов к кавернозному синусу. Инвазия опухоли в кавернозный синус подтвер ждена МРТ, КТ и интраоперационными данными. Для сравнения результатов использованы такие наиболее важ ные для этой группы больных показатели, как: послеопе рационная летальность, динамика зрения, функции гла зодвигательных нервов. 1. Группа пациентов, оперированных транссфенои дальным доступом, всего насчитывает 160 пациентов, из них 6 умерло (летальность 3. 8%). Зрительные функции: до операции не было зрительных нарушений у 100 боль ных. После операции ухудшение произошло у 5 (5%) и ос талось нормальным у 95 (95%). Имелись зрительные на рушения до операции у 54 пациентов. После операции улучшение наступило у 33 (61,1%), не изменилось у 16 (29,6%), ухудшение отмечено у 5 (9,3%) больных. Глазод вигательные функции: не имелось глазодвигательных рас стройств у 128 пациентов, появились после операции у 10 (7,8%) и у 4 (3,1%) отмечались преходящие нарушения, регрессировавшие к выписке. Имелись глазодвигательные расстройства до операции у 26 (16,9%), наросли после опе рации у 1 (3,8%), полностью регрессировали у 4 (15,4%), частично регрессировали у 9 (16,7%), не изменились у 12 (46,2%). 2. Группа пациентов, оперированных транскраниаль ным интрадуральным доступом, состоит из 63 пациентов, 10 из которых умерли после операции (летальность 15,9%). Зрительные функции: зрительных нарушений не было до операции у 8 (15,1%), у 5 (62,5%) из них зрение осталось без динамики, а у 3 (37,5%) отмечено ухудшение зритель ных функций. Имелись зрительные нарушения до опера ции у 45 (84,9%) пациентов, не изменилось зрение у 8 (17,8%), отмечено улучшение у 17 (37,8%), ухудшилось у 19 (42,2%). У 1 (2,2%) пациента зрительные функции не удалось исследовать изза грубых психических рас стройств после операции (акинетический мутизм). Гла зодвигательные функции: не имелось глазодвигательных расстройств до операции у 46 (86,8%) пациентов. У 23 (50%) глазодвигательные расстройства не появились. У 23 (50%) появились после операции. У 8 (15,1%) пациентов до операции имелись глазодвигательные расстройства, у 3 (37,5%) из них они остались неизменными после опера ции, у 3 (37,5%) наросли, и лишь у 2 (25%) регрессирова ли. При этом у 6 (11,3%) пациентов интраоперационно отмечено анатомическое повреждение глазодвигательных нервов. 3. Группа пациентов, оперированных с применением интра и экстрадурального доступа к кавернозному си нусу, насчитывает 7 пациентов, летальных исходов не было. Зрительные функции: не имелось расстройств зре ния до операции у 3 (42,9%), после операции у них не отмечено ухудшение зрительных функций. Снижение зрения до операции отмечалось у 4 (57,1%) пациентов. После операции без динамики оно осталось у 3 (75%), улучшение отмечено у 1 (25%). Ухудшения зрения не от мечено ни у одного пациента. Глазодвигательные рас стройства: до операции имелись у 2 (28,6%) пациентов – у одного был глубокий парез III нерва, перешедший в плегию после операции вследствие анатомического по вреждения нерва при интрадуральном удалении опухо ли, у второго пациента изначально имелось глубокое поражение III и VI нервов – у этого пациента не отмече но динамики после операции. У 3 (42,9%) пациентов, не имевших глазодвигательных расстройств до операции, после операции отмечено появление выраженных паре III ñúåçä íåéðîõèðóðãîâ Ðîññèè 120 Íåéðîîíêîëîãèÿ зов глазодвигательного и отводящего нервов. У 2 паци ентов, не имевших глазодвигательных расстройств, в послеоперационном периоде отмечено появление легко го изолированного нарушения функции только глазод вигательного нерва у 1 (14,9%) пациента и грубого паре за у 1 (14,9%) пациента. Кроме того, у 1 пациента до опе рации имелись признаки поражения тройничного нерва, выражавшиеся в снижении корнеального рефлекса, пос ле операции не отмечено положительной динамики. У 2 (28,6%) пациентов, не имевших поражения V нерва до операции, в послеоперационном периоде отмечено по явление нарушений инервации роговицы, у одного из них отмечено появление тяжелого трофического кера тита после регресса птоза. У двух пациентов отмечен не полный регресс глазодвигательных расстройств в срок 3 4 месяца после операции. Остальные 5 операций были выполнены в срок менее 4 месяцев к моменту написа ния данной работы. В ы в о д ы . Использование экстрадурального в сочета нии с традиционно применяемым интрадуральным дос тупом дает полную визуализацию и возможность сохра нения глазодвигательного, блокового и ветвей тройнич ного нерва, что облегчает ревизию полости синуса, кото рая остается недоступной для удаления при транссфено идальном доступе с меньшим риском анатомического по вреждения этих нервов. Риск повреждения глазодвига тельного нерва при интракраниальном удалении вторич ных узлов при этом не уменьшается. Таким образом, при менение экстрадурального доступа в сочетании с интра дуральным позволяет увеличить радикальность удаления опухоли и уменьшить риск нарастания зрительных рас стройств. Отмечается существенная разница статистических показателей в группах пациентов, оперированных транссфеноидальным и транскраниальным интраду ральным доступами. Однако обе эти группы отличают ся друг от друга по размеру и распространению опухо ли. Транссфеноидальным путем удалялись аденомы, расположенные преимущественно эндосупраинфра селлярно, с умеренной инвазией в кавернозный синус. При этом опухоль, расположенная латерально от инт ракавернозного сегмента внутренней сонной артерии остается не удаленной. Транскраниально удалялись в основном крупные аденомы гипофиза, имеющие пре имущественное интрадуральное распространение, с формированием вторичных узлов. Высокий показатель летальности при этом можно объяснить размерами опу холей. ÁÐÀÕÈÒÅÐÀÏÈß Â ËÅ×ÅÍÈÈ ÏÅÐÂÈ×ÍÛÕ È ÌÅÒÀÑÒÀÒÈ×ÅÑÊÈÕ ÎÏÓÕÎËÅÉ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Ëåùèíñêèé Â. Ã., Áåíöèîí Ä. Ë., Ôèàëêî Í. Â. Êîëîòâèíîâ Â. Ñ., Ëåùèíñêèé À. Â., Ãâîçäåâ Ï. Á. Óðàëüñêèé ìåæîáëàñòíîé íåéðîõèðóðãè÷åñêèé öåíòð èì. ïðîô. Ä. Ã. Øåôåðà, ÑÎÎÄ ÌÍÏÖ «Îíêîëîãèÿ», Åêàòåðèíáóðã Одним из новых и перспективных направлений в ней роонкологии является брахитерапия опухолей головного мозга. Этот метод заключается в доставке радиационной дозы к мишени (опухоли) путем кратковременного вне дрения источника излучения через тонкий полый кате тер (интрастат) непосредственно в ткань опухоли или в перифокальную зону. Брахитерапия используется само стоятельно или как этап комбинированного лечения в сочетании с оперативным лечением и дистанционной лу чевой терапией. Благодаря современным методикам дозиметрическо го планирования возможно оптимальное дозное распре деление в объеме мишени (опухоли). Реконструкция объе ма мишени происходит на основании данных КТ, МРТ, с применением навигационной системы. Это обеспечива ет минимальное облучение окружающего опухоль здоро вого мозга, тем самым дает возможность увеличение дозы, доставляемой к опухоли, по сравнению с использовани ем только дистанционной лучевой терапии. На базе Уральского межобластного нейрохирургичес кого центра с октября 2000 года 31 больному с супратен ториальными внутримозговыми опухолями головного мозга разнообразной гистологической структуры (глиаль ные опухоли различной степени злокачественности, ме тастатические опухоли) была проведена брахитерапия как один из этапов комбинированного лечения. Из общего количества наблюдений в 14 случаях при опухолях распо лагающихся в труднодоступных и функционально значи мых областях головного мозга, для имплантации интрас татов использовали стереотаксический метод. Планиро вание предстоящей биопсии опухоли и траектории уста новки интрастата по томограммам, а также по их 3D ре конструкциям выполняли на навигационной станции «Stryker» (Leibinger). 17 пациентам брахитерапию прово дили 2 этапом после прямого микрохирургического уда ления опухоли. Интрастаты в этих случаях имплантиро вали в перифокальную зону или в неудаленный участок опухоли. В планировании оперативного лечения и воз можной траектории установки использовали навигацион ную систему STN «Carl Zeiss», сопряженную с операци онным микроскопом «OPMI Neuro 200». После установ ки и фиксирования интрастатов все пациенты транспор тировались в отделение брахитерапии для проведения ле чения. Расчет дозы и поля облучения производили на пла нирующей системе «Abacus». Облучение проводили на аппарате GammaMed+ с источником Ir192 (HDR). Объем клинической мишени (CTV) включал в себя зону контра стного усиления (по КТ) + 0,5 см к периферии. В режиме LDR (перманентная имплантация) к мишени доставляли дозу 4060 Гр за 510 дней. В режиме HDR (remote afterloading) использовали различные схемы фракциони рования дозы 33,545 Гр за фракцию один раз в день или дважды в день с интервалом 68 часов. Суммарные дозы достигали 2435 Гр, что соответствовало длительности курса 35 дней. После достижения планируемой радиа ционной дозы интрастаты удалялись. Всем пациентам в процессе курса и после брахитера пии проводили МРТ контроль в ранние сроки. Уже на 10 15 сутки после курса наблюдали изменения МРТ струк туры и размеров опухоли. При этом перифокальный отек был выражен минимально ввиду особенности метода и точного подведения дозы. В дальнейшем КТ или МРТ контроль проводили через 1, 3, 6, 12 месяцев. Одногодичная выживаемость в данной серии пациен тов зависела от локализации и гистологической структу ры опухоли и составила 79,8%. 5 больных с метастатичес кими опухолями головного мозга погибло в связи с про грессированием и дальнейшей генерализацией основно го процесса. Брахитерапия – это малоинвазивный, хорошо перено симый, высокоэффективный способ, позволяющий улуч шить результаты комбинированного лечения больных с опухолями головного мозга. Возможность осуществить лучевое воздействие на опухоль в относительно больших дозах при минимальной лучевой травме окружающих структур головного мозга делает этот метод одним из пер спективных направлений в нейроонкологии. 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 121 Íåéðîîíêîëîãèÿ ÑÒÅÐÅÎÒÀÊÑÈ×ÅÑÊÀß ÁÐÀÕÈÒÅÐÀÏÈß ÎÏÓÕÎËÅÉ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Ëåùèíñêèé Â. Ã., Øåðøåâåð À. Ñ., Ãâîçäåâ Ï. Á., Êîëîòâèíîâ Â. Ñ., Ëåùèíñêèé À. Â., Áåíöèîí Ä. Ë., Ôèàëêî Í. Â. Óðàëüñêèé ìåæîáëàñòíîé íåéðîõèðóðãè÷åñêèé öåíòð èìåíè ïðîô. Ä. Ã. Øåôåðà, ÑÎÎÄ ÌÍÏÖ «Îíêîëîãèÿ», Åêàòåðèíáóðã Развитие медицины неотрывно связано с внедрением новых методов лечения. Одним из новых и перспектив ных направлений в нейроонкологии является стереотак сическая брахитерапия. Это метод прицельного обрати мого дробного введения с помощью стереотаксической навигационной системы в ткань опухоли радиоактивно го источника с целью непосредственного воздействия на опухоль радиационным излучением. Данный метод мож но отнести к разряду малоинвазивных. Метод достаточно высокотехнологичный. Направление находится на стыке нейрохирургии и радиологии. Одной из проблем современной нейроонкологии яв ляется проблема хирургии малодоступных или недоступ ных опухолей, а также метастазов. Ее определяет глубин ное расположение новообразования, а также локализация в функционально значимых зонах мозга. Метод стереотаксической брахитерапии позволяет ре шать проблему хирургии «недоступных» опухолей. Это направление заставляет пересмотреть отношение к откры той хирургии как к единственно возможному методу ле чения в нейроонкологии. Стереотаксическую брахитерапию на базе Уральского межобластного нейрохирургического центра начали про водить с августа 2001 года. Отбор пациентов был основан на невозможности открытого удаления опухоли или вви ду возможного получения значительного неврологичес кого дефицита при открытой операции. Наблюдалось 14 пациентов с опухолями различных локализаций и гистологических структур: 3 опухоли ги поталамической области (варианты астроцитомы), 5 – подкорковой области вблизи внутренней капсулы (вари анты астроцитомы, глиобластомы), 6 опухолей сенсомо торной зоны или вблизи нее (варианты астроцитомы, гли областомы), 2 метастаза рака молочной железы. Брахитерапия проводилась несколькими этапами: 1. Предварительное исследование на МРТ с контраст ным усилением, КТ с контрастированием сосудов мозга с фиксированной головой пациента к элементам стерео таксической системы. 2. Планирование предстоящей биопсии опухоли и тра ектории установки интрастата по томограммам, а также по их 3D реконструкциям на навигационной станции «Stryker» (Leibinger). 3. Стереотаксическая биопсия опухоли (спираль, ку сачки). 4. Имплантация гибкого интрастата. Их количество зависело от формы и размеров опухоли. 5. Расчет дозы и поля облучения на планирующей сис теме Abacus. 6. Лучевая терапия. Облучение проводилось на аппарате GammaMed+ с источником Ir192 (HDR) с дневной дозой 6 Гр, подводимой за 2 фракции с интервалом 6 часов. Общая доза составляла 24 Гр (36 Гр по изоэффекту). В объем мише ни включали опухоль и зону безопасности 5 мм во всех на правлениях. Курс облучения занимал 45 дней. Некоторым пациентам по показаниям в зависимости от гистологичес кой структуры опухоли после окончания курса брахитера пии проводился курс дистанционной лучевой терапии. Ближайшие результаты, основанные на данных МРТ контроля, позволяют отметить, что уже на 1015 сутки после курса брахитерапии наблюдались изменения струк туры и размеров опухоли. При этом перифокальный отек был выражен минимально ввиду особенностей метода и точного подведения дозы. Не было отмечено и нараста ния неврологической симптоматики в периоде наблюде ния. Не требовалось ведения больного в палате РАО. Па циенты на период брахитерапии находились в палатах нейрохирургического отделения. Все больные этой серии наблюдений находятся на дис пансерном учете и в перспективе планируется оценка от даленных результатов лечения. Учитывая непосредственные результаты брахитерапии, данный метод считаем перспективным. Минимальная травма вещества мозга при доступе к опухолям труднодо ступных локализаций, гарантированное избежание ране ния сосудов, возможность осуществить лучевое воздей ствие на опухоль в относительно больших дозах при ми нимальной лучевой травме окружающих структур голов ного мозга, короткие сроки пребывания в стационаре де лают этот метод конкурентоспособным направлением в нейрохирургии. ÃËÈÎÌÛ È ÈÌÌÓÍÍÀß ÑÈÑÒÅÌÀ ÎÐÃÀÍÈÇÌÀ Ëèñÿíûé Í. È., Ìàðêîâà Î. Â., Ñêèòÿê Ñ. À., Ãíåäêîâà È. À., Ëþáè÷ Ë. Ä. Èíñòèòóò íåéðîõèðóðãèè èì. àêàä. À. Ï. Ðîìîäàíîâà ÀÌÍ Óêðàèíû, Êèåâ, Óêðàèíà Несмотря на совершенствование диагностических воз можностей и хирургических или комбинированных ме тодов лечения, продолжительность жизни больных с гли альными опухолями в послеоперационном периоде ис числяется всего 23 годами, что обосновывает необходи мость как дальнейшего всестороннего изучения гистоби ологических особенностей самих опухолей, так и взаимо действие опухолей с иммунной системой организма. Проведенными нами исследованиями иммунного ста туса у больных с глиальными опухолями установлены из менения в различных звеньях иммунной системы, в суб популяционном составе лимфоцитов, цитокиновом и интерферонном статусе, пролиферативной и цитотокси ческой активности лимфоцитов. Исследование иммунокомпетентных клеток (макрофа гов, лимфоцитов), полученных из ткани опухоли, указы вает на направленное действие опухоли на функцию иммунных клеток. Среди иммунных изменений при глиальных опухолях можно выделить два вида изменений: зависимый и неза висимый от степени анаплазии опухоли, что, возможно, связано с возникновением в иммунной системе опреде ленных генетических нарушений. Так, для глиом голов ного мозга характерно угнетение процессов активации Т лимфоцитов и содержания натуральных киллеров, увели чение торможения синтеза IL2, IL4 и ФНОγ. В то же время при глиомах, особенно IIIIV степени анаплазии, отмечено увеличение продукции ИФНγ. Таким образом, при глиомах головного мозга проис ходит своеобразная перестройка в работе иммунной сис темы, проявляющаяся угнетением активации лимфоци тов и продукции Тх1зависимых цитокинов, усилением апоптических и цитолитических нарушений в клетках иммунной системы, что приводит к торможению проти воопухолевого иммунитета и активации опухолевого ро ста. Полученные данные обосновывают применение у больных с глиомами головного мозга иммунокоррегиру III ñúåçä íåéðîõèðóðãîâ Ðîññèè 122 Íåéðîîíêîëîãèÿ ющей терапии на этапах комбинированного лечения, а также направленной противоопухолевой иммунотерапии. ÕÈÐÓÐÃÈ×ÅÑÊÎÅ ËÅ×ÅÍÈÅ ÃËÈÎÌ ÁÎËÜØÈÕ ÏÎËÓØÀÐÈÉ Ñ ÈÑÏÎËÜÇÎÂÀÍÈÅÌ ÍÀÂÈÃÀÖÈÎÍÍÛÕ ÑÈÑÒÅÌ È ÔÓÍÊÖÈÎÍÀËÜÍÎÃÎ ÊÀÐÒÈÐÎÂÀÍÈß ÌÎÇÃÀ Ëîøàêîâ Â. À., Ãîëàíîâ À. Â., Ëóáíèí À. Þ., Ùåêóòüåâ Ã. À., Ãèìðàíîâ Ð. Ô., Êëèì÷óê Î. Â., Êóøåëü Þ. Â., Êàðìåíÿí Ê. Ê. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Известно, что в комплексном лечении глиом, в особен ности злокачественных, имеет значение радикальность удаления опухоли. Опухоль может располагаться в непос редственной близости от функционально значимых зон, таких как двигательные, сенсорные и речевые центры. Необходимо до операции определить локализацию опу холи, ее взаимоотношение с окружающими структурами, а также оценить состояние высших корковых функций. Анализ результатов хирургического лечения проведен в группе из 86 больных с глиомами различной степени злока чественности. Возраст больных варьировал от 18 до 70 лет. Локализация функционально значимых зон больших полушарий оценивалась с помощью функциональной МРТ (фМРТ), магнитоэнцефалографии (МЭГ) и нейро психологических исследований. Для планирования ней рохирургического вмешательства проводилась МРТ с трехмерной реконструкцией анатомических структур. Во время операции использовалась навигационная система Stealth Station или стереотаксическое наведение с исполь зованием стандартных стереотаксических рам и ультра звуковое сканирование. Проводился интраоперационный мониторинг: ЭКоГ, ССВП, МВП, а также электростиму ляция коры. На этапе определения речевых зон больные пробуждались. Радикальность удаления опухоли была следующей: то тальное удаление опухоли – в 72% наблюдений, субтоталь ное – в 16% и частичное удаление опухоли в 12% наблю дений. Использование навигационных систем эффективно для планирования оперативного вмешательства и помощи в интраоперационном ориентировании, в особенности при удалении низкой степени злокачественности глиом, не имеющих четких границ и локализующихся в функцио нально значимых зонах мозга, и при удалении глубинно расположенных опухолей. Интраоперационная функцио нальная идентификация коры головного мозга является методом, способным существенно снизить риск нараста ния симптоматики при удалении опухолей больших полу шарий. Проведение интраоперационного функционально го мониторинга и картирования несущественно удлиняет время операции, но в значительной мере обеспечивает со хранность функций, а также создает благоприятные усло вия для увеличения радикальности удаления опухоли и последующего комбинированного лечения глиом. ÊÎÐÐÅÊÖÈß ÈÌÌÓÍÍÛÕ ÍÀÐÓØÅÍÈÉ ÈÍÄÓÊÒÎÐÀÌÈ ÈÍÒÅÐÔÅÐÎÍÀ ÏÐÈ ÊÎÌÁÈÍÈÐÎÂÀÍÍÎÌ ËÅ×ÅÍÈÈ ÃËÈÎÌ III-IV ÑÒÅÏÅÍÈ ÀÍÀÏËÀÇÈÈ Ëèñÿíûé Í. È., Ðîçóìåíêî Â. Ä., Ãíåäêîâà È. À., Ñêèòÿê Ñ. À. Èíñòèòóò íåéðîõèðóðãèè èì. àêàä. À. Ï. Ðîìîäàíîâà ÀÌÍ Óêðàèíû, Êèåâ, Óêðàèíà Современные схемы комбинированного лечения гли ом включают иммунокоррекцию и иммунотерапию. Сре ди иммунотропных препаратов в последние годы все чаще используются индукторы интерферона, эффективность которых подтверждается экспериментальными исследо ваниями. Нами использован индуктор α−, β−, γ−интерферона – амиксин в комбинации с нуклеоплатом по схеме в комп лексной терапии глиом IIIIV степени анаплазии. Группу сравнения составили однотипные больные, не получав шие амиксина. Отмечен иммуномодулирующий эффект амиксина при проведении повторного иммунологического мониторинга после курса амиксина, заключающийся в восстановлении процентного и абсолютного содержания лимфоцитов в периферической крови, повышение СD16 лимфоцитов в 2,5 раза по сравнению с исходными значениями, что под тверждает данные о том, что все типы интерферона сти мулируют NК клетки, ускоряя их созревание в 150300 раз. В группе больных, получавших амиксин, в отличие от группы сравнения, отмечено более высокое содержание цитотоксических Тлимфоцитов (СD8). В то же время не выявлено существенного влияния амиксина на общее содержание СD3, СD4 лимфоцитов, Вклеток в крови. У больных глиомами IIIIV степени анаплазии при иммунологическом мониторинге выявлено высокое содер жание лимфоцитов с FASрецептором (СD95), отвечающих за апоптоз лимфоцитов. Комбинированная терапия с вклю чением амиксина не оказала влияния на этот показатель. Сочетанное назначения амиксин+нуклеоплат по схе ме снижало выработку фактора некроза опухоли иммуно компетентными клетками периферической крови почти в два раза, что отражает высокий противовоспалительный эффект данной схемы комбинированного лечения. Таким образом, полученные данные указывают на це лесообразность использование индукторов интерферона (амиксина) в комбинированном лечении злокачествен ных глиом головного мозга при исходно достаточном уровне лимфоцитов в периферической крови с целью ак тивации противоопухолевого иммунитета и уменьшения иммунодепрессивного действия химиопрепаратов. ÈÍÒÐÀÎÏÅÐÀÖÈÎÍÍÎÅ ÍÀÐÓØÅÍÈÅ ÃÅÌÎÄÈÍÀÌÈÊÈ Ó ÁÎËÜÍÛÕ Ñ ÍÅÂÐÈÍÎÌÀÌÈ VIII ÍÅÐÂÀ ÊÀÊ ÔÀÊÒÎÐ, ÎÏÐÅÄÅËßÞÙÈÉ ÎÁÚÅÌ ÎÏÅÐÀÒÈÂÍÎÃÎ ÂÌÅØÀÒÅËÜÑÒÂÀ Ìàêàðåíêî Ì. Ô., Êà÷êîâ È. À., Àíàíüåâà È. È., Ìîõîâ À. Å. Îáëàñòíîé íàó÷íî-èññëåäîâàòåëüñêèé êëèíè÷åñêèé èíñòèòóò, Ìîñêâà В настоящее время в литературе продолжает дискути роваться вопрос о показаниях к тотальному и субтоталь ному удалению неврином VIII нерва. С одной стороны, современная микрохирургическая и оптическая техника позволяют производить тотальное удаление опухоли, но с другой – сохраняется стабильный уровень послеопера ционной летальности от 3,8 до 4,7%. Проведен анализ 127 историй болезни больных с не вриномами VIII нерва, оперированных в отделении ней рохирургии МОНИКИ в период с января 1983 по декабрь 2000 года. Тотально опухоли были удалены у 98 больных, субтотально – у 29. 43 больным проведен интраопераци онный мониторинг состояния гемодинамики. В 16 слу чаях выявлены интраоперационные нарушения гемоди намики. По характеру проявления выделены две формы нарушений, которые расценены нами как проявление тригеминокардиального рефлекса (ТКР) и вагуснокар диального рефлекса (ВКР). У всех больных размеры опу холи превышали 40 мм в диаметре, преимущественный вектор роста – медиооральный. 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 123 Íåéðîîíêîëîãèÿ ТКР проявился у 11 больных и характеризовался сни жением артериального давления на 40%, урежением пуль са с 78 до 40 ударов в 1 минуту. Средняя длительность про явления ТРК – 40 секунд. После временного прекраще ния хирургических манипуляций эти показатели самосто ятельно возвращались к исходным. В двух случаях дли тельность ТКР превышала 1 минуту, изза угрозы разви тия ишемических нарушений в головном мозге внутри венно вводили атропина сульфат 0,1% – 0,5, после чего гемодинамические показатели также возвратились к ис ходным. Показанием к субтотальному удалению неври ном явилось повторение ТКР более 2 раз. У 5 больных интраоперационно зарегистрировано раз витие ВКР, который характеризовался развитием бради кардии до 20 ударов в 1 минуту и ниже, после чего показа тели артериального давления резко снижались на 54%. Во всех случаях развития ВКР операционные манипуляции прекращались. У одного больного трижды развивалась асистолия с падением артериального давления до 0/0 мм рт. ст. Проведение закрытого массажа сердца позволило восстановить гемодинамические показатели, но в течение 22 часов отмечалась предсердная аритмия, которая купи ровалась самостоятельно без применения специальных медикаментозных средств. При развитии ВКР проводи ли субтотальное удаление опухоли, так как имелась угро за рефлекторного развития необратимых гемодинамичес ких расстройств. Патогенетические аспекты развития ТКР и ВКР до настоящего времени до конца не изучены. Вероятно сле дует согласиться с существующей концепцией, что аффе рентные пути тройничного нерва продолжаются к его главному чувствительному ядру, находящемуся под дном IY желудочка. Короткие нервные волокна внутри ядра пе реключаются на эфферентный путь в ретикулярной фор мации, который начинается в моторном ядре блуждаю щего нерва. Волокнадепрессоры оканчиваются в миокар де и ведут к автономным изменениям работы сердца. Мы не можем исключить, что ТКР и ВКР являются двумя со ставными единого интраоперационного рефлекса, при водящего к тяжелым нарушениям гемодинамики. Таким образом, одним из показаний к субтотальному удалению невриномы VIII нерва является развитие ТКР или ВКР. Этот вопрос должен решаться совместно с ане стезиологом. ÍÀÐÓØÅÍÈß ÖÅÐÅÁÐÀËÜÍÎÉ ÃÅÌÎÄÈÍÀÌÈÊÈ ÊÀÊ ÔÀÊÒÎÐ ÐÈÑÊÀ Ó ÁÎËÜÍÛÕ Ñ ÍÅÂÐÈÍÎÌÀÌÈ VIII ÍÅÐÂÀ Ìàêàðåíêî Ì. Ô., Êà÷êîâ È. À., Ñîêîâ Å. Ë., Àíàíüåâà È. È., Äåðþãèíà Î. Â., Øåðìàí Ë. À. Îáëàñòíîé íàó÷íî-èññëåäîâàòåëüñêèé êëèíè÷åñêèé èíñòèòóò, Ìîñêâà Исследовано 24 больных с невриномами VIII нерва с преимущественно медиооральным направлением роста. Размеры опухоли составили от 2,5 до 8 см в диаметре. Боль ным проводились следующие исследования: аудиометрия, КТ, МРТ. Для характеристики мозгового кровотока ис пользовали радионуклеидную церебральную ангиогра фию (РЦА) и однофотонную эмиссионную компьютер ную томографию (ОФЭКТ). Установлено, что наличие остеохондроза у больных с невриномами VIII нерва приводит к нарушению крово тока в позвоночных и основных артериях, что подтверж дено данными РЦА. Выявлена зависимость нарушения мозгового кровотока в задней мозговой и средней арте риях от размеров опухоли. Эти нарушения появлялись, если опухоли превышали размер 5 см в диаметре (11 на блюдений). Опухоли больших размеров также приводи ли к венозной дисциркуляции в основных венозных кол лекторах головного мозга – в верхнем сагиттальном, по перечных, сигмовидных синусах, а также в яремных ве нах (11 наблюдений). ОФЭКТ позволила выделить нали чие двух вариантов нарушения кровоснабжения ткани головного мозга. При размерах опухоли от 2,5 до 4 см в диаметре выявлена радиологическая картина гипоперфу зии ишемического характера в мозжечке и полюсах ви сочных долей. Если размеры опухоли превышали 5 см в диаметре, то выявлялась радиологическая картина ише мии в лобных и височных долях и в ткани мозжечка (фе номен мозжечкового диасхиза). Таким образом, использованный комплекс обследова ния, включающий радиологические методы исследования мозгового кровотока, позволил выявить новую группу факторов риска у больных с невриномами VIII нерва, про являющуюся различными формами нарушенения цереб ральной гемодинамики. ÈÇÌÅÍÅÍÈß ÒÊÀÍÈ ÀÄÅÍÎÌ ÃÈÏÎÔÈÇÀ ÏÎÑËÅ ÊÐÈÎÂÎÇÄÅÉÑÒÂÈß Ìàíóêîâñêèé Â. À., ×åðåáèëëî Â. Þ., Ïîëåæàåâ À. Â. Êàôåäðà íåéðîõèðóðãèè ÂìåäÀ, Ñàíêò-Ïåòåðáóðã В клинике нейрохирургии ВМедА с 1999 года приме няется комбинированный метод удаления аденом гипо физа, включающий использование холодового разруше ния опухолей с последующими их ультразвуковой дезин теграцией и микрохирургическим удалением. Выполне но 85 трансназосфеноидальных вмешательства по поводу эндосупраселлярных аденом гипофиза с использовани ем криодеструкции. Во время оперативного вмешатель ства под эндовидеомониторингом и рентгеноптическим контролем фрагменты опухолевой ткани до и после холо дового воздействия микрокусачками забирались для гис тологического исследования, помещались в фиксирую щий раствор 10% формалина, далее по стандартной мето дике изготавливались и окрашивались гистологические препараты. Новообразования гипофиза в зависимости от их гис тологического строения, выявляемого при окраске гема токсилинэозином, азурIIэозином делили на хромофоб ную – 31 (%), эозинофильную – 7 (12,5%) и базофильную – 4 (4,2%) аденомы. Кроме того, в 3 (8,3%) наблюдениях выявили так называемые смешанные аденомы, содержа щие в своем составе хромофильные и хромофобные клет ки. При световой микроскопии ткань аденомы гипофиза распознавалась без особого труда по характерным альве олярным структурам и клеточным элементам определен ной окраски. Установлено, что холодовое воздействие приводит к значительным нарушениям в клетках опухо ли и межклеточном пространстве. Микроскопическая картина представляет собой зону практически тотально го некроза, в которой отсутствуют какиелибо жизнеспо собные клетки. В сохранившихся клетках отмечены гру бые изменения в виде гиалиноза цитоплазмы и различ ных степеней пикноза. Холодовое воздействие одинако во разрушительно для любых клеток вне зависимости от их гистологической структуры. Таким образом, при холодовой дезинтеграци аденом гипофиза возникает зона практически тотального разру шения опухолевых клеток. Использование криодеструк ции при транссфеноидальном удалении аденом гипофи за в большинстве случаев позволяет добиваться тотально сти и селективности оперативного вмешательства. III ñúåçä íåéðîõèðóðãîâ Ðîññèè 124 Íåéðîîíêîëîãèÿ ÒÐÀÍÑÑÔÅÍÎÈÄÀËÜÍÀß ÕÈÐÓÐÃÈß ÀÄÅÍÎÌ ÃÈÏÎÔÈÇÀ Ñ ÈÑÏÎËÜÇÎÂÀÍÈÅÌ ÊÐÈÎÄÅÑÒÐÓÊÖÈÈ Ìàíóêîâñêèé Â. À., ×åðåáèëëî Â. Þ., Ïîëåæàåâ À. Â. Êàôåäðà íåéðîõèðóðãèè ÂìåäÀ, Ñàíêò-Ïåòåðáóðã В клинике нейрохирургии ВМедА в последние годы используется криохирургический прибор, особенностью которого является применение в качестве хладоагента и хладоносителя разных веществ. Устройство выгодно от личается от известных аппаратов, работающих на жидком азоте. Оно легко управляемо, контролируем размер и объем ткани, подлежащей деструкции, имеется возмож ность мгновенного прекращения дезинтеграции при не обходимости. Изучены гистологические изменения био логической ткани после криовоздействия. Определено, что участок ткани после замораживания подвергается то тальному некрозу, на месте которого в последующем об разуется кистозная полость. Весьма мало выражена пери фокальная реакция, изменения кровообращения заклю чаются в умеренной локальной гиперемии, которая замет на на протяжении первых 1012 дней после деструкции. Отек в прилежащей к очагу деструкции зоне мозгового вещества незначителен и полностью исчезает к концу вто рой недели. Нами применяется комбинированный метод удаления опухолей гипофиза, включающий использование крио деструкции новообразований с последующим их удале нием. Выполнено 85 трансназосфеноидальных вмеша тельств по поводу эдо и супраселлярных аденом гипофиза с использованием криодеструкции. Перед оперативным вмешательством производится расчет размеров новооб разования, особенно учитываются его диаметр, денсито метрические данные, соотношение с окружающими ана томическими структурами, определяется глубина введе ния криозонда в толщу опухоли и расположение его по отношению к костным структурам. После осуществления доступа к турецкому седлу и опухоли с помощью эндос копа и электроннооптического преобразователя осуще ствляется навигация криозонда в толщу опухолевой тка ни. Данный прибор создает зону холодовой дезинтегра ции ткани диаметром до 1,5 см. После введения зонда в рассчетную зону проводится криодеструкция, которая по времени занимает не более 60 секунд. Далее прибор пере водится в режим размораживания, что требует около 20 секунд, и удаляется из операционной раны. Отмечено, что после выполнения деструкции визуально ткани не изме няются, сохраняя прежние цвет и консистенцию, но кро вотечения из опухоли нет вовсе или оно значительно уменьшается. Далее с помощью ультразвукового дезин тегратора и микрохирургической техники разрушенная ткань опухоли парциально удаляется. При размерах опу холи более 1,5 см в диаметре криодеструкция новообра зования выполняется фрагментарно, сочетаясь с после дующим удалением разрушенной опухолевой ткани с по мощью ультразвукового дезинтегратора и микрохирурги ческой техники. Холодовая дезинтеграция опухолей хиазмальносел лярной области безопасна при использовании зондов с контролируемыми объемами криовоздействия. Примене ние видеоэндоскопической и рентгенологической техни ки в достаточной мере позволяет контролировать распо ложение криоканюли, процесс криодеструкции. Во вре мя оперативного вмешательства сразу после криодеструк ции отмечена меньшая кровоточивость опухолевой тка ни, что упрощает проведение гемостаза и сокращает вре мя операции. Использование криодеструкции при транс сфеноидальном удалении аденом гипофиза позволяет добиваться тотальности и селективности оперативного вмешательства, что подтверждается результатами гисто логического исследования и катамнезом пациентов. ÑÒÅÐÅÎÒÀÊÑÈ×ÅÑÊÀß ËÎÊÀËÜÍÀß ÊÐÈÎÒÎÌÈß Â ÊÎÌÁÈÍÈÐÎÂÀÍÍÎÌ ËÅ×ÅÍÈÈ ÃËÈÀËÜÍÛÕ ÍÎÂÎÎÁÐÀÇÎÂÀÍÈÉ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Ìàðòûíîâ Á. Â., Ïàðôåíîâ Â. Å., Ãîâåíüêî Ô. Ñ., Íèçêîâîëîñ Â. Á., Õîëÿâèí À. È. Âîåííî-ìåäèöèíñêàÿ àêàäåìèÿ, Èíñòèòóò ìîçãà ÷åëîâåêà ÐÀÍ, Ñàíêò-Ïåòåðáóðã Одной из самых сложных задач современной нейроон кологии является лечение злокачественных глиом голов ного мозга. Несмотря на более чем 20 летний период ис пользования комплексного подхода в лечении этой кате гории пациентов с сочетанием хирургического вмешатель ства с тотальным и субтотальным удалением опухоли, пос леоперационной лучевой терапии, включением в лечение все новых и новых химиопрепаратов (ACNU, BCNU, PCNU, MCNU, CCNU, SarСNU, фотемустинCNU) и применением новых схем и путей доставки лекарств, ни какого значительного прогресса в выживании не получе но. Особенно неудовлетворительными являются результа ты хирургического лечения больных со злокачественны ми глиомами, которые связаны не только со значительны ми послеоперационными осложенниями, но формирова нием стойкого неврологического дефицита после прямого оперативного вмешательства. Инфильтративный характер роста глиальных новообразований, вовлечение в опухоле вой рост функционально и жизненно важных отделов го ловного мозга дают основание поставить вопрос о реаль ной целесообразности оперативного вмешательства в ле чение больных с глиальными новообразованиями. Мы проанализировали результаты лечения 3 пациен тов с фибриллярными астроцитомами в возрасте от 33 до 39 лет, которым были выполнены стереотаксические био псии и стереотаксические локальные криотомии, а двум больным была выполнена и стереотаксическая маркиров ка новобразования титановой меткой. У одного из этих пациентов было выполнено три стереотаксических вме шательства, у остальных – по одному вмешательству. Объем криотомии составил от 1/6 до половины объема опухоли. У двух пациентов диагностирована фибрилляр нопротоплазматическая астроцитома, у одного – анап ластическая астроцитома. Продолжительность жизни была оценена от даты радиологической диагностики (КТ и/или МРТ) до января 2002 года. Все пациенты получили лучевую терапию. Общая доза лучевой терапии составила 45,6±4,7 Gy. Первый препарат комбинировали с винкри стином 1,5 мг внутривенно в первый и восьмой день и прокарбазином 100 мг в день в течение 14 дней. Больные получили 3 курса PCVтерапии либо трехкратное внутри венное введение кармустина в дозе 150 мг/м2 через шесть недель. Больные оценивались по результатам КТ, МРТ и неврологического осмотра. Следует отметить высокую эффективность стереотак сической биопсии, так как во всех случаях полученное количество патологической ткани было достаточным для постановки диагноза. В результате комплексного лечения больных с применением стереотаксической локальной криотомии средняя продолжительность жизни состави ла более 23 месяцев, а средняя продолжительность безре цидивного периода составила более 16 месяцев. Эти дан ные не отличаются от результатов, приведенных в других исследованиях, но планирование предполагаемых очагов криодеструкции и стереотаксических траекторий позво 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 125 Íåéðîîíêîëîãèÿ ляет избегать крупных сосудов и функционально важных структур, что обуславливает малую травматичность и бе зопасность этого вида вмешательств. Первые результаты использования стереотаксической биопсии и стереотаксической локальной криотомии по зволяют предположить, что такой подход может быть аль тернативным хирургическому методом лечения злокаче ственных глиом. Для выработки рационального приме нения стереотаксической локальной криотомии внутри мозговых опухолей головного мозга необходимо прове дение дальнейших клинических исследований. ÑÎÂÐÅÌÅÍÍÛÅ ÌÅÒÎÄÛ ËÅ×ÅÍÈß ÎÏÓÕÎËÅÉ, ËÎÊÀËÈÇÓÞÙÈÕÑß Â ÎÁËÀÑÒÈ ØÈØÊÎÂÈÄÍÎÃÎ ÒÅËÀ Ìàðø, Ãåíðè Áîëüíèöà Àòêèíñîíà Ìîðëè, Ëîíäîí, Âåëèêîáðèòàíèÿ THE MODERN TREATMENT OF PINEAL REGION TUMOURS Marsh, Henry FRCS, Consultant Paediatric Neurosurgeon, Atkinson Morley’s Hospital, London, UK За последние двадцать лет методы лечения опухолей, локализующихся в области шишковидного тела, у детей и взрослых претерпели значительные изменения. Причи ной этого являются усовершенствование методов микро скопической нейрохирургии и лучшее понимание пато логии различных опухолей, развивающихся в данной об ласти. Двадцать лет назад стандартным методом лечения было шунтирование с последующей лучевой терапией. Сегодня в большинстве центров используется эндоско пическая вентрикулостомия, биопсия с последующим принятием решения либо о хирургическом вмешатель стве, либо о лучевой и химиотерапии. Лучший метод опе ративного вмешательства при данных опухолях – проти воречивый вопрос. Представлен опыт лечения подобных опухолей, накопленный за последние 15 лет. Особое вни мание обращается на то, когда следует оперировать боль ного и какие методы (стереотаксический, эндоскопичес кий или открытый) нужно использовать при биопсии. The treatment of pineal region tumours in both children and adults has changed greatly over the last twenty years as a result of improvements in the techniques of microscopic neurosur gery and a better understanding of the pathology of the various tumours that occur in the pineal region. Twenty years ago the standard treatment was to insert a shunt and then submit the patient to radiotherapy. Standard treatment now in many cen tres is to carry out an endoscopic ventriculostomy, biopsy the tumour and then decide whether to remove the tumour surgi cally or arrange radiotherapy and chemotherapy. The best way of operating upon these tumours remains controversial. The author’s experience of these tumours over the last fifteen years will be discussed with particular attention to the question of when to operate, and whether to biopsy the tumour using ster eotactic, endoscopic or open surgical methods. ÏÎÐÀÆÅÍÈÅ ÌÎÇÆÅ×ÊÀ ÏÐÈ ÎÏÓÕÎËßÕ ÇÀÄÍÅÉ ×ÅÐÅÏÍÎÉ ßÌÊÈ Ìàñëîâà Ë. Í., Ãóëÿåâ Ä. À, Óëèòèí À. Þ. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã При опухолях задней черепной ямки (ЗЧЯ) церебел лярные симптомы являются одними из наиболее частых и проявляются статокинетическими расстройствами и координаторными нарушениями в конечностях. Проанализированы клинические симптомы у 320 боль ных внемозговыми опухолями ЗЧЯ (невриномы VIII не рва и менингиомы по 160 больных) и у 72 больных с внут римозговыми опухолями (опухоли мозжечка, ствола моз га, IV желудочка). Нарушение статики выявлено во всех группах больных, наиболее часто у больных невриномами VIII нерва (92,5%), причем в 64,9% случаев атаксия преобладала на стороне опухоли. При менингиомах ЗЧЯ и внутримозго вых опухолях статическая атаксия отмечена несколько реже – 78,8 и 73,6% соответственно. Следует отметить, что пошатывание при ходьбе как первый симптом заболева ния преобладало в группе больных внутримозговыми опу холями (11,1%), а у больных невриномами VIII нерва и менингиомами ЗЧЯ заболевание проявилось шаткостью при ходьбе только в 6,9 и 3,8% случаев соответственно. Нарушение координации в конечностях проявлялось неловкостью движений, промахиванием при выполнении координаторных проб, адиадохокинезом, интенционным дрожанием, причем нарушения координации преобладали в руках. Чаще динамическая атаксия наблюдалась у боль ных менингиомами ЗЧЯ, больше была выражена в руках (71,9%), чем в ногах (51,3%), и только в этой группе у 1,9% больных заболевание дебютировало нарушением координа ции в руках. Относительно часто динамическая атаксия с преобладанием в руках отмечена и у больных невриномами VIII нерва (65 и 41,9%) и внутримозговыми опухолями (65,3 и 34,7%). Чаще нарушения координации преобладали в ко нечностях на стороне патологического процесса; при дву сторонней динамической атаксии они нередко были более выражены на стороне локализации опухоли. Нарушение координации в конечностях нередко соче талось с мышечной гипотонией, которая выявлена во всех группах больных. Несколько чаще гипотония наблюда лась у больных внутримозговыми опухолями (41,7%) и невриномами VIII нерва (40,6%), чем у больных менин гиомами ЗЧЯ (32,5%), причем двустороннее снижение мышечного тонуса преобладало у больных внутримозго выми опухолями, а при внемозговых опухолях мышечная гипотония в конечностях чаще наблюдалась на стороне опухоли. Снижение мышечного тонуса было достаточно равномерным как в руках, так и в ногах во всех группах больных, только у больных внутримозговыми опухолями мышечная гипотония преобладала в ногах. Таким образом, статическая атаксия характерна как для внемозговых, так и внутримозговых опухолей ЗЧЯ, осо бенно выражена при невриномах VIII нерва. Нарушение координации преимущественно в руках также наблюда лось во всех группах больных, несколько чаще при менин гиомах ЗЧЯ. Снижение мышечного тонуса в конечнос тях на стороне опухоли чаще наблюдалось при внемозго вой локализации новообразования. После хирургического лечения внемозговых опухолей ЗЧЯ отмечалось значительное уменьшение мозжечковых нарушений у 81% больных невриномами VIII нерва и у 64% больных менингиомами ЗЧЯ. ÕÈÐÓÐÃÈ×ÅÑÊÎÅ ËÅ×ÅÍÈÅ ÎÏÓÕÎËÅÉ ÊÐÀÍÈÎÑÏÈÍÀËÜÍÎÉ ËÎÊÀËÈÇÀÖÈÈ Ìàõìóäîâ Ó. Á., Ãðèãîðÿí À. À., Øèìàíñêèé Â. Í., Ñèäîðêèí Ä. Â. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Опухоли краниоспинальной локализации представля ют собой весьма сложную нейрохирургическую пробле му в плане выбора адекватного оперативного доступа и III ñúåçä íåéðîõèðóðãîâ Ðîññèè 126 Íåéðîîíêîëîãèÿ оптимальной тактики их хирургического удаления. Ана томическая близость к стволу мозга, позвоночной арте рии, краниоцервикальному сочленению создает трудно сти в достижении радикальности, равно как и оператив ной доступности ряда опухолей. За последние 3 года в 5ом нейроонкологическом отде лении НИИ Нейрохирургии им. Н. Н. Бурденко РАМН было оперировано 24 пациента с опухолями краниоспиналь ной локализации, включая 14 больных с менингиомами, 6 – с хордомами, 3 – с внутримозговыми глиальными опухо лями и 1 – с эпендимомой. Средний возраст пациентов со ставил 46 лет, соотношение мужчин и женщин было 1:1. Клиникорентгенологическая картина заболевания, в том числе магнитнорезонансная томография, в зависимости от преимущественного расположения опухолей позволила их разделить на следующие группы: 1. Опухоли переднего отде ла области большого затылочного отверстия (БЗО). 2. Опухо ли переднебокового отдела области БЗО. 3. Опухоли задне бокового отдела области БЗО. 4. Опухоли заднего отдела об ласти БЗО (дорзально расположенные опухоли). 5. Опухоли, занимающие более одного отдела области БЗО (распростра ненные опухоли). 6. Интрамедуллярные опухоли. Целью предложенной классификации является выбор оптимального хирургического доступа к опухоли, что по зволяет провести полное и безопасное удаление опухоли. Для удаления опухоли нами использованы оператив ные доступы, условно разделенные на передние и задние. К передним доступам мы относим трансоральный, транс сфеноидальный, транскраниальныйтрансбазальный, трансцервикальный (переднебоковой) доступы. К задним доступам относятся классический задний срединный до ступ, транскондиллярный заднебоковой доступ. 13 больных оперировано одномоментно. В 3 случаях у больных с распространенными хордомами было предпри нято двухэтапное лечение: после удаления опухоли из поло сти черепа одним из задних доступов, через несколько ме сяцев производился второй этап – трансоральное удаление тех узлов опухоли, которые распространялись в ротоглотку. При интрамедуллярном расположении опухоли (аст роцитома, глиобластома) лечение включало в себя деком прессивную трепанацию задней черепной ямки, биопсию или частичное удаление опухоли, и послеоперационный курс лучевой терапии. Смертность в нашей серии составила 4,17% и была обусловлена внемозговыми причинами. Таким образом, использование различных оператив ных доступов к опухолям краниоспинальной локализации в зависимости от ее расположения и направления роста, особенности тактики хирургического удаления, опреде ляющиеся характером и гистологической природой пато логического процесса, позволили расширить возможно сти и улучшить результаты хирургического лечения этих труднодоступных опухолей. Алгоритм принятия решения с целью адекватного хирургического лечения будет про демонстрирован и обсужден на клинических примерах. ÕÈÐÓÐÃÈß ÎÑÍÎÂÀÍÈß ×ÅÐÅÏÀ Ìàõìóäîâ Ó. Á., Êîíîâàëîâ À. Í., ×åðåêàåâ Â. À., Øèìàíñêèé Â. Í., Òàíÿøèí Ñ. Â., Áåëîâ À. È., Âèíîêóðîâ À. Å., Åðèãîðÿí À. À., Ìóðóñèäçå E. À., Ñèäîðêèí Ä. Â., Òàéëàêîâ Ø. Ò. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Лечение патологических процессов, прежде всего опу холевых, локализующихся в области основания черепа, представляет одну из наиболее сложных нейрохирурги ческих проблем. Многие новообразования, локализую щиеся в основании черепа, до недавнего времени счита лись неоперабельными, и летальность при них достигала очень высоких цифр. В последние десятилетия ситуация стала меняться в лучшую сторону и интерес к проблеме возрос. Причины успехов очевидны: 1. Появление новых методов диагностики, позволяю щих с большей четкостью высказаться о характере пато логического процесса, его взаимоотношениях с окружа ющими структурами. 2. Современная нейрохирургическая техника, в первую очередь микроскопы и совершенные режущие инструмен ты, являются второй составляющей успеха. 3. Не меньшее значение имел прогресс, достигнутый в смежных хирургических специальностях: челюстнолице вой, пластической хирургии, оториноларингологии, оф тальмологии и разделах онкологии, занимающихся хирур гией головы и шеи. Объединение усилий разных специа листов сделало доступным самые глубинные отделы ос нования черепа. В НИИ Нейрохирургии им. Н. Н. Бур денко РАМН на основе богатейшего опыта разработаны принципы хирургического лечения отдельных групп ба зальных опухолей. Речь идет о менингиомах основания черепа, в том числе краниофациальной локализации, ка вернозного синуса, пирамиды височной кости и большо го затылочного отверстия, о хордомах основания черепа, невриномах черепных нервов. злокачественных опухолях основания черепа. При анализе клинического опыта были выработаны об щие положения и задачи хирургии основания черепа: 1. Успешное хирургическое лечение процессов, лока лизующихся в области основания черепа, стало возмож ным благодаря объединению усилий разнопрофильных специалистов. Принцип «командной» работы остается основополагающим и в настоящее время. Идеальными являются условия, когда вместе с нейрохирургом работа ют отоларингологи, окулисты, пластические хирурги, близкие по уровню квалификации и интересам. При от сутствии этих условий нейрохирурги сами должны овла девать подходами и принципами лечения, применяемы ми упомянутыми специалистами 2. Для успешного выполнения сложных вмешательств на базальных отделах черепа необходимо соответствую щее диагностическое и хирургическое оборудование (в первую очередь – специальные режущие инструменты для операций на костных структурах). 3. Важным условием успешной работы является созда ние специальных лабораторий, позволяющих отрабаты вать методику операций на базальных структурах черепа. 4. Выбор доступа должен основываться на всесторон ней оценке характера и распространенности процесса. При необходимости должно планироваться поэтапное удаление опухоли. 5. Важнейшим этапом операции является надежное закрытие дефектов с использованием местных тканей (апоневроза, надкостницы, мышц), жировой ткани и пе ресаженных мягких тканей на сосудистой ножке. Для пре дупреждения ликвореи показано временное применение люмбального дренажа. 6. Специального изучения требует вопрос о месте ра диохирургических вмешательств и применении эндоско пической хирургии в лечении образований краниобазаль ной локализации. 7. Целесообразно создание в стране нескольких цент ров по лечению больных с краниобазальной патологией. 8. Дальнейшее развитие этого направления делает воз можным организацию обучения принципам базальной 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 127 Íåéðîîíêîëîãèÿ хирургии и проведение тематических семинаров и кон ференций. ÑÎÑÒÎßÍÈÅ ÏÅÐÅÊÈÑÍÎÃÎ ÎÊÈÑËÅÍÈß ËÈÏÈÄÎÂ Ó ÁÎËÜÍÛÕ ÑÎ ÂÒÎÐÈ×ÍÛÌ ÈØÅÌÈ×ÅÑÊÈÌ ÈÍÑÓËÜÒÎÌ ÏÎÑËÅ ÓÄÀËÅÍÈß ÎÏÓÕÎËÅÉ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Ìàõìóäîâà Ç. Ñ., Êàðèåâ Ã. Ì., Àáäóêàäûðîâ À. À. Ðåñïóáëèêàíñêèé íàó÷íûé öåíòð íåéðîõèðóðãèè, Êàôåäðà íåéðîõèðóðãèè, ÂÏÕ ÒàøÃîñÌÈ-1, Òàøêåíò, Óçáåêèñòàí Одной из основных причин инвалидизации и леталь ного исхода после удаления опухолей головного мозга является вторичная ишемия мозга, вызванная артериаль ным спазмом. В последние годы были исследованы и описаны важнейшие биохимические механизмы, опре деляющие развитие ишемических нарушений после опе рации удаления опухолей головного мозга. К ним мож но отнести нарушение энергетического обмена, лактоа цедоз и нейротоксические эффекты возбуждающих ами нокислот. Кроме того, показано, что наличие ишемичес кого очага и перифокального отека ведет к активации перекисного окисления липидов мозга (ПОЛ). Эти ме ханизмы наблюдались у нейроонкологических больных в дооперационном периоде в разгаре ишемии и после проведения терапии. Внедрение методики микродиали за позволило проводить исследования содержания в кро ви малонового диальдегида (МДА), супероксиддисмута зы (СОД), общей антиоксидантной активности (АОА), средних молекулярных пептидов (СМП). Показатели этих анализов использовались для прогнозирования ар териального спазма после удаления опухолей супратен ториальной локализации. Настоящие исследования дали возможность изучения взаимосвязи церебральной гемодинамики и энергетичес кого обмена мозга у больных с вторичной ишемией го ловного мозга. Поскольку среди метаболитических рас стройств, определяющих патохимические сдвиги обмена веществ в тканях головного мозга, важное место принад лежит активации ПОЛ, мы изучали состояние этих про цессов в крови больных с артериальным спазмом в пос леоперационном периоде. Исследования проводились у 56 больных с вторичным ишемическим инсультом. Изучали взаимосвязь состоя ния процессов перекисного окисления липидов и выра женности артериального спазма. С этой целью определя ли уровень содержания конечного продукта ПОЛ (СДА, СОД, АОА, СМП) в крови у нейроонкологических боль ных и велось контрольное допплерографическое иссле дование. Показано, что активация процессов перекисного окис ления липидов после удаления опухолей коррелирует с выраженностью артериального спазма и, вероятно, вно сит вклад в развитие ишемических нарушений. Приме нение антикоагулянтной терапии и вазоделятаторов для лечения больных с выраженным артериальным спазмом приводило к снижению интенсивности процессов свобод норадикального окисления липидов до уровня, характер ного для больных с умеренным спазмом. Полученные дан ные свидетельствуют о целесообразности включения вы шеуказанных препаратов (гепарин, фраксипарин, кавин тон, трентал) в комплексную терапию больных в острой стадии вторичных ишемий после удаления опухолей го ловного мозга. Выраженность артериального спазма у больных оценивали с помощью транскраниальной доп плерографии и сопоставляли с данными исследования ми ПОЛ в крови. В результате проведенного исследования были обна ружены достоверные данные о интенсификации процес сов радикалообразования и увеличении концентрации вторичных продуктов ПОЛ в крови всех больных в ост рой стадии артериального спазма. З а к л ю ч е н и е . Проведенные исследования показали, что активация процессов свободнорадикального окисле ния липидов после вторичных ишемических нарушений коррелирует с выраженностью вазоспазма и, вероятно, вносит вклад в развитие ишемического дефицита. Это сви детельствует о целесообразности включения антикоагу лянтов и вазоделятаторов в комплексную терапию боль ных в острой стадии артериального спазма. ÏÅÐÑÏÅÊÒÈÂÛ ÏÐÈÌÅÍÅÍÈß ÎÇÎÍÎÒÅÐÀÏÈÈ Â ÊÎÌÏËÅÊÑÍÎÌ ËÅ×ÅÍÈÈ ÇËÎÊÀ×ÅÑÒÂÅÍÍÕ ÎÏÓÕÎËÅÉ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Ìåäÿíèê È. À., Ðîãîæêèí Ñ. Á., Ðåõàëîâ À. Ô., Ïîëþøêîâ À. Þ. Îáëàñòíàÿ êëèíè÷åñêàÿ áîëüíèöà èì. Í. À Ñåìàøêî, Íèæíèé Íîâãîðîä Лечение больных со злокачественными опухолями го ловного мозга представляет собой сложную и не решен ную на сегодняшний день проблему. Так, несмотря на применение всех современных методов лечения, по дан ным разных авторов, двухлетняя выживаемость этой ка тегории больных составляет 20% и 5летняя – 5%. В связи с этим поиск новых и совершенствование уже существующих методик лечения этой сложной патологии оправдан и крайне необходим. В арсенале терапии злокачественных опухолей голов ного мозга важную роль играет химиотерапия. Во мно гих случаях она является единственно возможным ме тодом лечения. Но, не обладая избирательностью дей ствия, химиотерапевтические препараты оказывают ток сическое воздействие на весь организм. Одним из пато генетических механизмов является нарушение окисли тельного гомеостаза организма. Повреждение фермен тативных систем, накопление недоокисленных продук тов способствует активации свободнорадикальных про цессов. Для снижения их системной токсичности в кли нической практике применяют гемосорбцию, медика ментозную дезинтоксикационную, антиоксидантную терапию. В связи с этим, по нашему мнению, является перспек тивным возможность применения озонотерапии в комп лексном лечении злокачественных новообразований моз га. Известно, что внутривенное введение озонированно го физиологического раствора является мощным актива тором антиоксидантных систем организма. Нами в 12 случаях комбинированной терапии злока чественных опухолей головного и спинного мозга исполь зовались препараты нидран, CeeNU, винкристин, нату лан, этопозид, блеомицин, цисплатин, дакарбазин в тра диционно используемых схемах. На следующие сутки после химиотерапии в качестве адъювантного метода при менялось внутривенное введение озонированного физи ологического раствора с барботажной концентрацией озо нокислородной смеси 2,3 мг/л в количестве 150 мл. Ин фузии проводили ежедневно в количестве 57 процедур. Показатели гомеостаза организма контролировались по данным индуцированной хемилюминесценции и уровню ТБК активных продуктов в крови. Клинически наблюдалось снижение системной ток сичности химиотерапии, снижение миелотоксичности. Биохимические показатели свидетельствовали о норма III ñúåçä íåéðîõèðóðãîâ Ðîññèè 128 Íåéðîîíêîëîãèÿ лизации проантиоксидантного статуса в крови пациен тов. Целесообразно проведение дальнейших исследований, направленных на исследование влияния озонотерапии на динамику окислительных процессов, и возможную их коррекцию при химиотерапии в нейроонкологии. ÏÅÐÑÏÅÊÒÈÂÛ ÈÑÏÎËÜÇÎÂÀÍÈß ÀÍÒÈÎÊÑÈÄÀÍÒΠÏÐÈ ÕÈÌÈÎÒÅÐÀÏÈÈ ÇËÎÊÀ×ÅÑÒÂÅÍÍÛÕ ÎÏÓÕÎËÅÉ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Ìåäÿíèê È. À., Ðîãîæêèí Ñ. Á., Ðåõàëîâ À. Ô., Ïîëþøêîâ À. Þ. Îáëàñòíàÿ êëèíè÷åñêàÿ áîëüíèöà èì. Í. À. Ñåìàøêî, Íèæíèé Íîâãîðîä Из всех существующих методов лечения злокачествен ных опухолей головного мозга, наиболее широкое распро странение в настоящее время получил комбинированный метод, включающий оперативное лечение, химиотерапию и лучевую терапию. Известно пероральное, внутривенное, внутрикаротидное, местное, интратекальное введение химиотерапевтических препаратов. Однако основным дозоограничивающим фактором использования химио терапии является системная токсичность используемых препаратов. По данным литературы, одним из возможных путей снижения побочных эффектов является использование антиоксидантов. Их применение обосновано тем, что ме ханизм действия ряда химиопрепаратов и лучевой тера пии заключается в образовании свободных радикалов, которые и оказывают цитотоксический эффект. Кроме того, известны экспериментальные работы, исследующие противоопухолевую активность самих антиоксидантов. Нами исследовано влияние использования антиокси данта дигидрокверцетина в комплексной химиотерапии 13 больных со злокачественными опухолями головного мозга. Из них глиобластома была диагностирована у 6 па циентов, у 1 – метастаз карциномы, у 5 – анапластичес кая астроцитома, у 1 – анапластическая эпендимоастро цитома. Все больные с рецидивами опухолей. В лечении применялась комбинированная внутривенная и внутри артериальная химиотерапия препаратами нидран (100 мг/ м2), этопозид (100 мг/м2), цисплатин (60 мг/м2). При этом у больных до начала и после лечения исследовалось со стояние проантиоксидантного статуса организма. Иссле довалось содержание диеновых конъюгат, триеновых конъюгат, оснований Шиффа, индуцированной хемилю минесценции. Проведенное исследование показало, что клинически состояние больных при химиотерапии на фоне антиок сидантной терапии улучшалось. Отмечалось снижение общесистемной токсичности в виде снижения тошноты, рвоты, снижения миелотоксичности. Вместе с тем при исходно низких показателях активности свободноради кальных процессов в крови больных отмечено снижение сроков безрецидивного периода при использовании ан тиоксидантов. При нормальных и повышенных показа телях активности процессов ПОЛ использование антиок сидантов не оказывало существенного влияния на сроки ремиссии. Таким образом, использование антиоксидантов при химиотерапии злокачественных опухолей головного мозга требует дальнейшего исследования и возможно только при условии осуществления контроля окислительного гомеостаза организма пациентов. ÏÐÎÄÎËÆÅÍÍÛÉ ÐÎÑÒ ÀÄÅÍÎÌ ÃÈÏÎÔÈÇÀ Ñ ÊÐÎÂÎÈÇËÈßÍÈÅÌ È ÍÅÊÐÎÇÎÌ Â ÎÏÓÕÎËÈ Ìåëüêèøåâ Â. Ô., Êàìàëîâà Ã. Ì., Âàéíøåíêåð Þ. È. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã Принято считать, что продолженный рост (ПР) аденом гипофиза (АГ) развивается из клеток опухоли, оставших ся на внутренней поверхности или инфильтрирующих неудаленную часть капсулы (Кадашев Б. А с соавт., 1989; Лебедев К. А., 1990). Применение микрохирургической техники и комбинированного лечения не привело к ра дикальному уменьшению случаев ПР (Коновалов А. Н. с соавт., 1984). Его частота составляет 17,3% от всех выжив ших больных, нередки случаи запоздалой диагностики и неблагоприятные результаты лечения (Самотокин Б. Л., Хилько В. А., 1985). Это указывает на необходимость рас сматривать ПР АГ с позиций гипофизарного туморогенеза и выявления различных «маркеров», позволяющих про гнозировать повторную опухоль еще при первичной АГ. Так, у 7,7% из числа случаев ПР АГ выявлено изменение иммунофенотипа опухоли, среди которых большинство сопровождалось питуитарной апоплексией (ПА) (Mindermann T., 1994). Есть данные, что ПР наиболее под вержены богато васкуляризированные, гормонально ак тивные, малигнизирующиеся АГ. (Касумова С. Ю., 1985, 1989; Кадашев Б. А., 1992). Такие же АГ нередко сопро вождаются ПА (кровоизлиянием/некрозом в опухоли) (Rovit R. L. 1969, 1972; MullerJensen A., 1981). Целью исследования явилось выявление корреляции между кровоизлиянием/некрозом в АГ и продолженным ростом опухоли. М а т е р и а л и м е т о д ы и с с л е д о в а н и я . Проана лизировано 347 больных АГ, оперированных в институте за 198999 гг. с применением двустороннего субфронталь ного доступа. Они поделены на 3 группы: первая – 81 боль ной с геморрагией в АГ или кистами с признаками пере несенного кровоизлияния, вторая – 45 больных с некро зом в АГ, кистами с белесоватыми стенками и содержи мым, третья группа – 221 больной без кровоизлияния/ некроза в АГ. Кровоизлияние/некроз выявлялись при КТ, МРТ, на операции, гистологическим методом. Из 347 у 40 (11,5%) выявлен ПР: 23 мужчины и 17 женщин, сред ний возраст 46,6 лет. Пациентов с ПР АГ распределяли по группам в зависимости от наличия или отсутствия гемор рагических/некротических изменений при последней гос питализации больного. Процент больных с ПР, получав ших лучевую терапию, одинаков во всех трех группах. Ги стологический тип ПР АГ (световая микроскопия): хро мофобных – 22, хромофобноэозинофильных – 4, эози нофильных – 2, анапластических – 10 АГ, нет данных по 2; гистологический тип первичных АГ: хромофобных – 22, хромофобноэозинофильных – 5, эозинофильных – 4, хромофобнобазофильных – 1, анапластических – 6, нет данных по 2 АГ. Р е з у л ь т а т ы . Из 40 больных с ПР 20 пациентов от носились к первой группе (24,7% от группы), 6 – ко вто рой (13,3%) и 14 – к третьей (6,3%). Отличие первых двух групп от третьей достоверно (P<0,01). Общая летальность среди больных с ПР опухоли (без учета ПА) составила 7 (17,5%), из которых 5 (12,5%) – больные первой группы, а 2 (5,0%) – второй. Летальных исходов у больных с ПР опухоли без ПА в наших наблюдениях не было (Р<0,05). У большинства больных ПР АГ наблюдался однократ но: у 16 (80,0%), у 5 (83,3%), у 12 (85,7%) больных первой, второй, третьей групп соответственно. Дважды во всех трех группах ПР встречался гораздо реже. Три и четыре раза за 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 129 Íåéðîîíêîëîãèÿ период заболевания ПР АГ зарегистрирован только в пер вой группе в 2 (10,0%) наблюдениях. В первой группе чаще и вне зависимости от гормональ ной активности АГ отмечались короткие, до 2 лет, перио ды клинической ремиссии (P<0,05). Только в первой груп пе были случаи развития продолженного роста АГ с ин тервалом до 3 месяцев. Хромофобные АГ превалировали среди АГ с продол женным ростом. В первой группе продолженный рост был выявлен у всех эозинофильных (2 наблюдения) и у всех смешанных АГ (4). Степень анаплазии при ПР АГ увели чивалась более значительно в третьей группе (больные без кровоизлияний/некрозов в опухоли). В первой группе (кровоизлияние в опухоли) из 20 слу чаев продолженного роста АГ при рассмотрении их пер вичных опухолей у 16 были выявлены кровоизлияния, у 3 – некроз и по 1 данных нет. Во всех 6 наблюдениях с ПР второй группы (некроз в опухоли) в первичных АГ также наблюдался некроз. В третьей группе из 14 случаев ПР кровоизлияний/некрозов не было в 13 первичных АГ, по 1 данных нет (P<0,01). В ы в о д ы . АГ с кровоизлияниями и некрозами в опу холи, независимо от гистологического типа, более склон ны к продолженному росту, чем «неосложненные» опу холи. У них чаще, особенно при кровоизлияниях в АГ, отмечаются короткие периоды клинических ремиссий и летальные исходы. Кровоизлияния/некрозы, наблюдав шиеся в первичной АГ, как правило, «рецидивируют» при продолженном росте опухоли. Вероятно, что склонность к продолженному росту АГ с кровоизлияниями/некроза ми определяется свойствами самой опухолевой ткани, а также сохранностью после удаления первичной АГ фак торов, способствующих как росту опухоли, так и разви тию сосудистых катастроф в ней. ND-YAG-ËÀÇÅÐ Â ÌÈÊÐÎÕÈÐÓÐÃÈÈ ÝÊÑÒÐÀ- È ÈÍÒÐÀÌÅÄÓËËßÐÍÛÕ ÎÏÓÕÎËÅÉ Ìîèñååâ Â. Â., Ñòóïàê Â. Â., Êîáçåâ Â. Â., Ìàéîðîâ À. Ï., Ñòðóö Ñ. Ã., À. Þ. Öâåòîâñêèé Ñ. Á., Çàéäìàí À. Ì., Ñåðïåíèíîâà Í. Í. ÍÈÈ òðàâìàòîëîãèè è îðòîïåäèè, Íîâîñèáèðñê Опухоли спинного мозга (СМ) составляют среди забо леваний нервной системы от 1,4% до 3%. Хирургия опу холей СМ всегда направлена на полное удаление опухо ли, сдавливающей СМ, его сосуды, оболочки и корешки и нарушающей его многообразные функции. Для этого в настоящее время используется микрохирургическая тех ника, ультразвуковые аспираторы. Но несмотря на это, до конца остается нерешенным ряд проблем. Одна из них – это отработка щадящих операционных доступов к опу холям. При их удалении, как правило, еще используется ламинэктомия на нескольких уровнях. Другой нерешен ной проблемой является дополнительная травма СМ, воз никающая в момент удаления опухоли. Любые манипу ляции на СМ, даже с использованием микрохирургичес кой техники, ведут к травматизации мозга, что, несомнен но, приводит к углублению неврологической симптома тики и удлинению реабилитационного периода. Для решения вышеперечисленных задач в клинике нейрохирургии Новосибирского НИИТО у 67 больных с экстра и интрамедуллярными опухолями при их удале нии использован NdYAGлазер. Среди всех опухолей СМ экстрамедуллярных было 45, интрамедуллярных – 22. Среди экстрамедуллярных опухолей преобладали опухо ли интравертебральной локализации – их было 41. Инт ра, экстравертебральные экстрамедуллярные опухоли («песочные часы») диагностированы у 4 пациентов. На шейном уровне их было 15, на грудном – 16, поясничном – 10, крестцовом – 4. По гистологической структуре наи большее количество среди них было менингиом – 22. Не вриномы диагностированы у 18, менингосаркомы – у 5 больных. Все интрамедуллярные опухоли были протяженными и распространялись по длиннику, как правило, от 4 до 16 позвонков. Наиболее частая их локализация была в гру допоясничной области (12 пациентов), в шейной облас ти – у 2 больных, а в шейногрудном отделе позвоночни ка они диагностированы у 8 больных. Гистоструктура их была такова: астроцитомы были у 13, а эпендимомы у 9 пациентов. Основным методом диагностики опухолей служили кли нические исследования и МРТ спинного мозга. Физиоло гическое исследование чувствительных и пирамидных пу тей СМ в динамике осуществлялось с помощью ЭМГ, ССВП и транскраниальной магнитной стимуляцией. Применение лазера при удалении экстрамедуллярных опухолей, распространяющихся на протяжении 1,52 по звонков, и при интрамедуллярных образованиях, распро страняющихся на протяжении 49 позвонков, позволяло проводить нам их удаление в пределах видимых границ из гемиинтерламинэктомических доступов различной мо дификации с сохранением важных костных структур зад него опорного комплекса позвоночника. Так, например, использование лазера на микрохирургическом этапе уда ления высоко васкуляризированных и плотных экстраме дуллярных опухолей, расположенных интравертебрально, распространяющихся на протяжении 1,52 позвонков, позволяло нам проводить их тотальную резекцию из ин тергемиламинэктомического доступа только на одном уровне на ипсилатеральной стороне локализации опухо ли. При экстрамедуллярных образованиях, расположен ных интраэкстравертебрально («песочные часы»), то тальное удаление опухоли осуществлялось также из геми интерламинэктомических доступов одномоментно, не смотря на наличие большого экстравертебрального ком понента, сохраняя при этом важные анатомические об разования: остистые и суставные отростки, дужки и связ ки позвоночника. Послеоперационный период протекал, как правило, гладко без выраженного углубления очаговой неврологи ческой симптоматики. Данные МРтомографии СМ, по лученные в динамике, электрофизиологические исследо вания свидетельствовали о том, что использование хирур гического лазера не приводит к ухудшению функции СМ, к дополнительной его травме и прогрессированию отека. ÐÅÇÓËÜÒÀÒÛ ÕÈÐÓÐÃÈ×ÅÑÊÎÃÎ ËÅ×ÅÍÈß ÎÏÓÕÎËÅÉ ÕÈÀÇÌÀËÜÍÎ-ÑÅËËßÐÍÎÉ ÎÁËÀÑÒÈ È ÏÅÐÅÄÍÈÕ ÎÒÄÅËΠIII ÆÅËÓÄÎ×ÊÀ Ìîëäîâàíîâ Â. À., Ìàñëåííèêîâà Å. Í., Êîâàëåâ Ä. Ã., Êîíñòàíòèíîâ À. À. Êëèíèêà íåéðîõèðóðãèè Ãîñóäàðñòâåííîãî ìåäèöèíñêîãî óíèâåðñèòåòà, Ðîñòîâ За последние 7 лет (этот период соответствует внедре нию в повседневную практику клиники МРТ и операци онного микроскопа) авторами выполнено 70 вмеша тельств по поводу опухолей хиазмальноселлярной обла сти и передних отделов III желудочка. Все пациенты прошли комплексное КТ и МРТ обсле дование, которое позволило определить локализацию, границы, структуру образования, взаимоотношение с ок ружающими тканями, изменения ликвородинамики, III ñúåçä íåéðîõèðóðãîâ Ðîññèè 130 Íåéðîîíêîëîãèÿ предположить гистогенез. КТ более четко выявляла наличие изменений в костях основания черепа, участки кальцинации опухоли. При менение МРТ позволяло точнее распознать структуру опухоли, дифференцировать солидный и кистозный ком поненты, визуализировать сосуды, что позволяло в подав ляющем большинстве случаев не применять ангиографи ческое обследование, за исключением 3 наблюдений боль ных с аденомами гипофиза, у которых заболевание дебю тировало клиникой поражения глазодвигательного нерва на фоне эпизода головной боли. Значительную часть больных составили пациенты с большими или гигантскими аденомами гипофиза (34), из них у 3 опухоль заполняла полость III желудочка, а у 2 больных злокачественная аденокарцинома распространя лась эксцентрично параселлярно и субтенториально. Краниофарингиомы составили 15 наблюдений (из них 6 располагались преимущественно в полости III желудоч ка), глиомы III желудочка – 6, метастазы рака в III желу дочек – 2, коллоидные кисты III желудочка – 2, глиома тоз – 1, гигантская арахноидальная киста III желудочка – 1, холестеатомы – 3, гигантская липома мозолистого тела – 1, эктопическая пинеалома – 1, хондросаркома – 1, те ратобластома – 1, менингиомы с преимущественным ро стом из диафрагмы турецкого седла – 2. 12 пациентов составили дети, начиная с двухлетнего возраста. Впервые оперировано 64 пациента. Умер один (1,6%), 65 лет, вследствие тампонады III желудочка кровью. Повторно оперировано двое больных в связи с продол женным ростом кранифарингиомы и один с гигантской анапластической аденомой гипофиза, врастающей в ка вернозный синус (последний умер от тромбоза ВСА). В зависимости от размеров и локализации опухоли ис пользовали различные доступы: трансвентрикулярный – в случаях значительного асимметричного расширения боковых желудочков; транскаллезный – при коллоидных и арахноидальных кистах с вскрытием межножковой ци стерны, наиболее часто применяли односторонний суб фронтальный доступ. Причем хочется подчеркнуть его незаменимость при гигантских аденомах гипофиза, рас пространяющихся в полость III желудочка и параселляр но. В случаях значительного параселлярного распростра нения он легко трансформируется в лобноптериональ ный. При распространении опухоли в III желудочек и гли омах передних отделов III желудочка он дополнялся дос тупом через терминальную пластинку (13 наблюдений), что позволяло широко ревизовать III желудочек. В трех случаях использована комбинация трансвентрикулярно го и субфронтального доступов. Во всех случаях стреми лись к максимально возможной радикальности, оставляя лишь фрагменты опухоли, интимно связанные с дном III желудочка, стеблем гипофиза, врастающие в кавернозный синус, с последующим КТ контролем. Адекватное общее обезболивание обеспечивало ста бильность гемодинамических, метаболических и нейро вегетативных функций. Использовались как диприван, дормикум, рогипнол, гипномидат, так и традиционные – седуксен, оксибутират натрия. Широко применялась ней ролептаналгезия, управляемая гипотония с воздействием на альфаадренорецепторы. Контроль за состоянием больного и адекватностью анестезии осуществлялся при помощи мониторинга с оценкой респираторных и гемо динамических показателей. Как правило, в послеопера ционном периоде развивались нейроэндокринные нару шения разной степени выраженности. На первом месте – тяжелые нарушения электролитного баланса и метабо лизма в целом, на втором – расстройство электролитного и углеводного обменов, на третьем – сочетание наруше ний всех видов основного обмена с яркими проявления ми гипофункции щитовидной железы и надпочечников. Традиционная заместительная терапия (Lтироксин, глю кокортикоиды, адиуретин) в ряде случаев не способство вали стабильной коррекции нейроэндокринного синдро ма. С целью пресинаптической стимуляции альфа2ад ренорецепторов использовался на фоне заместительной терапии клофелин в дозировке 1 мкг/кг в/м с интервалом 6 часов в первые сутки с последующим переходом на ми нимальные гемодинамически незначимые дозировки. Таким образом, использование современного диагно стического комплекса, различных вариантов хирургичес ких доступов при полноценном анестезиологическом и реанимационном обеспечении позволяет получить хоро шие клинические результаты при высокой степени ради кальности вмешательств. ÍÀÐÓØÅÍÈÅ ÈÍÒÐÀÊÐÀÍÈÀËÜÍÎÃÎ ÂÅÍÎÇÍÎÃÎ ÊÐÎÂÎÎÁÐÀÙÅÍÈß ÏÐÈ ÎÏÓÕÎËßÕ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ ÑÓÏÐÀ-ÑÓÁÒÅÍÒÎÐÈÀËÜÍÎÉ ËÎÊÀËÈÇÀÖÈÈ Ìóçëàåâ Ã. Ã., Ðûæèé À. Â., Ðûæèé Â. Ã. Êóáàíñêàÿ ãîñóäàðñòâåííàÿ ìåäèöèíñêàÿ àêàäåìèÿ, êàôåäðà íåðâíûõ áîëåçíåé è íåéðîõèðóðãèè, Êðàñíîäàð В настоящее время в литературе в основном рассмат риваются вопросы, посвященные патологии артериаль ного русла головного мозга при его опухолях. В то же вре мя 80% объема циркулирующей в полости черепа крови приходится на венозную систему. Опухоли головного моз га, вызывая нарушения ликворооттока, повышение внут ричерепного давления, компрессию венозных коллекто ров, вызывают значительные нарушения венозного отто ка, что не может не сказаться на клинике и тактике хи рургического вмешательства, особенно если сама опухоль включается в дренажную венозную систему. Однако раз работка информативных, объективных, неинвазивных методов, характеризующих церебральный венозный кро воток в цифровом эквиваленте на этапах диагностики и хирургического лечения опухолей головного мозга, про должает оставаться актуальной проблемой. Не вызывает сомнений необходимость контроля изменений венозно го давления как одного из основных составляющих ком понентов внутричерепного давления, поскольку в ходе оперативного вмешательства на головном мозге интрао перационный мониторинг венозного давления играет су щественную роль в определении границ физиологичес кой дозволенности и этапности хирургических манипу ляций. Исследование проводилось у 90 больных с опухолями головного мозга. Супратенториальные глиомы – 32 боль ных, субтенториальные опухоли, компремирующие лик воропроводящие пути – 26 больных, менингиомы пара сагиттальной локализации – 32 больных. Контрольная группа – 35 человек без патологии головного мозга. Исследование проводилось до операции, на основных этапах операции и в послеоперационном периоде. Сте пень нарушения венозного кровообращения определяли путем измерения диастолического давления в централь ной вене сетчатки обоих глаз (ДЦВС) при помощи элект ронного офтальмодинамоментра ОЭ01, линейной ско рости кровотока в прямом синусе (ЛСКПС) с использо ванием аппарата «Сономед 300/м». Функциональная зна чимость вен мягких покровов головы в церебральном кро вотоке у больных с менингиомами парасагиттальной ло 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 131 Íåéðîîíêîëîãèÿ кализации определяли перед операцией с помощью мо дифицированной пробы «жгута». Интраоперационно проводился мониторинг ДДЦВС на этапах проведения кожного разреза, трепанации, вскрытия твердой мозго вой оболочки, удаления опухоли и после наложения кож ных швов. На 11е сутки после операции проводилось контрольное измерение ДДЦВС и ЛСКПС. Полученные результаты сопоставлялись с данными объективного и неврологического статуса, картиной глазного дна, ЭЭГ, РЭГ, ЭхоЭС, КТ и (или) МРТ головного мозга, цереб ральной ангиографии. Установлено, что опухоли головного мозга приводят к гемодинамически значимым изменениям кровотока во всех звеньях его венозной, с преобладанием на стороне опухоли. Наиболее грубо нарушают венозный кровоток менингиомы парасагиттальной локализации, которые не только берут на себя роль дополнительного резервуара венозной крови, но и способствуют развитию большого количества венозных коллатералей, повреждение которых может ухудшить исход операции. Следующими по часто те являются злокачественные глиомы, характеризующи еся быстрым ростом, выраженным массэффектом и на личием артериовенозного шунтирования между опухо левыми и мозговыми сосудами. Пути оттока венозной крови из полости черепа могут определяться не только характером сосудистой сети опухоли, но и индивидуаль ной особенностью ауторегуляции венозной системы. Компенсаторные возможности венозного оттока при опу холях головного мозга находятся на грани субкомпенса ции и при неправильно выбранной оперативной тактике декомпенсация развивается на операционном столе или в ближайшем послеоперационном периоде. Рациональ ная хирургическая тактика, учитывающая состояние ве нозного кровообращения, в большинстве случаев ведет к нормализации венозного отока и позволяет избежать ос ложнений как во время операций, так и в послеопераци онном периоде. Предлагаемые методы неинвазивной ди агностики нарушений венозного кровообращения при опухолях головного мозга в дооперационном периоде и во время основных этапов операции позволяют опреде лить наиболее рациональную хирургическую тактику и улучшить исход операций. ÎÑÎÁÅÍÍÎÑÒÈ ÊËÈÍÈ×ÅÑÊÎÉ ÊÀÐÒÈÍÛ ÈÍÒÐÀÌÅÄÓËËßÐÍÛÕ ÎÏÓÕÎËÅÉ ÑÏÈÍÍÎÃÎ ÌÎÇÃÀ Ìóðàâñêèé À. Â. Èíñòèòóò íåéðîõèðóðãèè èì. àêàä. À. Ï. Ðîìîäàíîâà ÀÌÍ Óêðàèíû, Ìåäèöèíñêàÿ àêàäåìèÿ ïîñëåäèïëîìíîãî îáðàçîâàíèÿ, Êèåâ, Óêðàèíà Проведен анализ особенностей клинической картины у 70 больных с интрамедуллярными опухолями спинного мозга, которые находились на лечении в первой спиналь ной клинике института нейрохирургии им. акад. А. П. Ро моданова АМН Украины с 1992 по 2000 год. Неврологический статус оценивался до операции, сразу же после операции, на момент выписки больного из ста ционара. Для оценки неврологического статуса и функ ционального состояния больных использовалась модифи цированная шкала McCormick. Длительность периода от первых клинических прояв лений до момента операции составляла от 45 дней до 9 лет (в среднем 32,6 месяцев). Клинические проявления инт рамедуллярных опухолей зависели от их расположения в спинном мозге. Наиболее общими клиническими прояв лениями были: боль в позвоночнике у 51 больного (72,86%), ухудшение движений в конечностях – у 45 (64,29%), чувствительные расстройства на туловище и в конечностях – у 24 (34,29%), прогрессирование кифос колиоза – у 21 (30,00%). У большинства пациентов ряд вышеуказанных симптомов провоцировался травмой. Боль была одним из наиболее частых клинических про явлений интрамедуллярных опухолей спинного мозга. Как правило, боль наблюдалась у таких больных на про тяжении длительного времени, имела достаточно интен сивный характер, локализовалась местно в месте проек ции опухоли на позвоночник. У 9 больных (12,86%) имел место радикулярный характер боли, который напоминал другие неврологические заболевания. Ухудшение моторных функций в конечностях было характерным признаком интрамедуллярных опухолей у 45 больных на момент постановки диагноза. Ухудшение мо торных функций было связано с уровнем расположения опухоли, ее размером. Чувствительные расстройства по типу болевых дизес тезий были характерными для трети больных с интраме дуллярными опухолями, как правило, характеризовались болевыми ощущениями холода или жара в одной или не скольких конечностях. Эпендимомы шейной локализа ции (в отличие от других гистологических типов опухол ей) характеризовались билатеральными симметричными дизестезиями, однако эта особенность не была характер ной для грудного уровня. В 6 (8,57%) случаях болевые ди зестезии были первыми симптомами клинического тече ния интрамедуллярных опухолей спинного мозга. Тазовые нарушения характеризовались наличием задер жки и недержанием мочи и в основном имели место при интрамедуллярных опухолях грудного отдела и конуса. В наших наблюдениях доминировали больные, функ циональное состояние которых перед операцией соответ ствовало IIIV степени по модифицированной шкале McCormick. Все анализируемые нами больные с интрамедуллярны ми опухолями спинного мозга были прооперированы. Послеоперационный неврологический статус оценивал ся на момент выписки больных со стационара. У большин ства больных послеоперационный неврологический ста тус оставался без изменений (38 наблюдений) или имело место улучшение по сравнению с предоперационным пе риодом (19 наблюдений), ухудшение в неврологическом статусе наблюдалось в 13 случаях. Чем меньшим невро логический дефицит был в предоперационном периоде, тем лучший функциональный результат наблюдался в послеоперационном периоде. Среди случаев, где имело место улучшение в невроло гическом статусе в послеоперационном периоде, подав ляющее большинство составило улучшение на одну сте пень у 15 больных из 19; улучшение на две степени было отмечено у 4 больных. Среди больных, где имело место ухудшение в невроло гическом статусе, у 9 из 13 ухудшение составило только на одну степень по сравнению с предоперационным состоя нием. Случаев, где ухудшение составляло более чем одну степень, было 4, на две степени – 2, на три степени – 2. После 1996 года в наших наблюдениях не было паци ентов, у которых в послеоперационном периоде по срав нению с предоперационным состоянием ухудшение не врологического статуса составило больше двух степеней. Выводы. 1. Клинические проявления интрамедуллярных опухо лей зависели от их расположения в спинном мозге. 2. Ранняя клиническая диагностика заболевания дает возможность вовремя провести оперативное лечение с наи III ñúåçä íåéðîõèðóðãîâ Ðîññèè 132 Íåéðîîíêîëîãèÿ меньшим риском ухудшения неврологического статуса. ÂÍÓÒÐÈ×ÅÐÅÏÍÛÅ ÝÏÈÄÅÐÌÎÈÄÍÛÅ ÊÈÑÒÛ Ìóðóñèäçå ÍÀ., Ìàõìóäîâ Ó. Á., Òàíÿøèí Ñ. Â., Øèìàíñêèé Â. Í. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà По данным НИИ Нейрохирургии им. Н. Н. Бурденко РАМН, внутричерепные эпидермоидные кисты состав ляют 0,5% от всех опухолей центральной нервной систе мы. В литературе под названием эпидермоидная киста опи сываются три генетически различных образования: 1. Первичные или истинные опухоли, развивающиеся из зародышевых включений эмбрионального эпидермиса. 2. Вторичные опухоли или воспалительные холестеа томы, скорее всего, воспалительногиперпластической природы. 3. Эпидермоидные кисты, происходящие вследствие механического перемещения клеток эпидермиса в суба рахноидальное пространство. В представленном докладе анализируются только ис тинные холестеатомы. Боковые цистерны мостомозжечкового угла и хиаз мальноселлярная область являются излюбленными ме стами расположения этих опухолей. Из всех внутричереп ных эпидермоидных кист 75% развиваются интрадураль но, 71% встречается субтенториально, 10,5% в хиазмаль носеллярной области, 60% в мостомозжечковом углу. Из всех опухолей мостомозжечкового угла эпидермоидные кисты составляют от 2,8% до 6,3%. Описаны редкие слу чаи эпидермоидных кист пинеальной области, препонти нокливальной, четвертого желудочка, третьего желудоч ка, боковых желудочков, внутримозговых, межполушар ной щели, краниоорбитальные и множественные. Эпи дермоидные кисты могут сочетаться с опухолями другой гистологической структуры. Характерным является асептический менингит типа Mollaret, отличающими признаками которого является стерильный посев ликвора, повышенное содержание бел ка, плеоцитоз, наличие кристаллов холестерола и боль ших эндотелиальных клеток До эры МРТ дифференциальная диагностика эпидер моидных кист была трудной и в большинстве наблюде ний заканчивалась во время операции. По мнению большинства авторов, вследствие того, что при микроразрывах эпидермоидной кисты развивается хорошо выраженная воспалительная реакция и форми руется тесная связь между капсулой опухоли и нейросо судистыми образованиями, ставить цель достижения аб солютной радикальности нерационально. Задачей будущей нейрохирургии является функцио нально щадящее 100% радикальное удаление этих добро качественных опухолей. ÄÎÎÏÅÐÀÖÈÎÍÍÎÅ ÎÁÎÑÍÎÂÀÍÈÅ ÂÛÁÎÐÀ ÄÎÑÒÓÏÎÂ Ê ÏÅÒÐÎÊËÈÂÀËÜÍÛÌ ÌÅÍÈÍÃÈÎÌÀÌ Ìóõàìåòæàíîâ Ä. Æ., Ìàõìóäîâ Ó. Á., Øèìàíñêèé Â. Í. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà С применением расширенных доступов к основанию черепа стало возможно более радикальное и даже 100% удаление опухолей (O. AlMefty, M. Samii, L. Sekhar). Учитывая современные диагностические возможнос ти, необходимо выяснить до операции строение артери ального круга большого мозга, компенсаторные возмож ности коллатерального кровообращения с различными тестами, источники кровоснабжения и дренирования па тологического образования, состояние венозной системы, развитость сигмовидных синусов и их длину, высоту выс тояния луковицы яремной вены и ее размеры, развитость нижней анастомотической вены. На КТ и МРТ можно выяснить строение и расположения всех анатомических структур. В дополнение можно на томограммах постро ить схему предполагаемого доступа, начертить оси и углы предполагаемого хирургического воздействия, сопоста вить глубину раны и углы «хирургической атаки» при раз личных возможных доступах и, наконец, можно просто сопоставить глубину раны с длиной рабочей части хирур гических инструментов (что также иногда бывает необ ходимо). Более широкое распространение пирамидных доступов к петрокливальной области обусловлено тем, что они наи более короткие, многоосевые, дают возможность подой ти одновременно к средней и задней черепным ямкам, обеспечивают широкий подход и хороший контроль за внутренней сонной и позвоночной артериями, сигмовид ным синусом, яремной веной, нижней анастомотической веной, кавернозным синусом и почти всеми черепномоз говыми нервами. Кроме гистологических типов, форм и источников кровоснабжения петрокливальных менинги ом, на выбор тактики лечения влияют: консистенция опу холи (плотная или мягкая), степень инфильтрации окру жающих структур, ширина места исходного роста (мат рикса) опухоли. Вопросы о показаниях и противопоказаниях к приме нению базальных доступов при петрокливальных менин гиомах являются важными и влияют на результаты хирур гического лечения. Если возможно удаление петрокливальной менингио мы через традиционный (простой) доступ с минимальны ми неврологическими нарушениями и приемлемой ради кальностью, то нужно использовать такую возможность. При измерении и сопоставлении глубины ретролаби ринтного пресигмовидного доступа с ретросигмовидным и субвисочным на 7 срезах через 1 мм, мы получили сле дующие средние соотношения: при ретролабиринтном доступе глубина раны до капсулы опухоли 45 мм (4,5 см) с вынужденной грубой тракцией мозжечка и недосягаемым противоположным (правым) полюсом опухоли, до кото рого еще 42 мм (т. е. 87 мм или 8,7 см) (длина рабочей ча сти стандартных микрохирургических байонетных пин цетов 80 мм). Невозможно подойти к части опухоли в ка вернозном синусе и выходящей в вырезку намета мозжеч ка. При субвисочном доступе глубина раны до опухоли 40 мм (средняя) с вынужденной грубой тракцией височной доли и после рассечения намета мозжечка до ствола еще 30 мм. Но недоступны при этом подходе в задней череп ной ямке нижний, левый и правый полюса опухоли. При ретролабиринтном пресигмовидном доступе глубина раны до капсулы опухоли 21 мм (с запасом 2 мм) при не значительной тракции мозжечка и височной доли. При этом подходе доступны все отделы опухоли. Углы «хирургической атаки» при ретросигмовидном доступе – 18°, при субвисочном для средней черепной ямки – 45°, для задней черепной ямки – 12°, при пресиг мовидном – 2540°. Таким образом, на дооперационном этапе на основа нии всех обследований, возможно обоснование выбора доступа к петрокливальным менингиомам. Подробное сообщение будет представлено в докладе. 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 133 Íåéðîîíêîëîãèÿ ÒÎÏÎÃÐÀÔÎ-ÀÍÀÒÎÌÈ×ÅÑÊÎÅ ÎÁÎÑÍÎÂÀÍÈÅ ÊËÀÑÑÈÔÈÊÀÖÈÈ ÏÅÒÐÎÊËÈÂÀËÜÍÛÕ ÌÅÍÈÍÃÈÎÌ Ìóõàìåòæàíîâ Ä. Æ., Ìàõìóäîâ Ó. Á., Øèìàíñêèé Â. Í. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà ÕÈÐÓÐÃÈ×ÅÑÊÀß ÒÀÊÒÈÊÀ ËÅ×ÅÍÈß ÁÎËÜÍÛÕ Ñ ÎÏÓÕÎËßÌÈ ÏÎÇÂÎÍÎ×ÍÈÊÀ Ìûøêèí Î. À., Øåâåëåâ È. Í., Äóðîâ Î. Â., Òèññåí Ò. Ï. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Петрокливальные менингиомы – в большинстве слу чаев доброкачественные опухоли. Современное отноше ние к доброкачественным опухолям основания черепа заключается в их радикальном удалении. С развитием хи рургии основания черепа увеличилась радикальность уда ления петрокливальных менингиом с 26% до 71100% и снизилась послеоперационная летальность с 50% до 90%. Менингиомы петрокливальной области до настояще го времени представляют серьезную хирургическую про блему. Нейрохирурги пытались и продолжают предлагать различные классификации менингиом задней черепной ямки, на основании которых можно выработать хирурги ческую тактику. Особую сложность в хирургии менинги ом задней черепной ямки представляют петрокливальные менингиомы. Некоторые клиники (нейрохирурги) к петрокливаль ным менингиомам относят менингиомы кавернозного синуса и области малого крыла основной кости, в связи с чем мы с точки зрения анатомии решили конкретизиро вать, какую область необходимо относить к петрокливаль ной. Первичные менингиомы ската срединного расположе ния встречаются крайне редко. Поэтому обоснованно выделены менингиомы, местом исходного роста которых являются арахноидэндотелиальные клетки в толще твер дой мозговой оболочки петрокливальной области. Пет рокливальная область располагается вдоль петрокливаль ного синхондроза, на стыке основной кости, пирамиды височной и ската затылочной костей. Границы петрокливальной области следующие: лате ральная – латеральный край вырезки тройничного нерва (вырезки Грубера), область входа тройничного нерва в твердую мозговую оболочку, далее она идет вниз по ус ловной линии, соединяющей латеральный край вырезки тройничного нерва с медиальным краем внутреннего слу хового прохода, затем вниз от медиального края внутрен него слухового канала до медиального края яремного от верстия, от нижнемедиального края яремного отверстия до латерального края канала подъязычного нерва и от ла терального края канала подъязычного нерва до заднеме диального края мыщелка затылочной кости; медиальная расположена по условной линии вдоль всего ската от спинки седла до затылочного отверстия на расстоянии 5 мм от средней линии ската. В 79% местом исходного роста менингиом является верхняя треть петрокливальной области, в 8,6% средняя треть и в 12,4% нижняя треть петрокливальной области. Большая частота расположения петрокливальных ме нингиом в верхней трети ската с супратенториальным рас пространением обусловлена большим скоплением арах ноидэндотелиальных клеток на стыке кавернозного, вер хнего, нижнего каменистых синусов, основного венозно го сплетения, у места входа в твердую мозговую оболочку III, IV, V, VI черепномозговых нервов, в области при крепления намета мозжечка, а также основнокаменис того синхондроза. Таким образом, все менингиомы с местом исходного роста из петрокливальной области нужно относить к пет рокливальным менингиомам. Опухоли позвоночника среди всех новообразований скелета составляют около 57%. Если к этому количе ству добавить метастазы злокачественных опухолей в позвоночник, то общее количество новообразований позвоночника значительно возрастет. Несмотря на ус пехи лучевой и химиотерапии, хирургическое лечение данной патологии не утрачивает своего значения. Даже учитывая высокий риск операции, хирургическое лече ние остается порой единственной возможностью по мочь больному. В первую очередь это касается больных с патологическим компрессионным переломом позвон ков, выраженным болевым синдромом вследствие ком прессии корешка или нестабильности позвоночника, когда оперативное вмешательство преследует цель уменьшения боли, удаления компрессии спинного моз га и стабилизации позвоночника. Хирургическое лече ние больных метастазами в позвоночник является пал лиативным и предпринимается для улучшения качества их жизни. Для решения вопроса о выборе метода лечения и воз можной радикальности хирургического вмешательства у больных метастазами в позвоночник мы использовали шкалу качества жизни по Tokuhashi с оценкой в баллах, шкалу по Harrington. Выбор доступа к опухоли, вариант пластического замещения удаленных позвонков или их частей, тип стабилизирующей системы определялся на основе классификации локализации опухоли по Wenstein BorianiBiagini (WBB). C 1998 по 2001 г. оперировано 25 пациентов по пово ду опухолей позвоночника. У 18 больных выявлены пер вичные опухоли (гемангиомы (3), аневризмальные ко стные кисты (3), гигантоклеточные опухоли (2), осте областомы (2), плазмоцитомы (3), хондросаркомы (3), а также мезенхимома (1) и ангиолимфоцитарная гипер плазия (болезнь Кимури) (1)), а у 7 больных поражение позвонков оказалось метастатическим. Больным про водилась чрескожная биопсия опухоли для уточнения гистологической природы опухоли, а больные метаста зами исследовались на предмет первичного источника опухоли и наличия метастазов другой локализации. Всем больным выполнено удаление опухоли путем внутриопухолевого кюретирования, кроме 3 больных гемангиомами, которым выполнена вертебропластика. У больных опухолями позвоночника радикальность операции определялась прежде всего по отсутствию опухоли на послеоперационных МРТ. 15 больным пос ле удаления опухоли выполнена стабилизация позво ночника, из них 4 пациентам выполнена стабилизация как переднего, так и заднего опорных комплексов. Все больные отметили исчезновение или значительное уменьшение болей, у них отмечено улучшение невро логического статуса и при необходимости достигнута стабильность позвоночника. Полученные результаты лечения больных с новообра зованиями позвоночника расцениваются по шкале Кар новского как удовлетворительные и соответствуют меж дународным показателям восстановления неврологичес кого дефицита для данного контингента больных. III ñúåçä íåéðîõèðóðãîâ Ðîññèè 134 Íåéðîîíêîëîãèÿ ÎÏÛÒ ËÅ×ÅÍÈß ÌÍÎÆÅÑÒÂÅÍÍÛÕ ÌÅÒÀÑÒÀÇΠ ÃÎËÎÂÍÎÉ ÌÎÇà Íîâèê Þ. Å., Çîðèí Í. À., Ñèðêî À. Ã. Ãîñóäàðñòâåííàÿ ìåäèöèíñêàÿ àêàäåìèÿ, Îáëàñòíàÿ êëèíè÷åñêàÿ áîëüíèöà èì. È. È. Ìå÷íèêîâà, Äíåïðîïåòðîâñê, Óêðàèíà Исторически наличие множественных метастазов в головной мозг рассматривалось как противопоказание для их оперативного лечения, даже в случае хирургической доступности. Удаление множественных метастазов в боль шинстве случаев не производилось изза чрезмерной трав матичности вмешательства при использовании традици онных методов подхода и хирургической техники. По дан ным литературы, применение системной химиотерапии для больных с множественными метастазами оказывает слабый эффект изза плохой проницаемости гематоэнце фалического барьера для большинства препаратов. Дис танционная гамматерапия, выполняемая по традицион ной методике, не оказывает ожидаемого эффекта при ме тастазах в головной мозг у пациентов с выраженной кли нической картиной. Применение же стереотаксической радиохирургии ограничено даже в развитых регионах стран СНГ. В нашей клинике с 1990 года наблюдалось 15 больных с множественными метастазами в головной мозг. Всем боль ным было проведено КТ с в/в контрастированием и МРТ. В трех случаях мы воздержались от проведения операции изза множественного поражения внутренних органов и тяжести состояния. Оперировано 12 больных. Из них 4 мужчины и 8 женщин. Два метастатических узла выявлено у 5 больных, 3 – у 4, 4 – у 2, и 7 – у 1 больного. Только супратенториально метастатические узлы обнаружены у 8 больных. При этом у 6 из них они определялись в обеих гемисферах большого мозга. У 3 больных метастазы были расположены как супра, так и субтенториально. И лишь у одного – в мозжечке. У 5 (42%) больных до нейрохирурги ческого вмешательства был удален первичный очаг. У 7 (58%) больных первичный очаг не выявлен. В период с 1990 по 1996 год оперировано 2 больных. Одному из них проведено удаление наибольшего по раз мерам очага, вызывающего клиническую симптоматику. Больной умер в послеоперационном периоде изза нарас тания отека мозга, вызванного оставшимися тремя мета стазами. Другому больному с двумя метастазами, распо ложенными в правом и левом полушарии головного моз га, выполнено поэтапное их удаление с интервалом в две недели. Состояние этого больного после удаления перво го метастаза оставалось тяжелым. Только после удаления второго метастаза состояние улучшилось и больной вы писан из стационара в удовлетворительном состоянии. В клинике разработана и с 1996 года успешно приме няется методика одномоментного удаления множествен ных метастазов с использованием модифицированного стереотаксического подхода к узлам опухоли. Данная ме тодика позволяет удалять множественные метастазы, не смотря на их размеры и локализацию, сократив при этом общую продолжительность операции. Замечено, что со стояние больных сразу после операции улучшается, на ступает быстрый регресс неврологических расстройств. Продолжительность операций, проведенных по данной методике, составила от 40 мин до 2,8 часа. Все больные данной группы выписаны из стационара с улучшением, рекомендовано проведение лучевой и хи миотерапии. Хирургическое лечение множественных метастазов в головной мозг рекомендуется даже больным с умеренно выраженными неврологическими расстройствами, но у которых компенсированы функции внутренних органов и систем. Одномоментная операция ведет к колоссально му эффекту, регрессу неврологических расстройств, обус ловленных больше отеком мозга вокруг метастазов. Обя зательными атрибутами хирургического лечения множе ственных метастазов являются стереотаксический подход и сокращение времени всей операции. ÊÎÌÁÈÍÈÐÎÂÀÍÍÀß ÑÏÅÖÈÔÈ×ÅÑÊÀß ÏÐÎÒÈÂÎÎÏÓÕÎËÅÂÀß ÈÌÌÓÍÎÒÅÐÀÏÈß Â ËÅ×ÅÍÈÈ ÁÎËÜÍÛÕ Ñ ÏÐÎÄÎËÆÅÍÍÛÌ ÐÎÑÒÎÌ ÃËÈÎÁËÀÑÒÎÌ: ÐÅÇÓËÜÒÀÒÛ ÏÈËÎÒÍÎÃÎ ÈÑÑËÅÄÎÂÀÍÈß Îëþøèí Â. Å., Òèãëèåâ Ã. Ñ., Îñòðåéêî Î. Â., Ôèëàòîâ Ì. Â. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã; Ñàíêò-Ïåòåðáóðãñêèé èíñòèòóò ÿäåðíîé ôèçèêè èì. Á. Ï. Êîíñòàíòèíîâà, Ãàò÷èíà Неудовлетворенность результатами лечения злокаче ственных глиом головного мозга, являющихся самыми частыми первичными опухолями у взрослых, способству ет поиску новых лечебных методик. Недостаток эффек тивных противоопухолевых методов лечения в нейроон кологии наглядно демонстрируют данные 5летней выжи ваемости этих больных. Если для пациентов раком 5лет няя выживаемость составляет 60%, то для пациентов с гли областомами – около 5,5%, а средняя продолжительность жизни 12 мес. После опровержения мнения о недоступности мозга для иммунной системы и согласно гипотезе иммуноло гического надзора Бернета и Томаса, в мировой науке ак тивно разрабатываются и развиваются иммунологические методы лечения опухолевых заболеваний. С позиции со временных взглядов наиболее перспективным является индукция антигенспецифического противоопухолевого иммунитета, в первую очередь его клеточного звена. В настоящее время известно, по крайней мере, 2 механизма уничтожения клеток опухоли цитотоксическими Тлим фоцитами: перфориновый, вызывающий образование пор в мембране клеток опухоли, и FasFasL, приводящий к апоптозу. Для запуска противоопухолевого иммунного ответа необходимо несколько условий: опухолевые антигены должны быть распознаны, процессированы и представ лены профессиональными антигенпрезентирующими клетками (наиболее потенциальные из них – дендритные клетки), опухоль должна быть иммуногенна, наличие ко стимулирующих молекул. Нами была использована комбинированная специфи ческая противоопухолевая иммунотерапия, имеющая три составные части: 1) дендритные клетки, полученные in vitro из аутологичных моноцитов больного с антигенами собственной опухоли пациента, 2) активированные ауто логичные лимфоциты, 3) лизат клеток опухоли. Дендритные клетки получали путем культивирования аутологичных моноцитов с ростовыми факторами. Анти генным материалом служил фрагмент опухоли больного, облученный рентгеновскими лучами, разрушенный затем механически и химически путем изменения pH среды, в которой находилась опухоль (лизат клеток). Лимфоциты пациента активировались с помощью фитогемаглютини на. Курс лечения включал по 3 инъекции дендритных кле ток и активированных лимфоцитов вместе с лизатом опу холи. В составе комбинированного лечения иммунотерапия (от 1 до 5 курсов) проведена 14 пациентам, повторно опе 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 135 Íåéðîîíêîëîãèÿ рированным по поводу продолженного роста глиоблас том. Контрольную группу составили 34 больных, также повторно оперированных в связи с продолженным рос том новообразования и получивших комбинированную терапию. Оценка эффективности иммунотерапии прово дилась на основании продолжительности жизни после последней операции (и начала иммунотерапии в иссле дуемой группе). Вторым показателем служило соотноше ние продолжительности жизни после последней опера ции по отношению к интервалу между предшествующи ми операциями. В группе больных, получавших иммунотерапию, сред няя продолжительность жизни составила 8,6 мес., а в кон трольной группе – 4,5 мес. Продолжительность жизни после последней операции превысила интервал между предшествующими операциями в исследуемой группе в 64% наблюдений, а в контрольной – только в 23%. Полученные первые результаты демонстрируют опре деленную эффективность иммунотерапии, но степень эффективности еще предстоит выяснить в последующих исследованиях. ÈÒÎÃÈ È ÏÅÐÑÏÅÊÒÈÂÛ ÊÎÌÏËÅÊÑÍÎÉ ÒÅÐÀÏÈÈ ÁÎËÜÍÛÕ ÃËÈÎÌÀÌÈ ÁÎËÜØÈÕ ÏÎËÓØÀÐÈÉ ÌÎÇÃÀ Îëþøèí Â. Å., Òèãëèåâ Ã. Ñ., Ôèëàòîâ Ì. Â., Ìàð÷åíêî Ñ. Â., Ìàñëîâà Ë. Í., Îñòðåéêî Î. Â., Ôàäååâà Ò. Í., Óëèòèí À. Þ. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã Частота заболеваемости первичными опухолями голов ного мозга (ОГМ) достигает 13,9 на 100 000 населения. Глиальные опухоли составляют 4050% всех первичных ОГМ, причем у взрослых пациентов 90% опухолей лока лизуются в больших полушариях мозга и 5560% из них являются злокачественными. Отдаленные результаты ле чения данных больных остаются неудовлетворительны ми и средняя выживаемость больных анапластическими астроцитомами составляет 24 месяца, а глиобластомами редко превышает 12 месяцев. В РНХИ им. проф. А. Л. Поленова за период 19912000 гг. проведено комплексное лечение 371 больного глиома ми больших полушарий головного мозга. Из них у 172 боль ных были доброкачественые глиомы, у 112 больных – зло качественные (анапластические астроцитомы и глиоблас томы) глиомы и 87 больных были оперированы в связи с продолженным ростом злокачественных глиом. Времен ной промежуток от появления первых симптомов заболе вания до поступления больных в клинику составил 58 ме сяцев. При поступлении половина больных находилась в субкомпенсированном состоянии, 1/5 больных – в край не тяжелом состоянии вследствие значительного распрос транения опухоли и ее выраженного массэффекта. Комплексное лечение включало хирургию, химиоте рапию, лучевое лечение, иммунокоррекцию и у 14 боль ных – применение специфической противоопухолевой иммунотерапии. Целью хирургии было удаление максимально возмож ного объема опухоли, нормализация анатомофизиоло гических условий функционирования головного мозга, установление точного гистологического диагноза. Всегда производилась только костнопластическая трепанация черепа и удаление опухоли с разумным радикализмом и соблюдением физиологической дозволенности. Такая тактика позволила в подавляющем числе наблюдений (97%) значительно улучшить состояние больных после операции. Химиотерапевтическое лечение – важнейшая состав ляющая часть терапии больных злокачественными глио мами. Использовался препарат группы нитрозомочеви ны ACNU (Нидран), который вводили методом чрезкож ной интракаротидной инфузии на стороне опухоли в дозе 2 мг/кг веса больного. Лечение начиналось на 410 сутки после операции при компенсированном состоянии боль ного и затем повторялось каждые 8 недель последующей жизни пациента. В ряде случаев использовались такие препараты группы нитрозомочевины, как: Белустин или Ломустин перорально в сочетании с внутривенным вве дением Винкристина. Временные интервалы аналогичны введению Нидрана. Лучевую терапию проводили всем больным как с доб рокачественными, так и со злокачественными глиомами. Использовался режим обычного фракционирования, оча говая доза 5060 Грей. Иммунокоррегирующую терапию проводили с исполь зованием целого спектра препаратов (Левамизол, Так тивин, Тимоген, Тимолин, Неовир). У ряда больных ис пользовался препарат Глютоксим. У 14 больных с продолженным ростом глиобластом после реоперации применялась специфическая противо опухолевая иммунотерапия, основанная на использова нии аутологических дендритных клеток с опухолевыми антигенами и активированных собственных лимфоцитов больного. Послеоперационная летальность больных доброкаче ственными глиомами составила 2,2%, при злокачествен ных глиомах – 2,7%, при реоперациях в связи с продол женным ростом глиобластом – 9,7%. Компенсация состо яния больных в ближайшие дни (15 сутки) послеопера ционного периода отмечена в 97,3%. Проведение химиотерапевтического лечения не сопро вождалось осложнениями как в месте введения препара та, так и со стороны внутренних органов. Умеренно вы раженная лейкопения и реже гипохромная анемия обыч но развивались лишь после 45 курсов лечения, но хоро шо коррегировались при соответствующей терапии. Лучевая терапия в комплексе с химиотерапией досто верно увеличила среднюю продолжительность жизни больных злокачественными глиомами в сравнении с груп пой наблюдений без проведения лучевой терапии. Иммунокоррегирующая терапия не увеличила сроки выживаемости больных, но ее проведение улучшало субъективно состояние больных и приводила к более бы строму восстановлению нормальных показателей крови. Проведение специфической противоопухолевой тера пии позволило увеличить среднюю продолжительность жизни больных глиобластомами после реопераций по сравнению с контрольной группой в 2 раза (8,6 месяца и 4,5 месяца соответственно) и улучшить функциональный статус пациентов у 68% больных. Комплексное лечение больных злокачественными гли омами позволило 11% больным вернуться к работе, огра ниченно трудоспособны и полностью себя обслуживают 52,3% пациентов. Средняя выживаемость больных при анапластических астроцитомах составила: до 1 года – 85,5%, до 2 лет – 70,9%, до 3 лет – 27,3%; при глиобласто мах средняя выживаемость до 1 года составила 68,1%, до 2 лет – 23,7%, до 3 лет – 4,3%. Перспективы улучшения отдаленных результатов свя заны с развитием специфической противоопухолевой иммунотерапии, поиске новых физических методов воз действия на опухоль и новых химиотерапевтических пре паратов. III ñúåçä íåéðîõèðóðãîâ Ðîññèè 136 Íåéðîîíêîëîãèÿ ÝÏÈÄÅÌÈÎËÎÃÈß ÃËÈÀËÜÍÛÕ ÎÏÓÕÎËÅÉ Â ÑÀÍÊÒ-ÏÅÒÅÐÁÓÐÃÅ Îëþøèí Â. Å., Óëèòèí À. Þ., Ãóëÿåâ Ä. À., Ñàôàðîâ Á. È., ×åñíîêîâà Å. À., Øåâ÷åíêî Å. Í. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã Проведено исследование эпидемиологии первичных глиальных опухолей в СанктПетербурге на основе мате риалов нейрохирургических стационаров города за пери од 19921994 гг., а также данных аутопсий. При общей распространенности ОГМ в СПб 13,9 на 100 000 населения частота глиальных опухолей составля ет 6,9 на 100 000. Только в СанктПетербурге каждый год примерно 200 человек, страдающих злокачественными глиомами, умирает вследствие этой патологии, не полу чая специализированной медицинской помощи изза не верно установленного диагноза. При оценке распростра ненности глиом в СПб и периферических, подчиненных ему населенных пунктах отмечено, что в городе таковая выше в 1,5 раза: 7,2 против 4,9. На основе Экологического атласа СанктПетербур га проведена сравнительная оценка основных факторов окружающей среды районов города, способных влиять на заболеваемость населения онкологическими заболе ваниями. При изучении распространенности глиом (на 100 тыс. населения) установлено, что в районах с не благоприятной экологической обстановкой она значи тельно выше (8,4 – в Красногвардейском, 8,6 – в Кали нинском, 8,1 – в Выборгском, 7,9 – в Центральном), чем в районах с хорошим состоянием окружающей сре ды (4,8 – в Курортном, 4,6 – в Колпинском, 5,9 – в Пушкинском). Наиболее высокой оказалась распространенность гли ом среди возраста старше трудоспособного (старше 55 лет) – 8,8 на 100 тыс. населения; в возрасте от 20 до 54 лет их частота – 7,9 на 100 тыс. населения. Глиальные опухоли занимают наибольший удельный вес среди ОГМ в СПб – 45,6% (56,4% – среди мужчин и 37,4% – среди женщин). Из них чаще других наблюда ется глиобластома – 16,7% (20,8% – у мужчин, 13,6% – у женщин), а также астроцитома – 17,9% (22,1% – у мужчин, 14,8% – у женщин), причем злокачественные формы астроцитом преобладают над доброкачествен ными в 1,7 раза среди лиц мужского пола и в 2 раза – среди женщин. Количество глиобластом в возрасте от 10 до 19 лет у лиц мужского пола составляет 27,2% и у лиц женского пола – 16% всех ОГМ. В возрасте от 30 до 39 лет – 15,6% и 7%, в возрасте от 40 до 54 лет – 21,5% и 12,3%, в возрасте от 55 до 69 лет – 25,4% и 18,5% соот ветственно. Распространенность глиобластом на 100 000 населения составляет – 1,04, астроцитом – 1,12, эпендимом и эпен димобластом – 0,11, олигодендроглиом – 0,12, олигоаст роцитом – 0,11. Наиболее часто глиомы располагались в больших по лушариях мозга (70,4%): в лобной доле (18,6%), в височ ной доле (12,8%), в теменной доле (8,6%). Опухоли сре динной локализации (шишковидная железа, мозолистое тело, червь мозжечка, хиазма, ствол головного мозга, тре тий желудочек) отмечались в 17% наблюдений. Средняя смертность от ОГМ, по нашим расчетам, составляет 11,8 на 100 тысяч населения в год (в сред нем 579 человек в год). Таким образом, каждый 23й человек, умирающий от новообразования, умирает от ОГМ, из которых около 8090% составляют глиальные опухоли. ÈÑÑËÅÄÎÂÀÍÈÅ ÂÛÇÂÀÍÍÎÉ ÝËÅÊÒÐÈ×ÅÑÊÎÉ ÀÊÒÈÂÍÎÑÒÈ ÏÐÈ ÎÏÓÕÎËßÕ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Îñåòðîâ Á. À., Ãîðáàòåíêîâà Î. Â. Ìåäèöèíñêàÿ àêàäåìèÿ ïîñëåäèïëîìíîãî îáðàçîâàíèÿ, Âîåííî-ìåäèöèíñêàÿ àêàäåìèÿ, Ñàíêò-Ïåòåðáóðã Было предпринято комплексное исследование группы больных с опухолями головного мозга. Помимо клини коневрологического метода, для диагностических целей использовались методы интраскопии (КТ, МРТ) для уточ нения локализации и характера объемного образования; полимодальные вызванные потенциалы (ВП) для выяв ления функциональных изменений со стороны нервной системы. Изучались зрительные вызванные потенциалы (ЗВП) со стимуляцией шахматным паттерном, слуховые вызванные потенциалы ствола (СВП), соматосенсорные вызванные потенциалы со стимуляцией срединных и большеберцовых нервов (ССВП). Всего исследовано 42 человека, средний возраст – 46 лет. 33 человека с новообразованиями супратенториаль ной локализации и 9 с субтенториальной. У 21 больного опухоли имели полушарную латеральную локализацию, с поражением одной или более долей, у 5 – полушарную сагиттального или сагиттальнопарасагиттального распо ложения, у 3 – опухоли таламуса, у 4 – аденомы гипофи за, у 6 – опухоли основания мозга, у 2 – опухоли мозжеч ка, у 1 – опухоль ствола. Состояние пациентов не всегда позволяло выполнить весь комплекс ВП. Регистрация ЗВП была выполнена у 20 больных, регистрация СВП – у 18 больных и ССВП – у 19 больных. Данные полимодальных ВП показали хорошую корре ляцию с данными клиники и МРТ. Помимо этого, име лись наблюдения, когда были выявлены изменения по казателей ВП при отсутствии клинических и интраско пических данных за поражение исследуемых сенсорных систем. В двух наблюдениях с новообразованиями таламуса при отсутствии клинической симптоматики были выявлены отклонения ЗВП от нормы в виде удлинения латентных периодов основного компонента Р100 и увеличения ин терокулярной разницы, что можно расценивать как вы явление латентно протекающих изменений в зрительном тракте. У 1 больной с астроцитомой левых лобной и височной долей, не имеющей стволовых симптомов, при исследо вании СВП межпиковый интервал (МПИ) IIII слева был удлинен. У пациента с множественными менингиомами голов ного мозга, большого серпа мозга с 2сторонним распро странением, при отсутствии симптомов со стороны сома тосенсорной системы, была обнаружена разница между МПИ L3P37 c 2х сторон, превышающая нормальные показатели. При неврологическом осмотре выявлялись симптомы поражения ствола мозга, не подтверждаемые данными МРТ, являющиеся, скорее всего, симптомами на отдалении. Поэтому можно предположить, что имею щиеся изменения ССВП были обусловлены латентно про текающими изменениями в соматосенсорных путях на уровне ствола. У пациента с новообразованием медиаль ных отделов правого зрительного бугра, также с отсутстви ем чувствительных расстройств, была определена разни ца между МПИ N13N20 с 2х сторон, превышающая нор му. У этого же больного имелись изменения ЗВП, также при отсутствии симптомов поражения зрительных путей. Логично предположить, что выявленные изменения ВП были проявлениями латентно протекающих патологичес 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 137 Íåéðîîíêîëîãèÿ ких процессов в головном мозге (скорее всего, в самом таламусе). Таким образом, метод ВП показал себя чувствитель ным методом, хорошо коррелирующим с клиническими данными и данными МРТ. Кроме того, в ряде случаев он выявляет ранние признаки дисфункции пораженных структур, а также структур на отдалении, связанные, ве роятно, с расстройствами микроциркуляции. ÂÎÇÌÎÆÍÎÑÒÈ ÈÍÒÐÀÎÏÅÐÀÖÈÎÍÍÎÃÎ ÍÅÉÐÎÔÈÇÈÎËÎÃÈ×ÅÑÊÎÃÎ ÌÎÍÈÒÎÐÈÍÃÀ  ÎÖÅÍÊÅ ÔÓÍÊÖÈÎÍÀËÜÍÎÃÎ ÑÎÑÒÎßÍÈß ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ ÏÐÈ ÂÛÏÎËÍÅÍÈÈ ÑËÎÆÍÛÕ ÍÅÉÐÎÕÈÐÓÐÃÈ×ÅÑÊÈÕ ÎÏÅÐÀÖÈÉ Îñòðåéêî Ë. Ì., Õèëüêî Â. À. Ãîðîäñêîé íàó÷íî-ïðàêòè÷åñêèé íåéðîõèðóðãè÷åñêèé öåíòð, ÃÌÏÁ ¹ 2, Ñàíêò-Ïåòåðáóðã С появлением современной электрофизиологической многофункциональной аппаратуры, позволяющей одно временно регистрировать разномодальные вызванные потенциалы (ВП) и ЭЭГ, возможности нейрофизиологи ческого интраоперационного мониторинга (ИОМ) в оценке функционального состояния головного мозга, прежде всего его стволовых структур, существенно рас ширились. Комплексное исследование биоэлектрической активности мозга позволяет выявить и оценить электро физиологические изменения на ранних стадиях структур нофункционального повреждения мозга, которые фор мируются либо при механическом воздействии, либо вследствие ишемических процессов в стволе мозга. М а т е р и а л и м е т о д ы . В основу работы положен анализ результатов нейрофизиологического ИОМ 108 операций по поводу удаления супратенториальных (у 46 больных) и субтенториальных (у 62 пациентов) опухолей. Особое внимание было уделено анализу нейрофизиоло гического контроля у 62 пациентов при удалении ново образований задней черепной ямки (ЗЧЯ), которые по степени воздействия на ствол мозга при их удалении чаще сопровождаются выраженными нейрофизиологическими реакциями. Опухоли ствола мозга удалялись у 14 больных, мостомозжечкового угла – у 19, основания ЗЧЯ – у 13, мозжечка – у 16 пациентов. В СанктПетербургском научнопрактическом нейро хирургическом центре ИОМ осуществлялся при помощи системы «VikingIV» (фирмы «Nicolet», США), позволив шей одновременно в реальном масштабе времени оцени вать ЭЭГ от 4х каналов, а также две модальности ВП: аку стические стволовые (АСВП) от 2х каналов и коротко латентные соматосенсорные (ССВП) от 2х каналов. Р е з у л ь т а т ы и о б с у ж д е н и е . Наиболее адекват ную информацию о состоянии стволовых структур мозга удалось получить при анализе данных АСВП, которые проявлялись отчетливым увеличением или снижением амплитуды, столь характерным и наглядным тестом оцен ки функционального состояния головного мозга. Выра женными реакциями АСВП считали, когда их амплитуда менялась в 23 раза, умеренными – менее, чем в 2 раза. Реакция могла продолжаться несколько минут, быть ус тойчивой или кратковременной. Чаще всего колебалась амплитуда IIIV пиков. В 6 случаях (при удалении опухо ли от варолиева моста) отмечалось преимущественное уве личение амплитуды III пика. Значительные изменения АСВП наблюдались при вмешательствах по поводу ново образований ЗЧЯ, когда на этапе доступа и удаления опу холи у 16 пациентов зарегистрированы выраженные ре акции АСВП, причем у 12 больных они сопровождались увеличением амплитуды, что совпадало с раздражением стволовых структур мозга. Своевременное выявление вы раженных нарушений активности мозга ирритативного типа позволяет менять тактику хирургического вмеша тельства, прежде всего ограничить объем или направлен ность операции, или закончить ее I этапом удаления опу холи. Из 62 случаев тотально удалены опухоли у 19 боль ных, субтотально – у 43. У 6 больных наблюдалось резкое снижение амплитуды АСВП, характерное для ишемичес ких нарушений ствола, что требовало проведения сроч ных профилактических мероприятий, которые могут за щитить мозг, улучшить его кровоснабжение. Умеренные реакции АСВП наблюдались у 18 больных. В этих случа ях необходимо было обратить внимание нейрохирурга на реакции функционально значимых структур и требую щуюся особую осторожность при удалении опухоли в этой зоне. Необходимо обратить внимание на проведение ИОМ не только во время доступа и удаления опухоли, но и на завершающих этапах операции, так как динамика актив ности мозга именно в этот период имеет прогностичес кое значение течения послеоперационного периода. Другие показатели АСВП – пиковые и межпиковые ла тентные периоды, практически всегда увеличивались к концу операции на 0,10,3 ме, что, вероятно, связано с прямым многофакторным воздействием на мозг во вре мя операции. Резких их изменений, отражающих реакцию мозга на возникшие нарушения, в данной группе боль ных мы не наблюдали. Выводы. 1. У больных с первичным поражением ствола мозга и грубым вторичным воздействием на него комплексное исследование активности мозга (ЭЭГ, АСВП, ССВП) дает объективную оценку его функционального состояния, но наиболее информативным и оперативным методом явля ется исследование АСВП. 2. Решающую роль в оценке функционального состоя ния ствола мозга играют изменения амплитуды АСВП, а не латентности. 3. Даже выраженные изменения биоэлектрической ак тивности мозга, регистрируемые во время удаления опу холи, могут быть обратимыми после изменения тактики оперативного вмешательства и (или) проведения необхо димых лечебных мероприятий. 4. Важным тестом благоприятного прогноза послеопе рационного течения является нормализация активности мозга, в том числе АСВП, на завершающих этапах опера ции. ÔÎÒÎÄÈÍÀÌÈ×ÅÑÊÀß ËÀÇÅÐÍÀß ÒÅÐÀÏÈß Â ÍÅÉÐÎÎÍÊÎËÎÃÈÈ Ïåíäþðèí È. Â., Ñòóïàê Â. Â., Îãèðåíêî À. Ï., Íèêîíîâ Ñ. Ä. ÍÈÈ òðàâìàòîëîãèè è îðòîïåäèè, Íîâîñèáèðñê Злокачественные мозговые опухоли астроцитарного ряда имеют инфильтративный рост в мозге и не имеют четких границ. В связи с этим, несмотря на комплексный подход в лечении злокачественных опухолей головного мозга, включающий и современные методы онкотерапии, очень редко удается стабилизировать рост опухоли и зна чительно продлить жизнь больным. Средняя продолжи тельность жизни больных при низкодифференцирован ных глиомах остается крайне низкой, и, по данным С. В. Марченко (1997), А. В. Голанова (1998), 5летняя выжи ваемость не превышает 3,5%. Лазерная фотодинамическая терапия (ЛФДТ) – новый, признаный в мире, метод лечения злокачественных опу холей. Метод основан на селективном накоплении фото III ñúåçä íåéðîõèðóðãîâ Ðîññèè 138 Íåéðîîíêîëîãèÿ сенсибилизатора, который при воздействии лазерного из лучения с определенной длиной волны переходит в ак тивное состояние и способен генерировать синглентный кислород и свободные радикалы, вызывающие гибель опухолевых клеток. Комбинация сенсибилизатора, све товой энергии и кислорода приводит к фотохимически обусловленному разрушению ткани опухоли. Целью нашего исследования являлись эксперимен тальное обоснование и отработка методики процедуры ЛФДТ в комплексном лечении злокачественных внутри мозговых опухолей головного мозга, основанной на ло корегиональном введении фотосенсибилизатора в лик ворную систему. Для проведения ЛФДТ нами использован фотосенси билизатор фотосенс – производное фталоцианина в виде водного 0,05% раствора. На этапе экспериментального обоснования метода нами на 30 животных на основании клинических, морфологических и электрофизиологичес ких методов было показано, что введение фотосенса в ликворную систему не вызывает нейротоксических реак ций. В эксперименте на 25 кроликах и в клинике у 25 па циентов с внутримозговыми злокачественными опухоля ми мозга, используя методы спектроскопии и высокоточ ной хроматографии, показано, что введение фотосенса, минуя гематоэнцефалический барьер непосредственно в ликворную систему, обеспечивает его накопление в до статочных концентрациях в туморозной жидкости и тка ни опухоли через 2426 часов с момента его введения. Процедуры ЛФДТ выполнены у 7 пациентов после операций нерадикального удаления глубинных астроци том (3 степень анаплазии) головного мозга. За сутки до проведения сеанса ЛФДТ фотосенс в ликворную систе му вводили в объеме 24 мл. В качестве источника свето вой энергии использован лазер на красителях Спектро мед2 с длиной волны 670 нм. Неудаленный объем опу холи облучали с помощью стерильного кварцевого све товода диаметром 400 мкн, который проводили через специальную иглу при пункции ликворных пространств головного мозга под контролем данных ЯМРтомогра фии. Торец световода устанавливали на расстоянии 34 см от ложа резецированной опухоли. Выходная мощ ность излучения на конце световода составляла 150200 мВт. Процедура ЛФДТ осуществлялась сканирующими движениями в течение 2030ти минут. Суммарная доза облучения у каждого больного составила 240270 Дж за сеанс. Процедуры ЛФДТ проводили двукратно с 13х дневным интервалом. Перед каждым сеансом спектро скопически подтверждали наличие фотосенса в ликво ре. В течение всего курса ЛДФДТ состояние больных оценивали посредством мониторинга артериального дав ления, частоты сердечных сокращений, потребления кислорода, температуры тела. Учитывалась общемозго вая и очаговая неврологическая симптоматика. Нами отмечено, что больные легко переносили процедуры, проводимые под местной анестезией. При проведении ЛФДТ регистрировались проявления фотодинамическо го эффекта, клинически проявляющиеся в виде ощуще ний умеренного локального жжения и тепла в зоне ло кализации опухоли, головной боли гипертензионного характера, комплекса симптомов, характерных для ост рой фазы иммунного ответа; довольно выраженные ре акции в виде познабливания, похолодания конечностей, преходящего нарушения микроциркуляции с последу ющим кратковременным повышением температуры тела до 39°С. На вторые сутки сохранялась слабость и общее недомогание. Нормализация самочувствия происходи ла к третьим суткам. Первый опыт проведения процедуры ЛФДТ, основан ный на локорегиональном введении фотосенса, показал, что она хорошо переносятся больными с опухолями го ловного мозга. Данные МРтомографии и клинические данные исследования, полученные у больных спустя 26 месяцев после проведения ЛФДТ, свидетельствуют о ста билизации процесса и об отсутствии продолженного рос та опухоли. Все это, как нам представляется, создает бла гоприятные предпосылки для дальнейшего развития это го метода лечения в нейроонкологии. ÂÛÁÎÐ ÎÏÅÐÀÒÈÂÍÎÃÎ ÄÎÑÒÓÏÀ ÏÐÈ ÕÈÐÓÐÃÈ×ÅÑÊÎÌ ËÅ×ÅÍÈÈ ÎÏÓÕÎËÅÉ ÑÏÈÍÍÎÃÎ ÌÎÇÃÀ Ïåðëüìóòòåð Î. À., Ãóäóøèí À. Ñ. ÍÈÈ òðàâìàòîëîãèè è îðòîïåäèè, Íèæíèé Íîâãðîä В период с 1993 по 2001 г. в Нижегородском нейрохи рургическом центре было оперированно 87 больных с опухолями спинного мозга, из них женщин было 61 (70,1%), мужчин 26 (29,9%). Средний возраст больных составил 43±2,8 лет. Наиболее часто опухоли располага лись на уровне грудных сегментов (44,7%), одинаково часто (16,5%) на уровне шейных сегментов и пояснич ного утолщения, в 18,4% наблюдений опухоли компри мировали корешки конского хвоста. Гистологически у 51,7% больных удалялись менингиомы, у 20,7% – неври номы, у 11,5% – эпендимомы корешков конского хвос та, у 2,3% – холестеатомы; у 8,0% – лимфосаркомы, у 4,6% – саркомы и у 1,1% – лимфомы эпидурального про странства. Считаем, что наилучший результат хирургического ле чения достигается только тогда, когда обеспечивается точ ный выход на «мишень» – опухоль, когда размеры кост ного окна совпадают с размерами опухоли, и при ее уда лении хирург практически не касается ткани спинного мозга. Подобная хирургическая тактика становится воз можной только после тщательного предоперационного обследования, которое не просто уточняет уровень рас положения опухоли, но дает полноценное представление о взаимодействии ее с дуральным мешком, камерами су барахноидального пространства и самим спинным моз гом, а также стенками позвоночного канала. Этим требо ваниям отвечают только контрастная компьютерная и магнитнорезонансная томография, с помощью которых исчерпывающая диагностика получена в 91,2% и 89,0% наблюдений соответственно. Относительно сегмента спинного мозга опухоли ло кализовались: дорзолатерально – в 13,8%, дорзально – в 20,6%, латерально – в 12,6%, вентрально – в 12,7%, вентролатерально – в 23%, циркулярно – 5,8%, между корешков конского хвоста – в 11,5% наблюдений. Опу холи удалялись задним (66 наблюдений), переднебо ковым (3 наблюдения), боковыми (18 наблюдений) до ступами. Задним доступом удалялись все опухоли дорзальной и дорзолатеральной локализации, интрамедуллярные и опухоли корешков конского хвоста. При малых раз мерах опухоли и ее некоторой латерализации доступ мог быть в виде гемиламинэктомии, если обнаруженная опухоль была больших размеров, то использовалась рас ширенная ламинэктомия (или заднебоковой доступ). Считаем возможным удалять задним доступом и гиган тские опухоли вентральной или вентролатеральной ло кализации на шейном и грудном уровнях, поскольку медленно растущая опухоль сама отодвигает спинной мозг и при ее удалении дополнительной тракции мозга не требуется. 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 139 Íåéðîîíêîëîãèÿ Боковой паравертебральный экстра или трансплев ральный доступы для удаления опухолей грудного отде ла, расположенных вентрально или вентролатерально, позволял избегать травматизации спинного мозга, т. к. исключался этап его оттеснения. У 18 больных, опери рованных по этой методике, имевших перед операцией выраженную проводниковую недостаточность и рас стройства функций тазовых органов, последние восста новились сразу же после выхода из наркоза, а невроло гический статус никогда не был хуже, чем до операции и быстро восстанавливался до нормы. У больных же, пе ренесших удаление вентральных или вентролатераль ных опухолей традиционным способом – путем лами нэктомии, тазовые расстройства усугублялись во всех случаях (8 наблюдений), парезы сменялись либо пара личами (6 наблюдений), либо углублялись (2 наблюде ния). Мы получили высоко убедительную достоверность разницы (р≤0,001) результатов при использовании адек ватных и неадекватных расположению компримирую щего субстрата доступов. Предлагаем удалять небольшие по размерам вентраль ные опухоли шейных сегментов спинного мозга передне боковым парафарингеальным доступом (3 наблюдения). Основным условием для выполнения такого вмешатель ства является диагностика объемного процесса на ранней стадии, когда для удаления опухоли не требуется широ кой передней корпорэктомии. Таким образом, в выборе хирургического доступа при удалении опухолей спинного мозга необходимо руковод ствоваться соображениями минимальной травматизации спинного мозга и точного выхода на ткань опухоли. Ис пользование дифференцированной тактики в лечении больных с опухолевой компрессией спинного мозга по зволяет в 76,7% наблюдений добиться отличных и хоро ших результатов. ÀËÃÎÐÈÒÌ ËÅ×ÅÍÈß ÎÏÓÕÎËÅÉ ÏÈÍÅÀËÜÍÎÉ ÎÁËÀÑÒÈ Ïèöõåëàóðè Ä. È., Êîíîâàëîâ À. Í., Êîðíèåíêî Â. Í., Ìåëèêÿí À. Ã., Êîðøóíîâ À. Ã., Áðàãèíà Í. Í., Ñåðîâà Í. Ê., Êðûìñêèé Â. À., Êîáÿêîâ Ã. Ë., Ðàåâñêàÿ Ñ. À. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Тактика лечения опухолей пинеальной области до на стоящего времени остается дискутабельной. Это объяс няется многообразием гистологических форм опухолей, возникающих в этой области. Большинство опухолей пи неальной области – злокачественные и требуют мульти дисциплинарного подхода к лечению. В основе главных положений предложенного алгорит ма диагностики и лечения лежит наш опыт лечения боль ных с опухолями пинеальной области в течение последних 2,5 десятилетий. За этот период в Институте прошли ле чение 287 больных, у которых был верифицирован гисто логический диагноз после удаления опухоли или стерео таксической биопсии. Удаление опухоли было осуществ лено у 245 больных (всего 255 операции). Стереотаксичес кая биопсия произведена у 61 пациента, среди них 18 слу чаев после удаления. 168 больных (58%) с окклюзионной гидроцефалией подверглись шунтирующим операциям. Лучевая терапия как самостоятельный метод или в ком бинации с удалением опухоли была осуществлена в 146 (51%) случаях. Катамнестические данные собраны среди 209 больных (80%). Основываясь на накопленном опыте, мы сформулиро вали следующие главные моменты диагностики и лече ния больных с опухолями пинеальной области. 1. Наиболее точным неинвазионным методом диагно стики опухолей пинеальной области являются магнитно резонансная и компьютерная томографии. Магнитноре зонансная томография является наилучшим диагности ческим методом в выборе адекватного хирургического доступа. 2. Исследование биологических маркеров (αфетопро теин, βчеловеческий хорионический гонадотропин) со вместно с КТ и МРТ является важным звеном в диагнос тике некоторых герминативноклеточных опухолей. 3. Стереотаксическая биопсия является относительно безопасным и эффективным методом тканевой диагнос тики. Стереотаксическая биопсия в основном показана в тех случаях, когда подозревается наличие «чистой» гер миномы. 4. Шунтирование желудочковой системы является практически постоянной составляющей частью в лечении злокачественных опухолей пинеальной области. В после днее время мы отдаем предпочтение эндоскопической и интраоперационной прямой вентрикулостомии одномо ментно с удалением опухоли затылочным транстентори альным доступом. 5. Методом лечения доброкачественных опухолей пи неальной области, которые составляют около 1/3 опухо лей данной локализации (тератома, менингиома, пинео цитома, эпендимома, пилоидная астроцитома и др.), яв ляется их удаление. 6. В лечении злокачественных опухолей пинеальной области (пинеобластома, анапластичекая пинеоцитома, злокачественные герминативноклеточные опухоли и др.) оптимальные результаты достигаются путем комбинации хирургического вмешательства, лучевой и химиотерапии. 7. «Чистая» герминома, несмотря на ее злокачествен ный характер, является исключительно радиочувствитель ной опухолью. Лечение больных с данной патологией пре дусматривает проведения только лучевой терапии после шунтирования. ÝÊÑÒÐÀÏÈÐÀÌÈÄÍÛÅ ÍÀÐÓØÅÍÈß ÏÐÈ ÑÓÏÐÀÒÅÍÒÎÐÈÀËÜÍÛÕ ÎÏÓÕÎËßÕ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Ïîâåðåííîâà È. Å., Áàëàêëååö À. Ñ. Ãîñóäàðñòâåííûé ìåäèöèíñêèé óíèâåðñèòåò, Ñàìàðà В работах, освещающих клинику и диагностику опу холей головного мозга, экстрапирамидная патология не получила достаточного отражения. До настоящего време ни многие аспекты возникновения подобных нарушений, в частности, паркинсонизма и гиперкинезов при опухо лях головного мозга остаются недостаточно изученными и спорными. Большинство исследований касается изуче ния опухолей подкорковых узлов, однако значительный интерес представляет изучение экстрапирамидных нару шений при внутриполушарных опухолях. Сложность в выборе методов оперативного вмешательства в зависимо сти от топики поражения опухолью подкорковых гангли ев или их вторичного поражения выдвигает данную про блему в ряд актуальных в современной нейрохирургии. Совершенствование диагностического нейрохирурги ческого комплекса, применение современных методов нейровизуализвции с использованием КТ и МРТиссле дований значительно улучшило распознавание опухолей головного мозга с учетом характера их роста, размеров, степени воздействия на подкорковые структуры и ствол мозга. Проведен анализ результатов исследования 67 больных с опухолями полушарий большого мозга, в клинической картине которых отмечались разной степени выраженно III ñúåçä íåéðîõèðóðãîâ Ðîññèè 140 Íåéðîîíêîëîãèÿ сти экстрапирамидные нарушения. Возраст больных ва рьировал от 20 до 70 лет. Во всех случаях диагноз верифи цирован на операции или на секции. У большинства боль ных проводилось КТ или МРТисследование головного мозга. Использовался комплекс клинических и электро физиологиеских методик, таких как электроэнцефалог рафия (ЭЭГ), акустические стволовые вызванные потен циалы (АСВП), электромиография /ЭМГ / и др. Ригиднобрадикинетический синдром выявлен у 38 больных: (56,7%), дрожательноригидный синдром у 29 больных (43,3%). Опухоли макроглиального ряда наблю дались у 52,3% больных, менингиомы – у 40,3% больных. В 7,4% случаях имели место метастазы рака легкого. Боль шинство больных (76%) поступили в нейрохирургическое отделение в клинической фазе умеренной и грубой деком пенсации. Выраженность экстрапирамидных нарушений при опухолях полушарий большого мозга зависела от ло кализации, гистологической структуры и стадии развития опухолевого процесса. Как показали наши наблюдения, синдром паркинсо низма чаще отмечался у больных с опухолями полушарий большого мозга, чем собственно базальных ганглиев. Наи более выраженными экстрапирамидные симптомы были при опухолях лобной, лобнотеменной и лобновисочной локализаций. Структура экстрапирамидных нарушений при опухолях полушарий большого мозга оболочечно сосудистого и макроглиального ряда имела много обще го. Экстрапирамидные симптомы чаще и на более ран них стадиях наблюдались при внутримозговых опухолях, но экстрапирамидный синдром проявлялся более комп лексно при менингиомах. Экстрапирамидные симптомы при внутримозговых опухолях полушарий большого моз га могут наблюдаться и при отсутствии опухолевого по ражения основной массы подкорковых образований. Синдром паркинсонизма нередко становился ведущим в клинической картине двигательных нарушений при па расагиттальных менингиомах, растущих из передней и средней трети большого серпа мозга и верхнего сагитталь ного синуса, а также при менингиомах крыльев клино видной кости. Как правило, выраженный акинетикори гидный синдром развивался на поздних стадиях, когда менингиомы достигали больших размеров, глубоко вне дрялись в межполушарную щель, оказывали вторичное воздействие на желудочки мозга, облитерировали просвет верхнего сагиттального синуса. Для развития синдрома паркинсонизма большое зна чение имели деформация и смещение подкорковых и стволовых структур, особенно мезенцефальных отделов, о чем свидетельствовал регресс всех симптомов после удачной операции удаления опухоли. На ЭЭГ у большинства больных с опухолями головно го мозга и экстрапирамидными нарушениями выявлялись изменения биоэлектрической активности, свидетельству ющие о заинтересованности срединных структур. Отме чалась корреляция степени изменений ЭЭГ и ВП при опу холях головного мозга в зависимости от размеров опухо ли. АСВП являются важным и полезным методом опре деления сдавления ствола мозга или прорастания его опу холью. По данным АСВП, у больных с опухолью голов ного мозга с зкстрапирамидными нарушениями имеется четкое изменение состояния стволовых структур на пон томезенцефальном уровне. Оценка функционального со стояния подкорковых и стволовых структур по комплек су показателей (ЭЭГ, АСВП) дает ценную информацию о глубине расположения опухоли головного мозга, что в значительной степени определяет возможный объем хи рургического вмешательства. ÈÈÒÐÀÌÅÄÓËËßÐÍÛÅ ÎÏÓÕÎËÈ ÑÏÈÍÍÎÃÎ ÌÎÇÃÀ – ÊËÈÍÈÊÎ-ÌÎÐÔÎËÎÃÈ×ÅÑÊÈÅ ÏÀÐÀËËÅËÈ Ïîëèùóê Í. Å., Ìóðàâñêèé À. Â. Èíñòèòóò íåéðîõèðóðãèè èì. àêàä. À. Ï. Ðîìîäàíîâà ÀÌÍ Óêðàèíû, Ìåäèöèíñêàÿ àêàäåìèÿ ïîñëåäèïëîìíîãî îáðàçîâàíèÿ, Êèåâ, Óêðàèíà Проведен анализ 70 больных с интрамедуллярными опухолями спинного мозга, которые находились на лече нии в первой спинальной клинике института нейрохирур гии им. акад. А. П. Ромоданова АМН Украины с 1992 по 2000 год. Предоперационное обследование включало МРТграфию, КТграфию, миелографию. Неврологичес кий статус оценивался до операции, сразу же после опе рации, на момент выписки больного из стационара. До минировали больные с локализацией интрамедуллярных опухолей на шейном, грудном и шейногрудном уровнях. Гистологические типы интрамедуллярных новообразо ваний были разнообразными. Доминировали больные с эпендимомами и астроцитомами (28 и 23 наблюдения со ответственно), несколько реже встречались гемангиобла стомы и кавернозные ангиомы (8 и 6 наблюдений). На долю глиобластом, липом, неврином, олигодендроглиом, холестеатом приходилось по 1 наблюдению соответствен но. Длительность периода между первыми клиническими проявлениями до момента операции составляла от 45 дней до 9 лет (в среднем 32,6 месяцев). Клинические проявле ния интрамедуллярных опухолей зависели от их располо жения в спинном мозге. Наиболее общими клиническими проявлениями, ко торые предрасполагали к дальнейшему рентгенологичес кому обследованию были: боль в позвоночнике у 51 боль ного (72,86%), ухудшение движений в конечностях – у 45 (64,29%), чувствительные расстройства на туловище и в конечностях – у 24 (34,29%), прогрессирование кифос колиоза – у 21 (30,00%). Все анализируемые нами больные с интрамедуллярны ми опухолями спинного мозга были прооперированы. Тотально и субтотально были удалены опухоли у боль шинства больных. Объем резекции интрамедуллярной опухоли не зависел от ее локализации относительно по звоночника. У большинства больных послеоперационный невроло гический статус оставался без изменений (38 наблюдений) или имело место улучшение по сравнению с предопера ционным периодом (19 наблюдений), ухудшение в невро логическом статусе наблюдалось в 13 случаях. Эпендимомы. Эпендимомы – наиболее часто встреча лись среди других интрамедуллярных опухолей в наших наблюдениях. Эти опухоли имели тенденцию к располо жению в ростральной части спинного мозга. В отличие от астроцитом, эпендимомы были четко отделены от окру жающих тканей спинного мозга, что давало возможность их тотально удалять. Эти опухоли имели достаточную плотность, отмечались сероватым, красноватым или жел тым оттенками. Они были относительно мало кровото чивыми, кровоток обеспечивался из ветвей передней спи нальной артерии, при операции необходимо было обра щать внимание на сохранение кровотока по передней спи нальной артерии. Астроцитомы. Большинство астроцитом спинного мозга были доброкачественными, однако у 5 больных они имели злокачественный характер. У 3 больных имели ме сто астроцитомы, которые распространялись от кранио вертебрального перехода до конуса, в таких случаях со 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 141 Íåéðîîíêîëîãèÿ лидная часть опухоли находилась между кистами. Эти опухоли инфильтративно прорастали жизненноважные проводящие пути спинного мозга и могли, как следствие, вызывать неврологический дефицит в послеоперацион ном периоде. Тотальное удаление опухоли в таких случа ях было невозможно. Гемангиобластомы. Эти опухоли были четко видимы ми вдоль дорзальной поверхности спинного мозга благо даря приводящим и дренирующим сосудам. В размерах они колебались от нескольких миллиметров до размера большой виноградины. Хотя гемангиобластомы были от носительно малыми по сравнению с другими интрамедул лярными опухолями, они ассоциировались с выражен ным отеком или кистами, которые располагались рост рально и каудально. Липомы. Интрамедуллярные липомы являются доста точно редкой патологией и наиболее часто встречаются в грудном отделе, что имело место и в нашем наблюдении. Липомы не являются типичными новообразованиями, а гистологически идентичны к нормальной жировой тка ни. Особенностью клинического течения у больных с ли помами интрамедуллярной локализации является медлен ное развитие явлений миелопатии. Выводы. 1. Среди гистологический типов интрамедуллярных опухолей доминируют астроцитомы и эпендимомы, реже встречаются гемангиобластомы и кавернозные ангиомы. 2. При эпендимомах аккуратное удаление опухоли по границе с нормальной мозговой тканью приводит к пол ному удалению солидной части опухоли. 3. При диффузном распространении опухоли в мозго вую ткань (злокачественные астроцитомы) тотальное уда ление опухоли считается невозможным. ÎÑÎÁÅÍÍÎÑÒÈ ÕÈÐÓÐÃÈ×ÅÑÊÎÃÎ ËÅ×ÅÍÈß ÈÍÒÐÀÌÅÄÓËËßÐÍÛÕ ÎÏÓÕÎËÅÉ ÑÏÈÍÍÎÃÎ ÌÎÇÃÀ Ïîëèùóê Í. Å., Ìóðàâñêèé À. Â., Ñëûíüêî Å. È. Èíñòèòóò íåéðîõèðóðãèè èì. àêàä. À. Ï. Ðîìîäàíîâà ÀÌÍ Óêðàèíû, Ìåäèöèíñêàÿ àêàäåìèÿ ïîñëåäèïëîìíîãî îáðàçîâàíèÿ, Êèåâ, Óêðàèíà Проведен анализ хирургического лечения 70 больных с интрамедуллярными опухолями спинного мозга, кото рые находились на лечении в первой спинальной клини ке института нейрохирургии им. акад. А. П. Ромоданова АМН Украины с 1992 по 2000 год. Мужчин в анализируе мой группе больных было 38, женщин – 32; возраст боль ных колебался от 15 до 64 лет. Все больные прооперированы. Тотально и субтоталь но были удалены опухоли у большинства больных (31 и 23 больных соответственно), частичное удаление опухо ли при первой операции имело место у 16 больных. То тальным считалось удаление не менее чем 95% объема опухоли, при удалении 8095% объема опухоли удаление считалось субтотальным, частичной считалась резекция менее чем 80% объема солидного компонента опухоли. У 7 больных было проведено повторное оперативное вме шательство (5 случаев с частичным удалением опухоли во время первой операции, 2 случая с субтотальным). Сроки проведение повторных оперативных вмешательств коле бались от 1 до 5 лет после первой операции. Летальных случаев во время оперативных вмешательств и в раннем послеоперационном периоде зафиксировано не было. Целесообразно остановиться на особенностях хирур гической тактики. Ламинэктомия проводилась в проек ции солидной части опухоли. Твердая мозговая оболочка раскрывалась над солидным компонентом опухоли; кис ту можно было легко дренировать на отдалении при уда лении солидной части опухоли. После разреза твердой мозговой оболочки проводилась идентификация задней срединной линии (в проекции задней срединной бороз ды). Это было особенно важным в случаях, когда спин ной мозг был ротированным и деформированным. Под увеличением рассекалась арахноидальная оболочка и вме сте с ней смещались сосуды. Миелотомия проводилась при помощи острого скальпеля. Для улучшения видимо сти опухоли использовалась тракция держалками за пи альную оболочку. Если в зоне разреза проходил крупный магистральный сосуд, его смещали латерально или про водили разрез ниже и выше его. Коагуляцией пользова лись крайне редко. Гемостаз осуществлялся орошением физраствором, «ватником» с перекисью водорода. В случаях с эпендимомами, как правило, удавалось идентифицировать границу между опухолью и неизме ненной мозговой тканью и удалить солидную часть опу холи одним блоком. При астроцитомах и интрамедулляр ных опухолях больших размеров граница между опухолью и нормальной мозговой тканью была выражена нечетко. Это не позволяло четко идентифицировать и удалить со лидную часть опухоли одним блоком. В таких случаях опу холь уменьшалась в объеме, устанавливались границы диссекции и опухоль удалялась до тех пор, пока опреде лялась граница между опухолью и неизмененным мозго вым веществом. Острый инструментарий не использовал ся при работе в глубинных частях мозга. По возможности, а также в зависимости от гистострук туры опухоли, желаемым было тотальное или, по край ней мере, субтотальное удаления опухоли. Это особенно важно в хирургии эпендимом, ганглиоглиом, диффузных фибриллярных астроцитом, которые встречаются доволь но часто и имеют относительно доброкачественный про гноз. В большинстве случаев (особенно при эпендимомах) аккуратное удаление опухоли по границе с нормальной мозговой тканью приводит к полному удалению солид ной части опухоли одним блоком или путем фрагмента ции ткани опухоли. Большой риск представляло удаление полюсов опухоли, которые истончаются и смешиваются с мозговой тканью. Это имеет определенный хирургичес кий риск. При опухолях с диффузным распространением в моз говой ткани, как в случаях со злокачественными астроци томами, тотальное удаление опухоли считаем невозмож ным. В этом случае целью операции является достижение значительного уменьшения объема опухоли без нараста ния послеоперационного неврологического дефицита. Выводы. 1. Современная тактика лечения данной патологии предусматривает радикальное удаление интрамедулляр ных опухолей спинного мозга. 2. Радикальность оперативного вмешательства зависит от типа роста опухоли, ее границы с мозговым веществом. ÌÀËÎÈÍÂÀÇÈÂÍÎÅ ÓÄÀËÅÍÈÅ ÄÎÁÐÎÊÀ×ÅÑÒÂÅÍÍÛÕ ÝÊÑÒÐÀÌÅÄÓËËßÐÍÛÕ ÎÁÚÅÌÍÛÕ ÎÁÐÀÇÎÂÀÍÈÉ ÑÏÈÍÍÎÃÎ ÌÎÇÃÀ Ïîëþøêîâ À. Þ., Ðîãîæêèí Ñ. Á., Ðåõàëîâ À. Ô., Ìåäÿíèê È. À. Îáëàñòíàÿ êëèíè÷åñêàÿ áîëüíèöà èì. Í. À. Ñåìàøêî, Íèæíèé Íîâãîðîä С развитием микрохирургии и появлением новых ди агностических технологий возникли предпосылки к ми нимизации операционной травмы с улучшением эффек III ñúåçä íåéðîõèðóðãîâ Ðîññèè 142 Íåéðîîíêîëîãèÿ тивности лечения. Принципы микрохирургических опе раций на позвоночнике и спинном мозге освоены в на шей клинике в 1986 г. Не раз при удалении грыж межпоз вонковых дисков больших размеров возникали мысли о подобной же операции и по поводу спинальной опухоли. Еще менее 10 лет назад малоинвазивное хирургическое лечение экстрамедуллярных объемных образований было затруднительно даже при наличии операционного мик роскопа. С появлением аппаратов КТ и ЯМРТ и внедре нием КТмиелографии значительно улучшилась диагно стика, появилась возможность уточнить размеры, лока лизацию патологического процесса по отношению к по перечнику спинного мозга. С тех пор изменилась страте гия и тактика хирургического вмешательства. Выполне ние прицельного малоинвазивного доступа с использова нием операционного микроскопа дает возможность хи рургу выйти непосредственно на объемное образование, что способствует минимальной травматизации спинного мозга и максимальному сохранению костных структур. Под малоинвазивным удалением опухолей спинного моз га мы подразумеваем оперативные вмешательства объе мом меньше, чем ламинэктомия. Малоинвазивная методика включает: 1) разрез мягких тканей в пределах 56 см, 2) выполнение междужкового транлигаментарного до ступа с первичной ориентацией в операционной ране и уточнением топографии опухоли, 3) выполнение интерламинэктомии, расширенной интерламинэктомии или гемиламинэктомиии в зависи мости от размера и локализации опухоли, 4) удаление патологического образования с использо ванием операционной микрохирургической техники и эндовидеомониторинга. В нашем отделении малоинвазивные удаления экстра медуллярных объемных образований выполнены 28 па циентам в возрасте от 28 до 45 лет. Транслигаментарно удалено 5 опухолей. У 11 пациентов выполнены интерла минэктомии, у 5 – расширенные интерламинэктомии, у 7 – гемиламинэктомии. В раннем послеоперационном периоде больные быст ро активизировались, с ними проводились занятия ЛФК. На вторые сутки после операции больному разрешалось вставать и ходить без фиксирующих повязок и корсетов. Выписка из стационара осуществлялась на 10 сутки пос ле снятия швов. До операции клинически чаще всего доминировали корешковые боли в сочетании с монопарезом нижней конечности. У 7 пациентов отмечался синдром Броун Секара с дизурическими нарушениями. 14 пациентов прооперированно под спинномозговой анестезией, 14 – под общим наркозом. Длительность опе раций не превышала 3 часов, составляя в среднем 2,5 часа. У всех прооперированных пациентов наблюдалось бы строе начало регресса неврологической клиники, что мы связываем с минимальной хирургической травмой спин ного мозга. В процессе динамического наблюдения в те чение 1 года отмечалась стойкая положительная динами ка (нарастала сила в конечностях, регрессировали дизу рические нарушения и чувствительные расстройства). В результате уменьшения операционной травмы и дли тельности анестезии снижается число и тяжесть ослож нений, связанных непосредственно с операцией и нарко зом. Минимальная травматизация спинного мозга сни жает вероятность развития отека и дисциркуляторных нарушений на уровне оперативного вмешательства, уменьшая риск нарастания неврологической симптома тики в послеоперационном периоде. Сохранение опор ной функции позвоночника не требует дорогостоящих фиксаторов и позволяет ставить пациента на ноги на 23 сутки после операции, что сводит к минимуму возмож ность развития послеоперационных осложнений (гипос татической пневмонии, пролежней, тромбозов и тромбо эмболии). Малоинвазивная методика имеет существен ный экономический эффект, так как сокращается пребы вание пациента в стационаре и общий срок нетрудоспо собности. ÑÓÁÒÅÍÒÎÐÈÀËÜÍÀß ÂÍÓÒÐÈÌÎÇÃÎÂÀß ÍÅÂÐÈËÅÌÌÎÌÀ Ïðîíüêî À. Â., Êàðï Â. Í., Çàáðîäñêèé À. Í. 5 Öåíòðàëüíûé âîåííûé êëèíè÷åñêèé ãîñïèòàëü ÂÂÑ, Êðàñíîãîðñê Неврилеммомы среди внутричерепных опухолей со ставляют 89%. Как правило, эти опухоли развиваются из шванновских клеток черепномозговых нервов, чаще все го VIII пары. Неврилеммомы, не связанные с черепно мозговыми нервами, встречаются редко. В доступной нам литературе описано 7 наблюдений внутримозговых суп ратенториальных неврилеммом. Вопрос о происхождении данных опухолей окончательно не решен. Имеются ги потезы о перерождении мезенхимальных пиальных кле ток в шванновские, о пролиферации шванновских кле ток периваскулярных сплетений, о дистопии шванновс ких клеток. Сообщений о субтенториальных внутримоз говых неврилеммомах не встретилось ни разу. Приводим наше наблюдение. Больная К., 52 лет, по ступила в нейрохирургическое отделение 5 ЦВКГ ВВС с жалобами на периодические приступообразные головные боли, шаткость походки. Считает себя больной с 12.08.2001, когда возник приступ острой головной боли. В дальнейшем отмечает 5 приступов цефалгии с продол жительностью до 1 часа (вероятно, переносила ликворо динамические кризы). Из сопутствующей патологии – миокардитический кардиосклероз, экстрасистолия по типу бигеминии Н1. При амбулаторном обследовании на МРТ 25.09.2001 выявлена опухоль правого полушария мозжечка 43х42х40 мм, расположенная субкортикально, накапливающая магневист. Расширения желудочковой системы не определяется. В неврологическом статусе – сознание ясное. Зрачки равные по 3 мм, фотореакции в норме. Мелкоразмашистый нистагм в крайних положе ниях глазных яблок. Легкая асимметрия мимической мус кулатуры. Легкая девиация языка влево. Нарушения слу ха нет. Бульбарных расстройств нет. Сила и тонус мышц конечностей достаточные. Глубокие рефлексы средней живости, без убедительной разницы сторон. Брюшные рефлексы низкие. Патологических знаков не выявлено. Чувствительных расстройств не предъявляет. Координа торные пробы с верхних конечностей выполняет удовлет ворительно, с незначительным мимопопаданием справа. Координаторные пробы с нижних конечностей – удов летворительно. Легкий адиадохокинез справа. Незначи тельный тремор кончиков пальцев при вытянутых вперед руках. Операция 10.10.2001 резекционная трепанация за тылочной кости справа, ламинэктомия С1 позвонка, уда ление опухоли. На операции опухоль была представлена плотным узлом, хорошо отграниченным от мозговой тка ни и локализующимся субкортикально в правом полуша рии мозжечка вне связи с черепномозговыми нервами. Имелась отчетливо выраженная питающая артерия, ис ходящая из ТМО. Опухоль удалена тотально. Послеопе рационное течение гладкое. Макроскопически создава лось впечатление о менингеоме. Однако при гистологи ческом исследовании выявлена неврилеммома с очагами 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 143 Íåéðîîíêîëîãèÿ высокой пролиферативной активности и немногочислен ными митозами. В послеоперационном периоде неврологический ста тус без отклонений, мозжечковая симптоматика регрес сировала. Кроме того, у больной прекратилась экстраси столия по типу бигеминии, которая была резистентной к терапевтическому лечению на протяжении 4 лет. Таким образом, данное наблюдение демонстрирует редкий случай внутримозговой неврилеммомы задней черепной ямки, не описанный в литературе. ÐÅÒÐÎÑÈÃÌÎÈÄÍÛÉ ÄÎÑÒÓÏ ÊÀÊ ÎÑÍÎÂÀ ÌÀËÎÈÍÂÀÇÈÂÍÎÉ ÕÈÐÓÐÃÈÈ ÌÎÑÒÎ-ÌÎÇÆÅ×ÊÎÂÎÃÎ ÓÃËÀ Ðçàåâ Ä. À., Øóëåâ Þ. À., Áèêìóëëèí Â. Í., Ðóäåíêî Â. Â., Ñìåêàëîâ À. Ñ., Âîðîáüåâ À. Â., Ðû÷êîâ Â. Ë. Ãîðîäñêàÿ ìíîãîïðîôèëüíàÿ áîëüíèöà ¹ 2, Ìåäèöèíñêàÿ àêàäåìèÿ ïîñëåäèïëîìíîãî îáðàçîâàíèÿ, Ñàíêò-Ïåòåðáóðã Область мостомозжечкового угла является одной из наиболее сложных анатомических областей головного мозга. Нейрохирурги, вторгающиеся в это маленькое, но очень тонко и сложно организованное пространство, дол жны выбрать оптимальный хирургический доступ, обес печивающий сочетание принципов малоинвазивности с достижением лучшего функционального результата. Ц е л ь . Проанализировать хирургические возможнос ти доступа в лечении патологических процессов мосто мозжечкового угла. М а т е р и а л . Анализ 85 операций, выполненных авто рами с 1997 по 2001 год в нейрохирургическом отделении № 1 ГМПБ № 2 с использованием ретросигмоидного до ступа. Из них: 50 микрохирургических декомпрессий кра ниальных нервов; 14 операций – удаление опухолей вер хушки пирамиды и опухолей петрокливальной локализа ции, 21 операция – удаление акустических неврином. Методы. Нейровизуализации (КТ, МРТ, ТКДГ, ЦАГ) для ус тановления локализации, зоны и направления роста, кон систенции, кровоснабжения опухоли и радикальности хирургического вмешательства. Интраоперационный мониторинг (интервалокарди ометрия, ЭКГ, АД, ЧСС, пульсооксиметрия, SО2, P CO2). В зависимости от преимущественного направления зоны хирургических интересов (орально с распростране нием за тенториум, центрально, каудально) использова ны три варианта латеральной позиции (Albert. L., Rhoton Jr., 1997; Peter J. Jannetta, 1998) с соответствующим фор мированием направлений мануальнооптической оси. Р е з у л ь т а т ы . Применением методики достигнута возможность полноценного и детального обзора зоны па тологического процесса и ее соотношение с краниальны ми нервами, сосудами и латеральной поверхностью ство ла. Использование адекватных сочетаний латеральной по зиции и мануальнооптической оси обеспечило возмож ность полноценного обзора намета, выполнение широ кой тенториотомии (у 11 больных), отделение матрикса опухоли от латеральных отделов ската в верхней и сред ней его третях и верхушки пирамиды (у 5 больных) с ораль ным направлением роста. У всех 50 больных с нейроваскулярным конфликтом (тригеминальная невралгия – у 44, фациальный гемис пазм – у 3, компрессия 512 нервов – у 3 больных с ано малиями базилярной артерии) достигнута возможность выполнения микрохирургических манипуляций с исчер пывающей реализацией хирургического плана в 48 слу чаях. Механических повреждений краниальных нервов у больных с нейроваскулярным конфликтом не было, сни жение слуха отмечено в 2х случаях у больных старше 70 лет. При оценке физиологической дозволенности операции во всех группах больных отмечено, что типы контролиру емых нейрофизиологических реакций у 81 больного не выходили за рамки адаптивных. При этом у двух больных в ходе микроваскулярной декомпрессии краниальных и у семи больных с опухолями внедрение в понтинномедул лярную складку было приостановлено по данным интер валокардиометрии. Умерло двое больных. Две пациентки с менигиомой петрокливальной локализации с суб, супратенториаль ным ростом (летальный исход наступил на 47е и 34е сут ки после операции изза ишемии ствола). У пяти боль ных, оперированных по поводу акустических неврином размерами более 30 мм, не удалось сохранить лицевой нерв. У двух больных на третьи сутки после операции воз никла отоликворея через ячейки сосцевидного отростка. Им была выполнена реоперация – тампонада ячеек лос кутом подкожножировой клетчатки. З а к л ю ч е н и е . Использование ретросигмоидного до ступа является компонентом единой минимальноинва зивной технологии эффективной хирургической коррек ции патологических процессов в области мостомозжеч кового угла. Применение латеральной позиции создает ус ловия комфортного расположения рук хирурга, обеспе чивает пластичность и расширяет диапазон микрохирур гических манипуляций. Несомненные преимущества и достоинства этого доступа могут быть достигнуты только при неукоснительном соблюдении всех элементов техно логического процесса – адекватного положения на сто ле, точного применения манипуляционнооптической оси в сочетании с соответствующими этому доступу ин струментами, материалами, хирургическими приемами. ËÀÇÅÐÍÀß ÒÅÐÌÎÄÅÑÒÐÓÊÖÈß: ÈÍÒÐÀÎÏÅÐÀÖÈÎÍÍÎÅ ÏÐÈÌÅÍÅÍÈÅ ÏÐÈ ÂÍÓÒÐÈÌÎÇÃÎÂÛÕ ÎÏÓÕÎËßÕ ÏÎËÓØÀÐÈÉ ÁÎËÜØÎÃÎ ÌÎÇÃÀ Ðîçóìåíêî Â. Ä., Õîìåíêî À. Â., Òÿãëûé Ñ. Â., Çâîçäÿê Ð. Ò., ×èðêî À. Ë. Èíñòèòóò íåéðîõèðóðãèè èì. àêàä. À. Ï. Ðîìîäàíîâà ÀÌÍ Óêðàèíû, Êèåâ, Óêðàèíà Лазерная термодеструкция (ЛТД) – принципиально новый метод хирургического лечения внутримозговых опухолей. Метод ЛТД основан на использовании эффек та лазерной гипертермической деструкции биологических тканей при контролируемом дозированном воздействии высокоэнергетического излучения неодимового – АИГ лазера (l=1,06 мкм) с мощностью излучения от 3 до 10 Вт. Клинической апробации метода ЛТД предшествовало математическое моделирование процесса в мозговой и опухолевой тканях с учетом особенностей их кровоснаб жения, перфузионных характеристик. В качестве источ ника высокоэнергетического излучения нами использо вались хирургические лазеры на алюмоиттриевом грана те с неодимом (l=1,06 мкм) непрерывным («Радуга 1») и импульсным («Нейронеодим») режимом генерации излу чения. В эксперименте на модели перевивной глиомы (штамм 101. 8) крыс определены оптимальные параметры излу чения, обеспечивающие дозированное объемное разру шение опухолевой ткани. Установлено, что выраженность морфологических термодеструктивных изменений в опу холи нарастает в динамике и достигает максимального III ñúåçä íåéðîõèðóðãîâ Ðîññèè 144 Íåéðîîíêîëîãèÿ значения через 24–48 часов после лазерного облучения. Разработаны и применены в клинической практике следующие способы проведения ЛТД: 1) ЛТД зон опухо левой инфильтрации стенок ложа удаленной опухоли; 2) ЛТД фрагментов опухолевой ткани, распространяющих ся в область центральных извилин, речевую зону, мозо листое тело, подкорковые структуры; 3) селективная ЛТД. ЛТД проводили интраоперационно путем дистанцион ного целенаправленного воздействия лазерным лучом на участки опухоли, подлежащие лазерному разрушению. «Контрастирование» опухоли при селективной ЛТД дос тигается путем внутривенного введения больному непос редственно во время операции (за 1520 минут до начала этапа лазерного воздействия) одного из рентгенконтрас тных веществ (например, урографин, верографин, ульт равист). С применением метода ЛТД проведено 104 операции. Планирование и выбор способа ЛТД проводили с учетом разработанного алгоритма и комплексной оценки резуль татов компьютерной томографии, магнитнорезонансной томографии, однофотонной эмиссионной компьютерной томографии. У 90 из 104 оперированных больных были первичные глиальные опухоли различной степени анап лазии, у 6 больных – саркоматозные опухоли, а у 8 боль ных – метастатические опухоли. Доминантное полуша рие большого мозга было поражено опухолью в 61 наблю дении. В 47 наблюдениях установлено распространение опухоли в срединные структуры мозга, а в 38 наблюдени ях – в функционально значимые зоны мозга. В 41 наблю дении опухоль располагалась в лобной доле, в 22 – в ви сочной доле, в 13 – в теменной доле. Две смежные доли были поражены в 23 наблюдениях (лобновисочная ло кализация – 13, височнотеменная – 8, теменнозатылоч ная – 2), три смежные доли – в 5 наблюдениях. 11 боль ных оперировано в связи с продолженным ростом глиаль ных опухолей. ЛТД зон опухолевой инфильтрации проведено в 52 на блюдениях, ЛТД опухолевых фрагментов – 38 наблюде ний, селективная ЛТД – 14 наблюдений. Если до операции преобладали больные, тяжесть со стояния которых по шкале Карновского соответствовала 60 баллам и ниже (что составляет 87,5%), то после опера ции процент таких больных снизился до 46, в то же время число больных с дооперационным индексом Карновско го 70 баллов и выше в результате проводимых оператив ных вмешательств увеличилось с 12,5 до 54% (Р<0,05). Осложнений, непосредственно связанных с использо ванием метода ЛТД, и послеоперационных летальных ис ходов в исследуемой группе наблюдений не было. Интраоперационное применение метода ЛТД позво ляет обеспечить: 1) оптимальный объем хирургического вмешательства при внутримозговых опухолях; 2) снижение травматичности операции и неосложнен ное течение послеоперационного периода; 3) повышение степени качества жизни оперированных больных. ÈÇÌÅÍÅÍÈß ÂÅÃÅÒÀÒÈÂÍÎÉ ÐÅÃÓËßÖÈÈ ÑÈÑÒÅÌÍÎÃÎ ÊÐÎÂÎÒÎÊÀ Ó ÁÎËÜÍÛÕ Ñ ÎÏÓÕÎËßÌÈ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Ðîùåíêî Â. À., Ñàôèí Ø. Ì., Ãàëååâ Ô. Ñ., Âå÷åðîâà Ñ. À. Ìåäèöèíñêèé óíèâåðñèòåò, Ðåñïóáëèêàíñêàÿ êëèíè÷åñêàÿ áîëüíèöà èì. Ã. Ã. Êóâàòîâà, Óôà Целью данного исследования явилась оценка состоя ния регуляции системного кровотока у больных до опе рации и в раннем послеоперационном периоде после уда ления опухолей головного мозга. Проведена оценка среднединамического АД (АДср.) на обеих верхних и обеих нижних конечностях (aa. brachialis, aa. femoralis) у больных с опухолями головного мозга в воз расте от 35 до 60 лет, из них 44 мужчины и 48 женщин, до операции и на 2, 5, 9 сутки после нее. АДср.=АДд.+(АДс. АДд.)/3; где АДд. – диастолическое давление, АДс. – си столическое артериальное давление. Первое измерение АД проводили в исходном положении лежа на спине с поднятым на 30° головным концом (голова и туловище на одной линии), а ноги в горизонтальном положении (по ложение А). Второе измерение проводили через 5 минут после пассивного (без участия пациента) подъема ног на угол 20° от горизонтального уровня (положение В). Тре тье измерение АД производят после опускания ног в ис ходное положение (положение С). Больные до операции были разделены на три группы: 1я группа имела 2й фун кциональный класс, 2я группа – 3й функциональный класс и 3я группа – 4й функциональный класс по клас сификации Американского общества анестезиологов (ASA, 1961). При сравнении полученных результатов в этих груп пах вегетативную регуляцию кровотока оценивали как: компенсированную (при значениях АДср. в положени ях А, В, С больше 79,5 и меньше 115,5 мм рт. ст.); деком пенсированную I степени (при значениях АДср. не бо лее чем на одной из конечностей хотя бы в одном из по ложений А, В, С меньше 79,5 или больше 115,5 мм рт. ст.); декомпенсированную II степени (при значениях АДср. не более чем на двух из конечностей хотя бы в од ном из положений А, В, С меньше 79,5 или больше 115,5 мм рт. ст.); декомпенсированную III степени (при зна чениях АДср. не более чем на трех из конечностей хотя бы в одном из положений А, В, С меньше 79,5 или боль ше 115,5 мм рт. ст.); декомпенсированную IV степени (при значениях АДср. на четырех конечностях хотя бы в одном из положений А, В, С меньше 79,5 или больше 115,5 мм рт. ст.). Степень декомпенсации вегетативной регуляции сис темного кровотока имела прямую сильную корреляцию с оценкой физикального статуса по функциональным клас сам классификации ASA. При комплексном стресстестировании системного кровотока по данным АДср. на обеих верхних и нижних конечностях выявлена асимметрия между левыми и пра выми, верхними и нижними конечностями, а также по их перекресту. На нижних конечностях эти изменения были более выражены. Значения АДср. хотя бы в одном из по ложений А, В, С на одной из конечностей не соответство вали нормальным на всех этапах исследования. На ниж них конечностях эти изменения были более выражены. У пациентов в условиях гемодинамической нагрузки (поло жение В) наблюдалось максимальное отклонение пока зателей АДср. от среднестатистической нормы. Т. о., по степени нарушения вегетативной регуляции системного кровотока на конечностях можно судить в режиме реального времени о физикальном статусе боль ного и компенсаторных возможностях его органов и сис тем. Измерение АД на одной из верхних конечностей не дает полной характеристики регуляции системного и пе риферического кровотока. Нагрузочная проба с подняти ем ног на угол 20° от горизонтального уровня у больных с опухолями головного мозга позволяет выявить скрытую декомпенсацию вегетативной регуляции системного кро вотока. 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 145 Íåéðîîíêîëîãèÿ ÒÐÀÍÑÊÐÀÍÈÀËÜÍÀß ÄÎÏÏËÅÐÎÃÐÀÔÈß Â ÎÖÅÍÊÅ ÏÎÑËÅÎÏÅÐÀÖÈÎÍÍÎÉ ÏÅÐÔÓÇÈÈ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Ó ÍÅÉÐÎÎÍÊÎËÎÃÈ×ÅÑÊÈÕ ÁÎËÜÍÛÕ Ðîùåíêî Â. À., Ñàôèí Ø. Ì., Ãàëååâ Ô. Ñ., Âå÷åðîâà Ñ. À., Âàñèëüåâà Í. Ê. Ìåäèöèíñêèé óíèâåðñèòåò, Ðåñïóáëèêàíñêàÿ êëèíè÷åñêàÿ áîëüíèöà èì. Ã. Ã. Êóâàòîâà, Óôà Целью работы явилась оценка прогнозирования исхо да хирургического лечения опухолей головного мозга (ОГМ) по данным транскраниальной допплерографии (ТКДГ). Обследовано 87 больных с ОГМ до и после операции. Динамику мозгового кровотока оценивали по данным УЗДГ с дискретной регистрацией линейных скоростей кровотока (ЛСК) по симметричным интракраниальным артериям головы. По данным ТКДГ паттерн вазоспазма зарегистрирован у 6 больных в послеоперационном периоде. Одновремен но отмечалась асимметрия сосудистых изменений, возра стание систолической и средней ЛСК на оперированной стороне. У 3 больных после операции положительная не врологическая симптоматика сочеталась с уменьшением вазоспазма, выявляемого по снижению ЛСК. У этой груп пы больных к 35 суткам сглаживалась межполушарная разница по ЛСК, которая в дальнейшем нивелировалась. В другой группе больных (64 человека) отмечалось сни жение ЛСК на стороне опухоли после операции. У 51 боль ного из этой группы признаки ассимметрии ЛСК отме чались и до операции. У больных с «компрометированным» мозговым крово током (6 больных с вазоспазмом и 62 больных со сниже нием ЛСК на стороне опухоли) в раннем послеопераци онном периоде улучшение состояния коррелировало с нормализацией ЛСК. В течение 3 суток у 14 больных после операции межпо лушарная разница по ЛСК отсутствовала. У 5 больных наблюдалась артериальная гипотензия, угнетение созна ния. При этом ишемия головного мозга подтверждалась снижением ЛСК по интракраниальным артериям в срав нении с исходными величинами, отсутствием диастоли ческой фазы кровотока вследствие выраженности процес сов отека и дислокации головного мозга. Эти изменения верифицировали данными магнитнорезонансной и ком пьютерной томографии головного мозга. Т. о., ТКДГ мо жет быть использована для оценки прогноза исхода хи рургического лечения ОГМ. ТКДГ мониторинг в после операционном периоде позволяет контролировать состо яние нейрохирургических больных и определять эффек тивность терапии ишемии головного мозга, т. к. отражает состояние мозгового кровотока. ÍÀÐÓØÅÍÈß ÈÍÒÐÀÊÐÀÍÈÀËÜÍÎÃÎ ÂÅÍÎÇÍÎÃÎ ÊÐÎÂÎÎÁÐÀÙÅÍÈß ÏÐÈ ÌÅÍÈÍÃÈÎÌÀÕ ÏÀÐÀÑÀÃÈÒÒÀËÜÍÎÉ ËÎÊÀËÈÇÀÖÈÈ Ðûæèé À. Â., Ìóçëàåâ Ã. Ã., Êîâàëåâ Ã. È., Ðûæèé Â. Ã., Óõèíà Å. Â., Øàãàë Ë. Â., Ëèòâèíåíêî Ä. Â., Áëóìåíàó È. Ñ. Êóáàíñêàÿ ãîñóäàðñòâåííàÿ ìåäèöèíñêàÿ àêàäåìèÿ, êàôåäðà íåðâíûõ áîëåçíåé è íåéðîõèðóðãèè, Êðàñíîäàð Ц е л ь . Целью настоящего исследования являлось изу чение кровотока в глубокой венозной системе головного мозга при менингиомах парасагиттальной локализации в зависимости от степени окклюзии верхнего сагиттально го синуса (ВСС). М а т е р и а л ы и м е т о д ы . Исследование проводилось у 32 больных с менингиомами парасагиттальной локали зации и 35 человек с поясничным остеохондрозом, соста вивших контрольную группу. По типу поражения опухо лью стенок ВСС, согласно классификации С. В. Можае ва (1993), больных основной группы мы разделили на три подгруппы: 1. А (54 тип) – полная окклюзия ВСС (1 человек); 2. В (32 тип) – частичная окклюзия ВСС (13 человек); 3. С (1 тип) – без окклюзии ВСС (18 человек). В предоперационном периоде до проведения дегидра тационной терапии проводился комплекс неинвазивных методов диагностики, включающий: 1. Измерение диастолического давления в центральной вене сетчатки (ДДЦВС) обоих глаз по модифицирован ной методике М. Я. Бердичевского, О. Н. Породенко (1977) при помощи электронного офтальмодинамометра ОЭ01; 2. Измерение линейной скорости кровотока (ЛСК) в прямом синусе (ПС) через затылочное окно (в области наружной затылочной бугристости) с использованием аппарата «Сономед 300/М». С целью оценки функциональной значимости вен мяг ких покровов головы в церебральном кровотоке регист рация ДДЦВС и ЛСК в ПС проводилась в горизонталь ном положении больного вначале без функциональных нагрузок, а затем с применением пробы жгута (ПЖ) по методике Г. С. Тиглиева, В. Е. Олюшина и соавт. (Ленин град, 1991). На 11е сутки после удаления опухоли проводилось контрольное измерение ЛСК и ДДЦВС в горизонтальном положении пациента без функциональных нагрузок. Степень окклюзии ВСС определялась по данным КТ, МРТ, церебральной ангиографии. Р е з у л ь т а т ы . Значения ДДЦВС, ЛСК в ПС в конт рольной группе при проведении статистической обработ ки мы приняли за 100%. Во всех подгруппах отмечалась отчетливая асимметрия ДДЦВС с преобладанием на стороне опухоли. Спонтан ный венозный пульс отсутствовал у всех больных. В подгруппе А отмечалось увеличение ДДЦВС на сто роне опухоли на 153,4%, на противоположной стороне на 139,5%; ЛСК в ПС – на 160,4%. При ПЖ наблюдался подъем ДДЦВС на стороне опухоли на 163,4%, на интак тной стороне – на 139,7%; ЛСК в ПС возрастала на 177,9%. Опухоль располагалась на уровне средней трети ВСС. Провести ее тотальное удаление не представлялось воз можным. Тем не менее, на 11е сутки после операции ДДЦВС на стороне опухоли снизилось на 23%, на интак тной стороне на 19%, ЛСК в ПС на – 25,3%, что указыва ло на снижение внутричерепного давления. В подгруппе В отмечалось увеличение ДДЦВС на сто роне опухоли на 96,2%, на противоположной стороне на 80,7%; ЛСК в ПС – на 98,1%. При ПЖ у 10 больных отме чалось увеличение венозного давления на стороне опухо ли на 120% и на интактной стороне на 110,3%; ЛСК в ПС возрастала на 130,5%. Удаление опухоли вело к снижению ДДЦВС на стороне опухоли на 62,2%, на интактной сто роне на 58,4%; ЛСК в ПС – на 64%. У 3 больных при ПЖ отмечалось снижение ДДЦВС с обеих сторон и ЛСК в ПС в два раза, что объясняется сбросом венозной крови через собственную сосудистую сеть опухоли. Удаление опухо ли в данных случаях усугубляло нарушения венозного кровотока, ДДЦВС, ЛСК в ПС оставались практически на дооперационном уровне или возрастали. В подгруппе С ДДЦВС увеличилось на 43,3% на сто роне опухоли и на 31,6% на интактной стороне; ЛСК в III ñúåçä íåéðîõèðóðãîâ Ðîññèè 146 Íåéðîîíêîëîãèÿ ПС – на 53,2%. При ПЖ в подгруппе С и в контрольной группе ДДЦВС и ЛСК в ПС не изменялись. Удаление опухоли приводило к снижению ДДЦВС на стороне опу холи на 36,5%, на интактной стороне на 31%, ЛСК в ПС на 41,2%. Выводы. 1. При менингиомах парасагиттальной локализации формируются дополнительные пути венозного оттока, степень развития которых зависит от типа окклюзии ВСС; 2. Пути оттока венозной крови из полости черепа мо гут определяться характером сосудистой сети менингио мы, ее способностью взять на себя роль дополнительного резервуара с последующим сбросом в систему наружной яремной вены, минуя изученные пути коллатерального кровотока, а также индивидуальной особенностью ауто регуляции венозной системы. ÂÎÇÌÎÆÍÎÑÒÈ ÏÓÍÊÖÈÎÍÍÎÃÎ ÒÐÀÍÑÍÀÇÎÑÔÅÍÎÈÄÀËÜÍÎÃÎ ÄÎÑÒÓÏÀ ÏÐÈ ÕÈÐÓÐÃÈ×ÅÑÊÎÌ ËÅ×ÅÍÈÈ ÀÄÅÍÎÌ ÃÈÏÎÔÈÇÀ Ñ ÈÑÏÎËÜÇÎÂÀÍÈÅÌ ËÀÇÅÐÍÎÃÎ ÈÇËÓ×ÅÍÈß Ðÿçàíöåâ À. À. Ãîñóäàðñòâåííûé èíñòèòóò ëàçåðíîé õèðóðãèè, ×åëÿáèíñê Статистические данные указывают на увеличение час тоты возникновения и выявления аденом гипофиза. При менение КТ и МРТ позволяет верифицировать АГ на ран них стадиях, четко определить границы новообразования и плотность опухолевой ткани. Исходя из общей тенден ции хирургии в стремлении к уменьшению травматизма в процессе операции, разработка пункционного доступа является актуальным направлением в хирургии аденом гипофиза. Ранее пункционный доступ применялся как первый этап хирургического лечения АГ при тяжелом состоянии больных, для деструкции аденом гипофиза различными физическими агентами. Однако вследствие технических сложностей, невозможности точного дозирования по вреждающего агента и значительного процента осложне ний эти операции не нашли широкого применения в прак тике. Экспериментально нами доказана возможность селек тивной деструкции ткани аденогипофиза направленным воздействием ближнего инфракрасного спектра лазерного излучения посредством транссфеноидального доступа. Результаты экспериментального исследования послужи ли основой в исполнении лазерной деструкции при хи рургическом лечении аденом гипофиза. Пункционный трансназосфеноидальный доступ был использован нами при хирургическом лечении аденом гипофиза эндо, инфра, супраселлярной локализации, имеющих, по данным компьютерной томографии (КТ), пониженную и изоплотность опухолевой ткани по срав нению с плотностью нормальной мозговой ткани (27 больных). Этот доступ осуществлялся также при лечении кистозных аденом гипофиза, имеющих эндоселлярный и супрапараселлярный рост (9 больных). Операция проводилась под наркозом. В положении больного лежа на спине канюля с перфоратором вводи лась через средний носовой ход под рентгенологическим контролем в прямой и боковой проекциях через переднюю стенку основной пазухи к дну турецкого седла. Перфора ция дна турецкого седла и прилежащей к нему капсулы опухоли осуществлялась поступательным продвижением канюли с перфоратором. Пункция полости турецкого сед ла обычно не вызывала затруднений вследствие истонче ния костной стенки, при этом конец канюли подводили к передненижним отделам турецкого седла. После уда ления перфоратора из канюли почти всегда под давлени ем выделялась желеобразная опухолевая ткань или кис тозная жидкость с крошкообразными фрагментами опу холи. После прекращения спонтанного выделения пато логической ткани проводилась активная аспирация ее через канюлю. В последующем с целью деструкции оставшейся опу холевой ткани воздействовали на нее высокоинтенсив ным лазерным излучением в непрерывном режиме через кварцевый световод. После удаления канюли полость носа тампонировалась на сутки. С профилактической целью больные получали антибактериальную терапию. Этим способом прооперировано 36 больных, из этих больных четверо ранее оперировались традиционными транскра ниальными методами в других ЛПУ. Осложнений во время операции и в послеоперацион ном периоде не отмечалось. Эффективность ее оценива лась по клиническим данным и результатам исследова ний при КТ и МРТ головного мозга. В послеоперацион ном периоде отмечался быстрый клинический эффект: головные боли проходили сразу после операции или в пер вую неделю, при КТ головного мозга регистрировалось уменьшение размеров опухоли, отмечался регресс опти кохиазмального синдрома расширением полей зрения. Осложнений и летальных исходов не отмечалось. Хирургическое лечение аденом гипофиза пункцион ным способом трансназосфенидальным доступом с ис пользованием высокоинтенсивного лазерного излучения для обработки ткани опухоли является малотравматичным методом, способствует быстрому регрессу неврологичес кой симптоматики, не вызывает осложнений со стороны гипоталамической области головного мозга. По резуль татам наших исследований может быть рекомендован как метод выбора при хирургическом лечении аденом гипо физа эндо, инфра, супраселлярной локализации. ÑÓÏÅÐÑÅËÅÊÒÈÂÍÀß ÂÍÓÒÐÈÀÐÒÅÐÈÀËÜÍÀß ÕÈÌÈÎÒÅÐÀÏÈß Â ËÅ×ÅÍÈÈ ÂÍÓÒÐÈÌÎÇÃÎÂÛÕ ÎÏÓÕÎËÅÉ Ñàâåëëî À. Â., Ñâèñòîâ Ä. Â., Ïàðôåíîâ Â. Å., Ìàðòûíîâ Á. Â., Êàíäûáà Ä. Â. Êàôåäðà íåéðîõèðóðãèè ÂìåäÀ, Ñàíêò-Ïåòåðáóðã Результаты исследований на животных и первые сооб щения о клинических испытаниях позволяют полагать, что суперселективное внутриартериальное введение ци тостатиков позволяет создавать высокую концентрацию химиотерапевтических веществ во внутричерепных ново образованиях. В настоящем сообщении мы представля ем наш клинический опыт применения 15 внутриартери альных инфузий кармустина и цисплатина в период с ок тября 2001 года по январь 2002 года. Кармустин и циспла тин вводили 9 пациентам (3 мужчин и 6 женщин) в дозе 200 мг. Применение суперселективной катетеризации внутри черепного сосудистого русла было продиктовано необхо димостью избежать токсического воздействия препаратов на орган зрения, для чего кончик микрокатетера должен располагаться, как минимум, выше устья глазничной ар терии. Во всех наблюдениях применяли чрезбедренную кате теризацию сосудистого русла с применением коаксиаль ных систем диаметром 56 F, производства BALT Extrusion и Cordis (J&J). Направляющий катетер устанавливали суб краниально и после обзорной ангиографии в стандартных проекциях осуществляли катетеризацию внутричерепно 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 147 Íåéðîîíêîëîãèÿ го русла. Применяли микрокатетеры 1,21,8 F, управляе мые в потоке. Наиболее адекватно отвечающим требова ниям явились микрокатетеры MAGIC 1,21,5 F. Для обес печения проникновения микрокатетера в супраклиноид ный сегмент в половине случаев применяли микропро водник SOR007. Осложнений, связанных с катетеризаци ей дистального сосудистого русла, не отмечено. Продол жительность этапа доступа составила от 2,0 до 19,6 минут (в среднем 8,3±4,9 минут) времени рентгеноскопии и, как правило, определялась особенностями анатомии ветвей дуги аорты и сифона внутренней сонной артерии. По завершении катетеризации осуществляли позици онирование микрокатетера на уровне проксимальнее лен тикулостриарных артерий СМА или в С1 сегменте ВСА в зависимости от локализации и ангиоархитектоники опу холи. После суперселективной ангиографии через мик рокатетер вводили препарат (автоматическим инъекто ром) в две фазы: первая – болюсное введение 40 мг пре парата; вторая – инфузия 160 мг препарата (8 мг/мин). В целях предупреждения осложнений проводили систем ную гепаринизацию (500010000 ЕД), вводили глюкокор тикоидные гормоны (дексазон/преднизолон 20/120 мг). До и после инфузии осуществляли допплерографическую оценку кровотока в ипсилатеральной СМА и ВСА на шее, оценивали ауторегуляцию методом компрессионного те ста. По завершении инфузии выполняли контрольную суперселективную и обзорную ангиографию. Средний возраст больных составил 39 лет (1569 лет). Среди опухолей были мультиформная глиобластома (n=4), анапластическая астроцитома (n=3), анапластичес кая хориоидпапиллома (n=1), олигдендроглиома (n=1). Неврологические осложнения манипуляции (джексо новские судороги (n=1), преходящий неврологический дефицит: гемипарез (n=3), смешанная афазия (n=1)) раз вились после 5 процедур, носили транзиторный характер и были связаны с токсическим действием препарата. На рушений проходимости магистральных артерий головы и шеи, спазма внутричерепных сосудов, нарушений крово тока (по данным ТКДГ) и ауторегуляции не отмечено. Продолжительность пребывания в стационаре составила 48 часов. Ближайший катамнез продемонстрировал благоприят ное течение послеоперационного периода с регрессом или отсутствием опухолевой прогрессии. Таким образом, суперселективное внутриартериальное введение химиопрепаратов относительно безопасно, ре ализуется без существенных затрат на техническое обес печение, сопровождается преимущественно преходящим неврологическим дефицитом, связанным с токсическим действием препарата. Клиническая эффективность супер селективной внутриартериальной инфузии химиопрепа ратов как компонента комплексного лечения больных с первичными внутримозговыми опухолями требует даль нейших исследований в сравнимых группах пациентов, получающих традиционные виды адъювантной терапии. Ê ÂÎÏÐÎÑÓ Î ÏÀÒÎÌÎÐÔÎÇÅ ÃËÈÎÌ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Ñàëååâ Ð. À., Îáðàçöîâà Ð. Ã., Äìèòðèåâ Ä. Â., Ìàòâååâà À. Ñ., ×åêàíîâà Î. Â. Óðàëüñêàÿ ãîñóäàðñòâåííàÿ ìåäèöèíñêàÿ àêàäåìèÿ, Ãîðîäñêàÿ êëèíè÷åñêàÿ áîëüíèöà ¹ 40, Åêàòåðèíáóðã В течение 19901999 гг. в нейрохирургической клини ке УГМА находилось на лечении 1162 человека с глиаль ными опухолями головного мозга. Больных в возрасте до 16 лет было 244 (21%), несколь ко преобладали мальчики – 144 (59%). При этом в 36 на блюдениях глиомы располагались супратенториально, а в 108 наблюдениях (75%) субтенториально. В группе де вочек (100 больных) субтенториальная локализация опу холи встретилась в 66 наблюдениях. При анализе гисто логической структуры глиом у детей выявлены следую щие особенности: у мальчиков злокачественные опухо ли (анапластические астроцитомы, медуллобластомы, глиобластомы) чаще диагностировались при их локали зации в задней черепной яме – в 52,7% случаев, в то вре мя как у девочек – при супратенториальной локализа ции (52,9%). Обращает на себя внимание тот факт, что удельный вес медуллобластом мозжечка составил у мальчиков 40,7%, а у девочек – 34,8%, что существенно меньше по сравне нию с нашими же данными 5060х годов прошлого сто летия – 56% и 44% соответственно. Тем не менее общее количество злокачественных глиом и у мальчиков, и у де вочек в наблюдениях девяностых годов примерно одина ковое и составляет 47,9% и 49%. С другой стороны, в 1950 1970 гг. злокачественные глиомы были выявлены у маль чиков в 48%, а у девочек – в 35% случаев. Что касается взрослых больных (918), то мужчин так же было несколько больше, чем женщин – 489 (53,3%). В 59 наблюдениях опухоль располагалась в задней черепной яме, в 430 наблюдениях (88%) – в больших полушариях. При этом обе гемисферы головного мозга поражались примерно одинаково часто – в 209 случаях левое полуша рие, в 197 – правое. Еще у 24 мужчин были вовлечены в процесс глубокие и медиальные образования головного мозга. Из числа 430 супратенториальных опухолей в 306 наблюдениях выявлены или глиобластомы, или анаплас тические глиомы, что составляет 71,2%. Из 59 субтенто риальных глиом злокачественные варианты установлены в 69,5% случаев. У женщин также доминировали опухоли больших по лушарий – в 353 из 429 наблюдений (82,3%), причем пра вое полушарие мозга было поражено несколько чаще (175), чем левое (157). У 21 больной глиомы локализова лись в глубоких отделах мозга. Злокачественные вариан ты глиом обнаружены в 253 случаях при супратенториаль ной локализации и в 61,8% при субтенториальной. Если обратиться к данным 5060х годов, то в эти деся тилетия злокачественные глиомы, включая анапластичес кие (недифференцированные), по данным Свердловской нейрохирургической клиники, были обнаружены в 59,1% случаев у мужчин и в 46,2% случаев у женщин. Таким об разом, сравнительный анализ позволяет выявить одну из ключевых тенденций патоморфоза глиальных опухолей головного мозга – нарастание количества злокачествен ных глиом у трех из четырех категорий больных: у муж чин – 59,1% и 70,3% (данные соответственно 5060х и 90х годов) и в еще более очевидной форме – у женщин (46,2% и 64,2%) и у девочек (35% и 49%). ÄÈÀÃÍÎÑÒÈÊÀ È ÕÈÐÓÐÃÈ×ÅÑÊÎÅ ËÅ×ÅÍÈÅ ÀÒÈÏÈ×ÅÑÊÈÕ È ÇËÎÊÀ×ÅÑÒÂÅÍÍÛÕ ÌÅÍÈÍÃÈÎÌ ÃËÎÂÍÎÃÎ ÌÎÇÃÀ Ñàìáîð Â. Ê. Èíñòèòóò íåéðîõèðóðãèè èì. àêàä. À. Ï. Ðîìîäàíîâà ÀÌÍ Óêðàèíû, Êèåâ, Óêðàèíà Менингиомы среди всех новообразований головного мозга занимают второе место после глиальных опухолей и составляют, по данным разных авторов, от 13% до 20%. В большинстве случаев менингиомы головного мозга встречаются у взрослых людей трудоспособного возраста (4060 лет), при этом у женщин эти опухоли встречаются чаще чем у мужчин, в соотношении 2:1. Локализуются ме III ñúåçä íåéðîõèðóðãîâ Ðîññèè 148 Íåéðîîíêîëîãèÿ нингиомы, главным образом, супратенториально, в об ласти задней черепной ямы эти новообразования встре чаются значительно реже (в соотношении 10:1). Следует отметить, что менингиомы головного мозга встречаются не только у взрослых, но и у детей. В детском возрасте ме нингиомы встречаются редко. Менингиомы, как прави ло, являются доброкачественными новообразованиями, однако среди них встречаются атипические и злокаче ственные гистобиологические типы (1015% от всех ти пов менингиом). Вопросы диагностики и хирургическо го лечения атипических и злокачественных менингиом головного мозга, на наш взгляд, в литературе освещены недостаточно, в связи с чем решению этих вопросов и было посвящено наше исследование. Наше исследование базируется на 104 наблюдениях больных с атипическими и злокачественными менинги омами головного мозга, которые находились на лечении в Институте нейрохирургии им. акад. А. П. Ромоданова за период 19942000 гг. Среди них 102 больных были взрос лыми людьми от 20 до 75 лет (средний возраст составил 50 лет) и 2 детей (оба мальчики), 12 и 16 лет (средний возраст – 14 лет). Больных мужского пола было 49 (46,7%), жен щин было 55 (53,3%). Взрослые больные с атипическими и злокачественны ми менингиомами составили 10,5%, а дети 0,2% всех боль ных с менингиомами головного мозга. Атипические ме нингиомы диагностированы у 87 больных (83,7%), у 17 больных (16,3%) установлен диагноз менингеальной сар комы. В подавляющем количестве наблюдений (94 больных, 90,3%) менингиомы имели супратенториальную локали зацию, и только у 10 больных (9,7%) опухоли локализова лись субтенториально. При анализе полученных данных выявлен более быст рый темп развития клинической картины заболевания у больных с атипическими и злокачественными менинги омами головного мозга (средняя длительность заболева ния около 10 месяцев), чем у больных с типическими ме нингиомами. При анализе данных дополнительных методов обсле дования установлено, что наиболее информативным не инвазивным методом диагностики является компьютер ная томография (КТ) с внутривенным усилением. Выяв лены отдельные КТ признаки, с помощью которых мож но с большой долей вероятности диагностировать атипи ческие и злокачественные менингиомы головного мозга на дооперационном этапе. Оперативные вмешательства были направлены на уда ление опухоли, резекцию твердой мозговой оболочки, а иногда и участков кости, проращенных опухолью, с вы полнением одномоментной пластики образовавшихся дефектов. Всем больным в послеоперационном периоде был про веден курс лучевой терапии на зону оперативного вмеша тельства в суммарной дозе 5060 Грей. ÐÅÇÓËÜÒÀÒÛ ÕÈÐÓÐÃÈ×ÅÑÊÎÃÎ ËÅ×ÅÍÈß ÃËÈÀËÜÍÛÕ ÍÎÂÎÎÁÐÀÇÎÂÀÍÈÉ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Ñàìîøåíêîâ À. Ã., Ñàìîøåíêîâ Ã. Ñ., Ðîìàíåíêîâ Â. Ì. Îáëàñòíàÿ áîëüíèöà, Òóëà Актуальность вопросов хирургического лечения глиом головного мозга остается на сегодняшний момент неоспо римой, поскольку, несмотря на значительный научнотех нологический прогресс в нейрохирургии, имеющий мес то последние годы, успехи в этой области остаются весь ма скромными. За период 19962000 годы в нейрохирургическом отде лении ТОБ обследовано 219 пациентов с глиальными но вообразования головного мозга. Из них мужчины составили 59%, женщины 41%, сред ний возраст 47,3 лет. Всем пациентам проводилось комп лексное профильное обследование, включающее РКТ головного мозга, МРТ в Т1, Т2, ангиорежиме. Оперативные вмешательства по поводу глиальных но вообразований произведены 170 пациентам (77,6%) с ис пользованием стандартных нейрохирургических досту пов, микрохирургической техники, медицинского лазе ра, УЗаспиратора. Из них дифференцированные астро цитомы составили 64 (37,2%), анапластические астроци томы 38 (21,2%), олигодендроглиомы 10 (6,2%), глиобла стомы 51 (31,2%), медуллобластомы 9 (5,3%). Глиомы по лушарной локализации составили 81,4% с четким доми нированием левой гемисферы (соотношение 1:1,5 соот ветственно), мозжечка и области IV желудочка 15,4%, ствола головного мозга 1,8%, области III желудочка и пи неальной области 1,8%. Послеоперационная летальность составила 15,4%. Число повторных операций в первый год после первичного вмешательства составило 17 человек (10%). Радикальное одномоментное хирургическое удаление глиальных новообразований головного мозга, в некото рых случаях проводимое даже в пределах «здоровой тка ни», является важнейшим и прогностически значимым фактором, позволяющим рассчитывать на хорошую не врологическую и социальную реабилитацию в условиях длительного безрецидивного периода, и соблюдение це лесообразной этапности методов комбинированной тера пии. Многоэтапные и щадящие вмешательства, в том чис ле и декомпрессивные, по нашему мнению, не оправды вают себя в практике и должны применяться лишь в край них случаях, при наличии соответствующих показаний. ÎÏÛÒ ËÀÇÅÐÍÎÉ ÌÈÊÐÎÕÈÐÓÐÃÈÈ Â ÍÅÉÐÎÎÍÊÎËÎÃÈÈ Ñàìîøåíêîâ Ã. Ñ. Îáëàñòíàÿ áîëüíèöà, Òóëà В последние годы применение лазерной техники в виде различных модификаций аппаратов нашло широкое при менение в практической нейрохирургии и особенно в ней роонкологии. В нейрохирургическом отделении Тульской областной больницы с 1993 г. применяется хирургический лазерный аппарат LST20/01 отечественного производства, изготов ленный в КБ приборостроения г. Тулы. С целью совершенствования техники лазерной микро хирургии в работу отделения в 1996 г. внедрена специаль но сконструированная в КБ приставка для хирургическо го микроскопа Wild М655, которая позволила не только соединить лазерный аппарат с микроскопом, но и мани пулировать лазерным лучом вместе с маркером в опера ционной раме радиусом 810 мм, при этом не меняя фо куса и местоположение тубуса микроскопа. Используя традиционную микрохирургическую техни ку в сочетании с лазерной микрохирургией, за период 19962000 гг. оперировано 38 больных с новообразовани ями головного и спинного мозга различной локализации. Из них 21 наблюдение – базальные менингиомы раз личной локализации, 3 – аденомы гипофиза, невриномы слухового нерва – 2, экстрамедуллярные опухоли спинно го мозга – 5, опухоли головного мозга глиального ряда – 7. В зависимости от этапа оперативного вмешательства и конкретной ситуации использовался сфокусированный, а при необходимости расфокусированный лазерный луч. 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 149 Íåéðîîíêîëîãèÿ Регулируя мощность излучения и воздействуя на кап сулу опухоли или на ее интракапсулярную часть, достига лось уменьшение объема опухоли, затем отделение ее от прилежащих структур мозгового вещества, сосудов. Уда ление опухоли сопровождалось минимальной кровопоте рей и снижением степени травматического повреждения перефокальных отделов мозговой ткани. Анализ результатов оперативных вмешательств пока зал, что применение лазерной микрохирургии наиболее эффективно в случаях удаления менингиом базальной локализации, опухолей спинного мозга. При этом, уда ляя опухоль, удавалось сохранить наиболее важные струк туры мозга с минимальной их травматизацией. Место исходного роста в зависимости от локализации обрабатывалось лазерным лучом различной мощности. Время экспозиции воздействия зависело от площади рас пространения исходного роста и радикальности удаления опухоли. Оценивая отдаленные результаты хирургических вме шательств с применением лазерной микрохирургии, сле дует признать, что применение ее раскрывает новые воз можности в нейроонкологии и позволяет повысить ради кальность удаления новообразований центральной не рвной системы, повысить точность и безопасность ис пользования лазерного воздействия на мозговую ткань, улучшить результаты хирургического лечения, особенно в труднодоступных зонах роста новообразований. ÏÐÈÌÅÍÅÍÈÅ ÃÅÌÈËÀÌÈÍÝÊÒÎÌÈÈ ÏÐÈ ÎÁÚÅÌÍÛÕ ÏÐÎÖÅÑÑÀÕ ÑÏÈÍÍÎÃÎ ÌÎÇÃÀ Ñáåéòè Â. Ì. Êàôåäðà íåðâíûõ è íåéðîõèðóðãè÷åñêèõ áîëåçíåé, Ãîñóäàðñòâåííûé ìåäèöèíñêèé óíèâåðñèòåò, Ìèíñê, Áåëàðóñü В течение многих лет при опухолях спинного мозга использовался метод ламинэктомия, после которого име ло место большое количество осложнений: нестабильность и патологические искривления позво ночника; сдавление спинного мозга и нарастание неврологи ческой симптоматики. Причиной осложнений являются большой объем опе рации с удалением нескольких остистых отростков и ду жек и удаление задних, костносвязанных структур позво ночника, которые выполняют не только защитную, но и опорностатическую функцию. Современные возможно сти диагностики и нейрохирургической техники позво ляют поставить вопрос об отказе от подобного доступа и использовании более экономного и щадящего доступа – гемиламинэктомии. Целью работы является изучение возможностей геми ламинэктомии при различных по локализации и гисто логической структуре опухолях спинного мозга. М а т е р и а л и м е т о д ы . С 1995 г. оперировано 160 больных с опухолями спинного мозга. Из них 134 боль ным была сделана гемиламинэктомия. Экстрадуральные опухоли были у 42 больных (метастазы – у 27, ретикуло саркома – у 15), экстрамедуллярные – у 70 (невринома – у 24, менингиома – у 33, эпендимома – у 9), интрамедул лярные – у 22 (астроцитома – у 15, ангиома – у 7). По от ношению к спинному мозгу 28 из 66 экстрамедуллярных опухолей были переднебокового расположения, 23 – зад небокового и 15 – заднего. В 18 случаях была выполнена гемиламинэктомия 1 дуж ки, в 72 – 2, в 31 – 3, и в 9 – 4. У всех больных опухоли удалены тотально. Р е з у л ь т а т ы и о б с у ж д е н и е . Ламинэктомия со провождается обширным разрушением опорнодвига тельных образований. Приходится удалять задние кост носвязочные структуры позвоночника, которые выпол няют не только защитную роль для спинного мозга, но и опорностатическую функцию. Это ведет к тому, что в отдаленном периоде, особенно у детей, развиваются не стабильность и патологические искривления позвоноч ника: возможно сдавление спинного мозга. Для уменьшения выраженности этих осложнений ре комендуют выполнять экономную ламинэктомию с со хранением суставных отростков. Для предупреждения прогрессирующей нестабильности позвоночника и ком прессии спинного мозга выполняют дополнительные ста билизирующие операции (одновременно или вторым эта пом), особенно при костных опухолях позвоночника. Предложены различные методы фиксации позвоночни ка после ламинэктомии. Гемиламинэктомия является более щадящим вмеша тельством, так как не повреждается костносвязочные об разования на здоровой стороне и остистые отростки, что в значительной степени сохраняет стабильность позвоноч ника. При больших разрушениях тела позвонка, если нет показаний к переднему доступу, стабильность позвоноч ника может быть улучшена фиксацией за остистые отрост ки. Широкая гемиламинэктомия в ряде случаев создает достаточные условия для декомпрессии спинного мозга при эпидуральных или интрамедуллярных опухолях. Пос ледние могут быть частично или полностью удалены, так как при широкой гемиламинэктомии обнажается и средин ная задняя борозда спинного мозга, через которую осуще ствляется доступ к интрамедуллярным процессам. Если в процессе операции выявляется, что геми ламинэктомия не обеспечивает доступа для достаточной декомпрессии спинного мозга, всегда есть возможность произвести ламинэктомию. Гемиламинэктомия создает хорошие возможности для удаления доброкачественных опухолей спинного мозга. Доступ достаточен для заши вания или пластики твердой мозговой оболочки. В отличие от ламинэктомии, при которой хорошо об нажаются только задняя и частично – боковые поверхно сти спинного мозга, при расширенной гемиламинэкто мии создается достаточный доступ и к опухолям передней локализации. Важным и необходимым является установ ление стороны локализации опухоли. Выводы. 1. Для удаления опухолей спинного мозга у ряда боль ных может быть использована гемиламинэктомия как менее травматичный доступ. 2. Гемиламинэктомия обеспечивает хороший доступ к опу холям различной гистоструктуры, локализующимся по бо ковой, передне или заднебоковой поверхности спинного мозга, позволяет в сочетании с микро нейрохирургической техникой успешно удалять экстрамедуллярные опухоли. ÏÐÎÃÍÎÑÒÈ×ÅÑÊÎÅ ÇÍÀ×ÅÍÈÅ ÈÍÄÅÊÑÀ ÌÅ×ÅÍÈß KI-S1 ÏÐÈ ÐÅÖÈÄÈÂÀÕ ÀÄÀÌÀÍÒÈÍÎÌÎÏÎÄÎÁÍÛÕ ÊÐÀÍÈÎÔÀÐÈÍÃÈÎÌ Ñåìåíîâà Æ. Á, Êîðøóíîâ À. Ã, Êîíîâàëîâ À. Í. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Несмотря на возросшую радикальность удаления крани офарингиом, число рецидивов остается попрежнему дос таточно высоким (735%). Согласно данным литературы, наибольшее число рецидивов возникает после удаления ада мантиномоподобных краниофарингиом. Как известно, воз никновение рецидива опухоли в значительной степени оп III ñúåçä íåéðîõèðóðãîâ Ðîññèè 150 Íåéðîîíêîëîãèÿ ределяется биологической активностью самой опухоли. Ц е л ь и с с л е д о в а н и я . На основании иммуногисто химических методов исследования изучить пролифератив ную активность адамантиномоподобных краниофаринги ом и выделить группу биологически активных опухолей. Основанием для исследования явились 97 пациентов с впервые диагностированными краниофарингиомами, оперированные в НИИ нейрохирургии им. акад. Н. Н. Бурденко с 1995 по 1997 год. Из низ дети – 51, взрослые – 46 наблюдений. При распределении по полу 52 пациента мужского пола, 45 – женского. Эндосупраселлярные краниофарингиомы составили 18 наблюдений, стебельные – 37 и краниофарингиомы III желудочка – 42 наблюдения. В 17 случаях размеры опухоли не превышали 3 см в ди аметре, в 54 наблюдениях размеры опухоли были от 3 до 5 см в диаметре и в 26 случаях это были гигантские кранио фарингиомы. В 60 наблюдениях осуществлено тотальное удаление опухоли, в 30 – субтотальное и в 7 случаях – частичное удаление. Рецидивы заболевания диагностированы у 14 больных. Сроки наблюдения составили от 2 до 5ти лет. Для оценки пролиферативной активности нами изуче на экспрессия ряда онкоассоциатиных белков (1) белок р53; 2) антиген ядер пролиферирующих клеток (АЯПК); 3) рецептор эпидермального фактора роста (РЭФР); 4) ДНКтопоизомераза II альфа; 5) тенасцин; 6) Сеr Bb2; 7) эпителиальный антиген), однако прогностически значи мым и позволяющим объективно оценить пролифератив ную активность является ДНК топоизомеразы II альфа (KiS1), который представляет собой внутриклеточный белок, участвующий в сегрегации удвоенных хромосом. Данный маркер позволяет определить количество клеток, находящихся в S, G и Mфазах клеточного цикла. Значение индекса мечения KiS1 в рецидивировавших опухолях варьировало от 1,5% до 12%, составило в среднем 7,2%, в то время как в контрольной (безрецидивной) группе было равно 0,6% (р<0,001). Пролиферативный потенциал рецидивировавших опухолей был выше 1% практически у всех больных, за исключением одного. В этом случае безре цидивный период составил 29 месяцев (был наиболее про должительным). В контрольной группе также в одном на блюдении значение индекса мечения было равно 1,5%. Анализ результатов показал, что наибольшие значения индекса мечения KiS1 коррелировали с размерами опу холи более 4 см в диаметре (4,3% vs 2,0%), массивными обызвествлениями (4,1% vs 2,1%), кистозным строением (3,9% vs 2,2% для компактных опухолей, p<0,001). Значения индекса мечения KiS1 не различались в груп пе тотального и субтотального удаления (6,2% vs 6,4%), что подчеркивает значение биологической активности опухо ли в возникновении рецидива. Отсюда следует, что реци дивы адамантиномоподобных краниофарингиом опреде ляются не только радикальностью хирургического лечения, но и гистобиологическими свойствами опухоли. ÌÎÒÎÐÍÎ-ÇÐÀ×ÊÎÂÀß ÔÓÍÊÖÈß Ó ÁÎËÜÍÛÕ Ñ ÎÏÓÕÎËßÌÈ ÏÈÍÅÀËÜÍÎÉ ÎÁËÀÑÒÈ (ÄÎ È ÏÎÑËÅ ËÅ×ÅÍÈß, ÎÒÄÀËÅÍÍÛÅ ÐÅÇÓËÜÒÀÒÛ) Ñåðîâà Í. Ê., Ïèöõåëàóðè Ä. È. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Расстройство моторнозрачковой функции является одним из основных клинических проявлений опухолей пинеальной области. Целью работы было провести анализ моторнозрачковой функции у пациентов с опухолями пинеальной области раз личной гистологической структуры до и после лечения. М а т е р и а л и м е т о д . Работа основана на исследо вании 135 больных с гистологически верифицированны ми опухолями пинеальной области. На основании гисто логической природы опухоли было выделено четыре груп пы пациентов: с герминогенными опухолями – 46 (34%), с опухолями паренхимы шишковидного тела – 30 (22%), с глиальными опухолями – 42 (31%), прочих – 17 (13%). Возраст пациентов варьировала от 3 до 70 лет. Мужчин было 68, женщин – 67. Злокачественные опухоли были вы явлены у 72 больных, доброкачественные – у 63. Удаление опухоли осуществлялось в 116 наблюдениях, у остальных 19 произведена стереотаксическая биопсия опухоли и лучевая терапия. Удаление опухоли осуществлялось преимуществен но затылочным транстенториальным доступом (61 опера ция) и инфратенториальным супрацеребеллярным доступом (42 операции). В отдельных случаях (9) был применен ком бинированный доступ и прочие редкие хирургические дос тупы (4). Радикальность удаления опухолей распределялась следующим образом: тотальное удаление – 101 больной (86%), субтотальное – 9 больных (8%), частичное удаление – 7 больных (6%). Лучевая терапия как самостоятельный метод лечения была проведена в 12 случаях, в 62 – в комби нации с удалением опухоли. У 10 больных лучевая терапия применялась совместно с химиотерапией. Нейроофтальмологическое исследование включало оценку остроты и поля зрения, моторнозрачковой фун кции, состояния глазного дна. Все пациенты исследованы до операции, в раннем пос леоперационном периоде или в процессе лечения и в от даленные сроки, которые составили от 6 до 228 месяцев (медиана 60 месяцев). Р е з у л ь т а т ы . Среди больных с доброкачественными опухолями моторнозрачковая функция распространя лось следующим образом: нет нарушений – 31%; умерен ные нарушения – 30%; грубые нарушения – 19%. Среди больных с злокачественными опухолями отсутствовали нарушения только в 14% наблюдений, умеренно выражен ные нарушения встречались – в 49%, доля грубых нару шений достигала 37%. Наиболее выраженная офтальмо логическая симптоматика поражения среднего мозга: на рушение зрачковой реакции на свет, парез вертикально го взора, нарушение конвергенции были у больных с гер миномами. Так, грубые моторнозрачковые расстройства имели место в 64%, в 32% они были умеренными, и в 4% отклонения от нормы отсутствовали. Была прослежена прямая зависимость между выраженностью поражения среднего мозга и величиной опухоли у пациентов как со злокачественными, так и доброкачественными опухоля ми. Более радикальное удаление опухоли приводило к усу гублению среднемозговой симптоматики у больных вне зависимости от гистологической структуры опухоли. Анализ динамики моторнозрачковых функций после ле чения показал: частота усугубления моторнозрачковых нару шений после лечения выше среди пациентов с злокачествен ными опухолями; в целом более благоприятным течение про цесса было у больных с доброкачественными опухолями. ÊÎÑÒÍÛÅ ÑÒÐÓÊÒÓÐÛ ÎÁËÀÑÒÈ ßÐÅÌÍÎÃÎ ÎÒÂÅÐÑÒÈß. ÐÅÇÓËÜÒÀÒÛ ÌÎÐÔÎÌÅÒÐÈ×ÅÑÊÈÕ ÈÑÑËÅÄÎÂÀÍÈÉ Ñèäîðêèí Ä. Â., Äîáðîâîëüñêèé Ã. Ô. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà В в е д е н и е . Яремное отверстие – это наиболее слож ное образование среди отверстий и каналов основания 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 151 Íåéðîîíêîëîãèÿ черепа, через которые проходят черепномозговые нервы и сосуды. Являясь объектом многочисленных исследова ний, область яремного отверстия до сих пор остается плохо изученной с анатомотопографических позиций и одной из самых сложных с точки зрения хирургических досту пов. Во многом это обусловлено вариабельностью строе ния, которая присуща яремному отверстию больше, чем любому другому образованию черепа. С одной стороны, у разных черепов можно наблюдать различия как по фор ме, так и по размерам. С другой стороны, для большин ства черепов характерна отчетливая асимметрия правого и левого яремных отверстий. Кроме того, существенно отличаются рельефы отверстия на внутренней и наруж ной поверхности черепа. Отверстие является сложным образованием с косым направлением, в формировании которого принимают участие две кости и множество не рвов и венозных коллекторов, проходящих через него. Яремное отверстие (foramen jugulare) состоит из трех частей: двух венозных и одной невральной (нервной). Это представление существенно отличается от принятого ра нее деления на две части: невральную (нервную) и веноз ную. Согласно современным представлениям, венозные части содержат больший по размерам заднелатеральный венозный канал, называемый сигмовидной частью (pars sigmoideus), и меньший переднемедиальный венозный канал, называемый каменистой частью (pars petrosa), ко торая получает кровь из нижнего каменистого синуса (sinus petrosus inferior). Внутрияремная или невральная (нервная) часть (pars intrajugularis). через которую прохо дят языкоглоточный (n. glossopharingeus), блуждающий (n. vagus) и добавочный (n. accessories) нервы, расположена между сигмовидной и каменистой частями отверстия. М а т е р и а л ы и м е т о д ы . Костные структуры облас ти яремного отверстия изучались на 112ти яремных от верстиях 56ти сухих черепов. Проводились измерения параметров отверстия, как на внутреннем, так и на наруж ном основании черепа. Обращалось внимание на конфи гурацию отверстия, наличие костной перегородки, край ние варианты строения и некоторые другие особенности. Результаты. 1. Термин «отверстие» не вполне подходит к данному анатомическому образованию, которое следовало бы на зывать «каналом». 2. Правое отверстие обычно больше левого. В наших исследованиях правое отверстие было больше левого в 55,4% (в 31м случае из 56ти). В 32,1% правое яремное отверстие оказалось меньше левого (18 из 56ти). В 12,5% случаев (7 из 56ти) размеры правого и левого отверстий оказались равны. Асимметрия яремных отверстий может быть резко выраженной. 3. Наиболее значительная разница длины правого и левого отверстия обнаружена нами в 7ми из 56ти случа ев и составляла от 5ти до 11ти миллиметров. Разница ширины яремного отверстия в сигмовидной части в боль шинстве случаев (31 препарат) была от 1го до 3х милли метров, а в 14ти случаях превышала 4 миллиметра и дос тигала максимума 11 миллиметров. Такая значительная разница величин нормальных яремных отверстий имеет принципиальное значение в диагностике и хирургии па тологических образований этой области. 4. Двойное яремное отверстие оказалось весьма частым анатомическим феноменом. Костная перегородка была только справа в 7ми случаях (12,5% черепов). Только сле ва в 9ти случаях (16,1% черепов). С двух сторон в 4х слу чаях (7,1% черепов). В общей сложности 24 яремных от верстия из 112ти оказались разделенными костной пе регородкой, что составило 20,5% всех отверстий. Други ми словами, яремное отверстие было разделено костной перегородкой с одной или с обеих сторон на 20ти из 56 ти исследованных нами черепов, что составило 35,7%. Как правило, костная перегородка разделяет отверстие в не вральной части и является производным внутрияремных отростков височной и затылочной костей. Костная пере городка в невральной части может быть образована не только внутрияремными отростками, а и внутрияремным гребнем. Кроме того, костная перегородка может распо лагаться в пределах сигмовидной либо каменистой части отверстия. 5. Нижний каменистый синус может иметь одно или несколько соединений с нижней петрокливальной веной на любом участке, чаще в задней трети. Об этом свиде тельствуют отверстия в борозде нижнего каменистого си нуса, обнаруженные на нескольких препаратах. ÍÅÂÐÈÍÎÌÛ ßÐÅÌÍÎÃÎ ÎÒÂÅÐÑÒÈß. ÄÈÀÃÍÎÑÒÈÊÀ È ÕÈÐÓÐÃÈ×ÅÑÊÎÅ ËÅ×ÅÍÈÅ Ñèäîðêèí Ä. Â., Ìàõìóäîâ Ó. Á., Øèìàíñêèé Â. Í., Ãðèãîðÿí À. À. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Невриномы яремного отверстия принадлежат к числу раритетов в хирургии основания черепа. За всю историю хирургии этой патологии в мировой литературе описано всего лишь около 120ти случаев. В отечественной лите ратуре описания данной патологии нами не обнаружено. Обычно, когда речь заходит об опухоли, располагающей ся в области яремного отверстия, подразумевают гисто логический диагноз параганглиомы. И действительно па раганглиомы, или опухоли яремного гломуса, более ха рактерны для данной локализации, тогда как невриномы и менингиомы встречаются значительно реже и опериру ются в крупных нейрохирургических центрах. За период с 1999го по 2001й год в институте нейрохи рургии им. академика Н. Н. Бурденко РАМН оперирова но 10 больных с невриномами области яремного отвер стия. Возраст больных был от 18ти до 59и лет. Средний возраст составил 38 лет. Мужчин было 4, женщин 6. Ис ходным ростом опухолей были 9, 10, 11й черепномоз говые нервы на уровне яремного отверстия. В 2х случаях опухоль располагалась интракраниально, в 2х случаях ин траэкстракраниально, в 4х преимущественно интракра ниально с незначительным экстракраниальным распро странением и в 2х экстракраниально. Во всех 10ти слу чаях опухоль разрушала костные структуры, окружающие яремное отверстие. Клиническая картина в 4х случаях была представлена неполным синдромом Вернета (Vernet syndrome), характе ризующимся поражением 9, 10 и 11го нервов, где 9й нерв частично функционировал. В других 3х из 10ти случаев выявлен синдром Колета Сикарда (Collet Sicards syndrome), при котором вовлечены нервы с 9го по 12й. Еще в двух случаях синдром Колета Сикарда был неполным за счет частичного сохранения функции 12го нерва. А в после днем случае наблюдался синдром Тапиа (Tapias syndrome): поражение 10го и 12го нервов. Такая симптоматика со ответствовала длительности заболевания и относительно большим размерам опухоли, исходившей из одного нерва и поражавшей два и более расположенных рядом черепно мозговых нерва. Как правило (7 из 10ти), в клинической картине присутствовало нарушение слуха, чаще глухота, поражение 13го и частичное поражение 5го нерва. По чти во всех случаях, кроме одного, были выявлены симп томы поражения 6го и/или 7го черепномозгового нерва. III ñúåçä íåéðîõèðóðãîâ Ðîññèè 152 Íåéðîîíêîëîãèÿ Внутричерепная гипертензия проявлялась изменени ями на глазном дне в 6ти из 10ти случаев. А в 3х глазное дно было нормальным. Но признаки воздействия на структуры ЗЧЯ, то есть стволовые либо мозжечковые сим птомы, присутствовали у всех, за исключением одного больного. Все больные оперированы. 9ти больным выполнено одномоментное удаление. Одна больная оперирована по вторно по поводу продолженного роста через год после первой операции, и удаление выполнено в 2 этапа с ин тервалом 2 недели. Учитывая локализацию и распростра ненность опухоли, использовались следующие оператив ные доступы: ретросигмовидный – в 2х случаях, ретро сигмовидныйтрансюгулярный – в 2х, ретроаурикуляр ныйтранстемпоральный (транспирамидныйтрансюгу лярный) – в 3х, латеральный трансцервикальный в 2х, и в 1м случае выполнено двухэтапное удаление (ретро сигмовидный + латеральный трансцервикальный досту пы). Одному больному устанавливался наружный люм бальный дренаж. Одному больному выполнена реконст рукция лицевого нерва путем создания анастомоза с нис ходящей ветвью подъязычного. У одного больного в те чение 2х недель после операции из раны наружного слу хового прохода наблюдалось истечение серозного отде ляемого, которое прекратилось полностью. Других ослож нений не было. Все больные выписаны с улучшением. Выводы. 1. На этапе диагностики показано проведение каротид ной ангиографии, что позволяет исключить парагангли ому. 2. При удалении неврином яремного отверстия наибо лее часто используются ретроаурикулярный транстемпо ральный и ретросигмовидный доступы с их модификаци ями. 3. Для радикального удаления неврином яремного от верстия, растущих интраэкстракраниально, необходима резекция части костных структур, окружающих яремное отверстие. 4. При осложнении невриномы яремного отверстия гнойновоспалительным процессом в структурах пирами ды височной кости показано экстрадуральное удаление опухоли через ретроаурикулярный транстемпоральный доступ. 5. В случаях с выраженными стволовыми симптомами и при наличии большого интракраниального и экстрак раниального слагаемого яремной невриномы целесооб разно удаление опухоли в два этапа. 6. При поражении лицевого нерва показана реконст руктивная операция путем создания анастомоза с нисхо дящей ветвью подъязычного. Ê ÏÐÎÁËÅÌÅ ËÅ×ÅÍÈß ÌÅÒÀÑÒÀÒÈ×ÅÑÊÈÕ ÎÏÓÕÎËÅÉ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Ñèðêî À. Ã., Íîâèê Þ. Å. Ãîñóäàðñòâåííàÿ ìåäèöèíñêàÿ àêàäåìèÿ, Îáëàñòíàÿ êëèíè÷åñêàÿ áîëüíèöà èì. È. È. Ìå÷íèêîâà, Äíåïðîïåòðîâñê, Óêðàèíà Лечение метастатических опухолей относится к одной из трудных и не до конца решенных проблем нейроонко логии. Между тем актуальность проблемы непрерывно возрастает, так как во всем мире неуклонно увеличивает ся абсолютное число больных раком, а, следовательно, и больных с внутричерепными метастазами. Так, в США ежегодно регистрируется около 100 тыс. больных с еди ничными метастазами в мозг. Причем эти метастазы в 22,739% случаев – первое, а иногда и единственное про явление скрытопротекающей первичной злокачествен ной опухоли. Метастазы относительно быстро приводят к декомпенсации состояния больных и при отсутствии лечения больные умирают через 15,5 мес. после обнару жения последних. Между тем поражение бластоматозным процессом только паренхиматозных органов допускает большую продолжительность жизни. Например, для боль ных раком легкого, отказавшихся от лечения, она состав ляет 1,52 года. После хирургического или комбинирован ного лечения первичного очага средняя продолжитель ность жизни заметно увеличивается и в зависимости от стадии заболевания достигает 5 и более лет у 3661,5% больных раком легкого, у 44,489,6% больных раком мо лочной железы и у 31,7% больных раком почек. В нейроонкологическом отделении ОКБ им. И. И. Меч никова г. Днепропетровска за период с 1990 по 2001 год обследовалось 156 больных с метастазами в головной мозг. 133 больным в возрасте от 17 до 75 лет проведено хирурги ческое лечение. От общего количества оперативных вме шательств по поводу опухолей мозга операции по удале нию метастазов в головной мозг составили 9%. Средний возраст оперированных больных – 51,4 года. Из них 55 жен щин и 78 мужчин. Первичный очаг выявлен у 81 (61%) боль ного. Рак легкого был источником метастазирования в 29 случаях, злокачественная меланома – 16, рак молочной железы – 15, рак щитовидной железы – 4, рак почки – 4, рак желудка – 3, рак толстой кишки – 3, рак прямой киш ки – 2, рак надпочечника – в 2 случаях. По одному случаю отмечались рак мочевого пузыря, рак тела матки и рак пред стательной железы. У 52 (39%) больных локализация пер вичного очага осталась неизвестной. У 39 (48%) больных из 81 с диагностированным первичным очагом к моменту удаления метастазов было проведено хирургическое лече ние первичного очага. У 121 больного диагностированы одиночные, а у 12 – множественные метастазы головного мозга. Одиночные узлы в 71% случаев имели супратенто риальную и в 29% – субтенториальную локализацию. Оценка общего статуса по шкале Карновского до опера ции у 117 (88%) больных была больше или равна 70 баллам, и только у 16 (12%) больных была ниже 70. Всем больным произведено тотальное удаление мета стазов. 115 (86,5%) больных выписаны из стационара в удовлетворительном состоянии с улучшением соматичес кого и неврологического статуса, 8 (6%) больных – с ухуд шением. Причем у 6 больных в последней группе ухудше ние состояния обусловлено не мозговой патологией, а прогресированием первичной опухоли. Умерло 10 боль ных, что составило 7,5%. У 6 из них до операции индекс Карновского был меньше 70 баллов, а у 4 меньше 60. Сле довательно, тяжелое состояние больных до операции слу жит фактором, неблагоприятно влияющим на их выжи ваемость. По этой причине мы воздержались от операции у 23 больных. Средняя продолжительность их жизни со ставила всего 3,2 недели с момента обнаружения метаста зов в мозг. Таким образом, хирургическое лечение служит мето дом выбора в лечении больных с метастатическим пора жением головного мозга, так как приводит к быстрому улучшению состояния и регрессу неврологических сим птомов. Улучшение состояния больных после таких опе раций позволяет продлить им жизнь, дает возможность провести комплексное лечение и дальнейшее обследова ние по выявлению первичного очага. Однако оператив ное лечение не показано больным, находящимся в тяже лом состоянии. Лечение больных с метастазами в головной мозг про водится в стационарах радиологического, химиотерапев 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 153 Íåéðîîíêîëîãèÿ тического и других профилей. Однако быстрая декомпен сация состояния неоперированных больных делает невоз можным проведение им всего комплекса лечебных и ди агностических мероприятий. Поэтому появление мозго вой симптоматики у онкологических больных должно служить сигналом для направления их на консультацию к нейрохирургу. ÌÎÍÈÒÎÐÈÍà ËÅ×ÅÍÈß ÖÅÐÅÁÐÀËÜÍÛÕ ÃËÈÎÌ Â ÑÂÅÒÅ ÏÎÇÈÒÐÎÍÍÎ-ÝÌÈÑÑÈÎÍÍÎÉ ÒÎÌÎÃÐÀÔÈÈ Ñêâîðöîâà Ò. Þ., Áðîäñêàÿ Ç. Ë., Ðóäàñ Ì. Ñ., Ãóð÷èí À. Ô., Ìåäâåäåâ Ñ. Â. Èíñòèòóò Ìîçãà ×åëîâåêà ÐÀÍ, Ñàíêò-Ïåòåðáóðã Четкое представление о патологоанатомической и метаболической характеристике церебральных опухолей в ходе лечения составляет основу лечебной тактики. Тра диционные МРТ и КТ раскрывают структурные измене ния, связанные, главным образом, с увеличением разме ров опухоли, обусловленным ее ростом, кровоизлияния ми, некрозами, вторичным массэффектом или даже ла теральной дислокацией срединных структур. Иными сло вами, раскрываются достаточно выраженные изменения, коррелирующие с ухудшением неврологической симпто матики, когда роль лучевой диагностики сводится к кон статации факта отрицательной динамики и уточнению отдельных деталей. Трактовка последних зачастую весь ма затруднена наслоением последствий хирургических и иных лечебных действий. Еще более неопределенно об стоит дело при стабильной клинике. МРТ не предостав ляет информацию о динамике метаболических особенно стей опухоли, что необходимо для своевременного суж дения как о злокачественной трансформации опухоли, так и о подавлении ее роста. Цель работы состояла в выяснении возможностей по зитронноэмиссионной томографии (ПЭТ) в мониторин ге оперативного, консервативного и комбинированного лечения церебральных глиом. Анализу подверглись результаты 51 ПЭТ исследования 24 больных. Из них 17 лечились оперативно и комбини рованно, 3 – только химиотерапией, 1 – только лучевой терапией. По течению основного процесса больные были разделены на 3 основные группы: рост опухоли (14), ста бильная картина (3), подавление роста (7). Сюда вошли также 3 пациента, у которых после временного улучше ния наступила отрицательная динамика. В качестве РФП был избран 11Сметионин. Показателями метаболической характеристики опухоли, кроме традиционной степени накопления РФП, модифицированной в индекс накоп ления (ИН), считали разработанные нами ранее допол нительные признаки: изолированный или сливной харак тер очагов максимального накопления РФП, их число и долевой объем в общей массе узла. Рост опухоли протекал с сохранением исходного ИН (9), с одновременным нарастанием ИН (2) или выражал ся только в изменении метаболической характеристики (3). При сохранении первоначального ИН, наряду с уве личением размеров опухоли, увеличивался долевой объем очагов максимального накопления, охватывавших более значительную ее часть. В подавляющем большинстве (8 из 9) это были первично злокачественные опухоли – гли областомы или анапластические астроцитомы, обладав шие заведомо высоким ИН. Наибольший интерес вызва ли 3 больных, у которых при явном ухудшении метаболи ческой характеристики (нарастание ИН, увеличение до левого объема очагов максимального накопления, заме на изолированных очагов сливными) величина опухоли оставалась прежней. При повторной операции у одного из этих больных оказалась глиобластома, тогда как гисто логическое исследование тканей, удаленных во время пер вой операции показало доброкачественную астроцитому. Подавление роста опухоли состояло либо в уменьше нии ее размеров в сочетании со стойким или уменьшен ным ИН (4), либо в избирательной положительной дина мике метаболической характеристики при прежней вели чине узла (3). Само по себе уменьшение размеров опухо ли достоверно документировалось ПЭТ исследованием, а стойкий ИН исключал озлокачествление. В последней группе больных оставшуюся после неполного оператив ного удаления часть анапластической астроцитомы под вергали лучевой или химиотерапии, схема которой все цело зависит от представления об активности опухоли на данном этапе лечения. Снижение ИН и уменьшение до левого объема очагов максимального накопления, не смотря на стабильные размеры опухоли, трактовали как подавление ее роста. Наблюдение за этими больными, повторные ПЭТ и МРТ подтвердили благоприятное те чение анапластических асроцитом под влиянием комби нированной консервативной терапии. Таким образом, метаболическая характеристика цереб ральных глиом может опережать изменения их размеров как при продолженном росте и малигнизации, так и при подавлении роста опухоли. Это делает ПЭТ исследование с 11Сметионином важной методикой раннего мониторин га комплексного лечения глиом головного мозга. ÑÐÀÂÍÈÒÅËÜÍÛÉ ÀÍÀËÈÇ ÇÀÁÎËÅÂÀÅÌÎÑÒÈ ÎÏÓÕÎËßÌÈ ÖÅÍÒÐÀËÜÍÎÉ ÍÅÐÂÍÎÉ ÑÈÑÒÅÌÛ ÄÅÒÅÉ Â ÑÀÍÊÒ-ÏÅÒÅÐÁÓÐÃÅ È ËÅÍÈÍÃÐÀÄÑÊÎÉ ÎÁËÀÑÒÈ ÇÀ ÏÅÐÈÎÄ 1989-99 ÃÃ. Ñíèùóê Â. Ï., Áåëîãóðîâà Ì. Á., Âëàäîâñêàÿ Ì. Ä. ËÎÄÊÁ, áîëüíèöà ¹ 31 «ÊÖÏÌÒ», Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, ÄÃÁ ¹ 19 èì. Ðàóõôóñà, Ïîïóëÿöèîííûé ðàêîâûé ðåãèñòð, Ñàíêò-Ïåòåðáóðã По данным раковых регистров европейских стран и США, опухоли центральной нервной системы (ЦНС) за нимают второе по частоте место среди всех злокачествен ных опухолей в детском возрасте. По данным различных авторов, заболеваемость опухолями ЦНС у детей состав ляет 2,54,5 на 100 тысяч детского населения. Подавляю щее большинство опухолей ЦНС представлено опухоля ми головного мозга, которые составляют приблизитель но 95% всех новообразований ЦНС. Литературные дан ные свидетельствуют о большей частоте инфратентори альных опухолей у детей. Задачей нашего исследования было изучить заболеваемость опухолями ЦНС у детей СанктПетербурга и Ленинградской области за последнее десятилетие. Источниками получения информации яви лись: Истории болезни и журналы госпитализации нейро хирургических стационаров (ДГБ № 19 им. Раухфуса, РНХИ им. Поленова, ЛОДКБ, ДИБ № 5), где проводится оперативный этап лечения детей с опухолями ЦНС и от деления детской онкологии и гематологии ГБ № 31, где проводится консервативное лечение этих больных (луче вая и химиотерапия). Гистопатологические заключения и протоколы аутоп сий. Данные Популяционного ракового регистра Санкт Петербурга (ПРР). Данные организационнометодического отдела БМС Комитета по здравоохранению Администрации Санкт Петербурга. III ñúåçä íåéðîõèðóðãîâ Ðîññèè 154 Íåéðîîíêîëîãèÿ За период 198999 гг. в СанктПетербурге выявлено 343 первичных больных с опухолями ЦНС, из них 153 девоч ки и 190 мальчиков, т. е. соотношение по полу (д/м) со ставило 1:1,24. За тот же период в Ленинградской области опухоли ЦНС были зарегистрированы у 165 детей, из них 88 мальчиков и 77 девочек (соотношение д/м=1:1,14). Показатель заболеваемости опухолями ЦНС в Санкт Петербурге за указанный период колебался от 3,21 до 4,64 на 100 тысяч детского населения, составив в среднем 3,72 на 100 тысяч детей. Значительно выше показатель забо леваемости за изучаемый период был в Ленинградской области. Минимальный уровень заболеваемости составил 3,5 (в 1992 г.), максимальный – 5,94 (в 1997 г.), среднее – 4,64/100 тыс. детей. При оценке заболеваемости детей опухолями ЦНС в зависимости от возраста в СПб выявлено преобладание детей в возрасте 59 лет (38,8%), дети в возрасте 14 лет и 1014 лет составили практически равные группы (27,4 и 28,9% соответственно), дети первого года жизни состави ли 5% заболевших. В Ленинградской области доминиро вали дети старшей возрастной группы (47,9%), дети 14 лет и 59 лет составили 20% и 28,5% соответственно, дети до 1 года – 3,6%. По локализации опухоли больные в СанктПетербур ге распределились следующим образом: супратенториаль ные опухоли имели 47%, инфратенториальные – выявле ны у 43% детей (из них 72% – опухоли мозжечка, 28% – опухоли ствола ниже намета мозжечка), опухоли спинного мозга имели 4% детей. У 6% больных точную локализа цию опухолевого процесса в головном мозге по имею щимся документам установить не удалось. В Ленинград ской области первое место занимают инфратенториаль ные опухоли (43,6), среди которых опухоли ствола встре чаются в 10% случаев. Опухоли супратенториальной ло кализации встречаются в 40,6%, спинного мозга – в 5,5%, неуточненной локализации – в 10,3% случаев. Среди детей разных возрастных групп распределение опухолей по локализации было неравномерным. В Санкт Петербурге у детей первого года жизни значительно пре обладали супратенториальные опухоли (65%). В группе детей от 1 года до 4 лет отмечено практически равное со отношение супратенториальных и инфратенториальных опухолей (43,6% и 46,8% соответственно), в группе детей от 5 до 9 лет значительно преобладали опухоли инфратен ториальной локализации (51%), а у подростков 1014 лет вновь чаще регистрировались супратенториальные про цессы (60,6%). В Ленинградской области в группе детей до 1 года также доминировали супратенториальные опу холи (67%), в группе детей 14 лет и 59 лет отмечалось выраженное преобладание инфратенториальных опухо лей (57,6% и 51,1% соответственно), а в старшей возраст ной группе супратенториальная локализация вновь зани мала лидирующую позицию (46,8%). Удельный вес опу холей спинного мозга был максимальный в возрастной группе 14 года и снижался с увеличением возраста ребен ка до 3,8%. Таким образом, в период 198999 гг. у детей в СанктПетербурге и Ленинградской области отмечался высокий уровень заболеваемости детского населения опу холями ЦНС (3,72 и 4,64/100 000 детей соответственно). Соотношение д/м составило 1/1,24 в СПб. и 1/1,14 в Лен. области. У исследуемой группы больных в СПб. преобладали супратенториальные опухоли, в Лен. области – инфратен ториальные. В СПб. 38,8% пациентов были в возрасте 59 лет, в Лен. области доминировали дети старшей возрастной группы (47,9%). Отмечена зависимость частоты встречаемости опухо лей той или иной локализации в зависимости от возраста. Дети первого года жизни и старшей возрастной группы (1014 лет) чаще заболевают опухолями супратенториаль ной локализации, дети в возрасте от 1 до 9 лет – инфра тенторильной. Для окончательных выводов требуются длительные эпидемиологические исследования. ÌÈÊÐÎÕÈÐÓÐÃÈß ÌÅÍÈÍÃÈÎÌ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Ñ ÈÑÏÎËÜÇÎÂÀÍÈÅÌ ND-YAG-ËÀÇÅÐÀ Ñòóïàê Â. Â., Ñîëîâüåâà Ò. À., Màéîðîâ À. Ï., Ñòðóö Ñ. Ã., Öâåòîâñêèé Ñ. Á., Çàéäìàí À. Ì., Ñåðïåíèíîâà Í. Í. ÍÈÈ òðàâìàòîëîãèè è îðòîïåäèè, Íîâîñèáèðñê У взрослого населения среди всех первичных опухолей головного мозга менингиомы (М) составляют до 27,9%. В настоящее время, несмотря на существенные достижения в хирургии экстрацеребральных опухолей головного моз га, проблема удаления менингиом, особенно гигантских и труднодоступной локализации, одна из наиболее слож ных и далекая от разрешения. Основными принципами в достижении хороших результатов лечения при менинги омах головного мозга являются совершенствование мик ронейрохирургической оперативной техники, разработ ка и использование разнообразных хирургических при емов. Использование современных методов в хирургии данных опухолей нередко сопровождается массивным артериальным и венозным кровотечением. Все это затруд няет тотальное удаление опухоли, ведет к очень большой интраоперационной кровопотере, дополнительной трав матизации мозга и усугублению очаговой и общемозго вой симптоматики. Исходя из этого, необходимо изыскивать новые мето ды удаления данных опухолей. Новые возможности для этого открывает использование NdYAGлазера. Для решения вышеперечисленных задач в клинике нейрохирургии Новосибирского НИИТО у 91 больного при удалении М головного мозга использован NdYAG лазер c длиной волны 1,06 мкм, изготовленный в Сибир ском лазерном центре. Лазер работал в импульснопери одическом режиме с длительностью импульса 200 мк сек. При удалении опухоли использовалась частота лазерного излучения в 100 Гц мощностью 4060 Вт. Размер пятна определялся визуализацией пилотного гелийнеонового лазера и изменялся в диаметре от 600 мк до 5 мм. Из 91 больного у 82 имелись менингиомы труднодос тупной, в том числе и базальной, локализации (бугорка турецкого седла, площадки клиновидной кости, малого и большого крыла основной кости, опухоли ольфакторной ямки, парасагиттальные и петрокливальные менингиомы с супрасубтенториальным ростом), у 9 пациентов были большие и гигантские конвекситальные менингиомы. Использование NdYAGлазера на основном этапе микрохирургического удаления М в режиме коагуляции позволяло всегда полностью удалить опухоль, при этом свести к минимуму дополнительную травму прилежаще го головного мозга и интраоперационную кровопотерю. Все это достигалось при выполнении следующих методи ческих приемов: после минимальной тракции мозга об нажался лишь небольшой участок опухоли и в зависимо сти от его размера производилась его поверхностная об работка дефокусированным лучем лазера мощностью 55 60 Вт в течение 35 минут. Все это приводило к коагуля ции сосудов и «свариванию» стромы опухоли на глубину до 0,5 см. В дальнейшем производили бескровное удале ние этого объема опухоли с помощью ультразвукового 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 155 Íåéðîîíêîëîãèÿ аспиратора. В зависимости от размера опухоли, а он ко лебался от 5х5х5 см до 12х11х10 см, производилось от 9 10 до 1620 таких последовательных манипуляций. Послеоперационный период у пациентов с М голов ного мозга всегда протекал гладко, без выраженных об щемозговых и очаговых симптомов. Данные МРтомог рафии головного мозга, полученные в послеоперацион ном периоде, свидетельствовали о том, что использова ние хирургического лазера не приводит к дополнитель ной травме мозга и прогрессированию отека. Интраопе рационный контроль стволовых слуховых вызванных по тенциалов во время удаления опухоли показал, что лазер ное излучение не вызывает нежелательных изменений функции ствола головного мозга. Операционная кровопотеря при лазерных операциях в среднем была равна 500 мл. Степень радикальности уда ления данного вида опухолей по классификации D. Simpson (1957) у всех наших больных была 12. Послеопе рационная летальность составила 5,5%. Таким образом, применение NdYAGлазерa при уда лении М, в том числе и труднодоступной локализации, позволяет радикально удалять их, при этом значительно снижается кровопотеря и уменьшается дополнительная травма мозга. ËÎÊÎÐÅÃÈÎÍÀËÜÍÀß ÈÌÌÓÍÎÒÅÐÀÏÈß Â ÊÎÌÏËÅÊÑÍÎÌ ËÅ×ÅÍÈÈ ÃËÈÀËÜÍÛÕ ÎÏÓÕÎËÅÉ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Ñòóïàê Â. Â., Öåíòíåð Ì. È., Íèêîíîâ Ñ. Ä., ×åðíûõ Å. Ð., Îñòàíèí À. À., Õîíèíà Í. À., Ëåïëèíà Î. Þ. ÍÈÈ òðàâìàòîëîãèè è îðòîïåäèè, Íîâîñèáèðñê По данным различных авторов, у городского населе ния частота заболевания первичными опухолями голов ного мозга (ГМ) приближается к 14 случаям на 100000 населения, среди которых наиболее часто (до 60% слу чаев) встречаются анапластические астроцитомы и гли областомы. Результаты комплексного лечения этих ви дов опухолей на сегодняшний день неудовлетворитель ны. Это обусловлено рядом причин. Вопервых, ограни ченными возможностями тотального удаления глиом мозга изза отсутствия в большинстве случаев четких гра ниц; физиологической значимостью пораженных зон мозга и инфильтрацией опухолевыми клетками перифо кальной зоны. Вовторых, способностью опухолевых клеток к синтезу «белков лекарственной устойчивости», что объясняет очень низкую чувствительность злокаче ственных глиом к лучевой и химиотерапии. Втретьих, состоянием вторичного иммунодефицита у нейроонко логических больных. Несмотря на комплексный подход в лечении злокачественных глиом мозга, включающий в себя оперативное вмешательство, лучевую, химиотера пию и иммунокоррекцию, средняя продолжительность жизни больных с глиобластомами составляет 8 месяцев, с анапластическими астроцитомами – 23 месяца. В те чение 6 месяцев после операции выживают 33% больных с глиобластомами, а 5летняя выживаемость не превы шает 3,5%. В настоящее время перспективы лечения злокаче ственных опухолей головного мозга во многом связы вают с применением микрохирургической техники, но вейших биотехнологий, направленных на активацию апоптоза опухолевых клеток. Одним из таких методов является экстракорпоральная адоптивная комбиниро ванная (антигенспецифическая + неспецифическая) иммунотерапия (ЭАКИТ). В силу наличия гематоэн цефалического барьера, внутривенное введение имму ноактивных клеток часто оказывается недостаточно эффективным, а внутривенное введение цитокинов в большинстве случаев сопровождается бурными общи ми «цитокиновыми» реакциями и нередко усилением отека головного мозга. Поэтому локорегиональный метод введения, на наш взгляд, является предпочтитель ным. В клинике нейрохирургии НИИТО комплексное ле чение 65 пациентам со злокачественными внутримозго выми опухолями ГМ (у 37 с анапластическими астроци томами и у 28 больных с глиобластомами) было дополне но курсом ЭАКИТ. Из них 42 пациента оперировано пер вично, 23 – повторно (23 раза). Средний возраст боль ных составил 48±0,2 лет (от 8 до 69 лет). При проведении оперативного вмешательства мы все гда стремились к радикальному удалению опухоли. Для этих целей использовалась микрохирургическая техника в сочетании с ультразвуковым аспиратором. Перед зак лючительным этапом операции в ложе удаленной опухо ли устанавливался хлорвиниловый катетер, который фик сировался к коже и использовался для локорегионально го введения клеточной взвеси. Иммунотерапия начина лась на 36е сутки после операции. Продолжительность курса ЭАКИТ 2 недели, он включает в себя 3 фазы: иммуноиндукции; локорегиональной иммунотерапии (введение неспецифических лимфокинактивированных «киллерных» лимфоцитов (ЛАК) с антигенспецифичес кими цитотоксическими лимфоцитами (ЦТЛ) и ронко лейкином); лимфотропной цитокинотерапии. Всем паци ентам проведен стандартный курс лучевой терапии (60 65 Гр). Лечение по предложенному протоколу было хорошо переносимым и не сопровождалось развитием какихлибо серьезных побочных или токсических реакций, что под тверждено результатами клинических (оценка невроло гического статуса в динамике, индекса качества жизни (ИКЖ) по шкале Карновского, иммуномониторинг) и электрофизиологических (зрительные вызванные потен циалы (ЗВП) на обращаемый паттерн) исследований. В настоящее время живы 51 пациентов из 65 (78,5%), комплексное лечение которых дополнено ЭАКИТ. Сред ний ИКЖ по шкале Карновского у них в настоящий мо мент составляет 84,9±0,05 балла (исходный средний ИКЖ составлял 60,3±0,24 балла, при выписке ИКЖ в среднем по группе был 78,2±0,23 балла; в группе сравнения ИКЖ составлял 57,2±0,22 и 65,7±0,3 балла соответственно). Только у двух пациентов ИКЖ меньше 70 баллов (в силу наличия очаговой симптоматики, обусловленной локали зацией опухоли). У 23 пациентов отмечена ремиссия более 12 месяцев (максимальный срок наблюдения пациентов с глиоблас томой 37 месяцев), одногодичная выживаемость состави ла 63,9% (в группе сравнения, состоящей из 58 человек – 34,5%). У остальных 24 пациентов срок наблюдения на сегодняшний день меньше 12 месяцев. Иммунологичес кие показатели при контрольном обследовании через 12 месяцев у большинства пациентов нормализовались. Из 65 больных умерло 14 человек (21,5%). В течение года по гибло 9 человек (средняя продолжительность жизни 4,9 месяцев), из них 8 – оперированные нами повторно. Ос тальные 5 пациентов погибли от прогрессирования забо левания в срок более года после операции (средняя про должительность жизни 14,8 месяцев). Таким образом, полученные данные позволяют наде яться, что применение локорегиональной адоптивной иммунотерапии в комплексном лечении позволит увели чить эффективность хирургического лечения этой груп пы больных и улучшить его отдаленные результаты. III ñúåçä íåéðîõèðóðãîâ Ðîññèè 156 Íåéðîîíêîëîãèÿ ÏÎÊÀÇÀÍÈß Ê ÕÈÐÓÐÃÈ×ÅÑÊÎÌÓ ËÅ×ÅÍÈÞ ÇËÎÊÀ×ÅÑÒÂÅÍÍÛÕ ÎÏÓÕÎËÅÉ ÎÑÍÎÂÀÍÈß ×ÅÐÅÏÀ Òàíÿøèí Ñ. Â., ×åðåêàåâ Â. À., Ðåøåòîâ È. Â., Ìàõìóäîâ Ó. Á., Øèìàíñêèé Â. Í., Ñäâèæêîâ À. Ì. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ãîðîäñêîé îíêîëîãè÷åñêèé äèñïàíñåð, Ìîñêâà В в е д е н и е . Подход к хирургическому лечению злока чественных опухолей является многоплановым и имеет су щественные отличия от хирургии доброкачественных опу холей основания черепа. Характер роста злокачественных опухолей, инвазия новообразованной тканью всех окружа ющих структур не позволяет добиться значимого резуль тата только при одновекторной направленности хирурги ческого воздействия. Для получения удовлетворительного результата необходима суммация различных хирургичес ких подходов. Поэтому для решения вопросов хирургичес кого лечения больных с ЗООЧ необходимо практическое воплощение параметров «teamwork surgery» и разработка методов оперативного лечения, основываясь на этом прин ципе. В применении хирургического лечения при ЗООЧ необходима выработка таких методов, которые сочетали бы в себе широту и радикальность онкологических вмеша тельств с основополагающим нейрохирургическим прин ципом физиологической дозволенности. М а т е р и а л и м е т о д ы . В настоящей работе приведен результат обследования и лечения 170 больных с злокаче ственными опухолями, поражающими основание черепа. У 90% больных проведены различные виды хирургических вмешательств. 46% больных были оперированы и получа ли лучевую и химиотерапию, у 38% хирургическое лечение сочеталось с лучевой терапией и у 7% больных проводи лось только хирургическое лечение. Из оперированных больных у 58% проведены радикальные операции. Р е з у л ь т а т ы и о б с у ж д е н и е . Показания к ради кальным хирургическим вмешательствам основываются на локализации новообразования и стадии онкологичес кого процесса. Распространение опухоли на основание черепа не является причиной отказа от хирургического вмешательства, прямые показания к радикальному хирур гическому вмешательству могут быть сформулированы при всех основных гистологических типах злокачествен ных опухолей, поражающих основание черепа, исключая опухоли лимфоретикулярного ряда, при характеристиках стадии заболевания T34N0ХM0. Для опухолей краниофа циального, краниоорбитального распространения и ло кализации в пределах основания передней черепной ямки проведение радикального хирургического лечения воз можно при распространении опухоли в околоносовые па зухи. полость носа и носоглотку, полость рта (с вовлече нием в процесс твердого неба или без такового), полость орбиты и решетчатого лабиринта, в направлении полос ти черепа – зона дна передней черепной ямки край опу холи менее 1 см от: латерально – уровня внутреннего края верхней глазничной щели и крыла основной кости, ме диально – уровня задних отделов ситовидной пластинки и линии соединяющей внутренние края верхних глазнич ных щелей. При локализации опухоли в области передне латеральных отделов основания черепа радикальная опе рация показана при распространении по мягким тканям птериональной области, поражении костных структур скуловой кости, чешуи височной кости, по крылу основ ной кости до переднего наклоненного отростка и внут реннего края верхней глазничной щели, по основанию средней черепной ямки, до линии, соединяющий осно вание переднего наклоненного отростка, овальное и круг лое отверстия, и до передней грани пирамиды височной кости; распространение на область крылонебной ямки до слизистой носоглотки, включая последнюю, распростра нение опухоли на мягкие ткани шеи. В случаях развития злокачественных опухолей латеральных отделов основа ния черепа (околоушная область и пирамида височной кости) радикальная операция показана при распростра нении новообразования по мягким тканям в околоушной области книзу до нижней трети грудиноключичнососце видной мышцы, инвазия костных структур по чешуе ви сочной кости, по пирамиде медиально до уровня интра петрозной части внутренней сонной артерии, по задней черепной ямке до яремного отверстия, распространение на сосцевидный и шиловидный отростки. Наличие метастазов в отдаленных лимфатических уз лах и отдаленных метастазов, исходный уровень активно сти менее 30 баллов по шкале Карновского, а также рас пространение опухоли на область турецкого седла, ската, большого затылочного отверстия и краниовертебрально го сочленения обуславливают противопоказания к про ведению радикальной операции. Показаниями к проведению паллиативных операций является необходимость уменьшения объема опухоли в связи с выраженным изменением внутричерепных объем ных соотношений для возможности проведения лучевой терапии – операции тотального или частичного удаления опухоли. Рецидивирующие кровотечения из опухоли, обильное кровоснабжение стромы новообразования слу жат показаниями к эмболизации сосудов опухоли либо как основное паллиативное вмешательство, либо как под готовка к основному радикальному хирургическому ле чению. ÏÐÎÄÎËÆÅÍÍÛÉ ÐÎÑÒ È ÐÅÖÈÄÈÂÛ ÌÅÍÈÍÃÈÎÌ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ: ÏÐÈ×ÈÍÛ ÂÎÇÍÈÊÍÎÂÅÍÈß È ÏÓÒÈ ÓÌÅÍÜØÅÍÈß ×ÀÑÒÎÒÛ Òàñòàíáåêîâ Ì. Ì., Òèãëèåâ Ã. Ñ., Îëþøèí Â. Å., Óëèòèí À. Þ., Ãóëÿåâ Ä. À. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã Несмотря на заметные успехи в хирургическом лече нии интракраниальных менингиом, проявившиеся в по вышении радикальности их удаления, попрежнему со храняется проблема продолженного роста и рецидивов данных новообразований. В связи с этим нами проведена попытка анализа при чин продолженного роста и рецидивов менингиом голов ного мозга, а также путей улучшения результатов лечения при данной патологии. Материалом исследования явились клинические на блюдения над 90 пациентами, оперированными в нейро онкологическом отделении РНХИ по поводу продолжен ного роста и рецидива интракраниальной менингиомы в период времени с 1982 по 2000 г. Женщины составили 63,3% (57 наблюдений) всей популяции. Средний возраст больных составил 52 года. Чаще всего рецидив или продолженный рост менин гиомы наблюдался при парасагиттальных менингиомах – 24 (26,7%) случая и при менингиомах крыльев клиновид ной кости – 31 (34,4%) наблюдение (более 3/4 их них со ставили менингиомы медиальных отделов крыльев кли новидной кости, прорастающие кавернозный синус). Реже всего отмечены рецидивы при конвекситальных ме нингиомах – 3 (3,3%)больных. Необходимо отметить, что анапластические менинги омы составили лишь 13,3% (12) всех наблюдений, во всех остальных случаях гистологически верифицированы 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 157 Íåéðîîíêîëîãèÿ вполне доброкачественные типы строения менингиом. Это весомое свидетельство того, что рецидив менингио мы обусловлен не только «биологической агрессивнос тью» опухоли. Среди объективных причин, обуславливающих нера дикальное удаление новообразования, главным образом следует отметить способность менингиомы инфильтри ровать и обрастать магистральные артерии, венозные си нусы и черепные нервы. Но все же нельзя не отметить и тот факт, что одной из основной причин высокой часто ты продолженного роста и рецидива менингиом является неоправданное ограничение радикальности операций. По нашему мнению, для увеличения радикальности хирургических операций и, соответственно, уменьшения частоты рецидивирования менингиом необходимо даль нейшее совершенствование хирургических доступов, так тики и микрохирургической техники операций с исполь зованием многоэтапных операций при удалении крупных и труднодоступных опухолей, вести непрерывную оцен ку функционального состояния ствола мозга и черепных нервов во время хирургического вмешательства, приме няя современные методы интраоперационной диагнос тики, в том числе и вызванные потенциалы. Для увеличения радикальности операций следует счи тать оправданным применение реконструктивных вмеша тельств на магистральных сосудах. Для компенсации ар териального и венозного кровотока возможно проведение пересадки фрагментов большого сальника на микрососу дистых анастомозах. Следует отметить, что, по нашему мнению, полное уда ление менингиомы – всегда желаемая, но не всегда обя зательная цель хирургического вмешательства. Важно, чтобы радикально выполненная операция не привела к стойкой инвалидизации пациента. Мы считаем, что ос новным критерием успешности проведенной операции всегда следует считать качество жизни больного после хи рургического вмешательства. ÎÑÍÎÂÍÛÅ ÏÐÈÍÖÈÏÛ ÕÈÐÓÐÃÈÈ ÌÅÍÈÍÃÈÎÌ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ ÍÀ ÑÎÂÐÅÌÅÍÍÎÌ ÝÒÀÏÅ Òèãëèåâ Ã. Ñ. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã Хирургия экстрацеребральных опухолей – один из наи более сложных и в то же время самых обнадеживающих (врача и больного) разделов нейроонкологии. Известно, что к настоящему времени достигнуты существенные ус пехи в хирургии доброкачественных околостволовых опу холей, в том числе и самых труднодоступных. Для полу чения хороших результатов лечения необходимо соблю дение ряда принципиально важных подходов к хирурги ческой тактике, микрохирургической технике, анестези ологическому обеспечению и мониторингу состояния жизненно важных функций и черепных нервов как в ходе операции, так и в ближайшем послеоперационном пери оде. Прежде всего следует подчеркнуть, что эффективность хирургического лечения церебральных внемозговых опу холей определяется сохранностью в ходе операции адек ватного мозгового кровообращения. В равной степени важно обеспечить полноценность не только артериально го, но и венозного кровообращения, которое особенно часто может страдать на этапе доступа к опухоли. Разуме ется, «мера» адекватности доступа определяется не толь ко сохранностью церебрального венозного кровообраще ния (путем бережного обращения к венам), но и степе нью механического воздействия на мозг в результате вы нужденной тракции его, а также обеспечением необходи мого обзора опухоли. Возникает своего рода порочный круг. Компрессионное решение этой проблемы, как из вестно, достигается путем максимального приближения нижнего края трепанационного отверстия к основанию черепа или благодаря обширным резекциям его костных структур. В хирургии крупных экстрацеребральных опухолей со хранение анатомической цельности связанных с опухо лью и функционально важных сосудов, черепных нервов, ствола мозга напрямую обусловлено тактическими при емами и хирургической техникой, применяемой в ходе операции. Здесь прежде всего необходимо подчеркнуть важность обязательного соблюдения принципа пофраг ментного удаления опухоли, использование всего арсена ла микрохирургических технологий, а также тесного ра бочего контакта с нейрофизиологом и анестезиологом в ходе операции. Фрагментирование опухолевого узла це лесообразно производить после отделения его от матрик са (если позволяют условия), что уменьшает кровоточи вость паренхимы новообразования. В процессе удаления экстрацеребральной опухоли особое внимание должно быть сосредоточено на сохра нении паутинной оболочки, разделяющей капсулу опу холи и мозговое вещество. Эта «линия разделения» не редко «теряется» в местах вхождения в опухоль питаю щих ее сосудов или функционально важных сосудов моз га, целостность которых обязательно должна быть сохра нена. Именно поэтому отделение капсулы опухоли от мозгового вещества следует начинать в зонах, свободных от сосудов, т. е. в местах, где хорошо выражена линия разделения: мозг – капсула опухоли. При врастании кап сулы опухоли в мягкую мозговую оболочку возможность тотального удаления менингиом ограничивается и дол жна быть определена в каждом конкретном случае. В та ких ситуациях особое внимание требуется при отделе нии от опухоли функционально значимых сосудов. Тран зиторный спазм артерии, возникающий при хирургичес ких манипуляциях, целесообразно блокировать местным применением вазоактивных препаратов. Повреждение коротких перфорирующих артерий, питающих ствол мозга, в любой ситуации недопустимо. Существенную роль в ограничении радикальности операций при удале нии менингиом основания черепа и головного мозга иг рает ее плотность. Опыт показывает, что чрезмерная торопливость при удалении опухолей крупных размеров, вызывающих не редко грубое воздействие на диэнцефальную область, ме зенцефальнобульбарные отделы ствола, чревата выра женной ирритацией этих структур. Возникающие при этом перестройки церебрального кровотока и метаболиз ма мозга требуют прекращения хирургических манипуля ций на некоторый, как правило, небольшой период вре мени для нормализации функционального состояния стволовых отделов мозга. Такие паузы в хирургических манипуляциях или перенос их на другие отделы операци онного поля позволяют обойтись без дополнительного применения медикаментозных средств. Необходимо подчеркнуть, что хирургическое лечение экстрацеребральных опухолей головного мозга требует наибольшего разнообразия хирургических подходов и так тических приемов по сравнению с любой другой цереб ральной патологией. Эти и другие принципиально важ ные вопросы предполагается осветить в данном докладе, равно как и ближайшие результаты хирургии менингиом головного мозга различных локализаций. III ñúåçä íåéðîõèðóðãîâ Ðîññèè 158 Íåéðîîíêîëîãèÿ ÐÅÇÓËÜÒÀÒÛ ÒÐÀÍÑÑÔÅÍÎÈÄÀËÜÍÎÉ ÌÈÊÐÎÕÈÐÓÐÃÈÈ ÝÍÄÎ-ÑÓÏÐÀÑÅËËßÐÍÛÕ ÀÄÅÍÎÌ ÃÈÏÎÔÈÇÀ Òðóíèí Þ. Ê. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà В НИХ с 1979 г. транссфеноидальным доступом опе рировано более 3000 больных с опухолями селлярносфе ноидальной области. В представленной работе приводится анализ 109 слу чаев эндосупраселлярных аденомам гипофиза, опериро ванных трансназальнотранссфеноидальным доступом в 198491 гг. Возраст больных колебался от 16 до 73 лет, сред ний возраст составил 39 лет. Мужчины составили 43 на блюдения, женщины 66. По гормональной активности аденомы гипофиза рас пределились следующим образом: 12 соматотропином, 45 пролактинсекретирующих опухолей, 35 гормональноне активных аденом, 15 больных имели смешанные опухо ли, продуцирующие СТГ и пролактин, 2 – кортикотро пиномы. По степени нарушения зрения больные разделены на 4 группы: 1. Больные без зрительных нарушений – 25 набл. 2. Больные с легкой степенью нарушений зрения – 31 набл. 3. Больные со средней степенью нарушений зрения – 44 набл. 4. Больные с грубыми зрительными нарушениями – 9 набл. В 1 группе больных, несмотря на наличие супраселляр ного роста опухоли, отсутствие зрительных нарушений можно объяснить либо «передним» расположением хиаз мы (что в таких случаях затрудняет удаления опухоли транскраниально), либо, наоборот, «длинными» зритель ными нервами. В подавляющем большинстве случаев (90%) в этой группе больных была «передняя» позиция хиазмы, что устанавливалось по расположению отрезка А1 передней мозговой артерии при ангиографии или МРТ. В этой группе больных в послеоперационном периоде улучшения зрения не было. Во второй группе больных зрительная функция после операции улучшилась в 93%; без изменений осталось у 7% наблюдений. В третьей группе зрительная функция улучшилась в 76%, без изменений осталось в 18% и ухудшение было у 6% больных. В четвертой группе больных улучшение отмечено толь ко в 2 случаях (22%), без изменения осталось у 6 (66%) и в 1 случае было ухудшение зрения. В целом после транссфеноидальных операций улучше ние общего состояния больных отмечено в 73% случаев; у 22% больных не было существенной динамики и в 5% слу чаев развилось ухудшение состояния. Общая летальность составила 4,4%. Непосредственно от операции скончалось 4 больных (в 2 случаях – базаль ный гнойный менингит на фоне ликвореи; в 1 случае кро воизлияние в ствол мозга после удаления ретроселлярно го узла опухоли; в 1 случае на операции была повреждена задняя соединительная артерия с образованием гемато мы на основании мозга и гемотампонадой желудочковой системы). В одном случае после удаления гигантской со матотропиномы произошла гемотампонада желудочковой системы вследствие кровотечения из недиагносцирован ной до операции артериовенозной аневризмы, распола гавшейся в области колена мозолистого тела. Катамнез прослежен в сроки от 8 до 15 лет; рецидивы составили 14%. ÒÐÀÍÑÑÔÅÍÎÈÄÀËÜÍÀß ÕÈÐÓÐÃÈß ÁÎËÜØÈÕ È ÃÈÃÀÍÒÑÊÈÕ ÎÏÓÕÎËÅÉ Ñ ÑÓÏÐÀÑÅËËßÐÍÛÌ ÐÎÑÒÎÌ Òðóíèí Þ. Ê., Àëåêñååâ Ñ. Í., Øêàðóáî À. Í., Ãðèãîðüåâà Í. Í. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà В в е д е н и е . Лечение базальных опухолей представля ется одной из сложных проблем современной нейрохи рургии. Несомненно, это относится к большим и гигант ским аденомам гипофиза и краниофарингиомам. Хирургическое лечение таких опухолей сопряжено с определенными техническими проблемами – часть опухо ли, которая расположена супраселлярно, удобнее удалять транскраниальным доступом, а ту часть, что располагается инфраселлярно возможно удалить только трансназальным доступом; удаление эндоселлярной части особых трудно стей не представляет и возможно из любого доступа. Существующие в мире способы хирургического лече ния, включающие одномоментное трансназальнотранс краниальное удаление опухоли и последовательное по этапное транскраниальное, а затем трансназальное ее уда ление, позволяют добиться полного удаления, но при этом представляются нам достаточно травматичными. С нашей точки зрения, их следует использовать только при много узловой форме строения супраселлярной части. М а т е р и а л ы и м е т о д ы . При лечении больших и ги гантских опухолей, не выходящих за пределы собствен ной капсулы, нам представляется более оптимальным трансназальный доступ, позволяющий исключить трак цию лобной доли и препаровку образований гипоталамо гипофизарной области во избежание травматизации и по явления нарушений кровоснабжения этих образований. Особенностью доступа является расширенная трепанация передней стенки основной пазухи, передней стенки и дна турецкого седла, что позволяет на последующих этапах операции использовать крупногабаритные инструменты – ложки и отсосы специальной формы. Трудности обзора операционного поля в зонах непря мой видимости частично компенсируются использовани ем электроннооптического преобразователя, хирурги ческих зеркал и эндоскопа. Обязательно применялось временное повышение внутричерепного давления по ори гинальной методике, что позволило в подавляющем боль шинстве случаев низвести капсулу в полость седла, в зону прямой видимости, и радикально удалить остатки опухо ли и коагулировать ее капсулу. С помощью этой методики за период 19992001 гг. опе рировано 60 пациентов, из них 45 с опухолями гипофиза и 15 с краниофарингиомами и эпидермоидными киста ми, по размерам 38 опухолей по нашей классификации относились к большим (от 3,6 до 6 см) и 22 к гигантским (более 6 см.) Р е з у л ь т а т ы . Улучшение зрительной функции было отмечено в 82% (49 больных), без изменения в 15% (9 боль ных), ухудшение у 3% (2 больных) больных. Динамика зрительных функций в основном зависела от выраженно сти атрофии дисков зрительных нервов. Так, при нали чии бледных дисков зрительных нервов улучшение насту пило только у 2 из 13 больных, у 9 больных функция зре ния осталась без изменения, а у оставшихся 2 отмечено ухудшение. Скончалась на 27 сутки после удаления гиган тской эндоинфрасупралатероселлярной опухоли ги пофиза одна больная в результате кровоизлияния в остав шийся неудаленным латероселлярный узел опухоли. З а к л ю ч е н и е . Таким образом, применение интрао перационного эндоскопического контроля и управляемой 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 159 Íåéðîîíêîëîãèÿ внутричерепной гипертензии при трансназальных опера циях расширяет возможность более радикального удале ния больших и гигантских аденом гипофиза. ÈÍÒÐÀÊÐÀÍÈÀËÜÍÛÅ ÌÅÒÀÑÒÀÇÛ Óëèòèí À. Þ., Ñàôàðîâ Á. È., ×åñíîêîâà Å. À., Òàñòàíáåêîâ Ì. Ì. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã Распространенность метастазов в головной мозг дос тигает 10/100 000 населения, и в западноевропейских странах в структуре нейроонкологических операций на их долю приходится до 40% всех нейроонкологических опе раций. В России этот показатель не достигает и 15%. Меж ду тем своевременное хирургическое лечение позволяет в значительной части случаев увеличить продолжитель ность жизни у данной группы больных с сохранением удовлетворительного уровня их качества жизни и соци альной адаптации. Нами проведен анализ 85 случаев метастатического поражения головного мозга у жителей СанктПетербур га, оперированных в РНХИ в период 19902000 гг. Мужчины составили 59%, женщины – 41%. Средний возраст больных был 53±2,1 года (p<0,05). Первичными очагами являлись: рак легких – в 36,5%, меланома кожи – в 27,5%, рак молочной железы – в 7,3%, рак почки – в 10,7%, опухоли желудочнокишечного тракта – в 6,4%, в 4,7% – опухоли другой локализации, неизвестно – в 7,6%. У 17 человек (20%) диагностировано более одного инт ракраниального метастаза, у 7 (8,2%) – более 2х метаста зов. У 76 больных (89%) опухолевые узлы располагались супратенториально. В 18 наблюдениях метастазы являлись синхронными, в 53 – метахронными. У 14 человек метастатическое по ражение головного мозга явилось первым проявлением опухолевого процесса. В группе пациентов с метахронны ми метастазами среднее время после проведения хирур гического лечения основного опухолевого очага состави ло 3,7±1,2 мес. (р<0,067). Все больные оперированы. В случаях с множественны ми метастазами у 18 больных (75%) выполнена 2х этап ная резекция опухолевых узлов. Послеоперационная ле тальность составила 2,3%. Причиной смерти были ослож нения, связанные с прогрессом первичного очага. Средняя продолжительность жизни после операции составила 13,1 мес. Рубежа однолетней выживаемости достигли 41,3% больных, пятилетней выживаемости – 10,8%. Наибольшая пятилетняя выживаемость отмечена у больных с метастазами опухолей легких – 16,2%, наи меньшая – у больных с метастатической меланомой – 4,8%. При синхронных и первичномножественных метаста зах пятилетней выживаемости не достиг ни один больной, один год прожили, соответственно, 9,7% и 10,2% паци ентов. На выживаемость отрицательно влияли следующие факторы: синхронные или первичномножественные метаста зы в головной мозг; характеристика первичного очага; состояние по шкале Карновского (ниже 60 баллов); возраст больного; присутствие метастазов в другие органы; субтенториальная локализация опухолевого узла; отсутствие в анамнезе лучевой терапии и (или) хими отерапии первичного опухолевого очага. Лишь 10,4% умерших больных погибли в результате роста интракраниальных узлов (все больные – с множе ственными метастазами), у остальной части больных при чиной смерти явились прогрессирование основного опу холевого узла и (или) метастазы в другие органы. Целесообразность хирургического лечения интракра ниальных метастазов обусловливается следующими по ложениями: хирургическая техника резекции данных но вообразований технически проста, послеоперационные осложнения редки, общемозговая и очаговая симптома тика регрессирует уже в раннем послеоперационном пе риоде, качество жизни при выписке составляет в среднем 87 баллов (по шкале Карновского). ÊÎÌÁÈÍÈÐÎÂÀÍÍÛÅ ÒÐÀÍÑÊÐÀÍÈÀËÜÍÛÅ ÄÎÑÒÓÏÛ Â ÕÈÐÓÐÃÈÈ ÃÈÃÀÍÒÑÊÈÕ ÀÄÅÍÎÌ ÃÈÏÎÔÈÇÀ Óëèòèí À. Þ., Òèãëèåâ Ã. Ñ., Îëþøèí Â. Å., Ìåëüêèøåâ Â. Ô., Òàñòàíáåêîâ Ì. Ì., Ãóëÿåâ Ä. À., Óñòðåõîâ À. Â., Áóðíèí Ê. Ñ. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã Аденомы гипофиза занимают третье место среди пер вичных интракраниальных образований (до 10%). Боль шие и гигантские аденомы гипофиза (диаметр опухоли более 3 см) диагностируются у 1015% больных с данной патологией, поступающих в нейрохирургические стаци онары. Все еще значительный уровень послеоперацион ной летальности, рецидивы опухоли, инвалидизация больных и грубые гормональные расстройства в позднем послеоперационном периоде связаны именно с этой ка тегорией аденом гипофиза. Несмотря на успехи транссфе ноидальной хирургии, для удаления крупных аденом ги пофиза сохраняют свое значение комбинированные транскраниальные субфронтальные трансбазальные до ступы. Проведен анализ хирургического лечения 320 больных с гигантскими аденомами гипофиза в нейроонкологичес ком отделении РНХИ за период с 1980 по 2001 г. У боль шинства больных (95,3%) опухоль удалялась из широко го двустороннего субфронтального доступа, который у 26 (8,5%) больных сочетался с транссфеноидальным досту пом путем резекции бугорка турецкого седла и площадки клиновидной кости. Преимуществами комбинированно го транскраниального доступа, который в случае выражен ного инфраселлярного роста опухоли или переднего по ложения хиазмы дополняется резекцией бугорка турец кого седла, являются: незначительная тракция лобных долей; сохранение переходных вен к полюсам лобных долей; возможность визуализировать и сохранить стебель гипофиза, который при гигантских размерах опухоли обычно грубо деформирован и истончен; облегчение резекции многоузловых форм аденом ги пофиза; при выраженном инфраселлярном и экстраселлярном росте опухоли возможность провести радикальную резек цию новообразования в один этап; использование интраоперационного эндоскопа по зволяет надежно контролировать радикальность резекции супра и ретроселлярных фрагментов опухоли и состоя ние прилежащих к опухоли анатомических структур; значительное увеличение возможностей радикально го удаления опухоли. Послеоперационная летальность в период 19801990 гг. составляла 5,4%, а в период 19972001 гг. по мере совер шенствования хирургической тактики, микрохирургичес III ñúåçä íåéðîõèðóðãîâ Ðîññèè 160 Íåéðîîíêîëîãèÿ кой техники и анестезиологического пособия она снизи лась до 1,3%. СОД при проведении лучевого лечения со ставила в среднем 50 Гр. Улучшения зрительных функций – увеличения остроты зрения и расширения поля зрения удалось добиться у 93% больных. Эндокринные расстрой ства уменьшились в 88,5% наблюдений. Рецидивы забо левания отмечены у 6,3% пациентов. С нашей точки зрения, транскраниальные комбини рованные доступы в хирургии гигантских аденом гипо физа обладают определенными преимуществами перед транссфеноидальными доступами или комбинированны ми транссфеноидальнотранскраниальными подходами. ÏÐÈÌÅÍÅÍÈÅ ÍÅÒÐÀÄÈÖÈÎÍÍÛÕ ÐÅÆÈÌΠÔÐÀÊÖÈÎÍÈÐÎÂÀÍÈß Â ÐÀÄÈÎÒÅÐÀÏÈÈ ÃËÈÎÁËÀÑÒÎÌ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Ôèàëêî Í. Â., Áåíöèîí Ä. Ë., Êîëîòâèíîâ Â. Ñ. Óðàëüñêèé ìåæîáëàñòíîé íåéðîõèðóðãè÷åñêèé öåíòð èì. ïðîô. Ä. Ã. Øåôåðà, ÑÎÎÄ ÌÍÏÖ «Îíêîëîãèÿ», Åêàòåðèíáóðã По данным литературы, непосредственные и отдален ные результаты лечения глиом головного мозга оценива ются как неудовлетворительные. Медиана выживаемос ти при глиобластомах составляет 7,5 месяцев. Радикаль ность большинства операций является условной в связи с невозможностью визуально оценить границы субклини ческого распространения опухоли и удалить ее в пределах здоровых тканей без нарастания неврологического дефи цита. Поэтому оперативное лечение опухолей головного мозга комбинируется с лучевой терапией, которая улуч шает отдаленные результаты. Медиана выживаемости при комбинированном лечении глиобластом повышается до 912 месяцев. Данные радиобиологических исследований свидетель ствуют, что лишь 10% клеток глиобластомы являются ра диочувствительными. Одним из самых привлекательных способов управления радиочувствительностью является нетрадиционное фракционирование дозы. С учетом кле точной кинетики, опухоли, характеризующиеся быстрым темпом роста, высоким пролиферативным пулом, требу ют подведения укрупненных суточных доз, а дневное дробление дозы позволяет добиться более полного вос становления нормальных тканей. С 1999 года в радиотерапевтическом отделении центра пролечено 56 пациентов с гистологически верифициро ванными глиобластомами. Распределение по полу было следующее: мужчин – 35 (63%), женщин – 21 (37%). Воз раст колебался от 25 до 67 лет (средний – 46). Пациенты разделены на 2 группы: В 1й группе (n=20) облучение проводилось в класси ческом режиме 2 Гр в день, 5 фракций в неделю до СОД 60 Гр. Общая длительность курса составила 3840 дней. Во 2й (n=36) послеоперационный курс лучевой тера пии проводился в режиме ускоренного гиперфракциони рования: классические фракции 2 Гр подводились 2 раза в день с интервалом 46 часов. За 12 лечебных дней суммарная доза составила 48 Гр (24 фракции), изоэффек тивная доза – 60 Гр. Общая длительность курса (с учетом предлучевой подготовки) составляет 1920 дней. Предлучевая топометрическая подготовка производи лась на КТ Philips, клинический объем мишени форми ровался на основании данных предоперационных иссле дований (КТ и МРТ). Начальный объем включал в себя опухоль, отек и зону безопасности 3 см во всех направле ниях. После подведения дозы 40 Гр в 1й группе и 32 Гр во 2й объем сокращался до размеров опухоли, отека и зоны безопасности 1 см во всех направлениях. Дозиметричес кое планирование осуществлялось на компьютерных пла нирующих системах «ROCS» и «Helax». Облучение про водилось на ЛУЭ 6 МэВ статическим способом с 2х про тиволежащих полей. Размеры полей варьировали от 36 до 120 кв. см. В терапию сопровождения были включены гормоны, мочегонные, сосудистые препараты. После лечения все па циенты находились под динамическим наблюдением с час тотой 1 раз в месяц (осмотр нейрохирурга, ОАК, КТ, МРТ). В результате проведенного исследования переноси мость курса в обеих группах расценена как удовлетвори тельная. Одногодичная выживаемость составила в 1й группе – 65,8%, во 2й – 70,8%; двухлетняя – 21 и 24,7% соответственно. Средняя выживаемость в 1й группе со ставила 11 месяцев, во 2й – 15. Данная методика имеет ряд преимуществ: сокращение сроков лечения – 3 недели по сравнению с конвенциональным режимом (6 недель); улучшение показателей выживаемости по сравнению со стандартными режимами. Учитывая то, что результаты лечения больных с глиоб ластомами остаются неудовлетворительными, мы счита ем, что попытки повышения суммарных доз в опухоли за счет нетрадиционного фракционирования являются пер спективными. ÄÈÀÃÍÎÑÒÈÊÀ È ÕÈÐÓÐÃÈ×ÅÑÊÎÅ ËÅ×ÅÍÈÅ ÑÏÈÍÀËÜÍÛÕ ÌÅÍÈÍÃÅÎÌ Ôîìè÷åâ Â. Ã. Êëèíèêà íåðâíûõ áîëåçíåé èì. À. ß. Êîæåâíèêîâà ÌÌÀ èì. È. Ì. Ñå÷åíîâà, Ìîñêâà Спинальные менингеомы составляют около 30% всех первичных спинальных опухолей, 715% от общего коли чества менингеом и 23% от всех опухолей ЦНС. Заболе ванием в основном страдают женщины, у мужчин оно развивается редко (5%). Спинальные менингеомы значи тельно чаще развиваются у лиц пожилого возраста. состав ляя в этой группе около 60% первичных спинальных опу холей. Большинство менингеом относится к группе инт радуральных экстрамедуллярных опухолей (9095%), ред ко встречаются опухоли с транс и экстрадуральным рос том (310%). Описано небольшое количество эктопичес ких интрамедуллярных менингеом (1%). Обычно разви вается одна опухоль, случаи множественных менингеом и сочетания их с интракраниальными редки (23%). Боль шинство менингеом обнаруживается в грудном отделе позвоночника (80%), реже на уровне шейного отдела по звоночника (1520%) и крайне редко поясничного (1%). Гистологически синальные менигеомы относятся к груп пе типических (доброкачественных) – 98%, среди них ча сто встречаются псаммоматозные формы (90%), редкие для краниальных менигеом. Активная хирургическая тактика в отношении этих больных определяется сравнительно низкой травматич ностью операции. Радикальное удаление опухолей воз можно в 9297%. Летальность не превышает 23%, а по ложительная динамика различной степени выраженнос ти отмечается в 70% наблюдений. Пожилой и старческий возраст больных, несмотря на обычно большое количе ство сопутствующих заболеваний, как и глубокая степень выраженности неврологических расстройств, не являют ся противопоказанием к операции. В нейрохирургическом отделении клиники в период с 1985 по июнь 2001 г. было прооперировано 143 больных со спинальными менингеомами. Женщин – 140, мужчин 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 161 Íåéðîîíêîëîãèÿ – 3. Возраст больных варьировал в пределах от 30 до 80 лет, средний возраст – 61 год. Опухоль располагалась на уровне шейного отдела позвоночника в 26 наблюдениях (18%), грудного отдела – 115 (81%), поясничного – 2 (1%) и соответственно компремировала спинной мозг на уров не верхнего шейного отдела в 6 случаях (4%), шейного утолщения –20 (14%), грудном –97 (68%), поясничного утолщения – 24 (17%) и конского хвоста – 2 (1%). 132 ме нингеомы (93%) располагались субдурально, 10 (6%), по мимо интрадурального узла, имели отчетливый экстраду ральный рост, в 1 (0,7%) наблюдении имелась эктопичес кая интрамедуллярная менингеома. По отношению к по перечнику спинного мозга опухоли располагались вент рально в 18 случаях (13%), вентролатерально – 53 (37%), дорзолатерально – 40 (28%),, дорзально – 21 (15%), лате рально (занимали вентральную и дорзальную поверх ность) – 9 (6%) и муфтообразно в 1 случае (0,7%). В 1 на блюдении обнаружены множественные менингеомы – 2 опухоли в верхнем и среднем отделах позвоночника. Со четания спинальных менингеом с краниальными не на блюдалось. Течение заболевания имело прогредиентный характер у 117 больных (81%) и ремиттирующий у 26 (19%). В неврологическом статусе на момент операции дви гательные и чувствительные расстройства отмечались у 138 больных (97%), болевой синдром – 84 (59%), наруше ние функций тазовых органов – 88 (62%). Выраженность клинических проявлений соответствовала корешковой стадии в 2 наблюдениях (1,4%), частичному поперечному поражению спинного мозга – 84 (59%) и полному – 56 (39%). Диагноз опухоли и ее локализацию устанавливали с помощью позитивной миелографии и МРТ. Опухоли компремировали спинной мозг обычно на уровне 23 сег ментов. У 3 больных (2,1%) операции были повторными и проводились в сроки 7, 11 и 19 лет после первого вме шательства. Для доступа к опухоли проводили ламинэк томию 14 позвонков. С помощью микрохирургической техники опухоли были тотально удалены у 138 (96,5%) и субтотально у 5 (3,5%) больных. В 4 случаях (2,8%) при выраженной петрификации матрикса вентрально и вент ролатерально расположенные петрифицированные уча стки матрикса не удалялись в связи с отсутствием призна ков компрессии мозга и высоким риском его поврежде ния. В 1 случае диффузного муфтообразного роста на уровне С1С2 позвонков удалена большая доступная часть опухоли. При дорзальных менингеомах производили ис сечение твердой мозговой оболочки в области матрикса опухоли, при других локализациях – коагуляцию. Гисто логическое исследование материала выявило в 131 случае (91,6%) псаммоматозные формы. Анапластических форм и кистообразования не обнаружено. 9 менингеом (6,3%) были полностью петрифицированы. Результат операции оценивался на момент выписки из стационара через 34 недели после операции и расценен как хороший у 66 пациентов (46%), удовлетворительный у 49 (34%) и неудовлетворительный у 27 (19%). Фактора ми, соответственно увеличивающими риск неудовлетво рительного функционального исхода операции, являют ся: проведение операции в фазе полного поперечного по ражения спинного мозга, возраст больных выше 60 лет, вентральное и вентролатеральное расположение опухоли и ее полная петрификация. Временное нарастание невро логической симптоматики после операции отмечалось в 24 случаях (17%) и встречается достоверно чаще при вен тральной локализации и петрификации менингеом. На момент выписки из стационара отрицательная невроло гическая динамика по сравнению с дооперационным со стоянием сохранялась в 10 наблюдениях (7%). ÕÈÐÓÐÃÈ×ÅÑÊÎÅ ËÅ×ÅÍÈÅ ÑÏÈÍÀËÜÍÛÕ ÍÅÃËÈÀËÜÍÛÕ ÂÍÓÒÐÈÌÎÇÃÎÂÛÕ ÎÏÓÕÎËÅÉ Ôîìè÷åâ Â. Ã., Åâçèêîâ Ã. Þ. Êëèíèêà íåðâíûõ áîëåçíåé èì. À. ß. Êîæåâíèêîâà ÌÌÀ èì. È. Ì. Ñå÷åíîâà, Ìîñêâà Опухоли неглиальной природы составляют около 20% внутримозговых спинальных опухолей и являются редки ми клиническими наблюдениями. В общей группе инт рамедуллярных опухолей липомы составляют 7%, геман гиобластомы – 7%, метастазы – 5%, дермоидные кисты – 3%. Отмечаются единичные наблюдения эктопических неврином, менингиом, метастазы опухолей головного мозга, лимфомы. Целью представленной работы явился анализ особен ностей клинического течения и результатов хирургичес кого лечения опухолей указанной группы. М а т е р и а л и с с л е д о в а н и я . В нейрохируругичес ком отделении клиники за последние 15 лет проведены операции 110 пациентам с интрамедуллярными опухоля ми, у 16 из них (14%) обнаружены опухоли неглиальной природы: липомы – 6 наблюдений (5%), гемангиоблас томы – 6 наблюдений (5%), эктопические невриномы – 2 наблюдения (2%), по одному наблюдению – менингеома (1%) и дермоидная киста (1%). Радикальное удаление проведено в 11 наблюдениях (липомы – 2 наблюдения, гемангиобластомы – 5, неври номы – 2, менингеома – 1, дермоидная киста – 1). Субто тальное удаление – 3 наблюдения (липомы – 2 наблюде ния, гемангиобластома – 1). Парциальное удаление – 2 наблюдения (липомы). Результаты и их обсуждение. В клинической картине опухолей неглиальной приро ды в 5 из 16 наблюдений отмечался синдром Броун–Се кара, что достоверно чаще (р<0,001) аналогичного пока зателя для глиом (1 из 94 наблюдений). Болевой синдром при опухолях неглиальной природы – 13 из 16 наблюде ний встречался также чаще, чем при глиомах – 57 из 94 наблюдений. Интрамедуллярные неглиальные опухоли часто выхо дили на поверхность спинного мозга и формировали опу холевые узлы вне пределов мозга. Опухоли указанной группы располагались интраэкстрамедуллярно в 6 из 16 наблюдений, при глиомах (эпендимомы и астроцитомы) подобное расположение встречалось значительно реже, аналогичный показатель составил 8 из 94 наблюдений (р<0,01). При интраэкстрамедуллярном расположении опухо лей во всех наблюдениях удаление проводилось через «спонтанную миелотомию» без дополнительного рассе чения спинного мозга. При удалении опухолей, не имев ших экстрамедуллярного роста, миелотомия проведена в проекции задней продольной щели в 9 наблюдениях, в проекции «DREZ»зоны в 1 наблюдении. Причинами нерадикального удаления опухолей являлось прочное прикрепления их фрагментов к ткани мозга, которое было более характерно для липом (4 из 6 наблюдений). Результаты операций оценивались на момент выпис ки пациентов из стационара в сроки 34 недели с момента операции на основании динамики основных неврологи ческих синдромов. При регрессе (частичном или полном) неврологических расстройств результат считался хоро шим; при отсутствии неврологической динамики – удов летворительным; при наличии отрицательной динамики – неудовлетворительным. Хороший результат отмечен в 9 наблюдениях (липомы – 3, гемангиобластомы – 3, не вринома – 1, менингеома – 1, дермоидная киста – 1), удов III ñúåçä íåéðîõèðóðãîâ Ðîññèè 162 Íåéðîîíêîëîãèÿ летворительный – 4 наблюдения (липомы – 2, геманги областома – 1, невринома – 1), неудовлетворительный – 3 наблюдения (липома – 1, гемангиобластомы – 2). При опухолях, удаление которых не сопровождалось миело томией (6 наблюдений), неудовлетворительных исходов не было, хороший результат отмечен в 4 наблюдениях, удовлетворительный – в 2 наблюдениях. При гемангиоб ластомах неудовлетворительные исходы отмечались чаще, чем при опухолях другой гистологической природы (2 из 6 наблюдений). Это связано, по нашему мнению, с бога тым кровоснабжением солидных опухолей данной гисто логической структуры, что повышает риск сосудистых расстройств в перифокальной зоне мозга. Удаление со лидных гемангиобластом требовало активного использо вания биполяной коагуляции, что также повышает риск операции за счет возможной хирургической травмы при лежащих участков мозга. ÐÎËÜ ÕÈÌÈÎÒÅÐÀÏÈÈ Â ËÅ×ÅÍÈÈ ÁÎËÜÍÛÕ Ñ ÊÎÌÏÐÅÑÑÈÅÉ ÑÏÈÍÍÎÃÎ ÌÎÇÃÀ ÂÛÇÂÀÍÍÎÉ ËÈÌÔÎÏÐÎËÈÔÅÐÀÒÈÂÍÛÌÈ ÇÀÁÎËÅÂÀÍÒßÌÈ Ôðåé÷êî Í. Â., Ãåðàñèìîâ Ì. Â. Óðàëüñêèé ìåæîáëàñòíîé íåéðîõèðóðãè÷åñêèé öåíòð èì. ïðîô. Ä. Ã. Øåôåðà, ÑÎÎÄ ÌÍÏÖ «Îíêîëîãèÿ», Åêàòåðèíáóðã Компрессия спинного мозга (КСМ) – одно из действи тельно неотложных состояний, встречающихся у больных онкологическими заболеваниями. Более 50% случаев при ходится на метастатический рак простаты, молочной же лезы и легкого, вместе взятых. Другими опухолями, часто сочетающимися с КСМ, являются лимфомы, меланомы, саркомы, множественная миелома, рак почки. Цель терапии у этой категории больных – сохранение возможности самостоятельно передвигаться и предупреж дение нарушения функций кишечника и мочевого пузы ря. Поэтому крайне необходима срочная декомпрессия спинного мозга. В настоящее время облучение места по ражения является главным направлением терапии. Хирур гическая декомпрессия может дать немедленный эффект, однако многие наблюдения показывают, что оперативное лечение ничем не превосходит лучевую терапию, а кроме того, сопряжено с риском послеоперационных осложне ний. Операция обычно остается в резерве при неэффек тивности консервативной терапии. Остается неоднознач ным место химиотерапии у данной группы пациентов. В нашем лечебном учреждении, совмещающем в себе онкологический и нейрохирургический центры, мы име ли уникальную возможность исследовать роль химиоте рапевтического компонента в лечении больных с клини кой КСМ, вызванной первичным либо вторичным пора жением позвоночника лимфопролиферативными заболе ваниями, поступавших для проведения хирургической декомпрессии. Лечение проводилось больным с морфологически ве рифицированным диагнозом лимфопролиферативного заболевания, осложнившимся КСМ, которая была под тверждена результатами КТ, МРТ. Проводилось 2 курса химиотерапии в режиме ВЕАСОР (в случае лимфограну лематоза) или по схеме СНОР (при неходжкинской лим фоме) с последующей лучевой терапией на зону пораже ния в режиме классического фракционирования. Эффект оценивался после окончания химиотерапии с использо ванием КТ, МРТ. Работа начата в 2001 году. Пролечено две пациентки. Обе больные поступили в нейрохирургическое отделение с кли никой КСМ, с преобладанием болевого синдрома в одном случае и нижним парапарезом во втором. У одной имел ме сто рецидив лимфогранулематоза (гистологически – ноду лярный склероз), развившийся после 13летнего безреци дивного периода, с локализацией в грудном отделе позво ночника. У другой – лимфома с изолированным поражени ем шейных позвонков (при биопсии опухоли получен ре зультат – Вкрупноклеточная диффузная лимфома). После проведения 2х курсов химиотерапии у обеих пациенток было зафиксировано обратное развитие невро логической симптоматики в виде купирования болевого синдрома, уменьшения явлений парапареза (больная на чала самостоятельно передвигаться). При контрольном исследовании – КТ, МРТ позвоночника – выявлена по ложительная динамика с регрессией размеров опухоли на 50% в первом случае и на 80% – во втором. В дальнейшем была проведена лучевая терапия, а затем продолжена хи миотерапия до максимального эффекта. Проведения хи рургического вмешательства не понадобилось. Таким образом, при наличии морфологической вери фикации опухолевого процесса, длительном безрецидив ном периоде, эффективности предшествующего лечения, а также принимая во внимание высокую и умеренновы сокую чувствительность к химиотерапии, представленная тактика является оправданной и достаточно эффективной. В заключение хотелось бы отметить, что подход к ле чению подобных больных в каждом конкретном случае должен быть индивидуальным и определяться коллеги ально с привлечением онкологов (радиолога, химиотера певта), с учетом не только повышения качества жизни, но и возможности ее продления за счет достижения полных или частичных ремиссий. ÔÐÎÍÒÎÇÈÃÎÌÀÒÈÊÎÎÐÁÈÒÀËÜÍÛÉ ÄÎÑÒÓÏ Â ÕÈÐÓÐÃÈ×ÅÑÊÎÌ ËÅ×ÅÍÈÈ ÎÏÓÕÎËÅÉ ÎÑÍÎÂÀÍÈß ×ÅÐÅÏÀ Õàéìóíè Â. Ô., Ñàêîâè÷ Â. Ï., Øàìîâ À. Þ., Ñóñëîâ Ñ. À. Êëèíèêà íåðâíûõ áîëåçíåé è íåéðîõèðóðãèè ÓÃÌÀ, ÃÊÁ ¹ 40, Óðàëüñêèé ìåæîáëàñòíîé íåéðîõèðóðãè÷åñêèé öåíòð èì. ïðîô. Ä. Ã. Øåôåðà, ÑÎÎÄ ÌÍÏÖ «Îíêîëîãèÿ», Åêàòåðèíáóðã Проблема удаления опухолей основания черепа оста ется одной из сложных проблем нейрохирургии. При уда лении таких опухолей из стандартных доступов радикаль ность операции может снижаться в связи с необходимос тью выполнения значительной тракции головного мозга, а также с возможностью повреждения внутренней сонной артерии, ее ветвей и черепных нервов. В связи с этим для удаления опухолей основания чере па необходимы оперативные доступы, позволяющие при минимальной тракции головного мозга добиться макси мального обозрения опухоли и прилежащих интракрани альных анатомических структур. На наш взгляд, этим требованиям отвечает фронтози гоматикоорбитальный доступ, при котором производит ся трепанация черепа в лобновисочной области с изъя тием фрагментов лобной кости, верхней и наружной сте нок орбиты, скулового отростка лобной кости и в некото рых случаях – скуловой дуги. При этом широко открыва ется содержимое орбиты, основание передней и средней черепной ямок. Мы располагаем опытом применения этого доступа у 35 больных. Среди них менингиом ольфакторной ямки было 15, кавернозного синуса – 2, бугорка турецкого сед ла – 10, площадки основной кости – 5, большого и мало го крыльев основной кости – 15, аденомы гипофиза с парасупраселлярным ростом – 3, опухоли вершины ор биты и канала зрительного нерва – 5. 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 163 Íåéðîîíêîëîãèÿ Р е з у л ь т а т ы . Тотальное удаление опухоли удалось выполнить у 45 больных, субтотальное – у 7, парциальное – у 3. Послеоперационные осложнения развились у 2 боль ных, в одном случае они послужили причиной смерти. По нашему мнению, этот доступ является методом вы бора при менингиомах кавернозного синуса, большого и малого крыльев основной кости. Что касается менинги ом другой локализации, то его следует считать альтерна тивным. Тем не менее, при менингиомах ольфакторной ямки, применяя этот доступ, нет необходимости трепа нировать лобную кость с двух сторон. При аденомах ги пофиза он оправдан, если опухоль имеет выраженный супрапараселлярный рост. Опыт также показал, что для удаления опухолей вершины орбиты и канала зрительно го нерва при этом доступе создаются лучшие условия, чем при традиционном фронтоорбитальном доступе. ÊËÈÍÈÊÎ-ÍÅÂÐÎËÎÃÈ×ÅÑÊÎÅ ÑÎÏÎÑÒÀÂËÅÍÈÅ ÎÑÒÅÎÕÎÍÄÐÎÇÀ ØÅÉÍÎÃÎ ÎÒÄÅËÀ ÏÎÇÂÎÍÎ×ÍÈÊÀ È ÂÍÅÌÎÇÃÎÂÛÕ ÎÏÓÕÎËÅÉ ÎÑÍÎÂÀÍÈß ÇÀÄÍÅÉ ×ÅÐÅÏÍÎÉ ßÌÊÈ Õèëüêî Â. À., Âåðåùàêî À. Â., Äóëàåâ Ñ. À. Êàôåäðà íåéðîõèðóðãèè ìåäèöèíñêîé àêàäåìèè ïîñëåäèïëîìíîãî îáðàçîâàíèÿ, Ãîðîäñêîé íàó÷íî-ïðàêòè÷åñêèé íåéðîõèðóðãè÷åñêèé öåíòð ïðè ÃÌÏÁ ¹ 2, Ñàíêò-Ïåòåðáóðã Как показали исследования, проведенные в ВМедА и НХЦ ГМПБ № 2, успех лечения опухолей ЗЧЯ во многом зависел от постановки диагноза опухоли, проведения диф ференциальной диагностики, прежде всего с остеохонд розом шейного отдела позвоночника (ОШОП). Обобще ны результаты наблюдения 128 больных с различной ло кализацией опухолей. Наиболее часто встречались менин гиомы – 31 (24,2%), хемодектомы – 46 (35,9%5, неврино мы (неврилеммомы) – 27 (21,1%) и 24 (18,8%) прочих опу холей (холестеатомы, саркомы, ангиофибромы, хордомы). Проведена дифференциальная диагностика у 42 пациен тов – больных с ОШОП. Выделено 4 группы больных с расположением опухо ли в области большого затылочного отверстия (ОБЗО), боковой цистерны моста (ОБЦ), блюменбахова ската (ОБС), яремного отверстия (ОЯО). Основную группу сре ди больных с менингиомами ЗЧЯ составили пациенты, у которых первым симптомом заболевания была головная боль в 18 (56,9%) случаев. При хемодектомах головная боль отмечена у 21 (45,6%). При невриномах 8 пары (с каудаль ным ростом опухоли) заболевание начиналось головной болью в 6 (25%) наблюдениях. На начальных этапах роста боли характеризовались как оболочечные, в последующем присоединялся гипертензионный компонент. Наиболее характерными являлись боли в затылочной области, шее, иногда с иррадиацией в надплечье, что порой заставляло расценивать их как боли, вызванные ОШОП. Боли при ОШОП, как правило, начинались в шейнозатылочной области и имели разный характер: тупые и распирающие, колющие и стреляющие, пульсирующие и стягивающие. Шейнозатылочная боль иррадиировала в половину го ловы, часто приступообразного характера. В межприступ ном периоде сохраняюлись боли, зависящие от движения головы, сохранялось напряжение мышц шеи с одной или обеих сторон. Исследование объема движений в шейном отделе сопровождалось болезненными ощущениями, а сам объем ограничен. Пальпация и перкуссия выявляли болезненные паравертебральные точки или болезнен ность остистых отростков. Особую трудность в плане диф ференциального диагноза представляли больные с ОБЗО – 9 (7,0%) наблюдений. В клинической картине этих боль ных, помимо болей в шейнозатылочной области, при сутствовали явления ограничения движений в шейном отделе позвоночника, ригидности мышц, гипестезии, па рестезии в зоне дерматомов С2СЗ, двигательные рас стройства, что сближало их с клиникой ОШОП. Отличи тельно было наличие и других неврологических наруше ний в виде чувствительных, двигательных расстройств по проводниковому типу, присоединение симптоматики поражения черепномозговых нервов с V по XII пар. Вторым по частоте признаком у больных менингеома ми ЗЧЯ, были кохлеовестибулярные нарушения, пред ставленные односторонним снижением слуха в 7 (22,5%) случаев или шумом в ухе – 4 (12,9%). При менингеомах боковой цистерны моста в 8 случаях нарушения слуха выявлялись поздно. Заболевание часто начиналось с об щей или местной головной боли, шаткости при ходьбе, болей или онемения в лице. Другие кохлеовестибулярные расстройства включали в себя – сильный шум в ухе, ощу щение системного головокружения. Среди больных невриномами каудальных черепных нервов и VIII пары заболевание проявлялось шумом в ухе в 14 (51,5%), у 6 (25%) больных первым симптомом бо лезни было снижение слуха на одно ухо. Вестибулярные нарушения отмечались у всех больных с невриномами VIII пары, хотя были не всегда типичными. Подобная клини ка проявляется и у больных с ОШОП, а именно с его про явлением – задним шейным симпатическим синдромом или синдромом позвоночной артерии. У данного контин гента больных имелись также: болезненность остистых отростков, дефанс паравертебральных мышц шейного отдела позвоночника, одним из ведущих синдромов яв лялся кохлеовестибулярный, который связан с дисцирку ляцией в артерии лабиринта, отходящей от задней ниж ней артерии мозжечка. При синдроме позвоночной арте рии кохлеарные расстройства характеризовались большим многообразием субъективных проявлений. Больные предъявляли жалобы на шум, звон, гудение в ушах. Клиническая картина ОЯО зависела от характера рос та. Головная боль – один из постоянных симптомов. Боль на стороне опухоли отмечена в 20 (43,5%) наблюдениях. Шум выявлен в 23 (50,0%) случаях. Головокружение и не устойчивость в позе Ромберга установлены у 15 (32,7%) пациентов. Для больных с опухолями этого типа харак терно прежде всего страдание каудальных нервов с пора жением IX и Х и XI в различных сочетаниях – 40 (89,1%). В клинике ОШОП еще в 1927 году Теггасоli была описана так называемая глоточная мигрень, выражающаяся в на рушении глотания и ощущении инородного тела в горле. Это парестезии в виде неприятных ощущений в глотке, сухость, царапанье, распирание, охриплость голоса, иног да затруднение при глотании. Объективные изменения, свидетельствующие в пользу поражения каудальной груп пы нервов, при ОШОП не выявлялись. ОБС с каудаль ной локализацией были отмечены в 5 (16,1%) случаях. Опухоли дебютировали ранними симптомами пирамид ной недостаточности, в последующем развивались геми парезы и плегии, в отличие от дискогенной шейной мие лопатии, где полного паралича обычно не отмечалось и больные передвигались самостоятельно. В пользу ОШОП свидетельствовали и корешковые изменения. Во всех на блюдениях у больных с ОБС наблюдались симптомы на рушения функции мозжечка, проявлявшиеся расстрой ством статики и походки, нарушением координации дви жений. При наличии нарушений функции черепномоз говой иннервации отмечалась картина альтернирующих синдромов. Оболочечногипертензионные явления раз III ñúåçä íåéðîõèðóðãîâ Ðîññèè 164 Íåéðîîíêîëîãèÿ вивались на фоне уже имеющейся локальной симптома тики. Проводя дифференциальную диагностику между опухо лями ЗЧЯ и проявлениями ОШОП, особое внимание уде лялось дополнительным методам обследования: рентгено графии, допплерографии сосудов шеи и головы, исследова нию глазного дна, КТ, АГ, нисходящей флебографии внут ренней яремной вены, МРТ. В пользу опухолей ЗЧЯ свиде тельствовали явления застоя на глазном дне, признаки внут ричерепной гипертензии на краниограммах, выявления маssэффекта по данным КТ и МРТ. Использование этих методов обследования в случаях с нетипичной клиникой ОШОП позволяло своевременно, на ранних стадиях разви тия опухоли ЗЧЯ, выставить правильный диагноз. Таким образом, течение внемозговых опухолей ЗЧЯ в достаточной большой группе – 1/3 больных, схоже с кли никоневрологической картиной ОШОП. Для улучшения дифференциальной диагностики про явлений и течения ОШОП и опухолей ЗЧЯ необходимо придерживаться комплексной оценки симптомов и син дромов с обязательным учетом проведенных дополни тельных методов исследования. Проводя анализ случаев, где лечение проводилось по поводу ОШОП, можно сказать, что причиной диагнос тических ошибок являлись не ошибки в собранных дан ных, а неверная оценка их. ÒÎÏÎÃÐÀÔÎÀÍÀÒÎÌÈ×ÅÑÊÎÅ ÎÁÎÑÍÎÂÀÍÈÅ È ÐÅÇÓËÜÒÀÒÛ ÕÈÐÓÐÃÈ×ÅÑÊÎÃÎ ËÅ×ÅÍÈß ÎÏÓÕÎËÅÉ ÑÒÂÎËÀ ÌÎÇÃÀ Ó ÂÇÐÎÑËÛÕ È ÄÅÒÅÉ Õèëüêî Â. À., Õà÷àòðÿí Â. À., Øóëåøîâà Í. Â., Ãàéâàðîíñêèé È. À. Êàôåäðà íåéðîõèðóðãèè ÂìåäÀ, Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Êëèíèêà íåðâíûõ áîëåçíåé Ãîñóäàðñòâåííîãî ìåäèöèíñêîãî óíèâåðñèòåòà èì. àêàä. È. Ï. Ïàâëîâà, Íàó÷íî-ïðàêòè÷åñêèé íåéðîõèðóðãè÷åñêèé öåíòð ïðè ÃÌÏÁ ¹ 2, Ñàíêò-Ïåòåðáóðã Результаты хирургического лечения опухолей ствола мозга во многом зависят от тщательного изучения вари антов топографоанатомических взаимоотношений в нор ме и при наличии новообразований. На протяжении последних лет на кафедре нормальной анатомии ВМедА проводились топографоанатомические исследования ствола мозга, что позволило уточнить опе ративные доступы при различной локализации опухолей мезэнцефальной области, варолиева моста и продолгова того мозга. В настоящем сообщении дается анализ топографоана томических взаимоотношений и их влияние на результа ты хирургического лечения 193 больных с первичными опухолями ствола мозга, врастающими в него опухолями из окружающих образований, а также околостволовыми опухолями. Из 193 больных было 89 детей и 104 взрослых человека. Лиц мужского пола – 103, женского – 90. Сред ний возраст детей – 6 лет 8 месяцев, взрослых – 30 лет 9 месяцев. Больные находились в ряде нейрохирургических и неврологических стационаров СанктПетербурга в пе риод с 1982 по 2000 год. Гистологическая структура опухоли ствола мозга у взрослых и детей была различной. У взрослых среди пер вичных и врастающих в ствол опухолей наиболее часто встретились астроцитомы – 32,9%, эпиндимомы – 9,6% и глиобластомы – 8,2%. У детей преобладали астроцито мы – 50%, медуллобластомы – 23%, глиобластомы – 9,6%. Хирургическому лечению подверглись 193 больных с опухолями ствола мозга. У взрослых опреративное вмешательство по поводу опухолей ствола мозга выполнено 103 больным, средний возраст которых составил около 30 лет. В большинстве случаев доступ к опухолям ствола моз га осуществлялся в положении сидя. При опухолях мезэн цефальных отделов, области четверохолмия и шишковид ной железы был использован парамедиальный разрез и субтенториальный доступ. При опухолях этой локализа ции возникали сложные взаимоотношения с венами, впа дающими в прямой синус, со смещенным опухолью чет верохолмием, задними отделами III желудочка и ножка ми мозга. При первичных и врастающих опухолях варолиева мо ста осуществляли срединный доступ с рассечением ниж ней половины червя мозжечка. Опухоли варолиева моста часто были связаны с ядром отводящего нерва и внутрен ним коленом лицевого нерва. В тех случаях, когда опухоль распространялась на про долговатый мозг, проводилась резекция большого затылоч ного отверстия и дужек 1 или 2 верхних шейных позвонков. Среди 103 больного с опухолями ствола мозга (первич ными, врастающими и околостволовыми) тотальное и субтотальное удаление опухолей произведено в 65,3% слу чаев. В 22,8% операции были ограничены декомпрессив ной трепанацией задней черепной ямки. Летальные ис ходы наступили в 11,9% случаев. Операции были выполнены 89 детям в возрасте от 1 года до 14 лет. При поступлении в стационар состояние боль ных было тяжелым и крайне тяжелым у 72 больных (81,8%). В большинстве случаев к опухолям ствола мозга (54,59%) был использован задний срединный доступ. Бо ковой доступ был использован в 40% наблюдений. Тотальное и субтотальное удаление опухолей ствола мозга у детей выполнено в 69,3% случаев. В 9% наблюде ний операция была ограничена декомпрессивной трепа нацией черепа. У 37,5% детей до или после операции были осуществлены различные ликворошунтирующие опера ции. После операции стабилизация состояния детей была достигнута в 79,5% случаев. Госпитальная летальность составила 7%. В последние 4 года при удалении опухолей ствола мозга и задней черепной ямки проводился нейрофизиологичес кий мониторинг при помощи компьютерной нейросисте мы «VikingIV» (Фирма «Nicolet», США). Во время опера ции осуществлялось исследование ЭЭГ – 4 канала и двух видов коротколатентных ВП: акустических стволовых выз ванных потенциалов (АСВП) и соматосенсорных вызван ных потенциалов (ССВП) – по 2 канала на каждую модаль ность. Регистрация АСВП возможна при стандартных ус ловиях проведения индукции наркоза диприваном. Для поддержания наркоза во всех случаях использовался фен танил, чаще фентанилклофелиновая смесь. ÈÍÒÐÀÎÏÅÐÀÖÈÎÍÍÛÉ ÌÎÍÈÒÎÐÈÍà ÑÎÑÒÎßÍÈß ÑÒÂÎËÀ ÌÎÇÃÀ ÏÐÈ ÓÄÀËÅÍÈÈ ÁÀÇÀËÜÍÎ ÐÀÑÏÎËÎÆÅÍÍÛÕ ÎÏÓÕÎËÅÉ Ñ ÏÐÈÌÅÍÅÍÈÅÌ ËÀÇÅÐÀ Öâåòîâñêèé Ñ. Á., Ñòóïàê Â. Â., Ñîëîâüåâà Ò. À., Ìàåðîâà Í. Ä. ÍÈÈ òðàâìàòîëîãèè è îðòîïåäèè, Íîâîñèáèðñê Использование лазерного хирургического инструмен та при удалении опухолей мозга уменьшает кровопотерю, существенно снижает инвазивность хирургического вме шательства. Однако при базальном расположении опухо 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 165 Íåéðîîíêîëîãèÿ лей во время операции важно контролировать функцио нальное состояние ствола мозга с целью определения до пустимых границ вмешательства и предупреждения воз можного нежелательного термического воздействия на ствол. У 30 больных интраоперационный мониторинг осу ществлялся нами путем регистрации коротколатентных акустических стволовых вызванных потенциалов (АСВП) с помощью системы «Нейропак2». Устройства для сти муляции и регистрирующие электроды модифицированы. В предоперационном периоде у пациентов с менинги омами мостомозжечкового угла или с невриномами слу ховых нервов АСВП имели выраженные отклонения от нормы с односторонним снижением или выпадением пер вых трех компонентов. При менингиомах очевидные из менения АСВП встречаются реже, при этом на первом плане изменения собственно стволовых компонентов IV и V различной степени выраженности. Наркоз существенно снижал амплитуду и увеличивал задержки компонентов АСВП по сравнению с регистра цией в дооперационном периоде. Выявлено, что значитель ное увеличение латентного времени компонентов АСВП, в том числе собственно стволовых их компонентов IV и V (увеличение задержки компонента V до значения 6,8 мс и более) при сохранении соотношения амплитуд и без гру бых изменений соотношения межпиковых интервалов не является коррелятом каких либо стволовых нарушений, угрожающих витальным функциям. К изменению функ ционального состояния чувствительны отношения ампли туд компонентов АСВП. Обнаружено, что в условиях крат ковременной гипоксии, вызванной факторами, не связан ными с манипуляциями хирурга на мозге и не являвшейся следствием ишемии стволовой области, электрогенез АСВП меняется. Так, на фоне гипертензионной началь ной реакции АД наблюдалось увеличение амплитуды ство ловых компонентов на 11%18%, что, вероятно, отражало функциональную активацию структур, ответственных за контроль витальных функций. Увеличение амплитуды со хранялось и в течение нескольких минут после снижения давления. В 27% случаев снижавшиеся на фоне вводного наркоза АСВП при переходе к основному наркозу несколь ко увеличивались по амплитуде. Сопоставление значений амплитуд ВП с характеристиками АД в ходе операции по казало, что стволовые ВП высокой амплитуды регистри руются у пациентов с нормальным или повышенным АД, При низком давлении или при его быстром снижении ам плитуда АСВП ниже, а задержки увеличиваются. Введение препаратов, повышающих АД, влияет на амплитуду, задер жки же меняются мало. Продолжительность операции, время пребывания пациента под наркозом влияют на за держки компонентов АСВП. При длительных операциях увеличивается латентное время, в том числе и компонента 1, генерируемого слуховым нервом. При этом и витальные функции в ходе операции, и исходы не отличаются значи мо от ситуаций с меньшим увеличением задержек. Как по казал опыт мониторинга, увеличение задержек компонен тов ВП отражает в первую очередь не локальные измене ния функционального состояния стволовых структур, на ходящихся вблизи удаляемой с помощью лазерного инст румента опухоли, а действие на скорость и характер прове дения нервных сигналов наркоза определенной глубины и продолжительности, а также препаратов, регулирующих гемодинамику. Т. о., в отсутствие повреждающего действия на ствол коротколатентные слуховые ВП в большей мере отражают особенности и течение анестезиологического обеспечения. В литературе (Острейко, 2000 и др.) сообщается о мно жестве случаев выраженной активации АСВП во время удаления опухолей мозга. При этом лишь при хирурги ческих вмешательствах на образованиях задней черепной ямки преобладало увеличение амплитуды компонентов IIIV, во многих других случаях увеличивались все пики АСВП. Изменения расценивались как ирритативные. Возможность столь значительной ирритации в условиях контролируемого наркоза вызывает вопросы, тем более что компоненты III генерируются периферическими структурами нервного аппарата слуха. В нашей работе мы не наблюдали значительного увеличения амплитуды ко ротколатентных слуховых ВП, связанных с какимлибо этапом хирургических вмешательств. Лишь у одной боль ной на этапе до применения лазера отмечено изменение формы комплекса стволовых компонентов 45, исход был неблагоприятен. На наш взгляд, это подтверждает не толь ко отсутствие существенного ирритирующего или угне тающего воздействия на стволовую область мозга при ма нипуляциях хирургическим лазерным инструментом, но и достаточность анестезиологического обеспечения опе раций. ÊÎÍÒÐÎËÜ ÔÓÍÊÖÈÎÍÀËÜÍÎÃÎ ÑÎÑÒÎßÍÈß ÌÎÇÃÀ ÁÎËÜÍÛÕ Ñ ÂÍÅ- È ÂÍÓÒÐÈÌÎÇÃÎÂÛÌÈ ÎÏÓÕÎËßÌÈ ÍÀ ÐÀÇËÈ×ÍÛÕ ÝÒÀÏÀÕ ÕÈÐÓÐÃÈ×ÅÑÊÎÃÎ ËÅ×ÅÍÈß Ñ ÏÐÈÌÅÍÅÍÈÅÌ ËÀÇÅÐÍÎÃÎ ÈÍÑÒÐÓÌÅÍÒÀ È ÈÌÌÓÍÎÀÊÒÈÂÈÐÓÞÙÅÉ ÒÅÐÀÏÈÈ Öâåòîâñêèé Ñ. Á., Ñòóïàê Â. Â., Ñîëîâüåâà Ò. À., Öåíòíåð Ì. È. ÍÈÈ òðàâìàòîëîãèè è îðòîïåäèè, Íîâîñèáèðñê При лечении больных с опухолями мозга актуальной является задача оценки функционального состояния моз говых структур как в период подготовки к операциям, так и в ходе операций по удалению опухолей, а также в после операционном периоде, особенно при осуществлении локорегиональной иммунотерапии. Для удаления опухо лей используется лазерный хирургический инструмент, что снижает инвазивность хирургического вмешательства. При удалении базально расположенных опухолей в ходе операции важно контролировать функциональное состо яние ствола мозга с целью предупреждения возможного нежелательного термического воздействия и определения допустимых границ вмешательства. Мониторинг состоя ния мозгового ствола осуществлялся нами путем регист рации коротколатентных слуховых вызванных потенци алов. Для оценки локальных и генерализованных изме нений электрической активности мозга, обусловленных наличием новообразования, и для контроля динамики функционального состояния мозга после операций с при менением лазерного хирургического инструмента исполь зовалось ЭЭГкартирование, Brain Mapping. При наличии базальных опухолей с воздействием на хиазму и зритель ные нервы регистрировались зрительные вызванные по тенциалы. В случаях, когда опухоли компремировали или вовлекали пути соматической чувствительности, в т. ч. в конвекситальных отделах, функциональные нарушения оценивались путем регистрации соматосенсорных выз ванных потенциалов. Операции по поводу парасагиттально расположенных опухолей, особенно менингиом передней трети фалькса, делают желательной оценку состояния высших психичес ких функций. Для этого использованы специально раз работанные компьютерные нейропсихологические тесты. Получены количественные оценки снижения интеллек туальных возможностей пациентов, корреляции между глубиной расстройств и объемом и темпом роста опухо ли. Изменения состояния функциональной межполушар III ñúåçä íåéðîõèðóðãîâ Ðîññèè 166 Íåéðîîíêîëîãèÿ ной асимметрии отмечены при заднелатеральной локали зации опухолей. Снижение оперативной памяти, внима ния, способности к целенаправленной деятельности осо бенно выражено при поражении передних отделов. При предоперационных обследованиях получены ха рактеристики исходных слуховых стволовых ВП. Наркоз снижал амплитуду и увеличивал задержки компонентов ВП по сравнению с регистрацией в дооперационном пе риоде. Опыт мониторинга показал, что значительное уве личение латентного времени компонентов СВП (увели чение задержки компонента V до значения 6,9 мс) при сохранении соотношения амплитуд и без грубых измене ний соотношения межпиковых интервалов, не является коррелятом каких либо стволовых нарушений, угрожаю щих витальным функциям. Увеличение задержек компо нентов ВП отражает в первую очередь не локальные из менения функционального состояния стволовых струк тур, находящихся вблизи удаляемой с помощью лазерно го инструмента опухоли, а действие на скорость и харак тер проведения нервных сигналов наркоза определенной глубины и продолжительности, а также препаратов, регу лирующих гемодинамику. Т. о., в отсутствие повреждаю щего действия на ствол коротколатентные слуховые ВП в большей мере отражают особенности и течение анесте зиологического обеспечения. Локорегиональная иммуноактивирующая терапия осу ществляется путем введения лимфокинактивированных киллеров (ЛАК) и антигенспецифических лимфоцитов в сочетании с рекомбинантным интерлейкином2 через катетер, установленный в ложе удаленной опухоли. При проведении ЛАКтерапии функциональное состояние мозга контролировалось для оценки реакций на введение определенного объема биологически активного субстра та и длительного стимулирующего эффекта. При этом в качестве основного индикатора функционального состо яния использовались зрительные вызванные потенциа лы на обращаемый шахматный паттерн. Такой выбор обусловлен следующим: ЗВП представляют собой отно сительно просто и надежно регистрируемые показатели прихода афферентной импульсации в кору мозга; удобны для анализа и описания; генез ЗВП осуществляется на церебральном уровне, ЗВП отражают внутримозговые процессы. Полисинаптический механизм генерации ЗВП (включая кору) позволяет надеяться на чувствительность параметров ЗВП к различным нейрохимическим факто рам и в целом к изменению функционального состояния мозга. В большинстве случаев (84%) изменения парамет ров ЗВП были позитивными как от сеанса к сеансу ЛАК терапии, так и непосредственно после введения дозы. Кратковременные негативные реакции на внутримозго вое введение объемной дозы явились исключением. ÕÈÐÓÐÃÈß ÈÍÒÐÀÊÐÀÍÈÀËÜÍÛÕ ÌÅÍÈÍÃÈÎÌ, ÐÀÑÏÐÎÑÒÐÀÍßÞÙÈÕÑß Â ÏÎÄÂÈÑÎ×ÍÓÞ ßÌÊÓ Öèêàðèøâèëè Â. Ì., ×åðåêàåâ Â. À., Áåëîâ À. È., Âèíîêóðîâ À. Ã., Òàòèøâèëè Î. Ç. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Менингиомы составляют около 22% интракраниаль ных первичных опухолей. Эти опухоли часто характери зуются инвазией прилежащей кости с образованием гие ростоза и экстракраниальных узлов, особенно при лока лизации менингиомы в области основания средней череп ной ямки. Кроме того, изза частого вовлечения в опухо левый процесс кавернозного синуса и магистральных моз говых сосудов частота продолженного роста менингиом этой локализации составляет около 45%. Несмотря на от носительную редкость вторичного распространения ме нингиом в подвисочную ямку, возникающая при этом инвалидизация больных в связи с трудностями (вплоть до невозможности) открывания рта, тяжелыми болевыми синдромами и косметическими дефектами делает актуаль ной разработку оптимальной тактики лечения таких боль ных. Материал настоящего исследования составили 32 на блюдения таких больных, оперированных с 1995 по 2001 г. Средний возраст больных составил 46 лет. 25 больным по поводу основного заболевания ранее производились хирургические вмешательства, часто повторные. Всем больным производили КТ с контрастным усилением, осо бо отмечали наличие или отсутствие гиперостоза, деструк ции костных структур. Во время операции особое внима ние обращали на инвазию опухолью твердой мозговой оболочки, костей основания черепа, мышц, нервов, сли зистой оболочки. Всем больным после операции прово дилась контрольная КТ. Характерными признаками распространения опухоли в подвисочную ямку являются снижение чувствительно сти в зоне иннервации ветвей 5 нерва, у 12 больных на блюдалась кондуктивная тугоухость вследствие блокады слуховой трубы, у 11 больных – тризм жевательной мус кулатуры или ограничение подвижности нижнечелюст ного сустава. Гиперостоз крыльев основной кости был выявлен в 24 наблюдениях, еще в 8 случаях была обнаружена деструк ция костных структур основания средней черепной ямки. Инфильтрация жевательных мышц отмечалась во всех наблюдениях, в 16 случаях было выявлено распростране ние опухоли по ветвям тройничного нерва, в 6 случаях – поражение опухолью слизистой оболочки околоносовых пазух или полости рта. Во всех случаях был использован орбитозигоматичес кий инфратемпоральный доступ, который обеспечивает визуализацию как интра, так и экстракраниальной час ти опухоли, а также анатомических структур кавернозно го синуса, подвисочной ямки. околоносовых пазух, но соглотки. В 80% наблюдений опухоль удалена в пределах види мости, в 20% случаев произведено частичное удаление опухоли. Во всех случаях получен положительный эффект в виде улучшения движений нижней челюсти, прекраще ния или значительного уменьшения болей, коррекции косметического дефекта. ÏÐÈÌÅÍÅÍÈÅ ÓËÜÒÐÀÇÂÓÊÎÂÎÃÎ ÄÅÇÈÍÒÅÃÐÀÒÎÐÀ CUSA-EXCEL ÔÈÐÌÛ VALLEYLAB (ÑØÀ) ÄËß ÒÐÀÍÑÑÔÅÍÎÈÄÀËÜÍÎÃÎ ÓÄÀËÅÍÈß ÀÄÅÍÎÌ ÃÈÏÎÔÈÇÀ ×åðåáèëëî Â. Þ., Ïîëåæàåâ À. Â. Êàôåäðà íåéðîõèðóðãèè ÂÌåäÀ, Ñàíêò-Ïåòåðáóðã Нами в клинике нейрохирургии Военномедицинской академии использовался ультразвуковой диссектораспи ратор CUSAExcel фирмы ValleyLab (США) с прямыми и изогнутыми фрагментаторами 36 кГц и 23 кГц в целом ряде оперативных вмешательств у больных с опухолями хиазмальноселлярной области головного мозга. Аппарат применяли при транссфеноидальном удале нии аденом гипофиза, краниофарингиом. Опухоли име ли различные размеры, разнообразные плотностные ха рактеристики, различные типы кровоснабжения и лока лизации. В большинстве случаев ультразвуковая дезинтег рация являлась одним из основных этапов оперативного вмешательства – удаления опухоли. Использованные в 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 167 Íåéðîîíêîëîãèÿ аппарате режимы и мощности ультразвуковой деструкции и вакуумного усиления позволяют аспирировать ткань новообразования практически любой плотности, вклю чая плотные фрагменты в составе краниофарингиом и аденом гипофиза. В то же время режимы работы прибора дают возможность производить деликатное удаление но вообразований с сохранением целостности паратумороз ных и внутриопухолевых сосудов. Применение диссектора способствовало уменьшению кровопотери во время опе рации, т. к. конструкция аппарата предусматривает воз можность создания коагуляции тем же наконечником, которым осуществляется ультразвуковая аспирация опу холи. Качество работы аппарата очень высоко и значитель но превосходит имеющиеся на снабжении отечественные дезинтеграторы. Ультразвуковой диссектор прост в под готовке к работе и стерилизации, форма и размеры нако нечников позволяют удалять опухоли любой локализации. Имеющиеся ультразвуковые наконечники дают возмож ность удалить аденому гипофиза даже в условиях глубо кого и узкого канала транссфеноидального доступа. Ис пользование ультразвукового диссектора CUSAExcel су щественно облегчало работу нейрохирургов и способство вало увеличению радикальности удаления опухолей, при адекватном и щадящем сохранении окружающих тканей, что в целом способствовало улучшению результатов опе раций. Использованная техника позволяет, с нашей точки зре ния, добиться минимальной травматичности и макси мальной радикальности в выполнении данного типа опе ративных пособий. ÈÍÒÐÀÎÏÅÐÀÖÈÎÍÍÎÅ ÊÎÍÒÐÀÑÒÈÐÎÂÀÍÈÅ ÁÀÇÀËÜÍÛÕ ÖÈÑÒÅÐÍ ÏÐÈ ÒÐÀÍÑÑÔÅÍÎÈÄÀËÜÍÎÉ ÕÈÐÓÐÃÈÈ ÀÄÅÍÎÌ ÃÈÏÎÔÈÇÀ ×åðåáèëëî Â. Þ., Ïîëåæàåâ À. Â., Ìàíóêîâñêèé Â. À. Êàôåäðà íåéðîõèðóðãèè ÂÌåäÀ, Ñàíêò-Ïåòåðáóðã На сегодняшний день именно хирургический метод остается основным в широком арсенале имеющихся спо собов лечения опухолей гипофиза. Использование прин ципов микрохирургии, внедрение эндоскопической тех ники и операционного микроскопа позволили значитель но улучшить результаты хирургических вмешательств. Послеоперационная летальность при удалении аденом за последние три десятилетия снизилась в среднем от 2530% до 3,47,8% (Мелькишев В. Ф., 1997). При этом обеспе чивается практическое выздоровление с восстановлени ем трудоспособности у 60,375% оперированных больных (Hardy J., Serri O., 1995). Все шире и шире используемый в последние десятиле тия транссфеноидальный доступ в хирургии аденом ги пофиза открывает новые перспективы и ставит новые за дачи. Возможность удаления больших и гигантских аде ном гипофиза в условиях длинного и узкого операцион ного канала делает необходимым четкую визуализацию верхних контуров новообразования. С этой целью в пос ледние годы широко используются различные контраст ные средства. Нами для вышеуказанных целей использовался кисло род, который вводился в ходе оперативного вмешатель ства эндолюмбально в количестве 1020 мл (в зависимос ти от массы пациентов). Контрастирование использова лось интраоперационно при 132 транссфеноидальных вмешательствах. 1020 мл кислорода достаточно для хо рошего заполнения хиазмальных цистерн, четкой визуа лизации верхних контуров новообразования при интрао перационной боковой флюороскопии. Введенный объем кислорода позволяет после удаления эндоинфраселляр ного опухолевого узла поэтапно удалить супраселлярные фрагменты новообразования, не повреждая растянутую диафрагму турецкого седла. Введение кислорода способ ствует более четкой визуализации функционально значи мых образований хиазмальноселлярной области, что об легчает манипулирование во время операции. Анализ проведенных оперативных вмешательств по зволил четко сформулировать постулат, что при «откры том» типе турецкого седла контрастирование базальных цистерн должно проводиться обязательно, т. к. оно зна чительно облегчает ход оперативного пособия, способ ствует более радикальному удалению больших и гигантс ких аденом гипофиза, позволяет избежать многих интра операционных ошибок и осложнений. ÎÐÁÈÒÎÇÈÃÎÌÀÒÈ×ÅÑÊÈÉ ÄÎÑÒÓÏ Ê ÎÏÓÕÎËßÌ ÎÑÍÎÂÀÍÈß ×ÅÐÅÏÀ ×åðåêàåâ Â. À., Áåëîâ À. È., Âèíîêóðîâ À. Ã., Öèêàðèøâèëè Â. Ì., Òàòèøâèëè Î. Ç. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Разработанный А. Hakuba с соавт. в 1986 году орбито зигоматический инфратемпоральный доступ является в настоящее время одним из наиболее универсальных пе реднелатеральных доступов к основанию черепа. Этот доступ позволяет за счет формирования и удале ния орбитозигоматического костного лоскута подойти к глазнице, передней и средней черепным ямкам, каверноз ному синусу, пирамиде височной кости, вырезке мозжеч кового намета, а при необходимости к основной и верх нечелюстной пазухам. При этом с минимальной тракци ей мозга возможна резекция кости основания черепа с открытием зрительного канала, верхней и нижней глаз ничных щелей, округлого, остистого и овального отвер стий с выделением проходящих в них сосудистонервных пучков. В зависимости от распространенности процесса применяется однолоскутная или двухлоскутная модифи кация орбитозигоматического доступа. С 1999 по 2001 год 83 больных в возрасте от 15 до 73 лет были оперированы с применением орбитозигоматичес кого доступа. В 62 наблюдениях это были менингиомы: 31 – гиперостотические менингиомы крыльев основной кости, 26 – большие узловые менингиомы медиальных отделов крыльев основной кости, 5 – менингиомы кавер нозного синуса. В 21 наблюдении были опухоли другой гистологической структуры: невриномы, фибромы, хон дромы, хондросаркомы, хордомы. При гиперостотических менингиомах для удаления опухоли было достаточно формирования орбитозигома тического лоскута, включающего скуловую дугу, верхне наружные отделы орбитального кольца, с последующим удалением гиперостоза и мягкой части опухоли. В осталь ных наблюдениях орбитозигоматический лоскут форми ровался как дополнение к лобновисочному лоскуту. Пластику базальных дефектов твердой мозговой обо лочки и основания черепа производили надкостничным лоскутом и фрагментом жировой клетчатки с передней брюшной стенки. Наш опыт показал, что орбитозигоматический доступ позволяет удалять опухоли средней черепной ямки, кры льев основной кости, подвисочной и крылонебной ямок с минимальной тракцией мозга. Косметический эффект удовлетворительный, так как костные лоскуты в конце операции укладываются на место. III ñúåçä íåéðîõèðóðãîâ Ðîññèè 168 Íåéðîîíêîëîãèÿ Осложнений, связанных с доступом, не было. Леталь ных исходов не было. ÊÎÌÏËÅÊÑÍÎÅ ËÅ×ÅÍÈÅ ÇËÎÊÀ×ÅÑÒÂÅÍÍÛÕ ÎÏÓÕÎËÅÉ ÎÑÍÎÂÀÍÈß ×ÅÐÅÏÀ ×åðåêàåâ Â. À., Òàíÿøèí Ñ. Â., Áåëîâ À. È. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Злокачественные опухоли головы и шеи составляют 1 2% среди злокачественных новообразований, в том числе злокачественные опухоли глаза и орбиты составляют 0,4 1,1%,. верхней челюсти 1,53,0%, полости носа и около носовых пазух 0,52,0%, мягких покровов и костей чере па, среднего уха – 0,81,5%. Злокачественные опухоли исходят в основном из экстракраниальных тканей – эпи телиальной выстилки наружного и среднего уха – различ ные виды рака и аденокарциномы, экстракраниальной мышечной ткани – некоторые виды сарком, перифери ческих нервов – нейроэпителиомы и злокачественные шванномы, солитарные опухоли лимфоидной ткани – плазмоцитома, гистиоцитома. Гистобиологические ха рактеристики этих новообразований таковы, что в про цессе агрессивного, деструктивного роста опухоль быст ро выходит за пределы одной анатомической зоны и в зна чительной части случаев поражает основание черепа и может внедряться в интракраниальное пространство. Рас пространение опухоли может происходить как путем пря мого прорастания структур основания, так и по перинев ральным пространствам, исходящих из черепа нервов. Подход к лечению злокачественных опухолей являет ся многоплановым и имеет существенные отличия от та кового при доброкачественных опухолях основания че репа. Комбинированный метод лечения, применение ко торого является обязательным при злокачественных опу холях, включает в себя хирургические, лучевые и \имио 1ерапевгические методы. Выбор каждого метода, комби нация их и последовательность применения зависят от гистологической природы и распространения опухоли. Показания к радикальным хирургическим вмешатель ствам основываются на локализации новообразования и стадии онкологического процесса. Распространение опу холи на основание черепа не является причиной отказа от хирургического вмешательства, прямые показания к радикальному хирургическому вмешательству могут быть сформулированы при всех основных гистологических ти пах злокачественных опухолей, поражающих основание черепа, исключая опухоли лимфоретикулярного ряда, при характеристиках стадии заболевания T34N0ХM0. По показателям объективного состояния больного, возраста, сопутствующей патологии и некоторые другие общие принципы показаний и противопоказаний сход ны с таковыми при всех нейрохирургических вмешатель ствах. В целом принято считать, что операция не показа на при уровне активности менее 30 баллов по шкале Кар новского. Следует отметить, что, в отличие от ситуации развития доброкачественной опухоли, при злокачествен ных процессах (в наибольшей степени это относится к краниофациальным процессам) наличие местных гной новоспалительных изменений, особенно в связи с рас падом и нагноением опухоли, не может служить проти вопоказанием к операции. Паллиативные операции вклю чают не только частичное удаление опухоли, но и такие виды хирургических вмешательств, как эмболизация со судов опухоли при некупируемых кровотечениях из но вообразованной ткани. Эти паллиативные вмешательства могут осуществляться как изолированно, так и в комби нации с радикальными методами резекции. Отдельной строкой проходят косметические операции, связанные с образованием грубых дефектов после радикальных резек ций. Показания к этим вмешательствам формулируются в позднем послеоперационном периоде при отсутствии признаков продолженного роста или рецидива опухоли. Разработка эффективных методов реконструктивной и пластической хирургии явилась основой для выполнения блокрезекции у больных со злокачественными опухоля ми основания черепа, когда удаляется опухоль единым блоком с прилежащими нормальными тканями (твердой мозговой оболочкой, мышцами, костями основания че репа и лицевого скелета, слизистой, тканями глазницы, кожей). ÈÍÒÐÀÎÏÅÐÀÖÈÎÍÍÀß ÓËÜÒÐÀÑÎÍÎÃÐÀÔÈß Â ÕÈÐÓÐÃÈ×ÅÑÊÎÌ ËÅ×ÅÍÈÈ ÑÓÏÐÀÒÅÍÒÎÐÈÀËÜÍÛÕ ÃËÈÀËÜÍÛÕ ÎÏÓÕÎËÅÉ ×åñíîêîâà Å. À., Áåðñíåâ Â. Ï., Òèãëèåâ Ã. Ñ., Êàìàëîâà Ã. Ì. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã Основная проблема, возникающая при хирургическом лечении глиальных опухолей заключается в необходимо сти избежать интраоперационного повреждения наибо лее значимых функциональных зон коры и проводящих путей головного мозга и в то же время выполнить макси мально полную резекцию опухолевой ткани. Очевидно, что наиболее существенную пользу в решении этой зада чи могут оказать те нейронавигационные системы, кото рые позволяют получать изображение непосредственно в операционной и последовательно отображать все изме нения в топографии мозговых структур, возникающие при изменении интракраниального давления в ходе оператив ного вмешательства. Так как нейронавигационные сис темы второго поколения, основанные на интраопераци онной МРТ с инфракрасным наведением, в настоящее время малодоступны для большинства нейрохирургичес ких клиник, актуальной остается дальнейшая разработка и внедрение более доступных и менее дорогостоящих ме тодов нейронавигации, одним из которых является инт раоперационная ультрасонография. Интраоперационная ультрасонография в Врежиме применяется нами при хирургическом лечении глиальных опухолей в течение 3х лет. За этот период исследование проведено у 42 больных с глиальными опухолями, из них 36 пациентов были прооперированы первично, тогда как 6ти больным была выполнена повторная операция по поводу продолженного роста опухоли. Отличительной особенностью обеих групп являлось то, что у большей ча сти больных кора головного мозга в опухолевый процесс вовлечена не была, что и обуславливало необходимость проведения навигации. В работе используется система Concept 2000 с секторным и линейным датчиками часто тою 5 и 7,5 МГц. УСнавигация осуществляется через ко стное окно как трансдурально, так и транскортикально. Плоскости сканирования выбирались произвольно, но для упрощения интерпретации полученных данных были максимально приближены к стандартным плоскостям при компьютерной и магнитнорезонансной томографии. Определялось расстояние от предполагаемого места рас сечения коры до латерального полюса опухоли в различ ных отделах полушарий мозга. Транскортикальный дос туп выбирался с учетом локализации функционально важ ных зон коры и данных о минимальном расстоянии до опухоли. В ходе операции проводился УСмониторинг. В конце операции по завершении удаления опухоли прово 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 169 Íåéðîîíêîëîãèÿ дился УСконтроль, позволявший определить объем вы полненного вмешательства. В ближайшем послеоперационном периоде (21 день) в динамике проводилась тщательная оценка неврологичес кого статуса больных и их общего состояния по шкале социальной адаптации Карновского в сравнении с доо перационными данными. Полученные в ходе работы ре зультаты показали, что в зависимости от акустических характеристик патологической ткани можно выделить два основных типа изображения опухолей при УСсканиро вании: это четко очерченные зоны, дающие высокий аку стический сигнал, что характерно при узловой форме гли альной опухоли и нечетко отграниченные от мозгового вещества гетероэхогенные образования, характерные для опухолей с инфильтративным ростом. По данным УС изображения не представляется возможным судить о сте пени анаплазии: не выявлено прямой зависимости меж ду интенсивностью сигнала и гистологическими характе ристиками опухоли. В группе пациентов, первично опе рируемых по поводу глиальных опухолей, разница в дан ных о размерах опухоли, полученных при предопераци онном КТ/МРТ и интраоперационном УСсканирова нии, составляла не более нескольких миллиметров. При повторных операциях при продолженном росте и на фоне предшествующей лучевой терапии полученные при УС исследовании измерения в ряде случаев значительно пре вышали показатели размеров опухоли по данным предо перационной МРТ и при визуальном контроле. Наиболее ценным представляется применение метода интраоперационной ультрасонографии в целях навигации и для выбора транскортикального доступа, что особенно важно при расположении опухоли в проекции фунцио нально важной зоны. Во всех наблюдениях удалось быст ро и достоверно установить локализацию опухоли, вклю чая те случаи, когда диаметр последней был менее 1 см, и выбрать наименее травматичный доступ к ней. При удалении инфильтративно растущих опухолей, когда граница между опухолью и здоровой тканью четко не определяется под контролем зрения, УСмониторинг позволил нам выявить участки неудаленной опухолевой ткани. Однако во всех наших наблюдениях при контроле объема выполненного вмешательства выявлялось тонкое гиперэхогенное кольцо 24 мм, окружающее полость ре зекции, обусловленное, вероятно, образованием тромбов на поверхности опухолевого ложа. Исходя из этого, для верификации полученных при УСмониторинге данных об объеме выполненного вмешательства целесообразным является тщательный визуальный контроль и повторная биопсия. ÔÎÒÎÄÈÍÀÌÈ×ÅÑÊÀß ÒÅÐÀÏÈß Â ÕÈÐÓÐÃÈ×ÅÑÊÎÌ ËÅ×ÅÍÈÈ ÏÎËÓØÀÐÍÛÕ ÃËÈÀËÜÍÛÕ ÎÏÓÕÎËÅÉ ×åñíîêîâà Å. À., Òèãëèåâ, Ã. Ñ., Êàìàëîâà Ã. Ì., Óëèòèí À. Þ., Ãóëÿåâ Ä. À., Ãåëüôîíä Ì. Ë., Âàñèëüåâ Ä. Â. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, ÍÈÈ îíêîëîãèè èì. ïðîô. Í. Í. Ïåòðîâà, Ñàíêò-Ïåòåðáóðã В основе фотодинамической терапии лежит термин «фотодинамическое действие», используемый для описа ния повреждения живых организмов светом в присутствии фотосенсибилизатора и кислорода. В настоящее время эта методика используется как адъювантная терапия в лече нии полушарных глиальных опухолей и основывается на введении фотосенсибилизатора, избирательном накопле нии его в опухолевой ткани и последующем взаимодей ствии со светом в присутствии кислорода, что вызывает фотохимически опосредованную деструкцию клеток. Ожидаемое соотношение накопления фотосенсибилиза тора в опухолевой ткани и мозговом веществе составляет не менее 4:1, при этом прослеживается прямая корреля ция между уровнем его накопления и степенью анапла зии опухоли. Кроме того, известно, что уровень пенетра ции светом биологической ткани повышается пропорци онально повышению степени целлюлярности последней. Так, в глиобластоме он более чем в два раза превышает уровень пенетрации в нормальной ткани. Таким образом, можно предполагать, что фотодинамическая терапия бу дет способствовать дополнительной редукции опухолевых клеток, тогда как нормальная мозговая ткань при этом сохранится неповрежденной. В нашей работе фотодинамическая терапия проводит ся у пациентов с глиальными опухолями как дифферен цированными, так и анапластическими и глиобластома ми. В наблюдение включены больные как с первично вы явленными опухолями, так и с продолженным ростом, оперируемые повторно. В нашей работе применяется фо тосенсибилизатор 2го поколения, вводится препарат внутривенно во время интубации. Ожидаемый макси мальный терапевтический эффект данного препарата на ступает через 34 часа после введения, т. е., другими сло вами, к моменту завершения удаления глиомы концент рация фотосенсибилизатора в клетках опухоли достигает своего максимального уровня. Используемый препарат максимально абсорбирует свет при длине волны 660 нм, что является его достоинством, так как известно, что адек ватная пенетрация биологических тканей светом дости гается при длине волны 650800 нм. Доза вводимого пре парата составляет 4,8 мл 2,7% раствора. В ходе операции проводится максимально возможное в зависимости от ло кализации и характера роста опухоли удаление опухоле вой ткани, после чего осуществляется облучение ложа опухоли. В работе используется опытный образец полу проводникового лазера с длиной волны излучения 660 нм, выходная мощность излучения на торце шестисотмикрон ного кварцевого моноволокна составляет 400 мВт. Облу чение ложа опухоли проводится сканирующими движе ниями световода в течение 20 минут на расстоянии 1 см от стенок полости резекции. Плотность мощности состав ляет в среднем 25 мВт/см2. Учитывая, что фотосенсибилизатор, представляющий собой продукт переработки гематопорфирина, имеет тен денцию к селективному накоплению не только в опухо левой ткани, но также в клетках кожи, где может длитель но персистировать, один из возможных побочных эффек тов фотодинамической терапии – фотосесибилизация кожи в ранние сроки после операции и, как следствие, развитие кожной эритемы. В наших наблюдениях ни в одном случае не наблюдалось развитие эритемы, тем не менее в послеоперационном периоде всем больным ре комендуется избегать воздействия прямого солнечного света в течение по крайней мере 7 дней. В качестве после дующего этапа лечения 1я группа больных, в которую входили пациенты с первично выявленными дифферен цированными и анапластическими глиальными опухоля ми, с 1525 суток после операции получала курс дистан ционной гамматерапии с суммарной дозой 50 Гр, во вто рой группе больных, включающей пациентов с первично выявленными анапластическими опухолями и с продол женным ростом, лучевое лечение не проводилось. Течение ближайшего послеоперационного периода оценивалось с учетом динамики общемозговой и очаго III ñúåçä íåéðîõèðóðãîâ Ðîññèè 170 Íåéðîîíêîëîãèÿ вой неврологической симптоматики, развития осложне ний, побочных эффектов. При анализе отдаленных ре зультатов учитывались длительность безрецидивного пе риода, состояние больного по шкале социальной адапта ции Карновского. Также всем больным для контроля эф фективности проведенного лечения через 1017 дней пос ле операции и через 2 месяца после завершения курса лу чевой терапии проводилась МРТ или КТ головного мозга с контрастированием. У всех больных, включенных в исследование, после операционный период протекал благоприятно, осложне ний не наблюдалось. В настоящее время все пациенты живы, признаков продолженного роста не отмечается. ÕÈÐÓÐÃÈ×ÅÑÊÎÅ ËÅ×ÅÍÈÅ ÌÅÍÈÍÃÈÎÌ ÍÀÌÅÒÀ ÌÎÇÆÅ×ÊÀ (ÍÅÊÎÒÎÐÛÅ ÂÎÏÐÎÑÛ ÄÎÑÒÓÏÀ) ×èðêèí Â. Þ., Òèãëèåâ Ã. Ñ. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã Менингиомы намета мозжечка составляют около 57% от всех опухолей оболочечнососудистого ряда. Выделя ют 3 основных варианта направления роста опухолей: суп ратенториальное, супрасубтенториальное и субтентори альное. Особенности расположения опухоли во многом опре деляют клиническую картину заболевания и тактику хи рургического лечения. Как известно, общепринятым при супратенториальном расположении опухоли является субтемпоральный дос туп, при преимущественно субтенториальном распрост ранении – односторонний субокципитальный, при суп расубтенториальном – комбинированный доступ. Однако использование субтемпорального доступа для удаления опухолей намета мозжечка, имеющих супратен ториальное распространение, сопряжено с тракцией зад них отделов височной и затылочной долей. Это неминуе мо приводит к развитию в послеоперационном периоде таких осложнений, как гомонимная гемианопсия, а уда ление опухолей на стороне доминантного полушария ос ложняется афатическими нарушениями. У некоторых больных расстройства венозного кровообращения, обус ловленные доступом, приводят к развитию эпилептичес ких припадков. Вместе с тем следует напомнить, что удаление меди ально расположенных опухолей сопряжено с необходи мостью отделения капсулы новообразования от ствола головного мозга, черепных нервов и крупных артериаль ных сосудов. Для устранения этих недостатков в нейроонкологичес ком отделении РНХИ был разработан оригинальный хи рургический доступ к менингиомам намета мозжечка с супратенториальным распространением, который в опре деленной степени можно считать универсальным, обес печивающим удаление опухоли практически любого рас положения. Операцию производят в положении больного сидя. Во всех случаях важным моментом является наклон головы на 2530 градусов, что обеспечивает наилучший обзор нижней поверхности намета мозжечка в связи с особен ностями анатомического строения последнего. Разрез кожи парамедианный длиной 1315 см. Выполняют од ностороннюю трепанацию чешуи затылочной кости. При этом латеральной границей резекции является сосцевид ный отросток, верхний край трепанационного окна дол жен обнажать нижний край поперечного синуса, меди альный не доходит до средней линии на 1,52 см. Твер дую мозговую оболочку вскрывают лоскутным разрезом вдоль поперечного синуса. Осуществляют тракцию полушария мозжечка вниз. Переходные вены с полушария мозжечка в поперечный синус коагулируют. Таким образом обнажают нижнюю поверхность намета мозжечка. Осматривая его нижнюю поверхность, идентифицируют область исходного роста опухоли, располагающейся супратенториально, которая выглядит как локальное уплотнение, «вздутие» твердой мозговой оболочки, имеет плотную консистенцию, крас новатый цвет и несколько шероховатую поверхность. За тем производят тенториотомию от свободного края, что позволяет избежать сдавления ствола головного мозга в ходе удаления опухоли. Следующим этапом производят циркулярное рассечение намета по периферии матрикса, при этом коагулируют и пересекают все дуральные арте риальные ветви, участвующие в кровоснабжении опухо ли. После этого осуществляют интракапсулярное удале ние супратенториального новообразования с последую щим выделением и удалением его капсулы. Если в про цессе удаления опухоли трудно визуализировать отдель ные части ее капсулы, используется эндоскоп. Операцию завершают тщательным гемостазом, установкой пассив ного дренажа в ложе удаленной опухоли и послойным ушиванием раны. Следует подчеркнуть, что особую сложность при уда лении опухолей намета мозжечка вызывают те новообра зования, которые располагаются в области свободного его края и нередко бывают связаны с черепными нервами. Удаление этих опухолей из предложенного доступа также вполне возможно. ÑÂÅÐÕÑËÀÁÎÅ ÑÂÅ×ÅÍÈÅ ËÈÊÂÎÐÀ ÏÐÈ ÎÏÓÕÎËßÕ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ ×ìóòèí Ã. Å., Êèì Âîí Ãè, Óíæàêîâ Â. Â. Êðàåâàÿ áîëüíèöà ¹ 2, Õàáàðîâñê Сверхслабое свечение, или биохемолюминесценция, присуще практически всем живым системам. Методы определения сверхслабого свечения биологических сис тем и их производных находят все более широкое приме нение в клинической практике, в основном с целью диаг ностики различных патологических процессов. В насто ящее время наиболее интенсивно данный метод исследу ется в Японии. Например, группа японских авторов на шла прямую зависимость между интенсивностью сверх слабой биохемолюминесценцией и нейрональной мета болической активностью, а также оксидативной дисфун кцией нейрональных клеток. Кроме того, была зарегист рирована сверхслабая биофотонная эмиссия с клеток культуры человеческой карциномы и авторами отмечено, что данный неинвазивный метод регистрации сверхсла бого свечения является новым методом в диагностике зло качественных новообразований. Были открыты некото рые новые механизмы данного явления. Ряд авторов пред положили, что химический состав спинномозговой жид кости зависит от метаболизма головного мозга, и, исполь зуя метод сверхслабой хемилюминесценции, обнаружи ли, что у больных с множественным склерозом интенсив ность свечения ликвора превышает таковую контрольной группы. В доступной нам литературе практически отсутствуют сведения об исследовании сверхслабого свечения ликво ра при опухолях головного мозга. Поэтому целью нашего исследования явилась оценка сверхслабого свечения у больных с опухолями головного мозга. 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 171 Íåéðîîíêîëîãèÿ Для достижения указанной цели нами обследовано 12 образцов ликвора у больных с опухолью головного мозга, 14 образцов составили контрольную группу и исследовались у практически здоровых пациентов с легкой черепномозго вой травмой. Сверхслабое свечение, или хемолюминесцен цию (ХЛ) ликвора исследовали на аппарате Luminescence Spectrometer LS50 фирмы Perkin Elmer (Швейцария). Спон танную ХЛ образцов ликвора исследовали в течение 1 ми нуты, после чего активизировали ХЛ и продолжали иссле дование ХЛ в течение 4 минут, таким образом, продолжи тельность исследования одного образца составила 5 минут. Индуцированность ХЛ достигали добавлением к 0,5 мл лик вора 2 мл бидистилированной воды и 3% перекиси водоро да. Проводилась компьютерная запись кинетической кри вой ХЛ с вычислением площади спонтанной и индуциро ванной ХЛ под графиком кривой ХЛ. Кроме того, исследо валась средняя величина максимальной вспышки ХЛ на 1 й минуте и средняя величина максимальной вспышки ХЛ на 2й, 3й 4й и 5й минутах соответственно. Обработка полученных данных проводилась пакетом прикладных программ Statistica 5. В результате проведенного исследования было выяв лено, что площадь под графиком спонтанной ХЛ в опыт ной группе была достоверно выше в сравнении с конт рольной группой. Площадь под графиком индуцирован ной ХЛ также достоверно превышала показатели конт рольной группой. Выводы. 1. Сверхслабое свечения ликвора у больных с опухоля ми головного мозга происходит более интенсивно в срав нении с практически здоровыми пациентами. 2. Сверхслабое свечение ликвора может являться ме тодом неспецифической диагностики у больных с опухо лями головного мозга. – у 6, эпилептические припадки – у 12, мозжечковая дис функция – у 18, отставание в психоинтеллектуальном развитии – у 10 больных. В группе больных (12 человек), у которых при поступлении наблюдались пароксизмы припадки оказались частыми (еженедельно и чаще у 9, а ежемесячные – у 3 больных). У 5 больных в анамнезе от мечались эпилептические статусы. Генерализованные припадки выявлены у 8 больных, простые парциальные – у 4, а сложные парциальные припадки наблюдались у 8 больных. У 6 больных имело место сочетание 2х и более пароксизмов. ЭЭГданные определяли эпилептическую активность у 11 больных, у которых наблюдались паро ксизмы. В 8 случаях эпиактивность диффузная. В группе больных с кистой большой цистерны и цис терны червя мозжечка пароксизмальная активность вы явлена лишь у 2х больных из 11. После операции в группе больных с эпилептическими припадками полное прекращение припадков и отчетли вая тенденция к нормализации ЭЭГ отмечена у 5 боль ных (по Engel I тип исхода). Значительное урежение па роксизмов (II тип) достигнуто у 4х, незначительное уре жение (III тип) – у 2х, а некоторое учащение пароксиз мов после операции отмечено у 1 больного. В группе больных, у которых до операции пароксиз мов не наблюдалось, после операции на фоне дисфунк ции кистоперитонеального шунта отмечено развитие 2х генерализованных припадков в течение 6 месяцев. З а к л ю ч е н и е . Наличие эпилептических припадков у больных с ретроцеребеллярной кистой и регресс паро ксизмального синдрома после устранения кисты может свидетельствовать о несомненной роли мозжечка, как зве на противоэпилептической системы мозга. Повидимо му, наличие эпилептических припадков может являться дополнительным показанием для проведения операции, иссечения кисты у этих больных. ÏÀÐÎÊÑÈÇÌÀËÜÍÛÉ ÑÈÍÄÐÎÌ Ó ÁÎËÜÍÛÕ Ñ ÊÈÑÒÎÉ ×ÅÐÂß ÌÎÇÆÅ×ÊÀ È ÁÎËÜØÎÉ ÖÈÑÒÅÐÍÛ ÌÎÇÃÀ ×ìóòèí Ã. Å., Õà÷àòðÿí Â. À., Ñàìî÷åðíûõ Ê. À., Ôàäååâà Ò. Í., Ëåáåäåâ Ê. Ý., Ìèðñàäûêîâ Ä. À. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã; Êðàåâàÿ áîëüíèöà ¹ 2, Õàáàðîâñê ÑÅÐÎËÎÃÈ×ÅÑÊÈÅ ÎÑÎÁÅÍÍÎÑÒÈ Ó ÁÎËÜÍÛÕ Ñ ÃËÈÎÁËÀÑÒÎÌÎÉ ×óìàêîâ Â. À., Áèêòèìèðîâ Ð. Ã., Êà÷êîâ È. À., Ïðîíèíà Î. À., Ãíó÷åâ Í. Â., Êóçíåöîâ Â. Ï., Ñó÷êîâ Ñ. Â. ÌÎÍÈÊÈ, ÈÁà ÐÀÍ, ÍÈÈÝÈÌ èì. Í. Ô. Ãàìàëåè, Ìîñêâà Единой тактики лечения эпилепсии у больных с расши рением ликворосодержащих полостей задней черепной ямки к настоящему моменту не существует. Хорошо извес тно, что атрофия мозжечка часто сопровождает эпилепсию, однако значение мозжечка в патогенезе эпилепсии и в на стоящее время изучено недостаточно (Cooper I., 1973, 1976). М е т о д и к а и с с л е д о в а н и я и л е ч е н и е . Проведен анализ результатов исследования и лечения 23 больных в возрасте от 3х до 26 лет. Дети до 15 лет составили 3/4 сре ди всех обследованных. Обследование больных сводилось к неврологическому, ЭЭГ, КТ, МРТ, ПЭТ, а также про ведению ликворологических и ликвородинамических ис следований. 20 больных были прооперированы. Произ водилось эндоскопическое рассечение стенок кист и вос становление связи ретроцеребеллярной кисты с большой цистерной (в 8 наблюдениях), рассечение стенок кисты через расширенное фрезевое отверстие (в 5 наблюдени ях), кистоперитонеостомия (в 4х наблюдениях), трепа нация задней черепной ямки и рассечение кисты (в 3х наблюдениях). Исход операции определяли посредством оценки динамики клиникоЭЭГ и интероскопических исследований до и после операции. Р е з у л ь т а т ы . При поступлении проявление гипер тензионного синдрома установлено у 11, гидроцефалия В последние годы особое внимание уделяется роли ци токинов, интерферонов и других биологически активных факторов в регуляции процессов апоптоза и механизмов цитотоксичности при опухолях глиального ряда (Castigli E. et al., 2000; Kawaguchi S. et al., 2000). Ранее было показано, что при ГБ имеется несколько путей апоптоза зрелых пе риферических цитокинсекретирующих иммуноцитов, опосредованных TNFα и INFγ (Чумаков В. А. с соавт., 2002). Вместе с тем часть из секретируемых ГБ факторов в условиях in vitro обладает иммуносупрессивными свойства ми, вызывая подавление продукции IL6 и IL10 при од новременном увеличени синтеза IL1β, IL12, TNFα и INFγ (Sasaki A. et al., 1995; Zou J. P. et al., 1999; Castigli E. et al., 2000). Показано также участие ряда онкомаркеров в контроле апоптотических процессов в ткани опухолей гли ального ряда (Биктимиров Р. Г. с соавт., 1991; Kuramitsu M. et al., 1986; Cras P. et al., 1988; Li Y. J. et al., 1998). Целью работы являлось сравнительное исследование содержания в образцах крови больных с ГБ наиболее из вестных онкомаркеров и цитокинов, предположительно участвующих в регуляции апоптоза и контроле опухоле вой прогрессии. Материалы и методы исследования. Образцы сыворо ток крови больных с ГБ (n=28) были получены из отделе III ñúåçä íåéðîõèðóðãîâ Ðîññèè 172 Íåéðîîíêîëîãèÿ ния нейрохирургии МОНИКИ. Возраст больных 3060 лет, длительность заболевания – 26 мес. Содержание в крови онкомаркеров NSE, CEA и AFP, интерферонов INFγ и INFα, а также TNFα, а также интерлейкинов IL4, IL6, IL10 и IL12 изучали методом ИФА. Результаты исследований. Ранее показано, что для ГБ характерно существование по меньшей мере двух иммуно логических фенотипов – I с картиной выраженного иммуно дефицита и II – без такового (Чумаков В. А. с соавт., 2002). У больных с фенотипом I в сыворотке крови выявилось достоверное (в 210 раз) снижение продукции TNFα, INF α и INFγ, а также IL12. В 36 раз по сравнению с конт рольной группой возрастала продукция IL4, IL6 и IL10. У больных с фенотипом II показатели TNFα и интер феронов практически не отличались от уровня здоровых доноров. Аналогичные данные получены в отношении продукции всех изученных интерлейкинов. Интересно, что у больных с иммунофенотипом I на фоне выраженного иммунодефицита значительно подав лена естественная цитотоксичность (ЕЦТ), которая явля ется независимым от HLAкомплекса механизмом про тивоопухолевой защиты. У этих больных уровень апоп тоза зрелых иммуноцитов весьма высокий (Чумаков В. А. с соавт., 2002). При этом обнаруживают два вида корре лятивной зависимости с показателями цитокиновой про дукции: между степенью выраженности иммунодефици та с одной стороны и содержанием IL4, IL6 и IL10, с другой; между апоптотической активностью зрелых иммуноцитов периферической крови с одной стороны и содержанием IL4, IL6 и ILы10. При дальнейших исследованиях будут установлены ос новные иммунофенотипические особенности и клинико иммунологические критерии ГБ, что будет положено в ос нову классификации нейроглиальных опухолей и разработ ку показаний для назначения иммунофармакотерапии. ÌÅÒÎÄÈÊÀ ÂÑÊÐÛÒÈß ÏÅÐÅÄÍÅÉ ÑÒÅÍÊÈ ÎÑÍÎÂÍÎÉ ÏÀÇÓÕÈ È ÄÍÀ ÒÓÐÅÖÊÎÃÎ ÑÅÄËÀ Ñ ÈÑÏÎËÜÇÎÂÀÍÈÅÌ ÓËÜÒÐÀÇÂÓÊÎÂÎÃÎ ÀÏÏÀÐÀÒÀ Øàõîâ À. Â., Ðîãîæêèí Ñ. Á., Ðåõàëîâ À. Ô., Ìåäÿíèê È. À., Ïîëþøêîâ À. Þ. Îáëàñòíàÿ êëèíè÷åñêàÿ áîëüíèöà èì. Í. À. Ñåìàøêî, Íèæíèé Íîâãîðîä С учетом тенденции развития нейрохирургии к мини мально инвазивным технологиям в последнее время бо лее широкое распространение получает эндоназально транссептальнотранссфеноидальный доступ при удале нии опухолей гипофиза. Одним из наиболее сложных этапов указанной опера ции является вскрытие основной пазухи и полости турец кого седла. Это связано с наличием близко расположен ных важных сосудистых образований, ограничением пло щади операционного поля, его глубиной. Обычно для вскрытия передней стенки основной па зухи используют специальный узкий желобоватый зонд или фрезу, затем отверстие расширяется пистолетными кусачками. Это не позволяет осуществить поэтапную, постоянно визуально контролируемую трепанацию. В нашем отделении при вскрытии передней стенки ос новной пазухи используется аппарат ультразвуковой мик ронейрохирургический УЗХ модель 9111МНМЕДЭЛ (производство НПО «Медицинская электроника», Ниж ний Новгород). Рабочий наконечник представлен длин ной, тонкой насадкой в виде микроскальпеля L=110 мм. При помощи такого инструмента нейрохирург как бы «разрезает» кость, контролируя свои действия под 2025 кратным оптическим увеличением. Для аспирации обра зующихся дымообразных продуктов дополнительно ис пользовали аспиратор мощностью 3 атмосферы. Ампли туда ультразвуковых колебаний, в зависимости от струк туры и плотности кости, колебалась от 80 до 100% от мак симальной величины (не менее 70 мкм). С использованием указанной методики проопериро вано 56 больных с аденомами гипофиза. Использование тонкой насадки с одновременной аспирацией образую щихся дымообразных продуктов обеспечивает постоян ный визуальный контроль проводимых манипуляций, позволяет осуществлять дозированную резекцию кости. В результате повышается безопасность операции и сокра щается время доступа к аденоме гипофиза. Осложнений, связанных с применением указанного способа вскрытия передней стенки основной пазухи и дна турецкого седла, не было. ÐÅÇÓËÜÒÀÒÛ ÌÈÊÐÎÕÈÐÓÐÃÈ×ÅÑÊÎÃÎ ËÅ×ÅÍÈß ÎÏÓÕÎËÅÉ ÑÏÈÍÍÎÃÎ ÌÎÇÃÀ. 10-ËÅÒÍÈÉ ÎÏÛÒ Øåâåëåâ È. Í., Ìûøêèí Î. À., Òèññåí Ò. Ï. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà В спинальном отделении НИИ нейрохирургии имени Н. Н. Бурденко с 1992 года по декабрь 2001 года было опе рировано 370 пациентов с опухолями спинного мозга. Анализируются катамнестические данные по следую щим категориям опухолей: интрамедуллярные опухоли, экстрамедуллярные опухоли, исходящие из оболочек и корешков, экстрадуральные опухоли, оказывающие выра женное компремирующее воздействие на спинной мозг, но не являющиеся опухолями костей позвоночника. Оценивается качество хирургического удаления опухо ли, частота продолженного роста и рецидивов, частота осложнений и летальных исходов по различным катего риям опухолей. Тотальность резекции определялась по отсутствию опухоли на послеоперационных МРТ в дина мике и впечатлению хирурга о максимально тотальном удалении. Проводится попытка оценки возможности ка чественного образа жизни в зависимости от давности за болевания, распространенности опухоли и объема опера тивного вмешательства. Отмечены основные методики и проводится оценка влияния их на различные категории опухолей спинного мозга. Прежде всего это использование операционного микроскопа и развитие микрохирургической техники. Оценивается введение в хирургическую практику комби нированных вмешательств с одномоментной стабилиза цией скомпрометированных сегментов. Рассмотрено вли яние методик мониторирования проводящих путей спин ного мозга. Анализируется использование ультразвуково го отсоса при резекции опухолей. Рассмотрены перспективы совершенствования опера ционной техники. ÊËÈÍÈÊÎ-ÐÅÍÒÃÅÍÎËÎÃÈ×ÅÑÊÀß ÕÀÐÀÊÒÅÐÈÑÒÈÊÀ ÌÅÍÈÍÃÈÎÌ ÌÎÇÆÅ×ÊÎÂÎÃÎ ÍÀÌÅÒÀ Øåëåñêî À. À., Ìàõìóäîâ Ó. Á., Êîðíèåíêî Â. Í., Äåäåãêàåâ À. Â. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Менингиомы мозжечкового намета представляют со бой сравнительно небольшую группу опухолей, развива ющихся из менинготелиальных элементов арахноидаль ной оболочки, прилегающей к намету. Доля тенториаль 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 173 Íåéðîîíêîëîãèÿ ных менингиом среди всех церебральных менингиом со ставляет 25%, по данным разных авторов, что составляет до 22% менингиом задней черепной ямки. В зависимости от направления роста тенториальные менингиомы могут проявлять себя как симптомами по ражения мозжечка, структур мостомозжечкового угла, ствола головного мозга, так и нарушением функции зри тельных центров затылочных долей. Методом радикального лечения тенториальных менин гиом является тотальное хирургическое удаление с резек цией участка мозжечкового намета, являющегося зоной исходного роста опухоли. В случае, если опухоль растет только под или над наметом и нет инфильтрации тенто риальной твердой мозговой оболочки, возможно удале ние опухоли без указанной резекции. При локализации зоны исходного роста менингиомы в области венозных синусов тотальное удаление опухоли часто невозможно. Необходимость обнаружения зоны роста на операции диктуется тем, что в случае ее сохранения обеспечен про долженный рост опухоли. За период с 1990 г. по 2001 г. в НИИ нейрохирургии им. Н. Н. Бурденко 207 больных с менингиомами намета мозжечка подверглись оперативному лечению, из них 157 пациентов – женщины. 80% больных составили возраст ную группу от 30 до 60 лет, причем почти треть больных (31%) – лица в возрасте от 40 до 50 лет. Доля больных с субтенториально расположенными опухолями составила 23%, с супратенториальными менингиомами – 19%, у большей части больных (58%) опухоль распространялась как суб, так и супратенториально. Всем больным до операции выполнена компьютерная томография (КТ), в 32% случаев дополнительно прово дилась магнитнорезонансная томография (МРТ). В 23% случаев КТ и МРТ дополнялись ангиографическими ис следованиями. 60% опухолей удалены радикально, в 26% случаев произведено субтотальное удаление, в 12% – час тичное, в 2% случаев хирургическое лечение ограничено выполнением ликворошунтирующей операции. На осно вании сравнительного анализа клинических и рентгено логических данных нами определены диагностические критерии менингиом намета мозжечка, выделены веду щие клиникорентгенологические синдромы заболева ния, уточнены показания к операции и к выбору хирур гического доступа. ÈÍÔÐÀÊÐÀÑÍÎÅ ÊÀÐÒÈÐÎÂÀÍÈÅ ÏÅÐÈÔÎÊÀËÜÍÎÉ ÇÎÍÛ ÏÐÈ ÓÄÀËÅÍÈÈ ÎÏÓÕÎËÅÉ ÁÎËÜØÈÕ ÏÎËÓØÀÐÈÉ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Øåëóäÿêîâ À. Þ., Êðàâåö Ë. ß., Êîëåñîâ Ñ. Í., Âîëîâèê Ì. Ã. ÍÈÈ òðàâìàòîëîãèè è îðòîïåäèè, Íèæíèé Íîâãîðîä На основе известных преимуществ неинвазивного теп ловизионного (ТВ) исследования в визуализации сосуди стых реакций мозга при удалении опухолей представляем новые возможности, которые дает количественная обра ботка тепловизионного образа. Эти возможности связа ны прежде всего с детализацией пространственнотемпе ратурных характеристик в проекции очага, в его перифо кальной зоне и на отдалении. М а т е р и а л ы и м е т о д ы . ТВ обследования выпол нены нами во время оперативных вмешательств у 37 боль ных с опухолями мозга. Среди них с менингиомами было 12 (парасагиттальными – 6, конвекситальными – 3, ба зальными – 3), с глиомами – 25 (глиобластомами – 9, анапластическими астроцитомами – 11, астроцитомами – 5). Исследования производились на портативной ТВ ка мере Agema470 с термоэлектрическим охлаждением при емника, встроенным дисководом и питанием от перенос ного блока или от сетевого адаптера. Длительность одно кратного измерения обычно не превышала 3040 с. На основе полученных тепловизионных данных, ис пользуя стандартную программу Microsoft Excel, форми ровался пространственный образ локального участка гра ницы мозга и опухоли. Р е з у л ь т а т ы и о б с у ж д е н и е . Образный анализ тепловизионных данных позволил выделить некоторые особенности пространственного, исходного распределе ния температур на границе патологического процесса и перифокальной зоны мозга. Отмечено три вида простран ственного температурного распределения: 1. Плавный – характеризуется плавным пространствен ным переходом из плоскости пониженного термосвече ния в плоскость нормального температурного свечения мозга. 2. Пикообразный – характеризуется образованием по вышенного температурного пика на границе перифокаль ной зоны патологического очага. 3. Реверсивный – характеризуется переходом из плос кости повышенного термосвечения патологического процесса в плоскость нормального термосвечения коры мозга. Выделенные типы пространственных температурных распределений пограничной зоны могут косвенно указы вать на характер патологического процесса в плане его ме таболической и сосудистой активности. Так, плавный тип пространственного температурного распределения погра ничной зоны характерен для глиальных опухолей с отно сительно низкой активностью митотического деления (ас троцитомы I и II степени). Реверсивный тип, напротив, более характерен для злокачественного патологического процесса и особенно широко присутствует при глиоблас томах. Операционное поле при продолженном росте гли альных опухолей в тепловизионном изображении имеет в целом высокий порог температурного минимума; при этом нечеткость температурной границы на фоне термоактив ного патологического очага и высокой температуры окру жающих мозговых структур говорит об особом энергети ческом уровне. Пикообразный тип пространственного тем пературного распределения характерен для патологическо го процесса, имеющего визуально четкую границу между мозгом и опухолью. На наш взгляд, существуют два меха низма формирования пикообразного типа пространствен ного температурного распределения. Первый вариант ха рактерен для доброкачественной опухоли – менингиомы, врастающей в мозговую ткань и вызывающей оттеснение сосудистых структур коры мозга по границе опухоли. Вто рой вариант пикообразного типа пространственного тем пературного распределения – формирование зоны повы шенной микроциркуляции и, возможно, усиления локаль ного метаболизма. Это отмечено при глиомах с визуально дифферентной границей и признаками «капсулы опухоли». Методом лазерной допплеровской флуометрии подтверж ден факт повышения микроциркуляции в зоне пика про странственного температурного распределения. Однако температурный уровень данной зоны обусловлен не толь ко усилением микроциркуляции. Повидимому, необхо димо исследовать метаболическую активность зоны пика пространственного температурного распределения. Таким образом, пространственная количественная оценка границы патологического очага уточняет его ха рактер и способствует оптимизации хирургической так тики. III ñúåçä íåéðîõèðóðãîâ Ðîññèè 174 Íåéðîîíêîëîãèÿ ÒÀÊÒÈÊÀ ÕÈÐÓÐÃÈ×ÅÑÊÎÃÎ ËÅ×ÅÍÈß ÎÏÓÕÎËÅÉ ÎÑÍÎÂÀÍÈß ÇÀÄÍÅÉ ×ÅÐÅÏÍÎÉ ßÌÊÈ, ÐÀÑÏÐÎÑÒÐÀÍßÞÙÈÕÑß ÑÓÏÐÀÒÅÍÒÎÐÈÀËÜÍÎ Øèìàíñêèé Â. Í., Ìàõìóäîâ Ó. Á., Ìóðóñèäçå Í. À., Ñèäîðêèí Ä. Â., Òàéëàêîâ Ø. Ò. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà Опухоли основания черепа, располагающиеся на осно вании задней черепной ямке и распространяющиеся суп ратенториально, относятся к одним из самых труднодос тупных новообразований в нейрохирургической практи ке. Сложность их удаления обусловлена как глубинным расположение, так и вовлечением в патологический про цесс магистральных сосудов и черепномозговых нервов. Среди рассматриваемых опухолей наиболее часто встре чаемыми являются менингиомы, невриномы тройнично го нерва, хордомы. Определение критериев, позволяющих оптимизировать тактику хирургического лечения этих опухолей, в первую очередь для выбора оперативного до ступа, явилось целью нашей работы. С 1997 по 2001 год включительно 108 пациентов с опу холями основания задней черепной ямки, распространя ющимися супратенториально, было оперировано в 5 ней роонкологическом отделении НИИ Нейрохирургии им. Н. Н. Бурденко РАМН. Компьютерная и магнитнорезо нансная томографии были основными исследованиями в диагностическом комплексе. Ангиография (прямая, магнитнорезонансная) позволяла определить источник и степень кровоснабжения опухоли, отношение опухоли к мозговым сосудам, так как от этого зависела радикаль ность удаления опухоли. Пресигмовидный, ретросигмовидный, комбинирован ный супрасубтенториальный, передний транспирамид ный и подвисочный с резекцией скуловой дуги доступы для одномоментного удаления опухоли были использо ваны. В 15 процентов случаев мы использовали двухэтап ное хирургическое лечение. При этом первым этапом было удаление супратенториальной части опухоли. Соот ношение между классическими и базальными доступами было равномерное – 1:1. Выбор оперативного доступа основывался на изучении многих факторов. К ним относятся место исходного рос та, ее распространение, предполагаемая гистологическая природа и возможная консистенция опухоли. Радикаль ность удаления опухоли зависела от степени инвазии опу холью сосудов основания черепа. Наше исследование показывает, что правильный вы бор оперативного доступа позволяет радикально удалить опухоль с достижением высокого уровня индекса Карнов ского в послеоперационном периоде. ÌÈÍÈÌÀËÜÍÎ-ÈÍÂÀÇÈÂÍÀß È ÝÍÄÎÑÊÎÏÈ×ÅÑÊÀß ÕÈÐÓÐÃÈß ÎÏÓÕÎËÅÉ ÎÑÍÎÂÀÍÈß ×ÅÐÅÏÀ Ñ ÈÑÏÎËÜÇÎÂÀÍÈÅÌ ÒÐÀÍÑÑÔÅÍÎÈÄÀËÜÍÎÃÎ, ÒÐÀÍÑÎÐÀËÜÍÎÃÎ ÄÎÑÒÓÏÎÂ È ÈÕ ÑÎ×ÅÒÀÍÈÉ Øêàðóáî À. Í. Èíñòèòóò íåéðîõèðóðãèè èì. Í. Í. Áóðäåíêî ÐÀÌÍ, Ìîñêâà В в е д е н и е . Для удаления опухолей передних отделов основания черепа используются различные транскрани альные доступы, включая расширенные транскраниаль нотрансфациальные. Применение в аналогичных ситу ациях экстракраниальных доступов (транссфеноидально го и/или трансорального) с использованием естественных анатомических ходов можно считать минимальноинва зивными вмешательствами, однако осложняющим мо ментом являются глубина и узость раны. Эта проблема решается внедрением интраоперационного эндоскопи ческого контроля – новой, перспективной технологии в нейрохирургии. Минимальная инвазивность такого ме тода все шире привлекает нейрохирургов в связи с повы шением эффективности операций, снижением интра и послеоперационных осложнений, а в конечном счете – уменьшением стоимости лечения. С 1995 г. нами исполь зуется интраоперационный эндоскопический контроль при транссфеноидальном удалении опухолей основания черепа. М а т е р и а л и м е т о д ы . С использованием различ ных экстракраниальных доступов нами оперировано 89 пациентов в возрасте от 8 до 68 лет. Использованы ориги нальные, запатентованные инструменты, устройства и способы хирургического лечения. 75 пациентов опериро ваны транссфеноидальным доступом с использованием интраоперационного эндоскопического контроля: 59 – с аденомами гипофиза (5 – эндоселлярной локализации, 54 – эндоэкстраселлярной локализации), 9 – с эндоэкст раселлярными краниофарингиомами, 3 – с хордомой ос нования черепа, 1 – с гигантской лимфомой основания черепа, 1 – с плазмоцитомой основания черепа, 1 – с плос коклеточным раком, 1 – с низкодифференцированным раком. Эндоскопический контроль производился ригид ными эндоскопами фирмы «Stryker» с наружным диамет ром 2,7 и 4 мм и оптикой 30 и 70 град., «Karl Storz» с на ружным диаметром 2 мм и оптикой 30 град., а также фиб роэндоскопом «Olympus» с наружным диаметром 5 мм. 10 пациентов с хордомами оперированы трансоральным до ступом, 3 с хордомами оперированы комбинированным: трансназальным и трансоральным доступом, 1 с распрос траненной хордомой основания черепа произведена од номоментная стабилизация краниовертебрального сочле нения и трансоральное удаление опухоли. При операци ях с трансоральным или комбинированным доступами в связи с хорошим обзором операционного поля не потре бовалось использования интраоперационного эндоско пического контроля. После удаления опухоли в 20 случа ях производилась герметизация и пластика основания черепа по оригинальной методике, позволяющей предот вращать послеоперационную ликворею. Р е з у л ь т а т ы и о б с у ж д е н и е . Определены показа ния, противопоказания для трансcфеноидального, трансорального доступов и их комбинации. Разработаны методические приемы эндоскопического контроля при удалении опухолей основания черепа с использованием транссфеноидального доступа (75 пациентов). Эндоско пическая техника позволяет: визуализировать опухолевую ткань супралатеросел лярной локализации, невидимую при прямолинейным обзоре операционного поля через микроскоп и удалять опухоль под непосредственным эндоскопическим конт ролем, визуализировать здоровую ткань гипофиза и ее взаи моотношение с опухолью, снизить операционную травму гипофиза, уменьшить число гипопитуитарных осложнений в послеоперацион ном периоде (лишь в 2 случаях отмечены явления прехо дящего несахарного диабета), миниминизировать вероятность развития интраопе рационной ликвореи (в последующем – возможной пос леоперационной ликвореи) за счет более деликатных, контролируемых зрением манипуляций на капсуле опу холи. Интраоперационная ликворея отмечена в 1 случае (1,35%), послеоперационной ликвореи не было, 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 175 Íåéðîîíêîëîãèÿ улучшить качество оперативного лечения: зрение улучшилось у 95,1% больных, без изменения – 4,9%, повысить радикальность операции, во всех случаях (по данным контрольных КТ и МРТ) опухоли были удалены радикально. Рецидивы отмечены у 4 больных (5,3%) (2 – краниофарингиомы, 2 – хордомы) в сроки от 2 до 4 лет. Летальных исходов не было. У 14 пациентов с хордомами, оперированных трансо ральным или комбинированным доступами, в 50% наблю дений опухоли удалены тотально и субтотально, в 50% – частично (всем больным проведены контрольные МРТ и/ или КТ). Регресс клинических симптомов заболевания наблюдался у всех больных. Послеоперационной ликво реи не отмечено, 2 больных оперированы повторно в сро ки от 1,5 до 2,5 лет. З а к л ю ч е н и е . Использование новых технологий в минимальноинвазивной хирургии опухолей основания черепа позволяет оптимизировать хирургическую техни ку, повысить качество лечения больных, улучшить резуль таты хирургического лечения, уменьшить количество ин тра и послеоперационных осложнений, расширить по казания к применению малотравматичных доступов в хи рургии опухолей основания черепа. Необходимо дальней шее развитие этой проблемы и совершенствование хирур гической техники и методики оперативного лечения. ÕÈÐÓÐÃÈ×ÅÑÊÎÅ ËÅ×ÅÍÈÅ ÌÅÍÈÍÃÈÎÌ ÊÐÀÍÈÎÎÐÁÈÒÎÔÀÖÈÀËÜÍÎÉ ËÎÊÀËÈÇÀÖÈÈ Øóãîëü Î. Ì., Ñàêîâè÷ Â. Ï., Àáäóëêåðèìîâ Õ. Ò., Êåñåëüìàí Ì. Ï., Õàéìóíè Â. Ô. Óðàëüñêèé ìåæîáëàñòíîé íåéðîõèðóðãè÷åñêèé öåíòð èì. ïðîô. Ä. Ã. Øåôåðà, ÑÎÎÄ ÌÍÏÖ «Îíêîëîãèÿ», ÃÊÁ ¹ 40, Åêàòåðèíáóðã Нами накоплен опыт хирургического лечения 52 боль ных с объемными процессами краниоорбитофациальной локализации. Среди них самую большую группу состави ли пациенты с менингиомами (29 человек, 56%). В основ ном этому заболеванию подвержены женщины в возрас те 4060 лет (23 пациентки – 79%). Краниоорбитальная локализация опухоли отмечена у 34 больных (из них у 5 были менингиомы зрительного нерва), орбитофациаль ная – у 7, краниоорбитофациальная – у 10. По гистоло гическому строению преобладали различные варианты доброкачественных менингиом (22 больных – 76%), у ос тальных – (7 пациентов – 24%) – анапластические менин гиомы. Наиболее ранними клиническими признаками менин гиом были односторонний экзофтальм с интерметтиру ющим отеком век и незначительное ограничение подвиж ности глазного яблока. Выраженного нарушения зритель ных функций на ранних стадиях заболевания не проис ходило. Больные обращались за помощью в среднем че рез 35 лет после появления первых симптомов. Все больные подверглись неврологическому и офталь мологическому обследованиям. Однако основными ме тодами диагностики были КТ, МРТ и, по показаниям, ка ротидная ангиография. Современные методы лучевой диагностики дают точное представление о преимуще ственной локализации опухоли, характере ее роста и вза имоотношениях с прилежащими структурами. Это позво ляет планировать хирургический доступ и степень резек ции пораженных структур. Были использованы следую щие доступы: фронтоорбитальный, дополняемый в ряде случаев временной резекцией верхнего края орбиты (8), лобновисочный (14), птериональный (1), бифронтоэтмо идоорбитальный (1), комбинированный – сочетание од ного из указанных интракраниальных доступов с лицевым подходом по Муру (5). Всего 29 больным было произведено 38 операций. 20 пациентов были прооперированы один раз, 5 – дважды, 2 больных – 4 раза. При этом из 8 пациентов, нуждающих ся в повторной операции, 6 первично оперировались в других лечебных учреждениях и имели признаки продол женного роста опухоли или отсутствие положительного эффекта после частичного ее удаления. Из 2 пациенток, первично прооперированных нами, повторное вмеша тельство проведено у одной больной ввиду продолженного роста образования (через 5 лет), у второй – ввиду невоз можности одномоментного удаления опухоли вследствие значительного ее распространения. Всем больным проводились контрольные МРТ (КТ) исследования в сроки от 2 недель до 6 месяцев, 20 паци ентам повторно – через год, с положительными результа тами. Срок наблюдения за больными составил от 6 месяцев до 5 лет. При оценке эффективности хирургического ле чения, критериями являлись радикальность и клиничес кий эффект. Тотальное удаление опухоли отмечено у 19 больных, субтотальное – у 10. Основной причиной непол ного удаления опухоли было прорастание ею важных ин тракраниальных образований (внутренней сонной арте рии, кавернозного синуса, структур верхней глазничной щели), повреждение которых при тотальном удалении могло бы привести к значительному неврологическому дефициту. Осложнения возникли у 2 больных. В одном случае возник эпидуральный абсцесс, потребовавший дрениро вания и удаления костного лоскута. У другой пациентки развился ишемический инсульт. Различная степень опущения верхнего века и глазо двигательных нарушений была у всех больных после опе рации. Подвижность глазного яблока восстанавливалась к моменту выписки, а различная степень птоза регресси ровала в сроки от 3 до 6 месяцев. Во всех наблюдениях после операции отмечалось значительное уменьшение экзофтальма, а к 6 месяцам – полное его исчезновение. У 3 больных после обширной резекции костей основания черепа выявлялась назальная ликворея. У 2 из них она купирована люмбальными пункциями в течение несколь ких дней, одному больному был наложен люмбоперито неальный шунт. Летальных исходов не было. Выводы. 1. Результаты хирургического лечения краниоорбито фациальных менингиом зависят от стадии развития забо левания, величины и преимущественного направления роста опухоли. 2. Операции по удалению менингиом являются обяза тельными независимо от стадии процесса. При распрост ранении процесса в кавернозный синус или обрастании магистральных сосудов удаление опухоли возможно толь ко субтотально. ÌÅÍÈÍÃÈÎÌÛ ÊÐÀÍÈÎÎÐÁÈÒÎÔÀÖÈÀËÜÍÎÉ ËÎÊÀËÈÇÀÖÈÈ (ÏÐÈ×ÈÍÛ, ÎÁÓÑËÎÂËÈÂÀÞÙÈÅ ÏÎÂÒÎÐÍÛÅ ÎÏÅÐÀÖÈÈ) Øóãîëü Î. Ì., Ñàêîâè÷ Â. Ï., Áåíåäèêòîâ À. È. Óðàëüñêèé ìåæîáëàñòíîé íåéðîõèðóðãè÷åñêèé öåíòð èì. ïðîô. Ä. Ã. Øåôåðà, ÑÎÎÄ ÌÍÏÖ «Îíêîëîãèÿ», Åêàòåðèíáóðã Хирургическое лечение менингиом крыльев основной кости, распространяющихся в орбиту, околоносовые па зухи представляет собой трудную задачу ввиду возможного конфликта при операции с сосудами и черепными нерва III ñúåçä íåéðîõèðóðãîâ Ðîññèè 176 Íåéðîîíêîëîãèÿ ми на основании мозга, необходимостью закрытия дефек тов основания черепа для предотвращения базальной лик ворреи. В то же время излишне щадящее отношение к явно измененным костным структурам является одной из причин нерадикальности оперативного вмешательства и как следствие – продолженный рост опухоли и необхо димость выполнения повторных вмешательств. В настоящей работе сделана попытка выяснения бо лее детальных причин, обусловивших продолженный рост опухоли, а также дана оценка результатам повторных опе раций. С 1995 по 2001 год в нашей клинике были опери рованы 24 больных с менингиомами краниоорбитофаци альной локализации с различной степенью заинтересо ванности костных структур мозгового и лицевого черепа (крылья основной кости, крыша орбиты, лобная, решет чатая кости, скуловая дуга). Опухоли распространялись в кавернозный синус, крылонебную ямку, околоносовые пазухи, полость носа. Среди оперированных больных пре обладали женщины. Пациенты были в возрасте от 40 до 60 лет. Из 24 пациентов повторные операции, ввиду продол женного роста опухоли, были выполнены у 8 больных (33%). Эти 8 пациентов перенесли в общей сложности 24 операции – у 2 больных было 2 операции, у 4 больных – 3, у 2 пациентов – 4 операции. 6 человек ранее были опери рованы в других лечебных учреждениях, и только у 2 боль ных первичное оперативное вмешательство было выпол нено в нашей клинике. Во всех случаях причиной про долженного роста опухоли послужило неполное ее удале ние при первичных операциях. У 5 больных при первой операции было выполнено частичное или субтотальное удаление опухоли при воз можности ее тотального удаления. Как правило, это па циенты, у которых при первичной операции удалялась лишь мягкотканная узловая часть опухоли и не резици ровались в достаточном объеме гиперостотически изме ненные костные структуры и не удалялась орбитальная и фациальная части опухоли. У этих же больных недо статочно верно трактовались данные методов лучевой диагностики. При завершающей операции удалось пол ностью убрать мягкотканный компонент опухоли и ре зецировать пораженные костные структуры до «здоро вых отделов». За время наблюдения с применением ме тодов КТ и МРТ признаков продолженного роста не об наружено. У 3 больных первично было выполнено частичное уда ление опухоли при возможности субтотального удаления. Это пациенты, у которых тотальное удаление опухоли было невозможно изза прорастания структур каверноз ного синуса, но объем резекции опухоли был явно недо статочен, и рано возникал продолженный рост опухоли. При завершающей операции были выполнены обширные резекции костей основания черепа и лицевого скелета с оставлением части опухоли в области кавернозного сину са. При наблюдении в течение 4 лет у 2 больных отмечен продолженный рост опухоли без углубления неврологи ческой симптоматики. Таким образом, хирургическое лечение больных с ги перостотическими менингиомами краниоорбитофаци альной локализации должно проводиться в специализи рованном нейрохирургическом учреждении, в котором возможно проведение всего комплекса диагностических (КТ, МРТ, ангиография), хирургических и лечебных ме роприятий, при необходимости с привлечением специа листов смежных специальностей. Удаление опухоли дол жно быть выполнено по возможности одномоментно и максимально радикально. ÎÑÎÁÅÍÍÎÑÒÈ ÊËÈÍÈ×ÅÑÊÎÉ ÊÀÐÒÈÍÛ ÎÏÓÕÎËÅÉ ÑÒÂÎËÀ ÃÎËÎÂÍÎÃÎ ÌÎÇÃÀ Ñ ÑÎÑÓÄÈÑÒÛÌ ÒÈÏÎÌ ÒÅ×ÅÍÈß Øóëåøîâà Í. Â. Ãîñóäàðñòâåííûé ìåäèöèíñêèé Óíèâåðñèòåò èì. àêàä. È. Ï. Ïàâëîâà, Ñàíêò-Ïåòåðáóðã В в е д е н и е . В последние десятилетия значительно вырос интерес к опухолям стволовой локализации, что связано как с улучшением диагностики, так и с успехами их хирургического лечения. Опухоли ствола мозга встре чаются в 520% среди всех церебральных опухолей, в зна чительной степени преобладая у детского контингента больных. Однако несмотря на улучшение диагностичес ких возможностей, нередко возникают сложности в ди агностике опухолей ствола мозга изза полиморфизма их клинического проявления. М е т о д ы . Проанализировано 190 наблюдений над больными с внутри и околостволовыми опухолями и 37 с сосудистыми поражениями ствола мозга. В диагности ке применялись такие методы исследования, как невро логический осмотр в динамике болезни, осмотр глазного дна, ЭЭГ, КТ и (или) МРТ головного мозга, транскрани альная ультрасонография (у детей), допплерография со судов мозга и др. Р е з у л ь т а т ы . Сосудистый тип течения опухолей ство ла встречался наиболее часто у взрослых (23,8%) по срав нению с детьми (5,6%). Он более характерен для опухо лей глиального ряда, менее – для менингососудистого. Этот вариант проявлялся острым развитием очаговых не врологических симптомов, иногда на фоне повышения АД и «сосудистых» головных болей. Это связано с крово излиянием в ткань опухоли или резким увеличением ки стозного содержимого опухоли. В последующем обычно полного регресса очаговых симптомов не возникает, а в динамике возможно возникновение нескольких подоб ных «сосудистых» эпизодов в одном и том же сосудистом бассейне с распространением на близкие по расположе нию зоны ствола мозга. Редко возможен прорыв крови в ликворосодержащие пространства вследствие разрыва микроаневризм из измененных сосудов опухоли. Диффе ренциальный диагноз следует проводить с ишемически ми и геморрагическими поражениями ствола мозга, ба зальными гигантскими артериальными аневризмами и ар териовенозными стволовыми мальформациями. З а к л ю ч е н и е . Опухоли ствола мозга в 5,623,8% слу чаев могут протекать инсультообразно, симулируя сосу дистую «катастрофу» в вертебральнобазилярном бассей не. В диагностике помогают анализ развития симптомов в динамике заболевания и данные дополнительных мето дов исследования, в частности, КТ, МРТ головного моз га и МРангиография. ÍÅÊÎÒÎÐÛÅ ÀÑÏÅÊÒÛ ÄÈÀÃÍÎÑÒÈÊÈ ÏÀÐÀÍÅÎÏËÀÑÒÈ×ÅÑÊÈÕ ÍÅÂÐÎËÎÃÈ×ÅÑÊÈÕ ÑÈÍÄÐÎÌΠØóëåøîâà Í. Â., Ëàïèí Ñ. Â., Òîòîëÿí À. À., Êàçàêîâ Â. Ì., Ñêîðîìåö À. À. Ãîñóäàðñòâåííûé ìåäèöèíñêèé óíèâåðñèòåò èì. àêàä. È. Ï. Ïàâëîâà, Ñàíêò-Ïåòåðáóðã В в е д е н и е . Известно, что паранеопластические син дромы и обнаруживаемые при них антитела возникают, как правило, задолго до выявления опухоли различной локализации. Антитела, обнаруживаемые при паранеоп ластических неврологических синдромах являются спе цифическими диагностическими маркерами наличия новообразования у больных с неврологической дисфун кцией. Идентификация органоспецифических аутоанти 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 177 Íåéðîîíêîëîãèÿ тел, циркулирующих в крови и спинномозговой жидко сти (СМЖ) больных, имеет огромную ценность в ранней диагностике опухоли. М е т о д ы . Помимо клинической диагностики паране опластического поражения нервной системы у больных с наличием в анамнезе диагностированной опухоли, элек трофизиологических методов (ЭМГ, ЭНМГ и др.), ис пользовался метод непрямой иммунофлюоресценции с применением тканей человека и лабораторных животных. Р е з у л ь т а т ы . Паранеопластические поражения – достаточно редкая патология, возникающая приблизи тельно у 6% больных злокачественными опухолями раз личной локализации. Нами наблюдалось 14 больных с различными неврологическими паранеопластическими поражениями при опухолях легких, молочной железы и яичников, ЖКТ, яичек и опухолях ствола мозга. Из 4х больных, обследованных иммуногистохимическим мето дом, у 2х были обнаружены аутоантитела (к клеткам Пур кинье при подострой паранеопластической дегенерации мозжечка и антинейрональные нуклеарные антитела при сенсомоторной паранеопластической миелополиневро патии). Клинически паранеопластические неврологичес кие синдромы отличаются значительным разнообразием, так как нервная и нервномышечная системы могут по ражаться на любом уровне. Отсутствие антител у больных с неврологическими симптомами, характерными для па ранеопластического процесса, не исключает присутствия опухоли. В то же время иногда выявляются высокие тит ры аутосомальных антител у больных с раком, но без не врологических симптомов. З а к л ю ч е н и е . Обнаружение в крови и СМЖ боль ных с различным неврологическим дефицитом органо специфических аутоантител методом иммуногистохимии свидетельствуют о наличии паранеопластического пора жения нервной или нервномышечной систем. Этот ме тод может считаться методом ранней диагностики опухо левого процесса. ÎÑÎÁÅÍÍÎÑÒÈ ÁÎÊÎÂÎÃÎ ÎÐÁÈÒÎÇÈÃÎÌÀÒÈ×ÅÑÊÎÃÎ ÒÐÀÍÑÑÔÅÍÎÈÄÀËÜÍÎÃÎ ÄÎÑÒÓÏÀ  ÇÀÂÈÑÈÌÎÑÒÈ ÎÒ ÄÀÍÍÛÕ ÊÐÀÍÈÎÌÅÒÐÈÈ Ùåðáèíèí À. Â., Ãîìàí Ï. Ã. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã Хирургическое лечение экстрадуральной опухоли об ласти ската является одной из сложных проблем хирур гии основания черепа. Для удаления новообразования данной локализации, ограниченной стенками клиновид ной пазухи и телом клиновидной кости, с 1988 года ус пешно используется трансбазальный доступ, описанный Derome. Однако при латеральном распространении нео плазм за пределы тела клиновидной кости данный доступ оказывается малоэффективным для удаления участков опухоли, распространяющихся в область подвисочной ямки. Для удаления этой части опухоли используют бо ковые доступы к наружному основанию черепа в качестве одного из этапов хирургического лечения. Целью работы является разработка практических рекомендаций для улучшения характеристик бокового орбитозигоматичес кого транссфеноидального доступа через подвисочную ямку к наружному основанию черепа в зоне средней че репной ямки и клиновидной пазухи. Работа выполнена на 20 трупах взрослых людей сред него и пожилого возраста. Методика состояла из общей краниометрии, проведения местных измерений, опреде ления локальных ориентиров при препарировании и вы полнении пробных доступов к наружному основанию че репа в зоне средней черепной ямки и клиновидной пазу хи. Параметры операционной раны определялись по мо дифицированному методу А. Ю. СозонЯрошевича. Про изводилась статистическая обработка полученных дан ных. Одной из задач исследования была разработка мало травматичных оперативных доступов к основанию сред ней черепной ямки из подвисочной ямки в зависимости от формы черепа. В результате проведенного сравнитель ного анализа для выполнения бокового орбитозигомати ческого транссфеноидального доступа можно рекомендо вать следующее сочетание стандартных и оригинальных действий. После костнопластической трепанации свода черепа проводилась мобилизация орбитозигоматического лоску та по методике AlMefty (1988) с отведением на питаю щей ножке из m. masseter. Это позволяло осуществить об нажение места прикрепления височной мышцы к венеч ному отростку нижней челюсти. Для обнажения наруж ной поверхности основания средней черепной ямки про изводили в ряде случаев резекцию коронарного отростка нижней челюсти с мобилизацией верхнечелюстной арте рии в подвисочной ямке и отведение костного лоскута на височной мышце кзади. Выделяли V2 и V3 ветви тройнич ных нервов в овальном и круглом отверстиях. Резекция основания крыловидного отростка между овальным и круглым отверстиями позволяла осуществить доступ в латеральный отдел клиновидной пазухи сразу над крыло видным каналом. Апертура такого доступа в среднем со ставляла 2х1,5 см, глубина обзора клиновидной пазухи достигала в среднем 3 см. Угол операционного действия, вне зависимости от особенностей строения подвисочной ямки, находился в пределах от 30 до 20°, глубина опера ционной раны от поверхности кожи до самой глубокой точки клиновидной пазухи достигала 1012 см, зона дос тупности в среднем не была более 3 кв. см. Для достиже ния указанных параметров была необходима тракция ви сочного полюса и нижней поверхности височной доли не более чем на 2 см от основания средней черепной ямки. Выявлено, что резекция венечного отростка нижней че люсти в ряде случаев не была показана изза достаточно го расстояния (более 2 см) между вершиной коронарного отростка и основанием средней черепной ямки (75% слу чаев). В остальных случаях при величине расстояния меж ду венечным отростком и основанием средней черепной ямки менее 2 см резекция данного отростка была необхо дима для достижения оптимальных параметров доступа. Для предоперационного прогнозирования необходимо сти резекции отростка нижней челюсти необходимы сле дующие действия: а) установление отношения уровня дна средней череп ной ямки к орбитозигоматической горизонтали (если дно средней черепной ямки находится на уровне орбитози гоматической горизонтали, то резекция венечного отро стка нецелесообразна); б) определение отношения длины задней ветви ниж ней челюсти к размерам ее горизонтальной части (при соотношении 1/1 – необходима резекция венечного от ростка, при соотношении 1/2 – выполнение подхода воз можно без резекции венечного отростка). Постоянными ориентирами для выполнения транс сфеноидальной части доступа являются контуры оваль ного и круглого отверстий. Остистое отверстие не являет ся надежным ориентиром для данного варианта доступа. Во всех случаях проводилась поднадкостничная резекция дна средней черепной ямки, что позволяло сохранить це III ñúåçä íåéðîõèðóðãîâ Ðîññèè 178 Íåéðîîíêîëîãèÿ лостность экстракраниальных ветвей нижнечелюстной ветви тройничного нерва. С учетом хода и топографии верхнечелюстной артерии наиболее безопасный уровень резекции венечного отростка нижней челюсти находил ся на расстоянии 1,5 см от его вершины. Данная методика обеспечивает достаточные парамет ры доступа и может быть использована для удаления ла терализованной части новообразования области тела кли новидной кости как отдельный хирургический прием, так и в сочетании с трансбазальным доступом. ÎÁÚÅÌ ÐÅÇÅÊÖÈÈ ÎÑÍÎÂÀÍÈß ×ÅÐÅÏÀ ÏÐÈ ÒÐÀÍÑÁÀÇÀËÜÍÎÌ ÄÎÑÒÓÏÅ Ñ Ó×ÅÒÎÌ ÄÀÍÍÛÕ ÕÈÐÓÐÃÈ×ÅÑÊÎÉ ÀÍÀÒÎÌÈÈ ÏÅÐÅÄÍÅÉ ×ÅÐÅÏÍÎÉ ßÌÊÈ Ùåðáèíèí À. Â., Ãóëÿåâ Ä. À. Ðîññèéñêèé íåéðîõèðóðãè÷åñêèé èíñòèòóò èì. ïðîô. À. Ë. Ïîëåíîâà, Ñàíêò-Ïåòåðáóðã Целью исследования является улучшение результатов хирургического лечения экстрадуральных опухолей обла сти ската. Для удаления новобразований данной локали зации мы используем трансбазальный доступ, описанный Derome в 1988 г. Одной из трудностей при этом доступе является определение границ необходимой резекции пе редней черепной ямки для максимально полной визуали зации опухоли в зависимости от данных хирургической анатомии. Неоправданно агрессивное расширение границ резекции основания черепа в области передней черепной ямки нежелательно как изза повышения травматичнос ти самого доступа, так и в связи с трудностями пластики дефекта основания черепа, увеличения риска гнойных осложнений в послеоперационном периоде. Тракция лоб ных долей при экстрадуральном подходе к бугорку турец кого седла должна быть максимально щадящей, но дос таточной для достижения необходимого угла операцион ного действия и обзора операционной раны. Для ответа на поставленные вопросы на секционном материале изучены 30 передних черепных ямок людей среднего возраста (мужчин 40%, женщин 60%). Работа проводилась на базе кафедры оперативной хирургии и топографической анатомии СПбГМУ им. акад. И. П. Пав лова. Были выделены 4 наиболее распространенных ва рианта строения передней черепной ямки. Критериями отбора являлось расположение относительно горизон тальной плоскости точек средней линии передней череп ной ямки: назиона, слепого отверстия, решетчатоклино видного шва и селлярной точки (основания бугорка ту рецкого седла). Наиболее частым (вариант 1) соотноше нием данных точек было такое, что назион и середина решетчатоклиновидного шва находились ниже горизон тальной плоскости между селлярной точкой и слепым отверстием (40%). В 10 случаях – 34% (вариант 2) назион и селлярная точка располагались ниже воображаемой ли нии между слепым отверстием и решетчатоклиновидным швом. В 16% все точки располагались приблизительно на одной линии (вариант 3). Наиболее редким вариантом строения в наших исследованиях (вариант 4) оказалась форма, при которой самой низкой точкой средней линии передней черепной ямки была середина решетчатокли новидного шва – 10%. После выполнении экстрадурального подхода к бугор ку турецкого седла величина необходимой тракции лоб ных долей для достижения максимально полного обзора тела клиновидной кости, по нашим данным, зависит от величины базилярного угла. Одной из сторон этого угла является линия, идущая от селлярной точки к базиону. В наших наблюдениях базилярный угол был ~150°. Мы до бивались, чтобы угол, образуемый базальной поверхнос тью лобных долей и линией от основания бугорка турец кого седла до базиона был близок к 175180°. При соблю дении данных параметров угол между базальной поверх ностью лобных долей и площадкой клиновидной кости был максимальным при 1 и 4 вариантах строения пере дней черепной ямки (4045°), и минимальным при 2 и 3 вариантах строения (3025°). Доступ к клиновидной па зухе и телу клиновидной кости выполнялся в соответствии с методикой, описанной Derome (1988). Угол операцион ного действия соответствовал углу подачи инструментов в вертикальной плоскости и во всех случаях ограничивался расстоянием между фиброзными кольцами интраканаль ных частей зрительных нервов ( (30). В ходе выполнения доступа оценивались объем возможной резекции тела ос новной кости, глубина операционной раны, площадь об нажаемой ТМО ската в зависимости от величины дефек та передней черепной ямки и угла обзора операционной раны. Выявлено, что при 1 и 4 вариантах строения пере дней черепной ямки, когда площадка клиновидной кос ти имеет наклон вперед, максимально полного обнаже ния ТМО ската и наибольшей глубины резекции тела кли новидной кости возможно достичь при таком расположе нии микроскопа, когда угол между площадкой клиновид ной кости и линией взора будет ~24°. При этом передней границей резекция основания черепа может быть решет чатоклиновидный шов. Формирование дополнительно го назоорбитального лоскута и расширение размеров ре зекции основания черепа в переднем направлении не при водят к улучшению параметров операционной раны (глу бина 6 см, угол операционного действия 30°, возможно обнажение до 70% площади ТМО ската), названных «оп тимальными». При 2 и 3 вариантах строения передней черепной ямки (площадка клиновидной кости имеет на клон в сторону турецкого седла или все точки расположе ны в одной плоскости) для достижения «оптимальных» параметров операционной раны всегда необходимо фор мирование дополнительного назоорбительного лоскута, а также расшиение передней границы резекции основа ния передней черепной ямки до середины решетчатой пластинки. При всех вариантах строения передней череп ной ямки, независимо от площади резекции основания черепа при выполнении трансбазального доступа, достичь обнажения ТМО ската более чем на 70% от его длины не представлялось возможным. Участок ТМО в области спинки турецкого седла всегда был скрыт за гипофизом. Представленные результаты могут оказаться полезны ми для рационального выполнения трансбазального дос тупа в зависимости от хирургической анатомии основа ния черепа. ÍÅÊÎÒÎÐÛÅ ÀÑÏÅÊÒÛ ÕÈÐÓÐÃÈ×ÅÑÊÎÃÎ ËÅ×ÅÍÈß ÎÏÓÕÎËÅÉ ÏÎÇÂÎÍÎ×ÍÈÊÀ  ÍÅÉÐÎÕÈÐÓÐÃÈ×ÅÑÊÎÉ ÊËÈÍÈÊÅ Þíäèí Â. È., Ãîðÿ÷åâ À. Â., Íóðæèêîâ Ñ. Ð., Ñàìñîíîâ Ê. Â. Ãîðîäñêàÿ êëèíè÷åñêàÿ áîëüíèöà ¹ 19, Ìîñêâà Выполнен анализ хирургического лечения 70 больных, находившихся в отделении спинномозговой нейрохирур гии с диагнозом объемного образования позвоночного канала, т. е. различными опухолями самого спинного моз га (экстра и интрамедуллярными), его корешков, пара вертебральными образованиями и опухолями тел позвон ков. Из этой группы у 26 больных (37,1%) компрессия спин ного мозга или его корешков была обусловлена первич ной или метастатической опухолью позвоночника. Из них: 11 больных с поражением шейного отдела позвоноч 4 – 8 èþíÿ 2002 ãîäà, Ñàíêò-Ïåòåðáóðã 179 Íåéðîîíêîëîãèÿ ника, 6 больных с поражением грудного отдела позвоноч ника и 9 больных с поражением поясничного отдела по звоночника. Первичные опухоли позвоночника были выявлены у 15 больных, метастатические – у 11 больных. Первичным очагом метастатических опухолей являлся рак почек, молочных желез, легких, яичников. В трех случаях метастазов первичный очаг не установлен. Средний воз раст больных 46 лет, 9 больных старше 60 лет. Мужчины – 17, женщины – 9. Доброкачественные опухоли выяв лены у 11 больных, из них остеокластобластома у 5 боль ных, остеоидостеома у 3 больных, гемангиома – у 2 боль ных, хондрома – у 1 больного. Среди злокачественных опухолей – 2 случая хондросаркомы и 2 случая саркомы. В диагностическом комплексе большое внимание мы уделяем неврологическому обследованию больных с це лью выявления компрессии спинного мозга или его ко решков. Определяется: наличие двигательных и чувстви тельных расстройств; изменение мышечного тонуса; из менение рефлекторных функций; нарушение функций тазовых органов. Параклинические методы обследования: обзорная спондилография; послойная томография; компьютерная томография, сцинтиграфия; МРТ. Часто приходится проводить трудный дифференциаль ный диагноз между mts, твс и банальным неспецифичес ким спондилитом. Но весь этот комплекс не всегда по зволяет точно установить диагноз. Тогда приходится при бегать к пункционной биопсии. Показанием к операции являлось: 1) клиника сдавления спинного мозга; 2) выраженный и не поддающийся консервативной те рапии болевой синдром; 3) нарушение опорных функций позвоночника и их профилактика. При оперативном вмешательстве предпочтение отда валось вентральному доступу, который позволяет более радикально удалить пораженные структуры тела позвон ка. Во всех случаях применялась замена удаленных одно го или более тел позвонков гомотрансплантатом, аутот рансплантатом или аллотрансплантатом. Обязательным условием являлось дополнительное применение фиксирующих металлических конструкций. При задней фиксации во всех случаях нами применялся только транспедикулярный спондилодез. При необходи мости, если позволяет общее состояние больного, приме няется комбинированный доступ с удалением передних и задних пораженных структур позвонков. При этом так же применялись передняя и задняя фиксация. При шейной локализации процесса – удаление позвон ков типичным передним доступом с замещением дефек та трансплантатом. При кранеовертебральной локализа ции процесса операция делится на 2 этапа: a) предварительный окципитоспондилодез; б) удаление опухоли подчелюстным парафаренгиаль ным доступом; при грудной локализации процесса – тран сторакотомия с удалением позвонков с обязательным за мещением дефекта трансплантатом. Некоторые трудности при операции возникают при груднопоясничной локализации (D11L2). В этих случаях мы применяем торакофренотомию справа. При поясничной локализации процесса мы чаще при меняем экстраперитониальный доступ, также с обязатель ным замещением тела позвонка с последующим передним или задним спондилодезом. III ñúåçä íåéðîõèðóðãîâ Ðîññèè 180