Глава 11. ГОРМОНЫ
advertisement
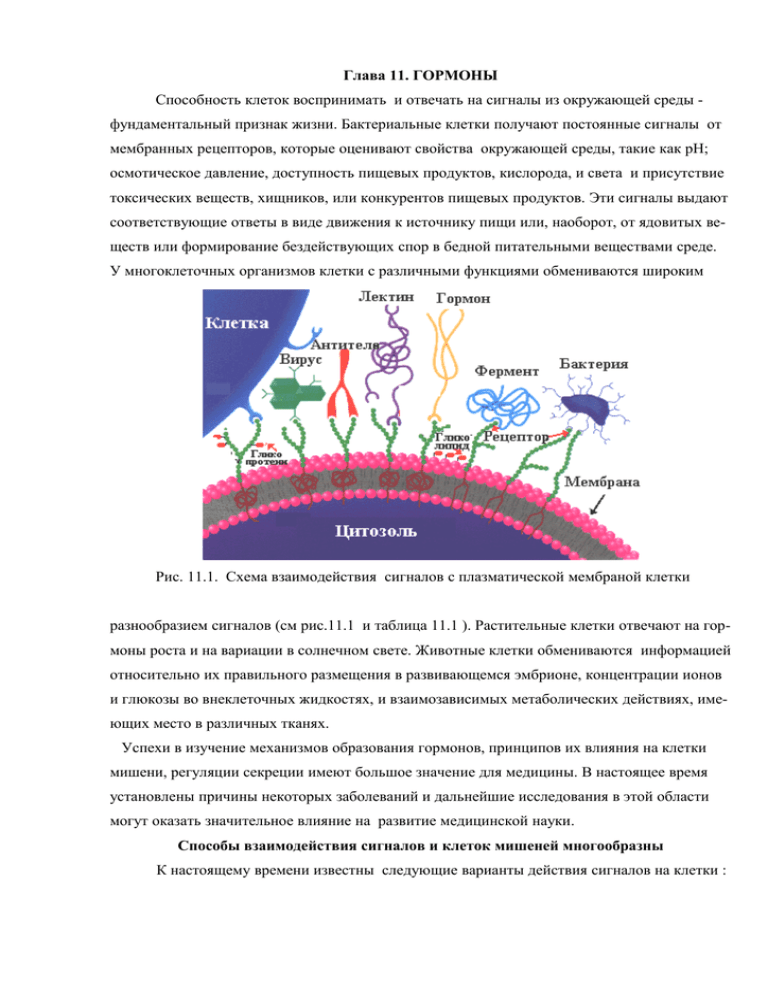
Глава 11. ГОРМОНЫ Способность клеток воспринимать и отвечать на сигналы из окружающей среды фундаментальный признак жизни. Бактериальные клетки получают постоянные сигналы от мембранных рецепторов, которые оценивают свойства окружающей среды, такие как pH; осмотическое давление, доступность пищевых продуктов, кислорода, и света и присутствие токсических веществ, хищников, или конкурентов пищевых продуктов. Эти сигналы выдают соответствующие ответы в виде движения к источнику пищи или, наоборот, от ядовитых веществ или формирование бездействующих спор в бедной питательными веществами среде. У многоклеточных организмов клетки с различными функциями обмениваются широким Рис. 11.1. Схема взаимодействия сигналов с плазматической мембраной клетки разнообразием сигналов (см рис.11.1 и таблица 11.1 ). Растительные клетки отвечают на гормоны роста и на вариации в солнечном свете. Животные клетки обмениваются информацией относительно их правильного размещения в развивающемся эмбрионе, концентрации ионов и глюкозы во внеклеточных жидкостях, и взаимозависимых метаболических действиях, имеющих место в различных тканях. Успехи в изучение механизмов образования гормонов, принципов их влияния на клетки мишени, регуляции секреции имеют большое значение для медицины. В настоящее время установлены причины некоторых заболеваний и дальнейшие исследования в этой области могут оказать значительное влияние на развитие медицинской науки. Способы взаимодействия сигналов и клеток мишеней многообразны К настоящему времени известны следующие варианты действия сигналов на клетки : 1) гормональное или гемокринное, т.е. действие на клетки, расположенные далеко от Рис.11-2 Основные механизмы действия сигнала на клетки источника сигналов и использующие кровообращение для переноса сигнала от клетки производителя до отдаленной клетки - мишени. 2) изокринное, или местное, когда химическое вещество, синтезированное в одной клетке, оказывает действие на клетку, расположенную в тесном контакте с первой, и высвобождение этого вещества осуществляется в межтканевую жидкость и кровь; 3) нейрокринное, или нейроэндокринное (синаптическое и несинаптическое), действие, когда гормон, высвобождаясь из нервных окончаний, выполняет функцию нейротрансмиттера или нейромодулятора, т.е. вещества, изменяющего (обычно усиливающего) действие нейротрансмиттера; 4) паракринное — разновидность изокринного действия, но при этом гормон, образующийся в одной клетке, поступает в межклеточную жидкость и влияет на ряд клеток, расположенных в непосредственной близости; 5) юкстакринное – разновидность паракринного действия, когда гормон не попадает в межклеточную жидкость, а сигнал передается через плазматическую мембрану рядом расположенной клетки. 6) аутокринное действие, когда высвобождающийся из клетки гормон оказывает влияние на ту же клетку, изменяя ее функциональную активность; 7) солинокринное действие, когда гормон из одной клетки поступает в просвет протока и достигает таким образом другой клетки, оказывая на нее специфическое воздействие (например, некоторые желудочно-кишечные гормоны). Во всех случаях, сигнал обнаруживается специфическим рецептором и преобразуется в клеточный ответ. Таблица. 11.1 Примеры сигналов, на которые реагируют клетки Антигены Факторы роста Гликопротеины поверхности клеток Гормоны рН, осмотическое давление Свет Компоненты внеклеточного матрикса Механическое воздействие Нейромедиаторы Одоранты Феромоны Вкусовые вещества Хотя число возможных биологических сигналов значительно (Таблица 11.1 ), клетки используют только несколько эволюционно сохраненных механизмов обнаружения внеклеточных сигналов и преобразования их во внутриклеточные изменения. В этой главе мы рассмотрим некоторые примеры главных механизмов передачи сигналов и их интеграцию в специфические биологические функции. Следует сразу подчеркнуть консервативность фундаментальных механизмов передачи биологических сигналов и адаптации этих основных связанных с мембраной процессов к широкому разнообразию сигнальных путей. В основе взаимодействия сигнала и рецептора лежит слабое взаимодействие Специфичность. Взаимодействие сигнала и рецептора подчиняется общим закономерностям взаимодействия лигандов и белков. Оно может быть оценено количественно методом Скэтчарда, позволяющего получить во многих случаях количественную меру сродства рецептора и сигнальной молекулы (Kd) и числа связывающих лиганды участков в молекуле рецептора. Это взаимодействие характеризуется прежде всего высокой специфичностью, которая обеспечивается комплементарностью между структурой сигнальной молекулы а и активного центра рецептора. Сигнальная молекула комплементарна активному центру рецептора; другие сигналы не комплементарны Кооперативность во взаимодействии лиганда и рецептора дает в результате большие изменения в активности рецептора при минимальной концентрации лиганда (подобно эффекту кооперативности при связывании кислорода с гемоглобином). . Когда ферменты активируют другие ферменты, число вовлекаемых молекул увеличивается в геометрической прогрессии в ферментных каскадах Вторая важная особенность механизмов передачи сигнала в клетках мишенях - усиление (амплификация) сигнала. Конечный ответ клетки на сигнал определяется числом исполнительных элементов клетки (ферментов, структурных белков, переносчиков и т.д.), на которые воздействует сигнал, причем, как правило, соотношение непосредственный регулятор: исполнительный элемент равняется 1:1 (см главу 2). Если бы сигнальные молекулы прямо взаимодействовали с исполнительными элементами , то это потребовало бы огромных количеств сигнальных молекул, перемещаемых по крови от места их образования к клеткам мишеням. Выход из этого положения - в создании механизмов усиления сигнала, с привлечением специальных ферментов и молекул, получивших название вторичных посредников Еще одна важная особенность в механизме передачи сигнала в клетке мишени – «выключение» действия сигнала. Это достигается разными приемами, включенными в механизм передачи сигнала. Активирование рецептора при взаимодействии с сигнальной молекулой одновременно включает механизм обратной связи, который отключает рецептор (например, путем фосфорилирования молекулы рецептора) или удаляет рецептор с поверхности клетки (путем эндоцитоза) или используются специальные белки, прерывающие передачу сигнала ( G-белки) и т.д.. Если два сигнала оказывают противоположный эффект на метаболические характеристики типа концентрации вторичного посредника X, или мембранный потенциал Vм., выходящий регуляторный сигнал - результат интегрирования входящих сигналов от обоих рецепторов. Наконец, еще одна примечательная особенность систем преобразования сигналов интеграция, способность системы, получая многочисленные и разнообразные сигналы, выдавать интегрированный ответ, соответствующий потребностям клетки или организма. Различные пути передачи сигналов перекрещиваются друг с другом на нескольких уровнях, создавая множество взаимодействий, что обеспечивает гомеостаз клетки и организма. Механизм передачи сигнала в клетку определяется особенностями свойств рецептора. Выделяют несколько систем передачи сигналов. Пусковой механизм для каждой системы может быть различен и определяется свойствами рецептора , но общие особенности передачи сигнала одинаковы у всех: сигнал взаимодействует с рецептором; активированный рецептор взаимодействует с клеточными механизмами, создавая второй сигнал или изменяя активность специфического клеточного белка; метаболическая активность клетки-мишени подвергается изменению и наконец, по окончанию действия сигнала клетка возвращается к своему исходному состоянию. Молекулярные подробности механизма передачи сигнала в клетку определяет тип рецептора. С позиций молекулярной биологии рецепторы — это генетически детерминированные макромолекулярные сенсоры (простые белки, глико-и липопротеины), локализованные в специализированных образованиях клетки (плазматическая мембрана, цитозоль, ядро), обеспечивающие при специфическом взаимодействии с физиологически значимыми сигналами химической и физической природы трансформацию и передачу заключенной в них информации на пострецепторные структуры, инициируя каскад биохимических и / или физико-химических процессов, приводящих к конкретному ответу клеткимишени на раздражитель. Все рецепторы можно разделить на две группы Все многообразие клеточных рецепторов в зависимости от их локализации в клетке можно разделить на 2 большие группы : • рецепторы плазматической мембраны • внутриклеточные рецепторы . I. Рецепторы плазматической мембраны клеток обеспечивают узнавание, связывание и передачу регуляторного сигнала внутрь клетки и относятся к одному из трех суперсемейств. a) 7-сегментные трансмембранные рецепторы (7-transmembrane segment receptots ) 7-TMС являются интегральными мембранными белками с семью трансмембранными спиральными сегментами, соединенными гидрофильными внеклеточными и внутриклеточными петлями. Внутриклеточные петли этих рецепторов содержат центры связывания Gбелка. Поэтому 7-TMС рецепторы иногда называют рецепторами, связанными с G-белком (G-protein-coupled receptors — GPCRs), а по форме расположения полипептидной цепи в мембране, напоминающей змею – серпентиновыми рецепторами. При связывании лиганда эти рецепторы косвенно активируют (через связанный с ним G-белок) ферменты внутри клеток, которые катализируют образование внутриклеточных вторичных посредников Рис11-3. Типы рецепторов b) Односегментные трансмембранные каталитически» рецепторы (single -transmembrane segment receptors ) 1-TMС — являются интегральными мембранными белками с одним трансмембранным сегментом и глобулярными доменами на экстраклеточной и внутриклеточной поверхностях мембраны. Внеклеточный домен содержит участок узна- вания и связывания лиганда, а внутриклеточный домен, инициирующий каскад биохимических реакций в клетке в ответ на образование лигандорецепторного комплекса, обладает каталитической активностью (гуанилатцикпазной, тирозинкиназной и др.) Когда один из таких рецепторов активируется внеклеточным лигандом, его внутриклеточный домен катализирует образование внутриклеточных вторичных посредников c) Каналообразующие рецепторы (channel-forming receptors) — состоят из ассоциированных белковых субъединиц, каждая из которых содержит несколько трансмембранных сегментов . Эти олигомерные структуры являются лигандозависимыми ионными каналами. Лигандами таких ионных каналов обычно являются нейромециаторы Это самые простые сигнальные преобразователи, которые открываются и закрываются (отсюда термин "ворота") в ответ на присоединение химических лигандов или изменений трансмембранного потенциала. II. Внутриклеточные рецепторы расположены в цитозоле или ядре и после связывания со своими специфическими лигандами (примером может служить рецептор стероидного гормона эстрогена), изменяют скорость транскрипции специфических генов и трансляции их с образованием белков. Более подробная классификация рецепторов может быть представлена в следующей таблице Таблица 11.1. Классификация рецепторов I. Мембранные рецепторы 1. 7ТМС рецепторы взаимодействуют с гетеротримерными G –белками 2. 1ТМС рецепторы • Рецепторы со свойствами гуанилатциклазы • Рецепторы со свойствами тирозинкиназы • Рецепторы, взаимодействующие с тирозинкиназами • Рецепторы со свойствами протеинфосфатаз • Рецепторы со свойствами СЕР/ТРЕ протеинкиназ 3. Ионные каналы • Лигандзависимые • Потенциалзависимые • Щелевые контакты II. Ядерные и цитозольные рецепторы • Класс I – ядерные или цитоплазматические, без лиганда связаны с белками теплового шока • Класс II - ядерные, не связаны с белками теплового шока Эндокринная сигнальная система одна из ведущих регулирующих систем в организме. Эндокринная система представлена железами внутренней секреции, ответственными за образование и высвобождение в кровь различных сигнальных молекул. Железы внутренней секреции или эндокринные железы, подразделяются на классические (гипофиз, щитовидная и околощитовидные железы, островковый аппарат поджелудочной железы, корковое и мозговое вещество надпочечников, яички, яичники, эпифиз) и неклассические (вилочковая железа, сердце, печень, почки, ЦНС, плацента, кожа, желудочно-кишечный тракт и т.д.). Сигнальные молекулы классических желез внутренней секреции носят название гормоны, хотя сам термин «гормон» (от греческого hormaο - возбуждаю ) был введен в 1905 году У. Бэйлиссом и Э. Старлингом для названия молекулы, синтезируемой двеннадцатиперстной кишкой и стимулировавшей секрецию желчи и сока поджелудочной железы. Гормоны классифицируют по их химической природе, что позволило выделить 4 основных класса гормонов (Табл. 11.3.) Таблица 11-3. Главные классы гормонов 1. Гормоны белковой природы • Гормоны - сложные белки (тиреотропин, гонадотропины) • Гормоны - простые белки (соматотропин, инсулин) • Гормоны - пептиды ( глюкагон, кортикотропин,) 2. Производные аминокислот • адреналин, серотонин, тироксин 3. Стероиды (производные холестерола и других полиизопренов) • альдостерон, кортизол, половые гормоны, ретиноевая кислота 4. Эйкозаноиды ( производные 20-углеродных, полиненасыщенных жирных кислот) • простагландин Е1, тромбоксан А2. Уровень гормона в крови не всегда определяет конечный эффект гормона Гормоны характеризуются чрезвычайно высокой эффективностью действия, поэтому концентрация их в крови и межклеточной жидкости очень низкая порядка от 10-6 до 10-12 М. Уровень гормона в крови – интегральный результат двух процессов скорости их синтеза и секреции и скорости распада и удаления из крови. Гормоны могут секретироваться двумя путями: • Регулируемая секреция: клетка хранит гормон в секреторных гранулах и выделяет гормон по мере необходимости. Это - наиболее часто используемый путь и позволяет клеткам выделять большое количество гормона в течение короткого периода времени. (пульсирующий характер секреции) • Конститутивная секреция: клетка не сохраняет гормон, а выделяет его из секреторных везикул по мере его синтеза. Секреция - наиболее частый объект действия регулирующих систем. Обычным прикладным принципом регуляции секреции гормона является принцип отрицательной обратной связи: сам гормон непосредственно или косвенно тормозит свою дальнейшую секрецию. - например, инсулин секретируется β клетками поджелудочной железы в ответ на увеличение уровня глюкозы в крови и его действие направлено на повышение усвоения глюкозы клетками, что приводит к снижению уровня глюкозы крови. Последнее является сигналом для уменьшения секреции инсулина. Однако в регуляции секреции некоторых гормонов может быть и принцип положи- тельной обратной связи, при котором гормон непосредственно или косвенно вызывает дополнительную секрецию гормона. - например, выброс лютеинизирующего гормона (ЛГ) перед овуляцией - результат положительной обратной связи влияния эстрогенов на переднюю долю гипофиза, ЛГ затем действует на яичники и усиливает секрецию эстрогенов. Важным в конечном эффекте гормона на клетку при одной и той же его концентра- ции в крови является скорость доставки через сосудистое русло: усиление кровотока к органу мишени или группе клеток- мишеней приводит к увеличению поставляемого гормона и усилению эффекта и наоборот. Значительно менее изучены механизмы удаления гормонов из сосудистого русла. Гормоны, подобно всем биомолекулам, имеют характерное для каждого время биологического полураспада, зависящее от многих условий. Прекращение секреции гормона с очень коротким временем полураспада, вызывает быстрое падение концентрации гормона в крови, но если время полураспада гормона - продолжительное, эффективные концентрации сохраняются в течение некоторого времени даже после того, как секреция прекращается. При изложении метаболизма отдельных гормонов будут приведены примеры особенностей обмена отдельных гормонов. Одним важным следствием того, что уровень гормона регулируется по принципу обратной связи и факта, что гормоны имеют ограниченную продолжительность жизни в сосудистом руле, является то, что секреция большинства гормонов имеет пульсирующий характер. На графике (рис 11.4) приводятся данные о изменениях концентрации лютеинизирующего Рис.11.4. Изменение уровня ЛГ в крови в течении 8 часового наблюдения. гормона в крови собаки в течение 8 часов, при исследовании уровня каждые 15 минут: Пульсирующая природа секреции лютеинизирующего гормона у этого животного очевидна. Эти данные указывают на необходимость осторожной интерпретации результатов исследования в клинической эндокринологии. Подобный пульсирующий характер изменений уровня характерен для многих гормонов. Помимо кратковременных колебаний, указанных здесь существуют долговременные ритмы, что следует учитывать при обследовании и здоровых и больных людей. Однако уровень гормона в крови еще не определяет конечный эффект гормона. Важное место в механизме действия гормонов отводится и количеству рецепторов в клетке, на которое сами гормоны могут оказывать существенное влияние. Возможны 2 варианта такого влияния 1. Понижающая регуляция рецепторов - гормон уменьшает число рецепторов для себя или для другого гормона. Например, прогестерон уменьшает количество своих рецепторов и рецепторов для эстрогенов в матке 2. Повышающая регуляция рецепторов - гормон увеличивает число рецепторов для себя или для другого гормона. - например, эстрогены увеличивают количество собственных рецепторов и рецепторов ЛГ в яичнике. Передача сигнала рецепторами, связанными с G-белками проходит с участием вторичных посредников Механизм проведения информационного сигнала с участием рецепторов, связанных с G-белками, состоит, по крайней мере, из 5 этапов. Первый этап передачи сигнала включает распознавание и связывание сигнальной молекулы специфическим рецептором плазматической мембраны клетки-мишени. Второй этап представляет собой сложный процесс переноса информации с внешней поверхности плазматической мембраны клетки на внутреннюю, что приводит к G-белок-зависимой активации мембрано-связанных ферментов (например, аденилатциклазы или фосфолипазы С). Третий этап этого многоступенчатого каскада сопровождается образованием и повышением уровня в цитозоле одного или нескольких низкомолекулярных внутриклеточных посредников (цАМФ, цГМФ, ДАГ, ионы Са2+ и т.д.). Повышение уровня низкомолекулярных внутриклеточных посредников внутри клетки инициирует четвертый этап проведения внешнего регуляторного сигнала – подключение ферментов, активность которых непосредственно регулируется низкомолекулярными внутриклеточными посредниками. Это, как правило, протеинкиназы, которые в свою очередь (пятый этап проведения регуляторного сигнала) оказывают влияние на активность ключевых клеточных ферментов, определяющих суть ответной реакции клетки на полученный ею извне конкретный информационный сигнал. Активированные каталитические субъединицы некоторых протеинкиназ (например, цАМФ – зависимых) могут оказывать свое влияние непосредственно в цитозоле или транслоцироваться из цитоплазмы в ядро при различных функциональных состояниях клетки. Результатом внутриядерных процессов может быть активация или торможение клеточного цикла, а также синтеза белковых молекул. Образование вторичных посредников – дело интегральных белков плазматической мембраны. Первые этапы передачи сигнала с образованием вторичных посредников протекают с участием интегральных белков плазматической мембраны. В этом процессе участвуют 7 ТМС рецептор, G белок и фермент, способствующий образованию вторичного посредника. Схематическое изображение структуры β-адренэргического рецептора показана на рис слева. Этот рецептор является членом одного из подсемейств большого суперсемейства 7 ТМС рецепторов, включающего 3 подсемейства: 1) подсемейство β-адренергического рецептора; 2) подсемейство секретиноподобных рецеторов; 3) подсемейство метаботропнык глутаматных рецепторов. Это разделение основано на особенностях аминокислотных последовательностей этих рецепторов. Представители подсемейства β-адренергического рецептора составляют большинство 7-TMS рецепторов, идентифицированных к настоящему времени. Это подсемейство включает α- и β-адренергические рецепторы, рецепторы гистамина, серотонина, брадикинина, субстанции Р, ангиотензина, интерлейкина 8, тромбина, саматостатина, гликопротеиновых гормонов, ацетилхолина (М-холинорецепторм) и т.д. β-адренергический рецептор, связывающий катехоламиновые агонисты (адреналин, норадреналин и т.д.), состоит из 418 аминокислотных остатков. Его внеклеточный N-концевой домен имеет два участка (сайта) гликозилирования. Гидрофобные участки аминокислотной последовательности β-адренергического рецептора образуют 7 трансмембранных а-спиральных сегментов, которые соединены между собой гидрофильными экстраклеточными и внутриклеточными петлями (последние содержат участки взаимодействия с G-белком). Подсемейство секретиноподобных рецепторов. Это подсемейство включает пептидергические рецепторы секретина, глюкагона, вазоинтестинального пептида, паратирина, кальцитонина, соматолиберина и др. Эти рецепторы характеризуются достаточно высокой гомологией аминокислотной последовательности внутри подсемейства и низкой гомологией с рецепторами подсемейства β-адренергического рецептора. Все представители подсемейства секретиноподобных рецепторов связаны с Gs-белком, активация которого лигандорецепторным комплексом приводит к увеличению внутриклеточного уровня цАМФ. Вместе с тем, известно, что наряду с активацией Gs-белка, рецепторы глюкагона, паратирина и каль- цитонина активируют и другие G-белки, приводящие к увеличению внутриклеточного уровня Са2* и инозитолтрифосфата. Подсемейство метаботропных глутаматных рецепторов. Метаботропные глутаматные рецепторы образуют третье, высокоспециализированное подсемейство 7-TMS рецепторов. Глутаматорецепторный комплекс активирует Gq-белок, что в конечном итоге приводит к стимуляции образования инозитолтрифосфата и мобилизации внутриклеточного Са2*. Поскольку увеличение внутриклеточного содержания последнего ведет к активации многих метаболических процессов в клетке эти рецепторы носят название метаботропных в отличие от ионотропных глутаматных рецепторов, являющихся лигандозависимыми ионными каналами. Метаботропные глутаматные рецепторы присутствуют в клетках центральной и периферической нервной системы, где участвуют в регуляции разнообразных функций в ответ на действие агониста L-глутамата. Метаботропные рецепторы характеризуются очень низкой степенью гомологии аминокислотной последовательности со всеми другими 7-TMS рецепторами. Эти рецепторы имеют значительно более высокую молекулярную массу по сравнению с типичными представителями других подсемейств 7-ТМS рецепторов. Рис.11.5. Схема строения мембраносвязанного G белка Второй участник передачи сигнала – G белки. Эти белки довольно широко представлены в клетке. Можно выделить по крайней мере 2 типа G белков: а) большие, состоящие из нескольких субъединиц, (как правило, гетеротримеры, состоящие из α,β и γ субъединиц с молекулярной массой 42 kDa, 35 kDa и 10 kDa соответственно) обычно связаны с мембранами благодаря липидным компонентам (пальмитиновая кислота) ковалентно присоединяемым к белку после синтеза на рибосомах б) низкомолекулярные, состоящие из одной полипептидной цепи (23 кДа), находятся в цитозоле Все G белки обладают ГТФазной активностью (отсюда их название) и их конформация зависит от того, связаны ли они в данный момент с ГДФ или ГТФ. Эти белки в клетке играют роль своеобразных молекулярных «выключателей» многих биохимических процессов (см. раздел по синтезу белков). На рис.11.5 представлена схема строения мембраносвязанного G белка. Он состоит из 3 субъединиц α, β и γ. В обычном (неактивном) состоянии три субъединицы соединены вместе и α субъединица связана с ГДФ. После присоединения гормона к 7 ТМС рецептору и взаимодействия с G белком в последнем происходит замена ГДФ на ГТФ и G белок диссоциирует с образованием сво- бодной α субъединицы и димера субъединиц βγ. α субъединица и димер βγ субъединиц затем перемещаются по мембране и могут взаимодействовать с третьим мембраносвязанным участником передачи сигнала эффекторным белком. Им может быть фермент, катализирую- щий образование низкомолекулярных вторичных посредников. Конечный эффект такого взаимодействия или активирование (Gs –белок) или ингибирование (Gi-белок) эффекторного белка. Продолжительность эффекта определяется ГТФазной активностью α-субъединицы и после гидролиза ГТФ до ГДФ действие субъединиц прекращается и происходит реассоциация их в исходное тримерное состояние. цАМФ - первый вторичный посредник в истории исследований переноса сигналов Эрл Уилбер Сазерленд, американский биохимик, в середине 50-х годов ХХ столетия, при исследовании механизма активирования распада гликогена под влиянием адреналина и глюкагона обнаружил, что эти гормоны не оказывают непосредственного влияния на распад гликогена. При инкубации мембран клеток печени в присутствии АТФ в среде появлялось термостабильное соединение, которое Сазерленд идентифицировал как циклическую адениловую кислоту (цАМФ). Это соединение возникало из АТФ под влиянием фермента, который он назвал аденилатциклазой. Как оказалось аденилатциклаза широко распространенный мембраносвязанный белок, состоящий из 1100 аминокислот, которые формируют 2 кластера по 6 трансмембранных сегментов, разделенных на цитоплазматической стороне двумя каталитическими доменами. Известны к настоящему времени 6 типов Рис.11.6. Влияние адреналина и простагландина Е1 на активность аденилатциклазы аденилатциклаз. Активность этих ферментов регулируется G- белками. В зависимости от типа аденилатциклаз, они могут взаимодействовать с α s субъединицей G белка и переходить в активное состояния или с α I cубъединицей и ингибироваться. На рис 11.6 приводится обобщенное представление о интегральном ответе аденилатциклазы. Одна и та же молекула не может взаимодействовать с двумя регуляторами с противоположным действием. Уровень цАМФ в клетках очень низок (< 10-7 М), но при активировании аденилатциклазы может быстро( секунды) увеличиться в несколько раз. Однако это повышение бывает кратковременным. Распад цАМФ катализируется цАМФ-фосфодиэстеразами (ФДЭ). Эти ферменты катализируют гидролиз фосфодиэфирной связи в молекуле цАМФ с образованием аденозин-5-монофосфата. Активность ФДЭ также можно регулировать. Известно, например, что некоторые производные пурина (кофеин) могут быть ингибиторами этого фермента, что также может приводить к повышению уровня цАМФ. цАМФ- аллостерический регулятор протеинкиназы А (ПКА). Эффект усиления распада гликогена, наблюдаемый Сазерлендом не был результатом прямого влияния цАМФ на фосфорилазу гликогена. Активность фосфорилазы изменялась путем ее фосфорилирования при участии еще одного фермента ц-АМФ-зависимой протеинкиназы (протеинкиназы А - ПКА). ЦАМФ является аллостерическим активатором протеинкиназы. В последующем было выделено несколько типов ПКА, имеющих схожее строение в разных тканях. Это гетеромеры, состоящие из 2-х каталитических (С2) и одной регуляторной субъединицы, состоящей из двух полипептидных цепей (R2). Были выделены 3 типа каталитических (α,β,γ ) субъединиц и два типа регуляторных (I и II). Холоэнзимы R2С2 неактивны. Присоединение цАМФ вызывает диссоциацию фермента. При этом каталитические субъединицы освобождаются и начинают активно катализировать перенос фосфорного остатка с АТФ на определенные остатки серина или треонина некоторых белков органа- мишени. Обычно специфичекой последовательностью аминокислот участков фосфорилирования АРГ-АРГ-Х-СЕР или ЛИЗ-АРГ-Х-ХСЕР, где Х- любая аминокислота. Такая ковалентная модификация фермента стабилизирует одно из конформационных состояний фермента: активное -расслабленное или неактивное- напряженное. Это уже зависит от свойств данного фермента. Так, фосфорилирование гликогенфосфорилазы активирует ее, а гликогенсинтетазы, наоборот, тормозит ее активность. Эффекты цАМФ обычно непродолжительны. В клетках имеются ферменты дефосфорилирующие белки, фосфорилируемые протеинкиназой А. Известны две главные протеинфосфатазы., одна из которых сама регулируется цАМФ. Последняя наиболее активна в отсутствии цАМФ. Рис11.7. Схема этапов влияния адреналина на клетку цАМФ может выполнять регуляторные функции и другими альтернативными механизмами, например, открытием цАМФ-зависимых ионных каналов. На рис 11.7 суммированы данные о механизме действия адреналина на β адренэргический рецептор Таблица 11.4.Некоторые клеточные ответы на действие гормонов, опосредуемое циклическим АМФ Гормон Клетки-мишени Главный ответ Тиротропин Тироциты Синтез и секреция тироксина Кортикотропин Лютропин Адреналин Паратгормон Адреналин Вазопрессин Адреналин, кортикотропин, глюкагон, тиротропин Клетки пучковой и сетчатой зоны коры надпочечников Клетки Лейдига яичников Миоциты, гепатоциты Остеокласты Р-клетки водителя ритма сердца Эпителиоциты канальцев нефрона почки Адипоциты Секреция кортизола Секреция прогестерона Распад гликогена Резорбция кости Увеличение частоты сокращений Реабсорбция воды Расщепление триацилглицеролов В таблице 11.4 представлены некоторые клеточные ответы на действие гормонов, активирующих аденилатциклазный путь сигнализации. Важно отметить, что разные лиганды, действующие через различные рецепторы на аденилатциклазу в данной клетке, обычно вы- зывают одну и ту же ответную реакцию. Например, в адипоцитах аденилатциклазу активируют по крайней мере четыре разных гормона, (адреналин, кортикотропин, глюкагон, тиротропин) и все они вызывают расщепление триацилглицеролов (резервная форма жира) до жирных кислот. Похоже, что различные рецепторы для этих гормонов активируют общий пул молекул аденилатциклазы. В некоторых животных клетках повышение уровня цАМФ приводит к активации транскрипции определенных генов. Например, в нейроэндокринных клетках гипоталамуса цАМФ "включает" ген, кодирующий синтез пептидного гормона соматостатина. Каков же механизм этого процесса? Дело в том, что активированная каталитическая субъединица ПКА может траслоцироваться из цитоплазмы в ядро. На уровне ядерного компартмента влияние протеинкиназы А реализуется через фосфорилирование так называемых ген-регуляторных белков (gene regulatory proteins), которые, активируясь, связываются со специфическими отвечающими элементами (response elements), представляющими собой короткие участки ДНК строго определенной последовательности генов-регуляторов, формируя при этом пусковое звено активации или репрессии транскрипции соответствующего транскриптона. В каскадном механизме передачи сигнала заложен механизм усиления сигнала На рисунке слева показана схема влияния адреналина на гепатоцит. Связывание одной молекулы гормона с одной молекулой рецептора активирует несколько молекул Gs белков. Каждая активная молекула Gs активирует молекулу аденилатциклазы, которая катализирует образование многих молекул цАМФ (на рис 40 молекул). цАМФ как вторичный посредник активирует ПKA (10 молекул ПКА, поскольку на активирование каждой молекулы приходится 4 молекулы цАМФ) , каждая молекула которой катализирует фосфорилирование многих (100 молекул ) молекул белка -мишени (киназы фосфорилазы b). Последняя активирует путем фосфорилирования фосфорилазу b (1000 молекул ). И как результат, под влиянием одной молекулы адреналина из клетки печени высвобождается 10000 молекул глюкозы. Несомнен- но, приведенные данные дают лишь приблизительные представления о количественных изменениях каскадного механизма усиления действия гормона. Эта киназа в свою очередь активирует гликогенфофорилазу, которая обеспечивает быструю мобилизации глюкозы из гликогена. Конечным результатом влияния такого последовательного взаимодействия ферментов является усиление гормонального сигнала на несколько порядков, что и объясняет очень низкую концентрацию адреналина (или любого другого гормона) необходимую для проявления его активности. На каждом этапе каскадного механизма усиления сигнала есть свои выключатели. Столь активное усиление сигнала требует тщательного контроля над количественными параметрами этого усиления. G-белки - один из примеров биологических выключателей, широко используемых в клетке. Связывание гормона и рецептора способствует замене на G –белке ГДФ на ГТФ, что является сигналом для диссоциации субъединиц G белка и активированию субединицами этого белка эффекторных белков ( аденилатциклазы). Продолжительность этого действия определяется скоростью гидролиза ГТФ субъединицей и после превращения ГТФ в ГДФ действие гормон –рецепторного комплекса выключается. Эффект токсина холерного вибриона связан с ингибированием ГТФазной активности G белков мембран энтероцитов. При этом естественный выключатель переходит в состояние постоянного включения, что и лежит в основе патологических проявлений холеры. Рис 11.8. Влияние холерного токсина на G белок Активирующее влияние комплекса гормон - рецептор может снижаться и фосфорилированием цитоплазматической части рецептора специфическими протеинкиназами. Как отмечено ранее, системы передачи сигнала подвергаются десенситизации (десенсибилизации) при длительном взаимодействии гормона с рецептором (высокий уровень гормона в межклеточном пространстве). Десенсибилизация β-адренэргического рецептора опосредуется протеинкиназой, которая фосфорилирует внутриклеточный домен рецептора, взаимодействующий с Gs. Эффект одного сигнала может модулирваться влиянием другого сиганала на ту же клетку. Некоторый гормоны действуют путем торможения аденилатциклазы, понижая уровень цАМФ и ингибируя фосфорилирование белков. Например, связывание соматостатина со своим рецептором ведет к активированию ингибирующего G белка или Gi, структурно гомологичного Gs, который ингибирует аденилатциклазу и понижает уровень цАМФ. Соматостатин тем самым уравновешивает эффекты глюкагона. В жировой ткани, простагландин E1 (ПГЕ1) ингибирует аденилатциклазу, снижая уровень цАМФ и замедляет мобилизацию запасов липидов, вызванных адреналином и глюкагоном. В некоторых других тканях ПГЕ1стимулирует синтез цАМФ, потому что его рецепторы соединены с аденилатциклазой через стимулирующий Gs белок. В тканях с α2 -адренэргическим рецептором, адреналин понижает уровень цАМФ, потому что α2 рецепторы связаны с аденилатциклазой при участии белка Gi. Таким образом , внеклеточный сигнал типа адреналина или PGE1 может иметь весьма различные эффекты на различные ткани или клеточные типы, в зависимости от (1) типа рецептора, (2) типа белка G (Gs или Gi) с которым рецептор соединен, и (3) набора ферментов мишеней PKA в клетке. Как упоминалось выше, уровень цАМФ быстро понижается под влиянием фосфодиэстеразы. На уровне ферментов, активность которых регулируется протеинкиназами, функционируют протеинфосфатазы, дефосфорилирующие белки субстраты протеинкиназ и снимающие эффект гормона. Два вторичных посредника образуются из фосфатидилинозитолов мембран Второй класс серпентиновых рецепторов связан через белок G с интегральным белком плазматической мембраны фосфолипазой Сβ (ФЛСβ)., специфическим субстратом которой является сложный липид фосфатидилинозитол 4,5-дифосфат, который расположен во внутреннем листке липидного бислоя плазматической мембраны. Этот чувствительный к гормону фермент катализирует формирование двух мощных вторичных посредников: диацилглицерола (ДАГ) и инозитол 1,4,5-трифосфата, или ИФ3. Последовательность событий в механизме передачи сигнала подобен описанному выше. Комплекс гормона с рецептором катализирует обмен ГТФ-ГДФ на специальном G белке Г, Gq , подобно тому, как β-адренэргический рецептор активировал Gs . Gq -ГТФ в свою очередь активизирует специфическую связанную с мембраной фосфолипазу Сβ (ФЛСβ). Менее чем за секунду этот фермент превращает фосфатидилинозитол-4,5-дифосфат (ФИДФ) в два продукта: инозитол-1,4,5-трифосфат (ИФ3) и диацилглицерол (ДАГ). Далее последующие события разделяются на две ветви, опосредуемые либо ИФ3, либо ДАГ. Поскольку обе названные молекулы играют важнейшую роль в последующем развитии ответа, мы рассмотрим их по отдельности (см рис11.9 ). ИФ3 обеспечивает повышение уровня ионов кальция в цитозоле. Инозитол-1,4,5- трифосфат (ИФ3) – небольшая водорастворимая молекула, переходит путем диффузии к цитоплазматической поверхности эндоплазматического ретикулума, и связывается с рецептором, открывая лиганд-зависимые кальциевые каналы, что приводит к резкому увеличению концентрации ионов Са2+ в цитозоле, который связывается специфическими кальций связывающими белками. Рис. 11.9. Структура фосфатидилинозитола-4,5 фосфата и схема его гидролиза Фосфолипазой С Один из таких белков калмодулин (CaM; ММ 17,000) - кислый белок с четырьмя высокоаффинными к кальцию участками. Когда уровень внутриклеточного кальция достигает приблизительно 10-6 М (1 мМ), кальций – кальмодулиновый комплекс присоединяется к различным белкам-мишеням, что сопровождается изменением активности последних. Калмодулин член семейства кальций связывающих белков, которое включает и тропонин , участвующий в мышечном сокращении в ответ на повышение кальция. Кальмодулин является субъединицей Са2+ /кальмодулин-зависимых протеинкиназ (СаМ киназы). Когда уровень внутриклеточного кальция увеличивается в ответ на некоторые стимулы, калмодулин связывая кальций и изменяя конформацию, активирует эти киназы. СаМ киназы фосфорилируют многие ферменты-мишени, регулируя их активность. Кроме фосфорилирования цитозольных белков, кальмодулин-зависимые киназы способны проникать из цитоплазмы в ядро, где они фосфорилируют ген-регуляторные белки, ответственные за активацию транскрипции. Калмодулин - регуляторная субъединица киназы фосфорилазы b в мышцах. Тем самым, кальций включает мышечное сокращение и одновременно активируеи распад гликогена используемого для для энергообеспечения мышечного сокращения. Много других ферментов, как известно, модулируются кальцием с участием калмодулина К числу белков- мишеней, регулируемых комплексом Са2+ - кальмодулин, относится много ферментов и мембранных транспортных белков (см табл) Таблица 11.5. Белки,регулируемые Са2+ и калмодулином Аденилат циклаза Са2+/калмодулин зависимая протеинкиназа ЦАМФ фосфодиэстераза Са2+ зависимый Na+ канал ЦАМФ зависимый канал (зрение) Киназа легкой цепи миозина НАДН киназа Синтаза оксида азота ИФ-3-киназа ЦГМФ - зависимая протеинкиназа киназа фосфорилазы Са2+ канал эндоплазматической сети Кальциневрин (фосфопротеинфосфатаза 2В) цГМФ зависимый Na+,Ca2+ канал (колбочки) Са2+ АТФаза плазм.мембран РНК хеликаза (р68) киназа легких цепей миозина фосфолипаза А2 У ДАГ – две «сигнальные» роли Если ИФ3 повышает концентрацию ионов Са2+ в цитозоле, другой продукт расщепления фосфатидилинозитол -4,5- дифосфата – ДАГ – остается в плазматической мембране и вызывает совершенно иные молекулярные эффекты. У него есть две "сигнальные" роли: он может гидролизоваться дальше с образованием арахидоновой кислоты, необходимой для синтеза простагландинов и родственных им медиаторов липидной природы, или способен активировать специфическую протеинкиназу, которая затем фосфорилирует ряд белков с различными функциями в клетке-мишени. Фермент, активируемый ДАГ, называется протеинкиназой С (ПКС) или С–киназой, так как активность его зависит от уровня Са2+ в цитозоле клетки. При низком внутриклеточном уровне Са2+ и отсутствии диацилглицерола протеинкиназа С находится в цитоплазме в неактивном состоянии. Связывание диацилглицерола изменяет конформацию протеинкиназы С, что сопровождается повышением ее сродства к ионам Са2+ и липидам. Это приводит к связыванию протеинкиназы С с цитоплазматической поверхностью плазматической мембраны и переводу фермента в активное состояние. Активация С-киназы кратковременна, так как через несколько секунд диацилглицерол фосфорилируется до фосфатидной кислоты или расщепляется с высвобождением арахидоновой кислоты. С-киназа, активированная диацилглицеролом и Са2+, переносит концевую фосфатную группу с АТФ на специфические сериновые или треониновые остатки белков-мишеней, которые в разных клетках различны. Например, во многих животных клетках С-киназа фосфорилирует и тем самым активирует Na+/H+ обменный насос плазматической мембраны, контролирующий внутриклеточный рН. Концентрация С-киназы выше всего в нейронах головного мозга, где, помимо, прочего она фосфорилирует ионные каналы нейронов и, изменяя их проницаемость, может влиять на возбудимость этих клеток. В некоторых клетках активация С - киназы усиливает транскрипцию определенных генов. Рис11.10. Роль ПКС в регуляции транскрипции. Известны два внутриклеточных пути, через которые активированная С-киназа усиливает транскрипцию генов. В одном, С-киназа активирует протеинкиназный каскад, приводяций к фосфорилированию митоген-активируемой протеинкиназы (МАП – киназы), которая фосфорилирует и активирует ген-регуляторный белок Elk-1. Elk-1 связан с короткой последовательностью ДНК (обозначаемой serum response element – SRE) и ассоциирован с другим ДНК - связывающим белком (обозначаемым serum response factor – SRF). В другом пути, активация С-киназы приводит к фосфорилированию ингибиторного белка Ik-B, что сопровождадется высвобождением из комплекса ген-регуляторного белка NF – kB, который мигрирует из цитозоля в ядро и активирует транскрипцию соответствующего гена. Существует группа соединений, среди которых наиболее хорошо изучены форболовые эфиры, которые являются мощными активаторами ПкС. Они действуют подобно ДАГ как вторичные посредники, но в отличие от естественного ДАГ, они разрушаются медленно. Постоянно активируя ПкС, эти синтетические вещества вмешиваются в нормальную регуляцию клеточного роста и деления и служат факторами, стимулирующими образование опухолей.. Обе ветви инозитолфосфолипидного пути действуют совместно Часто для получения полноценного клеточного ответа обе ветви инозитол-фосфолипидного сигнального пути должны действовать совместно. В таблице 11.6 приведены примеры некоторых клеточных ответов, осуществляемых через инозитол-фосфолипидный путь сигнализации. Таблица 11.6. Некоторые клеточные реакции, осуществляемые через инозитол-фосфолипидный путь Сигнальная молекула Ткань-мишень Главный ответ Вазопрессин Гепатоциты Активация распада гликогена Ацетилхолин Ацетилхолин Ацетилхолин Антиген Тромбин Ацинарные клетки поджелудочной железы Гладкомышечные клетки β-Клетки поджелудочной железы Тучные клетки Тромбоциты Секреция амилазы Сокращение Секреция инсулина Секреция гистамина Секреция серотонина Сопоставление данных, представленных в таблицах и позволяет констатировать следующее. Во-первых, одна и та же сигнальная молекула (например, вазопрессин), связываясь со специфическим рецептором клеток разных типов, может активировать разные сигнальные пути: аденилатциклазный – эпителий канальцев нефрона (главный ответ – реабсорбция воды) и инозитол-фосфолипидный – в гепатоцитах (главный ответ – распад гликогена). Вовторых, разные сигнальные молекулы (например, адреналин и вазопрессин), связываясь с разными рецепторами клеток одного типа (клеток печени) и запуская разные пути внутриклеточной сигнализации (адреналин – аденилатциклазный, вазопрессин – инозитол-фосфолипидный) могут приводить к одному и тому же клеточному ответу – активации гликогенолиза. Разные пути передачи сигнала с участием 7 ТМС рецепторов взаимодействуют между собой Каждый тип клетки имеет сложнейшую рецепторную систему, которая может отвечать на одновременное действие не одной – двух сигнальных молекул, а целой комбинации из нескольких десятков сигнальных молекул, которые активируют различные пути внутриклеточной сигнализации. Это предполагает существование довольно сложных механизмов взаимодействия между различными путями внутриклеточной сигнализации, обеспечивающих регуляцию функций данной клетки. Рис.11.11. Взаимосвязь цАМФ и ИФ3 зависимых путей передачи сигналов. На рис.11.11 представлены возможные механизмы взаимодействия между аденилатциклазным и инозитол-фосфолипидным путями внутриклеточной сигнализации. Важнейшим событием внутриклеточной сигнализации, осуществляемой через инозитол-фосфолипидный путь, является высвобождение из внутриклеточных депо ионов Са2+, которые могут активировать цАМФ – фосфодиэстеразу. Последняя вызывает разрушение цАМФ, что приводит к торможению эффектов аденилатциклазного пути, опосредованных повышением в клетке уровня цАМФ. Кроме того (на рисунке не показано), кальций - кальмодулиновые комплексы, связываясь с аденилатциклазой и цАМФ- фосфодиэстеразой, также могут регулировать их активность. Таким образом, через Са2+ и Са2+ - кальмодулиновый комплекс регулируется внутриклеточная концентрация цАМФ. С другой стороны, протеинкиназа А, активируемая цАМФ, способна фосфорилировать некоторые кальциевые каналы, повышать их проницаемость, что сопровождается изменением внутриклеточной концентрации ионов Са2+. Протеинкиназы, активируемые в одном из путей передачи сигналов, могут контролировать другой путь, катализируя фосфорилирование рецептора или ферментов, регулирующих уровень посредников второго пути. Чаще всего такое фосфорилирование блокирует передачу сигналов по второму пути. Однако в некоторых клетках два пути могут усиливать друг друга. Это наблюдается в том случае, когда протеинкиназы обоих путей (Са 2+ - зависимые киназы, кальмодулин- зависимые киназы, С- киназа и протеинкиназа А) фосфорилируют различные участки одного и того же белка. Например, в фосфорилировании гликогенсинтазы принимают участие кальмодулин - зависимая протеинкиназа, кальций-зависимая киназа, Скиназа и протеинкиназа А. Еще более сложными становятся взаимоотношения между системами переноса сигналов при подключении сигнальных путей, связанных с другими типами рецепторов. Многие рецепторы сами обладают ферментативной активностью. Как упоминалось выше, существует большая группа рецепторов, которые обладают ферментативной активностью. Это 1ТМС рецепторы. Взаимодействие с сигнальной молекулой активирует рецептор, который катализирует, как правило, фосфорилирование других ферментов или белков, являющихся регуляторами ферментативной активности. Гуанилатциклаза (ГЦ) - фермент с рецепторными функциями. Второй циклический пуриновый нуклеотид ц ГМФ закрепляет за циклическими пуриновыми нуклеотидами славу вторичных посредников в механизме переноса сигналов в клетку. При взаимодействии с сигнальной молекулой гуанилатциклаза катализирует образование гуанозин 3’,5’ - циклический монофосфата (циклический ГМФ или цГМФ) из ГТФ. Известны два типа (изофермента) ГЦ: 1.первый тип представлен двумя схожими мембраносвязанными формами, которые активируются внеклеточными лигандами: предсердным натрийуретическим фактором (НФП) (ГЦ в клетках почечных собирательных трубочек и гладкомышечных клетках кровеносных сосудов) и гуанилином (ГЦ в эпителиальных клетках кишечника). Гуанилиновый рецептор - также мишень бактериального эндотоксина, вызывающего тяжелую диарею. 2. второй тип - растворимый фермент, который активируется внутриклеточным оксидом азота (NO); эта форма найдена во многих тканях, включая мышечные клетки сердца и кровеносных сосудов Циклический ГМФ - вторичный посредник, который несет разные сообщения в различных тканях. В почке и кишечнике он вызывает изменения в транспорте ионов и воды; в сердеч ной мышце он способствует мышечному расслаблению, в мозге он может включаться Рис.11.12. Строение рецептора НФП. и в процессы развития и участвует в регуляции функций сформировавшегося мозга. ГЦ в почках активируется предсердным натрийуретическим фактором (НФП), который секретируется клетками предсердий при их растяжении от увеличения объема крови. Доставляемый по крови к почке, НФП активирует ГЦ в клетках собирательных трубочек. Повышение при этом уровня ц ГМФ способствует увеличению почечной экскреции Na и, следовательно, воды. Потеря воды восстанавливает объем крови, противодействуя стимулу, который первоначально вызвал секрецию НФП . Гладкие мышцы сосудов также имеет рецепторнyю гуанилатциклазу ; при связывании с этим рецептором, НФП вызывает расслабление мышц сосудистой стенки (вазодилятатацию), что ведет к снижению кровяного давления. Рецепторная ГЦ в плазматической мембране кишечных эпителиальных клеток активируется кишечным пептидом, гуанилином, который регулирует секрецию Cl- в кишечнике. Этот рецептор является также мишенью устойчивого к высокой температуре пептидного эндотоксина, образуемого E. coli и другими грамотрицательными бактериями. Повышение концентрации ц ГМФ, вызванной эндотоксином увеличивает секрецию Cl и следовательно уменьшает реабсорбцию воды кишечным эпителием, вызывая диарею. Рис 11.13. Синтаза оксида азота Совершенно иной тип ГЦ - цитозольный белок с прочно связанной группой гема (рис.11.12 ). Этот фермент активируется оксидом азота (NO). Последний образуется из аргинина Са2+ зависимой NO синтазой (NOC), присутствующей во многих животных тканях. NOC –сложный фермент, катализирующий образование оксида азота из аргинина(см рис). Комплекс Са2+-калмодулин обеспечивает формирование функционально активной пространственной организации доменов NOC, связанных с коферментами (гем, тетрагидробиоптерин и флавиновые коферменты ), необходимой для переноса электронов и протонов на молекулу кислорода. Оксид азота – газ, который легко распространяется путем диффузии из синтезировавшей его клетки к близлежащим клеткам. В клетках-мишенях, он связывается с группой гема ГЦ, активируя образование цГМФ. В сердце, цГМФ вызывает снижение силы сердечных сокращений, стимулируя ионные насос (ы), удаляющие кальций из цитозоля. Это индуцированное оксидом азота расслабление сердечной мышцы лежит в основе механизма действия таблеток нитроглицерина и других нитровазодилятаторов, принимаемых для уменьшения боли в сердце, вызванной нарушением доставки кислорода при спазмах коронарных сосудов. Оксид азота нестабилен, и его действие кратковременно; в течение нескольких секунд после его формирования, он подвергается окислению в нитриты или нитраты. Нитровазодилятаторы оказывают длительное расслабление сердечной мышцы, потому что они разрушаются медленно, обеспечивая более продолжительное действие NO. Избыточное кратковременное образование NO может привести к к развитию шока, а длительное ее образование лежит в основе развития хронического воспаления. Ишемические повреждения, возникающие при реперфузии, связаны с нарушением функции iNOС Большинство эффектов цГМФ, как предполагают, опосредуется цГМФзависимой протеинкиназой, также называемой протеинкиназой G или ПкG, которая фосфорилирует остатки Сер и Тре в белках- мишенях после ее активирования цГМФ. Каталитические и регулирующие домены этого фермента расположены на одном полипептиде. (ММ. 80,000). Связывание цГМФ активирует каталитический домен. Ц ГМФ обладает и другим действием. Оно проявляется в механизмах восприятия света: цГМФ стимулирует открытие специфичных ионных каналов в палочках и колбочках сетчатки. И наконец, цГМФ - активатор фосфодиэстераз, катализирующих гидролиз цАМФ и тем самым значительно снижающим эффект цАМФ опосредованных путей передачи сигнала в клетки. Наиболее широко распространенная группа 1ТМС рецепторов в клетках – рецепторные тирозинкиназы (РТК). В 1982 году впервые был открыт рецептор со свойствами тирозин -специфической протеинкиназы для эпидермального фактора роста (ЭФР). ЭФР- это маленький белок (53 аминокислоты), стимулирующий пролиферацию эпидермальных и некоторых других клеток. Его рецептор - классический 1TMS –рецептор. Он состоит из 1200 аминокислот и большой гликозилированной внеклеточной части, которая обеспечивает связывание ЭФР. При присоединении ЭФР активируется внутриклеточный домен, обладающий свойствами тирозинкиназы. Этот домен рецептора катализирует перенос остатка фосфорной кислоты на тирозиновый остаток самого рецептора и/или на тирозиновый остаток специфического внутриклеточного белка. Как оказалось, рецепторы многих других факторов роста также обладают свойствами тирозинкиназы и имеют ряд общих структурных и функциональных свойств. Можно выделить 4 основные домена в их структуре • Гликозилированный внеклеточный домен, связывающий лиганд. • Внутриклеточный домен с тирозинкиназной активностью. • Внутриклеточный регулирующий домен. • Трансмембранный домен Аминокислотные последовательности тирозинкиназных доменов РТК высоко консервативны и подобны цАМФ зависимой протеинкиназе (ПкА) в областях связывания АТФ и субстратов. Некоторые РТК имеет вставки аминокислотных последовательностей в киназные домены названные киназными вставками. РТК классифицируются на семейства, на основе структурных особенностей их внеклеточных частей: наличие или отсутствие киназных вставок, богатых цистеинами последовательностей, иммуноглобулинподобных областей, лейцин – богатых областей и т.д. Выделяют на по крайней мере на 14 различных семейств РПК. Некоторые рецепторные протеинкиназы могут катализировать фосфорилирование специальных белков цитозоля. Примером такого рода рецепторов является рецептор инсулина. Присоединение инсулина вызывает активирование его киназного домена, который помимо аутофосфорилирования, катализирует фосфорилирование остатков тирозина специального белка , названного субстратом инсулинового рецептора IRS-1. Фосфорилированные тирозиновые остатки связываются со специфическими доменами белков. Фосфотирозины , образующиеся в белках под влиянием рецеторной протеинкиназы затем служат местом присоединения и активирования многочисленных внутриклеточных белков. Способность связываться с фосфорилированными тирозинами обусловлена специфическими доменами в структуре таких белков, названными SH2 и SH3 доменами. Впервые эти домены бы ли обнаружены при исследовании механизмов развития опухолей (саркомы). Семейство протоонкогенов, выделенное при этих исследованиях и обладающих способностью связываться с тирозинами, получило название Src -семейства. Гомологичные домены, обнаруженные в других белках получили название SH2 и SH3 по аналогии с соответствующими участками Src белков ((S)rc (H)omology domain 2 или 3 ). Среди таких белков можно назвать фосфатидилинозитол 3-киназу (ФИ-3), фосфолипазу С-γ, белок, активирующий ГТФазу (GAP), Src –подобную нерецепторную тирозинкиназу и многие другие. Существует группа белков, названных малыми SH адапторными белками и состоящими из 2 доменов SH2 и SH3 . Эти белки не обладают каталитической активностью, а выполняют связующую роль между активированными тирозинкиназами и другими белками, которые не имеют своих SH2 и SH3 доменов. Известны и другие структуры, обеспечивающие узнавание фосфорилированных молекул. Фосфорилированные тирозины, таким образом, являясь местом присоединения разнообразных белков, служат инициаторами целых каскадов реакций, направленных на усиление сигналов и специфическое включение или выключение определенных функций, необходимых для выживания клеток, их пролиферации или программированной гибели. В передаче сигнала с участием 1ТМС рецепторов тоже есть выключатели. Важную роль в в передаче сигналов с участием активных рецепторных тирозинкиназ играют Ras белки. Ras белки - это се- Неактивная форма Р мейство мономерных ГТФаз. Подобно Ras ГТФ ГДФ БАГ содержат на С-конце ковалентно связан- Sos ГДФ Ras G-белкам (тримерным ГТФазам), они ный фарнезильный или геранильный остаток. С помощью такого гидрофоб- ГТФ ного конца белки Ras (p21ras) прикреп- Активная форма ляются к к цитоплазматической стороне плазматической мембраны. Ras белки участвуют в передаче сигнала от рецеторной тирозинкиназы к ядру при стимуляции клеточной пролиферации или дифференцировки факторами роста или гормонами. Если эти белки связать антителами, то нарушается передача информации и, как следствие, нарушается дифференцировка клеток , которая обычно вызывается активированием рецепторных тирозинкиназ. Как подобает мономерным ГТФазам, Ras белки могут переключать свою конформацию и быть активными, если к ним присоединяется ГТФ и становиться неактивными при замене ГТФ на ГДФ. Правда, Ras белки катализируют гидролиз ГТФ в 100 раз медленнее, чем большие тримерные G- белки и, учитывая высокую концентрацию ГТФ в клетке, Ras белки могут находиться в активном состоянии долго. Способность Ras белков взаимодействовать с ГТФ или катализировать ее гидролиз в свою очередь регулируется дополнительными белками. В клетках существуют 2 класса белков такого рода. Белок, активирующий ГТФазу (БАГ) усиливает степень гидролиза ГТФ Ras белками и поэтому инактивирует их, ингибируя передачу сигнала . Этому негативному регулятору противостоит белок, который ускоряет освобождение связанного ГДФ и замену его на ГТФ из цитозоля и поэтому оказывает активирующий эффект на Ras белок. Этот белок называют фактором, высвобождающим гуаниловые нуклеотиды (guanylnucleotide relisyng protein GRP. На рис 12-15 он обозначен Sos). Ras белки и их регуляторы консервативны в эволюции и подобны по строению у разных видов живых организмов. Фосфорилирование тирозина, катализируемое рецепторной протеинкиназой на цитоплазматической поверхности мембраны и активирование Ras длится короткий промежуток времени: специфические протеинфосфатазы катализируют дефосфорилирование тирозина, а активный Ras инактивируется путем гидролиза ГТФ, приостанавливая передачу сигнала внутрь клетки. В механизме передачи сигнала с участием 1ТМС рецепторов тоже есть система усиления сигнала. Подобно передаче сигналов с участием 7ТМС рецепторов, в механизме передачи сигналов с участием 1ТМС рецепторов существует своя система усиления сигнала. Она состоит из каскада ферментативных реакций, основу которых составляют протеинкиназы, наиболее хорошо изученными среди которых являются протеинкиназы, активируемые митогенами - МАП-киназы. Их называют также киназами, регулируемыми внеклеточными сигналами. Эти киназы могут активироваться не только РТК, но и рецепторами, связанными с G белками. Рецепторы, взаимодействующие с тирозинкиназами по механизму действия подобны рецепторным тирозинкиназам Существует большая гетерогенная группа 1ТМС рецепторов, которые не обладают ферментативной активностью. Эта группа включает рецепторы для большинства локальных регуляторов (названных цитокинами), регулирующих пролиферацию или дифференцировку гемопоэтических клеток, рецепторы для некоторых гормонов (гормон роста, пролактин) и антигенспецифические рецепторы Т и В лимфоцитов. Многие из этих рецепторов состоят из нескольких полипептидных цепей, не связанных друг с другом. Присоединение лиганда способствует ассоциации этих цепей в комплекс, способный взаимодействовать и активировать цитозольные тирозинкиназы Среди тирозинкиназ, взаимодействующих с рецепторами такого типа известны два хорошо изученных семейства нерецепторных протеинтирозинкиназ (Scr-семейство и Janus семейство ). В отличие от РТК они имеют 2 домена, один из которых обладает тирозинкиназной активностью, а второй обеспечивает взаимодействие с 1ТМС рецептором. После взаимодействия с рецептором и активирования тирозинпротеинкиназа может включать те же механизмы передачи сигнала, что и РТК. Некоторые представители этих семейств, обладающие SH2 доменами, могут активироваться путем присоединения к РТК. 1ТМС рецепторы могут катализировать дефосфорилирование белков. Тирозиновые остатки, фосфорилированные киназами, очень быстро дефосфорилируются протеинтирозин фосфатазами . Эти фосфатазы выделены в растворимой и мембраносвязанной формах и обладают высокой вариабельностью. Их высокая специфическая активность показывает, что фосфорилированные тирозины действуют короткое время, и их уровень очень низок в покоящейся клетке. Протеинтирозинфосфатазы не просто делают обратимым процесс фосфорилирования, но и сами могут быть регулируемыми и играть важную роль в клеточной сигнализации. Примером регулируемой протеинтирозин фосфатазы является белок СД45, который обнаружен на поверхности лейкоцитов и играет существенную роль в активировании Т и В лимфоцитов чужеродными антигенами. Белок СД45 - одноцепочечный трансмембранный гликопротеин расположенный на цитоплазматической стороне мембраны. Его нормальный лиганд неизвестен, но при активировании его каталитический домен участвует в удалении фосфатных групп на тирозиновых остатках белков-мишеней. 1ТМС рецепторы могут обладать и серин/треонин протеинкиназной активностью. Как упоминалось ранее, в цитозоле существует большая группа МАП-киназ –протеинкиназ с серин / треонин протеинкиназной активностью. Однако, как оказалось, такой активностью обладают и некоторые рецепторы. Одним из первых среди таких рецепторов был изучен рецептор для трансформирующего фактора роста βs (ТФР- βs). Существует семейство локальных медиаторов, которые регулируют пролиферацию и некоторые функции большинства типов клеток позвоночных. Пять членов этого семейства (ТФР- βs1- ТФР- βs 5) являются белками схожей структуры и функций. В зависимости от типа клеток они могут оказывать разное влияние: подавлять пролиферацию, стимулировать синтез белков внеклеточного матрикса, стимулировать образование костей. Сигнальные гидрофобные молекулы взаимодействуют с внутриядерными и цитозольными рецепторами Витамин Д, ретиноевая кислота, стероидные и тиреоидные гормоны связываются с внутриклеточными рецепторами, которые являются лигандоактивируемыми белками, регулирующими генную активность. Несмотря на различия этих гидрофобных сигнальных молекул по химической структуре и функции, общий механизм их действия во многом сходен. Они свободно диффундируют через плазматическую мембрану клетки-мишени и обратимо связываются с внутриклеточными рецепторными белками. Связывание лиганда ведет к изменению конформации рецепторного белка (процесс, называемый активацией рецептора), что повышает сродство последнего к ДНК и позволяет рецептору связываться со специфическими генами в ядре и регулировать их экспрессию. Рецепторы витамина Д, ретиноевой кислоты, стероидных и тиреоиднык гормонов образуют суперсемейство внутриклеточных рецепторов. Рецепторы этого суперсемейства на основе различий их аминокислотных последовательностей можно разделить на 2 подсемейства: подсемейство рецепторов стероидных гормонов и подсемейство рецепторов тиреоидных гормонов. К рецепторам подсемейства стероицных гормонов относятся рецепторы глюкокортикоидов, минералокортикоидов, андрогенов, прогестерона. К рецепторам подсемейства тиреоидных гормонов относятся рецепторы эстрогенов, тиреоидных гормонов, витамина Д и ретиноевой кислоты Рецепторы подсемейства стероидных гормонов, находясь в цитозоле, образуют мультимерные комплексы с белками теплового шока (heat shack proteins - hsp): hsp 90, hsp 70 и hsp 56. Белки теплового шока блокируют ДНК-связывающий домен рецептора. Связывание гормона рецептором приводит к отделению белка-ингибитора, и в результате рецептор активируется. Активированный гормонорецепторный комплекс подвергается транслокации в ядро, где и происходит его взаимодействие со строго определенными гормонузнающими элементами ДНК (hormone response element -HREs). Рецепторы подсемейства тиреоидных гормонов находятся преимущественно в ядре в связанном с хроматином состоянии, за исключением рецепторов эстрогенов, которые в ядре образуют комплексы с hsp 90. Полипептидная цепь рецепторов стероидных гормонов содержит от 800 до 1000 аминокислотных остатков и образует 3 домена: 1) гормоносвязываощий домен; 2) ДНК-связывающий домен и 3) вариирующая область, содержащая геноактивирующий домен (домен, активирующий транскрипцию). Центральная часть молекулы каждого рецептора стероидных гормонов содержит ДНК-связывающий домен. Аминокислотные последовательности этого домена у разных рецепторов стероидных гормонов являются высокогомологичными. Достаточно обширная N-концевая область рецепторов стероидных гормонов содержит последовательности, вовлеченные в активацию экспрессии генов. Удаление этой области у рецепторов стероидных гормонов лишает их способности активировать экспрессию генов. Гормоносвяэывающий домен находится в С-концевой области рецепторов стероиднык гормонов. Внутриклеточные рецепторы трийодтиронина (ТЗ) и тироксина (Т4) являются белками с молекулярной массой 53—55 кДа. Существуют 4 изоформы рецептора тиреоидных гормонов: α1, α2, β1, β2 ГОРМОНЫ ГИПОТАЛАМУСА И ГИПОФИЗА Выпадение функции передней доли гипофиза (пангипопитуитаризм) приводит к резкому изменению функций других желез внутренней секреции (щитовидной железы, коры надпочечников и половых желез), что в свою очередь вызывает нарушения метаболизма в органах мишенях гормонов секретируемых этими железами. Нарушение функции задней доли гипофиза проявляется в форме несахарного диабета, нарушении родовой деятельности. Нарушение функций гипоталамуса изменяют функциональную активность гипофиза. Гипоталамус являясь областью ЦНС при участии нейромедиаторов, гипофизотропных гормонов, а также симпатической и парасимпатической частей вегетативной нервной системы играет интегративную роль в регуляции функциональной активности гипофиза и периферических эндокринных желез. Нейроны гипоталамуса –нейросекреторные клетки Клетки гипоталамуса - это нейроны, но в отличие от других нейронов, образующих нейромедиаторы в областях контакта с другими клетками, нейроны гипоталамуса высвобождают свой секрет в капиллярную сеть, доставляющую их секрет к клеткам гипофиза. Преобладающими молекулами их секрета являются гормоны, оказывающие регулирующее влияние на образование и секрецию гормонов передней доли гипофиза – гипофизотрофные гормоны. Известные в настоящее время гипофизотропные гормоны гипоталамуса делятся на гормоны, усиливающие (высвобождающие, рилизинг-гормоны) и угнетающие (ингибирующие) секрецию и высвобождение (выделение) соответствующих тропных гормонов передней доли гипофиза. Комиссия по биохимической номенклатуре Международного общества чистой и прикладной химии Международного биохимического общества (1974 г.) рекомендовала принять окончание “либерин” в названиях гормонов гипоталамуса, усиливающих высвобождение соответствующих тропных гормонов гипофиза (например, гонадолиберин), и окончание “статин” в названиях гормонов с ингибирующим эффектом (например, пролактостатин). Таблица 11.7. Гормоны гипоталамуса Кортиколиберин - кортикотропин-рилизинг гормон или фактор КРГ(CRF или CRH) Белок (41 Ак) Влияет на кортикотрофы стимулируя образование АКТГ и β-эндорфина (липотропина) Гонадолиберин (люлиберин)- гормон (фактор), высвобождающий лютеинизирующий и фолликулостимулирующий гормоны ГнРГ Полипепптид (10 Ак) Влияет на гонадотрофы, стимулируя образование ЛГ и ФСГ Пролактолиберин- пролактин-рилизинг го1рмон (PRF), функцию которого выполня- См тиролиберин ют, вероятно, тиролиберин и ВИП Влияет на лактотрофы, способствуя выделению пролактина Пролактостатин - гормон, угнетающий высвобождение пролактина Влияет на лактотрофы, Пептид (56 Ак) или ингибируя выделение продофамин ? лактина Соматолиберин - соматотропин-рилизинггормон (GRF or GRH) Соматостатин - гормон, угнетающий высвобождение гормона роста (SIFили GIF) Тиролиберин - тиротропин-рилизинг гормон (TRH или ТRF) ТРГ Пептид [40 (сывоСтимулирует секрецию ротка) и 44 (гипогормона роста таламус) Ак] Полипептид (14 и 28 Ак) Трипептид : EHP Ингибирует секрецию ГР и ТСГ Стимулирует секрецию ТСГ и пролактина Меланолиберин Пептид Стимулирует секрецию МСГ Меланостатин Пептид Ингибирует секрецию МСГ Нейроны паравентрикулярного ядра гипоталамуса секретируют тиролиберин и кортиколиберин, дугообразное (аркуатное) ядро содержит нейроны, секретирующие соматолиберин и пролактостатин. Нейроны, секретирующие соматостатин, располагаются в передней гипоталамической области, а гонадолиберин – в предоптической области. Аксоны секретирующих нейронов заканчиваются в области срединного возвышения гипоталамуса, где начинается портальная система гипофиза, c помощью которой гипоталамус сообщается с передней долей гипофиза. Система портального кровообращения становится путем доставки гормонов к клеткам аденогипофиза, модулируя специфическую активность. Гипоталамусы 500000 овец были использованы для получения 1 мг кристаллического кортиколиберина в начале 80-х годов ХХ века для полной химической характеристики этого гормона. Кортиколиберин секретируется нейронами, расположенными главным образом в паравентрикулярном ядре и в меньшей мере нейронами других ядер гипоталамуса , хотя обнаружены нейроны , секретирующие кортиколиберин и в других отделах нервной системы. Иммуннореактивный кортиколиберин выявляется и в различных органах, например, в мозговом слое надпочечника, печени, поджелудочной железе, спинном мозге, плаценте. Такой тканевой кортиколиберин оказывает более продолжительное, чем гипофизотропный кортиколиберин, высвобождение АКТГ. Кортитропин-рилизинг-фактор или кортиколиберин представляет полипептид, состоящий из 41 аминокислоты с молекулярной массой 4758 Гормональной активностью обладает отрезок содержащий 15-41 аминокислотный остаток. Пептид синтезируется в составе прогормона , состоящего из 196 аминокислот. Время полураспада в плазме около 60 мин. Кортиколиберин стимулирует высвобождение АКТГ и других гормонов, входящих в состав проопиомеланокортина (ПОМК). Действие кортиколиберина на гипофиз можно снять высокими дозами кортизола. Мембраны кортикотрофов имеют 7ТМС рецептор, связывающий кортико- либерин, который после связывания с гормоном, активирует аденилатциклазный каскад передачи сигналов в клетку. Стимуляция высвобождения АКТГ наблюдается только в присутствии Са2+. Действием, подобным кортиколиберину, обладает и гормон задней доли гипофиза вазопрессин, правда в дозах в тысячи раз превышающих его антидиуретический эффект. В физиологических дозах вазопрессин оказывает потенцирующий эффект на действие кортиколиберина. Подобным усиливающим действием обладают также адреналин и ангиотензин II. Вазопрессин это делает через инозитолфосфатную систему, а адреналин и ангиотензин II – через цАМФ. На скорость биосинтеза и высвобождения кортиколиберина оказывают влияние многие моноамины. Так, адреналин, норадреналин, серотонин, ацетилхолин, глютамин, ангиотензин II, нейропептид Y и аспартамин стимулируют, а аргинин вазопрессин, g-аминомасляная кислота, вещество Р и опиоидные пептиды угнетают высвобождения кортиколиберина. Кроме того, холецистокинин, гастринвысвобождающий пептид, предсердный натрийуретический гормон также способны стимулировать высвобождение АКТГ. Таким образом, кортиколиберин стимулирует синтез и высвобождение АКТГ посредством цАМФ и системы ФИФ2 (инозитолфосфатная система), являющейся вторичным посредником вазопрессина. Повышение концентрации калия деполяризует клеточную мембрану и в присутствии ионов кальция происходит высвобождение АКТГ. Это действие кортиколиберина не требует синтеза белка. Кроме того, кортиколиберин ускоряет биосинтез АКТГ de novo, и это влияние может быть угнетено пуромицином и актиномицином D. К началу 80-х годов ХХ столетия была изучена химическая структура еще одного гипоталамического гипофизотрофина – соматолиберина, хотя впервые его получили из гипоталамуса еще в 1964 г. Молекула соматолиберина человека включает 44 аминокислотных остатка. N-концевой отрезок из 29 аминокислот обеспечивает биологическую активность этого гормона. Основное место синтеза соматолиберина - дугообразное (аркуатное) и вентромедиальное ядра гипоталамуса. Высвобождение соматолиберина стимулируется серотонином и норадреналином. В 1973 г при выделении соматолиберина из гипоталамуса удалось обнаружить полипептид, который тормозил секрецию гормона роста клетками гипофиза. Аминокислотная последовательность этого пептида была установлена в том же году. Присутствие двух остатков цистеина позволяет этому пептиду существовать в двух формах окисленной (циклической) и восстановленной (линейной). Обе формы обладают одинаковой биологической активностью. В последующем была выделена еще одна форма этого гормона, состоящая из 28 аминокислот. Все эти пептиды получили название соматостатинов. Молекулярная масса сомато- статина-14 равна 1638,12 Да, а соматостатина-28 - 3149 Да. Рецепторы соматостатина относятся к классу 7ТМС рецепторов. Секретируемый клетками желудочно кишечного тракта, соматостатин оказывает влияние на моторную и секреторную функции пищеварительной системы, ее кровообращение и кишечную абсорбцию. Он задерживает эвакуацию желудочного содержимого, угнетая высвобождение мотилина – гормона, стимулирующего моторику желудочно-кишечного тракта, снижает сократитильную активность желчного пузыря путем торможения действия холецистокинина. Соматостатин также угнетает секрецию инсулина и глюкагона поджелудочной железой. Список гормонов, секреция которых тормозится соматостатином довольно большой и включает помимо гормонов гипофиза (ТТГ, СТГ) еще и гастрин, секретин, инсулин, глюкагон, мотилин, глицентин, ВИП, ренин и др. Гормон роста действует по принципу положительной обратной связи, усиливая синтез и увеличивая содержание соматостатина в гипоталамусе. Самым первым из гипофизотропных гормонов, у которого была расшифрована химическая структура, является тиротропин-рилизинг-гормон или тиролиберин (1970). Он представляет собой трипептид следующего состава: пироГлу-Гис-Гли-NH2 с молекулярной массой 362, 42 Да. Он был и первым синтезированным гипоталамическим гормоном. Около 70% всего тиролиберина образуется вне гипоталамуса., где он выполняет роль нейромедиатора или нейромодулятора, оказывая в основном стимулирующее влияние (повышение спонтанной двигательной активности, артериального давления и т.д.). Время его полураспада составляет 3-4 мин (у больных тиротоксикозом 2 мин, а при гипотиреозе около 6 мин ). В начале 70-х годов ХХ века была установлена структура еще одного гормона гипоталамуса –гонадолиберина с молекулярной массой - 1182, 39. У человека наибольшее количество нейронов, содержащих гонадолиберин, локализуется главным образом в области медиобазального гипоталамуса между третьим желудочком и срединным возвышением, но обнаружены и в других областях ЦНС, ответственных за эмоциональное и половое поведение. В регуляции секреции гонадолиберина участвуют половые гормоны и моноамины. Высвобождение гонадолиберина как и других гормонов гипоталамуса происходит пульсирующим способом. По портальной системе гипофиза гонадолиберин попадает в гипофиз, где связывается рецепторами плазматических мембран клеток передней доли. Рецептор гонадолиберина относится к классу 7ТМС рецепторов, который связан с нозитолтрифосфатным путем передачи сигнала и мобилизацией кальция, вызывая повышение содержания внутриклеточного кальция ведущего к высвобождению ЛГ. Изменение количества рецепторов к гонадолиберину является важным фактором регуляции секреции гонадотропинов. Так, эстрогены и андрогены уменьшают количество ре- цепторов к гонадолиберину. Рецепторы к гонадолиберину помимо клеток передней доли гипофиза выявлены также в яичниках, где, видимо, гонадолиберин оказывает паракринное влияние. Период полураспада гонадолиберина в плазме составляет 5-7 минут. Если на большую часть гормонов гипофиза гипоталамус оказывает активирующее действие, то секреция пролактина гипоталамусом ингибируется. Это связывали с влиянием специального пептида –пролактостатина, хотя уже с конца 70-х годов получаемые данные заставляют усомниться в существовании такого регулятора. На роль пролактостатина все больше претендуют моноамины и прежде всего дофамин, ингибирующее влияние которого на образования пролактина уже давно известно, хотя и не исключается полностью возможность, что дофамин оказывает стимулирующее влияние на секрецию и высвобождение реально существующего пролактостатина. Функции пролактостатина может выполнять выделенный из эксрактов гипоталамуса 56-аминокислотный нейропептид, обладающий как гонадолибериновой активностью, так и активностью гормона, подавляющего высвобождение пролактина. Его назвали гонадолиберин-ассоциированным (связанным) пептидом (ГАП, GAP). ГАП является мощным ингибитором секреции пролактина. Дофамин оказывает свое ингибирующее действие на лактотрофы посредством специфических рецепторов, относимых к классу 7ТМС рецепторов, ингибирующих образование цАМФ, синтез фосфоинозитола, арахидоновой кислоты и обмен фосфолипидов. В пользу пролактостатической активности дофамина свидетельствуют клинические наблюдения по успешному применению для лечения гиперпролактинемии агонистов дофамина (парлодел, лизурид и др.). Пролактолиберин (тиролиберин). Исследование экстрактов гипоталамусов выявило их стимулирующее влияние на секрецию пролактина, что дало повод предположить о существовании специфического пролактолиберина, однако подобным эффектом обладал и тиролиберин, с которым многие связывают пролактолибериновую активность. Из гипоталамуса выделен ряд веществ, обладающих активностью пролактолиберина: ВИП, окситоцин, вазопрессин, пептид-гистидин-изолейцин-27 или PHI-27. Показано, что ВИП стимулирует непосредственно секрецию пролактина гипофизом при его добавлении в инкубационную среду или in vivo. Концентрация ВИП в портальной системе гипофиза достаточна для стимуляции высвобождения пролактина. Серотонин оказывает влияние на секрецию пролактина через стимуляцию высвобождения ВИП. Помимо ВИП, кандидатом на пролактолиберин является пептид гистидин-изолейцин, который имеет структурную гомологию с ВИП и обнаружен вместе с кортиколиберином в нейронах паравентрикулярного ядра. Меланостатин и меланолиберин. У животных были получены пептиды, оказывающие влияние на секрецию меланоцитостимулирующего гормона. Ферментативный гидролиз ок- ситоцина позволил получить ряд пептидов с меланостатической активностью. Из гипоталамуса получен гормон, усиливающий высвобождение МСГ-меланолиберин (пентапептид со следующей последовательностью аминокислотных остатков: Цис-Тир-Иле-Гли-Асн-OH). У человека в связи с отсутствием средней доли гипофиза самостоятельно не секретируется ни α-, ни β-МСГ, поэтому нет никаких предпосылок и для наличия меланостатина и меланолиберина в гипоталамусе. Однако клиническое испытание пептидов с меланостатической активностью показало их выраженное нейрофизиологическое влияние на поведение, что позволило применить такие пептиды для лечения паркинсонизма и психической депрессии. Гипофизотропным действием обладают и многие другие соединения, выделенные из гипоталамуса. К ним относятся: вещество P, гастринвысвобождающий пептид, ВИП, пептид YY, секретин, пептид-гистидин-метионин-27,нейропептид Y, нейротензин, мотилин, катакальцин, галанин, кальцитонин, ангиотензин-1 и 2, a-предсердный натрийуретический пептид, натрийуретический пептид-32 мозга, октапептид холецистокинина и др. Гормоны передней доли гипофиза можно разделить на три группы. Передняя доля ( pars anterior ) –состоит из функционально и структурно различных клеток, классифицируемых по отношению к гистологическим красителям на базофильные , эозинофильные и хромофобные клетки. Применение иммуноцитохимических методов исследования позволило усовершенствовать классификацию клеток передней доли гипофиза, выделив пять типов основных секретирующих гормоны клеток. (см табл.11.8 ) Таблица 11.8. Типы клеток гипофиза и их продукты Тип клеток Секретируемые гормоны Соматотрофы (аци40-50%. Соматотропный гордофильные клетки) мон, СТГ, соматотропин Лактотрофы, (ацидофильные клетки) 15-20 % Пролактин Тиротрофы, базофильные клетки 3-5% ТТГ, тиреотропин Кортикотрофы, базофильные клетки 15-20% ПОМК (АКТГ липотрофины, эндорфины) Гонадотрофы, базофильные клетки 10-15% ФСГ и ЛГ Эффект стимулирует линейный рост организма, синтез белка в клетках, образование глюкозы и распад липидов , оказывает прямое и опосредованное влияние на периферические ткани регулирует лактацию у млекопитающих, дифференцировку различных тканей, оказывает регулирующее влияние на инстинкты выхаживания потомства регулятор биосинтеза и секреции гормонов щитовидной железы Кортикотропин регулирует секрецию гормонов коры надпочечников ЛГ регулятор биосинтеза женских и мужских половых гормонов, стимулятор роста и созрева- Хромофобные клетки (нулевые клетки) ния фолликулов , овуляции, образования и функционирования желтого тела в яичниках. ФСГ -оказывает сенсибилизирующее действие на фолликулы и клетки Лейдига к действию ЛГ, и стимулирует сперматогенез. Предшественники секретирующих клеток Как видно из таблицы, большая часть гормонов передней доли гипофиза являются специфическими регуляторами других (периферических) эндокринных желез. Их называют "тропными" гормонами гипофиза. Исследование химической структуры, механизма действия и особенностей обмена гормонов гипофиза позволило выделить три группы гормонов • гормоны, не обладающие ярко выраженным тропным действием. Это гормоны белковой природы - соматомаммотропины - СТГ и пролактин • гормоны – сложные белки (гликопротеины) - ФСГ, ЛГ и ТТГ • гормоны – полипептиды, производные ПОМК - АКТГ, липотропины, МСГ, эндорфины Великаны и карлики- следствие нарушений функций гормона роста Впервые гормон роста (ГР) выделили в 1945 г из экстракта гипофиза быка. У человека ГР представляет собой полипептидную цепь, состоящую из 191 аминокислотного остатка. В отличие от ряда гормонов гипофиза влияние гормона на рост и метаболические процессы не связана с каким-то определенным фрагментом молекулы, для ее проявления, по-видимому, необходима полная молекула ГР. Соматотропины характеризуются выраженной видовой специфичностью. ГР разных животных (за исключением приматов) не проявляют биологической активности при введении их человеку, хотя ГР человека оказывает влияние на другие виды животных. Видовая специфичность определяется не только особенностями самого гормона, но связана и с особенностями рецепторов к гормону. Сам ГР обладает лактогенной активностью. В механизмах действия гормона роста участвуют посредники Многие эффекты гормона роста на периферические ткани зависят от взаимодействия между гормоном роста и соматомединами. Соматомедины – тканевые факторы, секретируемые под влиянием гормона роста. Один из первых соматомединов называли фактором сульфатирования , так как он усиливал использование сульфата хрящевой тканью. Одновременно усиливался синтез коллагена. Оказалось, что подобным эффектом обладает целое семейство факторов, которые назвали соматомединами. Соматомедины в свою очередь являются члена- ми суперсемейства факторов роста, влияющих на многие ткани и органы. Важнейшими (а у людей возможно единственными) соматомединами в циркулирующей крови являются подобный инсулину фактор роста I (ИФР-I, соматомедин C) и подобный инсулину фактор роста II (ИФР – II). Эти названия они получили за их структурную схожесть с проинсулином. Гормон релаксин, выделяемый желтым телом, маткой, предстательной железой, структурно подобен ИФР-II- также может быть отнесен к этому семейству; У людей выделены вариантные формы ИФР-I из мозга. Соматомедины выделены из многих органов. Конечный эффект гормона роста на метаболизм определяется сочетанием прямого и опосредованного ИФР влияния на клетки Сочетаясь в разных пропорциях с циркулирующим и локально образуемым ИФР-I ГР оказывает многообразное влияние на процессы метаболизма в отдельных клетках и тканях. Обмен белков. Основное действие гормона роста направлено на регуляцию обмена белков и процессов, связанных с ростом и развитием организма. Рис.11.14. Прямые и опосредованные через ИФР-1 эффекты ГР. Под влиянием гормона роста усиливается синтез белка в костях, хрящах, мышцах, печени и других внутренних органах, увеличивается общее количество РHК, синтез ДHК и общее число клеток, повышается активность ДHК-зависимой РHК-полимеразы, ускоряется транспорт аминокислот внутрь клеток через клеточную мембрану, тормозятся процессы катаболизма белков. Последнее проявляется снижением уровня остаточного азота и мочевины в крови, положительным азотистым балансом. ГР посредством стимуляции синтеза эпифизарного хряща оказывает влияние на рост в длину неполовозрелых животных. Кроме того, в связи с активацией периостального роста, увеличивается ширина и толщина костей. Одновременно с ростом костей происходит пропорциональный рост мышц и внутренних органов (сердце, легкие, печень, почки, кишечник, поджелудочная железа, надпочечники и др.). Обмен липидов. Хотя однократное введение ГР оказывает преходящее (в течение 3040 мин) инсулиноподобное действие, что проявляется усилением процессов липогенеза, однако в дальнейшем усиливаются процессы липолиза с повышением мобилизации жира из депо, что приводит к повышению в плазме крови свободных жирных кислот, а в случае недостаточности инсулина увеличивается содержание кетоновых тел в крови. Энергия, образующаяся при повышенном распаде жиров, используется на анаболические процессы белкового обмена. Углеводный обмен. ГР участвует в механизмах регуляции уровня глюкозы в крови. За ним давно закрепилось название «контринсулярный» гормон. При длительном его введении снижается использование глюкозы жировыми тканями и мышцами и активируются процессы глюконеогенеза в печени. Показано, что ГР стимулирует a-клетки поджелудочной железы, секретирующие глюкагон, и повышает активность ферментов, разрушающих инсулин. Это антиинсулиновое влияние гормона роста компенсируется повышением секреции инсулина, и гиперинсулинемией, что может вызывать истощение резервных возможностей bклеток поджелудочной железы и постепенно смениться гипоинсулинемией, абсолютной инсулиновой недостаточностью и развитием сахарного диабета. Повышение уровня инсулина в крови вызывает снижение количества рецепторов в инсулинзависимых тканях и развитию резистентности к инсулину. Минеральный обмен. ГР способствует накоплению кальция, магния и фосфата и вызывает задержку Na+, К+ и С1~. Эти эффекты можно связать с действием ГР на рост костной ткани: он стимулирует рост длинных костей в области эпифизарных пластинок у детей и аппозиционный или акральный рост у взрослых. У детей ГР усиливает и образование хряща ГР - один из факторов, регулирующих рост. Cодержание гормона роста в сыворотке крови при определении радиоиммунологическим методом составляет 3,82+0,24 нг/мл (от 1 до 4,5 нг/мл). Обычно утром натощак у здорового человека уровень ГР в плазме крови не превышает 5 нг/мл (232 пмоль/л). Период полураспада в сыворотке или плазме крови составляет 20-40 мин. Около 5% ГР, содержащегося в гипофизе, ежедневно высвобождается, что составляет около 1,2 мг за 24 ч Секреция гормона роста носит пульсирующий характер и зависит от многих факторов (см. Таб.11.8. ) Точкой приложения влияния этих факторов является гипоталамус, обеспечивающей регуляцию по принципу обратной связи. Таблица 11.8. Стимулы, которые влияют на секрецию гормона роста у людей. Стимулы, которые увеличивают секрецию Стимулы, снижающие секрецию Дефицит энергетических субстратов Голода- Глюкоза ние Гипогликемия Кортизол Физические упражнения Увеличение уровня некоторых аминокислот в крови Преимущественно белковое питание Стресс (боль, холод, тревога, хирургическое вмешательство) Введение аргинина и некоторых других аминокислот Глюкагон Лизин вазопрессин Засыпание L ДОФA и альфаадренэргические факторы Эстрогены и андрогены жирные кислоты ГР Некоторые эффекты соматолиберина дублируются дофамином, который также повышает продукцию гормона роста. Торможение секреции гормона роста обеспечивается соматостатином, который, может подавлять секрецию глюкагона, инсулина, тиреотропина, фоллитропина, адренокортикотропина и многих других гормонов, но не влияет на высвобождение пролактина и его синтез. Рост –сложный физиологический процесс, на который оказывают влияние многочисленные факторы. У людей выделяют два периода быстрого роста: первый в младенческом возрасте и второй - в позднем пубертатном периоде, перед прекращением роста. Первый период ускоренного роста - частично продолжение эмбрионального периода роста. Второй всплеск роста, во время половой зрелости, является следствием влияния гормона роста, андрогенов, и эстрогенов. Это может быть связано с анаболическим влиянием андрогенов, и повышенной секрецией андрогенов в надпочечниках в это время у обоих полов. Однако, это является и следствием взаимодействия между половыми стероидами, гормоном роста, и ИФР-I. Введение эстрогенов и андрогенов усиливает ответы гормона роста на стимулы типа инсулина и аргинина. Половые стероиды также увеличивают уровень ИРФ-1 в плазме, но не в состоя- нии вызвать это увеличение у людей с дефицитом гормона роста. По-видимому, половые гормоны вызывают увеличение амплитуды пиков секреции гормона роста, что увеличивает секрецию ИФР-1, и это в свою очередь вызывает ускорение роста. Хотя андрогены и эстрогены первоначально стимулируют рост, эстрогены в конечном счете обеспечивают завершение роста, Рис 11.15.Участие гормонов в регуляции роста человека в разные периоды жизни. вызывая закрытие эпифизов трубчатых костей. Так как девочки созревают раньше мальчиков, этот всплеск роста появляется раньше у девочек. ГР активно участвует в обоих периодах, поэтому изменение его влияния существенно сказываются на конечном результирующем росте. Нарушения роста может возникать на разных этапах жизни человека. Одной из важнейших внешних причин, оказывающих влияние на рост, является питание. Неполноценное питания в периоды интенсивного роста сопровождается нарушениями роста, травмы и заболевания, сопровождающиеся усилением катаболизма белков также ведут к нарушению роста. Однако наиболее частыми причинами, вызывающими изменения механизмов роста являются изменения секреции гормона роста. Они могут проявляться по разному, в зависимости от времени их наступления. Избыточная секреция СТГ в молодом возрасте (у детей и подростков) обычно приводит к развитию гигантизма, при котором отмечается пропорциональный рост костей скелета (гигантизмом принято называть рост выше 190 см). При отсутствии адекватного лечения гигантизма и длительном течении заболевания у этих больных могут возникать признаки акромегалии. Акромегалия - заболевание, развитие которого обусловлено повышенной секрецией гормона роста у лиц с закончившимся физиологическим ростом и характеризуется патологическим диспропорциональным ростом костей скелета, мягких тканей, внутренних органов, а также нарушением обмена веществ. Акромегалия - сравнительно редкое заболевание, его распространенность составляет 40-70 на 1 млн населения и встречается практически одинаково часто как у мужчин, так и у женщин в возрасте 35-45 лет. Почти в 99% случаев акромегалия является следствием избыточной секреции СТГ аденомой гипофиза (соматотропинома) и около 1% случаев связано с нарушением функции гипоталамуса, серетирующего соматотропин или при опухолях, клетки которых секретируют соматотропин (опухоли бронхов, поджелудочной железы, надпочечников и ворот почки). Продолжительная повышенная секреция ГР и высокий уровень ИФР 1 в сыворотке крови приводят к изменению толерантности к глюкозе и в дальнейшем к сахарному диабету, хотя содержание иммунореактивного инсулина в сыворотке крови больных акромегалией натощак повышено. Это можно объяснить уменьшением количества рецепторов к инсулину и развитием относительной инсулиновой недостаточности. У молодых женщин, страдающих акромегалией встречается галакторея, что связано с повышением секреции пролактина или является избыточной секреции ГР, который обладает лактогенной активностью. Hарушается функция половых желез. У женщин, страдающих акромегалией, имеется нарушение менструального цикла вплоть до аменореи, а у мужчин снижается потенция и либидо нарушается сперматогенез и может развиться атрофия семенников. Если причинами гигантизма и акромегалии является усиление секреции ГР, то причины карликового роста (карликовым считается рост у мужчин ниже 130 см и у женщин менее 120 см) многобразны и не всегда связаны со снижением секреции ГР. Такими причинами могут быть: 1. изолированная или сочетанная с другими гормонами гипофизарная недостаточность синтеза и секреции ГР, 2. недостаточность образования и секреции соматолиберина в гипоталамусе, 3. наследственные формы недостаточности, связанные с мутациями гена ГР, гена фактора регуляции синтеза ГР (Pit-1), нарушениями сплайсинга иРНК, кодирующего ГР, 4. синдром высокого содержания белка связывающего ГР, 5. Образование дефектных рецепторов к гормону роста – (синдром Ларона), 6. Hедостаточность соматомединов (и ИФР 1 и ИФР-2 или только ИФР-1 при нормальном уровне ИФР-2), 7. Отсутствие рецепторов к ИФР 1, 8. Нарушение пострецепторного механизма действия ИФР 1., 9. Пороки развития, заболевания печени, опухоли гипофиза и т.д.., В большинстве случаев причину установить трудно, хотя принято считать карликовость чаще всего генетически обусловленным нарушением роста. Самые сложные белковые гормоны. Группу гормонов передней доли гипофиза: тиротропный гормон (тиротропин, ТТГ), ФСГ (фоллитропин), ЛГ (лютропин) и хорионический гонадотропин объединяет несколько общих структурных признаков: 1.Молекулы этих гормонов состоят из двух субъединиц (α и β ) 2. Молекулы этих гормонов содержат углеводы. 3. α – Субъединица имеет одинаковый аминокислотный состав у всех гормонов этой группы. Она состоит из 89 аминокислотных остатков с молекулярной массой 14 кДа. Рекомбинация α субъединиц одного гормона этой группы с β субъединицами другого показывает, что специфиче- ские свойства гормона (узнавание рецептора, иммунные свойства) определяются β субъединицей. Структура названных гормонов была впервые проанализирована в начале 70-х годов ХХ века. Тиреотропин – основной регулятор функции щитовидной железы, синтезируется базофильными клетками передней доли гипофиза. На секрецию ТТГ оказывают влияние и другие регуляторы: соматостатин и дофамин ингибируют, вазопрессин активирует образование ТТГ. Гонадотропины- гормоны регулирующие функциональную активность половых желез Гонадотропные гормоны – члены семейства гормонов –гликопротеинов представлены фолликулостимулирующим гормоном ( ФСГ, фоллитропином), лютеинизирующим гормоном (ЛГ, лютропином), синтезируемыми гонадотрофами гипофиза и хорионическим гонатотропином (ХГ). Гонадотрофы в гипофизе составляют 10-15% клеточного состава передней доли гипофиза и расположены по соседству с лактотрофами, что обеспечивает паракринную связь между этими клетками. Молекулярная масса ФСГ около 33 кДа, ЛГ – около 29 кДа. ХГ синтезируется трофобластом плаценты и имеет молекулярную массу около 36.7 кДа. Период полураспада гормонов в крови определяется структурой их углеводной части и составляет для ФСГ около часа, для ЛГ – 25-30 мин, а для ХГ, обладающего наибольшим количеством углеводов в структуре молекулы – 8 часов. Мембраны гонадотрофов содержат 7 ТМС рецепторы, взаимодействующие с гонадолиберином гипоталамуса, синтез которого жестко регулируется по механизму обратной отрицательной связи половыми гормонами, а также многочисленными нейромедиаторами и другими регуляторами, влияющими на гипоталамус . Гонадолиберин оказывает стимулирующее влияние на высвобождение обоих гонадотропинов, хотя влияние его на секрецию ФСГ модулируется ингибинами и активинами, Гонадотропины у мужчин и женщин выполняют разные функции. Наиболее хорошо изучено их влияние у женщин. Изменения секреции гонадотропинов подчиняется часовым, суточным, месячным циклическим процессам. Изменение или появление новых циклов тесно связано с возрастным развитием женского организма Созревание первичных фолликулов обеспечивается ФСГ. Под его влиянием около 20 первичных фолликулов начинают развиваться во вторичные фолликулы, активно синтезирующие эстрадиол. Повышение уровня эстрадиола стимулирует синтез рецепторов ФСГ в клетках гранулозы. Однако повышение секреции эстрадиола и ингибина фолликулами оказывает тормозящее действие на образование и секрецию ФСГ передней долей гипофиза. Уменьшение образования ФСГ является причиной того, что дальнейшему развитию подвергаются только фолликулы с самой высокой концентрацией рецепторов к ФСГ, а остальные атрофируются и регрессируют. Обычно лишь один фолликул отбирается для овуляции. После овуляции разрушенный фолликул развивается в желтое тело. ЛГ, уровень которого постепенно снижается благодаря возобновлению механизма отрицательной обратной связи эстрадиола на гипофиз, регулирует образование эстрадиола и прогестерона клетками желтого тела. Продолжительность функции желтого тела зависит от стимулирующего эффекта ЛГ, которое снижается примерно к 25 дню цикла. Падение уровня этого гормона приводит к снижению стероидогенеза, что в свою очередь становится причиной менструации. Снижение эстрадиола и прогестерона снимает ингибирующее влияние на гипофиз, который - под действием гонадолиберина возобновляет секрецию ФСГ и ЛГ, необходимые для начала следующего цикла. В семенниках ФСГ способствует активации процессов сперматогенеза и вызывает пролиферацию клеток Сертоли (поддерживающие эпителиоциты, сустентоциты) и сперматогенного эпителия. ФСГ связывается со специфическими рецепторами клеток Сертоли и стимулирует образование ряда белков и пептидов: ингибины, g-глютамилтранспептидаза, трансферин, андрогенсвязывающий белок. В стимуляции процессов сперматогенеза ФСГ и ЛГ действуют как синергисты и увеличивают синтез белков, связывающих тестостерон. Показано, что в клетках Лейдига под влиянием ФСГ стимулируются процессы образования и увеличения количества рецепторов к ЛГ, что повышает их чувствительность к ЛГ, который является основным модулятором секреции тестостерона, т.е. ЛГ стимулирует генерацию высокой концентрации внутритестикулярного уровня тестостерона. Последний действует на сперматогонии и первичные сперматоциты, которые затем превращаются в зрелые сперматозоиды. ФСГ контролирует развитие сперматид в зрелые сперматозоиды. Препроопиомеланокортин (ПОМК)– в одной полипептидной цепи несколько гормонов В 1979 году группа американских и японских исследователей опубликовала полную аминокислотную последовательность белка, получившего название препроопиомеланокортин. (ПОМК),на основании данных о последовательности нуклеотидов гена, кодирующего этот белок. ПОМК стал классическим примером роли ограниченного протеолиза в процессах посттрансляционной модификации белков и полипептидов. Ген, кодирующий ПОМК, расположен на 2-й хромосоме и разделен интронами на 3 экзона. Молекулярная масса ПОМК 28.5 кДа. Он состоит из 241 аминокислотного остатка. Основным местом синтеза проопиомеланокортина являются передняя и промежуточная доля гипофиза (примерно 3% клеток передней и более чем 90% клеток промежуточной доли гипофиза у крыс) . иРНК ПОМК об- наружена в гипоталамусе , миндалине мозга , коре головного мозга , органах репродуктивной системы , плаценте , коже , кишечнике , клетках иммунной системы и различных опухолях. В процессе посттрансляционного процессинга ПОМК молекула ПОМК гликозилируется , фосфорилируется , ацетилируется и разделяется на отдельные фрагменты с разной биологической активностью в разных клетках гипофиза. Регулятором образования и секреции ПОМК является соматолиберин гипоталамуса, который взаимодействуя с рецепторами соматотрофов передней доли активирует образование цАМФ и повышает активность протеинкиназ (ПКА), стимулирущих синтез (увеличение количества иРНК- долговременный ответ) и протеолиз (увеличение секреции –быстрый ответ) ПОМК. В соматотрофах передней доли ПОМК распадается с образованием N-концевого фрагмента (из которого может затем образоваться гамма МСГ), АКТГ (39 аминокислотный пептид) и бета липотропина. В средней доле гипофиза взрослого человека, секреторная активность которой четко определяется в период эмбриональной жизни и при беременности, образуется a-МСГ (13 аминокислот) и АКТГ-подобный пептид (21 аминокислота), b-липотропин, из которого в последующем образуются γ-липотропин и β-эндорфин. β-МСГ (37-58 аминокислоты g-липотропина) у человека, вероятнее всего, является продуктом постсекреторного протеолиза. AКТГ (кортикотропин) является главным физиологически активным продуктом кортикотрофов. β-липотропин (β-LPH) обладает небольшой активностью у людей. Другие продукты процессинга ПОМК синтезируются клетками в разных отделах нервной системы или образуются в гипофизе на определенных этапах развития. Так, например, у эмбрионов человека и у беременных женщин промежуточная доля гипофиза активно образует эндорфины и энкефалины. Эти соединения связываются с опиатными рецепторами в клеток и участвуют в процессах торможения болевых сигналов, идущих к мозгу. N-концевой фрагмент кортикотропина определяет его функциональную активность. Адренокортикотропный гормон (АКТГ, кортикотропин) человека представляет собой одиночную пептидную цепь, состоящую из 39 аминокислотных остатков со следующей последовательностью. Его молекулярная масса 4500 Да. Основные биологические свойства гормона (влияние на стероидогенез, функциональная специфичность) связаны с N-концевым фрагментом гормона, состоящим из 24 аминокислот, последовательность которых идентична у разных видов животных и человека. Влияние на стероидогенез определяется отрезком из 18 аминокислот. С-концевой отдел гормона обеспечивает стабильность и предохраняет молекулу АКТГ от ферментативного разрушения в период его транспорта по кровяному руслу, а также отвечает за иммунологические свойства кортикостерона. Последовательность из четырех аминокислот Гис-Фен-Арг-Три, характерная для проявления меланоцитостиму- лирующей активности МСГ придает АКТГ способность оказывать влияние на обмен пигментов у человека. Синтетический препарат гормона из 24 аминокислот имеет более длительный период полураспада, чем 18 аминокислотный препарат, поэтому он успешно применяется в клинической практике. В действии на надпочечники у кортикотропина четко выявляются 2 эффекта: регуляция стероидогенеза и поддержание их массы. Рецепторы гормона относятся к 7 ТМС рецепторам, действующим на синтез цАМФ и активирующих протеинкиназы (ПКА). Эти протеинкиназы влияют на ключевую реакцию образования прегненолона из холестерола (десмолаза холестерола). Одновременно активируются и холестеролэстеразы, катализирующие гидролиз эфиров холестерола, ингибируются синтетазы эфиров и усиливается синтез белка, необходимого для образования полифосфинозидов, транспортирующих холестерол внутрь митохондриальных мембран и обеспечивающих его взаимодействие с десмолазой холестерола и начало биосинтеза кортикостероидов. Все эти действия направлены на усиление синтеза кортизола и обеспечивают относительно быстрый эффект действия гормона. Влияние на поддержание массы надпочечников (пролонгированное действие) также опосредуется 7ТМС рецеторным действием АКТГ. Активируемые таким образом протеинкиназы участвуют в фосфорилировании белков рибосом, активируют РНК- полимеразу и усиливают образование нуклеиновых кислот, необходимых для синтеза ферментов, обеспечивающих биосинтез кортикостероидов и деление клеток сетчатой и пучковых зон надпочечников. Детали такого влияния кортикотропина мало известны. АКТГ оказывает влияние и на другие ткани. В жировой ткани он усиливает процессы липолиза, стимулирует поглощение аминокислот и глюкозы мышечной тканью, вызывает гипогликемию, стимулируя высвобождение инсулина из b-клеток поджелудочной железы. АКТГ влияет на процессы пигментации (участок тетрапептидного кора молекулы). При заболеваниях, сопровождающихся высоким содержанием АКТГ в плазме (болезнь Аддисона, синдром Hельсона), наблюдается избыточная пигментация. Секреция АКТГ изменяется в течении суток. За сутки гипофиз человека секретирует 25-50 мкг АКТГ. Это примерно 1/10 часть того, что содержится в гипофизе. Уровень АКТГ в сыворотке (или плазме) крови колеблется от 10 до 70-80 пг/мл, причем в ранние утренние часы он составляет от 10 до 150 пг/мл (6-8 часов утра), а вечером - несколько ниже (до 85 пг/мл). Период полураспада при определении биологическим методом составляет 3-9 минут, при использовании РИА- 7-12 минут. В основе регуляции секреции АКТГ лежат цепи обратной связи на нескольких уровнях. Длинная цепь обратной связи замыкается на уровне гипоталамуса. Кортизол угнетает секрецию кортиколиберина нейронами гипоталамуса. На уровне гипофиза кортизол снижает сродство ре- цепторов клеток, секретирующих кортикотропин, к кортиколиберину. Эта быстрая реакция уменьшения секреции АКТГ усиливается ингибирующим влиянием кортизола на экспрессию гена ПОМК. К ингибиторам секреции кортиколиберина относятся также: ГАМК, опиоиды, вещество Р, предсердные натрийуретические пептиды, оксид азота и АКТГ. Секреция кортиколиберина усиливается под действием цитокинов, образующихся при действии стрессовых факторов. Меланоцитостимулирующие гормоны (МСГ) синтезируются клетками промежуточной доли гипофиза, которая имеется у низших животных и млекопитающих. У человека она практически отсутствует, а клетки, характерные для средней доли гипофиза, единично представлены в дистальной части гипофиза. Увеличение объема средней доли гипофиза с повышением ее функциональной активности отмечено при беременности. α−МСГ у человека обнаруживается лишь в опухолях и в гипофизах плода. Молекула β-МСГ гипофиза млекопитающих включает 18 аминокислот. У человека βМСГ как самостоятельный гормон, по-видимому, отсутствует, а роль меланоцитостимулирующего фактора играют два гормона: АКТГ и β-липотропин. При патологических состояниях, проявляющихся избыточной пигментацией (болезнь Иценко-Кушинга, болезнь Аддисона) и повышенным отложением меланина, всегда обнаруживается повышенное содержание в сыворотке крови как АКТГ, так и β-липотропина. Липотропин - источник эндогенных опиатов Давно известно о жиромобилизующем и липолитическом действии экстрактов гипофиза, однако все попытки выделить из гипофиза вещество, обладающее этими свойствами, оказывались безуспешными. В 1964-1966 гг. из гипофиза овцы был изолирован полипептид, обладающий указанными свойствами, названный β-липотропином и состоящий из 90 аминокислотных остатков. Исследование аминокислотной последовательности β липотропина показало, что на его С- конце расположены фрагменты, которые при отщеплении от цельной молекулы обладают особой биологической активностью. Они вызывают выраженные морфиноподобные эффекты (опийподобные эффекты) в мозге - обезболивание, снятие ощущений страха и др. Введенные в организм, эти пепетиды вызывают ряд слабых побочных наркотических эффектов, характерных для препаратов морфина. Такие пептиды мозга - эндогенные опиоиды – получили название экефалины и эндорфины . Наиболее активный из них метэнкефалин представляет собой пентапептид (Тир-Гли-Гли-Фен-Мет), является частью β-липотропина. Фрагмент 61-91 липотропина представляет β эндорфин, включающий метэнкефалин, α-эндорфин(1-16) и γ-эндорфин(1-17), δ-эндорфин(1-27) . Чем меньше аминокислот в составе эндорфина, начиная с 61-65-го энкефалинового фрагмента, тем выше его морфино- подобная активность. Тетрапептид (47-50) в составе липотропина оказывает влияние на процессы запоминания. Значение β-эндорфина в организме велико. Он принимает участие в процессах формирования ощущения боли (анальгетический эффект) и обладает спазмолитической активностью, участвует в половом поведении, питании, обучении, памяти и модулирует многие нейроэндокринные функции в организме. Анальгетический эффект связан с Nконцевым фрагментом β-эндорфина, аминокислотная последовательность которого соответствует метэнкефалину. Однако эндорфин и метэнкефалин оказывают свое действие через различные рецепторы. Гормоны задней доли гипофиза Принято считать гормонами задней доли гипофиза два гормона - окситоцин и вазопрессин, хотя они образуются и секретируются нейронами, формирующими ядра гипоталамуса. Вазопрессин преимущественно синтезируется нейронами супраоптического, а окситоцин паравентрикулярного ядер. Это нанопептиды с очень подобным аминокислотным составом и последовательностью. Вазопрессин имеет некоторые видовые различия: арг-вазопрессин у человека и лиз-вазопрессин у свиньи, а окситоцин одинаково устроен у всех видов животных. После синтеза в составе секреторных пузырьков вместе с белками получившими название нейрофизинов, оба гормона аксоплазматическим током переносятся в нервные окончания задней доли гипофиза , из которых секретируются в кровоток при соответствующей стимуляции. Свое название вазопрессин получил благодаря способности повышать артериальное давление, а название окситоцин также связано с его физиологическим эффектом ускорения родов, хотя эти гормоны оказывают и другие эффекты. Вазопрессин – антидиуретический гормон. Несмотря на вазоконстрикторское действие, оправдывающее его название, основным для вазопрессина оказался антидиуретический эффект. Вазопрессин – ведущий гормон, обеспечивающий сохранение воды в организме. Основным регулятором секреции вазопрессина является изменение осмотического давления крови. Осморецепторы, расположенные в переднем гипоталамусе, обладают высокой чувствительностью к изменению осмотического давления и начинают реагировать на изменение менее чем на 1% осмолярности плазмы. Кроме того имеются внегипоталамические (печеночные или портальные осморецепторы) которые реагируют на изменение осмолярности плазмы более чем на 1% от нормальных величин. Другим регулятором оказывающим влияние на секрецию вазопрессина является изменение объема циркулирующей крови. Импульсы с барорецепторов левого предсердия, каротидного синуса и дуги аорты ингибируют секрецию вазопрессина. Снижение интенсивно- сти нервной импульсации от этих рецепторов приводит к повышению высвобождения вазопрессина. Основной физиологический эффект окситоцина соответствует названию гормона. Рис.11.16. Регуляция лактации. За последние годы представления о роли окситоцина несколько расширились, хотя по-прежнему лучше изучена его роль у женщин. Можно выделить три основных эффекта влияния этого гормона: 1.Усиление сокращения мышц матки во время родов. 2.Стимуляция выхода молока в лактирующей молочной железе из альвеол в протоки. 3.Регуляция поведенческой активности , связанной с беременностью, лактацией и уходом за потомством. В 90-е годы прошлого столетия было показано участие окситоцина в механизмах фиксации памяти. Главными стимулами высвобождения окситоцина являются нервные импульсы, возникающие при раздражении грудных сосков (см рис 12-27) Растяжение влагалища и матки также играет некоторую роль в стимуляции образования окситоцина. При многих воздействиях, вызывающих секрецию окситоцина, происходит высвобождение пролактина что дает право говорить, что фрагмент окситоцина может играть роль пролактин-рилизингфактора. Эстрогены стимулируют, а прогестерон ингибирует продукцию окситоцина. Рецепторы окситоцина (ОТ) найдены в клетках матки и миоэпителиальных клетках молочной железы . Их количество увеличивается под действием эстрогенов и снижается под влиянием прогестерона . Наступление лактации до родов можно, очевидно, объяснить одновременным повышением количества эстрогенов и падением уровня прогестерона непосредственно перед родами. У мужчин основной эффект окситоцина связывают с его стимулирующим влиянием на семявыносящие протоки (эйякуляция) и влиянием на поведенческую активность, связанную с половой функцией. Инактивация окситоцина как и вазопрессина происходит главным образом почками (40%) и печенью (около 50%). Экзогенно введенный вазопрессин частично (10-20%) выделяется с мочой в биологически активной форме. В процессах инактивации окситоцина определенное место занимает также молочная железа Несахарное мочеизнурение – форма проявления функциональной недостаточности вазопрессина. Термин несахарный диабет был введен для обозначения полиурии, при которой моча не имела сладкого вкуса, что позволяло отличить это состояние от сахарного диабета. Заболевание проявляется жаждой и экскрецией большого количества мочи (до 20 л) с низкой плотностью. Прием большого количества жидкости является компенсаторной реакцией для предотвращения дегидратации и гиперосмолярности в организме. Заболеваемость несахарным диабетом составляет 1 вновь выявленный случай на 1 млн. населения Различают две основные формы несахарного диабета: Гипоталамический ("центральный") несахарный диабет является следствием нарушения образования вазопрессина гипофизом. Причинами такого нарушения могут быть травмы головы, инфекции или опухоли гипоталамуса, аутоиммунные заболевания. Нефрогенный несахарный диабет является следствием нарушения функции V2 рецепторов вазопрессина. Рецептор кодируется геном, расположенным на Х хромосоме (Xq2.8), поэтому врожденная форма этого заболевания характерна для мужчин. Подобные нарушения функции рецепторов могут быть при некоторых заболеваниях почек. Почка при таком повреждении неспособна отвечать даже на высокие уровни антидиуретического гормона. Повышенное образование разбавленной мочи, может быть следствием психологического волнения (псигогенная полидипсия), при котором люди пьют большие объемы воды. Еще одной достаточно редкой причиной полиурии могут быть генетические дефекты гена кодирующего аквапорины – водные каналы в эпителии канальцев. При повышенном образовании вазопрессина выделение мочи не прекращается. При травмах и опухолях мозга, инфекционных заболеваниях, нарушениях мозгового кровообращения, опухолях, секретирующих вазопрессмн может развиться синдром избыточной или нерегулируемой секреции вазопрессина. При этом, несмотря на значительную гипонатриемию и гипоосмолярность плазмы, почки продолжают выделять концентрированную мочу. Усиленная реабсорбция воды приводит к значительному разведению электро- литов плазмы. Резко снижается концентрация натрия в плазме (ниже 120 ммоль/л), хотя общее содержание натрия в организме остается в пределах нормы. При снижении уровня натрия до 110 ммоль/л и осмолярности плазмы до 250 ммоль/кг развивается сонливость, апатия, дезориентация, психозы, спазмы мышц вплоть до судорог, теряется аппетита, снижается температура тела. При дальнейшем снижении содержания натрия в крови наступает кома и смерть. ГОРМОНЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ Гормоны щитовидной железы оказывают существенное влияние на три фундаментальных физиологических процесса: клеточную дифференцировку, рост, и метаболизм. Не многие из гормонов могут оказывать такое всесторонее действие на организм. Известны с давних пор два основных гормона образующихся в щитовидной железе - трииодтиронин (Т3) и тетраиодтиронин (Т4, тироксин). Являясь производными аминокислоты тирозина Т3 и Т4 действуют на клетки через рецепторы, которые по свойствам подобны рецепторам стероидных гормонов и ведущим в их механизме действия является влияние на процессы синтеза белков. В щитовидной железе образуется еще один гормон, называемый кальцитонином. Это полипептид, участвующий в регуляции уровня кальция и фосфора и оказывающий влияние на процессы минерализации в костной ткани. Особенностью структуры гормонов щитовидной железы является присутствие микроэлемента йода. Это придает обмену этих гормонов ряд специфических черт и в первую очередь зависимость их образования от поступления йода с пищей. Низкое содержание йода в продуктах питания и питьевой воде в ряде биогеохимических провинций на Земле создает условия для развития патологии щитовидной железы Заболевания щитовидной железы известны с давних пор и составляют в настоящее время наиболее частую причину обращения к эндокринологам. Радиоактивный йод находит широкое применение в диагностике этих заболеваний. Авария на ЧАЭС подтвердила существующее мнение о радиоактивном йоде как факторе риска при возникновении опухолей щитовидной железы и указала лишний раз на тесную связь здоровья человека с состоянием окружающей среды. Т3 и Т4 – производные аминокислоты тирозина. В основе структуры йодсодержащих гормонов щитовидной железы лежит тирониновое ядро , которое состоит из двух конденсированных молекул L- тирозина . Важнейшой структурной особенностью производных тиронина - наличие в их молекуле 3 или 4 атомов йода. Хорошо изучены два йодсодержащих производных тиронина, обладающих гормональной активностью - 3,5,3’,5'-тетраиодтиронин (Т4, тироксин), открытый впервые в 1 915 году Кэндаллом и 3,5,3'-трийодтиронин (Т3), получивший известность как гормон щитовидной железы в 1952 году (Гросс и Питт-Риверс) . Третье производное тиронина 3,3',5-T3 не обладает гормональной активностью ( обратный Т3) В щитовидной железе синтезируется и секретируется главным образом Т4, хотя T3 обладает значительно большей активностью. Это связано с более высоким сродством рецепторов к Т3 в 10 раз превышающее сродство к Т4. Некоторое количество T3 также синтезируется железой, но большая часть его образуется путем дейодирования T4 в периферических тканях, прежде всего в печени и почках. Дейодирование T4 может приводить и к образованию обратного Т3, не обладающего гормональной активностью. В синтезе гормонов щитовидной железы можно выделить 4 этапа 1.Включение йода в щитовидную железу. Органические и неорганические соединения иода поступают в желудочно-кишечный тракт с пищей и питьевой водой и всасывается в виде йодидов. Суточное потребление йода зависит от особенностей питания и составляет от 150-300 мкг в странах Европы до 500 мкг в США . Таблица 11.9. Рекомендуемые суточные нормы поступления иода Группа людей Суточная норма, мкг Подростки и взрослые 150 Беременные и лактирующие женщины 175-200 Дети до 6 мес 40 или 8 мкг/кг веса 6-12 мес 50 1-12 лет 70-120 Эпителиальные клетки разных органов обладают способностью концентрировать иод со скоростью около 2 мкг в час. Эти клетки обладают «ловушкой иода» (йодным насосом). В его работе принимает участие Na+ K+ зависимая АТФ –аза. Общее представление об обмене йода в организме представлено на следующем рис.11.17 Рис.11.17.Общее представление об обмене йода в организме. Работа «йодного насоса» не отличается высокой специфичностью. Ряд анионов (тиоцианат- SCN-, перхлорат -ClO-4, пертехнетат- TcO-4)., поступающих в железу тем же механизмом, могут конкурентно ингибировать поступление иодидов в клетки щитовидной железы. путем конкуренции. При избыточном поступлении в организм этих анионов, наступает недостаточный захват йодидов щитовидной железой, что приводит к снижению их количества в этом органе и как следствие – к недостаточному синтезу тироидных гормонов. Известны клинические варианты недостаточности щитовидной железы , связанные с нарушеннием захвата йодидов из плазмы крови и транспорта его через мембрану тироцита. 2.Органификация (окисление) йода или йодирование тирозина в тиреоглобулине. Cледующим этапом после захвата йода щитовидной железой является синтез тиреоидных гормонов, который начинается с быстрой фиксации йода в молекулы тирозинов, входящих в состав тиреоглобулина. Тиреоглобулин –главный белок коллоида, заполняющего фолликулы. Это гликопротеин с ММ 660 кДа, состоящий из 5496 аминокислот, среди которых 134 остатка тирозина, но только от 4 до 8 из них иодируются . Процессу иодирования тирозинов предшествует окисление иодидов в активную форму при помощи фермента тиреопе- роксидазы и перекиси водорода (H2О2). В механизме образования перекиси водорода в щитовидной железе принимает участие НАДФH-зависимая дегидрогеназа, расположенная на апикальной мембране клеток, которая в присутствии ионов Са2+ переносит электроны на О2 с образованием перекиси водорода. Тиреопероксидаза катализирует окисление иодидов перекисью водорода с образованием активных форм йода I+ и HOI. Этот процесс стимулируется ТТГ. Рис.11.18. Участие тиреоидпероксидазы в синтезе гормонов щитовидной железы Тиреопероксидаза, как и тиреоглобулин, могут стать антигенами, к которым образуются антитела при аутоиммунных заболеваниях щитовидной железы и, в частности, при аутоиммунном тироидите. Активированный таким образом йодид (I+) способен йодировать молекулы тирозина в структуре тиреоглобулина с образованием монойодтирозина (МИТ) или дийодтирозина (ДИТ). При помощи этой тиреопероксидазной системы щитовидная же- леза использует каждый поступающий в нее атом йода и препятствует возможному возвращению йодида в кровяное русло. Однако тиреопероксидаза может катализировать йодирование тирозина, входящего в состав других белков (альбумин и др.). Такой метаболически неактивный белок может выделяться в кровообращение, что приводит к большой “утечке” йода из щитовидной железы. Йодирование тиреоглобулина происходит на границе между апикальной частью тироцита и коллоидом, содержащимся в просвете фолликула. Ряд химических соединений (пропилтиоурацил, мерказолил, метимазол) ингибируют активность тиреопероксидазы, блокируя тем самым образование тиреоидных гормонов, что нашло применение в лечении гиперфункции щитовидной железы 3. Процесс конденсации. МИТ и ДИТ, образовавшиеся на предыдущем этапе, конденсируются с образованием гормонов щитовидной железы. При конденсации двух молекул ДИТ образуется Т4, если же происходит конденсация молекул МИТ и ДИТ - образуется Т3. Процесс конденсации протекает в 3 этапа под влиянием тиреопероксидазы, которая участвует на всех этапах образования гормонов щитовидной железы. Образование МИТ и ДИТ и их конденсация происходят на мембране в апикальной части тироцита, где локализуется тиропероксидаза. По мере иодирования остатков тирозина с последующим образованием йодтирозинов и тиронинов, молекулы тиреоглобулина перемещаются в просвет фолликула, где они накапливаются “про запас”. Этого запаса хватает на месяц при условии полной блокады биосинтеза гормонов. 4. Высвобождение (секреция) гормонов щитовидной железы. Гормоны щитовид Рис.11.19.Этапы секреции гормонов щитовидной железы. ной железы освобождаются из тиреоглобулина при участии гидролаз лизосом эпителиальных клеток. В процессе гидролиза происходит также и высвобождение МИТ и ДИТ, которые подвергаются дейодированию под действием йодтирозиндейодазы, которая выявляется в митохондриях и микросомах и является НАДФH-зависимым флавопротеином. Освобождающийся йодид вновь используется щитовидной железой в биосинтезе тиреоидных гормонов. Т3 и Т4 – регуляторы своего уровня во внеклеточном пространстве. Ось гипоталамус-гипофиз-щитовидная железа представляет собой систему, образующую гормоны щитовидной железы и контролирующую их образование. Т4 и Т3 тормозят свой собственный синтез по механизму обратной связи. Т3, ( Т4 превращается в гипофизе в Т3 ) основной сигнал в этой связи. Повышение уровня гормона ингибирует высвобождение и синтез тиреотропина в гипофизе и тиреолиберина в гипоталамусе. Это связано с тем, что Т3 попадая в клетки гипофиза (тиротрофы) связываются с ядерными рецепторами этих клеток и тормозят экспрессию генов, кодирующих обе субъединицы тиреотропина. Таков же механизм действия Т 3, по-видимому, и на механизм образования тиреолиберина в гипоталамусе. Наоборот, снижение уровня гормонов стимулирует высвобождение указанных регуляторов. Помимо Т3, Т4 и тиролиберина, на секрецию ТТГ оказывают влияние и другие гормоны. Кортизол угнетает секрецию тиротропина. Гормон роста также тормозит секрецию ТТГ. Это действие СТГ на синтез и высвобождение ТТГ связывается с влиянием соматостатина, стимуляция образования которого отмечается при введении СТГ. . Глюкокортикоиды снижают уровень ТТГ в сыворотке крови. Эстрогены не влияют на базальную секрецию ТТГ, однако увеличивают ее ответ на тиролиберин, тогда как андрогены угнетают ответ ТТГ на тиролиберин. Все клетки организма, по-видимому, мишени гормонов щитовидной железы. Физиологические эффекты гормонов щитовидной железы хорошо и давно известны. Эти гормоны необходимы для нормального роста и развития организма. Они контролируют образование тепла, скорость поглощения кислорода, участвуют в поддержании нормальной функции дыхательного центра, оказывают инотропный и хронотропный эффекты на сердце, увеличивают количество b-адренергических рецепторов в сердечной и скелетной мыщцах, жировой ткани и лимфоцитах, увеличивают образование эритропоэтина и повышают эритропоэз, стимулируют моторику желудочно-кишечного тракта, стимулируют синтез многих структурных белков в организме Калоригенное влияние, по-видимому, первично в действии гормонов на организм Суммарный эффект T4 и T3 можно оценить по изменению скорости потребления кислорода тканями, отражающей в свою очередь интенсивность метаболических процессов в клетках.. Гормоны увеличивают потребление O2 почти всеми метаболически активными тканями. Исключением является мозг взрослого человека, яички, матка, лимфатические узлы, селезенка и передняя доля гипофиза. В гипофизе происходит даже снижение потребление O2, что, возможно, связано с торможением секреции ТТГ под влиянием гормона. Активирование потребления О2 наступает через несколько часов после введения небольшого количества тироксина и длится несколько суток. Такое отсроченное действие - своеобразное подтверждение действия гормонов на генетическом уровне. Повышение потребления О2 связывают с усилением окисления жирных кислот, мобилизация которых значительно увеличивается под влиянием гормонов. Увеличение выведения азотсодержащих конечных продуктов обмена белков указывает на катаболический эффект гормонов на обмен белков. Правда, у гипотиреоидных детей введение гормонов способствует задержке азота (положительный азотистый баланс). Гормоны щитовидной железы увеличивают скорость поглощения углеводов в желудочно-кишечном трактате. При гипертиреозе уровень глюкозы в крови после приема пищи быстро увеличивается, порою превышая почечный порог, хотя также быстро возвращается к нормальным значениям. Давно известно о выраженных изменениях в митохондриях под влиянием гормонов щитовидной железы. Сведения о разобщающем эффекте на окислительное фосфорилирование высоких концентраций гормонов щитовидной железы вошли во все пособия по митохондриологии. Механизм такого действия остается не выясненным. Кроме того, гормоны щитовидной железы увеличивают активность мембраносвязанной Na+-K+ ATФазы во многих тканях, оказывая влияние тем самым на механизмы активного транспорта, сопряженные с этим ферментом. Указывалось даже, что это один из основных объектов влияния гормонов щитовидной железы. О системных эффектах гормонов можно судить, сопоставляя изменения, наблюдаемые при гипо и гиперфункциях железы Таблица 11.10 Основные проявления гипо и гипертиреоза Орган или сиГипотиреоз Гипертиреоз стема Кожа Бледные, холодные отечные кож- Теплая, влажная кожа, усиление ные покровы, сухие ломкие воло- потоотделения, истончение волос сы и ногти, желтоватый цвет (каротины), микседема Нервная систе- Заторможенность, замеделние Нервозность, эмоциональная лама мыслительных процессов перифе- бильность , гипрекинезия рические нейропатии Сердечно-сосу- Повышение сопротивления пери- Снижение сопротивления перидистая система фирических сосудов, снижение фирических сосудов, повышение частоты сердечных сокращений , частоты сердечных сокращений , ударного объема, сердечного выударного объема, сердечного вы- броса , пульсового давления, сердечная недостаточность броса , пульсового давления, сердечная недостаточность, аритмии,стенокардия Легкие Гиповентиляция , ацидоз, выпот в Диспноэ, уменьшение жизненной плевральной полости емкомти Пищеваритель- Снижение аппетита, перистальти- Повышенный аппетит, усиленная ная система ки, выпот в брюшной полости перистальтика,, снижение массы тела Опорно-двига- Мышечная слабость, снижение Общая слабость усиление глуботельная система глубоких сухожильных рефлексов ких сухожильных рефлексов, остеопороз Выделительная Снижение скорости почечного Повышение скорости почечного система кровотока и скорости клубочкокровотока и скорости клубочковой фильтрации вой фильтрации, полиурия Репродуктивная Инфертильность, снижение либи- Нарушения менструального циксистема до, импотенция, олигоспермия, ла, повышенный метаболизм стеснижение обмена стероидных гор- роидных гормонов. монов. Кровь Снижение эритропоэза, анемия, Усиление эритропоэза, анемия, повышение уровня холестерола, гирегликемия, повышение уровня триацилглицеролов, , снижение жирных кислот, снижение холескорости элиминации гормонов и стерола и триацилглицеролов, полекарств, каротинемия, повышевышение скорости элиминации ние уровня некоторых органоспе- гормонов и лекарств, гиперкальцифических ферментов циемия, гипопротеинемия Обмен веществ Снижение уровня основного обПовышение основного обмена, отмена слабо положительный азоти- рицательный азотистый баланс стый баланс Развитию гипотиреоза у взрослых может предшествовать увеличение размеров щитовидной железы- зоб Простое увеличение щитовидной железы - это «попытка» организма компенсировать сниженное образование тиреоидных гормонов и является следствием повышения уровня тиреотропина. Нарушение любого из этапов синтеза гормонов, связанных с недостатком иодидов, нарушением их транспорта, йодирования тирозинов, нарушениями реакции конденсации, недостаточностью дейодиназы, дефектами в структуре транспортных белков может вызывать развитие простого зоба у взрослых людей. Простой зоб можно лечить экзогенными тиреоидными гормонами. При специфических формах зоба рекомендуют увеличение или ограничение потребления йода. Любое из приведенных выше нарушений синтеза или транспорта гормонов приводит к дефициту свободных Т3 или Т4, и обусловливает появление клинического состояния, известного как гипотиреоз. Однако гипотиреоз не всегда связан только с недостаточностью функций щитовидной железы. Он может развиться и при нарушениях функций гипофиза или ги- поталамуса. При гипотиреозе снижаются основной обмен, а также скорость других процессов, зависящих от тиреоидных гормонов (см табл. 11.10 ). Гипотиреоз у плода и новорожденного приводит к нарушению роста и развития. Проявления недостаточности гормонов щитовидной железы зависят от возраста, в котором возникает гипотиреоз. Наиболее неблагоприятным для дальнейшего развития ребенка является гипотиреоз, развивающийся у плода или сразу после рождения. Гипотиреоз у плодов или новорожденных приводит к кретинизму, который характеризуется множественными врожденными нарушениями и тяжелой необратимой задержкой умственного развития. При возникновении гипотиреоза у детей старшего возраста наблюдается отставание в росте без задержки умственного развития. Различные формы гипотиреоза лечат заместительным введением тиреоидных гормонов. Увеличение размеров щитовидной железы может быть признаком гиперфункции Гипертиреоз, или тиреотоксикоз это состояние, обусловленное избыточным образованием гормонов щитовидной железы. Среди множества форм этой патологии, наиболее известной является диффузный токсический зоб (болезнь Грейвса , Базедова болезнь) аутоиммунное заболевание, связанное с образованием тиреоид-стимулирующего иммуноглобулина (IgG), действующего подобно ТТГ и активирующего рецептор тиреотропина. При болезни Грейвса наблюдается диффузное разрастание щитовидной железы и избыточная неконтролируемая продукция Т3 и Т4. Проявления гипертиреоза включают многосистемные сдвиги. Одним из признаком болезни Грейва является экзофтальм – выпячивание глазных яблок, связанное с набуханием мышц. Лечение гипертиреоза, или болезни Грейвса, состоит в подавлении образования гормонов, что достигается применением антитиреоидных средств, блокированием функции железы радиоактивным изотопом йода (таким, как 1311) или комбинацией этих двух приемов. Иногда производят хирургическое удаление железы. Увеличение размеров щитовидной железы может быть следствием применения антитиреоидных средств. Большинство лекарственных препаратов, тормозящих функцию щитовидной железы оказывают влияние на механизм йодного насоса по конкурентному принципу или блокируют органификацию йода. Многие моновалентные анионы конкурирует с йодидами за активный транспорт в щитовидную железу и тем самым ингибируют поступление йода в железу. Этот ингибирующий эффект может снизить введением дополнительного количества иодидов. К таким анионам относятся хлорат, пертехнетат, периодат, дииодат, нитрат и перхлорат.. Длительное применение антитиреоидных препаратов приводит к увеличению размеров щитовидной железы. Некоторые овощи содержат вещества, обладающие ингибирующим действием на функции щитовидной железы. Описаны «капустные» зобы у вегетарианцев. Из капусты и брюквы выделены предшественники (прогоитрины) и факторы, превращающие эти предшественники в активные вещества (гоитрины) , тормозящие образование гормонов щитовидной железы. Учитывая способность гормонов щитовидной железы всасываться в желудочно-кишечном тракте, использование ткани щитовидной железы в питании может быть причиной гипертиреоидных состояний. Кальцитонин- гормон-полипептид Кальцитонин является гипокальциемическим гормоном и секретируется парафолликулярными или С-клетками щитовидной железы, которые отличаются от фолликулярных клеток не только конечным продуктом секреции, но и происхождением. Кальцитонин человека представляет собой полипептид, состоящий из 32 аминокислот. Мол. м. 3000 дальтон. Период полураспада около 5 мин. Кальцитонин, помимо мономерной формы, может образовывать путем ковалентной связи димерные и, не исключено, полимерные формы гормона, однако биологически активной является только мономерная форма гормона. Было показано, что в процессе трансляции образуется препрокальцитонин и прокальцитонин с мол. м. около 13 кДа. Специфическим стимулятором секреции кальцитонинна является повышение концентрации кальция в крови более 2,25 ммоль/л (9 мг/100 мл). Кроме того, стимуляторами секреции кальцитонина являются катехоламины, холецистокинин, глюкагон, гастрин. Глюкагон и катехоламины, взаимодействуя с рецепторами, увеличивают содержание цАМФ, который стимулирует секрецию кальцитонина, так же как и паратгормона, т.е. цАМФ является внутриклеточным медиатором секреции кальцитонина. Кальцитонин метаболизируется в почках, печени и, возможно, в костной ткани. Биологический эффект кальцитонина проявляется снижением уровня кальция и фосфора в крови, что является следствием влияния кальцитонина на костную ткань и почки. В кости кальцитонин угнетает процессы резорбции как кальция, так и белкового матрикса. Это проявляется снижением экскреции гидроксипролина и содержания кальция в крови. Одновременное уменьшение фосфора в сыворотке крови является результатом снижения мобилизации фосфора из кости и непосредственной стимуляции поглощения фосфора костной тканью. Кальцитонин ингибирует активность и количество остеокластов. Механизм действия кальцитонина опосредуется цАМФ и активацией протеинкиназ, что сопровождается изменением активности щелочной фосфатазы, пирофосфатазной активности и активности ферментов. Кальцийурический и фосфоруретический эффект гормона дополняет его действие на костную ткань, приводящее к гипокальциемии и гипофосфатемии. Как в костной ткани, так и в почках взаимодействие кальцитонина с рецепторами приводит к увеличению внутриклеточного медиатора – цАМФ. Если в костной ткани кальцитонин и паратгормон взаимодействуют с рецепторами, локализованными в основном на остеокластах, то в почках эти гормоны комплексируются с рецепторами клеток-мишеней в различных частях нефрона. Рецепторы к кальцитонинну располагаются в восходящей части петли нефрона и дистальных канальцах, тогда как рецепторы к паратгормону находятся в проксимальных канальцах, нисходящей части петли нефрона и дистальных канальцах. Паращитовидные железы – регуляторы обмена кальция и фосфора Околощитовидные железы представлены двумя парами (верхние и нижние) небольших телец состоящими из главных, ацидофильных и переходные между этими видами (транзиторные) паратироцитов. Основным видом являются главные клетки, цитоплазма которых богата гликогеном и липидами. Помимо паратгормона, околощитовидные железы секретируют также хромогранин А (прежнее название “секреторный протеин-1 околощитовидных желез”). Хромогранин А состоит из 450 аминокислотных остатков и косекретируется вместе с паратгормоном. Биологическая значимость хромогранина А пока не установлена. Паратгормон представляет собой простую полипептидную цепь, состоящую из 84 аминокислотных остатков с молекулярной массой 9500 Д; период полураспада около 2 мин. Паратгормон образуется на рибосомах в виде препропаратгормона – полицептида, состоящего из 115 аминокислотных остатков. Этот пептид транспортируется в область шероховатой эндоплазматической сети (эндоплазматического ретикулума), где происходит отщепление пептида, состоящего из 25 аминокислотных остатков. Пропаратгормон состоит из 90 аминокислотных остатков и имеет мол. м. 10200 Д. Далее в комплексе Гольджи отщепляется полипептид из 6 аминокислотных остатков, функция которого состоит в обеспечении транспорта гормона из эндоплазматического ретикулума в этот комплекс, где паратгормон “складируется” в секреторные гранулы и по мере необходимости поступает в кровяное русло. Кроме паратгормона в организме человека образуется паратгормонподобный белок, который имеет более сложную, чем паратгормон, структуру (отдельные фрагменты гормонов имеют близкую гомологию) и может взаимодействовать с рецепторами к паратгормону. Биосинтез паратгормонподобного белка находится под контролем отдельного гена. Ген паратгормона экспрессируется преимущественно в главных клетках околощитовидных желез, а ген паратгормонподобного белка – во многих типах нормальных клеток и тканей организма (многих эндокринных железах), где оказывает преимущественно аутокринное или паракринное действие. Регуляция секреции паратгормона осуществляется несколькими механизмами. В течение короткого времени биосинтез паратгормона регулируется ионизированным кальцием, а в течение длительного времени – 1,25(ОН)2D3 cовместно с кальцием. У человека секреция паратгормона на протяжении суток имеет пульсирующий характер. Паратгормон взаимодействует с 7ТМС рецепторами. Такое взаимодействие приводит к активации аденилатциклазы и повышению цАМФ, что сопровождается увеличением содержания этого соединения как в крови, так и в моче. Помимо цАМФ, в механизме действия паратгормона участвуют йонизированный кальций цитозоля, а также инозитолтрифосфат и диацилглицерин. В некоторых тканях указанные вещества участвуют в качестве внутриклеточных модуляторов, в других опосредуют действие паратгормона независимо от цАМФ. Основная функция паратгомона заключается в поддержании постоянного уровня ионизированного кальция в крови и эту функцию он выполняет, влияя на кости, почки и посредством витамина D – на кишечник. Метаболизм и деградация паратгормона осуществляется в основном в печени (около 62-70%), а также в почках (30-38%). Влияние паратгормона на резорбцию костной ткани на пострецепторном уровне осуществляется в основном через инозитолтрифосфат и диацилглицерин. Тканью-мишенью для паратгормона в костях являются в основном. Влияние паратгормона на костную ткань зависит от СТГ и ИФР I. Помимо остеобластов, рецепторы к паратгормону выявлены также на преостеокластах и остеокластах. Механизм действия паратгормона на костную ткань осуществляется через цАМФ, активирование цАМФ-зависимых протеинкиназ, фосфолипазы С, диацилглицерина, инозитолтрифосфата и ионов Са.. Активированные остеокласты синтезируют повышенное количество коллагеназы и других ферментов, участвующих в деструкции матрикса, например, кислой фосфатазы, углеродной ангидразы, Н+, К+-аденозинтрифосфатазы и др. Кроме паратгормона, на процессы хондрогенеза и оссификации костной ткани и, в частности, на процессы ремоделирования костной ткани, оказывает большое влияние и паратгормонподобный белок, который осуществляет эти влияния через специфические рецепторы. В проксимальных канальцах почек паратгормон, угнетает реабсорбцию фосфатов, что ведет к фосфатурии и гипофосфатемии и увеличивает реабсорбцию кальция в дистальных отделах канальцев, т.е. уменьшает экскрецию кальция. Кроме того, паратгормон повышает активность 1-гидроксилазы в почках, которая контролирует конверсию 25-гидроксивитамина D в 1,25-дигидроксивитамин D, ответственный за повышение реабсорбции кальция в кишечник ГОРМОНЫ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ В 1889 году Мерингом и Минковским впервые было показано, что после удаления поджелудочной железы у животных возникали симптомы, характерные для сахарного диабета у человека. Основное действующее начало, недостаток которого вызывал развитие диабета -инсулин ( от лат. insula- островок), в чистом виде был получен в 1922 г. из спиртовых экстрактов панкреатических островков Ф. Бантингом и Ч. Бестом. В настоящее время известны по крайней мере четыре пептида с гормональной активностью, которые секретируются островками Лангерганса поджелудочной железы. Два из них инсулин и глюкагон, являются важными регуляторами метаболизма углеводов, белков и липидов Третий гормон, соматостатин, играет роль в регуляции секреторной активности островковых клеток, а четвертый панкреатический полипептид, вероятно оказывает регулирующее влияние прежде всего на функции желудочно-кишечного тракта. Глюкагон, соматостатин, и возможно панкреатический полипептид секретируются также клетками слизистой желудочно-кишечного тракта. Инсулин анаболический гормон, способствующий сохранению глюкозы, жирных кислот, и аминокислот. Глюкагон, наоборот, катаболический гормон, мобилизует глюкозу, жирные кислоты, и аминокислоты из тканевых запасов в кровоток. Эти два гормона функционально тесно взаимосвязаны. Избыток инсулина вызывает гипогликемию, которая может привести к судорогам и коме. Дефицит инсулина, (абсолютный или относительный), вызывает сахарный диабет, тяжелое хроническое заболевание, которое без лечения приводит к смерти. Среди причин смертности в мире диабет и его осложнения занимают третье место после сердечно-сосудистых заболеваний и рака. Дефицит глюкагона может вызвать гипогликемию, а избыток глюкагона усложняет течение диабета. Повышенное образование соматостатина в поджелудочной железе вызывает гипергликемию и другие проявления диабета Молекулы инсулина обладают видовой специфичностью Инсулин является полипептидом, состоящим из двух цепей, включающих 51 аминокислотный остаток. А-Цепь содержит 21 аминокислотный остаток, B-цепь – 30. Обе цепи связаны двумя дисульфидными мостиками через остатки цистеина в положениях В7 и А7, В19 и А20. К настоящему времени последовательность аминокислотных остатков в молекуле инсулина изучена более чем у 25 видов животных. Инсулин человека и свиньи имеют наиболее близкую структуру и отличаются друг от друга только одной аминокислотой в положении В30. В инсулине человека в этом положении имеется треонин, а в инсулине свиньи – аланин. Различия в аминокислотном составе не оказывают влияния на биологическую активность специфического инсулина у другого вида, но придают ему антигенные свойства. Если инсулин одного вида вводится в течение длительного периода животному другого вида, образуются антитела против инсулина ингибирующие введенный инсулин. Почти все люди которые получали коммерческий бычий инсулин более 2 месяцев имели антитела против бычьего инсулина, но титр их обычно низок. Различия человеческого и свиного инсулинов только по одной аминокислоте позволяет его использовать в качестве препарата для заместительной терапии. Широко используется человеческий инсулин, полученный методами генной инженерии, что позволяет обойти проблему образования антител Синтез инсулина проходит по законам синтеза секретируемых белков Инсулин синтезируется на полирибосомах В-клетками поджелудочной железы. Подобно другим полипептидным гормонам и белкам, которые поступают в эндоплазматическую сеть, инсулин синтезируется как часть большого препрогормона. Препроинсулин имеет 23-аминокислотый сигнальный пептид (лидирующая последовательность) удаляемый при поступлении в эндоплазматическую сеть. Остаток молекулы сворачивается и при участии дисульфидных мостиков, образуется проинсулин. Пептидный сегмент, связывающий А и B цепи , соединяющий пептид (C пептид), способствует этому сворачиванию и затем удаляется в гранулах перед секрецией, у него не обнаружено другой физиологической активности. Обычно, 90-97 % продукта, высвобождаемого из В клеток - инсулин наряду с эквимолекулярными количествами C пептида. Остальное - главным образом проинсулин. Количество C пептида можно измерить при помощи РИА, и его уровень отражает функцию В-клеток у больных получающих экзогенный инсулин. В регуляции синтеза самого инсулина и в механизме его действия важную роль играют переносчики глюкозы Существуют два основных механизма поступления глюкозы в клетки: облегченная диффузия и вторичный активный транспорт, сопряженный с переносом ионов Na+. Последний характерен для кишечника и почек. В инсулинзависимых тканях (мышечная, жировая) и некоторых других , инсулин способствует поступлению глюкозы в клетки по механизму облегченной диффузии, увеличивая количество переносчиков глюкозы в клеточных мембранах. Переносчики глюкозы, обеспечивающие механизм облегченной диффузии глюкозы через клеточные мембраны, формируют семейство родственных гомологичных белков характерным признаком структуры которых является длинная полипептидная цепь образующая 12 трансмембранных спиральных сегментов. Инсулин-«гормон изобилия» Физиологические эффекты инсулина многообразны, сложны и зависят от времени. Удобно их разделить на быстрые, промежуточные, и отсроченные , как показано в таб.11.9. Таблица 11.9. Эффекты инсулина Быстрые (секунды) Усиление транспорта глюкозы, аминокислот и K+ в инсулинзависимые клетки Промежуточные (минуты) Стимуляция синтеза белков Торможение распада белков Активирование ферментов гликолиза и гликогенсинтазы Торможение ферментов глюконеогенеза и фосфорилазы Длительные (часы) Увеличение синтеза иРНК ферментов липогенеза и других ферментов Наиболее хорошо известным из быстрого ответа эффектом является понижение уровня глюкозы в крови, хотя одновременно изменяется транспорт аминокислот и электролитов, изменяется активность ряда ферментов. В более поздние сроки происходят изменения синтеза белков и ферментов. Результирующий эффект влияние гормона – накопление углеводов, белков и жиров. Поэтому инсулин часто называется "гормоном изобилия". Эффекты инсулина тканеспецифичны. Таблица 11.10. Влияние инсулина на разные ткани. Жировая ткань 1. Усиление поступления глюкозы в адипоциты 2. Повышение синтеза жирных кислот 3. Усиление синтеза глицеролфосфата 4. Усиление образования триацилглицеролов 5. Активирование липопротеинлипазы 6. Ингибирование гормончувствительной липазы 7. Повышение поступления K+ Мышечная ткань 1. Усиление поступления глюкозы в миоциты 2. Усиление образования гликогена 3. Усиление поступления аминокислот 4. Усиление синтеза белка на рибосомах 5. Снижение катаболизма белков 6. Уменьшение высвобождения гликогенных аминокислот 7. Усиление использования кетоновых тел 8. Повышение поступления K+ Печень 1. Снижение кетогенеза. 2. Усиление синтеза белков. 3. Усиление синтеза липидов. 4. Уменьшение высвобождения глюкозы в связи с угнетением глюконеогенеза и повышением синтеза гликогена Общее действие 1. Стимуляция клеточного роста Активирование поступления глюкозы в адипоцит сопровождается ингибированием липолиза В адипоцитах активирование ФИ-3-киназы инсулином приводит также к ингибированию липолиза. Лимитирующей стадией липолиза в адипоцитах является реакция, катализируемая гормончувствительной липазой, которая активна в фосфорилированной форме (цАМФ-зависимое фосфорилирование). Указанное выше активирование протеинкиназы В (ПК В) инсулином приводит к снижению уровня цАМФ в адипоцитах. Активная ПК катализирует фосфорилирование (и активирует) фосфодиэстеразу цАМФ. При низкой концентрации цАМФ гормончувствительная липаза переходит в нефосфорилированное неактивное состояние, что уменьшает степень липолиза жировых депо. Инсулиновый рецептор и его субстрат активируют путь передачи сигнала с участием ГТФазы. Белок RAS относится к растворимым в цитозоле ГТФ-азам, инициирующим пути передачи сигнала с участием митогенами активируемых киназ- МАП-киназ. Белок RAS при участии белка Grb-2 (growth factor receptor bound protein), который обладает SH2- и SH3 до Рис 11.16. Роль pp90S6-киназы в механизмах регуляции метаболизма гликогена менами связывается с фосфорилированными тирозинами рецептора инсулина или его субстрата и переходит в активную форму, заменяя ГДФ на ГТФ. В регуляции этой замены участвуют белки SOS и GAP (см раздел о механизмах передачи сигналов). Активная форма RAS связывается и активирует в свою очередь киназу киназы МАП киназы (Raf-1), которая начинает ферментный каскад усиления, приводящий к появлению большого числа активных МАП киназ Последние фосфорилируют определенные белки цитоплазмы (в частности - про- теинкиназу pp90S6, фосфолипазу А2 и рибосомальную киназу), а также могут проникать в ядро и фосфорилировать (активировать ) ряд факторов транскрипции. Протеинкиназа pp90S6 катализирует фосфорилирование сериновых и треониновых остатков протеинфосфатазы, связанной с гранулами гликогена (ПФГр-1). Фосфорилированная (активная) форма ПФГр-1-Р дефосфорилирует (активирует) гликогенсинтазу (ускоряется синтез гликогена). ПФГр-1-Р дефосфорилирует также киназу фосфорилазы и гликогенфосфорилазу (прекращается мобилизация гликогена). Комплекс нарушений, вызванных недостаточностью функций инсулина называется сахарным диабетом. Греческие и римские врачи использовали термин "диабет", для обозначения состояния, кардинальным проявлением которого был большой объем мочи, и различали два типа диабета: " сахарный диабет", при котором дегустируемая моча имела сладкий вкус и " несахарный диабет" с безвкусной мочой. Сегодня, термин несахарный диабет предназначен для состояний, при которых есть дефицит образования или активности вазопрессина, а не модифицированное слово «диабет» чаще используется как синоним сахарного диабета. У людей диабет - общее и тяжелое патологическое состояние. Диабет характеризуется полиурией, полидипсией, потерей веса несмотря на полифагию (увеличенный аппетит), гипергликемией, глюкозурией, кетозом, ацидозом, и комой. И хотя все эти проявления сопровождаются значительными биохимическими расстройствами, фундаментальные дефекты, с которыми связано большинство расстройств: • уменьшение поступления глюкозы в различные "периферические" ткани и • увеличение выхода свободной глюкозы в кровообращение из печени. Отмечается избыток внеклеточный глюкозы, который сопровождается внутриклеточ- ным дефицитом глюкозы во многих клетках, положение, которое названо " голодание среди изобилия ", уменьшением поступления аминокислот в мышцы и увеличением липолиза. Снижение толерантности к глюкозе при диабете - следствие нарушения использования глюкозы периферическими тканями Характерный признак диабета - гипергликемия, которая заметно проявляется особенно после еды, поэтому при нагрузке глюкозой больного диабетом повышение глюкозы в плазме значительно выше, а возвращение к начальному уровню проходит более медленно, чем у здоровых людей. Такой стандартный тест с нагрузкой на толерантность к глюкозе используется в клинической диагностике диабета (см. гл 5 ). Сниженная толерантность к глюкозе при диабете связана частично с уменьшением поступления глюкозы в клетки (уменьшение периферического использования). В отсутствии инсулина, поступление глюкозы в скелетную, сердечную, и гладкую мышцы и другие ткани уменьшается . Поглощение глюкозы печенью также снижено, хотя этот эффект косвенный. Всасывание глюкозы в кишечнике и реабсорбция в почках клетками проксимальных канальцев не изменяется, также как и поступление глюкозы в клетки мозга и эритроциты. Вторая основная причина гипергликемии при диабете – расстройство глюкостатической функции печени. Печень служит не только органом, депонирующим глюкозу в форме гликогена, но как орган, содержащий глюкоза-6-фосфатазу, также поставляет глюкозу в кровь. Клод Бернард говорил о печени, как эндокринной железе, которая секретирует глюкозу. Инсулин способствует синтезу гликогена и ингибирует выход глюкозы из печени. Если уровень глюкозы в плазме повышен, секреция инсулина обычно увеличена, и глюконеогенез в печени снижается. Этот эффект отсутствует при диабете. Глюкагон также вносит вклад в гипергликемию, и, кроме того, выход глюкозы из печени ускоряется катехоламинами, кортизолом и гормоном роста. Рис11.17.Основные причины, вызывающие повышение уровня глюкозы в крови. Гипергликемия при диабете – причина «диабета». Гипергликемия, достигающая 180 мг% превышает реабсорбционные возможности почек и становится причиной глюкозурии.. Выделение oосмотически активных молекул глюкозы влечет за собой потерю больших количеств воды (осмотический диурез). Дегидратация активирует механизмы, регулирующие обмен воды, что приводит к полидипсии. Одновременно отмечается значительная потеря Na+ и K+ с мочой. Потеря глюкозы - потеря энергетически важных соединений. Увеличение поступления глюкозы для компенсации этой потери просто повышает уровень глюкозы в крови и еще больше увеличивает глюкозурию и не предотвращает активную мобилизацию эндогенных запасов белков и липидов и потерю в весе. Длительная гипергликемия способствует неферментативному гликозилированию белков Молекула глюкозы может взаимодействовать со свободными аминогруппами аминокислот в белках (Лиз, Арг, N-концевая аминокислота). При этом образуется нестабильная альдиминовая группировка, которая может превращаться в ряд других, более стабильных соединений (ранние продукты гликозилирования). Это приводит к нарушению заряда белковой молекулы, изменению ее конформации и нарушению функции такого белка. Глюкозилирование происходит медленно и в норме обычно таких белков мало. Однако при гипергликемии гликозилирование значительно усиливается. Определение уровня гликозилированной формы гемоглобина HBA1С является специфическим приемом для мониторинга лечения инсулином. Избыток глюкозы вне клеток при диабете контрастирует с ее внутриклеточным дефицитом. Катаболизм глюкозы -главный источник энергии для клеточных процессов, и нарушение ее поступления в клетки при диабете приводит к привлечению других энергетических источников и значительному усилению катаболизма белков и липидов. Снижение количества гликогена – одно из следствий внутриклеточного дефицита глюкозы. Прежде всего резко усиливаются процессы катаболизма аминокислот до CO2 и H2O. Одновременно, значительное количество аминокислот превращаются в глюкозу. При диабете, результирующим эффектом влияния повышенного превращения белков в CO2, H2O и глюкозу и снижения белкового синтеза, является отрицательный азотистый баланс со значительными потерями белков. Белковая недостаточность любой причины в свою очередь связана со слабой "устойчивостью" к инфекциям. Диабет – болезнь липидного обмена? Проявления нарушения обмена липидов настолько сильно выражены при диабете, что диабет часто называют больше болезнью липидного, чем углеводного обмена. Основные нарушения обмена липидов при диабете – усиление катаболизма липидов, увеличение образования кетоновых тел и снижение синтеза жирных кислот и триацилглицеролов. У здорового человека обычно 50%поступившей глюкозы распадается CO2 и H2O; около 5 % преобразуется в гликоген, а остальная часть превращается в липиды в жировых депо. При диабете лишь 5 % глюкозы превращается в липиды при том, что количество распадающейся до CO2 и H2O глюкозы также уменьшается, а количество преобразуемой в гликоген изменяется незначительно. Результатом нарушения потребления глюкозы становится повышение уровня глюкозы в крови и удаление ее с мочой. Внутриклеточный дефицит глюкозы приводит к снижению синтеза жирных кислот. У больных, не получающих лечения наблюдается увеличение в плазме содержания триацилглицеролов и хиломикронов и плазма часто является липемической. Повышение уровня этих компонентов вызывает уменьшение липолиза в жировых депо. Понижение активности липопротеинлипазы дополнительно вносит вклад в снижение липолиза. Кетоновые тела –важный источник энергии. Избыток ацетил-КoA обычно используется в синтезе ацетоацетил-КoA - соединения , которое в печени может превращаться в ацетоацетат и затем в ацетон или β-гидроксибутират. Образующиеся в больших количествах указанные соединения ( кетоновые тела) поступают в кровообращение. Циркулирующие кетоновые тела - важный источник энергии при голодании. Около половины энергетических затрат у голодающих нормальных собак, например, обеспечивается окислением кетоновых тел. При диабете доля используемых в качестве источника энергии кетоновых тел также значительна. Показано, что максимальное потребление кетоновых тел без развития проявлений кетоза - 2.5 г/кг веса тела /сутки у людей больных диабетом. В случае развития диабета без лечения инсулином образование кетоновых тел намного превышает эту величину, и кетоновые тела накапливаются в кровотоке. Показано также, что при тяжелом диабете скорость использования кетоновых тел может также снижаться, что усиливает кетоз, поскольку инсулин, как считают, увеличивает поглощение кетоновых тел мышечной тканью. Кетоновые тела – источник протонов Ацетоацетат и β- гидроксибутират -органические кислоты, диссоциирующие полностью в физиологических условиях и их протоны обычно связываются буферными системами, однако при повышенном синтезе кетоновых тел может развиться тяжелый метаболический ацидоз. Изменение pH плазмы вызывает стимуляцию дыхательного центра, что сопровождается быстрым, глубоким дыханием, описанном Куссмаулем как "кислородное голодание" и известное как дыхание Куссмауля. Моча сильно подкисляется. Выведение повышенных концентрации анионов кислот сопровождается значительными потерями Na+ и К+, поскольку возможности почек по нейтрализации возрастающих количеств анионов ионами аммония превышаются. Потери электролитов и воды ведут к дегидратации, гиповолемии, и гипотонии. Все это постепенно может приводить к развитию комы. Диабетическая кома развивается медленно, в течение нескольких дней, но иногда может развиться за несколько часов. Появляются тошнота, рвота, черты лица заостряются, Рис.11.18. Схема нарушений метаболизма, приводящих к коме глаза западают, нарастает безучастность к окружающему, заторможенность, переходящая в глубокую кому (полностью выключенное сознание, отсутствие рефлексов, атония мышц и др.). В помещении, где находится больной, ощущается явственный запах ацетона. Артериальное давление снижено, почти всегда наблюдается олигурия или анурия. Ацидоз – наиболее частая причина ранней смерти при клиническом диабете. При тяжелом ацидозе, общее содержание натрия в организме заметно уменьшается и когда потеря натрия превышает водную потерю, уровень Na+ в плазмы также может быть низким. Общее содержание калия в организме тоже понижается, но уровень К+ в плазме обычно в пределах нормы. Это связано с уменьшением объема внеклеточной жидкости и перемещением K+ из клеток во внеклеточную жидкость в ответ на рост концентрации Н+. Кроме того, отсутствует стимулируемое инсулином поступление K+ в клетки.Причиной комы может быть резкое повышение уровня глюкозы в крови, что вызывает повышение осмотического давления, приводящее к нарушению сознания (гиперосмолярная кома). Накопление лактата в крови (молочный ацидоз) может также осложнять диабетический кетоацидоз в условиях гипоксических состояний. У больных диабетом кетоацидоз во многих случаях может осложняться отеком мозга, что также может вызывать коматозное состояние.. Причины для отека мозга неизвестны, но он является тяжелым осложнением с плохим прогнозом. .Основная первопричина диабета –нарушение поступления глюкозы в клетки • Н а рис 11.18 приведены основные изменения метаболизма в ответ на функцио- нальную недостаточность инсулина. Одна из главных особенностей инсулиновой недостаточности - сниженное поступления глюкозы в ткани (уменьшение периферического использования глюкозы). Одновременно увеличивается высвобождение глюкозы из печени (повышенная продукция глюкозы), что является ответом на избыточное высвобождение глюкагона. Гипергликемия ведет к глюкозурии и дегидратирующему осмотическому диурезу. Дегидратация - причина полидипсии. В силу внутриклеточного дефицита глюкозы, стимулируется аппетит, глюкоза образуется из белков (глюконеогенез), и потребности в энергии удовлетворяются обменом белков и жиров. Теряется вес и развивается белковая недостаточность. Одновременно усиливается распад липидов. Кровеносное русло заполняется триацилглицеролами и свободными жирными кислотами. Синтез жирных кислот ингибируется и катабо- лические пути не могут справиться с избытком образующегося ацетил-КoA. В печени, ацетил-КoA служит источником синтеза кетоновых тел. Кетоновые тела –в основном органические кислоты накапливаются в кровообращении (кетоз) в связи с тем, что скорость их образования превышает возможности клеток по их использованию. Это приводит к развитию метаболического ацидоза. К дегидратации добавляются потери Na+ и K+, поскольку эти плазменные катионы выделяются с органическими анионами, не закрытыми Н+ и NH4+ , секретируемыми почками. Постепенно развивается коматозное состояние и может наступить смерть, если не проводится лечение. Выделяют две формы диабета. • Основная причина клинических проявлений диабета дефицит эффектов инсулина на клеточном и тканевом уровнях. Одна из наиболее широко распространенных форм диабета - инсулин зависимый сахарный диабет (ИЗСД), или диабет типа 1, является следствием дефицита инсулина, вызываемым аутоиммунным разрушением В- клеток в панкреатических островках; A, D, и F- клетки остаются интактными. Вторая форма, не зависимый от инсулина сахарный диабет (НИЗСД), или диабет 2 типа, характеризуется устойчивостью к инсулину и сниженной секрецией инсулина. Недостаточно понятно, что является первичным, но выбор может быть сделан в пользу изменения устойчивости к инсулину. Повышение резистентности к инсулину ведет к повышению уровня глюкозы, что в свою очередь стимулирует секрецию инсулина и так происходит до превышения резервов В-клеток. В таких условиях уровень инсулина в плазме увеличивается, однако это повышение не достигает тех значений, которое бывает при нормальных условиях в ответ на тот же уровень сахара в плазме. Кроме этих форм связанных непосредственно с нарушениями обмена инсулина и его путей переноса сигнала в клетке описаны случаи диабета, как следствие других заболеваний таких, например, как хронический панкреатит, полная резекция поджелудочной железы, синдром Кушинга, акромегалия. Они составляют 5 % всех случаев диабета и иногда классифицируются как вторичный диабет • Диабет 1 типа обычно развивается до 40 лет и его называют диабетом юных. Такие больные не страдают ожирением и у них проявляется высокая склонность к кетозу и ацидозу. ИЗСД встречается примерно у 10 % больных диабетом. Это - аутоиммунное заболевание, сопровождающееся образованием анти-B-клеточных антител, которые вызывают разрушение В- клеток. Существует генетическая предрасположенность к этому заболеванию Основные изменения происходят в области основного комплекса гистосовместимости на хромосоме 5, хотя описаны изменения и других генов. • Более часто встречается НИЗСД. Это заболевание развивается обычно у людей старше 40 лет, не связано с потерей способности клеток секретировать инсулин и редко сопровождается кетозом. В- клетки таких больных морфологически не изменены и содержание инсулина обычно находится в пределах нормы на начальных этапах развития заболевания. Большинство больных с этой формой диабета страдают ожирением и толерантность к глюкозе у них повышается после снижения веса.. У больных НИЗСД обнаруживается недостаточное количество переносчика ГЛУТ4 в инсулинзависимых тканях. Ответ инсулина на данный стимул определяется частично секреторной предисторией В- клеток. У людей, получающих диету, богатую углеводами в течение нескольких недель отмечается более высокий уровень инсулина в плазме и большая секреторная реакция на нагрузку глюкозы чем у людей, которые находились на изокалорийной низкоуглеводной диете. Хотя В- клетки отвечают на стимуляцию гипертрофией, подобно другим эндокринным клеткам, они под влиянием длительной и интенсивной стимуляции теряют способность секретировать инсулин (истощение Вклеток). Если прекратить стимуляцию сразу после приостановки секреции, они могут восстановить свою активность, но если стимуляция продолжается , они в конечном счете погибают. Пока нет убедительных доказательств, что такая "атрофия истощения " встречается в любой другой эндокринной железе. Панкреатический резерв большой, и довольно трудно воспроизвести истощение В-клеток у нормальных животных; но если этот резерв уменьшить, например, частичной резекцией поджелудочной железы или малыми дозами алоксана, истощение оставшихся В-клеток может быть достигнуто любым воздействием, вызывающим повышение уровня глюкозы в плазме. Таковы причины диабета, вызываемого у животных с ограниченным панкреатическим резервом экстрактами передней доли гипофиза, гормоном роста, гормонами щитовидной железы или длительным непрерывным введением одной глюкозы. Диабет, вызываемый гормонами у животных вначале обратим, но при длительном действии он становится постоянным. Такие формы диабета обычно называют, используя название причины, вызвавшей диабет, например, " гипофизарный диабет", " тиреоидный диабет". Постоянный диабет, который сохраняется после такого воздействия, обозначают приставкой мета-, например, " метагипофизарный диабет " или " метатиреоидный диабет. " Когда инсулин применяется вместе с диабетогенными гормонами, В- клетки защищены, вероятно потому, что уровень глюкозы в плазме понижен и диабет не развивается. Глюкокортикоиды также вызывают повышение уровня глюкозы в плазме, но оказалось трудно вызывать постоянный диабет у животных введением только одних стероидов. Высокие дозы инсулина также ведут к коме • На рис.11.19 показаны реакции, которые проявляются при изменении уровня глюкозы в крови. Все известные последствия избытка инсулина непосредственно или косвенно связаны с влиянием гипогликемии на нервную систему. Кроме голодающих на протяжении длительного времени, глюкоза - единственное топливо, используемое в значительных количествах мозгом. Резервы углеводов в нервной ткани очень ограничены, и нормальная функция зависит от непрерывной поставки глюкозы. Как только уровень глюкозы в крови начинает понижаться, появляться первые симптомы – учащенное сердцебиение, потоотделение и нервное возбуждение. При более низких уровнях глюкозы в плазме появляются нейрогликопенические симптомы. Они включают ощущение голода, беспокойство. При еще большем снижении наступает летаргия, кома, конвульсии и, в конечном счете, может наступить смерть. Уже начальные симптомы гипогликемии требуют проведения мероприятий, направленных на введение глюкозы или глюкозусодержащих жидкостей (соки). Хотя быстрое исчезновение симптомов - обычная реакция, однако расстройства от переходного притупление интеллекта до постоянной комы могут сохраняться, если гипогликемия была тяжелой или продолжительной. Рис.11.19. Ответные реакции организма на изменение уровня сахара в крови • Падение уровня глюкозы компенсируется специальными механизмами. Самая простая и важная компенсация гипогликемии - прекращение секреции эндогенного инсулина. Полное ингибирование секреции инсулина наступает при достижении содержания 80 мг%. Одновременно гипогликемия стимулирует секрецию по крайней мере четырех контринсулиновых гормонов: глюкагона, адреналина, гормона роста, и кортизола. Глюкагон и адреналин стимулируют гликогенолиз, увеличивая выход глюкозы из печени. Гормон роста снижает использование глюкозы периферическими тканями, сходным действием обладает и кортизол. Ведущую роль в этой компенсации играют адреналин и глюкагон: если концентрация любого из них увеличивается, низкий уровень глюкозы полностью нормализуется, при отсутствии реакции со стороны этих гормонов уровень глюкозы остается низким. Действие остальных гормонов лишь вспомогательное. Глюкагон образуется А- клетками поджелудочной железы Глюкагон впервые был обнаружен в коммерческих препаратах инсулина еще в 1923 г., однако только в 1953 г. венгерский биохимик Ф. Штрауб получил этот гормон в гомогенном состоянии. Человеческий глюкагон - линейный полипептид с молекулярной массой 3485 Да, образуется А- клетками панкреатических островков и верхних отделов желудочно-кишечного тракта. Он содержит 29 остатков аминокислот. Глюкагон действует через 7ТМС рецепторы Глюкагон оказывает гликогенолитический, глюконеогенический, липолитический и кетогенный эффекты. Он действует на 7ТМС рецепторы с молекулярной массой около 190 кДа. В печени после взаимодействия с рецептором он действует через Gs белок, активируя аденилатциклазу и стимулируя образование цАМФ. Это ведет при участии протеинкиназы к активированию фосфорилазы и увеличению распада гликогена, повышению уровня глюкозы в плазме. Основные принципы такого классического примера действия гормона через цАМФ обсуждены ранее. Однако, глюкагон взаимодействует с разными рецепторами, расположенными на одних и тех же печеночных клетках и может активировать фосфолипазу C, увеличивая уровень цитоплазматического Ca2+ , что также может стимулировать гликогенолиз. Кроме того, протеинкиназа А, активируемая с участием глюкагона, снижает метаболизм глюкоза- 6-фосфата ингибируя преобразование фосфоенолпирувата в пируват. Это ведет к уменьшению концентрацию фруктозы 2,6 - дифосфата, что в свою очередь ингибирует преобразование фруктоза-6-фосфата во фруктоза 1,6 - дифосфат. Конечный эффект указанных изменений - увеличение глюкоза 6-фосфата, который в печени превращается в свободную глюкозу. Повышение выхода глюкозы из печени обеспечивается также усилением глюконеогенеза из доступных аминокислот в печени и увеличением интенсивности метаболизма. Кроме того, глюкагон увеличивает образование кетоновых тел, способствуя снижению уровня малонил-КоА в печени. Усилению кетогенеза способствует и стимуляция глюкагоном липолиза в адипоцитах. Калоригенное действие глюкагона не связанно прямо с гипергликемией, но скорее всего с активироавнием дезаминирования аминокислот в печени. Глюкагон—мощный стимулятор липолиза. Повышая содержание сАМР в адипоцитах, он активирует гормончувствительную липазу. Образующиеся при этом в большом количестве жирные кислоты могут использоваться в качестве источников энергии или превращаться в кетоновые тела (ацетоацетат и β-гидроксимасляная кислота). Глюкагон не оказывает гликогенолитического действия на мышечные клетки. Большие дозы экзогенного глюкагона оказывают положительный инотропный эффект на сердце, не изменяя возбудимость миокарда возможно потому, что он увеличивает уровень цАМФ в миокарде. Глюкагон стимулирует секрецию гормона роста, инсулина и панкреатического соматостатина. Основной регулятор секреции глюкагона - глюкоза Глюкагон имеет период полураспада в кровообращении 5-10 минут. Он разрушается многими тканями, но особенно печенью. Так как глюкагон секретируется в портальную вену и достигает печени прежде, чем достигает периферического кровообращения, его уровень в периферической крови относительно низок. Рост уровня глюкагона в периферической крови, вызываемый нервными стимулами (см. ниже) боле выражен у больных с циррозом, возможно из-за сниженного печеночного разрушения гормона. Регуляция секреции Таблица 11.11.Регуляторы секреции глюкагона Стимуляторы Ингибиторы Аминокислоты (в основном гико- Глюкоза генные: аланин, серин, глицин, Соматостатин цистеин, и треонин) Секретин CCK, гастрин Жирные кислоты Кортизол Кетоновые тела Физические упражнения Инсулин Инфекции Фенитоин Разные стрессовые ситуации α-адренэргичесике стиβ-Адренэргические стимуляторы муляторы Теофиллин ГАМК Ацетилхолин Факторы, влияющие на секрецию глюкагона показаны в таблице 12-23. Основным регулятором является уровень глюкозы в крови: секреция увеличивается в ответ на гипогликемию и снижается при повышении уровня глюкозы в плазме. B- клетки способны синтезировать ГАМК, и ее уровень повышается при увеличении секреции инсулина, вызываемой гипергликемией. Высвобождаемая В- клетками ГАМК, связывается с ГАМКA -рецепторами А- клеток. ГАМКA -рецепторы - ионные (Cl-)каналы. Поступление ионов Cl- вызывает гиперполяризацию А- клеток и торможение секреции глюкагона Секреция глюкагона увеличивается стимуляцией симпатической нервной системы. Этот эффект опосредован β- адренергическими рецепторами и цАМФ. А- клетки подобно Вклеткам увеличивают секрецию при стимуляции β – адренергических рецепторов и тормозят секрецию при стимуляции α- адренергических рецепторов. Однако, суммарная панкреатическая реакция на симпатическую стимуляцию в отсутствии блокаторов – увеличение секреции глюкагона, так как эффект β - рецепторов преобладают в клетках секретирующих глюкагон. Стимулирующие эффекты различных стрессовых воздействий, физических упражнений и инфекций опосредуются по крайней мере частично симпатической нервной системой. Секреция глюкагона увеличивается в ответ на поступление аминокислот и богатую белками пищу. Высокой активностью обладают гликогенные аминокислоты. Увеличение секреции глюкагона во время приема белковой пищи играет важную роль, так как аминокислоты стимулируют одновременно и секрецию инсулина, и секретируемый глюкагон предотвращает развитие гипогликемии, а инсулин в то же время ускоряет депонирование поступающих углеводов и липидов. Секреция глюкагона увеличивается при голодании. Пик секреции наступает на третий день голода, во время максимального глюконеогенеза и после того как жирные кислоты и кетоновые тела становятся главными источниками энергии. Во время физических упражнений повышается использование глюкозы, которое сбалансировано усилением образования глюкозы, вызванным секретируемым глюкагоном. Пероральный прием аминокислот оказывает более выраженный стимулирующий эффект на секрецию глюкагона, чем внутривенное введение аминокислот. Это позволило выявить некоторые факторы, влияющие на секрецию глюкагона, секретируемые слизистой желудочно- кишечного тракта. CCK и гастрин увеличивают секрецию глюкагона, а секретин оказывает тормозящий эффект. Так как секреция CCK и гастрина увеличивается в ответ на белковую пищу, оба гормона можно рассматривать своеобразными посредниками желудочно-кишечного тракта в секреции глюкагона. Секреция глюкагона также ингибируется свободными жирными кислотами и кетоновыми телами, хотя этот ингибирующий эффект преодолевается при диабетическом кетоацидозе, когда уровень глюкагона достаточно высок. Молярное отношение инсулин :глюкагон - важный показатель состояния регуляторных систем метаболизма. Как отмечено выше, по своему действию инсулин является гликогенным, антиглюконеогенетическим, антилиполитическим, и антикетогенным гормоном, обеспечивающим депонирование поступающих питательных веществ. Глюкагон, наоборот, обладает гликогенолитическим, глюконеогенетическим, липолитическим, и кетогенным эффектами. Молярное отношение этих молекул в образце крови несет большую информацию о состоянии регуляторных систем у человека D- клетки поджелудочной железы секретируют соматостатин В разделе, посвященном гормонам гипофиза, уже упоминалось о гормоне, подавляющем секрецию гормона роста и названном поэтому соматостатином, однако, как оказалось, он синтезируется многими другими клетками, в частности D- клетками поджелудочной железы. У больных с опухолями, возникающими из этих клеток и секретирующими большие количества соматостатина проявляются многие симптомы инсулиновой недостаточности, которые исчезают после удаления опухоли. У этих больных наблюдаются также явления диспепсии из-за замедления опорожнения желудка и снижения образования соляной кислоты. Нарушение моторной функции желчного пузыря способствует образованию желчных камней, торможение секреции ферментов экзокринной части поджелудочной железы – причина нарушения переваривания белков. Панкреатический полипептид синтезируется F- клетками поджелудочной железы Панкреатический полипептид - линейный полипептид из 36 остатков аминокислот (молекулярная масса около 4200 Да), синтезируется F- клетками островков поджелудочной железы. Он структурно связан с двумя другими 36-аминокислотыми полипептидами: полипептидом YY (PYY), который обнаружен в кишечнике и возможно может быть отнесен к желудочно-кишечным гормоном, и нейропептидом Y, который синтезируется некоторыми нейронами в мозгу. Их объединяют концевые остатки тирозина и амидинированные карбоксильные группы С- концевых аминокислот. Методами РИА панкреатический полипептид может быть определен в периферической крови. По крайней мере частично, его секреция находится под холинергическим управлением, уровень в плазме падает под влиянием атропина Секреция панкреатического полипептида увеличивается после приема богатой белками пищи, при голодании, под влиянием физических упражнений и острой гипогликемии. Секреция снижается соматостатином и внутривенно введенной глюкозой. Введение лейцина, аргинина и аланина не оказывают влияния, так что стимулирующий эффект белковой пищи опосредуется косвенными механизмами. Панкреатический полипептид замедляет всасывание в кишечнике продуктов переваривания. Его физиологические функция продолжают исследоваться. ГОРМОНЫ НАДПОЧЕЧНИКОВ Гормоны коры надпочечников - производные холестерола. Подобно холестеролу, желчным кислотам, витамину D и стероидным гормонам половых желез они содержат ядро циклопентанопергидрофенантрена. Выделяют три типа биологически активных стероидов: • C21 стероиды, которые имеют двухуглеродную боковую цепь в положении 17; • C19 стероиды, которые имеют кето или гидроксильную группу в положении 17; и • C18 стероиды, которые, в дополнение к 17-кето или гидроксильной группам, не имеют боковой метиловой группы, присоединенной в положении 10. В коре надпочечников образуются преимущественно C21 и C19 стероиды. C19 сте- роиды за характерную кетогруппу в положении 17 называют 17-кетостероидами. C21 стероиды, имеющие гидроксильную группу в 17 положении часто называют 17-гидроксикортикоидами или 17-гидроксикортикостероидами. C19 стероиды проявляют андрогенную активность. C21 стероиды классифицируются, Рис 11.20. Основные классы стероидных гормонов. используя терминологию Селье, как минералокортикоиды или глюкокортикоиды. Все секретируемые C21 стероиды обладают и глюкокортикоидной и минералокортикоидной активно- стями. Минералокортикоидами принято называть те соединения, у которых преобладает влияние на выделение Na+ и K+ , а глюкокортикоидами – соединения с преобладающим эффектом на обмен глюкозы и белков. Детали номенклатуры стероидов и изомерии можно найти в учебных пособиях по биоорганической химии, однако следует напомнить, что греческая буква ∆ указывает на двойную связь и что группы, которые лежат выше плоскости каждого из стероидных колец, обозначаются греческой буквой β (цис) и сплошной линией (-ОН) в то время как группы, которые лежат ниже плоскости кольца обозначаются буквой α (транс) и прерывистой линией (---ОН). У большинства естественных стероидов, секретируемых надпочечниками, 17 гидроксигруппы находятся в α конфигурации, в то время как 3-, 11-, и 21 гидроксигруппы находятся в β конфигурации. Из надпочечников выделено большое количество стероидов (свыше 50), но биологически активными стероидами, секретируемыми в физиологически значимых количествах являются: минералокортикоид альдостерон, глюкокортикоиды кортизол и кортикостерон, и андрогены дегидроэпиандростерон (DHEA) и андростендион. Таблица 11.12 . Основные гормоны коры надпочечников у взрослого человека.1 Название Синоним Средняя концентрация Среднее секретируев плазме (свобод. и мое количество связан.)1 (µг/дЛ) (мг/24 ч) Кортизол Соединение F, 13.9 10 гидрокоризон Кортикостерон Соединение B 0.4 3 Адьдостерон 0.006 0.15 ДезоксикортикостеDOC 0.006 0.20 рон Дегидроэпиандросте- DHEAS 175.0 20 рон сульфат 1 Все концентрации в плазме за исключением DHEAS - утренние значения после ночного голодания. Дезоксикортикостерон -минералокортикоид, который обычно секретируется в примерно в равных альдостерону количествах, но обладает лишь 3 % минералокортикоидной активности альдостерона. Его влияние на минеральный обмен обычно незначительно, но при заболеваниях, сопровождающихся увеличением его секреции, влияние дезоксикортикостерона может значительно повышаться. Часть эстрогенов, которые не синтезируются в яичниках, образуются в кровообращении из надпочечного андростендиона. Почти весь дегидроэпиандростерон секретируется в комплексе с сульфатом, все же остальные стероиды секретируются в свободной, неконъюгированной форме. Скорость секреции стероидов определяется введением небольших доз меченых стероидов с последующим определением скорости, с которой радиоактивный стероид, выделяемый почками, разбавляется немеченым секретируемым гормоном. У всех видов от амфибий до человека, основными C21 стероидами, секретируемыми корой надпочечников являются, альдостерон, кортизол, и кортикостерон, хотя отношение кортизола к кортикостерону различно. Основной исходный субстрат для синтеза гормонов коры надпочечников – холестерол. Липиды в надпочечниках составляют до 20% их массы и главным липидом надпочечников является холестерол (3-10% их массы). 80-90% всех запасов холестерола представляют эфиры и около 10% составляет свободный холестерол, который находится в основном в мембранах эндоплазматической сети и митохондриях. Биосинтез холестерола и его поступление из крови регулируется кортикотропином, который оказывает влияние на скорость стероидогенеза в надпочечниках, изменяя метаболизм холестерола и его перераспределение как внутри клетки, так и в митохондриях. Скорость синтеза холестерола зависит от его поступления из крови и при достаточном количестве внеклеточного холестерола отмечается угнетение его синтеза клетками надпочечников. Синтезированный холестерол хранится в липидных вакуолях в форме эфиров с жирными кислотами. При участии гидролазы эфиров холестерола свободный холестерол высвобождается из липидных вакуолей и переносится в митохондрии. Прегненолон –прямой предшественник всех стероидных гормонов. Образование основного предшественника всех стероидных гормонов прегненолона происходит в митохондриях. При участии специфического белка переносчика с периодом полураспада 8-10 мин, синтез которого регулируется котикотропином ( при участии цАМФ зависимой протеинкиназы ПКА) холестерол переносится в митохондрии, где холестерол 20, 22-гидроксилаза: 20, 22-десмолаза катализирует отщепление боковой цепи холестерола и образование прегненолона. Этот фермент представляет митохондриальный цитохром P450, который называют также ферментом распада боковой цепи, P450scc, или CYP11A. Прегненолон в дальнейшем становится основным исходным субстратом в синтезе всех гормонов коры надпочечника. Клетки гломерулярной зоны синтезируют альдостерон потому, что у них есть синтаза альдостерона Рис.11.21.Реакции образования альдостерона В гломерулярной зоне с участием таких же ферментов, как и в сетчатой и пучковой зонах, происходит образование стероидов до стадии 11-дезоксикортикостерона. Однако в клетках гломерулярной зоны синтезируется специальный фермент, синтаза альдостерона, который катализирует формирование кортикостерона, его последующее гидроксилирование и окисление и образование альдостерона (см. рис.11.21). Синтаза альдостерона (CPY11β2), на 95 %, идентична CPY11β1, и гены обоих ферментов локализуются на одной и той же части хромосомы 8. Однако синтаза альдостерона синтезируется только в гломерулярной зоне. Все это позволяет объяснить возможности гломерулярной зоны по синтезу альдостерона и отсутствие возможностей синтезировать 17-гидроксистероиды или половые гормоны. Транскортин- главный транспортный белок стероидных гормонов Секретируемые кортизол и кортикостерон в крови связываются со специфическим глобулином - транскортином или глобулином, связывающим кортикостероиды (ГСК), и небольшая часть их связывается с альбумином плазмы. Связывание кортикостерона с белка ми слабое, поэтому период полураспада кортизола в кровообращении более длителен (приблизительно 60-90 минут), чем у кортикостерона (50 минут). Связанные стероиды физиологически не активны. Свободные формы этих белков присутствуют в очень незначительных количествах в крови и моче. Печень –основной орган катаболизма стероидных гормонов надпочечников Кортизол метаболизирует в печени, которая является основным местом катаболизма глюкокортикоидов. Большая часть кортизола восстанавливается в дигидрокортизол и затем в тетрагидрокортизол, который связывается с глюкуроновой кислотой . Глюкуронилтрансферазная система, ответственная за это преобразование также катализирует формирование глюкуронидов билирубина и множества других гормонов и препаратов. Существуют конкурентные взаимоотношения между этими субстратами для системы фермента. Печень и другие ткани содержат фермент 11β-гидроксистероид дегидрогеназу (см. ниже). Известны две формы этого фермента. Тип 1 катализирует и преобразование кортизола в кортизон и обратную реакцию, хотя она обычно катализирует редуктазную реакцию, образуя кортизол из кортикостерона. Тип 2 катализирует почти исключительно одностороннее преобразование кортизола в кортизон. Кортизон - активный глюкокортикоид и более известен из-за его широкого использования в медицинской практике, но он не секретируется в значительных количествах надпочечниками. Только небольшое количество кортизона, образующегося в печени, поступает в кровообращение в связи с его быстрым восстановлением и образованием глюкуронида тетрагидрокортизона. Тетрагидроглюкуронидные производные ("коньюгаты") кортизола и кортикостерона легкорастворимы. Они поступают в кровообращение, где они, не связываясь с белками, быстро выделяются почками с мочой частично секретируясь эпителием канальцев. Около 10 % секретированного кортизола преобразуются в печени в 17-кетостероидные производные кортизола и кортизона. Кетостероиды коньюгируют главным образом с сульфатом и затем выделяются мочой. Образуются и другие метаболиты, включая 20 гидроксипроизводные. Существует энтерогепатический оборот глюкокортикоидов и около 15 % секретируемого кортизола выделяется кишечником. Метаболизм кортикостерона подобен таковому у кортизола, за исключением того, что он не образует 17-кетопроизвод ных. Скорость печеночной инактивации глюкокортикоидов понижается при заболеваниях печени а также во время хирургических операций и других стрессовых воздействий . Таким образом, у подвергнутых стрессу людей, уровень свободного кортизола выше чем при максимальной стимуляции АКТГ в отсутствии напряжения. Альдостерон связывается с белками слабо и его период полураспада короткий (около 20 минут). Секретируется он в небольших количествах и уровень общего альдостерона в плазме у людей очень низкий (0.006 мкг/100мл (0.17 нмоль/л)) в сравнении с уровнем кортизола (связанным и свободным) равным 13.5 мкг/100мл (375 нмоль/л). Большая часть альдостерона преобразуется в печени в тетрагидроглюкуронидные производные, но некоторое количество его в печени и в почках превращается в 18-глюкурониды. Эти глюкурониды, которые в отличие от продуктов распада других стероидов, освобождают альдостерон при гидролизе при pH 1.0, часто называют "кислотно-лабильные коньюгаты." Меньше 1 % секретируемого альдостерона появляются в моче в свободной форме. Около 5 % находится в форме кислото-лабильных коньюгатов и до 40 % находится в форме тетрагидроглюкуронидов. 17-кетостероиды мочи – продукт распада андрогенов Главный надпочечный андроген - 17-кетостероид дегидроэпиандростерон, хотя секретируется также и андростендион. 11 гидроксипроизводные андростендиона и 17-кетостероиды, образованные из кортизола и кортизона путем удаления боковой цепи в печени, единственные 17-кетостероиды, которые имеют =O или - ОН группы в 11 положении ("11окси-17-кетостероиды "). Тестостерон также превращается в 17-кетостероид. Так как ежедневное выделение17-кетостероидов составляет у нормальных взрослых - 15 мг у мужчин и 10 мг у женщин, две трети кетостероидов мочи у людей секретируется надпочечниками или образуется из кортизола в печени и одна треть имеют тестикулярное происхождение. Этиохоланолон, один из метаболитов надпочечных андрогенов и тестостерона, в случае, если он не коньюгирован с уроновыми кислотами может вызывать лихорадку. У некоторых людей могут наступать эпизодические приступы лихорадки вследствие накопления в крови у них неконъюгированного этиохоланолона ("этиохоланолоновая лихорадка "). Секреция АКТГ и кортикостероидов подвержена циркадным ритмам . Существует эндогенный ритм, определяющий секрецию кортиколиберина, и следовательно, АКТГ. Этот циркадный ритм в норме настроен так, чтобы обеспечивать увеличение кортизола в крови вскоре после засыпания. Во время сна уровень кортизола продолжает возрастать, достигая пика между 4 и 10 часами, затем постепенно падает до минимальных величин к концу дня и в ранние вечерние часы. Этот циркадный ритм в секреции АКТГ наблюдается и у больных с недостаточностью надпочечников, получающих постоянные дозы глюкокортикоидов. Конечный эффект - результат последовательных эпизодов импульсного выброса кортизола, которым предшествует импульсная секреция АКТГ. Все вместе эти события составляют сложный цикл, зависящий от светового периода и циклов питания— голодания и сна — бодрствования. Удлинение светового дня изменяет суточный ритм секреции. Исчезновение суточной периодичности секреции стероидов обычно связано с патологией гипофизарно-адреналовой системы, некоторыми видами депрессивных состоянии, а также с дальними перелетами через несколько часовых поясов. На секрецию кортизола влияют также физический и эмоциональные стрессы, состояние тревоги, страха, волнения и боль. Эти реакции могут нивелировать воздействия системы отрицательной обратной связи и суточного ритма. Свободные глюкокортикоиды ингибируют секрецию АКТГ, и степень ингибирования гипофиза пропорциональна циркулирующему уровню глюкокортикоидов. Ингибирующий эффект проявляется и на гипофизарном и гипоталамических уровнях. Ингибирование, пре жде всего, связано с действием на ДНК и максимальное ингибирование проявляется через несколько часов. Однако есть и более " быстрая обратная связь". АКТГ– ингибирующая активность различных стероидов параллельна их глюкокортикоидным свойствам. Падение уровня кортикоидов в покое стимулирует секрецию АКТГ, и при хронической надпочечной недостаточности есть отмеченное увеличение скорости синтеза и секреции АКТГ. Заслуживают внимания опасность, возникающая после прекращения лечения противовоспалительными дозами глюкокортикоидов. Мало того, что надпочечники при этом истощаются, но даже после восстановления реактивности введением АКТГ, гипофиз неспособен секретировать нормальные количества АКТГ в течение месяца. Причина дефицита – снижение синтеза АКТГ. Поэтому, следует медленно повышать АКТГ к супранормальным уровням. Это в свою очередь будет стимулировать надпочечники, а повышение выделения глюкокортикоидов, с торможением по принципу обратной связи, постепенно снизит повышенные уровни АКТГ до нормы. Рис.11.22.Механизм регуляции и регуляторы секреции гормонов коры надпочечников (сплошная линия –активирование, прерывистая- ингибирование) Этих осложнений стероидной терапии можно избежать медленным уменьшением доз стероидов на протяжении длительного периода. Регуляция секреции альдостерона мало зависит от АКТГ Первичными регулирующими секрецию альдостерона факторами являются АКТГ из гипофиза, ренин из почек при участии ангиотензина II, и прямое стимулирующее действие повышения концентрации K + плазмы на кору надпочечников. АКТГ стимулирует высвобождение альдостерона также, как и глюкокортикоидов и половых гормонов. Хотя количество АКТГ необходимое для этого несколько больше чем количество, которое стимулирует максимальную секрецию глюкокортикоидов, оно находится в пределах диапазона эндогенной секреции АКТГ. Эффект преходящий и даже если секреции АКТГ остается повышенной, выход альдостерона снижается через1-2 дня. С другой стороны, секреция минералокортикоида дезоксикортикостерона остается повышенной. Снижение выхода альдостерона частично следствие уменьшения секреции ренина, вторичной к гиперволемии (см. ниже), но возможно, что некоторые другие факторы также уменьшают превращение кортикостерона в альдостерон. После гипофизэктомии, скорость базальной секреции альдостерона остается нормальной. Стрессовые стимулы не вызывают повышения его секреции, хотя секреция альдостерона увеличивается в ответ на диетическое ограничение солей в течение некоторого времени. Позже, атрофия гломерулярной зоны осложняет картину продолжительного гипопитуитаризма, и может привести к потере солей и гипоальдостеронизму. Ведущий фактор в регуляции секреции альдостерона – ренин –ангиотензиновая система. Рис.11.23.Механизмы регуляции секреции альдостерона. В ответ на: • • переход из горизонтального положения в вертикальное; снижение внутрисосудистого давления и объема вследствие дегидратации, кровотечения, приема диуретиков, гипоальбуминемии; • стрессовые ситуации, повышение активности симпатический нервной системы, прием β-адреностимуляторов (изопреналин, адреналин); • ограничение приема натрия; • стимуляцию секреции простагландинов, глюкагона, брадикинина; • сердечную недостаточность и цирроз печени; • снижение кровотока в почечной артерии юкстагломерулярные клетки почечных афферентных артериол обладают способностью секретировать протеолитический фермент ренин. У человека это - гликопротеин с молекулярной массой 37,326 Да. Молекула фермента состоит из двух долей или доменов, между которыми расположен активный центр. Ренин – аспарагиновая протеаза. Единственной известной функцией ренина является гидролитическое отщепление декапептида ангиотензина I от N концевого отдела ангиотензиногена. Ангиотензин-конвертирующий фермент (АКФ) — гликопротеин, выявляется в легких, эндотелиальных клетках и в плазме крови, отщепляет от ангиотензина I два С-концевых аминокислотных остатка, превращая его в ангиотензин II. AКФ - эктофермент, который существует в двух формах: соматической форме, которая является компонентом мембран эндотелиальных клеток и форме, обнаруженной в сперматогенных клетках и сперматозоидах. Реакция, которую катализирует АКФ, видимо, не является скорость-лимитирующей. Различные нонапептиды—аналоги ангиотензина I—способны ингибировать превращающий фермент и потому используются для лечения ренин-зависимой гипертонии. АКФ расщепляет также брадикинин, мощное сосудорасширяющее средство. Таким образом, этот фермент повышает кровяное давление двумя различными путями. Период полураспада ангиотензина II в кровообращении, у людей оставляет1-2 минуты. Его дальнейшие превращения катализируются различными пептидазами. Аминопептидаза удаляет остаток аспарагиновой кислоты от аминоконца пептида. Образующийся гептапептид, в отличие от других фрагментов пептида, обладает физиологической активностью и иногда называется ангиотензином III. Кроме того, аминопептидаза может действовать на ангиотензин I, образуя (des-Asp1) ангиотензин, а это соединение может быть преобразовано непосредственно в ангиотензин III действием АФК. Ферменты, катализирующие распад ангиотензина найдены в эритроцитах и многих других тканях. Ангиотензин II – гипертезин Ангиотензин I –основной предшественник ангиотензина II . В этом его главное физиологическое значение. Продукт его протеолиза ангиотензин II- первоначально названный гипертензином или ангиотонином - действует непосредственно на гладкие мышцы сосуди- стой стенки, вызывая сужение артериол и повышая систолическое и диастолическое кровяное давление. Это - один из наиболее мощных из известных вазоконстрикторов, который в четыре- восемь раз активнее норадреналина. Однако, его вазопрессорная активность уменьшается при недостаточности натрия и у больных с циррозом и некоторыми другими болезнями. В этих условиях, уровень циркулирующего ангиотензина II значительно повышается, что вызывает снижение количества рецепторов ангиотензина в гладкомышечных клетках и снижает чувствительность к вводимому ангиотензину II. Ангиотензин II также действует непосредственно на кору надпочечников, увеличивая секрецию альдостерона, а ренин- ангиотензиновая система главный регулятор секреции альдостерона. Дополнительным эффектом действия ангиотензина II является усиление выделения норадреналина прямым действием на постганглионарные симпатические нейроны, сокращение мезангиальных клеток с результирующим уменьшением в скорости клубочковой фильтрации и прямой эффект на почечные канальцы с увеличением реабсорбции Na+. Ангиотенсин II оказывает влияние на мозг, увеличивая поступление воды и секрецию вазопрессина и АКТГ. Не проникая через гематоэнцефалический барьер, он вызывает эти реакции, действуя структуры мозга, которые расположены вне гематоэнцефалического барьера Ангиотензин III обладает примерно 40 % вазопрессорной активности ангиотензина II, и равен ему по активности в стимулирующем действии на секрецию альдостерона. Предполагалось даже, что ангиотензин III - естественный пептид стимулирующий образование и секрецию альдостерона, в то время как ангиотензин II – пептид, регулирующий кровяное давление, хотя больше данных за то, что ангиотензин III - просто продукт распада с некоторой биологической активностью. Определенную роль в действии ангиотензина может играть и биосинтез простагландинов. Судя по тому, что простагландины Е1 и Е2 стимулируют высвобождение альдостерона, a F1a и F2a тормозят, в целом это типично для опосредованных простагландинами реакций. Ингибитор биосинтеза простагландинов индометацин тормозит как базальное, так и стимулированное ангиотензином II высвобождение альдостерона. Уровень К+ в плазме - еще один регулятор образования альдостерона. Секреция альдостерона зависит от изменений уровня калия в плазме: увеличение калия всего лишь на 0,1 м-экв/л стимулирует секрецию, а снижение на ту же величину тормозит синтез и секрецию гормона. Эффект K+ не зависит от уровней Na+ и ангиотензина II в плазме крови. Продолжительная гиперкалиемия приводит к гипертрофии клубочковой зоны и повышению чувствительности ее клеток к ионам калия. К+ воздействует на те же фер- ментативные этапы, что и ангиотензин II, но механизм его эффекта не известен. Подобно ангиотензину II, K+ не влияет на биосинтез кортизола. При свободной диете и нормальном содержании в ней хлорида натрия секреция альдостерона у практически здоровых лиц составляет от 100 до 500 нмоль/сут (30-150 мкг/сут) при концентрации его в сыворотке крови от 15 до 400 нмоль/л (5-15 нг/100 мл). Глюкокортикоидные гормоны стимулируют образование глюкозы. Конечный эффект действия глюкокортикоидных гормонов – повышение уровня глюкозы в крови при голодании и при снижении уровня инсулина. Это достигается увеличением ее образования и координированным гормональным воздействием на разные ткани и включает как катаболические, так и анаболические эффекты. Под влиянием глюкокортикоидов происходит: • Активирование катаболизма белков в мышечной и лимфоидной тканях, способствующее увеличению вывобождения аминокислот – основных субстратов глюконеогенеза. • Усиление механизмов распада аминокислот с образованием a-кетокислот из гликогенных аминокислот (индукция и активирование аминотрансфераз). • Увеличение скорости глюконеогенеза (активирование и индукция ключевых ферментов глюконеогенеза совместно с глюкагоном). • «Пермиссивное действие» на другие гормоны, позволяющее им стимулировать ключевые метаболические процессы, в том числе глюконеогенез, с максимальной эффективностью. • Снижение потребления глюкозы во внепеченочных тканях. Глюкокортикоиды увеличивают запасы гликогена в печени как голодных, так и сытых животных. Это влияние связано с превращением неактивной формы гликогенсинтазы в активную путем активации фосфатазы, которая способствует этому превращению. У здоровых животных эти влияния глюкокортикоидов уравновешиваются действием инсулина, который оказывает противоположный эффект. Существует тканевая специфичность в действии глюкокортикостероидов на липидный обмен. Эффекты глюкокортикоидов на липидный обмен проявляются при использовании высоких доз глюкокортикоидов, которые стимулируют липолиз в одних частях тела (конечности) и липогенез — в других (лицо и туловище). Этот эффект может быть связан с повышением уровня инсулина в крови, возникающее в ответ на избыток глюкокортикоидов. Однако очевидно существует, какая-то тканевая специфичность, поскольку стимуляция липолиза либо липогенеза в этих условиях наблюдается отнюдь не во всех частях тела. В таких условиях возрастает уровень свободных жирных кислот в плазме крови. Это может быть следствием прямой стимуляции липолиза, а также снижением потребления и использования глюкозы жировой тканью и образования глицерола, который используется в синтезе нейтрального жира. Повышение концентрации свободных жирных кислот в крови и сопряженное с этим усиление их превращения в кетоны способствуют развитию кетоза, особенно при инсулиновой недостаточности. Эти эффекты имеют большое значение, но самое важное действие глюкокортикоидов на липидный обмен вытекает из их способности усиливать липолитическое действие катехоламинов и гормона роста. На обмен белков глюкортикостероидов оказывают двоякий эффект Из описанного выше молекулярного механизма действия очевидно анаболическое действие глюкокортикоидов: они стимулируют синтез нуклеиновых кислот и белков. Однако в большинстве органов за исключением печени, ярко проявляется и катаболический эффект гормонов: их главная задача обеспечить оптимальные условия для глюконеогенеза, однако молекулярные механизмы этого эффекта мало изучены. Высокие концентрации глюкокортикоидов тормозят иммунологический ответ. Глюкокортикоиды в высоких концентрациях нашли широкое применение для лечения аутоиммунных заболеваний или для подавления реакции отторжения при пересадке тканей. Эти концентрации глюкокортикоидов тормозят иммунологический ответ на разных уровнях: на пролиферацию лимфоцитов в ответ на антигены, на процессинг антигена макрофагами, выработку антител В-лимфоцитами, супрессорную и хелперную функции Т-лимфоцитов и метаболизм антител. Однако роль физиологических концентраций этих гормонов на иммунный ответ остается не изученным. Высокие концентрации глюкокортикоидов подавляют воспалительную реакцию. Подобно влиянию на иммунный ответ высокие дозы глюкокортикоидов подавляют воспалительную реакцию. Они вызывают снижение числа циркулирующих лимфоцитов, моноцитов и эозинофилов за счет их перехода из сосудистого русла в костный мозг, лимфоидную ткань или селезенку и повышают выход полиморфноядерных лейкоцитов из костного мозга, увеличивая их число в крови. В участках воспаления глюкокортикоиды тормозят накопление лейкоцитов и высвобождение из них веществ, участвующих в воспалительной реакции (кининов, плазминогенактивирующего фактора, простагландинов и гистамина), ингибируют пролиферацию и некоторые другие функции фибробластов. Оказывая ингибирующий эффект на активность фосфолипазы А2, они уменьшают выход арахидоновой кислоты из фосфолипидов ткани и следовательно уменьшают формирование лейкотриенов, тромбоксанов, простагландинов и простациклина. Сочетание указанных эффектов ведет к ухудше- нию заживления ран, повышенной чувствительности к инфекции и снижению воспалительного ответа, что обычно наблюдается у больных с избытком глюкокортикоидов. Глюкокортикоиды оказывают влияние практически на все органы и системы Обладая свойствами минералокортикоидов, глюкокортикоидные гормоны увеличивают выработку ангиотензиногена, а соответственно—и ангиотензина II, в итоге они способствуют повышению кровяного давления, усиливают задержку натрия и вызывают выведение калия. Все это оказывает влияние на сердечно-сосудистую систему, которое усиливается пермиссивным действием глюкокортикоидов на эффекты катехоламинов. При недостаточности глюкокортикоидов нарушается экскреция воды. Это связывают с изменением секреции АДГ, которую глюкокортикоиды тормозят и при их отсутствии уровень АДГ может возрастать, задерживая воду в организме. Одновременно изменяется скорость клубочковой фильтрации, что может повлечь за собой снижение клиренса несвязанной воды. Упомянутое выше ингибирующее действие на рост и деление фибробластов ведет к ослаблению структурной основы кожи и соответственно к типичным для избыточности глюкокортикоидов в организме явлениям, а именно истончению кожи, ее быстрой повреждаемости, плохому заживлению ран. Это сказывается и на процессах в костной ткани, в которой при длительном применении гормонов развивается уменьшение массы. Тяжелая атрофия мышц и мышечная слабость характерны для больных, длительное время подвергавшихся воздействию избытка глюкокортикоидов, которые оказывают выраженный катаболический эффект на эту ткань. Минералокортикоиды увеличивают реабсорбцию Na+ Альдостерон и другие стероиды с минералокортикоидной активностью увеличивают реабсорбцию Na+ из мочи, пота, слюны и желудочного сока. Ионы натрия перемещаются из мочи (или слюны, пота, или желудочного сока) в окружающие эпителиоциты и активно транспортируются из этих клеток в интерстициальную жидкость. Количество удаленного Na+ из этих жидкостей пропорционально скорости активного транспорта Na+. Таким образом, минералокортикоиды вызывает задержку Na+ во внеклеточной жидкости. В почках, они действуют, прежде всего, на эпителий собирательных трубочек. Они могут также способствовать увеличению уровня K+ и снижению уровня Na+ в мышцах и мозговых клетках. Под влиянием альдостерона, задержка Na+ в действительности происходит в обмен на K+ и Н+ в почечных канальцах, усиливая выделение K+ и повышая кислотность мочи. Для проявления своей активности альдостерон связывается с внутриклеточным рецептором. Механизм действия альдостерона подобен действию других стероидных гормонов. Альдостерон не имеет специальных транспортных белков и легко проникает в клетки, где связывается с внутриклеточным минералокортикоидным рецептором, который при помощи своего ДНК-связывающего домена взаимодействует с определенными участками генома и ускоряет синтез иРНК и белков. Недостаточность ферментов, катализирующих синтез кортикостероидов, ведет к гиперплазии надпочечников. Введение глюкокортикоидов показано при всех формах вирилизирующей врожденной надпочечной гиперплазии, потому что они восстанавливают дефицит глюкокортикоидов и ингибируют секрецию АКТГ, уменьшая патологическую секрецию андрогенов и других стероидов. Однако, дозы, которые только восстанавливают активность глюкокортикоидов до нормального уровня, полностью не устраняют избыток продукции андрогенов, потому что нарушение биосинтеза стероидов все же сохраняется, и некоторое количество эндогенных субстратов используется на синтез андрогенов. Предлагается для решения этой проблемы вводить высокие дозы глюкокортикоидов или комбинировать введение глюкокортикоидов с препаратами, которые предотвращают эффекты избытка половых гормонов Синдром Кушинга развивается при избытке глюкокортикоидов. Состояние, развивающаяся на фоне длительного повышения уровня глюкокортикоидов в плазме называется синдромом Кушинга . Оно может быть следствием применения больших количеств экзогенных гормонов или повышенным синтезом гормонов опухолями надпочечников (АКТГ независимый синдром Кушинга) или состояниями, которые увеличивают секрецию АКТГ (АКТГ зависимый синдром Кушинга).Обычно, АКТГ зависимые состояния называют болезнью Кушинга, а АКТГ независимые - синдромом Кушинга, хотя это и вносит некоторую путаницу. Основные проявления этого синдрома связаны с белковой недостаточностью, вызванной усилением распада белков Кожа и подкожные ткани истончаются , мышцы плохо развиты. Раны заживают плохо, и незначительные механические повреждения вызывают появление гематом и подкожных кровоизлияний. Волосы редкие. У многих на лице появляются угри. Это вызвано увеличенной секрецией андрогенов, что часто сопровождает увеличение секреции глюкокортикоида. Происходит также своеобразное перераспределение отложений жира, а именно ожирение туловища. Конечности тонкие, но жир собирается на брюшной стенке, лице. Сочетание тонкой кожи на животе с увеличенными подкожными жирными складами часто приводит к разрывам кожи с образованием рубцов. Активное превращение аминокислот в глюкозу в печени и снижение потребления глюкозы периыфирическими тканями может быть причиной устойчивого к инсулину сахарного диабета, особенно у больных наследственно предрасположенных к диабету. Глюкокортикоиды могут повышаться до значений, при которых начинает проявляться минералокортикоидная активность. Задержка солей и воды и отложение липидов на лице придает своеобразное выражение лицу. Значительные потери K+ вызывают слабость. Приблизительно 85 % пациентов с синдромом Кушинга гипертензивны. Артериальная гипертензия может быть следствием увеличения секреции дезокикортикостерона, увеличенной ангиотензиногенной секрецией или прямым влиянием глюкокортикоидов на кровеносные сосуды. Избыток глюкокортикоидов способствует развитию остеопороза и нарушению функций костной системы. Первичная недостаточность надпочечников - аддисонова болезнь. Наиболее частой причиной первичной недостаточность надпочечников является идиопатическая атрофия коры надпочечников, обусловленная аутоиммунным процессом. Однако это состояние развивается при заболеваниях надпочечников (туберкулез), после двусторонней адреналэктомии по поводу болезни Кушинга, подавления функции надпочечников после длительной терапии стероидами и др. Вторичная надпочечниковая недостаточность обусловлена патологией, которая возникает в результате любой из причин гипопитуитаризма. Симптомы недостаточности надпочечников вызваны дефицитом как кортизона так и альдостерона. Недостаточность кортизола проявляется в форме: • гиперпигментации кожи обусловленной повышенным содержанием мелано- цитостимулирующего гормона (сопровождает гиперсекрецию АКТГ, вызванную дефицитом кортизола). Гиперпигментация наиболее заметна на слизистых оболочках, открытых участках складках и рубцах кожи. При вторичной недостаточности надпочечников (патология гипофиза) уровень АКТГ чаще понижен, и гиперпигментация отсутствует, • гипотонии, часто ортостатической , вызванной отсутствием прессорного эф- фекта кортизола на тонус сосудов и снижением сердечного выброса, • желудочно-кишечных симптомов: анорексии, тошноты, рвоты и похудания, • гипогликемии, связанной с уменьшением кортизол-индуцированного глюко- неогенеза, • психических симптомов - летаргии, спутанности сознания, депрессии, иногда возникают психозы. • непереносимости стрессов - у больных, не способных увеличивать выброс кортизола в ответ на тяжёлый стресс, есть риск быстрого прогрессирования перечисленных симптомов до угрожающего жизни сосудистого коллапса. Составляющая аддиссоновой болезни, обусловленная дефицитом альдостерона проявляется в виде • гиповлолемии, сниженного сердечного выброса и сниженного кровотока в почках, азотемии, слабости, гипотензии и похудания, связанных с потерей натрия, обусловленной снижением регулируемой альдостероном реабсорбции натрия в дистальных почечных канальцах. • нарушений сердечного ритма и гиперкалиемии • адреналовоно криза (аддисонова криза) — острого, угрожающего жизни, осложнения аддисоновой болезни, при котором резко выражены проявления надпочечниковой недостаточности. Проявляется в форме лихорадки, рвоты, болей в животе, изменении психического статуса и сосудистого коллапса. Первичный альдостеронизм – болезнь Кона Обычная причина избыточного образования альдостерона надпочечниками одиночная малая аденома надпочечников (0,5-3 см). Реже (20-40% случаев) наблюдается двусторонняя гиперплазия коры надпочечников. Альдостерон увеличивает реабсорбцию натрия и экскрецию калия и ионов водорода в дистальных почечных канальцах. Задержка натрия, вызывающая повышение артериального давления — главное клиническое проявление данного синдрома. Количество задерживаемого натрия и воды ограничивают компенсаторные механизмы, способствующие экскреции натрия почками в ответ на увеличение объёма внеклеточной жидкости; баланс натрия восстанавливается после накопления 1-2 л жидкости. Хотя подобное увеличение объёма не вызывает отёков, длительное повышение сердечного выброса и, возможно, другие эффекты избытка минералокортикоидов приводят к гипертензии. Потеря калия вызывает гипокалиемию, мышечную слабость, парестезии и тетанию Потери почками калия и водорода приводят метаболическому алкалозу. Гормоны мозгового слоя надпочечников образуются из тирозина Почти каждый день приходится решать проблему «борьбы или бегства» и важнейшими факторами, обеспечивающими это решение, являются адреналин, норадреналин и дофамин –три соединения объединенные общим названием катехоламины, которые синтезируются и запасаются хромаффинными клетками мозгового слоя надпочечников. Рис.11.24.Реакции синтеза катехоламинов. Мозговой слой надпочечников является частью вегетативной нервной системы, который представляет своеобразный ганглий, клетки которого синтезируют нейромедиаторы, обладающие дистантным действием. Основная задача этих гормонов - мобилизация энергетически важных субстратов для работы мышечных клеток (жирные кислоты), мозга (глюкоза) и снижение потребления глюкозы другими тканями, где их функции противостоят функциям инсулина. Катехоламины выполняют свои функции совместно с другими молекулами регуляторами, среди которых можно назвать глюкокортикоиды, глюкагон, вазопрессин и др. Основные этапы синтеза катехоламинов представлены на рис.11.24. Они синтезируются из тирозина и его превращение в адреналин включает четыре последовательных этапа: 1) гидроксилирование кольца, 2)декарбоксилирование, 3) гидроксилирование боковой цепи и 4) N-метилирование. Ключевым и лимитирующим скорость всего процесса биосинтеза катехоламинов является фермент тирозингидроксилаза. Кофактором этого фермента служит тетрагидробио- птерин. Тирозингидроксилаза катализирует превращение L-тирозина в L-дигидроксифенилаланин (L-ДОФА). Фермент служит объектом действия ряда регуляторов, среди которых, прежде всего, следует назвать сами катехоламины, которые по принципу обратной связи конкурируют с ферментом за птеридиновый кофактор, образуя с ним шиффово основание. Ряд производных тирозина (например метилтирозин, фенилаланин ) являются изостерическими регуляторами этого фермента. Соединения образующие комплексы с железом также подавляют активность тирозингидроксилазы. Вторая реакция на пути образования – декарбоксилирование ДОФА. Она катализируется декарбоксилазой ДОФА- пиридоксальфосфат зависимым ферментом. Этот фермент встречается практически во всех тканях. L-ДОФА превращается в 3,4-дигидроксифенилэтиламин (дофамин). Соединения, напоминающими по структуре L-ДОФА, (например α-метил-ДОФА) являются конкурентными ингибиторами этого фермента и нашли широкое употребление в лечении некоторых форм гипертонии. При болезни Паркинсона нарушается образование дофамина в мозге и ДОФА, который легко проникает гематоэнцефалический барьер используется в лечении этого заболевания. Норадреналин образуется из дофамина путем гидроксилирования медьсодержащим ферментом дофамин-b-гидроксилазой (ДБГ). Донором электронов в этой реакции служит аскорбиновая кислота Эта реакция проходит в секреторных гранулах клеток мозгового слоя надпочечников. Фермент высвобождается из клеток мозгового слоя надпочечников и нервных окончаний вместе с норадреналином, но (в отличие от последнего) не подвергается обратному захвату нервными окончаниями. Растворимый фермент фенилэтаноламин — N-метилтрансфераза (ФNMT) катализирует четвертую реакцию на пути образования адреналина. Этот фермент находится исключительно в адреналин-продуцирующих клетках мозгового слоя надпочечников. Донором метильной группы в этой реакции служит S-аденозилметионин. Эта реакция протекает вне гранул, в цитозоле. Количество ФNMT в клетках стимулируется глюкокортикоидами, проникающими в мозговой слой по внутринадпочечниковой портальной системе. Благодаря этой системе обеспечивается высокая концентрация ( в 100 раз больше чем в артериальной крови) стероидов в мозговом слое, что, по-видимому, необходимо для индукции синтеза ФNMT. После гипофизэктомии концентрация глюкокортикоидов в портальной крови падает и синтез адреналина уменьшается. Период полураспада катехоламинов составляет 1- 2 минуты. Инактивация катехоламинов происходит с участием двух ферментных систем: катехол-О-метилтрансферазы (КОМТ) и моноаминоксидазы (МАО). КОМТ является внутриклеточным ферментом, который локализуется в цитозоле. Около 50% КОМТ находится в синаптосомах центральной и периферической нервной системы, а остальная часть (50-55%) приходится на другие органы – печень, почку, кишечник, селезенку, слюнные железы, аорту, матку, жировую ткань, эритроциты.. Он катализирует присоединение метильной группы обычно по третьему положению (мета-положение) бензольного кольца различных катехоламинов. Реакция требует присутствия двухвалентного катиона и S-аденозилметионина в качестве донора метильной группы. В результате этой реакции в зависимости от использованного субстрата образуются гомованилиновая кислота (дофамин), норметанефрин (норадреналин) и метанефрин (адреналин). Моноаминоксидаза катализирует дезаминирование моноаминов. Она широко распространена в тканях организма (печень, почки, желудок, кишечник, нервная ткань, головной мозг, сердце, половые железы, надпочечники, тромбоциты). Рис.11.25.Основные продукты распада адреналина и норадреналина. В мозговом веществе надпочечников большая часть МАО располагается в митохондриях и лишь незначительное ее количество выявляется в гранулах хромаффинных клеток. Описаны, по крайней мере, два изофермента МАО: МАО-А нервной ткани, дезаминирующая серотонин, адреналин и норадреналин, и МАО-В других (не нервных) тканей, наиболее активная в отношении 2-фенилэтиламина и бензиламина. Дофамин и тирамин метаболизируются обеими формами. Ингибиторы МАО нашли применение при лечении гипертонии и депрессии, однако способность этих соединений вступать в опасные для организма реакции с содержащимися в пище и лекарственных препаратах симпатомиметическими аминами снижает их ценность. Продукты метаболизма катехоламинов образуют конъюгаты с глюкуроновой или серной кислотой. Определение количества продуктов метаболизма катехоламинов используется в диагностике, поскольку присутствуют в моче в больших количествах. Широкое распространение получили исследования уровня метанефринов и З-метокси-4-гидроксиминдальной кислоты ( ванилилминдальной кислоты, ВМК). При феохромоцитоме концентрация метанефринов или ВМК в моче повышена более чем у 95% больных. Диагностические тесты, основанные на определении этих соединений точны, особенно при использовании в сочетании с определением катехоламинов в моче или плазме. Феохромоцитомы – опухоли, ведущие к гипертензии Феохромоцитомы - опухоли, состоящие из хромаффинных клеток. Она обнаруживается у 0,5% всех больных с тяжелой гипертензией и у 0,05% с гипертензией, может носить семейный характер. . При феохромоцитоме часто бывает повышено отношение норадрена- лин: адреналин. Возможно, именно этим и можно объяснить различия в клинических проявлениях, поскольку норадреналину приписывают основную роль в патогенезе гипертонии, а адреналин считают ответственным за гиперметаболизм. Наиболее информативными показателями являются повышение выделения продуктов метаболизма катехоламинов. ГОРМОНЫ ПОЛОВЫХ ЖЕЛЕЗ Данные современной генетики и экспериментальной эмбриологии показывают, что у большинства видов млекопитающих, различия между мужчиной и женщиной зависят прежде всего от одной хромосомы (Y хромосома) и пары эндокринных структур, яичек (семенников) у мужчин и яичников у женщин. Дифференцировка примитивных половых желез в яички или яичники у плода - генетически детерминирована у людей, но формирование внешних мужских признаков и «мужского» поведения определяется функционально активными секретирующими яичками, в их отсутствии развитие происходит по женскому типу. Показано, что мужское сексуальное поведение и, у некоторых видов, мужской тип секреции гонадотропинов связан с действием мужских гормонов на мозг на ранних этапах развития. После рождения половые железы остаются функционально мало активными до юности, когда они активируются гонадотропинами передней доли гипофиза. Гормоны, секретируемые половыми железами в это время вызывают появление особенностей, типичных для взрослого мужчины или женщины и начала полового цикла у женщин. У женщин функция яичников регрессирует после определенного числа лет и половые циклы прекращаются (менопауза). У мужчин с увеличением возраста происходит медленное снижение функциональной активности гонад, но способность к зачатию сохраняется. Роль половых желез характеризуется рядом особенностей, которые отличают их от других желез внутренней секреции: • Половые железы — бифункциональные органы. В них формируются зароды- шевые клетки и секретируются половые гормоны. Эти функции обеспечивают размножение и следовательно, выживание видов. • В функциональной активности половых желез важную роль играет временной фактор. Это касается прежде всего связи уровня секреции половых гормонов с возрастом. Изменения секреции половых гормонов оказывают существенное влияние на интенсивность метаболических процессов и лежат в основе механизмов старения. Знание особенностей механизмов циклической секреции половых гормонов у женщин важно при разработке новых подходов к контрацепции. Клетки Лейдига –основное место синтеза андрогенов Рис.11.26.Основные этапы синтеза тестостерона Тестостерон, основной мужской половой гормон, является C19 стероидом содержащим ОH группу в 17 положении . Он синтезируется из холестерола клетка ми Лейдига в яичках, и также может синтезироваться из андростендиона, секретируемого корой надпочечников Биосинтетические пути во всех эндокринных органах, которые синтезируют стероидные гормоны, довольно схожи и различаются только системами ферментов, обеспечивающими синтез. Белки плазмы обеспечивают транспорт гормонов к органам мишеням Таблица 11.12. Распределение стероидных гормонов в плазме (в%.) Стероид СвободСвязан с ный CBG GBG Альбумин Тестостерон 2 0 65 33 Андростендион 7 0 8 85 Эстрадиол 2 0 38 60 Прогестерон 2 18 0 80 Кортизол 4 90 0 6 1 CBG, глобулин, связывающий кортикостероиды; GBG, глобулин, связывающий половые гормоны Тестостерон, подобно другим стероидным гормонам, плохо растворяется в воде, поэтому около 98% тестостерона в крови связана с белками (см табл. 11.12).Около 65% тестостерона переносится специфическим транспортным белком из класса бета глобулинов – белок- связывающий половые гормоны (GBG -gonadal steroid-binding globulin) и 33% связывается альбумином плазмы. Тестостерон действует через внутриклеточные рецепторы Физиологические эффекты мужских половых гормонов хорошо известны. Помимо указанных выше влияний на дифференцировку тканей, развитие вторичных половых структур, тестостерон и ДГТ участвуют в процессах сперматогенеза, оказывают выраженное анаболическое действие, усиливая процессы синтеза белков, что выражается в увеличении мышечной массы, росте костей, способствуют задержке натрия, калия, воды, кальция, сульфата и фосфата, обеспечивают увеличение размера почек. Правда, попытки получить синтетические стероиды, в которых анаболический эффект отделен от маскулинизирующего действия и повышения либидо, пока оказались безуспешными. Широкий спектр изменений, вызываемых андрогенами, затрудняет точное определение клеток мишеней для этих гормонов. К классическим клеткам-мишеням ДГТ, имеющим наиболее высокую активность 5а-редуктазы, относятся предстательная железа, семенные пузырьки, наружные половые органы и кожа половых органов. Мишенями для тестостерона являются эмбриональные вольфовы структуры, сперматогонии, мышцы, кости, почки и мозг. Как и другие стероидные гормоны, тестостерон и ДГТ связываются с внутриклеточными рецепторами, и образующийся комплекс гормон - рецептор затем взаимодействует с ДНК в ядре, способствуя транскрипции различных генов. Рис.11.27. Механизм действия и эффекты мужских половых органов. Комплексы рецептор- тестостерон менее устойчивы в сравнениями с комплексами ДГТ - рецептор в клетках- мишенях, и они обладают более низким сродством к участкам ДНК. Таким образом, формирование ДГТ - путь усиления действия тестостерона в тканях мишенях Комплексы рецептор-тестостерон ответственны за формирование мужских внутренних половых органов в течении развития, а комплексы ДГТ – рецептор необходимы для формирования внешних мужских половых органов. С действием последних связано увеличение предстательной железы и вероятно полового члена во время половой зрелости, а также распределения волосяного покрова по мужскому типу. Однако, увеличение мышечной массы, рост костей и особенности мужского поведения и либидо зависит в большей мере от тестостерона чем от ДГТ. Таким образом, андрогены (тестостерон и ДГТ) обеспечивают • Регуляцию генератора пульсаций гонадолиберина - эффекты могут быть прямыми и косвенными. Предполагается, что в этом механизме конечным исполнительным элементом является эстрадиол. Для этого необходимо локальное преобразование тестостерона в эстрадиол. • Механизмы сперматогенеза. Сперматогенез требует адекватного уровня те- стостерона. Внутритестикулярная концентрации тестостерона намного выше чем, в кровообращении (приблизительно в 100 раз) • Проявления мужского поведения. Правда, непосредственным исполнителем этих свойств могут быть эстрадиол или дигидротестостерон, поскольку оба эти гормона оказывают влияние на поведение и образуются локально в пределах дискретных областей мозга из тестостерона. • Функции мужских дополнительных половых желез и придатка яичка. Кроме того у тестостерона обнаружен ряд эффектов не связанных прямо с репродуктивной функцией, однако необходимых для нормального протекания процессов жизнедеятельности. Ниже перечислены ткани, метаболизм которых во многом регулируется с участием тестостерона. • Иммунная система • Костная ткань • Мышечная система Эти эффекты важны по нескольким причинам. Во-первых, уровень тестостерона снижается при старении. Во вторых, эти эффекты проявляются при попытках создать и использовать мужские противозачаточные средства, основанные на блокаде секреции тестостерона. В-третьих, при некоторых заболеваниях при длительном постельном режиме секреция тестостерона уменьшается и, наконец, может пока это не столь важно, но при длительном пребывании в космическом полете показано, что секреция тестостерона у животных и людей снижается. Конечный эффект тестостерона определяется его концентрацией, которая тщательно регулируется. Регуляторы образования тестостерона у эмбриона до 6-недельного возраста неизвестны, а начиная с 6-той недели основным регулятором становится хорионический гонадотропин, который является ведущим до середины беременности, после чего основная регуляция образования и секреции тестостерона становится функцией системы гипоталамус-гипофиз. Сам тестостерон в то же время является сигнальной молекулой, регулирующей образование и секрецию гонадолиберинов и ЛГ. На образование ФСГ- другого гонадотропного гормона гипофиза, тестостерон не оказывает влияния. Повышенный уровень ФСГ обнаружили у больных с атрофией семенных канальцев, но с нормальными уровнями ЛГ и тестостерона. Свойства участников и механизмы регуляции подробно описаны в разделе посвященном гормонам гипофиза. Современная " рабочая гипотеза " пути, которым регулируются функции яичек, показаны на рис. 11.28. Кастрация сопровождается повышением содержания в гипофизе и секреции ФСГ и ЛГ, а повреждение гипоталамуса предотвращают это повышение. . Тестостерон ингибирует секрецию ЛГ, действуя непосредственно на переднюю долю гипофиза и ингибируя секрецию гонадолиберина гипоталамусом. Ингибин действует непосредственно на переднюю долю гипофиза, ингибируя секрецию ФСГ. Рис.11.28. Схема регуляции секреции тестостерона В ответ на ЛГ, часть тестостерона, секретируемого клетками Лейдига омывает эпителий семенных канальцев и обеспечивает высокую локальную концентрацию андрогенов клеткам Сертоли, которая необходима для нормального сперматогенеза. Вводимый извне тестостерон не обеспечивает повышение уровня андрогенов в яичках до требуемых высоких концентраций, но ингибирует секрецию ЛГ. Следовательно, результирующим эффектом вводимого извне тестостерона в целом является уменьшение числа сперматозоидов. Лечение тестостероном было предложено, как средство мужской контрацепции. Однако, дозы тестостерона, необходимые для подавления сперматогенеза, вызывают задержку натрия и воды в организме. В настоящее время исследуется возможность использование ингибинов, как мужских противозачаточных средств. Недостаточность мужских половых гормонов может проявляться по разному Клиническая картина мужского гипогонадизма зависит от времени развития недостаточности яичек. Если недостаточность яичек наступает после полового созревания - вследствие их заболеваний, уровень циркулирующих гонадотропинов повышен (гипергонадотроный гипогонадизм), если она связана с нарушением функций гипофиза или гипоталамуса, уровень циркулирующих гонадотропинов понижен (гипогонадотропный гипогонадизм). При этом , вторичные половые признаки изменяются медленно, потому что для поддержания их функций требуется очень небольшое количество андрогенов. Рост гортани в течение юности постоянен и голос остается грубым. Люди, кастрированные во взрослом со- стоянии, имеют некоторую потерю либидо. Они более раздражительны, пассивны и заторможены. Недостаточность клеток Лейдига до наступления полового созревания проявляется в форме евнухоидизма. Для таких людей в возрасте свыше 20 лет характерен высокий рост, хотя и не достигающий значений роста людей с гиперфункцией гипофиза. Это связано с тем, что их эпифизы остаются открытыми и рост продолжается после наступления нормального возраста половой зрелости. У них узкие плечи и плохо развита мышечная система, конфигурация тела подобна таковой взрослой женщины. Недоразвиты гениталии и сохраняется высокий голос. "Гиперфункция" яичек в отсутствии формирования опухоли - не установлена. Андрогенсекретирующие опухоли клеток Лейдига редки и проявляются обнаруживаемыми эндокринными признаками только у препубертатных мальчиков, в форме развития рано развившейся псевдополовой зрелости. Яичники –источник женских половых гормонов и половых клеток Яичники выполняют две важнейшие функции: • Образование женских половых гормонов (эстрогенов и прогестинов) • Образование женских половых клеток (яйцеклеток) Эстрогены образуются их андрогенов По известной легенде ребро Адама послужило основным «субстратом» для создания Евы. Молекулярной аналогией этой легенды является механизм синтеза женских половых гормонов: эстрогены образуются путем ароматизации андрогенов. Природные эстрогены 17β −эстрадиол, эстрон и эстриол секретируются клетками зернистого слоя овариальных фолликулов, желтым телом и плацентой. Клетки стромы яичника также обладают способностью синтезировать андрогены и эстрогены, однако количество синтезируемых ими гормонов невелико. Значительная часть эстрогенов образуется путем ароматизации андрогенов периферическими тканями. У женщин важным источником эстрогенов служат андрогены, синтезируемые надпочечниками: до 50% Е2 во время беременности образуется в результате ароматизации ДГЭА-сульфата, а превращение андростендиона в эстрон служит главным источником эстрогенов в постменопаузе. Ароматазная активность обнаружена в адипоцитах, печени, коже и других тканях. Повышенная активность этого фермента, по-видимому, играет важную роль в «эстрогенизации», наблюдаемой при таких состояниях, как цирроз печени, гипертиреоз, старение и ожирение. Лишь два процента эстрогенов в крови находится в свободном, не связанном с белками состоянии. Около 60 % эстрадиола транспортируется альбумином плазмы и 38 % - связы- вающим половые стероиды глобулином, который переносит и тестостерон. Эстрадиол находится в крови в равновесии с эстроном. В печени, которая выполняет основную роль по катаболизму стероидных гормонов, эстрадиол и эстрон могут превращаться в эстриол, наименее активную форму эстрогенов и образуя коньюгаты с глюкуроновой (УДФ-глюкуроновая кислота) или серной (ФАФС) кислотами, наряду с другими метаболитами, выделяются почками. Значительные количества конъюгатов секретируются в составе желчи и могут повторно реабсорбируются в кровь (энтерогепатическая циркуляция). . Основной источник прогестерона – желтое тело Прогестерон - C21 стероид секретируется желтым телом, плацентой и (в небольших количествах) фолликулами яичника. Он является важным промежуточным звеном в биосинтезе стероидов во всех тканях, которые секретируют стероидные гормоны, и его небольшие количества очевидно поступают в кровообращение из коры надпочечников. 17α−гидроксипрогестерон секретируется наряду с эстрогенами овариального фолликула и его секреция параллельна секреции 17β-эстрадиола. Приблизительно 2 % циркулирующего прогестерона находится в свободной форме, 80 % связаны с альбуминами и 18 % с глобулином, связывающим кортикостероиды. Прогестерон имеет короткий период полураспада и превращается в печени к прегнандиол, который в форме коньюгата с глюкуроновой кислотой выделяется почками Прегнандиол-20-глюкуронид натрия — основной метаболит прогестинов, обнаруженный в моче человека . Некоторые синтетические стероиды, например 17α-гидроксипрогестерон и 17α-алкилзамещенные соединения 19-нортестостерона, обладают активностью прогестинов и при этом не подвергаются в печени никаким превращениям. Поэтому они широко используются в качестве пероральных контрацептивов. Количество синтезируемых гормонов зависит от возраста и фазы менструального цикла Уровень половых гормонов у девочек до полового созревания низкий, хотя способность повышать синтез этих гормонов в ответ на экзогенно вводимые гонадолиберины у них сохранена. Принято считать, что гипоталамо-гипофизарная система по мере роста и развития постепенно утрачивает чувствительность к ингибирующему действию половых гормонов на образование гонадолиберинов. В период полового созревания происходит значительное изменение характера секреции гонадолиберинов и выброс ЛГ резко увеличивает синтез гормонов яичниками. Желтое тело после оплодотворения – железа внутренней секреции У всех млекопитающих желтое тело яичника после оплодотворения не регрессирует, а увеличивается в ответ на стимуляцию гонадотропинами, секретируемыми плацентой. Плацентарный гонадотропин у людей называется человеческим хорионическим гонадотропином (ХГЧ). Увеличенное желтое тело- тело беременности секретирует эстрогены, прогестерон и релаксин. Релаксин поддерживает беременность, ингибируя сокращения миометрия. У большинства видов животных, удаление яичников на любом этапе беременности вызывает аборт. У людей плацента после 6-й недели беременности производит достаточное количество эстрогенов и прогестерона, чтобы компенсировать потерю функции желтого тела. Поэтому овариэктомия до шестой недели может остановить развитие плода, но овариэктомия в более поздние сроки не оказывает эффекта на беременность. Функция желтого тела, хотя и начинает снижаться после 8 недель, но сохраняется до конца беременности. Секреция ХГЧ снижается после начального повышения, а секреция эстрогенов и прогестерона увеличивается непосредственно перед родами. Плацента секретирует свой гормон роста. Синтициотрофобласт секретирует также большие количества белкового гормона, который является лактогенным и имеет малую рост - стимулирующую активность. Этот гормон назван хорионическим гормоном роста - пролактином (ХРП) и человеческим плацентарным лактогеном (ПЛ), но теперь его называют человеческим хорионическим соматомаммотропином (ЧХС). Состав и последовательность аминокислот ХЧС подобны гормону роста человека, и возможно, что эти два гормона и пролактин, произошли от общего гормона предшественника. В крови матери уровень ХЧС довольно высокий и низкий в крови плода. Секреция гормона роста гипофизом матери не увеличивается в течение беременности и потребность в этом гормоне компенсируется. ХЧС, который рассматривается как " материнский гормон роста беременности ".Под его влиянием происходит накопление азота, калия и кальция, стимуляция расщепления липидов и снижение потребления глюкозы, отмечаемое при беременности. Эти эффекты гормона направлены на улучшение обеспечения плода глюкозой. Количество секретируемого ХЧС пропорционально размеру плаценты, которая обычно весит одну шестую от веса плода, и низкие ХЧС уровни - признак плацентарной недостаточности. Фетоплацентарная единица –кооперация в синтезе стероидных гормонов Плод и плацента обмениваются субстратами при формировании стероидных гормонов. В клетках плаценты происходит синтез прегненолона и прогестерона из холестерола. Часть прогестерона поступает в кровообращение плода и используется в качестве субстрата в синтезе кортизола и кортикостерона надпочечниками плода (Рис.12-79). Некоторое количество прегненолона также поступают в кровь плода и, и служит дополнением к прегененолону, синтезируемому в печени плода для синтеза дегидроэпиандростерон сульфата (ДГЭАС) и 16-гидроксидегидроэпиандростерон сульфата (16- гидрокси ДГЭАС) надпочечниками плода. Резкое снижение уровня эстрогенов инициирует лактацию после родов В течении беременности молочные железы постепенно увеличиваются. Небольшое количество молоко может секретироваться в протоки уже на пятый месяц беременности и у большинстве животных молоко начинает секретироваться в больших количествах в пределах первого часа после родов, но у женщин на это уходит 1-3 суток. После изгнания плаценты резко снижается уровень эстрогенов и прогестерона в крови. Это является основным сигналом для инициации лактации. Пролактин и эстрогены синергисты в действии на рост молочной железы, но эстрогены являются ингибиторами секреции молока, что позволяет их использовать тем, кто не желают кормить грудью своих младенцев. Кормление грудью индуцирует секрецию пролактина и окситоцина гипофизом. Окситоцин стимулирует сокращение миоэпителиальных клеток, окружающих альвеолярные протоки, способствуя таким образом выбросу молока из железы, пролактин поддерживает и увеличивает секрецию молока. Гинекомастия – развитие молочных желез у мужчин Развитие грудных желез у мужчин называют гинекомастией. Она может быть односторонней, но чаще двусторонняя и встречается у почти 75 % новорожденных из-за трансплацентарного переноса эстрогенов матери, наблюдается в умеренной, переходной форме у 70 % нормальных мальчиков во время полового созревания и у многих мужчин после 50 лет . Причиной гинекомастии может быть резистентность к андрогенам, осложнения при лечении эстрогенами и развитие эстрогенсинтезирующих опухолей. Гинекомастия описана при целом ряде несвязанных между собой состояний- евнухоидизме, гипертиреозе и циррозе печени. Применение препаратов наперстянки может вызвать это состояние из-за эстрогенной активности сердечных гликозидов. Особенностью, обнаруженной практически во всех случаях гинекомастии, является увеличение отношения эстрогенов к андрогенам в плазме или из-за увеличения уровня эстрогенов или снижения уровня андрогенов. Менопауза – результат снижения активности яичников. С возрастом яичники становятся устойчивыми к гонадотропинам и их функция снижается. Число фолликулов в яичниках постепенно уменьшается и прекращается в связи с этим секреция прогестерона и 17β – эстрадиола. Эстрогены образуются в небольших количествах ароматизацией андростендиона в крови. Матка и влагалище постепенно атрофируются. Снижение уровня гормонов яичников стимулирует секрецию ФСГ и ЛГ и их уровень в плазме достигает высоких значений. У женщин эти явления начинают проявляться в возрасте между 45 и 55 годами. Средний возраст начала менопаузы увеличился с начала ХХ столетия и в настоящее время составляет 52 года. Эстрогены регулируют синтез белков Подобно другим стероидам эстрогены, проникая в клетку, взаимодействуют с внутриклеточным рецептором Комплекс гормон-рецептор затем связывается со специфической нуклеотидной последовательностью на ДНК и регулирует синтез иРНК. Бесплодие – одна из важных медицинских проблем. Раскрытие причины бесплодия у каждой семьи, обратившейся за медицинской помощью требует порой обширных клинических исследований. В 30 % случаев проблемы связаны с мужчиной, в 45 %, - с женщиной, в 20 % - с обоими партнерами, и в 5 % отыскать такие причины практически невозможно. Оплодотворение in vitro, при котором зрелая яйцеклетка оплодотворяется сперматозоидами в пробирке с последующим внедрением нескольких клеток на четырехклеточной стадии развития в матку позволяет с вероятностью 5-10 % добиться успешного родоразрешения и поэтому может быть способом решения проблемы бесплодия в некоторых из этих случаев. ГОРМОНЫ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА. За завтраком или обедом большинство людей вряд ли задумываются о том огромном количестве задач, которые должна решить их пищеварительная система по перевариванию, всасыванию и усвоению поступающих питательных веществ. Полноценное решение этих проблем невозможно без координации процессов пищеварения в разных отделах желудочнокишечного тракта, которая обеспечивается нервной и эндокринной системами. В эндокринном контроле функции пищеварения участвует большая группа гормонов, нейропептидов и нейромедиаторов. Сразу следует заметить, что большинство этих регуляторов синтезируются клетками гастроэнтеропанкреатической (ГЭП) системы - своеобразной железы внутренней секреции желудочно- кишечного тракта. Однако весь набор регуляторов, синтезируемых ГЭП системой секретируется также и нейронами мозга, хотя значение этого синтеза остается пока мало понятным. Организация эндокринной системы желудочно-кишечного тракта отличается рядом особенностей Рис.11.29.Локализация синтеза гормонов желудочно-кишечного тракта Огромная протяженность желудочно-кишечного тракта и разнообразие органов, участвующих в переваривании и усвоении продуктов питания создает определенные сложности в регуляции процессов пищеварения, а регуляторам придает свойства, отличающие их от общепринятого понятия гормона. В секреции гормонов ЖКТ важным элементом является временная составляющая – не все гормоны секретируются одновременно, их секреция тесно увязывается во времени с фазами пищеварения (рис. 12-84) Таблица 11.12. Роль отдельных гормонов ЖКТ и стимуляторы их секреции. Стимулирует секрецию соляной кислоты и Пептиды и аминокислоты в пролиферацию желудочного эпителия просвете желудка Холецистокинин Стимулирует секрецию панкреатических Жирные кислот и аминокисферментов, сокращение и эвакуацию солоты в тонкой кишке держимого желчного пузыря Секретин Стимулирует секрецию воды и бикарбона- Низкие значения pH в прота поджелудочной железой и желчными свете тонкой кишки протоками Мотилин Регулирует перистальтику желудка и тонГолодное состояние кого кишечника Желудочный Ингибирует желудочную секрецию и пери- Липиды и глюкоза в тонкой ингибиторгый стальтику, потенцирует выделение инсули- кишке пептид на В клетками в ответ на увеличение концентрации глюкозы крови Гастрин Семейство гастрина регулирует первые этапы пищеварения. Гастрин синтезируется клетками названными G клетки (гастринсинтезирующие клетки), которые расположены в пилорических и кардиальных железах тела и дна желудка. Гастрин типичный пептидный гормон и, как многие гормоны этой природы, проявляет макро и микрогетерогенность. Макрогетерогенность связана с присутствием в тканях и жидкостях организма пептидных цепей гастрина различной длины, микрогетерогенность обусловлена химической модификацией отдельных остатков аминокислот в структуре гастрина. Препрогастрин подвергается протеолитическому процессингу с образованием фрагментов различных размеров. Чрезмерная секреция гастрина, или гипергастринемия, является причиной тяжелой болезни известной как синдром Цоллингера-Эллисона, который встречается у людей и собак. Основное проявление этой болезни – образование язв желудка и12 перстной кишки вследствие чрезмерной и нерегулируемой секреции соляной кислоты. Наиболее часто гипергастринемия - результат секретирующих гастрин опухолей (гастриномы), которые развиваются в поджелудочной железе или двенадцатиперстной кишке. Эстафету регуляции у гастрина забирает другой член гастринового семейства холецистокинин (ХЦК). Ранее считалось, что один гормон, названный холецистокинином регулирует сокращение желчного пузыря, а отдельный гормон, называемый панкреозимином увеличивает секрецию панкреатического сока, богатого ферментами. Оказалось, что этими действиями обладает один гормон, который назвали холецистокинин-панкреозимин (ХЦК-ПЗ) или холецистокинин (ХЦК). Он играет ключевую роль в ускорении переваривания в тонком кишечнике. ХЦК секретируется эпителиоцитами 12 перстной кишки и стимулирует выделение в тонкую кишку пищеварительных ферментов поджелудочной железой и желчи желчным пузырем. Холецистокинин широко распространен в мозгу. Холецистокинин – ведущий регулятор высвобождения панкреатических ферментов и желчи в тонкую кишку. В свою очередь стимулятором секреции холецистокинина –является появление частично переваренных жиров и белки в просвете двенадцатиперстной кишки. Холецистокинин способствует: • Выделению пищеварительных ферментов из поджелудочной железы в двена- дцатиперстную кишку. • кишку. Сокращению желчного пузыря и выделению желчи в двенадцатиперстную Панкреатические ферменты и желчь обеспечивают переваривание и всасывание молекул, которые стимулировали секрецию холецистокинина. Таким образом, когда всасывание завершилось, секреция холецистокинина также прекращается. Введение холецистокинина в желудочки мозга стимулирует появление чувства насыщения у лабораторных животных. Показано, что нарушения синтеза ХЦК или его рецепторов в мозге могут быть частью патогенеза некоторых типов нарушений психики. Секретин - первый гормон в истории эндокринологии Секретин занимает уникальное положение в истории эндокринологии. В 1902 году Бэйлисс и Старлинг впервые показали, что при введении соляной кислоты в тонкую кишку экспериментальным животным происходило увеличение секреции жидкости поджелудочной железой. Экстракт слизистой кишечника вводимый внутривенно вызывал такой же эффект. Вещество, которое выделялось слизистой кишечника и активировало секрецию сока поджелудочной железы получило название секретина, а для обозначения химических агентов, которые секретируются клетками и, попадая в кровообращение, действуют на отдаленные органы Старлингом было введено понятие гормон. Современная эндокринология - доказательство правильности этой гипотезы. Секретин секретируется S клетками, которые расположены в железах слизистой верхней части тонкого кишечника. Структура секретина значительно отличается от таковой у членов семейства гастрина, но подобна структуре целого ряда других биологически активных пептидов, выделяемых кишечником (гюкагон, ВИП и ГИП). В отличие от гастрина выделена только одна активная форма секретина, состоящая из 27 аминокислотных остатков. Инкретины –гормоны стимулирующие секрецию инсулина. ГИП (глюкозозависимый инсулинотропный пептид) и GLP (глюкагон подобные пептиды) были идентифицированы как инкретины : гормоны, которые стимулируют секрецию инсулина. Они синтезируются и депонируются эндокринными клетками кишечника. ГИП – полипептид, состоящий из 42 аминокислот Вазоактивный интестинальный полипептид член семейства секретина Вазоактивный интестинальный полипептид (ВИП) — это основной 28-членный пептид, образующийся в нейронах подслизистого сплетения, миоэнтерального сплетения в форме препроВИПа, в состав которого входит сам ВИП и подобный ВИПу пептид (PHM-27 у людей, PHI-27 у других видов).Время полураспада в крови около 2 минут. Он оказывает выраженное стимулирующее действие на секрецию кишечником воды и солей, вызывает расслабление гладких мышц кишечника; расширение периферических кровеносных сосудов и ингибирует секрецию кислоты в желудке. ВИП обнаружен в мозгу и многих вегетативных нервах , где он часто соседствует с ацетилхолином, усиливая действие последнего в некото- рых тканях (слюнных железы). Опухоли секретирующие ВИП (ВИПомы) сопровождаются тяжелой диареей, гипокалиемией и ахлоргидрией.. Таблица 11.13. Место образования и роль гормонов ЖКТ Пептиды Сокращ. обозн. Источник Изменения во время еды Действие Соматостатин СТ Все части ЖКТ Нет в крови паракринное; ингибирующее Гастрин высвобождающий пептид GRP Нейроны в стенке желудка В норме нет в крови; нейромедиатор "животный бомбезин", стимулирует образование гастрина Вазоактивный интестинальный пептид ВИП Нейроны стенки ЖКТ В норме нет в крови; нейромедиатор Увеличивает ток крови, секрецию бикарбонатно-солевого раствора, расслабляет сфинктеры Панкреатический полипептид ПП Бокаловидные клетки ацинусов поджелудочной железы Уровень в крови заметно растет после еды Ингибитор секреции ферментов, бикарбоната и солей Пептид YY ПYY Эндокринные клетки кишечника Уровень в крови заметно растет после еды; липиды и глюкоза Ингибитор секреции кислоты, пепсиногена, бикарбонатов. Тормозит перистальтику Мотилин не входит ни в семейство гастрина ни в семейство секретина Мотилин – 22 аминокислотный пептид, секретируемый эндокриноцитами (ЕС-клетки) слизистой оболочки проксимальной тонкой кишки. Основываясь на данных последовательности аминокислоты, мотилин не похож на другие гормоны. Мотилин участвует в регуляции характера сокращений гладкой мышцы в верхнем желудочно-кишечном тракте. Есть два основных состояния подвижности желудка и тонкой кишки: состояние при котором пищевые продукты присутствуют и состояние между приемами пищи. Мотилин секретируется в кровообращение в голодном состояния с интервалами около 100 минут. Эти взрывы секреции мотилина по времени связаны с началом «вспомогательных сокращений», которые очищают желудок и тонкую кишку, от непереваренного материала (также называемые мигрирующим моторным комплексом). Регуляция секреции мотилина в значительной степени неизвестна, хотя некоторые исследования предполагают, что щелочной pH в двенадцатиперстной кишке стимулирует его высвобождение Интересно отметить, что эритромицин и подобные ему антибиотики действуют как непептидные агонисты мотилина, и иногда эту их способность используют для стимуляции желудочно-кишечной подвижности. Механизмы действия многих гормонов ЖКТ еще не известны. Клетки слизистой ЖКТ секретируют многие гормоны, которые образуются другими клетками вне желудочно кишечного тракта. Вот несколько примеров таких гормонов. Соматостатин - гормон, первоначально изолированный из гипоталамуса, секретируется в кровообращение D клетками панкреатических островков и слизистой желудочно-кишечного тракта. Как указывалось ранее, существуют 2 секретируемые формы соматостатин 14 и соматостатин 28. Соматостатин - ингибитор секреции гастрина, ВИП, ГИП, секретина и мотилина. Подобно нескольким другим желудочно-кишечным гормонам, соматостатин секретируется в основном в полость кишечника. Он также ингибирует панкреатическую экзокринную секрецию, секрецию кислоты в желудке и перистальтику, сокращение желчного пузыря и всасывание глюкозы, аминокислот и липидов. Тиреотропин и кортикотропин также найдены в желудочно-кишечном тракте. По-видимому, эти гормоны не поступают в кровообращение, поскольку гипофизэктомия или нарушения функции гипоталамуса не компенсируются в условиях интактного желудочно-кишечного тракта. Функции этих гормонов недостаточно понятны, но есть доказательства роли локально образованного тиреотропина в регуляции секреторной активности кишечника. Тиреотропин обнаружен в панкреатических островках, где он вероятно локализуется в В клетках. Гуанилин - недавно выделенный полипептид, который взаимодействует с гуанилатциклазой типа C. Он состоит из 15 остатков аминокислот и секретируется клетками слизистой кишечника. Стимуляция гуанилатциклазы увеличивает концентрацию внутриклеточной цГМФ, а это в свою очередь вызывает повышение активности хлорного канала, что ведет к повышению секреции Cl- в кишечную полость. Гуанилин действует паракринным способом, и образуется клетками вдоль всего кишечника от пилорического отдела до прямой кишки. Теплоустойчивый энтеротоксин некоторых, вызывающих диарею видов E coli, имеет структуру, подобную гуанилину и активирует рецепторы гуанилина в клетках кишечника. Рецепторы гуанилина также найдены в почках, печени и женской репродуктивной системе и гуанилин может, действуя эндокринным способом, регулировать обмен жидкости в этих тканях. Нейротензин, 13-аминокислотый полипептид, образуется нейронами и клетками слизистой подвздошной кишки. Его выделение стимулируется жирными кислотами. Он ингибирует желудочно-кишечную перистальтику и увеличивает кровоток в подвздошной кишке. Вещество Р -первый пептид, обнаруженный в кишечнике и мозге. Активный домен этого 11-аминокислотного пептида, образован С-концевым пентапептидом. Пептид стимулирует сокращения гладких мышц кишечника. ГРП – гастрин-рилизинг пептид состоит из 27 аминокислот. С-концевой декапептид идентичен последовательности аминокислот в положениях 5-14 полипептида, выделенного из кожи лягушки - бомбезина. Он образуется в вагусных нервных окончаниях, которые взаимодействуют c G клетками и выполняет роль нейромедиатора, вызывающего опосредованное вагусом увеличение секреции гастрина. ГРП стимулирует желудочную и панкреатическую секрецию и увеличивает перистальтику желчного пузыря и кишечника. Если секретируется в очень больших количествах, то может поступать в кровообращение. Нейротензин (13-членный пептид), мет- и лей-энкефалины, серотонин найдены в клетках кишечника и могут проявлять активность в его тканях. Здесь приведены сведения о небольшом числе из известных пептидов, обнаруженных в ЖКТ, и весьма вероятно, что еще много желудочно-кишечных пептидов ждет своего открытия Клетки, которые секретируют желудочно-кишечные полипептиды, могут формировать опухоли. 50% этих опухолей - гастриномы и 25 % - глюкагономы. Описаны также ВИПомы, нейротензиномы и др.

