Довгуша В.В. НАРКОЗ ИНЕРТНЫМИ ГАЗАМИ
advertisement

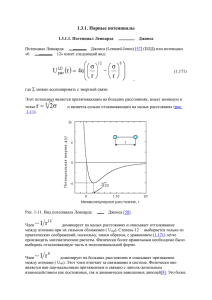
Довгуша В.В. НАРКОЗ ИНЕРТНЫМИ ГАЗАМИПОЛЯРИЗАЦИЯ И ВОЗНИКНОВЕНИЕ ДИПОЛЬНОГО МОМЕНТА Санкт-Петербург 2011 УДК 613.83 В брошюре обосновывается концепция возникновения наркоза инертными газами за счет их поляризации и возникновения дипольного момента в водных структурах биологических жидкостей. © Довгуша В.В., 2011 Подписано в печать 6.06.2011. Отпечатано в типографии ООО «Пресс-Сервис» Санкт-Петерург, пр. Юрия Гагарина, д. 65 Наркоз инертными газами – поляризация и возникновение дипольного момента. В 1936 г. Н.В.Лазарев пришел к выводу о существовании обратно пропорциональной зависимости между наркотическим действием и полярностью молекул наркотика. Затем он разработал теорию физиологического действия неэлектролитов, к которым относятся азот, водород и инертные газы. Эта теория основывалась на закономерности, выявленной Г.Мейером (1899) и Е.Овертоном (1901) о том, что всякое вещество, инертное в химическом отношении, но растворимое в жирах и липидах, является наркотиком. До настоящего времени ни одна из рассматриваемых теорий полностью не соответствует действительности, поскольку наркотический эффект определяется природой, физико-химическими характеристиками вдыхаемого газа и его давлением (концентрацией). Мы не отвергаем действующие на настоящее время мембранную теорию и теорию критического объема, а предлагаем рассмотреть их в свете волновых взаимодействий в организме. Ряд исследователей, пытавшихся объяснить механизм наркотического действия различных веществ химическими или физикохимическими взаимодействиями, пришли к прогрессивным и перспективным выводам. Вот некоторые из них: - окончательный механизм действия наркотических веществ должен быть одинаковым; - данный механизм не сопровождается химическим взаимодействием; - имеется зависимость от коэффициентов растворимости в воде и жирах; - существуют различия в механизмах действия на нервные и соматические клетки; 3 - зависимость от полярности молекул и других физических характеристик; - способность инертных газов взаимодействовать с водой, давая принципиально новые вещества с характерными только для них свойствами. Сформулированные эмпирические закономерности говорят о многом, однако они не объясняют, каким образом взаимодействие анестетика с водой внутри организма может приводить к анестезии. Как известно, индифферентные газы применяются в качестве разбавителя кислорода с целью предупреждения его токсического действия. Индифферентность таких разбавителей относительная, ибо при повышенном парциальном давлении они обладают наркотическим действием. Биологическое действие индифферентных газов при повышенном парциальном давлении связано с увеличивающейся их плотностью в дыхательной смеси и количеством в организме. Необходимо учитывать, что в условиях длительного пребывания под повышенном давлением биологический эффект индифферентных газов резко возрастает, так как они обладают высокой поверхностной активностью, при этом повышается растворимость. Сила наркотического действия инертных газов как в нормальных условиях, так и под давлением, в значительной мере зависит и от их молекулярного веса. Чем больше молекулярный вес, тем больше сила наркотического действия газа. Н.В.Лазарев наркотическое действие инертных газов рассматривал как частный случай биологического действия под названием «неэлектролитное». Под наркотическим действием индифферентных газов понимается патологическая реакция организма на воздействие повышенных парциальных давлений или концентраций индифферентных газов в газовой среде (смеси), характеризующаяся изменением функций ЦНС и соматических клеток (Павлов Б.Н. 1998). Биологическое действие повышенных парциальных давлений (концентраций) индифферентных газов обычно квалифицируется как наркотическое, поскольку не происходит изменений не только хими4 ческой структуры газов, но и химической структуры подвергающихся их действию тканей. При снижении давления (концентрации) этот эффект является обратимым. По нашему мнению, к объяснению возможности возникновения наркоза индифферентными газами необходимо подходить с двух позиций: 1) анализа состояния инертного газа в момент попадания в организм; 2) физических, химических и биофизических характеристик индифферентных газов, способствующих возникновению наркоза при создании в биологических жидкостях совместных водных структур. Исходя из анализа литературных данных, теоретических и практических исследований, нами, на основе передовых идей различных теорий наркоза инертными газами, отмечено, что в механизмах возникновения наркоза основную роль играют водные (гидратные) структуры биологических жидкостей с инертными газами. Физикохимические свойства этих структур кардинально отличаются от атомов и молекул их образующих в основном состоянии. Растворению (взаимодействию) инертного газа в водных структурах биологических жидкостей и возникновению наркоза способствует: 1. Атомная масса – она у ксенона в 4 раза больше, чем у азота (N2 ). 2. Радиус атома (радиус взаимодействия) – у ксенона почти в 1,5 раза больше, чем у азота. 3. Потенциал ионизации первых пяти внешних электронов – у ксенона он наименьший. 4. Энергия возбуждения электронов у ксенона в два раза меньше, чем у неона. 5. Сродство к электрону. 6. Средняя и относительная поляризуемость в 2,5 и в 20 раз у ксенона больше, чем у азота и гелия соответственно. Возникновение дипольного момента. 7.Электроотрицательность абсолютная – у ксенона наименьшая. 8. Степени окисления – имеются только у криптона и ксенона. 9. Атмосферное давление, повышенная концентрация, при 5 которых возникает наркоз: у ксенона при нормальном давлении (0,1 МПа), у азота в шесть раз больше (0,6 МПа). 10. Содержание мнертного газа в теле человека весом 70 кг при наступлении наркоза (л) – у ксенона наибольшее. 11. Содержание в водосодержащих средах (л) у ксенона в 2-4 раза больше, чем у азота и др. газов(табл.2)(Довгуша В.В. с соавт., 2007, 2010). Каждая биофизическая реакция может идти как в прямом, так и в обратном направлении. Реакция в прямом направлении происходит при увеличении энергии электронных состояний, изменении колебательной энергии реагирующих веществ; в обратном, соответственно, при уменьшении энергии. Для кинетики газовых биофизических реакций характерно наличие двух или нескольких стадий, следующих одна за другой, в прямую и в обратную стороны (ксеноновые и постксеноновые эффекты). В первой стадии образуется большое количество метастабильных атомов (молекул), затем возникают различные водные кластеры, временные диполи инертных газов, достигается уровень «наркозной» концентрации, возникает стадия наркоза. При прекращении подачи газовой смеси (уменьшении давления) инертный газ десатурирует, исчезают кластеры, диполи, возникают плотные ассоциаты воды (постксеноновые ассоциаты). Исследования различных биофизических реакций приводят к заключению о большой сложности их механизма. Одним из критериев и признаков сложности биофизического механизма реакции является образование промежуточных структур в ходе реакции. Промежуточных не в смысле элементарного изменения состава взаимодействующего вещества, а в плане энергетического, пространственного, конформационного состояния. При этом расходуются не реагирующие элементы, а изменяются их качественные характеристики (состояние). Количество элементов реагирующих веществ сохраняется. Характерным для биофизических реакций является то, что, как правило, они носят коллективный, кооперативный характер и хорошо анализируются (контролируются) ИК-спектрометрией. 6 Границы биофизических реакций гораздо шире химических, когда релаксационный процесс идет благодаря резонансному характеру (колебательные кванты разнятся на ±40 см-1). Практически, в любом случае в основе механизма волнового взаимодействия газов лежит совокупность процессов, отвечающих превращению наименьшего колебательного кванта в системе в увеличение колебательной, поступательной энергии или возбуждения низшего колебательного уровня. Колебательная релаксация электронно-возбужденных атомов (молекул) осуществляется быстрее колебательной релаксации тех же молекул в основном электронном состоянии. При нарушении равновесного распределения энергии в результате повышения давления или увеличения концентрации инертного газа в дыхательной смеси повышаются скорости движения молекул (атомов) газа и количество столкновений. Это приводит к увеличению богатых энергией молекул (активированных, метастабильных). Энергия молекул газа под давлением всегда отличается от энергетического состояния этих молекул в обычных условиях и именно это отличает характер взаимодействия. Важно представлять, что энергия электронных возбуждений составляет основной процент всех биофизических реакций, что очень существенно для биологических систем. Если скорость химических (метаболических) реакций определяется изменением концентрации реагирующих веществ во времени, то скорость биофизических реакций зависит от качественного состояния (состава) метастабильных реагентов на уровне слабых и сверхслабых волновых взаимодействий и количественно в ходе взаимодействия практически не изменяется. Водогазовые образования (кластеры) в биологических жидкостях представляют собой метастабильные структуры, образование и разложение которых зависит от давления (концентрации) и температуры, состава газа и водных структур биологических жидкостей. Качественное объяснение причин возможного образования газогидратов в биологических жидкостях дает модель, разработанная 7 В.И. Косяковым и В.А. Шестяковым (1996-2000). Они предложили описывать области существования структурных форм газовых гидратов не только в зависимости от формы гостевой молекулы, но и от «силы» ее ван-дер-ваальсова взаимодействия с молекулами воды в каркасе. Такой подход объясняет разницу в образовании гидратов легких и тяжелых инертных газов. Становится понятным, почему в биологических жидкостях превалируют структуры КС-I и КС-II, причем только как метастабильные. В биологических системах из-за высокой чувсвительности к слабым взаимодействиям достаточно небольших изменений условий равновесия (концентрации, давления, температуры, изменения электролитного состава и др.) для того, чтобы один и тот же гость мог стабилизировать разные каркасы. Характерно, что для кластеров, в которых гостями являются молекулы одного сорта структура КС-II из-за относительно высокого содержания малых додекаэдрических полостей и хорошей их стабилизации в случае малых молекул (O2, N2, Ar, Kr (3,8-4,0 Å)), становится более выгодной. Для КС-II характерны и двойные гидраты, т.к. заполнение ее малых полостей вспомогательным газом (H2, He) дополнительно стабилизирует структуру. В работе В.Кухса с соавт. (1997) экспериментально показано, что в больших полостях КС-I и КС-II может разместиться по две молекулы азота, которым выгоднее разместиться в этих полостях. Поэтому гидраты КС-II с малыми гостями устойчивее, чем гидраты КС-I. У гидратов с атомами Хе размещение по две в одной полости затруднительно, поэтому для них предпочтительнее КС-I. Ассоциаты воды, как правило, неполярны, в них отсутствует ориентационный эффект. В кластерах электроотрицательность инертных газов больше, чем электроотрицательность молекул Н2О. В этом случае молекулы воды имеют положительный эффективный заряд (>0, но <+1), атом инертного газа – соответствующий отрицательный заряд. Инертные газы в пустотах ассоциатов воды за счет своего метастабильного состояния способствуют структурной переориентации молекул Н2О внутри ассоциата, возникновению дипольного момента (мгновенного) и увеличению энергонасыщения кластера. 8 Кластерные гидратированные ионы газов (воздуха) имеют большое значение в природе, в том числе и для живого организма. При гибели биологического объекта динамическое образование кластеров и их разрушение прекращается. Этим живое отличается от неживого. При внедрении инертного газа в пустоты ассоциата воды, связующие пары молекул Н2О смещаются в сторону атома инертного газа как более отрицательного элемента. Это смещение приводит к несовпадению центров положительных и отрицательных зарядов, кластер поляризуется, приобретает характер диполя. Полярность кластера оценивается величиной момента диполя μ, представляющего собой произведение расстояния между центрами зарядов (длины диполя) τ на величину электрического заряда ε. Количественной мерой поляризуемости кластера наряду с моментом диполя является также эффективный заряд атома инертного газа (у Хе он наибольший по сравнению с другими инертными газами). Чем больше значение эффективного заряда атома приближается к целому числу (1, 2, 3 и т.д.), тем больше подтверждается, что связи в кластере носят чисто ионный характер. Ковалентный характер носят только связи самих молекул Н2О. Водный каркас метастабилен по отношению к исходной модификации, но при некоторой степени заполнения полостей молекулами гостей становится устойчивее ее. Здесь кластер представляет собой новую фазу переменного состава за счет изменения степени заполнения полостей и с изменением условий равновесия (Дядин Ю.А. с соавт., 1988). Молекулы воды в живом организме строят несколько близких по энергии каркасов, поэтому могут образовываться гидраты включения разных структур в зависимости от размеров и формы молекулы гостя, а также окружающих условий. Каркасные структуры биологических жидкостей в большинстве своем имеют полиэдрическое строение. Самым выгодным полиэдром является пентагондодекаэдр, т.к. угол в нем между Н-связями (108о) мало отличается от тетраэдрического и даже ближе к валентному углу в 104,5о, характерному для молекул воды в свободном состоянии. 9 Возможно и гидрофобно-гидрофильное внедрение. Это подтверждает то, что очень многие тонкие процессы живой природы являются надмолекулярными и большинство из них идет при участии воды. Это также наглядный пример из супрамолекулярной химии, демонстрирующий, как реакционная способность (например, токсических, метаболических) компонентов плазмы крови и стабильность образующихся соединений в системе гость-хозяин зависят от пространственной комплементарности, повышая (понижая) температуру тела (меняется температура плавления гидрата). Кластеры биологических структур очень зависят от первоначальной заселенности неустойчивого водного каркаса молекулами кислорода и азота атмосферного воздуха. Вопрос о влиянии растворенных неполярных ( в том числе инертных) газов на структуру воды и биологических жидкостей имеет фундаментальное значение для оценки их роли в стабильности биологических систем. Растворение благородных газов сопровождается такими перестройками в воде и биологической жидкости, которые приводят к общему росту упорядоченности системы, причем упорядочивающий эффект тем больше, чем более структурирована вода и чем больше размер гидратирующих частиц (Крестов Г.А., Абросимов В.К., 1964; Абросимов В.К., Крестов Г.А. с соавт., 1986). Авторами на основании данных по парциальным молярным объемам неполярных газов в водных растворах рассчитаны структурные составляющие энтропии гидратации важнейших компонентов атмосферного воздуха (N2, O2, He, Ar, Kr и Н2) при 282-323о К. Показано, что растворенные газы оказывают стабилизирующее влияние на локальную структуру жидкой воды. При этом для газов Ar, Kr, N2, O2 структурный эффект не ограничивается только стабилизацией, он связан и с дополнительным развитием зон упорядоченности, что объясняет скачкообразное увеличение растворимости при переходе от «легких» газов к более «тяжелым». При уменьшении температуры этот эффект усиливается. Гидратация неполярных газов является энтропийно и структурно контролируемым процессом. Концепция гидрофобной гидратации 10 остается лидирующей при трактовке термодинамических и структурных данных, относящихся к водным растворам неполярных веществ. Растворение гидрофобных молекул в воде изменяет ее локальную структуру либо путем стабилизации, либо путем перестройки в клатратоподобную. Очевидно, что во втором случае энтропийные эффекты будут более значительными. Промотирование собственной структуры воды является, вероятно, следствием кооперативности водородных связей и объясняет скачкообразное увеличение растворимости при переходе от Н2, Не к Аr, О2 и другим газам. Этим же можно объяснить взаимное увеличение растворимости газов при их совместном растворении. Данные по парциальным молярным объемам смесей неполярных газов также указывают на усиление структурирующей способности молекул растворенного газа в присутствии других идентичных молекул. Это явление получило название аутосинергического эффекта растворимости (Абросимов В.К. с соавт., 2000). Стабилизация существующей водной структуры характерна для газов, размеры молекул которых не превышают размеров полостей в структурной матрице растворителя. Из рассматриваемых здесь атмосферных газов это водород и гелий. Для остальных газов структурный вклад в энтропию гидратации скачкообразно возрастает (становится более отрицательным) в 2-3 раза. Молекулы кислорода и, по-видимому, азота могут взаимодействовать с молекулами воды с образованием двух видов кластеров: с водородной связью и без нее, причем, второй вид конфигурации более предпочтителен. Этот вывод подтверждают данные расчетов, которые свидетельствуют о том, что молекулы воды ориентированы относительно молекул N2 и О2 таким образом, что образовавшаяся ячейка не имеет результирующего дипольного момента, т.е. полностью симметрична. Мы считаем, что эти положения справедливы для указанных температур при нормальном атмосферном давлении и обычной концентрации. При повышенном давлении окружающей среды или увеличении процентного содержания инертных газов во вдыхаемой сме11 си возникают кластеры преимущественно с наличием водородных и ван-дер-вальсовых связей, а также двойные кластеры. Именно следствием кооперативности этих связей и объясняется скачкообразное увеличение растворимости при переходе от «легких» газов к Ar, Kr, Xe и другим газам, а также усиление структурирующей способности указанных газов в присутствии других идентичных и неидентичных молекул. Действие на организм инертных газов, как наркотических веществ, свидетельствует об отсутствии химических процессов или реакций. Молекулы наркотического вещества в процессе взаимодействия с нервной клеткой ничего не окисляют и не восстанавливают, сами химически не изменяются, но тем не менее, вызывают наркоз. Действительно, для протекания любой химической реакции почти наверняка требовалось бы участие ферментов, а поскольку ферменты стереоспецифичны, то левая и правая формы наркотического вещества вели бы себя при этом различно. Собственно говоря, в контексте рассматриваемого нами вопроса, они и ведут себя по-разному – одни вещества, например левовращающий изомер морфина, обладают сильными наркотическими свойствами, а их оптические правовращающие изомеры – нет. По-видимому, определенные изомеры биологически активных веществ, в т.ч. и наркотиков, пространственно соответствуют реакционным центрам рецепторов мембран. Основную роль при этом должно играть поляризованное излучение кластеров. Откуда же оно возникает? Химия инертных газов имеет свои особенности. Одна из них – это то, что при определенных условиях орбитали наружных электронов инертных газов (октеты) могут оказаться «размытыми», «разрыхленными», «сдвинутыми» и тогда инертный газ в кластере приобретает индуцированную полярность, а отдельные электроны обретают способность вступать даже в химическую связь. Рассматривая этиопатогенез наркотического действия индифферентных газов необходимо отметить, что азот, аргон, гелий, водород и неон относятся к числу метаболически индифферентных газов, т.к. они не вступают в организме в биохимические реакции. При нор12 мальном атмосферном давлении они являются нейтральными газами для организма. При повышенном парциальном давлении эти газы вызывают ряд биологических ответных реакций организма, которые могут быть приспособительными и патологическими. Криптон, ксенон и радон также метаболически индифферентные газы для организма. Однако, при нормальном давлении и повышенном содержании в газовой смеси (>концентрации) они вызывают наркотический эффект. В первую очередь такое поведение инертных газов указывает на зависимость эффектов от размеров атомов (молекул), способности внедряться в полости воды, возможности проникновения внутрь клетки или трансмембранного действия, от их количества в организме. Все молекулы инертных газов гидрофильны и способны проникать в пустоты молекул воды биологических жидкостей. Вероятность и скорость рекомбинации зависит от степени гидратации и кластеризации. Кластеры инертных газов в биологической жидкости находятся в неустойчивом равновесии. За счет повышения давления или увеличения концентрации (процентного содержания в газовой смеси) увеличивается количество столкновений атомов (молекул) инертного газа друг с другом. Это приводит к повышенному образованию метастабильных атомов и молекул газа. Метастабильные состояния обладают повышенной энергией, реакционной способностью и т.п. В данном случае, активированные молекулы газов проникая в полости молекул воды, группируются в большие кластеры, которые препятствуют или замедляют рекомбинацию (дезактивацию) атомов и молекул инертных газов и тем самым создают условия для накопления энергии в определенном объеме (полости). При этом приобретается способность за счет гидратирования присоединять электроны в кластере и делаться энергонесущими. Наркоз инертными газами наступает при почти одинаковой концентрации разных веществ в какой-то биофазе. При образовании кластера ритмологическая инициатива идет от нижнего организационного уровня – от атома инертного газа, его 13 относительной атомной массы. В результате формируется главный (интегрирующий) ритм надмолекулярной (атомной) структуры, который диктует правила ритмологического поведения всем кластерообразующим элементам. Интегрирующий ритм есть фактор, определяющий функцию кластера. В процессе роста кластера инертного газа слои воды перемещаются параллельно друг другу. То есть, процесс частотной синхронизации имеет четкий вектор, а конечные (по окружности) атомы Н2О, или не вошедшие в состав кластера, являются элементами, синхронизирующими частотные параметры молекул воды, еще находящиеся вне структуры кластера, но уже ориентированных для встраивания в него. Внешним фактором, побуждающим рост кластера в плазме крови (для N2 внутри клетки) является уменьшение свободных молекул воды и ее ассоциатов (т.е. образование перенасыщенного раствора). Кластеры обладают свойством вращения плоскости поляризации в зависимости от кластерообразующего элемента. Различаются лево- и правовращающие кластеры, что соответственно отражается на силе наркотического действия изомеров. Следовательно, кластер инертного газа характеризуется не только четкой структурой упорядоченности, но и упорядоченностью частотных колебаний электромагнитных полей составляющих его элементов и своего внутреннего электромагнитного поля в целом. Поляризация, изменение дипольного и индукционного моментов оказывает значительное влияние на сетку водородных связей и коллективные эффекты как в кластере инертного газа, так и в биологических жидкостях. При этом почти в два раза увеличивается время релаксации водородных связей. Трудно понять, что совершенно инертное может способствовать биологической макромолекуле изменить свою конфигурацию. Имеет также значение тот факт, что характерный для кристаллов дальний порядок в биологической системе отсутствует (не проявляется). В отсутствии же дальнего порядка и следующих из него коллективных эффектов не может быть резкого изменения скорости биохимических 14 реакций при упрочнении гидратной оболочки. Изменить, приостановить ход биохимических реакций может только излучение этих кластеров с длинной волны более 750-800нм, когда прекращаются все метаболические реакции (Довгуша В.В. с соавт., 2006). Сохраняющийся ближний порядок, т.е. характерная для клатратов клеточная структура водных кластеров, включающих в свои пустоты «молекулы-гостей» инертных газов и создает эти осцилляты. Электрические, оптические, магнитные и другие свойства атомов и молекул в конечном счете связаны с волновыми функциями и энергиями различных состояний элементов: через них выражаются и электрический дипольный момент, и магнитный момент, и поляризуемость, и магнитная восприимчивость. В этом суть атомных и молекулярных спектров (Волькенштейн М.В.,1981). Фаза – это ступень развития какого-либо явления. В термодинамике – это термодинамически равновесные состояния вещества, отличающиеся по своим физическим свойствам от других фаз (равновесных состояний) того же вещества (для ксенона, например, основное – метастабильное – поляризованное состояние и обратно) (БСЭ). Фазовое превращение – это переход вещества из одной фазы в другую при изменении внешних условий (температуры, давления, магнитного и электрического полей и др.). В узком смысле – это скачкообразное изменение физических свойств при непрерывном действии внешних факторов. Фаза – однородная часть неоднородной системы, ограниченная поверхностью раздела. Под системой в химии понимается ограниченная часть пространства, заполненная веществом или смесью веществ. Гомогенные системы однофазны. Гетерогенные системы состоят более чем из одной фазы. Для немолекулярных кристаллов фаза – это носитель всех физических, химических и биофизических свойств вещества, кристаллизирующегося в координационной решетке, т.е. свойства вещества немолекулярной структуры зависят от состава и химического строения фаз. У соединений, не имеющих молекулярной структуры, вместо молекулярного веса вводится понятие формульного веса: он равен 15 сумме атомных весов, умноженных на фактические стехиометрические индексы химических формул соединений. В настоящее время стехиометрические законы химии формулируется с учетом единства молекулярной и немолекулярной форм существования вещества. Конечное состояние: продукт реакции (газовый гидрат) в адсорбированном состоянии – также характеризуется иным значением энергии. Это приводит к тому, что активационный барьер за счет адсорбционных возможностей и явлений в некоторых случаях может значительно понижаться. Этому способствует концентрация реагентов (кластеров) в поверхностном слое, которая значительно выше, чем объемная концентрация. Кластеры в адсорбированном состоянии определенным образом ориентируется, что способствует большему поляризационному эффекту. Полученное состояние напоминает явление гетерогенного катализа в преддверии химической реакции. Дисперсионные системы – гетерогенные системы, состоящие из двух и более фаз с сильно развитой поверхностью раздела между ними. В дисперсных системах (например, плазме крови) по крайней мере одна из фаз – дисперсная фаза – распределена в виде кластеров газа в другой, сплошной фазе – дисперсионной жидкой среде. Размер кластеров (частиц дисперсной фазы) составляет 10-9 -10-7 м, т.е. лежит в интервале от нанометров до долей микрометра. Физические свойства дисперсной системы зависят от соответствующих свойств фаз, составляющих систему. Свойства кластерных дисперсий зависят также от природы границы раздела между дисперсной фазой и дисперсной средой. Добавление малых количеств других веществ (газов, ПАВ и др.) может существенно изменить объемные свойства дисперсных систем. Это наблюдается при замене одного газа в дыхательной смеси на другой (-е). Клатратные гидраты являются прекрасными модельными объектами для изучения гидрофобных взаимодействий и возможных способов надмолекулярной организации воды. Понятно, что их структуры и свойства должны существенно отличаться при моделировании для биологических объектов. Мы четко 16 представляем, что при нормальном атмосферном давлении, при невысоких давлениях (0,7 – 1,0 – 5,0 МПа) и температуре биологических объектов 36,6о С существует свой класс гидратных соединений включения инертных газов. Практический опыт свидетельствует, что это так, а достаточных физико-химических сведений в настоящее время еще не хватает. Известно, что способностью образовывать гидраты обладают все гидрофобные газы, а также некоторые слабо взаимодействующие с водой гидрофильные соединения (СО2, SО2, окись этилена и др.). Каким же образом в биологических структурах вещества не имеющие никакого химического сродства, такие как вода, с одной стороны и благородные газы – с другой, могут взаимодействовать, при этом образовывать временно устойчивые в термодинамическом плане соединения? Этому способствует: - выигрыш в энергии по сравнению с энергией смеси составляющих исходных компонентов при тех же условиях; - эволюционно закрепленное в биологических объектах свойство обволакивать молекулами воды любые поступающие в организм элементы и т.д. Процесс напоминает межфазную поликонденсацию на границе раздела жидкость-газ. Это неравновесный процесс. Скорость его определяется диффузионными факторами. Реакция взаимодействия обычно происходит при комнатной температуре. Чем тяжелее инертный газ, тем прочнее он образует гидрат. Этот эффект основывается на различной поляризуемости газов, зависит от размеров и массы атомов (молекул), связан с нарушением равновесия между газообразной и растворенной фазами газа в организме. От величины давления (концентрации) зависят некоторые физико-химические характеристики инертных газов и жидкостей. В первую очередь это объем, сдвиг точки кипения жидкостей. Увеличивается растворимость газов, что приводит к росту количества атомов газа в биологических жидкостях. Все это способствует наруше17 нию привычных (эволюционных) метаболических, биологических, физиологических взаимоотношений в организме. Фазовые переходы Хе из газового состояния в газогидрат и обратно сопровождаются перестройкой его электронной структуры, электронной структуры молекул Н2О ассоциата, в который он внедряется, и сильным объемным эффектом. Интересно, что с подобными особенностями (объемным эффектом, изменением характера связей) связана также феноменальная устойчивость алмаза – метастабильной в нормальных условиях модификации углерода. Модификация атома Хе несколько другого рода – от инертного до диполя. Причем, параметры его и Н2О в кластере почти не отличаются от нормальных (обычных) параметров. Меняются только объемные характеристики. В таком состоянии эти метастабильные структуры могут оставаться относительно недолго, т.к. термодинамически это невыгодное состояние. После всех фазовых переходов взаимодействующие вещества (Хе и Н2О) сохраняют исходное состояние. В процессе фазового перехода Хе преобразуется в диполь, что обусловлено переходом наружных эектронов Хе из состояний S2p2 в Sp3 . Окружающие атомы молекул воды, имеющие иное электронное строение, при таком принципиальном изменении первоначальной структуры Хе будут испытывать существенное воздействие, отражающееся на их объемной плотности. Именно при таких состояниях происходят изменения в характере химической водородной и ионной связях! Рассматривая процессы, происходящие на границе раздела газвода необходимо четко представлять состояние атома инертного газа при адсорбции, а именно: - степени его искажения или структурных изменений; - процессов обмена энергией между атомом инертного газа и молекулами воды в биологических жидкостях; - физико-химических изменений, протекающих внутри кластера (водогазового образования) молекул воды. Атом инертного газа, попав внутрь полости, образованной молекулами воды, взаимодействует с их внутренней поверхностью за 18 счет слабых сил (ван-дер-ваальсовых). Происходит адсорбция молекул (атомов). При обратимой адсорбции и при изменении парциального давления (концентрации), температуры, атом инертного газа переходит в основную газовую фазу при других неизменных условиях эксперимента. Прочность связи атомов инертных газов с молекулами воды кластера (энергия адсорбции) различна для разных газов и зависит от физических характеристик (дипольный момент, поляризуемость и т.д.) и реакционной способности. Величины энергий адсорбции меняются от 0,1 эВ до значений чуть меньше химических связей. Слабая адсорбция с энергией, не превышающей 0,3 эВ, называется физической. При физической адсорбции происходит деформация атомов и молекул инертных газов в полостях из молекул воды с изменением распределения электронной плотности как в атомах газа, так и окружающих молекул воды, с которыми происходит это взаимодействие. Все взаимодействующие элементы сохраняют свою индивидуальность. Взаимное влияние атомов и молекул в кластере обуславливает полярность и поляризуемость слабых связей как в кластерах, так и в органических молекулах. При десорбции атомы инертных газов переходят в свое основное состояние. Дисперсионное взаимодействие обычно вносит основной вклад в полную энергию ван-дер-ваальсова взаимодействия, кроме воды. В Н2О вклад дисперсионного взаимодействия составляет лишь 24% от полного ван-дер-ваальсова, а вклад ориентационных взаимодействий около 69% (Бараш Ю.С., Гинсбург В.Л.,1984). Между физическими и химическими связями трудно провести четкую границу, т.к. они имеют общую физическую природу (электрическую). Устойчивость физической связи определяется только в пределах фазы. Ионная связь ближе к физической связи. Поляризуемостью характеризуется способность электронной оболочки любого атома или молекулы смещаться под действием электрического поля, в результате чего в нейтральном элементе соз19 дается индуцированный дипольный момент (μ инд = aF, где F – напряженность поля, а – поляризуемость атома инертного газа). При реакции инертных газов с водой взаимодействие более значительно для атомов с легкой поляризуемостью (в данном случае – тяжелых инертных газов). В водном кластере биологической жидкости связь атома инертного газа с внутренней поверхностью молекул Н2О осуществляется в основном, ван-дер-ваальсовыми силами. Это физическая адсорбция. Она характерна для инертных атомов. Энергия взаимодействия, соответствующая физической адсорбции, порядка 10-2 – 10-3 эВ. Для тяжелых инертных газов (Kr, Xe), поляризуемости которых сравнительно велики, необходимо учесть наличие наведенного в них при адсорбции дипольного момента. Такой дипольный момент направлен перпендикулярно поверхности. Он возникает вследствие деформации электронных оболочек первоначально сферически-симметричного атома за счет его взаимодействия с поверхностью дипольных молекул воды. Для легких атомов (H2, He, Ne) с достаточно малыми поляризуемостями оказываются малыми и наведенные в них дипольные моменты (Бараш Ю.С., Гинсбург В.Л.,1984). Газы в биологических жидкостях образовывают кластеры, отличающиеся очень большой величиной межфазной границы. Для таких состояний энергия межфазных границ является очень важным фактором. Обычно на межфазных границах сосредоточены электрические заряды и этим обусловлены разнообразные свойства и эффекты, характерные для подобных систем. Образованный в плазме крови кластер обладает индуцированным диполем и зарядом внешних слоев молекул воды. При интенсивном обтекании кластеров на поверхности нервной клетки потоком плазмы крови на границах кластера может возникать электрическое напряжение. Фазовый переход жидкости (молекул Н2О) в другую жидкость (типа Хе ·6Н2О или Хе ·(Н2О)46), или при повышении давления до 0,7 МПа, когда образуются кластеры составом (N2)16(Н2О)46 и более, принципиально меняется ближний порядок действия: разру20 шается старое и вновь образуется новое взаимное расположение молекул воды в ассоциатах и новое в кластерах с гидратируемыми частицами. То, что это новое состояние со своими физическими характеристиками подтверждает тот факт, что обезболивающей активностью обладают только левоизомеры веществ морфиевого ряда, тогда как правовращающиеся активностью не обладают. Эти же данные могут свидетельствовать, что инертные газы – левовращающие наркотические вещества. В случае излучения кластера в одном электронном переходе (при росте или разрушении кластера) могут наблюдаться линии с различным состоянием поляризации. Степень поляризации испускаемых линий существенно не меняется, т.к. структура кластера инертного газа относительно постоянная. Во всех случаях (кластеры Хе, Кr, Аr)поляризация почти не изменяется в пределах длинноволновой полосы излучения (табл.1). Передача энергии от кластера к мембране происходит за счет резонансной миграции при частичном наложении спектров излучения и поглощения, т.е. при наличии общих частот в этих процессах. Кластеры ксенона эффективны только на резонирующей длине волны (частоте). Ведущую роль при этом играет насыщенность газом биологических жидкостей. Нейроны имеют характерный размер около 1000 Å. Кластеры Хе, Кr, Аr имеют одно ребро около 12 Å. Таким образом, около 90-100 кластеров инертного газа блокируют нервную клетку, увеличивают дипольный момент наружного слоя мембраны. Налицо чисто биофизическое неспецифическое воздействие (Довгуша В.В., 2005). Наркотический эффект газовой смеси Хе/О2 (80/20%) при нормальном давлении равен (эквивалентен) наркотическому действию воздуха, сжатого до 0,7 МПа. Можно предполагать, что у азота при этом давлении физические характеристики сдвигаются до уровня ксенона при нормальном давлении, особенно при создании двойных азотных кластеров. Азот проникает внутрь клетки, ксенон – нет. 21 22 70 66 Rn N O 154 140 120 122 160 191 198 218 5,1 7,30 7,54 7,18 12,3 10,6 7,70 6,8 5,85 Электро­ отрица­ тельность (эВ) абсо­ лютная Удельная магнитная восприимчивость (м3/кг) миним. средн. 860,0 1246,9 844,69 1875,1 2058,1 885,4 965,8 877,7 3507,0 макс. Основные линии в атомном спектре (нм)* 1,0 -2,5 • 10-9 434,0 656,3 -9 1,70 -5,9 • 10 388,9 1083,0 -9 5,85 -4,2 • 10 837,8 865,4 -9 6,75 -6,16 • 10 696,5 811,5 8,25 -4,32 • 10-9 587,1 811,3 -9 8,25- -4,20 • 10 823,2 881,9 15,61 8,25 435,0 749,0 -9 3,90 -5,4 • 10 399,5(П)** 657,9 -9 4,55 +1,355 • 10 777,2 844,64 Эффек­ тивный заряд ядра * – для перехода к ангстремам (Å) необходимо умножить на 10. ** – однократно заряженный ион. *** – для перевода радиусов в ангстремы (Å) необходимо делить на 100. 30 122 160 192 189 209 H He Ne Ar Kr Xe кова­ ван-дерлентный ваальсовый Радиус (нм)*** Некоторые физические характеристики газов Таблица 1 16,6 11,5 9,9 8,3 Энергия возбуждён­ ного электро­ на, эВ -0,22 -0,22 -0,37 -0,42 -0,45 Срод­ ство к электро­ ну, эВ 23 Азот N2 Аргон 28,0 40,0 1,54 1,92 0,42 0,38 1 14,53 15,76 2 29,59 27,61 Энергии ионизации первых пяти внешних электронов 3 47,44 40,70 (эВ) 4 77,46 59,79 5 97,82 75,00 Скорость насыщения 1,0 1,04 Коэффициент диффузии в сыворотке 21,7 18,2 Электроотрицательность абсолютная (эВ) 7,3 7,7 Эффективный заряд ядра 3,90 6,75 3 -9 Удельная магнитная восприимчивость (м /кг) -5,4∙10 -6,16∙10-9 Средняя поляризуемость (α∙1024 см3) 1,74 1,64 Атомная масса (вес) Радиус атома, Å Ван-дер-ваальсов диаметр, нм Показатель Элемент 83,8 1,97 0,41 14,00 24,35 36,94 52,54 64,66 1,88 12,6 6,8 8,25 -4,32∙10-9 2,49 Криптон 131,3 2,18 0,44 12,13 21,20 32,09 44,56 56,99 3,82 10,1 5,85 8,25-15,61 -4,20∙10-9 4,02 Ксенон Физические, химические и биофизические характеристики индифферентных газов, способствующих возникновению наркоза Таблица 2 24 0,140 5,3 25,2 5,92 18,2 1,04 нет 0,43 1148 0,061 5,1 30,1 7,04 21,7 1,0 да 1 1052 1276 в жирах Относительная масса кластера Коэффициент диффузии (х 10-6 см2/с) 811,5 965,8 0,026 696,5 Аргон средние максимальные в воде Азот N2 399,5 (II) 657,9 1246,9 0,013 минимальные Элемент в воде оливковое масло в сыворотке крови Скорость насыщения (рассыщения) жировой ткани (по отношению к N2) Проникновение в клетку Сила наркотического действия (относительная) Растворимость см3/100 см3 (Р ≈ 101 кПа) Жироводный коэффициент Основные линии в атомном спектре (нм) Показатель Продолжение таблицы 2 1498 0,14 нет 1,88 9,6 17,5 4,10 19,6 0,43 811,3 877,7 0,045 587,1 Криптон 1878 0,039 нет 3,82 20,0 14,0 3,27 10,1 1,7 881,9 3507,0 0,085 823,2 Ксенон 25 Элемент Давление при котором наступает наркоз (МПа) Содержание инертно- Водосодержащих го газа в теле человека тканях (л) весом 70 кг при дыхании смесью 21% О2 – Жировых тканях (л) 79% инертного газа (л) при 0,1 МПа Содержание инертного газа в теле человека весом 70 кг при наступлении наркоза (л) Показатель Окончание таблицы 2 0,4 0,96 7,48 8,44 0,48 5,4 5,88 Аргон 0,7 Азот N2 5,16 3,50 1,66 0,3 Криптон 15,34 13,2 2,14 0,1 Ксенон Чем больше относительная масса инертного газа или кластера, тем менее его частотные характеристики. Эквивалентность энергии и массы справедлива для любого вида излучения. Это значит, что чем больше основные линии в атомном спектре, тем меньше частота колебаний атома и, соответственно, кластера им образуемого, тем выраженнее биоэффекты торможения. Остальные физические характеристики у ксенона при нормальном давлении в несколько раз значимее, чем у азота и других инертных газов(табл.2). Наркотические концентрации различных газов в объемном или весовом выражении различаются гораздо значительнее, чем концентрации, выраженные в физико-химических терминах, отражающих растворимость и степень межмолекулярного взаимодействия этих веществ. Важную роль играет и величина молекулы наркотического вещества, и величина кластера, общий эффективный объем молекул, а также их число (на примере азота) и расположение в водном ассоциате (кластере). Наркоз вызывает большее количество молекул азота, которые затем могут вызвать и газообразование в тканях организма(табл.2). В данном случае используется естественная способность организма переносить при больших давлениях большие пересыщения. При прекращении подачи газовой смеси резко снижается напряжение индифферентных газов в артериальной ситеме, а в венозной, наоборот, значительно повышается. Наркоз ксеноном возникает при равенстве его концентраций в артериальной и венозной крови. «Выход» из наркоза происходит тогда, когда это равновесие нарушается в сторону увеличения концентрации в венозной крови. Кластеры ксенона от мембран клеток уходят быстро, как только уменьшается его количество в артериальной крови. У азота процесс более длительный, т.к. ему необходимо еще покинуть клетку. Помимо химической (межатомной) связи, существуют физические силы взаимодействия между молекулами. Благодаря этим силам происходит сцепление молекул (вода, жидкий инертный газ и др.); без них распались бы кристаллы твердых тел, а жидкость превратилась бы в твердое тело. Это силы электрического (электромагнит26 ного) происхождения, хотя они и способны проявляться в различных формах. В связи с тем, что атомы и молекулы инертных газов электрически нейтральны – силы взаимодействия возникают у них только в результате поляризации молекул, т.е., смещения внешних электронных слоев относительно ядер, что приводит к неравномерному распределению электронной плотности в молекуле. Многие неполярные молекулы могут временно стать полярными, если они окажутся в электрическом поле соседних полярных молекул (например, Н2О). При этом заряды (+ и -) в молекуле инертного газа смещаются, сама она деформируется, в ней появляется наведенный (индуцированный) диполь. Уплотнение молекул сопровождается выделением энергии; уменьшается потенциальная энергия системы, она становится более устойчивой (например, кластер с несколькими молекулами ксенона). Кроме электростатического притяжения диполей существуют еще и дисперсионные силы (силы Лондона). Они возникают также вследствие взаимной поляризации молекул, но и тут участвуют особого рода диполи, появляющиеся периодически, очень часто и на ничтожно короткое время. Такие состояния обязаны своим происхождением повторяющимся временным смещением части электронных орбит относительно ядер. Дисперсионные силы универсальны – в большей или меньшей мере они проявляются при взаимодействии любых молекул. Например, в энергии сил межмолекулярного взаимодействия воды они составляют 19 %, а у инертных газов все 100 %. Относительная слабость дисперсионных сил и способность их появляться лишь в наиболее тесном контакте молекул может объяснить их взаимодействие в кластере. Тем более, что силы межмолекулярного взаимодействия у тяжелых инертных газов выражены более значительно, особенно у ксенона и радона, т.к. дисперсионные силы обладают еще и свойством аудитивности. Это значит, что величина их тем больше, чем значительнее масса взаимодействующих молекул. В термодинамике фигурирует функция, именуемая энтропией (S). Это всеобщая мера беспорядка в системе, мера рассеивания его 27 энергии. Величины энтропии простых веществ являются периодической функцией их атомных номеров, а максимальной энтропией в каждом периоде обладают именно инертные газы (Финкельштейн Д.Н., 1979). Чем больше величина энтропии вещества, тем значительнее та часть его энергии, которую невозможно превратить в работу, в т.ч. и химическую (биохимическую) работу. Образовавшийся кластер инертного газа со своим дипольным моментом обусловливает притяжение соседних аналогичных кластеров, которое проявляется тем больше, чем больше дипольный момент атомов инертного газа μ. Чем больше размер атома инертного газа или чем больше их встраивается в пустоты ассоциата, тем больше дипольный момент кластера им образованного, тем сильнее взаимодействие между собой и дипольными молекулами мембраны нервной клетки. Метастабильные состояния атомов и молекул – такие состояния, которые не могут распадаться с высвечиванием фотона и обладают большими излучательными временами жизни. При этом надо различать излучение фотона с электроном или без него. Диссипативное излучение ассоциатов и кластеров воды происходит без излучения фотона с электроном, а только фотона. Запрет на излучение фотона из метастабильного состояния снимается за счет релятивистских и других типов взаимодействия. Внутри шестигранника (Н2О)6 скрыто около 11 единиц потенциальной энергии. Имея такой запас энергии нейтральный шестигранник воды может использовать ее при искажении симметрии. В первую очередь это искажение происходит при внедрении тяжелых инертных газов и азота в пустоты водных структур биологических жидкостей. Атомы Хе имеют отчетливое различное состояние в полостях молекул воды и в газовой фазе (Дядин Ю.А., Удачин К.А., Бондарюк И.В., 1988). Чем больше масса атома, тем больше создаваемый дипольный момент, тем больше полярность атома инертного газа. Поляризуемость инертных газов уменьшается от Хе до Nе и Не в несколько раз. 28 Поляризуемость – это количественная мера наведенного дипольного момента, который пропорционален внешнему полю. У инертных газов поляризуемость увеличивается потому, что от Не до Хе падает потенциал ионизации, т.к. при этом электроны занимают уровни с более низкой энергией связи (принцип Паули – низкие уровни уже заняты). При этом радиус атома инертного газа увеличивается, ослабевает связь внешних электронов с ядром – они наиболее подвержены сдвигу во внешнем поле. Существует три вида поляризации и соответствующей им поляризуемости – электронная, ядерная и ориентационная. Последняя зависит от температуры и от постоянного дипольного момента молекулы (атома), возникновение которого связано с разностью электроотрицательностей (взаимодействующих) атомов и смещением электронной плотности (заряда) от менее к более отрицательному атому. Электронная поляризуемость является мерой деформации электронных орбиталей и она имеет тот же порядок, что и размеры орбиталей – порядок r3 ( r – Боровский радиус). Существует три типа сил ван-дер-ваальса: ориентационные, индукционные и поляризационные. Индукционные (поляризационные) и дисперсионные силы действуют между полярной (Н2О) и неполярной молекулой (атомом) инертного газа. Эти силы возникают в тех случаях, когда нейтральная молекула реального газа находится в электрическом поле, созданном другой (другими) молекулами. Молекулы должны обладать высокой поляризуемостью. Под поляризацией атомов понимается смещение электрических зарядов в атомарных системах под действием электрического поля Е. В результате такого смещения у этих частиц (атомов) появляется дипольный момент р. Такой индуцированный дипольный момент р исчезает при выключении поля (разрушении, например, кластера инертного газа). В жидкости к внешнему полю добавляется Евнутреннее, создаваемое окружающими частицу зарядами других атомов и молекул. В относительно слабых полях зависимость р от Е является линейной 29 р = αεоЕ, где α –количественная мера поляризуемости (поляризуемость), имеет размерность объема; Е – электрическое поле в месте нахождения атома инертного газа. Статистическому полю отвечает статическое значение поляризуемости (Богословский С.В., 2001). Для инертных газов характерно индукционное взаимодействие с молекулами Н2О водной полости. Именно оно возникает при взаимодействии неполярных молекул (атомов) с полярными. Полярные молекулы воды действуют на неполярный атом инертного газа и вызывают в нем образование так называемого индуцированного дипольного момента (μинд = αF, где F – напряженность поля, α – поляризуемость молекулы) имеет то же направление, что и постоянный диполь. Энергия этого взаимодействия убывает пропорционально шестой степени расстояния (u ~1/r) и не зависит от температуры. Это связано с тем, что ориентация наведенного диполя не может быть хаотичной, она определяется направлением как у постоянного диполя. Именно такие процессы происходят при взаимодействии инертных газов с водой (в биологической жидкости) и оно значительно для атомов с легкой поляризуемостью (например, Кr , Хе) за счет, вероятно, искажения полостей внедрения. На практике это происходит и под влиянием дисперсионных сил, а взаимодействие называется дисперсионным. Например, атом инертного газа можно представить в виде положительно заряженного ядра и отрицательно заряженных электронов, т.е. как полюса мгновенного диполя. Направление этих диполей меняется с частотой v = 1015 циклов в сек. Поэтому атом не обладает дипольным моментом постоянного направления. В среднем дипольный момент атома равен нулю. При встрече атома инертного газа с молекулой воды с большим дипольным моментом происходит переориентировка мгновенных диполей инертного атома и диполи ориентируются на водный диполь (относительно друг друга). Возникают микродиполи, которые и взаимодействуют. Это уменьшает потенциальную энергию системы на величину энергии дисперсионного взаимодействия. 30 Особенностью дисперсионного взаимодействия является его всеобщность – во всех атомах и молекулах есть движущиеся электроны. Оно является главным и практически единственным источником сил ван-дер-ваальса для неполярных молекул. Именно оно вносит вклад в энергию ионных связей и оно аддитивно. Вклад различных видов взаимодействия в энергию ван-дерваальса можно проследить на следующем примере: Веще­ ство Ar Н2О μ, d 0 1,84 a 1,63 1,48 Ориен­ тацион­ ное 0 36,4 Индук­ ционное 0 1,93 Диспер­ сионное 8,49 9,0 Суммар­ ное 8,49 47,3 Отчетливо видно, что наибольший вклад в силы межмолекулярного взаимодействия вносит дисперсионное взаимодействие. И только в воде явно преобладают силы ориентационного взаимодействия, что указывает на их необычный характер. Электрическое поле не только ориентирует молекулы, но и создает в молекулах дополнительный дипольный момент (эффект Керра). Это очень существенно для инертных газов, атомы которых в отсутствие поля не обладают дипольным моментом. В результате действия поля в веществе возникает определенная ориентация частиц. Тепловое движение препятствует ориентации атомов и молекул, поэтому постоянная Керра убывает с ростом температуры и, вероятно, уменьшением концентрации в кластерах инертных газов, что позволяет вымывать их из углубленной клеточной мембраны. Поскольку электронные оболочки инертных газов замкнутые, то межмолекулярные силы носят поляризационный характер (силы ван-дер-ваальса). Инертные газы обладают очень малой химической активностью, что объясняется жесткой восьмиэлектронной структурой внешнего электронного слоя. Однако, как известно, с увеличением числа электронных слоев поляризуемость атомов растет. Увеличивается и растворимость этих газов (табл. 3). 31 Таблица 3 Некоторые физические характеристики инертных газов Радиус атома, нм Первый потенциал ионизации, эВ Относитель­ ная поля­ ризуемость атома, усл. ед. Энергия воз­ буждённого электрона, эВ Гелий Неон Аргон Криптон 0,122 0,160 0,192 0,198 24,58 21,56 15,76 14,00 1 2 3 12 16,6 11,5 9,9 Ксенон 0,218 12,13 20 8,3 Элемент В воде (биологической жидкости) у атомов индифферентных газов возникает дипольный момент, суть которого состоит в том, что в одной части атома, например Хе, «скапливается» – перераспределяется – больше электронов, чем в другой. Это приводит к разности потенциалов в различных ее областях. Сила притяжения между различными зарядами усиливает связь с окружающими молекулами воды. Чем больше атом инертного газа, тем легче образуется диполь. В работах М.О.Буланина и И.М.Кислякова (1998, 1999) проведен расчет динамических поляризуемостей Не, Ne, Ar, Kr и Хе на основе данных о дифференциальных распределениях дипольных сил этих осцилляторов в широкой области спектров от статистического предела до второго резонансного перехода. Динамические дипольные поляризуемости являются важнейшими электрооптическими параметрами, от которых зависят разнообразные оптические явления, в том числе преломление, фазовый синхронизм, эффект Фарадея и рассеяние излучения в диэлектрических средах. Через дипольные поляризуемости при мнимых частотах выражаются также постоянные С6 межмолекулярного дисперсионного взаимодействия. Значение С6 определяется через динамические по32 ляризуемости взаимодействующих молекул (атомов), в нашем случае – атомов инертных газов и молекул воды в кластере. Задача вычисления статических и динамических поляризуемостей основных возбужденных состояний атомов является очень важной для анализа различных проблем в атомно-молекулярной физике в приложении ее к медицине и биологии. Многоэлектронные эффекты наиболее существенны для основного и нескольких низколежащих возбужденных электронных состояний. По мере увеличения радиуса атома инертного газа поляризуемость быстро растет, что отражает факт ослабления связи внешних электронов с ядром. Явление полярзации служит убедительным доказательством «пластичности» электронной оболочки атомов благородных газов. Например, поляризуемость гелия по абсолютной величине в несколько раз меньше поляризуемостей Ne и Ar. Эффекты поляризуемости наблюдаются как в конденсированном, так и в газовом состоянии. При неизменном составе вещества и его заданной плотности поляризуемость атомов и молекул является основным фактором воздействия на электронную оболочку относительно слабыми полями. Слабыми, поскольку эти поля обычно меньше полей в атомах и молекулах на 3-4 порядка (Потапов А.А., 2003). При обычных напряженностях полей имеет место линейная поляризация и мерой деформации электронных оболочек служит диэлектрическая восприимчивость. Появлению поляризации, возникновению дипольного момента у инертных газов способствует взаимная деформация распределения электрических зарядов в атомах (молекулах) во время соударения. Поскольку электрический дипольный момент, индуцируемый в молекулах в момент соударения и вызывающий метастабильность, является функцией поляризуемости молекул, он изменяется при тех колебаниях молекул, которые происходят с изменением поляризуемости (Филимонов В.Н., 1959). Способность тяжелых атомов инертных газов приобретать электрический дипольный момент р в электрическом поле Е молекул 33 воды в кластере рассматривалась уже давно, однако никто не связывал ее с возможно основным механизмом возникновения наркоза. В электрическом поле кластеров заряды инертного газа (электроны) смещаются один относительно другого – у атома появляется индуцированный дипольный момент, который исчезает при разрушении кластера или разрушении его термодинамического равновесия. Понятие поляризуемость, как правило, не относится к частицам, обладающим постоянным дипольным моментом. Для инертных газов характерна электронная поляризуемость. Она обусловлена смещением в поле Е внешних электронных оболочек относительно атомного ядра инертного газа. Величина α для атомов инертных газов составляет порядка их объема (~10-24 см3), а время релаксации ~10-14 – 10-15с. В нашем случае электрическое поле молекул воды в кластере является статическим и оно соответствует статическому значению поляризуемости атомов инертных газов, отражая их индивидуальные физико-химические характеристики. Под действием электрического поля молекул воды кластера электронные облака атома инертного газа смещаются относительно ядер на расстояния, меньше самого размера атома. Поляризация различна для различных квантовых состояний атома, соответствующих той же его энергии. Возможно, появление явления Штарке (расщепление уровней энергии). Электронная поляризуемость атома инертного газа ае служит мерой его устойчивости (деформируемости). На внутренней поверхности кластера (сетки водородных связей) сумма дипольных моментов молекул воды не равна нулю, т.е. заряды молекулы воды строго ориентированы и поверхность таким образом обладает электрическим полем. Происходит поляризация атома инертного газа, если сродство к электрону внутренней поверхности кластера инертного газа велико. Детальное рассмотрение и расчет вклада ван-дер-ваальсовых сил во взаимодействие атомов с поверхностью конденсированной среды, а также вклад в свободную энергию этих сред, приведен в работе Ю.С.Бараша и В.Л. Гинзбурга (1984). 34 Частота собственных колебаний кластера (вибратора) инертного газа или ассоциата воды жестко связана с их размерами (количеством молекул Н2О в структуре). В связи с этим, например, при полной идентичности L- и D- изомеров морфина по своим химическим свойствам, они будут отличаться друг от друга пространственными частотными характеристиками (основными частотами) и, самое главное, вектором поляризации. В этом смысл различия силы наркотического действия изомеров. Даже при одной частоте кластеров двух изомеров у них будет различаться направленность (поляризованность) испускаемого излучения. Значение вектора поляризации кластера Хе (ассоциата Н2О) в эффекте возникновения наркоза прямо доказывает, что сигнал от кластера Хе представляет собой электромагнитную волну, взаимодействующую с существующими комплексами на поверхности мембраны нервной клетки (внутри клетки), который также формирует монохроматические излучения дискретных волн (поля). При прохождении волнового сигнала, например, от кластера наркотического вещества, к воспринимающей структуре на мембране нервной клетки (белковым головкам) необходим однонарпавленный с полем организма вектор поляризации, иначе при движении сигнала в поле, Рис.1 Схематическое изображение случая электронного взаимодействия в процессе физической адсорбции. 35 имеющем противоположный вектор, левовращательный вектор сильного поля организма и правовращающий вектор сигнала от кластера (например, D-изомера морфина) сложатся, и сигнал от кластера исчезнет, не дойдя до воспринимающей структуры. Все зависимости радиусов α (α) дают наглядное представление о характере поведения поляризуемости как свойства атомов к упругой деформации в ряду закономерного изменения их радиусов. По мере увеличения радиуса поляризуемость начинает быстро расти, отражая факт ослабления связи внешних электронов с ядром. С другой стороны, поляризуемость сильно зависит от выбора расстояния ядра до места локализации электронного заряда, т.е. от выбора типа радиуса атома. Поляризуемость атомов благородных газов от «различных» радиусов представлена в табл.4. Многочисленные исследования подтверждают простую связь между поляризуемостью и радиусом α атомов и ионов (Потапов А.А., 2004). αе = кα3 или αе = (α)1/3 Таблица 4 Поляризуемость и радиусы атомов благородных газов (Потапов А.А., 2005) Атом H He Ne Ar Kr Xe α · 1024, см3 αо Å αе Å αк Å αВ Å αв Å αм Å 0,667 0,205 0,396 1,640 2,484 4,0 0,53 0,29 0,354 0,66 0,79 0,99 0,87 0,58 0,73 1,18 1,41 1,58 0,96 1,18 1,45 1,60 1,77 1,2 1,25 1,60 1,92 1,98 2,18 0,26 1,1 1,3 1,83 2,1 2,47 0,54 0,85 1,03 1,44 -Радиусы: α0 – орбитальный; αе – «поляризационный»; αк и αв – кинетические; αВ – ван-дер-вальсов; αм – магнитный. 36 Где αе – электронная поляризуемость атомов и ионов; к – коэффициент, равный 1, или больше, или меньше ее. Формулу можно объяснить тем, что в силу сферической симметрии атомов (и ионов) у них появляется только один вид поляризации – электронный, а для описания их структуры достаточно лишь одного параметра – радиуса. Таблица рассчитана при к=1. Электронной поляризуемостью обладают все без исключения вещества. Свойства и динамика водных кластеров (Н2О)n – предмет активных исследований. В отличие от металлических кластеров с их фиксированной пространственной структурой, водные кластеры размером от нескольких до нескольких десятков молекул даже при температурах ниже комнатной, остаются жидкими: у таких кластеров есть много равноправных форм, между которыми они непрерывно перескакивают. Такая особенность водных кластеров отражается и на их электрических свойствах. Как известно уже более полувека, молекула воды полярна. Положительные и отрицательные заряды в ней слегка смещены друг относительно друга, и в результате она обладает довольно большим дипольным моментом и создает вокруг себя электрическое поле. Результаты экспериментов, проведенных исследовательской группой из Университета Южной Калифорнии и опубликованные в статье R. Moro et al., Physical Review Letters, 97, 123401 (18 September 2006), доказали, что кластеры, содержащие от 3 до 18 молекул воды, тоже обладают большим дипольным моментом. Непосредственное измерение дипольного момента кластеров разного размера уже само по себе имеет большое значение для понимания структуры воды. Действительно, получается, что когда кластеры воды «складываются» в сплошную среду, они чувствуют друг друга не только через непосредственный контакт, но и через электрическое взаимодействие диполей. Характер движения молекул оказывает влияние на устойчивость и структуру водного агрегата. Кластеры, содержащие от 10 до 50 молекул воды, обладают дипольным моментом, достигающим значения 15Д. Кластеры воды, содержащие десять и более молекул, электрически более упорядочены, чем маленькие и остаются жидкими в окрестности, температуры '233 К (Рахманова О.Р., 2009). 37 Переход вещества из одной среды в другую – фазовый переход – всегда связан с качественными изменениями свойств элемента. Примером фазового перехода могут служить изменения агрегатного состояния вещества или переходы, связанные с изменениями в составе, строении и свойствах вещества. В данном случае мы имеем фазовый переход второго рода, который не связан с поглощением или выделением теплоты и изменением объема. Этот переход характеризуется постоянством объема и энтропии, но скачкообразным изменением теплоемкости. Согласно трактовке Л.Д.Ландау (1908-1968) фазовые переходы второго рода связаны с изменением симметрии: выше точки перехода система (инертный газ) обладает более высокой симметрией. Переход инертного газа (например, ксенона) из одной фазы в другую, из основного состояния в метастабильное, поляризационное с образованием диполя при изменении концентрации, магнитного и электрического полей внутри ассоциатов воды биологической жидкости может иметь место. Этому, в первую очередь, способствовует низкий потенциал возбуждения внешних электронов (8,2 эВ), высокий диполь молекул Н2О и ее ассоциатов, широкие возможности кооперативных эффектов этих процессов, поляризация внешних электронов инертного газа электрическим полем внутри водной полости и т. д. При этом происходит качественный скачок на энергетическом (диполь) уровне. Фазовые переходы подчиняются определенным закономерностям, в основе которых лежит понятие равновесия фаз. Это равновесие характеризуется константой равновесия, которая зависит от температуры и давления (концентрации). Константа фазового равновесия элемента характеризуется отношением мольной доли компонента в газовой фазе к мольной доле этого компонента в жидкой фазе, находящейся в равновесном состоянии с газовой фазой. Для определения равновесного состояния газожидкостных смесей используются законы Дальтона и Рауля. В данном случае можно говорить о квантовом фазовом переходе (квантовое фазовое превращение) – переход инертного газа из 38 основного состояния (одной термодинамической фазы) в состояние с приобретением заряда (диполя) происходящее при отсутствии тепловых флуктуаций. Таким образом, система перестраивается под действием нетепловых параметров (например, давления, концентрации, магнитного и электрического полей). Квантовые флуктуации могут переводить систему в другую биофазу. Характерной особенностью фазового превращения инертного газа в биологической жидкости является резкое изменение его свойств (как в прямом, так и в обратном превращении). Фазовые переходы могут быть связаны с изменением давления (концентрации) (Ландау Л.Д., 1937)*. Вблизи точки фазовых переходов второго рода, фазы мало отличаются друг от друга. Однако, такой фазовый переход для инертного газа (биофаза), каким бы необычным он не был, все же есть постоянное фазовое превращение всей системы (биологической жидкости), поскольку он существенным образом сказывается на всех биологических параметрах. Вот здесь и происходит то, чего ранее не замечали многие исследователи – полярность инертных газов при растворении в воде увеличивается пропорционально их атомной массе! Получается, что чем больше приобретается полярность, тем сильнее наркотическое действие. Чем больше размер атома инертного газа, тем больше образуемый дипольный момент. Соответственно, ксенон самый сильный анестетик. Все становится на свои места – не может нейтральная (инертная) молекула (атом) быть наркотиком. Именно это незначительное изменение в структуре или пространственной ориентации приводит к весьма существенным изменениям свойств вещества (инертного газа), которые отражаются на функциях биологических объектов. В данном случае – вызывает наркоз. Зависимость результата (силы наркоза) от концентрации (парциального давления) кластеров благородных газов указывает на значении интенсивности потока излучения (волн) от кластера для достижения порога активации структур на клеточной мембране (в данном случае – активации торможения). Известно, что информатив* Ландау Л.Д., Лифшиц Е.М. Статическая физика. – М.:-1976, изд. 3,ч.1 39 ные дозы излучений оптического диапазона клетками имеют низкую интенсивность (от нескольких десятков до сотен фотонов на 1 см2; для зрительного анализатора достаточно одного фотона). Снижение (увеличение) потока фотонов через единицу площади в единицу времени (интенсивности излучения) до порога нечувствительности (чувствительности) неизбежно должны привести или к толерантности, или к параличу нервной клетки, ибо в обоих случаях, связаны с недостаточной или избыточной концентрацией (парциальным давлением) кластеров инертных газов (осцилляторов). Осцилляции (волновое воздействие) кластеров благородных газов необходимо рассматривать с позиций чужеродности для живого организма его волнового воздействия на нервную клетку (~ > 800 нм), определяемых дипольным моментом, вектором поляризации излучения, резонансными границами (диапазонами) частоты воспринимающей молекулы, а также от интенсивности потока излучения (фотонов) от кластера, зависящей от концентрации (парционального давления) инертного газа (или другого вещества). Число биофизических критериев, которые имеют непосредственное отношение к возникновению механизмов наркоза четко соответствуют числу основных параметров излучения любого диполя (магнитная восприимчивость, поляризация, дипольный момент составляющих, конформация и т.д.). Таким образом, водные структуры биологических жидкостей совместно с индифферентными газами могут создавать осцилляторы, способные волновыми взаимодействиями вызывать наркоз. Поскольку силы сцепления между атомами инертных газов и воды очень малы, то и рассыщение происходит легко и быстро, без затрат энергии. Оставшиеся без инертного газа пустоты воды в биологической жидкости (ассоциаты) становятся более компактными за счет сокращения водородных связей, изменения углов соединения этих связей и оставшейся после молекул инертных газов потенциальной инергии. Это более активные формы ассоциатов (плотностей молекул Н2О) с излучением ~350 – 550 нм. 40 ЗАКЛЮЧЕНИЕ В представленной работе нами предлагается ряд новых методических подходов при изучении механизма действия инертных газов на биологические системы: 1. Обращается внимание на оценку состояния инертного газа перед поступлением его в организм (увеличение метастабильных атомов и т.п.). 2. Рассматривать физико-химические и биологические свойства отдельно у легких (Н2, Не, Nе) и тяжелых (Ar, Kr, Xe и N2) инертных газов. 3. Результаты взаимодействия инертных газов с биологическими объектами, в т.ч. и человеком, оценивать с точки зрения непосредственного действия инертных газов и их последствия. 4. Механизм действия инертных газов на биологические объекты рассматривать с позиции образования единого действующего комплекса: индифферентный газ и молекулы воды биологических жидкостей (кластеры, клатраты, газогидраты, включения – независимо от синонима). 5. Поляризация и возникновение дипольного момента – это самое главное во всех физико-химических и биофизических взаимодействиях инертных газов с биосистемами и т.д. В дальнейших исследованиях необходимо целенаправленно, исходя из физико-химических, биофизических, биологических свойств живых систем, выявить закономерности в поведении водобиологических систем – гидрофобно-гидрофильный гость при нормальном атмосферном давлении и температуре. Оценить информацию о структурах и составах образующихся клатратных гидратов (кластеров), а также энергетических эффектах, сопровождающих эти процессы. Необходимо рассмотреть влияние энтропийного факта на устойчивость водно-газовых образований в биологических системах. 41 ЛИТЕРАТУРА 1. Абросимов В.К., Крестов Г.А., Виноградов В.И. Современные проблемы химии растворов. – М.: Наука. – 1986.-С.97 2. Абросимов В.К., Ефремова Л.С., Иванова Е.В., Панкратов Ю.П. Изменение структуры воды под влиянием растворенных компонентов воздуха // Журнал физ. химии. – 2000.- Т.74,№5.С.854-857. 3. Бараш Ю.С., Гинзбург В.Л. Некоторые вопросы теории сил вандер-ваальса // Успехи физических наук. – 1984. Т.143, вып.3. – С.345-383. 4. Богословский С.В. Физические свойства газов и жидкостей (Учебное пособие). – СПб.:2001. – 73с. 5. Буланин М.О., Кисляков Н.М. Динамические поляризуемости атомов благородных газов. Криптон и ксенон //Оптика и спектроскопия…1998, №6 – 897-903 с. 6. Буланин М.О., Кисляков Н.М. Динамические поляризуемости атомов благородных газов. Гелий, неон и аргон // Оптика и спектроскопия. – 1999. №5. – с.86. 7. Волькенштейн М.В. Биофизика. – М.: Наука. – 1981. – 575с. 8. Дисперсионное взаимодействие // Химическая энциклопедия. т.2. – М.: Советская энциклопедия, 1990. – С.78. 9. Довгуща В.В., Лехтлаан-Тыниссон Н.П., Довгуша Л.В. Вода – привычная и парадоксальная. – СПб.: 2007. – 242с. 10. Довгуша В.В., Следков А.Ю. Достижения и перспективы изучения действия индифферентных газов под повышенным давлением на молекулярном и клеточном уровнях // В кн. Индифферентные газы в водолазной практике, биологии и медицине. – М.: Фирма «Слово». – 2000. С. 48-53. 11. Довгуша В.В., Следков А.Ю. Индифферентные газы, рецепция и наркоз. – СПб.: 2006.-102с. 12. Довгуша В.В., Фок М.В., Зарицкая Г.А. Возможный молекулярный механизм наркотического действия инертных газов // Биофизика, 2005, Т.50, вып. 5. – С. 903-908. 42 13. Довгуша В.В. Биофизические механизмы физиологического, биологического действия ксенона (инертных газов). – М.: 2009. 14. Довгуша В.В., Довгуша Л.В. Морфопатогенез и изменения физико-химических свойств биологических жидкостей // Международный форум «Биофизтехнологии». Биосистемы, физические поля и технологии для здоровья человека. – СПб.: 27-29 ноября 2008. –С.18-27. 15. Довгуша В.В. Дискуссионные вопросы действия индифферентных газов на организм. – СПб.: ООО «Пресс-Сервис», 2011. – 115с. 16. Довгуша В.В. Водогазовые структуры в природе, биологии и медицине.- СПб.: ООО «Пресс-Сервис», 2011. – 151с. 17. Косяков В.И., Шестаков В.А. // Журнал физической химии. – 1999, т. 40, №2.-С.287-295. 18.Косяков В.И., Шестаков В.А. Расчет растворимости инертных газов во льду с использованием двух моделей твердых растворов // Электронный научный журнал «Исследование в России». – 2006. 163 pdf. 19. Крестов А.Г., Абросимов В.К. Термодинамическая характеристика связанных с гидратацией ионов структурных изменений воды при различных температурах // Журнал структур. химии. – 1964. –Т.5. – С.510-516. 20. Лазарев Н.В. Наркотики.- Л.: 1940. -400с. 21. Лазарев Н.В. Биологическое действие газов под давлением. – Л.: Изд.ВМедА, 1941.-219с. 22. Лазарев Н.В. Общее учение о наркотиках и наркозе. – Л.: Изд. ВМедА, 1958. – 124с. 23. Павлов Б.Н. Физиологическое действие индифферентных газов при нормальном и повышенном давлении. Дисс. доктора мед. наук. – М.: – 1998.- 233с. 25. Потапов А.А. Вариальная теория деформационной поляризации // Химия и компьютерное моделирование. Бутлеровские сообщения. 2003. №2. – С. 33-41. 43 26. Потапов А.А. Деформационная поляризация: поиск оптимальных моделей. – Новосибирск: Наука, 2004. – 511с. 27. Потапов А.А. Абсолютный радиус многоэлектронных атомов по данным их поляризуемости. Электронный журнал «Исследовано в России». – 2005. 28. Филимонов В.Н. Индуцированное поглощение молекулами инфракрасного излучения // Успехи физических наук. 1959. – Т. LXIX. вып. 4. – С. 565-590. 29. Финкильштейн Д.Н. Инертные газы. –М.: Наука. – 1979. – 200с. 44