Коэффициенты диффузии метана. Процесс растворения газа.
advertisement
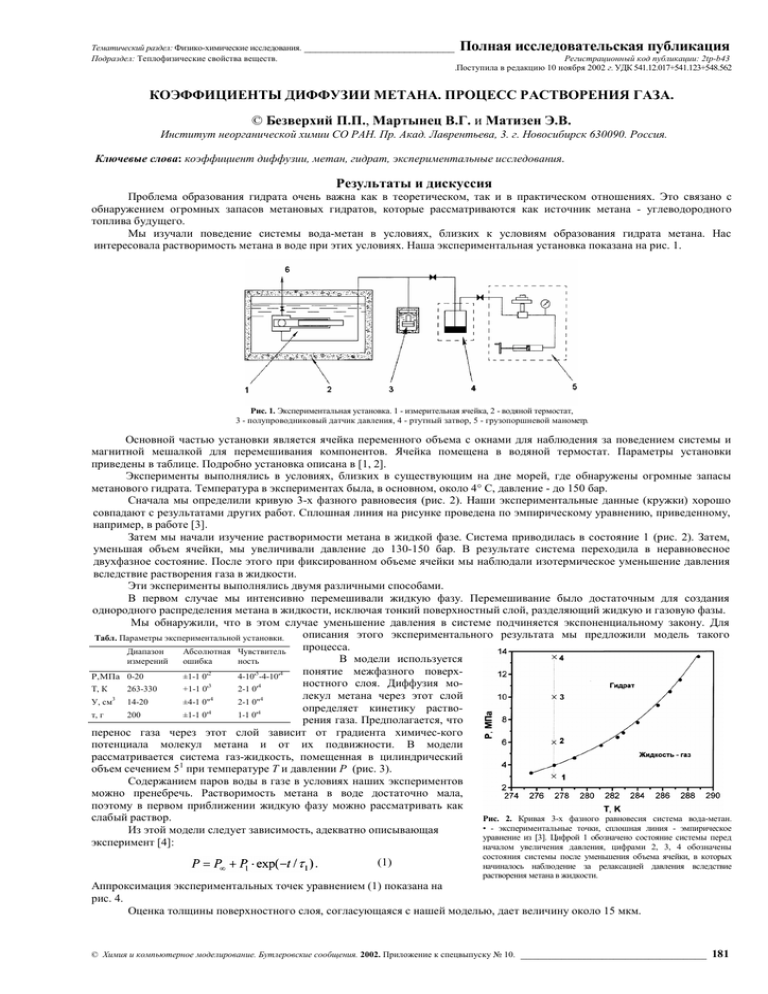
Тематический раздел: Физико-химические исследования. ___________________________ Подраздел: Теплофизические свойства веществ. Полная исследовательская публикация Регистрационный код публикации: 2tp-b43 .Поступила в редакцию 10 ноября 2002 г. УДК 541.12.017+541.123+548.562 КОЭФФИЦИЕНТЫ ДИФФУЗИИ МЕТАНА. ПРОЦЕСС РАСТВОРЕНИЯ ГАЗА. © Безверхий П.П., Мартынец В.Г. и Матизен Э.В. Институт неорганической химии СО РАН. Пр. Акад. Лаврентьева, 3. г. Новосибирск 630090. Россия. Ключевые слова: коэффициент диффузии, метан, гидрат, экспериментальные исследования. Результаты и дискуссия Проблема образования гидрата очень важна как в теоретическом, так и в практическом отношениях. Это связано с обнаружением огромных запасов метановых гидратов, которые рассматриваются как источник метана - углеводородного топлива будущего. Мы изучали поведение системы вода-метан в условиях, близких к условиям образования гидрата метана. Нас интересовала растворимость метана в воде при этих условиях. Наша экспериментальная установка показана на рис. 1. Рис. 1. Экспериментальная установка. 1 - измерительная ячейка, 2 - водяной термостат, 3 - полупроводниковый датчик давления, 4 - ртутный затвор, 5 - грузопоршневой манометр. Основной частью установки является ячейка переменного объема с окнами для наблюдения за поведением системы и магнитной мешалкой для перемешивания компонентов. Ячейка помещена в водяной термостат. Параметры установки приведены в таблице. Подробно установка описана в [1, 2]. Эксперименты выполнялись в условиях, близких в существующим на дне морей, где обнаружены огромные запасы метанового гидрата. Температура в экспериментах была, в основном, около 4° С, давление - до 150 бар. Сначала мы определили кривую 3-х фазного равновесия (рис. 2). Наши экспериментальные данные (кружки) хорошо совпадают с результатами других работ. Сплошная линия на рисунке проведена по эмпирическому уравнению, приведенному, например, в работе [3]. Затем мы начали изучение растворимости метана в жидкой фазе. Система приводилась в состояние 1 (рис. 2). Затем, уменьшая объем ячейки, мы увеличивали давление до 130-150 бар. В результате система переходила в неравновесное двухфазное состояние. После этого при фиксированном объеме ячейки мы наблюдали изотермическое уменьшение давления вследствие растворения газа в жидкости. Эти эксперименты выполнялись двумя различными способами. В первом случае мы интенсивно перемешивали жидкую фазу. Перемешивание было достаточным для создания однородного распределения метана в жидкости, исключая тонкий поверхностный слой, разделяющий жидкую и газовую фазы. Мы обнаружили, что в этом случае уменьшение давления в системе подчиняется экспоненциальному закону. Для описания этого экспериментального результата мы предложили модель такого Табл. Параметры экспериментальной установки. процесса. Диапазон Абсолютная Чувствитель В модели используется измерений ошибка ность понятие межфазного поверхР,МПа 0-20 ±1-1 0'2 4-10'5-4-10'4 ностного слоя. Диффузия моТ, К 263-330 +1-1 0'3 2-1 0'4 лекул метана через этот слой 3 4 4 У, см 14-20 ±4-1 0" 2-1 0" определяет кинетику раство4 4 т, г 200 ±1-1 0' 1-1 0' рения газа. Предполагается, что перенос газа через этот слой зависит от градиента химичес-кого потенциала молекул метана и от их подвижности. В модели рассматривается система газ-жидкость, помещенная в цилиндрический объем сечением 51 при температуре Т и давлении Р (рис. 3). Содержанием паров воды в газе в условиях наших экспериментов можно пренебречь. Растворимость метана в воде достаточно мала, поэтому в первом приближении жидкую фазу можно рассматривать как слабый раствор. Рис. 2. Кривая 3-х фазного равновесия система вода-метан. • - экспериментальные точки, сплошная линия - эмпирическое Из этой модели следует зависимость, адекватно описывающая уравнение из [3]. Цифрой 1 обозначено состояние системы перед эксперимент [4]: началом увеличения давления, цифрами 2, 3, 4 обозначены (1) состояния системы после уменьшения объема ячейки, в которых начиналось наблюдение за релаксацией давления вследствие растворения метана в жидкости. Аппроксимация экспериментальных точек уравнением (1) показана на рис. 4. Оценка толщины поверхностного слоя, согласующаяся с нашей моделью, дает величину около 15 мкм. © Химия и компьютерное моделирование. Бутлеровские сообщения. 2002. Приложение к спецвыпуску № 10. ________________________________ 181 Полная исследовательская публикация ________________________________ Безверхий П.П., Мартынец В.Г. и Матизен Э.В. При втором типе экспериментов растворение газа происходило без перемешивания жидкой фазы. Было обнаружено, что экспериментальные точки в этом случае в пределах точности измерений описываются двухэкспоненциальной зависимостью. Рис. 3. Экспериментальные точки, полученные при перемешивании жидкой фазы раствора, и их аппроксимация уравнением (1), следующим из первой модели. Рис. 4. Экспериментальные точки, полученные без перемешивания жидкой фазы раствора, и их описание уравнением (7), следующим из второй модели. Мы рассмотрели особенности такого процесса и предложили вторую модель растворения метана в неподвижной жидкости. В отличие от первого случая здесь принимается во внимание диффузия газа, как через поверхностный слой, так и в жидкой фазе. Раствор метана в жидкой фазе также предполагается слабым. Уравнения, определяющие перенос газа в жидкость можно записать следующим образом: (2) (3) (4) Здесь (2) – уравнение баланса чисел частиц в замкнутой системе метан-вода, (3) – уравнение диффузии метана в воде, (4) – равенство потоков метана через слой в жидкой фазе при х=0, u0 , v0 , ∆u(t), ∆v(t)начальные значения плотности числа частиц метана в газе и в жидкости и их значения, соответственно. Начальные играничные условия для решения уравнений имеют вид: (5) Для решения этой системы уравнений мы использовали преобразования Лапласа, сводящие дифференциальные уравнения к системе обыкновенных дифференциальных уравнений (р-представление). Найдя в р - представлении выражения для изменения плотности метана в газовой и жидкой фазах - ∆ u(p), ∆ v(0,p) , ∆ v(x,p) , ∆ v(h,p), и переходя от образов к оригиналам, мы получили искомые зависимости изменения плотности числа частиц в зависимости от времени в виде рядов. Изменение плотности числа частиц в газе имеет вид: (6) L -1/2 Здесь λ=(hD ) , b= u0Hh/ v0DL , g=u0Hδ/v0D. Переходя от плотности числа частиц к давлению, мы получили закон уменьшения давления вследствие растворения газа в неподвижной жидкости: (7) где P∞ , P1 , P2 - коэффициенты, зависящие от λ, b, g. Сравнение с экспериментом показало, что в нашем случае можно ограничиться двумя первыми членами этого ряда. Это как раз с точностью до экспериментальной погрешности соответствует зависимости, найденной нами при аппроксимации экспериментальных данных. На рис. 5 показано сравнение экспериментальных точек с модельной кривой (7). 182 _______ http://chem.kstu.ru __________ © Chemistry and Computational Simulations. Butlerov Communications. 2002. Supplement to Special Issue No. 10. 181-183 Часть коэффициентов в (7) определялась из начальных условий опыта: u0, v0 , H, h, коэффициент находили по экспериментальному значению р∞ , подгоночными параметрами являлись коэффициент В. Наилучшее описание моделью экспериментальных точек получилось при D =5-10-9 м2/с, DL =2.5-10" м/с. Среднеквадратичная погрешность представления моделью экспериментальных данных равна 0.013 МПа при начальном давлении эксперимента -14 МПа (0.1%). Как видно из результатов аппроксимации, коэффициент диффузии в неподвижной воде DL меньше, чем в слое - D. Можно предположить, что такое отличие возникает из-за существования в толще раствора неполных фрагментов гидратов метана (прекурсоров), которые имеют большой радиус. В соответствие с теорией Стокса-Эйнштейна [5] это приводит к уменьшению переноса метана в неперемешиваемой воде, по сравнению с переносом в межфазном слое (DL <D), так как в слое из-за его малой Pис. 5. толщины прекурсоры не успевают образоваться. Таким образом, наша работа дает полезную информацию о кинетических особенностях начальной стадии образования гидрата при растворении метана в воде. Отметим, что полученные нами результаты полезны и для описания растворения других газов с малой растворимостью. Работа поддержана Интеграционной программой СО РАН «Газовые гидраты в природных экосистемах». КОЭФФИЦИЕНТЫ ДИФФУЗИИ МЕТАНА. ПРОЦЕСС РАСТВОРЕНИЯ ГАЗА ______________________________________________________________ Литературa [1] V.G. Martynets, Е.V. Маtizen , N.V. Kuskova, V.F. Kukarin. Critical lineof (xenon+carbon dioxide). J. Chem. Thermodynam. 1999. V.31. Р.191. [2] Безверхий П.П., Кускова КВ., Мартынец В.Г., Матизен Э.В. Метастабильная область и кривые равновесия фаз при образовании и распаде гидрата метана. Химия в интересах устойчивого развития. 1999. Т.7. С.643. [3] Y.Р.Напда. Effect of hydrostatic pressure and salinity on the stability of gas hydrates. J. Phys. Chem.1990. Vо1.94. No.6. Р.2652. [4] Мартынец В.Г., Афанасьев КС., Безверхий П.П., Кускова КВ., Матизен Э.В. Равновесные и кинетические свойства гидрата метана. ТОХТ. 2002. Т.36. №4. С.1. [5] Афанасьев И.С., Безверхий К.П., Мартынец В.Г., Матизен Э.В. Нестационарная абсорбция метана водой перед образованием гидрата. ДАН. 2001. Т.381. №4. С.499. [6] Ландау Л.Д., Лифшиц Е.М. Механика сплошных сред. М.: Гостехтеориздат. 1953. © Химия и компьютерное моделирование. Бутлеровские сообщения. 2002. Приложение к спецвыпуску № 10. ______ E-mail: info@kstu.ru ___________ 183
