10. ФЕНОЛЫ
advertisement
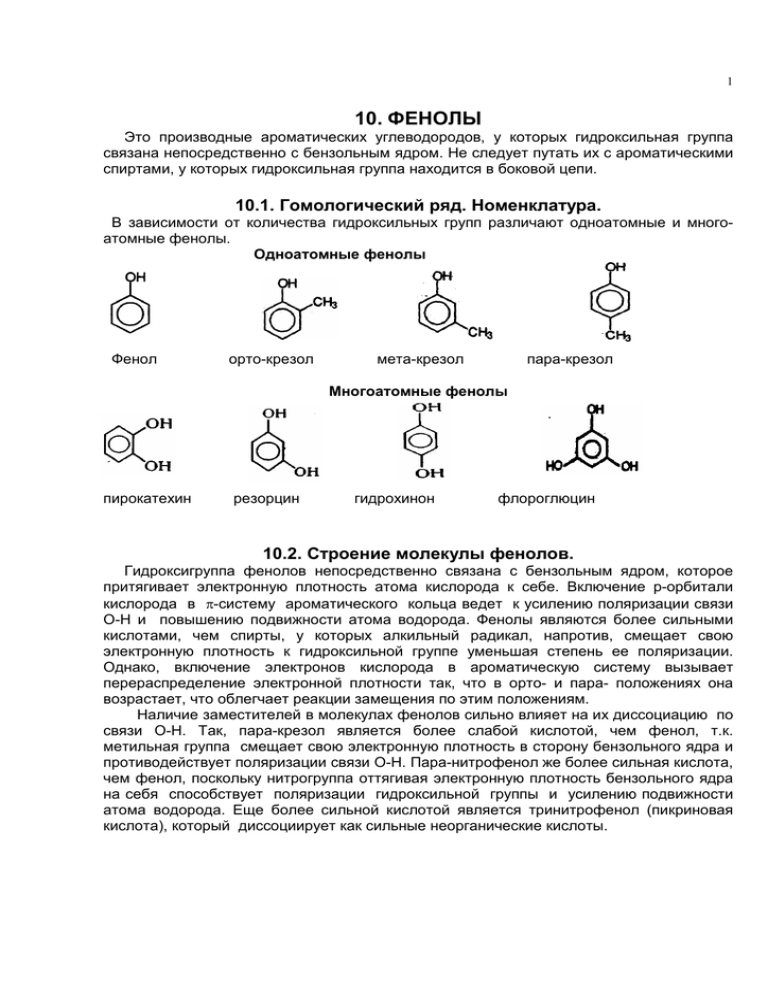
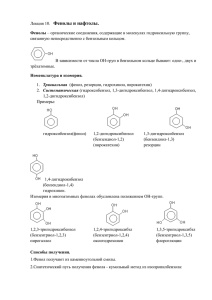
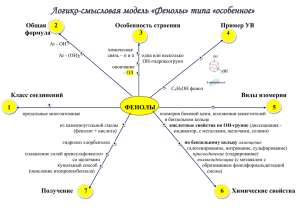
1 10. ФЕНОЛЫ Это производные ароматических углеводородов, у которых гидроксильная группа связана непосредственно с бензольным ядром. Не следует путать их с ароматическими спиртами, у которых гидроксильная группа находится в боковой цепи. 10.1. Гомологический ряд. Номенклатура. В зависимости от количества гидроксильных групп различают одноатомные и многоатомные фенолы. Одноатомные фенолы Фенол орто-крезол мета-крезол пара-крезол Многоатомные фенолы пирокатехин резорцин гидрохинон флороглюцин 10.2. Строение молекулы фенолов. Гидроксигруппа фенолов непосредственно связана с бензольным ядром, которое притягивает электронную плотность атома кислорода к себе. Включение р-орбитали кислорода в π-систему ароматического кольца ведет к усилению поляризации связи О-Н и повышению подвижности атома водорода. Фенолы являются более сильными кислотами, чем спирты, у которых алкильный радикал, напротив, смещает свою электронную плотность к гидроксильной группе уменьшая степень ее поляризации. Однако, включение электронов кислорода в ароматическую систему вызывает перераспределение электронной плотности так, что в орто- и пара- положениях она возрастает, что облегчает реакции замещения по этим положениям. Наличие заместителей в молекулах фенолов сильно влияет на их диссоциацию по связи О-Н. Так, пара-крезол является более слабой кислотой, чем фенол, т.к. метильная группа смещает свою электронную плотность в сторону бензольного ядра и противодействует поляризации связи О-Н. Пара-нитрофенол же более сильная кислота, чем фенол, поскольку нитрогруппа оттягивая электронную плотность бензольного ядра на себя способствует поляризации гидроксильной группы и усилению подвижности атома водорода. Еще более сильной кислотой является тринитрофенол (пикриновая кислота), который диссоциирует как сильные неорганические кислоты. 2 Фенол крезол пара-нитрофенол тринитрофенол 10.3. Физические и химические свойства фенолов. Фенолы это кристаллические вещества, плохо растворимы в холодной воде, но хорошо в горячей. Фенолы как и спирты склонны к образованию водородных связей. Наличие подвижного атома водорода в гидроксильной группе обеспечивает кислотные свойства фенолов, которые выражены сильнее, чем у спиртов. Фенол поэтому, еще называют карболовой кислотой. В отличие от спиртов фенолы почти не вступают в реакции, в которых гидроксигруппа отщепляется целиком, что связано с включением электронной плотности кислорода в ароматическую систему и повышением прочности связи между кислородом и бензольным ядром. Фенолы способны также вступать в реакции замещения, характерные для ароматических соединений. Кислотные свойства фенолов. 1. Фенолы в водных растворах диссоциируют с образованием ионов Н+, что можна заметить по изменению цвет кислотно-основных индикаторов (спирты подобными свойствами не обладают). Однако фенолы это слабые кислоты (слабее угольной кислоты). - C6H5OH С6Н5O + H + 2. Фенолы образуют со щелочными металлами и щелочами стойкие феноляты (спирты со щелочами не взаимодействуют, а только с щелочными металлами). 2C6H5OH + 2Na → 2С6Н5ONa + H2 С6H5OH + NaOH → С6Н5ONa + H2O 3. Феноляты устойчивы в водных растворах, но разрушаются под влиянием кислот. C6H5ONa + HCl → С6Н5OH + NaCl C6H5ONa + CO2 + H2O → С6Н5OH + NaHCO3 4. Фенолы образуют сложные эфиры с ангидридами карбоновых кислот, но не с самими кислотами (спирты дают сложные эфиры как с теми, так и другими). В реакции этерификации происходит замещение атома водорода гидроксигруппы на остаток кислоты. С6H5OH + CH3СOCl → С6H5-O-CO-CH3 + HCl фенилацетат 5. Фенолы образуют простые эфиры при взаимодействии с галогеналканами и спиртами. С6H5ONa + C2H5I → С6H5-O-C2H5 + NaI; фенетол С6H5OH + CH3OH → С6H5-O-CH3 + H2O анизол 3 6. В отличие от спиртов гидроксигруппа фенолов не замещается на галоген, а под влиянием РCl3, PCl5, SOCl2 происходит хлорирование бензольного ядра. 7. Качественной реакцией на фенолы является взаимодействие с хлоридом железа(III), При этом образуется комплексное соединение фиолетового цвета. Окисление фенолов Окисление фенолов идет даже на воздухе. Поэтому фенолы окрашены в розовый цвет продуктами окисления. Первым продуктом окисления фенола является гидрохинон, а затем хинон. Двухатомные фенолы окислении образуют хиноны. + О2 + → H2O Реакции замещения в бензольном ядре 1. Взаимодействие фенолов с бромной водой. Гидроксильная группа фенола ориентирует бром в орто- и пара-положения. Это качественная реакция на фенолы (выпадает белый осадок 2,4,6-трибромфенола). + → 3Br2 + 3HBr 2. Нитрование фенола идет в орто- и пара-положения с последовательным образованием мононитрофенолов, динитрофенолов и в конце тринитрофенола пикриновой кислоты (взрывчатое вещество). + 3HNO3 → 3H2O + пикриновая кислота 3. Сульфирование также проходит последовательно по орто- или пара-положениям с образованием моно- ди- и тризамещенных фенолсульфокислот. 4. Взаимодействие с формальдегидом идет преимущественно по орто-положению и приводит к образованию фенолформальдегидных смол (бакелитов). Это реакция поликонденсации, так в ней выделяется вода (побочный низкомолекулярный продукт). На первой стадии формальдегид приосоединяется в орто-положение фенола с 4 образованием орто-оксибензилового спирта, который затем взаимодействует с новой молекулой фенола, образуя линейный полимер. На этой стадии выделяется вода. + 3Н2О В результате образуется пространственно сшитый полимер типа: 10.4. Получение фенолов 1. Перегонкой каменноугольной смолы. 2. Синтез из бензола, через промежуточный продукт хлорбензол. . C6H6 + Cl2 → C6H5Cl + HCl C6H5Cl + 2NaOH → C6H5ONa + NaCl + H2O 3. Кумольный метод - одновременно получаются 2 ценных продукта - фенол и ацетон. Вначале из бензола получают кумол. Кумол затем окисляют до гидропероксида кумола, который разлагают действием серной кислоты на фенол и ацетон. C6H6 + CH2=CH-CH3 C6H5-CH(CH3)2 (кумол) + О2 → → СН3СОСН3 + кумол (изопропилбензол) гидропероксид ацетон фенол 5 4. Сплавление солей сульфокислот со щелочами. Образующийся фенолят натрия разрушают кислотами. C6H5-SO3Na + 2NaOH → C6H5ONa + Na2SO3 + H2O 5. Гомологи фенола получают алкилированием фенола. (CH3OH) + CH3I + HI → (H2O) фенол орто-крезол 10.5. Применение фенолов. Дезинфецирующее средство. Сырье при производстве красителей, фенолоформальдегидных пластмасс, многих лекарственных средств (салициловая и ацетилсалициловая кислоты, парацетамол. Гидрохинон используется в фотографии.