Термодинамика поверхности
advertisement

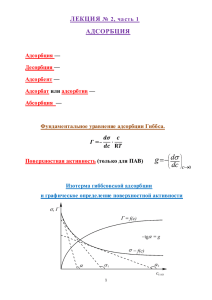
3. ТЕРМОДИНАМИКА ПОВЕРХНОСТИ. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ 3.1. Поверхностная энергия. Состояние атомов на поверхности отличается от состояния атомов в объеме. Причина этого – неодинаковое взаимодействие поверхностных атомов с окружающими соседними атомами (они взаимодействуют не только с атомами своей фазы, но и с частицами прилегающей фазы). Поэтому свойства поверхностного слоя вещества отличаются от его объемных свойств. Чем больше отношение площади поверхности твердого тела к его объему, тем сильнее сказывается влияние поверхностных свойств. Так как площадь поверхности тела растет пропорционально квадрату его геометрических размеров, а объем пропорционально кубу, то для больших тел поверхностными эффектами по сравнению с объемными, можно пренебречь. Однако, если вещество находится в мелкораздробленном состоянии, то такая система обладает развитой поверхностью и поверхностными эффектами в этом случае пренебрегать нельзя. Появление поверхности раздела сопровождается увеличением свободной энергии системы. Часть этой энергии, которая идет на образование поверхности называется поверхностной энергией dGs=d, d - изменение площади поверхности, - поверхностное натяжение. Исходя из этой формулы, поверхностное натяжение можно рассматривать как удельную поверхностную энергию = dGs/d. Увеличение поверхности системы сопровождается затратой энергии, так как для образования новой поверхности некоторые частицы должны перейти из объема на поверхность, что связано с совершением работы против сил молекулярного взаимодействия. Таким образом, поверхностное натяжение определяется как работа, затрачиваемая на создание единичной поверхности Другая интерпретация поверхностного натяжения связана с аналогией силы в механике. Рассмотрим следующий пример. Поверхность жидкости ограничена петлей (рис. 3.1). Предположим, что жидкость ведет себя как упругая пленка. Для увеличения площади поверхности вдоль координаты x на расстояние dx небходимо приложить силу f. Совершенная работа равна приращению поверхностной энергии A=fdx; A=d=ldx, где l – размер поверхности раздела, перпендикулярный направлению действия силы. Тогда поверхностное натяжение, представляет собой силу, приходящуюся на единицу длины =f/l. dx Поверхность жидкости l f Рис. 3.1. Увеличение площади поверхности под действием силы f При увеличении температуры поверхностное натяжении уменьшается, так как при нагревании происходит ослабление сил взаимного притяжения, как в объеме, так и на поверхности. Зависимость поверхностного натяжения от температуры в большинстве случаев линейна (T)=0-aT Может существовать такая критическая температура Tкр, при которой =0. В этих условиях поверхности раздела фаз не существует, т.е. в конденсированном состоянии вещество выше Ткр находиться не может. При постоянных температуре и давлении самопроизвольно протекают такие процессы, для которых характерно уменьшение свободной энергии, т.е dGs <0. Если =const, то d<0 , т.е. протекающие процессы сопровождаются уменьшением площади поверхности раздела фаз. Для жидкостей поверхностная энергия минимальна при шарообразной форме. Для кристаллических тел наименьшее значение Gs достигается при определенных соотношениях размеров граней кристалла, поскольку поверхностные энергии разных граней различны. Конфигурация кристалла, при которой Gs минимальна, наиболее устойчива (принцип Гиббса-Кюри). Равновесная форма кристалла характеризуется тем, что его грани удалены от определенной точки на расстояния, пропорциональные поверхностным натяжениям этих граней (теорема Вульфа): 1/h1=2/h2=3/h3= … =n/h 1 2 h2 h1 Рис. 3.2. Соотношение между формой кристалла и поверхностными энергиями граней Искривление поверхности приводит к новым эффектам. Так при равновесии сферических капель жидкости с паром давление в капле pж и давление пара pп связаны условием pж - pп = 2/r - формула Лапласа r - радиус капли, считается положительным, если кривизна поверхности направлена в жидкую фазу. В данном случае p<0, т.е. давление пара над искривленной поверхностью капли больше, чем над ровной поверхностью (когда r ∞). Таким образом, на поверхности раздела двух фаз (капля-пар) существует скачок давления равный 2 /r. Эта величина называется поверхностным давлением или давлением Лапласа. В случае формы отличной от сферической p=(1/r1+1/r2), где r1 и r2 – главные радиусы кривизны. Аналогичная ситуация имеет место для пузырька газа в жидкости. r/c o s h r Рис. 3.3. Поднятие жидкости по капилляру За счет давления, обусловленного поверхностным натяжением происходит поднятие (или опускание) жидкости по капилляру (рис. 3.3). Высота поднятия жидкости определяется по формуле: 2 cos h= . gr Большой фундаментальный и прикладной интерес представляют эффекты смачивания поверхности. Для равновесной конфигурации жидкой фазы на поверхности твердого тела также естественно ожидать формы, отвечающей минимуму энергии. Степень смачивания характеризуется видом и степенью искривления поверхности жидкой фазы в месте соприкосновения трех фаз – жидкой, твердой и пара. Такое искривление называют мениском. Мерой смачивания служит контактный угол – угол между твердой поверхностью и касательной к поверхности жидкости в точке соприкосновения жидкой и твердой фаз. «Силовая» интерпретация поверхностного натяжения позволяет представить его в виде векторов силы. ж-пар тв-пар тв-ж Рис. 3.4. Контактный угол Условие равновесия соприкасающихся фаз описывается уравнением тв-пар = тв-ж + ж-парcos. сos = (тв-пар - тв-ж) / ж-пар Если тв-пар > тв-ж, то <90о – в этом случае жидкость хорошо смачивает поверхность твердого тела (рис. 3.5 а). Если тв-пар < тв-ж , то >90о и в этом случае смачивание плохое (рис. 3.5 б). а) б) Рис. 3.5. Хорошее (а) и плохое (б) смачивание поверхности твердого тела Предельные случаи =0 - полное смачивание и =180о – полное несмачивание поверхности твердого тела. Если соприкасаются две поверхности твердого тела, т.е. судить о смачивании невозможно, то вводится аналогичное смачиванию понятие адгезии как явления и меры взаимодействия поверхностей твердых тел. Адгезия измеряется силой отрыва одной поверхности от другой. 3.2. Адсорбция Адсорбция - изменение концентрации вещества на границе раздела фаз по сравнению с объемом. В настоящее время этим термином обозначают также и процесс поглощения, и количество поглощенного вещества, отнесенного к единице площади поверхности или массы адсорбента. Адсорбент - вещество, на поверхности которого происходит процесс адсорбции, адсорбат - сорбирующееся вещество. Различают два типа адсорбции – физическую адсорбцию и химическую адсорбцию (хемосорбцию). Между ними трудно провести чёткую границу, так они составляют два последовательных этапа единого процесса. Косвенным критерием определения типа адсорбции является величина теплоты адсорбции. Теплота адсорбции Q - теплота, выделяющаяся в процессе адсорбции, отнесенная к одному молю адсорбата. Если Q < 30÷40 кДж · моль-1, говорят о физической адсорбции, при Q > 40 кДж · моль-1 - о хемосорбции. Концентрирование вещества в поверхностном слое идёт самопроизвольно и процесс сорбции характеризуется отрицательным значением свободной энергии Гиббса ∆G. Физическая адсорбция обусловлена силами межмолекулярного взаимодействия. Межмолекулярные взаимодействия (силы Ван-дер-Ваальса) по своей природе относятся к типу диполь-дипольных взаимодействий. Различают ориентационное, индукционное и дисперсионное взаимодействия: а) ориентационной взаимодействие обусловлено взаимной ориентацией взаимодействующих диполей и характерно для адсорбции полярных молекул на полярных адсорбентах; б) индукционное взаимодействие возникает при сближении диполя с неполярной молекулой, в результате чего последней индуцируется электрический момент; характерно для адсорбции неполярных молекул на полярном адсорбенте или наоборот – полярных молекул на неполярном адсорбенте; в) дисперсионное взаимодействие возникает за счет образования синхронно осциллирующих диполей и характерно для адсорбции неполярных молекул на неполярных адсорбентах. Энергетическое состояние физически адсорбированной частицы показано на рис. 3.6 в виде энергетической диаграммы — зависимости энергии взаимодействия частицы с поверхностью от расстояния до этой поверхности. Глубина потенциальной ямы Eф представляет собой энергию физической адсорбции. Поверхность адсорбента E Адсорбированная молекула x Eфа Рис. 3.6. Энергетическая диаграмма физической адсорбции Адсорбированная молекула, удерживаемая силами Ван-дер-Ваальса на поверхности совершает тепловые колебания по нормали к поверхности с частотой ~1013 Гц. Это приводит к тому, что молекулы, обладающие достаточной энергией, покидают поверхность. Среднее время жизни молекулы в адсорбированном состоянии зависит от энергии адсорбции Eф: E = 0 exp ф . kT Здесь 0 — период колебаний молекулы. Таким образом наряду с концентрированием вещества на поверхности идет обратный процесс его удаления (десорбция), т.е. физическая адсорбция является обратимой. Хемосорбция обусловлена силами химической природы типа гомеополярной или гетерополярной связи. Хемосорбцию нельзя считать химической реакцией, т.к. при этом не образуется каких-либо новых веществ. Она является только преддверием гетерогенной химической реакции. Для активации хемосорбции часто используется температура, в этом смысле хемосорбция является термоактивационным процессом. Температурная зависимость адсорбции показана на рис. 3.7. a физ. адсорбция хемосорбция T Рис. 3.7. Температурная зависимость адсорбции Для количественного выражения адсорбции используют понятия удельной абсолютной адсорбции: ni - количество вещества на единицу поверхности, и избыточной (гиббсовской) адсорбции: a i= ni - избыток вещества на поверхности по сравнению с объемом. Следует иметь в виду, что гиббсовская адсорбция может быть как положительной, так и отрицательной, так в зависимости от знака ni. Адсорбция вещества на поверхности раздела фаз приводит к изменению поверхностной энергии. Связь между адсорбцией и поверхностной энергией можно установить из уравнения i= dG=−SdT Vdp∑ i dni d . i При условия равновесия при постоянных температуре и давлении из этого уравнения вытекает соотношение: ni =− , откуда следует адсорбционное уравнение Гиббса: i=− . С его помощью можно можно вычислить адсорбцию, если известна зависимость поверхностного натяжения от состава системы, который связан с химическим потенциалом. Зависимость количества адсорбированного поверхностью вещества от давления или концентрации этого вещества в другой фазе выражается с помощью изотермы адсорбции функциональной зависимости вида a = ƒ(p)T=const, a = ƒ(c)T=const. Для описания монослойной локализованной адсорбции на однородной поверхности используют изотерму Ленгмюра: bp a = am ⋅ , 1 + bp где am – предельная адсорбция, b – константа адсорбционного равновесия. Для разбавленных растворов: bc a = am ⋅ . 1 + bc Уравнение Ленгмюра описывает равновесную адсорбцию веществ при выполнении следующих трёх условий: 1) адсорбент представляет собой совокупность одинаковых адсорбционных центров (поверхность однородна); 2) межмолекулярными взаимодействиями адсорбата можно пренебречь; 3) каждый адсорбционный центр взаимодействует только с одной молекулой адсорбата. Из условий 2) и 3) следует что адсорбция ограничена одним слоем молекул, причем предельное число адсорбированных молекул на поверхности равно числу адсорбционных центров. Для монослойной адсорбции удобно оперировать со степенью заполнения поверхности, которую определяют как отношение адсорбции при данном давлении (концентрации) к предельной величине адсорбции: bp a Θ = = . a m 1 + bp Θ a am 1 p а) p б) Рис. 3.8. Изотерма адсорбции Ленгмюра При низких давлениях (когда bp<<1) 1+bp≈1 и последнее уравнение преобразуется к виду =bp. При высоких давлениях (когда bp>>1) 1+bp≈bp и =1. При одновременной адсорбции нескольких газов степени заполнения рассчитывают по формуле: bi p i Θi= 1 + ∑ bi p i . i Если поверхность энергетически неоднородна, используют эмпирическое уравнение Фрейндлиха: a = kp 1 / n ,) где k и n – аппроксимационные коэффициенты. При многослойной адсорбции изотерма описывается уравнением Брунауера-ЭмметаТеллера (БЭТ) a=am bp 1− p ps 1bp s−1 p ps , где ps - давление насыщенного пара адсорбата. 3.3. Механизм зарождения новой фазы на поверхности твердого тела Рост тонких плёнок на подложках при конденсации из парагазовой фазы начинается со стадии зародышеобразования. Данный процесс заключается в возникновении и росте на поверхности твердого тела агрегатов молекул осаждаемого вещества в виде последовательности бимолекулярных реакций: A1 +A1 = A2 A2 +A1 = A3 ................. Ai-1 +A1 = Ai где Ai – агрегат, состоящий из i молекул, который представляет собой зародыш новой фазы. В общем случае он может расти или уменьшаться. Образование зародыша новой фазы на поверхности подложки сопровождается некоторым изменением свободной энергии системы: G=G s G v Причем ∆GV<0, так как образование нового объема сопровождается уменьшением свободной энергии системы, а ∆GS>0, что связано с затратами энергии на создание границ раздела, поскольку поверхностная энергия всегда положительна. Следовательно знак суммарной энергии зародышеобразования определяется соотношением вкладов объемного и поверхностного слагаемых. Этот знак должен зависеть от размера зародыша r, так как величины пропорциональны соответственно площади поверхности и объему зародыша. На рис. 3.9 качественно показаны зависимости ∆GV ∆GS и ∆G от радиуса зародыша. ∆G ∆GS ∆Gкр ∆GS+∆GV rкр r ∆GV Рис. 3.9. Зависимость энергии образования зародыша от его характерного размера При малых r преобладает влияние поверхностного вклада, а при больших – объемного. Из-за разных знаков суммарная кривая проходит через максимум ∆Gкр при размере зародыша rкр. Зародыши таких размеров называются критическими. Докритические зародыши с размерами r < rкр неустойчивы, поскольку их рост связан с повышением энергии. Закритические зародыши с размерами r > rкр напротив, способны к дальнейшему росту, так как энергия при этом уменьшается. Возникновение критических зародышей связано с преодолением барьера зародышеобразования ∆Gкр, который представляет собой энергию образования критического зародыша. Рассмотрим элементы термодинамической теории зародышеобразования. Термодинамическая теория рассматривает зародыши как частицы сплошной среды только малых размеров и приписывает им термодинамические свойства массивного материала. Такая модель применима лишь к макроскопическим зародышам, состоящим из большого числа частиц. Задачей термодинамической теории является определение размера критического зародыша и энергии его образования. Механизм образования зародышей новой фазы может быть гомогенным, когда в исходной фазе отсутствуют какие-либо поверхности и частицы, на которых происходит зародышеобразование, либо гетерогенным – на границе раздела фаз. Модель гомогенного зародышеобразования. В данной модели предполагается, что зародыш имеет сферическую форму (ввиду отсутствия взаимодействия с подложкой) с радиусом r. В этом случае G=4 r 2 dG d 4 3 r 3 dG dV dG d dG dV = - удельная поверхностная энергия (поверхностное натяжение); =− RT V ln p po =− g V - удельная объемная энергия, где p – равновесное давление пара, p0 - давление пересыщеного пара (отношение p/p0 представляет собой степень пересыщения). Таким образом G=4 r 2 − 4 r 3 gV 3 (1) Выражение для rкр можно получить из условия максимума функции ∆G - (d∆G/dr = 0): r кр = 2 (2) gv Подставляя (2) в (1) получим энергию образования критического зародыша: Gкр = 16 3 3 (3) g 2V Модель гетерогенного зародышеобразования. Модель гетерогенного зародышеобразования отличается от модели гомогенного наличием геометрического фактора, учитывающего влияние поверхности. В данной модели предполагается, что зародыш имеет куполообразную форму (рис.3.10), что справедливо для кристаллов с изотропной или слабо анизотропной поверхностью. Для кристаллов с сильно выраженной анизотропией поверхности зародыш имеет форму многогранника (пирамида, куб и т.п.). Фаза 1 12 Фаза 2 1п 2п r Подложка 2 Рис. 3.10. Модель куполообразного зародыша с радиусом r и контактным углом Контактный угол определяется уравнением Юнга cos = 1п− 2п 12 Объем куполообразного зародыша равен V з= где r3 3 2−3cos cos3 = 4 r 3 f , 3 f =2−3cos cos3 /4 - функция контактного угла. Объемная составляющая энергии образования зародыша: GV =−V з gV =− 4 3 r 3 f gV Поверхностная энергия: GS =2 r 2 1−cos 12 r 2 sin 2 2п− 1п=4 r 2 12 f Суммарная энергия: 4 r 3 g V f . 3 Радиус критического зародыша и энергия его образования соответственно равны G= 4 r 2 12 − r кр = Gкр = 16 3 2 gv 3 12 g2V f Как видно из формул, условия взаимодействия подложки и зародыша, характеризуемые контактным углом, не влияют на критический радиус, но существенно воздействуют на величину ∆Gкр. На рис.3.11 показана зависимость функции f() от контактного угла. f() 1 0,5 0 90 180 Рис. 3.11. Функция контактного угла При =180о f()=1 и ∆Gкр максимальна. Этот случай соответствует гомогенному зародышеобразованию. В диапазоне 0<<180o f()<1. Это понижает энергию зародышеобразования по сравнению с гомогенным механизмом. Следовательно, подложка оказывает каталитическое воздействие на рост зародышей новой фазы обеспечивая преимущественно гетерогенное зародышеобразование. При =0 f()=0 и Gкр=0. В этом случае зародыш имеет форму плоского диска моноатомной высоты.