лабораторная работа 20
advertisement
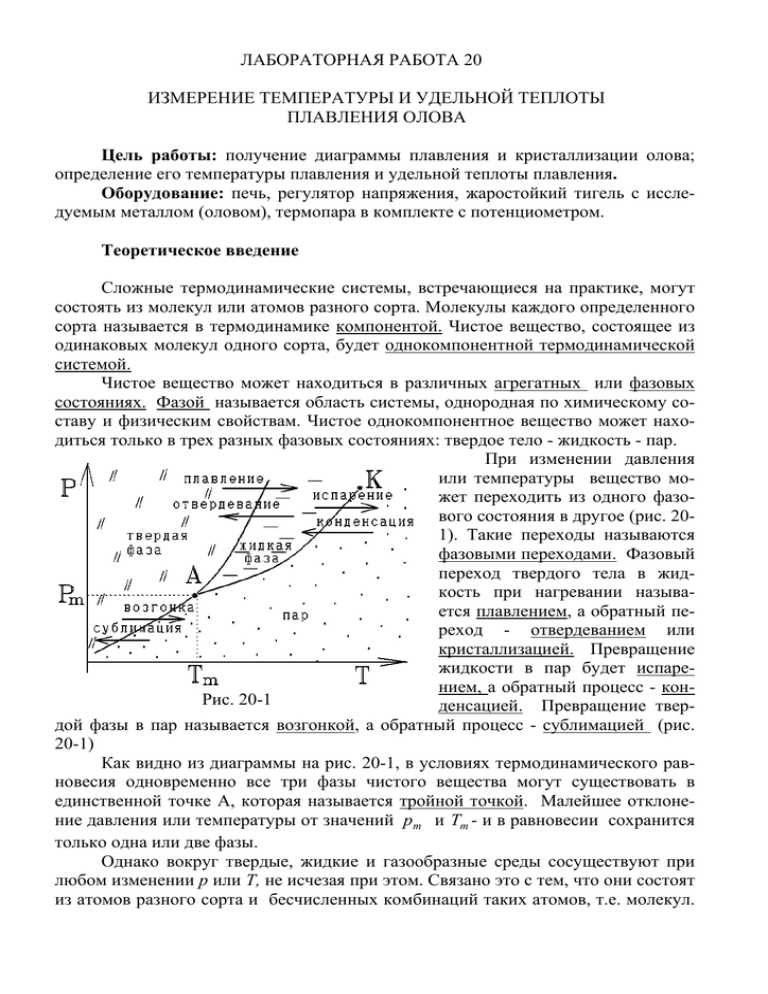
ЛАБОРАТОРНАЯ РАБОТА 20 ИЗМЕРЕНИЕ ТЕМПЕРАТУРЫ И УДЕЛЬНОЙ ТЕПЛОТЫ ПЛАВЛЕНИЯ ОЛОВА Цель работы: получение диаграммы плавления и кристаллизации олова; определение его температуры плавления и удельной теплоты плавления. Оборудование: печь, регулятор напряжения, жаростойкий тигель с исследуемым металлом (оловом), термопара в комплекте с потенциометром. Теоретическое введение Сложные термодинамические системы, встречающиеся на практике, могут состоять из молекул или атомов разного сорта. Молекулы каждого определенного сорта называется в термодинамике компонентой. Чистое вещество, состоящее из одинаковых молекул одного сорта, будет однокомпонентной термодинамической системой. Чистое вещество может находиться в различных агрегатных или фазовых состояниях. Фазой называется область системы, однородная по химическому составу и физическим свойствам. Чистое однокомпонентное вещество может находиться только в трех разных фазовых состояниях: твердое тело - жидкость - пар. При изменении давления или температуры вещество может переходить из одного фазового состояния в другое (рис. 201). Такие переходы называются фазовыми переходами. Фазовый переход твердого тела в жидкость при нагревании называется плавлением, а обратный переход - отвердеванием или кристаллизацией. Превращение жидкости в пар будет испарением, а обратный процесс - конРис. 20-1 денсацией. Превращение твердой фазы в пар называется возгонкой, а обратный процесс - сублимацией (рис. 20-1) Как видно из диаграммы на рис. 20-1, в условиях термодинамического равновесия одновременно все три фазы чистого вещества могут существовать в единственной точке А, которая называется тройной точкой. Малейшее отклонение давления или температуры от значений pт и Tm - и в равновесии сохранится только одна или две фазы. Однако вокруг твердые, жидкие и газообразные среды сосуществуют при любом изменении р или Т, не исчезая при этом. Связано это с тем, что они состоят из атомов разного сорта и бесчисленных комбинаций таких атомов, т.е. молекул. Разные молекулы образуют разные компоненты. В многокомпонентных системах фазы многочисленны. Так твердая медь и твердое олово или жидкая вода и жидкий спирт являются разными фазами, являются разными фазами, так как отличаются физическими свойствами, например плотностью. Если их смешать, то образуется новая фаза - раствор, где молекулы разных компонентов перемешаны. Твердый раствор может быть твердым телом, металлом, в котором различные атомы, чередуясь, выстроены в одну кристаллическую решетку. Но может получиться сплав, или интерметаллид, в котором чередуются микроскопические кристаллы то одного, то другого чистого металла. Например, бронза - это сплав олова и меди, состоящий из чередующихся фаз Cu и Sn. Условие термодинамического равновесия многофазной и многокомпонентной системы определяется правилом фаз Гиббса: равновесная система из m фаз и n различных компонент описывается (20-1) I=2+n-m независимыми термодинамическими параметрами. Т.е. равновесие может быть достигнуто только при I ≥ 0. Так для чистого вещества (п =1) в случае сосуществования т = 3 фаз имеем I = 0 и равновесие выполняется в единственной тройной точке А (рис. 20-1). Две фазы (m = 2, n = 1, I = 1) могут сосуществовать при изменении одного независимого параметра - например, давления р или температуре Т. На диаграмме состояний точки, в которых две фазы существуют в равновесии одновременно, лежат на некоторой кривой р = р(Т) или Т = Т (р). Это кривая равновесия двух фаз. На рис. 202 такими кривыми будут: АС или АВ - кривая плавления (кристаллизации), АК - кривая испарения (конденсации), АЕ - кривая возгонки (сублимации). Во всех остальных точках рис. 20-2 Рис. 20-2 равновесное состояние вещества может быть только однофазным. Для большинства чистых веществ кривая имеет положительный наклон к dp > 0 и при повышении давления температура плавления Tn будет оси Т, т.е. dT повышаться. Такие вещества, например, олово называются нормальными (кривая АС на рис. 20-2). Однако встречаются аномальные вещества, для которых на кри- dp < 0 и температура плавления Tn уменьшается с ростом давлеdT ния р (кривая АВ на рис. 20-2). Таким веществом будет вода. Кривая равновесия двух фаз описывается уравнением Клапейрона - Клаузиуса: dp q , = (20-2) dT T (υ 2 − υ1 ) где q - удельная теплота фазового перехода, т.е. количество теплоты, которое поглощается или выделяется при превращении 1 кг вещества из фазового состояния 1 в фазовое состояние 2; υ 2 и υ1 - удельные объемы фаз, т.е. объемы, которые занимает 1 кг вещества в фазовом состоянии 2 или 1 при данной температуре фазового перехода. Так как ρ = m V = 1 кг υ , то вместо удельных объемов можно использовать плотности вещества в данном фазовом состоянии: υ i = 1 ρ i . И переписать уравнение Клапейрона - Клаузиуса (20-2) в следующем виде: dp q . = (20-3) dT T (1 ρ 2 − 1 ρ1 ) dp < 0 и ρ 2 = ρ жидк > ρ1 = ρ тверд . При плавлении аномальных веществ dT Плотность воды при плавлении больше, чем плотность льда и лед плавает в воде. Но в данной работе исследуется плавление нормального вещества - олова с кривой плавления АС (рис. 20-2). Процессы плавления и кристаллизации показаны на dp этом рисунке стрелками. Для такого вещества > 0 и ρ жидк < ρ тверд - твердое dT олово тонет в расплавленном жидком олове. Заметим, что кривые плавления идут очень круто. Например, для изменения на ∆T = 1 K температуры плавления льда надо изменить давление на вых плавления ∆ p = 1,32 ⋅ 10 7 Па ≈ 132 атм! Другие кривые равновесия фаз описываются тем же уравнением (20-3). Но для кривой испарения АК (рис. 20-2) ρ 2 = ρ пара > ρ1 = ρ жидк и эта кривая всегда dp > 0. При повышении давления температура исdT парения растет. Растет и плотность пара до тех пор, пока в критической точке К она не сравняется с плотностью жидкости. В этой точке жидкая и газообразная фазы чистого вещества ничем не отличаются друг от друга и теряет смысл понятие фазового перехода. При нагревании олова в открытом тигле достичь критической точки К невозможно. Олово соседствует с молекулами воздуха, стенок тигля и т.п., т.е. система многокомпонентна, и, согласно условию (20-1), в равновесии могут находиться три агрегатных состояния олова. Уже в точке плавления Tn над оловом образуется некоторое количество пара. Испарение в многокомпонентной системе идет при любой температуре. Однако плотность и давление такого насыщенного имеет положительный наклон пара крайне невелики и влияния на уравнение (20-3), описывающее кривую плавления он практически не оказывает. С ростом температуры Т , когда все олово уже находится в жидком состоянии, а давление насыщенного пара достигло атмосферного давления окружающей среды и не может расти дальше, все жидкое олово начинает превращаться в пар. Это - точка кипения. Фазовые превращения, описываемые уравнением Клапейрона - Клаузиуса и сопровождающееся выделением или поглощением скрытой теплоты q называются фазовыми переходами первого рода. Они происходят при неизменной температуре. Действительно, в кристаллическом твердом теле атомы упорядочены в жесткую кристаллическую решетку и совершают тепловые колебания вблизи ее узлов (рис. 20-3, а) Расстояние d между узлами соответствует минимуму потенциальной энергии взаимодействия U вз двух соседних атомов (рис. 204). Соответствующие этой энергии силы притяжения связывают атомы друг с другом. При нагревании твердого тела увеличивается амплитуда тепловых колебаний атомов, но межатомные связи сохраняются. Только при достижении определенной температуры плавления Tn они начинают разрываться. Вся поступающая теплота при этом идет не на нагревание вещества, а на разрыв межатомных связей, т.е. превращается в скрытую теплоту плавления q. При неизменной температуре Tn в твердом теле образуются очаги жидкости и они постоянно разрастаются, до тех пор, пока все твердое тело не превратится в жидкость. Только после этого температура снова начнет расти. При температуре фазового перехода Tn сосуществуют твердая и жидкая фазы. В жидкостях часть межатомных связей Рис. 20-3 разорвана, но оставшиеся связи, по-прежнему, объединяют атомы в большие комплексы (рис. 20-3, б). Атомы с легкостью переходят из одного комплекса в другой, т.е. жидкость легко деформируется, течет. Но сохранившиеся связи не позволяют атомам разлететься, и плотность жидкости не слишком отличается от плотности твердого тела. Отрыв отдельных атомов (испарение) может происходить при любой температуре, но только при температуре кипения будут разрушаться все оставшиеся связи и жидкость превратится в пар (рис. 20-3, в). При охлаждении жидкости до температуры Tn начинается обратный процесс. В жидкости присутствуют центры кристаллизации - посторонние частицы твердой примеси, загрязнения. Вокруг них появляются зародыши кристаллической решетки и она начинает расти. Идет процесс кристаллизации объем жидкой фазы уменьшается, а твердой кристаллической фазы растет при неизменной температуре Tn . Так Рис. 20-4 как энергия связанных атомов меньше на величину U связи (рис. 20-4), то при кристаллизации выделяется скрытая теплота q. Если жидкость очень чистая и в ней отсутствуют посторонние частицы (центры кристаллизации), то ее можно охладить ниже температуры Tn . Такая жидкая фаза называется переохлажденной (точка Р на рис. 20-2). Это состояние нестабильно или внутренне неравновесно - при малейшем возмущении переохлажденная жидкость кристаллизуется, превращаясь в однофазную твердую среду. Переохлажденная жидкость имеет малую текучесть. Заметим, что аморфные твердые тела, такие, как стекло, не образуют кристаллическую решетку. Они являются очень вязкими жикостями, с очень малым числом разорванных межатомных связей (рис. 20-3, б). Их можно считать переохлажденными жидкостями с очень большим временем кристаллизации (порядка сотен или тысяч лет). Поэтому при нагревании или охлаждении аморфных твердых тел речь идет не о плавлении или кристаллизации, а о размягчении или отвердевании, которое происходит не при одной температуре Tn , а в некотором интервале температур ∆T . Методика эксперимента Рис. 20-5 В данной работе определяется удельная теплота плавления q чистого олова, имеющего относительно малую температуру плавления. Схема лабораторной установки показана на рис. 20-5. В электропечь 1 с регулятором 2 напряжения, подаваемого на нагреватель, установлен жаростойкий фарфоровый тигель 3, наполненный исследуемым металлом 4 (оловом). Температура тигля и металла измеряется хромель - копелевой термопарой 5 в комплекте с потенциометром 6, отградуирован- ном на температурную шкалу с ценой деления 10 D C . Для предотвращения контакта термопары с расплавленным металлом, она окружена защитным кожухом в виде тонкостенного стального цилиндра, закрытого со стороны расплава. При нагревании или охлаждении тигля с оловом его температура Т меняется со временем t , как показано на рис. 20-6. При температуре плавления Tn олово существует в двухфазном состоянии жидкость - твердое тело и вся поступающая от нагревателя тепловая мощность dQ dt преобразуется в скрытую теплоту плавления. Горизонтальный участок ВС графика изменения температуры , измеРис. 20-6 ряемого в эксперименте, будет более выраженным при охлаждении олова. Поэтому производится измерение процесса остывания олова, показанного стрелками на рис. 20-6. При этом на участке СВ жидкое олово постепенно кристаллизуется в твердое и выделяется скрытая теплота, поддерживающая постоянство температуры Tn всей системы олово тигель - кожух термодатчика. С другой стороны, эта система ежесекундно отдает окружающей среде постоянное тепло dQ dt . За время τ n существования двухфазного состояния выделится теплота dQ ⋅τ n = qm1 , (20-4) dt где q - удельная теплота плавления или кристаллизации олова, m1 - его масса. После кристаллизации всего сплава температура начнет падать (участок ВА). Можно считать, что вблизи температуры плавления Tn , т.е. при небольшом изменении температуры ∆T , система ежесекундно отдает то же, приблизительно постоянное, количество теплоты, и записать уравнение теплового баланса: dQ (c1m1 + c2 m2 + c3 m3 )∆T = , (20-5) ∆t dt где c1 , c2 , c3 - удельные теплоемкости, соответственно , олова, фарфорового тигля и стального кожуха вместе с нагреваемой частью термопары; m1 , m2 , m3 - их массы; ∆t - время уменьшения температуры на ∆T . Исключая из уравнений (20-4) и (20-5) тепловую мощность dQ dt , находим формулу для вычисления удельной теплоты плавления олова: q= (c1m1 + c2 m2 + c3 m3 )∆T ⋅ τ n . m1∆t (20-6) Контрольные вопросы 1. Что называется термодинамической фазой? Чем фазовое равновесие может отличаться от агрегатного? 2. Что называется фазовыми переходами первого рода? При каких условиях они происходят? Что такое кристаллизация, плавление, возгонка, сублимация, конденсация, испарение? Покажите кривые этих переходов на фазовой диаграмме. 3. Что является многокомпонентной фазой? Будет ли это сплав или раствор? Приведите примеры таких фаз. 4. Сформулируйте правило фаз Гиббса. Что оно описывает? Какое состояние называется термодинамически равновесным? Что такое тройная точка? Сколько различных однокомпонентных и многокомпонентных фаз могут существовать в равновесии? 5. Какие вещества называются нормальными и аномальными? Чем отличаются их фазовые диаграммы? Покажите на этих диаграммах температуры и давления, при которых вещество может существовать в однофазном, двухфазном и трехфазном состоянии. Может ли вода в реальных условиях существовать в трех агрегатных состояниях одновременно? 6. Сформулируйте уравнение Клапейрона -Клаузиуса. Какую зависимость давления и температуры оно описывает? Что называется скрытой теплотой фазового перехода. Что такое удельный объем фазы и как его вычислить? 7. Почему лёд плавает в воде, а твердое железо тонет в расплавленном ? 8. Что происходит с температурой плавления и кипения таких веществ как H 2 O и Sn при изменении давления и почему? 9. Фигурист массы m = 60 кг стоит на коньке, площадь лезвия которого, соприкасающаяся со льдом, S = 0,5 мм 2 . С помощью уравнения Клапейрона - Клаузиуса вычислите температуру льда, при котором он начнет плавиться под коньком. 10. Что такое критическая точка и точка кипения? Чем отличаются процессы кипения и испарения? Почему испарение может происходить при любой температуре? Почему вся жидкость обязана превращаться в пар в точке кипения? Что произойдет с жидкостью, если её вынести в вакуум и почему? 11. Как движутся атомы в кристаллическом твердом теле, жидкости и в паре? Почему плотность вещества в жидком и твердом состоянии приблизительно одинакова, а в газообразном - много меньше? 12. Почему фазовые переходы первого рода происходят при неизменной температуре? На фазовой диаграмме (рис. 20-2) укажите процесс нагревания и охлаждения, проводимый в данной работе и укажите точки, где система находится в твердом, жидком и двухфазном состоянии. 13. Каким образом получить переохлажденную жидкость? Каковы ее свойства? Почему это состояние называется метастабильным? Что является центрами кристаллизации? Почему при остывании стали из расплава образуется поликристаллическая структура? 14. Как ведут себя при нагревании аморфные твердые тела? Какой для них будет диаграмма на рис. 20-6? 15. Объяснить формулы (20-4) и (20-5) и получить формулу (20-6). Объяснить график на рис. 20-6. Почему в одних точках этого графика температура меняется, а в других нет? Почему нельзя измерять большой интервал изменения температуры ∆T ? 16. Что такое удельная теплота плавления, удельная теплота кристаллизации, удельная теплота испарения? Какая удельная теплота измеряется в данной работе? Порядок выполнения работы 1. Ознакомиться с устройством экспериментальной установки. 2. Включить электропечь, зафиксировав начальную температуру олова в фарфоровом тигле и начало процесса нагревания на часах с секундной стрелкой. 3. Зафиксировать время достижения оловом 100 D C , после чего измерять и фикси ровать температуру каждую минуту. 4. После достижения температуры олова 240 D C выключить электропечь. 5. После окончания подъема температуры, вызванного тепловой инертностью электропечи, измерять и фиксировать температуру олова в процессе его охлаж дения каждую минуту (до 150 D C ). 6. Включить повторно электропечь и повторить все операции по пп. 3-6. 7. Значения температуры и времени фиксировать в таблице. Табл. 1 t, мин Т, К t, мин Т, К t, мин Т, К ∆T / ∆t = K /c 1 2 …. < Tn > ± ∆T = < q > ± ∆q = K Дж / кг < τ n > ± ∆τ n = c 8. Построить по опытным данным диаграмму плавления в координатах температура - время. 9. Выбрать участок диаграммы, параллельный оси времени; определить по длине этого участка время плавления (затвердевания) олова τ п. , а также температуру плавления Тпл.. 10.Выделить на диаграмме прямолинейный участок, соответствующий нагреванию (охлаждению) твердого металла вблизи области фазового перехода , оп ределив по длине этого участка изменение температуры ∆T и времени ∆τ , а ∆T dT ≈ . также отношение ∆τ dτ 11. С помощью формулы (20-6) вычислить удельную теплоту плавления олова. 12. Оценить погрешность в определении удельной теплоты плавления. ВНИМАНИЕ! В процессе эксплуатации электропечи запрещается вынимать термопару из защитного кожуха, касаться защитного кожуха и наружной поверхности печи во избежание ожогов. Справочные данные Масса олова m1 = 288,2 г. . Масса фарфорового тигля m2 = 54,7 г .. Масса нагревающейся части термодатчика m3 = 55 г . Дж . Удельная теплоемкость олова с1 = 248 кг ⋅ К Дж Удельная теплоемкость фарфора c2 = 882 . кг ⋅ К Удельная теплоемкость стального кожуха и нагреваемой части термопары Дж . c3 = 507 кг ⋅ К Литература 1. Савельев И.В., Курс физики. - М.: Наука, 1989, Т 2. с. 392-399. 2. Ю.Н. Колмаков, Ю.А. Пекар, Л.С. Лежнева Термодинамика и молекулярная физика. 1999, гл 7, § 5; гл. 8, § 1.

