5.2. Правило фаз Изучение любого сплава, прежде всего
advertisement
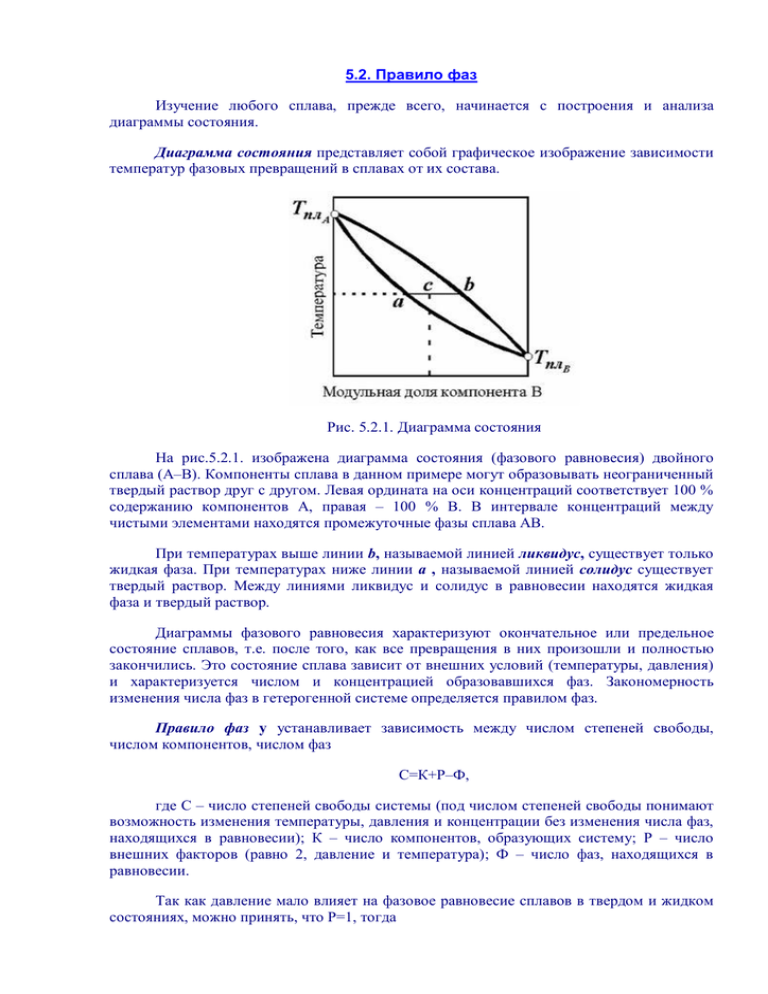
5.2. Правило фаз Изучение любого сплава, прежде всего, начинается с построения и анализа диаграммы состояния. Диаграмма состояния представляет собой графическое изображение зависимости температур фазовых превращений в сплавах от их состава. Рис. 5.2.1. Диаграмма состояния На рис.5.2.1. изображена диаграмма состояния (фазового равновесия) двойного сплава (А–В). Компоненты сплава в данном примере могут образовывать неограниченный твердый раствор друг с другом. Левая ордината на оси концентраций соответствует 100 % содержанию компонентов А, правая – 100 % В. В интервале концентраций между чистыми элементами находятся промежуточные фазы сплава АВ. При температурах выше линии b, называемой линией ликвидус, существует только жидкая фаза. При температурах ниже линии a , называемой линией солидус существует твердый раствор. Между линиями ликвидус и солидус в равновесии находятся жидкая фаза и твердый раствор. Диаграммы фазового равновесия характеризуют окончательное или предельное состояние сплавов, т.е. после того, как все превращения в них произошли и полностью закончились. Это состояние сплава зависит от внешних условий (температуры, давления) и характеризуется числом и концентрацией образовавшихся фаз. Закономерность изменения числа фаз в гетерогенной системе определяется правилом фаз. Правило фаз у устанавливает зависимость между числом степеней свободы, числом компонентов, числом фаз С=К+Р–Ф, где С – число степеней свободы системы (под числом степеней свободы понимают возможность изменения температуры, давления и концентрации без изменения числа фаз, находящихся в равновесии); К – число компонентов, образующих систему; Р – число внешних факторов (равно 2, давление и температура); Ф – число фаз, находящихся в равновесии. Так как давление мало влияет на фазовое равновесие сплавов в твердом и жидком состояниях, можно принять, что Р=1, тогда С=К+1–Ф. Поскольку число степеней свободы не может быть меньше 0, то Ф К+1. Отсюда следует, что число фаз в сплаве, находящемся в равновесном состоянии, не может быть больше, чем число компонентов плюс единица (т.е. в двойной системе в равновесии может находиться не более трех фаз, в тройной – не более четырех и т.д.). Если в равновесии в системе находится максимальное число фаз, то число степеней свободы равно нулю (С=0). В этом случае сплав может существовать только в совершенно определенных условиях: при постоянной температуре и определенном составе всех находящихся в равновесии фаз. Такое состояние называют нонвариантным. Обычно диаграммы состояния строят экспериментально. Для этой цели экспериментально получают кривые охлаждения отдельных сплавов и по их перегибам, связанным с тепловыми эффектами превращений, определяют температуры соответствующих превращений. Эти температуры называют критическими точками. Полученное значение критических точек изучаемых сплавов откладывают на вертикальных линиях, соответствующих химическому составу этих сплавов. Затем соединяют критические точки и получают линии диаграммы состояний. Количественное соотношение фаз в период кристаллизации устанавливают по правилу отрезков (см. рис. 5.2.1). Для определения количественного соотношения фаз, находящихся в равновесии при данной температуре в сплаве с заданной концентрацией, необходимо через точку с заданной температурой и концентрацией провести линию, параллельную оси концентраций (горизонтальную) до пересечения с линиями ликвидус и солидус (см. рис. 5.2.1, в данном примере проведена линия асb через точку «с»). Точки пересечения укажут концентрацию фаз, а отрезки будут обратно пропорциональны весу фаз. Количество жидкой и твердой фазы в данном случае (см. рис. 5.2.1) в сплаве составит: Ж=(ас/аb) 100 %, Тв=(bc/аb) 100 %.






