Вещества Реакции ∆H (кДж/моль) ∆H H3PO4 (г.) + 128 + 50
advertisement
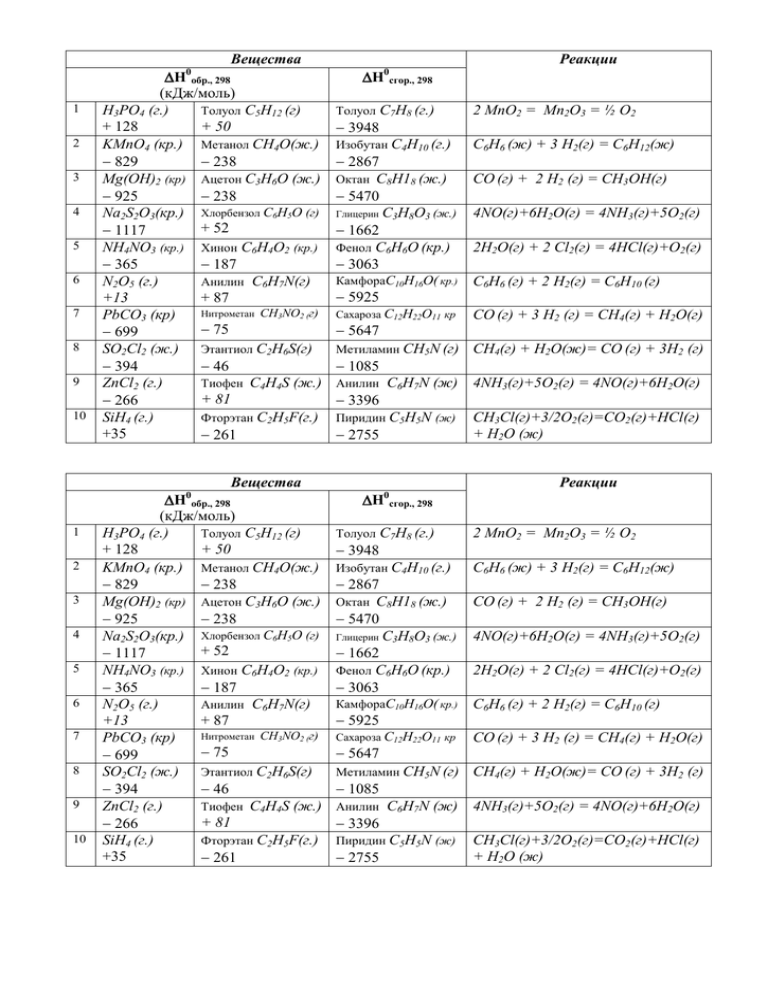
Вещества H обр., 298 (кДж/моль) H3PO4 (г.) Толуол С5Н12 (г) + 128 + 50 KMnO4 (кр.) Метанол СН4О(ж.) 829 238 Mg(OH)2 (кр) Ацетон С3Н6О (ж.) 925 238 Na2S2O3(кр.) Хлорбензол С6Н5О (г) + 52 1117 NH4NO3 (кр.) Хинон С6Н4О2 (кр.) 365 187 N2O5 (г.) Анилин C6H7N(г) +13 + 87 Нитрометан CH3NO2 (г) PbCO3 (кр) 75 699 SO2Cl2 (ж.) Этантиол C2H6S(г) 394 46 ZnCl2 (г.) Тиофен C4H4S (ж.) + 81 266 SiН4 (г.) Фторэтан C2H5F(г.) +35 261 0 1 2 3 4 5 6 7 8 9 10 1 2 3 4 5 6 7 8 9 10 Вещества H0обр., 298 (кДж/моль) H3PO4 (г.) Толуол С5Н12 (г) + 128 + 50 KMnO4 (кр.) Метанол СН4О(ж.) 829 238 Mg(OH)2 (кр) Ацетон С3Н6О (ж.) 925 238 Na2S2O3(кр.) Хлорбензол С6Н5О (г) + 52 1117 NH4NO3 (кр.) Хинон С6Н4О2 (кр.) 365 187 N2O5 (г.) Анилин C6H7N(г) +13 + 87 Нитрометан CH3NO2 (г) PbCO3 (кр) 75 699 SO2Cl2 (ж.) Этантиол C2H6S(г) 394 46 ZnCl2 (г.) Тиофен C4H4S (ж.) + 81 266 SiН4 (г.) Фторэтан C2H5F(г.) +35 261 Реакции H 0 Толуол 3948 сгор., 298 С7Н8 (г.) Изобутан С4Н10 (г.) 2867 Октан С8Н18 (ж.) 5470 Глицерин С3Н8О3 (ж.) 1662 Фенол С6Н6О (кр.) 3063 2 MnO2 = Mn2O3 = ½ O2 С6Н6 (ж) + 3 Н2(г) = С6Н12(ж) СО (г) + 2 Н2 (г) = СН3ОН(г) 4NO(г)+6Н2О(г) = 4NH3(г)+5О2(г) 2Н2О(г) + 2 Cl2(г) = 4HСl(г)+О2(г) КамфораС10Н16О( кр.) С6Н6 (г) + 2 Н2(г) = С6Н10 (г) Сахароза С12Н22О11 кр СО (г) + 3 Н2 (г) = СН4(г) + Н2О(г) Метиламин СН5N (г) СН4(г) + Н2О(ж)= СО (г) + 3Н2 (г) 5925 5647 1085 Анилин 3396 C6H7N (ж) 4NH3(г)+5О2(г) = 4NO(г)+6Н2О(г) Пиридин C5H5N (ж) 2755 СН3Cl(г)+3/2O2(г)=CO2(г)+НСl(г) + Н2О (ж) Реакции H0сгор., 298 Толуол 3948 С7Н8 (г.) Изобутан С4Н10 (г.) 2867 Октан С8Н18 (ж.) 5470 Глицерин С3Н8О3 (ж.) 1662 Фенол С6Н6О (кр.) 3063 2 MnO2 = Mn2O3 = ½ O2 С6Н6 (ж) + 3 Н2(г) = С6Н12(ж) СО (г) + 2 Н2 (г) = СН3ОН(г) 4NO(г)+6Н2О(г) = 4NH3(г)+5О2(г) 2Н2О(г) + 2 Cl2(г) = 4HСl(г)+О2(г) КамфораС10Н16О( кр.) С6Н6 (г) + 2 Н2(г) = С6Н10 (г) Сахароза С12Н22О11 кр СО (г) + 3 Н2 (г) = СН4(г) + Н2О(г) Метиламин СН5N (г) СН4(г) + Н2О(ж)= СО (г) + 3Н2 (г) 5925 5647 1085 Анилин 3396 C6H7N (ж) 4NH3(г)+5О2(г) = 4NO(г)+6Н2О(г) Пиридин C5H5N (ж) 2755 СН3Cl(г)+3/2O2(г)=CO2(г)+НСl(г) + Н2О (ж) РУДН. Кафедра физической и коллоидной химии. Специальность «Фармация ЗО. 2014г. Задание № 1 (1-ый семестр). Химическая термодинамика. Вариант 1. Часть 1. Ответы на вопросы. 1 2 3 4. 5 6 7 8 9 10 11 12 баллы Стрелкой (система окружающая среда) покажите направление переноса энергии, отвечающее следующей записи Q 0 и Q 0 ? Запишите закон термодинамики для закрытой (а) и открытой (б) системы в дифференциальной форме. Какие параметры характеризуют состояние системы? Приведите примеры. Реакция протекает при Т=const и V=const. Теплота реакции в этих условиях равна ……. (приведите вывод). Сформулируйте закон Гесса и его следствия. Стандартная теплота образования кальцита СаСО3 равна H0298,обр = 1206 кДж/моль. Напишите уравнение реакции, к которой относится этот тепловой эффект. Реакция экзотермическая или эндотермическая? Смысл H0298? Тот же вопрос для веществ строчки №10 таблицы. В изолированной системе протекает реакция СН4 = Ств. + 2Н2 . Чему равно изменение внутренней энергии и энтальпии реакции?. То же для реакции №10 Почему тепловой эффект реакции Ств. + 2Н2 = СН4 равен теплоте образования метана. Запишите H0реакции для реакции №1 . Какое соотношение между изменением энтропии S (в также U, G, Q) в равновесном и неравновесном процессах? Единицы измерения S U, G, Q. Определите соотношение (поставьте знаки >, <, =) между S(тв..) , S(жид.) , S(пар,газ) . Как надо проводить процесс, чтобы G было равно максимальной полезной работе W`? Будет ли протекать химическая реакция произвольно при постоянных Т и р , если для неё Н 0 и S 0 ? Ответ обоснуйте. Как рассчитать стандартное изменение энергии Гиббса G0 реакции №10 (см таблицу), если известны: а) тепловой эффект реакции Н0 и стандартные энтропии каждого из веществ Si0 ; б) величины G0 образ. каждого участника реакции; в) константа равновесия реакции Кр ? 1 Часть 2. Расчеты термодинамических функций химической реакции 25 2 2 2 3 2 2 2 1 2 1 5 Для реакции 6СН3Сl газ + P2O3 ж. + 3 H2O газ = 6СН3OH ж. + 2PCl3 газ вычислите 1) Hо 298 , 2) Uо 298 , 3) Sо 298 , 4) Gо 298 , 5) HоТ , 6) SоТ , 7) GоТ пользуясь справочными данными: СН3Сl газ PCl3 газ H2O газ P2O3 ж. СН3OH ж о H обоаз., кДж/моль 86,3 287 242,8 1097 238,6 о 0 40,75 71,84 188,7 144,4 81,6 С р , Дж / моль К o 0 234,5 312 33,6 142 126,78 S 298 , Дж / моль К Какие термодинамические функции используются в расчетах? Как определить пойдет 0 ли реакция при комнатной температуре (25 0С) и при температуре С РУДН. Кафедра физической и коллоидной химии. Специальность «Фармация ЗО. 2014г. Задание № 1 (1-ый семестр). Химическая термодинамика. Вариант 2. Часть 1. Ответы на вопросы. 1 2 3 4. 5 6 7 8 9 10 11 12 Назовите и охарактеризуйте формы передачи энергии от системы к окружающей среде. Запишите закон термодинамики для закрытой системы в интегральной форме и в дифференциальной форме. баллы 1 2 Стрелкой (система окружающая среда) покажите направление переноса энергии, отвечающее следующей записи Q <0 и W0. Тело изобарически нагревается от температуры Т1 до температуры Т2. Чему равно Н ? Какая связь между энтальпией и внутренней энергией? Н и U? В изолированной системе протекает реакция Н2Ож = ½ О2 + Н2. Что больше изменение внутренней энергии или изменение энтальпии этой реакции? Ответьте на тот же вопрос, если Н2О – пар. Стандартная теплота сгорания газообразного метана равна H0298 = 890 кДж/моль. Напишите уравнение реакции, к которой относится этот тепловой эффект. Реакция экзотермическая или эндотермическая? Смысл H0298? Тот же вопрос для вещества по таблице (строчка 2). Стандартная теплота образования газообразного метантиола СН4S равна H0298 = 23 кДж/моль. Напишите уравнение реакции, к которой относится этот тепловой эффект. Реакция экзотермическая или эндотермическая? Смысл H0298? Тот же вопрос для веществ по таблице (строчка 2). Чему равен тепловой эффект реакции № 8 (таблица), если известны теплоты образования H0298 образ. веществ ? Смысл H0298? Для водорода H0298,обр= … Какое соотношение между S и приведенной теплотой Q/T в случае неравновесного самопроизвольного процесса ? Как рассчитать стандартное изменение энтропии S0 реакции № 8 (см вопрос 7), если известны стандартные энтропии всех участников реакции S0 i ? В каких единицах измеряется энтропия ? Как изменяется энтропия вещества при его охлаждении? Как рассчитать стандартное изменение энергии Гиббса G0 реакции № 8 (см таблицу), если известны: а) тепловой эффект реакции Н0 и стандартные энтропии каждого из веществ Si0 ; б) величины G0 образ. каждого участника реакции; в) константа равновесия реакции Кр ? 1 Часть 2. Расчеты термодинамических функций химической реакции 25 2 2 2 3 2 2 2 1 5 Для реакции 6 NO2 газ + H2SO4 жид. + 2 H2Oжид = Sтв, ромб + 6 HNO3 жид вычислите 1) Hо 298 , 2) Uо 298 , 3) Sо 298 , 4) Gо 298 , 5) HоТ , 6) SоТ , 7) GоТ пользуясь справочными данными: HNO3 жид Sтв NO2 газ H2Oжид H2SO4 жид. о 0 34,19 H обоаз., кДж/моль 173,0 285,8 814 о 0 109,9 22,68 36,66 75,3 138,9 С р , Дж / моль К o 0 156,16 31,92 240,06 69,9 156,9 S 298 , Дж / моль К Какие термодинамические функции используются в расчетах? Как определить пойдет 0 ли реакция при комнатной температуре (25 0С) и при температуре С РУДН. Кафедра физической и коллоидной химии. Специальность «Фармация ЗО. 2014г. Задание № 1 (1-ый семестр). Химическая термодинамика. Вариант 3. баллы Часть 1. Ответы на вопросы. 1 2 3 4. 5 6 7 8 9 10 11 12 Работа, совершаемая системой над окружающей средой, считается положительно или отрицательной? Запишите закон термодинамики для открытой системы в интегральной форме и в дифференциальной форме. 2 Стрелкой (система окружающая среда) покажите направление переноса энергии, отвечающее следующей записи Q < 0 и W 0/ При каких условиях проведения реакции Q =U (а) и Q =Н (б) ? Стандартная теплота образования сгорания уксусной кислоты С2Н4О2 (ж) равна H0298 = 875 кДж/моль, а теплота образования H0298 обр = 484 кДж/моль Напишите уравнения реакции, к которым относится тепловой эффект. Реакция экзотермическая или эндотермическая? Смысл H0298 обр? Тот же вопрос для веществ из таблицы, строчка 3. Для реакции № 3 (см. таблицу) напишите уравнение для расчета изменения теплоемкости в ходе реакции по справочным теплоемкостям веществ С0р. Если реакция №7 протекает в изолированной системе, то чему равно изменение внутренней энергии и энтальпии реакции? Чему равен тепловой эффект реакции №3, если известны теплоты сгорания H0298.,сг (теплоты образования H0298 образ.) каждого из веществ ? Смысл H0298? В каком случае можно считать, что тепловой эффект реакции увеличивается с повышением температуры? Какое уравнение описывает зависимость H от Т? Каково соотношение между S и приведенной теплотой Q/T в случае: а) равновесного, б) неравновесного самопроизвольного процесса ? Какое соотношение между изменением энтропии S, а также (Н, U и G,) в равновесном и неравновесном процессах? Будет ли протекать химическая реакция произвольно при постоянных Т и р , если для неё Н > 0 и S < 0 ? Что означает, что S < 0? Как рассчитать стандартное изменение энергии Гиббса G0 реакции №7 (см таблицу), если известны: а) тепловой эффект реакции Н0 и стандартные энтропии каждого из веществ Si0 ; б) величины G0 образ. каждого участника реакции; в) константа равновесия реакции Кр ? 1 Часть 2. Расчеты термодинамических функций химической реакции 25 1 3 1 2 2 2 2 2 2 5 Для реакции CO2 газ + H2O жид. + HCl газ = CH3Cl газ + 3/2 O2 газ вычислите 1) Hо 298 , 2) Uо 298 , 3) Sо 298 , 4) Gо 298 , 5) HоТ , 6) SоТ , 7) GоТ пользуясь справочными данными: H о ккал/моль С р , кал / моль 0К So298 , кал / моль 0К о обоаз., CH3Cl газ - 19,6 7,2 55,97 O2 газ 0 7,02 49,0 CO2 газ - 94,05 8,87 51,06 H2Oжид - 68,31 18,0 16,7 HCl газ - 22,06 6,94 44,62 Какие термодинамические функции используются в расчетах? Как определить пойдет 0 ли реакция при комнатной температуре (25 0С) и при температуре С РУДН. Кафедра физической и коллоидной химии. Специальность «Фармация ЗО. 2014г. Задание № 1 (1-ый семестр). Химическая термодинамика. Вариант 4. баллы Часть 1. Ответы на вопросы. 1 2 3 4. 5 6 7 8 9 10 11 12 Теплота, полученная системой из окружающей среды, считается положительной или отрицательной? Запишите закон термодинамики для изолированной системы в интегральной форме и в дифференциальной форме. 2 Стрелкой (система окружающая среда) покажите направление переноса энергии, отвечающее следующей записи W <0 и W <0 . Что означает W < 0 ? Реакция А+В=С+Е протекает при постоянных температуре и объеме. Зависит ли теплота реакции от пути процесса? Изменению, какой функции состояния равна теплота реакции в этих условиях? Приведите вывод. В изолированной системе протекает реакция СО (г) + 2 Н2 (г) = СН3ОН(г) Чему равно изменение внутренней энергии и энтальпии реакции? Для реакции вопроса 4 напишите уравнение для расчета изменения теплоемкости в ходе реакции по справочным данным теплоемкости веществ Ср. Стандартная теплота образования жидкого бензола С6Н6 равна H0298, обр = 49 кДж/моль, а теплота сгорания H0298, сг = 3267 кДж/моль Напишите уравнения реакций, к которым относится этот тепловой эффект. Реакция экзотермическая или эндотермическая? Тот же вопрос для веществ из таблицы, строчка 4. В каком случае можно считать, что тепловой эффект реакции не зависит от температуры? Напишите математическое выражение закона термодинамики для конечного и бесконечно малого изменения состояния системы в равновесном процессе для а) изолированной системы, б) закрытой системы. Протекает ли химическая реакция самопроизвольно в изобарно-изотермических условиях, если Н 0 и S 0 (что это означает) ? Без расчета определите знак S ( >, <, =0 ) в реакции 2 MnO2 = Mn2O3 = ½ O2 Ответ обоснуйте. Как рассчитать стандартное изменение энтропии S0 реакции № 9), если известны стандартные энтропии всех участников реакции S0 i ? Как рассчитать стандартное изменение энергии Гиббса G0 реакции № 9 (см таблицу), если известны: а) тепловой эффект реакции Н0 и стандартные энтропии каждого из веществ Si0 ; б) величины G0 образ. каждого участника реакции; в) константа равновесия реакции Кр ? 1 Часть 2. Расчеты термодинамических функций химической реакции 25 Для реакции J2 тв + 2 KOH тв + O2 газ вычислите 1) Hо 298 , 2) Uо 298 , 3) Sо 298 пользуясь справочными данными: KJтв о H обоаз., кДж/моль 327,9 53,0 Со р , Дж / моль 0К o 0 106,4 S 298 , Дж / моль К = 2 KJтв + O3 газ + 2 2 1 3 1 2 2 2 2 5 H2Oжид , 4) Gо 298 , 5) HоТ , 6) SоТ , 7) GоТ O3 газ 142,26 39,25 238,8 O2 газ 0 29,37 205,0 H2Oжид 285,8 75,3 69,9 J2 тв 0 54,44 116,14 KOH тв 424,7 65,6 79,28 Какие термодинамические функции используются в расчетах? Как определить пойдет 0 ли реакция при комнатной температуре (25 0С) и при температуре С РУДН. Кафедра физической и коллоидной химии. Специальность «Фармация ЗО. 2014г. Задание № 1 (1-ый семестр). Химическая термодинамика. Вариант 5 баллы Часть 1. Ответы на вопросы. 1 2 3 4. 5 6 7 8 9 10 11 12 Назовите и охарактеризуйте формы передачи энергии от системы к окружающей среде.. 2 Стрелкой (система окружающая среда) покажите направление переноса энергии, отвечающее следующей записи W < 0. Смысл W? Какие величины не зависят от пути процесса (U , W, H, F, Q, G ). Назовите их и дайте объяснение. Стандартная теплота сгорания кристаллического фенола С6Н6О равна H0298 = 3063 кДж/моль. Напишите уравнение реакции, к которой относится этот тепловой эффект. Реакция экзотермическая или эндотермическая? Смысл H0298? Тот же вопрос для жидкого глицерина (см. таблицу, вариант №5). Реакция протекает при Т=const и V=const . Изменению какой функции состояния равна теплота реакции в этих условиях? Объясните почему (вывод)? Изменение теплоемкости в ходе реакции Ср<0. Как изменится тепловой эффект реакции при понижении и повышении температуры? Напишите уравнение. Чему равен тепловой эффект реакции С6Н12(ж) = С6Н6 (ж) + 3 Н2(г), если известны теплоты образования H0298 образ. углеводородов ? Смысл H0298? Чему равно H0298 образ. Н2? Тело изобарически нагревается от температуры Т1 до температуры Т2. Н = ? Напишите математическое выражение закона термодинамики для конечного и бесконечно малого изменения состояния системы в равновесном и неравновесном самопроизвольном процессах для изолированной системы. Чему равно изменение энтропии S в процессе испарения вещества Н2О(жид.).Н2О(пар)? Какой знак (>0, <0, =0) имеет S? В каком случае будет протекать химическая реакция произвольно при постоянных Т и р , если для неё Н < 0 и S 0 ? Как рассчитать стандартное изменение энергии Гиббса G0 реакции (см таблицу №4), если известны: а) тепловой эффект реакции Н0 и стандартные энтропии каждого из веществ Si0 ; б) величины G0 образ. каждого участника реакции; в) константа равновесия реакции Кр ? 1 Часть 2. Расчеты термодинамических функций химической реакции 25 2 3 2 2 2 1 2 1 2 5 Для реакции 6 СН3OH ж. + 2PCl3 газ = 6 СН3Сl газ + P2O3 ж. + 3 H2O газ вычислите 1) Hо 298 , 2) Uо 298 , 3) Sо 298 , 4) Gо 298 , 5) HоТ , 6) SоТ , 7) GоТ пользуясь справочными данными: Hообоаз., кДж/моль Со р , Дж / моль 0К So298 , Дж / моль 0К СН3OH ж. 238,6 81,6 126,78 PCl3 газ 287 71,84 312 H2O газ 242,8 188,7 33,6 P2O3 ж. 1097 144,4 142 СН3Сl газ 86,3 40,75 234,5 Какие термодинамические функции используются в расчетах? Как определить пойдет 0 ли реакция при комнатной температуре (25 0С) и при температуре С РУДН. Кафедра физической и коллоидной химии. Специальность «Фармация ЗО. 2014г. Задание № 1 (1-ый семестр). Химическая термодинамика. Вариант 6. Часть 1. Ответы на вопросы. 1 2 3 4. 5 6 7 8 9 10 11 12 баллы Работа, совершаемая окружающей средой над системой, считается положительно или отрицательной? Запишите закон термодинамики для закрытой системы в интегральной форме и в дифференциальной форме. Какие величины не зависят от пути процесса (U , W, H, F, Q, G ). Назовите их. Какой смысл имеет внутренняя энергия U ? U? Идеальный газ изотермически расширяется. Чему равна работа расширения n молей газа? Стандартная теплота сгорания жидкого этилацетата С4Н8О2 равна H0298 = 2246 кДж/моль. Напишите уравнение реакции, к которой относится этот тепловой эффект. Реакция экзотермическая или эндотермическая? Смысл H0298 сгор? Тот же вопрос для камфоры (см. таблицу строчка 6). Стандартная теплота образования газообразного циклобутана С4Н8 равна H0298 = 26,6 кДж/моль. Напишите уравнение реакции, к которой относится этот тепловой эффект. Эта реакция экзотермическая или эндотермическая? Смысл H0298? Ответьте на тот же вопрос для веществ таблицы (вещества под №6). Чему равно U и Н для реакций СН4(г) + Н2О(ж)= СО (г) + 3Н2 (г.) и СН4(г) + Н2О(пар)= СО (г) + 3Н2 (г), протекающих в изолированной системе. Напишите математическое выражение закона термодинамики для конечного (бесконечно малого) изменения состояния системы в равновесном процессе для а) изолированной системы, б) закрытой системы. Какое соотношение между изменением энтропии S в равновесном и неравновесном процессах? Тот же вопрос для U, G, Q. Как проводится процесс, чтобы G было равно максимальной полезной работе W`? Определите соотношение (знаки >, <, =) между S(тв..) , S(жид.) , S(пар,газ) . В каких единицах измеряется энтропия, энергия Гиббса G, теплота Q , работа W, внутренняя энергия, энтальпия H, теплоемкость С ? Как рассчитать стандартное изменение энергии Гиббса G0 реакции № 6 (см таблицу), если известны: а) тепловой эффект реакции Н0 и стандартные энтропии каждого из веществ Si0 ; б) величины G0 образ. каждого участника реакции; в) константа равновесия реакции Кр ? 2 Часть 2. Расчеты термодинамических функций химической реакции 25 2 1 3 2 2 2 2 1 1 2 5 Для реакции 4 NO газ + 6 Н2О ж. = 4 NН3 газ + 5О2 газ вычислите 1) Hо 298 , 2) Uо 298 , 3) Sо 298 , 4) Gо 298 , 5) HоТ , 6) SоТ , 7) GоТ пользуясь справочными данными: NO газ H2O ж. NН3 газ О2 газ о 91,3 0 H обоаз., кДж/моль 285,8 46,9 о 0 29,9 75,3 35,16 29,4 С р , Дж / моль К o 0 211 69,9 192,6 205,04 S 298 , Дж / моль К Какие термодинамические функции используются в расчетах? Как определить пойдет 0 ли реакция при комнатной температуре (25 0С) и при температуре С РУДН. Кафедра физической и коллоидной химии. Специальность «Фармация ЗО. 2014г. Задание № 1 (1-ый семестр). Химическая термодинамика. Вариант 7. баллы Часть 1. Ответы на вопросы. 1 2 3 4. 5 6 7 8 9 10 11 12 Работа, совершаемая системой над окружающей средой, считается положительно или отрицательной? Запишите закон термодинамики для изолированной системы в интегральной форме и в дифференциальной форме. 2 Стрелкой (система окружающая среда) покажите направление переноса энергии, отвечающее следующей записи Q <0 Идеальный газ изотермически расширяется. Чему равна работа расширения n молей газа? Стандартная теплота сгорания жидкого циклопентана С5Н10 равна H0298 = 3290 кДж/моль. Напишите уравнение реакции, к которой относится этот тепловой эффект. Реакция экзотермическая или эндотермическая? Смысл H0298? Тот же вопрос для изобутана (см. таблицу, строчка 7). Реакция протекает при Т=const и p=const . Изменению какой функции состояния равна теплота реакции в этих условиях? Объясните почему? В изолированной системе протекает реакция ½ О2 + Н2 = Н2Ож.. Чему равно изменение внутренней энергии и энтальпии реакции? Чему равен тепловой эффект реакции С6Н6 (ж) + 3 Н2(г) = С6Н12(ж), если известны теплоты сгорания H0298.,сг (теплоты образования H0298 образ.) каждого из веществ ? Смысл H0298? Какое соотношение между изменением энтропии S (U, G, W) в равновесном и неравновесном процессах? Как рассчитать стандартное изменение энтропии S0 той же реакции (см вопрос 7), если известны стандартные энтропии всех участников реакции S0 i ? В каких единицах измеряется энтропия, энергия Гиббса G, теплота Q , работа W, внутренняя энергия, энтальпия H, теплоемкость С ? Будет ли протекать химическая реакция произвольно при постоянных Т и р , если для неё Н >0 и S< 0 ? Как рассчитать стандартное изменение энергии Гиббса G0 реакции №2 (см таблицу), если известны: а) тепловой эффект реакции Н0 и стандартные энтропии каждого из веществ Si0 ; б) величины G0 образ. каждого участника реакции; в) константа равновесия реакции Кр ? 2 Часть 2. Расчеты термодинамических функций химической реакции 25 1 3 2 2 2 1 2 1 2 5 Для реакции Sтв, ромб + 6 HNO3 жид = 6 NO2 газ + H2SO4 жид. + 2 H2Oжид вычислите 1) Hо 298 , 2) Uо 298 , 3) Sо 298 , 4) Gо 298 , 5) HоТ , 6) SоТ , 7) GоТ пользуясь справочными данными: H о обоаз., кДж/моль Со р , Дж / моль 0К So298 , Дж / моль 0К HNO3 жид 173,0 109,9 156,16 Sтв 0 22,68 31,92 NO2 газ 34,19 36,66 240,06 H2Oжид 285,8 75,3 69,9 H2SO4 жид. 814 138,9 156,9 Какие термодинамические функции используются в расчетах? Как определить пойдет 0 ли реакция при комнатной температуре (25 0С) и при температуре С РУДН. Кафедра физической и коллоидной химии. Специальность «Фармация ЗО. 2014г. Задание № 1 (1-ый семестр). Химическая термодинамика. Вариант 8. баллы Часть 1. Ответы на вопросы. 1 2 3 4. 5 6 7 8 9 10 11 12 Запишите закон термодинамики для закрытой системы в интегральной форме и в дифференциальной форме. Объясните его смысл. 2 Стрелкой (система окружающая среда) покажите направление переноса энергии, отвечающее следующей записи Q > 0. При каких условиях проведения реакции Q =U ? Почему? Стандартная теплота образования газообразного пропилена С3Н6 равна H0298 = 20,4 кДж/моль. Напишите уравнение реакции, к которой относится этот тепловой эффект. Эта реакция экзотермическая или эндотермическая? Смысл H0298? Аналогичный вопрос (см.список веществ в таблице под №8 ). В изолированной системе протекает реакция ½ О2 + Н2 = Н2Опар,. Чему равно изменение внутренней энергии и энтальпии реакции? Для реакции в таблице под №1 напишите уравнение для расчета изменения теплоемкости в ходе реакции по справочным данным теплоемкости веществ Ср. Чему равен тепловой эффект реакции (в таблице №1), если известны теплоты образования H0298 образ. каждого из веществ ? Смысл H0298? Как рассчитать стандартное изменение энтропии S0 реакции (см.№8 в таблице), если известны стандартные энтропии всех участников реакции S0 i ? Каково соотношение между S и приведённой теплотой Q/T в случае неравновесного самопроизвольного процесса ? Будет ли протекать химическая реакция произвольно при постоянных Т и р , если для неё Н < 0 и S>0 ? Как надо проводить процесс, чтобы G было равно максимальной полезной работе W`? Как рассчитать стандартное изменение энергии Гиббса G0 реакции (см. таблицу), если известны: а) тепловой эффект реакции Н0 и стандартные энтропии каждого из веществ Si0 ; б) величины G0 образ. каждого участника реакции; в) константа равновесия реакции Кр ? 1 Часть 2. Расчеты термодинамических функций химической реакции 25 1 3 2 2 2 2 1 2 2 5 Для реакции CH3Cl газ + 3/2 O2 газ = CO2 газ + H2O жид. + HCl газ вычислите о о о о о 1) H 298 , 2) U 298 , 3) S 298 , 4) G 298 , 5) H Т , 6) SоТ 7) GоТ пользуясь справочными данными: Hообоаз., ккал/моль Со р , кал / моль 0К So298 , кал / моль 0К CH3Cl газ 19,6 7,2 55,97 O2 газ 0 7,02 49,0 CO2 газ 94,05 8,87 51,06 H2Oжид 68,31 18,0 16,7 HCl газ 22,06 6,94 44,62 Какие термодинамические функции используются в расчетах? Как определить пойдет 0 ли реакция при комнатной температуре (25 0С) и при температуре С . РУДН. Кафедра физической и коллоидной химии. Специальность «Фармация ЗО. 2014г. Задание № 1 (1-ый семестр). Химическая термодинамика. Вариант 9. баллы Часть 1. Ответы на вопросы. 1 2 3 4. 5 6 7 8 9 10 11 12 Стрелкой (система окружающая среда) покажите направление переноса энергии, отвечающее следующей записи W0. Тоже для Q <0 . Смысл W и Q ? Идеальный газ изотермически сжимается. Чему равна работа сжатия n молей газа? Она положительная или отрицательная? Когда она максимальная? При каких условиях проведения реакции Q =Н ? Приведите вывод. Стандартная теплота образования жидкого хлороформа (трихлорметана) СНCl3 равна H0298 обр = 132 кДж/моль. Напишите уравнение реакции, к которой относится этот тепловой эффект. Реакция экзотермическая или эндотермическая? Смысл H0298? Тот же вопрос для веществ из таблицы, №9. Чему равен тепловой эффект реакции (см таблицу), если известны теплоты образования H0298 образ.? Чему равна H0298 образ. Н2 и О2? Для реакции № 9 из таблицы, что больше H или U? На какую величину? В изолированной системе протекает реакция С6Н12(ж) = С6Н6 (ж) + 3 Н2(г). Чему равно U и H реакции? Тот же вопрос для С6Н12(г) = С6Н6 (г) + 3 Н2(г). В каком случае можно считать, что тепловой эффект реакции не зависит от температуры? Ответ обоснуйте. Каково соотношение между S и приведенной теплотой Q/T в случае: а) равновесного, б) неравновесного самопроизвольного процесса ? Система состоит из трех частей, энтропия которых S1 , S2 , S3 . Как вычислить энтропию всей системы? Будет ли протекать химическая реакция произвольно при постоянных Т и р , если для неё Н > 0 и S 0 ? Как рассчитать стандартное изменение энергии Гиббса G0 реакции № 5 (см таблицу), если известны: а) тепловой эффект реакции Н0 и стандартные энтропии каждого из веществ Si0 ; б) величины G0 образ. каждого участника реакции; в) константа равновесия реакции Кр ? 2 Часть 2. Расчеты термодинамических функций химической реакции 25 2 1 3 2 2 2 1 2 1 2 5 Для реакции 2С2Н5ОН газ = С4Н6 ж. + 2Н2О ж. + Н2 газ вычислите 1) Hо 298 , 2) Uо 298 , 3) Sо 298 , 4) Gо 298 , 5) HоТ , 6) SоТ , 7) GоТ пользуясь справочными данными: H о кДж/моль С р , Дж / моль 0К So298 , Дж / моль 0К о обоаз., С2Н5ОН газ 234,8 65,75 281,4 С4Н6 ж. + 110,2 79,5 278,74 H2O ж. 285,8 75,3 69,9 Н2 газ 0 28,9 130,5 Какие термодинамические функции используются в расчетах? Как определить пойдет 0 ли реакция при комнатной температуре (25 0С) и при температуре С РУДН. Кафедра физической и коллоидной химии. Специальность «Фармация ЗО. 2014г. Задание № 1 (1-ый семестр). Химическая термодинамика. Вариант 10. баллы Часть 1. Ответы на вопросы. 1 2 3 4. 5 6 7 8 9 10 11 12 Какие параметры характеризуют состояние системы? Назовите формы передачи энергии от системы к окружающей среде. Тело изохорически нагревается от температуры Т1 до температуры Т2. Чему равно U ? Напишите вывод уравнения. Стандартная теплота образования кристаллического ZnCO3 Hf0298 = 812,5 кДж/моль. Напишите уравнения реакции, к которой относится этот тепловой эффект. Эта реакция экзотермическая или эндотермическая? Смысл Hf0298? Тот же вопрос по таблице под №10. Зависит ли величина теплоты образования соединения от способа его получения? Ответ обоснуйте. В изолированной системе протекает реакция Ств. + 2Н2 = СН4. Чему равно изменение внутренней энергии и энтальпии реакции? Тот же вопрос по таблице для реакции под №10. Изменение теплоемкости в ходе реакции Ср > 0. Как изменится тепловой эффект реакции при повышении и понижении температуры? Дайте объяснение. Для каких реакций из списка H больше U и на какую величину? Приведите примеры, когда H = U ? Напишите математическое выражение закона термодинамики для конечного и бесконечно малого изменения состояния системы в равновесном и неравновесном самопроизвольном процессе, протекающем в закрытой системе. От каких параметров зависит стандартное изменение энергии Гиббса G0 в реакции А+В=С (р, Т, V, природа веществ, концентрация реагентов) ? Без расчета определите знак S ( >, <, =0 ) в реакции Н2(газ) + Br2(газ) = 2НBr(жид.). Ответ обоснуйте. Как изменяется энергия Гельмгольца, энергия Гиббса и энтропия если в закрытой системе протекает несамопроизвольный процесс? Как рассчитать стандартное изменение энергии Гиббса G0 реакции №3 (см. таблицу), если известны: а) тепловой эффект реакции Н0 и стандартные энтропии каждого из веществ Si0 ; б) величины G0 образ. каждого участника реакции; в) константа равновесия реакции Кр ? 1 Часть 2. Расчеты термодинамических функций химической реакции 25 Для реакции 2 KJтв + O3 газ + H2Oжид вычислите 1) Hо 298 , 2) Uо 298 , 3) Sо 298 пользуясь справочными данными: KJтв о H обоаз., кДж/моль 327,9 о 0 53,0 С р , Дж / моль К o 0 106,4 S 298 , Дж / моль К 2 3 1 2 2 2 2 2 1 2 5 = J2 тв + 2 KOH тв + O2 газ , 4) Gо 298 , 5) HоТ , 6) SоТ , 7) GоТ O3 газ 142,26 39,25 238,8 O2 газ 0 29,37 205,0 H2Oжид 285,8 75,3 69,9 J2 тв 0 54,44 116,14 KOH тв 424,7 65,6 79,28 Какие термодинамические функции используются в расчетах? Как определить пойдет 0 ли реакция при комнатной температуре (25 0С) и при температуре С