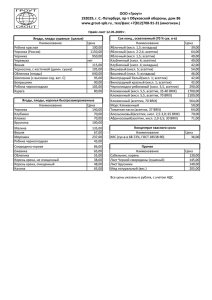
7. тематический план изучения дисциплины
advertisement

Министерство образования и науки Российской Федерации Государственное образовательное учреждение высшего профессионального образования «Российский экономический университет им. Г. В. Плеханова» Факультет экономики торговли и товароведения Кафедра химии и физики РАБОЧАЯ ПРОГРАММА УЧЕБНОЙ ДИСЦИПЛИНЫ «Органическая химия» Направление подготовки 260800 «Технология продукции и организации общественного питания» Профили подготовки: Квалификация (степень) выпускника - бакалавр Москва 2010 1 Составитель: к.х.н., доцент Фирсова Ю.Н. . Рецензент: д.т.н., профессор Сагалович В.П.___________________. ученая степень, ученое звание, Ф.И.О. ____________________________________________________________________. (наименование организации, где работает рецензент) Программа дисциплины «Органическая химия», включает основные понятия и законы химии, строение и свойства основных классов органических соединений Программа предназначена для студентов Инженерно-экономического факультета и входит в цикл Б2. Рабочая программа дисциплины составлена на основании Направлению 260800 . ФГОС ВПО по «Технология продукции и организации общественного питания» (ФГСО ВПО по направлению, примерной программы по профилю) Рабочая программа утверждена на заседании кафедры протокол № 4 от «21» декабря 2010года. Заведующий кафедрой __________ (подпись) Одобрено советом (методической факультета, протокол № ___ , от « » Попов А. А. (Ф.И.О.) комиссией) Председатель _________ ______________________ (подпись) . (Ф.И.О.) 2 химии и физики , . __________________________________ 20 года. Содержание: 1. Организационно – методический раздел 2. Место дисциплины в структуре ООП ВПО 3. Требования к результатам освоения содержания дисциплины 4. Содержание программы учебной дисциплины 4.1. Содержание разделов дисциплины 4.2. Обеспечение содержания дисциплины 4.3. Образовательные технологии 5. Учебно-методическое, информационное и материально-техническое обеспечение дисциплины 5.1. Литература 5.2. Рекомендации по использованию Интернет-ресурсов и других электронных информационных источников 6. Оценочные средства 6.1. Вопросы к зачету и экзамену 6.2. Примеры тестов для контроля знаний 7. Тематический план изучения дисциплины 3 4 4 4 8 8 20 23 24 24 24 25 25 26 31 1. ОРГАНИЗАЦИОННО–МЕТОДИЧЕСКИЙ РАЗДЕЛ. Цель дисциплины: -получить базовые химические знания для изучения всех последующих общих химических и специальных дисциплин, необходимых для подготовки специалистовбакалавров. -дать понимание современных представлений о строении и свойствах органических веществ, являющихся основой пищевого и промышленного сырья. -подготовить студентов к изучению биохимии, пищевой химии и основ товароведения промышленных и продовольственных товаров. -выработать экспериментальные навыки, необходимые при исследовании состава и свойств сырья и товаров по областям применения. -дать понимание основ химических методов анализа, научить студентов владению методами, используемыми при оценке показателей качества. Учебные задачи дисциплины: 1 . Изучение основных разделов органической химии, а именно: -классы и номенклатура органических соединений -химическая связь и механизмы ее образования; - общетеоретические основы строения органических веществ -химические свойства и превращения органических соединений; - основные механизмы реакций органических веществ. 2. Раскрытие практических аспектов использования системы знаний по химии в деятельности будущих бакалавров в области технологии продуктов питания таких как: -методы разделения, очистки и идентификации органических веществ при исследовании сырья. -принципы аналитического определения, методы химического анализа, метрологические аспекты. Методы преподавания дисциплины: Словесный, практический, наглядный методы обучения, работа с книгой. Самостоятельная работа студентов, в которую входит освоение теоретического материала, подготовка к лабораторным работам, их защита, оформление отчета по выполненным заданиям, а также выполнение письменных и устных домашних заданий. 2. МЕСТО ДИСЦИПЛИНЫ В СТРУКТУРЕ ООП ВПО Программа курса «Органическая химия» предназначена для студентов 2 курса Инженерноэкономического факультета. В процессе изучения учебной дисциплины студенты получают базовые знания, необходимые для лучшего понимания и усвоения учебного материала по дисциплине. Для изучения данного курса студенты должны овладеть знаниями основ органической химии, научных законов естествознания, а также математической статистики. 3.Требования к результатам освоения содержания дисциплины В результате изучения учебной дисциплины «Органическая химия» студенты должны: знать: -теорию основных разделов химии в соответствии с данной программой; - проявление теоретических закономерностей в растворах пищевых и непищевых компонентов (в гомогенных и гетерогенных системах). -основные законы химии, общетеоретические основы строения органических веществ и основные механизмы реакций. уметь: -применять теоретические знания по химической связи и строению молекул к компонентам пищевых и непищевых систем; 4 -проводить исследования по заданной методике и анализировать результаты экспериментов (ПК-30) -решать практические задачи и применять полученные знания в процессе изучения специальных дисциплин; -изучать и анализировать научно-техническую информацию, отечественный и зарубежный опыт по производству продуктов питания; -применять методы математического анализа и моделирования, теоретического и экспериментального исследования органических веществ при изучении сырья (ПК-3); -измерять и составлять описание проводимых экспериментов, подготавливать данные для составления обзоров, отчетов и научных публикаций (ПК-32) владеть: -основными методами технической безопасности. -статистическими методами и средствами обработки экспериментальных данных проведенных исследований (ПК-32) -самостоятельной работы в химической лаборатории, проведения химанализа для последующего его использования при контроле качества продуктов питания. Формы контроля: 1.Текущий контроль. Выдается задание для самоподготовки. Этот материал студент должен проработать до выполнения лабораторных работ. Письменный ответ на вопросы для самоконтроля рассматривается как допуск к выполнению лабораторной работы. Интенсификация учебного процесса, сокращение времени на проверку усвоения студентами отдельных разделов практикума достигается применением контролирующим программ- тестов. Программы используются для проведения экспресс-контроля, а также для самостоятельной подготовки студентов к выполнению лабораторных работ. Проверка отчета по выполненной лабораторной работе, защита работы, включающая усвоение учебного материала по отдельным разделам дисциплины осуществляется в форме собеседования, а также компьютерного тестирования. 2. Итоговый контроль. Итоговым контролем по дисциплине является экзамен, проводимый в письменном виде. Формирование итоговой оценки по дисциплине с использованием бально-рейтинговой оценки работы студента в семестре. Пример формирования итоговой оценки по дисциплине с использованием балльнорейтинговой оценки работы студента Форма контроля Посещаемость Контрольные и домашние работы дисциплины Индивидуальный проект (творческий рейтинг) Работа на занятиях Экзамен (зачет) ИТОГО Максимальное количество баллов 2,0 2,0 1,0 1,0 4,0 10,0 Формирование рейтинга до экзамена осуществляется следующим образом: 5 1. Оценка выполненных домашних работ (каждая домашняя работа может оценена по 0,25 балла из расчета 2 балла рейтинговой оценки на 8 домашних работ) Номера домашних работ и доля их выполнения ФИО Итого студента 1 2 3 4 5 6 7 8 Требуемый объем выполнения 6 4 5 5 4 6 8 4 (кол-во заданий) 1. Иванов 4/6 4/4 5/5 4/5 4/4 5/6 5/8 2/4 6,425 П.Я. 2. Петров В.Л. 3/6 2/4 5/5 3/5 4/4 2/6 7/8 3/4 5,558 3. Семенов 6/6 3/4 5/5 4/5 4/4 5/6 8/8 4/4 7,383 А.И. 2. Оценка выполненной самостоятельной работы (индивидуальный творческий рейтинг) Блоки к самостоятельной задаче и доля их выполнения ФИО студента Итого Балл 1 2 3 4 5 Требуемый объем выполнения 3 3 3 3 3 1,0 (кол-во заданий) 1. Иванов П.Я. 2/3 3/3 3/3 2/3 1/3 3,667 0,73 2. Петров В.Л. 2/3 2/3 3/3 3/3 2/3 4 0,80 3. Семенов 3/3 2/3 3/3 3/3 3/3 4,667 0,93 А.И. быть Балл 2,0 1,61 1,39 1,85 проект, 3. Оценка работы на занятиях 20 13 15 Работа на занятия х 20 11 15 18 18 Посещаемость Максимально 1. Иванов П.Я. 2. Петров В.Л. 3. Семенов А.И. Кол-во пропуско в Балл за посещае -мость Балл за работу на занятиях 7 5 2,0 1 1,5 1,0 0,55 0,75 3,0 1,55 2,25 3,89 4,44 2 2 0,9 2,90 5,68 4. Итоговый балл формируется суммированием балла за экзамен и балла, набранного перед экзаменом. Приведение суммарной оценки к пятибалльной шкале производится следующим образом: 5. Студент считается допущенным до экзамена составляет не менее 4 баллов. 6. Перевод итоговой оценки в пятибалльную шкалу 6 при условии, что его рейтинг Максимальная оценка – 10 баллов: Менее 5,0 – «неудовлетворительно»/ «незачтено» 5,0-6,9 баллов – «удовлетворительно»/ «зачтено» 7,0-8,4 баллов – «хорошо»/ «зачтено» 8,5-10,0 баллов – «отлично»/ «зачтено» 7 4. СОДЕРЖАНИЕ ПРОГРАММЫ УЧЕБНОЙ ДИСЦИПЛИНЫ «ОРГАНИЧЕСКАЯ ХИМИЯ» 4.1. Содержание разделов дисциплины “Органическая химия” № Наименование п/п разделов дисциплины 1.1 Теория химического строения. Основы стереохимии. Содержание Формируемые Результаты освоения (знать, уметь, компетенции владеть) Раздел 1. Теоретические основы органической химии Химическое строение органических соединений как природа и последовательность связей атомов в молекуле (А.М. Бутлеров). Структурные понятия: углеродный скелет, радикал, функциональная группа. Изомерия. Основы классификации органических соединений по углеродному скелету и функциональным группам. Гомология и гомологические ряды в органической химии. Принципы систематической номенклатуры ИЮПАК. Молекулярные модели и стереохимические формулы. Пространственная ПК-3, ПК-30, ПК-31, ПК-32 8 Знать: химическое строение органических соединений, порядок и последовательность связей атомов в молекуле. Уметь: изображать структурную формулу органической молекулы и давать название в соответствии с ИЮПАК, строить изомеры. Владеть: принципами систематической номенклатуры ИЮПАК и стереохимической номенклатуры (D,L-, E,Z-, и R,S-номенклатура). Образовательные технологии Презентационные лекции с использованием мультимедийных средств; лабораторные работы; самостоятельная работа литературой 1.2 Электронное строение органических соединений изомерия органических соединений (конформационная, геометрическая, оптическая). Асимметрический атом углерода. Понятие о стереохимической номенклатуре (D,L-, E,Z-, и R,S-номенклатура). Качественная электронная теория Роль валентных электронов в образовании химической связи. Типы связей в органических молекулах (ковалентные, ионные, координационные, водородные). Электронноточечные формулы (формулы Льюиса), правило октета, обобщенные и неподеленные электронные пары, формальные заряды атомов в молекуле. Квантовая органическая химия Квантовомеханическое описание химической связи. Перекрывание атомных орбиталей как необходимое условие образования ПК-3, ПК-30, ПК-31, ПК-32 9 Знать: качественную электронную теорию, квантовую теорию, типы химической связи и способы образования связей в молекуле. Уметь: рассчитывать формальные заряды атомов в молекуле, строить атомноорбитальные схемы. Владеть: методом валентных связей. Презентационные лекции с использованием мультимедийных средств; лабораторные работы; самостоятельная работа литературой 1.3 Общие принципы реакционной способности ковалентной связи: σ- и πсвязи. Гибридизация атомных орбиталей (sp3, sp2, sp). Описание органических молекул на основе метода валентных связей (ВС). Атомноорбитальные схемы органических молекул. Открытые и замкнутые сопряженные системы. Электронное строение и реакционная способность Перераспределение валентных электронов как сущность химических процессов. Способы разрыва ковалентной связи (гомолитический, гетеролитический). Промежуточные реакционноспособные частицы (радикалы, карбокатионы, карбанионы). Факторы, влияющие на распределение электронной плотности в молекуле. Понятие об индуктивном и мезомерном эффектах, электронодонорных и электроноакцепторных заместителях. ПК-3, ПК-30, ПК-31, ПК-32 10 Знать: факторы, влияющие на распределение электронной плотности в молекуле (индуктивный и мезомерный эффект), основные механизмы органических реакций, протонную и электронную теории, понятие относительной силы кислот и оснований (рКа, рКв). Уметь: описывать механизм реакций, определять силу органических кислот и оснований. Владеть: понятиями субстрат-реагент, радикал, электрофил, нуклеофил и др. Презентационные лекции с использованием мультимедийных средств; лабораторные работы; самостоятельная работа литературой; письменное домашнее задание Понятие о механизмах органических реакций Механизм реакции как последовательность элементарных стадий. Понятие о субстрате и реагенте. Одно- и многостадийные реакции, понятие о переходном состоянии и интермедиате. Современная классификация органических реакций: по результату, способу разрыва ковалентной связи и типу атакующего реагента (радикальные, электрофильные, нуклеофильные). Кислотность и основность органических соединений Понятие о протонной и электронной теориях (теории Бренстеда и Льюиса). Основные типы органических кислот и оснований. Относительная сила кислот и оснований, единицы их количественной характеристики (рКА и рКВ). Значение понятий кислотности и основности для объяснения 11 реакционной способности органических соединений. Раздел 2. Основные классы органических соединений. 2.1 Углеводороды всех гомологических рядов Предельные углеводороды Строение алканов, причины их пониженной реакционной способности, понятие о важнейших реакциях (галогенирование, окисление, крекинг), их промышленное значение. Механизм свободнорадикальных реакций, цепные реакции и их основные стадии (инициирование, рост цепи, обрыв цепи). Понятие об ингибиторах и инициаторах радикальных процессов. Относительная устойчивость углеводородных свободных радикалов. Понятие о циклоалканах, особенности строения и химические свойства. Непредельные углеводороды Классификация непредельных углеводородов (этиленовые, ПК-3, ПК-30, ПК-31, ПК-32 12 Знать: гомологический ряд алканов, алкенов, алкинов, аренов, химические и физические свойства данных классов соединений, правило Марковникова, правило Хюккеля. Уметь: записать механизмы свободнорадикального замещения, электрофильного присоединения и электрофильного замещения. Владеть: понятиями ингибитор, катализатор, мономер, олигомер, полимер, сополимер, правилами замещения I и II рода. Презентационные лекции с использованием мультимедийных средств; самостоятельная работа литературой; письменное домашнее задание ацетиленовые, диеновые). Особенности строения и реакционная способность. Реакции электрофильного присоединения. Правило Марковникова. Относительная устойчивость карбокатионов. Реакции полимеризации непредельных углеводородов. Основные понятия химии полимеров (мономер, макромолекула, олигомер, полимер, сополимер). Ароматические углеводороды Классификация аренов. Особенности электронного строения аренов. Условия ароматичности, правило Хюккеля. Важнейшие реакции электрофильного замещения (галогенирование, нитрование, сульфирование,),их промышленное значение. Правила замещения, ориентанты I и II рода. Понятие о реакциях присоединения и окисления. 13 Канцерогенность аренов. Классификация, изомерия, номенклатура. Реакции нуклеофильного замещения. Кинетические и стереохимические критерии SN1 и SN2 реакций. Реакции отщепления (элиминирования). Фреоны, ядохимикаты. Галогенопроизводные и экология. 2.3 Кислородосодержащие Спирты и фенолы соединения Классификация, изомерия, номенклатура. Электронное строение гидроксильной группы. Водородные связи, кислотность и основность. Влияние на физические свойства. Реакции нуклеофильного замещения гидроксильной группы, роль кислотного катализа, понятие о реакциях элиминирования и окисления. Представители многоатомных спиртов и фенолов (этиленгликоль, глицерин, ксилит, сорбит, гидрохинон). Понятие о простых эфирах. Альдегиды и кетоны 2.2 Галогенопроизводные углеводородов ПК-3, ПК-30, ПК-31, ПК-32 Знать: классификацию, изомерию и номенклатуру галогенопроизводных. Уметь: записать механизм нуклеофильного замещения. Владеть: понятиями SN1 и SN2 реакции. Презентационные лекции с использованием мультимедийных средств; самостоятельная работа литературой; письменное домашнее задание ПК-3, ПК-30, ПК-31, ПК-32 Знать: классификацию, изомерия, номенклатуру и гомологические ряды спиртов(фенолов), альдегидов, кетонов и карбоновых (гидроксикарбоновых) кислот. Уметь: записать механизм реакции нуклеофильного присоединения. Владеть: понятиями полуацеталь (полукеталь), основания Шиффа, оксимы, гидразоны, простые и сложные эфиры, ангидриды, амиды. Презентационные лекции с использованием мультимедийных средств; лабораторные работы; самостоятельная работа литературой; письменное домашнее задание 14 Классификация, изомерия, номенклатура. Электронное строение карбонильной группы. Реакции нуклеофильного присоединения (гидратация, образование полуацеталей и ацеталей, присоединение синильной кислоты и бисульфитов). Нуклеофильное присоединение с отщеплением, образование иминов (оснований Шиффа), оксимов, гидразонов. Окислительновосстановительные реакции. Карбоновые кислоты и их производные Классификация, изомерия и номенклатура. Электронное строение карбоксильной группы. Кислотность и основность. Функциональные производные карбоновых кислот: ангидриды, галогенангидриды, амиды, сложные эфиры. Механизмы реакций этерификации, гидролиза и омыления. Промышленные полиэфиры ( лавсан ). 15 Гидроксикарбоновые кислоты как представители гетерополифункциональных производных. Гликолевая, молочная, винная, яблочная, лимонная, изолимонная кислоты. Стереохимия гидроксикислот. 2.4 Азотосодержащие соединения Важнейшие ПК-3, ПК-30, Знать: классификацию и номенклатуру азотсодержащие ПК-31, ПК-32 аминов функциональные группы: Уметь: записать механизм взаимодействия амино-, нитрозо-, нитро-, аминов с азотистой кислотой, механизм диазо- и азогруппа. реакции азосочестания. Амины, Владеть: понятиями основность аминов классификация и номенклатура. Основность аминов. Взаимодействие аминов с азотистой кислотой. Реакции диазотирования и азосочетания, их техническое значение. Канцерогенность азотсодержащих соединений. Раздел 3. Элементы биоорганической химии. 16 Презентационные лекции с использованием мультимедийных средств; самостоятельная работа литературой; письменное домашнее задание 3.1 Углеводы (сахара) Классификация и номенклатура углеводов. Моносахариды. Пентозы и гексозы, альдозы и кетозы. Стереоизомерия моносахаридов, D- и Lряды. Циклические формы: пиранозы и фуранозы, α- и β-аномеры. Гликозидный гидроксил, явление мутаротации. Характеристика важнейших химических свойств моносахаридов (окислительновосстановительные реакции, образование гликозидов, простых и сложных эфиров). Понятие о природных гликозидах. Олиго- и полисахариды. Строение и химические свойства восстанавливающих и невосстанавливающих дисахаридов (мальтоза, сахароза). Инверсия сахарозы. Полисахариды (крахмал, целлюлоза). Строение и важнейшие химические свойства ПК-3, ПК-30, ПК-31, ПК-32 17 Знать: классификацию, строение, стереоизомерия, номенклатуру и основные химические свойства углеводов. Уметь: строить формулы Фишера и циклические формулы Хеуорса для некоторых представителей моно-, ди- и полисахаридов. Владеть: понятиями восстанавливающий/невосстанавливающий сахар, методами определения сахаров в различных органических системах. Презентационные лекции с использованием мультимедийных средств; лабораторные работы; самостоятельная работа литературой; письменное домашнее задание (реакция гидролиза, образование простых и сложных эфиров). Пищевое и техническое значение полисахаридов. Понятие об искусственных и синтетических подслащивающих веществах. 3.2 Аминокислоты, пептиды и белки Строение, классификация и стереохимия аминокислот. Образование пептидов. Полипептиды и белки. Понятие о первичной, вторичной, третичной и четвертичной структуре белковой молекулы. Роль водородных, ионных, дисульфидных, сложноэфирных связей и гидрофобных взаимодействий в формировании пространственного строения молекулы белка. Кислотноосновные свойства аминокислот пептидов и белков (амфотерность, изоэлектрическая точка). Реакции денатурации и гидролиза. Пищевое и ПК-3, ПК-30, ПК-31, ПК-32 18 Знать: строение, классификацию стереохимию аминокислот. Уметь: строить пептиды. Владеть: понятиями амфотерность, изоэлектрическая точка, методами определения и качественными реакциями на белки. Презентационные лекции с использованием мультимедийных средств; лабораторные работы; самостоятельная работа литературой; письменное домашнее задание техническое значение белков. Понятие о синтетических полиамидах (капрон, нейлон). 19 4.2. Обеспечение содержания дисциплины Раздел 1. Теоретические основы органической химии 1.1. Теория химического строения. Основы стереохимии 1.2. Электронное строение органических соединений 1.3 Общие принципы реакционной способности органических соединений Литература: [ 1 ] ,c.95 Вопросы для самопроверки: 1.Сформулируйте понятие «кислота и основания» по протонной теории( теория Бренстеда) и по электронной теории ( теория Льюиса). 2.Как влияют электронодонорные и электроноакцепторные группы на силу кислот и оснований. Вопросы и задания для самостоятельной работы: 1)Какая из кислот является более сильной: уксусная; хлоруксусная; трихлоруксусная? 2)Какое из оснований является более сильным: метиламин, диметиламин, анилин? 3) Сравните кислотные свойства пара-метифенола, фенола, пара-нитрофенола. 4) Какое из приведенных веществ является кислотой Льюиса: этиламин,хлорид алюминия, этанол? 5)Сравните кислотные свойства воды, этанола, фенола. Раздел 2. Основные классы органических соединений 2.1. Углеводороды всех гомологических рядов Предельные углеводороды Литература: [ 1 ], c.145-158 Курс лекций. Вопросы для самопроверки: [2 ], c. 3 , 7, 8,18. Вопросы и задания для самостоятельной работы: Какой из приведенных углеводородов легче подвергается монобромированию по механизму радикального замещения SR. Напишите уравнения соответствующих реакций. К образованию, каких веществ приведет «обрыв цепи»? 1) метан; 3-метилпентан; пентан. 2) этан; 2-метилпропан; гептан. 3) 2-метилпентан; этан; 2,2-диметилгексан. 4) 2,2-диметилбутан; метан; этилциклопентан. 5) 3-метилгексан; 3,3-диметилгексан; метан. 6) циклопентан; метилциклопентан;пентан. Литература: [ 1 ], c.164-178. Вопросы для самопроверки: [ 2 ] 238 зад. 2 , 11, 15, 23. Вопросы для самостоятельной работы: Для алкенов характерны реакции электрофильного присоединения (АЕ). Реакция присоединения хлороводорода будет идти по правилу Марковникова для одного из указанных ниже веществ. Напишите эту реакцию для соответствующего алкена и приведите механизм. 1. 2-метилбутен-2; этен; бутен-2. 2. пропен-2-аль; бутан; бутен-1. 3. гексен-3; пентен-1; 3,3,3-трифторпропен-1. 4. 3-метилпентен-2; пентен-2; акриловая кислота (пропен-2-овая кислота.). 5. пропен-1; 2,4-диметилпентан; бутен-2.. 6. 1-этилциклогексан; гексен-2; гексен-1. Ароматические углеводороды Литература : [ 1 ], c.208-219 Вопросы для самопроверки: [ 2 ], c.244 зад. 3, 4, 11, 12. Вопросы и задания для самостоятельной работы: Напишите уравнения реакций монохлорирования следующих ароматических производных, по механизму электрофильного замещения .Какое из двух веществ активней в реакции? Ответ аргументируйте. Дайте название продуктам реакций. 1. Пропилбензол; сульфобензол. 2. Нитробензол; фенол. 3. Толуол; бензойная кислота; 4. Аминобензол; нитробензол; 5. Бензальдегид; бензол; 6. Этилбензол; хлорбензол. 2.2. Галогенопроизводные углеводородов Литература: [ 1 ], c. 261-267, 275 Вопросы для самопроверки: [2 ], c. 247, зад. 3, 4, 7 Вопросы и задания для самостоятельной работы: Какое из ниже приведенных галогенопроизводных легче реагирует с водным раствором едкого натра по механизму SN2? 1. а) 2-бромпропан; б) 1-хлор-2-метилпропан; в) 3-хлорпентан. 2. а) 2-хлор-2-метилпропан; б) 2-бромпентан; в) 1-хлорпентан. 3. а) 3,3-дихлор-2-метилпентан; б) 1-бромпентан; в) 3-хлорпентан. 4. а) 1-бром-3-метилбутан; б) 2-хлоргексан; в) 1-хлорэтен. 5. а) 3-бром-3-метилпентан; б) 1-хлорпропан; в) 2- бромпентан. 6. а) 3-фенил-1-хлорпентан; б) 2,2-дибромпропан; в) 3-хлорпентан. 2.3. Кислородсодержащие органические соединения Спирты и фенолы Литература: [ 1 ], c .278 - 302 Вопросы для самопроверки: [2 ], c.247 зад. 13, 15, 17, 33, 42. Вопросы и задания для самостоятельной работы: Какой из приведенных спиртов окисляется раствором бихромата калия в кислой среде с образованием альдегида? 1. а) бензиловый спирт; б) 2-метилбутанол-2; в) пропанол-2. 2. а) пентанол-1; б) пентанол –3; в) пентанол-2. 3. а) бутанол-2; б) бутанол-1; в) 2-метилбутанол-2. 4. а) метанол; б) бутандиол-2,3; в) гексанол-3 . 5. а) этиловый спирт; б)трет-бутиловый спирт; в) пропанол-2. 6. а) гексанол –2; б) пентандиол-2,3 ; в) пентандиол-1,5. Альдегиды и кетоны Литература: [1] , c. 330-355 Вопросы для самопроверки: [ 2], c. 252 зад. 2, 9, 13, 25, 29. Вопросы и задания для самостоятельной работы: Качественные реакции: 21 1).Какая реакция позволяет отличить бутаналь от бутанона-2 :а) с метанолом; б) реакция поликонденсации; в) с гидроксидом меди ( II)? 2) Реакция образования полуацеталя характерна для: а) пропанола; б) пропаналя; в) пропановой кислоты? 3) Какая реакция является качественной на альдегиды: а) гидрирование; б) «серебряного зеркала»; в) с этанолом? 4). Какие реакции являются общими для альдегидов и кетонов: а) с гидроксидом меди(II); б) с цианидом калия; в) реакция этерификации? 5) Идентификация кетонов возможна с помощью реакции: а ) с гидроксидом меди(II); б) с гидроксиламином в) со спиртом? 6) Альдольная конденсация возможна для: а) 2- метилпропаналя; б) этаналя; в) пентанона? Карбоновые кислоты и их производные Литература: [ 1 ] , c.357-391.; c.410 , 419. Вопросы для самопроверки: [ 2 ], с. 255 зад. 2 ,4, 11, 17 ( а, б, в ), 27, 37, 38. с. 260 зад. 1, 2 ,7 ,12.. Вопросы и задания для самостоятельной работы: Укажите, какие вещества необходимы для получения следующих сложных эфиров по реакции этерификации. Ответ аргументируйте. 1. 2. 3. 4. 5. 6. метилпропионат: а) пропанол; б) метанол; в) пропановая кислота; этилацетат: а) этановая кислота; б) метановая кислота; в) этанол; пропилпропионат: а) пропанол; б) бутановая кислота; в) пропионовая кислота; бутилбензоат: а) бутановая кислота; б) бутанол; в) бензойная кислота; метилформиат: а) метановая кислота; б) этановая кислота; в) метанол; пентилацетат: а) пентановая кислота; б) этановая кислота; в) пентанол; 2.4. Азотсодержащие органические соединения Литература: [ 1 ], c.314-328. Вопросы для самопроверки: [ 2 ], c.265 ,зад 4, 5, 7 Вопросы и задания для самостоятельной работы: Какой из приведенных аминов является более сильным основанием? Ответ обоснуйте с точки зрения электронного строения органических соединений. 1) а) пропиламин; б) метилпропиламин; в) фениламин (анилин). 2) а) триметиламин; б) дифениламин; в) бутиламин. 3) а) диметиламин; б) метиламин; в) трифениламин. 4) а) анилин; б) метилэтиламин; в) этиламин. 5) а) метилфениламин; б) фениламин; в) метиламин. 6) а) пентиламин; б) диэтиламин; в) дифениламин. Раздел 3. Элементы биоорганической химии. 3.1. Углеводы ( Сахара ) Литература: [ 1 ], c.453-481 Вопросы для самопроверки: [ 2 ], c. 263-265, зад. 1,2,3, 5, 10. Вопросы и задания для самостоятельной работы: Напишите структурные формулы Хеуорса и аномеры для следующих моносахаридов и их производных: 1. 2. 3. D – ксилоза ; L- галактоза; L –рибоза ; D-глюкоза; D – арабиноза; L-гулоза; 22 4. L – фруктоза; D-рибоза; 5. D –манноза; L-дезоксирибоза; 6. D – фруктоза; L- аллоза; Какой из приведенных моносахаридов является аномером по отношению к ά , D - глюкофуранозе : 1. ά, L-глюкофураноза,; β , D -глюкофураноза ; β , D-глюкопираноза? Обоснуйте свой выбор. 2. Какой из моносахаридов является энантиомером по отношению к L- галактозе: L- глюкоза; D- глюкоза; D-галактоза? Напишите формулы сахаров и объясните. 3. Какой из сахаров является аномером для β, D-фруктофуранозы: α , D фруктопираноза; α , D- фруктофураноза? Напишите формулы этих сахаров. 4. Напишите структурную формулу Фишера для D-рибозы. Укажите ее энантиомер в ряду: D- глюкоза, L - дезоксирибоза , L-рибоза. 5. Напишите формулу Хеуорса для α , D -глюкопиранозы. Являются ли ее аномерами: β , D-глюкофураноза; β , D- глюкопираноза; β , D-галактопираноза? 6. Напишите формулу Фишера для L-фруктозы. Найдите ее энантиомер в ряду: α, Lфруктопираноза; β , L-фруктофураноза; D- фруктоза.Напишите формулы этих сахаров. 3.2 Аминокислоты, пептиды и белки Литература: [ 1 ], с. 393-407. Вопросы для самопроверки: [ 2 ] ,c.266-268, зад.1,10, 11, [ 7 ] Вопросы и задания для самостоятельной работы: Задание 1. Укажите аминокислоту, которая может участвовать в построении белковой молекулы. Образуйте дипептид с молекулой глицина, который будет являтся Сконцевой аминокислотой. Обладает ли полученный дипептид амфотерными свойствами? 1) а) 3-аминопропановая кислота; б) аминоуксусная; в) этановая. 2) а) 2-оксибутановая кислота; б)2- аминопропановая кисл.; в) З- аминопентан. 3) а) масляная кисл.; б) капроновая кисл. в)2-амино-3-метилбутановая. 4) а) 2-аминобутандиовая кисл. б) этановая кисл. в) 2-аминопропанол. 5) а) 3- аминобутановая кисл.; б) 2- метилпропиламин; в) 2-амино-3гидроксипропановая кислота . 6) а) 2- аминобутан; б) каприловая кисл. в)2- аминопентандиовая кислота 4.3. ОБРАЗОВАТЕЛЬНЫЕ ТЕХНОЛОГИИ В процессе освоения дисциплины «Органическая химия» используются следующие образовательные технологии: 1. Стандартные методы обучения: -Лекции; -Практические занятия с выполнением лабораторных работ; -Письменные домашние работы; -Самостоятельная работа студентов, в которую включается освоение экспериментальных методов анализа; -Консультации преподавателей. 2. Методы обучения с применением интерактивных форм образовательных технологий: Компьютерное тестирование. 23 5. УЧЕБНО-МЕТОДИЧЕСКОЕ, ИНФОРМАЦИОННОЕ И МАТЕРИАЛЬНО-ТЕХНИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ДИСЦИПЛИНЫ 5.1. Литература: Основная литература по дисциплине: 1. Грандберг И.И. Органическая химия: Учебник 4-е изд. М.: Дрофа, 2001. 2. Грандберг И. И. Практические работы и семинарские занятия по органической химии: Учеб. пособие для вузов. 4-е изд. М.: Дрофа, 2001. 3. Лабораторный практикум по органической химии.Полумикрометод( составители: Т.Д.Силаева, Н.Н.Иванова, Ю.Н.Фирсова,В.П.Сагалович, И.Ю.Сахаров).М. Изд-во Рос. экон. акад., 2007г. Рекомендуемая литература (дополнительная) 4. Сагалович В.П. Номенклатура органических соединений. Методические указания и задания. М.: РИО МИНХ, 1990. 5. Сагалович В.П., Иванова Н.Н. Введение в теорию строения органических соединений. Задания для самостоятельной работы по органической химии. М.:Изд-во Рос. экон. акад., 2005г. 6. Сахаров И.Ю. Высокомолекулярные соединения. Лекция. М.: РЭА, 2003. 7. Силаева Т.Д. Аминокислоты и пептиды. Методические указания. М.: РИО МИНХ, 1990. 8. Силаева Т.Д., Иванова Н.Н. Природные гетероциклические соединения. Методические указания и задания. М.: РИО МИНХ, 1990. 9. Силаева Т.Д., Крисюк Б.Э. Практические работы по дисциплине "Физико-химические методы исследования". Тема "Хроматография". М.: РЭА, 2002. 5.2 Рекомендации по использованию Интернет-ресурсов и других электронных информационных источников 1. http:/home.ptd.net/~swenger/ Содержится 250 фрагментов информации по химии; 2. http://www.chemistry.memaster.ca/faculty/bader/aim Типы связей между атомами в молекулах. Дается представление о квантовой механике. 3. http://antoine.fsu.umd.edu/chem/senese/101/links.html Представлены базы данных, содержание лекций, лабораторных занятий, дискуссии по проблемам химии, новости науки. Рассказывается о научных методах в химии и использовании химии в повседневной жизни. 4. Сахаров И.Ю., Фирсова Ю.Н. Органическая химия. Курс лекций. http://www.rea.ru/Main.aspx?page=KHF_Uchebnye_materialy 5. www.fepo.ru 6. www.slovari.ua Перечень рекомендуемых компьютерных программ: Пакет test Материально-техническое обеспечение дисциплины Лекции с использование мультимедийных средств, демонстрационные приборы и реагенты для проведения опытов. 24 6. ОЦЕНОЧНЫЕ СРЕДСТВА 6.1 Примерные вопросы к экзамену 1. Предельные углеводороды. Реакция окисления. 2. Понятие об ингибиторах и инициаторах радикальных процессов. Относительная устойчивость углеводородных свободных радикалов. 3. Непредельные углеводороды. Механизм реакций электрофильного присоединения. 4. Галогенопроизводные. Номенклатура, классификация. 5. Механизм реакций нуклеофильного присоединения типа SN1, SN2. 6. Арены. Механизм реакций электрофильного замещения. 7. Реакции боковых цепей в аренах. 8. Спирты и фенолы. Классификация, изомерия, номенклатура. Электронное строение гидроксильной группы. 9. Спирты и фенолы. Водородные связи, кислотность и основность. Реакции нуклеофильного замещения гидроксильной группы, роль кислотного катализа, понятие о реакции окисления 10. Карбоновые кислоты и их производные. Функциональные производные карбоновых кислот: сложные эфиры. Механизмы реакций этерификации, гидролиза 11. Оксикислоты. Номенклатура, свойства. Жирные кислоты. Реакции этерификации , гидролиза и омыления с участием жирных кислот. 12. Азотосодержащие органические соединения, их классификация, свойства. 13. Классификация углеводов. 14. Характеристика важнейших химических свойств моносахаридов (окислительновосстановительные реакции, образование гликозидов). Понятие о природных гликозидах. 15. Дисахариды. Строение и химические свойства восстанавливающих и невосстанавливающих дисахаридов (мальтоза, сахароза). Инверсия сахарозы. 16. Понятие об аминокилотах. Незаменимые аминокислоты. Классификация, строение и свойства аминокислот. 17. Построение ди-, трипептидов. 6.2 Примеры тестов для контроля знаний 1.Какой из приведенных углеводородов легче подвергается монобромированию по механизму радикального замещения SR. 1. пентан; 2-метилбутан; бензол. 2. 3-этилпентан; гексан; 3,3-диметилпентан. 3. 2-метилбутан; 2,2-диметилбутан; нафталин. 4. метан; 3-метилпентан; пентан. 5. этан; 2-метилпропан; гептан. 6. 2-метилпентан; нитробензол; 2,2-диметилгексан. 7. 2,2-диметилбутан; бензол; этилциклопентан. 8. 3-метилгексан; 3,3-диметилгексан; метан. 9. циклопентан; метилциклопентан;пентан. 10. этилбензол; стирол; изопропилбензол. 11. пропан; изобутан; 3,3-диметилпентан. 12. 2-метилгексан; этан; 3,3-диметилгептан. 25 13. сульфобензол; 3-метилпентан; метан. 14. бутан; 2-метилпропан; 2,2-диметилпропан. 15. 3,3-диэтилпентан; 2-метилбутан; пентан. 2. Для алкенов характерны реакции электрофильного присоединения (АЕ). Реакция присоединения хлороводорода будет идти по правилу Марковникова для одного из указанных ниже веществ. Напишите эту реакцию для соответствующего алкена и приведите механизм. 1. 2-метилбутен-2; этен; бутен-2. 2. пропен-2-аль; бутан; бутен-1. 3. гексен-3; пентен-1; 3,3,3-трифторпропен-1. 4. 3-метилпентен-2; пентен-2; акриловая кислота (пропен-2-овая кислота.). 5. пропен-1; 2,4-диметилпентан; толуол. 6. 1-этилциклогексан; бензол; гексен-1. 7. 2,3-диметилбутан; 3-этилпентен-2; гексен-2. 8. нитробензол; 1-метилциклопентен; циклопентен. 9. пропен-1; гексен-3; фторэтилен. 10. 3-метилгексен-3; гексен-2; гексан. 11. пентан; пентен-1; циклопентан. 12. этен; бутен-2; 2-метилбутен-2. 13. толуол; гексен-3; гексен-1. 14. 2-метилпентен-1; этилбензол; циклопентан. 15. 2,3-диметилбутан; бутен-1; циклопентан. 3. Какое из ниже приведенных галогенопроизводных легче реагирует с водным раствором едкого натра по механизму SN2? 1. а) 2-бромпропан; б) 1-хлор-2-метилпропан; в) 3-хлорпентан. 2. а) 2-хлор-2-метилпропан; б) 2-бромпентан; в) 1-хлорпентан. 3. а) 3,3-дихлор-2-метилпентан; б) 1-бромпентан; в) 3-хлорпентан. 4. а)1-бром-3-метилбутан; б) 2-хлоргексан; в) 1-хлорэтен. 5. а) 3-бром-3-метилпентан; б) 1-хлорпропан; в) 2- бромпентан. 6. а)3-фенил-1-хлорпентан; б) 2,2-дибромпропан; в) 3-хлорпентан. 7 а). 3-бромпентан; б) 2-бромпентен-1; в) 1-бромпентан. 8. а) хлористый этил; б) хлористый винил; в) 1-фенил-1-хлорбутан. 9. а) 3-бромпентан б) 1-хлорпентен-1; в) 1-хлорбутан. 10. а) 2-хлор-2-этилпентан; б) 1-хлорпентен-1; в) 1-хлорпропан. 11. а) 3-хлорпентан; б) 3-метил-3-хлорпентан; в) 1-бромпентан. 12. а) 1-хлорбутан; б)1-бромбутан; в) 1-хлорбутен-1. 13. а) хлористый бензил; б) хлористый фенил; в) мета-хлортолуол. 14. а) 2-хлор-2метилбутан; б) 1-хлорбутан; в) 2-хлорбутан. 15. а) 1-бромэтен; б) 2- бромпропан; 1-бромэтан. 4. Какой из приведенных спиртов окисляется раствором бихромата калия в кислой среде с образованием альдегида? 1. а) бензиловый спирт; б) 2-метилбутанол-2; в) пропанол-2. 2. а) пентанол-1; б) пентанол –3; в) пентанол-2. 7. а) бутанол-2; б) бутанол-1; в) 2-метилбутанол-2. 8. а) метанол; б) бутандиол-2,3; в) гексанол-3 . 26 9. а) этиловый спирт; б) фенол; в) пропанол-2. 10. а) гексанол –2; б) 1-фенилпропанол -1 ; в) пентандиол-1,5. 11. а) пропанол-1; б) бутандиол-2,3; в) 2-метилпропанол-2. 12. а) гександиол-2,5 ; б) первичный пропиловый спирт; в) пропанол-2. 13. а) пентанол-1; б) пентанол-3; в) пентандиол-2,4. 14. а) этанол; б) трет-пропиловый спирт; в) пропанол-2. 15. а) циклогексанол; б) 1,3-дигидроксициклогексан; в) гексанол-1. 16. а) бензиловый спирт; б) фенол; в) циклогексанол. 17. а) пентанол-1; б) пентанол-2; в) циклопентанол. 18. а) виниловый спирт; б) этиловый спирт; в) вторичный пропиловый спирт. 19. а) 2-метилбутанол-2; б) бутандиол-2,3; в) пропантриол-1,2,3. 5. Образование простого эфира возможно при взаимодействии веществ: 1. а) этанол; б) пропанол-1;в) пропаналь. 2. а) пентанон-2; б) метанол; в) бутанол-2. 3. а) пропанол-1; б) пропанол-2; в) пропаналь. 4. а) этилата натрия;б) хлорэтана; в) этаналя. 5. а)1-бромбутана; б)пропилата натрия; в) пропанон. 6. а) бутанол-2; б) бутановая кислота; в) этанол. 7. а) метанол; б) метаналь; в) этанол. 8. а) бутанол-1; б) бутанол-1; в) бутаналь. 9. а) бензиловый спирт; б) метиловый спирт; в) бутаналь. 10. а) циклопентанол; б) этанол; в) пропанон-2. 11. а) циклогексанол; б) бутаналь;в)метиловый спирт. 12. а) пентанол-1; б) пентанол-2; в) фенол. 13. а) фенолят натрия; б) бромистый метил; в) метанол. 14. а) трет-пропиловый спирт; б) этанол; в) пентаналь. 27 двух из предлагаемых 15. а) пентанол-2; б) пентанол-1; в) пентанон-3. 1. Какие из приведенных соединений являются гомологами: 1) а) пропаналь ; б) пропанол-1; в) гексаналь. 2) а) бутанон-2; б) бутанол-2; в) гексанон-2. 3) а) уксусный альдегид; б) пентаналь; в) гептанол-3. 4)а) 2-метилпропаналь; б) 2- метилпентанол-3; в) пентаналь. 5)а)3-метилпентанол-1; б) пропанон; в) гексанон-2. 6)а) этаналь; б) гексанол-1; в) пропаналь. 7) а) пентанон -3; б) пентанол-3; в) пропанон. 8) а) метаналь; б) метанол; в) бутаналь. ; в) пентаналь. 9) а)пропанол-1; б) пентаналь; в) этаналь. 10) а) 3- метилпентаналь; б) гептанол-3; в) гептаналь. 11) а) метанол; б) пропанон-2; в) пентанон-2. 12) а) 2-метил-2-бутеналь;б) бутанон-2; в) 3-метил-2-пентеналь. 13) а) уксусный альдегид; ; б) пентаналь. в) пентанол-3 14) а) 2,4-диметилпентанон-3; б) гексанол-1; в) 2-метилпентанон-3. 15) а) пропеналь; б) 3-бутеналь; в) бутанон-2. Задание 2. Укажите изомеры в ряду перечисленных альдегидов и кетонов: 1) а) 2-метилпропаналь; б) пентаналь; в) бутаналь. 2)а) 3-метилгексанон-2; б)2-метилгептанон-3; в)2-метилгексанон-3 . 3)а) пентанон-2; б) 2-метилпентанон-3; в) пентанон-3. 4) а) пара-этилбензальдегид;б) 2,4- диметилбензальдегид;в) орто-метилбензальдегид. 5) а) 3-метилбутанон-2;б) бутанон-2; в) пентанон-3. 6) а) 2,3-диметилпентаналь; б) 3-этилпентаналь; в) 4-метилпентаналь. 7) а)2- пропеналь; б) 2-метил-2-пропеналь; в) 2-бутеналь. 8) а) 2-метил-3-этилбензальдегид; б) орто-этилбензальдегид; в)пара-пропилбензальдегид. 9) а) гексонон-3; б) 4-метилгексанон-3; в) гексанон-2. 10) а) 2,3-диметилпентаналь; б) 2,4-диметилгексаналь; в) 3-этилпентаналь. 11) а) метаналь; б) бутаналь; в) 2-метилпропаналь. 12) а) 3-метилгексанон-2; б) 2- метилгексанон-3; в) 3-метилгептанон-2. 13) а) метилфенилкетон; б) этилфенилкетон;в)метил- (3-метилфенил)кетон. 14) а) пропаналь; б) бутаналь.; в)2-метилпропаналь. 15) а) 2-метилпентаналь; б) 3-этилпентаналь;в) 3,;-диметилпентаналь. 6. Качественные реакции 1).Какая реакция позволяет отличить бутаналь от бутанона-2 :а) с метанолом; б) реакция поликонденсации; в) с гидроксидом меди ( II)? 2) Реакция образования полуацеталя характерна для: а) пропанола; б) пропаналя; в) пропановой кислоты? 3) Какая реакция является качественной на альдегиды: а) гидрирование; б) «серебряного зеркала»; в) с этанолом? 4). Какие реакции являются общими для альдегидов и кетонов: а) с гидроксидом меди(II); б) с цианидом калия; в) реакция этерификации? 5) Идентификация кетонов возможна с помощью реакции: а ) с гидроксидом меди(II); б) с гидроксиламином в) со спиртом? 6) Альдольная конденсация возможна для: а) 2- метилпропаналя; б) этаналя; в) пентанона? 7) В какой среде проходят качественные реакции на альдегиды: а) кислой; б) щелочной в) нейтральной? 28 8).При гидрировании пентанона-3 образуется: а) пентен-3; б) пентанол-3; в) пентаналь? 9).Реакция с бисульфитом натрия позволяет выделить из смеси веществ: а) бутановую кислоту;б)ацетон; в) пентанол-2 ? 10) Полуацеталь образуется при взаимодействии альдегида с:а) кетоном; б) алкеном в) спиртом. 11)Какой из приведенных ниже кетонов может образовывать бисульфитное производное: а) этилфенилкетон; б)метилэтилкетон.; в) диэтилкетон? 12)Какой реагент позволяет выделить альдегиды и кетоны из смеси веществ: а) пропанол;б) гидроксиламин;в) сульфит натрия? 13) Альдольная конденсация возможна для: а)пропаналя; б)2-метилбутаналя;в) бензальдегида? 14) Идентифицировать альдегиды позволяет реакция с: а) этанолом б) Сu(ОН)2; в) формальдегидом? 15) При восстановлении кетонов образуются: а) кислоты; б) альдегиды; в) вторичные спирты? 7. Какая из приведенных кислот является более сильной? 1. а) СНз – СН2 – СН2-СООН бутановая. ; б) СНз-СН2 –СН(Cl)СООН 2хлорбутановая.; 2. a) СН(Сl)2 – COOH дихлоруксусная, б) CH2(Сl)СООН хлоруксусная; 3. а) СНз-С6Н4-СООН пара-метилбензойная, б) С6Н5-СООН бензойная; 4. а) НСООН муравьиная, б) СНз-СН2-СООН пропановая; 5. а) С6Н5-СООН бензойная, б) О2N-С6Н4-СООН пара-нитробензойная; 6. а) СзН7-СООН бутановая, б) НСООН муравьиная; 7. а) НСООН муравьиная, б) СНз-СООН уксусная; 8. а) СНз-СООН уксусная;б) СFзСООН трифторуксусная1 9. а) НООС-СООН щавелевая кислота; б) НСООН муравьиная кислота. 10. а) СНзСООН уксусная кислота; б) СН2(Cl)COOH хлоруксусная кислота 11. а)Cl-CH2-CH2-COOH 3-хлорпропановая, б) CHз-СН2-СООН пропановая; 12. а) СН3-С6Н4-СООН пара-метилбензойная ,б)НO3S-C6H4-COOH пара-сульфо-бензойная. 13. а) С6Н5СООН бензойная; б) СНз-С6Н4-СООН пара-метилбензойная. 14. а) НООС-СООН щавелевая; б) НСООН муравьиная. 15. а) СН2(F)СООН фторуксусная; б) СН2(Cl)СООН хлоруксусная. 8. Укажите, какие вещества необходимы для получения следующих сложных эфиров по реакции этерификации: 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. метилпропионат: а) пропанол; б) метанол; в) пропановая кислота; этилацетат: а) этановая кислота; б) метановая кислота; в) этанол; пропилпропионат: а) пропанол; б) бутановая кислота; в) пропионовая кислота; бутилбензоат: а) бутановая кислота; б) бутанол; в) бензойная кислота; метилформиат: а) метановая кислота; б) этановая кислота; в) метанол; пентилацетат: а) пентановая кислота; б) этановая кислота; в) пентанол; бензилацетат: а) бензойная кислота; б) уксусная кислота; в) бензиловый спирт; гексилпропионат: а) гексанол; б) пропанол; в) пропановая кислота; бутилформиат: а) бутановая кислота; б) метановая кислота; в) бутиловый спирт; метилбензоат: а) бензойная кислота; б) метановая кислота; в) метанол; этилбутират: а) бутановая кислота; б) этанол; в) бутанол; пентилпропионат: а) пентанол; б) пропанол; в) пропановая кислота; гексилацетат: а) этановая кислота; б) гексановая кислота;в) гексанол; диэтилоксалат: а) этанол; б) этандиовая кислота в) октановая кислота; трет-бутилпропионат: а) бутанол-2; б) пропановая кислота; в) 2-метилпропанол-2. 29 9. Какой из приведенных аминов является более сильным основанием? 7) 8) 9) 10) 11) 12) 13) 14) 15) 16) 17) 18) 19) 20) 21) а) пропиламин; б) метилпропиламин; в) фениламин (анилин). а) триметиламин; б) дифениламин; в) бутиламин. а) диметиламин; б) метиламин; в) трифениламин. а) анилин; б) метилэтиламин; в) этиламин. а) метилфениламин; б) фениламин; в) метиламин. а) пентиламин; б) диэтиламин; в) дифениламин. а) пара-метиланилин; б) пара-нитроанилин; в) анилин. а) 2-амино-2метилпропан; б) 1,3-диаминопропан; в) пропиламин. а) этиламин; б) диэтиламин; в) анилин. а) метиламин; б) диметиламин; в) метилфениламин. а) пара- этиланилин; б) анилин; в) пара-сульфоанилин. а) анилин;б) N -метиланилин; в) N ,N -диметиланилин. а) этиламин; б) бутилэтиламин; в) фенилэтиламин. а) 1,4-диаминобутан; б) 1-аминобутан; в) фениламин. а) аммиак; б) анилин; в) пропиламин. 10. Укажите аминокислоту, которая может участвовать в построении белковой молекулы. 7) а) 3-аминопропановая кислота; б) аминоуксусная; в) этановая. 8) а) 2-оксибутановая кислота; б)2- аминопропановая кисл.; в) З- аминопентан. 9) а) масляная кисл.; б) капроновая кисл. в)2-амино-3-метилбутановая. 10) а) 2-аминобутандиовая кисл. б) этановая кисл. в) 2-аминопропанол. 11) а) 3- аминобутановая кисл.; б) 2- метилпропиламин; в) 2- амино-3гидроксипропановая кислота 12) а) 2- аминобутан; б) каприловая кисл. в)2- аминопентандиовая кислота 13) а) 2,6- диаминогексановая кислота; б) уксусная кислота; в) 3—аминогексанол-2. 14) а) бутандиовая кисл.; б )пропионовая кислота; в) 2-амино-3-гидроксибутановая кисл. 15) а) 3-аминопентановая кислота б) 2-гидрокси-3-аминобутановая кислота; в) 2-амино3- гидроксибутановая кисл. 16) а) 2-амино-3-фенилпропановая кислота б) 3,4-диаминобутановая кислота; в) 2аминопропанол-1. 17) а) 3-аминопентановая кисл. б) 2,5- диаминопентановая кисл.; в) 4- аминопентановая кисл. 18) а) пропандиовая кисл.; б) 2- окси-4-аминопентановая кисл; в) 2- амино-3гидроксипропановая кисл. 19) а) 3- аминопропановая кисл; б) 2- аминопропановая кисл.; в) 2,4- диаминопентан. 20) а) 2- аминопентандиовая кисл.; б) 3-аминопентандиовая кисл. в) бутаналь. 21) а) фениламин; б) 2-амино-3-фенилпропановая кисл; в) 4- аминобензойная кисл. . 30 7. ТЕМАТИЧЕСКИЙ ПЛАН ИЗУЧЕНИЯ ДИСЦИПЛИНЫ № п/ п 1. 2. 3. 4. 5. 6. 7. Аудиторные часы Самосто Интерак яПракт Лабора -тивные Наименование тельная иформы Всег разделов и тем работа Лекции ческие торны обучени о (формы, заняти е я часы) я работы Раздел 1. Теоретические основы органической химии Теория химического 4, лит., п.з. строения. Основы 2 4 6 стереохимии Электронное строение 4, лит.,п.з. 2 4 6 органических соединений Общие принципы реакционной 2, 10, 2 2 способности лит., п.з., Комп.з Раздел 2. Основные классы органических соединений Углеводороды всех гомологических рядов 16, 6 12 18 . лит., п.з., Галогенопроизводны е Кислородосодержащ ие органические соединения 2 4 6 8, лит., п.з., р.а.з. 8 8 16 10, лит., п.з., р.а.з. 2 2 4 8, лит., п.з., р.а.з. Азотосодержащие соединения Раздел 3. Элементы биоорганической химии 31 . 3, Комп.з. Формы текущего контроля Проверка письменных заданий Проверка письменных заданий Проверка письменных заданий Проверка письменных заданий и защита лабораторны х работ Проверка письменных заданий и защита лабораторны х работ Проверка письменных заданий и защита лабораторны х работ Проверка письменных заданий и защита лабораторны х работ 8. 9. Углеводы (сахара) 4 4 8 6, лит., п.з., р.а.з. 3, Комп.з. 2 4 6 6, лит., п.з., р.а.з. 2, Комп.з. 28 44 72 72 10 Аминокислоты, пептиды, белки Итого: 32 Проверка письменных заданий и защита лабораторны х работ Проверка письменных заданий и защита лабораторны х работ Протокол междисциплинарного согласования рабочей программы учебной дисциплины с прочими дисциплинами учебного плана органическая химия . наименование дисциплины в 2010 / 2011 учебном году Рабочая программа . Наименование дисциплин учебного плана Математика Общая химия Стандартизация и контроль качества продукции Метрология, стандартизация и сертификация органическая химия согласована Кафедра Принятое решение кафедрой, разработавшей программу (протокол №, дата) Высшей математики Химии и физики ТОПП Предложения об изменениях в содержании материала, пропорциях, порядке изложения и т.д. Без изменений Без изменений Без изменений ТОПП Без изменений Одобрить Одобрить Одобрить Одобрить Члены экспертной (методической) комиссии: ________________ ________________ ________________ ________________ ________________ ________________ ________________ ___Попов А.А. (подпись) (подпись) (подпись) Заведующий кафедрой (подпись) 33 (Ф.И.О.) (Ф.И.О.) (Ф.И.О.) (Ф.И.О.) . ВЫПИСКА из протокола заседания кафедры кафедра химии и физики . (наименование кафедры) № от « » 200 г Слушали: О внесении дополнений и изменений в рабочую программу учебной дисциплины органическая химия_______________________. (наименование дисциплины) Постановили: Внести в рабочую программу учебной дисциплины следующие изменения: 1. Изменение трудоемкости. 2. Изменение наименований разделов дисциплины. Заведующий кафедрой ________________ (подпись) Попов А.А. (Ф.И.О.) . Внесение изменения утверждаю Декан факультета факультет ЭТТ (название факультета) « » (подпись) 200 г 34 Самарин В.И. (Ф.И.О.) .