Document 118749
advertisement
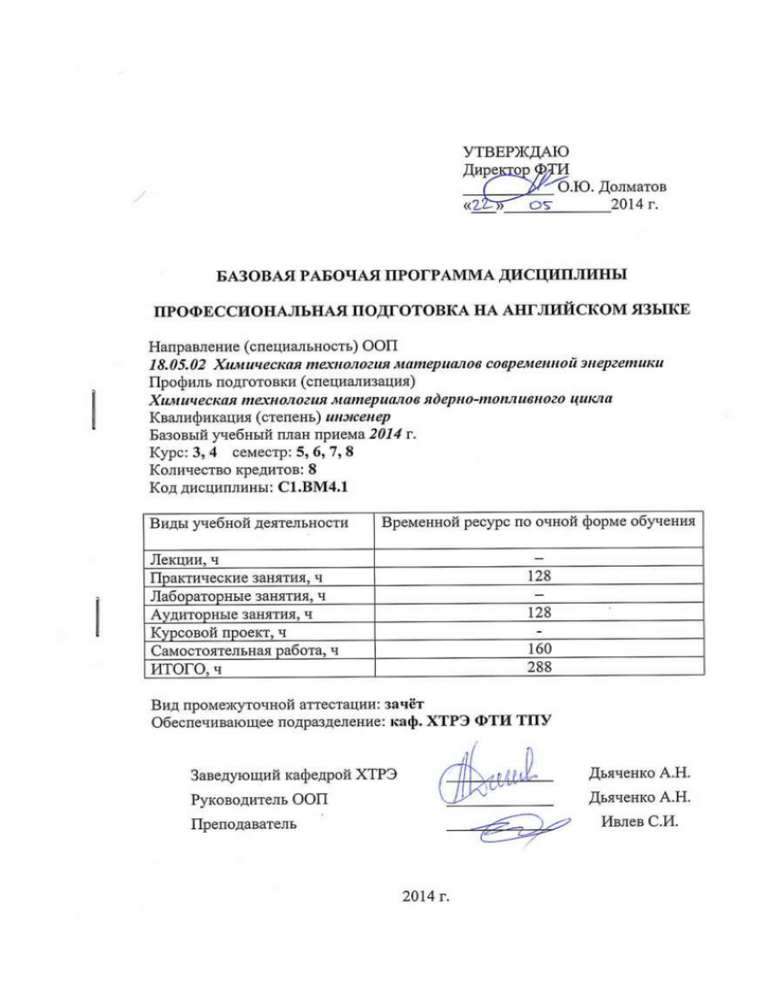
1. Цели освоения дисциплины Код Цели освоения дисциплины Цели ООП цели «Профессиональная подготовка на английском языке» Ц1 Формирование способности понимать и применять английский язык на уровне, необходимом для осуществления международной профессиональной коммуникации в области химии и химической технологии Подготовка выпускников к производственно-технологической деятельности в специальной и междисциплинарных областях, связанной с эксплуатацией и модернизацией существующих, внедрением новых наукоемких технологий материалов современной энергетики, к активному участию в инновационной деятельности предприятия или организации. Ц2 Формирование способностей, связанных с представлением и изложением профессионально значимой информации и результатов научноисследовательской деятельности на английском языке Подготовка выпускников к научноисследовательской деятельности в области химической технологии материалов современной энергетики, интегрированию новых идей, применению естественнонаучных, математических и специальных знаний и умений к решению инновационных задач, связанных с получением, изучением свойств веществ, разработкой и оптимизацией производственных установок и технологических схем Ц5 Формирование навыков самостоятельного поиска и анализа информации в международных научных изданиях по химии и химической технологии Подготовка выпускников к поиску и получению новой информации, необходимой для решения инженерных и научных задач в области технологии материалов современной энергетики, интеграции знаний применительно к своей области деятельности, к самообучению и постоянному профессиональному самосовершенствованию. 2. Место дисциплины в структуре ООП Дисциплина «Профессиональная подготовка на английском языке» относится к базовой части общепрофессионального цикла ООП. Дисциплина взаимосвязана с дисциплинами базовой части гуманитарного, социального и экономического цикла ООП (умения и языковой материал, необходимые для общения на изучаемом языке в бытовой, общественной, образовательной сферах) и базовой части математического и естественно-научного цикла (терминология и понятия основных разделов химии). Приступая к изучению дисциплины «Профессиональная подготовка на английском языке», студент должен владеть языковыми навыками и умениями на уровне не ниже В1 по шкале CEFR. Пререквизиты: иностранный язык (английский) С1.БМ1.4, химия С1.БМ2.1, аналитическая химия С1.ВМ4.8, физическая химия С1.ВМ.4.13. 3. Результаты освоения дисциплины В результате освоения дисциплины «Профессиональная подготовка на английском языке» обучающиеся должны овладеть английским языком в объеме, необходимом для получения информации из зарубежных источников, устного и письменного общения в профессиональной сфере химии и химической технологии редких, рассеянных и радиоактивных элементов. В соответствии с требованиями ООП освоение дисциплины направлено на формирование у студентов следующих компетенций (результатов обучения), в т.ч. в соответствии с ФГОС: Таблица 1 Составляющие результатов обучения, которые будут получены при изучении данной дисциплины Результаты Составляющие результатов обучения обучения Ко Ко Ко Владение (компетенции Знания Умения д д д опытом из ФГОС) Результаты обучения (компетенции из ФГОС) Р1 Демонстрирова ть глубокие естественнонау чные, математические и инженерные знания и детальное понимание научных принципов профессиональ ной деятельности Р9 Применять иностранный язык в сфере коммуникаций и профессиональ ной деятельности, представлять результаты научных исследований и Составляющие результатов обучения Ко Знания д Ко д Умения Ко д Владение опытом З1. О законах У1 Решать В1 Навыками 1 и понятиях .1 практически .1 работы с основных е и учебной, разделов проблемносправочной, химии и ориентирова технической химическо нные и научной й задачи, литературой технологии встречающи еся в практическо й деятельност и инженерахимика З2. Англоязыч У2 Извлекать и В2 Использован 1 ной .1 анализирова .1 ия терминолог ть информацион ии и необходиму ных понятий, ю технологий и являющихс информаци электронных я ю из ресурсов для общеприня письменных поисковых и тыми в англоязычн исследовател химическо ых ьских целей й источников на технологии английском языке Результаты обучения (компетенции из ФГОС) разработок в виде отчетов, публикаций, публичных обсуждений Составляющие результатов обучения Ко Знания д Ко д Умения Ко д Владение опытом З2. Особеннос У2 Выбирать В2 Опытом 2 ти устных .2 адекватные .2 выполнения и речевые индивидуаль письменны формулы, ных и х научных соответству групповых и научноющие научнотехнически определенн исследовател х текстов ому стилю ьских общения в заданий с рамках представлени межкультур ем ной результатов коммуникац на ии в английском академическ языке ой и профессион альной сферах общения З2. Стратегии У2 Использова 3 коммуника .3 ть основные тивного стратегии поведения работы с в аутентичны ситуациях ми межкульту аудиотекста рного ми по академичес научно и кого и профессион профессио альнонального ориентирова общения нной тематике Результаты обучения (компетенции из ФГОС) Составляющие результатов обучения Ко Знания д Ко д Умения Ко д Владение опытом У2 Использова .4 ть основные стратегии работы с аутентичны ми письменными текстами по научной и профессион альноориентирова нной тематике в процессе чтения У2 Представлят .5 ь результаты собственны х исследовани й в устной и письменной форме на английском языке В результате освоения дисциплины «Профессиональная подготовка на английском языке» студентом должны быть достигнуты следующие результаты: Таблица 2 Планируемые результаты освоения дисциплины Код результата РД 1 РД 2 Результат освоения дисциплины применять знание английского языка при осуществлении профессиональной деятельности уметь находить, извлекать из различных источников, Код результата РД 3 РД 4 Результат освоения дисциплины анализировать, интерпретировать и излагать устно или письменно профессионально-значимую информацию с использованием английского языка уметь взаимодействовать с представителями других культур при осуществлении профессиональной деятельности, быть способным к пониманию и преодолению межкультурных различий, быть толерантными, нести ответственность за поддержание партнерских, доверительных отношений применять знания иностранного языка для планирования и реализации перспективных линий интеллектуального, культурного, нравственного и профессионального саморазвития, самообразования и самосовершенствования 4. Структура и содержание дисциплины Семестр 5 Раздел 1. General and Inorganic Chemistry (общая и неорганическая химия) Тематика раздела: 1. The basic skills 1.1. Matter 1.2. Energy 1.3. Scientific notation. Significant figures 1.4. Units of measurement 2. Atomic structure 2.1. The atom 2.2. The nature of light 2.3. Bohr Atom Model and Ryberg Equation 2.4. Wave Properties of Matter and Quantum Mechanics 3. Elements and Compounds 3.1. The Periodic Table and the Mole 3.2. Ionic and Covalent Compounds 3.3. Molar Mass and Percent Composition 3.4. Solutions 4. Chemical Reactions 4.1. Reactions 4.2. Stoichiometry 4.3. Titrations and Combustion Analysis 4.4. Limiting Reactants and Yield of a Reaction Повторение грамматического материала: 1. Tenses: Present Indefinite, Present Continuous, Past Indefinite, Future Indefinite 2. Articles: a/an, the, zero article 3. Ways of talking about the future Семестр 6 Раздел 2. Physical chemistry (физическая химия) Тематика раздела: 1. Chemical thermodynamics 1.1. The First Law: enthalpy 1.2. The Second Law: entropy and Gibbs energy 1.3. Phase diagrams 1.4. Chemical equilibrium 2. Chemical kinetics 2.1. Empirical chemical kinetics 2.2. The kinetics of complex reactions 2.3. The kinetics of heterogeneous reactions 2.4. Catalysis 3. Essentials of material science 3.1. Macromolecules and aggregates 3.2. Levels of structure 3.3. The solid state 3.4. The properties of solids 4. Introduction to electrochemistry 4.1. Half-reactions and electrodes 4.2. The electromotive force 4.3. Standard potentials 4.4. Applications of standard potentials Повторение грамматического материала: 1. Tenses: Present Perfect, Past Continuous, Future Continuous 2. Modals and semi-modals 3. Passive voice Семестр 7 Раздел 3. Analytical chemistry (аналитическая химия) Тематика раздела: 1. Essentials of analytical chemistry 1.1. Types of solution concentrations 1.2. Tolerance and significant figures 1.3. Accuracy and precision 1.4. Quality control and calibration 2. Chemical analysis 2.1. Qualitative and quantitative analyses 2.2. Gravimetric analysis 2.3. Volumetric analysis 2.4. Identification of common elements 3. Instrumental techniques 3.1. Optical and ultraviolet spectroscopy 3.2. Atomic spectroscopy 3.3. Diffraction techniques 3.4. Electrochemical sensors 4. Sample preparation 4.1. Milling and grinding 4.2. Treatment with acids 4.3. Fusion with fluxes 4.4. Microwave-assisted leaching Повторение грамматического материала: 1. Tenses: Present Perfect Continuous, Past Perfect Continuous 2. Adverbial clauses and conjunctions 3. Reporting speech Семестр 8 Раздел 4. Chemical engineering (химическая технология) Тематика раздела: 1. Types of industrial equipment 1.1. Heat transfer equipment and solid drying 1.2. Adsorption and ion exchange 1.3. Liquid-liquid extraction 1.4. Chemical reactors 2. Heat and mass transfer 2.1. Material balances without reaction 2.2. Material balances involving reactions 2.3. Material balances for multi-unit systems 2.4. Heat balances 3. Process safety in chemical industry 3.1. Hazardous materials and conditions 3.2. Process safety analysis 3.3. Safety equipment, process design, and operation 3.4. Waste management 4. Selected chapters of chemical engineering 4.1. Engineering Economics and Management 4.2. Equipment Design 4.3. Energy Resources and Utilization 4.4. Industrial Pollution and Control Повторение грамматического материала: 1. Linking devices 2. Verb complementation 3. Agreement between subject and verb 5. Образовательные технологии Методы и формы организации обучения дисциплине «Профессиональная подготовка на английском языке» представлены в виде матрицы в таблице 7. Таблица 3 Методы и формы организации обучения Методы Практические занятия СРС IT-методы + + Работа в команде + + Игра + Методы обучения Обучение опыта проблемного + на основе + Опережающая самостоятельная работа Проектный метод + + + + + 6. Организация и учебно-методическое обеспечение самостоятельной работы студентов 6.1. Виды и формы самостоятельной работы 1. Домашняя работа (задания тренировочного характера с целью закрепления ранее изученного материала), выполнятся в следующих формах: 1.1. Тренировочные задания на закрепление содержания каждого занятия; 1.2. Задания на ознакомление с содержанием следующего занятия; 1.3. Самостоятельная работа, предполагающая изучение тем, вынесенных на самостоятельную проработку; 1.4. Подготовка устных и письменных сообщений (докладов, рефератов, презентаций); 2. Творческая проблемно-ориентированная самостоятельная работа включает следующие виды работы: 2.1. Индивидуально-поисковая работа по самостоятельному изучению материала с использованием англоязычных научных изданий и международной периодики; 2.2. Творческая самостоятельная работа, выполняемая по инициативе студента: написание статей и докладов на английском языке, подготовка выступлений на конференциях и т.д. 6.2 Содержание самостоятельной работы студентов по дисциплине 1. Перечень тем для творческой самостоятельной работы № п/п Тема 1 Substances, processes, and operations in the chemical technology of rare, less common and radioactive elements (в зависимости от направления учебно-исследовательской работы студента) 2. Темы, выносимые на самостоятельную проработку № п/п Тема 1 Selected topics on academic English 2 Secondary periodicity of elements 3 Bonding in transition metal complexes 4 Chemistry of alkali metals 5 Helmholtz energy 6 Common ways of processing heterogeneous kinetic data 7 Aerogel synthesis 8 Chemometrics 9 Chemical analysis for determination of radioactive elements 10 Luminescence 11 Transport and storage of fluids 12 Thermal isolation in industry 13 Energy resources used at chemical plants 6.3. Контроль самостоятельной работы Оценка результатов самостоятельной работы организуется как единство двух форм: самоконтроль и контроль со стороны преподавателя. Самоконтроль зависит от определенных качеств личности, ответственности за результаты своего обучения, заинтересованности в положительной оценке своего труда, материальных и моральных стимулов, от того насколько обучаемый мотивирован в достижении наилучших результатов. Задача преподавателя состоит в том, чтобы создать условия для выполнения самостоятельной работы (учебно-методическое обеспечение), правильно использовать различные стимулы для реализации этой работы (рейтинговая система), повышать её значимость, и грамотно осуществлять контроль самостоятельной деятельности студента (фонд оценочных средств). Контроль выполнения тренировочных заданий на закрепление содержания занятия, а также заданий на ознакомление с содержанием следующего занятия осуществляется как преподавателем, так и студентами (при наличии ключей к тренировочным заданиям и указаний для самоконтроля). Контроль выполнения творческой самостоятельной работы, выполняемой по инициативе студента, осуществляется преподавателем совместно с научным руководителем студента. 7. Средства текущей и промежуточной оценки качества освоения дисциплины Оценка качества освоения дисциплины производится по результатам следующих контролирующих мероприятий: Контролирующие мероприятия Результаты обучения по дисциплине Входной контроль РД1, РД2, РД3, РД4 Выполнение практических заданий РД1, РД2, РД3, РД4 Выполнение и защита индивидуальных заданий РД1, РД2, РД3, РД4 Контрольные работы РД1, РД2, РД3, РД4 Зачёт РД1, РД2, РД3, РД4 Для оценки качества освоения дисциплины при проведении контролирующих мероприятий предусмотрены следующие средства (фонд оценочных средств): Вопросы входного контроля в начале изучения дисциплины: Choose the correct answer: 1. When can we meet again? - When are you free? - It was two days ago. - Can you help me? 2. My aunt is going to stay with me. - How do you do? - How long for? - How was it? 7. I can't find my keys anywhere - I ...... have left them at work. - can - must - ought - would 8. When a car pulled out in front of her, Jane did well not to ...... control of her bicycle. 3. When do you study? - at school - in the evenings - in the library - miss - lose - fail - drop 9. According to Richard's ...... the 4. Would you prefer lemonade or train leaves at 7 o'clock. - opinion orange juice? - Have you got anything else? - advice - If you like. - knowledge - Are you sure about that? - information 5. Let's have dinner now. - You aren't eating. - There aren't any. - Tom isn't here yet 10. When you stay in a country for some time you get used to the people's ...... of life. - habit - custom 6. The snow was ...... heavily when I - way - system left the house. - dropping - landing - falling - descending Пример вопросов на практических занятиях: 1. Determine the state of an electron in a hydrogen atom if the energy of the electron is –1.36 ∙ 10-22 kJ. 2. Which of the following is NOT true according to the Law of Conservation of Mass? - Matter cannot be created or destroyed by a physical change - It only applies to matter in specific phases - Matter can be converted from one form to another - Matter cannot be created or destroyed by a chemical change - Mass must remain constant in any type of change 3. How many moles of NaCH3COO are in 20. mL of a solution of 0.500 M NaCH3COO? Пример индивидуального задания с вариантами исходных данных: In this individual homework you have to find the limiting reactant and to calculate the unknown quantities for the following reaction: NH3(l) + NO(g) → N2(g) + H2O(l) Consult with the lecturer if you do not know your task number. Variant 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Amount of NH3 12.3 g 1.0 mol 0.75 g 4.7 g 96.0 g 0.07 mol 3.2 mol 32.5 g 1.9 g 21.7 mol 77.1 g 0.8 mol 1.4 mol 0.61 g 32.4 g 3.8 g 10.5 mol 0.55 mol 46.5 g 12.0 g Amount of NO 54.2 L 30.4 g 0.01 mol 2.2 L 105 L 0.4 g 76 g 32.5 L 0.4 mol 54.9 L 54.0 L 0.7 g 7.6 g 6.1 L 1.2 mol 9.1 mol 23.4 L 1.2 g 656 L 43.4 L Amount of N2 Amount of H2O Пример контрольной работы: 1. What mass of carbon, in grams, is present in 255. mL of a 2.50-M sucrose solution, C12H22O11(aq)? Report your answer to one decimal place. 2. Calculate the molar mass of the mineral autunite, Ca(UO2)2(PO4)2. 3. How many of the compounds from the following list that share the same empirical formula? C6H12O6 C7H6O3 C3H6O C5H5(OH)5 H2C2O4 4. Rank the following compounds in order of decreasing mass percentage of nitrogen (highest % nitrogen first, lowest % nitrogen last). N2O4 NH3 LiNO3 N2O5 5. What volume of water, in milliliters, is needed to dissolve 1.17 grams of NaCl to produce a solution having a sodium chloride concentration of 0.53 M? Assume that the volume of the solution is equal to the volume of water. Round and report your answer to two significant figures. 6. Select only the IONIC compounds from the following list of species. Li2CO3 SF6 NH4+ NO2 K2S CuCl CH2Cl2 CaF2 7. An oxide of phosphorus having a molar mass of 283.88 g/mol is 43.64% P by mass. What is the chemical formula of this compound? 8. How many moles of hydrogen gas, H2(g), could be generated from the hydrogen atoms contained within 0.55 kg of aspirin, C9H8O4? Round and report your answer to the nearest whole number. 9. 695 mL of a 0.356 M NaClO3 solution was added to 1.5 L of pure water. The resulting solution was heated overnight to drive off all water. What mass of NaClO3, in grams, remains? Report your answer to one decimal place. 10. A sample of an organic compound is composed of 391 mg carbon, 0.0869 moles of atomic hydrogen and 1.96∙1022 oxygen atoms. What is the empirical formula of this compound? Пример билета с вопросами, выносимыми на зачёт: Variant №1 1. Theory: Matter and its classification. 2. Practice: In a neutralization reaction between strong acid H2SO4 and strong base KOH, K2SO4 forms along with water. If you added 67.5 mL of base to 100. mL of 2.0 M strong acid in order to reach the equivalence point, what was the original molarity of the base? 3. Language: All the objects from everyday life that we can see, touch or squeeze are composed of atoms. This atomic matter is made up of interacting subatomic particles – usually a nucleus of protons and neutrons, and a cloud of orbiting electrons. Typically, science considers these composite particles matter because they have both rest mass and volume. By contrast, massless particles, such as photons, are not considered matter, because they have neither rest mass nor volume. However, not all particles with rest mass have a classical volume, since fundamental particles such as quarks and leptons are considered "point particles" with no effective size or volume. Nevertheless, quarks and leptons together make up "ordinary matter", and their interactions contribute to the effective volume of the composite particles that make up ordinary matter. 8. Рейтинг качества освоения дисциплины Оценка качества освоения дисциплины в ходе текущей и промежуточной аттестации обучающихся осуществляется в соответствии с «Руководящими материалами по текущему контролю успеваемости, промежуточной и итоговой аттестации студентов Томского политехнического университета», утвержденными приказом ректора № 77/од от 29.11.2011 г. В соответствии с «Календарным планом изучения дисциплины»: текущая аттестация (оценка качества усвоения теоретического материала (ответы на вопросы и др.) и результаты практической деятельности (решение задач, выполнение заданий, решение проблем и др.) производится в течение семестра (оценивается в баллах (максимально 60 баллов), к моменту завершения семестра студент должен набрать не менее 33 баллов); промежуточная аттестация (экзамен, зачет) производится в конце семестра (оценивается в баллах (максимально 40 баллов), на экзамене (зачете) студент должен набрать не менее 22 баллов). Итоговый рейтинг по дисциплине определяется суммированием баллов, полученных в ходе текущей и промежуточной аттестаций. Максимальный итоговый рейтинг соответствует 100 баллам. 9. Учебно-методическое и информационное обеспечение дисциплины основная литература 1. Покушалова, Лидия Владимировна. Профессиональный английский язык для студентов химических специальностей : учебное пособие / Л. В. Покушалова; Национальный исследовательский Томский политехнический университет (ТПУ). – Томск: Изд-во ТПУ, 2011. – 120 с.: ил. 2. Петровская, Татьяна Семёновна. Английский язык для инженеровхимиков. Книга для студента: учебное пособие для вузов / Т. С. Петровская, И. Е. Рыманова, А. В. Макаровских; Национальный исследовательский Томский политехнический университет (ТПУ). – Томск: Изд-во ТПУ, 2013. – 163 с.: ил. – Библиогр.: с. 162-163. – ISBN 978-5-4387-0354-9. 3. Кузнецова, Анна Александровна. Английский язык для специальных целей: аналитическая химия и химическая технология = English for Analytical Chemistry and Chemical Technology Studies: книга для студента: учебное пособие / А. А. Кузнецова; Национальный исследовательский Томский политехнический университет (ТПУ). – Томск: Изд-во ТПУ, 2012. – 124 с.: ил. – Библиогр.: с. 126. 4. Степанова, Наталия Алексеевна. Практический курс английского языка для студентов-химиков = About the Foundations of Chemistry. A Practical Course of English for the First Year Chemistry Students : учебное пособие / Н. А. Степанова. – СПб.: Политехника, 2009. – 120 с. – Учебное пособие для вузов. – Библиогр.: с. 120. – ISBN 9785-7325-0925-0. дополнительная литература 1. Абоянцева, Альбина Анатольевна. Введение в деловую и профессиональную коммуникацию для студентов технических специальностей : учебное пособие для вузов / А. А. Абоянцева, А. Р. Васюхина; Национальный исследовательский Томский политехнический университет (ТПУ). – Томск: Изд-во ТПУ, 2010. – 119 с.: ил. – Книга на англ. яз. – Библиогр.: с. 118. 2. Даминова, София Оскаровна. Англо-русский словарь сокращений в химии = English-Russian Dictionary of Shortenings in Chemistry : учебное пособие для вузов / С. О. Даминова, И. А. Леенсон. – Москва: Либроком, 2011. – 192 с. – ISBN 978-5-397-01514-1. 3. Industrial High Pressure Applications. Processes, Equipment and Safety / edited by R. Eggers. – Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA, 2012. – 404 p.: il. – Index: p. 397-404. – ISBN 978-3-52732586-3. 4. Hites, Ronald. Elements of Environmental Chemistry / R. A. Hites, J. A. Raff. – 2nd ed. – Hoboken: John Wiley & Sons, Inc., 2012. – 339 p.: il. – Index: p. 331-339. – ISBN 978-1-118-04155-0. 5. Harris, Daniel. Exploring Chemical Analysis / D. C. Harris. – 5th ed. – New York: W. H. Freeman and Company, 2013. – 631 p.: il. – International Edition. – ISBN 978-1-4292-7503-3. 6. Baird, Colin. Environmental Chemistry / C. Baird, M. Cann. – 5th ed. – New York: W. H. Freeman and Company, 2012. – 818 p.: il. – Index: p. 785-818. – ISBN 978-1-46411-349-9. 7. Banica, Florinel-Cabriel. Chemical Sensors and Biosensors: Fundamentals and Applications / F.-G. Banica; editor by G. Fogg. – Chichester: John Wiley & Sons, Ltd., 2012. – 541 p.: il. – Index: p. 531541. – ISBN 978-0-47071-067-8. электронные издания: 1. Кутепова М.М. The World of Chemistry. Английский язык для химиков. Учебник: учебно-методический комплекс – 5-е издание, доп. и перераб. – Издательство: КДУ, 2013. – ISBN: 978-5-98227899-9. –256 с. – Режим доступа: https://tpu.bibliotech.ru/?BasicSearchString=chemistry&page=1# 2. Причард Э., Барвик В. Контроль качества в аналитической химии. – Издательство «Профессия», 2011. 320 с. – ISBN: 978-5-91884-023-8. – Режим доступа: http://e.lanbook.com/view/book/46070/ 3. Петровская, Татьяна Семёновна. Химические технологии [Электронный ресурс] = Class book: книга для студента / Т. С. Петровская, И. Е. Рыманова, А. В. Макаровских; Национальный исследовательский Томский политехнический университет (ТПУ). – 1 компьютерный файл (pdf; 1.9 MB). – Томск: Изд-во ТПУ, 2010. – Заглавие с титульного экрана. – Доступ из корпоративной сети ТПУ. – Системные требования: Adobe Reader. http://www.lib.tpu.ru/fulltext2 /m/2011/m331.pdf 10. Материально-техническое обеспечение дисциплины Для проведения занятий по дисциплине «Профессиональная подготовка на английском языке» требуется следующее материально-техническое обеспечение: № Наименование (компьютерные классы, учебные Корпус, ауд., п/п лаборатории, оборудование) количество установок 1 Проектор или телевизор, компьютер с 10 корпус, ауд. аудиовыходом и доступом к сети Интернет 326 Программа составлена на основе Стандарта ООП ТПУ в соответствии с требованиями ФГОС по направлению подготовки: 240501 (18.05.02) «Химическая технология материалов современной энергетики». Программа одобрена на заседании кафедры ХТРЭ ФТИ (протокол № ______ от «____» ___________ 2014 г.) Автор: Ассистент каф. ХТРЭ ФТИ С.И. Ивлев
